Настоящее изобретение относится к новым производным ксантина формулы I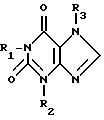
и их физиологически переносимым солям,
где R1 - гидроксиалкил с 1 - 8 атомами углерода, углеродная цепь которого может быть неразветвленной или разветвленной и гидроксильная группа которого представляет функцию первичного, вторичного или третичного спирта;
R2 - водород;
R3 - этоксиалкил с 1 - 4 атомами углерода, углеродная цепь которого может быть неразветвленной или разветвленной.
Эти соединения обладают ценными свойствами и применяются для изготовления лекарственных препаратов для лечения закрытых черепно-мозговых травм.
Производные ксантина формулы I ингибируют образование свободных радикалов.
Пригодными филологическими солями производных ксантина формулы I являются соли щелочных, щелочноземельных металлов и соли аммония.
Соединения согласно изобретению получают тем, что
а) защищенные по R2 или по R2 и R3 ксантины в щелочных условиях подвергают реакции с соединением формулы II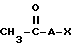
или формулы III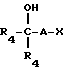
или с алкилгалогенидом с максимально 6 C-атомами,
где A представляет собой алкилгруппу с 1-6 атомами углерода;
X - такой галоген, как фтор, хлор, бром или иод;
R4 - водород и/или метил,
и непосредственно после этого защитные группы отщепляют;
б) ксантины, защищенные по R2, подвергают реакции с соединением формулы II или формулы III или с алкилгалогенидом с максимально 6 C-атомами, с превращением в 3,7-замещенный ксантин, непосредственно после этого подвергают реакции с соединением формулы II или формулы III или с алкилгалогенидом с максимально 6 C-атомами и после этого защитные группы отщепляют.
Исходные вещества, участвующие в реакциях, известны или могут быть легко приготовлены известными из литературы методами.
Соединения формулы I могут использоваться для получения фармацевтических компзицийв, которые состоят из по крайней мере одного производного ксантина формулы I и/или по крайней мере одной из его физиологически совместимых солей, а кроме того, содержат фармацевтически пригодны и физиологически совместимые наполнители (носители), разбавители и/или другие активные и вспомогательные компоненты (добавки).
Пример 1. Получение 7-Этоксиметил-1-(5-гидрокси-5-метилгексил) ксантина.
а) 48,4 г (0,02 моль) 3-бензилксантина растворяют в растворе 8 г (0,2 моль) гидроксида натрия в 200 мл воды. После фильтрования остаток упаривают в вакууме, несколько раз дистиллируют с метанолом и высушивают натриевую соль в высоком вакууме.
Высушенная соль суспендируется в 0,6 л диметилформамида (ДМФ), при перемешивании смешивается с 18,92 г (0,2 моль) этоксиметилхлорида и перемешивается 18 ч при 110oC. После этого горячая смесь фильтруется, упаривается в вакууме, остаток растворяется в 500 мл 2 н. едкого натра и для удаления образующегося в качестве побочного продукта 1,7-диалкилированного 3-бензилксантина встряхивается с хлороформом. Щелочной водный раствор с помощью 2 н. соляной кислоты при перемешивании доводят до pH 9, образующиеся кристаллы отсасывают на humre, промывают сначала свободной от хлора водой и затем метанолом и высушивают в вакууме. Температура плавления: 136 - 138oC.
C15H16N4O4 (молекулярный вес = 300,3)
б) 15 г полученного в пункте а) 7-Этоксиметил-3-бензил-ксантина в 300 мл ДМФ смешивается с 7,5 г (0,064 моль) карбоната калия и 8,2 г (0,054 моль) 1-хлор-5-гидрокси-5-метилгексана (изготовленного, как это описано в US 4833146) и при перемешивании в течение 5 ч прогреваются при 110oC. Горячую смеси отсасывают, упаривают и остаток вносят в хлороформ, промывают сначала 1 н. едким натром и затем водой, высушивают над сульфатом натрия, отгоняют под пониженным давлением растворитель и перекристаллизовывают остаток из диизопропилового эфира при добавлении этилацетата.
Выход: 19,1 г (92,3% от теории)
Температура плавления: 96 - 97oC
C22H30N4O4 (молекулярный вес = 414,5).
с) 4,14 г (0,01 моль) полученного в пункте Б) 7-Этоксиметил-1-(5-гидрокси-5-метилгексил)-3-бензил-ксантина при 60oC и давления 3,5 бар, в течение 198 часов, при перемешивании гидрируются в 100 мл этанола, 75 мл воды, 5 мл концентрированного N H4OH-раствора над 1,5 г палладия (10%) на активированном угле. После охлаждения заполняют азот, отфильтровывают катализатор, упаривают и перекристаллизовывают твердый остаток из этилового эфира уксусной кислоты.
Выход: 2,6 (80,1% от теории)
C15H24N4O4 (молекулярный вес = 324,4)
Пример 2. Получение 1-(5-гидрокси-5-метилгексил)ксантина.
а) 36,3 г (0,15 моль) 3-бензилксантина, 3,6 г (0,15 моль) NaH перемешиваются при 45oC в 500 мл ДМФ. Затем по каплям добавляются 25,6 г бензилбромида, растворенные в 45 мл ДМФ, и смесь нагревается 5 часов при 100 - 110oC. После этого продукт очищается, как это описано в примере 1a).
б) 19,9 г (0,06 моль) полученного в а) 3,7-дибензилксантина, 8,3 г карбоната калия и 10 г (0,065 моль) 1-хлор-5-гидрокси-5-метиленгексана в 350 мл ДМФ прогреваются 8 ч при перемешивании при температуре 110 - 120oC, и далее продукт очищается, как это описано в 1б).
с) 4,46 (0,01 моль) полученного в б) 3,7-дибензил-1-(5-гидрокси-5-метилгексил)ксантина в течение 163 ч подвергаются реакции, как это описано в примере 1с), и, согласно этому примеру, далее полученный продукт очищается.
Выход: 1,53 г (57,5% от теории).
Температура плавления: 238 - 239oC.
C12H18N4O3 (молекулярный вес = 266,3).
Биологическая активность производных ксантина формулы III подтверждена ниже приведенными данными.
Пример 3. Фармацевтические испытания и результаты.
Для измерения внутриклеточного образования свободных кислородных радикалов в перитонеальных макрофагах, а также в культурах активированной микроглии был выбран проточный цитометрический метод (Rorhe, Oser, Voilet, Naturwissenchoiffen 75, 354, 1988). Специально определяли образование свободных радикалов в отдельных витальных клетках, при этом измерялось внутриклеточное окисление мембранопроницаемого и не флуоресцирующего дигидрородамина 123 (DHR; Eugene, OR, США) в мембранонепроницаемый и внутриклеточно "захваченный", зеленый флуоресцирующий родамин 123.
Дигидрородамин растворялся в 43,3 мМ исходного раствора в N,N- диметилформамиде (ДМФ; Мерк, Дармштадт, ФРГ). Метод пригоден также для индивидуального и одновременного измерения различных подпопуляций внутри одной гетерогенной клеточной популяции; он позволяет поэтому исключение загрязненных популяций. Исходя их этого в другой серии опытов гарантированно идентифицировали, подлежащие измерению типы клеток посредством специфического иммуноцитохимического окрашивания антител непосредственно во время поточного цитометрического измерения. Перитонеальные макрофаги получались посредством перитонеального промывания с 10 мл HBS - Hаnks (Серва Файнбиохемика, Гейдельберг/Serva Feinbiochemica, Heidelberg) мужских особей Вистар-крыс в возрасте 12 недель. Клетки седиментировались при 20 г в 20oC в течение 5 мин и ресуспендировались в HBS - Hanks (4 х 106 клеток/мл). Все клетки после приготовления хранились до цитометрического анализа при 4oC в течение максимально 2 часов.
Перед началом измерения все клетки (суспензия макрофагов (10 мкл) еще разбавлялась 1 мл HBS - Hanks) 5 минут при 37oC, окрашивались с 1 мкл 43,4 мМ раствора дигидрородамина 123 (DHR) в диметилформамиде. Для того чтобы испытать влияние соединения 1, в экспериментальных группах DHR - загруженные клетки инкубировались с 10 мкМ или 50 мкМ предлагаемого по изобретению соединения в течение 15, 25, 35, 45 и 60 мин, а именно с или без параллельно протекающего стимулирования образования свободных радикалов посредством конканавалина A (Сигма Хеми, Дайзенхофен, сопА, 100 мкМ/мл). К соответствующим контрольным группам активное вещество не добавлялось.
Микроглиальные культуры препарировались из головного мозга новорожденных крыс (Ginlian & Baker, F.Neuroscience, 1986, 6:2163-2178). После механической диссоциации ткани в модифицированной среде Далбекко-Иглса (Dulbecco's modifiziertem Eagle's Medium) (Сигма Хеми/Sigma Chemie, ДМЕМ), дополненные 2 г/л NaHCO3 и 20% жаро-инактивированной эмбриональной сывороткой телят, первичные культуры в течение 2 - 4 недель выдерживались в 75 см3-сосудах при 3% pCO2 и 37oC. Клетки, которые вырастали на поверхности непрерывного слоя клеток, удалялись при помощи встряхивания, гранулировались и ресуспендировались (3 х 106 клеток/мл) в Hepes Hanks-буферный солевой раствор (5 мМ Hepes, 0,15 M NaCl, pH 7,35; Серва Фейнбиохемика, Гейдельберг, ФРГ). Для того чтобы испытать влияние соединения 1, в экспериментальных группах DHR -загруженные клетки инкубировались с 50 мкМ предлагаемого по изобретению соединения в течение 15, 25, 35, 45 и 60 минут, а именно с или без параллельно протекающего стимулирования образования свободных радикалов посредством конканавалина A (сопА, 100 мкМ/мл). К соответствующим контрольным группам активное вещество не добавлялось.
Клеточный объем и две флуоресценции измерялись одновременно в почти 10000 клетках на "образец" с помощью FACScan - проточного цитометра (Бектон Дикинсон, Сан Хосе, США/Becton Dickinson, San Jose, USA). Флюоресценция родамина 123-зеленого (500 - 530 нм) и флюоресценция пропидий иодида-красного (590 - 700 нм) измерялись при возбуждении при помощи аргонового лазера с длиной волны 488 нм. Цитометр калибровался с помощью стандартизованных желто-зелено-флюоресцирующих "микросфер" диаметром 4,3 мкм (Полисайенс, ФРГ/Polyscience, St. Goar, F.R.G.)
Каждое измеренное значение основывается на измерениях отдельных клеток, содержащих в одном "образце" (около 10000). Для того чтобы поддерживать экспериментальные граничные условия возможно постоянными, проводилось несколько экспериментов друг за другом в один день. В одной такой серии опытов цитометрически измерялись 4 различных "образца" одной экспериментальной группы и их контроль в различные, определенные моменты времени. Как правило, выполнялись 3 - 4 серии опытов на одну экспериментальную группу.
A) Действие на перитонеальные макрофаги.
Стимуляция перитонеальных макрофогов посредством конканавалина A (сопА, 100 мкг/мл) ведет к значительному росту образования свободных кислородных радикалов, измеренному как % увеличения зеленой флюоресценции после окисления дигидрородамина 123 (DHR) в родамин 123. Когда измерялись перитонеальные макрофаги в присутствии 50 мкМ соединения 1, стимуляторный эффект сопА был блокирован (таблица 1). Влияние соединения 1 при времени инкубации свыше 15 минут значительно во всех измерениях (p<0,05 в t-тесте). Измеренная % флюоресценция сопА-стимулированных перитонеальных макрофагов в присутствии 50 мкМ соединения I была даже меньше, чем в контрольных измерениях нестимулированных макрофагов. Супрессивный эффект (подавляющее действие) соединения I на образование свободных радикалов зависел от дозы, наиболее значительный эффект достигался при концентрации соединения 1 10 мкМ. При этом измерялось % торможения (подавления) 10 мкМ соединения I на сопА-стимулированные макрофаги при максимальной сопА-активирующей способности. Он составлял в момент времени 35 мин; 21% и был значительным (p<0,05 в t-тесте).
Таблица 1 описывает эффект 50 мкМ соединения I на образование свободных радикалов посредством сопА-стимулированных макрофагов.
Численные значения в таблице (средние значения ± приведенное в скобках) дают значения флюоресценции в собственных единицах прибора.
Данные, приведенные в примечании, статистически значительно отличаются от контроля p<0,05, t-тест.
B) Действие на микроглиальные клетки
В культивированных микроглиальных клетках образование свободных радикалов (измеренное как флюоресценция родамина) было существенно выше (приблизительно в 50 - 100 раз), чем в перитонеальных макрофагах. Как описывалось ранее (Банати с сотрудниками/Banati et al, Glia, 1991), это обширное образование свободных радикалов в микроглиальных клетках не может быть еще увеличено посредством стимулирования конканавалином A. Инкубирование микроглиальных клеток с 50 мкМ соединения I ведет к ярко выраженному торможению образования свободных радикалов. После инкубирования в течение 35 мин в 50 мкМ соединения I подавление клеточной родамин 123-флуоресценции достигает своего максимума и составляет приблизительно треть от контрольного значения без соединения I (таблица 2). Влияние соединения 1 при времени инкубации свыше 15 минут значительно во всех измерениях (p<0,05 в t-тесте).
Таблица 2 описывает эффект 50 мкМ соединения I на образование свободных радикалов в культивированных микроглиальных клетках
Численные значения (средние значения ± приведенные в скобках) дают значения флюоресценции в собственных единицах прибора.
Сведения, приведенные в примечании, статистически значительно отличаются от контроля P<0,05, t-тест.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОР ВНУТРИКЛЕТОЧНОГО ОБРАЗОВАНИЯ СВОБОДНЫХ РАДИКАЛОВ | 1992 |
|
RU2080862C1 |
| СПОСОБ ИЗМЕРЕНИЯ ЭФФЕКТОВ КОМПОНЕНТОВ НА ПРОДУКЦИЮ РЕАКЦИОННОСПОСОБНЫХ ФОРМ КИСЛОРОДА В КЛЕТКЕ | 2009 |
|
RU2480759C2 |
| ПРОИЗВОДНЫЕ КСАНТИНА, ИХ СТЕРЕОИЗОМЕРЫ И ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ УМЕНЬШАЮЩЕЙ ПАТОЛОГИЧЕСКУЮ ГИПЕРАКТИВНОСТЬ ЭОЗИНОФИЛЬНЫХ ГРАНУЛЯТОВ АКТИВНОСТЬЮ | 1995 |
|
RU2159617C2 |
| КОМПОЗИЦИЯ УБИХИНОЛА ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2016 |
|
RU2635993C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФРОНДОЗИДА А И СПОСОБ СТИМУЛИРОВАНИЯ ИММУННОЙ СИСТЕМЫ МЛЕКОПИТАЮЩИХ | 2005 |
|
RU2339644C2 |
| ПРОИЗВОДНЫЕ КСАНТИНА И ИХ ФАРМАКОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ | 1993 |
|
RU2138500C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ КЛЕТОЧНЫЙ ИММУНИТЕТ МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2415863C1 |
| ПРОИЗВОДНОЕ АЛЬФА-АМИНОГИДРОКСАМОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2265592C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЭФФЕКТОР МЕТАБОЛИЗМА ГЛУТАТИОНА ВМЕСТЕ С АЛЬФА-ЛИПОЕВОЙ КИСЛОТОЙ, ДЛЯ ТЕРАПИИ ПРИ ПЕРЕСАДКЕ ПОЧЕК | 2002 |
|
RU2285525C2 |
| ПРОИЗВОДНЫЕ 8-АРИЛ-1,7-НАФТИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 1997 |
|
RU2174123C2 |
Производные ксантина формулы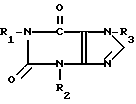
где R1 гидроксиалкил (C1-C8), углеродная цепь которого может быть неразветвленной или разветвленной; R2 водород; R3 этоксиалкил (C1-C4) или их физиологически переносимые соли; обладают способностью ингибировать образование свободных радикалов. 2 табл.
Производные ксантина формулы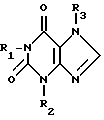
где R1 - гидроксиалкил с 1 - 8 атомами углерода, углеродная цепь которого может быть неразветвленной или разветвленной;
R2 - водород;
R3 - этоксиалкил с 1 - 4 атомами углерода,
или их физиологически переносимые соли.
| Способ получения производных ксантина | 1983 |
|
SU1240361A3 |
| DE 3328636 A1, 1984 | |||
| БУРОВОЙ МАГНИТОСТРИКЦИОННЫЙ ВИБРАТОР | 0 |
|
SU386683A1 |
| СПОСОБ СОЕДИНЕНИЯ КОСТНОГО ТРАНСПЛАНТАТА С ТРУБЧАТОЙ КОСТЬЮ | 1973 |
|
SU435811A1 |
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
1999-02-20—Публикация
1992-07-10—Подача