ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к сапонинам, полученным из голотурий, в частности к сапонину, известному как фрондозид А.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Сапонины или гликозиды, состоящие из углеводной цепи и тритерпенового или стероидного агликона, широко распространены в растениях. Присутствие тритерпеновых гликозидов характерно для большинства голотурий, животных относящихся к классу Holothurioidea (тип Echinodermata) и для некоторых губок. Тритерпеновые гликозиды голотурий имеют агликоны ланостанового типа, большинство имеет агликоны с 18(20)-лактонами и относится к голостановому типу. Углеводные цепи гликозидов голотурий состоят из двух - шести моносахаридных остатков, включая ксилозу, хиновозу, глюкозу, 3-О-метилглюкозу и (иногда) 3-O-метилксилозу и могут содержать одну, две или три сульфатные группы. (V.A.Stonik, V.I.Kalinin, S.A.Avilov, "Toxins from Sea Cucumbers (Holothuroids): Chemical Structures, Properties, Taxonomic Distribution, Biosynthesis and Evolution," J. Nat. Toxins. 1999, 8, 235-248)
Благодаря способности формировать комплекс с 5(6)-ненасыщенными стеринами клеточных мембран гликозиды обладают широким спектром биологической активности, включая гемолитическую, антигрибковую, цитотоксическую, и многие другие виды мембранотропного действия. Более того, эти гликозиды известны как имеющие сильное иммуномудулирующее действие при очень низких концентрациях, что может иметь практическое значение. (V.I.Kalinin, M.M.Anisimov, N.G.Prokofieva, S.A.Avilov, S.S.Afiyatullov, V.A.Stonik. "Biological activities and biological role of triterpene glycosides from holothuroids (Echinodermata)". Echinoderm Studies. Vol.5, A.A.Balkema, Rotterdam, p.139-181, 1996). Иммуномодулирующее действие было изучено для нескольких видов голотурий (D.L.Aminin, I.G.Agafonova, E.V.Berdyshev, E.G.Isachenko, S.A.Avilov, V.A.Stonik. "Immunomodulatory Properties of cucumariosides from the Edible Far-Eastern Holothurian Cucumaria japonica," J. Med. Food. 2001, 4, 127-135). Было показано, что большинство эффективных иммуностимуляторов являются моносульфатированными гликозидами, в то время как ди- и трисульфатированные являются иммунодепрессантами. Комплекс холестерина и суммы моносульфатированных гликозидов из Cucumaria japonica (ИСКОМ-подобная композиция) и композиции на его основе также были использованы как иммуностимуляторы (В.А.Стоник, Д.Л.Аминин, В.М.Богуславский, С.А.Авилов, И.Г.Агафонова, А.С.Сильченко, Л.П.Пономаренко, Н.Г.Прокофьева, Е.А.Галкина. Иммуномодулирующий препарат "Кумазид" и фармакологическая композиция на его основе (Заявка на Патент РФ №2004120434/15, приоритет 2.07.2004).
Таким образом, очень важно иметь чистый стандартный гликозид, чтобы обеспечить гарантированный и стабильный иммуностимулирующий эффект. Фрондозид А, объект настоящего изобретения, значительно отличается от других моносульфатированных гликозидов, таких как кукумариозид А2-2, и других кукмариозидов из Cucumaria japonica, для которых сообщались иммуностимулирующие свойства (G.B.Elyakov, V.A.Stonik. "Marine bioorganic chemistry as the base of marine biotechnology" Rus. Chem. Bull. 2003, 52). Таким образом, открытие иммуностимулирующих свойств для фрондозида А в настоящем изобретении является новым и неочевидным из-за следующих отличий между кукумариозидами и фрондозидом А из С.frondosa:
1. фрондозид А имеет 16-ОАс группу при С-16 агликона, а не кетогруппу;
2. фрондозид А имеет ксилозу в качестве третьего моносахаридного остатка, но не глюкозу;
3. фрондозид А не имеет двойной связи в боковой цепи агликона.
Более того, иммуномодулирующее действие фрондозида А является неожиданным и неочевидным, поскольку кукмариозид G1, который имеет очень схожий агликон с той же самой 16-ОАс группой, не обладает аналогичной биологической активностью (Y.I.Grishyn, N.N.Besednova, V.A.Stonik, S.A.Avilov, "Regulation of hemopoesis and immunogenesis by triterpene glycosides of the sea cucumbers" Radiobiologia, 1990, 30, 556).
Cucumaria frondosa обитает в Северо-Атлантических холодных водах и добывается для пищевых целей в штате Мэн и Канаде. В России этот вид голотурий обитает в Баренцовом море. Cucumaria frondosa содержит очень сложную смесь моно-, ди- и трисульфатированных гликозидов, главным образом, пентаозидов. (М.Girard, J.Belanger, J.W.ApSimon, F.-X. Garneau, C. Harvey, J.-R. Brisson. "Frondoside A. A Novel Triterpene Glycoside from the Holothurian Cucumaria frondosa" Can. J. Chem. 1990. 68, 11-18); (J. Findlay, N. Yayli, L. Radics. "Novel sulphated oligosaccharides from the sea cucumber Cucumaria frondosa," J. Nat. Prod. 1992, 55, 93-101); (Yayli, N., Findlay, J. "A Triterpenoid Saponin from Cucumaria frondosa," Phytochemistry. 1999, 50, 135-138); (N.Yayli, "Minor Saponins from the Sea Cucumber Cucumaria frondosa," Indian J. Chem. 2001, 40B, 399-404); (S.A.Avilov, O.A.Drozdova, V.I.Kalinin, A.I.Kalinovsky, V.A.Stonik, E.N.Gudimova, R.Riguera, C.Jimenez. "Frondoside C, a New Nonholostane Triterpene Glycoside from the Sea Cucumber Cucumaria frondosa: Structure and Cytotoxicity of its Desulphated Derivative", Can. J. Chem. 1998, 76, 137-141). В ходе промышленной переработки голотурий в качестве отходов образуются значительные количества варочных вод, содержащих сапонины. Однако иммуномодулирующие свойства индивидуальных гликозидов из С.frondosa никогда не изучались.
Лизосомальная активность является одним из важных маркеров физиологического и биохимического статуса макрофагов. Увеличение количества в них внутриклеточных органелл и увеличение размера этих органелл, так же как увеличение кислотности, свидетельствует об активации некоторых клеточных функций и лизосомальных ферментов, а также о подготовке клеток к фагоцитозу и перевариванию поглощенных частиц. (А.С.Allison, M.R.Young. Vital Staining and Fluorescence Microscopy of Lysosomes. In "Lysosomes in Biology and Pathology". Vol.2, North Holland, Amsterdam, p.600-628, 1969); (C.Millot, "Characterization of Acidic Vesicles in Multidrug-Resistant and Sensitive Cancer Cells by Acridine Orange Staining and Confocal Microspectrofluorometry", J. Histochem. Cytochem. 1997, 45, 1255-1259); (F.Zoccarato, L.Cavallini, A.Alexandre, "The pH-Sensitive Dye Acridine Orange as a Tool to Monitor Exocytosis/Endocytosis in Synaptosomes", J.Neurochem. 1999, 72, 625).
Фагоцитоз является важным механизмом питания в одноклеточных организмах, а также используется для защиты против инфекций в высших позвоночных. Процесс фагоцитоза может наблюдаться и количественно оцениваться как в человеческих полиядерных клетках, так и мышиных макрофагах по включению инородных частиц, таких как флуоресцентно меченные иммунные комплексы и бактериальные частицы. Эта технология позволяет обнаруживать внутриклеточную флуоресценцию, вызванную поглощенными частицами, равно как проводить эффективное погашение флуоресценции зонда во внеклеточной среде трипановым синим. (C.R.Uff, A.G.Pockley, R.K.Phillips. "A Rapid Microplate-Based Fluorometric Assay for Phagocytosis." Immunol Invest. 1993, 22, 407); (CP. Wan, C.S. Park, B.H. Lau. "A Rapid and Simple Microfluorometric Phagocytosis Assay." J Immunol Meth. 1993. 162, 1).
Способность генерировать синглетный кислород, перекись водорода и продукты их взаимодействия друг с другом и с NO, так называемый оксидативный взрыв, также важен для макрофагов, чтобы убивать инфекционные микроорганизмы. Регистрируемое в данном исследовании превращение дигидрородамина 123 в родамин 123 в клетках отражает выработку мышиными макрофагами Н2О2, О2 и пероксинитрита, который ассоциируется с выработкой оксида азота и образованием НАДФ-оксидазозависимого супероксида. Эти активные формы кислорода являются очень токсичными и необходимы для килинга поглощенных микроорганизмов, их окисления и дезинтеграции. (E.W.Childs, K.F.Udobi, J.G.Wood, F.A.Hunter, D.M.Smalley, L.Y.Cheung. "In vivo Visualization of Reactive Oxidants and Leukocyte-Endothelial Adherence Following Hemorrhagic Shock," Shock. 2002. 18, 423 - 7); (S.F.Emmendorffer, M.Hecht, M.-L. Lohman-Mattes, J.Roester. "A Fast Easy Method to Determine the Production of Reactive Oxygene Intermediates by Human and Murine Phagocytes Using Dihydrorodamine 123," J.Immunol. Meth. 1990, 131, 269-275).
В сравнении с выделением сапонинов из растений выделение сапонинов из голотурий существенно отличается в связи со следующими особенностями, как-то: высокополярный характер большинства гликозидов; присутствие более значительных количеств белков, пептидов, липидов, и солей в животных. Большинство обычных приемов выделения гликозидов сводятся к следующим: экстракция сырого животного материала 70% этанолом или метанолом, обессоливание упаренного экстракта на гидрофобном сорбенте таком, как например, XAD-4 и т.д. с последующей хроматографией на силикагеле и дальнейшим выделением индивидуальных веществ с помощью ВЭЖХ. (S.A.Avilov, A.S.Antonov, A.S.Silchenko, V.I.Kalinin, A.I.Kalinovsky, P.S.Dmitrenok, V.A.Stonik, R.Riguera, C.Jimenez, "Triterpene Glycosides from the Far Eastern Sea Cucumber Cucumaria conicospermiumr J. Nat. Prod. 2003, 66, 910-916); (H.D.Chludil, C.C.Muniain, A.M.Seldes, M.S.Maier, "Cytotoxic and Antifungal Triterpene Glycosides from the Patagonian Sea Cucumber Hemoidema spectabilis", J. Nat. Prod. 2002, 65, 860-865).
Однако подобная процедура не подходит для промышленных или полупромышленных целей, поскольку коллоидная природа водного раствора упаренного этанольного или метанольного экстракта, содержащего большое количество частиц различных неполярных соединений, таких как липиды, пигменты и др. может препятствовать протеканию сольвента через колонку с тефлоном или каким-либо иным гидрофобным сорбентом. Выделение гликозидов из варочной воды непосредственно с помощью гидрофобной хроматографии на тефлоне или на каком-либо ином неполярном сорбенте после фильтрации этой варочной воды затруднено, поскольку необратимая сорбция гидрофобных белков будет вести к постепенной потере соответствующей колонкой своих адсорбционных свойств. Протекание сольвента также задерживается коллоидными частицами различных белков. Более того, значительная часть гликозидов может образовать комплекс с гидрофобными белками и быть потерянной при фильтрации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является создание промышленно пригодного и эффективного способа получения фрондозида А из продуктов промышленной переработки голотурий, особенно из варочных вод, образующихся при такой переработке. Дополнительной задачей настоящего изобретения является создание способа, обеспечивающего стабильное стимулирование и/или восстановление иммунной системы млекопитающих, нуждающихся в этом, и особенно сельскохозяйственных животных или домашних хорьков при опасности вирусных, грибковых или оппортунистических болезней, связанных с уменьшением иммунного ответа у этих млекопитающих.
Дополнительной задачей настоящего изобретения является создание эффективного медицинского препарата для животных с пониженным статусом иммунной системы, особенно людей, инфицированных ВИЧ, а также в ходе лечения болезней с использованием методов радио- и химиотерапии. Вдобавок, такой медикамент может быть использован в такой подходящей форме, как это может быть определено любым человеком, имеющим достаточную терапевтическую квалификацию.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Метод выделения
Настоящее изобретение предусматривает использование хлороформ/метанольной смеси в качестве растворителя в различных пропорциях по отношению к твердому материалу, последующее упаривание и экстракцию этилацетатом и водой и последующую хроматографию водной фазы на тефлоне и колонках с силикагелем. Этот процесс используется для выделения тритерпеновых гликозидов (сапонинов) высокой чистоты, особенно фрондозида А из высушенных варочных вод и размолотых в порошок тканей голотурий, используемых вместо остатка после упаривания варочных вод. Настоящее изобретение также включает метод стимулирования лизосомальной активности макрофагов, фагоцитоза и образования активных форм кислорода у млекопитающих после назначения фрондозида А.
Хотя полярные гликозиды не так легко растворяются в безводных хлороформ/метанольных смесях, неожиданно было найдено, что смесь хлороформа и метанола способна растворять их при повышенной температуре при кипячении с обратным холодильником. Температура может контролироваться путем использования различных соотношений между смесью растворителей и твердым субстратом, поскольку, чем большее количество растворителя добавлено в смесь, тем меньшая температура кипения экстракта будет достигнута. Полная экстракция гликозидов, включая ди- и трисульфатированные пентаозиды, хлороформ/метанолом в приблизительном соотношении 1:1 возможна при количестве растворителя пропорциональном соотношении 4 мл смеси растворителей на 1 г сухой варочной воды при 1,5 часовом кипячении с обратным холодильником или более. Соответственно, при большем количестве растворителя, а именно в пропорциональном соотношении 6 мл смеси растворителя на 1 г сушеной варочной воды, было достигнуто более селективное выделение моносульфатированных гликозидов, преимущественно фрондозида А. Однако прямая хроматография выпаренного и перерастворенного в воде хлороформ/метанольного экстракта на тефлоне не вполне эффективна из-за наличия значительного количества липидного материала. Эффективная делипидизация и удаление пигментов достигается водно/этилацетатной экстракцией. Получаемые при этом водные фазы почти полностью свободны от пигментов и липидов.
Дальнейшее обессоливание на тефлоновом порошке производится путем загрузки водной фазы на тефлон с предварительным разбавлением примерно в 8-10 раз относительно объема колонки; промывания колонки водой до полного обессоливания с последующим элюированием ацетоном (или другим воднорастворимым полярным органическим растворителем, включая метанол, этанол, изопропанол и т.д.) или смесью полярного растворителя и воды при контроле процесса элюирования по ТСХ, что позволяет отделить гликозиды от следовых количеств оставшихся липидов. Водная фаза должна быть упарена досуха после водно/этилацетатной экстракции в случае использования любого гридрофобного сорбента за исключением тефлона для того, чтобы убрать предварительно следы этилацетата.
Дальнейшая очистка гликозидов может быть достигнута обычной хроматографией низкого давления на силикагеле или при использовании простейшей силикагельной флэш-колонки, при этом получается фракция практически чистого фрондозида А, а также фракции, содержащие моно-, ди- и трисульфатированные гликозиды. Чистота фрондозида А, 3-O-метил-β-D-глюкопиранозил-(1→3)-β-D-ксилопиранозил-(1→4)-[β-D-ксилопиранозил-(1→2)]-β-D-хиновопиранозил-(1→2)-4-O-натрий сульфат-β-D-ксило-пиранозил-3-O-голост-7(8)-ен-3β-ол-16β-О-ацетата может быть проверена спектроскопией 13С ЯМР и масс-спектрометрией.
Экстракция животных материалов хлороформ/метанольными смесями обычно используется для выделения липидов и согласно нашим сведениям никогда до этого не использовалась для непосредственной экстракции полярных гликозидов из животного материала и никогда не применялась для выделения гликозидов из варочной воды голотурий или разделения различных гликозидов друг от друга. Авторами неожиданно была обнаружена возможность непосредственной загрузки водной фазы после этилацетатной колонки на тефлоновый порошок без предварительного упаривания ее досуха, что дает значительное упрощение процедуры. Это возможно только на тефлоновом порошке, но не на XAD, о чем ранее не сообщалось.
Процедура, аналогичная описанной выше, может быть использована для выделения биологически активных гликозидов из голотурий, в частности из С.frondosa, при которой метод выделения может включать экстракцию высушенной варочной воды, получаемой при промышленной переработке Cucumaria frondosa или высушенных тканей Cucumaria frondosa смесью хлороформа и метанола при кипячении с обратным холодильником, и упаривание полученного экстракта с последующим экстрагированием остатка этилацетатом и водой один или более раз, чтобы получить водную фазу, которую хроматографируют на тефлоне и силикагельных колонках, собирая фракции фиксированного объема, и затем, тестируя каждую фракцию после упаривания и перерастворения в воде, для тестирования на животных путем орального введения, производя контроль метаболитов и сравнивая результаты с контрольными пустыми пробами.
Само собой разумеется, что методика выделения гликозидов, могущих быть использованных при оральном введении, является только примером, и такие протоколы могут быть модифицированы и оптимизированы любым квалифицированным лицом без каких-либо ограничений, и которые можно представить, сохраняя предмет, цели и смысл заявляемого здесь изобретения.
Тестирование in vivo
Изобретателями было обнаружено, что фрондозид А, выделенный из С.frondosa, вызывает в диапазоне концентраций от 0,002-2,0 мкг/мышь значительный дозозависимый иммуностимулирующий эффект на перитонеальные макрофаги. Введение низких доз фрондозида А ведет к увеличению числа и объема лизосом, так же как и увеличению их кислотности в мышиных перитонеальных макрофагах, что регистрировалось с помощью флуоресцентного зонда акридинового оранжевого на четвертый день после обработки. Максимальный стимулирующий эффект был обнаружен при концентрации фрондозида А 0.2 мкг/мышь, что приводило более чем к двукратному стимулированию лизосомальной активности. С другой стороны, существенно большие дозы, такие как 20 мкг/мышь и 200 мкг/мышь, вызывали противоположный эффект, показывающий значительное подавление лизосомальной активности, относительно контроля.
После введения фрондозида А значительное стимулирование происходило даже в первый день после инъекции. Максимальный стимулирующий эффект фрондозида А проявлялся на 4-5-й день после инъекции гликозида. После этого периода эффект плавно уменьшался и возвращался к уровню контроля на 12-й - 18-й день. Таким образом, стимулирующий эффект фрондозида А после однократной инъекции наблюдался в течение двух недель.
Фагоцитоз
Фрондозид А влияет как дозозависимый иммуномодулятор на поглощение бактериальных клеток Staphylococcus aureus перитонеальными макрофагами мыши in vitro. В концентрации от 0,01-0,0001 мкг/мл, фрондозид А стимулировал фагоцитоз бактерий с максимальным эффектом в 20% при концентрации 0,001 мкг/мл. При концентрации 0,01 мкг/мл гликозид существенно ингибировал фагоцитоз, а при концентрации 0,1 мкг/мл происходило незначительное уменьшение фагоцитоза.
Влияние на образование активных форм кислорода
Фрондозид А оказывает двойственное влияние на образование активных форм кислорода (АФК) или "оксидативный взрыв " в макрофагах in vitro. Этот эффект зависит от используемой концентрации гликозида. При концентрации фрондозида А 0,0001-0,01 мкг/мл обнаруживалось увеличение внутриклеточной флуоресценции в зеленой области, связанной с образованием родамина 123. Максимальный стимулирующий эффект наблюдался при концентрации 0,001 мкг/мл. С другой стороны, фрондозид А, примененный при цитотоксической концентрации 1,0 мкг/мл, значительно ингибировал образование активных форм кислорода, а при концентрации 0,1 мкг/мл был практически неэффективен относительно контрольного уровня.
Данные по влиянию фрондозида А на образование активных форм кислорода и на процессы фагоцитоза в макрофагах близки и показывают, что фрондозид А является прямым иммуномодулятором клеточного иммунитета.
Токсичность
Острая токсичность фрондозида А на белых мышах была определена как 9,9 мг/кг. Гемолитическая активность фрондозида А в тесте с 1%-ной суспензией мышиных эритроцитов составляет 3,50 мкг/мл (ЕС50) или 12,50 мкг/мл (ЕС100). Эмбриотоксичность фрондозида А относительно развивающихся эмбрионов морских ежей составляет 0.98 мкг/мл (ЕС50) или 3,12 мкг/мл (ЕС100).
Эти данные показывают, что эффективные иммуностимулирующие дозы фрондозида А примерно на два порядка ниже токсических доз при биотестировании в тестах как in vivo, так и in vitro.
Стимулирование иммунной системы млекопитающих путем введения фрондозида А в субтоксических дозах никогда ранее не было описано.
Описание иммуностимулирования и болезней, связанных с иммунитетом
Основная защитная функция иммунной системы относится к сопротивлению против вторжения патогенов, включая вирусы, рикетсии, микоплазмы, бактерии, грибы и паразиты всех типов. Таким образом, усиление иммунного ответа, особенно когда он изначально подавлен, улучшает сопротивляемость к инфицированию или инвазии вышеназванными патогенами.
Вторая защитная функция иммунной системы состоит в сопротивлении вживления инородной ткани либо естественной, либо от эмбрионов к материнскому организму или искусственной при трансплантации органов.
Третья защитная функция включает отсутствие реакции на собственные ткани с помощью положительных супрессорных механизмов. При автоиммунных и сходных нарушениях иммунная реактивность направлена на собственные антигены или избыточный, повышенный и несомненно деструктивный иммунный ответ.
В общем, иммунная система включает такие функциональные компоненты как клеточная иммунная система и гуморальный иммунитет. Иммунитет может быть специфичным или неспецифичным, врожденным и т.д. Основная цель иммунотерапии является коррекция различных иммунодефицитных явлений. Иммуномодуляторы нормализуют функционирование некоторых или/и всех частей иммунной системы животных с врожденным или приобретенным иммунодефицитом. Было найдено, что фрондозид А или физиологически приемлемая композиция на его основе действует как иммуностимулятор и усиливает клеточный иммунитет организма.
Таким образом, вещество в соответствии с изобретением или физиологически приемлемая композиция на его основе может быть использовано для лечения болезней, связанных с дефектами в иммунной системе, и/или увеличивать активность иммунной системы выше нормального уровня.
Настоящее изобретение обеспечивает использование фрондозида А или физиологически приемлемых композиций на его основе для производства медикаментов для активации иммунной системы.
Фармацевтическая композиция может быть таблеточной формой, включающей в себя фрондозид А как активное вещество и дополнительно картофельный крахмал и гипс как наполнитель в соотношении на одну таблетку, мг: фрондозид А - 0,05; картофельный крахмал - 45,0; гипс - 5,0 или фрондозид А - 0,005; сорбит - 45,0; стеарат кальция - 5,0.
Физиологически приемлемой композицией на основе фрондозида А может быть ИСКОМ (иммуностимулирующий комплекс, приготовленный на основе сапонина, холестерина, фосфолипида и белкового антигена). ИСКОМ является вакцинной формой, которая сочетает наличие какого-либо антигена и адъювант [Hoglund, S., Dalsgaard, К., Lovgren, К., Sundquist, В., Osterhaus, A. and В. Morein. «Iscoms and immunostimulation with viral antigens». In: Subcellular biochemistry (Ed. Harris, J.R.) Plenum, New York, 1989, p.39-68; Morein, В., Akerblom L. «The iscom - an approach to subunit vaccines». In: Recombinant DNA vaccines. Rationale and strategy (Ed. Isaacson, R.E.) Marcel Dekker, New York, 1992, p.369-386; Morein В., Villacres-Eriksson M., Akerblom L., Ronnberg В., Lovgren K., Sjolander A. 1994. «Mechanisms behind the immune response induced by immunostimulating complexes)). Aids Research and Human Retroviruses 10(S2): S109-S114; Morein В., Lovgren K., Ronnberg В., Sjolander A. and Villacres-Eriksson M. 1995. «Immunostimulating complexes: Clinical potential in vaccine development)). Clinical Immunotherapeutics 3: 461-475.]. Он имеет ячеистую структуру, построенную из сапонинов, холестерина, фосфолипидов, и белка. Обычно ИСКОМ'ы имеют симметрию икосаэдра, имея диаметр 30-40 нм и состоят из 12-нм кольцеобразных субъединиц. Встроенный с ИСКОМ'ом антиген вызывает усиление связанного с клетками иммунного ответа, усиление реакции гиперчувствительности замедленного типа и цитотоксический Т-лимфоцитный ответ при ограничении МНС класса I. Увеличенная экспрессия молекул МНС класса II также отмечается как первично, так и в обратной иммунизации ИСКОМ'ами. Экспериментальные ИСКОМ'овские вакцинные формы вызывают защитный иммунитет к большому числу микроорганизмов, в том числе и к вирусам, включая ретровирусы, паразиты и бактерии в различных видах животных, включая приматов. Использование ИСКОМ'ов как орального или интранасального иммунизационного вектора с естественными или рекомбинантными антигенами представляет новое направление в доставке антигенов, которое может увеличить индуцированный защитный иммунный ответ и может также иметь потенциальное прикладное значение на рынке вакцин для будущего использования в индустрии здоровья животных. ИСКОМ'ы являются стабильными частицами, построенными из сапонинов и липидов, организованных в мультимолекулярные структуры, которые содержат включенные антигены и, как было показано на бактериальных и вирусных моделях, дают увеличение иммунного ответа по различным транспортным маршрутам как на гуморальном, так и клеточном уровнях. Эти уникальные способности делали ИСКОМ'ы превосходными кандидатами для использования в птицеводстве вместе с антипаразитарными, анитивирусными и антибактериальными вакцинами.
ИСКОМ'ы представляют интересный подход к стимулированию гуморального и клеточного иммунного ответа к антипатическим антигенам. Это относительно стабильный, но нековалентносвязанный комплекс сапонинового адъюванта, холестерина и амфипатического антигена. Спектр вирусных капсульных антигенов и невирусных амфипатических антигенов, пригодных для вакцинации человека и встраиваемых в ИСКОМ'ы, включает грипп, корь, бешенство, gp340 из ЕВ-вируса, gpl20 из вируса ВИЧ, Plasmodium falciparum и Trypanosoma cruzi. Процедура приготовления ИСКОМ'ов включает солюбилизацию амфипатических белков в подходящих неионных детергентах, добавлении гликозида, холестерина и фосфатидилхолина. В присутствии амфипатических белков при удалении детергента образуются частицы ИСКОМ. Если в смеси нет белка или антигена, то образуется ИСКОМ'овский матрикс. Уникальными компонентами ИСКОМ'овского матрикса являются сапонины, обладающие аффинностью к холестерину, стабилизируя тем самым комплекс.
Несмотря на их сложность, ИСКОМ'ы относительно просты в приготовлении. В идеале ингредиенты используются в молярном соотношении 1:1:1:1 гликозида, холестерина, фосфатидилхолина и антигена. При использовании центрифуги три последних компонента помещаются на вершину 10-40% сахарозного градиента, содержащего 0.1% гликозид и нейтральный буфер с низкой ионной силой. Пробирка центрифугируется 4 часа при 150000 g, и ИСКОМ'ы скапливаются в зоне 19S примерно в середине градиента. Они последовательно отмываются рецентрифугированием в 20% сахарозе. Если для получения антигена используются детергенты с высокой критической концентрацией мицелл (т.е. когда выделяются белки вирусной оболочки), то тогда рекомендуется диализный метод для получения ИСКОМ'ов. По этому методу три реакционных компонента смешиваются с гликозидом таким образом, чтобы гликозид имел концентрацию 0.1%. Последующий 24-часовой диализ убирает детергент, образуются ИСКОМ'ы, а избыток гликозидов удаляют ультрацентрифугированием в 20% сахарозе. ИСКОМ'ы могут быть введены орально, интранозально или одновременно обоими путями. Оптимальные дозы должны быть определены для суспензии ИСКОМ'ов с конкретными антигенами.
Существует большое число обстоятельств, при которых иммунная система может быть поврежденной или работать неэффективно. Так, например, дефицит иммунной системы обычен для только что рожденных животных. Она также может быть подавлена определенными лекарствами, что может быть связано и их побочным действием, например при химиотерапии опухолей. Неупорядоченное функционирование одной или более составляющих частей иммунной системы, как это бывает при некоторых формах рака, также может приводить к иммунодефициту. Иммунодефицит может быть вызван вирусными инфекциям, включая ВИЧ. Домашние и сельскохозяйственные животные, например свиньи, при содержании на промышленных фермах могут иметь ослабленный иммунитет в результате тесного содержания животных и возникновением в связи с этим обстоятельством возбудителей различных болезней.
Следующий аспект настоящего изобретения раскрывает метод лечения пациентов или других млекопитающих с иммунодефицитом, который заключается во введении млекопитающему (включая человека) эффективных доз фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ или любую ИСКОМ-подобную композицию - это комбинации сапонина с холестерином без фосфолипида и антигена или только без антигена.
Под эффективным количеством понимается количество фрондозида А, которое будет восстанавливать или увеличивать иммунную функцию до нормального уровня, или увеличивать ее выше нормальной, чтобы избавиться от инфекции, бактериальной или вирусной патологии. Введение специфических доз таких иммуномодуляторов может быть определено квалифицированным специалистом в этой области, основываясь на данных, приведенных ниже.
Фрондозид А или физиологически приемлемые композиции на его основе могут быть введены для лечения или профилактики иммунодефицитных млекопитающих как сами по себе, так и в комбинации с другими терапевтическими агентами или противоопухолевыми агентами, например, с другими антивирусными агентами или антираковыми агентами.
Следующим аспектом настоящего изобретения является использование фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ'ы и любые ИСКОМ-подобные композиции для лечения или профилактики острых и хронических вирусных инфекций.
Примерами острых вирусных инфекций, против которых иммунотерапия фрондозидом А или физиологически приемлемыми композициями на его основе, включая ИСКОМ'ы и любые ИСКОМ-подобные композиции, может быть использована, преимущественно в комбинации с антивирусными агентами, которыми являются: вирусы герпеса, инфлуенцы, параинфлюенцы, аденовирусы, ротавирусы, вирусы гепатита А, вирус Алеутской болезни норок и хорьков, вирусы папилломы и энтеровирусы, аренавирусы, риновирусы, полиовирусы, вирус Нью-Кастлской болезни, вирусы бешенства, и, в общем, вирусные патогенезы, вызванные промышленным содержанием сельскохозяйственных животных.
Примерами хронических вирусных инфекций, против которых может быть использована терапия фрондозидом А или физиологически приемлемыми композициями на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, могут быть: персистентная герпесная вирусная инфекция, вирусная инфекция Эпштейна-Барра, инфекция вирусного гепатита и инфекция ВИЧ.
Настоящее изобретение применимо к лечению вирусных гепатитов во всех формах, пять из которых известны к настоящему времени: гепатиты А, В, С, D и Е соответственно.
Являясь ДНК-вирусами, эти вирусы герпесной группы являются источниками большинства обычных вирусных инфекций человека. Эта группа включает герпесный симплекс-вирус (HSV), варицелла зостер-вирус (VZV), цитомегаловирус (CMV); вирус Эпштейна-Барра (EBV) и вирус герпеса человека 6 (HHV6). HSV 1 и HSV 2 относятся к некоторым из наиболее обычных инфекционных агентов человека. Большинство из этих вирусов способны проникать в нервные клетки организма-хозяина; будучи единожды инфицированы, зараженные получают риск повторных клинических приступов инфекции, которые могут раздражать как психологически, так и физиологически.
Одна из групп РНК-вирусов имеет особую практическую важность, это ретровирусы. Ретровирусы образуют подгруппу РНК-вирусов, которая, чтобы реплицироваться, должна сначала обратно транскрибировать РНК их генома в ДНК (под "транскрипцией" условно описывают синтез РНК из ДНК). Будучи в форме ДНК вирусный геном может быть инкорпорирован в геном клетки-хозяина, позволяя ему принять участие в механизм транскрипции в клетке-хозяине с целью репликации. Будучи инкорпорированной, вирусная ДНК практически неотличима от ДНК клетки хозяина, и в этом состоянии вирус может сохраняться для жизни в клетке.
В случае иммуносупрессии в результате ВИЧ-инфекции профилактика может потребоваться тем пациентам, кто диагносцирован как серопозитивный по отношению к ВИЧ-инфекции, то есть имеет антитела к ВИЧ, и тем, у кого имеется прогрессирующая общая лимфоаденопатия (PGL) или ARC (СПИД-индуцированный комплекс), а также пациентам, страдающим от СПИДа, или пациентам, страдающим от СПИДоподобного иммунодефицита, где ВИЧ-инфекция не обнаруживаема, и кому требуется восстановление иммунитета, который не имеет специфичности к какому-либо конкретному вирусу.
Соединения или физиологически приемлемые композиции на их основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, могут быть применены как сами по себе, так и в комбинации с другими терапевтическими агентами для лечения вышеназванных инфекций или состояний. Комбинированная терапия, в соответствии с представляемым изобретением, состоит во введении фрондозида А или физиологически приемлемой композиции на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции и, по крайней мере, одного иного фармакологически активного ингредиента. Эти активные ингредиенты и фармакологически активные агенты могут быть введены вместе или по отдельности и при введении отдельно могут быть введены последовательно или отдельно в любом порядке. Количества активного ингредиента (ингредиентов) и фармакологически активных агентов и относительные графики введения будут выбираться для того, чтобы достичь желаемого комбинированного терапевтического эффекта. Преимущественно комбинативная терапия включает введение одного фрондозида А или физиологически активного функционального производного на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композицией одного из подходящих агентов.
Сообщалось, что по крайней мере 60% пациентов больных СПИДом страдают от пневмонии, вызванной вирусом Pneumocystis carinii (W.T.Huges, "Threatment and Prophylaxis of Pneumocystis carinii pneumoniae" Parasitology Today. 1987, 3, 332-335).
Без интенсивного лечения пневмония Pneumocystis carinii всегда смертельна для иммунодефицитных больных. Наиболее широко используемое лечение от этого состояния является лечение триметоприм-сульфаметаоксазолом (котримоксаолом) и пентамидином. Однако сообщается, что при обоих этих методах лечения имеется лишь примерно 50-70% эффективность относительно больных СПИДом, причем у более чем 50% больных наблюдаются вредные побочные эффекты от триматопорин-сульфаметоксазола или пентамидина (С.В. Wofsy, Antimicrobial Agents Annual. 1986, 1, 377-400).
Таким образом, существует потребность в новых агентах, особенно для профилактики пневмонии P. carinii.
Другим аспектом настоящего изобретения является применение фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, для лечения и профилактики пневмонии Pneumocystis carinii у млекопитающих, включая человека.
Следующий аспект настоящего изобретения обеспечивает использование фрондозида А и физиологически приемлемых композиций на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, для лечения состояний, вызванных относительным или абсолютным дефицитом Т-клеток, таких как синдром ДиДжорджа, грибковые инфекции, микоплазменные инфекции, туберкулез, проказа и волчанка.
Следующий аспект настоящего изобретения обеспечивает использование фрондозида А или физиологически приемлемой композиции на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, как вакцинного адъюванта. Вакцина может быть, следовательно, приготовлена из антигенного компонента с фрондозидом А.
Фрондозид А может быть введен млекопитающему перорально, парентерально (включая подкожное, кожное, внутримышечное и внутривенное введение), ректально и ингаляцией. Эффективная доза соединения будет зависеть от большого числа факторов, включая особенности пациента, тип иммунодефицита, различные условия, связанные с методом лечения и путем введения.
Для каждой вышеприведенной ситуации такая эффективная доза будет, в общем, колебаться в пределах от 1 до 20 мкг/кг веса человека или млекопитающего в день, предпочтительно в диапазоне от 1 до 15 мкг/кг веса тела в день и наиболее предпочтительно в диапазоне от 8 до 11 мкг/кг веса тела в день; оптимальной дозой является 10 мкг/кг веса тела в день. Вышеприведенные дозы при применении человеком оптимально должны повторно вводиться каждые 10 дней для эффективного стимулирования иммунной системы.
Несмотря на то, что возможно использование фрондозида А при введении его как индивидуального химического вещества, предпочтительнее использовать его в какой-либо лекарственной форме. Формы настоящего изобретения включают в себя фрондозид А, как это приведено выше, вместе с одним или более приемлемыми носителями и, оптимально, с другими терапевтическими ингредиентами. Носитель (носители) должны быть «приемлемы» в смысле быть совместимыми с другими ингредиентами и не отторгать реципиента от них.
Эти формы включают в себя те, которые подходят для перорального, парентерального (включая подкожное, кожное и внутримышечное), внутрилегочного и ректального введения, хотя наиболее подходящий путь будет зависеть, например, от состояния реципиента. Формы могут условно быть представлены в единицах дозирования, таких как капсулы, облатки или таблетки, могут быть приготовлены каким-либо методом, хорошо известным фармакологам. Все методы включают стадию внесения в смесь фрондозида А (действующее начало) с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем, формы готовятся однородными и с первоначально привнесенным в смесь активным ингредиентом с жидкими носителями или отдельно твердыми носителями и активными ингредиентами, а затем, если необходимо, производится преобразование продукта в желаемую форму.
Лекарственные формы настоящего изобретения подходят для перорального введения и могут быть представлены как отдельные единицы или капсулы, облатки или таблетки, каждая содержащая предопределенное количество активных ингредиентов; как порошки или гранулы; как раствор или суспензия в водной жидкости или неводной жидкости; или как липидная эмульсия масла в воде, аэрозоль или эмульсия воды в масле. Активный ингредиент может также быть представлен как пилюля, электуарий или паста.
Таблетка может быть сформована давлением или литьем, по необходимости с одним или более вспомогательным ингредиентом. Прессованные таблетки могут быть приготовлены сжатием активного ингредиента в виде порошка или гранул, по выбору, смешанного со связующим веществом, смазкой, инертным разбавителем, поверхностно активным или диспергирующим агентом. Литые таблетки могут быть сделаны литьем в подходящей машине смеси порошкообразных компонентов, увлажненных инертным жидким разбавителем. Таблетки могут быть по выбору облитыми или рифлеными и могут быть составленными таким образом, чтобы обеспечить медленный или контролируемый выход активного компонента из них.
Формы для паренталыюго введения включают водную или неводную стерильную инъекцию растворов, которые могут содержать антиоксиданты, бактериостатики и растворы, которые обеспечивают форме совместимость с кровью предполагаемого реципиента; а также водные или неводные стерильные суспензии, которые могут включать суспендирующие агенты. Формы могут быть представлены в одноразовой упаковке или многодозовых контейнерах, например, запаянных ампулах и пенициллиновых склянках, и могут храниться в сухом (лиофильно высушенном) состоянии, требующем только добавки стерильного жидкого носителя, например воды для инъекций непосредственно перед использованием. Подходящие инъекции растворов и суспензий могут быть приготовлены из стерильных порошков, гранул и таблеток в виде, описанном выше.
Формы для ректального введения могут быть представлены как свечи с обычными носителями, такими как масло какао.
Форма, подходящая для введения через легкие, представляет собой частицы, содержащие активный ингредиент и желательно имеющие диаметр от 0,5 до 7 микрон, и вдувается в бронхи реципиента.
Как одна из возможностей, такие формы могут быть приготовлены в виде мелко истолченного порошка, который по условиям может быть помещен в проникающей капсуле, например из желатина, для применения в ингаляторе или альтернативно, как самопроникающая форма, содержащая активный ингредиент, подходящий жидкий пропеллант и, по выбору, другие ингредиенты, такие как суфрактант и/или твердый разбавитель. Самопроникающие формы могут также быть применены таким образом, чтобы активный ингредиент распылялся в форме брызг раствора или суспензии.
Такие самопроникающие формы могут быть аналогичны известным и могут быть приготовлены по описанным процедурам. Подходящим образом они могут быть представлены в виде контейнера, обеспечивающего ручное или автоматическое использование регулятора, дающее желаемые характеристики аэрозоля; в более сложных вариантах регулятор также дает возможности впрыскивать фиксированные объемы, например, от 50 до 100 микролитров.
Помимо этого, активный ингредиент может быть использован в форме раствора для использования с помощью распылителя или форсунки посредством ускоренного воздушного потока или ультразвуковым перемешиванием, чтобы продуцировать аэрозоль для ингаляции.
Формы, подходящие для закапывания через нос, включают, подобные перечисленным выше формы для введения через легкие. Желательно, чтобы после диспергирования такие формы имели частицы диаметром от 10 до 200 микрон, чтобы быть способными задержаться в носовой полости; это может быть достигнуто, подходящим образом, через использование порошка с подходящими размерами частиц или выбора подходящего регулятора. Другими подходящими формами могут быть крупнозернистые порошки, имеющие диаметр частиц порядка 20 - 500 микрон, для быстрой ингаляции через носовой проход из контейнера, поднесенного близко к носу, и носовые капли, содержащие от 0,2 до 5 объемных процента активного ингредиента в водном или масляном растворе.
Предпочтительными формами единиц введения являются те, которые содержат эффективную дозу, как процитировано выше, или подходящую фракцию на ее основе, включая активный ингредиент.
Предпочтительными формами единиц введения являются те, которые содержат дневную дозу или часть дневной дозы, как процитировано выше, фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции.
Необходимо понимать, что добавления к ингредиентам, частично упомянутым выше, могут включать другие агенты, соответствующие конкретным формам, например в те, которые подходят для перорального введения, могут быть добавлены вкусовые агенты.
Фрондозид А или физиологически приемлемые композиции на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, могут быть использованы как депозитарные формы, известные соответствующим специалистам, из которых активный ингредиент выходит в течение пролонгированного периода, после введение этих форм в тело реципиента.
Фрондозид А может быть использован как средство для лечения и профилактики животных в случае иммунодефицитных состояний в случае вирусных или бактериальных инфекций. Дополнительно изобретение обеспечивает средство профилактики и лечения алеутской болезни, чумки и других болезней, сопровождающих ослабление иммунитета норок, хорьков и других животных. Также препараты могут быть использованы для увеличения количества новорожденных животных и уменьшения их смертности на постнатальной стадии развития, в виду того, что усиление иммунного ответа необходимо для успешного развития и здоровья новорожденных животных.
Культивирование пушных животных на фермах при искусственном климате требует высокоэффективных ветеринарных препаратов. В частности, химическое соединение фрондозид А с широким спектром физиологического действия может быть принято как один из таких препаратов. Типичные случаями массового применения являются: период перед гоном, в случае угнетенной иммунной системы и чумки, для превентивной терапии алеутской болезни норок. Широкий спектр действия и эффективность низких доз фрондозида А обеспечит возможное применение фрондозида А в звероводстве или для домашних животных, живущих внутри дома.
Свиньи при промышленном разведении в течение нескольких месяцев после прекращения кормления материнским молоком имеют повышенную смертность из-за оппортунистических инфекций, вызванными вирусами, бактериями, простейшими и грибами [Blecha et al., (J.Anim. Sci. 1983, 56, 396-400), Willcock et Schwartz (Salmonellosis, In: Diseases of Swine, 7th edition, Leman et al. (eds.), Iowa State University Press, Ames, Iowa, 1992, pp.570-583)]. Было обнаружено, что отлученные от кормления материнским молоком поросята имеют повышенную восприимчивость к инфекционным болезням относительно взрослых свиней или, наоборот, поросят-сосунков. Это увеличение в восприимчивости к инфекционным агентам после прекращения кормления материнским молоком может быть вызвано множеством факторов, включая потерю антител, вырабатываемых матерью, иммунодефицитом, связанным с быстрым развитием, а также стресс-индуцированной восприимчивостью из-за увеличения содержания глюкокортикоидов у этих поросят [Blecha et al. (ibid); Wilcock and Schwartz (ibid); Blecha et al. (Am. J.Vet. Res. 1985, 46, 1934-1937); Aurich et al. (J.Reprod. Fert. 1990, 89, 605-612); Abughali et al. (Blood. 1994, 83, 1086-1092); and El-Awar and Hahn (J. Leuk. Biol. 1991, 49, 227-235].
При общей тенденции к отрыву поросят от матери как можно раньше, в ряде случаев на 8-10-й день, уменьшение иммунитета, вызванного развитием, ведущее к увеличению чувствительности к инфекционным заболеваниям, становится более чем важной проблемой (Blecha et al., ibid). Соответствующий иммунный дефицит и последующее увеличение восприимчивости к инфекционным заболеваниям хорошо известно для млекопитающих. Например, дети, жеребята и телята проявляют дефицит как ослабленных нейтрофильных, так и Т-клеточных функциий, в первые недели жизни [Coignal et al. (Am. J. Vet. Res. 1984, 45, 898-901); Hauser et al. (Am. J. Vet. Res. 1986, 47, 152-153); Hill (Pediatric Research. 1997, 22, 375-382); Miller (Pediatrics. 1979, (suppl.), 709-712); Rosenthal and Cairo (Intern. J. Ped. Hem./Onc. 1995, 2, 477-487); Higuchi et al. (J. Vet. Med. Sci. 1997, 59, 271-276); Lee and Roth (Comp. Haem. Intern. 1992, 2, 140-147); Lee and Kehrli (Am. J. Vet. Res. 1998, 59, 37-43); and Zwahlen et al. (J. Leuk. Biol. 1992, 51, 264-269)]. Чувствительность к грамотрицательным бактериям также хорошо документирована для жеребят, поросят и телят [Carter and Martens (Comp. Cont. Educ. Pract. Vet. 1986, 8, 256-270); Drieson et al. (Aust. Vet. J. 1993, 70, 259-262); and Selim et al. (Vaccine. 1995, 13, 381-390)]. Молодые поросята имеют дефицит в отношении гуморального и клеточного компонента иммунной системы. Развитие компартментов В и Т-клеток до стабильного состояния в неонатальных поросятах занимает несколько недель, а содержание различных классов иммуноглобулинов в различных местах изменяются с возрастом поросят [Bianchi et al. (Vet. Immun. Immunopath. 1992, 33, 201-222) and McCauley and Hartmann (Res. Vet. Sci. 1984, 37, 234-241)]. Также отмечались пониженный митогенный ответ Т-клеток и пониженная нейтрофильная функция у молодых поросят [Blecha et al. (1983, ibid); El-Awar and Hahn (ibid); Shi et al. (J. Leuk. Biol. 1994, 56, 88-94); and Hoskinson et al. (J. Anim. Sci. 1990, 68, 2471-2478)].
Настоящий метод и иммуностимулирующие композиции этого изобретения могут быть эффективны для защиты свиней и/или норок и хорьков против инфекций, вызываемых большим набором микроорганизмов. Без каких-либо ограничений процесс и композиция полезны для обеспечения защиты против вирусных, бактериальных грибковых и протозойных патогенных состояний у свиней, норок и хорьков, включая те, которые описаны в литературе [Wilcock and Schwartz (ibid); The 1984 Yearbook of Agriculture: Animal Health.Hayes (ed.), U.S.Government Printing Office, LC 84 - 601135, 1984 - 451-784, pp.277-306]. В предпочтительном воплощении метод и композиции, в частности, эффективны для защиты свиней от сальмонелезов, вызванных, например, Salmonella choleraesuis and S. typhimurium. Изобретение может быть использовано для различных видов животных, включая хорьков, норок, свиней и других.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГ.1. Дозозависимый эффект фрондозида А на лизосомальною активность перитонеальных макрофагов мышей линии BALB/c; импользовали 0,5 мл гликозидного раствора (в стерильном физиологическом растворе, 0.9% NaCl i.p.). На 4-й день после инъекции макрофаги выделяли и оценивали лизосомальную активность с использованием красителя акридиновый оранжевый и счетчика флуоресценции. Значения определены ±se (n=100); 3 мыши (20 г средний вес) были использованы для каждой дозы.
ФИГ.2. Времязависимый эффект фрондозида А на лизосомальную активность перитонеальных макрофагов в мышах линии BALB/c, применение 0,5 мл гликозидного раствора при дозе 0.2 мкг/мышь (в стерилизованном физиологическом растворе, 0.9% NaCl, i.p.). В определенные дни после введения макрофаги выделялись, и лизосомальную активность оценивали, используя краситель акридиновый оранжевый и систему подсчета флуоресценции. Значения измерены ±se (n=100); 4 мыши (20 г средний вес) были использованы для каждой дозы.
ФИГ.3. Влияние фрондозида A in vitro на фагоцитоз меченных FITC клеток Staphylococcus aureus в перитонеальньгх макрофагах мыши. Время инкубации Фрондозида А с мышью составляет 1 ч.
ФИГ.4. Влияние фрондозида А, примененного при различных концентрациях, на выработку активных форм кислорода (оксидативный взрыв) в перитонеальных макрофагах мышей in vitro. Время инкубации гликозидов с клетками 1 час. Значения приведены ±se (n=100).
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ПРИМЕР 1
100 г порошка лиофильно высушенной варочной воды, полученной при промышленной пищевой переработке С.frondosa, помещают в литровую колбу, добавляют к нему смесь хлороформа и метанола в соотношении (1:1) (400 мл) и кипятят на теплой водяной бане с обратным холодильником при осторожном нагревании, чтобы избегать слишком резкого кипения смеси, в течение 1,5 часов. Затем экстракт охлаждают и фильтруют через вату с использованием обычной воронки. К остатку затем добавляют смесь хлороформ/метанол (1:1) (200 мл) и затем жидкую фазу декантируют и фильтруют. Эти экстракты объединяют и упаривают с добавлением небольших порций бутанола как пеногасителя.
Упаренные хлороформ/метанольные экстракты перерастворяют в воде в несколько приемов путем добавления небольших порций воды. Порции декантируют в отдельную колбу. В результате получают 0,7 л коллоидного раствора. Затем к раствору добавляют 300 мл этилацетата. Смесь перемешивают 3 часа на магнитной мешалке и оставляют на ночь для расслаивания фаз. Затем водную фазу декантируют через сифонный шланг, разбавляют водой в 10 раз и затем загружают на колонку с тефлоновым порошком (Teflon Dupont No.9В) (объем колонки составляет около 1,5 л).
Колонку с тефлоном затем промывают водой до удаления солей и следовых количеств пигментов. Гликозиды элюируют 65% ацетоном. Объем каждой собираемой фракции составляют около 50 мл. Гликозид-содержащие фракции затем упаривают с добавлением бутанола как пеногасителя и колонку регенерируют чистым ацетоном в количестве двух объемов колонки. Получают 850 мг сырой гликозидной суммы.
Для дальнейшего разделения смеси используют силикагельную флэш-колонку Biotage Si 40L 2632-2 с подвижной фазой хлороформ/этанол/вода (100:100:17). Сырую гликозидную фракцию, полученную после хроматографии на тефлоне, растворяют в минимальном количестве системы растворителей при добавлении по каплям небольшого количества воды и загружают на колонку. Колонку затем элюируют 0,5 л подвижной фазы, собирают фракции по 10 мл. После завершения выхода фрондозида А подвижную фазу меняют на хлороформ/этанол/вода (100:150:50). Все стадии контролируют по ТСХ (хлороформ/этанол/вода (100:100:17) на пластинках с силикагелем. Получено 50 мг фрондозида А, 136 мг фракции дисульфатированных и 171 мг фракции трисульфатированных гликозидов.
ПРИМЕР 2
100 г порошка лиофильно высушенной варочной воды С.frondosa помещают в 1 л колбу, заливают смесью хлороформ/метанол (1:1) (600 мл) и кипятят с обратным холодильником на теплой водяной бане при осторожном нагревании в течение 1,5 часов. Экстракт затем охлаждают и фильтруют через вату, используя обычную воронку. Остаток затем промывают смесью хлороформ/метанол (1:1). Жидкие фазы декантируют и фильтруют. Эти экстракты затем объединяют и упаривают с добавлением бутанола как пеногасителя.
Упаренный хлороформ-метанольный экстракт растворяют в воде в несколько приемов. Порции воды декантируют в отдельную колбу. В результате получают около 0,7 л коллоидного раствора. Затем к раствору добавляют 300 мл этилацетата. Эту смесь затем перемешивают на магнитной мешалке и оставляют на ночь для разделения слоев. Водный слой затем декантируют с помощью сифонного шланга. Водную фазу разбавляют в десять раз и загружают на колонку с тефлоном (Teflon Dupont No.9В), объем колонки составляет порядка 1,5 л.
Колонку с тефлоном промывают затем водой до удаления солей и следов пигментов. Затем гликозиды промывают 65% ацетоном. Объем каждой фракции составляет порядка 50 мл. Гликозид-содержащие фракции затем упаривают с добавлением бутанола как пеногасителя, а колонку регенерируют чистым ацетоном в количестве равном двум объемам колонки. Получают 110 мг сырой смеси, содержащей Фрондозид А.
Для дальнейшей очистки используют силикагельная флэш-колонка Biotage Si 40L 2632-2 с системой хлороформ/этанол/вода (100:100:17). Пробу сырого фрондозида А после хроматографии на тефлоне растворяют в минимальном объеме системы растворителей при добавлении по каплям воды на горячей водяной бане и загружают на колонку. Колонку затем элюируют 0,5 литрами системы растворителей, собирая фракции по 10 мл. Все стадии контролируют по ТСХ. Получают 50 мг фрондозида А.
ПРИМЕР 3
100 г лиофильно высушенных и истолченных в крупнозернистый порошок стенок тела С.frondosa помещают в литровую колбу, добавляют к нему смесь хлороформа и метанола в соотношении (1:1) (400 мл) и кипятят на теплой водяной бане с обратным холодильником при осторожном нагревании, чтобы избегать слишком резкого кипения смеси, в течение 1,5 часов. Экстракт затем охлаждают и фильтруют через вату с использованием обычной воронки. К остатку затем добавляют смесь хлороформ/метанол (1:1) (200 мл) и жидкую фазу затем декантируют и фильтруют. Эти экстракты объединяют и упаривают с добавлением небольших порций бутанола как пеногасителя.
Упаренные хлороформ-метанольные экстракты перерастворяют в воде в несколько приемов путем добавления небольших порций воды. Порции декантируют в отдельную колбу. В результате получают 0,7 л коллоидного раствора. Затем к раствору добавляют 300 мл этилацетата. Смесь перемешивают 3 часа на магнитной мешалке и оставляют на ночь для расслаивания фаз. Водную фазу затем декантируют через сифонный шланг. Водную фазу затем разбавляют водой в 10 раз и загружают на колонку с тефлоновым порошком (Teflon Dupont No.9В) (объем колонки составляет около 1,5 л).
Колонку с тефлоном затем промывают водой до удаления солей и следовых количеств пигментов. Гликозиды затем элюируют 65% ацетоном. Объем каждой собираемой фракции составляет около 50 мл. Гликозид-содержащие фракции затем упаривают с добавлением бутанола как пеногасителя и колонку регенерируют чистым ацетоном в количестве двух объемов колонки. Получают 970 мг сырой гликозидной суммы.
Для дальнейшего разделения смеси используют силикагельную флэш-колонку Biotage Si 40L 2632-2 с подвижной фазой хлороформ/этанол/вода (100:100:17). Сырую гликозидную фракцию, полученную после хроматографии на тефлоне, растворяют в минимальном количестве системы растворителей при добавлении по каплям небольшого количества воды и загружают на колонку. Колонку затем элюируют 0,5 л подвижной фазы, собирая фракции по 10 мл. После завершения выхода фрондозида А подвижную фазу меняют на хлороформ/этанол/вода (100:150:50). Все стадии контролируют по ТСХ на пластинках с силикагелем. Система растворителей для ТСХ - хлороформ/этанол/вода (100:100:17). Получают 65 мг фрондозида А, 60 мг фракции дисульфатированных и 246 мг фракции трисульфатированных гликозидов.
ПРИМЕР 4
Для тестирования in vivo использовались мыши линии BALB/c. Фрондозид А вводили внутрибрюшинно (0,5 мл раствора фрондозида А в дистиллированной воде). Дистиллированную воду вводили в контрольных мышей. Через четыре дня после обработки мышей умерщвляли методом первисцеральной дислокации и перитонеальные макрофаги выделяли по стандартной методике.
Оценка внутриклеточной лизосомальной активности проводилась окраской и локализацией лизосом в живых макрофагах флуоресцентным красителем акридиновый оранжевый с последующим анализом изображений флуореценции клеток. С этой целью 250 мкл перитонеальной жидкости мышей помещали на предметное стекло микроскопа и оставляли инкубироваться на один час при 37°С. После адгезии макрофагов предметное стекло трижды промывали фосфатно-солевым буферным раствором (ФСБ, pH 7,5). 250 мкл раствора акридинового оранжевого ("Calbiochem", 100 мкг/мл в ФСБ) было по каплям добавлено в клеточный монослой, и стекло инкубировали при 37°С в течение 30 минут. Клеточный монослой затем трижды промывали ФСБ. Покровные стекла монтировались на предметном столике флуоресцентного сканирующего устройства, основанного на инверсионном микроскопе Axiovert 200 (Zeiss, Germany). Люминесцентная лампа 75 W Optosource xenon arc lamp и DAC-контролируемый монохроматор Optoscan (Cairn Research Ltd., UK) использовались в качестве источников света для возбуждения флюоресценции при λ=489 нм; фильтр-блок HQ FITC (Chroma Technology Corp., USA) и объектив Fluar 40×/1.30 Oil objective (Zeiss, Germany) были использованы для визуализации флуоресценции акридинового оранжевого в лизосомах. Изображения красно-оранжевой флуоресценции клеток регистрировались с помощью цифровой видеокамеры Hamamatsu Orca-ER С4742-95 (Hamamatsu Photonics K.K., Japan) и передавались в IBM-совместимый компьютер P-IV с интерфейсом Firewire data. Интенсивность флуоресценции случайно выбранных 100 изображений клеток оценивалась с помощью программы AQM Advance 6 (Kinetic Imaging Ltd., UK) и вычислялась по средней интенсивности флуоресценции каждой клетки, выраженной в пикселях.
Для каждой дозы использовалось шесть мышей. Все эксперименты были повторены трижды. Значения и стандартные отклонения для каждого эксперимента вычислялись и наносились на график с помощью программы SigmaPlot 3.02 (Jandel Scientific, San Rafael, CA).
Фрондозид А вводился в низких субтоксических концентрациях в диапазоне 0,002-2,0 мкг/мышь, вызывающих значительный иммуностимулирующий эффект на мышиные перитонеальные макрофаги дозозависимым образом. Инъекция этих доз гликозида приводила к увеличению в числе и объеме лизосом, так же как к увеличению их кислотности, измеренной по флуоресценции акридинового оранжевого. Максимальный стимулирующий эффект был определен при концентрации фрондозида А 0,2 мкг/мышь, при этом была показана более чем двукратная стимуляция их лизосомальной активности. С другой стороны, намного большие дозы 20 мкг/мышь и 200 мкг/мышь вызывали противоположный эффект, выражавшийся в значительном подавлении лизосомальной активности относительно контрольного уровня. Результаты показаны на Фиг.1.
Таким образом, было определено дозозависимое иммуномодулирующее влияние фрондозида А. Показано, что фрондозид А дает иммуностимулирующий эффект в низких субтоксических концентрациях и вызывает ингибиторные эффекты на лизосомальну активность макрофагов при концентрациях в 100 раз больших, чем стимулирующие дозы.
ПРИМЕР 5
Лизосомальная активность определялась, как описано в примере 3. При экспериментах с каждой дозой использовалось по четыре мыши. Значения и стандартные отклонения вычислялись и наносились на график с помощью программы SigmaPlot 3.02 (Jandel Scientific, San Rafael, CA).
Все эксперименты проводились в течение 24 дней. В течение этого времени активность лизосом макрофагов контрольных животных существенно не изменялась. Действие фрондозида А проявлялось как быстрая и значительная стимуляция, которая обнаруживалась уже на 1-й день после инъекции. Максимальный стимулирующий эффект фрондозида А был показан на 4-5-й день после инъекции (Фиг.2). После этого периода эффект плавно уменьшался и возвращался к контрольному уровню на 12-18-й день эксперимента.
Таким образом, стимулирующий эффект фрондозида А после единичной инъекции наблюдался в течение двух недель.
ПРИМЕР 6
Фагоцитоз в мышиных макрофагах наблюдался и оценивался после интернализации инородных частиц, таких как бактериальные частицы, меченных флуоресцентно. При этой методике использовалась возможность обнаружения внутриклеточной флуоресценции, вызванной поглощенными частицами, равно как гашение флуоресценции зонда во внеклеточной области с помощью трипанового синего.
Бактерии Staphylococcus aureus (209 штамм) были деактивированы нагреванием в течение 40 минут при 100°С и затем инкубированы при концентрации 1×109 бактерий/мл с раствором 0,1 мг/мл флуоресцин изотиоцианата (FITC "Sigma", растворенный в DMSO) в 50 мМ NaHCO3 в 100 мМ NaCl (pH 9.5) в течение 7 часов при +4°С в темноте. Бактерии затем дважды промывали ФСБ (центрифугирование, 1000×g, 25 мин), чтобы удалить свободный FITC и ресуспендировали в ФСБ до конечной концентрации 1×108 бактерий/мл. Меченые бактерии хранили до эксперимента при -70°С.
Фагоцитоз оценивался в соответствии с протоколом Molecular Probes protocol для набора Vybrant™ Phagocytosis Assay Kit.
Макрофаги были выделены из перитонеальной жидкости белых мышей линии BALB/c по стандартной методике. Клеточную суспензию (100 мкл) с концентрацией 1×106 клеток/мл в ФСБ раскапывали в каждую лунку 96-луночной микропланшеты и добавляли по 50 мкл раствора фрондозида А в ФСБ в различных концентрациях. Некоторые отрицательные (без макрофагов) и положительные (без эффектора) контроли также были включены в экспериментальный ряд микропланшеты. Затем микропланшеты помещались в термостат при 37°С, как минимум, на час, чтобы дать клеткам прикрепится ко дну и для инкубации клеток с тестируемым веществом. Затем среду удаляли вакуумной аспирацией и во все лунки добавляли по 100 мкл приготовленной суспензии бактериальных клеток, меченных FITC с концентрацией 1×107 бактерий/мл, и микропланшету помещали в термостат на два часа. Затем суспензию флуоресцирующих бактерий удаляли и в лунки немедленно добавляли 100 мкл раствора трипанового синего (конечная концентрация трипанового синего составляла 0,25 мг/мл). Микропланшету инкубировали 1 минуту при комнатной температуре и затем среду убирали вакуумной аспирацией.
Флуоресценция в экспериментальных и контрольных лунках измерялась флуоресцентным планшетным сканнером Fluoroscan Ascent ("ThermoLabsystems", Finland) с набором пары фильтров 485 нм и 518 нм для возбуждения и регистрации флуоресценции, соответственно. Эффективность фагоцитоза в ответ на эффектор затем определялся следующим образом:
% Эффекта = Чистое экспериментальное считывание / Чистое положительное считывание × 100% где:
Чистое экспериментальное считывание - разница между средней интенсивностью флуоресценции группы экспериментальных лунок и группы лунок отрицательного контроля. Это значение отражает изменение фагоцитоза при введении эффектора.
Чистое положительное считывание - разница между средней интенсивностью флуоресценции группы лунок отрицательного контроля и группы позитивного контроля. Это значение представляет фагоцитоз при нормальных физиологических условиях. Эксперименты при различных концентрациях эффектора проводились группами по 4-5 повторов. Все эксперименты проводились трижды.
Фрондозид А действовал как иммуномодулятор дозозависимым образом. При концентрации 0,01-0,0001 мкг/мл, фрондозид А стимулировал фагоцитоз бактерий с максимальным эффектом около 20% при концентрации 0,001 мкг/мл (Фиг.3). При концентрации 1 мкг/мл гликозид значительно ингибировал фагоцитоз, а при концентрации 0,1 мкг/мл также наблюдалось незначительное уменьшение фагоцитоза.
ПРИМЕР 7
Образование активных форм кислорода в мышиных перитонеальных макрофагах оценивался по количеству нефлуоресцирующего дигидрородамина 123 после его окисления внутриклеточным дыхательным взрывом до родамина 123. Конверсия дигидрородамина 123 в родамин 123 отражает продукцию в мышиных макрофагах Н2О2, О2 и пероксинитрита, которые связаны с продукцией окиси азота, и образование перекисей, зависимых от НАДФ-оксидазы.
Анализ флуоресценции при обнаружении образования активных форм кислорода в макрофагах проводили в соответствии со стандартным методом (с некоторыми модификациями). (E.W. Childs, K.F. Udobi, J.G. Wood, F.A. Hunter, D.M. Smalley, L.Y. Cheung, "In vivo Visualization of Reactive Oxidants and Leukocyte-Endothelial Adherence Following Hemorrhagic Shock," Shock. 2002. 18, 423 - 7); (S.F. Emmendorffer, M. Hecht, M.-L. Lohman-Mattes, J. Roester, "A Fast Easy Method to Determine the Production of Reactive Oxygene Intermediates by Human and Murine Phagocytes Using Dihydrorodamine 123," J.Immunol. Meth. 1990. 131, 269-275).
С этой целью 250 мкл перитонеальной жидкости белых мышей линии BALB/c помещали на покровное стекло микроскопа и оставляли на один час при 37°С. После адгезии макрофагов покровное стекло трижды промывали раствором ФСБ (pH 7.5). 250 мкл раствора фрондозида А в различных концентрациях в ФСБ добавляли к клеточному монослою и стекла инкубировали еще в течение одного часа при 37°С. После инкубации клетки промывали трижды и к клеточному монослою добавляли по каплям 250 мкл раствора дигидрородамина 123 ("Sigma", 100 нг/мл в PBS включая 0,5 мМ азида натрия) и стекла инкубировали 10 минут при 37°С. Клеточный монослой затем трижды промывался ФСБ. Покровные стекла монтировались на предметном столике флуоресцентного сканирующего устройства, основанного на инверсионном микроскопе Axiovert 200 (Zeiss, Germany). Люминесцентная лампа 75W Optosource xenon arc и DAC-контролируемый монохроматор Optoscan (Cairn Research Ltd., UK) использовались в качестве источников света для возбуждения флюоресценции при Х=488 нм; фильтр-блок HQ FITC (Chroma Technology Corp., USA) и объектив A-Plan 40×/0.65 Ph2 объектив (Zeiss, Germany) были использованы для визуализации флуоресценции использовались для визуализации флуоресценции родамина 123 в клетках. Изображения зеленой флуоресценции клеток регистировались с помощью цифровой видеокамеры Hamamatsu Orca-ER С4742-95 (Hamamatsu Photonics K.K., Japan) и передавались в IBM-совместимый компьютер P-IV с интерфейсом Firewire data. Флуоресенцию случайно выбранных 300 изображений клеток измеряли с помощью программы AQM Advance 6 (Kinetic Imaging Ltd., UK) и выражали как среднюю интенсивность флуоресценции для каждой клетки в пикселях.
Все эксперименты проводили трижды. Значения и стандартные отклонения для каждого эксперимента вычислялись и графически обрабатывались с использованием программы SigmaPlot 3.02 (Jandel Scientific, San Rafael, CA).
Фрондозид А вызывал двойной эффект на образование активных форм кислорода в мышиных макрофагах. Этот эффект зависел от используемой концентрации гликозида. При концентрации фрондозида А в диапазоне 0,0001-0,01 мкг/мл наблюдалось увеличение внутриклеточной зеленой флуоресценции родамина 123. Максимальный стимулирующий эффект наблюдался при концентрации 0,001 мкг/мл. С другой стороны, фрондозид А, использованный при цитотоксической концентрации 1,0 мкг/мл, существенно ингибировал образование активных форм кислорода, а при концентрации 0,1 мкг/мл практически не влиял на образование активных форм кислорода относительно контроля (Фиг.4).
ПРИМЕР 8
В экспериментах по определению острой токсичности использовались лабораторные белые мыши. Каждая экспериментальная группа состояла из 6 животных (19-21 г весом). Фрондозид А в растворе 0,9% NaCl в различных концентрациях водился i.p. в объеме 0,5 мл на животное. Физиологический раствор без фрондозида А был введен как контроль. Схема применения гликозида показана в Таблице 1.
Наблюдение за животными проводилось в течение двух недель, количество погибших и живых животных определялось ежедневно.
Для вычисления LD50 использовался метод Кербера (G. Karber, Arch. Exp. Pathol. Pharm. 1931, 162, 480.) с использованием следующей формулы:
LD50=LD100-∑(zd)/m;
где:
LD100 - доза, которая вызывает эффект на всех животных в группе;
z - среднеарифметические значения числа животных, где эффект наблюдался под влиянием двух смежных доз;
d - интервал между каждыми двумя смежными дозами;
m - число животных в каждой группе.
Острая внутрибрюшинная токсичность (LD50) для фрондозида А определена как 9,9 мг/кг
ПРИМЕР 9
Эритроциты были выделены из крови мышей, трижды промыты ФСБ (pH 7,4) с использованием центрифугирования (450×g, 10 мин), и осадок эритроцитов был ресуспендирован в ФСБ до конечной концентрации 1,0% и оставлен на хранение на льду.
Для определения гемолитической активности 100 мкл водного раствора фрондозида А при различных концентрациях перемешивались с 900 мкл суспензии эритроцитов и инкубировались при 37°С в течение 1 часа. Затем клетки осаждали центрифугированием, а аликвоту супернатанта (200 мкл) помещали в лунки 96-луночной микропланшеты и концентрацию гемоглобина в супернатанте определяли спектрометрически при λех=541 на фотометре планшетного формата "μQuant" (Bio-Tek Instruments, Inc). Результаты были представлены как процент гемолиза и нанесены на график.
Фрондозид А вызывал гемолитическое действие на эритроциты мыши. Эффективные концентрации, вызывающие гемолиз, были 3,5 мкг/мл (ЕС50) и 12,5 мкг/мл (ЕС100)
ПРИМЕР 10
Для определения эмбриотоксичности использовали эмбрионы морского ежа Strongylocentrotus nudus в соответствии с методом Кобаяши с некоторыми модификациями. Для выделения созревших яйцеклеток или спермы в полость морского ежа вводили 1-2 мл 0,5 М раствора KCl. Яйцеклетки и сперма (отдельно) собирались в стеклянные стаканы с морской водой. Когда женские особи полностью выметывали икру, яйцеклеткам давали возможность осесть на дно культивационного бокса, заполненного фильтрованной и насыщенной воздухом морской водой, и затем просто морской водой. Процесс повторяли три раза, чтобы отмыть желеобразную пленку с яиц. После искусственного оплодотворения 0,9 мл суспензии яйцеклеток с плотностью 1×103 клеток/мл помещали в каждую лунку 24-луночной микропланшеты, содержащей тестируемый раствор (0,1 мл) и затем планшету оставляли при 20-22°С в течение 2 часов до достижения стадии 8-бластомеров (контроль). Затем аликвоты раствора формальдегида (2%) добавляли в каждую лунку, чтобы зафиксировать эмбрионы. Несколько сот эмбрионов проверялись для каждой концентрации токсиканта и количество развившихся до стадии 8-бластомеров эмбрионов определялось с помощью инверсионного микроскопа. Все эксперименты повторяли трижды. Результаты выражали как процент от контроля и наносили на график.
Значения и стандартные отклонения для каждой пробы вычислялись с помощью дозозависимых графиков, используя программу SigmaPlot 3.02 (Jandel Scientific, San Rafael, CA).
Фрондозид А вызывал эмбриотоксический эффект на развитие эмбрионов морского ежа. Эффективные концентрации составляли 0,98 мкг/мл (ЕС50) и 3,12 мкг/мл (ЕС100).
ПРИМЕР 11. Получение ИСКОМ (иммуностимулирующий комплекс, приготовленный на основе сапонина, холестерина, фосфолипида и белкового антигена).
Общий экспериментальный подход:
ИСКОМ'ы получаются на основе фрондозида А, холестерина, яичного фосфатидилхолина и антигена вируса гриппа в молярном соотношении 1:1:1:1. Метод получения 1: три последних компонента (холестерин, яичный фосфатидилхолин и антиген вируса гриппа) помещают на вершину 10-40% градинета сахарозы, содержащий 0.1% фрондозида А и нейтральный буфер с низкой ионной силой, например PBS. Пробирку ультрацентрифугируют 4 часа при 150000g, и ISCOM'ы образуются в зоне, соответствующей 19S недалеко от середины градиента. Затем они последовательно отмываются рецентрифугированием в 20% сахарозе.
Метод получения 2: если для получения антигена используются детергенты с высокими критическими концентрациями мицелл (т.е. когда выделяется протеиновая оболочка вируса), тогда для получения ISCOM'a используется диализ. По этой методике холестерин, яичный фосфатидилхолин и антиген вируса гриппа смешивается с фрондозидом А, чтобы конечная концентрация гликозида достигла 0.1%. В последующие 24 часа детергент удаляют с помощью диализа, образуются ИСКОМ'ы, а избыток гликозида удаляется ультрацентрифугированием в 20% сахарозе в течение 4 часов при 150000 g.
В любом типе ИСКОМ'ов концентрация фрондозида А должна быть 100 мкг/мл суспензии ИСКОМ'а. Последующие компоненты суспензии ИСКОМ'а: холестерин-386,7 Da, яичный фосфатидилхолин - приблизительно 700 Da, неструктурный белок оболочки вируса гриппа А - 26 kDa. Следовательно, 1 мл всех компонентов ИСКОМ должен состоять из следующих компонентов: холестерин - 386,7 мг, яичный фосфатидилхолин - 700 мг, неструктурный белок оболочки вируса гриппа А - 26 г. 1 мл этой композиции смешивается со 100 мкг фрондозида А таким образом, чтобы конечная концентрация фрондозида А составляла 100 мкг/мл или 0.01%.
Иммуностимулирование у животных и людей с ослабленным иммунитетом
ПРИМЕР 12. Определение увеличения иммунитета у поросят. Экспериментальный дизайн:
Две группы поросят, на 10-й или 11-й день оторванных от свиноматки и изолированных от других групп, используются в испытаниях действия фрондозида А как подкожно инъектированного иммуностимулирующего агента, способного защитить растущих свиней от оппортунистических болезней, связанных с уменьшением иммунного ответа, обычного для таких условий. Поросятам группы А делаются подкожные инъекции фрондозида А при дозировке 1 мкг/кг веса тела каждые десять дней в течение четырех месяцев. Группа В не подвергается инъекциям. В конце четырех месяцев свиньи группы А, которым делались инъекции, показали значительно меньшую смертность и заболеваемость, чем группа В.
Повышенная восприимчивость к инфекционным заболеваниям при отрыве от свиноматки может быть связана с несколькими факторами, включая потерю антител, производимых свиноматкой, дефицитом в иммунитете, связанным с развитием поросенка и повышенным содержанием глюкокортикоидов в животных после отрыва от матери. Спрос на продукцию свиноводческой индустрии заставляет промышленников искать пути увеличения продукции. Один из возможных способов увеличить продукцию мог бы быть связан с максимально ранним отрывом поросят-сосунков от свиноматки. Однако оторванные от свиноматки поросята и детеныши других видов в раннем возрасте показывают ослабленное здоровье и выживаемость относительно взрослых животных, наиболее вероятно из-за дефицита в иммунном ответе и связанной с этим невозможностью бороться с инфекцией [Blecha et al., 1983, (ibid); Wilcock and Schwartz (ibid); El-Awar and Hahn (ibid); Carter and Martens (ibid); Drieson et al. (ibid); Selim et al. (ibid); Shi et al., J.Leuk. Biol. 1994, 56, 88-94; and Hoskinson et al., J.Anim. Sci. 1990, 68, 2471-2478]. Если потеря материнских антител и дефицит иммунной системы, связанный с развитием молодых поросят, по-крайней мере, частично ответственны за увеличенную восприимчивость к бактериальным заболеваниями после отрыва от матери, ранний отрыв поросят от свиноматок оставляет этих поросят с точки зрения иммунологиии более беззащитными, чем поросят, отрываемых от свиноматки в более взрослом возрасте.
ПРИМЕР 13. Определение антивирусной активности против Алеутской болезни норок и хорьков. Экспериментальный дизайн:
Алеутская болезнь в норках и хорьках обуславливается парвовирусом, против которого нет эффективной терапии. Развитие болезни включает в себя накопление иммунных комплексов в различных органах, IL-6 экспрессию, нейрологическую патологию, воспалительные состояния, неизбежный упадок сил и, в определенном процентном отношении от пораженных животных, иммунный взрыв и смерть.
В условиях хосписа для домашних хорьков, пораженных Алеутской болезнью, фрондозид А инъектировался подкожно в дозе 1 мкг/кг веса тела 10 животным, зараженным Алеутской болезнью с симптоматикой гипертрофированного иммунного ответа, вызванного болезнью. По прошествии трех месяцев симптомы болезни уменьшились, что было выявлено определением уровня антител относительно исходного уровня для каждой особи.
ПРИМЕР 14. Фрондозид А и антипротозойная лекарственная терапия инфекции Pneumocystis carinii, связанной с ВИЧ. Экспериментальный дизайн:
ВИЧ-1 исследуемый пациент помещается в больницу из-за пневмонии Pneumocystis carinii (РСР). Пациент подвергается в течение двух недель терапии аэрозолированным пентамидином и фрондозидом А с дозами фрондозида при 1 мкг/кг живого веса введенном IP. Симптоматика проходит через две недели.
ПРИМЕР 15. Определение улучшения в CD-4 счете в ВИЧ-инфицированных людях.
Экспериментальный дизайн:
Ожидается, что иммуностимулирующая активность, показанная как в экспериментах in vitro, так и in vivo будет иметь применение к патологиям ВИЧ-инфицированных. Как иллюстративный пример, 20-ти ВИЧ-инфицированным со счетом CD-4 ниже 250 вводится внутримышечно каждую неделю фрондозид А в физрастворе в дозе 3 мкг/кг живого веса. После четырех месяцев такого лечения счет CD-4 возвращается к нормальному уровню выше, чем 400, патологии оппортунистических болезней уменьшаются и пациенты становятся свободными от симптомов болезни. Увеличенный фагоцитоз макрофагов, ведущий к антивирусной активности, определяется по наблюдаемым эффектам.
ПРИМЕР 16. Определение сопротивляемости к бактерии сибирской язвы в человеке.
Экспериментальный дизайн:
Поскольку увеличение иммунного ответа в млекопитающих является одним из факторов в защите против бактериальной инфекции человек, в которого ввели фрондозид А из настоящего изобретения, определенно имеет большую резистентность против биотеррористической атаки, в которую включена обычная или специально полученная для военных целей сибирская язва. В предполагаемом эксперименте лабораторные животные разделяются на две группы, группа А и группа В. Группы А и В инфицируются сибирской язвой методами, известными специалистам в этой области. Только животным группы А за 10 дней до и в течение двух месяцев в процессе исследования внутрибрюшинно вводится фрондозид А при дозах 3 мкг/кг веса тела. В случае группы А свыше 60% животных остаются живыми в конце эксперимента. Может быть экстраполировано, что такой эксперимент на животных или проведенный в иных условиях, описанный настоящим изобретением, будет клинически использоваться теми специально обученными представителями населения, такими как солдаты и др., которые имеют повышенный риск подвергнуться инфицированию сибирской язвой или другими бактериальными патогенами.
Совершенно ясно, что вышеупомянутое подробное описание дается только для иллюстрации и что модификации и вариации, не нарушающие сути и буквы изобретения, могут быть сделаны.
ПРИМЕР 17. Тестирование ИСКОМ'а.
Общий экспериментальный подход:
ИСКОМ'ы, содержащие антиген инфлюенцы, фрондозид А, холестерин и фосфатидилхолин, как это описано выше, вводятся орально в течение 14 дней пациентам, экспериментально инфицированным вирусом инфлюенцы. Десять дополнительных добровольцев инфицируются экспериментально, но без получения ИСКОМ'а или какого-либо иного лечения. В течение эксперимента пациенты, которым назначен ИСКОМ, получают его равными порциями (примерно по 1 мл суспензии в день). В конце двухнедельного периода пациенты контрольной группы имеют больше вирусной симптоматики, чем те, которым давался ИСКОМ. Дополнительные способы введения, включая интранасальный, используются в ходе дальнейших экспериментов с тестируемой и контрольными группами со схожими результатами, показывающими, что фрондозид А включенный в форму ИСКОМ'а, является эффективным при интранасальном пути введения.
ПРИМЕР 18. Тестирование ИСКОМ-подобной композиции
Общий экспериментальный подход:
ИСКОМ-подобные композиции, содержащие фрондозид А, холестерин и фосфатидилхолин, как описано ранее, но без антигена вводятся орально домашним хорькам, нуждающимся в иммуностимулировании в результате иммунодефицита, вызванного продолжительной Алеутской болезнью. Композиции даются орально, ежедневными дозами, приблизительно соответствующими 10 микрограммам фрондозида А при соотношении фрондозида А, холестерина и фосфолипида 1:1:1 в течение 14 дней. В конце 14-дневного периода симптоматика Алеутской болезни значительно уменьшается по оценке владельцев животных.
Ежедневная доза фрондозида А, включенная в ИСКОМ-подобные композицию, должна быть 1 мкг на кг веса тела пациента. Следовательно, 1 мл суспензии включает 100 мкг фрондозида А, как описано ранее в примере 11. Если пациент будет принимать 1 мл суспензии в день, то тогда средняя доза фрондозида А для пациента со средним весом 100 кг составит 1 мкг на кг в день.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Метод выделения фрондозида А и все его возможные модификации любым лицом, обладающим достаточной квалификацией в химии природных соединений, позволяет получить несколько десятков грамм иммуномодулирующего сапонина без серьезных технических проблем. Благодаря экстремально низким иммуномодулирующим дозам этого сапонина нужно всего несколько десятков грамм, чтобы закрыть все потребности потенциального рынка. Таким образом, метод и его модификации могут быть использованы в промышленном масштабе и иметь промышленное значение.
Источники информации
Kalinin et al., Biological Activities and Biological Role of Triterpene Glycosides from Holothuroids (Echinodermata). In: "Echinoderm Studies" Vol.5, A.A.Balkema, Rotterdam, p.139-181, 1996.
Stonik et al., J. Nat. Toxins, Vol.235-248, 1999.
Habermehl & Krebs, Toxins of Echinoderms. In: "Studies in Natural Products Chemistry". Vol.7, Elsevier Science Publishers B.V., Amsterdam, p.265-316, 1990.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ КЛЕТОЧНЫЙ ИММУНИТЕТ МЛЕКОПИТАЮЩИХ | 2009 |
|
RU2415863C1 |
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО "КУМАЗИД" И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2004 |
|
RU2271820C1 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ МНОЖЕСТВЕННУЮ ЛЕКАРСТВЕННУЮ УСТОЙЧИВОСТЬ ОПУХОЛЕВЫХ КЛЕТОК | 2012 |
|
RU2494742C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОСИТЕЛЯ АНТИГЕНОВ НА ОСНОВЕ ЛИПИДОВ ИЗ МОРСКИХ МАКРОФИТОВ И ТРИТЕРПЕНОВОГО ГЛИКОЗИДА КУКУМАРИОЗИДА | 2005 |
|
RU2319506C2 |
| ПРОДУКТЫ КАРОТИНОИДОЛИПИДНЫЙ, ПРОТЕИНСОДЕРЖАЩЕЙ ФРАКЦИЙ МОРСКОГО ОГУРЦА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 1999 |
|
RU2234928C2 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ВНУТРЕННОСТЕЙ ГОЛОТУРИЙ С ПОЛУЧЕНИЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВОК К ПИЩЕ И БИОЛОГИЧЕСКИ АКТИВНЫЕ ПИЩЕВЫЕ ДОБАВКИ "ТИНГОЛ-2" И "ЭРОГОЛ" | 2001 |
|
RU2215532C2 |
| НОСИТЕЛЬ АНТИГЕНОВ | 2006 |
|
RU2322259C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2184556C1 |
| СПОСОБ ПОВЫШЕНИЯ ПОЛОВОЙ АКТИВНОСТИ (ПОТЕНЦИИ) ЧЕЛОВЕКА И ЖИВОТНЫХ | 2001 |
|
RU2210377C1 |
| ИММУНОСТИМУЛИРУЮЩИЙ КОМПЛЕКС, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2010 |
|
RU2446822C2 |
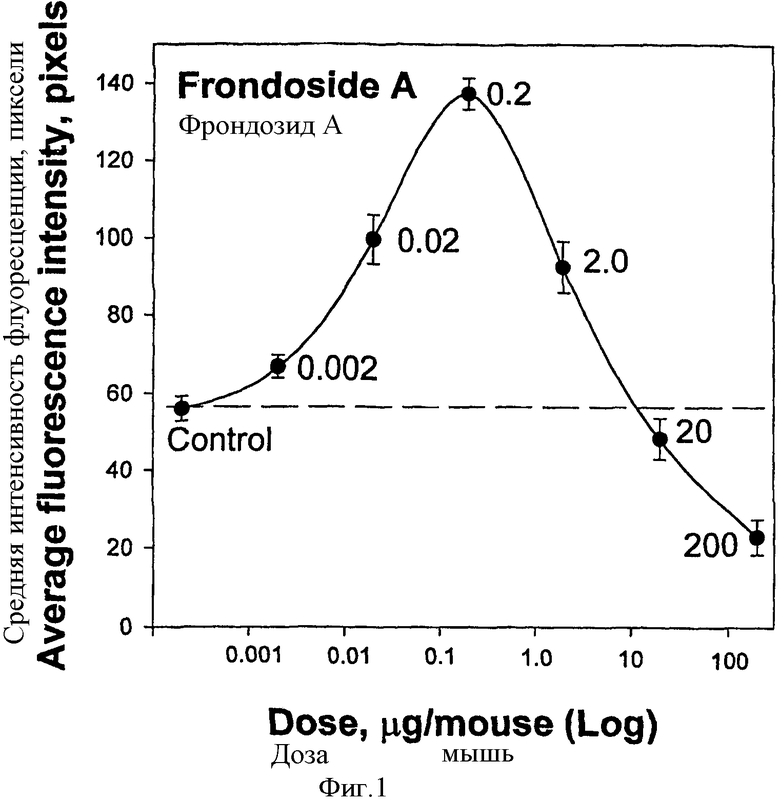
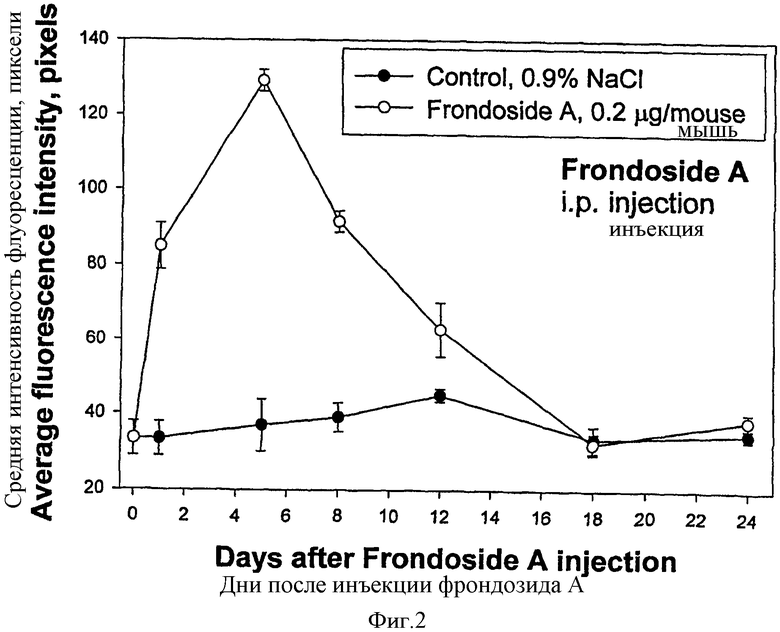
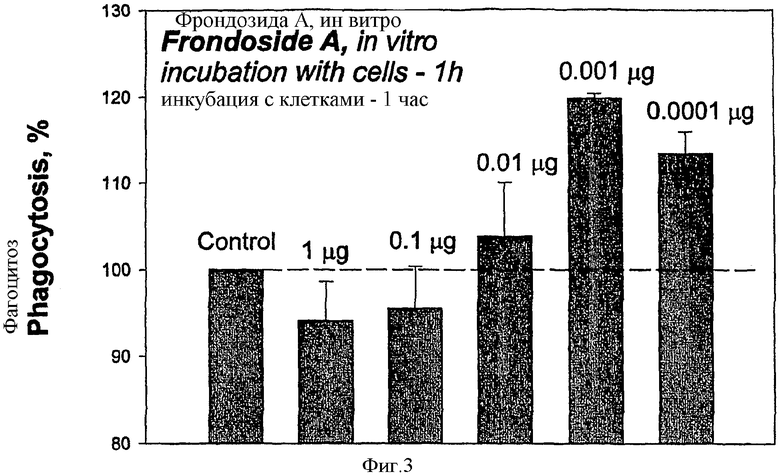
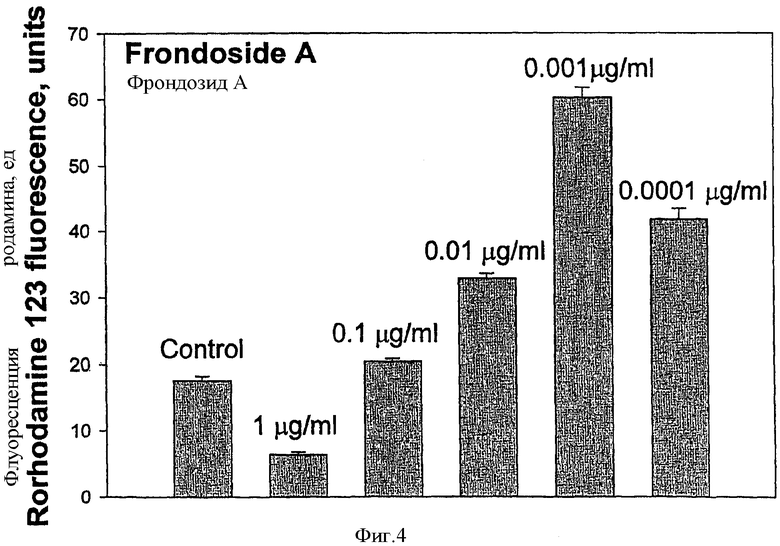
Изобретение относится к иммунологии. Проводят экстрагирование высушенных варочных вод голотурии Cucumaria frondosa или высушенных порошкообразных тканей Cucumaria frondosa смесью хлороформа и метанола при кипячении с обратным холодильником для получения органического экстракта; упаривание экстракта, перерастворение упаренного экстракта в воде, декантирование полученного коллоидного раствора и добавление к нему этилацетата с последующим декантированием водной фазы и хроматографией водной фазы на тефлоновой или силикагельных колонках. Стимулирование иммунной системы млекопитающих, включая стимулирование лизосомальной активности, фагоцитоза и образования активных форм кислорода в макрофагах млекопитающих, зараженных бактериальными клетками, вирусами, простейшими, осуществляют введением фрондозида А оральным или внутрибрюшным, или внутримышечным способом, или их комбинацией в дозах от 1 до 15 мкг/кг, предпочтительно 10 мкг/кг. Изобретение позволяет реализовать указанное назначение. 2 н. и 9 з.п. ф-лы, 1 табл., 4 ил.
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПРОДУКТОВ ИЗ ГОЛОТУРИИ | 1995 |
|
RU2112527C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ВНУТРЕННОСТЕЙ ГОЛОТУРИЙ С ПОЛУЧЕНИЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВОК К ПИЩЕ И БИОЛОГИЧЕСКИ АКТИВНЫЕ ПИЩЕВЫЕ ДОБАВКИ "ТИНГОЛ-2" И "ЭРОГОЛ" | 2001 |
|
RU2215532C2 |
| US 6055936 А, 20.05.2000 | |||
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ КОЖНЫХ ЗАБОЛЕВАНИЙ И РАН У ЧЕЛОВЕКА И ЖИВОТНЫХ | 2000 |
|
RU2183962C2 |
| ОБЩЕУКРЕПЛЯЮЩЕЕ НЕСПЕЦИФИЧЕСКОЕ ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 1996 |
|
RU2147239C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЛУЧЕВОЙ БОЛЕЗНИ | 1997 |
|
RU2141833C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АЛЕУТСКОЙ БОЛЕЗНИ НОРОК | 1990 |
|
RU2036654C1 |
Авторы
Даты
2008-11-27—Публикация
2005-06-03—Подача