Настоящее изобретение относится к новым производным пергидроизоиндола общей формулы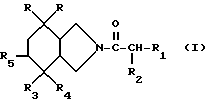
также, как к их солям, которые являются антагонистами по отношению к эффекту вещества Р и поэтому представляют особый интерес в терапевтических областях, где это вещество применяется.
В европейской заявке на патент EP 429366 описываются антагонисты вещества Р структуры /А/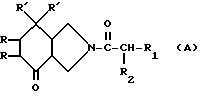
в которой
символы R обозначают водород или вместе образуют связь;
символы R' обозначают в случае необходимости замещенные фенильные радикалы; и символы R1 и R2 обозначают различные заместители. Однако эти производные пергидроизоиндолона оказываются особенно активными в тестах на связывание при использовании гомогенатов головного мозга крысы и проявляют себя менее активными в тестах на связывание при использовании лимфобластических человеческих клеток в культуре.
В патенте США 4042707 описываются производные изоиндола общей формулы /Б/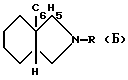
обладающие активностью препарата опия. Эти продукты неактивны по отношению к веществу P.
Вплоть по настоящего времени, несмотря на проводимые поиски и несмотря на существующий интерес [M.R. Hanley, TINS /5/, 139 /1982/], практически не найден продукт, специфически воздействующий на вещество Р и обладающий непептидной структурой, поэтому производные изоиндола общей формулы /1/ представляют большой интерес.
В общей формуле /1/:
- символы R являются одинаковыми и обозначают фенильные радикалы, в случае необходимости замещенные атомом галогена или метильным радикалом в положении 2 или 3;
- символ R1 обозначает фенильный радикал, в случае необходимости замещенный одним или несколькими атомами алогена или гидроксильными радикалами, алкильными радикалами, которые в случае необходимости могут быть замещены [атомами галогена или амино-, алкиламино- или диалкиламинорадикалами], алкилокси- или алкилтиорадикалами, которые в случае необходимости могут быть замещены /гидроксильными, амино-, алкиламино- или диалкиламинорадикалами, в случае необходимости замещенными {фенильными, гидроксильными или аминорадикалами}, или диалкиламинорадикалами, алкильные части которых с атомом азота, с которым они связаны, образуют 5-6-членный гетероцикл, который может содержать другой гетероатом, выбираемый среди кислорода, серы или азота, в случае необходимости замещенный алкильным, гидроксильным, гидроксиалкильным радикалом], или замещенный амино-, алкиламино-, диалкиламинорадикалами, алкильные части которых вместе с атомом азота, с которым они связаны, могут образовывать гетероцикл, такой как указанный выше; или обозначает циклогексадиенильный, нафтильный, инденильный или гетероциклильный радикал, моно- или полициклический, насыщенный или ненасыщенный, содержащий 5 - 9 атомов углерода и один или несколько гетероатомов, выбираемых среди кислорода, азота или серы, и в случае необходимости замешенный атомом галогена или алкильным или алкилоксирадикалом;
- символ R2 обозначает атом водорода или галогена, или гидроксильный алкильный, аминоалкильный, алкиламиноалкильный, диалкиламиноалкильный, алкилокси-, алкилтио-, ацилокси-, карбоксильный, алкилоксикарбонильный, диалкиламиноалкилоксикарбонильный, бензилоксикарбонильный, амино- или адиламинорадикал;
- символ R3 обозначает фенильный радикал, в случае необходимости замещенный в положении 2 алкильным или алкилоксирадикалом, содержащим 1 или 2 атома углерода;
- символ R4 обозначает атом фтора или гидроксильный радикал; и
- символ R5 обозначает атом водорода; или
- символы R4 и R5 обозначают гидроксильные радикалы; или
- символ R4 вместе с R5 образует связь.
Имеется в виду, что вышеуказанные алкильные или ацильные радикалы [за исключением специального указания] содержат 1 - 4 атома углерода в линейной или разветвленной цепи.
Когда R содержит в качестве заместителя галоген, то этот последний может быть выбран среди хлора или фтора.
Когда R1 содержит атом галогена, то этот последний может быть выбран среди хлора, брома, фтора или иода.
Когда R1 обозначает моно- или полициклический, насыщенный или ненасыщенный гетероциклильный радикал, то, в качестве примера, он может быть выбран из группы, включающей тиенил, фурил, пиридил, дитиинил, индолил, изоиндолил, бензотиенил, тиазолил, изотиазолил, оксазолил, имидазолил, пирролил, триазолил, тиадиазолил, хинолил, изохинолил или нафтиридинил.
Если R1 обозначает фенил, замещенный цепью, которая содержит гетероцикл, то этот последний может быть выбран среди пирролидинила, морфолиногруппы, пиперидинила, тетрагидропиридинила, пиперазинила, тиоморфолиногруппы.
Кроме того, продукты общей формулы /1/ имеют различные стереоизомерные формы, имеется в виду, что рацемические формы и стереоизомерные формы структуры /1а/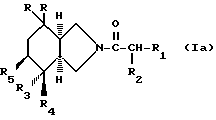
также, как их смеси, входят в рамки настоящего изобретения. Более конкретно производные пергидроизоиндола, в которых R4 обозначает гидроксил или фтор и R5 обозначает водород, формы /3а S, 4 S, 7a S/ в чистом состоянии или в форме рацемической cмеси /3aRS, 4RS, 7aRS/; производные пергидроизоиндола, в которых R4 и R5 обозначают гидроксил, формы /3aS, 4S, 5S, 7aS/ в чистой состоянии или в форме рацемической смеси /3aRS, 4RS, 5RS, 7aRS/; производные пергидроизоиндола, в которых R4 вместе с R5 образуют связь, формы /3aS, 7aR/ в чистом состоянии или в форме рацемической смеси /3aRS, 7aSR/, входят в рамки настоящего изобретения. Более того, если символ R2 иной, чем атом водорода, замещенная цепь на изоиндоле имеет хиральный центр, имеется в виду, что стереоизомерные формы /R/ или /S/ и их смеси составляют часть настоящего изобретения.
Согласно изобретению, производные пергидроизоиндола общей формулы /1/ могут быть получены путем воздействия кислоты общей формулы /II/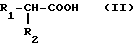 ,
,
или реакционноспособного производного этой кислоты, в которой R1 и R2 имеют вышеуказанные значения, на производное изоиндола общей формулы /III/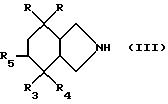
в которой символы R, R3, R4 и R5 имеют вышеуказанные значения, затем, в случае необходимости, путем превращения полученного продукта, в котором R4 обозначает гидроксильный радикал и R5 обозначает атом водорода, в продукт, в котором R4 обозначает атом фтора и R5 обозначает атом водорода, или в продукт, в котором R4 и R5 вместе образуют связь.
Имеется в виду, что амино-, алкиламино- или карбоксильные радикалы, содержащиеся в R1 и/или R5, предпочтительно предварительно защищены. Защиту осуществляют с помощью любой совместимой группы, введение и удаление которой не затрагивают остальной части молекулы. Особенно работают согласно способам, описанным T.W. Greene, Protective Groups in Organic Synthesis, A.Wiley-Interscience Publication /1981/ или Mc Оmie, Protective Groups in Organic Chemistry, Plenum Press /1973/.
В качестве примера:
- амино- или алкиламиногруппы могут быть защищены метоксикарбонильным, этоксикарбонильным, трет.-бутоксикарбонильным, аллилоксикарбонильным, винилоксикарбонильным, трихлорэтоксикарбонильным, трихлорацетильным, трифторацетильным, хлорацетильным, тритильным, бензгидрильным, бензильным, аллильным, формильным, ацетильным радикалами; бензилоксикарбонильным радикалом или его замещенными производными;
-кислотные группы могут быть защищены метильным, этильным, трет.-бутильным, бензильным, замещенным бензильным или бензгидрильным радикалами.
Более того, когда R2 обозначает гидроксильный радикал, то предпочтительно предварительно защищать этот радикал. Защиту осуществляют, например, с помощью ацетильного, триалкилсилильного, бензильного радикала, в форме карбоната с помощью радикала -COORа, в котором Ra обозначает алкильный или бензильный радикал, или в форме кетона.
Также имеют в виду, что стереохимия производного изоиндола общей формулы /III/ подобна таковой, описанной выше для производных общей формулы /1/.
Если осуществляют конденсацию реакционноспособного производного кислоты общей формулы /II/, предпочтительно работают с помощью хлорангидрида кислоты, ангидрида кислоты, смешанного ангидрида кислоты или реакционноспособного сложного эфира, в котором сложноэфирный остаток представляет собой сукцинимидо-, в случае необходимости замещенный бензотриазол- 1-ильный, 4-нитро-фенильный, 2,4-динитрофенильный, пентахлорфенильный или фталимидо-радикал.
Реакцию обычно осуществляют при температуре от -40oC до +40oС, в органическом растворителе, таком как хлорированный растворитель [например, дихлорметан, дихлорэтан, хлороформ] , углеводород [например, толуол], простой эфир [например, тетрагидрофуран, диоксан], сложный эфир [например, этилацетат], амид [например, диметилацетамид, диметилформамид] или кетон [например, ацетон] , или в смеси этих растворителей; в присутствии акцептора кислоты, такого как азотсодержащее органическое основание, как, например, пиридин, диметиламинопиридин N-метилморфолин или триалкиламин [особенно триэтиламин], или такого, как эпоксид [например, пропиленоксид]. Также можно работать в присутствии агента конденсации, такого как карбодиимид [например, дициклогексилкарбодиимид или 1-/3-диметиламино-пропил/-3-этил-карбодиимид], N,N'-карбонилдиимидазол или 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или в водно-органической среде, в присутствии щелочного агента конденсации, как бикарбонат натрия.
В альтернативе, если получают производное пергидроизоиндола общей формулы /1/, в котором R4 обозначает гидроксильный радикал и R5 обозначает атом водорода, и хотят получить производное пергидроизоиндола, в котором R4 обозначает атом фтора и R5 обозначает атом водорода, фторируют вышеполученное производное.
Реакцию предпочтительно осуществляют с помощью агента фторирования, как фторид серы [тиоморфолинотрифторид, тетрафторид серы (0rg. Chem., 40, 3808 /1975/), диэтиламинотиотрифторид (Tetrahedron, 44, 2875 /1988/), фенилтиотрифторид (J. Am. Chem. Soc., 84, 3058 /1962/); как селенийтетрафторид {J. Am. Chem. Soc., 96, 925/1974/}] или как тетрафторфенилфосфоран {Tel. Let., 907 /1973/} , работая в органическом растворителе, таком как хлорированный растворитель [например, дихлорметан, дихлорэтан], при температуре от -30oC до 30oC.
В альтернативе, если получают производное пергидроизоиндола общей формулы /1/, в котором R4 обозначает гидроксильный радикал и R5 обозначает атом водорода, и хотят получить производное пергидроизоиндола, в котором R4 и R5 вместе образуют связь, работают любым известным способом дегидратации спиртов, при котором не затрагивается остальная часть молекулы. В частности, дегидратацию осуществляют в кислой среде, например, путем воздействия сульфокислоты [п-толуолсульфокислоты. . . ] , серной кислоты, фосфорной кислоты, пентоксида фосфора или оксида алюминия или путем воздействия смеси соляной кислоты с уксусной кислотой или бромоводородной кислоты с уксусной кислотой, при температуре от 25oC до температуры кипения с обратным холодильником реакционной смеси.
Согласно изобретению производные изоиндола общей формулы /I/, в которых R5 иной, чем гидроксильный радикал, также можно получать путем воздействия металлоорганического соединения общей формулы /IV/
R3 - M /IV/,
в которой R3 имеет вышеуказанное значение, а М обозначает литий, радикал MgX или CeX2, в котором X представляет собой атом галогена, на производное пергидроизоиндолона общей формулы /V/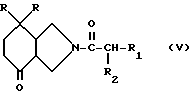
в которой R, R1 и R2 имеют вышеуказанное значение, затем в случае необходимости полученный спирт общей формулы /I/ превращают в производное пергидроизоиндола, в котором R4 обозначает атом фтора и R5 представляет собой атом водорода, или в производное пергидроизоиндола, в котором R4 и R5 вместе образуют связь.
Реакцию осуществляют в безводной среде, в обычных условиях взаимодействия металлоорганических соединений с кетоном, при которой не затрагивается остальная часть молекулы. В частности, работают в простом эфире /например, как тетрагидрофуран или диэтиловый эфир/, в случае необходимости в присутствии безводного хлорида церия, при температуре от -78oC до 30oC.
Последующие операции превращения в производное общей формулы /I/, в котором R4 обозначает атом фтора и R5 обозначает водород, или в котором R4 и R5 вместе образуют связь, осуществляют в вышеописанных условиях.
Кислоты общей формулы /II/ могут быть получены согласно нижеописанным в примерах способам, согласно способам, описанным в европейской заявке на патент ЕР 429366, или по аналогии с этими способами.
Производное пергидроизоиндола общей формулы /III/, в котором R4 и R5 вместе образуют связь, могут быть получены путем дегидратации соответствующего производного пергидроизоиндола, в котором R4 обозначает гидроксильный радикал и R5 обозначает атом водорода.
Реакцию осуществляют в условиях, описанных выше для получения производных общей формулы /I/, в которой R4 и R5 вместе образуют связь из соответствующего производного пергидроизоиндола, в котором R4 обозначает гидроксильный радикал и R5 обозначает атом водорода.
Производное изоиндола общей формулы /III/, в котором R4 обозначает атом фтора и R5 обозначает атом водорода, может быть получено путем фторирования производного изоиндола общей формулы /VI/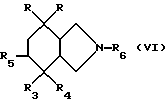
в которой R и R3 имеют вышеуказанное значение, R6 обозначает защитный радикал, R4 обозначает гидроксильный радикал и R5 обозначает атом водорода; затем путем удаления защитного радикала R6.
Защитным радикалом R6 может быть любая, защитная для аминогруппы группа, которая совместима с реакцией и введение и удаление которой не затрагивает остальной части молекулы. В качестве примера можно назвать алкилоксикарбонильные, бензилоксикарбонильные, в случае необходимости замещенные бензильные, формильные, хлорацетильные, трихлорацетильные, трифторацетильные, винилоксикарбонильные, феноксикарбонильные, 1-хлорэтоксикарбонильные или хлоркарбонильные группы.
Когда хотят получить фторпроизводное пергидроизоиндола общей формулы /III/, фторирование осуществляют в условиях, описанных выше для фторирования производного общей формулы /I/, в которой R4 обозначает гидроксил, при температуре от -30oC до 30oC.
Последующее удаление защитного радикала R6 осуществляют обычными способами, особенно согласно методам, описанным Т.W. Greene, A. Wiley или Mc Omie в вышеприведенных ссылках.
Производное пергидроизоиндола общей формулы /III/ или /VI/, для которого R4 обозначает гидроксильный радикал и R5 обозначает атом водорода или гидроксильный радикал, может быть получено путем воздействия металлоорганического соединения общей формулы /IV/ на соответствующее производное пергидроизоиндолона общей формулы /VII/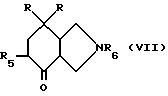
в которой R и R6 имеют вышеуказанное значение, а R5 обозначает атом водорода или в случае необходимости защищенный гидроксильный радикал, затем путем снятия защиты с радикала R5 и в случае необходимости удаления защитной группы R6.
Реакцию проводят в условиях, аналогичных таковым, описанным для получения пергидроизоиндола общей формулы /I/ из соответствующего пергидроизоиндолона. Имеется в виду, что в зависимости от природы защитной группы для радикала R5 последняя может быть удалена одновременно с реакцией.
Производное пергидроизоиндола общей формулы /VI/ может быть получено путем защиты аминогруппы соответствующего производного общей формулы /III/.
Защиту осуществляют обычными способами, в частности, согласно вышеприведенным ссылкам.
Производное пергидроизоиндолона общей формулы /VII/, в котором R5 обозначает атом водорода, может быть получено по аналогии со способом, описанным в европейской заявке на патент EP 429366. Производное пергидроизоиндолона общей формулы /VII/, в которой R5 обозначает предварительно защищенный гидроксильный радикал, также может быть получено по аналогии с этим способом или как описано ниже в примерах.
Получение производного пергидроизоиндолона общей формулы /V/ осуществляют по аналогии со способом, описанным в европейской заявке на патент EP 429 366.
Имеется в виду, что производные пергидроизоиндола общих формул /I/, /III/, /V/, /VI/ и /VII/ имеют несколько стереоизомерных форм. Когда хотят получить продукт общей формулы /I/ формы /3aS, 7aS/, то разделение изомерных форм осуществляют предпочтительно на уровне производного общей формулы /VII/ или на уровне другого промежуточного соединения, содержащего оксорадикал в положении 4. Это разделение также может быть осуществлено на уровне производного общей формулы /III/. Разделение осуществляют любым известным и совместимым с молекулой способом.
В качестве примера, разделение может быть осуществлено путем получения оптически активной соли за счет воздействия L/+/- или D/-/-миндальной кислоты, или дибензоилвинной или дитолуоилвинной кислоты, затем разделения изомеров путем кристаллизации. Целевой изомер высвобождают из его соли в основной среде.
Новые производные изоиндола общей формулы /I/ в случае необходимости можно очищать физическими методами, такими как кристаллизация или хроматография.
В случае необходимости новые производные общей формулы /I/, в которых символы R1 и/или R2 содержат амино- или алкиламинозаместители, можно превращать в соли присоединения кислот. В качестве примеров солей присоединения фармацевтически приемлемых кислот можно назвать соли, образованные с неорганическими кислотами [хлоргидраты, сульфаты, нитраты, фосфаты] или с органическими кислотами [сукцинаты, фумараты, тартраты, ацетаты, пропионаты, малеаты, цитраты, метансульфонаты, п-толуолсульфонаты, изэтионаты, или с замещенными производными этих соединений].
Новые производные изоиндола общей формулы /I/ также, в случае необходимости, если R2 обозначает карбоксильный радикал, можно превращать в соли металлов или в соли присоединения азотсодержащих оснований, согласно само по себе известным способам. Эти соли могут быть получены путем воздействия основания металла [например, щелочного или щелочноземельного металла], аммиака или амина на продукт согласно изобретению в соответствующем растворителе, таком как спирт, простой эфир или вода, или путем реакции обмена с солью органической кислоты. Образовавшуюся соль осаждают после возможного концентрирования раствора, отделяют ее путем фильтрации, декантации или лиофилизации. В качестве примеров фармацевтически приемлемых солей можно назвать соли с щелочными металлами /как натрий, калий, литий/ или с щелочноземельными металлами /как магний, кальций/, соль аммония, соли азотсодержащих оснований [как этаноламин, диэтаноламин, триметиламин, триэтиламин, метиламин, пропиламин, диизопропиламин, N,N-диметилэтаноламин, бензиламин, дициклогексиламин, N-бензил- β -фенетиламин, N,N-дибензилэтилендиамин, дифенилендиамин, бензгидриламин, хинин, холин, аргинин, лизин, лейцин, дибензиламин].
Новые производные изоиндола согласно настоящему изобретению, которые антагонизируют эффекты вещества P, могут найти применение в случае анальгезии, воспаления, астмы, аллергий, воздействия на центральную нервную систему, на сердечно-сосудистую систему, в качестве антиспазмотического средства, или на иммунную систему, также как в области стимуляции слезных выделений.
Продукты согласно изобретению проявляют сродство к рецепторам вещества P в дозах 10 - 1000 нмоль, согласно способам D.G.Payan и др., J. of Immunology, 133, /6/, 3260-5 /1984/: Stereospecific receptors for substance P on cultured human IM-9 lymphoblasts, и Mc Pherson и др. J. Pharmacol. Ueth. 14, 213 /1985/: Analysis of radioligand binding experiments.
Кроме того, показано, что речь идет об антагонистическом эффекте различных продуктов по отношению к веществу Р. В способе, описанном S. Rosell и сотр. , Substance P: изд. US. Von Euler и B.Pernow, Raven Press, Нью-Йорк /1977/, с. 83 - 88, изучаемые продукты проявляют антагонизм по отношению к сокращениям подвздошной кишки морской свинки, вызываемым веществом P, или сокращениям подвздошной кишки морской свинки, вызываемым септидом, в концентрациях 6-1000 нмоль.
Вещество Р, как известно, применяется в некоторых патологических областях: - Agonists and antagonists of Substance P [Антагонисты и антагонисты вещества P], A.S. Dutta Drugs of the futur, 12 /8/, 782 /1987/; - Substance P and pain: an updating, J.L.Henry, TINS, 3/4/, 97, /1980/; - Substance P in inflammatory reactions and pain, S. Rosell, Actual, Chim. Ther, 12-тая серия, 249 /1985/; - Effects of Neuropeptides on Prooduction of Inflammatory Cytokines by Human Monocytes, M.Lotz и сотр., Science, 241, 1218 /1988/; - Neuropeptides and the pathogenesis of allergy, Allergy, 42, I - II /1987/; - Substance P in Human Essential Hypertension, J.Cardiovascular Pharmacology, 10 /доп.12/, 5172 /1987/.
Изучение некоторых производных изоиндола общей формулы /I/ по способу A. Saria и сотр., Arch. Pharmacol 324, 212 - 218 /1983/, осуществляемому на морской свинке, позволяет выявить ингибирующее воздействие на увеличение капиллярной проницаемости, вызываемое септидом /агонист вещества P/, которое свидетельствует о противовоспалительной активности (см.табл.1).
Инъекция вещества P животному вызывает гипотензию. Продукты, изучаемые по способу C.A.Maggi и сотр., J.Auton. Pharmac., 7, 11-32 /1987/, проявляют антагонистический эффект по отношению к этой гипотензии у морской свинки. Определяют ЭД50, дозу, которая снижает на 50% гипотонию, вызванную внутривенной инъекции 250 нг/кг вещества P (см. табл.2).
Инъекция вещества P животному вызывает бронхоспазм. Сужение бронхов ин виво у морских свинок, вызываемое инъекцией вещества P или селективного агониста вещества P: /Pro9/ - веществo P изучается согласно способу H.Konzett и R.Rosseler, Archiv. Exp. Path. Pharmak., 195, 71 - 74, /1940/. Это сужение бронхов ингибируется инъекцией продукта согласно изобретению, что свидетельствует об антиастматической активности. Определяют ЭД50 дозу, которая уменьшает на 50% бронхоспазм, вызванный внутривенной инъекцией 3 мкг/кг /Pro9/ - вещества P. В этом способе ЭД50 продукта примера 1 составляет 0,7 мг/кг внутривенно.
Кроме того, в тесте на боль от воздействия формалина у морской свинки продукт примера 1, введенного перорально за 1 час до теста, показывает ЭД50= 11 мг/кг.
Наконец, производные изоиндола согласно настоящему изобретению не обладают токсичностью, они оказываютcz нетоксичными в случае мыши при введении внутривенно в дозе 10 мг/кг или при введении подкожно в дозе 40 мг/кг.
Особый интерес представляют собой продукты общей формулы /1/, в которых:
- символы R являются одинаковыми и обозначают фенильные радикалы;
- символ R1 обозначает фенильный радикал, замещенный в случае необходимости одним или несколькими гидроксильными, алкилоксильными, диалкиламино-, нафтильными, иденильными радикалами или гетероциклильными радикалами, выбираемыми среди тиенила, индолила, бензотиенила; и в случае необходимости замещенный атомом галогена или алкильным или алкоксильным радикалом;
- символ R2 обозначает атом водорода или гидроксильный, алкильный или аминорадикал;
- символ R3 обозначает фенильный радикал, в случае необходимости замещенный в положении 2 алкильным или алкоксильным радикалом, содержащим 1 или 2 атома углерода; и
- символ R4 обозначает атом фтора или гидроксильный радикал; и
- символ R5 обозначает атом водорода; или
- символы R4 и R5 обозначают гидроксильные радикалы; или
- символ R4 вместе с R5 образует связь.
Более конкретно следует назвать:
7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-метокси-фенил/-пропионил] - пергидроизоиндол-4-ол;
7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-метокси-фенил/-пропионил] - пергидроизоиндол-4,5-диол;
7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-гидрокси-фенил/-ацетил] - пергидроизоиндол-4-ол;
7,7-дифенил-4-/2-метокси-фенил/-2-/3-индолил-ацетил/-пергидроизоиндол -4,5-диол;
7,7-дифенил-4-/2-метокси-фенил/-2-[/2-метокси-фенил/-ацетил] - пергидроизоиндол-4-ол;
7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-гидрокси-фенил/-пропионил ]-пергидроизоиндол-4-ол;
в рацемической форме, в вышеуказанных стереоизомерных формах или в виде смеси.
Следующие примеры, данные в качестве не ограничивающих объема охраны изобретения, иллюстрируют настоящее изобретение.
В нижеследующих примерах имеется в виду, за исключением специального указания, что 1H-ЯМР-спектры снимаются при 250 мГц в диметилсульфоксиде; химсдвиги выражены в м.д. /ррm/
Пример 1
К суспензии 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 60 см3 безводного дихлорметана добавляют 0,025 г 1-гидрокси-бензотриазола, 0,38 г 2-/2-метокси-фенил/-/S/-пропионовой кислоты, 0,32 см3 диизопропилэтиламина, затем этот раствор охлаждают до + 5oC и быстро добавляют суспензию 0,43 г хлоргидрата 1-/3-диметиламино-пропил/-3-этил-карбодиимида в 10 см3 безводного дихлорметана. Реакционную смесь перемешивают в течение 2 часов при +5oC, в течение 2 часов при комнатной температуре, промывают с помощью 20 см3 воды, затем промывают с помощью 20 см3 водного насыщенного раствора хлорида натрия /2 раза/, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,8 см, высота 20 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [80/20 по объему] и собирая фракции по 25 см3. Фракции 9 - 15 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из смеси ацетонитрила с диизопропиловым эфиром. Получают 0,17 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-метокси-фенил/-/S/-пропионил] - /3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 244oC.
Хлоргидрат 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4aS, 7aS/-пергидроизоиндол-4-ола может быть получен следующим образом.
К раствору 7,63 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет.- бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 66 см3 диоксана при комнатной температуре добавляют 100 см3 5,2 н. раствора хлороводорода в диоксане. Реакционную смесь перемешивают в течение 1 часа при этой температуре, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток промывают ацетонитрилом, отсасывают, затем высушивают. Получают 4,88 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 271oC [блок Maquenne].
7,7-Дифенил-4-/2-метокси-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ол может быть получен следующим образом.
К суспензии 20 г 7,7-дифенил-2-трет.-бутоксикарбонил-/3aS, 7aS/-пергидроизоиндол-4-ола и 31,6 г безводного хлорида церия в 250 см3 безводного тетрагидрофурана при комнатной температуре и при перемешивании прикапывают суспензию 2-метокси-фенилмагнийбромида [приготовленного из 75,3 г 2-бром-анизола и 9,8 г магния] в 100 см3 безводного тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, обрабатывают с помощью 400 см3 водного насыщенного раствора хлорида аммония, разбавляют с помощью 200 см3 этилацетата, промывают с помощью 300 см3 воды /два раза/, затем с помощью 300 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 5,8 см, высота 26,5 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [80/20 по объему] и собирая фракции по 100 см3. Фракции 9-29 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 17,82 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,36 (с., 9H, -С/CH3/3); 1,54 [дмт, J=14, 1H, экваториальный H из -CH2- в положении 5]; 2,3 /дмт, J=14, 1H, экваториальный H из -CH2- в положении 6/; 2,34 /тд, J=14 и 2,5, 1H, аксиальный H из -CH2- в положении 5/; 3,07 /тд., J=14 и 2,5, аксиальный H из -CH2- в положении 6/; 3,49 /с. , 3H, -OCH3/; 2,6-3,6 /мт., другие -CH2- и -CH/; 6,85-7,7 /мт., 14 H, ароматические/.
7,7-Дифенил-2-трет. -бутоксикарбонил-/3aS, 7aS/-пергидроизоиндол-4-он может быть получен следующим образом.
К суспензии 80 г хлоргидрата 7,7-дифенил-/3aS, 7aS/-пергидроизоиндол-4-она в 400 см3 безводного дихлорметана при комнатной температуре и при перемешивании добавляют 34,3 см3 триэтиламина, 57,6 г ди-трет.-бутил-дикарбоната, затем 2,98 г 4-диметиламино-пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, промывают с помощью 100 см3 водного раствора лимонной кислоты, затем с помощью 100 см3 водного раствора гидрокарбоната натрия, затем с помощью 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давления /2,7 кПа/. Получают 106,5 г 7,7-дифенил-2-трет.-бутоксикарбонил-/3aS, 7aS/-пергидроизоиндол-4-она в виде воздушной массы оранжевого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,4 /с., 9H, -C/CH3/3/; 2,11 /т.д., J = 15 и 7,5 , 1H, аксиальный H из -CH2- в положении 5/, 2,3 /дт., J = 15 и 3,5 , 1H, экваториальный H из -CH2- в положении 5/; 2,75 - 2,9 /мт., 4H, -CH2- в положении 6 и -CH2- в положении 1/; 3,26 /дд., J = 7,5 и 7, 1 H, -CH в положении 3а/; 3,35 /дд., J = 11 и 7, 1H, 1H из -CH2- в положении 3/; 3,97 /мт., 1H, -CH в положении 7а/; 4,1 /д., J = 11, 1H, другой H из -CH2- в положении 3/; 7,1 - 7,7 /мт., 10H, ароматические/.
Хлоргидрат 7,7-дифенил-/3aS, 7aS/-пергидроизоиндол-4-она может быть получен следующим образом.
К суспензии 20 г хлоргидрата 7,7-дифенил-/3аRS, 7aRS/- пергидроизоиндол-4-она в 250 см3 этилацетата при перемешивании медленно добавляют 50 см3 водного 4 н. раствора гидроксида натрия; перемешивание продолжают вплоть до исчезновения исходного продукта. Органический раствор промывают с помощью 100 см3 дистиллированной воды, 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и отфильтровывают. К таким образом полученному раствору при перемешивании добавляют раствор 9,3 г D-/-/-миндальной кислоты в 50 см3 этилацетата. Образовавшиеся кристаллы отфильтровывают, отсасывают, промывают с помощью 50 см3 этилацетата /два раза/ и высушивают. Кристаллы обрабатывают раствором 220 см3 ацетонитрила и 60 см3 дистиллированной воды, смесь кипятят с обратным холодильником в течение 15 минут; образовавшиеся кристаллы отфильтровывают и снова кристаллизуют из смеси 100 см3 ацетонитрила и 35 см3 дистиллированной воды. Получают 6,4 г D-манделата 7,7-дифенил-/3aS, 7aS/-пергидроизоиндол-4-она.
К 6,4 г D-манделата 7,7-дифенил-/3aS, 7aS/-пергидроизоиндол-4-она в виде раствора в 100 см3 этилацетата добавляют 50 см3 водного 1 н. раствора гидроксида натрия; реакционную смесь перемешивают при комнатной температуре вплоть до исчезновения исходного продукта; органический раствор промывают с помощью 50 см3 дистиллированной воды, с помощью 50 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и отфильтровывают; его подкисляют при перемешивании путем добавления 2 см3 9 н. раствора хлороводорода в этаноле; образовавшиеся кристаллы отсасывают, промывают этилацетатом, затем диизопропиловым эфиром и высушивают. Получают 4,24 г хлоргидрата 7,7-дифенил-/3aS,7aS/-пергидроизоиндол-4-она в виде белых кристаллов, плавящихся при 270oC с разложением.
2-/2-Метокси-фенил/-/S/-пропионовая кислота может быть получена по аналогии со способами, описанными D.A. Evans и сотр., Tetrahedron, 44, 5525 /1988/, согласно следующей методике.
К раствору, охлажденному до +5oC, 4,1 г 4-метил-5-фенил-3-[2-/2-метокси-фенил/-/S/-пропионил] -/4S, 5S/- оксазолидин-2-она в 60 см3 тетрагидрофурана и 30 см3 воды добавляют 1,52 г гидроксида лития. Реакционную смесь перемешивают 3 часа при этой температуре, затем после возврата к комнатной температуре добавляют этилацетат, декантируют, водную фазу подкисляют водным 1 н. раствором соляной кислоты, экстрагируют этилацетатом, органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученное твердое вещество перекристаллизуют из гексана, отсасывают и высушивают. Получают 0,4 г 2-/2-метокси-фенил/-/S/-пропионовой кислоты в виде белых кристаллов, плавящихся при 102oC. [α]
4-Метил-5-фенил-3-{2-[2-метокси-фенил]-/S/-пропионил}-/4S, 5S/-оксазолидин-2-он может быть получен следующим образом.
К охлажденному до -50oC раствору 10 г 4-метил-5-фенил-3-//2- метокси-фенил/-ацетил/-/4S, 5S/-оксазолидин-2-она в 150 см3 тетрагидрофурана добавляют 19,1 г 1,1,1,3,3,3-гексаметил-дисилазаната натрия, перемешивают в течение 45 минут при этой температуре, затем добавляют 7,72 см3 метилиодида. Реакционную смесь затем перемешивают в течение 15 часов при комнатной температуре, затем разбавляют этилацетатом, промывают с помощью 50 см3 воды, затем 50 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученный остаток кристаллизуют из диизопропилового эфира, отсасывают и высушивают. Получают 4,2 г 4-метил-5-фенил-3-[2-/2-метокси-фенил/-/S/-пропионил]-/4S, 5S/-оксазолидин-2-она в виде твердого вещества белого цвета.
4-Метил-5-фенил-3-/2-метокси-фенилацетил/-/4S, 5S/-оксазолидин-2-он может быть получен следующим образом.
К суспензии 1,89 г гидрида натрия /80%-ная дисперсия в вазелине/ в 200 см3 безводного тетрагидрофурана при комнатной температуре добавляют 9,38 г 2-метокси-фенилуксусной кислоты. Эту суспензию охлаждают до -30oC, добавляют 7,77 см3 пивалоилхлорида, затем, наконец, добавляют охлажденный до -78oC раствор, полученный путем добавления 35,27 см3 1,6 М раствора бутиллития в гексане к охлажденному по -78oC раствору 10 г 4-метил-5-фенил-/4S, 5S/-оксазолидин-2-она в 200 см3 безводного тетрагидрофурана. Реакционную смесь перемешивают 45 минут при -30oC, затем, после возврата к комнатной температуре, добавляют 200 см3 водного насыщенного раствора хлорида аммония, затем 500 см3 этилацетата; после декантации органическую фазу промывают два раза по 100 см3 воды, затем два раза по 100 см3 водного насыщенного раствора хлорида натрия; сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем /гранулометрия 0,04 - 0,06 мм, диаметр 4,3 см, высота 36 см3/, элюируя под давлением азота 0,6 бар смесью циклогексана с этилацетатом [85/15, затем 80/20 по объему] и собирая фракции по 50 см3. Фракции 14 - 31 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 13,6 г 4-метил-5-фенил-3-/2-метокси-фенилацетил/-/4S, 5S/-оксазолидин-2-она в виде желтого масла.
Пример 2
Следуя методике нижеприведенного примера 22, из 0,68 г хлоргидрата 7,7-дифенил-4-/2-метил-фенил/-/3aS, 4S, 7aS/-пepгидроизоиндол-4-ола и 0,28 см3 фенилацетилхлорида получают 0,4 г 7,7-дифенил-4-/2-метил-фенил/-2-фенилацетаил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 208oC.
Хлоргидрат 7,7-дифенил-4-/2-метил-фенил/-/3aS, 4S,7aS/-пергидроизоиндол-4-ола может быть получен следующим образом.
Поступая согласно примеру 1, из 1,2 г 7,7-дифенил-4-/2- метил-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола получают 0,68 г хлоргидрата 7,7-дифенил-4-/2-метил-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3325, 3100-3000, 3000-2850, 3000-2300, 1600, 1585, 1560, 1495, 1445, 750, 700.
7,7-Дифенил-4-/2-метил-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ол может быть получен следующим образом.
Поступая по способу работы примера 1, из 3 г 7,7-дифенил-2-трет.-бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-она и суспензии 2-метил-фенилмагнийбромида [полученной из 4,6 см3 2-бром-толуола и 0,93 г магния в 15 см3 безводного тетрагидрофурана] получают 1,5 г 7,7-дифенил-4-/2-метил-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде масла, используемого таким, какое есть в следующем опыте.
Пример 3
К суспензии 1,1 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в 25 см3 безводного дихлорметана при комнатной температуре добавляют 0,35 см3 триэтиламина, затем 0,33 см3 фенилацетилхлорида. Реакционную смесь перемешивают 24 часа при этой температуре, разбавляют с помощью 200 см3 дихлорметана, промывают с помощью 100 см3 насыщенного раствора гидрокарбоната натрия, 100 см3 воды /два раза/, затем водным насыщенным раствором хлорида натрия, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Мerck /гранулометрия 0,04-0,06 мм, диаметр 2 см, высота 22 см/, элюируя под давлением азота 50 кПа смесью циклогексана с этилацетатом [55/45 по объему] и собирая фракции по 20 см3. Фракции 11-18 объединяют и кристаллизуют досуха при пониженном давлении /2,7 кПа/. Полученный остаток кристаллизуют из 70 см3 ацетонитрила, кристаллы отсасывают и высушивают. Получают 0,5 г 7,7-дифенил-4-/2-метокси-фенил/-2-фенилацетил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в виде твердого белого вещества.
1H-ЯМР-спектр /ДМСО-d6/: 1,5 /дмт., J = 14,1 1H, экваториальный 1H из -CH2- в положении 5/; 2,26 /дмт, J = 14, 1H, экваториальный H из -CH2- в положении 6/; 2,31 /тд., J = 14 и 3, 1H, аксиальный H из -CH2- в положении 5/; 2,85 /мт., 1H,  в положении 3а/; 3,02 /т.д., J = 14 и 2,5, 1H, аксиальный H из -CH2- в положении 6/; 3,2 - 3,6 /массив, -CH2- и
в положении 3а/; 3,02 /т.д., J = 14 и 2,5, 1H, аксиальный H из -CH2- в положении 6/; 3,2 - 3,6 /массив, -CH2- и 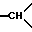 / 3,44 /с. , 3H, -OCH3/; 6,8-7,6 /мт., 19 H, ароматические/.
/ 3,44 /с. , 3H, -OCH3/; 6,8-7,6 /мт., 19 H, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3100-3000, 3000-2850, 2840, 1640, 1600, 1580, 1495, 1450, 1245, 1030, 750, 720, 700.
Хлоргидрат 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ол может быть получен следующим образом.
Поступая согласно способу работы примера 1, из 2,7 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет. -бутоксикарбонил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола получают 1,77 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в виде твердого вещества белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,55 /д. уширенный, J = 14, 1H, экваториальный H из -CH2- в положении 5/; 2,34 /т.п., J = 14 и 2,5, 1H, аксиальный H из -CH2 в положении 5/; 2,37 /д. уширенный, J = 14, 1H, экваториальный H из -CH2- в положении 6/; 2,52 /мт., 1H из -CH2- в положении 1/; 2,93 /тд., J = 14 и 2,5, 1H, аксиальный H из -CH2- в положении 6/; 3-3,3 /мт., 3H, -CH2- в положении 3 и другой H из -CH2 в положении 1/; 3,42 /с., 3H, -OCH3-/; 3,4-3,7 /мт. , 2H, 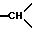 в положении 3a и 7a/; 5,3 /массив, уширенный, 1H, -OH/; 6,8-7,7 /мт., 14 H, ароматические/.
в положении 3a и 7a/; 5,3 /массив, уширенный, 1H, -OH/; 6,8-7,7 /мт., 14 H, ароматические/.
7,7-Дифенил-4-/2-метокси-фенил/-2-трет. -бутоксикарбонил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ол может быть получен следующим образом.
Поступая согласно методике работы примера 1, из 2,75 г 7,7-дифенил-2-трет.-бутоксикарбонил-/3aRS, 7aRS/-пергидроизоиндол-4-она, 1,73 г безводного хлорида церия и суспензии 2-метокси-фенилмагнийбромида /полученного из 6,57 г 2-бром-анизола и 0,84 г магния/ получают 2,72 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет.-бутоксикарбонил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре наблюдают смесь геометрических изомеров: 1,3 и 1,35 /мт., 1H, 1H из -CH2- в положении 5/; 2,15 и 2,4 /мт., 2H, другой H из -CH2- в положении 5 и 1H из -CH2- в положении 6/; 2,5-3,6 /мт., -CH2 и 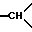 /; 3,35 и 3,39 /2с., 3H, -OCH3/; 4,68 и 4,72 /2с., 1H, -OH/; 6,8-7,7 /мт., 14H, ароматические/.
/; 3,35 и 3,39 /2с., 3H, -OCH3/; 4,68 и 4,72 /2с., 1H, -OH/; 6,8-7,7 /мт., 14H, ароматические/.
7,7-Дифенил-2-трет. -бутоксикарбонил-/3aRS, 7aRS/-пергидроизоиндол-4-он может быть получен следующим образом.
К суспензии 10 г хлоргидрата 7,7-дифенил-/3aRS, 7aRS/-пергидроизоиндол-4-она в 50 см3 безводного дихлорметана при комнатной температуре и при перемешивании добавляют 4,3 см3 триэтиламина, 7,4 г ди-трет.-бутил-дикарбоната, затем 0,37 г 4-диметиламино-пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, промывают с помощью 150 см3 водного раствора лимонной кислоты, затем с помощью 100 см3 водного раствора гидрокарбоната натрия, после этого 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 11 г 7,7-дифенил-2-трет.-бутоксикарбонил- /3aRS, 7aRS/-пергидроизоиндол-4-она в виде воздушной массы кремового цвета.
1H-ЯМР-спектр /ДМСО-d6/ 1,38 /с., 9H, -С/CH3/3/; 2,08 /тд. J = 14 и 6, 1H, аксиальный H из -CH2- в положении 5/, 2,28 /дмт., 1H, экваториальный H из -CH2- в положении 5/; 2,7-2,85 /мт., 4H, -CH2- в положении 1 и -CH2- в положении 6/; 3,27 /мт., 2H, 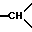 в положении 3a и 1H из -CH2- в положении 3/; 3,9 - 4,05 /мт., 2H,
в положении 3a и 1H из -CH2- в положении 3/; 3,9 - 4,05 /мт., 2H, 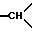 в положении 7a и другой H из -CH2- в положении 3/; 7,1-7,7 /мт., 10H, ароматические/.
в положении 7a и другой H из -CH2- в положении 3/; 7,1-7,7 /мт., 10H, ароматические/.
Пример 4
К суспензии 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пepгидpoизoиндoл-4-oлa в 80 см3 безводного дихлорметана добавляют 0,025 г 1-гидрокси-бензотриазола, 0,27 см3 2-фенил-/S/-пропановой кислоты, 0,32 см3 диизопропилэтиламина, затем этот раствор охлаждают до +5oC и быстро добавляют суспензию 0,43 г хлоргидрата 1-/3-диметиламино-пропил/-3-этил-карбодиимида в 10 см3 безводного дихлорметана. Реакционную смесь перемешивают 2 часа при +5oC, 18 часов при комнатной температуре, промывают с помощью 20 см3 воды, затем промывают с помощью 20 см3 водного насыщенного раствора хлорида натрия /2 раза/, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04- 0,06 мм, диаметр 2,8 см, высота 20 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [65/25 по объему] и собирая фракции по 25 см3. Фракции 6 - 12 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растирают в диизопропиловом эфире. Получают 0,53 г 7,7-дифенил-4-/2-метокси-фенил/-2-/2-фенил-/S/-пропионил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 128oC с разложением.
Пример 5
К суспензии 0,75 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 60 см3 безводного дихлорметана добавляют 0,024 г 1-гидрокси-бензотриазола, 0,33 г 2-ацетилокси-2-фенил-/S/-уксусной кислоты, затем этот раствор охлаждают до +5oC и быстро добавляют суспензию 0,4 г хлоргидрата 1-/3-диметиламинопропил/-3-этил-карбодиимида в 20 см3 безводного дихлорметана, затем раствор 0,63 см3 диизопропилметана в 20 см3 безводного дихлорметана. Реакционную смесь перемешивают 2 часа при +5oC, 24 часа при комнатной температуре, разбавляют с помощью 120 см3 дихлорметана, промывают с помощью 100 см3 воды, затем 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,5 см, высота 39 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [50/50 по объему] и собирая фракции по 60 см3. Фракции 6-10 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 0,96 г 7,7-дифенил-4-/2-метокси-фенил/-2-/2-ацетилокси-2-фенил-/S/-ацетил/- /3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре наблюдают смеси двух геометрических изомеров: 1,25 /дмт. , J = 14, экваториальный H из -CH2- в положении 5/; 1,4 /дмт., J = 14, экваториальный H из -CH2- в положении 5/; 2,01 /с. , 3H, -OCOCH3/; 2,27 /мт., 2H, H из -CH2- в положении 5 и 1H из -CH2- в положении 6/; 2,65-3,6 /мт., -CH2- и 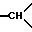 /; 3,22 /с., 3H, -OCH3/; 4,38 /с., OH геометрического изомера/; 4,86 /с., OH другого геометрического изомера/; 5,66 /с., -CO-CH-O одного геометрического изомера/; 5,88 /с., -CO-CH-O другого геометрического изомера/; 6,6-7,6 /мт., 19H, ароматические/.
/; 3,22 /с., 3H, -OCH3/; 4,38 /с., OH геометрического изомера/; 4,86 /с., OH другого геометрического изомера/; 5,66 /с., -CO-CH-O одного геометрического изомера/; 5,88 /с., -CO-CH-O другого геометрического изомера/; 6,6-7,6 /мт., 19H, ароматические/.
ИК- спектр /KBr/, характеристические полосы /см-1/: 3400, 3100-3000, 3000-2850, 2830, 1740, 1660, 1600, 1580, 1495, 1450, 1235, 1050, 755, 700.
К раствору 0,8 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-ацетилокси-2-фенил-/S/-ацетил] - /3аS, 4S, 7aS/-пергидроизоиндол-4-ола в 30 см3 этанола добавляют 1,4 см3 водного 1 н. раствора гидроксида натрия, затем 10 см3 воды. Реакционную смесь в течение 1 часа кипятят с обратным холодильником, концентрируют досуха при пониженном давлении /2,7 кПа/, обрабатывают с помощью 50 см3 воды, затем 1,5 см3 водного 1 н. раствора соляной кислоты и экстрагируют с помощью 40 см3 этилацетата /3 раза/. Органические фазы объединяют, промывают с помощью 50 см3 воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,5 см, высота 27 см/, элюируя под давлением азота 0,4 бар смесью циклогексана с этилацетатом [50/50 по объему] и собирая фракции по 30 см3. Фракции 2 - 5 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растирают в диизопропиловом эфире. Получают 0,6 г 7,7-дифенил-4-/2-мeтoкcи-фeнил/-2-[2-гидpoкcи-2-фeнил-/S/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 256oC.
Пример 6
Поступая согласно примеру 4, из 2,25 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 1,25 г 2-трет.-бутоксикарбониламино-2-фенил-/S/-уксусной кислоты получают 0,35 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-трет. -бутоксикарбониламино-2- фенил-/S/-ацетил]-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр (ДМСО-d6): при комнатной температуре наблюдают смесь геометрических изомеров: 1,3 и 1,4 /2с., -C/CH3/3/; 1,3-1,7 /мт., 1H из -CH2- в положении 5/; 2,15-2,45 /мт., 2H, другой H из -CH2- в положении 5 и H из -CH2- в положении 6/; 2,7-3,7 /мт., -CH2 и 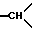 /; 3,33 и 3,4 /2с., -OCH3/; 4,84 и 5,11 /2с, 1H из NCO-CH-N обоих изомеров/; 6,6-7,7 /мт., 19H, ароматические/.
/; 3,33 и 3,4 /2с., -OCH3/; 4,84 и 5,11 /2с, 1H из NCO-CH-N обоих изомеров/; 6,6-7,7 /мт., 19H, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3580, 3550-3450, 3420, 3100-3000, 3000-2850, 2835, 1710, 1645, 1600, 1580, 1490, 1455, 1395, 1370, 1240, 1170, 1030.
Поступая согласно примеру 1, из 0,62 г 7,7 дифенил-4-/2-метокси-фенил/-2-[2-трет. -бутоксикарбониламино-2-фенил- /S/-ацетил]-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола получают 0,54 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-2-[2-амино-2-фенил-/S/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: наблюдают смесь диастереоизомеров: 1,34 и 1,53 /2 дмт., J = 14, 1H, в совокупности, экваториальный H из -CH2- в положении 5 для обоих изомеров/; 2,31 /мт., 2H, другой H из -CH2- в положении 5 и 1H из -CH2- в положении 6/; 2,8-3,7 /мт., -CH2- и 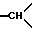 / 3,36 и 3,42 /2с., 3H, -OCH3/; 4,76 и 4,95 /2с., 1H, NCO-CH-N обоих изомеров/; 6,6-7,7 /мт., 19H, ароматические/.
/ 3,36 и 3,42 /2с., 3H, -OCH3/; 4,76 и 4,95 /2с., 1H, NCO-CH-N обоих изомеров/; 6,6-7,7 /мт., 19H, ароматические/.
Ик-спектр /KBr/, характеристические полосы /см-1/: 3425, 3100-3000, 3000-2850, 2830, 3150-2500, 1660, 1600, 1585, 1495, 1450, 1235, 1030, 755, 700.
Пример 7
К раствору 0,28 г /2-метокси-фенил/-уксусной кислоты в 20 см3 безводного дихлорметана добавляют 0,28 г карбонилдиимидазола. Перемешивают при комнатной температуре в течение 1 часа, затем добавляют последовательно суспензию 0,7 г хлоргидрата 4,7,7-трифенил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 20 см3 безводного дихлорметана, затем 0,48 см3 триэтиламина. Реакционную смесь перемешивают 24 часа при комнатной температуре, разбавляют с помощью 100 см3 дихлорметана, промывают с помощью 100 см3 воды /два раза/, затем 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2 см, высота 16 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [55/45 по объему] и собирая фракции по 20 см3. Фракции 7-8 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 16 см3 ацетонитрила. Кристаллы отсасывают и высушивают. Получают 0,3 г 4,7,7-трифенил-2[/2-метокси-финил/-ацетил]-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 236oC.
Хлоргидрат 4,7,7-трифенил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола может быть получен следующим образом.
К раствору 6,8 г 4,7,7-трифенил-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 60 см3 диоксана при комнатной температуре добавляют раствор 115 см3 6,3 н. раствора хлороводорода в диоксане. Реакционную смесь перемешивают 2 часа при этой температуре, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток промывают ацетонитрилом, отсасывают, затем высушивают. Получают 4 г хлоргидрата 4,7, 7-трифенил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,51 /тд., J = 14, 1H, аксиальный H из -CH2- в положении 5/; 1,72 /д. уширенный, J = 14, 1H, экваториальный H из -CH2- в положении 5/; 2,34 /д. уширенный, J = 14, 1H, экваториальный H из -CH2 в положении 6/; 2,42 /тд., J = 10, 1H из -CH2- в положении 1/; 2,87 /тд., J = 14, 1H, аксиальный H из -CH2- в положении 6/; 2,94 /мт., 1H, 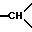 в положении 3a/; 3,05-3,25 /мт., 3H, другой H из -CH2- в положении 1 и 1H из -CH2- в положении 3/; 3,57 /мт., 1H,
в положении 3a/; 3,05-3,25 /мт., 3H, другой H из -CH2- в положении 1 и 1H из -CH2- в положении 3/; 3,57 /мт., 1H, 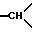 в положении 7a/; 5,67 /массив, 1H, ОH/; 7,1-7,6 /мт., 15H, ароматические/; 8,9 /2 массива, 1H, каждый, NH
в положении 7a/; 5,67 /массив, 1H, ОH/; 7,1-7,6 /мт., 15H, ароматические/; 8,9 /2 массива, 1H, каждый, NH
ИК-спектр (KBr), характеристические полосы /см-1/: 3500-3250, 3100-3000, 3000-2925, 2800-2250, 1600, 1580, 1495, 1445, 1075, 750, 700.
4,7,7-Трифенил-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ол может быть получен следующим образом.
К раствору 11,66 г 7,7 дифенил-2-трет.-бутоксикарбонил-/3aS, 7aS/-пергидроизоиндол-4-она в 70 см3 безводного тетрагидрофурана, при комнатной температуре и при перемешивании, прикапывают суспензию 10,78 г фенилмагнийбромида в 65 см3 диэтилового эфира. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, кипятят с обратным холодильником в течение 5 часов, затем обрабатывают с помощью 250 см3 водного насыщенного раствора хлорида аммония, разбавляют с помощью 200 см3 этилацетата, промывают с помощью 200 см3 воды /два раза/, затем 200 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 5,3 см, высота 31,5 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом /90/10 по объему/ и собирая фракции по 100 см3. Фракции 23-48 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 5,75 г 4,7,7-трифенил-2-трет.-бутоксикарбонил-/3aS, 4S, 7aS/- пергидроизоиндол-4-ола в виде воздушной массы бледно-желтого цвета.
1ЯМР-спектр /ДМСО-d6/: 1,37 /с., 9H, -С/CH3/3/; 1,65 /мт., 2H, -CH2- в положении 5/; 2,28 /д, уширенный J = 14, 1H, экваториальный H из -CH2- в положении 6/; 2,65 /т., J = 9, 1H из -CH2- в положении 1/; 2,85 /мт., 1H, 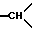 в положении 3a/; 3,05 /тд., J = 14 и 3,5, 1H, аксиальный H из -CH2- в положении 6/; 3,25 /мт., 2H, другой H из -CH2- в положении 1 и 1H из -CH2- в положении 3/; 3,4 /д. , J = 11, 1H, другой H из -CH2- в положении 3/; 3,5 /мт., 1H,
в положении 3a/; 3,05 /тд., J = 14 и 3,5, 1H, аксиальный H из -CH2- в положении 6/; 3,25 /мт., 2H, другой H из -CH2- в положении 1 и 1H из -CH2- в положении 3/; 3,4 /д. , J = 11, 1H, другой H из -CH2- в положении 3/; 3,5 /мт., 1H, 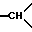 в положении 7a/; 4,4 /с., 1H, OH/; 7,1-7,6 /мт., 15H, ароматические/.
в положении 7a/; 4,4 /с., 1H, OH/; 7,1-7,6 /мт., 15H, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3425, 3100-3000, 3000-2850, 1680, 1600, 1580, 1495, 1475, 1410, 1365, 1170, 750, 700.
Пример 8
Поступая согласно примеру 4, из 1,13 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,42 г /2 метокси-фенил/-уксусной кислоты получают 0,61 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2- метокси-фенил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 204oC.
Пример 9
Поступая согласно примеру 4, из 0,75 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,28 г /3-метокси-фенил/-уксусной кислоты получают 0,54 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-метокси-фенил/ацетил]-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 185oC.
Пример 10
Поступая согласно примеру 4, из 0,75 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,28 г /4-метокси-фенил/-уксусной кислоты получают 0,61 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/4-метокси-фенил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 211oC.
Пример 11
Поступая согласно примеру 4, из 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,38 г 1-нафтил-уксусной кислоты получают 1,16 г 7,7-дифенил-4-/2-метокси-фенил/-2-/1-нафтил-ацетил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде твердого вещества белого цвета, плавящегося при 225oC.
Пример 12
Поступая согласно примеру 4, из 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,34 г 3-тиенил-уксусной кислоты получают 0,53 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-тиенил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде кристаллов белого цвета, плавящихся при 106oC с разложением.
Пример 13
К раствору 0,44 г 3-индолил-уксусной кислоты в 20 см3 безводного дихлорметана добавляют 0,41 г карбонилдиимидазола. Перемешивают при комнатной температуре в течение 1 часа, затем добавляют последовательно суспензию 1,1 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 7aRS/- пергидроизоиндол-4-ола в 25 см3 безводного дихлорметана, затем 0,7 см3 триэтиламина. Реакционную смесь перемешивают 24 часа при комнатной температуре, разбавляют с помощью 100 см3 дихлорметана, промывают с помощью 100 см3 воды /два раза/, затем 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем /гранулометрия 0,04-0,06 мм, диаметр 2 см, высота 22 см/, элюируя смесью циклогексана с этилацетатом [35/65 по объему] под давлением азота 0,5 бар и собирая фракции по 20 см3. Фракции 7-8 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток порошкуют в диизопропиловом эфире. Получают 0,17 г 7,7-дифенил-2-/3-индолил-ацетил/-4-/2-метокси-фенил/-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в виде твердого вещества белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,48 /д. уширенный, J = 14,5, 1H, экваториальный H из -CH2- в положении 5/; 2,27 /д. уширенный, J = 14,5, 1H, экваториальный H из -CH2- в положении 6/; 2,32 /тд., J = 14,5 и 2, 1H, аксиальный H из -CH2- в положении 5/; 3,02 /тд., J = 14,5 и 2, 1H, аксиальный H и -CH2- в положении 6/; 2,88 и 3,2-3,7 /2 мт., соответственно, 1H и 5H, -CH2- и -CH/; 3,44 /с. , 3H, -OCH3/; 3,52 /с:, 2H, -N-COCH2/; 6,8-7,6 /мт., 19H, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3425, 3125-3000, 3000-2850, 1625, 1585, 1490, 1460, 1235, 1030, 745, 700.
Пример 14
К суспензии 0,96 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 25 см3 безводного дихлорметана последовательно при комнатной температуре и при перемешивании добавляют раствор 0,43 г 2-[3-индолил] -2-оксо-ацетил-хлорида в 20 см3 безводного дихлорметана, затем раствор 0,6 см3 триэтиламина в 5 см3 безводного дихлорметана. Реакционную смесь перемешивают 24 часа при этой температуре, затем разбавляют с помощью 200 см3 дихлорметана, промывают с помощью 100 см3 водного 1 н. раствора гидроксида натрия, 50 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,5 см, высота 31 см/, элюируя под давлением азота 0,4 бар смесью 1,2-дихлорэтана с метанолом [70/30 по объему] и собирая фракции по 15 см3. Фракции 2-9 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 1,15 г 7,7-дифенил-2-[2-оксо- 2-/3-индолил/-ацетил] -4-/2-метоксифенил/-/3aS, 4S, 7aS/-пepгидроизоиндол-4-ола в виде воздушной массы оранжевого цвета.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3400, 3250, 3100-3000, 3000-2850, 2835, 1650-1600, 1580, 1520, 1490, 1455, 1235, 1030, 755, 700.
К раствору 1,1 г 7,7-дифенил-2-{2-оксо-2-[3-индолил]-/RS/-ацетил}-4-/2-метокси-фенил/- /3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 35 см3 этанола при комнатной температуре и при перемешивании добавляют 0,38 г боргидрида натрия. Реакционную смесь перемешивают 4 часа при этой температуре, затем обрабатывают с помощью 2 см3 уксусной кислоты и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растворяют в 100 см3 этилацетата, органическую фазу промывают 50 см3 водного 0,1 н. раствора гидроксида натрия, 50 см3 воды, затем 50 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,8 см, высота 27 см/, элюируя под давлением азота 0,4 бар смесью 1,2-дихлорэтана с метанолом [96/4 по объему] и собирая фракции по 10 см3. Фракции 17-31 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растирают в диизопропиловом эфире. Получают 0,45 г 7,7-дифенил-2-[2-гидрокси-2-/3-индолил/-/RS/-ацетил] -4-/2-метокси- фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре наблюдают смесь изомеров и геометрических изомеров: 1,4 /мт., 1H, экваториальный H из -CH2- в положении 5/; 2,3 /мт., 2H, аксиальный H из -CH2- в положении 5 и 1H из -CH2- в положении 6/; 2,5-3,8 /мт., -CH2- и 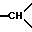 /; 3,30-3,32-3,35 и 3,38 /4с., OCH3 различных изомеров и геометрических изомеров/; 5-5,12-5,24 и 5,28 /4с., 1H,
/; 3,30-3,32-3,35 и 3,38 /4с., OCH3 различных изомеров и геометрических изомеров/; 5-5,12-5,24 и 5,28 /4с., 1H,  -CO-CH-O различных изомеров и геометрических изомеров/; 6,5-7,8 /мт., ароматические/.
-CO-CH-O различных изомеров и геометрических изомеров/; 6,5-7,8 /мт., ароматические/.
ИК-спектр /КВч/, характеристические полосы /см-1/: 3420, 3125-3000, 3000-2850, 1630, 1600, 1580, 1495, 1450, 1235, 1030, 755, 745, 700.
Пример 15
Поступая согласно примеру 4, из 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,39 г /5-фтор-3-индолил/-уксусной кислоты получают 0,36 г 7,7-дифенил-2-[/5-фтор-3-индолил/-ацетил] -4-/2- метоксифенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 170oC с разложением.
Пример 16.
Поступая согласно примеру 4, из 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,41 г /5-метокси-3-индолил/-уксусной кислоты получают 0,66 г 7,7-дифенил-2-[/5-метокси-3-индолил/-ацетил] -4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы бежевого цвета.
1H-ЯМР-спектр /ДМСО-d6/: 1,5 /д. уширенный, J = 14, 1H, экваториальный H из -CH2- в положении 5/; 2,29 /д. уширенный, J = 14, 1H, экваториальный H из -CH2- в положении 6/; 2,35 /тд., J = 14 и 2,5; аксиальный 1H из -CH2- в положении 5/; 3,04 /тд., J = 14 и 2,5; аксиальный H из -CH2- в положении 6/; 2,8-3,9 /мт. , -CH2- и 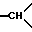 /; 3,44 /с., -OCH3/; 3,75 /с., NCO-CH2-/; 3,89 /с., 3H, -OCH3 индола/; 6,7-7,7 /мт., 18 H ароматические/; 10,3 /массив, 1H, NH индола/.
/; 3,44 /с., -OCH3/; 3,75 /с., NCO-CH2-/; 3,89 /с., 3H, -OCH3 индола/; 6,7-7,7 /мт., 18 H ароматические/; 10,3 /массив, 1H, NH индола/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3300-2200, 3125-3000, 3000-2850, 2830, 1625, 1600, 1580, 1485, 1450, 1230, 1215, 1025, 755, 700.
Пример 17
Поступая согласно примеру 4, из 0,75 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,32 г /1-метил-3-индолил/-уксусной кислоты получают 0,56 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/1-метил-3-индолил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы бежевого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре наблюдают смесь двух геометрических изомеров: 1,42 /мт. , 1H, 1H из -CH2- в положении 5/; 2,31 /мт., 2H, другой H из -CH2- в положении 5 и 1H из -CH2- в положении 6/; 2,94 /мт. , другой H из -CH2- в положении 6/; 2,7-3,6 /мт., -CH2- и 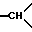 /; 3,37 /с. , 3H, -OCH3/; 3,45 и 3,5 /2с., 2H, -COCH2Ar/; 3,72 и 3,76 /2с., 3H, NCH3/; 6,8-7,7 /мт., 19Н, ароматические/.
/; 3,37 /с. , 3H, -OCH3/; 3,45 и 3,5 /2с., 2H, -COCH2Ar/; 3,72 и 3,76 /2с., 3H, NCH3/; 6,8-7,7 /мт., 19Н, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3400, 3125-3000, 3000-2850, 2830, 1637, 1600, 1580, 1485, 1450, 1235, 1050, 750, 700.
Пример 18
К раствору 4,5 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в 100 см3 дихлорметана, охлажденному до 0oC, добавляют 4,2 см3 триэтиламина, затем 2,4 г хлорангидрида /2-метокси-фенил/-уксусной кислоты в 50 см3 дихлорметана. При комнатной температуре перемешивают в течение 90 минут; реакционную смесь промывают 2 раза по 10 см3 воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Выкристаллизовавшееся твердое вещество обрабатывают 100 см3 диизопропилового эфира, затем отфильтровывают, промывают 50 см3 насыщенного раствора бикарбоната натрия, потом 50 см3 диизопропилового эфира. Получают 4,35 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-метокси-фенил/-ацетил] -/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в виде твердого вещества светло-бежевого цвета, плавящегося при 278oC.
Хлорангидрид /2-метокси-фенил/-уксусной кислоты получают из смеси 2,2 г /2-метокси-фенил/-уксусной кислоты и 20 см3 тионилхлорида путем кипячения в течение 30 минут с обратным холодильником. После концентрирования досуха при пониженном давлении /2,7 кПа/ получают 2,4 г желтого масла, используемого в неочищенном состоянии в последующих синтезах.
Хлоргидрат 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола может быть получен следующим образом.
К раствору 5,15 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет.- бутоксикарбонил-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в 25 см3 диоксана при комнатной температуре, добавляют 25 см3 6 н. раствора хлороводорода в диоксане. Реакционную смесь перемешивают 1 час при этой температуре, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток промывают 20 см3 ацетонитрила, отсасывают и высушивают. Получают 4,5 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4аRS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в виде белых кристаллов, плавящихся при температуре выше 300oC.
7,7-Дифенил-4-/2-метокси-фенил/-2-трет.-бутоксикарбонил-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диол может быть получен следующим образом.
К суспензии 26,4 г 5-ацетокси-7,7-дифенил-4-/2-метокси-фенил/-2-трет.-бутоксикарбонил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она и 43,3 г безводного хлорида церия в 265 см3 безводного тетрагидрофурана при комнатной температуре и при перемешивании прикапывают суспензию 30,9 г 2-метокси-фенилмагнийбромида в 170 см3 безводного тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, обрабатывают с помощью 400 см3 водного насыщенного раствора хлорида аммония, обрабатывают с помощью 1000 см3 этилацетата, затем отфильтровывают через целит. Органическую фазу декантируют, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 7 см, высота 55 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [70/10 по объему] и собирая фракции по 250 см3. Фракции 10-19 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 18 г 7,7-дифенил-4-/2-метокси -фенил/-2-трет. -бутоксикарбонил-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в виде белых кристаллов, плавящихся при 229oC.
5-Ацетокси-7,7-дифенил-2-трет. -бутоксикарбонил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-он может быть получен следующим образом.
К суспензии 19 г хлоргидрата 5-ацетокси-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она в 200 см3 безводного дихлорметана при температуре около 5oC и при перемешивании добавляют 46,9 см3 триэтиламина, 11,8 г ди-трет. -бутилдикарбоната, затем 0,3 г 4-диметиламино-пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, затем промывают водным насыщенным раствором бикарбоната натрия. Органическую фазу декантируют, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 120 см3 диизопропилового эфира. Получают 21 г 5-ацетокси-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она в виде белых кристаллов; плавящихся при 213oC.
5-Ацетокси-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-он может быть получен следующим образом.
К раствору 51,2 г 5-ацетокси-7,7-дифенил-2-винилоксикарбонил-/3aRS, 5RS, 7aRS/-пергидроизоиндолин-4-она в 118 см3 диоксана при комнатной температуре добавляют 394 см3 5,2 н. раствора хлороводорода в диоксане. Реакционную смесь перемешивают в течение 1 часа при этой температуре, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток перекристаллизуют из 200 см3 кипящего этанола. Получают 13,4 г хлоргидрата 5-ацетокси-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она в виде белых кристаллов, плавящихся при температуре выше 300oC.
5-Ацетокси-7,7-дифенил-2-винилоксикарбонил-/3aRS, 5RS, 7aRS/-пергидроизоиндолин-4-он может быть получен следующим образом.
К раствору 58 г 5-ацетокси-2-бензил-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндолин-4-она в 580 см3 безводного дихлорметана, при комнатной температуре и при перемешивании, добавляют 13,6 см3 винилхлорформиата. Реакционную смесь в течение часа кипятят с обратным холодильником, охлаждают до комнатной температуры и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 400 см3 смеси диизопропилового эфира с петролейным эфиром [50/50 по объему]. Получают 51,4 г 5-ацетокси-7,7-дифенил-2-винилоксикарбонил-/3aRS, 5RS, 7aRS/-пергидроизоиндолин-4-она в виде желтых кристаллов, плавящихся при 205-210oC.
5-Ацетокси-2-бензил-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-он может быть получен следующим образом.
К раствору 86 г 6-ацетокси-4,4-дифенил-циклогоксан-2-она и 96 см3 N-бутоксиметил-N-триметилсилилметил-бензиламина в 1000 см3 дихлорметана добавляют 15 капель трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 15 часов, затем добавляют 2 г карбоната натрия и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 7 см, высота 70 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [20/80 по объему] и собирая фракции по 200 см3. Фракции 6-10 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 70 г 5-ацетокси-2-бензил-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она в виде меда /т. пл. ниже 40oC/.
N-Бутоксиметил-N-триметилсилилметил-бензиламин может быть получен согласно методу Y. TERAO с сотр., Chem. Pharm. Bull. 33, 2762/1985/.
6-Ацетокси-4,4-дифенил-циклогексан-2-он может быть получен согласно методу, описанному W. OPPOLZER и сотр., Helv. Chim. Acta. 59, 2012 /1976/.
Пример 19
Поступая согласно примеру 18, из 0,5 г хлоргидрата 7,7-дифенил-4-фенил-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола и 0,39 г /2-метокси-фенил/-уксусной кислоты получают 0,4 г 7,7-дифенил-4-фенил-2-[/2-метокси-фенил/-ацетил] -/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола в виде белого твердого вещества, плавящегося при 150oC с разложением.
Пример 20
Поступая согласно примеру 1, из 0,5 г хлоргидрата 7,7-дифенил-4-фенил-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола и 0,25 г 2-/2-метокси-фенил-/S/-пропионовой кислоты получают 0,52 г 7,7-дифенил-4-фенил-2-[2-/2-метокси-фенил/-/S/-пропионил] -/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола в виде белого твердого вещества, плавящегося при 158oC с разложением.
Пример 21
К раствору 0,9 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, 0,4 г 3-индолил-уксусной кислоты и 20 мг 1-гидрокси-бензотриазол-гидрата в 90 см3 дихлорметана, охлажденному до 0oC, добавляют 0,46 г 1-/3-диметил-амино-пропил/-3-этил-карбодиимида и 0,34 см3 диизопропиламина. Перемешивают при комнатной температуре в течение 15 часов, подкисляют 0,1 HCl, затем обрабатывают водным насыщенным раствором хлорида натрия. Органическую фазу декантируют, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученную меренгу перекристаллизуют из 10 см3 кипящего ацетонитрила. Получают 0,85 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-индолил/-ацетил] -/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в виде твердого белого вещества, плавящегося при 266oC.
Пример 22
К суспензии 0,14 г хлоргидрата 7,7-дифенил-4-фтор-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндола в 7 см3 безводного дихлорметана при комнатной температуре добавляют 0,1 см3 триэтиламина, затем 0,04 см3 фенилацетилхлорида. Реакционную смесь перемешивают 5 часов при этой температуре, разбавляют с помощью 100 см3 дихлорметана, промывают с помощью 40 см3 насыщенного раствора гидрокарбоната натрия, затем 40 см3 воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученный остаток порошкуют в диизопропиловом эфире. Получают 0,1 г 7,7-дифенил-4-фтор-4-/2- метокси-фенил/-2-фенилацетил-/3aS, 4S, 7aS/-пергидроизоиндола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре наблюдают смесь геометрических изомеров: 1,62 /мт., 1H, 1H из -CH2- в положении 5/; 2-3,8 /мт., -CH2- и 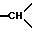 /; 3,38 и 3,42 /2с., 3H, -OCH3/; 6,7-7,6/ мт., 19H, ароматические/.
/; 3,38 и 3,42 /2с., 3H, -OCH3/; 6,7-7,6/ мт., 19H, ароматические/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3100-3000, 3000-2850, 2840, 1640, 1600, 1580, 1495, 1455, 1240, 1030, 755, 720, 700.
Хлоргидрат 7,7-дифенил-4-фтор-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндола может быть получен следующим образом.
К раствору 2,07 г 7,7-дифенил-4-фтор-4-/2-метокси-фенил/-2-трет.-бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндола в 20 см3 диоксана при комнатной температуре добавляют 20 см3 6,3 н. раствора хлороводорода в диоксане. Реакционную смесь перемешивают при этой температуре в течение 3 часов, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 40 см3 абсолютного этанола, кристаллы отсасывают, затем высушивают. Получают 1 г хлоргидрата 7,7-дифенил-4-фтор-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндола в виде белых кристаллов, плавящихся при 270oC.
7,7-Дифенил-4-фтор-4-/2-метокси-фенил/-2-трет.-бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол может быть получен следующим образом.
К охлажденному до 0oC раствору 6,48 г 7,7-дифенил-4-/2- метокси-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 70 см3 безводного дихлорметана прикапывают раствор 4,3 см3 диэтиламинотиотрифторида в 20 см3 безводного дихлорметана. Реакционную смесь перемешивают 3 часа при этой температуре, промывают с помощью 100 см3 водного насыщенного раствора гидрокарбоната натрия, затем 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04 - 0,06 мм, диаметр 4,8 см, высота 26 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [95/5 по объему] и собирая фракции по 50 см3. Фракции 34-63 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 2,2 г 7,7-дифенил-4-фтор-4-/2-метокси-фенил/-2-трет. -бутоксикарбонил-/3aS, 4S, 7aS/-пергидроизоиндола в виде воздушной массы белого цвета.
Пример 23
К раствору 1,5 г хлоргидрата 4,4-дифенил-7-/2-метокси-фенил/-2,3,3а, 4,5,7а-гексагидро-/3aS, 7aR/-изоиндола в 20 см3 дихлорметана, охлажденному до 0oC, добавляют 1,5 см3 триэтиламина, затем 1,6 г хлорангидрида /2-метокси-фенил/-уксусной кислоты. Перемешивают при комнатной температуре в течение 15 часов; реакционную смесь промывают 2 раза с помощью 40 см3 воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 3,6 см, высота 25 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [75/25 по объему] и собирая фракции по 25 см3. Фракции 14-28 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученную желтого цвета воздушную массу перекристаллизуют из 10 см3 циклогексана, получая 0,38 г 4,4-дифенил-2-[/2-метокси-фенил/-ацетил]-7-/2-метокси-фенил/- 2,3,3а,4,5,7а-гексагидро-/3aS, 7aR/-изоиндола в виде твердого вещества бежевого цвета, плавящегося при 142oC.
Хлоргидрат 4,4-дифенил-7-/2-метокси-фенил/-2,3,3а, 4,5,7а- гексагидро-/3aS, 7aR/-изоиндола может быть получен следующим образом.
Раствор 8,56 г 7,7-дифенил-4-/2-метокси-фенил/-2-трет.-бутокси-карбонил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в 53 см3 уксусной кислоты и 30 см2 12 н/ соляной кислоты нагревают при 95oC в течение 45 минут, затем охлаждают до комнатной температуры и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток перекристаллизуют из 20 см3 ацетонитрила. Получают 5,2 г хлоргидрата 4,4-дифенил-7-/2-метокси-фенил/-2,3,3а, 4, 5,7а-гексагидро-/3aS, 7aR/-изоиндола в виде белых кристаллов, плавящихся при температуре выше З00oC и используемых в неочищенном состоянии в последующих синтезах.
Пример 24
Раствор 1,03 г 7,7-дифенил-4-/2-метокси-фенил/-2-фенилацетил-/3aS, 7aS/-пергидроизоиндол-4-ола и 0,95 г 4-метил-фенил-сульфокислоты в 50 см3 толуола в течение 3 часов кипятят с обратным холодильником. После охлаждения реакционную смесь разбавляют с помощью 200 см3 дихлорметана, промывают с помощью 100 см3 водного 4 н/ раствора гидроксида натрия /2 раза/, 100 см3 воды, затем 100 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04 - 0,06 мм, диаметр 3,5 см, высота 25 см/, элюируя под давлением азота 0,4 бар смесью циклогексана с этилацетатом [50/50 по объему] и собирая фракции по 60 см3. Фракции 5-8 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растирают в петролейном эфире. Получают 0,38 г 4,4-дифенил-7-/2-метокси-фенил/-2-фенил-ацетил-2,3,3а, 4,5,7а- гексагидро-/1H/-/3aS, 7aR/-изоиндола в виде воздушной массы белого цвета,
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре, наблюдают смесь геометрических изомеров: 2,5-3,9 /мт. , -CH2- и  /; 3,17 и 3,32 /аб, J = 12,5 и аб ограниченное, -COCH2Ar/; 3,48 и 3,5 /2с., -OCH3/; 5,87 /мт., 1H, винильный H/; 6,7-7,6 /мт., 19H, ароматические/.
/; 3,17 и 3,32 /аб, J = 12,5 и аб ограниченное, -COCH2Ar/; 3,48 и 3,5 /2с., -OCH3/; 5,87 /мт., 1H, винильный H/; 6,7-7,6 /мт., 19H, ароматические/.
ИК-спектр /KBч/, характеристические полосы /см-1/: 3100-3000, 3000-2850, 2840, 1640, 1600, 1580, 1495, 1450, 1245, 1030, 750, 720, 700.
Пример 25
Поступая согласно примеру 4, но из 1 г хлоргидрата 7,7- дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,37 г фенилуксусной кислоты получают 0,3 г 7,7-дифенил-4-/2-метокси-фенил/-2-фенилацетил-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 192oC.
Пример 26
Поступая согласно примеру 4, но исходя из 1 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,48 г /2-диметиламино-фенил/-уксусной кислоты получают 0,91 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-диметиламино-фенил/-ацетил] - /3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 207oC.
Пример 27
Поступая согласно примеру 4, но исходя из 1 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,48 г 3-инденил-уксусной кислоты получают 0,21 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-инденил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре, наблюдают смесь геометрических изомеров: 3,35 /2с., 3H из OCH3/; 4,82 /1H, из OH/; 6,1 и 6,4 /1H индена/; 6,8-7,6 /м., 18H фенилом и индена/.
ИК-спектр /KBr/, характеристические полосы /см-1/: 3410, 3100-3000, 3000-2850, 2830, 1630, 1600, 1580, 1495, 1485, 1450, 1460-1425, 1235, 1025, 755, 755-700.
Пример 28
Поступая согласно примеру 4, но исходя из 2 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,96 г 3-индолил-уксусной кислоты получают 2,17 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-индолил/-ацетил] -/3aS, 4S, 7aS/-пepгидpoизoиндoл-4-oлa в виде белых кристаллов, плавящихся при 142oC.
Пример 29
Поступая согласно примеру 4, но исходя из 0,8 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,46 г [3-бензо/б/тиенил] -уксусной кислоты получают 0,5 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/3-бензо/б/тиенил/-ацетил]-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 130oC с разложением.
Пример 30
Поступая согласно примеру 4, но исходя из 0,73 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 7aS/-пергидроизоиндол-4-ола и 0,5 г 2-/2-бензилокси-фенил/-/S/-пропионовой кислоты получают 0,73 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-бензилокси-фенил/-/S/- пропионил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре, наблюдают смесь геометрических изомеров: 1,15 /2д., 3H, CH3-CH/; 3,35 /2с., 3H, из OHC3/; 3,98 и 3,78 /2к. , 1H от CH-CH3/; 4,2 /с., 1H из ОH/, 4,6-5 /2дд., 2H, из CH2О/; 6,7-7,6 /м., 23H, ароматические/.
К раствору 0,73 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-бензилокси-фенил/-/S/- пропионил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола, полученного выше, в 20 см3 абсолютного этанола добавляют 0,005 г 10 %-ного палладия-на-угле и в течение 2 часов при комнатной температуре через реакционную смесь пропускают водород. Реакционную смесь фильтруют через целит, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2,4 см, высота 20 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [80/20 по объему] и собирая фракции по 30 см3. Фракции 3-8 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 0,2 г 7,7-дифенил-4-/2-метокси- фенил/-2-[2-/2-гипрокси-фенил-/S/-пропионил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 150oC с разложением.
2-/2-Бензилокси-фенил/-/S/-пропионовая кислота может быть получена следующим образом.
Раствор 1,07 г N-[2/2-бензилокси-фенил/-/S/-пропионил]-2,10-камфор-/1R, 2S/-сультама в смеси 0,47 см3 водного 30%-ного раствора гидроксида натрия и 10 см3 тетрагидрофурана перемешивают при комнатной температуре в течение 48 часов. Реакционную смесь концентрируют досуха при пониженном давлении /2,7 кПа/, затем разбавляют 20 см3 дистиллированной воды, водную фазу экстрагируют с помощью 25 см3 дихлорметана, затем подкисляют с помощью 3 см3 водного 37%-ного раствора соляной кислоты, и, наконец, экстрагируют 3 раза по 25 см3 дихлорметанат. Органическую фазу сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 0,5 г 2-/2-бензилокси-фенил/-/S/-пропионовой кислоты в виде бесцветного масла.
1H-ЯМР-спектр /CDCl3/: 1,5 /д., 3H из CH3-CH/; 4,18 /к., 1H из CH-CH3 /; 5,1 /2H из OCH2/; 6,95-7,45 /м., 9H, ароматические/.
N-[2-/2-Бензилокси-фенил/-/S/-пропионил] -2,10-камфор-/1R, 2S/-сультам может быть получен следующим образом.
К раствору 4,1 г N-[/2-бензилокси-фенил/-ацетил]-2,10-камфор-/1R, 2S/-сультама в 40 см3 тетрагидрофурана, охлажденному до -78oC, порциями добавляют 1,62 г трет.-бутилата калия, затем к этой суспензии прикапывают раствор 2,63 см3 метилиодида в 2 см3 тетрагидрофурана. Реакционную смесь перемешивают в течение 18 часов при -78oC, затем добавляют 40 см3 насыщенного водного раствора хлорида аммония. После возврата к комнатной температуре реакционную смесь экстрагируют 80 см3 этилацетата, органическую фазу промывают два раза по 25 см3 водного насыщенного раствора хлорида аммония, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 4 см, высота 39 см/, элюируя под давлением азота 0,3 бар дихлорметаном и собирая фракции по 25 см3. Фракции 21-53 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из диизопропилового эфира. Получают 1,1 г N-[2-/2-бензилокси-фенил/-/S/-пропионил]-2,10-камфор-/1R, 2S/-сультама в виде белых кристаллов, плавящихся при 131oC.
N-[/2-Бензилокси-фенил/-ацетил] -2,10-камфор-/1R, 2S/-сультам может быть получен следующим образом.
К охлажденному до +10oC раствору 3,23 г 2,10-камфор-/1R, 2S/-сультама в 16 см3 безводного дихлорметата прикапывают раствор 0,74 г гидроксида натрия в 20 см3 дистиллированной воды, затем 0,03 см3 Aliquat 336®. После этого при +10oC прикапывают раствор 3,9 г /2-метокси-фенил/-ацетилхлорида в 5 см3 дихлорметана. Реакционную смесь перемешивают в течение 1 часа при +10oC, декантируют, водную фазу экстрагируют с помощью 80 см3 дихлорметана, органические фазы объединяют, промывают с помощью 80 см3 дистиллированной воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 15 см3 диизопропилового эфира. Получают 4,1 г N-[/2-бензилокси-фенил/-ацетил]-2,10-камфор-/1R, 2S/-сультама в виде белых кристаллов, плавящихся при 116oC.
Пример 31
Поступая согласно примеру 4, но исходя из 12,27 г хлоргидрата 7,7-дифенил-4-/2-метокси-фенил/-пергидроизоиндол-4-ола и 7,88 г /2-бензилокси-фенил/-уксусной кислоты получают 16,4 г 7,7-дифенил-4-/2-метокси-фенил/-[/2-бензилокси-фенил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде воздушной массы белого цвета.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре, наблюдают смесь геометрических изомеров: 3,4 /с., 3H из OCH3/; 5 /с., 2H из -CH2О/; 6,85-7,5 /м., 23 H, ароматические/.
Поступая согласно примеру 30, из 16,4 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-бензилокси-фенил/-ацетил] -/3aS, 4S, 7aS/- пергидроизоиндол-4-ола получают 11,4 г 7,7-дифенил-4-/2-метоксифенил/-2-[2-/2-гидрокси-фенил/-ацетил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 190oC.
Пример 32
К суспензии 5 г хлоргидрата 4,4-дифенил-7-/2-метокси-фенил/- 2,3,3a, 4,5,7a-гeкcaгидpo-/1H/-/3aS, 7aR/-изоиндола в 70 см3 безводного дихлорметана добавляют 0,16 г 1-гидрокси-бензотриазола, 2,59 г 2-/2-метокси-фенил/-/S/-пропионовой кислоты, 2,08 см3 диизопропилэтиламина, затем этот раствор охлаждают до +5oC и быстро добавляют суспензию 2,8 г хлоргидрата 1-/3-диметиламино-пропил/-3-этил-карбодиимида в 10 см3 безводного дихлорметана. Реакционную смесь перемешивают 2 часа при +5oC, затем 24 часа при комнатной температуре, промывают 20 см3 воды, затем 20 см3 водного насыщенного раствора хлорида натрия /2 раза/, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 4 см, высота 20 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [80/20 по объему] и собирая фракции по 50 см3. Фракции 2-8 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток растирают в диизопропиловом эфире. Получают 4,43 г 4,4-дифенил-7-/2-метокси-фенил/-[2-/2-метокси-фенил/-/S/-пропионил] - 2,3,3а, 4,5,7а-гексагидро-/1H/-/3aS, 7aR/-изоиндола в виде белых кристаллов, плавящихся при 104oC с разложением.
Пример 33
К раствору 1,1 г 7,7-дифенил-4-/2 метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола и 0,56 г 2-/2-метокси-фенил/-/S/-пропионовой кислоты в 30 см3 дихлорметана, охлажденному до 0oC, добавляют 30 мг 1-гидрокси-бензотриазол-гидрата, 0,66 г 1-/3-диметиламино-пропил/-3-этил-карбодиимида и 0,6 см3 диизопропилэтиламина. Перемешивают 3,5 часа при комнатной температуре, добавляют 100 см3 воды и 50 см3 водного насыщенного раствора хлорида натрия. Органическую фазу декантируют, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Полученный остаток желтого цвета хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 2 см, высота 30 см/, элюируя под давлением азота 50 кПа смесью циклогексана с этилацетатом [60/40 по объему] и собирая фракции по 25 см3. Фракции 6-14 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 0,9 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-метокси-фенил/-/S/-пропионил] -/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола, плавящегося при 250oC.
7,7-Дифенил-4-/2-метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диол может быть получен следующим образом.
К 13 г 1,4-дитолуоил-L-тартрата 7,7-дифенил-4-/2-метоксифенил- /3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола в виде раствора в 260 см3 метанола добавляют 520 см3 воды и 70 см3 1 н. водного раствора гидроксида натрия; реакционную смесь перемешивают при комнатной температуре вплоть до исчезновения исходного продукта. Образовавшиеся кристаллы отфильтровывают, отсасывают и высушивают. Получают 7,6 г 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола, плавящегося при 235oC.
1,4-Дитолуоил-L-тартрат 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола может быть получен следующим образом.
К раствору 30 г 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола в 500 см3 метанола при перемешивании добавляют 29,2 г /-/-1,4-дитолуоил-L-винной кислоты. После полного растворения реакционную смесь концентрируют досуха при пониженном давлении /2,7 кПа/; полученную воздушную массу кристаллизуют из 500 см3 диэтилового эфира. Полученные кристаллы перекристаллизуют до постоянной вращательной способности из смеси этанола с водой [60/40 по объему]. Получают 13,3 г 1,4-дитолуоил-L-тартрата 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола, плавящегося при 240oC.
7,7-Дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диол может быть получен следующим образом.
Смесь 2 г 2-бензил-7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола и 50 см3 этанола нагревают при 65oC при перемешивании; добавляют 0,65 г 20%-ного гидроксида палладия-на-угле, затем реакционную смесь гидрируют при перемешивании при температуре 65oC и атмосферном давлении. После протекания реакции в течение 1 часа абсорбируется теоретический объем водорода; реакционную смесь отфильтровывают, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 10 см3 диизопропилового эфира. Получают 1,45 г 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, плавящегося при 230oC.
2-Бензил-7,7-дифенил-4-[2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диол может быть получен следующим образом.
К суспензии 84,4 г 2-метокси-фенилмагнийбромида в 1000 см3 тетрагидрофурана при комнатной температуре и при перемешивании прикапывают раствор 22 г 5-ацетокси-2-бензил-7,7-дифенил-/3aRS, 5RS, 7aRS/-пергидроизоиндол-4-она в 220 см3 тетрагидрофурана. Реакционную смесь перемешивают в течение 18 часов при комнатной температуре, обрабатывают с помощью 200 см3 водного насыщенного раствора хлорида аммония, затем обрабатывают 200 см3 диэтилового эфира и 200 г льда. Органическую фазу декантируют, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 250 см3 петролейного эфира, затем перекристаллизуют из 200 см3 метанола; кристаллы промывают 200 см3 диизопропилового эфира. Получают 16,4 г 2-бензил-7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/- пергидроизоиндол-4,5-диола, плавящегося при 236oC.
Пример 34
7,7-Дифенил-4-/2-метокси-фенил/-2-[/2-бензилокси-фенил/-ацетил] -/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диол может быть получен согласно методике примера 33, исходя из 1,24 г 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола и 0,8 г /2-бензилокси/-фенил-уксусной кислоты. Получают 1,7 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-бензилокси-фенил/-ацетил] - /3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, плавящегося при 158oC.
Смесь 1,5 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-бензилокси-фенил/-ацетил] - /3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола и 50 см3 этанола нагревают при 60oC при перемешивании; добавляют 0,5 г 20%-ного гидроксида палладия-на-угле, затем реакционную смесь гидрируют при перемешивании при температуре 60oC и при атмосферном давлении. После протекания реакции в течение 45 минут абсорбируется теоретический объем водорода; реакционную смесь отфильтровывают, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 20 см3 диизопропилового эфира. Получают 0,8 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-гидрокси-фенил/-ацетил]-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, плавящегося при 188-190oC.
Пример 35
Поступая согласно способу работы примера 21, из 0,62 г 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола и 0,30 г /2-диметиламино/-фенил-уксусной кислоты получают 0,47 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/2-диметиламино-фенил/-ацетил]- /3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, плавящегося при 250oC.
Пример 36
Поступая согласно способу работы примера 21, из 1,04 г 7,7-дифенил-4-/2-метокси-фенил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола и 0,49 г 3-индолил-уксусной кислоты получают 1,25 г 7,7-дифенил-4-/2-метокси-фенил/-2-/3-индолил-ацетил/-/3aS, 4S, 5S, 7aS/-пергидроизоиндол-4,5-диола, плавящегося при 210oC.
Пример 37
Поступая согласно способу работы примера 21, из 0,62 г 7,7-дифенил-4-/2-метокси-фенил/-/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола и 0,31 г 3-/N-метил-индолил/-уксусной кислоты получают 0,55 г 7,7-дифенил-4-/2-метокси-фенил/-2-[/N-метил-3-индолил/-ацетил] -/3aRS, 4RS, 5RS, 7aRS/-пергидроизоиндол-4,5-диола, плавящегося при 240oC.
Пример 38
К суспензии 6,4 г 7,7-дифенил-2-[2-/2-метокси-фенил/-/S/-пропионил]-/3aS, 7aS/-пергидроизоиндол-4-она и 8,7 г безводного хлорида церия в 250 см3 безводного тетрагидрофурана при комнатной температуре и при перемешивании прикапывают суспензию 2-метокси-фенил-магнийбромида [полученного из 14 см3 2-бром-анизола и 2,8 г магния] в 50 см3 безводного тетрагидрофурана. Суспензию перемешивают при комнатной температуре в течение 20 часов, затем кипятят с обратным холодильником в течение 6 часов. После охлаждения реакционную смесь обрабатывают водным насыщенным раствором хлорида аммония, разбавляют 500 см3 этилацетата, промывают 100 см3 воды, затем 100 см3 водного насыщенного раствора хлорида натрия /2 раза/, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 5 см, высота 40 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [80/20 по объему] и собирая фракции по 100 см3. Фракции 16-26 объединяют, затем концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из смеси ацетонитрила с диизопропиловым эфиром. Получают 1,83 г 7,7-дифенил-4-/2-метокси-фенил/-2-[2-/2-метокси-фенил/-/S/-пропионил] -/3aS, 4S, 7aS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 244oC.
7,7-Дифенил-2-[2-/2-метокси-фенил-/S/-пропионил] -/3aS, 7aS/-пергидроизоиндол-4-он может быть получен следующим образом.
К раствору 9,85 г 7,7-дифенил-/3aS, 7aS/-пергидроизоиндол-4-она в 120 см3 безводного дихлорметана добавляют 0,46 г 1-гидрокси-бензотриазола и 7,07 г 2-/2-метокси-фенил/-/S/-пропионовой кислоты, затем этот раствор охлаждают до +5oC и быстро добавляют суспензию 7,91 г хлоргидрата 1-/3-диметиламино-пропил/-3-этил-карбодиимида в 130 см3 безводного дихлорметана. Реакционную смесь перемешивают 2 часа при +5oC, 2 часа при комнатной температуре, промывают 50 см3 воды, затем промывают 50 см3 водного насыщенного раствора хлорида натрия /2 раза/, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,04-0,06 мм, диаметр 6 см, высота 30 см/, элюируя под давлением азота 0,5 бар смесью циклогексана и этилацетата [80/20 по объему] и собирая фракции по 50 см3. Фракции 36-60 объединяют и концентрируют досуха при пониженном давлении /2,7 кПа/. Получают 12,3 г 7,7-дифенил-2-[2-/2-метокси-фенил/-/S/-пропионил] -/3aS, 7aS/-пергидроизоиндол-4-она в виде твердого белого вещества.
1H-ЯМР-спектр /ДМСО-d6/: при комнатной температуре, наблюдают смесь двух геометрических изомеров: 1,13 и 1,23 /2д., J = 7,5, 3H в совокупности, -CH3/; 1,9-2,3 /мт. , 2H, -CH2- в положении 5/: 2,6-4,2 /мт., -CH2- и -CH/; 3,36 и 3,86 /2с., 3H в совокупности, -OCH3/; 6,7-7,7, /мт., 14H, ароматические/.
Пример 39
К суспензии 4,09 г 7,7-дифенил-2-фенилацетил-/3aRS, 7aRS/-пергидроизоиндол-4-она в 50 см3 тетрагидрофурана добавляют раствор фенилмагнийбромида [полученный из 3,14 г бромбензола и 0,48 г магния в 30 см3 эфира]. Реакционную смесь перемешивают 1 час при 25oC, затем кипятят с обратным холодильником в течение 2,5 часов, охлаждают и обрабатывают с помощью 150 см3 насыщенного раствора хлорида аммония. Органическую фазу промывают водой /2 раза по 100 см3/. Водные фазы экстрагируют 100 см3 этилацетата. Объединенные органические фазы промывают 100 см3 насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток кристаллизуют из 30 см3 ацетонитрила, получая 2,9 г 2-фенилацетил-4,7,7-трифенил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-ола в виде белых кристаллов, плавящихся при 270oC.
Пример 40
К суспензии фенилмагнийбромида [полученного из 4,7 см3 бромбензола и 1,1 г магния] в 40 см3 диэтилового эфира при 5oC и в течение 20 минут добавляют по каплям раствор 7,0 г 2-/3- индолил-ацетил/-7,7-дифенил-/3aRS, 7aRS/-пергидроизоиндол-4- она в 50 см3 тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 4 часов, обрабатывают 100 см3 водного насыщенного раствора хлорида аммония, экстрагируют три раза по 150 см3 этилацетата. Органический раствор промывают 200 см3 водного насыщенного раствора хлорида натрия, сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении /2,7 кПа/. Остаток хроматографируют на колонке с силикагелем Merck /гранулометрия 0,06-0,20 мм, диаметр 4 см, высота 30 см/, элюируя под давлением азота 0,5 бар смесью циклогексана с этилацетатом [60/40 по объему] и собирая фракции по 100 см3. После концентрирования при пониженном давлении /2,7 кПа/ получают 6,6 г 2-/3-индолил-ацетил/-4,7,7-трифенил-/3aRS, 4RS, 7aRS/-пергидроизоиндол-4-она в виде белого твердого вещества, плавящегося при 187oC.
Настоящее изобретение также относится к фармацевтическим композициям, образованным продуктом общей формулы /I/ или солью, когда они существуют, в случае необходимости, в ассоциации с любым другим, фармацевтически приемлемым продуктом, который может быть инертным или физиологически активным. Композиции согласно изобретению можно вводить парентерально, орально, подъязычно, ректально, топически, в глаза, в нос или в виде аэрозолей с целью введения в легкие.
Стерильные композиции для парентерального введения, которые особенно могут быть использованы в форме перфузий, предпочтительно представляют собой водные или неводные растворы, суспензии или эмульсии. В качестве растворителя или эксципиента можно использовать воду, пропиленгликоль, полиэтиленгликоль, растительные масла, в особенности оливковое масло, сложные органические эфиры, которые можно вводить путем инъекции, например этилолеат, или другие пригодные органические растворители. Эти композиции также могут содержать вспомогательные средства, в особенности смачиватели, изотонизирующие агенты, эмульгаторы, диспергаторы и стабилизаторы. Стерилизацию можно проводить несколькими путями, например путем асептизирующей фильтрации, путем включения в композицию стерилизующих агентов, путем облучения или путем нагревания. Их можно также приготовлять в виде твердых стерильных композиций, которые могут быть растворены в стерильной среде для инъекции в момент использования.
Композиции для ректального/кишечного/ введения представляют собой свечи, или ректальные капсулы, которые содержат, кроме активного продукта, эксципиенты, такие как масло какао, полусинтетические глицериды или полиэтиленгликоли.
В качестве твердых композиций для орального введения могут быть использованы таблетки, пилюли, порошки или гранулы. В этих композициях активный продукт согласно изобретению [в случае необходимости ассоциированный с другим фармацевтически приемлемым продуктом] смешан с одним или несколькими инертными разбавителями или инертными вспомогательными средствами, такими как сахароза, лактоза или крахмал. Эти композиции также могут включать другие, чем разбавители, вещества, например, смазку, такую как стеарат магния.
В качестве жидких композиций для орального введения можно использовать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и элексиры, содержащие инертные разбавители, такие как вода или парафиновое масло. Эти композиции также могут включать другие, чем разбавители, вещества, например смачиватели, подслащивающие или ароматизирующие вещества.
Композиции для топического применения могут представлять собой, например, кремы, помады или лосьоны.
Композиции для введения в глаза могут представлять собой препараты для введения в виде капель /глазные капли/.
Композиции для введения в нос могут представлять собой фармацевтически приемлемые растворы или порошки, предназначенные для введения в виде капель или путем пульверизации.
Композиции также могут быть аэрозолями. Для использования в форме жидких аэрозолей, композиции могут представлять собой стерильные стабильные растворы или твердые композиции, растворяемые в момент использования в стерильной апирогенной воде, сыворотке или любом другом, фармацевтически приемлемом, вспомогательном средства. Для применения в форме сухих аэрозолей, предназначенных непосредственно для ингаляций, действующее начало тонко измельчают и ассоциируют с твердым водорастворимым разбавителем или эксципиентом с гранулометрией 30-60 мкм, например как декстран, маннитол или лактоза.
В терапии человека продукты согласно изобретению могут быть особенно пригодны для лечения болезней травматического, послехирургического, менструального, головного происхождения; сосудистых альгий липа /cluster headache/ и при лечении мигреней. Новые производные изоиндола также пригодны для лечения воспалений в ревматологии, лечения ревматоидного артрита и расстройств, вызванных нарушением иммунной системы, для лечений воспалений в дерматологии, таких как псориаз, герпес, крапивница, экземы, фотодерматозы, ожоги, и при воспалительных расстройствах зубов или глаз, а также в области слезных выделений; они также пригодны при лечении спазмодических, болевых и воспалительных симптомов пищеварительных путей [язвенные колиты, синдром раздражения оболочной кишки, болезнь Crohn], мочевых путей [мочевые гиперрефлексии, циститы] и дыхательных путей [астма, бронхиальная гиперсекреция, хронический бронхит, риниты]. Продукты согласно изобретению могут также найти применение при лечениях неврологических заболеваний, болезни Паркинсона, болезни Alzeimer, при лечениях воспалительных и/или аутоиммунных и/или демиелинизирующих заболеваний центральной нервной системы и/или периферической нервной системы [рассеянный склероз, синдром Guillain-Barre, энцефалопатии вирусного происхождения. ..], неврологических синдромов в связи с плазматической экстравазацией [отек спинного мозга, отек головного мозга...], в связи с поражением гематоэнцефалического барьера или при лечении любого неврологического спастического синдрома [миорелаксантные лечения]. Продукты согласно изобретению также могут быть пригодны для лечений тревоги, психозов, шизофрении, или еще для лечений сердечно-сосудистых расстройств, таких как гипотония. Другим применением также может быть лечение гинекологических расстройств, лечение расстройств, связанных с плохой регуляцией роста [нанизм, вторичные гипотрофии при хронических болезнях ребенка, остеопорозов, развитие пересадок].
Дозы зависят от желаемого эффекта и продолжительности лечения. Для взрослого они обычно составляют 0,25-1500 мг в день, вводимые частями.
Как правило, врач определяет соответствующую дозировку, которую он подбирает в зависимости от возраста, веса и других факторов, присущих пациенту.
Нижеследующий пример, не ограничивающий объема охраны изобретения, иллюстрирует композицию согласно изобретению.
Пример
Готовят согласно обычному методу таблетки с активным веществом, имеющие следующий состав:
7,7-дифенил-4-/2-метоксифенил/-2-[2-/2-метоксифенил/-/S/-пропионил/- /3aS, 4S, 7aS/-пергидроизоиндол-4-ол - 25 мг
крахмал - 83 мг
диоксид кремния - 30 мг
стеарат магния - 3 мг
В прилагаемой табл.3 представлены результаты испытаний соединений согласно изобретению в тесте на сродство к рецепторам вещества Р лимфобластов человека IМ9, осуществленном согласно методике, описанной в документе "Stereospecific receptors for substance Р on cultured human IM-9 lymphoblasts".
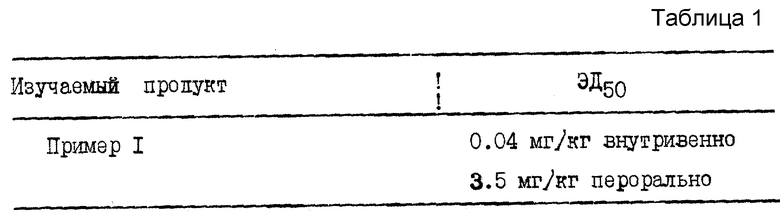
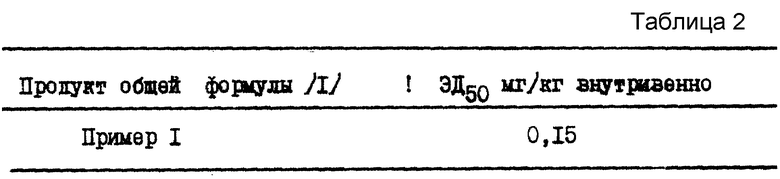
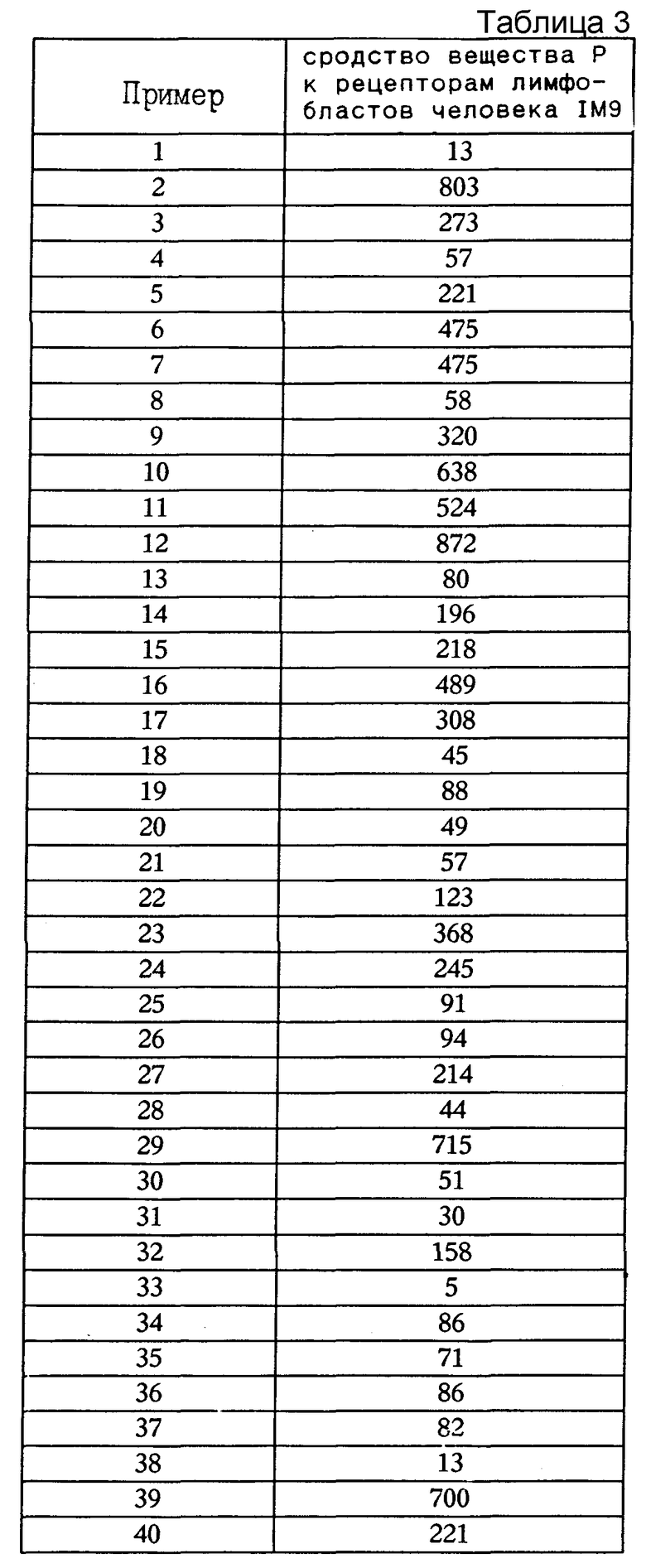
Производные пергидроизоиндола общей формулы I, где R - фенил; R1 - фенил, возможно замещенный алкокси, гидрокси, диалкиламинорадикалами, или нафти, инденил, тиенил, бензо (в) тиенил, или индолил, возможно замещенный галогеном, алкокси, алкилом; R2 - водород, гидроксил, алкил, аминорадикалы; R3 - фенил, возможно замещенный в положении 2 C1-C2-алкилоv, C1-C2-алкоксилом; R4 - фтор, гидроксил, R5 - водород, или R4 и R5 - гидроксил, или R4 вместе с R5 образуют связь, причем алкильные радикалы линейные или разветвленные и содержат 1 - 4 атома углерода, а также их стериоизомерные формы. Используют в качестве фармацевтической композиции, являющейся антагонистом вещества Р. 4 c. и 3 з.п.ф-лы, 1 табл.
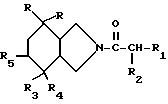
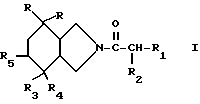
где R являются одинаковыми и обозначают фенил;
R1 обозначает фенил, в случае необходимости замещенный алкокси, гидрокси, диалкиламинорадикалами, или означает нафтил, инденил, тиенил, бензо(b)тиенил, иои индолил, возможно замещенный атомом галогена, радикалом алкокси или алкилом;
R2 означает атом водорода, гидроксильный, алкильный или аминорадикал;
R3 означает фенил, в случае необходимости замещенный в положении 2 алкильным или алкоксильным радикалом, содержащим 1 или 2 атома углерода;
R4 означает фтор или гидроксил;
R5 - означает атом водорода, или R4 и R5 означают гидроксильные радикалы, или R4 вместе с R5 образуют связь, причем вышеуказанные алкильные радикалы являются линейными или разветвленными и содержат 1 - 4 атома углерода,
в рацемической форме или в его стериоизомерных формах структуры Ia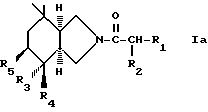
в его (R) и (S)-формах в цепи - CHR1R2, или в виде смеси нескольких из этих форм, или их фармацевтически приемлемые соли.
R4 означает фтор или гидроксильный радикал, R5 означает атом водорода, или R4 и R5 означают гидроксильные радикалы, или R4 вместе с R5 образуют связь.
7,7-дифенил-4-(2-метоксифенил)-2-[2-(2-метоксифенил)-пропионил] -пергидроизоиндол-4-ол;
7,7-дифенил-4-(2-метоксифенил)-2-[2-(2-метоксифенил)-пропионил] -пергидроизоиндол-4,5-диол;
7,7-дифенил-4-(2-метоксифенил)-2-[2-(2-гидроксифенил)-ацетил] - пергидроизоиндол-4-ол;
7,7-дифенил-4-(2-метоксифенил)-2-(3-индолил-ацетил)- пергидроизоиндол-4,5-диол;
7,7-дифенил-4-(2-метоксифенил)-2-[2-(2-метоксифенил)-ацетил] -пергидроизоиндол-4-ол; или
7,7-дифенил-4-(2-метоксифенил)-2-[2-(2-гидроксифенил)пропионил] -пергидроизоиндол-4-ол;
5. Способ получения производного пергидроизоиндола формулы I по п.1, отличающийся тем, что кислоту формулы II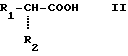
или ее галоидангидрид,
где R1 и R2 определены выше,
подвергают взаимодействию с производным изоиндола общей формулы III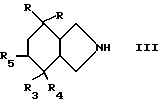
где R, R3, R4, R5 определены выше,
с последующим в случае необходимости превращением полученного соединения в соль.
R3 - MgX,
где R3 определен выше;
X - означает атом галогена,
вводят во взаимодействие с производным пергидроизондолона формулы V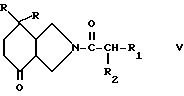
где R, R1, R2 определены выше,
с последующим в случае необходимости превращением полученного соединения в соль.
| СПОСОБ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН | 1971 |
|
SU429366A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М: Медицина, 1988, ч | |||
| I , с | |||
| ПЕРЕДВИЖНАЯ ДИАГРАММА ДЛЯ СРАВНЕНИЯ ЦЕННОСТИ РАЗЛИЧНЫХ ПРОДУКТОВ ПО ИХ КАЛОРИЙНОСТИ | 1919 |
|
SU285A1 |
Авторы
Даты
1999-03-10—Публикация
1993-04-08—Подача