Изобретение относится к новым таксоидам общей формулы (I)
в которой Ra означает атом водорода или гидроксильный радикал, алкоксильный радикал с 1-4 атомами углерода, ацилокси-радикал с 1-4 атомами углерода или алкоксиацетокси-радикал, алкильная часть которого содержит 1-4 атома углерода;
Rb означает атом водорода; или
Ra и Rb вместе с атомом углерода, с которым они связаны, образуют кетонную функцию;
Z означает атом водорода или радикал общей формулы (II)
в которой R1 означает бензоильный радикал, возможно замещенный одним или несколькими, одинаковыми или разными атомами или радикалами, выбираемыми среди атомов галогена и алкильных радикалов с 1-4 атомами углерода, алкоксильных радикалов с 1-4 атомами углерода или трифторметила; теноил или фуроил, или радикал R2-O-CO-, в котором R2 означает:
- алкильный радикал с 1-8 атомами углерода, алкенильный радикал с 2-8 атомами углерода, алкинильный радикал с 3-8 атомами углерода, циклоалкильный радикал с 3-6 атомами углерода, циклоалкенильный радикал с 4-6 атомами углерода, бициклоалкильный радикал с 7-10 атомами углерода, причем эти радикалы, каждый, могут быть замещены одним или несколькими заместителями, выбираемыми среди атомов галогена и гидроксильного радикала, алкоксильного радикала с 1-4 атомами углерода, диалкиламино-радикала, каждая алкильная часть которого содержит 1-4 атома углерода, пиперидино-радикала, морфолино-радикала, пиперазин-1-ильного радикала (возможно замещенного в положении 4 алкильным радикалом с 1-4 атомами углерода или фенилалкильным радикалом, алкильная часть которого содержит 1-4 атома углерода), циклоалкильного радикала с 3-6 атомами углерода, циклоалкенильного радикала с 4-6 атомами углерода, фенильного радикала (возможно замещенного одним или несколькими атомами или радикалами, выбираемыми среди атомов галогена и алкильных радикалов с 1-4 атомами углерода или алкоксильных радикалов с 1-4 атомами углерода), циано-радикала, карбоксила или алкоксикарбонила, алкильная часть которого содержит 1-4 атома углерода;
- фенильный или α-, или β-нафтильный радикал, возможно замещенный одним или несколькими атомами или радикалами, выбираемыми среди атомов галогена и алкильных радикалов с 1-4 атомами углерода или алкоксильных радикалов с 1-4 атомами углерода; или гетероциклический ароматический пятичленный радикал, выбираемый предпочтительно из фурильного и тиенильного радикалов;
- или насыщенный гетероциклильный радикал с 4-6 атомами углерода, возможно замещенный одним или несколькими алкильными радикалами с 1-4 атомами углерода;
R3 означает линейный или разветвленный алкильный радикал с 1-8 атомами углерода, линейный или разветвленный алкенильный радикал с 2-8 атомами углерода, линейный или разветвленный алкинильный радикал с 2-8 атомами углерода, циклоалкильный радикал с 3-6 атомами углерода, фенильный или α-, или β-нафтильный радикал, возможно замещенный одним или несколькими атомами или радикалами, выбираемыми среди атомов галогена и алкильных, алкенильных, алкинильных, арильных, аралкильных, алкоксильных, алкилтио-, арилокси-, арилтио-, гидроксильного, гидроксиалкильного, меркапто-, формильного, ацильного, ациламино-, ароиламино-, алкоксикарбониламино-, амино-,
алкиламино-, диалкиламино-, карбоксильного, алкоксикарбонильного, карбамоильного, алкилкарбамоильного, диалкилкарбамоильного, циано-, нитро- и трифторметильного радикалов; или ароматический пятичленный гетероцикл, содержащий один или несколько, одинаковых или разных гетероатомов, выбираемых среди атомов азота, кислорода или серы, и ,возможно, замещенный одним или несколькими, одинаковыми или разными заместителями, выбираемыми среди атомов галогена и алкильных, арильных, амино-, алкиламино- диалкиламино-, алкоксикарбониламино-, ацильного, арилкарбонильного, карбоксильного, карбамоильного, алкилкарбамоильного, диалкилкарбамоильного или алкоксикарбонильного радикалов, при условии, что в заместителях фенильного, α-, или β-нафтильного и гетероциклических ароматических радикалов алкильные радикалы и алкильные части других радикалов содержат 1-4 атома углерода; алкенильные и алкинильные радикалы содержат 2-8 атомов углерода, а арильные радикалы представляют собой фенильные или α-, или β-нафтильные радикалы; и
R4 означает:
- линейный или разветвленный алкильный радикал с 1-8 атомами углерода, линейный или разветвленный алкенильный радикал с 2-8 атомами углерода, линейный или разветвленный алкинильный радикал с 2-8 атомами углерода, циклоалкильный радикал с 3-6 атомами углерода, циклоалкенильный радикал с 4-6 атомами углерода или бициклоалкильный радикал с 7-11 атомами углерода, причем каждый из этих радикалов может быть замещен одним или несколькими заместителями, выбираемыми среди атомов галогена и гидроксильного радикала, алкоксильного радикала с 1-4 атомами углерода, диалкиламино-радикала, каждая алкильная часть которого содержит 1-4 атома углерода, пиперидино-радикала, морфолино-радикала, пиперазин-1-ильного радикала (возможно замещенного в положении 4 алкильным радикалом с 1-4 атомами углерода или фенилалкильным радикалом, алкильная часть которого содержит 1-4 атома углерода), циклоалкильного радикала с 3-6 атомами углерода, циклоалкенильного радикала с 4-6 атомами углерода, возможно замещенного фенильного радикала, циано-радикала, карбоксила или алкоксикарбонила, алкильная часть которого содержит 1-4 атома углерода;
- или арильный радикал, возможно замещенный одним или несколькими атомами или радикалами, выбираемыми среди атомов галогена и алкильных, алкенильных, алкинильных, арильных, аралкильных, алкоксильных, алкилтио-, арилокси-, арилтио-, гидроксильного, гидроксиалкильного, меркапто-, формильного, ацильного, ациламино-, ароиламино-, алкоксикарбониламино-, амино-, алкиламино-, диалкиламино-, карбоксильного, алкоксикарбонильного, карбамоильного, алкилкарбамоильного, диалкилкарбамоильного, циано-, нитро-, азидо-, трифторметильного или трифторметокси-радикалов;
- или насыщенный или ненасыщенный 4-6-членный гетероциклильный радикал, возможно замещенный одним или несколькими алкильными радикалами с 1-4 атомами углерода; и
R5 означает линейный или разветвленный алкильный радикал в 1-8 атомами углерода, линейный или разветвленный алкенильный радикал с 2-8 атомами углерода, линейный или разветвленный алкинильный радикал с 2-8 атомами углерода, циклоалкильный радикал с 3-6 атомами углерода, циклоалкенильный радикал с 4-6 атомами углерода или бициклоалкильный радикал с 7-11 атомами углерода, причем эти радикалы могут быть замещены одним или несколькими заместителями, выбираемыми среди атомов галогена и гидроксильного радикала, алкоксильного радикала с 1-4 атомами углерода, диалкиламино-радикала, каждая алкильная часть которого содержит 1-4 атома углерода, пиперидино-радикала, морфолино-радикала, пиперазин-1-ильного радикала (возможно замещенного в положении 4 алкильным радикалом с 1-4 атомами углерода или фенилалкильным радикалом, алкильная часть которого содержит 1-4 атома углерода), циалоалкильного радикала с 3-6 атомами углерода, циклоалкенильного радикала с 4-6 атомами углерода, возможно замещенного фенильного радикала, циано-радикала, карбоксила или алкоксикарбонила, алкильная часть которого содержит 1-4 атома углерода;
при условии, что циклоалкильные, циклоалкенильные или бициклоалкильные радикалы могут быть замещены одним или несколькими алкильными радикалами с 1-4 атомами углерода.
Предпочтительно, арильные радикалы, которыми могут быть R3 и/или R4, являются фенильными или α-, или β-нафтильными радикалами, возможно замещенными одним или несколькими атомами или радикалами, выбираемыми среди атомов галогена (фтор, хлор, бром, иод) и алкильных, алкенильных, алкинильных, арильных, арилалкильных, алкоксильных, алкилтио-, арилокси-, арилтио-, гидроксильного, гидроксиалкильного, меркапто-, формильного, ацильного, ациламино-, ароиламино-, алкоксикарбониламино-, амино-, алкиламино-, диалкиламино-, карбоксильного, алкоксикарбонильного, карбамоильного, диалкилкарбамоильного, циано-, нитро-, азидо-, трифторметильного и трифторметокси-радикалов, при условии, что алкильные радикалы и алкильные части других радикалов содержат 1-4 атома углерода, алкенильные и алкинильные радикалы содержат 2-8 атомов углерода и арильные радикалы представляют собой фенильные или α-, или β-нафтильные радикалы.
Предпочтительно, гетероциклические радикалы, которыми могут быть R3 и/или R4, являются гетероциклическими ароматическими пятичленными радикалами, содержащими один или несколько одинаковых или разных атомов, выбираемых среди атомов азота, кислорода или серы, возможно замещенными одним или несколькими, одинаковыми или разными заместителями, выбираемыми среди атомов галогена (фтор, хлор, бром, иод) и алкильных радикалов с 1-4 атомами углерода, арильных радикалов с 6-10 атомами углерода, алкоксильных радикалов с 1-4 атомами углерода, арилокси-радикалов с 6-10 атомами углерода, амино-радикала, алкиламино-радикала с 1-4 атомами углерода, диалкиламино-радикала, каждая алкильная часть которого содержит 1-4 атома углерода, ациламино-радикала, ацильная часть которого содержит 1-4 атома углерода, алкоксикарбониламино-радикала с 1-4 атомами углерода, ацильного радикала с 1-4 атомами углерода, арилкарбонильного радикала, арильная часть которого содержит 6-10 атомов углерода, циано-, карбоксильного, карбамоильного радикалов, алкилкарбамоильного радикала, алкильная часть которого содержит 1-4 атома углерода, диалкилкарбамоильного радикала, каждая алкильная часть которого содержит 1-4 атома углерода, или алкоксикарбонильного радикала, алкоксильная часть которого содержит 1-4 атома углерода.
Предпочтительно, настоящее изобретение относится к продуктам общей формулы (I) , в которой Ra означает гидроксил, алкоксил с 1-4 атомами углерода, ацилокси-радикал с 1-4 атомами углерода или алкоксиацетокси-радикал, алкильная часть которого содержит 1-4 атома углерода; Rb означает атом водорода; Z означает атом водорода или радикал общей формулы (II) , в которой R1 означает бензоильный радикал или радикал R2-O-CO-, в котором R2 означает трет. -бутильный радикал, и R3 означает алкильный радикал с 1-6 атомами углерода, алкенильный радикал с 2-6 атомами углерода, циклоалкильный радикал с 3-6 атомами углерода, фенильный радикал, возможно замещенный одним или несколькими атомами или радикалами, одинаковыми или разными и выбираемыми среди атомов галогена (фтор, хлор) и алкильных (метил), алкоксильных (метоксигруппа), диалкиламино (диметиламиногруппа), ациламино (ацетиламиногруппа), алкоксикарбониламино-(трет.-бутоксикарбониламиногруппа) или трифторметильного радикалов, или 2-фурильный или 3-фурильный радикал, 2-тиенильный или 3-тиенильный радикал или 2-, 4- или 5- тиазолильный радикал; R4 означает фенильный радикал, возможно замещенный одним или несколькими атомами или радикалами, одинаковыми или разными и выбираемыми среди атомов галогена и алкильных, алкоксильных, амино-, алкиламино-, диалкиламино-, ациламино-, алкоксикарбониламино-, азидо-, трифторметильного и трифторметокси-радикалов, или 2- или 3- тиенильный радикал или 2- или 3-фурильный радикал; и R5 означает возможно замещенный алкильный радикал с 1-4 атомами углерода.
Еще более предпочтительно, настоящее изобретение относится к продуктам общей формулы (I) , в которой Ra> означает атом водорода или гидроксильный или ацетилокси- или метоксиацетокси-радикал; Rb означает атом водорода; Z означает атом водорода или радикал общей формулы (II), в которой R1 означает бензоильный радикал или радикал R2-O-CO, в котором R2 означает трет.-бутильный радикал, и R3 означает изобутильный, изобутенильный, бутенильный, циклогексильный, фенильный, 2- или 3- фурильный, 2-тиенильный, 3-тиенильный, 2-тиазолильный, 4-тиазолильный или 5-тиазолильный радикал; R4 означает фенильный радикал, возможно замещенный атомом галогена; и R5 означает алкильный радикал с 1-4 атомами углерода.
Продукты общей формулы (I), в которой Z означает радикал общей формулы (II) , обладают ценными противоопухолевыми и антилейкемическими свойствами.
Согласно настоящему изобретению, продукты общей формулы (I) , в которой Ra означает атом водорода или алкоксильный, ацилокси- или алкоксиацетокси-радикал; Rb означает атом водорода; R4, R5 и Z имеют вышеуказанное значение, могут быть получены путем воздействия галогенида щелочного металла (как хлорид натрия, иодид натрия, фторид калия) или азида щелочного металла (как азид натрия) или четвертичной аммониевой соли или фосфата щелочного металла на продукт общей формулы (III)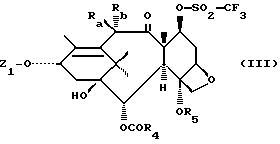
в которой Z1 означает атом водорода или радикал общей формулы (II), в которой R1 и R3 имеют вышеуказанное значение, или радикал общей формулы (IV)
в которой R1 и R3 имеют вышеуказанное значение, и/или R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу, или R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл; R4 и R5 имеют вышеуказанное значение; Ra означает атом водорода или алкоксильный, ацилокси-, алкоксиацетокси-радикал или защищенный гидроксильный радикал, предпочтительно 2,2,2-трихлор-этоксикарбонилокси-радикал, и Rb означает атом водорода; или Ra и Rb вместе с атомом углерода, с которым они связаны, образуют кетонную функцию; для получения продукта общей формулы (V)
в которой Z1, R4, R3, Ra и Rb имеют вышеуказанное значение, с последующей, если требуется, заменой защитной группы, которую содержит радикал Ra, или защитных групп, обозначаемых R7 и/или R6 и R7, атомами водорода.
Обычно реакцию проводят в органическом растворителе, выбираемом среди простых эфиров (тетрагидрофуран, диизопропиловый эфир, метил-трет.-бутиловый эфир) и нитрилов (ацетонитрил), которые используют индивидуально или в виде смеси, при температуре от 20oC до температуры кипения реакционной смеси.
Продукт общей формулы (V), в которой Z1 означает атом водорода или радикал общей формулы (II), Ra означает атом водорода или гидроксил, алкоксил с 1-4 атомами углерода, ацилокси-радикал с 1-4 атомами углерода или алкоксиацетокси-радикал, алкильная часть которого содержит 1-4 атома углерода, и Rb означает атом водорода, или Ra и Rb вместе с атомом углерода, с которым они связаны, образуют кетонную функцию, идентичен продукту общей формулы (I).
В общей формуле (V), в случае, когда Z1 означает радикал общей формулы (IV) и когда R6 означает атом водорода, R7 означает предпочтительно метоксиметил, 1-этоксиэтил, бензилоксиметил, триметилсилил, триэтилсилил,  триметилсилилэтоксиметил, бензилоксикарбонил или тетрагидропиранил, или, когда R6 и R7 вместе образуют гетероцикл, он предпочтительно представляет собой возможно монозамещенный или гем-замещенный, в положении 2 оксазолидиновый цикл.
триметилсилилэтоксиметил, бензилоксикарбонил или тетрагидропиранил, или, когда R6 и R7 вместе образуют гетероцикл, он предпочтительно представляет собой возможно монозамещенный или гем-замещенный, в положении 2 оксазолидиновый цикл.
Замену защитных групп R7 и/или R6 и R7 атомами водорода и, возможно, радикала Ra гидроксильным радикалом, в зависимости от их природы, можно осуществлять следующим образом:
1) когда R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу, Ra означает алкоксил, ацилокси- или алкоксиацетокси-радикал, замену защитных групп атомами водорода осуществляют с помощью неорганической кислоты (соляная кислота, серная кислота, фтороводородная кислота) или органической кислоты (уксусная кислота, метансульфокислота, трифторметансульфокислота), п-толуолсульфокислота), которые используют индивидуально или в виде смеси, работая в органическом растворителе, выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, галогенированных алифатических углеводородов, ароматических углеводородов или нитрилов, при температуре от -10oC до 60oC;
2) когда R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу, Ra означает 2,2,2-трихлор-этоксикарбонилокси-радикал, замену защитной группы R7 осуществляют в условиях, описанных выше в п. 1), а замену Ra осуществляют путем обработки цинком, возможно в сочетании с медью, в присутствии уксусной кислоты при температуре от 30 до 60oC или с помощью неорганической или органической кислоты, такой как соляная кислота или уксусная кислота, в виде раствора в алифатическом спирте, содержащем 1-3 атома углерода (метанол, этанол, пропаном, изопропанол), или в сложном алифатическом эфире (этилацетат, изопропилацетат, н-бутилацетат), в присутствии цинка, возможно в сочетании с медью;
3) когда R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл и более предпочтительно оксазолидиновый цикл общей формулы (VI)
в которой R1 имеет вышеуказанное значение, R8 и R9, одинаковые или разные, означают атом водорода или алкильный радикал с 1-4 атомами углерода или аралкильный радикал, алкильная часть которого содержит 1-4 атома углерода, а арильная часть предпочтительно означает фенильный радикал, возможно замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, или арильный радикал, предпочтительно означающий фенильный радикал, возможно замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода; или R8 означает алкоксильный радикал с 1-4 атомами углерода или тригалогенметильный радикал, такой как трихлорметил, или фенильный радикал, замещенный тригалогенметильным радикалом, таким как трихлорметил; и R9 означает атом водорода; или R8 и R9 вместе с атомом углерода, с которым они связаны, образуют четырех - семичленный цикл; и Ra означает ацилокси- или алкоксиацетокси- или 2,2,2-трихлор-этоксикарбонилокси-радикал, замену защитной группы, образуемой радикалами R6 и R7, на атомы водорода и радикала Rа на гидроксильный радикал можно осуществлять в зависимости от значений Ra, R1, R8 и R9, следующим образом:
а) когда R1 означает трет.-бутоксикарбонильный радикал, R8 и R9, одинаковые или разные, означают алкильный радикал или аралкильный радикал (бензил) или арильный радикал (фенил), или R8 означает тригалогенметильный радикал или замещенный тригалогенметильным радикалом фенильный радикал, и R9 означает атом водорода, или R8 и R9 вместе образуют 4-7-членный цикл, то обработка сложного эфира общей формулы (V) неорганической или органической кислотой, возможно в органическом растворителе, таком как спирт, приводит к продукту общей формулы (VII)
в которой Ra, Rb, R3, R4 и R5 имеют вышеуказанное значение, который ацилируют с помощью бензоилхлорида, в котором фенильное ядро возможно замещено, теноилхлорида, фуроилхлорида или продукта общей формулы (VIII)
R2-O-CO-X (VIII),
в которой R2 имеет вышеуказанное значение, а X означает атом галогена (фтор, хлор) или остаток -O-R2 или -O-CO-O-R2, для получения продукта общей формулы (IX)
в которой Ra, Rb, R1, R3, R4 и R5 имеют вышеуказанное значение, и если радикал Ra означает защищенный гидроксильный радикал, то, при необходимости освобождают гидроксильный радикал.
Предпочтительно, продукт общей формулы (V) обрабатывают муравьиной кислотой при температуре около 20oC.
Предпочтительно, ацилирование продукта общей формулы (IX) с помощью бензоилхлорида, в котором фенильный радикал может быть замещен, теноилхлорида или фуроилхлорида или продукта общей формулы (VIII) осуществляют в инертном органическом растворителе, выбираемом среди сложных эфиров, таких как этилацетат, изопропилацетат или н-бутилацетат, и алифатических галогенированных углеводородов, таких как дихлорметан или 1,2-дихлорэтан, в присутствии неорганического основания, такого как гидрокарбонат натрия, или органического основания, такого как триэтиламин. Реакцию проводят при температуре от 0 до 50oC, предпочтительно около 20oC.
Предпочтительно, замену защитной группы радикала Ra, когда он означает 2,2,2-трихлор-этоксикарбонилокси-радикал, осуществляют в описанных выше в п. 2) условиях;
б) когда R1 означает возможно замещенный бензоильный радикал, теноильный радикал или фуроильный радикал или радикал R2O-CO-, в котором R2 имеет вышеуказанное значение, R8 означает атом водорода или алкоксильный радикал с 1-4 атомами углерода или фенильный радикал, замещенный одним или несколькими алкоксильными радикалами с 1-4 атомами углерода, и R9 означает атом водорода, то замену защитной группы, образуемой R6 и R7, атомами водорода осуществляют в присутствии неорганической кислоты (соляная кислота, серная кислота) или органической кислоты (уксусная кислота, метансульфокислота, трифторметансульфокислота, п-толуолсульфокислота), которые используют индивидуально или в виде смеси, в стехиометрическом или каталитическом количестве, работая в органическом растворителе, выбираемом среди спиртов, простых и сложных эфиров, алифатических углеводородов, галогенированных алифатических углеводородов и ароматических углеводородов, при температуре от -10oC до 60oC, предпочтительно от 15 до 30oC, и замену защитной группы радикала Ra, когда он означает 2,2,2-трихлор-этоксикарбонилокси-радикал, атомом водорода, осуществляют в условиях, описанных выше в п. 2);
4) когда Ra означает алкоксиацетокси-радикал и R6 и R7 имеют указанное в п. 1) значение, сначала осуществляют замену защитной группы R7 атомом водорода, работая в описанных выше в п. 1) кислых условиях, затем возможно заменяют Ra гидроксильным радикалом путем обработки в щелочной среде или путем воздействия галогенида цинка в условиях, при которых не затрагивается остальная часть молекулы. Обычно щелочную обработку проводят путем воздействия аммиака в водно-спиртовой среде или гидразингидрата в спиртовой среде при температуре около 20oC. Обычно обработку галогенидом цинка, предпочтительно иодидом цинка, проводят в метаноле при температуре около 20oC;
5) когда Ra означает алкоксиацетокси-радикал и R6 и R7 имеют указанное выше в п. 3-а) значение, замену радикала Ra гидроксильным радикалом осуществляют путем обработки в щелочной среде или путем обработки галогенидом цинка в условиях, описанных выше в п. 4), затем полученный продукт общей формулы (V) обрабатывают в условиях удаления защитных групп и ацилирования, описанных выше в п. 3-а).
6) когда Ra означает алкоксиацетокси-радикал и R6 и R7 имеют указанное выше в п. 3-б) значение, замену радикала Ra гидроксильным радикалом осуществляют путем обработки в щелочной среде или путем обработки галогенидом цинка в условиях, описанных выше в п. 4), затем полученный продукт обрабатывают в описанных выше в п. 3-б) условиях.
Продукт общей формулы (III), в которой Z1 означает радикал общей формулы (II) или радикал общей формулы (IV), может быть получен путем этерификации продукта общей формулы (X)
в которой R4, R5 имеют указанное выше значение и Ra означает атом водорода или алкоксильный, ацилокси-, алкоксиацетокси-радикал или защищенный гидроксильный радикал, и Rb означает атом водорода, с помощью кислоты общей формулы (XI)
в которой R1 и R3 имеют вышеуказанное значение, или R6 означает атом водорода и R7 означает защитную для гидроксильной функции группу, или R6 и R7 вместе образуют насыщенный пяти- или шестичленный гетероцикл; или с помощью производного этой кислоты для получения сложного эфира общей формулы (XII)
в которой Ra, Rb, R1, R3, R4, R5 R6 и R7 имеют вышеуказанное значение, с последующей, если необходимо, заменой защитных групп, обозначаемых R7 и/или R7 и R7, атомами водорода и возможно Ra, когда он означает ацилокси-, алкоксиацетокси-радикал или защищенный гидроксильный радикал, гидроксильным радикалом в условиях, описанных выше для замены защитных групп продукта общей формулы (V), в которой Z1 означает радикал общей формулы (IV).
Этерификацию с помощью кислоты общей формулы (XI) можно осуществлять в присутствии агента конденсации (карбодиимид, реакционноспособный карбонат) и активирующего агента (аминопиридины) в органическом растворителе (простые и сложные эфиры, кетоны, нитрилы, алифатические углеводороды, галогенированные алифатические углеводороды, ароматические углеводороды) и при температуре от -10oC до 90oC.
Этерификацию также можно осуществлять при использовании кислоты общей формулы (XI) в виде ангидрида, работая в присутствии активирующего агента (аминопиридины), в органическом растворителе (простые и сложные эфиры, кетоны, нитрилы, алифатические углеводороды, галогенированные алифатические углеводороды, ароматические углеводороды) и при температуре от 0 до 90oC.
Этерификацию также можно осуществлять при использовании кислоты общей формулы (XI) в виде галоидангидрида или в форме ангидрида с алифатической или ароматической кислотой, возможно полученного in situ, в присутствии основания (алифатический третичный амин), работая в органическом растворителе (простые и сложные эфиры, кетоны, нитрилы, алифатические углеводороды, галогенированные алифатические углеводороды, ароматические углеводороды) и при температуре от 0 до 80oC.
Согласно изобретению, продукты общей формулы (III), в которой R4 и R5 имеют вышеуказанное значение, Ra означает атом водорода или алкоксильный, ацилокси- или алкоксиацетокси-радикал, и Rb означает атом водорода, a Z1 означает атом водорода, могут быть получены путем воздействия производного трифторметансульфокислоты, такого как ангидрид или N-фенил-трифторметансульфонимид, на продукт общей формулы (XIII)
в которой Ra, Rb, R4 и R5 имеют вышеуказанное значение.
Обычно реакцию проводят в инертном органическом растворителе (возможно галогенированные алифатические углеводороды, ароматические углеводороды), в присутствии органического основания, такого как третичный алифатический амин (триэтиламин) или пиридин, при температуре от -50oC до 20oC.
Продукты общей формулы (XIII), в которой R4 и R5 имеют вышеуказанное значение, Ra означает атом водорода или алкоксильный, ацилокси- или алкоксиацетокси-радикал или защищенный гидроксильный радикал, Rb означает атом водорода, могут быть получены путем воздействия фтороводородной (плавиковой) кислоты или трифторуксусной кислоты в основном органическом растворителе, таком как пиридин, возможно замещенный одним или несколькими алкильными радикалами с 1-4 атомами углерода, или триэтиламин, возможно в сочетании с инертным органическим растворителем, таким как дихлорметан или ацетонитрил или тетрагидрофуран, при температуре от 20 до 80oC, на продукт общей формулы (XIV)
в которой R4 и R5 имеют вышеуказанное значение, Ra означает атом водорода или алкоксильный, ацилокси- или алкоксиацетокси-радикал или защищенный гидроксильный радикал, Rb означает атом водорода, и символы G1, которые являются одинаковыми, означают триалкилсилил.
Продукт общей формулы (XIV), в которой Ra означает алкоксильный, ацилокси- или алкоксиацетокси-радикал или защищенный гидроксильный радикал, и Rb означает атом водорода, может быть получен путем воздействия продукта общей формулы (XV)
R-Y, (XV)
в которой R означает алкильный, алканоильный или алкоксиацетильный радикал или защитную для гидроксильной функции группу и Y означает атом галогена, на продукт общей формулы (XVI)
в которой R4, R5 и G1 имеют вышеуказанное значение.
Когда R означает алканоильный или алкоксиацетильный радикал, то особенно предпочтительно работать в основном органическом растворителе, таком как пиридин, или в инертном органическом растворителе, таком как дихлорметан, хлороформ или 1,2-дихлорэтан, в присутствии третичного амина, такого как триэтиламин или пиридин, при температуре около 0oC.
Когда R означает алкильный радикал, то особенно предпочтительно предварительно металлировать вторичную гидроксильную функцию с помощью гидрида щелочного металла (гидрид натрия) или металлалкильного соединения (бутиллитий).
Продукт общей формулы (XVI) и, возможно, продукт общей формулы (XIV) могут быть получены путем воздействия металлоорганического производного общей формулы (XVII)
R4 - M, (XVII)
в которой R4 имеет вышеуказанное значение и M означает атом металла, предпочтительно атом лития или магния, на продукт общей формулы (XVIII)
в которой Ra, Rb, R5 и G1 имеют вышеуказанное значение.
Обычно реакцию проводят в органическом растворителе, таком, как простой эфир (тетрагидрофуран), при температуре ниже -50oC, предпочтительно около -78oC. Продукт общей формулы (XVIII) может быть получен путем этерификации до сложного эфира продукта общей формулы (XIX)
в которой Ra, Rb и G1 имеют вышеуказанное значение, с помощью галогенида общей формулы (XX)
R5 - Гал, (XX)
в которой R5 имеет вышеуказанное значение и Гал означает атом галогена.
Особенно предпочтительно металлировать третичную гидроксильную функцию продукта общей формулы (XIX) путем воздействия гидрида или амида щелочного металла, такого как гидрид натрия или диизопропиламид лития, до воздействия продукта общей формулы (XX).
Обычно реакцию проводят в полярном органическом растворителе, таком как диметилформамид, при температуре от 0 до 50oC.
Продукт общей формулы (XIX) может быть получен путем воздействия продукта общей формулы (XV) на продукт общей формулы (XXI)
в которой G1 имеет вышеуказанное значение, в условиях, описанных выше для воздействия продукта общей формулы (XV) на продукт общей формулы (XVI).
Продукт общей формулы (XXI) может быть получен путем воздействия фосгена или одного из его производных, такого как трифосген, на продукт общей формулы (XXII)
в которой G1 имеет вышеуказанное значение, работая в основном органическом растворителе, таком как пиридин, при температуре ниже -50oC, предпочтительно около -78oC.
Продукт общей формулы (XXII) может быть получен воздействием галогентриалкилсилана на продукт общей формулы (XXIII)
в которой G1 имеет вышеуказанное значение, работая в основном органическом растворителе.
Продукт общей формулы (XXIII) может быть получен в условиях, описанных D.G.I.Kingston и сотр., Journal of Nat.Prod., 56, 884 (1993).
Продукты общей формулы (XIV), в которой R4 означает фенильный радикал, R5 имеет вышеуказанное значение, Ra означает атом водорода или гидроксильный, алкоксильный, ацилокси- или алкоксиацетокси-радикал или защищенный гидроксильный радикал и Rb означает атом водорода, могут быть получены путем воздействия продукта общей формулы (XX) на продукт общей формулы (XXIV)
в которой Ra и Rb имеют вышеуказанное значение, a G1 также имеет вышеуказанное значение, в условиях, описанных выше для воздействия продукта общей формулы (XX) на
продукт общей формулы (XIX).
Продукты общей формулы (XXIV), в которой Ra означает защитную группу гидроксильной функции, идентичную G1, и Rb означает атом водорода, могут быть получены путем воздействия галогентриалкилсилана на продукт общей формулы (XXV)
в которой G1 имеет вышеуказанное значение.
Реакцию предпочтительно проводят в органическом растворителе, таком как диметилформамид, в присутствии имидазола.
Продукты общей формулы (XXIV), в которой Ra означает алкоксильный, ацилокси- или алкоксиацетокси-радикал, Rb означает атом водород и G1 имеет вышеуказанное значение, могут быть получены путем воздействия продукта общей формулы (XV) на продукт общей формулы (XXVI)
в которой G1 имеет вышеуказанное значение,
в условиях, описанных выше для воздействия продукта общей формулы (XV) на продукт общей формулы (XVI).
Продукты общей формулы (XXVI) могут быть получены путем воздействия галогентриалкилсилана на продукт общей формулы (XXV) в условиях, описанных выше для воздействия галогентриалкилсилана на продукт общей формулы (XXIII).
Продукты общей формулы (XXV) могут быть получены в условиях, описанных D.G.I.Kingston и сотр., Tetrahedron Letters, 35, 6839 (1992).
Продукты общей формулы (I) , в которой Ra и Rb, каждый, означают атом водорода, могут быть получены путем электролитического восстановления продукта общей формулы (I) , в которой Ra означает гидроксильный радикал или ацилокси- или алкоксиацетокси-радикал, или в условиях, описанных в международной заявке PCT 93/06093.
Продукты общей формулы (I), в которой Ra и Rb вместе с атомом углерода, с которым они связаны, образуют кетонную функцию, могут быть получены путем окисления продукта общей формулы (I), в которой Ra означает гидроксильный радикал и Rb означает атом водорода, с помощью, например, пиридинийхлорхромата, пиридинийдихромата, бихромата калия, бихромата аммония или диоксида марганца.
Новые продукты общей формулы (I) , полученные путем осуществления способов согласно изобретению, могут быть очищены известными методами, такими как кристаллизация или хроматография.
Продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают ценными биологическими свойствами.
Определение биологической активности ин витро проводят на тубулине, извлеченном из головного мозга свиньи, методом M.L.Shelanski и сотр., Proc. Natl. Acad. Sci., США, 70, 765-768 (1973). Изучение деполимеризации микротрубочек до тубулина осуществляют по методу G.Chauviere и сотр. C.R. Acad. Sci. , 293, серия II, 501-503 (1981). При этом исследовании продукты общей формулы (I), в которой Z означает радикал общей формулы (II), проявили себя по крайней мере такими же активными, как таксол и таксотер.
Ин виво, продукты общей формулы (I), в которой Z означает радикал общей формулы (II), в случае мыши, которой трансплантирована меланома В16, проявили активность в дозах, составляющих от 1 до 10 мг/кг интраперитонеально, так же как и в отношении других "жидких" или твердых опухолей.
Новые продукты обладают противоопухолевыми свойствами и в особенности активны в отношении опухолей, которые резистентны к, таксолу® или таксотеру®. Под такими опухолями понимают опухоли ободочной кишки, которые обладают повышенной экспрессией гена mdг I (ген устойчивости к многочисленным лекарственным средствам). Устойчивость к многочисленным лекарственным средствам представляет собой термин, обычно относящийся к устойчивости опухоли к различным продуктам разных структур и разных механизмов действия. Таксоиды вообще известны тем, что они очень хорошо распознаются экспериментальными опухолями, такими, как P388/DOX - линия клеток, селекционированная по ее резистентности к доксорубицину (DOX) и которая сверхэкспрессирует mdг I.
Следующие примеры иллюстрируют настоящее изобретение.
ПРИМЕР 1
Раствор 40 мг 2α-бензоилокси- 1β, 10β-дигидрокси- 5β, 20-эпокси- 4α-метокси- 7β, 8-метилен-19-нор-9-оксо-такс-11-ен-13α-ил-3-трет.бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата-(2R, 4S, 5R) в 450 мкл 0,1 н. раствора хлороводорода в этаноле перемешивают в течение трех часов при температуре около 0oC. Реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа) при 20oC. Полученный сырой продукт растворяют в 10 см3 дихлорметана и 10 см3 водного насыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют декантацией, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют при пониженном давлении (2,7 кПа) при 40oC. Получают 59 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 0,5 мм, элюируя смесью циклогексана с этилацетатом в соотношении 60:40 по объему. Таким образом получают 12 мг 2α-бензоилокси- 1β, 10β- дигидрокси- 5β, 20-эпокси-4α-метокси-7β, 8-метилен-19-нор-9-оксо-текс-11-ен-13α-ил---3-трет. -бутоксикарбонил-амино-2-гидрокси-3-фенил-пропионата-(2R, 3S) в виде меренги белого цвета, физические характеристики которого следующие: 1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д. (миллионные доли); константы связывания J в Гц): 1,20 (с, 6Н: CH3); 1,35 (с, 9Н: C(CH3)3); 1,35-1,60 (м, 1Н: H в положении 7); 1,73 (с, 1Н: ОН в положении 1); 1,81 и 2,27 (2 мультиплета, 1Н каждый: CH2 в положении 19); 1,90 (с, 3Н: CH3); 2,07 и 2,26 (2 мультиплета, 1Н каждый: CH2 в положении 6); 2,35 и 2,87 (2 мультиплета, 1Н каждый: CH2 в положении 14); 3,24 (м, 1Н: ОН в положении 2'); 3,46 (C, 3Н: OCH3); 3,70 (д, J = 7, 1Н: H в положении 3); 3,97 и 4,39 (2 д, J = 9, 1Н каждый: CH2 в положении 20); 4,24 (уширенный с, 1Н: ОН в положении 10); 4,62 (м, 1Н: H в положении 2'); 4,90 (уширенный д, J= 4, 1Н: H в положении 5); 4,98 (с, 1Н: H в положении 10); 5,36 (м, 1Н: H в положении 3'); 5,48 (д, J= 10,1H: CONH); 5,69 (д, J= 7, 1Н: H в положении 2); 6,24 (м, 1Н: H в положении 13); 7,25-7,50 (м, 5Н: ароматические протоны в положении 3'); 7,49 (т, J= 7,5, 2Н: OCOC6H5 H в мета-положении); 7,57 (т, J = 7,5, 1H: OCOC6H5 H в пара-положении); 8,12 (д, J = 7,5, 2H: OCOC6H5 H в орто-положении).
2α- Бензоилокси- 1β, 10β-дигидрокси- 5β, 20-эпокси-4α- метокси-7β, 8-метилен-19-нор-9-оксо-такс-11-ен- 13α- ил---3- трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5- карбоксилат-(2R, 4S,5R) может быть получен следующим образом:
К раствору 112 мг 2α-бензоилокси-1β, 10β-дигидрокси-5β, 20-эпокси- 4α-метокси-9-оксо-7β-трифторметансульфонилокси-такс-11-ен- 13α-ил---3-трет. -бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3- оксазолидин-5-карбоксилата-(2R, 4S, 5R) в 1 см3 ацетонитрила и 0,1 см3 тетрагидрофурана последовательно добавляют 100 мг молекулярного сита 4  в виде порошка и 100 мг азида натрия. Реакционную смесь перемешивают при температуре около 75oC в течение трех часов, затем при температуре около 20oC добавляют 50 см3 дихлорметана и 50 см3 водного насыщенного раствора хлорида натрия. Органическую фазу отделяют путем декантации, промывают 2 раза по 40 см3 насыщенного водного раствора хлорида натрия, после чего сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 77 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 2 мм, элюируя смесью дихлорметана с метанолом в соотношении 90: 10 по объему. Таким образом получают 45 мг 2α- бензоилокси- 1β, 10β- дигидрокси 5β, 20-эпокси- 4α- метокси- 7β, 8-метилен-19-нор-9-оксо-такс-11-ен- 13α- ил---3-трет. -бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3- оксазолидин-5-карбоксилата-(2R,4S,5R) в виде меренги белого цвета, физические характеристики которого следующие:
в виде порошка и 100 мг азида натрия. Реакционную смесь перемешивают при температуре около 75oC в течение трех часов, затем при температуре около 20oC добавляют 50 см3 дихлорметана и 50 см3 водного насыщенного раствора хлорида натрия. Органическую фазу отделяют путем декантации, промывают 2 раза по 40 см3 насыщенного водного раствора хлорида натрия, после чего сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 77 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 2 мм, элюируя смесью дихлорметана с метанолом в соотношении 90: 10 по объему. Таким образом получают 45 мг 2α- бензоилокси- 1β, 10β- дигидрокси 5β, 20-эпокси- 4α- метокси- 7β, 8-метилен-19-нор-9-оксо-такс-11-ен- 13α- ил---3-трет. -бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3- оксазолидин-5-карбоксилата-(2R,4S,5R) в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; при температуре 57oC (330oК);  в м.д.; константы связывания J в Гц): 1,10 (с, 9H: C(CH3)3); 1,20 (с, 3H: CH3); 1,22 (с, 3H: CH3); 1,29 (м, 1H: H в положении 7); 1,68 (с, 3H: CH3); 1,78 и 2,25-2,35 (2 мультиплета, 1H каждый: CH2 в положении 19); 1,99 и 2,24 (соответственно дублет и уширенный дублет, J = 17 и 4 и J= 17, 1H каждый: CH2 в положении 6); 2,25--2,35 и 2,56 (соответственно м. и дд, J = 15 и 7, 1H каждый: CH2 в положении 14); 3,06 (с, 3H: ОCH3); 3,67 (д, J = 7, 1H: H в положении 3); 3,80 (с, 3H: ArOCH3); 3,96 и 4,26 (2 д, J= 9, 1H каждый: CH2 в положении 20); 4,17 (уширенный сигнлет, 1H: OH в положении 10); 4,66 (д, J = 5, 1H: H в положении 2'); 4,78 (уш. д, J =4, 1H: H в положении 5); 4,92 уш. с, 1H: H в положении 10); 5,48 (м, 1H: H в положении 3'); 5,66 (д, J = 7, 1H: H в положении 2); 6,05 (м, 1H: H в положении 13); 6,38 (с, 1H: H в положении 5'); 6,91 (д, J = 8,5, 2H: ароматические протоны в орто-положении к ОCH3); 7,30-7,50 (м, 7H: ароматические протоны в положении 3' и OCOC6H5 H в мета-положении); 7,41 (д, J = 8,5, 2H: ароматические протоны в мета-положении к ОCH3); 7,58 (т, J = 7,5, 1H: OCOC6H5 H в пара-положении); 7,96 (д, J = 7,5, 2H: OCOC6H5 H в орто-положении).
в м.д.; константы связывания J в Гц): 1,10 (с, 9H: C(CH3)3); 1,20 (с, 3H: CH3); 1,22 (с, 3H: CH3); 1,29 (м, 1H: H в положении 7); 1,68 (с, 3H: CH3); 1,78 и 2,25-2,35 (2 мультиплета, 1H каждый: CH2 в положении 19); 1,99 и 2,24 (соответственно дублет и уширенный дублет, J = 17 и 4 и J= 17, 1H каждый: CH2 в положении 6); 2,25--2,35 и 2,56 (соответственно м. и дд, J = 15 и 7, 1H каждый: CH2 в положении 14); 3,06 (с, 3H: ОCH3); 3,67 (д, J = 7, 1H: H в положении 3); 3,80 (с, 3H: ArOCH3); 3,96 и 4,26 (2 д, J= 9, 1H каждый: CH2 в положении 20); 4,17 (уширенный сигнлет, 1H: OH в положении 10); 4,66 (д, J = 5, 1H: H в положении 2'); 4,78 (уш. д, J =4, 1H: H в положении 5); 4,92 уш. с, 1H: H в положении 10); 5,48 (м, 1H: H в положении 3'); 5,66 (д, J = 7, 1H: H в положении 2); 6,05 (м, 1H: H в положении 13); 6,38 (с, 1H: H в положении 5'); 6,91 (д, J = 8,5, 2H: ароматические протоны в орто-положении к ОCH3); 7,30-7,50 (м, 7H: ароматические протоны в положении 3' и OCOC6H5 H в мета-положении); 7,41 (д, J = 8,5, 2H: ароматические протоны в мета-положении к ОCH3); 7,58 (т, J = 7,5, 1H: OCOC6H5 H в пара-положении); 7,96 (д, J = 7,5, 2H: OCOC6H5 H в орто-положении).
2α-Бензоилокси- 1β, 10β- дигидрокси-5β,20-эпокси-4α-метокси-9-оксо- 7β-трифторметансульфонилокси-такс-11-ен-13α-ил--- 3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5- карбоксилат-(2R, 4S,5R) может быть получен следующим образом:
К раствору 100 мг 2α- бензоилокси- 5β,20-эпокси- 4α-метокси-9-оксо- 7β-трифторметансульфонилокси- 1β, 10β, 13α-тригидрокси-такс-11-ена в 4 см3 безводного этилацетата последовательно добавляют 70 мг (2R,4A,5R)-3-трет.-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой кислоты, 50 мг дициклогексилкарбодиимида и 6 мг 4-диметиламинопиридина при температуре около 20oC. Реакционную смесь перемешивают в течение 3,5 часов в атмосфере аргона и при температуре около 20oC. Добавляют 30 см3 этилацетата и 20 см3 водного насыщенного раствора хлорида аммония. Органическую фазу отделяют декантацией, промывают 2 раза по 20 см3 воды, затем сушат над сульфатом магния. После отфильтровывания и концентрирования фильтрата досуха при пониженном давлении (2,7 кПа) при 40oC получают 200 мг продукта, который очищают путем хроматографии на 15 г диоксида кремния (0,063-0,2 мм), помещенных в колонку диаметром 1 см, элюируя смесью цикло-гексана с этилацетатом в соотношении 80:20 по объему и собирая фракции по 8 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 112 мг 2α-бензоилокси-1β, 10β- -дигидрокси-5β,20-эпокси- 4α-метокси-9-оксо- 7β-трифторметансульфонилокси-такс-11-ен-13α-ил---3-трет. -бутоксикарбонил-2-(4-метокси-фенил)-4-фенил-1,3- оксазолидин-5-карбоксилата-(2R,4S,5R) в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; при температуре 60oC (333oC); δ в м.д.; константы связывания J в Гц): 1,10 (с, 9H: C(CH3)3); 1,13 (C., 3H: CH3); 1,18 (с, 3H: CH3); 1,77 (с, 3H: CH3); 1,87 (с, 3H: CH3); 2,33 и 2,76 (2 дд, J = 15 и 11 Гц и J = 17 и 7 Гц, 1H каждый: CH2 в положении 14); 2,36 и 2,68 (2 мультиплета, 1H каждый: CH2 в положении 6); 3,19 (с, 3H: OCH3); 3,44 (д, J= 6, 1H: H в положении 3); 3,83 (с, 3H; Ar OCH3); 3,95 (уш. с. 1H: OH в положении 10); 4,19 и 4,34 (2 д, J= 9, 1H каждый: CH2 в положении 20); 4,66 (д, J = 5,5, 1H: H в положении 2'); 4,85-4,95 (м, 2H: H в положении 7 и H в положении 5); 5,32 (уш.с, 1H: H в положении 10); 5,49 (д, J= 5,5, 1H: H в положении 3'); 5,60 (д, J= 6; 1H: H в положении 2); 5,95 (м, 1H: H в положении 13); 6,38 (с, 1H: H в положении 5'); 6,94 (д, J = 8,5, 2H: ароматические протоны в ортоположении к OCH3); 7,30-7,50 (м, 7H: ароматические протоны в положении 3' и OCOC6H5 H в мета-положении); 7,40 (д, J= 8,5, 2H: ароматические протоны в мета-положении к OCH3); 7,60 (т, J= 7,5, 1H: OCOC6H5, H в пара-положении); 7,97 (д, J = 7,5, 2H: OCOC6H5 H в орто-положении).
2α-Бензоилокси- 5β, 20-эпокси-4α-метокси-9-оксо-7β-трифторметансульфонилокси-1β, 10β, 13α-тригидрокси-таксен 11 может быть получен следующим образом:
К раствору 51,6 мг 2α- бензоилокси- 5β, 20-эпокси- 4α-метокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксена-11 в 0,5 см3 дихлорметана и 24 мкл пиридина добавляют 25 мкл ангидрида трифторметансульфокислоты при температуре около 0oC. Реакционную смесь перемешивают в течение 20 минут при температуре около 0oC, затем добавляют 15 см3 дихлорметана и 3 см3 воды. Органическую фазу отделяют декантацией, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида аммония, после чего сушат над сульфатом магния. После отфильтровывания и концентрирования фильтрата досуха при пониженном давлении (2,7 кПа) при 20oC получают 72 мг продукта, который очищают путем хроматографии на пластинке диоксида кремния толщиной 2 мм, элюируя смесью дихлорметана с метанолом в соотношении 90:10 по объему. Получают таким образом 8 мг 2α-бензоилокси- 5β, 20-эпокси- 4α-метокси- 1β, 10β, 13α-тригидрокси-9-оксо- 7β-трифторметансульфонилокси-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,06 (с, 3H: CH3); 1,10 (с, 3H: CH3); 1,86 (с, 3H: CH3); 2,13 (с, 3H: CH3); 2,41 и 2,74 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,47 и 2,59 (2 дд, J = 16 и 10 и J = 16 и 4, 1H каждый: CH2 в положении 14); 2,96 (уш. д, J = 10, 1H: OH в положении 13); 3,66 (с, 3H: OCH3); 3,79 (д, J = 6, 1H: H в положении 3); 3,95 (уш.с, 1H: OH в положении 10); 4,30 и 4,49 (2 д, J = 9, 1H каждый: CH2 в положении 20); 4,57 (м, 1H: H в положении 13); 4,98 (дд, J = 12 и 6, 1H: H в положении 7); 5,04 (дд, J = 10 и 3, 1H: H в положении 5); 5,42 (уш.с, 1H:
H в положении 10); 5,61 (д, J = 6, 1H: H в положении 2); 7,59 (т, J = 7,5, 2H: OCO6H5 H в мета-положении); 7,63 (т, J = 7,5, 1H: OCOC6H5H в пара-положении); 8,00 (д, J = 7,5, 2H: OCOC6H5H в орто-положении).
2α-Бензoилoкcи- 5β, 20-эпoкcи- 4α-метoкcи-9-oкco-1β, 7β, 10β, 13α-тетрагидрокси-таксен-11 может быть получен следующим образом:
К раствору 338 мг 2α-бензоилокси- 1β, 10β-дигидрокси- 7β, 13α-дитриэтилсилилокси- 5β, 20-эпокси- 4α-метокси-9-оксо-таксена-11 в 5 см3 дихлорметана при температуре около 20oC добавляют 7,5 см3 комплекса триэтиламина с фтороводородной кислотой. Реакционную смесь перемешивают в течение двух часов при температуре 20oC, затем добавляют 50 см3 дихлорметана и 50 см3 водного насыщенного раствора гидрокарбоната натрия. Органическую фазу отделяют декантацией, промывают 2 раза по 50 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. После отфильтровывания и концентрирования фильтрата досуха при пониженном давлении (2,7 кПа) при 40oC получают 420 мг продукта, который очищают путем хроматографии на 60 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью дихлорметана с метанолом в соотношении 95:5 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 184 мг 2α-бензоилокси- 5β, 20-эпокси- 4α-метокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,05 (с, 3H:CH3); 1,10 (с, 3H: CH3); 1,72 (с, 3H: CH3); 1,99 и 2,40-2,55 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,09 (с, 3H: CH3); 2,48 и 2,69 (2 дд, J = 16 и 10 и J= 16 и 4, 1H каждый: CH2 в положении 14); 3,15 (уш. д, J = 11, 1H: OH в положении 13); 3,65 (с, 3H: OCH3); 3,74 (д, J = 6, 1H: H в положении 3); 3,78 (дд, J=12 и 6, 1H: H в положении 7); 4,13 (уш. с, 1H: OH в положении 10); 4,31 и 4,45 (2 д, J = 9,5, 1H каждый: CH2 в положении 20); 4,54 (м, 1H: H в положении 13); 5,00 (дд, J = 10 и 3, 1H: H в положении 5); 5,27 (уш. с, 1H: H в положении 10); 5,61 (д, J = 6, 1H: H в положении 2); 7,48 (т, J=7,5, 2H: OCOC6H5 H в мета-положении); 7,62 (т, J = 7,5, 1H: OCOC6H5 H в пара-положении); 8,03 (д, J = 7,5, 2H: OCOC6H5; H в орто-положении).
2α-Бензоилокси-1β, 10β-дигидрокси-7β, 13α-дитриэтилсилилокси- 5β, 20-эпокси- 4α-метокси-9-оксо-таксен-11 может быть получен следующим образом:
К раствору 940 мг 7β, 13α-дитриэтилсилилокси- 5β-20-эпокси-4α- метокси-10β-метоксиацетокси-9-оксо-такс-11-ен-1β, 2α-кapбoнaтa в 45 см3 безводного тетрагидрофурана добавляют 2,22 см3 1 М раствора фениллития в тетрагидрофуране при температуре около -78oC. Реакционную смесь перемешивают в течение 2,5 часов при температуре около -78oC, затем добавляют 20 см3 водного насыщенного раствора хлорида аммония. При температуре около 20oC добавляют 50 см3 воды и 100 см3 этилацетата. Органическую фазу отделяют путем декантации, промывают 2 раза по 50 см3 водного насыщенного раствора хлорида натрия, после чего сушат над сульфатом магния. После отфильтровывания и концентрирования фильтрата при пониженном давлении (2,7 кПа) при 40oC получают 1,2 г продукта, который очищают путем хроматографии на 100 г диоксида кремния (0,063-0,2 мм), которые находятся в колонке диаметром 3 см, элюируя смесью этилацетата с циклогексаном в соотношении 15:85 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 734 мг 2α-бензoилoкcи-1β, 10β-дигидpoкcи-7β, 13α-дитриэтилсилилокси-5β, 20-эпокси-4α- метокси-9-оксо-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 0,55 (м, 6H: CH2 этила); 0,70 (к, J=7,5 6H: CH2 этила); 0,93 (т, J= 7,5, 9H: CH3 этила), 1,05 (т, J=7,5, 9H: CH3 этила); 1,09 (с, 3H: CH3); 1,14 (с, 3H: CH3); 1,55 (с, 1H, OH в положении 1); 1,71 (с, 3H: CH3); 2,02 и 2,33 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,07 (с, 3H: CH3); 2,12 и 2,74 (2 дд, J=15 и 9, Гц и J=15 и 7,5, 1H каждый: CH2 в положении 14); 3,43 (с, 3H: OCH3); 3,47 (д, J = 7, 1H: H в положении 3); 3,85 (дд, J =11 и 6, 1H: H в положении 7); 4,17 и 4,29 (2д, J=8,5, 1H каждый: CH2 в положении 20); 4,27 (д, J=2, 1H: OH в положении 10); 4,95 (м, 1H: H в положении 13); 5,00 (дд, J = 10 и 3, 1H: H в положении 5); 5,14 (д., J =2, 1H: H в положении 10); 5,59 (д, J = 7, 1H: H в положении 2); 7,45 (т, J = 7,5, 2H: OCOC6H5H в мета-положении); 7,57 (т, J = 7,5, 1H: OCOC6H5H в пара-положении); 8,07 (д, J =7,5, 2H: OCOC6H5H в орто-положении).
7β, 13α-Дитриэтилсилилокси-5β,20-эпокси-4α-метокси-10β-метоксиацетокси-9-оксо-такс-11-ен-1β, 2α-карбонат может быть получен следующим образом:
К раствору 510 мг 7β, 13α-дитриэтилсилилокси-5β, 20-эпокси-4α-гидрокси-10β-метоксиацетокси-9-оксо-такс-11-ен-1β, 2α-карбоната в 6 см3 диметилформамида добавляют 0,3 г молекулярного сита  , 12 см3 метилиодида и 90 мг гидрида натрия, при температуре около 20oC и в атмосфере аргона. Реакционную среду перемешивают при температуре около 20oC в течение трех часов. Добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 дихлорметана. Органическую фазу отделяют путем декантации, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. После отфильтровывания и концентрирования досуха фильтрата при пониженном давлении (2,7 кПа) при 40oC, получают 715 мг продукта, который очищают путем хроматографии на 50 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 25:75 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 494 мг 7β, 13α-дитриэтилсилилокси- 5β, 20-эпокси-4α- метокси- 10β- метоксиацетокси-9-окос-такс-11-ен-1β, 2α-карбоната в виде меренги белого цвета, физические характеристики которого следующие:
, 12 см3 метилиодида и 90 мг гидрида натрия, при температуре около 20oC и в атмосфере аргона. Реакционную среду перемешивают при температуре около 20oC в течение трех часов. Добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 дихлорметана. Органическую фазу отделяют путем декантации, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. После отфильтровывания и концентрирования досуха фильтрата при пониженном давлении (2,7 кПа) при 40oC, получают 715 мг продукта, который очищают путем хроматографии на 50 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 25:75 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 494 мг 7β, 13α-дитриэтилсилилокси- 5β, 20-эпокси-4α- метокси- 10β- метоксиацетокси-9-окос-такс-11-ен-1β, 2α-карбоната в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 0,60 (к, J = 7,5, 6H: CH2 этила); 0,68 (к, J= 7,5, 6H: CH2 этила); 0,92 (т, J = 7,5 Гц, 9H: CH3 этила); 1,03 (т, J = 7,5, 9H: CH3 этила); 1,19 (с, 3H: CH3); 1,23 (с, 3H: CH3); 1,44 (с, 1H: OH в положении 1); 1,1 (с, 3H: CH3); 1,99 и 2,4 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,15 (с, 3H, CH3); 2,32 и 2,93 (2 дд, J = 15 и 9 и J = 15 и 6,5, 1H каждый: CH2 в положении 14); 2,89 (д, J= 5, 1H: H в положении 3); 3,45 и 3,51 (2с, 3H каждый: OCH3); 4,10 (дд, J = 10,5 и 7, 1H: H в положении 7); 4,17 (AB ограниченный, J = 16, 2H: OCOCH2O); 4,41 (д, J = 5, 1H: H в положении 2); 4,43 и 4,79 (2 д, J = 10, 1H каждый: CH2 в положении 20); 4,93 (м, 1H: в положении 13); 5,10 (уш. д, J = 10, 1H: H в положении 5); 6,51 (с, 1H: H в положении 10)
ПРИМЕР 2 К раствору 18 мг 2α- бензоилокси- 1β, 10β- дигидрокси- 5β, 20-эпокси- 4α- этокси-9-оксо- 7β- трифторметансульфонат-такс-11-ен-13α-ил-- 3-трет. бутоксикарбониламино-2-гидрокси-3-фенил-пропионата-(2R,3S) в 233 мкл ацетонитрила и 23 мкл тетрагидрофурана последовательно добавляют 15 мг молекулярного сита  в порошке и 27 мг хлорида натрия. Реакционную смесь перемешивают в течение трех часов при температуре около 75oC, затем, при температуре 20oC, добавляют 15 см3 дихлорметана и 15 см3 водного насыщенного раствора хлорида натрия. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 22 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 0,25 мм, элюируя смесью дихлорметана с метанолом в соотношении 95:5 по объему. Таким образом получают 10 мг 2α- бензоилокси-1β, 10β-дигидрокси- 5β, 20-эпокси-4α-этокси-7β, 3-метилен-19-нор-9-оксо-такс-11-ен-13α-ил--3-трет. бутоксикарбониламино-2-гидрокси-3-фенил-пропионата-(2R, 3S) в виде меренги белого цвета, физические характеристики которого следующие:
в порошке и 27 мг хлорида натрия. Реакционную смесь перемешивают в течение трех часов при температуре около 75oC, затем, при температуре 20oC, добавляют 15 см3 дихлорметана и 15 см3 водного насыщенного раствора хлорида натрия. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 22 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 0,25 мм, элюируя смесью дихлорметана с метанолом в соотношении 95:5 по объему. Таким образом получают 10 мг 2α- бензоилокси-1β, 10β-дигидрокси- 5β, 20-эпокси-4α-этокси-7β, 3-метилен-19-нор-9-оксо-такс-11-ен-13α-ил--3-трет. бутоксикарбониламино-2-гидрокси-3-фенил-пропионата-(2R, 3S) в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,21 (с, 3H: CH3); 1,28 (с, 3H: CH3); 1,37 (с, 9H: C(CH3)3); 1,35 (м, 1H: H в положении 7); 1,47 (т, J=7, 3H: CH3 этила в положении 4); 1,72 (с, 1H: OH в положении 1); 1,84 и 2,32 (соответственно т. и дд, J = 6 и J = 10 и 6, 1H каждый: CH2 в положении 19); 1,89 (с, 3H: CH3); 2,03 и 2,22 (соответственно д. и уш. д, J = 16 и 4 и J = 16, 1H каждый: CH2 в положении 6); 2,20 и 2,90 (соответственно дд и уш. дд, J = 16 и 9, 1H каждый: CH2 в положении 14); 3,22 (массив, 1H: ОН в положении 2'); 3,47 и 3,68 (2 мультиплета, 1Н каждый: CH2 этила в положении 4); 3,65 (д, J= 7, 1Н: H в положении 3); 4,02 и 4,39 (2д, J= 9, 1Н каждый: CH2 в положении 20); 4,26 (уш.с, 1Н: ОН в положении 10); 4,61 (м, 1Н: H в положении
2'); 4,87 (м, 1Н: H в положении 5); 4,95 (уш. с, 1H: H в положении 10); 5,33 (уш. д, J = 10, 1H: H в положении 3'); 5,42 (д, J = 10, 1H: CONH); 5,67 (д, J = 7, 1H: H в положении 2); 6,28 (уш. т, J=9, 1H: H в положении 13); 7,30-7,45 (м, 5Н: ароматические протоны в положении 3'); 7,49 (т, J = 7,5, 2Н: OCOC6H5H в мета-положении); 7,60 (т, J = 7,5, 1H: OCOC6H5H в пара-положении); 8,11 (д, J = 7,5, 2Н: OCOC6H5H в орто-положении).
2α-Бензоилокси- 1β, 10β-дигидрокси- 5β-20-эпокси- 4α-этокси-9-оксо- 7β-трифторметансульфонилокси-такс-11-ен-13α-ил--3-трет-бутоксикарбониламино-2-гидрокси-3-фенил-пропионат-(2R,3S) может быть получен следующим образом:
Раствор 66 мг 2α- бензоилокси- 1β, 10β- дигидрокси- 5β, 20-эпокси- 4α- этокси-9-оксо- 7β- трифторметансульфонилокси-такс-11-ен-13α- ил---3-трет-бутоксикарбонил-2-(4- метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата-(2R, 4S,5R) в 1,5 мл 0,1 н. раствора хлороводорода в этаноле перемешивают в течение 19 часов при температуре около 0oC. Реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа) при 20oC. Получают 82 мг продукта, который очищают путем препаративной хроматографии на пластинке диоксида кремния толщиной 0,25 мм, элюируя смесью дихлорметана с метанолом в соотношении 95: 5 по объему. Таким образом получают 20 мг 2α- бензоилокси- 1β, 10β- дигидрокси- 5β, 20-эпокси- 4α- этокси-9-оксо- 7β- трифторметансульфонилокси-такс-11-ен- 13α- ил--3-трет-бутоксикарбониламино-2-гидрокси-3-фенил-пропионата-(2R, 3S) в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (600 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,13 (с, 3H: CH3); 1,25 (с, 3H: CH3); 1,40 (с, 9H: C(CH3)3) 1,47 (т, J = 7, 3H: CH3 этила в положении 4); 1,58 (с, 1H: OH в положении 1); 1,90 и 2,25 (соответственно м. и дд, J = 16 и 9, 1H каждый: CH2 в положении 14); 1,92 (с, 3H: CH3); 1,94 (с, 3H: CH3); 2,40 и 2,70 (2 мультиплета, 1H каждый: CH2 в положении 6); 3,18 (уш.с, 1H: OH в положении 2'); 3,43 (д, J = 6,5, 1H: H в положении 3); 3,75 и 3,82 (2 мультиплета, 1H каждый: CH2 этила в положении 4); 4,05 (уш.с, 1H: OH в положении 10); 4,28 и 4,46 (2 д, J = 9, 1H каждый: CH2 в положении 20); 4,63 (м, 1H: H в положении 2'); 4,92 (дд, J = 11 и 7, 1H: H в положении 7); 5,03 (дд, J = 10 и 2, 1H: H в положении 5); 5,32 (м, 1H: H в положении 3'); 5,33 (уш. с, 1H: H в положении 10); 5,45 (д, J = 10, 1H: CONH); 5,65 (д, J = 6,5, 1H: H в положении 2); 6,20 (уш. т, J = 9, 1H: H в положении 13); 7,30-7,55 (м, 5H: ароматические протоны в положении 3'); 7,49 (т, J = 7,5, 2H: OCOC6H5, в мета-положении); 7,61 (т, J = 1,5, 1H: OCOC6H5H в пара-положении); 8,02 (д, J= 7,5, 2H: OCOC6H5H в орто-положении).
2α-Бензоилокси-1β, 10β-дигидpoкcи-5β-20-эпoкcи-4α-этокси-9-оксо-7β-трифторметансульфонилокси-такс-11-ен-13α-ил--3-трет-бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5- карбоксилат-(2R, 4S,5R) может быть получен следующим образом:
К раствору 90 мг 2α-бензоилокси- 5β, 20-эпокси- 4α-этокси-9-оксо- 7β-трифторметансульфонилокси 1β, 10β, 13α-тригидрокси-таксена-11 в 4 см3 безводного этилацетата последовательно добавляют 60 мг (2R,4S, 5R)-3-трет-бутокси-карбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5- карбоновой кислоты, 42 мг дициклогексилкарбодиимида и 5 мг 4-диметиламинопиридина при температуре около 20oC. Реакционную смесь перемешивают в течение 6 часов в атмосфере аргона и при температуре около 20oC. Добавляют 30 см3 этилацетата и 20 см3 водного насыщенного раствора хлорида аммония. Органическую фазу декантируют, промывают 2 раза по 20 см3 воды, затем сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 140 мг продукта, который очищают путем хроматографии на 30 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью циклогексана с этилацетатом в соотношении 70: 30 по объему и собирая фракции по 8 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 110 мг 2α-бензоил-окси-1β, 10β-дигидрокси- 5β, 20-эпокси- 4α-этокси-9-оксо- 7β-трифторметансульфонилокси-такс-11-ен-13α- ил--3-трет. бутоксикарбонил-2-(4-метоксифенил)-4-фенил-1,3-оксазолидин-5-карбоксилата (2R, 4S,5R) в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,10 (с, 15Н: C(CH3)3 - CH3 и CH3 этила в положении 4); 1,19 (с, 3Н: CH3); 1,51 (с, 1H: OH в положении 1); 1,64 (с, 3H: CH3); 1,85 (с, 3H: CH3); 2,25-2,40 и 2,66 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,25-2,40 и 2,88 (соответственно м. и дд, J=16 и 8, 1H каждый: CH2 в положении 14); 3,35 (д, J = 6,5 1H: H в положении 3); 3,52 и 3,62 (2 мультиплета, 1H каждый: CH2 этила в положении 4); 3,84 (с, 3H: ArOCH3); 4,01 (д, J = 1, 1H: OH в положении 10); 4,20 и 4,34 (2 д, J=9, 1H каждый: CH2 в положении 20); 4,64 (д, J=4, 1H:H в положении 2'); 4,85 (дд, J= 11,5 и 6,65, 1H: H в положении 7); 4,92 (уш. д, J=10,5, 1H: H в положении 5); 5,26 (д, J= 1H: H в положении 10); 5,55 (уш. массив, 1H: H в положении 3'); 5,59 (д, J = 6,65, 1H: H в положении 2); 5,91 (м, 1H: H в положении 13); 6,40 (уш.массив, 1H: H в положении 5'); 6,94 (д, J= 8,5, 2H: H в орто-положении к OCH3); 7,30-7,50 (м, 9H: ароматические протоны в положении 3'; H в мета-положении к OCH3 и OCOC6H5H в мета-положении); 7,63 (т, J=7,5, 1H: OCOC6H5H в пара-положении); 7,95 (д, J=7,5, 2H: OCOC6H5H орто-положении).
2α-Бензоилокси-5β, 20-эпокси-4α-этокси-9-оксо-7β-трифторметансульфонилокси-1β, 10β, 13α-тригидрокси-таксен-11 может быть получен следующим образом:
К раствору 260 мг 2α-бензоилокси 5β, 20-эпокси-4α-этокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксена-11 в 10 см3 дихлорметана и 145 мкл пиридина добавляют 200 мкл ангидрида трифторметансульфокислоты при температуре около 0oC. Реакционную смесь перемешивают в течение 45 минут при температуре около 0oC, затем добавляют 15 см3 дихлорметана и 10 см3 воды. Органическую фазу декантируют, промывают 2 раза по 10 см3 водным насыщенным раствором гидрокарбоната натрия, после чего сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 20oC. Получают 308 мг продукта, который очищают путем хроматографии на 60 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 40:60 по объему собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 90 мг 2α-бензоилокси- 5β, 20-эпокси- 4α- этокси- 1β, 10β, 13α-тригидрокси-9-оксо- 7β-трифторметансульфонилокси-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (300 мГц; дейтерохлороформ; δ в м.д.; константы cвязывaния J в Гц): 1,07 (с, 3H: CH3); 1,12 (с, 3H: CH3); 1,47 (т, J=7, 3H: CH3 этила в положении 4); 1,87 (с, 3H: CH3); 2,05 (с, 1H: OH в положении 1); 2,15. (с, 3H: CH3); 2,38 и 2,75 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,49 и 2,65 (2 дд, соответственно, J = 16 и 9 и J = 16 и 3,5, 1H каждый: CH2 в положении 14); 2,89 (д, J = 10, 1H: OH в положении 13); 3,72 (д, J = 6,5, 1H: H в положении 3); 3,80 - 3,95 (м, 2H: CH2 этила в положении 4); 3,97 (д, J = 1, 1H: OH в положении 10); 4,30 и 4,48 (2 д, J = 9, 1H каждый: CH2 в положении 20); 4,57 (уш.т, J=10, 1H: H в положении 13); 4,95 - 5,15 (м, 2H: H в положении 5 и H в положении 7); 5,42 (д, J = 1, 1H: H в положении 10); 5,63 (д, J= 6,5, 1H: H в положении 2); 7,48 (т, J = 7,5, 2H: OCOC6H6 H в мета-положении); 7,63 (т, J = 7,5, 1H: OCOC6H5 H в пара-положении); 8,00 (д, J = 7,5, 2H: OCOC6H6 H в орто-положении).
2α- Бензоилокси- 5β, 20-эпокси- этокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксен-11 может быть получен следующим образом:
этокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксен-11 может быть получен следующим образом:
К раствору 524 мг 2α-бензоилокси- 5β, 20-эпокси- 4α-этокси- 1β- гидрокси-9-оксо-7β, 10β, 13α-трис(триэтилсилилокси)-таксена-11 в 8 см3 дихлорметана при температуре около 20oC добавляют 10 см3 комплекса триэтиламина с фторводородной кислотой. Реакционную смесь перемешивают в течение 7 часов при температуре около 20oC, затем добавляют 100 см3 дихлорметана и 200 см3 водного насыщенного раствора гидрокарбоната натрия. Органическую фазу декантируют, промывают 2 раза по 50 см3 водного насыщенного раствора хлорида натрия, после чего сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 260 мг 2α-бензоилокси-5β, 20-эпокси-4α-этокси-9-оксо-1β, 7β, 10β, 13α-тетрагидрокси-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 1,06 (с, 3H: CH3); 1,12 (с, 3H: CH3); 1,46 (т, J = 7, 3H: CH3 этила в положении 4); 1,72 (с, 3H: CH3); 1,99 и 2,50 (2 мультиплета, 1H, каждый: CH2 в положении 6); 2,04 (с, 1H: OH в положении 1); 2,10 (с, 3H: CH3); 2,45-2,55 (мультиплет, 1H: OH в положении 7); 2,50 и 2,65 (соответственно м. и дд, J= 16 и 3,5, 1H каждый: CH2 в положении 14); 3,06 (д, J=11, 1H: OH в положении 13): 3,70 (д, J=6,5, 1H: H в положении 3); 3,84 (м, 1H: H в положении 7); 3,89 и 3,96 (2 мультиплета, 1H каждый: CH2 этила в положении 4); 4,15 (уш. с, 1H: OH в положении 10); 4,31 и 4,44 (2 д, J = 9 Гц, 1H каждый: CH2 в положении 20); 4,54 (уш. т, J =10, 1H: H в положении 13); 4,93 (дд, J= 10 и 3,5, 1H: H в положении 5); 5,28 (с, 1H: H в положении 10); 5,63 (д, J= 6,5, 1H: H в положении 2); 7,48 (т, J = 7,5, 2H: OCOC6H5H в мета-положении); 7,61 (т, J= 7,5, 1H: OCOC6H5H в пара-положении); 8,02 (д, J= 7,5, 2H: OCOC6H5H в орто-положении).
2α-Бензоилокси- 5β, 20-эпокси-4α-этoкcи-1β-гидpoкcи-9-оксо- 7β, 10β, 13α- трис(триэтилсилилокси)-таксен-11 может быть получен согласно одному из следующих способов:
1) К раствору 253 мг 5β, 20-эпокси-4α-этокси-9-оксо- 7β, 10β, 13α-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбоната в 13 см3 безводного тетрагидрофурана добавляют 320 мкл 1 М раствора фениллития в тетрагидрофуране при температуре около -78oC. Реакционную смесь перемешивают в течение 1,5 часов при температуре около -78oC, затем добавляют 10 см3 водного насыщенного раствора хлорида аммония. При температуре около 20oC добавляют 10 см3 воды и 50 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 20 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают
и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 500 мг продукта, который очищают путем хроматографии на 50 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 3 см, элюируя смесью этилацетат с циклогексаном в соотношении 15:85 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 260 мг 2α-бензоилокси-5β, 20-эпoкcи- 4α-этoкcи-1β-гидpoкcи-9-oкco-7β, 10β, 13α-трис(триэтилсилилокси)-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 0,55-0,75 (м, 18H: CH2 этила); 0,90-1,10 (м, 27 H: CH3 этила); 1,15 (с, 3H: CH3); 1,22 (с, 3H: CH3); 1,38 (т, J = 7, 3H: CH3 этила в положении 4); 1,50 (с, 1H: OH в положении 1); 1,65 (с, 3H: CH3); 2,00 и 2,39 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,02 (с, 3H: CH3); 2,05 и 2,85 (2 дд, соответственно, J= 16 и 9 и J=16 и 8,5, 1H каждый: CH2 в положении 14); 3,43 (д, J=6,5, 1H: H в положении 3); 3,44 и 3,90 (2 мультиплета, 1H каждый: CH2 этила в положении 4); 3,91 (м, 1H: H в положении 7); 4,20 и 4,30 (2 д, J = 9, 1H каждый: CH2 в положении 20); 4,93 (дд, J = 10 и 3,5, 1H: H в положении 5); 4,97 (уш. т, J = 9, 1H: H в положении 13); 5,17 (с, 1H: H в положении 10); 5,60 (д, J= 6,5, 1H: H в положении 2); 7,45 (т, J = 7,5, 2H: OCOC6H5H в мета-положении); 7,57 (т, J= 7,5, 1H: OCOC6H5H в пара-положении); 8,06 (д, J=7,5, 2H: OCOC6H6 H в орто-положении).
5β, 20-Эпокси- 4α-этокси-9-оксо-7β, 10β, 13α-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбонат может быть получен следующим образом:
К раствору 353 мг 5β, 20-эпокси-4α-гидрокси-9-оксо- 7β, 10β, 13α-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбоната в 2,1 см3 диметилформамида добавляют 0,3 г молекулярного сита  , 4,2 см3 этилиодида и 68 мг 80%-ного гидрида натрия, при температуре около 20oC и в атмосфере аргона. Реакционную смесь перемешивают в течение 1 часа при температуре около 20oC. 3атем добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 дихлорметана. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 500 мг продукта, который очищают путем хроматографии на 25 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 10:90 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 253 мг 5β, 20-эпoкcи-4α-этoкcи-9-oкco-7β-10β, 13α-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбоната в виде меренги белого цвета, физические характеристики которого следующие:
, 4,2 см3 этилиодида и 68 мг 80%-ного гидрида натрия, при температуре около 20oC и в атмосфере аргона. Реакционную смесь перемешивают в течение 1 часа при температуре около 20oC. 3атем добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 дихлорметана. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 500 мг продукта, который очищают путем хроматографии на 25 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 10:90 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 253 мг 5β, 20-эпoкcи-4α-этoкcи-9-oкco-7β-10β, 13α-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбоната в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц): 0,55-0,75 (м, 18H: CH2 этила); 0,90-1,10 (м, 27 H: CH3 этила); 1,17 (с, 3H: CH3); 1,25 (с, 3H: CHp3); 1,25 (т, J = 7, 3H: CH3 этила в положении 4); 1,68 (с, 3H: CH3); 1,98 и 2,47 (2 мультиплета, 1H каждый: CH2 в положении 6); 1,98 (с, 3H: CH3); 2,26 и 3,07 (2 дд, соответственно, J = 16 и 9 и J= 16 и 7, 1H каждый: CH2 в положении 14); 2,87 (д, J=5 Гц, 1H: H в положении 3); 3,71 и 3,82 (2 мультиплета, 1H каждый: CH2 этила в положении 4); 4,05 (дд, J = 10 и 7, 1H: H в положении 7); 4,39 (д, J=5, 1H: H в положении 2); 4,45 и 4,77 (2д, J =9, 1H каждый: CH2 в положении 20); 4,97 (м, 1H: H в положении 13); 5,03 (уш, д, J =10, 1H: H в положении 5); 5,15 (с, 1H: H в положении 10).
5β, 20-Эпокси- 4α-гидрокси-9-оксо- 7β-10β-13β-трис(триэтилсилилокси)-такс-11-ен-11-ен-1β, 2α-карбонат может быть получен следующим образом:
К раствору 98 мг 7β, 13α-бис(триэтилсилилокси)- 1β, 2α-карбонат-4α-10β-дигидрокси-5β, 20-эпокси-9-оксо-таксена-11 в 1 см3 диметилформамида, при температуре около 20oC и в атмосфере аргона, добавляют 51 мг имидазола и 50 мкл триэтилсиланхлорида. Реакционную смесь перемешивают при температуре около 20oC в течение 72 часов. Добавляют 10 см3 воды и 20 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 190 мг продукта, который очищают путем препаративной хроматографии в тонком слое толщиной 2 мм, элюируя с помощью смеси циклогексана с этилацетатом в соотношении 75:25 по объему. Таким образом получают 58 мг 5β, 20-эпокси- 4α-гидрокси-9-оксо- 7β, 10β, 13β-трис(триэтилсилилокси)-такс-11-ен-1β, 2α-карбоната в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР (400 мГц; дейтерохлороформ; δ в м.д.; константы связывания J в Гц); 0,50-0,70 и 0,74 (2 мультиплета, соответственно 12H и 6H: CH2 этила); 0,90-1,10 (м, 27 H: CH3 этила); 1,14 (с, 3H, CH3); 1,19 (с, 3H: CH3); 1,63 (с, 3H: CH3); 1,98 и 2,50 (2 мультиплета, 1H каждый: CH2 в положении 6); 1,98 (с, 3H: CH3); 2,55 и 2,67 (2 дд, соответственно, J= 16 и 9 и J= 16 и 3,5, 1H каждый: CH2 в положении 14); 3,00 (с, 1H: OH в положении 4); 3,11 (д, J= 5, 1H: H в положении 3); 4,14 (дд, J = 10 и 7, 1H: H в положении 7); 4,33 (д, J= 5,1H: H в положении 2); 4,54 (AB ограниченный, J=9, 2H: CH2 в положении 20); 4,73 (уш. д, J= 9, 1H: H в положении 13); 4,77 (уш. д, J =10, 1H: H в положении 5); 5,23 (с, 1H: в положении 10).
7β, 13α-Бис(триэтилсилилокси)-1β, 2α-карбонат-4α-10β-дигидрокси-5β, 20-эпокси-9-оксо-таксен-11 может быть получен следующим образом:
К раствору 108 мг 7β, 13α-бис(триэтилсилилокси)-1β, 2α-карбонат-5β, 20-эпокси-4α-гидрокси-10β-метоксиацетокси-9-оксо-таксена-11 в 3,5 см3метанола при температуре около 20oC и в атмосфере аргона добавляют 0,3 г молекулярного сита  и 470 мг иодида цинка. Реакционную смесь перемешивают при температуре около 20oC в течение 72 часов. Добавляют 10 см3 воды и 20 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 90 мг продукта, который очищают путем препаративной хроматографии в тонком слое толщиной 2 мм, элюируя смесью циклогексана с этилацетатом в соотношении 75: 25 по объему. Таким образом получают 56 мг 7β, 13α- бис(триэтилсилилокси)- 1β, 2α- карбонат- 4α-10β- дигидрокси- 5β, 20-эпокси-9-оксо-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
и 470 мг иодида цинка. Реакционную смесь перемешивают при температуре около 20oC в течение 72 часов. Добавляют 10 см3 воды и 20 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 90 мг продукта, который очищают путем препаративной хроматографии в тонком слое толщиной 2 мм, элюируя смесью циклогексана с этилацетатом в соотношении 75: 25 по объему. Таким образом получают 56 мг 7β, 13α- бис(триэтилсилилокси)- 1β, 2α- карбонат- 4α-10β- дигидрокси- 5β, 20-эпокси-9-оксо-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (400 мГц; дейтерохлороформ; δ в м.д.: константы связывания J в Гц): 0,54 и 0,74 (2 мультиплета, 6H каждый: CH2 этила); 0,91 и 1,03 (2 т, J= 7,5 Гц, 9H каждый: CH3 этила); 1,12 (с, 3H: CH3); 1,20 (с, 3H: CH3); 1,72 (с, 3H: CH3; 1,98 и 2,46 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,04 (с, 3H: CH3); 2,55 и 2,67 (2 дд, соответственно J = 16 и 9 и J= 16 и 3,5, 1H каждый: CH2 в положении 14); 3,00 (с, 2H: OH в положении 4); 3,14 (д, 7 = 5, 1H: H в положении 3); 4,07 (дд, J = 10 и 7, 1H: H в положении 7); 4,19 (д, J = 2, 1H: OH в положении 10); 4,33 (д, J= 5, 1H: H в положении 2); 4,54 (AB ограниченный; J= 10, 2H: CH2 в положении 20); 4,76 (уш.д., J= 9, 1H: H в положении 13); 4,82 (уш. д, J = 10,1 H:H в положении 5); 5,18 (д, J = 2, 1H: H в положении 10).
2) К раствору 200 мг 2α- бензоилокси- 1β, 4α- дигидрокси- 5β- 20-эпокси-9-оксо- 7β, 10β, 13α- тpиc(триэтилсилилокси)-таксена-11 в 6 см3 диметилформамида при температуре около 20oC и в атмосфере аргона добавляют 0,3 г молекулярного сита  , 1 см3 этилиодида и 34 мг 50%-ного гидрида натрия. Реакционную смесь перемешивают при температуре около 20oC в течение 1 часа. Добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 320 мг продукта, который очищают путем хроматографии на 100 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 10:90 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 38 мг
, 1 см3 этилиодида и 34 мг 50%-ного гидрида натрия. Реакционную смесь перемешивают при температуре около 20oC в течение 1 часа. Добавляют 10 см3 водного насыщенного раствора хлорида аммония и 30 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 10 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 320 мг продукта, который очищают путем хроматографии на 100 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 1 см, элюируя смесью этилацетата с циклогексаном в соотношении 10:90 по объему и собирая фракции по 10 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 38 мг  бензоилокси- 4α-этокси- 5β, 20-эпокси-1β-гидрокси-9-оксо-7β, 10β, 13α-трис(триэтилсилилокси)-таксена-11 в виде меренги белого цвета, физические характеристики которого идентичны таковым вышеполученного продукта.
бензоилокси- 4α-этокси- 5β, 20-эпокси-1β-гидрокси-9-оксо-7β, 10β, 13α-трис(триэтилсилилокси)-таксена-11 в виде меренги белого цвета, физические характеристики которого идентичны таковым вышеполученного продукта.
2α-Бензоилокси-1β, 4α-дигидрокси-5β, 20-эпокси-9-оксо- 7β, 10β, 13α-трис(триэтилсилилокси)-таксен-11 может быть получен следующим образом:
К раствору 4,2 г 2α-бензоилокси-5β, 20-эпокси-9-оксо-1β, 4α, 10β, 13α-тетрагидрокси-7β-триэтилсилилокси-таксена-11, полученного согласно D.G. Kingston и др., Tetrahedron Letters, 35, 6839 (1994), в 50 см3 диметилформамида, при температуре около 20oC и в атмосфере аргона, добавляют 4,6 г имидазола и 2,35 г триэтилсиланхлорида. Реакционную смесь перемешивают при температуре около 20oC в течение 72 часов. Добавляют 30 см3 воды и 100 см3 этилацетата. Органическую фазу декантируют, промывают 2 раза по 30 см3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, отфильтровывают и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Получают 12 г продукта, который очищают путем хроматографии на 100 г диоксида кремния (0,063-0,2 мм), которые содержатся в колонке диаметром 3 см, элюируя смесью этилацетата с циклогексаном в соотношении 10:90 по объему и собирая фракции по 20 см3. Фракции, содержащие только целевой продукт, объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40oC. Таким образом получают 3,6 г 2α-бензоилокси-1β, 4α-дигидрокси-5β, 20-эпокси-9-оксо-7β, 10β, 13α-трис(триэтилсилилокси)-таксена-11 в виде меренги белого цвета, физические характеристики которого следующие:
1H-ЯМР-спектр (300 мГц; дейтерохлороформ; δ в м.д.: константы связывания J в Гц): 0,57 и 0,60-0,85 (2 мультиплета, соответственно, 6H и 12 H: CH2 этила); 0,90-1,10 (м, 3ОH: CH3 этила и CH3); 1,21 (с, 3H: CH3); 1,53 (с, 3H: CH3); 1,63 (с, 1H: OH в положении 1); 1,96 (с, 3H: CH3); 1,97 и 2,45 (2 мультиплета, 1H каждый: CH2 в положении 6); 2,32 и 2,60 (2 дд, соответственно, J = 16 и 9 и J = 16 и 2,5, 1H каждый: CH2 в положении 14); 3,61 (д, J=6, 1H: H в положении 3); 3,80 (уш.с, 1H: OH в положении 4); 4,05 (дд, J= 11,5 и 6, 1H: H в положении 7); 4,23 и 4, 27 (AB ограниченный, J = 9, 2H: CH2 в положении 20); 4,64 (уш. д, J= 9, 1H: H в положении 13); 4.71 (дд, J= 10 и 4, 1H: H в положении 5); 5,25 (с, 1H: H в положении 10); 5,54 (д, J= 6, 1H: H в положении 2); 7,42 (т, J= 7,5 2H: OCOC6H5H в мета-положении); 7,55 (т, J = 7,5, 1H: OCOC6H5H в пара-положении); 8,11 (д, J= 7,5, 2H: OCOC6H5H в орто-положении).
Новые продукты общей формулы (I) , в которой Z означает радикал общей формулы (II), проявляют значительную ингибирующую активность в отношении анормальной пролиферации клеток и обладают терапевтическими свойствами, позволяющими лечить заболевания с патологическими состояниями, ассоциированными с анормальной пролиферацией клеток. Патологические состояния включают анормальную пролиферацию злокачественных и незлокачественных клеток различных тканей и/или органов, которые охватывают, не ограничивая этим объема охраны изобретения, мышечные ткани, костные ткани или соединительные ткани, кожу, (головной) мозг, легкие, половые органы, лимфатические или почечные системы, клетки молочной железы или клетки крови, печень, пищевательный аппарат, поджелудочную железу и щитовидные или надпочечниковые железы. Эти патологические состояния также могут включать псориаз, твердые опухоли, раковые заболевания яичников, женской груди, головного мозга, простаты, ободочной кишки,желудка, почки или тестикулов, саркому Калоши, холангиокарциному, хориокарциному, нейробластому, опухоль Вильмса, болезнь Ходжкина, меланомы, множественные миеломы, хронические лимфоцитарные лейкемии, гранулоцитарные, острые или хронические лимфомы. Новые продукты согласно изобретению особенно пригодны для лечения рака женской половой железы. Продукты согласно изобретению могут быть использованы для предупреждения или замедления появления или повторного появления патологических состояний или для лечения этих патологических состояний.
Продукты согласно изобретению можно вводить больному в различных формах, приспособленных к выбранному пути введения, которым предпочтительно является парентеральный путь введения. Введение парентеральным путем включает внутривенное, интраперитональное, внутримышечное или подкожное введение. Наиболее предпочтительным является интраперитональное или внутривенное введение.
Настоящее изобретение относится также к фармацевтическим композициям, которые содержат по крайней мере один продукт общей формулы (I) в достаточном количестве, приспособленном для использования в терапии человека или животного. Композиции могут быть получены обычными способами, используя одну или несколько фармацевтически приемлемых добавок, один или несколько фармацевтически приемлемых носителей или эксципиентов. Пригодные носители включают разбавители, стерильные водные среды и различные нетоксичные растворители. Предпочтительно, композиции находятся в форме водных растворов или суспензий, растворов для инъекции, которые могут содержать эмульгаторы, красители, консерванты или стабилизаторы.
Выбор добавок или эксципиентов может определяться растворимостью и химическими свойствами продукта, конкретным путем введения и исходя из фармацевтической практики.
Для парентерального введения используют стерильные водные или неводные растворы или суспензии. Для приготовления неводных растворов или суспензий можно использовать природные растительные масла, такие как оливковое масло, кунжутное масло или парафиновое масло, или сложные органические эфиры, пригодные для инъекций, такие как этилолеат. Водные стерильные растворы могут представлять собой водный раствор фармацевтически приемлемой соли. Водные растворы пригодны для внутривенного введения, в которых устанавливают заданное pH или обеспечивается изотоничность, например с помощью достаточного количества хлорида натрия или глюкозы. Стерилизацию можно осуществлять путем нагревания или любым другим способом, который не затрагивает свойств композиции.
Само собой разумеется, что все продукты, входящие в композиции согласно изобретению, должны иметь высокую степень чистоты и быть нетоксичными в используемых количествах.
Композиции могут содержать по крайней мере 0,01% терапевтически активного продукта. Количество активного продукта в композиции является таким, чтобы можно было прописывать пригодную дозировку. Предпочтительно, композиции готовят так, чтобы единичная доза содержала около 0,01-1000 мг активного продукта для парентерального введения.
Терапевтическую обработку можно проводить одновременно с другими терапевтическими обработками, включающими применение антинеопластических лекарственных средств, моноклональных антител, иммунологической терапии или рентгенотерапии, или модификаторов биологических ответов. Модификаторы ответов включают, не ограничивая этим объема охраны изобретения, лимфокины и цитокины, такие как интерлейкины, интерфероны (α, β или δ) и фактор некроза опухоли. Другие химиотерапевтические агенты, пригодные для лечения нарушений, возникающих вследствие анормальной пролиферации клеток, включают, не ограничивая этим объема охраны изобретения, алкилирующие агенты, такие как горчичные газы, как мехлоретамин, циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, как бусульфан; нитрозомочевины, как кармустин, ломустин, семустин и стрептозоцин; триазены, как дакарбазин; антиметаболиты, как аналоги фолиевой кислоты, такие, как метотрексат; аналоги пиримидина, как фторурацил и цитарабин; аналоги пуринов, как меркаптопурин и тиогуанин; природные продукты, такие как алкалоиды vinca, как винбластин, винкристин и вендезин; эпиподофиллотоксины, как этопосид и тенипосид; антибиотики, как дактиломицин, даунорубицин, доксорубицин, блеомицин, пликамицин и митомицин; ферменты, как L-аспарагиноза; различные агенты, как координационные платиновые комплексы, такие как цисплатина; замещенные мочевины, такие как гидроксимочевина; производные метилгидразина, как прокарбазин; адренокортикоидные супрессоры, как митотан и аминоглютетимид; гормоны и антагонисты, как адренокортикостероиды, такие как преднизон; прогестины, как гидроксипрогестеронкапроат, метоксипрогестеронацетат и мегестролацетат; эстрогены, как диэтилстильбестрол и этинилэстрадиол; антиэстрогены, как тамоксифен; андрогены, как тестостеронпропионат и флюоксиместерон.
Дозы, используемые для осуществления способов согласно изобретению, являются такими, которые позволяют проводить профилактическую обработку или получать максимум терапевтического ответа. Дозы изменяют в зависимости от формы введения, выбранного конкретного продукта и присущих излечиваемому субъекту особенностей. Обычно дозы представляют собой такие количества, которые терапевтически эффективны для лечения нарушений, возникающих вследствие анормальной пролиферации клеток. Продукты согласно изобретению можно вводить настолько часто, насколько это необходимо для достижения желательного терапевтического эффекта. Некоторые пациенты могут быстро реагировать на относительно сильные или слабые дозы, затем они нуждаются в поддерживающих слабых дозах или вообще не нуждаются в лекарстве. Обычно слабые дозы используют в начале лечения и, если необходимо, вводят все более и более сильные дозы вплоть до достижения оптимального эффекта. Для других пациентов может оказаться необходимым введение поддерживающих доз 1-8 раз в день, предпочтительно 1-4 раза, в зависимости от физиологических особенностей рассматриваемого пациента. Также возможно, что для некоторых пациентов необходимо использовать только для введения в день.
В случае человека дозы обычно составляют 0,01-200 мг/кг. Интраперитонально дозы обычно составляют 0,1-100 мг/кг и предпочтительно 0,5-50 мг/кг и еще более предпочтительно 1-10 мг/кг. При введении внутривенно дозы обычно составляют 0,1-50 мг/кг и предпочтительно 0,1-5 мг/кг и еще более предпочтительно 1-2 мг/кг. Разумеется, что для выбора наиболее подходящей дозировки нужно учитывать путь введения, вес пациента, общее состояние его здоровья, его возраст и все факторы, которые могут влиять на эффективность лечения.
Следующий пример 3 иллюстрирует композицию согласно изобретению.
ПРИМЕР 3
40 мг полученного в примере 1 продукта растворяют в 1 см3 Эмульфора EL 620 и 1 см3 этанола, затем раствор разбавляют путем добавления 18 см3 физиологической сыворотки. Композицию вводят путем вливания в течение 1 часа в физиологическом растворе.
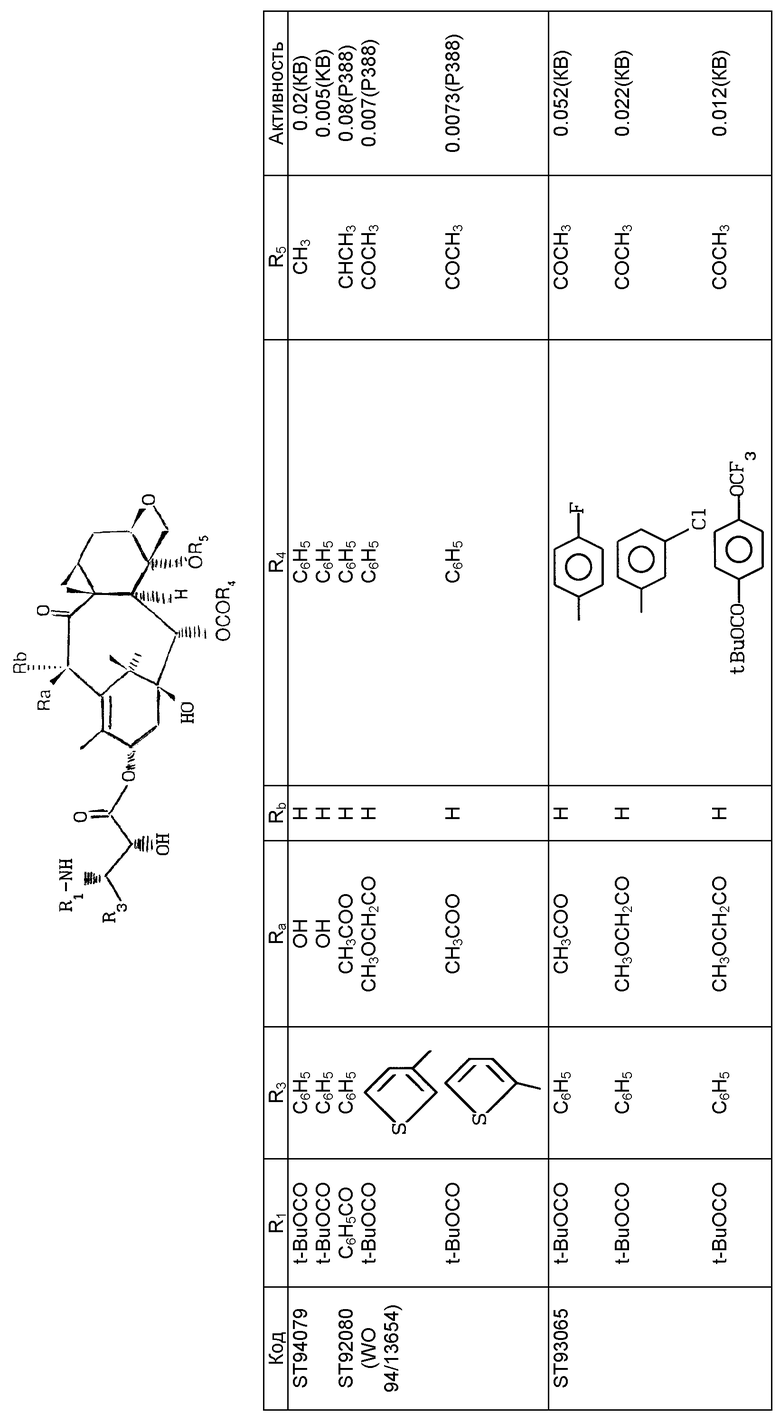

Описываются новые соединения общей формулы (I), где Ra означает атом водорода или гидроксильный радикал или алкоксиацетокси-радикал, содержащий в алкильной цепи 1-4 атома углерода; Rb означает атом водорода; Z означает атом водорода или радикал общей формулы (II), в которой R1 означает радикал бензоил или радикал R2-O-CO-, в котором R2 означает алкильный радикал с 1-8 атомами углерода; R3 означает фенил; R4 означает фенил; R5 означает линейный или разветвленный алкил, содержащий 1-8 атомов углерода. Новые продукты общей формулы (I), в которой Z означает радикал общей формулы (II), обладают противоопухолевыми и антилейкемическими свойствами. Описывается также способ их получения и фармацевтическая композиция на основе соединений формулы (I). 4 с. и 2 з.п. ф-лы, 1 табл.



где Ra означает атом водорода или гидроксильный радикал или алкоксиацетокси радикал, содержащий в алкильной цепи 1 - 4 атома углерода;
Rb означает атом водорода;
Z означает атом водорода или радикал общей формулы II
где R1 означает радикал бензоил или радикал R2-O-CO-, где R2 означает алкильный радикал с 1 - 8 атомами углерода;
R3 означает фенил;
R4 означает фенил;
R5 означает линейный или разветвленный алкил, содержащий 1 - 8 атомов углерода.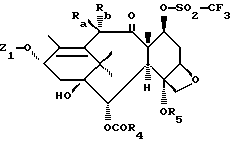
где Z1 означает атом водорода или радикал общей формулы II, в которой R1 и R3 имеют вышеуказанное значение, или Z1 радикал общей формулы IV
где R1 и R3 имеют вышеуказанное значение;
либо R6 означает атом водорода, а R7 означает защитную группу для гидроксильной функции, либо R6 и R7 образуют вместе насыщенный 5 или 6-членный гетероцикл;
R4 и R5 имеют вышеуказанное значение;
Ra означает атом водорода или алкоксиацетоксирадикал или защищенный гидроксильный радикал;
Rb означает атом водорода,
обрабатывают галогенидом или азидом щелочного металла или четвертичной аммониевой солью или фосфатом щелочного металла для получения продукта общей формулы V
где Z1, R4, R5, Ra и Rb имеют вышеуказанное значение, с последующей, если требуется, заменой защитной группы, которую содержит радикал Ra, или защитных групп, обозначаемых R7 и/или R6 и R7, атомами водорода.
| WO 9413654 A1, 23.06.1994 | |||
| US 5254580 A, 19.10.1993 | |||
| WO 9413655 A1, 23.06.1994 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСОЛА | 1990 |
|
RU2017724C1 |
Авторы
Даты
2000-07-27—Публикация
1995-10-23—Подача