Предметом настоящего изобретения является способ селекции генетически трансформированных клеток, в которые введена требуемая нуклеотидная последовательность, путем обеспечения трансформированных клеток селективным преимуществом. Селективное преимущество, которым обладают трансформированные клетки, может иметь место благодаря их усиленной по сравнению с нетрансформированными клетками способностью использовать вносимое соединение в качестве питательного вещества, фактора роста или источника энергии.
Известно, что в том случае, когда генетический материал должен быть введен в популяцию клеток путем трансформации, успешно трансформируется только определенное количество клеток. Идентификацию и отделение трансформированных клеток традиционно производят с применением "отрицательной селекции", при которой трансформированные клетки способны выживать и расти, в то время как нетрансформированные клетки подвергаются ростовому ингибированию или, возможно, даже убиваются веществом, к которому трансформированные клетки проявляют устойчивость в силу их трансформации.
Например, в случае трансформации популяции растительных клеток селекция трансформированных клеток обычно базируется на наличии в трансформированных клетках "селективного гена", который придает им устойчивость к антибиотику или гербициду. Селективный ген, который сам по себе может не выполнять никакой полезной функции в трансформированном растении (а может быть даже нежелательным для растения), спаривают или вводят совместно с требуемым геном, который необходимо ввести в растение, так что оба гена вводятся в популяцию клеток или, что правильнее, в определенные клетки популяции, поскольку трудно, если не невозможно, практически трансформировать все клетки. Затем клетки культивируют на/в среде, содержащей антибиотик или гербицид, к которому генетически трансформированные клетки обладают устойчивостью в силу наличия в них селективного гена, что позволяет идентифицировать трансформированные клетки, поскольку нетрансформированные клетки, которые не содержат гена устойчивости к антибиотику или гербициду, подвергаются ростовому ингибированию или погибают.
Подобные методы отрицательной селекции обладают рядом недостатков. Например, нетрансформированные клетки могут погибать из-за присутствия антибиотиков или гербицидов в ростовой среде. В результате в том случае, когда популяция клеток представляет собой организованную ткань, существует опасность, что могут погибнуть не только нетрансформированные клетки, но также и трансформированные клетки в силу того, что гибель нетрансформированных клеток может прервать поступление питательных веществ к трансформированным клеткам, либо в силу того, что угнетенные или погибающие нетрансформированные клетки могут выделять токсичные соединения.
Другим недостатком отрицательной селекции является то, что присутствие несущественного гена, например, гена, кодирующего устойчивость к антибиотику, является нежелательным. Среди исследовательских групп и государственных органов существуют определенные сомнения в том, насколько безопасно вводить гены антибиотикоустойчивости в растения и микроорганизмы. Это опасение особенно существенно в отношении пищевых растений и микрорганизмов, которые не предназначены для применения в замкнутых системах (например, микрорганизмы, предназначенные для применения в сельском хозяйстве), также как и в отношении микрорганизмов, которые предназначены для применения в замкнутых системах, но могут случайно проникнуть за их пределы.
Другим недостатком отрицательной селекции является то, что растительные ткани или клетки, обработанные токсичными веществами, становятся более чувствительными к бактериальной инфекции. Это представляет проблему при применении в качестве вектора для трансформации Agrobacterium, поскольку обработанные ткани или клетки иногда зарастают бактерией, даже при применении антибиотиков для предотвращения бактериального роста.
Кроме того, селекция клеток или тканей с применением отрицательной селекции требует строгого подбора времени экспрессии вводимых генов по отношению к селекционному процессу. Если трансгенные клетки обработают токсичным соединением перед тем как произойдет экспрессия гена детоксикации или перед тем как продуцируется достаточно генных продуктов для того, чтобы ослабить действие токсичного соединения, то как трансгенные, так и нетрансгенные клетки будут убиты. Если селекцию проводят слишком поздно, то селекции трансгенных клеток или тканей может помешать, например, формирование побега или каллуса из нетрансформированных клеток или тканей, который создаст барьер для проникновения соединения, применяемого для селекции трансформированных клеток.
Вышеуказанные недостатки устраняются по меньшей мере в значительной степени способом согласно настоящему изобретению (именуемому "положительная селекция" или комбинированная "положительная/отрицательная селекция"), который делает возможной идентификацию и изоляцию генетически трансформированных клеток без опасности гибели нетрансформированных клеток в популяции и без необходимости совместного введения генов устойчивости к антибиотикам или гербицидам. В дополнение к тому факту, что устраняется потребность в генах антибиотико- или гербицидоустойчивости, способ положительной селекции согласно настоящему изобретению часто является намного более эффективным, чем традиционная отрицательная селекция, а сочетание положительной и отрицательной селекции обеспечивает частоту селекции трансгенных побегов такую же, если не более высокую, чем частота, наблюдаемая при применении только одной отрицательной селекции. Кроме того, применение положительной селекции дает то преимущество, что один ген может быть использован в качестве как репортерного гена, так и селективного гена, что приводит к упрощению векторных конструкций, большей стабильности таких конструкций и 100%-ной корреляции между экспрессией репортерного и селективного генов.
Положительная селекция также может устранить вышеизложенные проблемы в отношении выбора времени, так как селективные соединения могут продуцироваться вследствие действия генных продуктов, образованных в результате экспрессии введенного гена, на специфические субстраты. Поэтому селективное соединение может накапливаться как следствие экспрессии селективного гена, а селективное действие появляется тогда, когда продуцируется достаточное количество селективного соединения.
Согласно настоящему изобретению предлагается способ идентификации или селекции из популяции эукариотических клеток, культивируемых на/в среде, содержащей по меньшей мере одно соединение клеток, обладающих метаболическим преимуществом, являющимся результатом их трансформации, при котором:
а) клетки трансформируют нуклеотидной последовательностью или вводимой совместно нуклеотидной последовательностью, одна из которых содержит область, которая: (а) кодирует белок, участвующий в метаболизме указанного соединения, и/или (б) регулирует активность гена, кодирующего указанный белок;
б) соединение является маннозой или ксилозой либо их производным или предшественником, либо субстратом для белка, либо оно может быть метаболизировано трансформированными клетками в такой субстрат, причем указанное соединение не является маннозой в случае, когда белок является маннозо-6-фосфат-изомеразой.
Изобретение включает также способ идентификации или селекции из популяции эукариотических клеток, культивируемых на/в среде, содержащей по меньшей мере одно соединение, клеток, которые обладают метаболитным преимуществом, являющимся результатом их трансформации, при котором:
a) клетки трансформируют нуклеотидной последовательностью или совместно вводимой нуклеотидной последовательностью, одна из которых содержит область, которая: (а) кодирует белок, участвующий в метаболизме указанного соединения, и/или (б) регулирует активность гена, кодирующего указанный белок;
б) в среду добавляют реагент, который понижает токсичность указанного соединения для клеток.
Предпочтительно, чтобы в том случае, когда реагент, понижающий токсичность, добавляют в культуральную среду, указанное соединение являлось бы маннозой, а нуклеотидная последовательность или совместно вводимая нуклеотидная последовательность кодировала бы маннозо-6-фосфат-изомеразу.
Клетки, которые обладают "метаболитным преимуществом", помимо прочего способны к более быстрому росту по сравнению с клетками, не обладающими таким преимуществом, и/или способны утилизировать субстраты (такие как предшественники питательных веществ и др.), которые клетки, не обладающие этим преимуществом, утилизировать неспособны, и/или способны детоксифицировать субстраты, которые являются токсичными или ингибирующими иным способом рост клеток, не обладающих указанным преимуществом.
Белок, который "участвует в метаболизме соединения", является, как правило, но не исключительно, ферментом, который может быть ответственным, прямо или косвенно, за продуцирование или утилизацию указанного соединения либо его производных или предшественников. Белок может также участвовать в метаболизме соединения, если он связывается с ним, переносит из одного сайта в другой в пределах клетки либо ткани или организма или в противном случае изолирует его, изменяя тем самым его локальную доступность.
Область нуклеотидной последовательности, "которая регулирует активность гена, кодирующего белок", может изменять уровень экспрессии эндогенного гена в силу того, что она является промотором либо обладает промоторной активностью и локализована вблизи него. Под понятием "вблизи" подразумевают участок длиной до 10000 т.п. о. С другой стороны, непрямая регуляция может являться результатом изменения связывания РНК-полимеразы с промотором структурного гена, кодирующего белок, или комплементарного связывания нуклеотидной последовательности с по меньшей мере частью структурного гена, понижая тем самым количество белка в клетке.
Под "производным" маннозы или ксилозы понимают любое соединение, способное утилизироваться, связываться, являться субстратом для или продуктом любого белка, участвующего прямо или косвенно в метаболизме маннозы или ксилозы. В случае маннозы к числу подобных производных относятся углеводы, такие как глюкоза или галактоза, которые могут подвергаться действию эпимераз с образованием маннозы либо ее производных или предшественников. Термин "производное" включает также остатки маннозы или ксилозы, имеющие одну или более гидроксильных групп, с которыми остатки связаны ковалентной или ионной связью. К числу подобных связанных остатков относятся сложноэфирные, эфирные группы, аминогруппы, амидогруппы, фосфатные группы, сульфатные группы, карбоксильные группы, карбоксиалкильные группы и их сочетания. Производные маннозы или ксилозы могут включать также предшественников маннозы или ксилозы при условии, что модифицирующие группы могут быть удалены с образованием маннозы или ксилозы.
Термин "клетка" в контексте изобретения включает протопласты, термин "популяция" включает ткань, орган или его часть, популяцию отдельных клеток в/на субстрате либо целый организм, например, растение.
Настоящее изобретение включает также трансформированные клетки, которые селектируют с применением способа по изобретению, и такие трансформированные клетки, которые являются растительными клетками, а также растения, потомство или семена, полученные из таких клеток. К числу растений, которые могут быть отселектированы согласно изобретению, относятся: фрукты, включая томаты, манго, персики, яблоки, груши, землянику, бананы и дыню; полевые культуры, такие как канола, подсолнечник, табак, сахарная свекла, зерновые с мелким зерном, такие как пшеница, ячмень и рис, кукуруза и хлопок, овощи, такие как картофель, морковь, салат, капуста и лук.
Наиболее предпочтительными растениями являются сахарная свекла и кукуруза.
Применение настоящего способа положительной селекции in vitro наиболее целесообразно, например, в применении к трансформации, проводимой на целых растениях или частях растений, при которой растения или их части содержат как трансформированные, так и нетрансформированные клетки, поскольку селекцию трансформированных клеток проводят без непосредственного повреждения соседних нетрансформированных клеток. Поэтому трансформированные клетки обладают селективным "преимуществом" по сравнению с нетрансформированными клетками (например, способность формировать побеги), но нетрансформированным клеткам не наносится при этом никакого ущерба в том смысле, что они могут быть повреждены или убиты, как в случае отрицательной селекции с применением антибиотиков или гербицидов.
"Селективное преимущество", которым обладают трансформированные клетки, может, как правило, являться отличием или преимуществом, позволяющим идентифицировать трансформированные клетки простым визуальным способом, то есть без применения специального анализа для определения присутствия маркерного гена.
Популяцию клеток можно культивировать в/на среде, содержащей по меньшей мере одно соединение, которое может быть неактивным и которое прямо или косвенно активируется в трансформированных клетках, это соединение является неактивным в нетрансформированных клетках или менее активным в нетрансформированных клетках по сравнению с трансформированными клетками таким образом, чтобы трансформированные клетки обладали селективным преимуществом, позволяющим проводить их селекцию из клеточной популяции.
Популяцию клеток можно также культивировать в/на среде, содержащей соединение, которое становится доступным для трансформированных клеток за счет экспрессии или транскрипции нуклеотидной последовательности, при этом такое соединение не является доступным для нетрансформированных клеток или является менее доступным для нетрансформированных клеток, посредством чего трансформированные клетки приобретают селективное преимущество.
В том случае, когда полипептид, кодируемый нуклеотидной последовательностью, прямо активирует неактивное соединение в трансформированных клетках, нетрансформированные клетки могут эндогенно содержать или продуцировать определенное количество указанного полипептида, который чаще всего может представлять собой фермент. В таких случаях нет необходимости в том, чтобы "неактивное соединение" было полностью неактивным в нетрансформированных клетках, так как может оказаться вполне достаточным, чтобы соединение или питательное вещество было лишь существенно менее активным в нетрансформированных клетках по сравнению с трансформированными клетками. Другими словами, качественное отличие трансформированных и нетрансформированных клеток в отношении активации изначально неактивного соединения может являться достаточным критерием для проведения селекции. В таких случаях к клеткам могут быть добавлены ингибиторы или субстраты, которые конкурируют с нативными ферментами. Особенно подходящими являются ингибиторы, активируемые нативными ферментами, приводящими к самокатализируемому продуцированию этого активного ингибитора в количестве, при котором указанный нативный фермент является по существу полностью ингибированным.
Клетки также могут быть трансформированы совместно вводимой нуклеотидной последовательностью, которая может кодировать пермеазу или другой транспортный фактор, который позволяет соединению проникать через клеточную мембрану и поступать в трансформированные клетки либо проникать через другую (органельную) мембрану, так что "активация" неактивного соединения включает селективное поглощение соединения трансформированными клетками, а поглощение нетрансформированными клетками невозможно либо происходит в меньшей степени. Вместо того, чтобы облегчать проникновение соединения в клетку, совместно вводимая нуклеотидная последовательность может, напротив, направлять свой продукт в область, в которой локализовано неактивное соединение, например за плазменную мембрану или в вакуоль либо эндоплазматический ретикулум.
В том случае, когда две нуклеотидные последовательности совместно вводят в клетки, они могут быть спарены друг с другом либо могут вводиться совместно таким образом, что присутствие одной нуклеотидной последовательности в клетке указывает на присутствие или на повышенную вероятность присутствия в клетке другой последовательности. Эти две нуклеотидные последовательности являются, таким образом, типичной, хотя и не необходимой частью одной и той же генетической конструкции и могут быть введены с помощью одного и того же вектора.
Поскольку необходимо, чтобы вводимые нуклеотидные последовательности экспрессировались в трансформированных клетках, генетическая конструкция, содержащая две нуклеотидные последовательности, обычно имеет регуляторные последовательности, способствующие экспрессии нуклеотидных последовательностей, например, известные промоторы и терминаторы транскрипции. Таким образом, совместно вводимая нуклеотидная последовательность обычно ассоциирована с промотором, который может быть констуитивным или регуляторным.
Описанные здесь способы могут быть также применены в случае, когда две нуклеотидные последовательности вводят независимо. Это может быть осуществлено, например, путем использования одной и той же бактерии для введения обоих генов и введения относительно большого количества копий требуемой нуклеотидной последовательности в клетку, в силу чего относительно высока вероятность того, что клетки, которые, как показано, экспрессируют совместно вводимую нуклеотидную последовательность, также будут содержать и экспрессировать требуемую нуклеотидную последовательность. Независимое введение двух или более генов, приводящее к совместной экспрессии генов в одной и той же клетке, имеет, как можно ожидать, низкую вероятность, а улучшенные частоты селекции, имеющие место при реализации способа положительной селекции, как следует поэтому ожидать, являются особым преимуществом в таких системах.
Соединение, применяемое для целей селекции, может, кроме того, оказывать как положительное, так и отрицательное действие. Например, манноза в достаточно высоких концентрациях токсична для большинства растений, но в клетках, содержащих ферменты, метаболизирующие маннозу, ее отрицательное влияние элимировано, и клетки дополнительно получают преимущество, заключающееся в способности использовать маннозу в качестве источника углеводов. В этом случае одно соединение и один ген совместно обеспечивают комбинированную систему положительной и отрицательной селекции, хотя такая система может быть создана и с применением двух или более генов, которые совместно отвечают за ингибирование отрицательного воздействия соединения и за проявление положительного воздействия соединения в трансформированных клетках.
В дальнейшей реализации способа экспрессия и транскрипция нуклеотидной последовательности приводит к блокировке метаболизма соединения, вносимого в популяцию клеток, или блокировке синтеза соединения в трансформированных клетках, в силу чего трансформированные клетки могут быть идентифицированы или отселектированы от нетрансформированных клеток.
В дальнейшей реализации способа трансформированные клетки могут быть отселектированы путем применения комбинации положительной селекции и отрицательной селекции, нуклеотидную последовательность в трансформированные клетки обычно вводят совместно с дополнительной нуклеотидной последовательностью, кодирующей устойчивость к по меньшей мере одному компоненту, выбранному из группы, состоящей из токсинов, антибиотиков и гербицидов, а среда в/на которой клетки культивируют, содержит по меньшей мере один компонент, выбранный из группы, состоящей из токсинов, антибиотиков и гербицидов, к которым трансформированные клетки оказываются устойчивыми. Предпочтительно, чтобы нуклеотидную последовательность вводили совместно с по меньшей мере двумя различными селективными генами.
Предпочтительно, чтобы соединение являлось маннозой или ксилозой. Как было показано выше, соединение, однако, может представлять собой производное маннозы, например, маннозо-6-фосфат, или производное ксилозы, такое как ксилозофосфат, либо предшественник маннозы или ксилозы.
Клетки могут быть трансформированы любой нуклеотидной последовательностью, предназначенной для введения в них. Такая нуклеотидная последовательность может кодировать гены, придающие вирусную, грибную, бактериальную устойчивость либо устойчивость к нематодам.
Клетки могут быть трансформированы бактерией, такой как бактерия рода Agrobacterium, чувствительной к указанному соединению, так что селекция трансформированных клеток с помощью указанного соединения приобретает преимущество, заключающееся в том, что уменьшается опасность послетрансформационного заражения трансформированных клеток бактерией. Следует отметить, что клетки могут быть трансформированы любым из приемлемых известных способов, включая электропорацию, микроинъецирование, применение микрозарядной пушки и трансформацию Ri- и Ti-плазмидами. Трансформированные клетки в соответствующих случаях могут быть регенерированы в целые растения, в которых рекомбинантная ДНК стабильно введена в геном.
Предпочтительно, чтобы белок представлял собой фермент, участвующий в метаболизме маннозы или ксилозы. К числу таких ферментов относятся ксилозоизомеразы, фосфоманнозоизомеразы, такие как маннозо-6-фосфат-изомераза; маннозо-1-фосфат-изомераза; фосфоманномутаза, маннозоэпимеразы, которые превращают углеводы в маннозу или маннозу в такие углеводы, как глюкоза и галактоза; фосфатазы, такие как маннозо-6-фосфатаза и маннозо-1-фосфатаза; и пермеазы, которые участвуют в транспорте маннозы, либо ее производного или предшественника, в клетку.
Реагентом, понижающим токсичность соединения для клеток, обычно является производное глюкозы, такое как метил-3-O-глюкоза или флоридзин.
Настоящее изобретение будет далее раскрыто на основании рассмотрения следующего текста совместно с прилагаемыми иллюстрациями, на которых:
На фиг. 1 представлена схема получения BcII/HindIII рестрикционного фрагмента, содержащего кодирующую область фосфоманнозоизомеразы E.coli;
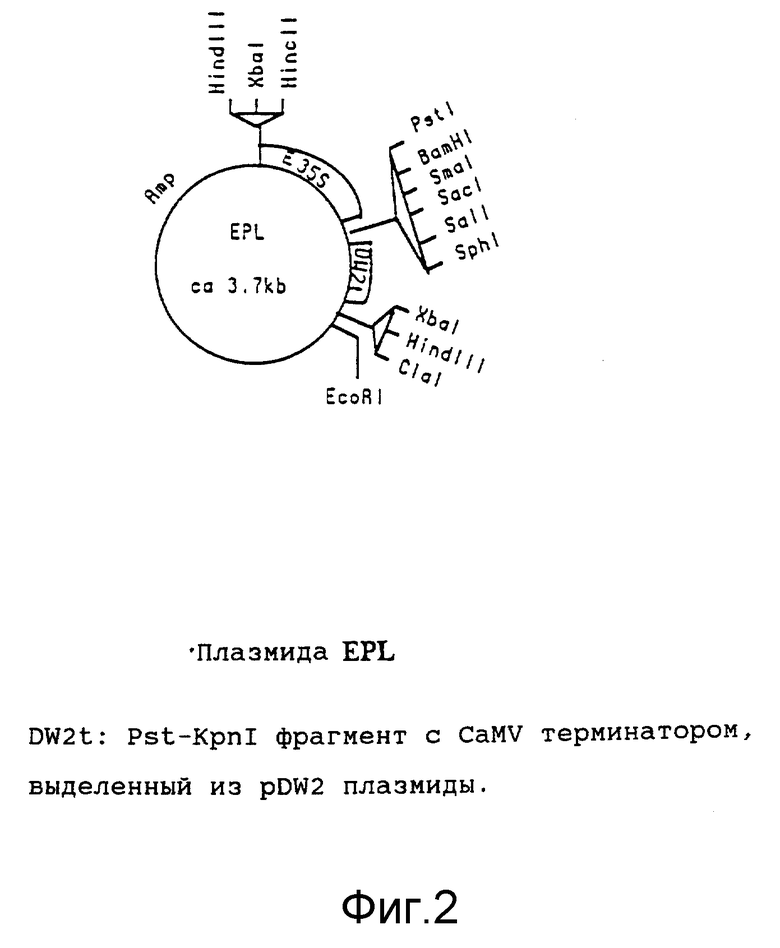
на фиг. 2 представлено строение плазмиды EPL [1];
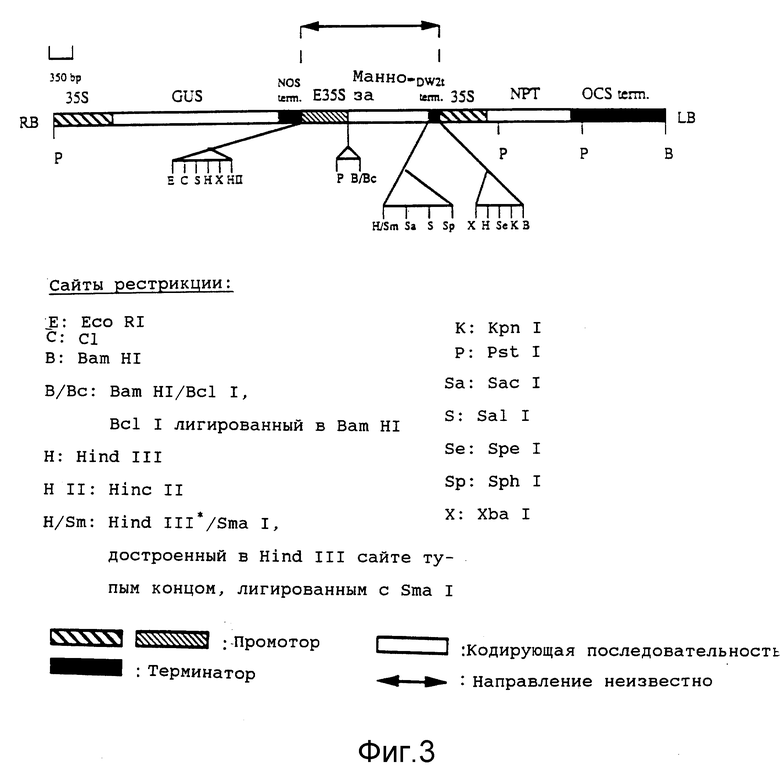
на фиг. 3 представлено строение бинарной плазмиды pBKL4 [2];
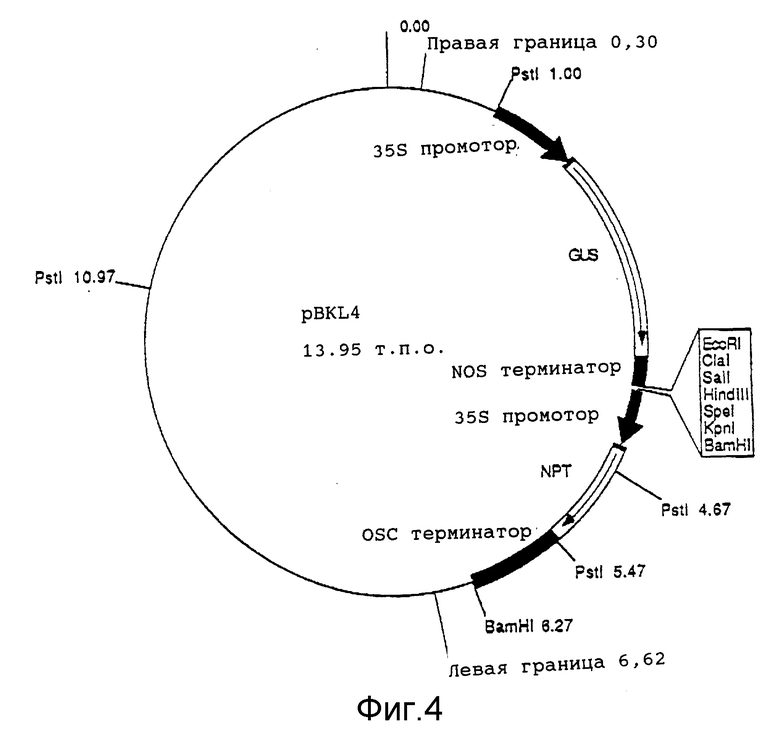
на фиг. 4 представлено строение плазмиды pBKL4, содержащей man A ген, встроенный между GUS геном и NPTII геном.
Конструирование бинарной плазмиды p(BKL4-манноза), содержащей кодирующие последовательности фосфоманнозоизомеразы E.coli
Ген фосфоманнозоизомеразы E. coli (EC 5.3.2.8) происходит из плазмиды pGS63 [3] (фиг. 1), конструкции, полученной из pBR322, в которой область между уникальными PstI и HindIII сайтами была замещена участком E.coli хромосомы, несущим структурный ген (man A) фосфоманнозоизомеразы и фрагмент соседнего гена фумаразы (fum A). Поэтому в pGS63 утеряна часть гена β-лактамазы и ее селекцию следует вести на тетрациклине.
В сайт множественного клонирования pUC18 был лигирован PstI/BamHI фрагмент (2466 т.п.н), содержащий полный PstI/HindIII хромосомный фрагмент и участок pBR322 длиной 357 т.п.н., что привело к образованию pDO18 (см. фиг. 1).
pDO18 расщепляют рестриктазой HindIII, а полученные недоступные 3' концы достраивают с помощью полимеразы Кленова. Линеаризованную DO18 плазмиду с заполненным HindIII сайтом (HindIII*) (см. фиг. 1) расщепляют рестриктазой BcII, а полученный BcII-HindIII* фрагмент длиной 1218 т.п.н., содержащий кодирующую область фосфоманнозоизомеразы, клонируют в плазмиду pEnhanced-Peter-Linker (усиленный линкер Peter) (pEPL), которую сначала подвергли рестрикции по SmaI, а затем - по BamHI. Полученную плазмиду именуют p(EPL-манноза).
pEPL конструируют из pCaMVCN [4, 5], в которой CAT ген удален путем рестрикции по PstI. Небольшой линкер (линкер: PstI-BamHI-BaII-PstI) встраивают в PstI сайт этой плазмиды, в результате чего получают плазмиду, именуемую pLise (pL). pL подвергают рестрикции по HincII и BgIII, а результирующий фрагмент, содержащий 35S промотор и NOS терминатор, клонируют в другую pL плазмиду, подвергнутую рестрикции по EcoRV и BgIII. Как EcoRV, так и HincII являются сайтами с тупыми концами. Полученную конструкцию именуют pEnhanced-Lise (pEL). pEL существенно отличается от CaMVCN тем, что она содержит вариант 35S промотора с тандемной дупликацией 250 пар оснований вышележащей последовательности промотора. Вариант 35S промотора обладает транскрипционной активностью приблизительно в десять раз более высокой, чем природный 35S промотор [6] . pEL подвергают рестрикции по PstI и BgIII, удаляя тем самым NOS терминатор, а вместо него встраивают CaMV терминатор (DW2t). И наконец, в PstI сайт, расположенный между усиленным 3e5S промотором и CaMV терминатором, встраивают линкер (PstI-BamHI-SmaI-SacI-SaII-Sphi). Эту плазмиду именуют pEPL (см. фиг. 2).
p(EPL-манноза) подвергают рестрикции по HindIII для выделения фрагмента, содержащего полный усиленный 35S промотор, кодирующую область фосфоманнозоизомеразы E.coli и CaMV терминатор. Выделенный фрагмент клонируют в HindIII сайт бинарного вектора pBKL4 (фиг. 4). Полученную плазмиду именуют p(BKL-манноза). HindIII сайт в pBKL4 расположен между геном устойчивости к канамицину и геном β-глюкуронидазы (GUS) (см. фиг.3). Химерный маннозный ген, ген устойчивости к канамицину (NPTII) и GUS ген имеют каждый собственный промотор и терминатор. На фиг. 4 представлена p(BKL-манноза) конструкция, содержащая химерный ген фосфоманнозоизомеразы, встроенный между GUS и NPTII генами плазмиды pBLK4.
Конструкцию p(BKL-манноза) выделяют из E.coli и трансформируют ею Agrobacterium tumefaciens штамм LBA4404, который содержит обезоруженную хелперную плазмиду pAL4404 [7,8], методом замораживания-оттаивания [9].
Последовательность структурного гена (man A), кодирующего фосфоманнозоизомеразу, была опубликована [3].
Аксеничные исходные культуры
Культуры побегов Solanum tuberosum 'Saturna', 'Bintje' или 'Dianella' поддерживают, как описано [10], на LS субстрате (см. ниже) с добавлением 2 uM тиосульфата серебра, при температуре 25oC и циклической смене освещенности: 16 ч свет/8 ч темнота. Исходные культуры пересевали через 20-40 суток. Листья отделяли от побегов и разрезали их на узловые сегменты (приблизит. 0,8 см), содержавшие по одному узлу.
Инокуляция тканей картофеля
Чашки для сокультивирования содержат LS субстрат (сахароза 30 г/л), агар (8 г/л), 2,4-дихлорфеноксиуксусная кислота (2,0 мг/л) и транс-зеатин (0,5 мг/л).
Побеги из примерно 40-суточных культур побегов (высота приблизит. 5-6 см) разрезают на межузловые сегменты (приблизит. 0,8 см). Сегменты помещают в жидкий LS-субстрат (LS-среда), содержащий Agrobacterium tumefaciens, трансформированную таким образом, что он содержит бинарный вектор, несущий гены, которые предназначены для введения в клетки картофеля. К числу таких генов относятся, например, гены, кодирующие β-глюкуронидазу (GUS), NPTII ген, кодирующий устойчивость к антибиотику канамицину и/или гены, кодирующие белки, участвующие в метаболизме маннозы, например, маннозо-6-фосфат-изомераза, маннозоэпимеразы, фосфоманномутазы и т.д. (см. ниже).
Agrobacterium культивируют в течение ночи в YMB-субстрате дикалий гидрофосфат (тригидрат) (0,66 г/л); сульфат магния (гептагидрат) (0,20 г/л); хлорид натрия (0,10 г/л); маннитол (10,0 г/л) и дрожжевой экстракт (0,40 г/л)), содержащем необходимые соответствующие антибиотики (соответствующие гену устойчивости штамма Agrobacterium), до тех пор, пока оптическая плотность при 660 нм (ОП-660) не достигнет значения приблизительно 0,8. Затем суспензию центрифугируют, а клетки ресуспендируют в LS-среде так, чтобы значение ОП составило 0,5.
Вышеуказанные межузловые сегменты затем инкубируют в суспензии ресуспендированной Agrobacterium в течение 30 минут, а затем избыток бактерии удаляют из сегментов путем промокания их стерильной фильтровальной бумагой.
Сокультивирование сегментов побегов и Agrobacterium
Сегменты побегов сокультивируют с бактерией в течение 72 часов на фильтровальной бумаге на LS-субстрате (как описано выше) в чашках Петри, покрытых белой бумажной тканью. Этот субстрат будет именоваться далее как "субстрат для сокультивирования". Субстрат и сегменты покрывают стерильной фильтровальной бумагой, а чашки Петри выдерживают при 25oC и циклической смене освещения: 16 ч свет/8 ч темнота.
Процедура промывки
Через 48 часов сокультивирования сегменты побегов переносят на LS-среду, содержащую 800 мг/л карбенициллина. Эти пересаженные сегменты затем аккуратно покачивают для того, чтобы смыть и разрушить прилипшие клетки Agrobacterium.
Селекция трансформированной ткани
Промытые таким образом сегменты переносят затем на LS-субстрат (как и ранее) с тем отличием, что концентрация транс-зеатина составляла 1 мг/л, а в субстрат добавляют гиббереллиновую кислоту (0,1 мг/л) и карбенициллин (800 мг/л), допустимо добавление также канамицин сульфата (50 мг/л) и/или маннозы (0-20 г/л) и/или сахарозы (0-20 г/л). Этот субстрат далее именуют как "субстрат для селекции/регенерации". Сегменты инокулируют на свежий субстрат с интервалами в две недели либо так, как описано ниже. Через 2-4 недели из сегментов развиваются побеги, при этом образование новых побегов продолжается около 3-4 месяцев.
Укоренение регенерировавших побегов
Регенерировавшие побеги переносят на субстрат для укоренения, представляющий собой LS-субстрат с добавлением карбенициллина (500 мг/л).
Перенос регенерировавших побегов в почву
Заново укорененные регенерировавшие побеги (растения) (высота приблизительно 2-3 см) пересаживают из субстрата для укоренения в почву и помещают в растильную камеру при 21oC с циклическим освещением: 16 часов свет/8 часов темнота и 200-400 uE/м2/сек. После того как растения достаточно хорошо приживутся, их переносят в теплицу, где их выращивают до тех пор, пока не разовьются клубни, а надземная часть не увянет.
Контроль генетической подлинности трансформантов
Трансгенные генотипы регенерировавшего побега контролируют:
(а) посредством проведения NPTII анализов, как описано [II];
(б) посредством проведения GUS анализа на ферменте, экспрессируемом совместно вводимым геном β-глюкуронидазы согласно [12];
(в) посредством анализа экспрессии мРНК введенного гена, кодирующего фермент, например, фосфоманнозоизомеразу, участвующего в метаболизме маннозы, либо посредством измерения активности фермента.
Пример 1
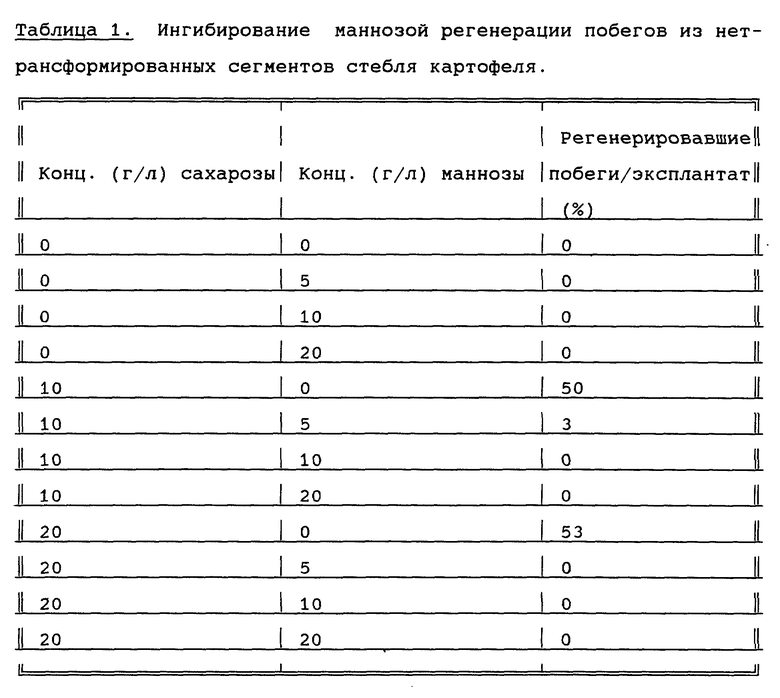
Регенерировавшие растения получают, как описано выше, с тем отличием, что сегменты побегов не сокультивируют с бактерией, а последующую процедуру промывки не проводят. Количество регенерировавших побегов определяют на 40-е сутки от начала эксперимента. В таблице 1 представлены результаты ингибирования маннозой регенерации побегов из сегментов ствола картофеля, которые не были трансформированы Agrobacterium. Из таблицы 1 видно, что манноза эффективно ингибирует регенерацию таких побегов, а сахароза стимулирует такую регенерацию. Вообще говоря, маннозу нельзя применять в качестве источника углеводов для большинства видов растений. При добавлении к растениям маннозы она метаболизируется и накапливается маннозо-6-фосфат. Маннозо-6-фосфат может быть превращен во фруктозо-6-фосфат с помощью маннозо-6-фосфат-изомеразы, причем количество превращенного вещества зависит от активности изомеразы. Такой фруктозо-6-фосфат может быть утилизирован растениями, но в целом высокие уровни маннозы (независимо от того, имеется или нет другой источник углеводов) токсичны для растений. Таким образом, как видно из таблицы 1, образование побегов полностью ингибируется, когда концентрация маннозы составляет 5-10 г/л, независимо от доступности сахарозы, даже если она присутствует в высоких концентрациях.
Пример 2
Регенерированные растения получают, как описано выше. Agrobacterium, с которой соинкубируют сегменты побегов, была трансформирована конструкцией p(BKL-манноза), полученной, как описано выше, таким образом, что бактерия несет вектор, содержащий гены, кодирующие GUS и маннозо-6-фосфат-изомеразу.
Трансгенные побеги (GUS+) селектируют на основании их способности метаболизировать маннозу в присутствии реагента (метил-3-O-глюкоза), который понижает токсичность маннозы для побегов. Побеги, являющиеся GUS+, селектируют на основании их способности расти в присутствии маннозы в концентрации около 5 г/л.
Проводили также контрольные эксперименты, в которых Agrobacterium, применявшаяся для трансформации сегментов побегов, несла вектор, сходный с p(BKL-манноза) с тем отличием, что у него отсутствует ген, кодирующий маннозо-6-фосфат-изомеразу. В случае, когда регенерировавшие трансформированные побеги росли в присутствии 5 г/л маннозы и 20 г/л сахарозы GUS+ трансформанты не были получены.
Пример 3
Проводят следующий эксперимент, в котором Agrobacterium, которую применяют для трансформации сегментов побегов, несет вектор, сходный с p(BKL-манноза) с тем отличием, что у него отсутствует ген, кодирующий маннозо-6-фосфат-изомеразу. Такой вектор содержит ген, кодирующий NPTII, который способен придавать трансформированным клеткам устойчивость к канамицину. Соответственно этому GUS+ трансформанты селектируют на основании их устойчивости к канамицину, присутствующему в концентрации 50 мг/л. В этой последней селекции GUS+ генотип имела меньшая по сравнению с примером 2 часть отобранных клеток.
Пример 4
Повторяют пример 3 с тем отличием, что Agrobacterium трансформируют плазмидой p(BKL-манноза), a GUS+ трансформанты отбирают на основании их способности расти на канамицине (50 мг/мл). В этом случае меньшая чем в примере 3 часть отобранных побегов является GUS+.
Пример 5
Выполняют стандартную методику листовых дисков для табака, как описано в примере 13 [13] , с тем отличием, что исключают инокуляцию Agrobacterium и стадию сокультивации. В качестве цитокинина применяют бензиладенин (1 мг/л), а содержание углеводов соответствует представленному ниже. Количество регенерировавших из каждого листового диска побегов регистрируют спустя 21 сутки.
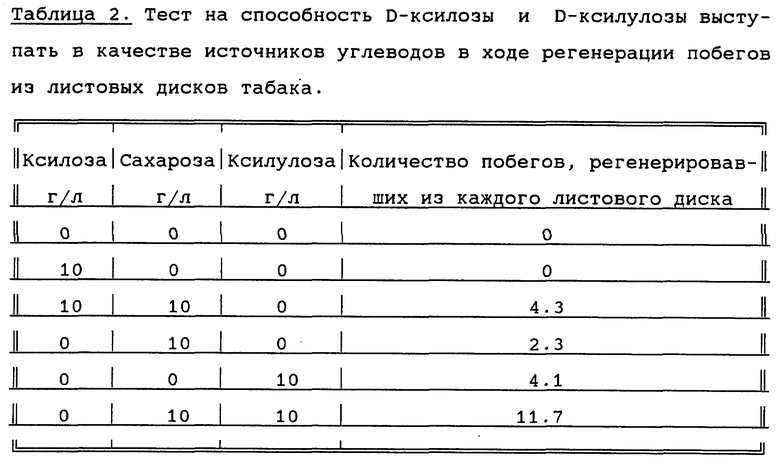
Таблица 2 показывает, что D-ксилоза не ингибирует регенерацию побегов в присутствии сахарозы и, кроме того, D-ксилоза не утилизируется в качестве источника углеводов. D-ксилулоза является хорошим источником углеводов в ходе регенерации побегов.
Ксилоза может быть превращена в ксилулозу с помощью ксилозоизомеразы. В соответствии с этим функциональный ген ксилозоизомеразы, а также структурный ген, находящиеся под контролем подходящих промоторов и терминаторов, внедряют в растения или их части, или их клетки, и трансформированные растения (или их части, или их клетки) селектируют по их способности использовать ксилозу в качестве источника углевода.
Пример 6
Эксплантаты получают и обрабатывают, как описано выше в пункте "Селекция трансформированной ткани", с тем отличием, что в субстрат для селекции/регенерации не был добавлен канамицин или карбенициллин, а растительная ткань не является трансформированной. Таким образом, единственной стадией субкультивирования является перенос эксплантатов с субстрата для сокультивирования на субстрат для селекции/регенерации, обогащенный ксилозой в концентрациях, указанных ниже. Количество регенерировавших побегов регистрируют спустя 12 недель.
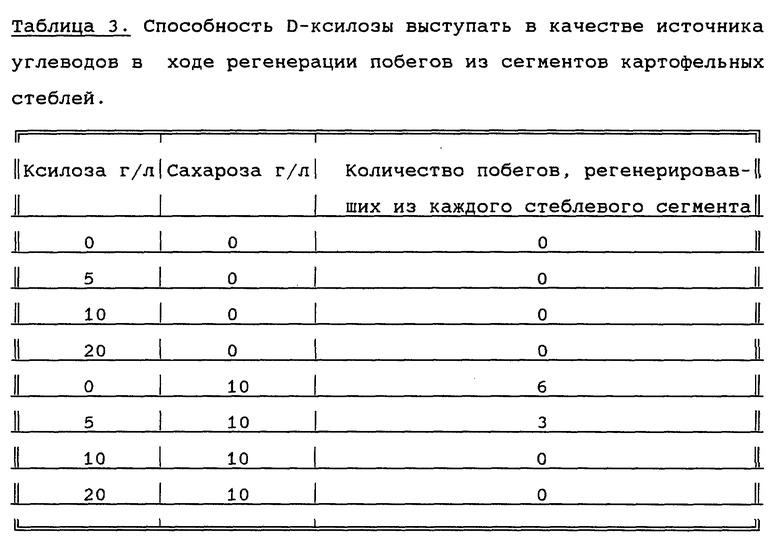
Из результатов, представленных в таблице 3, видно, что D-ксилоза (по сравнению с D-маннозой) является слабым ингибитором регенерации побегов в присутствии сахарозы и, кроме того, D-ксилоза не является источником углеводов в растениях, которые являются нетрансгенными по ферменту или белку, метаболизирующему ксилозу. Более того, D-ксилоза (5 г/л), добавленная в субстраты при отсутствии в них сахарозы, вызывала регенерацию 2,2 побегов на эксплантат через 9 недель.
Пример 7
Повторяют пример 5, с тем отличием, что субстрат для селекции/регенерации обогащен метил-3-O-глюкозой (МОГ) в концентрациях, приведенных в таблице 4. Процент живых эксплантатов регистрировали через 8 недель.
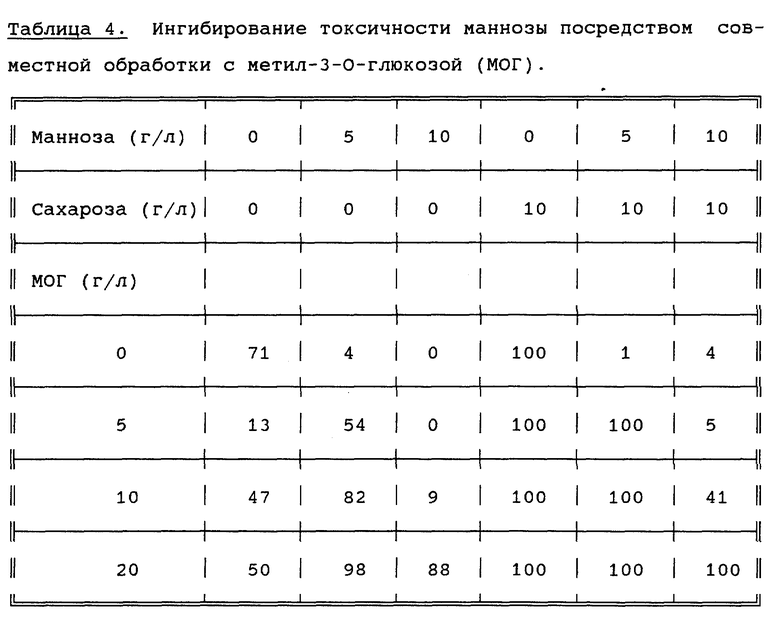
Из результатов, представленных в таблице 4, видно, что совместная обработка с МОГ ингибирует токсическое действие маннозы на чувствительные растительные ткани. Так как манноза токсична в концентрациях, являющихся оптимальными для соединений, служащих источниками углеводов, то добавление МОГ создает возможность для обогащения субстрата углеводами в форме маннозы в оптимальных концентрациях. Это делает возможным применение маннозы в качестве агента положительной селекции при отсутствии других источников углеводов.
Пример 8
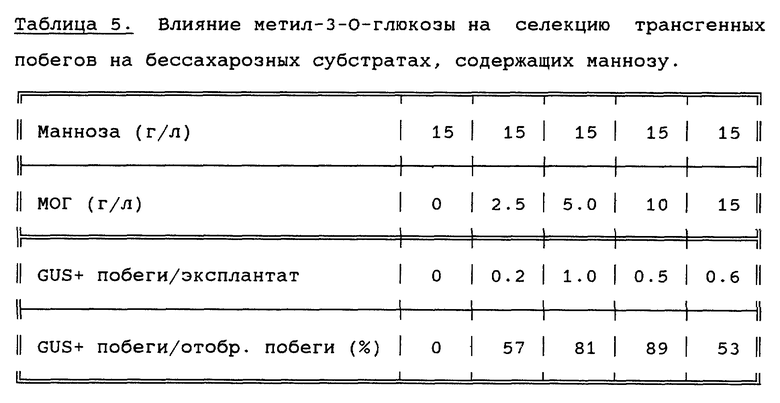
Повторяют пример 7, с тем отличием, что субстрат для регенерации/селекции содержит маннозу (15 г/л), метил-3-O-глюкозу в концентрациях, приведенных в таблице 5, и не содержит сахарозы. Трансформированный растительный материал является трансгенным по гену маннозо-6-фосфат-изомеразы. Спустя 21 сутки отселектированные побеги собирают. Все собранные побеги анализируют на предмет экспрессии совместно введенного гена β-глюкуронидазы, а затем вычисляют общее количество (по двум сборам) трансгенных побегов, экспрессирующих β-глюкуронидазу (GUS+), на эксплантаты, как долю побегов, экспрессирующих β-глюкуронидазу (GUS+) от общего количества отселектированных побегов (таблица 5).
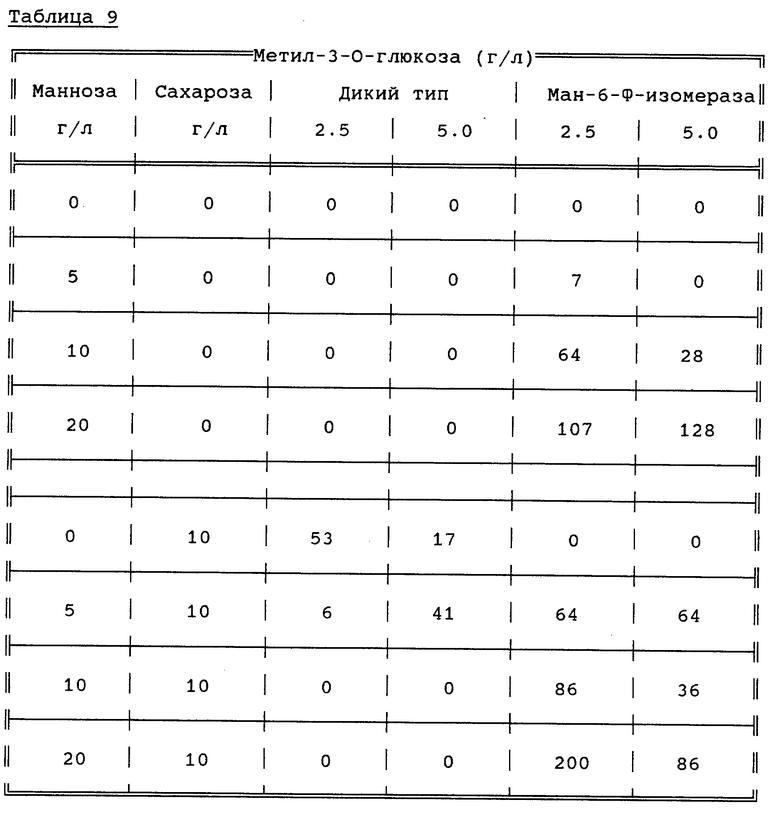
Из результатов, представленных в таблице 5, видно, что при совместном добавлении маннозы и метил-3-O-глюкозы селекция трансгенных побегов возможна даже при высоких концентрациях маннозы и отсутствии других источников углеводов.
Пример 9
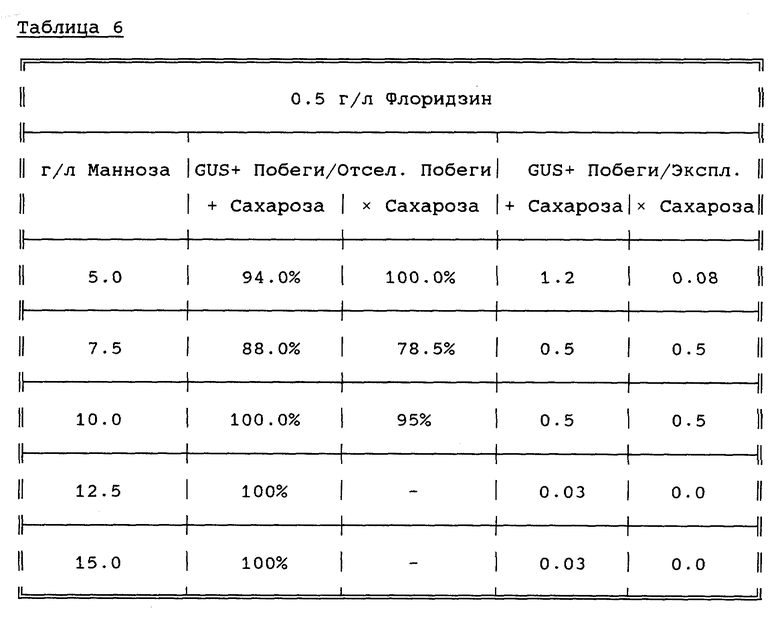
Повторяют пример 8, с тем отличием, что МОГ заменяют флоридзином. Из таблицы 6 видно, что при совместном добавлении маннозы и флоридзина возможна селекция 100% трансгенных побегов при высоких концентрациях маннозы и отсутствии других источников углеводов. Это является примером того, как симбиотический рост на минимальной среде и продуцирование эксудатов может быть сведено к минимуму посредством добавления ингибитора углеводного транспорта.
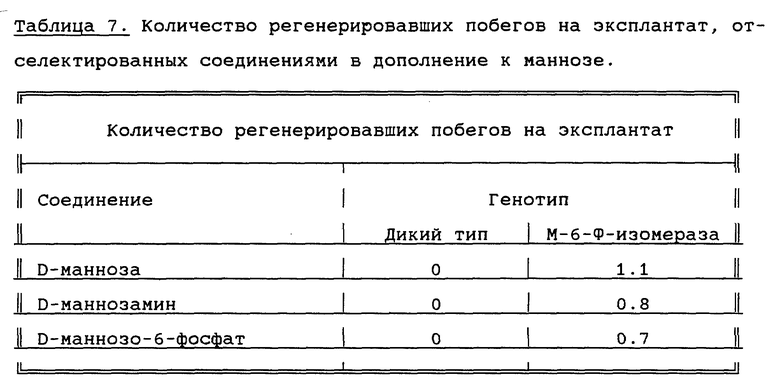
Пример 10
Из таблицы 7 видно, что соединения, не являющиеся маннозой, могут быть применены в качестве селектирующих агентов для трансгенной растительной ткани, которая несет, среди прочего, ген маннозо-6-фосфат-иэомеразы из Е.coli.
Пример 11
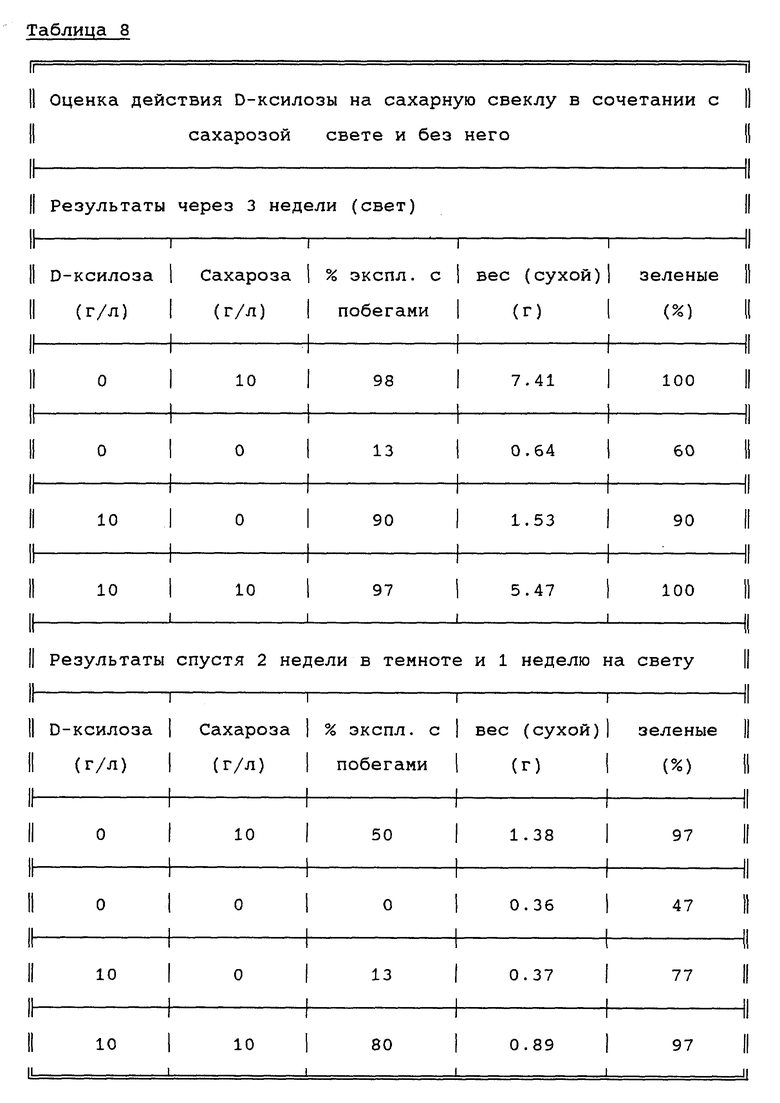
Сахарную свеклу трансформируют так называемым cot-pet (сем-гер) способом [14] , при котором в качестве эксплантов используют семядоли, включая черешки. Проростки отделяют от семян, пророщенных и выращивавшихся в течение 4-7 недель при 12oC в световом режиме 16 ч день/8 ч ночь. Семядоли отрезают на 2-3 мм ниже узла, отделяют и культивируют либо в темноте, либо на свету в присутствии или отсутствии ксилозы. Из таблицы 8 видно, что ксилоза утилизируется сахарной свеклой в качестве источника углеводов в присутствии света, но не в темноте, что свидетельствует о том, что основанную на ксилозе положительную селекцию сахарной свеклы, трансгенной, среди прочего, по гену ксилозо-изомеразы, следует проводить в темноте.
Пример 12
Получают эксплантаты, трансгенные, среди прочего, по гену маннозо-6-фосфат-изомераэы, а в субстрат для селекции/регенерации добавляют маннозу и сахарозу, как указано в таблице 9. Количество регенерировавших побегов регистрируют через 11 недель. В таблице 9 представлено количество регенерировавших побегов на субстратах, содержащих метил-3-О-глюкозу как процент от количества побегов, регенерировавших на субстратах без маннозы и метил-3-O-глюкозы.
Регенерация побегов на субстрате, содержащем сахарозу (10 г/л) и не содержащем ни маннозу, ни метил-3-O-глюкозу:
Трансгенная ткань: - 1,4 побега/эксплантат
Ткань дикого типа: - 1,7 побега/эксплантат
Следует иметь ввиду, что настоящее изобретение не ограничивается приведенными выше примерами. Например, тканеспецифическая экспрессия гена, кодирующего фермент, участвующий в метаболизме маннозы или ксилозы, либо в метаболизме производного маннозы или ксилозы или предшественника маннозы или ксилозы, может быть применена для контроля ростовой регуляции таких тканей при их культивировании на субстрате, являющемся модулятором указанного фермента. Более того, манноза или ксилоза (включая их производные или предшественники) могут быть использованы в качестве селективного гербицида для культур, обладающих селективным преимуществом, которые были трансформированы путем введения генов, кодирующих белки, участвующие в метаболизме ксилозы или маннозы либо их предшественников или производных.
Следует также иметь ввиду, что применение способа согласно изобретению может охватывать:
a) эукариотические организмы, обладающие в целом или в отдельных типах тканей/клеток пониженными уровнями фруктозо-6-фосфата либо его производных, благодаря введению гена, кодирующего, например, фосфоманнозоизомеразу;
б) эукариотические организмы, обладающие в целом или в отдельных типах тканей/клеток повышенными уровнями маннозо-6-фосфата либо его производных, благодаря введению гена, кодирующего, например, фосфоманнозоизомеразу;
в) эукариотические организмы, обладающие во всех или в некоторых типах клеток повышенной фосфоманнозоизомеразной активностью благодаря введению гена, кодирующего фосфоманнозоизомеразу, в эти клетки.
Литература
1. Pietrzak, M. et al., Nucleic Acids Res. 14, pp. 5857-5868 (1986).
2. Nielsen, K. K. et al., Mol. Plant Microbe Interact. 6, pp. 495-506 (1993).
3. Miles, H. et al., Gene 32, pp. 41-48 (1984).
4. Fromm et al., Proc. Natl. Acad. Sci. USA 82, p. 5824 (1985).
5. Fromm et al., Nature 319, p. 791 (1986).
6. Kay et al., cience 236, pp. 1299-1302 (1987).
7. Hoekema et al., Nature 303, pp. 179-180 (1983).
8. Ooms et al., Plasmid 7, pp. 15-29 (1982).
9. Holsters et al., Mol. Gen. Genet. 163, pp. 181-187 (1978).
10. Linsmaier et al., Phisiol. Plant. 18, pp. 100-127 (1965).
11. Radke et al., Theor. Appl. Genet. 75, pp. 685-694 (1988).
12. Hodal et al., Plant Sci. 87, pp. 115-122 (1992).
13. PCT/92/00252.
14. Заявка PCT/DK 92/00108.
Введение в популяцию эукариотических клеток нуклеотидной последовательности, кодирующей белок, например фермент маннозо-6-фосфат-изомеразу, когда питательная среда содержит соединение, токсическое для клеток или ингибирующее их рост, например маннозу, при добавлении реагента, снижающего токсичность или ингибирующее действие, позволяет идентифицировать и селектировать трансформированные клетки без опасности гибели нетрансформированных клеток в популяции и без совместного введения генов устойчивости к антибиотикам и гербицидам (положительная селекция). Положительная селекция также упрощает используемые векторные конструкции, т.к. один и тот же ген может быть использован в качестве как репортерного, так и селективного гена. 8 з. п.ф-лы, 4 ил., 9 табл.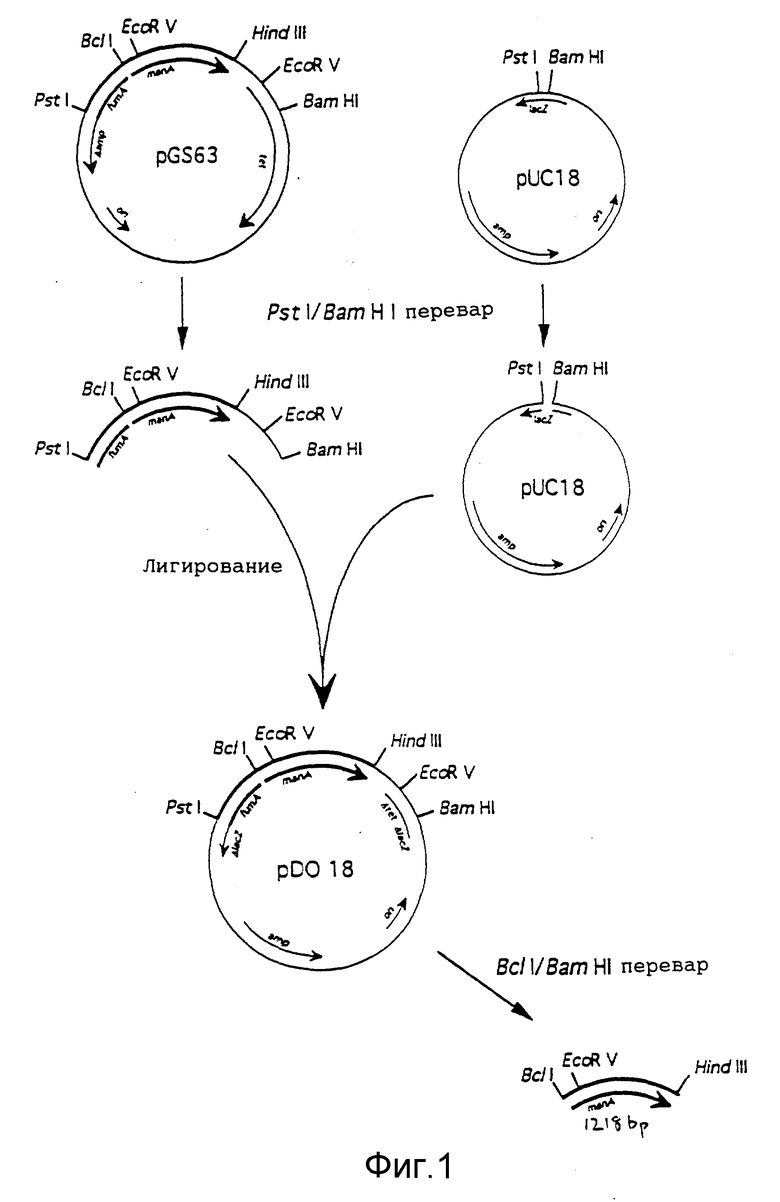
| Устройство для сборки картеров коробки перемены передач | 1960 |
|
SU131623A1 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВИЫХ КРАСИТЕЛЕЙ | 0 |
|
SU303780A1 |
| US 4857467 A, 1989 | |||
| Генная инженерия растений./Под ред | |||
| Дрейпера Дж.-М.: Мир, 1991, с.95-103. | |||
Авторы
Даты
1999-03-20—Публикация
1994-02-28—Подача