Изобретение относится к способу выделения генетически трансформированных клеток, в которые введена заданная последовательность нуклеотидов, заключающемуся в том, что трансформированные клетки получают избирательные преимущества без разрушения нетрансформированных клеток, а также к новым соединениям, которые используются в указанном способе.
Предпосылки изобретения.
Хорошо известно, что в тех случаях, когда необходимо ввести путем трансформации новый генетический материал в популяцию клеток, успешно трансформируется, т. е. получает новый генетический материал, лишь небольшое количество клеток. Затем генетически трансформированные клетки необходимо идентифицировать с тем, чтобы эти клетки можно было бы отделить от нетрансформированных клеток популяции. Идентификация и отделение трансформированных клеток традиционно осуществляется с помощью метода, получившего название метода "негативной селекции", иными словами, способа отбора, при использовании которого трансформированные клетки способны развиваться и расти, в то время как рост нетрансформированных клеток подавляется или же они даже убиваются веществами, действию которых способны противостоять трансформированные клетки.
Например, в том случае, если популяция растительных клеток подвергается генетической трансформации, отделение трансформированных клеток обычно осуществляется с использованием селективного гена, с помощью которого кодируется устойчивость к действию антибиотиков и гербицидов. Селективный ген, который сам по себе обычно не выполняет никаких полезных функций в генетически трансформированном растении и даже может оказаться нежелательным для данного растения, присоединяется или вводится вместе с геном, который необходимо внедрить в данное растение, так что оба этих гена вносятся в популяцию клеток или, вернее, в некоторые клетки популяции, поскольку практически невозможно трансформировать все или даже большинство клеток. Клетки далее выращивают на среде, которая содержит антибиотик или гербицид, к действию которого генетически трансформированные клетки устойчивы благодаря присутствию селективного гена, что и позволяет идентифицировать трансформированные клетки, поскольку у нетрансформированных клеток, которые не содержат данный ген, обеспечивающий их устойчивость к действию антибиотиков или гербицидов, рост подавляется, либо же они убиваются.
Указанный метод негативной селекция имеет, однако, определенные недостатки, Прежде всего, нетрансформированные клетки могут отмереть вследствие присутствия, в частности, антибиотиков в питательной среде. В результате этого, если популяция клеток представляет собой однородную связанную ткань, появляется вполне определенный риск того, что умрут не только нетрансформированные клетки, но и трансформированные клетки, поскольку отмирание нетрансформированных клеток может привести к прекращению подачи питательных веществ к трансформированным клеткам, или же вследствие того, что поврежденные или отмирающие клетки выделяют токсичные соединения.
Следующим значительным недостатком метода негативной селекции является то, что присутствие постороннего гена, обеспечивающего, например, устойчивость по отношению к антибиотикам, может оказаться нежелательным. Так, например, в правительственных кругах высказываются определенные сомнения относительно того, является ли безопасным введение в растения и микроорганизмы генов, кодирующих устойчивость по отношению к действию антибиотиков. Такие опасения приобретают особое значение в случае используемых в пищу растений или же микроорганизмов, которые не предназначены для использования в изолированной среде (например, микроорганизмы, применяемые в сельском хозяйстве), а также микроорганизмов, которые рассчитаны на использование в изолированной среде, но могут оказаться за ее пределами, Хотя эти опасения, вероятно, являются беспочвенными, они могут привести к появлению правительственных ограничений на использование генов, обеспечивающих устойчивость к действию антибиотиков, например, в растениях, а потому желательно разработать новые метода выделения генетически трансформированных клеток, которые не зависели бы от подобных генов.
Еще одним недостатком метода негативной селекции является то, что растительные клетки или клетки, обработанные токсичными веществами, становятся более восприимчивыми к бактериальной инфекции. Такая проблема возникает, в частности, при использовании Agrobacterium в качестве трансформирующего вектора, поскольку бактерия иногда перерастает обработанные ткани или клетки несмотря на то, что для предотвращения роста бактерий используются антибиотики.
Далее, отделение клеток или тканей с использованием метода негативной селекции требует очень точного времени экспрессии введенного гена по отношению к процессу селекции. Если трансгенные клетки обрабатываются токсичным соединением до экспрессии обезвреживающего гена или до того, как образуется достаточно генных продуктов, чтобы подавить действие токсичного соединения, трансгенные клетки будут убиты вместе с нетрансгенными клетками. Если же селекцию проводят слишком поздно, то отдалению трансгенных клеток или тканей могут воспрепятствовать, например, отростки, образуемые нетрансгенными клетками или тканями.
Указанные выше недостатки устраняются в способе по настоящему изобретению (названном методом "позитивной селекции"), в котором впервые становится возможным идентифицировать и выделить генетически трансформированные клетки без повреждения или уничтожения нетрансформированных клеток популяции и без совместного введения гена, обеспечивающего устойчивость по отношению к антибиотикам или гербицидам. Помимо того, что устраняется необходимость введения генов, обеспечивающих устойчивость к действию антибиотиков и гербицидов, было также показано, что метод позитивной селекции по настоящему изобретению часто гораздо более эффективен, чем традиционный метод негативной селекции. Как указано ниже в примерах, количество трансгенных побегов, выделенных из дисков листьев табака с использованием метода позитивной селекции, например, в 30 раз превышает количество побегов, выделенных с использованием традиционной системы негативной селекции на основе кетамина, а сочетание методов позитивной и негативной селекции позволяет достичь частоты селекции трансгенных отростков, которая в 10 раз превышает значение, которое может быть достигнуто с использованием только метода негативной селекции (см. пример 11). Более того, использование метода позитивной селекции предоставляет то преимущество, что один и тот же ген может использоваться в качестве регистрирующего гена и селективного гена, что приводит к упрощению векторных конструкций, получению более стабильных структур и 100%-ной корреляции между экспрессией регистрирующего и селективного генов. В методе позитивной селекции устраняются также указанные выше проблемы, связанные с точным проведением операций во времени, поскольку совпадения, образующиеся при селекции, будут всегда получаться благодаря экспрессии гена. Таким образом, выбранные соединения будут накапливаться в процессе экспрессии селективного гена, при этом селективный эффект проявляется тогда, когда получено достаточное количество заданного соединения.
Краткое описание изобретения.
Одной из целей настоящего изобретения является способ выделения из популяции клеток генетически трансформированных клеток, в которые введена требуемая последовательность нуклеотидов, в котором в трансформированных клетках заданная последовательность нуклеотидов или последовательность совместно вводимых нуклеотидов привносит или усиливает положительное воздействие соединения или питательного вещества, которым снабжается популяция клеток, что позволяет идентифицировать или отделить трансформированные клетки от нетрансформированных клеток.
В одном из вариантов реализации настоящего изобретения указанный способ осуществляют путем выращивания популяции клеток на среде, содержащей по крайней мере одно неактивное соединение или питательное вещество, которое прямо или косвенно активирует клетки, содержащие введенную совместно последовательность нуклеотидов или требуемую последовательность нуклеотидов, при этом указанное соединение или питательное вещество является неактивным в нетрансформированных клетках или по крайней мере является менее активным в нетрансформированных клетках, чем в трансформированных клетках, так что трансформированные клетки получают избирательные преимущества, благодаря которым их можно выделить из популяции клеток.
В другом варианте реализации настоящего изобретения способ осуществляют путем выращивания популяции клеток на среде, содержащей по крайней мере одно неактивное соединение или питательное вещество, которое становится доступным для трансформированных клеток благодаря экспрессии или транскрипции введенных совместно последовательностей нуклеотидов или заданных последовательностей нуклеотидов, при этом соединение или питательное вещество недоступно или менее доступно для нетрансформированных клеток, чем для трансформированных клеток, так что трансформированные клетки получают избирательные преимущества, благодаря которым их можно выделить из популяции клеток.
В еще одном варианте осуществления настоящего изобретения экспрессия вносимой совместно последовательности нуклеотидов приводит к усилению активности фермента, который содержится эндогенно в популяции клеток, так что активность фермента в трансформированных клетках выше, чем активность фермента в нетрансформированных клетках.
Наконец, в еще одном варианте осуществления настоящего изобретения экспрессия или транскрипция вносимой совместно последовательности нуклеотидов или требуемой последовательности нуклеотидов приводит к блокированию метаболизма соединения, поступающего в популяцию клеток, или блокированию синтеза соединения в трансформированных клетках, что позволяет идентифицировать трансформированные клетки и отделить их от нетрансформированных клеток.
Следующей целью настоящего изобретения являются новые соединения, которые могут использоваться в указанном выше способе.
Эта цель связана с соединением общей формулы (1)
где
R2 является H, CH3, S-CH3, SO2-CH3, SCH2-фенил, SH, OH, Cl или группой -S-R10, -NH-R10 или -O-R10, где R10 является β-D-глюкопирануронозильной группой (структура которой становится понятной из рабочих примеров) или ее солью или сложноэфирным или амидным производным по карбоксильной группе;
R6 является бензильной группой, которая может содержать в бензольном кольце такие заместители, как оксигруппа, (C1-C6) алкоксигруппа, атом галогена, (C1-C4) алкильная группа, аминогруппа, трифторметильная группа или группы -O-R10, -S-R10 или -NH-R10, где значение R10 указано ранее; (C1-C8)алкильной группой или (C2-C8)алкенильной группой, которая может быть замещена от 1 до 3 гидроксильными группами, глюкозилоксигруппой или (C1-C6)алкоксигруппой, фенильной группой и/или группами -O-R10, -S-R10 или -NH-R10, где зачение R10 указано ранее; этерифицированной (C1-C6)алкильной группой или (C2-C6)алкенильной группой; фурфурильной группой; или циклогексилуреидогруппой, фенилуреидогруппой или толилуреидогруппой;
а также
(i) R7 и Y обозначают половинки связи, которые вместе образуют целую связь,
(ii) одна из групп R3 или R9 является атомом водорода или группой R10, значение которой указано ранее, а другая группа обозначает половинку связи, которая вместе с половинкой связи X образует целую связь, или же радикал R9 является рибозильной группой, 5'-фосфорибозильной группой, глюкозильной группой или группой -CH2CH(NH2)COOH, а радикал R3 обозначает половинку связи, которая вместе с половинкой связи X образует целую связь, и
(iii) R8 является H, CH3, S-CH3, SO2-CH3, SCH2-фенил, SH, OH, Cl или группой -S-R10, -NH-R10 или -O-R10, где значение R10 указано выше, или
(iv) R7 является рибозильной группой, 5'-фосфорибозильной группой, глюкозильной группой, R8 является атомом водорода, R9 и Y являются половинками связи, которые вместе образуют целую связь, а R3 является половинкой связи, которая вместе с половинкой связи X образует целую связь;
при условии, что один из радикалов R2, R3, R6, R8 и R9 является или содержит β- D- глюкопирануронозильную группу, или ее соль, или сложноэфирное или амидное производное по карбоксильной группе.
Следующей целью настоящего изобретения являются дополнительные соединения, которые могут быть использованы в указанном методе. Так, настоящее изобретение относится также к соединению общей формулы (II)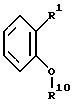
где
R1 является группой цис-CH=CH-COOH, ее солью или сложноэфирным производным по карбоксильной группе, или амидным производным группы цис- и/или транс-CH=CH-COOH, а значение R10 указано выше.
Далее, изобретение относится к генетически трансформированным клеткам, которые выделяются в соответствии с указанным способом, в частности растительным клеткам, а также растениям, потомству и семенам, полученным из таких генетически трансформированных растительных клеток.
Подробное описание изобретения.
Термин "клетки" в контексте настоящего изобретения относится к любому типу клеток, из которых можно идентифицировать и выделить индивидуальные генетически трансформированные клетки, используя способ по настоящему изобретению, включающие растительные клетки, животные клетки и микроорганизмы, такие как бактерии, грибки, дрожжи и т.д. Более того, термин "клетки" охватывает в данном случае также протопласты, т. е. протоплазму клетки, заключенную в мембрану, но не имеющую клеточной стенки. Хотя подразумевается, что общие принципы настоящего изобретения могут быть применены для любых типов клеток, предлагаемый способ особенно полезен для выделения генетически трансформированных растительных клеток.
Термин "популяция клеток" относится к любой группе клеток, которую подвергают генетической трансформации и в которой необходимо идентифицировать те клетки, которые были генетически трансформированы, и отделить генетически трансформированные клетки от нетрансформированных клеток. Популяция может быть, в частности, тканью, органом или их частью, популяцией индивидуальных клеток на подложке, такой как культура клеток микроорганизма, в частности популяция клеток в растворе или суспензии, или организмом в целом например, целым растением.
Термин "селекция" относится к процессу идентификации и/или отделения генетически трансформированных клеток от нетрансформированных клеток с использованием способа, приведенного в данном описании.
Термин "требуемая последовательность нуклиотидов" может относиться к любой последовательности нуклеотидов, которую необходимо внедрить в данную клетку для получения генетически трансформированных клеток. Внедрение последовательности нуклеотидов в растения, микроорганизмы или животных широко распространено и не существует ограничений в последовательностях нуклеотидов, присутствие которых может быть установлено с использованием описываемого метода позитивной селекции. Используя указанный способ, можно установить присутствие заданной последовательности нуклеотидов в генетически трансформированных клетках, избегая указанных выше недостатков, которые присущи традиционным системам негативной селекции.
Тот факт, что последовательность нуклеотидов "вносится совместно" с требуемой последовательностью нуклеотидов означает, что обе последовательности нуклеотидов связаны друг с другом или вносятся вместе таким образом, что присутствие в клетке вносимой совместно последовательности нуклеотидов указывает на то, что заданная последовательность нуклеотидов также внесена в клетку, т. е. если показано, что одна последовательность нуклеотидов внедрена, то вероятность того, что внедрена и вторая последовательность, значительно возрастает.
Обе последовательности нуклеотидов являются обычно, но не обязательно, частью той же самой генетической конструкции и вносятся, например, одним и там же вектором.
Описываемые здесь методы могут также использоваться в том случае, когда вносимая совместно последовательность нуклеотидов и требуемая последовательность нуклеотидов внедряются независимо друг от друга. Это может быть, например, осуществлено при использовании той же самой бактерии для введения обоих генов и включения в клетку сравнительно большого количества копий заданной последовательности нуклеотидов, при этом достаточно велика вероятность того, что клетки, которые отражают присутствие вносимой совместно последовательности нуклеотидов, будут также содержать и отражать заданную последовательность нуклеотидов. Вероятность независимого введения двух или большего количества генов, что приводит к совместной экспрессии генов в одной клетке, обычно считается незначительной, поэтому ожидается, что увеличение частоты селекции, которое достигается в методе позитивной селекции, будет особенно полезно в таких системах.
Поскольку необходимо, чтобы введенные последовательности нуклеотидов проявлялись в трансформированных клетках, то генетическая конструкция, включающая две последовательности нуклеотидов, должна содержать, хотя это и необязательно, регулирующие последовательности, которые способствуют экспрессии нуклеотидных последовательностей; ими, в частности, могут быть промоторы и прерыватели транскрипции. Таким образом, совместно вводимые последовательности нуклеотидов, как правило, должны быть связаны с промотором, который может быть образующим и регулирующим промотором, а требуемая последовательность нуклеотидов также будет связана с образующим и регулирующим промотором.
Как указывалось ранее, данный способ особенно удобен для выделения генетически трансформированных растительных клеток, при этом он позволяет идентифицировать и отделить такие клетки без использования кодирования селективным геном для введения устойчивости к действию антибиотиков или гербицидов. Аналогично традиционным методам негативной селекции предлагаемый метод позитивной селекции может применяться в условиях in vitro. Однако метод позитивной селекции можно применять и в условиях in vivo. Использование метода позитивной селекции в условиях in vivo особенно удобно, например, в случае проведения генетических преобразований по отношению ко всему растению в целом или к отдельным его частям, при котором растение или его части будут состоять как из трансформированных, так и нетрансформированных клеток, поскольку селекция трансформированных клеток достигается без прямого разрушения соседствующих нетрансформированных клеток. Трансформированные клетки получают, таким образом, избирательное "преимущество" по сравнению с нетрансформированными клетками (например, способность давать отростки), однако нетрансформированные клетки не испытывают каких-либо неудобств в том смысле, что они не разрушаются и не убиваются, как это обычно происходит при использовании антибиотиков и гербицидов в методе негативной селекции.
"Неактивным соединением или питательным веществом" может быть любое соединение и питательное вещество в неактивной форме или в форме предшественника, т. е. такое вещество, которое в отсутствие экспрессии совместно вводимой последовательности нуклеотидов существует в биологически практически неактивной форме по отношению к данным клеткам, но которое при экспрессии или транскрипции совместно вводимой последовательности нуклеотидов гидролизуегся или активируется каким-либо иным способом или же участвует в процессах метаболизма, что и обеспечивает получение генетически трансформированными клетками, содержащими требуемую последовательность нуклеотидов, избирательных преимуществ; это и позволяет идентифицировать и отделить такие клетки. Неактивным соединением или питательным веществом может быть, в частности, неактивный регулятор роста, например, дезактивированный цитокинин, ауксин или гибберилин, какой-либо витамин, например, дезактивированный тамин, углевод (например, манноза в том случае, если совместно вводимая последовательность нуклеотидов кодирует манноза-6-фосфатизомеразу, или галактоза или галактозусодержащее соединение в том случае, если совместно вводимая последовательность нуклеотидов кодирует UDP -галактоза-4-эпимеразу), азотсодержащее соединение (в частности, один в том случае, если совместно вводимая последовательность нуклеотидов кодирует метаболизм опина или транспортный фермент), крахмал, белок или какое-либо другое питательное вещество в неактивной форме или соединение, которое играет важную роль в процессе дифференциации и дедифференциации клеток или тканей. Обработку клеток или тканей соединениями, которые привносят зависимость от дополнительно вводимого важного соединения, можно проводить одновременно с введением соответствующих неактивных соединений. Такой путь может быть использован, в частности, в том случае, когда ингибируется синтез стеринов или сапонинов и вносятся неактивные стерины или сапонины. Неактивным соединением, далее, может быть, например, минеральное вещество, которое образует хелатное соединение и, таким образом, становится доступным для генетически трансформированных клеток.
В отличие от традиционного метода негативной селекции, в котором нетрансформированные клетки повреждаются или убиваются под действием присутствующих в субстрате антибиотиков, гербицидов или токсинов, неактивные соединения или питательные вещества, используемые в методе позитивной селекции по настоящему изобретению, не оказывают прямого вредного воздействия на нетрансформированные клетки. Вместо этого трансформированные клетки приобретают физиологические преимущества, которые позволяют идентифицировать и выделить их, в то время как в присутствии неактивного соединения и питательного вещества, используемого в селективных целях, на нетрансформированные клетки не оказывается никакого влияния или же оказывается меньшее воздействие.
Традиционный метод "негативной селекции" характеризуется, таким образом, использованием селективного гена, который снижает негативное воздействие добавленного соединения на трансформированные клетки. Наоборот, термин "позитивная селекция" используется в контексте настоящего изобретения по отношению к селективному гену, который обеспечивает усиление положительного воздействия добавленного соединения на трансформированные клетки.
Соединение, используемое для целей селекции, может также оказывать как положительное, так и отрицательное воздействие. Например, манноза является токсичной для большинства клеток растений, однако в клетках, которые содержат манноза-6-фосфатизомеразу, негативный эффект устраняется, более того, клетка становится способной использовать маннозу в качестве источника углеводов. В этом случав одно соединение и один ген являются компонентами селективной системы, совмещающей как позитивные, так и негативные свойства, однако такие системы, обладающие положительным и отрицательным действием, могут быть созданы с использованием двух или более генов, которые вместе отвечают за подавление отрицательных эффектов соединения и проявление положительного воздействия соединения в трансформированных клетках.
Неактивным соединением или питательным веществом, используемым в методе позитивной селекции, необязательно должно быть соединение или вещество, которое активируется непосредственно пептидом, который кодируется совместно вводимой последовательностью нуклеотидов. Это вещество или соединение может активироваться косвенно, например в том случае, если совместно вводимая последовательность нуклеотидов оказывает косвенное воздействие на неактивное соединение или питательное вещество в генетически трансформированных клетках, а не в нетрансформированных клетках. Так, совместно вводимая последовательность нуклеотидов может быть такой, которая при экспрессии в трансформированных клетках косвенно увеличивает, например, активность фермента, который является эндогенным для данной популяции клеток, что приводит к большей активности фермента и активированию неактивного соединения или питательного вещества в данных генетически трансформированных клетках.
Совместно вводимая последовательность нуклеотидов может, в частности, кодировать пермиазу или другой транспортный фактор, который позволяет рассматриваемому соединению или питательному веществу проходить сквозь мембрану клетки и проникать в трансформированные клетки или пересекать другую мембрану (органеллу), так что "активация" неактивного соединения или питательного вещества в этом случае включает избирательный захват соединения или питательного вещества трансформированными клетками, в то время как захват соединения или питательного вещества нетрансформированными клетками оказывается невозможным или же наблюдается в меньшей степени. Вместо облегчения захвата соединения клеткой совместно вводимая последовательность нуклеотидов может, наоборот, направить свой продукт в отделение, в котором располагается неактивное соединение, например, вне клеточной мембраны или внутри вакуоли или эндоплазматического ретикулума.
Отбор в соответствии с таким подходом достигается тем, что соединение становится доступным для трансформированных клеток, в то время как соединение остается недоступным или менее доступным для нетрансформированных клеток. Рассматриваемое соединение или питательное вещество, которое в таком случае может и не быть "неактивным" в полном значении этого слова (т.е. соединение или питательное вещество может бать таким, активность которого проявляется при попадании в трансформированную клетку без какого-либо дополнительного превращения, в частности, гидролиза внутри клетки), а может быть того же типа, что и рассмотренные выше, единственное отличие состоит в том, что соединение или питательное вещество в таком случае переносится в трансформированную клетку вместо того (или в добавление к тому), чтобы активироваться внутри трансформированных клеток.
Примерами соединений, которые способны оказывать физиологическое воздействие при проникновении через стенку клетки, но которые с трудом захватываются клеткой или отделением клетки, являются сильно гидрофильные или гидрофобные соединения, в частности, соединения, несущие заряд, большие молекулы, такие как полимеры, в частности протеины, пептида, олиго- или полисахариды, в том числе гормоны, фосфорилированные метаболиты, такие как фосфорилированные углеводы, фосфорилированные витамины, фосфорилированные нуклеозиды, в том числе цитокинины, и соединения, которые связаны с углеводами, содержащими карбоновые кислоты, и аминокислотами, в том числе коньюгаты растительных гормонов.
Предполагается далее, что основной способ по настоящему изобретению может быть модифицирован таким образом, что вместо активирования неактивного соединения или питательного вещества в трансформированных клетках, отбор может быть осуществлен путем блокирования синтеза промежуточных продуктов обмена данного соединения в этих клетках. Например, метаболизм цитокинина, прибавленного в субстрат, может быть заблокирован в трансформированных клетках по механизму десенсибилизации. Так, авторы настоящего изобретения обнаружили, что при ингибировании гликосилирования циатина оптимальная концентрация, стимулирующая рост, понижается в 5-100 раз. Путем ингибирования метаболизма циатина становится, таким образом, возможным получить отростки от дисков табачных листьев при концентрации цеатина, которая неспособна стимулировать рост в нетрансформированных дисках листьев с нормальным метаболизмом цеатина. Было показано, что воздействие индолуксусной кислоты (ИУК) может быть усилено в том случае, если ингибируется обмен этого соединения. Так, при частичном подавлении обмена ИУК было обнаружено, что влияние ИУК на образование наростов усиливается в 5-100 раз. Аналогично, ингибирование метаболизма углеводов или полисахаридов может оказать влияние на использование введенных углеводов и обеспечить дополнительные возможности при подобном варианте позитивной селекции.
"Избирательное преимущество", получаемое трансформированными клетками, может быть любым отличием или преимуществом по отношению к нетрансформированным клеткам, которое позволяет легко идентифицировать и отделить трансформированные клетки от нетрансформированных клеток. Обычно это такое отличие или преимущество, которое позволяет идентифицировать трансформированные клетки простыми визуальными средствами, т.е. без использования отдельного анализа для определения наличия гена-маркера.
В том случае, если полилептид, кодируемый совместно вводимой последовательностью нуклеотидов или заданной последовательностью нуклеотидов, непосредственно активирует неактивное соединение или питательное вещество в трансформированных клетках, нетрансформированные клетки могут в некоторых случаях содержать или производить определенное количество данного полипептида. Например, в том случав, если активирующий полилептид является ферментом, нетрансформированные клетки могут обладать определенным количеством природной ферментативной активности, при этом природный фермент имеет тот же тип, что и введенный активирующий фермент. В таких случаях "неактивное соединение или питательное вещество" необязательно должно быть полностью неактивным в трансформированных клетках, поскольку может оказаться достаточным то, что соединение или питательное вещество просто значительно менее активно в нетрансформированных клетках, чем в трансформированных клетках. Другими словами, качественное отличие между трансформированными клетками и нетрансформированными клетками по отношению к процессу активации первоначально неактивного соединения или питательного вещества может в ряде случаев оказаться достаточным для целей селекции. С этой целью могут быть добавлены ингибиторы или субстраты, которые конкурируют с природным ферментом. Особенно удачными оказываются ингибиторы, которые активируется природным ферментом, что приводит к самокатализируемому производству активного ингибитора до такого уровня, при котором действие природного фермента в значительной степени подавляется.
Активирующий полипептид, кодируемый совместно вводимой последовательностью нуклеотидов, не ограничивается каким-либо конкретным полилептидом и может быть любым полипептидом, который является активным, прямо или косвенно, по отношению к определенному соединению или питательному веществу, которое необходимо активировать в генетически трансформированных клетках. Полипептид, в частности, часто является ферментом.
Ферментом, который оказался пригодным для отбора генетически трансформированных растительных клеток, является бета-глюкуронидаза ("GUS"), при этом отбор осуществляют, используя глюкуронидное соединение, включающее регулятор роста растений, которое расщепляется бета-глюкуронидазой, в частности глюкуронид цитокинина (значение которого будет пояснено в примерах). Удивление вызывает тот факт, что отбор генетически трансформированных растительных клеток может быть проведен с использованием гена GUS, поскольку в связи с настоящим изобретением было обнаружено, что высшие растения обладают собственной GUS- активностью. Это наблюдение противоречит тому, что сообщалось ранее. Так в патенте Великобритании 2197653-A заявляется, что высшие растения не обнаруживают сколько-нибудь заметной активности бета-глюкуронидазы и, таким образом, подразумевается, что, поскольку активность GUS не обнаруживается в высших растениях, контроль за экспрессией конструкции изучаемого гена с использованием гена GUS является очевидным. Однако, что поясняется далее (см. примеры), в действительности это не так, и использование гена GUS для контроля за присутствием нужного гена совсем не является простым и очевидным, поскольку высшие растения на самом деле обладают значительной собственной (фоновой) активностью бета-глюкуронидазы.
Так, с целью отбора генетически трансформированных растительных клеток, популяцию клеток можно вырастить в среде или на среде, содержащей глюкуронид цитокинина, который расщепляется в трансформированных клетках бета-глюкуронидазой, выделяя, таким образом, свободный цитокинин и индуцируя образование отростков и/или наростов в трансформированных клетках.
Для целей настоящего изобретения был разработан ряд новых глюкуронидных соединений цитокинина. Получение этих соединений, а также их использование для позитивной селекции генетически трансформированных клеток подробно описывается далее.
В некоторых случаях желательно модифицировать основной метод, который приводится в данном описании, в частности, путем более эффективного отделения или упрощения методики селекции. В том случае, когда неактивным соединением, используемым в процессе позитивной селекции, является соединение, способное расцепляться под действием бета-глюкуронидазы, основной метод может бать модифицирован путем применения различных средств, с целью получения лучших результатов. Одним из этих средств является использование определенных глюкуронидных соединений стеринов, в частности холестерин-бета-D-глюкуронида или бета-ситостерин-бета-D-глюкуронида в сочетании с соединением, ингибирующим синтез стеринов, таким как тридеморф (4-тридецил-2,6-даметилморфолин). В примерах 5 и 6, приводимых далее, описывается использование таких соединений. Мы полагаем, что путем использования ингибиторов синтеза стеринов вместе с глюкуронидами стеринов, которые, за счет гидролиза бета-глюкуронидазой подавляют воздействие ингибитора синтеза стеринов, можно предотвратить в процессе селекции так называемое "перекрестное питание" (т. е. диффузию активированных соединений из клетки, в которой они были активированы, в другую клетку), поскольку стериновые соединения не могут перемещаться из клетки в клетку после того, как произошло отщепление гидрофильного глюкуронидного фрагмента. Таким образом может быть достигнуто более локализованное воздействие. Соответствующие результаты могут бать получены и с большим количеством других глюкуронидов, которые содержат гидрофобный агликон.
Как уже пояснялось, в отличие от того, о чем ранее сообщалось, было обнаружено, что высшие растения на самом деле обладают собственной GUS-активностью. По этой причине большее введение гена GUS в растение необязательно окажется достаточным для достижения необходимой селекции генетически трансформированных клеток, а потому может оказаться необходимым или желательным уменьшить собственную активность бета-глюкуронидазы в популяции клеток. Поскольку вводимая бета-глюкуронидаза может обладать отличными свойствами от свойств собственной глюкуронидазы, то снижение активности какой-либо эндогенной бета-глюкуронидазы может осуществляться различными способами, например, введением в питательную среду соединения, ингибирующего бета-глюкуронидазу, которое обладает более сильным воздействием на собственную бета-глюкуронидазу, чем на бета-глюкуронидазу, кодируемую нуклеотидом или последовательностью нуклеотидов. Одним из таких соединений является соль аммония.
Активность собственной бета-глюкуронидазы в популяции клеток может быть также существенно снижена прибавлением в питательную среду соединения, которое после его гидролиза образует вещество, способное ингибировать активность собственной бета-глюкуронидазы, и которое преимущественно подавляет активность природной бета-глюкуронидазы, чем активность внесенной бета-глюкуронидаэы. Это можно осуществить саморегулирующимся или локализованным способом, например, локализованно в каком-либо отделении, в котором может находиться или же не находятся ген GUS. Примером продукта гидролиза, который ингибирует природную бета-глюкуронидазу, является глюкуроновая кислота, которая, в частности, образуется при гидролизе глицирризовой кислоты и глюкуронидов стеринов.
Собственную активность бета-глюкуронидазы в популяции клеток можно также снизить прибавлением в питательную среду ингибитора бета-глюкуронидазы, в частности бета-глюкуронида, который в клетках, в которые не вводили ген бета-глюкуронидазы, подавляет активность бета-глюкуронидазы сильнее, чем в клетках, в которые введен ген бета-глюкуронидазы. Это может быть, например, слабый субстрат бета-глюкуронидазы (глюкуронид), который обладает большим сродством по отношению к природной бета-глюкуронидазе, чем внесенной бета-глюкуронидазе.
Бета-глюкуронидаза, которая кодируется введенным геном бета-глюкуронидазы и используется для достижения целей настоящего изобретения, является активной в довольно широком интервале значений pH, в то время как природная бета-глюкуронидаэа, обнаруживаемая в различных образцах многих растений, активна только в сравнительно узком интервале значений pH, обычно приблизительно при pH 4-5 (см. далее в примере 3). Таким образом, активность природной бета-глюкуронидазы в этом случае можно ослабить прибавлением в питательную среду глюкуронида, который способен подвергаться гидролизу природной бета-глюкуронидазой и который после гидролиза приводит к возрастанию величины pH, например, глюкуронид о-кумарила.
Поскольку было обнаружено, что собственная бета-глюкуронидаза является активной при pH приблизительно 4-5, то активность природной бета-глюкуронидазы можно также подавить прибавлением в питательную среду вещества-регулятора кислотности, которое создает в питательной среде pH в интервале приблизительно от 5,5 до 8,5, предпочтительно в интервале приблизительно от 6,0 до 8,0, в частности в интервале приблизительно от 6,5 до 7,5, или же вещества-регулятора кислотности, которое повышает значение pH в клетках или отделениях клеток до указанных значений. В этих интервалах значений pH бета-глюкуронидаза, которую кодирует ген GUS, сохраняет свою активность, в то время как активность природной бета-глюкуронидазы существенно ослабляется. Примером вещества-регулятора кислотности, которое может быть использовано с указанной целью, является соль аммония или вещество, выделяющее аммоний, в частности нитрат аммония.
Наконец, активность природной бета-глюкуронидазы можно уменьшить или существенно подавить физическим воздействием, таким как тепловая обработка, в частности, обработка при температуре в интервале 50-65oC с короткими импульсами приблизительно за 1-2 дня до переноса в субстрат для селекции и/или использования температуры в интервале 30-45oC в процессе отбора (см. пример 10).
Генетические трансформации в растительных клетках часто проводят с использованием штаммов Agrobacterium, в частности штаммов Agrobacterium tumifaciens. Было обнаружено, что некоторые лишенные отростков штаммы Agrobacterium стимулируют образование побегов вследствие выделения в процессе их выращивания индуцирующих рост веществ, поэтому такие штаммы следует обычно избегать в тех случаях, когда для целей селекции генетически трансформированных клеток используют гидролиз глюкуронидов цитокининов под действием GUS. Так, генетические трансформации клеток с использованием глюкуронида цитокинина в качестве неактивного соединения предпочтительно проводят, применяя штаммы Agrobacterium, которые не производят цитокинин или другое вещество-стимулятор роста или производят лишь незначительные количества таких соединений, таким образом устраняя или существенно ослабляя индуцирование образования отростков, вызванное присутствующей в клетке или на клетке живой бактерией.
В определенных случаях, когда необходима большая частота селекции, желательно вводить требуемую последовательность нуклеотидов совместно с по крайней мере двумя различными селективными генами, дополнительный селективный ген может быть таким дополнительным геном, который кодирует фермент (или другой белок или полипептид), пригодный для позитивной селекции по настоящему изобретению, или же это может быть ген, который кодирует фермент (или другой белок, или полипептид), пригодный для традиционной негативной селекции, в частности кодирует устойчивость по отношению к токсину, антибиотику или гербициду. Таким образом, генетически трансформированные клетки можно отобрать, используя комбинацию методов позитивной и негативной селекции, при этом требуемая последовательность нуклеотидов совместно вводится дополнительно с еще одной последовательностью нуклеотидов, которая кодирует устойчивость к действию по крайней мере одного токсина, антибиотика или гербицида, а среда содержит по крайней мере один токсин, антибиотик или гербицид, к действию которого трансформированные клетки проявляют устойчивость.
Как уже указывалось ранее, одной из целей настоящего изобретения являются генетически трансформированные клетки, которые выделены в соответствии с указанным способом, в частности, клетки растений, а также растения, потомство или семена, полученные из таких генетически трансформированных клеток. Преимущество этих клеток, в частности, заключается в том, что они являются генетически трансформированными клетками, геном которых не содержит в качестве маркера введенную (т.е. неактивную) последовательность нуклеотидов, которая кодирует устойчивость по отношению к действию токсина, антибиотика или гербицида. Ранее уже отмечалось, что высказываются опасения относительно того, является ли безопасным вводить гены, кодирующие, в частности, устойчивость к действию антибиотиков, например, в растения, употребляемые в пищу. Генетически трансформированные клетки растений, отобранные в соответствии со способом по настоящему изобретению, которые не содержат селективных генов, в частности, обеспечивающих устойчивость к действию антибиотиков, а также растения, потомство и семена, полученные из этих клеток, обладают с этой точки зрения несомненными преимуществами.
Синтез соединения общей формулы (1) по изобретению.
Известно несколько более или менее общих методов синтеза глюкуронидов цитокинина, охватываемых формулой (1), и два из них, которые, как нам кажется, являются наилучшими, приведены далее.
А) Окисление соответствующего D-глюкозида цитокинина.
В этом подходе группы -CH2OH, присоединенные к пиранозному кольцу бета-D-глюкозида, соответствующего рассматриваемому глюкурониду, окисляются в соответствующих условиях в карбоксильные группы. Вероятно, лучшим способом осуществления такой реакции окисления является прямое и высоко селективное каталитическое окисление кислородом, преимущественно с использованием в качестве катализатора платиновой черни или платины на угле в слабо щелочной (pH 8-10) водной или водно-спиртовой среде (например, в водном этаноле). Реакцию удобно проводить в интервале температур 60-100oС в течение от 2 до 24 часов. Можно проводить окисление (в общем случае некаталитическое), используя другие стандартные окислительные агенты, отличные от кислорода, однако следует ожидать, что такие реакции окисления в общем случае приводят к получения продуктов с более низкими выходами и обладают меньшей специфичностью (т.е. приводят к получению смесей продуктов окисления, в частности, в том случае, если не приняты меры для защиты других способных окисляться групп в исходном глюкозиде путем введения соответствующих защитных групп (см. далее)).
Пример осуществления каталитического окисления представлен методом 1 в примере 1C по настоящему изобретению, в котором N6-бензилиден-9-бета-D-глюкопиранозид (BA9G) окисляется в N6-бензилиден-9-бета-D-глюкопирануроновую кислоту (которая далее выделяется в виде натриевой соли) под действием кислорода в присутствии платиновой черни. Указанный метод носит вполне общий характер применительно к синтезу 9-глюкуронидов цитокинина из соответствующих 9-глюкозидов, Он оказался также вполне удовлетворительным для синтеза, например, цеатин-O-глюкуронидов (см. пример 1G в данном описании) из соответствующих глюкозидов; цеатин-O-глюкуронид является примером соединения по формуле (1) по настоящему изобретению, в котором глюкуронидный фрагмент замещается на фрагмент R6 - как указано в данном описании - (C2-C8)алкенильного типа, и рассматриваемый метод является, как нам кажется, достаточно общим для получения других глюкуронидов цитокинина по настоящему изобретению, в которых O-глюкуронидный фрагмент сохраняется в виде заместителя в группе R6, которая представляет собой группу одного из следующих типов, как это ранее указано в связи о соединением по общей формуле (1): бензильная группа; (C1-C8)алкильная или замещенная (C1-C8)алкильная группа; (C2-C8)алкиленовая или замещенная (C2-C8)алкиленовая группа.
Однако этот подход не является общим в случае, например, синтеза 3-глюкуронидов цитокинина.
Как уже отмечалось, очевидно, что при использовании подхода, предусматривающего окисление глюкозида цитокинина, другие способные окисляться (в рассматриваемых окислительных условиях) функциональные группы, которые могут присутствовать в исходном глюкозиде цитокинина и которые должны быть сохранены без изменения в конечном глюкураниде по формуле (1), необходимо защитить введением подходящей защитной группы. Примерами потенциально способных окисляться групп, которые могут присутствовать в рамках принятых обозначений по формуле (1), являются (вместе с занимаемым ими положением, как указано в связи с общей формулой (1) (см. выше)): группа - SH, которая может присутствовать в качестве заместителя R2 и/или заместителя R8, оксигруппа или глюкозилоксигруппа, которая может присутствовать в виде заместителя в R6 группах типа замещенных(C1-C8)алкильных групп или замещенных (C2-C8)-алкиленовых групп; и рибозильная группа, 5'-фосфорибозильная группа или глюкозильная группа, которые могут присутствовать в виде R9 или R7 групп. Если, например, необходимо защитить алифатическую (спиртовую) оксигруппу, такую как гидроксильные группы при вторичном атоме углерода в рибозильной группе, 5-фосфорибозильной группе или глюкозильной группе, то в качестве подходящих защитных групп часто можно использовать ацетильные группы, которые вводят, применяя методы, хорошо известные специалистам, и которые можно удалить по окончании процесса окисления щелочным гидролизом.
При использовании мягкого каталитического окислительного процесса, рассмотренного ранее, оксигруппы при первичных атомах углерода являются в общем случае устойчивыми к окислению, в то время как оксигруппы при вторичных (и третичных) атомах углерода в общем случае не являются устойчивыми, таким образом, при окислении указанным способом фрагмента -CH2OH в положении 5 глюкопиранозного кольца в бета-D-глюкозиде цитокинина, оксигруппы, в положениях 2, 3 и 4 глюкопиранозного кольца в общем случае не потребуют защиты. Группа -SH, которая должна присутствовать в качестве группы R2 или R8, обычно требует защиты при таком окислении, и защиту такой группы -SH удобно осуществить в виде бензильного производного (см. далее в связи с методом Б, который рассматривается ниже).
Многочисленные глюкозиды цитокинина, которые могут использоваться в качестве исходных материалов в рассматриваемом методе, являются доступными на рынке; например, многие из этих соединений поставляются фирмой Apex Organics Ltd, Лейчестер, Англия, а некоторые 9-глюкозиды цитокинина могут быть получены от фирмы Sigma Chemical Company, P.O. box 14508, St. Louis, МО 63178. USA. Гликозиды цитокинина можно также получить известными способами, приведенными в литературе. Например, синтез ряда 9-глюкозидов цитокинина, держащих группы R6, охватываемые настоящим изобретением, можно осуществить непосредственно по методу, описанному Cowley et al. (Aust. J.Chem., 31 (1978) 1095) для синтеза 9-бета-D-глюкопиранозидов цеатина и N6-бензиладенина.
Б) Синтезы по типу реакции Кенигса-Кнорра
Этот подход, который базируется на методе, разработанном В.Кенигсом и Е. Кнорром (Chem. Ber. 34 (1901) 957), включает взаимодействие метил (2,3,4-три-O-ацетил-алъфа-D- глюкопиранозилбромид)уроната (сокращенно MBTG; удобный метод его синтеза описан Bollenback et al., J. Amer. Chem. Soc. 77 (1955) 3310) со спиртовой или фенольной гидроксильной группой, меркаптогруппой (-SH) или расположенном в кольце атомом азота в ароматическом или ненасыщенном гетероциклическом фрагменте.
Этот подход, вероятно, представляет собой наиболее общий способ синтеза глюкуронидов цитокинина по настоящему изобретению (или глюкуронидов предшественников, которые достаточно легко превращаются в требуемые глюкурониды цитокинина), исходя из соответствующих цитокининов (или предшественников цитокинина, см. далее), и, как мы полагаем, может быть широко использован для получения соединений, описываемых общей формулой (1).
Общая методика заключается в следующем.
Соответствующий цитокинин или его предшественник (см. ниже), растворенный в таком растворителе, как N,N-диметилформамид (ДМФА), хинолин, пропиленкарбонат, метанол или диэтиловый эфир, взаимодействует с 1,25-2 молярными эквивалентами MBTG при температуре в интервале 25-100oC в течение от 3 до 96 час, предпочтительно в присутствии акцептора галогенида (бромида), такого как оксид серебра или карбонат серебра (в случае использования, например, ДМФА в качестве растворителя, растворитель сам часто является акцептором галогенида, и в этом случае добавление еще одного акцептора необязательно). В результате этой реакции образуется метиловый эфир промежуточного перацетилированного глюкуронида, который, как правило, выделяют и подвергают очистке; это можно осуществить, например, (i) испарением растворителя с последующей экстракцией остатка таким растворителем как хлороформ, удалением последнего из экстракта, очисткой полученного сырого промежуточного продукта перекристаллизацией и/или обычными методами колоночной хроматографии; или, например, (ii) выделением промежуточного соединения непосредственно из реакционной смеси путем обычной колоночной хроматографии с последующим удалением из нужных фракций растворителя, использованного в качестве элюента, и перекристаллизации сырого продукта,
В том случае, если требуемый конечный продукт по формуле (1) должен содержать глюкуронидный фрагмент в амидной форме (глюкуронамид), то превращение формы перацетилированного метилового эфира в амидную форму удобно проводить на этой стадии, что обычно осуществляется обработкой перацетилированного метилового эфира (преимущественно очищенного так, как это указано ранее) раствором безводного аммиака в абсолютном метаноле при низких температурах, в частности при температуре в интервале от 0oC до -10oC, или же, что тоже возможно, концентрированным (насыщенным) водным раствором аммиака приблизительно при комнатной температуре в течение 0,5-4 час. Затем глюкуронамид может быть выделен путем испарения раствора аммиака, например, в вакууме, и перекристаллизацией из подводящего растворителя или смеси растворителей, таком как 90%-ный этанол. Пример подобного превращения приведен в примере 1B данного описания, в котором получают N6-бензилиден-3-глюкуронамид (BA3GNamide) из соответствующего метилового эфира.
Далее, в случае использования методики, в которой исходят из предшественника цитокинина определенного типа, химические превращения, которые необходимо осуществить для превращения фрагмента предшественника цитокинина в соответствующий цитокининовый фрагмент, часто можно провести над метиловым эфиром перед проведением операции выделения свободного глюкуронамида. Например, синтез 9-глюкуронидов цитокинина (получение которых с применением метода каталитического окисления уже рассмотрено выше) можно обычно с удовлетворительным выходом провести, исходя из замещенного или незамещенного пурина, содержащего атом хлора в положении 6; указанное 6- хлорпроизводное можно превратить в метиловый эфир или соответствующий перацетилированный 9-глакуронид с помощью указанной выше общей методики с использованием MBTG, а затем 6-хлоргруппу можно легко превратить в требуемый фрагмент -NH-R6, вводя продукт из последней реакции во взаимодействие с соответствующим амином (R6-NH2), который обычно удобно генерировать in situ из гидрохлорида амина (R6-NH2•HCl) и избытка (преимущественно 2-4-кратного молярного избытка) подходящего основания, в частности, третичного алифатического амина, такого как триэтиламин, в подходящем полярном растворителе, таком как (C1-C4)алифатический спирт, при температуре в интервале 65-120oC. Сказанное иллюстрируется в методе 2 в примере 10 настоящего описания, в котором приводится методика синтеза N-бензилиден-9-глюкуронида (BA9GN) (в виде его натриевой соли) указанным способом.
Ацетильные группы в глюкуронидном фрагменте затем удаляют с помощью щелочного гидролиза, используя такое основание как водный раствор едкого натра, водно-метанольный или водно-этанольный раствор едкого натра или раствор аммиака в метаноле при температуре в интервале 0-25oC в течение от 0,5 до 6 час. Используя основания, например, одно из указанных выше годных или спиртовых растворов едкого натра, можно получить по этой методике (после нейтрализации избытка основания) соль соответствующего глюкуронида цитокинина, в то время как при использовании такого реагента, как метанольный раствор аммиака, с последующим удалением избытка аммиака испарением, получается амидная форма глюкуронида. Последнюю предпочтительно очищают обычными способами, такими как хроматография, в частности хроматография с обращенной фазой, и/или перекристаллизацией из подходящего растворителя, такого как органический растворитель, в частности 80-90%-ный водный этанол.
Очевидно, что если исходный цитокинин или предшественник цитокинина содержит несколько функциональных групп, которые способны реагировать с MBTG в условиях рассматриваемой реакции и которые должны быть сохранены без изменения в конечном глюкурониде по формуле (1), то такие функциональные группы должны быть предварительно защищены с помощью подходящих защитных групп; примерами таких реакционноспособных функциональных групп, которые могут присутствовать в исходных цитокининах, образующих соединения, соответствующие представленным формулой (1), являются (вместе с занимаемым ими положением, как указано в связи с общей формулой (1) (см. выше)): группы -OH или -SH , которые могут присутствовать в качестве заместителя R2; группы -OH или -SH, которые могут присутствовать в качестве заместителя R8; группы -OH или NH2, которые могут присутствовать в качестве заместителя в фенильном кольце группы R6, представляющей собой замещенную бензильную группу, оксигруппа или глюкозилоксигруппа, которая может присутствовать в виде заместителя R6 в группах типа замещенных (C1-C8)алкильных групп или замещенных (C2-C8)алкиленовых групп, рибозильная группа, 5-фосфорибозильная группа или глюкозильная группа, которые могут присутствовать в виде R9 или R7 групп; и группа -NH2 в группе -CH2CH(NH2)COOH, которая может присутствовать в виде заместителя R9.
Что касается защитных групп, пригодных для защиты приведенных выше примеров реакционноспособных функциональных групп, которые могут присутствовать в исходных цитокининах, то группу -OH обычно удобно защищать введением ацетильной группы (см. ранее в связи с окислительным способом получения соединения по формуле (1)) с образованием соответствующей ацетоксигруппы (-OCOCH3). Группу -SH обычно удобно защищать в виде производного бензилтиоэфира (-SCH2C6H5) путем введения бензильной группы (в частности, по реакции с бензилхлоридом, аналогичной той, которая детально рассматривается далее в связи с предшественниками цитокинина, которые содержат, по крайней мере формально, оксогруппу (=O) или тиоксогруппу (=S) в положении 2 и оксогруппу в положении 6 (см. далее)). Группу -NH2 обычно удобно защищать, превращая ее во фталимидную группу следующим образом: нагревают цитокинин или предшественник цитокинина с избытком фталевого ангидрида в относительно инертном растворителе, таком как хлороформ или 1,2-диметоксиэтан, при температуре в интервале 70-100oС в течение нескольких часов, обычно в течение 4 часов. Группа -NH2 может быть после проведения реакции по типу Кенигса-Кнорра регенерирована обработкой водно-спиртовым раствором (например водно-этанольным раствором) гидразина.
Группой предшественников цитокинина, которые особенно удобны для использования в синтезе глюкуронидов цитокинина до настоящему изобретению и в которых глюкуронидный фрагмент (соответствует группе F10 в соединении общей формулы (1)) присоединен в виде групп -O-R10 или -S-R10 в положении 2 пуринового кольца, являются предшественники цитокинина, которые содержат, по крайней мере формально, оксогруппу (=O) или тиоксогруппу (=S) в положения 2 и оксогруппу в положении 6; следует заметить, что соединения рассматриваемого типа, имеющие 2-оксогруппы и 2-тиоксогруппы, по крайней мере в растворе, обычно находятся в таутомерном равновесии с соответствующими 2-окси- и 2-меркаптопроизводными (6-оксогруппа в этом случае присутствует в виде 6-оксигруппы) и указанные таутомерные формы обычно присутствуют в значительной пропорции.
Указанные окси- и меркаптогруппы в положении 2 на конечной стадии всего процесса синтеза превращаются с помощью реакции Кенигса-Кнорра в соответствующие группы -O-R10 и -S-R10; однако перед проведением последовательности реакций по типу Кенигса-Кнорра 6-оксигруппу удобно превратить, через промежуточно образующуюся 6-галоидную (предпочтительно-6-хлор) группу, во фрагмент -NH-R6, указанный в формуле (1), а для этого необходимо защитить оксигруппу или меркаптогруппу в положении 2 подходящей защитной группой. Для обеих указанных групп защитной группой может быть бензильная группа, которую обычно можно ввести непосредственно в процессе реакции, включающей постепенное прибавление небольшого избытка хлористого бензила к перемешиваемому раствору или суспензии рассматриваемого предшественника цитокинина в водном растворе щелочи (обычно с pH приблизительно 12-13), таком как водный раствор едкого кали или едкого натра приблизительно при комнатной температуре. После непрерывного перемешивания в течение обычно 1-2 час реакционную смесь нейтрализуют прибавлением, например, ледяной уксусной кислоты, и нерастворимый, защищенный бензильной группой продукт выделяют фильтрованием,
6-оксигруппу полученного производного 2-бензилокси- или 2-бензилтиокси-6-пуринола затем превращают в 6-хлоргруппу, обычно используя избыток хлорирующего агента, такого как хлорокись фосфора в присутствии органического основания, такого как N,N-даэтиланилин; последнюю реакцию преимущественно проводят при кипячении с обратным холодильником в течение от 10 минут до 3 час.
6-хлоргруппу затем превращают в требуемый -NH-R6 фрагмент, вводя продукт последней реакции во взаимодействие с соответствующим амином, R6-NH2, который обычно генерируют in situ из гидрохлорида амина (R6-NH2•HCl) и избытка (преимущественно 2-4-кратного) подходящего основания, в частности третичного алифатического амина, такого как триэтиламин, в подходящем полярном растворителе, таком как (C1-C4) алифатический спирт (например, 1-бутанол), при температуре в интервале 65-120oC.
После выделения продукта защитную группу снимают, высвобождая 2-окси- или 2-меркаптогруппу; в случав использования в качестве защиты бензильной группы это удобно осуществлять, например, путем обработки полученного продукта избытком натрия в жидком аммиаке.
В случае продуктов, которые имеют на этой стадии 2-меркаптогруппу, перед введением глюкуронидного фрагмента по типу реакции Кенигса-Кнорра, рассмотренной ранее, представляется удобным превратить 2-меркаптогруппу в солевую форму (-S-). например, калиевую соль. Пример удобной методики такого типа описывается далее на стадии 4 рабочего примера 1E, и условия, указанные там, как нам кажется, носят весьма общий характер и могут быть использованы достаточно широко. Однако в некоторых случаях можно проводить реакцию Кенигса-Кнорра с использованием MBTG (см. далее и без предварительного превращения 2-меркаптогруппы в солевую форму,
Наконец, вводят глюкуронидный фрагмент взаимодействием с MBTG, как это уже рассмотрено ранее в связи с описанием реакции взаимодействия по типу Кенигса-Кнорра.
Пример, поясняющий последовательность операций при синтезе, рассмотренных выше, приведен в примере 1E для синтеза N6-(2'-изо-пентенил)аденин-2-тиоглюкуронида натрия (1P29GN), исходя из 2-тиоксантина, и большая часть информации, представленная там, касающаяся выбора растворителей при перекристаллизации и экстракции, выбора концентраций и количеств реагентов и т.д. , как нам кажется, имеет более общее применение при осуществлении последовательности операций, указанных ранее, исходя из предшественника цитокинина, содержащего "2-тиоксо"группу (т.е. 2-меркаптогруппу) и "6-оксо"группу (т.е. 6-оксигруппу).
Аналогично, группой предшественников цитокинина, которые весьма удобны для использования в синтезе глюкуронидов цитокинина по настоящему изобретению и которые содержат глюкуронидный фрагмент (соответствующий группе R10 в общей формуле (1)), присоединенный в виде групп -O-R10 или -S-R10 в положении 8 пуринового кольца, являются предшественники цитокинина, которые содержат, по крайней мере формально (по тем же самым причинам, аналогичным указанным выше применительно к предшественникам цитокинина, содержащим формально 2-оксо- и 2-тиоксогруппу и формально 6-оксогруппу), оксо- (=O) или тиоксогруппу (= S) в положении 8, и которые также имеют оксигруппу в положении 6. Эти соединения могут быть в общем случае превращены в требуемые конечные продукты по формуле (1) при использовании последовательности реакций (защита, введение 6-хлоргруппы, введение фрагмента -N-R6 и наконец проведение реакции с MBTG, аналогично описанной для случая глюкуронидов цитокинина, у которых глюкуронидный фрагмент присоединен в виде групп -O-R10 или -S-R10. Пример такого рода превращений представлен в примере 1F в настоящем описании для случая синтеза N6-(2'-изо-пентенил)-аденин-8-тиоглюкуронида (в виде натриевой соли).
Соединения по формуле (1), в которых глюкуронидный фрагмент представлен в форме карбоновой кислоты, могут быть в общем случае получены из соответствующих солей, например, натриевых солей (способ получения которых уже рассмотрен ранее), подкислением при перемешивании раствора или раствора/суспензии солевой формы в подходящем растворителе (например, в водном растворе спирта, таком как водный этанол), преимущественно при температуре ниже 25oC, минеральной кислотой, такой как соляная кислота, до pH приблизительно 2,5. После перемешивания в течение нескольких минут, растворитель удалят в вакууме. Сырой продукт можно преимущественно подвергнуть хроматографической обработке с целью удаления неорганических солей (детальное описание типичной методики и подходящего для этой цели хроматографического субстрата см. в частности, в примере II в данном описании), после чего продукт можно перекристаллизовать из подходящего растворителя, обычно полярного растворителя, такого как метанол или этанол.
Соединения по формуле (1), в которых глюкуронидный фрагмент представлен в форме метилового эфира или этилового эфира, могут быть в общем случае получены с высоким выходом по реакции соответствующего глюкуронида цитокинина в форме карбоновой кислоты (полученного, например, как указано ранее) с диазометаном или диазоэтаном, соответственно, используя условия реакции, которые являются обычными для проведения подобных превращений и которые хорошо известны специалистам.
Многочисленные цитокинины и предшественники цитокининов, пригодные для использования в качестве исходных материалов по методу Б, являются доступными, а другие могут быть синтезированы известными способами, описанными в литературе, Например, синтез разнообразных соответствующих N6-замещенных аденинов, содержащих группы R6, которые охватываются настоящим изобретением, может быть осуществлен по способу, описанному Iwamura et al. (Phytochemistry 19 (1980) 1309), а ряд 2-, 8- и 2,8-замещенных N6-(2'-изо-пентенил)аденинов, содержащих группы R2 и/или R8, которые попадают под определения настоящего описания, могут быть получены, как описано Damman et al., ( Phytochemistry 13 (1974) 329).
Предпочтительными примерами соединений по формуле (1) являются сведущие соединения:
соединение по формуле (1), в котором R2 является атомом водорода, R3 является бета-D-глюкопиранозильной группой или солью по ее карбоксильной группе, R9 и X являются половинками связи, которые вместе образуют целую связь, R6 является бензильной группой, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода;
соединение по формуле (1), в котором R2 является атомом водорода, R3 является амидным производным бета-D-глюкопиранозильной группы по ее карбоксильной группе, R9 и X являются половинками связи, которые вместе образуют целую связь, R6 является бензильной группой, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода;
соединение по формуле (1), в котором R2 является атомом водорода, R3 и X являются половинками связи, которые вместе образуют целую связь, R9 является бета-D-глюкопиранозильной группой или солью по ее карбоксильной группе, R6 является бензильной группой, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода;
соединение по формуле (1), в котором R2 является атомом водорода, R3 является бета-D-глюкопиранозильной группой или солью по ее карбоксильной группе, R9 и X являются половинками связи, которые вместе образуют целую связь, R6 является 2-изо-пентенильной группой, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода;
соединение по формуле (1), в котором R2 является бета-глюкопиранозильной группой или солью по ее карбоксильной группе, R9 является атомом водорода, R3 и X являются половинками связи, которые вместе образуют целую связь, R6 является 2-изо-пентильной группой, и R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода;
соединение по формуле (1), в котором R2 является атомом водорода, R9 является атомом водорода, R3 и X являются половинками связи, которые вместе образуют целую связь, R6 является 2-изопентенильной группой, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является бета-D-глюкопиранозильной группой или солью по ее карбоксильной группе; и
соединение по формуле (1), в котором R2 является атомом водорода, R3 и X являются половинками связи, которые вместе образуют целую связь, R9 является атомом водорода, R6 является группой формулы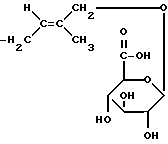
или ее солью, R7 и Y являются половинками связи, которые вместе образуют целую связь, R8 является атомом водорода.
Синтез соединений общей формулы (II) по настоящему изобретению.
Соединения общей формулы (II) по настоящему изобретению могут быть получены непосредственно из легко синтезируемого метилового эфира о-кумариновой кислоты (т. е. 3-(2-оксифенил)-2-пропановой кислоты). Последний эфир можно приготовить кипячением свободной кислоты (получаемой, например, от фирмы Aldrich Chemical Company, Гиллингэм, Дорсет, Англия, номер по каталогу H2, 280-9) с обратным холодильником в метаноле в присутствии серной кислоты. Следует заметить, что получается смесь цис- и транс-форм (по отношению к кратной этиленовой связи) соответствующего фрагмента. Мы полагаем, что транс-форма превалирует независимо от метода получения. Однако это не является существенным, поскольку было показано, что как цис- (кумаринил), так и транс- (кумарил) глюкурониды нацело превращаются в кумарин после гидролиза под действием GUS, вследствие того, что кумариновая кислота в течение нескольких дней медленно превращается (неферментативно; вероятно, при каталитическом воздействии света) в кумарин.
Эффективными способами синтеза соединений по формуле (II), в которых (a) группы R1 и R10 содержатся в форме карбоновых кислот и (б) группы R1 и R10 содержатся в амидной форме, подробно описаны в примерах 1H и 11, соответственно. Соединения по формуле (II), в которых как группа R1 так и группа R10 присутствуют в форме натриевых солей, удобно получать щелочным гидролизом метилового эфира перацетилированных глюкуронидов (получаемых (из метил-о-кумарата) и выделяемых аналогично первой части методики синтеза, описанной в примере 11), используя метанольный раствор едкого натра, аналогично способу, описанному в начале второй части методики синтеза, приведенной в примере 11; вместо доведения pH гидролизата до 2,5 с помощью соляной кислоты, как описано в примере 11, смесь умеренно нейтрализуют (до pH приблизительно 7) соляной кислотой. Продукт в форме натриевой соли выделяют из смеси хроматографически, например, на неионной смоле Amberlite XAD-2, при этом колонку промывают водой, чтобы удалить неорганические соли, а затем обычно элюируют метанолом. Сырой глюкурогид в форме натриевой соли, который получают после удаления метанола, может быть далее перекристаллизован, например, из абсолютного метанола. Очевидно, что калиевую соль можно получить по той же самой методике, используя при гидролизе, например, метанольный раствор едкого кали.
Соединения по формуле (II), в которых обе группы R1 и R10 присутствуют в форме метилових эфиров или этиловых эфиров, удобно получать взаимодействием, соответственно, даазометана или диазоэтана с соединениями по формуле (II), в которых обе группы R1 и R10 присутствуют в форме карбоновых кислот. Условия проведения процесса преимущественно будут такими же, что и при получении метиловых или этиловых эфиров глюкуронидов цитокинина.
Предпочтительными соединениями по общей формуле (II) являются следующие:
соединение по формуле (11), в котором R1 является цис- и/или транс-2-амидоэтинильной группой (цис- и/или транс-CH= CHCONH2), a R10 является амидным производным бета-D-глюкопиранозильного заместителя по его карбоксильной группе (2-оксициннамил-бета-D-глюкопиранурамид);
соединение по формуле (II), в котором R1 является цис-2-карбоксиэтинильной группой (цис-CH= CHCOOH), а R10 являемся бета-D-глюкопиранозильной группой (2-оксициннамил-бета-D-гликопирануроновая кислота).
Приводимые ниже примеры поясняют общие принципы по настоящему изобретению применительно к растениям, в частности с использованием бета-глюкуронидазы в качестве селективного гена новых глюкуронидных субстратов, которые способны гидролизоваться под действием указанного гена. Основываясь на результатах данной работы, предполагается также, что гены, подобные гену бета-глюкуронидазы, могут быть использованы для родственных применений. Так, ген глюкуронидазы можно использовать в методе, предусматривающем получение эффекта локализованного регулирования роста или регулирования роста специфических тканей в части растения или его тканях, в которых действие введенного гена бета-глюкуронидазы проявляется сильнее, чем в других частях или тканях в том же самом растении; указанный метод состоит в обработке растения соединением, которое способно гидролизоваться введенным геном бета-глюкуронидазы, так что указанное соединение гидролизуется в какой-либо части или тканях, содержащих введенный ген бета-глюкуронидазы, выделяя при этом в тканях соединение, регулирующее рост, что приводит к возрастанию стимулирущего рост воздействия только в этой части или тканях растения или к такому возрастанию стимулирующего рост воздействия в этой части или тканях растения, которое значительно превосходит эффект, который достигается в других частях или тканях этого растения. Предполагается, что предпочтительнее использовать регуляторы роста растений, такие как питокинин, в виде глюкуронидов или производных глюкуронида, а не в виде свободного цитокинина, в частности для достижения преимущества, состоящего в том, что они, вероятно, будут транспортироваться или распределяться в растениях иначе, чем, например, соответствующие свободные или рибозилированные цитокинины.
В приводимых далее примерах, предлагаются другие варианты использования бета-глюкуронидазы. Одним из них является способ отбора и идентификации в условиях in vitro глюкуронидных соединений цитокинина (или глюкуронидных соединений других регуляторов роста), которые способны гидролизоваться в условиях in vivo под действием введенного гена бета-глюкуронидазы. Бета-глюкуронидазу можно далее использовать в системах, предусматривающих отбор соединений, которые пригодны в качестве селективных агентов в методе позитивной селекции, который рассматривается в данном описании (см. пример 2). В примерах 3 и 12 рассматриваются системы, которые могут быть применены для отбора соединений, избирательно ингибирующих природный фермент бета-глюкуронидазу в клетках растений и не оказывающих значительного воздействия на фермент, кодируемый введениям геном бета-глюкуронидазы.
Пример1.
Синтез глюкуронидных соединений.
Ниже приводятся методики синтеза ряда новых глюкуронидных соединений. В добавление к принятым сокращениям названий индивидуальных соединений, используются также следующие сокращения:
БА N6-бензиладенин
AcOH уксусная кислота
ДМФА N,N-диметилформамид
ИП N6-(2-изопентинил)аденин
MBTG метил(2,3,4-три-O-ацетил-альфа-D-глюкопиранозилбромид)уронат
Пример 1A.
3-бета-D-глюкопирануронозил-6-бензиламинопурин, натриевая соль
Синонимы: N6-бензиладенин-N3-бета-D-глюкопирануроновая кислота, натриевая соль,
N6-бензиладенин-3-глюкуронид, натриевая соль.
Сокращение: BA3GN натриевая соль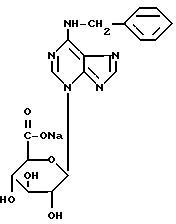
Конденсация N6-бензиладенина (БА) и метил(2,3,4-три-O-ацетил-альфа-1)-глюкопиранозилбромид)уроната (MBTG)
БА (12, 6 ммол) и MBTG (15,1 ммол) (Bollenback et al., J.Amer. Chem. Soc. , Vol. 77, 1955. pp. 331O-3315) суспендируют в безводном ДМФА (50 мл) и нагревают до 100oC в течение приблизительно 10 час. Большую часть ДМФА удаляют в вакууме и полученный сырой продукт растворяют в хлороформе (300 мл) и промывают водой (3 х 300 мл). После осушки над безводным сульфатом магния хлороформенный экстракт упаривают в вакууме и полученное масло темного цвета перекристаллизовывают из этанола. Сырой продукт (смесь БА, BA9GN и BA3GN в виде их перацетилированных метиловых эфиров) очищают на колонке со 100 г силикагеля и градиентно элюируют смесями хлороформа и 0-4% этанола. Сырой перацетилированный метиловый эфир BA3GN перекристаллизовывают из метанола. Получено 280 мг бесцветного аморфного вещества.
Перацетилированный метиловый эфир BA3GN гидролизуют обработкой 5%-ным раствором едкого натра в 50%-ном водном растворе этанола при комнатной температуре. Через пять минут после растворения твердого вещества реакционную смесь осторожно нейтрализуют соляной кислотой при охлаждении льдом. После сушки в вакууме сырую натриевую соль BA3GN очищают хроматографией с обращенной фазой (с 100 г октадецилсиликагеля), элюируя продукт водой (1 л), а затем 20%-ным водным раствором метанола с последующей перекристаллизацией из этанола. Чистая натриевая соль BA3GN (150 мг) получается в виде бесцветного мелкокристаллического твердого вещества, которое сушат до постоянного веса в вакууме над хлористым кальцием (табл. А).
Полученные результаты идентичны для приведенных в литературе данных для БА-3-бета-D-глюкопиранозида и N3, N6 дизамещенного аденина. (N.J. Leonard, K. L. Carraway and J.P. Helgeson, J.Heterocyclic Chem., Vol.2, 1965. 291-297).
Жидкостная хроматография высокого разрешения (ЖХВР).
ЖХВР проводят с использованием колонки 10 х 0,46 см с октадецилсиликагелем, изократично элюируя 60%-ным водным раствором метанола, содержащим 10% уксусной кислоты, со скоростью 1 мл/мин. Контроль проводят по УФ-детектору на длине волны 290 нм.
Полученная натриевая соль BA3GN имеет чистоту не менее 95%; содержание свободного БА оценивается на уровне < 0,05%.
Гидролиз под действием бета-глюкуронидазы (GUS).
Натриевую соль BA3GN (500 мкг) в 500 мкл 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с бета-глюкуронидазой (GUS, фирма Sigma, тип G7896), 2500 единиц Sigma по "Фишману", в течение 18 час при температуре 37oC. ЖХВР (условия указаны выше) показывает практически полное исчезновение пика BA3GN одновременно с появлением пика соединения, которое хроматографируется вместе из смеси 1:1 с аутентичным образцом БА. Таким образом, поддерживается идентичность продукта как производного БА и бета-D-глюкуроновой кислоты.
Следующий анализ проведен для другой порции натриевой соли BA3GN, получение которой описано выше.
УФ-спектр
Этанол Amax 297 нм
ЖХВР
15 х 0,46 см колонка с октадецилсиликагелем, градиентное элюирование 20-60% метанол/10% уксусная кислота в течение 30 минут со скоростью 1 мл/мин. Чистота по данным хроматографии 99,5%; содержание свободного БА < 0,05%.
Тонкослойная хроматография (ТСХ).
Анализ проводят на силикагеле, элюируя смесью 1-бутанол/уксусная кислота/вода (12/8/5). Чистота по данным ТСХ составляет 99,5%. Содержание свободного БА < 0,05%.
Гидролиз под действием бета-глюкуронидазы (GUS).
Натриевую соль BA3GN (500 мкг) в 500 мкл 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с бета-глюкуронидазой (GUS, фирма Sigma, тип G7896), 2500 единиц Sigma по "Фишману", в течение 12 часов при температуре 37oC. ЖХВР и тонкослойная хроматография показывают практически полное (> 99%) исчезновение пика BA3GN с образованием соединения, которое хроматографируется вместе из смеси 1:1 с аутентичным образцом БА.
Пример 1B.
3-бета-D-глюкопирануронамид-6-бензиламинопурин.
Синонимы: N6-бенэиладенин-N3-бета-D-глюкопирануронамид
N6-бензиладенин-3-глюкуронамид
Сокращение: BA3GN амид
Перекристаллизованный перацетилированный метиловый эфир BA3GN (1,5 г), полученный как указано в примере 1A, суспендируют в абсолютном метаноле (200 мл) и охлаждают до 0oC. Прибавляют еще некоторое количество метанола (400 мл), насыщенного аммиаком при -10oC, и смесь перемешивают при охлаждении льдом. Вновь прибавляют охлажденный льдом абсолютный метанол до тех пор, пока твердое вещество полностью не растворится. Реакционную смесь перемешивают при охлаждении льдом еще в течение 3 час. Избыток аммиака и метанола удаляют в вакууме и полученный продукт тщательно растирают с горячим этанолом, получая бесцветное твердое вещество (1,3 г).
BA3GN амид, как и другие аденин-3-глюкозиды, лишь частично растворяется в воде и спирте, но растворяется на уровне 2,4 мг/мл в 50%-ном метаноле, содержащем 25% уксусной кислоты.
Анализ.
Тонкослойная хроматография (ТСХ) (силикагель - хлороформ/метанол/ледяная уксусная кислота, 50/50/5).
Единственное пятно (Rf 0,36) без каких-либо обнаруживаемых примесей при загрузке 50 мкг. Чистота не менее 98%. Не обнаруживается (<1%) перацетилированный метиловый эфир BA3GN (Rf 0,89) или BA3GN (Rf 0,02).
ТСХ (силикагель - хлороформ/метанол, 9/1).
Данный анализ используется для определения содержания БА. BA3GN амид при загрузке 192 мкг не обнаруживает присутствие 6-бензаденина. Таким образом, содержание БА составляет не более 0,2%.
Пример 1C.
9-бета-D-глюкопирануронозил-6-бензиламинопурин, натриевая соль
Синонимы: N6-бензиладенин-N9-бета -3-глюкопирануроновая кислота, натриевая соль,
N6-бензиладенин-9-глюкуронид, натриевая соль.
Сокращение: BA3GN натриевая соль
Синтез.
Способ 1. Каталитическое окисление N6-бензиладенин-9-бета-D-глюкопиранозида (BA9G)
BA9G (50 мг) суспендируют в смеси 50 мМ раствора бикарбоната натрия (25 мл) и платиновой черни (200 мг). Смесь нагревают до 80oC на водяной бане и энергично продувают кислород. Затем при интенсивном перемешивании прибавляют еще 100 мг платинового катализатора. Через 4 час прибавляют еще 100 мг платинового катализатора. Приблизительно с выходом более 95% через 20 часов обработки BA9G превращается в соответствующую 9-бета-D-глюкопирануроновую кислоту и некоторое количество БА. Смесь нейтрализуют и полученную натриевую соль BA9G очищают хроматографией с обращенной фазой (с 20 г октадецилсиликагеля), элюируя 200 мл воды, а затем 20%-ным раствором метанола.
Чистую натриевую соль BA9G, свободную от глюкозида и БА, сушат в вакууме над хлористым кальцием и получают бесцветное вещество.
Способ 2. Конденсация 6-хлорпурина и метил(2,3,4-три-O-ацетил-альфа-D-глюкопиранозилбромид)уроната (MBTG)
6-хлорпурин (высушенный над пятиокисью фосфора, 1,13 г), MBTG (3,87 г) и свежепрокаленный карбонат калия (1,5 г) перемешивают в безводном пропиленкарбонате (30 мл) в течение 24 час при комнатной температуре. Полученную темную смесь фильтруют и очищают колоночной хроматографией на силикагеле (100 г), градиентно элюируя 0-80% раствором этилацетата в хлороформе. Основную фракцию (в которой не содержится непрореагировавший 6-хлорпурин) высушивают и перекристаллизовывают из кипящего этанола, получая метил 6-хлорпурин-9-(2', 3', 4'-три-O-ацетил-бета-D-гликопирануронат) в виде твердого вещества бледно-желтого цвета (450 мг), которое сушат в вакууме над пятиокисью фосфора. ЖХВР указывает на чистоту не менее 95%.
Метил 6-хлорпурин-9-(2',3',4'-три-O-ацетил-бета-D-глюкопирануронат) (312 мг) и бензиламин (171 мкл) нагревают совместно в 1-бутаноле (13,5 мл) при 100oC в течение 1 час. Твердое вещество легко растворяется с образованием прозрачного раствора желтого цвета. Большую часть бутанола удаляют в вакууме и получают твердое вещество беловатого цвета, которое встряхивают с 5%-ным раствором едкого натра в 50%-ном этаноле (25 мл) при комнатной температуре в течение 1-2 час. После нейтрализации продукт сушат в вакууме для удаления остатков бутанола и полученную натриевую соль BA9GN очищают хроматографией с обращенной фазой, как описано в способе 1.
Чистый продукт сушат в вакууме над хлористым кальцием и пятиокисью фосфора и получают бесцветное твердое вещество (210 мг), которое хроматографируется вместе с BA9GN, полученным при каталитическом окислении.
Анализ натриевой соли BA9GN, подученной по реакции конденсации, способ 2 (табл. Б).
Полученные результаты согласуются со структурой N6, N9-дизамещенного аденина. Коэффициенты экстинкции практически совпадают со значениями для чистого BA9GN, что указывает на отсутствие примесей, непоглощающих в УФ-области. Чистота по данным спектров УФ составляет не менее 95%.
ЖХВР.
Колонка с октадецилсиликагелем 10 х 0,46 см, УФ-детектор на длине волны 270 нм. Изокритическая (50% метанол/0,2 М уксусная кислота, 2 мл/мин) и градиентная ЖХВР (0-60% метанол/0,2 М уксусная кислота, 2 мл/мин) показывает острый симметричный пик BA9GN, который элюируется чуть раньше соответствующего глюкозида. BA9GN, полученный по реакции конденсации, совместно хроматографируется из смеси 1:1 при ЖХВР (градиентной и изократической) с BA9GN, полученным при каталитическом окислении. Это свидетельствует о том, что BA9GN, полученный по реакции конденсации, является изомером бета-D-глюкопиранозила. BA9GN не содержит обнаруживаемых количеств (<2%) альфа-аномера или других примесей, в том числе БА. Чистота по данным ЖХВР составляет не менее 98%.
ТСХ (силикагель-хлороформ/метанол, 9/1).
Метод используется для определения примеси БА в полученном BA9GN. BA9GN не сдвигается со старта в указанной системе. Минимальный уровень обнаружения БА составляет 200 нг. При загрузке BA9GN 200 мкг наличие БА не обнаруживается. Чистота но данным ТСХ составляет не менее 98%. Содержание БА не превышает 0,1%.
Кислотный гидролиз.
Минеральная кислота превращает глюкозид цитокинина в соответствующее свободное цитокининовое основание. После обработки натриевой соли BA9GN (1 мг/мл) 1M раствором соляной кислоты при 100oC в течение 12 час полученный продукт дает по данным ТСХ одно пятно, которое хроматографируется вместе с аутентичным образцом БА. Этот тест показывает, что BA9GN является лабильным в кислотных условиях продуктом связывания БА.
Ферментативный гидролиз.
Натриевую соль BA9GN (500 мкг) в 500 мкл 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с бета-глюкуронидазой, полученной от фирмы Sigma (GUS, тип G 7896), 2500 единиц Sigma no "Фишману", в течение 18 час при температуре 37oC. ЖХВР и ТСХ не показывают образование БА. Дальнейшее выдерживание при комнатной температуре в течение 3 дней также показывает отсутствие гидролиза. Таким образом, BA9GN не подвержен гидролизу бета-глюкуронидазой.
Пример 1D.
3-бета-D-глюкопирануронозил-6-(3-метил-бут-2-ениламино)пурин, натриевая соль
Синонимы: N6-(2'-изо-пентенил)аденин-N3-бета-D-глюкопирануроновая кислота, натриевая соль,
N6-(2'-изо-пентенил)аденин-3-глюкуронид, натриевая соль.
Сокращение: IP3GN натриевая соль
Синтез.
N6-(2-изо-пентенил)аденин (9,48 г) и MBTG (22,1 г) нагревают в безводном ДМФА (170 мл) до 100oC в течение 12 час. Большую часть ДМФА удаляют в вакууме при нагревании на водяной бане и полученный охлажденный сироп растворяют в хлороформе (500 мл), Хлороформенный раствор промывают водой (3 х 500 мл) и органическую фазу сушат над безводным сульфатом натрия. Большую часть хлороформа упаривают в вакууме и оставшийся сироп очищают хроматографически на силикагеле с градиентом от 0 до 3,75% метанола в хлороформе. Сырой перацетилированный метиловый эфир IP3GN перекристаллизовывают из метанола, одновременно обесцвечивая активированным углем, и получают чистый бесцветный перацетилированный метиловый эфир IP3GN (3,2 г), который сушат в вакууме над хлористым кальцием. Часть перацетилированного метилового эфира IP3GN (1,2 г) гидролизуют, растворяя приблизительно в 1 л 75%-ного водного раствора метанола, содержащего 5% едкого натра, при перемешивании в течение 10 минут при комнатной температуре. Смесь охлаждают в бане со льдом, осторожно нейтрализуют соляной кислотой и упаривают в вакууме до образования сиропа. Сырой продукт очищают хроматографически последовательно сначала на колонке со смолой XAD-2, а затем октадецилсиликагелем и получают натриевую соль IP3GN (810 мг) в виде бесцветного микрокристаллического вещества, которое сушат над хлористым кальцием.
Растворимость натриевой соли IP3GN в воде составляет 2 мг/мл.
Анализ.
ТСХ (силикагель-1-бутанол/ледяная AcOH/вода, 12/3/5)
Натриевая соль IP3GN дает на хроматограмме одно компактное пятно (Rf 0,32) при загрузке 100 мкг; присутствие
N6-(2-изо-пентинил)аденина (Rf 0,66) или других примесей не обнаружено. Чистота не менее 99,5%.
Гидролиз под действием бета-глюкуронидазы (GUS).
Натриевую соль IP3GN (500 мкг) в 500 мкл 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с бета-глюкуронидазой (GUS, фирма Sigma, тип G 7896), 2500 единиц Sigma по "Фишману", в течение 12 час при температуре 37oC. Анализ ТСХ указывает на исчезновение проявляющегося в УФ-пятна, соответствующего IP3GN, и появление пятна нового соединения, которое хроматографируется вместе с аутентичным образцом N6-(2-изо-пентенил)аденина.
Пример 1E.
6-(3-метил-бут-2-ениламино)пурин-2-ил-1-тио-бета-D -глюкопирануроновая кислота, натриевая соль
Синонимы: N6-(2'-изо-пентенил)аденин -2-тиоглюкопирануроновая кислота, натриевая соль,
N6-(2'-изо-пентенил)аденин-2-тиоглюкуронид, натриевая соль.
Сокращение: IP2SGN натриевая соль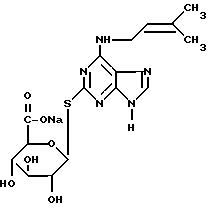
Синтез.
1) 2-бензилтио-6-пуринол
Хлористый бензил (1,4 мл) прибавляют по каплям при энергичном перемешивании к раствору 2 г 2-тиоксантина в 12 мл 1 M раствора едкого натра, разбавленного водой до 140 мл. По окончании прибавления образуется осадок кремового цвета. Реакционную смесь перемешивают еще в течение часа при комнатной температуре и фильтруют. Полученное твердое вещество тщательно промывают водой и оставляют сушиться на ночь в вакууме над хлористым кальцием, а затем до постоянного веса над пятиокисью фосфора. Полученный продукт (2 г) без перекристаллизации используют на следующей стадии.
2) 2-бензилтио-6-хлорпурин.
К 2-бензилтио-6-пуринолу (2 г) прибавляют смесь хлорокиси фосфора (20 мл) и даэтиланилина (2 мл). Смесь при перемешивании кипятят с обратным холодильником в течение часа, охлаждают и выливают на лед (100 г). Образовавшийся осадок желтого цвета отфильтровывают, тщательно промывают водой и сушат в вакууме. Сырой продукт перекристаллизовывают из метанола и получают твердое вещество светло-кремового цвета (1,2 г), которое сушат до постоянного веса над пятиокисью фосфора.
3) 2-бензилтио-N6-(2-изо-пентенил)аденин.
Смесь 2-бензилтио-6-хлорпурина (1,2 г) и гидрохлорида изо-пентениламина (1,04 г) в 1-бутаноле (25 мл), содержащем триэтиламин (2,2 мл) нагревают в запаянной трубке при температуре 110oC в течение 2 час. Бутанол удаляют в вакууме и смесь встряхивают с ледяной водой (100 мл). Продукт отфильтровывают, перекристаллизовывают из этанола, одновременно обесцвечивая активированным углем, и сушат в вакууме над пятиокисью фосфора. Выход 2-бензилтио-N6-(2-изо-пентенил)аденина в виде бесцветного твердого вещества составляет 1,3 г. Полученное вещество без дальнейшей очистки используют на следующей стадии.
4) 2-тио-N6-(2-изо-пентенил)аденин
2-бензилтио-N6-(2'-изо-пентенил)аденин (0,64 г) растворяют в жидком аммиаке (62,5 мл) с образованием прозрачного желтого раствора. Небольшими порциями прибавляют натрий (приблизительно 200 мг), пока устойчивая голубая окраска не будет сохраняться в течение 10 мин. Для удаления избытка натрия осторожно прибавляют небольшое количество хлорида аммония и дают аммиаку испариться. К остатку прибавляют диэтиловый эфир (65,5 мл) и экстрагируют эфирный раствор водой (62,5 мл). Водную фазу подкисляют до pH от 4 до 5 уксусной кислотой, при этом образуется кремовый осадок. После охлаждения продукт отфильтровывают и сушат в вакууме над пятиокисью фосфора. Выход 340 мг.
Неочищенный 2-тио-N6-(2-изо-пентенил)аденин переводят в его калиевую соль суспендарованием в воде и прибавлением эквимолярного количества едкого калия и необходимого для обеспечения растворения количества спирта. Полученный раствор упаривают в вакууме над пятиокисью фосфора.
5) N6-(2'-изо-пентенил)аденин-2-тиогликопирануронид
Калиевую соль 2-тио-N6-(2-изо-пентенил)аденина (2,89 ммол) растворяют в абсолютном метаноле и прибавляют MBTG (5 ммол). Смесь перемешивают в течение 24 ч при комнатной температуре; в течение указанного времени выпадает кремово-белый осадок. Смесь упаривают в вакууме и гидролизуют при комнатной температуре обработкой 5%-ным водным раствором едкого натра (50 мл) и выделяют свободный глюкопирануронид в виде его натриевой соли. Смесь нейтрализуют при охлаждении осторожным прибавлением концентрированной соляной кислоты и получают бесцветный осадок натриевой соли IP2SGN.
Полученный продукт очищают хроматографией с обращенной фазой, перекристаллизовывают из этанола и сушат в вакууме над хлористым кальцием, получая бесцветное аморфное вещество (150 мг). Полученный продукт умеренно растворим в 50%-ном водно-спиртовом растворе (табл. В).
УФ-спектр IP2SGN является типичным для 2-тиозамещенных цитокининов и очень похож на спектр аутентичного образца 2-метилтио-N6-(2-изо-пентенил)аденина. УФ-анализ подтверждает, что продукт является производным 2-N6-замещенного аденина.
ЖХВР.
При проведении ЖХВР используют 15 х 0,46 см колонку с октадецилсиликагелем и проводят в течение 30 минут градиентное элюирование 0-60%-ным метанолом, содержащим 0,2 M уксусную кислоту, со скоростью 1 мл/мин. Контроль осуществляют УФ-детектором на длине волны 270 нм.
IP2SGN имеет чистоту не менее 98% и не содержит 2-тио-N6-(2-изо-пентенил)аденина в пределах обнаружения метода анализа (<0,1%).
Гидролиз под действием бета-глюкуронидазы (GUS).
Натриевую соль IP2SGN (500 мкг) в 500 мкл 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с бета-глюкуронидазой (GUS, фирма Sigma, тип G7896), 2500 единиц Sigma по "Фишману", в течение 48 час при температуре 37oC. Анализ по данным ЖХВР (условия указаны выше) показывает частичное превращение (65%) IP2SGN с образованием пика вещества, которое хроматографируется вместе из смеси 1:1 с 2-тио-N6-(2-изо-пентенил)аденином. Этот анализ подтверждает, что натриевая соль IP2SGN, являющаяся продуктом взаимодействия 2-тио-N6-(2-изо-пентенил)аденина и бета-D-глюкуроновой кислоты, лишь частично подвергается гидролизу под действием GUS.
Пример 1F.
6-(3-метил-бут-2-ениламино)пурин-8-ил-1-тио-бета-D-глюкопирануроновая кислота, натриевая соль.
Синонимы: N6-(2'-изо-пентенил)аденин-8-тиоглюкопирануроновая кислота, натриевая соль, N6-(2'-изо-пентенил)аденин-8-тиоглюкуронид, натриевая соль.
Сокращение: IP2SGN натриевая соль
Реакция 1. 6-окси-8-тиопурин.
Сульфат 4,5-диамино-6-оксипиримидана (25 г) и тиомочевину (100 г) смешивают и нагревают в течение 30 минут на масляной бане при температуре 200oC. Охлажденный заставший продукт растворяют в горячем 1M растворе NaOH (500 мл), кипятят с активированным углем и отфильтровывают. Горячий фильтрат подкисляют, получая твердое вещество красного цвета, которое переосаждают из горячего щелочного раствора, хорошо промывают водой и сушат в вакууме при 80oC. Выход составляет 5,28 г (табл.Г).
Реакция 2. 6-окси-8-бензилтиопурин.
5,28 г 6-окси-8-тиопурина суспендируют в 78,5 мл 1M NaOH и разбавляют водой до 400 мл. Прибавляют 3,7 мл хлористого бензила и полученную смесь энергично перемешивают при комнатной температуре в течение 3 час, доводят pH до 5 с помощью ледяной уксусной кислоты и отфильтровывают. Полученный продукт тщательно промывают водой и оставляют сушиться на ночь в вакууме при температуре 80oC, получая 7,33 г красновато-розового твердого вещества, которое используют без дальнейшей очистки.
Реакция 3. 6-хлор-8-бензилтиопурин.
6-окси-8-бензилтиопурин (7,33 г) прибавляют к смеси хлорокиси фосфора (70 мл) и N,N-диэтиланилина (7,5 мл) и кипятят полученную смесь с обратным холодильником в течение 2 час, получая продукт темно-красного цвета. Смесь упаривают в вакууме и образовавшийся сироп медленно выливают при перемешивании на лед (400 г). Дают смеси отстояться в течение 15 минут, затем сильно подщелачивают холодным концентрированным раствором KOH. Растирают тщательно смесь для растворения большей части масла и подкисляют при охлаждении льдом до значения pH 1, медленно прибавляя холодную концентрированную соляную кислоту.
Оставляют на 1 час при комнатной температуре и отфильтровывают продукт, промывают его тщательно водой и сушат в вакууме в течение 2 час при 80oC, получая 7,8 г продукта.
Реакция 4. 8-бензилтио-N6-(2'-изо-пентенил)аденин.
Смесь 6-хлор-8-бензилтиопурина (3,9 г) и гидрохлорида изо-пентиламина (3,42 г) в 1-бутаноле (100 мл), содержащем триэтиламин (7,5 мл) кипятят с обратным холодильником в течение 2 час. Большую часть 1-бутанола упаривают в вакууме и реакционную смесь охлаждают льдом и встряхивают с водой.
Смесь оставляют в холодильнике на ночь, отфильтровывают и получают сырой продукт, который очищают хроматографически на силикагеле (100 г), градиентно элюируя 0-2,5%-ным раствором метанола в хлороформе. Хроматографически чистый продукт перекристаллизовывают из метанола, получая 1,18 г бесцветного аморфного вещества.
Анализ.
ТСХ (силикагель-2,5% метанол/хлороформ).
Чистота не менее 38%. Никаких примесей не обнаружено.
УФ-спектр
95% этанол/HCl - 307 нм
95% этанол - 291 нм
95% этанол/аммиак - 298 нм
Реакция 5. 8-тио-N6-(2'-изо-пентенил)аденин.
8-бензилтио-N6-(2'-изо-пентенил)аденин (1,18 г) растворяют в жидком аммиаке (125 мл) с образованием прозрачного желтого раствора. Небольшими порциями прибавляют натрий до тех пор пока устойчивая голубая окраска не будет сохраняться в течение 15 мин. Для удаления избытка натрия осторожно прибавляют небольшое количество хлорида аммония и аммиак испаряют при нагревании на горячей плитке. К остатку прибавляют диэтиловый эфир (125 мл).
После удаления большей части оставшегося аммиака эфирный раствор экстрагируют водой (2 х 65 мл). Водную фазу (с pH 12-13) охлаждают льдом и доводят ее pH до 5 ледяной уксусной кислотой. Кремово-белый осадок отфильтровывают, тщательно промывают водой и оставляют на ночь сушиться над хлористым кальцием, получая светлый порошок, выход 760 мг.
Замечание: 8-тио-N6-(2'-изо-пентенил)аденин легко окисляется в растворах щелочей.
Анализ.
ЖХВР (колонка с октилсиликагелем длиной 15 см, 0-80% метанол/0,2 ледяная уксусная кислота, 30 мин, 1 мл/мин, УФ-контроль по длине волны 300 нм).
Наблюдается острый симметричный пик; примесей не обнаружено. Чистота не менее 98% (табл. Д).
Реакция 6. IP8SGN натриевая соль.
8-тио-N6-(2'-изо-пентенил)аденин (600 мг) суспендируют в 50 мМ раствора едкого натра (102 мл), содержащего 1% 2-меркаптоэтанола в качестве антиоксиданта. Для растворения осадка прибавляют достаточное количество этанола. Раствор упаривают в вакууме над хлористым кальцием, а затем пятиокисью фосфора. Сухой продукт растворяют в абсолютном метаноле (100 мл), содержащем 2-меркаптоэтанол (50 мкл) и прибавляют MBTG (2 г). Смесь перемешивают при комнатной температуре в течение 24 час и сушат в вакууме над хлористым кальцием и пятиокисью фосфора. Содержащий защитную группу эфир гидролизуют в течение 1 час при комнатной температуре в 50 мл 5%-ного раствора едкого натра.
После нейтрализации концентрированной соляной кислотой продукт очищают хроматографически в колонках с обращенной и нормальной фазами и получают бесцветное твердое вещество, которое сушат до постоянного веса над хлористым кальцием, выход 190 мг (табл. Е).
ТСХ (силикагель - хлороформ, метанол, 1/1)
IP8SGN при величине пробы 34, 68, 102 и 134 мкг дает единственное компактное пятно; примеси не обнаруживаются, Чистота не менее 99,5%. Содержание свободного цитокининового основания, 8-тио-N6-(2'-изо-пентенил)аденина, < 0,1%.
ЖХВР (колонка с октилсиликагелем длиной 15 см, 0-80% метанол/0,2 М ледяная уксусная кислота, 30 мин, 1 мл/мин, УФ-контроль по длине волны 300 нм).
Наблюдается один широкий пик; время удерживания 18,2 мин; примесей не обнаружено. Чистота не менее 99,5%/
Гидролиз под действием GUS.
Натриевую соль IP8SGN с концентрацией 1 мг/мл в 50 мМ натрийфосфатного буфера с pH 7,0 выдерживают с 2500 единицами GUS (от фирмы Sigma) в течение 24 час при температуре 37oC. Анализ ТСХ (1/1, метанол/хлороформ) показывает полное (> 95%) превращение натриевой соли IP8SGN в соединение, которое хроматографируется вместе с 8-тио-N6-(2'-изо-пентенил)аденином. Таким образом, натриевая соль IP8SGN подвержена гидролизу под действием GUS.
Пример 1G.
O-бета-D-глюкопирануронозилзеатин, натриевая соль
Синонимы: зеатин-O-бета-D-глюкопирануроновая кислота, натриевая соль, зеатин-O-глюкуронид, натриевая соль.
Сокращение: ZOGH натриевая соль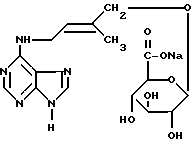
Синтез.
Метиловый эфир транс-2-метил-4-фталимидобут-2-енил-(2',3',4' -три-O-ацетил-бета-D-глюкопирануроновой кислоты
Транс-1-окси-2-метил-4-фталимидобут-2-ен (1,87 г; Corse & Kuhnle 1972, Synthesis, pp. 618-619) и свежеактивированный карбонат серебра (9 г) суспендируют в безводном эфире (300 мл), содержащем молекулярные сита (9 г). После перемешивания в течение 30 минут при комнатной температуре прибавляют MBTG (3,24 г) и смесь перемешивают при комнатной температуре в темноте в течение 2 дней. Прибавляют дополнительное количество MBTG (1,62 г) и смесь перемешивают еще в течение 2 дней. Реакционную смесь отфильтровывают, упаривают в вакууме до образования бесцветного сиропа, а затем сушат в вакууме над хлористым кальцием, получая бесцветное пенообразное вещество, которое легко растирается в порошок. Примеси сахара из полученного сырого продукта удаляют хроматографически на силикагеле (200 г), элюируя хлороформом. Выход очищенного продукта составляет 2,45 г (55,4%).
Транс-2-метил-4-амино-бут-2-енил-бета-D-глякопиранозилуронамид.
Метиловый эфир транс-2-метил-4-фталимидобут-2-енил- (2',3',4'-три-O-ацетил-бета-D-глюкопирануроновой кислоты (2,45 г) растворяют в абсолютном метаноле (150 мл), охлаждают в бане со льдом и пропускают через охлаждаемый льдом раствор аммиак в течение 6 час. После удаления в вакууме метанола сырой продукт очищают хроматографически на целлюлозе (200 г), промывая колонку смесью бутанол-этанол-уксусная кислота-вода (8:2:1:3 по объему). Элюат упаривают в вакууме и получают коричневое масло, которое используют без дальнейшей очистки на стадии конденсации.
Зеатин-O-бета-D-глюкуроновая кислота, натриевая соль.
Масло с предыдущей стадии нагревают в запаянной трубке с 6-хлорпурином (0,8 г) и триэтиламином (1,5 мл) в метаноле (25 мл) при 90oC в течение 4 час, с целью получения амида. Для превращения амида в кислоту метанол удаляют в вакууме и прибавляют 5%-ный водный раствор едкого натра (25 мл). После перемешивания при комнатной температуре в течение 6 час смесь осторожно нейтрализуют 2 М раствором соляной кислоты и очищают методом колоночной хроматографии с обращенной фазой на октадецилсиликагеле (100 г), элюируя водой. Полученную сырую натриевую соль ZOGN, содержащую непрореагировавший 6-хлорпурин, сушат в вакууме и очищают хроматографически на силикагеле (50 г), градиентно элюируя 0-100% раствором метанола в хлороформе. После удаления растворителя в вакууме продукт, представляющий собой аморфное вещество, сушат в вакууме над хлористым кальцием; выход 158 мг (табл.Ж).
Натриевая соль ZOGN при загрузке 50 мкг показывает одно пятно (Rf 0,16); присутствие примесей не обнаружено. Не обнаружено также присутствие зеатина (Rf 0,66) или 6-хлор- пурина (Rf 0,70). Чистота конечного продукта не менее 98%.
ЖХВР (колонка с октадецилсиликагелем, УФ-контроль по длине волны 270 нм),
Градиентное элюирование (0-100% метанола в течение 30 минут со скоростью 1 мл/мин).
Натриевая соль ZOGN элюируется в виде сравнительно широкого пика (время удерживания 10,0 мин) с небольшим количеством неорганических примесей, которые выходят вместе с пиком растворителя. Общий выход составляет не менее 97%.
Изократическое элюирование (50%-ный метанол, 1 мл/мин).
Изократическое элюирование используют для определения содержания зеатина. Время удерживания составляет 1,1 минуты; аутентичный образец имеет время удерживания 2,2 минуты. ЖХВР натриевой соли ZOGN при загрузках не выявляет присутствие зеатина. Таким образом, содержание зеатина составляет не более 0,1%. Полученный результат подтверждается ТСХ на силикагеле в системе хлороформ/метанол, 9/1. Натриевая соль ZOGN в этой системе не трогается со старта, однако любые примеси зеатина заметно отделяются, имея Rf 0,39, Не было обнаружено примесей зеатина при загрузке натриевой соли ZOGN в количестве 200 мг; таким образом, загрязнение транс-зеатином составляет не более 0,1%.
Ферментативный гидролиз.
Образец натриевой соли ZOGN выдерживают с бета-глюкуронидазой (Sigma, G 9387) в 50 мМ растворе натрийфосфатного буфера с pH 7,0 при 37oC, ЖХВР (изократическое элюирование 50%-ным метанолом) свидетельствует о практически полном превращении в транс-зеатин. Идентичность транс-зеатина в гидролизате с ферментом подтверждают совместной хроматографией смеси 1:1 гидролизата и аутентичного образца транс-эеатина в 8 различных хроматографических системах.
Пример 1H.
2-оксициннамил-бета-D-глюкопиранурамид.
Синонимы: о-кумарил-бета-D-глюкопиранурамид, о-кумарил-глюкуронамид.
Сокращение: CouGN амид
Синтез.
Метиловый эфир о-кумаровой кислоты (15 г) и MBTG (16,8 г) смешивают вместе с хинолином (25 мл) до образования однородной пасты. Порциями при тщательном перемешивании прибавляют оксид серебра (1) (10,7 г), при этом смесь охлаждают в бане со льдом. По окончании прибавления реакционную смесь выдерживают при комнатной температуре в течение 3 час, затем экстрагируют эфиром (1 л) и промывают эфирный экстракт водой (1л). Сушат органическую фазу над безводным сульфатом натрия и упаривают в вакууме. Полученное масло красного цвета промывают петролейным эфиром (300 мл) для удаления непрореагировавшего метил-о-кумарата и сушат в вакууме. Полученный продукт перекристаллизовывают из этанола, одновременно обесцвечивая с помощью активированного угля, и получают перацетилированный метиловый эфир 2-оксициннамид-O-бета-D-глюкопирануроновой кислоты (3,5 г).
Полученный перацетилированный метиловый эфир (3,5 г) растворяют в абсолютном метаноле (250 мл) и гидролизуют при перемешивании при 0oC в течение 3 час, добавив дополнительно количество абсолютного метанола (250 мл), насыщенного при -10oC газообразным аммиаком. Избыток аммиака и метанол удаляют в вакууме и сырой продукт перекристаллизовывают из этанола и сушат в вакууме над хлористым кальцием, получая чистый CouGN амид в виде бесцветного душистого твердого вещества (1,7 г).
Анализ.
ТСХ (силикагель - хлороформ/метанол, 1/1).
Одно компактное пятно с Rf 0,63. Никаких загрязняющих веществ не обнаружено при величине пробы 50 мкг, чистота не менее 98%. Примеси не более, чем 0,5% метил-о-кумарата или кумарина.
ТСХ (силикагель - хлороформ/метанол/ледяная уксусная кислота, 50/50/5).
Одно компактное пятно с Rf 0,68. Чистота не менее 98%. Примесь о-кумаровой кислоты (Rf 0,80) не обнаружена (< 0,5%).
Пример 1I.
2-оксициннамил-бета-D-глюкопирануроновая кислота.
Синонимы: о-кумарил-бета-D-глюкопирануроновая кислота, о-кумарил-глюкуронид.
Сокращение: CouGN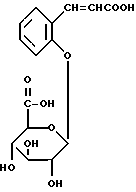
Синтез.
Метиловый эфир о-кумаровой кислоты (17,8 г) и MBTG (20 г) смешивают вместе с хинолином (20 мл) до образования однородной пасты. Порциями при тщательном перемешивании прибавляют оксид серебра (1) (13 г), при этом смесь охлаждают в бане со льдом, По окончании прибавления реакционную смесь выдерживают при комнатной температуре в течение 3 час, затем экстрагируют эфиром (1 л) и промывают эфирный экстракт водой (1 л). Сушат органическую фазу над безводным сульфатом натрия и упаривают в вакууме. Полученное масло красного цвета промывают петролейным эфиром (300 мл) для удаления непрореагировавшего метил-о-кумарата и сушат в вакууме. Полученный продукт перекристаллизовывают из этанола, одновременно обесцвечивая с помощью активированного угля, и получают перацетилированный метиловый эфир CouGN (2,9 г).
Перацетилированный метиловый эфир (2,9 г) суспендируют в метаноле (250 мл) и при перемешивании и охлаждении в бане со льдом прибавляют 2 М водный раствор едкого натра (250 мл). Смесь перемешивают при комнатной температуре еще в течение 1,5 час и доводят pH до 2,5 с помощью соляной кислоты. Метанол упаривают в вакууме и остаток очищают хроматографически на колонке XAD-2. Смолу, на которой проводят хроматографирование, вначале промывают водой для удаления неорганических солей, а продукт элюируют метанолом. После упаривания в вакууме продукт перекристаллизовывают из этанола и сушат в вакууме над хлористым кальцием, получая чистый CouGN в виде бесцветного аморфного вещества (1,5 г).
Растворимость CouGN в водном буферном растворе с pH 7 составляет 5 мг/мл; растворяется также в 50%-ном водном растворе спирта с образованием прозрачного бесцветного раствора.
Анализ.
ТСХ (силикагель - хлороформ/метанол/ледяная уксусная кислота, 50/50/1).
Основное пятно с Rf 0,12 и небольшая примесь с Rf 0,24. Чистота не менее 90%. Не обнаружен (< 1%) кумарин (Rf 0,90), метил-о-кумарат (Rf 0,91) или о-кумаровая кислота (Rf 0,80). Основной продукт хроматографируется вместе с аутентичным образцом CouGN, полученным при каталитическом окислении 2-окси-циннамил-O-бета-D-глюкопиранозида.
Гидролиз под действием GUS.
CouGN (5 мг) растворяют в 50 мМ натрийфосфатного буфера с pH 7,0 (1 мл) и выдерживают с GUS (1000 единиц, фирма Sigma тип G 5897) в течение 12 час при 37oC. ТСХ указывает на 93,4%-ную конверсию в соединение, которое хроматографируется вместе с о-кумаровой кислотой. о-кумаровая кислота медленно превращается (неферментативно) в кумарин в течение нескольких дней.
Пример 2.
Глюкурониды цитокининов гидролизуются бета-глюкуронидазой, высвобождая немодифицированные цигокинины.
Для идентификации тех глюкуронидов цитокинина, которые способны гидролизоваться под действием бета-глюкуронидазы, выделенной из E.coli, был разработан специальный метод анализа. (Различные особенности фермента и гена бета-глюкуронидазы описаны в следующих публикациях: Blanco & Nmoz, Biochemie 69, pp. 157-161, 1987: Jefferson et al., Proc. Natl. Acad. Sci. USA, Vol. 83, pp. 8447-8452, 1986; Levvy & March, Advan. Carbohydrate Chem. 14, pp. 381-428; патент США 4721671).
Исследуемое соединение выдерживают в 50 мМ натрийфосфатного буферного раствора с pH 7,0 (обычно 500 мкг соединения в 500 мкл буферного раствора) с бета-глюкуронидазой (обычно от компании Sigma, тип G 7896, 2500 единиц Sigma по "Фишману". в течение 12-24 час при температуре 37oC. Продукты гидролиза затем исследуют методами ЖХВР и ТСХ.
В табл. 1 представлены результаты проведения указанного выше анализа на примере ряда цитокинин-бета-D-глюкуронамидов и цитокинин-бета-D-глюкуронамидов.
Поскольку единственными субстратами, которые использовались для исследования фермента GUS, выделенного из E.coli, в трансгенных организмах являются O-глюкурониды и поскольку ранее сообщалось (Jefferson, "The GUS reporter gene system", Nature, Vol. 342, pp.837-838, 1989), что субстраты бета-глюкуронидазы являются D-глюкуроновой кислотой, связанной через бета-O-гликозидный фрагмент с агликоном, то вызывает удивление то, что некоторые N-глюкурониды и S-глюкурониды также оказываются хорошими субстратами для этого фермента. Можно, таким образом, предположить, что такие N- и S-глюкуронидные соединения могут быть использованы для исследования активности фермента бета-глюкуронидазы, выделяемого из E.coli и растений, в частности аналогично методу испытаний X-gluc, рассмотренному ранее.
В патенте Великобритании 2197653 A заявляется, что применяя систему бета-глюкуронидазы и новые субстраты, можно получить положительные результаты при использовании активности GUS в методах позитивной и негативной селекции. Однако эта гипотеза не исследовалась и возможность осуществления ферментативного гидролиза таких соединений не была показана даже с теоретической точки зрения, исходя из химических свойств субстратов для бета-глюкуронидазы, выделяемой из E.coli. Как установлено в настоящем изобретении, не все глюкурониды являются субстратами для фермента бета-глюкуронидазы, выделяемой из E. coli, и нельзя ожидать, что большинство глюкуронидов являются субстратами для фермента GUS.
Ответные реакции растительных клеток, отражающие воздействие гена бета-глюкуронидазы, выделяемой из E.coli, были использованы в качестве метода оценки, который позволяет определить, могут ли конкретные глюкурониды (в том числе предшественники растительных гормонов) гидролизоваться под действием фермента в условиях in vivo (Jefferson, "The GUS gene fusion as a versatile tool for agricultural molecular biology", реферат сообщения на Международном конгрессе по генетическому управлению при выращивании растений, Эльсинор, Дания, 11-16 сентября, 1988). К сожалению, этот подход неосуществим, поскольку в растительных тканях наблюдается сильная активность эндогенной бета-глюкуронидазы (см. , в частности, ниже в примере 3, а также Hodal et al., "Detection, expression and specific elimination of endogenous beta-glucuronidase activity in transgenic and nontransgenic plants", будет опубликовано в Plant Science). Проявление активносги эндогенной бета-глюкуронидазы означает также, что при использовании методики, приводимой Джефферсоном, невозможно установить, являются ли эффекты, наблюдаемые в присутствия глюкуронидов, следствием гидролиза соединения или же они могут быть объяснены тем, что сам глюкуронид является активным. Чтобы соединение было пригодным для проведения селекции, оно должно активироваться ферментом GUS, а также не должно проявлять заметной активности в глюкуронидной форме.
Описанный выше метод анализа может быть использован для отбора гдюкуронидов цитокинина, которые способна гидролизоваться под действием данного фермента бета-глюкуронидазы, который представлен в настоящем описании ферментом бета-глюкуронидазой, выделяемой из E.coli.
При использовании методов ЖХВР и ТСХ было также установлено, что немодифицированные активные цитокинины являются продуктами гидролиза под действием GUS (см. приведенные выше примеры, касающиеся получения и анализа новых глюкуронидных соединений цитокининов). Так, было, в частности, обнаружено, что гидролиз натриевой соли BA3GN под действием фермента бета-глюкуронидазы, выделяемой из E.coli, приводит к практически полному исчезновению натриевой соли BA3GN и образованию соединения, которое хроматографируется вместе из смеси 1:1 с аутентичным образцом БА. Аналогично, методом ЖХВР было показано, что выдерживание натриевой соли ZOGN с бета-глюкуронидазой, выделяемой из E. coli, приводит к практически полному превращению указанного соединения в транс-зеатин; а по данным ТСХ (1:1, MeOH/хлороформ) выдерживание натриевой соли IP8GN с бета-глюкуронидазой в течение 24 час приводит к почти полной конверсии (> 95%) IP8GN в соединение, которое хроматографируется вместе с 8-тио-(2-изопентенил)аденином.
Аналогично, по их способности гидролизоваться под действием бета-глюкуронидазы, могут быть отобраны и другие типы глюкуронидов. Например, выдерживание о-кумарил-бета-D-глюкуронида (5 мг в 1 мл буферного раствора) в течение 12 час с бета-глюкуронидазой (тип Sigma G 5897, 1000 единиц) приводит, как показано методом ТСХ, к 93,4%-ной конверсии в соединение, которое хроматографируется вместе с о-кумаровой кислотой. Выдерживание других соединений, представленных в табл. 1 (за исключением двух соединений, которые не являются субстратами для бета-глюкуронидазы, выделяемой из E.coli) дает похожие результаты, т.е. приводит к образованию продуктов гидролиза, которые и ожидались после проведения гидролиза с использованием бета-глюкуронидазы (см. представленные выше примеры, касающиеся получения различных глюкуронидных соединений). С другой стороны, BA9GN, который, как видно из табл. 1, не является субстратом для бета-глюкуронидазы, выделяемой из E.coli, и который не показывает заметного (< 1%) образования БА после выдерживания при 37oC в течение 18 час, не индуцирует и образование отростков дисков табачных листьев (см. далее в табл. 2).
Пример 3.
Индуцирование гликуронидами цитокинина образования отростков тканями растений, содержащих и не содержащих введенный ген бета-глюкуронидазы.
Были проведены исследования, с целью определить, могут ли глюкурониды цитокинина (а также глюкуронамид цитокинина) индуцировать в условиях in vivo образование отростков растения, содержащего и не содержащего, соответственно, ген бета-глюкуронидазы.
Семена от GUS-позитивного и GUS-негативного растения, табака (Nicotiana tabacum "Wisconsin 38") проращивают на среде MCO (питательная среда Мурасиге и Скута без гормонов, описан в Murashige & Skoog, Physiol. Plant 15: 473-497, 1962; получают от фирмы Sigma, США). GUS-позитивный растительный материал содержит введенный ген бета-глюкуронидазы, выделенный из E.coli (uidA) и активируемый промотором 35S из вируса мозаики цветной капусты, который описан, например, Jefferson et al., The EMBO Journal, Vol. 6, N 13, pp. 3901-3907, 1987. Оригиналы трансгенных GUS-позитивных растений получали по традиционной схеме негативной селекции с использованием канамицина, которая приведена, например, Burow et al., Plant Molecular Biology Reporter, Vol. 8(2), pp. 124-139, 1990. GUS-позитивные сеянцы были идентифицированы с использованием анализа X-gluc, как это уже описано выше.
После 4-5 недель верхние части растений или побегов переносят в новую питательную среду MCO и указанную процедуру повторяют необходимое количество раз. Таким образом растительный материал (как GUS-позитивный, так и GUS-негативный) содержат в виде стерильных отростков культуры (см. Burow et al., Plant Molecular Biology Reporter, Vol.8(2), pp.124-139, 1990). Диски перфорируют от самых больших листьев (в возрасте 3-5 недель) и переносят в питательную среду, которая указана далее в табл. 2. Основной используемой питательной средой является MCO, при этом различные испытываемые соединения прибавляют небольшими порциями в виде растворов с концентрацией до 250 мкМ. Используют небольшие чашки Петри (диаметром 5 см), при этом в каждую чашку Петри помещают по 3 диска листьев. Каждый опыт повторяют по крайней мере 4 раза.
Было обнаружено, что несколько видов глюкуронидов цитокинина вызывают образование отростков в тканях растения, содержащих фермент бета-глюкуронидазу.
Результаты представлены в табл. 2.
Из табл. 2 видно, что все глюкурониды цитокинина, которые индуцируют образование побегов на дисках листьев, табака, содержащих введенную бета-глюкуронидазу, при концентрации ниже 250 мкМ, способны также инициировать образование побегов, при тех же концентрациях, в соответствующих дисках листьев, которые не содержат введенный ген бета-глюкуронидазы. С другой стороны, глюкуронид цитокинина BA9GN, который, как было показано, не является субстратом для бета-глюкуронидазы, выделяемой из E.coli (см. пример 2), не приводит к образованию побегов в дисках листьев ни с введенным геном бета-глюкуронидазы, ни в его отсутствии. Тем не менее глюкуронамид цитокинина BA3GNамид, который, как указано в примере 2, не реагирует как субстрат для бета-глюкуронидазы, выделяемой из E.coli, оказывается способным индуцировать образование побегов как в GUS-позитивных, так и GUS-негативных дисках листьев, что свидетельствует о том, что глюкуронамиды цитокинина превращаются в растительных тканях в соответствующие глюкуроновые кислоты цитокинина. Таким образом, предшественники глюкуронидов цитокинина способны оказывать такое же воздействие в условиях in vivo, что и сами глюкурониды цитокинина.
Полученные результаты свидетельствуют о том, что высшие растения, в данном случае табак, обладают эндогенной активностью бета-глюкуронидазы. Это согласуется с тем, о чем недавно сообщалось (Hu et al., Plant Cell Reports 9, pp. 1-5, 1990) по поводу обнаружения активности, напоминающей GUS-активность в 52 образцах семян растений, а также с исследованиями Hodal et al. (будут опубликованы в Plant Science). Hu et al. обнаружили, что частички, которые проявляют позитивную активность, напоминающую GUS-активность, распределяются в каждой ключевой группе ангиоспермы, а также в некоторой части гимноспермы. (Хотя Hu et al. не обнаружили активность в табаке, это можно объяснить тем, что они проводили анализ в условиях in vitro при pH 7. Как показано далее, ферменты, ответственные за негативную GUS-активность в табаке, не проявляют активности при pH 7, однако активны при pH 4-5).
Эти открытия противоречат описанию патента Великобритании 2197653 A, в котором заявляется, что высшие растения, в том числе табак, не обнаруживают активность бета-глюкуронидазы. В патенте Великобритании 2197653 A, в котором, кроме всего прочего, заявляется метод контроля за экспрессией изучаемого гена с использованием гена GUS, поясняется, что присутствие активности GUS указывает на экспрессию изучаемого гена и, поскольку активность GUS не обнаруживается в высших растениях, то делается вывод, что контроль за экспрессией изучаемого гена с использованием гена GUS является очевидным и не представляет сложности. Однако приведенные выше результаты показывают, что это на самом деле не так, и использование гена GUS для установления присутствия требуемого гена вовсе не является простым или очевидным, поскольку на самом деле высшие растения обладают значительно собственной (фоновой) активностью бета-глюкуронидазы.
С целью установления природы наблюдаемой GUS-активности в образцах растительного происхождения, содержащих и не содержащих введенного гена бета-гликуронидазы, определяли зависимость GUS-активности от pH, используя стандартный гистохимический анализ с применением "X-gluc" (5-бром-4-хлор-3-индолил-бета-глюкуронид).
Анализ с применением X-gluc может быть осуществлен путем предварительного приготовления среды для анализа растворением 50 мг X-gluc в растворе, содержащем 25 мл 0,2 М натрийфосфатного буфера, обычно с pH 7,0, 24 мл дистиллированной воды, 0,25 мл 0,1 М раствора K3[Fe(CN6)], 0,25 мл 0,1 М раствора K4[Fe(CN6)] и 0,5 мл 1,0 М раствора динатриевой соли ЭДТК, с последующим перемешиванием до полного растворения (около 30 минут). Свежесрезанный или хранящийся в растворе формальдегида срез (с толщиной не более 0,5 мм) или ткань затем выдерживают при температуре 87oC в среде, содержащей X-gluc, от нескольких минут до 24 час. После термостатирования образцы промывают натрийфосфатным буфером или водой и изучают под микроскопом. GUS-активность проявляется в виде голубого окрашивания обработанного образца растительной ткани со стороны активности фермента (Jefferson, Plant Molecular Biology Reporter, Vol. 5, N 4. pp. 387-405, 1987). Во время проведения анализов по настоящему изобретению время выдерживания обычно составляет 20 час. После термостатирования образцы дисков обрабатывают 96%-ным этанолом для удаления хлорофилла.
Полученные результаты представлены в табл. 3.
Как видно из представленных данных, фермент, ответственный за фоновую активность бета-глюкуронидазы в дисках листьев табака, не содержащих введенного гена бета-глюкуронидазы, активен лишь в узком интервале значений pH, который соответствует значению кислотности внутри растений (приблизительно pH 5), в то время как бета-глюкуронидаза, являющаяся продуктом экспрессии введенного гена, активна в широком интервале значений pH от 4 до 8. Эта зависимость от кислотности среда может объяснить, почему предыдущие попытки обнаружить GUS-активность в растениях были большей частью неудачными, что приводило к ошибочным заключениям (в частности в патенте Великобритании 2197653 A) о том, что растения не обладают собственной GUS-активностью.
Тот факт, что продемонстрированная ранее активность бета-глюкуронидазы в образцах растительного происхождения, не содержащих введенного гена GUS, является на самом деле результатом гидролиза субстрата на основе глюкуронида цитокинина под действием бета-глюкуронидазы, а не проявлением неспецифической реакции расщепления субстрата, например, при неферментативном кислотном гидролизе глюкуронидов (которые, как известно, расщепляются при низких значениях pH) был доказан исследованием действия ингибиторов различных ферментов при pH 5 в негенетически трансформированных образцах растительного происхождения (т. е. образцах, обладающих лишь собственной GUS-активностью). Исследования проводились с использованием GUS-анализа, описанного выше, при pH 5,0 в течение 20 час (табл. 4).
Шесть исследованных ингибиторов показали следующие результаты.
Сахаро-1,4-лактон является специфическим ингибитором для фермента бета-глюкуронидазы (другими словами, он ингибирует только бета-глюкуронидазу и он ингибирует все бета-глюкуронидазы). Общепризнано, что GUS-активность, которая подавляется этим соединением, является результатом действия фермента бета-глюкуронидазы.
Глюконолактон является ингибитором бета-глюкозидазы. Он соответствует сахаро-1,4-лактону, за исключением того, что является специфическим ингибитором для бета-глюкозидазы.
UDP-глюкуронид является субстратом для UDP-глюкуронидтрансферазы.
Глюкуроновая кислота является продуктом любой реакции с участием бета-глюкуронидазы, а потому является продуктом-ингибитором бета-глюкуронидазы и других ферментов, действие которых приводит к образованию глюкуроновой кислота.
Галактоза является ингибитором реакций, которые контролируются UDP-глюкуронидтрансферазой.
Глюкуронид метилумбеллилферила является субстратом для всех бета-глюкуронидаз, которые известны в настоящее время, и является, таким образом, конкурирующим ингибитором для ферментов GUS.
Поскольку было обнаружено, что ЭДТК (которая подавляет действие UDP-глюкуронидтрансферазы) не оказывает воздействия, то маловероятно, что подобные трансферазы участвуют в проявлении наблюдаемой GUS-активности. Приведенная табл.4 показывает, что те соединения, которые должны ингибировать фермент трансферазу, не оказывают никакого действия даже при очень больших концентрациях. Можно также заметить, что глюконолактон не оказывает ингибирующего воздействия, поэтому маловероятно, чтобы GUS-активность объяснялась активностью бета-глюкозидазы.
Можно далее отметить, что специфический ингибитор GUS, а именно сахаро-1,4-лактон является сильным ингибитором, что глюкуроновая кислота (ингибирование действия бета-глюкуронидазы продуктом гидролиза) является ингибитором средней силы, а глюкуронид метилумбеллилферила (субстрат GUS, а потому является конкурирующим субстратом для X-gluc, если фермент бета-глюкуронидаза отвечает за гидролиз X-gluc) является слабым ингибитором. Таким образом, GUS-активность в табаке отвечает всем критериям и может быть классифицирована как результат действия фермента бета-глюкуронидазы. Можно поэтому сделать вывод, что растения содержат фермент бета-глюкуронидазу.
Была проведена соответствующая серия экспериментов с целью убедиться, что воздействие ингибиторов проявляется достаточно быстро, чтобы блокировать действие фермента. В указанной серии опытов образцы растительного происхождения предварительно выдерживают в исследуемых соединениях (ингибиторах) в течение 24 час перед проведением анализа с использованием X-gluc для тех же самых соединений. Полученные результаты идентичны результатам, полученным без предварительного выдерживания, что свидетельствует о том, что ингибиторы проникают в ткани растений достаточно быстро, чтобы блокировать реакцию с участием GUS, чем появится голубое окрашивание.
Результаты, аналогичные описанным, были получены и при другом исследовании, связанном с проявлением GUS-активности в растениях. В этом случае на ряде образцов исследовалась зависимость гистологической реакции GUS от кислотности среды в интервале pH от 3 до 8 как в присутствии, так и в отсутствии сахаро-1,4-лактона, являющегося специфическим ингибитором GUS.
Использованный метод является анализом с применением X-gluc, который описан ранее. Тест проводят при температуре 37oC в течение 20 час. Листья рассекают (стерильной бритвой), так что каждый лист исследуют при нескольких различных значениях pH.
Как указано в табл. 5, эти исследования подтверждают, что растения действительно обладают собственной GUS-активностью, что эта активность является следствием ферментативной реакции (реакция не наблюдается в присутствии специфического ингибитора GUS) и что фермент в основном активен при значениях pH приблизительно 4-5.
Тот факт, что растения обладают собственной GUS-активностью позволяет применять ген, кодирующий глюкуронидпермиазу, в качестве селективного гена без применения какого-либо другого селективного гена, используя то обстоятельство, что глюкуронидные соединения быстрее захватываются трансформированными клетками. Было, например, обнаружено, что глюкурониды с трудом проникают в клетки растений через клеточные мембраны. Однако, если в клетку введен ген глюкуронидпермиазы, то глюкурониды с большей легкостью пересекают клеточные мембраны и проникают в клетку. В таком случае глюкурониды станут доступны для расщепления собственным ферментом GUS в трансформированных клетках. Наоборот, рассматриваемые глюкурониды не попадут в нетрансформированные клетки, и, таким образом, будет достигнута цель позитивной селекции. Аналогично, позитивную селекцию можно осуществить, используя другие пермиазы и другие типы соединений, которые или активируются, или каким-либо иным способом оказывают биологическое воздействие в трансформированных клетках, в которые они переносятся.
Пример 4.
Глюкурониды цитокинина являются устойчивыми и неактивными.
Воздействие глюкуронида цитокинина натриевой соли BA3GN блокируется в том случае, если ингибируется активность GUS в растительных тканях, содержащих этот глюкуронид цитокинина. Другими словами, сам глюкуронид цитокинина не является активным. Более того, было показано, что глюкуронид цитокинина устойчив в питательной среде, а также в растительных тканях в отсутствие бета-глюкуронидазы, что подтверждается тем, что специфический ингибитор GUS, сахаро-1,4-лактон (СЛ), сильно подавляет образование отростков, индуцированное глюкуронидом цитокинина, натриевой солью BA3GN, но лишь слабо ингибирует образование отростков, индуцированное свободным цитокинином БА (при использовании щелочного способа, описанного ранее в примере 3) (табл. 6).
Сравнивая результаты, представленные в табл. 6, с результатами, приведенными в табл. 2, можно обратить внимание на то, что натриевая соль BA3GN, которая индуцирует образование отростков как в GUS-позитивных, так в GUS-негативных дисках листьев табака, не вызывает образование отростков в соответствующих дисках листьев в присутствии такого специфического ингибитора бета-глюкуронидазы, каким является сахаро-1,4-лактон.
Сахаро-1,4-лактон не является устойчивым соединением при значениях pH, которые используются при проведении данного анализа. Он существует в равновесии с сахарной кислотой. Однако это равновесие устанавливается медленно, и превращение сахаро-1,4-лактона в сахарную кислоту сопровождается уменьшением значения pH. По этой причине в течение недели перед применением сахаро-1,4-лактона необходимо устанавливать значение pH, до тех пор пока оно не стабилизируется в питательной среде, содержащей сахаро-1,4-лактон.
Тот факт, что глюкурониды цитокинина являются устойчивыми и неактивными, если отсутствует бета-глюкуронидаза, далее подтверждается тем, что BA9GN, который не может гидролизоваться под действием бета-глюкуронидазы, не в состоянии индуцировать образование отростков в образцах растительного происхождения, обладающих активностью бета-глюкуронидазы (см. примеры 2 и 3).
Важно, что глукуронидные соединения цитокинина являются неактивными и устойчивыми в питательных средах, не содержащих фермент бета-глюкуронидазу, поскольку эта устойчивость является предпосылкой для правильного функционирования системы позитивной селекции, в которой они используются.
Однако следует ожидать, что не все производные глюкуроновой кислоты будут устойчивыми. Например, эфиры на основе глюкуронидов не будут устойчивыми в растительных тканях, которые содержат не обладающую специфическим действием эстеразу. Это означает, что глюкуронидные соединения цитокининов, полученные и используемые по настоящему изобретению (бета-глюкурониды, связанные с агликоном через гликозидные атомы кислорода, серы или азота), обладают необходимой устойчивостью. С другой стороны, соединения, имеющие другие типы глюкуронидных связей, в частности, амидные или сложноэфирные глюкурониды, видимо, не будут избирательно гидролизоваться бета-глюкуронидазами вследствие присутствия в растениях эстераз и амидаз, не обладающих специфическим действием.
Возвращаясь вновь к примеру 3, можно отметить следующее: показано, что исследованные глюкурониды цитокинина, которые, как видно из этого примера, сами не обладают активностью цитокинина. расщепляются в условиях in vivo под действием бета-глюкуронидазы или под действием введенного гена бета-глюкуронидазы, при этом высвобождается питокинин.
Пример 5.
Индуцирование образования отростков в тканях растений, содержащих введенный ген бета-глюкуронидазы с использованием глюкуронидов стеринов.
Было показано, что другие глюкурониды, в том числе глюкурониды стеринов, глицирризовой кислоты и оксихинолина, гидролизуются под действием бета-глюкуронидазы, что приводит к образованию отростков в модифицированных питательных средах, в которых ответственными за образование отростков являются продукты гидролиэа. Это демонстрируется примерами 5 и 6.
Были проведены исследования для определения индуцирующего воздействия на образование отростков двух стериновах глюкуронидов, бета-ситостерил-бета-D-глюкуронида (СГ) и холестерил-бета-D-глюкуронида (ХГ), для случая, когда в тканях ингибируется синтез стеринов. Применяемые в данном случав методы в основном соответствуют методам, приведенным выше в примере 3. Однако помимо одного или обоих указанных стериновых глюкуронидов питательная среда содержит также 0,1 мМ тридеморфа и 5 мг/л натриевой соли BA3GN. Количество отростков регистрируют через 30 дней.
Тридеморф (4-тридецил-2,6-диметилморфолин) является фунгицидом, который ингибирует синтез стеринов и аналогичных им соединений. Тридеморф оказывает ингибирующее воздействие на регенерацию отростков (но не оказывает фатального воздействия на эксплантант) в том случае, если растительные ткани не получают стерины. Таким образом, в отсутствии свободных стеринов образование отростков должно быть эффективно приостановлено.
ХГ был получен от фирмы Sigma, США, а СГ был синтезирован в соответствии с методикой, приведенной Ando et al., J.Antibiotics, Vol. 73. p. 408, 1970.
Полученные результаты приведены в табл. 7.
Данные, приведенные в табл. 7, показывают, что ситостерил-бета-D-глюкуронид способен противодействовать ингибирующему эффекту тридеморфа, а сочетание ситостерил-бета-D-глюкуронида и холестерил-бета-D-глюкуронида обеспечивает наибольшее количество отростков. Таким образом, становится возможным осуществление позитивной селекции по настоящему изобретению с применением введенного гена бета-глюкуронидазы, используя, в частности, одно или оба указанных выше глюкуронидных соединений стеринов совместно с соединением, ингибирующим образование отростков, например, тридеморфа. Полученные результаты свидетельствуют о том, что для позитивной селекции в тканях, содержащих введенный ген бета-глюкуронидазы, можно использовать и другие стерины и подобные им соединения.
Преимущество использования этих очень трудно растворимых в воде соединений для позитивной селекции состоит в том, что их воздействие в основном будет локальным, поскольку соединения не диффундируют от клетки к клетке после того, как гидрофильный глюкуронидный фрагмент отщепляется под действием фермента бета-глюкуронидазы. Иными словами, эти соединения могут использоваться для предотвращения перекрестного питания во время проведения операции отбора.
Проведенные исследования свидетельствуют далее о том, что ингибирующее воздействие тридеморфа, а также других соединений, которые подавляют синтез стеринов, на образование отростков можно преодолеть прибавлением в питательную среду стеринов и производных стеринов, при этом может быть получена система для отбора, обладающая указанными выше преимуществами, которая основывается на снабжении трансгенных клеток стеринами и подобными им соединениями.
Пример 6.
Индуцирование образования отростков в тканях растений, содержащих и не содержащих введенного гена бета-глюкуронидазы, с использованием ситостерил-бета-D-глюкуронида.
Опыт, аналогичный эксперименту, описанному в примере 5, проводят как над нетрансформированными, так и трансформированными дисками листьев табака, используя ситостерил-бета-D-глюкуронид, или БД, или натриевую соль BA3GN.
Применяемые методы в основном совпадают с описанными в примере 5. В данном эксперименте тридеморф добавляют в питательную среду в количестве 0,1 мМ, а концентрация ситостерил-бета-D-глюкуронида составляет 121 мг/л. Питательная среда содержит также либо 1,88 мг/л натриевой соли BA3GN или 0,1 мг/л БА. Количество отростков регистрируют через 40 дней.
Количество полученных отростков указано в табл.3.
Можно заметить, что, как и в случае приведенного ранее примера 5, присутствие ситостерил-бета-D-глюкуронида способно противодействовать ингибирующему воздействию на образование отростков, которое оказывает тридеморф. Более того, в том случае, если ситостерил-бета-D-глюкуронид используется совместно с натриевой солью BA3GN, то на GUS-позитивных дисках листьев наблюдается селективное образование отростков, в то время как у GUS-негативных дисков листьев в питательной среде, содержащей натриевую соль BA3GN, образование отростков не наблюдается.
Эти результаты также свидетельствуют о том, что использование комбинации различных глюкуронидов (в данном случае BA3GN и СГ вместо БА и СГ) может способствовать улучшению реакции трансгенных клеток при проведении отбора,
Поскольку стерины и стероиды являются важными регуляторами роста клеток животных, то соответствующие методики отбора могут быть такте использованы и для селекции клеток животных, которые выражают признаки бета-глюкуронидазы.
Пример 7.
Лишенные отростков штаммы Agrobacterium производят цитокинины.
Было обнаружено, что некоторые штаммы Agrobacterium индуцируют образование отростков благодаря выделению стимулирующих рост веществ при совместном выращивании. Таких штаммов следует, как правило, избегать, если необходимо применить гидролиз глюкуронидов цитокинина для целей селекции генетически трансформированных клеток, поскольку такие штаммы могут индуцировать образование отростков и, таким образом, мешать процессу отбора.
В качестве примера, в табл. 8 представлены результаты экспериментов с двумя различными штаммами Agrobacterium, один из которых индуцирует образование отростков на дисках листьев табака после совместного выращивания.
Используемые методы в основном совпадают с теми, которые приведены в примере 13, однако после совместного выращивания диски листьев переносят в питательную среду MCO без гормонов, содержащую 300 мг/л цефотаксима и 300 мг/л карбенициллина.
Количество регенерированных отростков регистрируют через 4 недели после совместного выращивания.
Из приведенных данных видно, что способность индуцировать образование отростков некоторых штаммов Agrobacterium не зависит от генов, входящих в состав T-ДНК. Это означает, что за инициирование процесса образования отростков отвечают гены, которые находятся за пределами Т-ДНК.
Ген вне сферы действия Т-ДНК, который отвечает за получение цитокинина, был назван tzs (R. O. Morris, Ann. Rev. Plant Physiol, 37, pp. 509-538, 1986). Штамм C58 содержит ген tzs, неперемещаемый ген, который кодирует синтез зеатина во время совместного выращивания. Штамм LBA4404 не содержит ген tzs. Тот факт, что штаммы, инициирующие образование отростков, имеют плазмиду, содержащую ген tzs, свидетельствует о том, что именно этот ген отвечает за инициирующие образование отростков свойства, которые наблюдаются в этих экспериментах, и что следует избегать штаммы Agrobacterium, содержащие ген tzs, в системах селекции на основе цитокинина. Следует также избегать и другие штаммы Agrobacterium, которые инициируют образование отростков.
Пример 8.
Позитивная селекция трансгенных отростков с использованием глюкуронида питокинина натриевой соли BA3GN.
Генетически трансформированные отростки можно отделить, используя глюкурониды цитокинина.
Была проведена серия экспериментов для оценки эффективности системы позитивной селекции с использованием глюкуронида цитокинина натриевой соли BA3GN, с концентрациями 7,5 и 15 мг/л. Опыты проводили на дисках листьев некультурного сорта табака с двумя различными штаммами Agrobacterium с различными питательными средами для совместного выращивания. Применяемый способ трансформации описан ниже в примере 13, за исключением того, что вместо питательной среда MCO используют питательную среду Gamborg B5 (Gamborg et al., Exp. Cell Res. 50. 151-158, 1968; получают от компании Sigma, США). Приведенные ниже данные являются средними из двух независимых экспериментов, каждый из которых проводят на 27 листьях.
Штамм BSIO вводит ген GUS, стимулированный модифицированным промотором 35S, неактивным в Agrobacterium, как описано Janssen & Gardner, Plant Molecular Biology, 14, pp. 61-72, 1989. Штамм LDHI вводит ген GUS, стимулированный немодифицированным промотором 35S.
Результаты, приведенные в табл. 9, показывают, что позитивная селекция трансгенных отростков, отражающих действие введенного гена бета-глюкуронидазы, может быть проведена с использованием натриевой соли BA3GN. Подобные результаты ожидались и имеют большое значение, так как было обнаружено, как описано в примере 3, что глюкурониды цитокинина способны инициировать образование отростков в дисках листьев, не содержащих введенный ген бета-глюкуронидазы. Различные обработки в процессе совместного выращивания, видимо, не оказывают заметного воздействия на селекцию.
Приведенные данные указывают на то, что использование штамма Agrobacterium с активным геном бета-глюкуронидазы (штамм LDHI отражает GUS-активность в бактерии) не влияет на систему трансформирования по сравнению со штаммом, который не имеет активного гена бета-глюкуронидазы (штамм BSIO не отражает GUS-активность в бактерии).
Пример 9.
Отбор генетически трансформированных отростков с использованием глюкуронида цитокинина, зеатин-O-бета-глюкуроновой кислоты.
Используя в основном ту же методику, которая приведена в примере 13, получают и отбирают трансгенные отростки табака, используя в качестве средства позитивной селекции глюкуронид цитокинина, зеагин-O-бета-глюкуроновую кислоту (ZOGN).
Совместное выращивание проводят в течение 3 дней, оптическая плотность посевной культуры на длине волны 660 нм составляет 1,5. После совместного выращивания используют питательную среду MCO, содержащую 300 мг/л карбенициллина, 300 мг/л цефотаксима и 0,1 мг/л индолуксусной кислоты (ИУК). Субкультуру через 3 недели переносят в ту же питательную среду, но не содержащую ИУК. pH всех используемых в данном примере питательных средств составляет 8,0. Для каждой обработки используют 18 листьев.
Через пять недель после совместного выращивания отростки переносят в питательную среду MCO, содержащую 200 мг/л сульфата канамицина, 32 мМ сахарной кислоты, 300 мг/л цефотаксима и 300 мг/л карбенициллина, pH 8,0. Сахарную кислоту, которая является ингибитором фермента бета-глюкуронидазы, прибавляют для того, чтобы приостановить дальнейшее превращение глюкуронида зеатина в зеатин. Вместе с геном бета-глюкуронидазы совместно переносится и ген NPT. который обеспечивает устойчивость по отношению к канамицину. Нетрансформированные отростки (негативные контрольные образцы) выживают, однако рост этих отростков в данной среде приостанавливается, в то время как все трансформированные отростки (позитивные контрольные образцы), содержащие активный ген NPT, не только выживают, но и продолжают расти.
Регистрируют количество отростков и определяют количество GUS-позитивных отростков из общего их числа с помощью анализа с использованием X-gluc (пример 3) через 3 недели после последней субкультивации (8 недель после совместного выращивания). Полученные результаты представлены в табл. 10.
Результаты, представленные в табл. 10, показывают, что при использовании ZOGN достигается позитивная селекция генетически трансформированных отростков. Индуцирование образования трансгенных отростков подавляется в том случае, если к субстрату прибавляют сахаро-1,4-лактон, который является специфическим ингибитором бета-глюкуронидазы, что говорит в пользу того, что рост трансгенных побегов и, таким образом, успех позитивной селекции, зависит от катализируемого бета-глюкуронидазой превращения ZOGN в зеатин.
Пример 10.
Отбор генетически трансформированных отростков с использованием зеатин-O-бета-глюкуроновой кислоты при различных температурах
Температурную зависимость системы позитивной селекции с использованием глюкуронида цитокинина исследуют с помощью зеатин-O-бета-глюкуроновой кислоты (ZOGN) в качестве позитивного агента селекции при 25oC, 30oC и 35oC.
Трансгенные отростки табака получают, применяя в основном ту же методику, что и описанная ниже в примере 13. Совместное выращивание проводят в течение 3 дней, оптическая плотность посевного материала на длине волны 660 нм равна 1,5. После совместного выращивания используют питательную среду MCO, содержащую 10 мг/л 2-(2-оксиэтиламино)-6-бензиламино-9-метилпурина (9-met), 350 мг/л карбенициллина, 350 мг/л цефотаксима и 0,1 мг/л индолуксусной кислоты, а также натриевую соль ZOGN, как указано ранее. Прибавляют 9-met (получен от фирмы Apex Organics Ltd, Великобритания) для ингибирования реакции глюкозилирования зеатина и производных зеатина. Каждой обработке подвергают по 18 листьев.
Через семь недель после совместного выращивания отростки переносят в питательную среду MCO, содержащую 300 мг/л сульфата канамицина, 350 мг/л цефотаксима, 350 мг/л карбенициллина, 0,1 мг/л индолуксусной кислоты и 10 мг/л 6-(м-оксибензиламино)пурина (OH-БА) и оставляют при температуре 25oC. OH-БА может быть получен как описывают Kaminek et al., Plant Growth Reg. 6, pp. 113-120, 1987).
После выдерживания в течение шести недель в питательной среде с канамицином регистрируют количество зеленых отростков. Устойчивость к действию канамицина указывает на то, что отростки являются трансгенными, поскольку наряду с геном бета-глюкуронидазы совместно переносится ген NPT, обеспечивающий устойчивость по отношению к канамицину. Ни один из нетрансформированных отростков (негативные контрольные образцы) не выживает в этой питательной среде, в то время как выживают все трансгенные отростки (позитивные контрольные образцы), содержащие активный ген NPT.
Процентное содержание устойчивых по отношению к канамицину отростков среди общего числа регенерированных отростков подсчитывают как число зеленых побегов, выживших в питательной среде, которая содержит канамицин, деленное на число побегов, перенесенных в питательную среду, содержащую канамицин. Полученные результаты представлены в табл. 11.
Биоанализ, который описывается в этом примере, проводят на связанном совместно перенесенном гене. Это означает, что ген бета-глюкуронидазы используется для целей селекции, в то время как анализируется устойчивость, которая привносится геном NPT (ген устойчивости по отношению к канамицину).
Представленные выше результаты показывают, что помимо гена бета-глюкуронидазы в процессе позитивной селекции с использованием гена бета-глюкуронидазы наблюдается и экспрессия совместно введенного гена. Далее, можно отметить, что отбор при более высоких температурах (в частности при 30-35oC) улучшает селекцию отростков на один диск листа, а также общую фракцию трансгенных отростков среди общего числа регенерированных отростков.
Путем анализа с использованием X-gluc при различных температурах было обнаружено в связи с настоящим изобретением, что активность собственной бета-глюкуронидазы, имеющейся в растениях, подавляется при повышенных температурах, в то время как активность введенной бета-глюкуронидаэы не изменяется. Таким образом, было показано, что активность собственной бета-глюкуронидазы постепенно уменьшается с повышением температуры вплоть до 60oC, при которой активность собственной бета-глюкуронидазы практически отсутствует (как следует из анализа с использованием X-gluc). Этим можно объяснить улучшение селекции при повышенных температурах.
Пример 11.
Позитивная селекция в сравнении и в сочетании с негативной селекцией.
Было показано, что системы позитивной селекции, которые здесь описываются, являются высокоэффективными и обладают преимуществами по сравнению с традиционной негативной селекцией на основе канамицина. Однако хорошие результаты получаются в том случае, когда система позитивной селекции применяется совместно с традиционной негативной селекцией.
Полученные результаты в терминах количества GUS-позитивных отростков табака на один диск листа и процентного отношения GUS-позитивных отростков к общему их числу приведены в табл. 12 для позитивной селекции с использованием натриевой соли ZOGN, традиционной негативной селекции с использованием канамицина и БА, а также сочетания позитивной и негативной селекции. Включен также опыт проведения селекции с использованием натриевой соли ZOGN вместе с сахаро-1,4-лактоном (сильный специфический ингибитор введенной бета-глюкуронидазы).
Использованные методы в основном совпадают с приведенными далее в примере 13, однако вместо среды MCO используют питательную среду Gamborg B5.
Эксперимент, в котором БА используют вместе с канамицином. представляющим традиционную систему негативной селекции, был повторен в виде двух независимых опытов с 54 дисками листьев в каждом опыте. Из отобранных 23 отростков обнаружен лишь один GUS-позитивный отросток. Результаты для натриевой соли ВАЗGM получены с использованием 324 дисков листьев. Эксперимент с использованием СЛ (сахаро-1,4-лактона) проводят один раз со 162 дисками листьев.
Приведенная табл. 12 показывает, что позитивная селекция с использованием 15 мг/л натриевой соли BA3GN (без канамицина) позволяет получить в 30 раз большее количество GUS-позитивных отростков на один диск листьев, чем традиционная система негативной селекции, в которой используется 1 мг/л БД и 300 мг/л сульфата канамицина. Более того, большее процентное содержание от общего количества отростков являются GUS-позитивными в случае использования позитивной селекции (7,4%), чем негативной селекции (4,3%).
Предпочтительные результаты были также получены при совместном использовании позитивной и негативной селекции, т. е. при замене цитокинина в традиционной системе негативной селекции на основе канамицина на глюкуронид цитокинина (натриевую соль BA3GN). Так, при сочетании 15 мг/л натриевой соли BA3GN и 300 мг/л сульфата канамицина процентное содержание GUS-позитивных отростков в 11 раз превышает это значение при использовании БА и канамицина, а когда 15 мг/л натриевой соли BA3GN используют совместно с 33 мг/л сульфата канамицина, то количество GUS-позитивных отростков на один диск листа в 40 раз превосходит значение, полученное при использовании БА и канамицина.
Если 15 мг/л натриевой соли BA3GN применяют вместе с 10 мМ СЛ, который является ингибитором GUS, количество GUS-позитивных отростков на один диск листьев и процентное отношение GUS-позитивных отростков значительно сокращается, по сравнению с использованием только 15 мг/л натриевой соли BA3GN. Это доказывает, что за предпочтительные результаты, полученные при использовании системы позитивной селекции, отвечает ген GUS, поскольку добавление СЛ в питательную среду существенно подавляет катализируемое бета-глюкуронидазой превращение неактивного глюкуронида цитокинина (натриевой соли BA3GN) в активный цитокинин в клетках, выращенных в данной питательной среде, что приводит к наблюдаемому уменьшению количества индуцированных отростков. Таким образом, система позитивной селекции функционирует, как и предполагалось, т.е. использует введенную бета-глюкуронидазу для расщепления глюкуронида цитокинина в генетически трансформированных клетках, высвобождая в этих клетках цитокинин, что и приводит к образованию отростков.
Пример 12.
Модификация системы позитивной селекции для улучшения селективного воздействия глюкуронидов цитокинина.
Как уже было показано (см. табл. 3, пример 3), встречающаяся в растениях собственная бета-глюкуронидаза неактивна при относительно больших значениях pH, т. е. при pH выше приблизительно 6, в то время как введенная бета-глюкуронидаза активна вплоть до pH 8. Добавляя в питательную среду соединение, которое способно повышать pH внутри клетки, в частности нитрат аммония, можно далее улучшить селективное образование отростков от GUS-позитивных клеток, поскольку при этом становится возможным заблокировать любую фоновую активность бета-глюкуронидазы, возникающую в нетрансформированных клетках благодаря собственной бета-глюкуронидазе.
В табл. 13 показано количество отростков, полученных от GUS-позитивных и GUS-негативных дисков листьев табака с использованием различных концентраций натриевой соли BA3GN и нитрата аммония. Используемые методы аналогичны методам, описанным в примере 3, за исключением того, что вместо питательной среда MCO используют питательную среду Gamborg B5.
Как видно из табл. 13, использование соответствующих концентраций натриевой соли BA3GN и нитрата аммония приводит к селективному образованию отростков в GUS-позитивных дисках листьев. Например, сочетание 15 мг/л натриевой соли BA3GN и 55 мМ нитрата аммония позволяет получить 34 отростка от GUS-позитивных дисков листьев и ни одного отростка от соответствующих GUS-негативных дисков листьев, которых подвергают той же самой обработке.
Другим улучшением избирательности системы позитивной селекции с использованием глюкуронидов цитокинина является добавление в питательную среду субстрата, который после своего расщепления под действием бета-глюкуронидазы приводит к повышению pH, ингибируя таким образом гидролиз глюкуронидов цитокинина в нетрансформированных клетках, но не подавляя в то же время воздействие свободного цитокинина.
Этот принцип иллюстрируется экспериментом, в котором изучают воздействие различных концентраций о-кумарил-бета-D-глюкопирануроновой (CouGN) кислоты на образование отростков от (GUS-негативных дисков листьев табака, индуцируемое натриевой солью BA3GN или БА. При расщеплении о-кумарил-бета-D-глюкопирануроновой кислоты под действием бета-глюкуронидазы выделяется о-кумаровая кислота. Как уже отмечалось (см. пример 11), о-кумаровая кислота самопроизвольно превращается в кумарин. При этом происходит отщепление кислотной группы (см. ниже) и наблюдается повышение pH до уровня, при котором активность собственной бета-глюкуронидазы растений заметно снижается.
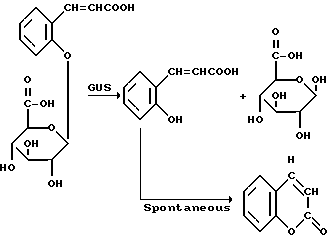
Эксперимент проводят при концентрации БА 0,5 мг/л и концентрации натриевой соли BA3GN 10,0 мг/л. Обрабатывают 12 дисков и через 19 дней регистрируют количество отростков. Полученные результаты представлены в табл. 14.
Приведенные в табл. 14 данные показывают, что присутствие в питательной среде о-кумарил-бета-D-глюкопирануроновой кислоты ингибирует регенерацию, индуцируемую натриевой солью BA3GN, но не БА. Наилучшие результаты получены при проведении этого эксперимента при использовании концентрации о-кумарил-бета -глюкопирануроновой кислоты приблизительно 3-4 мМ. Можно предложить несколько механизмов ослабления процесса образования отростков, индуцированного BA3GN, в том числе: 1) увеличение pH вследствие выделения о-кумаровой кислоты, как это уже пояснялось ранее, 2) конкуренция субстратов между CouGN и BA3GN, которая приводит к уменьшению вероятности гидролиза BA3GN и 3) ослабление механизма доставки BA3GN к клеткам. Хотя точный механизм наблюдаемого ослабления процесса образования отростков в присутствии CouGN не установлен, мы полагаем, что, по крайней мере частично, это ослабление может быть объяснено увеличением значения pH. Во всяком случае, проведенный эксперимент указывает на то, что избирательность системы позитивной селекции можно улучшить путем введения гена бета-глюкуронидазы для создания саморегулируемого механизма, который может значительно ослабить воздействие фонового фермента.
Пример 13.
Получение генетически трансформированных растений.
В приводимой ниже методике описывается общий способ, который можно использовать для получения генетически трансформированных растений.
Образцы растений.
Листья (Nicotina Tabacum "Wisconsin 38") получают от растений, выращенных как в условиях in vitro, так и в условиях in vivo. В последнем случае листья перед проведением трансформации предварительно стерилизуют. Стерилизацию можно проводить, помещая листья на 20 минут в 5%-ный раствор гипохлорита кальция, содержащий 0,1 мл Tween 80 per 1, с последующим ополаскиванием 5 раз в стерилизованной воде. Растения в условиях in vitro выращивают в контейнерах на 1/2 MCO (1/2 MCO - это та же питательная среда MCO с концентрацией 50% за исключением агара, сахара и витаминов).
Листья по очереди помещают в чашки Петри диаметром 14 см. Листья перфорируют или разрезают на кусочки размером приблизительно по 1 кв. см, не используя жилки листа, при этом края образцов состоят из тканей, которые были разрезаны. Любые образцы, которые обесцвечиваются при стерилизации в гипохлорите, отбрасывают.
Выращивание бактерий.
За один день до проведения трансформации начинают выращивать бактерии, прибавляя 2-3 мл раствора с бактериями к 200 мл среды LB, помещенной в колбу Эрленмейера. Выращивают бактерии при перемешивании (300 об/мин) при температуре 28oC.
Трансформация.
Культуру с бактериями разбавляют в 50 раз пли до оптической плотности 0,1 (на длине волны 660 нм) с помощью 1/2 MCO непосредственно перед проведением трансформации. Приблизительно 10 мл разбавленной суспензии бактерий приливают в чашку Петри, диаметром 9 см и опускают в нее кусочки листьев приблизительно на 15 минут. Затем кусочки листьев вынимают и избыток суспензии бактерий удаляют с помощью стерильной фильтровальной бумаги.
Совместное выращивание.
За день до проведения трансформации на чаши для совместного выращивания (обычно содержащие среду MCO) помещают стерильную фильтровальную бумагу, на которую обратной стороной кладут кусочки листьев, которые окунали в суспензию с бактериями. Кусочки листьев выдерживают в ростовой камере в течение 2 дней со следующим режимом: 12 часов при освещении, 12 часов в темноте.
Отбор/регенерация.
Кусочки листьев переносят в чашки Петри, содержащие, как уже отмечалось, глюкуронид цитокинина и либо 350 мг/л карбенициллина + 350 мг/л цефотоксима, либо 800 мг/л одного карбенициллина, в некоторых случаях в сочетании с сульфатом канамицина. Кусочки листьев субкультивируют а течение 3 недель в той же среде, но не содержащей глюкуронид цитокинина.
Анализ.
Регенерированные отростки переносят в контейнеры с 1/2 MCO. Приблизительно через 2 недели зеленые отростки подвергают анализу с использованием X-gluc. В случае необходимости отростки субкультивируют.
Выращивание растений.
Генетически трансформированные отростки, которые имеют корни (и являются GUS-позитивными) выращивают в ростовой камере. Отростки выращивают в подходящей среда, например, на сфагнуме. Затем их покрывают пластмассовыми пакетиками и выращивают в течение приблизительно 1 недели, после чего уголки пластмассовых пакетиков отрезают. Еще через одну неделю пластмассовые пакетики удаляют.
Пример 14.
Индуцирование образования отростков растительных тканей, содержащих и не содержащих введенный ген бета-глюкуронидазы с использованием стеринов и ди-бета-глюкуронида.
Проводят испытания, аналогичные описанным в примерах 5 и 6, дисков GUS-позитивных и GUS-негативных листьев табака, используя питательные среды, содержащие 100 мг/л бета-ситостерина, 100 мг/л холестерина, 10 мг/л кампестерина, 1,88 мг/л натриевой соли BA3GN и различные концентрации дибета-глюкуронида глицирризовой кислоты в виде диаммониевой соли. Далее, половина субстратов содержит 0,1 мМ тридеморфа. Количество отростков регистрируют через 17 дней.
Полученные результату представлены в табл. 15..
Как видно, сочетание стерина и диаммониевой соли глицирризовой кислоты приводит к селективному образованию отростков в дисках листьев, содержащих введенный ген бета-глюкуронидазы. Как уже отмечалось ранее (см. пример 5), тридеморф подавляет синтез стеринов и таким образом оказывает ингибирующее воздействие на процесс регенерации отростков в том случае, если ткань растения не обеспечивается стеринами. Хотя эффект индуцирования образования отростков наблюдается в питательных средах как содержащих, так и не содержащих тридеморф, наибольшее количество отростков получено для субстратов, содержащих тридеморф, особенно при концентрации диаммониевой соли глицирризовой кислоты равной 0,125 мМ.
Пример 15.
Избирательное ингибирование процесса образования отростков, индуцированного BA3GN, в дисках некультурного сорта табака (GUS-).
Проводят эксперименты как описано в примере 3, используя вместо сорта "Wisconsin 38" сорт табака "Burley". С различными концентрациями прибавляют к питательной среде метил-бета-D-глюкуронид (МГ), который гидролизуется под действием GUS, давая метанол и глюкуроновую кислоту, в сочетании либо с 1 мг/л БА или 15 мг/л натриевой соли BA3GN. Как было показано, метанол ингибирует природный фермент GUS, не оказывая большого влияния на введенный фермент, который выделяют из E.coli (Kosugi еt al., 1990, Plant Sci., 133-120), в то время как глюкуроновая кислота, высвободившаяся из метил-бета-D-глюкуронида является продуктом, который ингибирует ферменты GUS. При независимом прибавлении МГ вместо двух указанных соединений продукты гидролиза образуются локально и концентрируются в той части, где находится фермент. Полученные результаты представлены в табл. 16.
Приведенные результаты показывают, что прибавление либо МГ либо глюкуроновой кислоты приводит к уменьшению количества отростков, получаемых на субстрате BA3GN, по сравнению с количеством отростков, получаемых на субстрате БА. Обрабатывая ткани с помощью МГ перед экспрессией введенного фермента GUS, становится, таким образом, возможным избирательно устранять или снижать активность или воздействие собственного фермента GUS в процессе отбора. Различие между введенным и собственным ферментами GUS относительно ингибирования вследствие конкуренции субстратов, чувствительности к ингибированию субстратом, количества фермента (активности) и чувствительности по отношению к ингибированию продуктами также может служить объяснением слияния МГ и других соединений, имеющих похожее воздействие на ткани некультурных растений, обработанных глюкуронидами.
Возможно также, что МГ осуществляет свое воздействие, конкурируя с захватом других глюкуронидов, таких как BA3GN. Если это действительно так, то МГ может использоваться для снижения или подавления захвата других глюкуронидов в клетках некультурных растений. Введение гена, кодирующего фермент GUS, который выделяется, или гена, кодирующего глюкуронидпермиазу, может использоваться для отбора трансгенных клеток в том случае, если захват ингибируется, например, прибавлением МГ к субстрату. В случае глюкуронидпермиазы лишь трансгенные клетки получат глюкуронид (например, BA3GN) и обычно благодаря присутствию в растениях собственного фермента (см., в частности, пример 3) соединение будет активироваться внутри клеток, отражая действие пермиазы (или другого белка, который облегчает захват глюкуронидов).
Интересно также, что сама глюкуроновая кислота способна избирательно ингибировать воздействие BA3GN, в основном за счет блокирования процесса высвобождения БА из BA3GN под действием GUS.
Пример 16.
Использование позитивной селекции и негативной секции для повышения эффективности отбора трансгенных клеток, тканей или отростков от трудно поддающихся обработке образцов.
Сахарная свекла является весьма непокорной с точки зрения получения трансгенных растений. Многие нетрансформированные отростки "отбираются" в тех условиях, которые приводят к появлению трансгенных отростков в обычных системах трансформирования. То же самое было обнаружено, когда опыты по позитивной селекции (без добавления канамицина) проводили с использованием 5-15 мг/л натриевой соли BA3GN в указанных ниже условиях.
В примере 11 (см. табл. 12) было показано, что комбинация позитивной и негативной селекции приводит к снижению количества "отобранных" нетрансформированных отростков. По указанной причине сочетание позитивной и негативной селекции было опробовано на сахарной свекле и, как оказалось, дало лучшие результаты.
Трансформирование проводят, используя эксплантанты на стадии образования семядоли, как указано ниже.
Семена проращивают в течение 4 дней в темноте в питательной среде, содержащей 0,7 г/л агарозы и 2 г/л сахарозы. Рассаду переносят в контейнер Нунка, содержащий 1/2 питательной среды MCO, и выращивают в течение 3 дней на свету. Семядоли отдаляют от рассады и на черешок листа эксплантантов семядолей кисточкой наносят суспензию Agrobacterium, при этом Agrobacterium имеет 35S-NPT11 и 35S-GUS (оптическая плотность 0,1 на длине волны 660 нм). Семядоли затем совместно выращивают в течение 4 дней в питательной среде, содержащей 1/10 питательной среда MCO и 200 мкМ ацетосирингона. Трансформированные эксплантанты переносят в питательную среду MCO, которая дополнительно содержит 0,25 мг/л БА или 15 мг/л натриевой соли BA3GN (вместо BAP), 0,025 мг/л нафтилуксусной кислоты, 400 мг/л канамицина, 800 мг/л карбенициллина и 25 мг/л ванкомицина, и выдерживают эксплантанты в этой среде в течение 21 дня. Регенерированные отростки затем переносят в контейнер, содержащий ту же самую питательную среду. Через 52 дня выдерживания в указанной питательной среде все отростки переносят в питательную среду MCO которая дополнительно содержит 800 мг/л карбенициллина, 25 мг/л ванкомицина и 0,1 мг/л БА. Через 14 дней отобранные образцы растений подвергают анализу с использованием GUS, как это описано в примере 3.
Полученные результаты приведены в табл. 17.
Как можно видеть, при сочетании позитивной и негативной селекции трансгенные отростки получаются в тех условиях, при которых при использовании традиционной системы негативной селекции никаких трансгенных отростков не образуется. Таким образом, применение системы позитивной селекции в случае сахарной свеклы дает заметные преимущества по сравнению с использованием системы негативной селекции в чистом виде.
В свою очередь это свидетельствует о том, что использование позитивной селекции (в сочетании с негативной селекцией) позволяет получить трансгенные растения и в других трудно поддающихся обработке образцах, в которых наблюдается лишь малая частота трансформирования/селекции или из которых невозможно вообще отобрать трансгенные растения при использовании систем негативной селекции.
Пример 17.
Системы позитивной селекции, основанные на использовании неактивных источников азота, которые становятся доступными при введении преобразующих генов.
Эксперименты проводят так, как описано в примере 3, однако обычное содержание азота в питательной среде уменьшают до нуля. Вместе этого вводят азотсодержащие соединения, указанные в табл. 18. Питательная среда содержит также БА в количестве 1 мг/л. В качестве позитивной контрольной среды используют питательную среду, содержащую нитрат аммония.
Эти опыты проводят с целью установить, являются ли опины неактивными и могут ли они усваиваться клетками растений в качестве источников азота из питательных сред, не содержащих других источников азота. Поскольку гены, которые кодируют ферменты, регулирующие обмен опинов, хорошо известны, то основной предпосылкой для применения опинов в системе позитивной селекции является идентификация опинов, которые не могут использоваться в качестве источника азота тканями и клетками растений, не содержащих введенных генов, которые способствуют усваиванию клетками растения исследуемых опинов. Полученные результаты представлены в табл. 18.
В исследуемых питательных средах, не содержащих азот, было регенерировано некоторое количество отростков. Это становится возможным вследствие того, что азот может быть мобилизован из тканей эксплантанта. Чтобы избежать вообще какого-либо образования отростков в средах, не содержащих азот, количество азота в эксплантантах истощают путем выращивания родственных культур перед использованием в питательных средах, не содержащих азот, или путем предварительной обработки эксплантантов в питательных средах, не содержащих азот, в частности не имеющих гормонов, стимулирующих образование отростков.
Неожиданно было обнаружено, что октопин и нопалин не могут поддерживать процесс образования отростков, в то время как маннопин может служить хорошим источником азота и поддерживает процесс образования отростков от дисков листьев.
Вероятной причиной того, что нопалин и октопин не могут служить источниками азота, является то, что эти соединения не захватываются, не участвуют в обмене веществ и не гидролизуются в усваиваемые соединения. Хорошо известно, что организмы, содержащие гены, участвующие в транспорте и метаболизме опинов, в частности Agrobacterium, способны использовать опины в качестве источников азота, в то время как Agrobacterium или другие штаммы бактерий, не содержащих генов, кодирующих обмен опинов, не в состоянии расти в питательных средах, которые содержат в качестве источника азота лишь опин.
Основываясь на полученных результатах, можно разработать систему позитивной селекции путем введения одного или нескольких генов, контролирующих метаболизм или транспорт опинов в трансгенные клетки растений, используя для селекции питательные среда, не содержащие источников азота, отличных, например, от нопалина или октопина, или с пониженным их содержанием. Идентификация и выделение генов или генетического материала, который обеспечивает реципиенту способность усваивать октопин или нопалин, описаны в литературе: см., например, C.Beaulieu et al., 1988. Can. J.Microbiel., 38: 843-849, P.M. Klapwijk et al., 1976, J.Gen. Microbiol., 96: 155-163; C.L. Scharde and C.I. Kado, 1983, Mol. Gen. Genet., 191: 10-16 или H.Wabiko et al., 1990, J.Gen. Microbiol. , 136: 97-103. При выделении генетического материала, кодирующего метаболизм опинов, эукариотные организмы могут быть трансформированы в соответствии со стандартной методикой, описанной в литературе, с последовательностью, необходимой для функционирования генов, регулирующих обмен опинов.
Из полученных результатов можно заключить, что аналогично могут быть использованы и другие опины и соответствующие гены, регулирующие процессы катаболизма, а также, вероятно могут быть использованы другие неактивные источники азота, которые можно идентифицировать аналогичным образом, и соответствующие им гены, в частности амида в сочетании с амидазами, пептиды в сочетании со специфическими пептидазами и т.д.
Пример 18.
Получение трансгенных наростов от устойчивых образцов с использованием позитивной селекции в сочетании с негативной селекцией.
Проводят эксперименты аналогично примеру 11 с некоторыми изменениями. Использованные образцы растений представляют собой очень трудно поддающиеся обработке партии рассады "V486" озимого масляничного рапса и "S487" ярового масляничного рапса. Семена стерилизуют и проращивают, как описано в примере 16. В качестве эксплантантов используют гипокотилы, на которые наносят культуру бактерий, а затем совместно выращивают в соответствии с примером 11. После совместного выращивания эксплантанты переносят в питательную среду MCO, содержащую 0,1 мг/л нафтилуксусной кислоты, 0,01 мг/л гиббереллиновой кислоты, 500 мг/л карбенициллина, 500 мг/л сульфата канамицина и 6,0 г/л агарозы. Питательная среда дополнительно содержит либо 1 мг/л БА, либо 3,75, 7,5 или 15,0 мг/л натриевой соли BA3GN; pH устанавливают на уровне 5,8. Использованная Agrobacterium содержит в своей Т-ДНК ген GUS и ген неомицинфосфотрансферазы 11, активируемый промотором 35S. Анализы с использованием GUS проводят через 8 недель и в качестве GUS-положительных регистрируют те наросты, которые дают наиболее интенсивное голубое окрашивание. (См.. табл. 19).
Полученные результаты свидетельствуют о том, что для этих, очень трудно поддающихся обработке образцов масляничного рапса лишь сочетание позитивной и негативной селекции позволяет отобрать трансгенные наросты, в то время как при использовании традиционной негативной селекции (питательные среды, содержащие БА вместо BA3GN) GUS-позитивные наросты вообще не могут быть выделены.
Все это указывает на то, что внедрение метода позитивной селекции предоставляет значительные преимущества по сравнению с чистой системой негативной селекции и для получения наростов. Это также указывает на то, что применение позитивной селекции (самостоятельно или в сочетании с негативной селекцией) позволит получать трансгенные растения от других трудно поддающихся обработке образцов, в которых наблюдается малая частота трансформирования/ селекции или от которых вообще нельзя получить трансгенные растения при использовании только систем негативной селекции.
После того, как трансгенный нарост отбирают, его можно регенерировать в трансгенные отростки, например, в питательной среде, содержащей цитокинин в сочетании с ауксином с низкой концентрацией. В течение проведения этого процесса селекция не требуется.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ ИЛИ СЕЛЕКЦИИ ЭУКАРИОТИЧЕСКИХ КЛЕТОК | 1994 |
|
RU2127759C1 |
| СПОСОБ СЕЛЕКЦИИ ГАПЛОИДОВ И ДВОЙНЫХ ГАПЛОИДОВ РАСТЕНИЙ | 1994 |
|
RU2158502C2 |
| МАНИПУЛИРОВАНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТЬЮ ПРОТОПОРФИРИНОГЕНОКСИДАЗЫ У ЭУКАРИОТ | 1995 |
|
RU2192468C2 |
| ДНК-ПОСЛЕДОВАТЕЛЬНОСТЬ ДЛЯ ЭКСПРЕССИИ ГЕНОВ В ТКАНЯХ И ОРГАНАХ | 1993 |
|
RU2128704C1 |
| ФРАГМЕНТ ДНК (ВАРИАНТЫ), СЛИТЫЙ ФРАГМЕНТ ДНК ДЛЯ ЭКСПРЕССИИ В РАСТЕНИЯХ И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО РАСТЕНИЯ И ЕГО ПОТОМКОВ | 1989 |
|
RU2130491C1 |
| ХИМЕРНЫЙ ГЕН, СОДЕРЖАЩИЙ ЕГО РЕКОМБИНАНТНЫЙ ВЕКТОР И СЕМЕННОЙ МАТЕРИАЛ, И СПОСОБЫ, ПРЕДУСМАТРИВАЮЩИЕ ИСПОЛЬЗОВАНИЕ ЭТОГО ГЕНА | 1995 |
|
RU2266332C2 |
| СПОСОБ ТРАНСФОРМАЦИИ РАЗМНОЖАЮЩИХСЯ ПУТЕМ ОПЫЛЕНИЯ РАСТЕНИЙ | 1988 |
|
RU2054482C1 |
| ВЫДЕЛЕННАЯ ДНК, ПРЕДСТАВЛЯЮЩАЯ СОБОЙ ПРОМОТОР (ВАРИАНТЫ), ВЕКТОР, СОДЕРЖАЩИЙ ЭТУ ДНК, И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО РАСТЕНИЯ С ПОМОЩЬЮ ЭТОЙ ДНК (ВАРИАНТЫ) | 1999 |
|
RU2245921C2 |
| ТРАНСФОРМАЦИЯ ГУАРА | 1995 |
|
RU2173345C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ ZEA MAYS L., УСТОЙЧИВЫХ К ПОВРЕЖДЕНИЯМ, ВЫЗЫВАЕМЫМ НАСЕКОМЫМИ | 1988 |
|
RU2126047C1 |
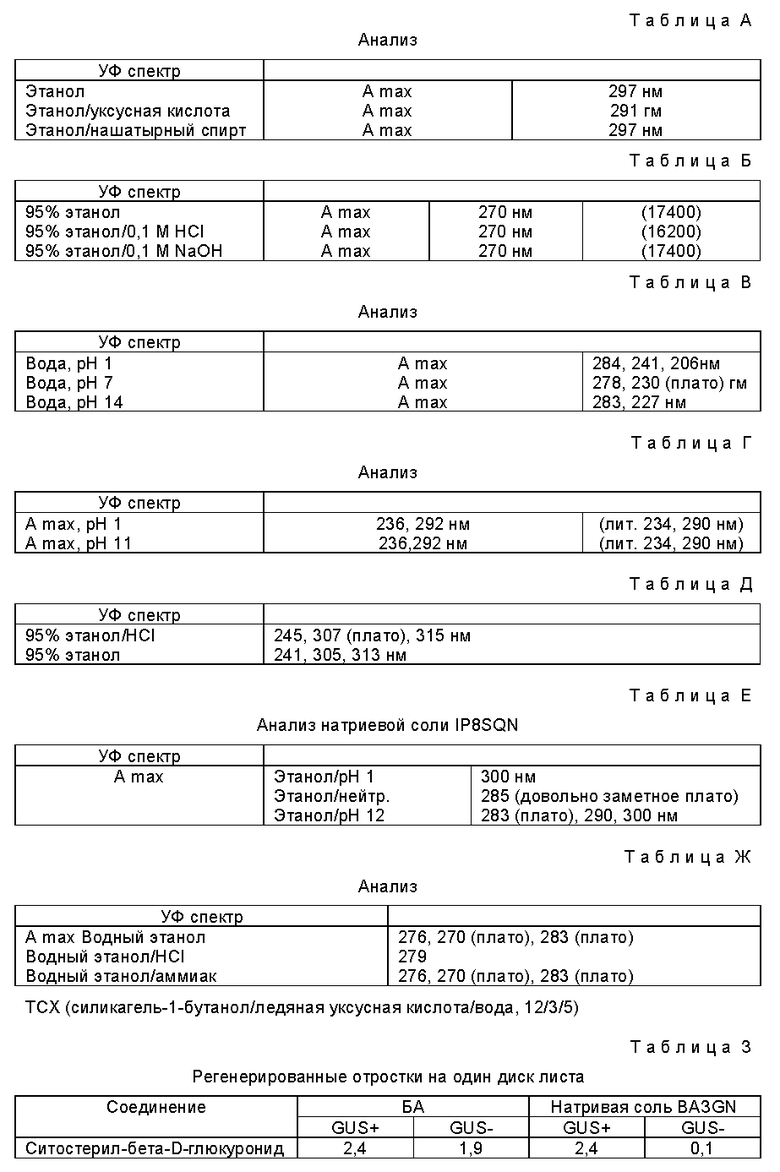
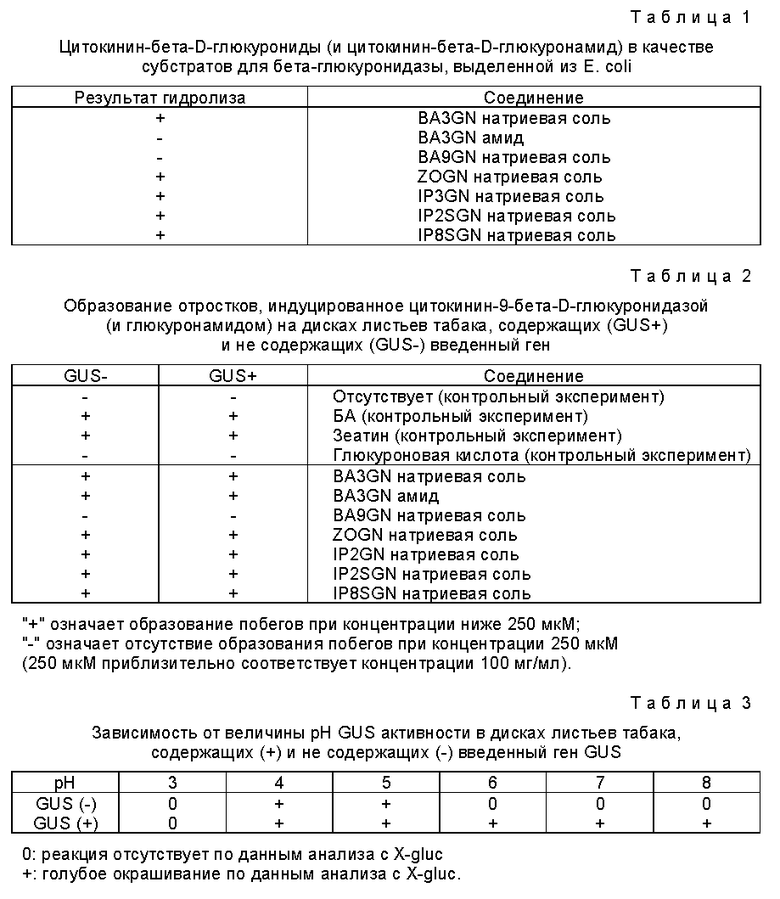




Способ селекции может быть использован для выращивания растений. При трансформации растительных клеток вместе со структурной последовательностью вводят последовательность, кодирующую селективный ген. Последовательности выбирают такие которые одновременно индуцировали бы или усиливали положительное воздействие соединения, вводимого в ростовую среду. Это позволяет выделить трансформированные клетки без повреждения нетрансформированных клеток популяции и без совместного введения гена, обеспечивающего устойчивость к антибиотикам или гербицидам, а также увеличить число побегов у трансгенного растения. 15 з.п.ф-пы, 27 табл.
| Устройство для сборки картеров коробки перемены передач | 1960 |
|
SU131623A1 |
| US 4857467 A, 15.08.89 | |||
| WO 8903880 A, 05.05.89 | |||
| Генная инженерия растений/ Под.ред.Дрейпера Дж., пер с англ | |||
| - М.: Мир, 1991, с.95-103. | |||
Авторы
Даты
1999-02-27—Публикация
1992-08-27—Подача