Изобретение относится к неизвестному до сих пор классу соединений, которые обладают противовоспалительным и иммуномодулирующим действиями, а также проявляют сильную активность в стимулировании дифференциации и ингибировании нежелательной пролиферации некоторых клеток, включая раковые клетки и клетки кожи, к фармацевтическим препаратам, содержащим эти соединения, единицам дозировки таких препаратов, и к их применению в лечении и профилактике гиперпаратиреоза, в частности вторичного гиперпаратиреоза, связанного с почечной недостаточностью, ряда состояний заболеваний, включающих диабет, артериальную гипертонию, угри, облысение, старение кожи, дисбаланс иммунной системы, воспалительных заболеваний, таких, как ревматоидный артрит и астма, заболеваний, характеризуемых аномальной клеточной дифференциацией и/или клеточной пролиферацией, таких, как псориаз и рак, профилактике и/или лечении атрофии кожи стероидного происхождения, для улучшения остеогенеза и лечения остеопороза.
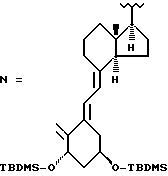
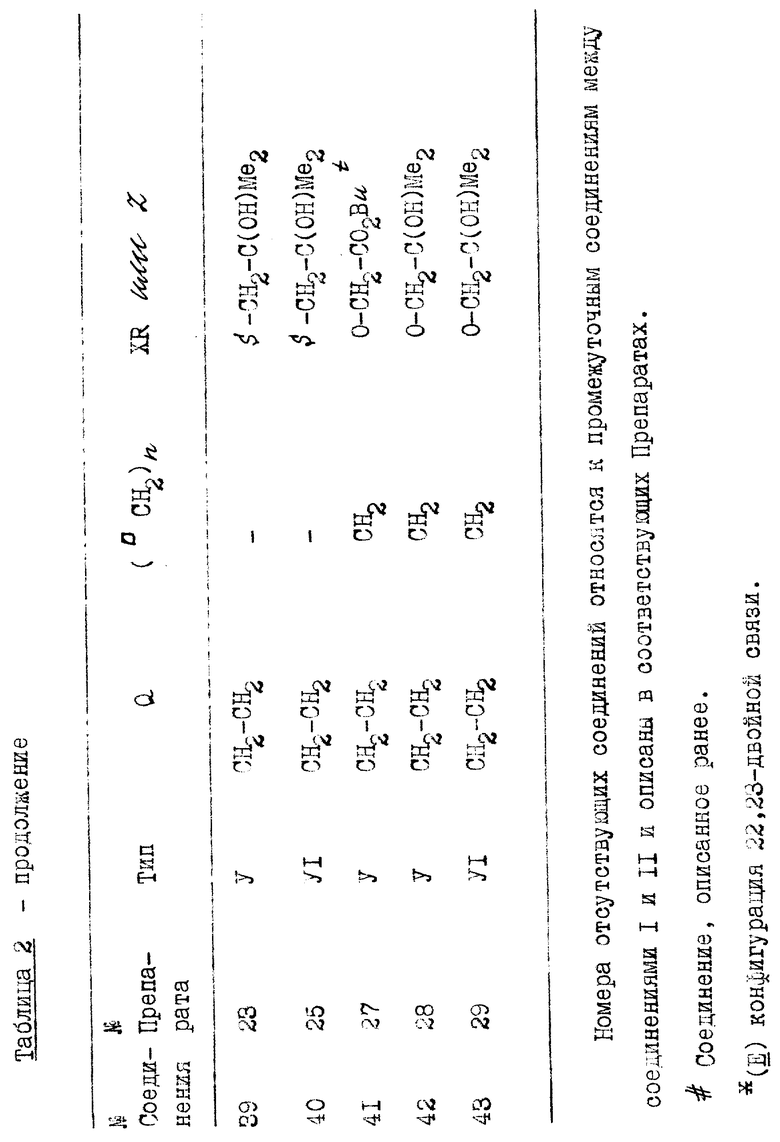
Соединениями настоящего изобретения являются производные 1α, 25-дигидрокси-20-эпи-витамина D3, представленные общей формулой I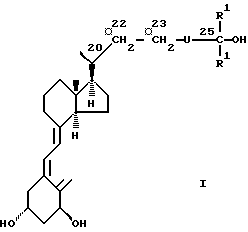
в которой 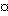 указывает, что этот углерод может быть модифицированным, и группа U, замещающая 24-метилен 1α, 25-дигидрокси-20-эпи-витамина D3, означает (CH2)n-Y-(CH2)m, где n - 0, 1 или 2, m - 1 или 2, и Y - кислород или сера; и производные, образованные замещением либо 22-метилена, либо 23-метилена кислородом, или замещением 22- и 23- метилена группой -CH=CH-; R1 - метил или этил; и в которой один или несколько атомов углерода, непосредственно связанные с C-25, могут замещаться одним или несколькими атомами фтора.
указывает, что этот углерод может быть модифицированным, и группа U, замещающая 24-метилен 1α, 25-дигидрокси-20-эпи-витамина D3, означает (CH2)n-Y-(CH2)m, где n - 0, 1 или 2, m - 1 или 2, и Y - кислород или сера; и производные, образованные замещением либо 22-метилена, либо 23-метилена кислородом, или замещением 22- и 23- метилена группой -CH=CH-; R1 - метил или этил; и в которой один или несколько атомов углерода, непосредственно связанные с C-25, могут замещаться одним или несколькими атомами фтора.
В зависимости от характера цепи, связывающей C-20 и C-25, соединения изобретения могут включать несколько изомерных форм (например, R или S конфигурации на асимметричных атомах углерода, E или Z конфигурации двойных связей). Изобретение охватывает все эти диастереоизомеры в чистой форме или в виде диастереоизомерных смесей. Кроме того, производные I, в которых одна или несколько гидроксигрупп замаскированы как группы, которые можно вновь преобразовать в гидроксигруппы ин виво, также входят в объем изобретения.
Соединения I, в которых гидроксильная группа на углероде-25 замещается водородом, представляют собой другой тип пролекарства. Эти соединения относительно неактивны ин витро, но преобразуются в активные соединения I ферментным гидроксилированием после попадания в организм пациента.
Было выявлено, что 1α, 25-дигидрокcи-витамин D3 (1,25 (OH)2D3) влияет на действия и/или выработку интерлейкинов (Muller и др., Jmmund. Lett 17, 361-366 (1988)), что указывает на потенциальную возможность использования этого соединения в лечении заболеваний, характеризующихся дисфункцией иммунной системы, например аутоиммунных заболеваний, СПИД, реакций "хозяин против трансплантата", и отторжении трансплантатов или других состояний, характеризующихся аномальной выработкой интерлейкина-1, например воспалительных заболеваний, таких, как ревматоидный артрит и астма.
Также было выявлено, что 1,25(OH)2D3 способен стимулировать дифференциацию клеток и тормозить избыточную клеточную пролиферацию (Abe. E. и др., Prac. Natl. Acad. Sci. США, 78, 4990-94 (1981)), и было сделано предположение, что это соединение может быть полезным в лечении заболеваний, характеризующихся аномальной клеточной пролиферацией и/или клеточной дифференциацией, таких, как лейкемия, миелофиброз и псориаз.
Кроме того, предлагалось использовать 1,25(OH)2D3, или его пролекарство 1α-OH-D3 для лечения артериальной гипертонии (Sind. L. и др., Acta Med. Stand. 222, 42S-427 (1987)) и диабета (Jnomata и др., Bone Mineral, 1, 187-192 (1986)). Другое назначение 1,25(OH)2D3 предложено как результат недавнего выявления связи между наследственной устойчивостью к витамину Д и облысением; лечение 1,25(OH)2D3 может способствовать росту волос (Editarial, Lancet 4 марта 1989, стр. 478). Кроме того, факт, что местное применение 1,25(OH)2D3 снижает размер сальных желез в ушах самцов сирийских хомяков, предполагает, что это соединение может быть полезным для лечения угрей (Malloy, V. L. и др. , Tricontinental Meeting for Investigative Dermatol. Вашингтон, 1989).
Однако терапевтические возможности таких показаний 1,25(OH)2D3 сильно ограничены хорошо известным сильным действием этого гормона на обмен кальция; повышенные концентрации в крови будут началом гиперкальциемии. Таким образом, это соединение и его сильнодействующие синтетические аналоги не являются достаточно удовлетворительными для использования в качестве лекарственных средств в лечении, например, псориаза, рака или иммунных заболеваний, которые могут требовать продолжительного назначения лекарства в относительно больших дозах.
Известны многие окса- и тиа-аналоги витамина D3, включая 24-окса, аналог 24a-гомо- 1α , 25-дигидрокси-витамина D3 и его 26,27-диалкил производные (Европейская патентная заявка N 450 743A). Окса-соединения настоящего изобретения структурно отличаются от этих соединений тем, что у них атом кислорода расположен в другой позиции, т.е. 24a или 24b, в еще более удлиненной боковой цепи, и/или тем, что они имеют эпи-конфигурацию в 20-позиции. Был описан ряд 23-окса и 23-тиа соединений (Международная патентная заявка N PCT/DK91/00091). И эти соединения также отличаются от соединений настоящего изобретения тем, что они не содержат связующий атом кислорода или серы в позиции 24 или дальше (т.е. 24a или 24b) в боковой цепи.
Полезность аналога витамина Д в указанных случаях зависит не только от высокой активности, демонстрируемой в ин витро тесте на клеточную дифференциацию, но также от метаболического пути соединения в организме.
Теперь выявлено, что соединения настоящего изобретения проявляют благоприятную селективность по отношению к их действиям на клеточную дифференциацию ин витро и их кальцемические действия ин виво и в то же самое время показывают высокую биологическую доступность, а также химическую и метаболическую стабильность.
Селективность соединений иллюстрируется тем фактом, что хотя концентрация, необходимая для индуцирования клеточной дифференциации в моноцитарной опухолевой клеточной линии человека, та же самая или значительно ниже концентрации 1,25(OH)2D3 для получения такого же эффекта, у крыс ин виво соединения менее активны, чем 1,25(OH)2D3 в индуцировании гиперкальциурии и гиперкальциемии.
Поэтому соединения изобретения особенно пригодны как для местного, так и системного лечения и профилактики нарушений у людей и животных, которые характеризуются 1) аномальной клеточной пролиферацией и/или клеточной дифференциацией, такой, как некоторые дерматологические расстройства, включая псориаз и некоторые формы рака, 2) дисбалансом иммунной системы, например, в аутоиммунных заболеваниях, включая диабет, реакцию "хозяин против трансплантата", и отторжение трансплантатов; и помимо этого, для лечения воспалительных заболеваний, таких, как ревматоидный артрит и астма. Угри, облысение и гипертония - другие состояния, которые можно лечить соединениями изобретения. И наконец, поскольку после местного лечения соединениями изобретения наблюдается утолщение кожи, эти соединения могут быть полезны в лечении или профилактике старения кожи, включая светостарение.
Учитывая низкую тенденцию соединений к образованию гиперкальциемии при продолжительном назначении, они представляют особую ценность в длительном лечении гиперпаратиреоза (особенно вторичного гиперпаратиреоза, связанного с почечной недостаточностью) и в улучшении остеогенеза и лечении остеопороза. По этим показаниям описанные здесь соединения обладают лучшим терапевтическим эффектом, чем соединения известного уровня.
Настоящие соединения можно использовать в комбинации с другими фармацевтическими веществами. В профилактике отторжения трансплантата и реакции "хозяин против трансплантата" лечение настоящими соединениями можно выгодно комбинировать с лечением, например, циклоспорином.
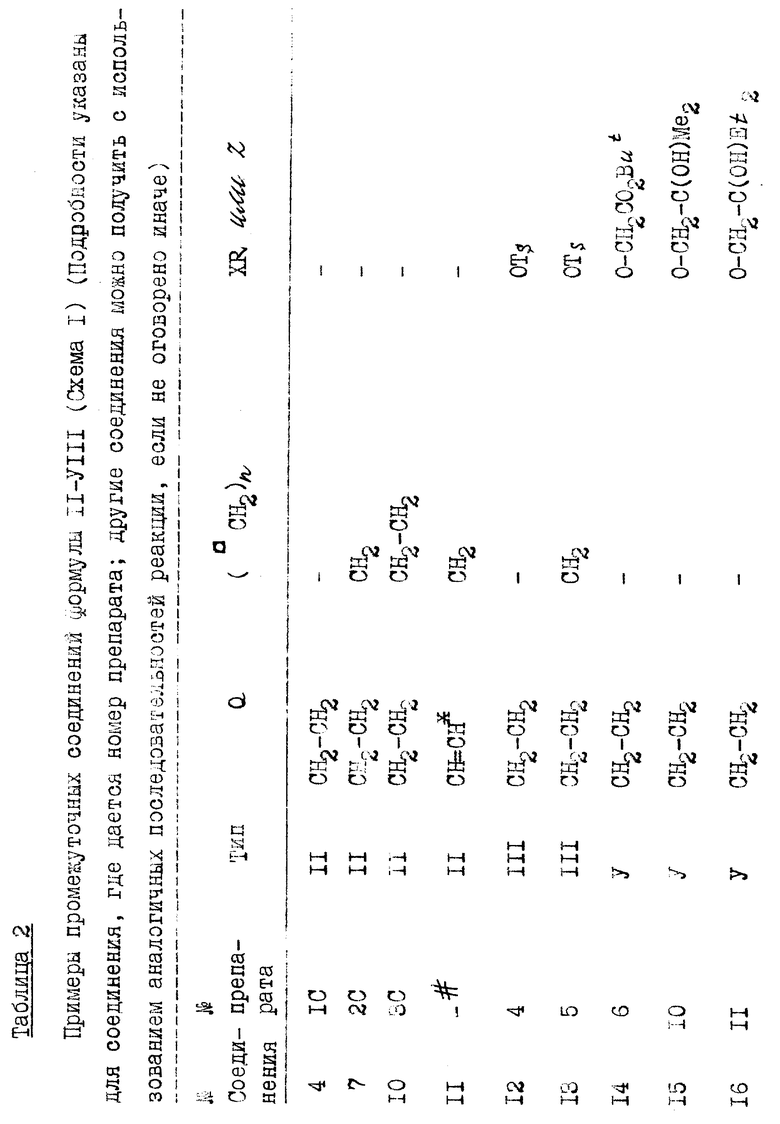
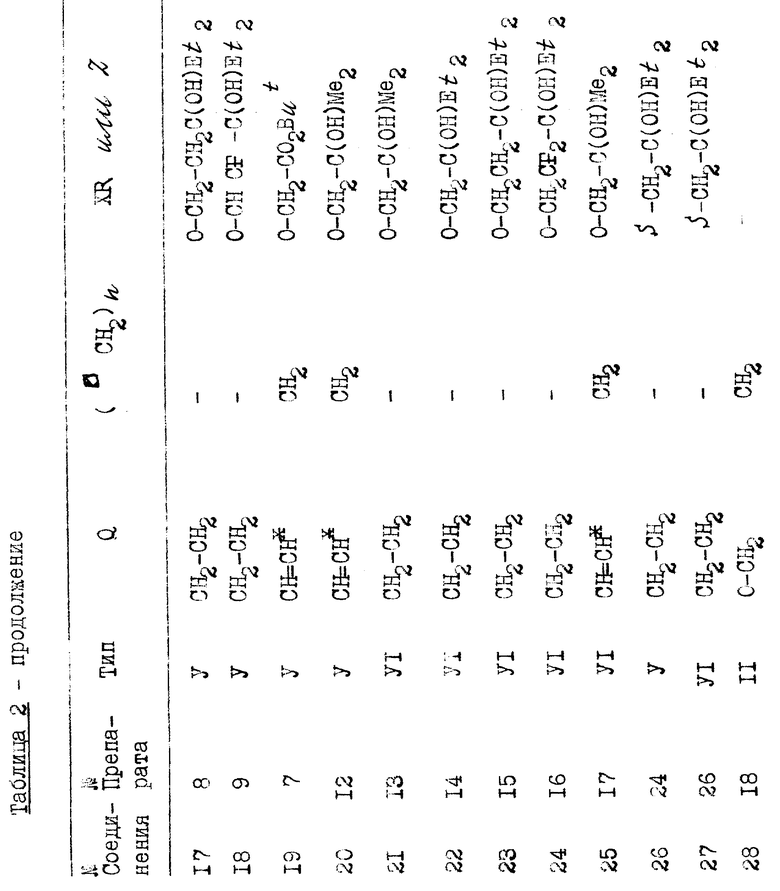
Соединения формулы I можно легко получить из производного I витамина Д (Tetrahedron 43, 4609 (1987)), например, способами, указанными в схеме 1. Способы, используемые для получения ключевых промежуточных соединений II, некоторые из которых являются известными соединениями, не указываются н2а схеме, но некоторые из них показаны в препаратах. Символ "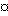 " рядом с атомом углерода (см. формулу I) указывает, что этот метилен
" рядом с атомом углерода (см. формулу I) указывает, что этот метилен 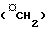 может необязательно замещаться радикалом той же валентности, как показано в Препаратах, Таблицах 1 и 2. В формулах II-VIII, n=0, 1 или 2, и символ Q является заменителем атомов 22 и 23, т.е.
может необязательно замещаться радикалом той же валентности, как показано в Препаратах, Таблицах 1 и 2. В формулах II-VIII, n=0, 1 или 2, и символ Q является заменителем атомов 22 и 23, т.е. 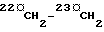 формулы I или группы, которую можно преобразовать в нее.
формулы I или группы, которую можно преобразовать в нее.
В этом раскрытии используются следующие стандартные сокращения: Me = метил; Et = этил; Prn = н-пропил; Pri = изопропил; But = трет-бутил = т-бутил; THP = тетра-гидро-4H-пиран-2-ил; THF = тетрагидрофуран; TS = n-толуолсульфонил; TBA = тетра-(н-бутил)-аммоний; TBDMS = трет-бутилдиметилcилил; DMF = N,N-диметилформамид.
Примечания к Схеме 1
а) Несколько стадий: см. Препараты.
б) Преобразование OH в уходящую группу (например, тозилированием для Z= OTS или бромированием для Z=Br).
в) (i) Нуклеофильное замещение тиоацетатом, (u) гидролиз в щелочной среде.
г) Алкилирование образующим блоком R-Z боковой цепи в присутствии основания (например, NaOH, KOBut, NaH или KH), с катализатором или без него (например, 18-Crown-6, ТВА бромид) в безводном растворителе (например, ДМФ или ТГФ), или в условиях перехода фазы (например, толуол-вода).
д) Реакция с блоком, образующим боковую цепь. R-XH в присутствии основания (например, NaOH, KOBut, NaH или KH), с катализатором или без него (например, 18-Crown-6, ТВА бромид) в безводном растворителе (например, ДМФ или ТГФ) или в условиях перехода фазы (например, толуол-вода).
е) Возможная модификация функциональной группы в боковой цепи.
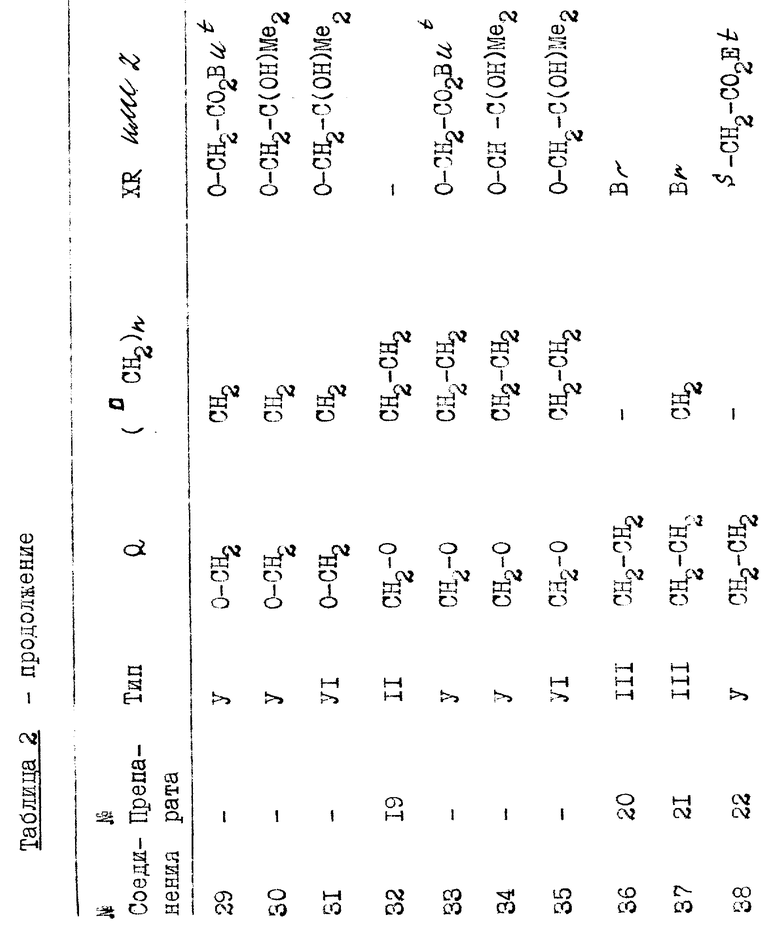
ж) Изомеризация с hu-сенсибилизатором триплета, например, антраценом.
з) Снятие защиты TBA+F- или HF.
Хотя показанные промежуточные соединения могут иметь гидроксильные группы, защищенные как трет-бутил-диметилоилил эфиры, объем изобретения не исключает использования альтернативных гидроксильных защитных групп, хорошо известных в области техники (таких, как те, которые описаны у T.W. Greene, 3ащитные группы в органическом синтезе, Wiley, Нью-Йорк, 1981) вместе с альтернативными реакциями для снятия защиты.
 Алкилирование II или
Алкилирование II или  алкилирование формулы IV для получения VLX = 0 из 11; X = S из IV) достигается обработкой в щелочных условиях блоком образования боковой цепи общей формулы Z-R, в которой Z - уходящая группа, такая, как галоген (Cl, Br или I) или n-толуолсульфонилокси или трифторметаноульфонилокси, и
алкилирование формулы IV для получения VLX = 0 из 11; X = S из IV) достигается обработкой в щелочных условиях блоком образования боковой цепи общей формулы Z-R, в которой Z - уходящая группа, такая, как галоген (Cl, Br или I) или n-толуолсульфонилокси или трифторметаноульфонилокси, и 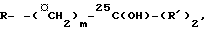 в которой R'- метил или этил, и m = 1 или 2 с тем, чтобы в конечном итоге завершить боковую цепь I (так, что -(□CH2)n-X-(□CH2)m- соответствует "V"), или необязательно радикал, который может быть преобразован в это соединение на любой удобной более поздней стадии (или на нескольких стадиях). Таким образом R в соединениях V, VI, VII и VIII не обязательно имеет одно и то же значение на протяжении определенной последовательности синтеза. Преобразование R в -(□CH2)m-25C(OH)- (R')2 может вовлекать несколько стадий, а также временную защиту чувствительной системы триена молекулы, например, как цикло-аддукт, образованный с диоксидом серы. Другой вариант включает обработку промежуточного соединения III (Z - уходящая группа, как описано выше) в щелочных условиях блоком образования боковой цепи HX-R, в котором X - кислород или сера и R имеет значение, указанное выше, чтобы получить промежуточное соединение V. Помимо необходимой модификации внутри остатка боковой цепи (R), преобразование V в I включает стадию фотоизомеризации и стадию десилилирования, аналогичные стадиям, используемым на последних этапах синтеза других аналогов витамина D (см. европейский патент N 0227826).
в которой R'- метил или этил, и m = 1 или 2 с тем, чтобы в конечном итоге завершить боковую цепь I (так, что -(□CH2)n-X-(□CH2)m- соответствует "V"), или необязательно радикал, который может быть преобразован в это соединение на любой удобной более поздней стадии (или на нескольких стадиях). Таким образом R в соединениях V, VI, VII и VIII не обязательно имеет одно и то же значение на протяжении определенной последовательности синтеза. Преобразование R в -(□CH2)m-25C(OH)- (R')2 может вовлекать несколько стадий, а также временную защиту чувствительной системы триена молекулы, например, как цикло-аддукт, образованный с диоксидом серы. Другой вариант включает обработку промежуточного соединения III (Z - уходящая группа, как описано выше) в щелочных условиях блоком образования боковой цепи HX-R, в котором X - кислород или сера и R имеет значение, указанное выше, чтобы получить промежуточное соединение V. Помимо необходимой модификации внутри остатка боковой цепи (R), преобразование V в I включает стадию фотоизомеризации и стадию десилилирования, аналогичные стадиям, используемым на последних этапах синтеза других аналогов витамина D (см. европейский патент N 0227826).
Может быть удобнее изменить порядок реакции алкилирования (г или д) и реакции фотоизомеризации (ж), в этом случае (5Z)-изомер II, III или IV будет промежуточным соединением.
Блоки образования боковой цепи RZ представляют собой либо известные соединения (несколько из них описаны в международной патентной заявке PCT/DK 89/00079), либо их можно получить аналогично соединениям, описанным в PCT/DK 89/00079. R-Z представляет собой обычно Br-(□CH2)m-25C(OY)-(R′)2, где Y является гидроксильной защитной группой, например, тетрагидропиранилокси или триалкилсилилокси. (Любые такие ТНР эфиры R-Z. которые не описаны в PCT/DK 89/00079, легко получить из соответствующего спирта).
Блоки образования HX-R боковой цепи также соединения известные, или их можно получить способами, аналогичными тем, которые используются для получения таких известных соединений. Синтез новых соединений R-Z или HX-R иллюстрируется в Препаратах. Для случая, где m=1, R-Z может быть Br-CH2CO2But, и HX-R может быть H SCH2CO2Et, и сложноэфирная группа преобразуется реакцией, например, с реактивом Гриньяра, в 25C-(R')2OH.
Как указано в схеме выше, по меньшей мере, для соединений "24-тиа" способ не исключает отнесение алкилирования тиола даже вплоть до последней стадии (например, VIII, R=H->I).
Настоящие изобретения предполагается использовать в фармацевтических композициях, которые полезны в лечении нарушений у людей и животных, как описано выше.
Количество соединения формулы I (далее упоминается как активный ингредиент), необходимое для обеспечения терапевтического эффекта, будет различным в зависимости от конкретного соединения, способа назначения и субъекта лечения. Соединения изобретения могут назначаться парентерально, внутрь сустава, в кишечник или местно. Они очень хорошо всасываются при кишечном назначении и поэтому это предпочтительный способ назначения в лечении системных расстройств. В лечении дерматологических заболеваний, таких, как псориаз, желательны формы для местного или кишечного назначения.
В лечении респираторных заболеваний, таких, как астма, предпочтительны аэрозоли.
Хота активный ингредиент можно назначать в чистом виде, как химическое соединение, все же желательно, чтобы он входил в состав фармацевтического препарата. Наиболее пригодно, если активный ингредиент включен в количестве от 1 части на миллион до 0,1% по весу от препарата.
Под термином "единица дозировки" понимается унифицированная, т.е. разовая доза, которую можно назначать пациенту и которую можно упаковать, так что она будет сохранять химическую и физическую стабильность и содержать активный материал в чистом виде или в виде смеси с твердыми или жидкими фармацевтическими разбавителями или носителями.
Поэтому препараты как для ветеринарного использования, так и для лечения людей включают активный ингредиент вместе с фармацевтически приемлемым носителем, а возможно и другими терапевтическими ингредиентами. Носитель(и) должны быть "приемлемыми" в смысле совместимости с другими ингредиентами препаратов и быть безвредными для пациента.
Препараты имеют форму, приемлемую для орального, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), внутрисуставного и местного назначения.
Препараты могут готовиться в форме единиц дозировки любым из способов, хорошо известных в области фармацевтики. Все способы включают стадию смешивания активного ингредиента с носителем, который включает один или несколько дополнительных ингредиентов. Как правило, препараты готовятся непосредственным и однородным смешиванием активного ингредиента с жидким носителем или мелко измельченным твердым носителем, либо и тем и другим, и затем, при необходимости формованием продукта в нужный препарат.
Препараты настоящего изобретения, пригодные для орального назначения, могут быть в форме отдельных единиц дозировки, таких, как капсулы, пакетики, таблетки или пастилки, каждая с содержанием определенного количества активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной жидкости или неводной жидкости; или в форме эмульсии масло-в-воде или вода-в-масле. Активный ингредиент может также назначаться в форме шариков, электуария или пасты.
Таблетки могут готовиться прессованием или формованием активного ингредиента с одним или несколькими дополнительными ингредиентами. Прессованные таблетки готовятся прессованием в соответствующей машине активного ингредиента в свободно-текучей форме, такой, как порошок или гранулы с возможным введением связующего, смазывающего веществ, инертного разбавителя, поверхностно-активного или диспергирующего агента. Формованные таблетки готовятся формованием в соответствующей для этого машине смеси порошкового активного ингредиента и подходящего носителя, увлажненного инертным жидким разбавителем.
Препараты для ректального назначения могут быть в форме суппозиториев, включающих активный ингредиент и носитель, такой, как масло какао, или в форме клизмы.
Препараты для парентерального назначения обычно содержат стерильный маслянистый или водный препарат с активным ингредиентом, который изотоничен по отношению к крови пациента.
Препараты для назначения внутрь сустава могут быть в форме стерильного водного препарата активного ингредиента, который имеет микрокристаллическую форму, например, в форме водной микрокристаллической суспензии. Липосомные препараты или полимерные системы со способностью биораспада могут также использоваться для назначения активного ингредиента внутрь сустава и для офтальмологического применения.
Препараты для местного назначения, включая местное назначение в глаза, представляют собой жидкие или полужидкие препараты, такие, как линименты, лосьоны, аппликанты, эмульсии масло-в-воде или вода-в-масле, такие, как кремы, мази или пасты; или растворы и суспензии, такие, как капли.
Для лечения астмы можно использовать ингаляции порошка, самораспыляющиеся препараты или спреи, с дозированным распылением из флакона. В таких препаратах размер частиц предпочтительно составляет диапазон от 10 до 100 мкм.
Лучше всего, если такие препараты будут в форме мелко измельченного порошка для назначения в легкие из ингаляциодного устройства или дозирующего закона с распылением. В случае использования самораспыляющегося раствора и спреев эффекта можно достичь либо выбором клапана с нужными характеристиками распыления (т.е. способного дать струю с нужным размером частиц) либо включением активного ингредиента в виде суспендированного порошка с контролируемым размером частиц. Эти самораспыляющиеся препараты могут быть препаратами с выбросом порошка или с выбросом активного ингредиента в виде микрокапель раствора или суспензии.
Самораспыляющиеся препараты с выбросом порошка обычно включают диспергированные частицы твердых активных ингредиентов и жидкое реактивное вещество о температурой кипения ниже 18oC при атмосферном давлении. Жидкое реактивное вещество может быть веществом, пригодным для медицинских целей и включать одно или несколько C1-C6-алкил углеводородов или галогенированных C1-C6-алкил углеводородов или их смесей; при этом особенно предпочтительны хлорированные и фторированные C1-C6-алкил углеводороды. Обычно реактивное вещество включено в препарат в количестве 45-99,9% вес/вес, а активный ингредиент - количество от 1 части/милл до 0,1% вес/вес.
Помимо указанных ингредиентов препараты по изобретению могут включать один или несколько дополнительных ингредиентов, таких, как разбавители, буферы, ароматизирующие агенты, связующие вещества, поверхностно-активные агенты, сгустители, смазывающие вещества, консерванты, например, метил гидроксибензоат (включая антиокислители), эмульгирующие агенты и другие. Кроме этого композиции могут включать и другие терапевтически активные соединения, используемые обычно в лечении вышеупомянутых патологических состояний.
Настоящее изобретение далее касается метода лечения пациентов, страдающих от одного из указанных состояний, этот метод заключается в назначении нуждающемуся в лечении пациенту эффективного количества одного или нескольких соединений формулы I, отдельно или в комбинации с одним или несколькими другими терапевтическими активными соединениями, применяемыми обычно в лечении упомянутых патологических состоянии. Лечение настоящими соединениями или другими терапевтически активными агентами может проводиться одновременно или с интервалами.
При лечении системных нарушений ежедневные дозы соединения формулы I назначаются в количестве от 0,1 до 100 мкг, предпочтительно от 0,2 до 25 мкг. При местном применении в лечении дерматологических нарушений назначаются мази, кремы или лосьоны, содержащие 0,1-500 мкг/г, предпочтительно 1-100 мкг/г соединения формулы I. Оральные композиции назначаются в препаратах, таких как таблетки, капсулы или капли, содержащих 0,05-50 мкг, предпочтительно 0,1-25 мкг соединения формулы I на единицу дозировки.
Далее изобретение будет описано в следующих Препаратах и Примерах, которые не следует рассматривать как ограничивающие его.
Препараты и Примеры
Общие сведения
Приведенные в качестве примеров соединения 1 даются в Таблице 1. Промежуточные соединения Схемы 1, на которые дается ссылка в Препаратах, следует соотносить по номерам с соответствующими формулами в Таблице 2. Они используются для иллюстрации типичного синтеза данных в Примерах соединений 1.
Для спектра ядерно-магнитного резонанса (300 МГц) величины химического смещения (б) указаны в част/милл. для растворов дейтериохлороформа (если не указано иначе) относительно к внутреннему тетраметилсилану (δ = 0) или хлороформу (δ = 7,25). Величина для мультиплета, определенного (дуплет (д), триплет (т), квартет (кв. )), или не определенного (м) на приблизительной средней точке дается, если не указан диапазон (с = синглет, шир. = широкий). Константы сочетания 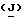 даются в Герцах и иногда приближены к наиближайшей единице.
даются в Герцах и иногда приближены к наиближайшей единице.
Эфиром является диэтиловый эфир и высушивается над натрием. ТГФ высушивался над натрий-бензофеноном. Петролеиный эфир относится к фракции пентана. Если не указано иначе, % означает об./об.%. Если не оговорено иначе, реакции проводились при комнатной температуре. Рабочая процедура включает разбавление конкретным, растворителем (либо органическим растворителем), экстракцию водой и затем соляным раствором, высушивание над безводным MgSO4, и концентрацию в вакууме до получения остатка. Хроматография проводилась на силикагеле.
Общая процедура 1
A: Преобразование тозилата в нитрил с последующим B: Восстановлением до альдегида, и затем C: Восстановление до спирта формулы II (Препараты 1-3)
A: К раствору тозилата (7,50 мМ) в ДМФ (80 мл) при комнатной температуре был добавлен цианид калия (4,97 г, 76,2 мМ) и 18-Crown-6 (0,50 г, 1,89 мМ). После перемешивания в течение 5 часов при 50oC реакционная смесь выливалась в воду и дважды экстрагировалась этилацетатом. Соединенные органические слои промывались несколько раз водой, высушивались над MgSO4 и концентрировались. Остаток очищался хроматографией (75 г силикагеля; 5% EtOAc в петролейном эфире в качестве элюанта) для получения нитрила.
B: К раствору нитрила из Части A (7 мМ) в сухом эфире (30 мл) при -78oC добавлялся 1,0 М раствор гидрида диизобутилалюминия в толуоле (9,0 мл). Реакционная смесь нагревалась до 0oC. После 2 часов добавлялся еще гидрид диизобутилалюминия (6,0 мл) и смесь перемешивалась еще один час при 0oC. Смесь быстро охлаждалась насыщенным водным NH4Cl (5 мл) и метанолом (5 мл) и экстрагировалась этилацетатом. Органическая фаза промывалась водой (дважды) и соляным раствором, затем высушивалась над MgSO4 и концентрировалась в вакууме. После флэш хроматографии (75 г силикагеля; 5% EtOAc в петролейном эфире) был получен альдегид.
C: Перемешанный охлажденный льдом раствор альдегида со стадии B (3,22 мМ) в ТГФ (10 мл) и этаноле (35 мл) обрабатывался боргидридом натрия (0,14 г, 3,54 мМ). После 30 минут реакционная смесь разделялась между этилацетатом и водой, и органический слой промывался соляным раствором и высушивался. После концентрации в вакууме получен спирт формулы II.
Препарат 1A
1(S), 3(E)-бис-трет-бутилдиметилсилилокси-20(S)-цианометил-9,10- секопрегна-5(E),7(E),10(19)-триен(Соединение 2)
Используемым тозилатом является 1(S), 3(R)-бис- третбутилдиметилсилилокси-20(R)-(n-толуолсульфонилоксиметил)- 9,10-секопрегна-5(E), 7(E), 10(19)-триен (5,47 г). Соединение 2: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,85 (с, 9H), 0,89 (с, 9H), 1,09 (д, 3H), 1,00-2,03 (м, 13H), 2,08 (шт. 1H), 2,31 (ш. о, 1H), 2,43 (м, 2H), 2,54 (дд, 1H), 2,88 (м, 1H), 4,21 (м, 1H), 4,52 (м, 1H), 4,94 (м, 1H), 4,98 (м, 1H), 5,82 (д, 1H), 6,43 (д. 1H).
Препарат 1B
1(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-формилметил-9,10- секопрегна-5(E),7(E),10(19)-триен (Соединение 3)
Используемым нитрилом является соединение 2 (4,06 г). Соединение 3: δ 0,05 (м, 12H), 0,57 (с, 3H), 0,86 (с, 9H), 0,89 (с, 9H), 0,94 (д, 3H), 1,10-2,12 (м, 14H), 2,17-2,37 (м, 2H), 2,55 (дд, 1H), 2,65 (дд, 1H), 2,87 (дд, 1H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,98 (м, 1H), 5,83 (д, 1H), 6,44 (д, 1H), 9,74 (дд, 1H).
Препарат 1C
I(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)- (2-гидроксиэтид)-9,10-секопоегна-5(E),7(E),10(19)-триен (Соединение 4)
Используемым альдегидом является соединение 3 (1,89 г). Соединение 4: δ 0,05 (м, 12H), 0,56 (с, 3H), 0,85 (с, 9H), 0,89 (с, 9H), 0,86 (д, 3H), 1,10-2,10 (м, 17H), 2,30 (ш.д. 1H), 2,55 (дд, 1H), 2,87 (м, 1H), 3,55-3,80 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,98 (м, 1H), 5,82 (д, 1H), 6,45 (д, 1H).
Препарат 2A
I(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(2'- цианоэтил-9,10-оекопрегна-5(E),7(E),10(19)триен (Соединение 5)
Используемый тозилат представляет собой 1(S),3(S)- бис-трет-бутилдиметилсилилокси-20(S)-(2'-n-толуолсульфонилоксиэтил) -9,10-секопрегна-5(E), 7(E),10(19)-триен (Соединение 12, препарат 4), (5,57 г).
Препарат 2B
I(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(2'-формилэтил) -9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 6)
Используемый нитрил представляет собой соединение 5 (4,16 г). Соединение 6:  0,05 (ш.с, 12H), 0,55 (с, 3H), 0,85 (д, 3H), 0,85 (с, 9H), 0,88 (с, 9H), 1,20 - 2,05 (м, 16H), 2,25-2,80 (м, 4H), 2,87 (дд, 1H), 4,20 (м, 1H). 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H), 9,77 (т, 1H).
0,05 (ш.с, 12H), 0,55 (с, 3H), 0,85 (д, 3H), 0,85 (с, 9H), 0,88 (с, 9H), 1,20 - 2,05 (м, 16H), 2,25-2,80 (м, 4H), 2,87 (дд, 1H), 4,20 (м, 1H). 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H), 9,77 (т, 1H).
Препарат 2C
1(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(3'-гидрокси-1' -пропил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 7)
Используемым альдегидом является соединение 6 (1,94 г). Соединение 7: δ 0,05 (м, 12H), 0,53 (с, 3H), 0,85 (с, 9H), 0,89 (с, 9H), 0,86 (д, 3H), 1,15-2,05 (м, 19H), 2,30 (шд, 1H), 2,55 (дд, 1H), 2,87 (м, 1H), 3,55-3,70 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,98 (м, 1H), 5,82 (д. 1H), 6,45 (д, 1H).
Препарат 3A
1(3), 3(R)-бис-трет-бутилдиметилсилилокои-20(S)-(3'-циано-1 -пропил)-9,10-секопрегна-5(E),7(E),10(19)-триен Соединение 8)
Используемый тозилат представляет собой 1(S)3(S)- бис-трет-бутилдиметилсилилокси-20(S)-(3'-n-толуолсульфонилокси-1 -пропил)-9,10-оекопрегна-5(E),7(E),10(19)-триен (Соединение 13, Препарат 5) (5,68 г).
Препарат 3B
1(S), 3(R)-био-трет-бутилдиметилсилилокои-20(S)-(3'-формил-1- пропил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 9)
Используемым нитрилом является соединение 8 (4,26 г). Соединение 9: δ 0,05 (ш. с, 12H), 0,55 (с, 3H), 0,85 (д, 3H), 0,85 (с, 9H), 0,88 (с, 9H), 1,05-2,05 (м, 18H), 2,35 (ш.д, 1H), 2,40 (м, 2H), 2,55 (дд, 1H). 2,87 (дд, 1H), 2,87 (дд, 1H), 4,20 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H), 9,77 (т, 1H).
Препарат 3C
1(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(4'- гидрокси-1'-бутил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 10)
Используемый альдегид представляет собой соединение 9 (1,98 г). Соединение 10: δ 0,05 (м, 12H), 0,53 (с, 3H), 0,85 (с, 9H), 0,89 (с, 9H), 0,84 (д, 3H), 1,05-2,05 (м, 21H), 2,30 (ш.д 1H), 2,55 (дд, 1H), 2,87 (м, 1H), 3,64 (т, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,98 (м, 1H), 5,82 (д, 1H), 6,45 (д, 1H).
Общая процедура 2
Преобразование спирта формулы II в тозилат формулы III (Препараты N 4 и 5)
Спирт (1,19 мм) растворяют в дихлорметане (20 мл) и пиридине (1 мл), и раствор перемешивают и охлаждают льдом во время добавления n-толуолсульфонилхлорида (0,81 г, 4,25 мМ). Реакционную смесь выстаивают при комнатной температуре вою новь до разделения между этилацетатом и водой. Органический слой последовательно промывался насыщенным раствором сульфата меди (дважды), водой, 5%-ым бикарбонатом натрия, и рассолом, а затем высушивался и концентрировался в вакууме, флэш хроматографией (50 г силикагеля, 2%-5% этил ацетата в петролейном эфире в качестве элюанта) был получен тозилат.
Препарат 4
1(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(2'- n-толуолоульфонилоксиэтил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 12)
Используемый спирт представляет собой соединение 4 (0,70 г). Соединение 12: δ 0,05 (м, 12H), 0,47 (с, 3H), 0,77 (д, 3H), 0,85 (с, 9H), 1,10-2,05 (м, 16H), 2,29 (ш. д, 1H), 2,43 (с, 3H), 2,54 (дд, 1H), 2,85 (д, 1H), 4,08 (м, 2H), 4,20 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,80 (д, 1H), 6,43 (д, 1H), 7,33 (д, 2H), 7,78 (д, 2H).
Препарат 5
1(S), 3(R)-био-трет-бутилдиметилсилилокси-20(S)-(3'- n-толуолсульфонилокси-1-пропил)-9,10-секопрегна-5(E),7(E),10(19)- триен (Соединение 13)
Используемый спирт представляет собой соединение 7 (0,72 г).
Общая процедура 3
O-алкилирование соединений II для получения соединения Y (Препараты 6, 7 и 27)
Смесь спирта II (2,55 мм), т-бутил бромацетата (1,15 мл, 7,65 мМ) и каталитического количества (200 мг) тетра-н-бутиламмоний бромида энергично перемешивалась всю ночь при комнатной температуре в толуоле (40 мл) NaOH (водный, 20%, 30 мл), реакционная смесь разделялась между этилацетатом и водой, и органический слой промывался рассолом, высушивался над MgSO4, и выпаривался в вакууме. Очистка остатка хроматографией (50% силикагеля, 5% EtOAc в петролейном эфире в качестве элюанта) дала соединение V.
Препарат 6 - Соединение 14
Используемый спирт представляет собой соединение 4 (1,50 г). Соединение 14: δ 0,05 (м, 12H), 0,55 (с, 3H), 0.85 (с, 9H), 0,89 (с. 9H), 0,82-0,92 (д, 3H), 1,47 (с, 9H), 1,00-2,10 (м, 16H), 2,30 (шд, 1H), 2,55 (дд, 1H), 2,86 (м, 1H), 3,53 (м, 2H), 3,93 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H).
Препарат 7 - Соединение 19
Используемым спиртом является соединение 11 (1,53 г). Соединение 19: δ 0,05(м, 12H), 0,51 (с, 3H), 0,86 (с, 9H), 0,88 (с, 9H), 1,11 (д, 3H), 1,47 (с, 9H), 1,05-2,15 (м, 14H), 2,30 (шд, 1H), 2,55 (дд, 1H), 2,85 (м, 1H), 3,92 (с, 2H), 4,02 (м. 2H), 4,21 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,47 (м, 1H), 5,60 (дд, 1H), 5,80 (д, 1H), 6,44 (д, 1H).
Общая Процедура 4
Преобразование Соединений III в Соединения V (Препараты 8, 9, 18, 19 и 22)
Способ A (X=0)
К раствору блока образования боковой цепи R-XH (0,372 мM), добавляется соединение III, гидрид калия (0,187 мл, 20% суспензия в масле) и 18-Crown-6 (98 мг) в сухом ТГФ (6 мл). Смесь перемешивалась при комнатной температуре всю ночь, разбавлялась этилацетатом и экстрагировалась дважды водой и рассолом. После высушивания над MgSO4 и удаления растворителя в вакууме продукт очищался хроматографией (30 г силикагеля; 10% EtOAc в петролейном эфире в качестве элюанта) для получения соединения V.
Способ B (X=S)
Дисперсия гидрида натрия (55% в масле, 60 мг) промывалась петролейным эфиром (3 х 2 мл) в атмосфере аргона. Добавлялся раствор R-XH (0,82 мМ) в ДМФ (высушенный над молекулярными силами (2 мл), с последующим добавлением Соединения III (около 0,5 мМ) в ДМФ (1 мл). После 30 минут реакционная смесь обрабатывалась эфиром (60 мл). Остаток очищался хроматографией с получением соединения V.
Препарат 8 - Соединение 17
С использованием способа A блок R-XH образования боковой цепи представляет собой 3-этил-1,3-пентандиол (91 мг), и соединение III - соединение 12 (139 мг). Соединение 17: δ 0,05 (с, 12H), 0,54 (с, 3H). 0,85 (с, 9H), 0,89 (с, 9H), 0,80-0,90 (м, 9H), 1,51 (м, 4H), 1,71 (т, 2H), 0,75-2,10 (м, 16H), 2,30 (шир.д, 1H), 2,55 (дд, 1H), 2,86 (м, 1H), 3,22 (с, 1H), 3,44 (м, 2H), 3,62 (м, 2H), 4,21 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (м, 1H), 6,44 (д, 1H).
4,4-Дифторо-3-этил-3-триметилсилилокси-5-гексен
Гетерогенный раствор промытого кислотой цинкового порошка (4,74 г, 72,5 мМ), 3-пентанона (3,84 мл, 36,4 мМ), и сухой ТГФ (25 мл) охлаждались до 0oC в бане воды со льдом и медленно добавлялась смесь 3-бром-3,3-дифторпропена (6,00 г, 38,2 мМ) в сухом ТГФ (10 мл). Реакционная смесь выстаивалась при комнатной температуре всю ночь. Затем к реакционной смеси добавлялась водная хлористоводородная кислота (5%, 30 мл) и она перемешивалась 5 минут. Избыток цинка удалялся фильтрацией и промывался эфиром. Органическая фаза промывалась насыщенным раствором бикарбоната натрия, водой (дважды), высушивалась над MgSO4 и концентрировалась. Это масло растворялось в дихлорметане (50 мл), и добавлялись триэтиламин (7,05 мл), 50,8 мМ и 4-(N,N-диметиламино)-пиридин (250 мл). Реакционная смесь охлаждалась до 0oC и по каплям добавлялся хлорид триметилсилила (6,42 мл, 50,8 мМ). Смесь перемешивалась при комнатной температуре всю ночь. Реакционная смесь выливалась в воду и дважды экстрагировалась эфиром. Соединенные органические слои несколько раз промывались водой, высушивались над MgSO4, и выпаривались в вакууме. Остаток очищался хроматографией (50 г силикагеля; 2% EtOAc в петролейном эфире в качестве элюанта) с получением соединения в виде бесцветного масла, δ 0,13 (с, 9H), 0,89 (м, 6H), 1,5-1,8 (м, 4H), 5,43 (м, 1H), 5,63 (м, 1H), 5,92-8,13 (м, 1H).
2,2-Дифтор-3-этил-3-триметилсилилокси-пентанал
4,4-Дифторо-3-этил-3-триметилсилилокси-5-гексен (2,00 г, 8,88 мМ) растворялся в дихлорметане (80 мл), и раствор охлаждался до -78oC. Газообразная смесь O3 в O2 пропускалась в раствор, пока он не стал голубым. Азот барботировался через раствор, чтобы удалить избыточный озон, добавлялся диметилсульфид (3 мл), и раствор медленно доводился до комнатной температуры. После разложения озонида добавлялся дихлорметан и органический слой промывался водой (дважды), высушивался над CaCl2 и концентрировался при пониженном давлении. Флэш хроматография (50 г силикагеля; 5% EtOAc в петролейном эфире в качестве элюанта) дала искомое соединение в виде бледно-желтого масла, δ 0,14 (с, 9H), 0,91 (м, 6H), 1,54 (м, 2H), 1,85 (м, 2H), 9,55 (т, 1H).
2,2-Дифтор-3-этил-3-триметилсилилокси-пентан-1-ол
Перемешанный охлажденный льдом раствор 2,2-дифтор-3-этил-3-триметилсилилокси-пентанала (1,45 г, 6,08 мМ) в ТГФ (5 мл) и этаноле (15 мл) обрабатывался борогидридом натрия (2,76 мг, 7,30 мМ). После 30 минут реакционная смесь разделялась между этилацетатом и водой и органический слой промывался рассолом, высушивался над MgSO4 и концентрировался. После флэш хроматографии (50 г силикагеля; 10% Et OAc в петролейном эфире в качестве элюанта) было получено искомое соединение в виде бесцветного масла, δ 0,15 (с, 9H), 1,35 (т, 6H), 2,48 (м, 1H), 3,93 (м, 2H).
Препарат 9 - Соединение 18
После проведения способа A, блок R-XH образования боковой цепи представляет собой 2,2-дифторо-3-этил-3-триметилсилилокси-пентан-1-ол (289 мг) и соединение III - соединение 12 (200 мг). Процедура изоляции инициировала десилилирование в боковой цепи. Соединение 18: δ 0,05 (с, 12H), 0,54 (с, 3H), 0,86 (д, 3H), 0,86 (с, 9H), 0,90 (с, 9H), 0,93 (т, 6H), 1,10-2,10 (м, 20H), 2,30 (шир.д, 1H), 2,55 (дд, 1H), 2,62 (с, 1H), 2,87 (м, 1H), 3,57 (м, 2H), 3,79 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,94 (м, 1H), 4,98 (м, 1H), 5,81 (м, 1H), 6,44 (д, 1H).
Общая процедура 5
Модификация "XR" в Соединениях V: реакция эстерной функции внутри "R" с металлорганическим реагентом для получения спирта (Препараты 10, 11, 12, 23, 24 и 28)
К раствору сложного эфира V (0,306 мМ) в сухом эфире (5 мл) при -40oC по каплям добавлялся металлорганический реагент. Смесь перемешивалась при -40oC 1/2 часа и при 0oC 1 час. Реакционная смесь выливалась в перемешанную охлажденную льдом смесь эфира (25 мл) и хлорида аммония (1,5 г) в воде (10 мл). Слой эфира отделялся и водный слой экстрагировался еще эфиром (2 х 50 мл). Соединенные эфирные слои промывались последовательно водой (2 х 50) и насыщенным водным хлоридом натрия (50 мл), высушивались и концентрировались в вакууме, флэш хроматография (30 г силикагеля, 10% с повышением до 30% эфира в петролейном эфире в качестве элюента) дала спирт V.
Препарат 10 - Соединение 15
Эстер V представляет собой соединение 14 (215 мг), и металлорганическим реагентом является MeMgBr(3 М раствор в эфире, 1,0 мл). Соединение 15: δ 0,05 (м, 12H), 0,35 (с, 3H), 0,85 (с, 9H), 0,86 (д, 3H), 0,89 (с, 9H), 1,19 (с, 6H), 1,00-2,10 (м, 16H), 2,30 (шир. 1H), 2,32 (с, 1H), 2,55 (дд, 1H), 2,87 (м, 1H), 3,22 (м, 2H), 3,50 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,98 (м, 1H),5,82 (д, 1H), 6,45 (д, 1H).
Препарат 11 - Соединение 16
Эстер V является соединением 14 (215 мг), и металлорганический реагент - EtMgBr (3 М раствор в эфире, 1,0 мл). Соединение 16: δ 0,05 (м, 12H), 0,55 (с, 3H), 0,85 (с, 9H), 0,89 (с, 9H), 0,82-0,92 (м, 9H), 1,50 (м, 4H), 1,10-2,10 (м, 16H), 2,13 (с, 1H), 2,31 (шир.д. 1H), 2,55 (дд, 1R), 2,87 (м, 1H), 3,25 (м, 2H), 3,46 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,98 (м, 1H), 5,82 (д, 1H), 6,45 (д, 1H).
Препарат 12 - Соединение 20
Эстер V является соединением 19 (219 мг), и металлорганический реагент - MeMgBr (3 М раствор в эфире, 1,0 мл). Соединение 20: δ 0,05 (м, 12H), 0,51 (с, 3H), 0,66 (с, 9H), 0,88 (с, 9H). 0,94 (д, 3H), 1,18 (с, 6H), 1,15-2,15 (м. 14H), 2,30 (шир. д, 1H), 2,55 (дд, 1H), 2,85 (м, 1H), 3,22 (м, 2H), 3,96 (м, 2H), 4,21 (м, 1H), 4,52 (с, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,47 (м, 1H), 5,54 (дд, 1H), 5,80 (д, 1H), 6,43 (д, 1H).
Общая процедура 6
Изомеризация соединений V в соответствующие соединения VI (Препараты 13, 17, 25, 26 и 29)
Раствор соединения V (ок. 0,2 г), антрацен (200 мг) и триэтиламин (0,3 мл) в дихлорметане (15 мл) в азоте в колбе из Пирекса облучался светом ультрафиолетовой лампы высокого давления типа TQ718>2 (Hanau) при 10oC 30 минут. Реакционная смесь фильтровалась, концентрировалась в вакууме и очищалась хроматографией для получения соединения VI.
Препарат 13 - Соединение 21
Соединением V является соединение 15, и хроматографические условия были следующими: 30 г силикагеля, 10% эфира в петролейном эфире в качестве элюанта. Соединение 21: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,87 (с, 18H), 0,82-0,92 (д, 3H), 1,19 (с, 6H), 1,10-2,05 (м, 16H), 2,20 (дд, 1H), 2,32 (с, 1H), 2,44 (дд, 1H), 2,82 (м. 1H), 3,23 (м, 2H), 3,50 (м, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,85 (м, 1H), 5,17 (м, 1H), 6,01 (д, 1H), 6,23 (д, 1H).
Препарат 14 - Соединение 22
Соединением V является соединение 16, и хроматографические условия были следующими: 30 г силикагеля, 10% эфира в петролейном эфире в качестве элюанта. Соединение 22: δ 0,05 (м, 12H), 0,53 (с, 3H), 0,87 (с, 18H), 0,82-0,92 (м, 9H), 1,52 (м, 4H), 1,00-2,05 (м, 16H), 2,13 (с, 1H), 2,21 (дд, 1H), 2,44 (дд, 1H), 2,82 (м, 1H),3,24 (м, 2H), 3,46 (м, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,85 (м, 1H), 5,17 (м, 1H), 6,01 (д, 1H), 6,22 (д, 1H).
Препарат 15 - Соединение 23
Соединением V является соединение 17, и хроматографические условия были следующими: 30 г силикагеля, 10% эфир в петролейном эфире в качестве элюанта. Соединение 23; δ 0,05 (м, 12H), 0,52 (с, 3H), 0,87 (с, 18H), 0,75-0,95 (м, 9H), 1,71 (т, 2H), 1,15-2,05 (м, 20H), 2,20 (дд, 1H), 2,43 (дд, 1H), 2,81 (м, 1H), 3,22 (ш. с, 1H), 3,43 (м, 2H), 3,61 (м, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,85 (м, 1H), 5,17 (м, 1H), 6,00 (д, 1H), 6,22 (м, 1H).
Препарат 16 - Соединение 24
Соединение V является соединением 18, и хроматографические условия были следующими: 30 г силикагеля, 10% эфир в петролейном эфире в качестве элюанта. Соединение 24: δ 0,05 (м, 12H), 0,53 (м, 3H), 0,87 (с, 18H), 0,88 (д. 3H), 0,92 (м, 6H), 1,10-2,10 (м, 20H), 2,21 (дд, 1H), 2,43 (дд, 1H), 2,63 (с, 1H), 2,82 (м, 1H), 3,56 (м, 2H), 3,80 (м, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,85 (м, 1H), 5,17 (м, 1H), 6,00 (д, 1H), 6,22 (д, 1H).
Препарат 17 - Соединение 25
Соединение V является соединением 20, и хроматографмческие условия были таковы: 30 г силикагеля, 10% с увеличением до 30% эфира в петролейном эфире в качестве элюанта. Соединение 25: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,87 (с, 18H), 0,94 (д, 3H), 1,18 (с, 6H), 1,10-2,15 (м, 14H), 2,20 (дд, 1H), 2,32 (с, 1H), 2,44 (дд, 1H), 2,82 (м, 1H), 3,22 (с, 2H), 3,96 (м, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,86 (м, 1H), 5,17 (м, 1H), 5,47 (м, 1H), 5,54 (дд, 1H), 6,01 (д, 1H), 6,23 (д, 1H).
Препарат 18 - Соединение 28
Соединение было получено O-алкилированием 1(S)-3(R)-бис-трет- бутилдиметилсилилокси-20(R)-гидрокси-9,10-секопрегна-5(E), 7(E),10(19) -триена KH и аллил бромидом в ТГФ с последующим преобразованием продукта в SO2-аддукт реакцией с жидким SO2. Озонолиз двойной связи боковой цепи с восстановительной процедурой (O3 в CH2Cl2-MeOH и затем NaBH4) и в конечном итоге расщепление SO2 (NaHCO3, кипящий этанол) дали искомое соединение.
Препарат 19 - Соединение 32
Соединение было получено способом препарата 18, но с использованием 1(S), 3(R)-бис-трет-бутилдиметилсилилокси- 20(R)-гидроксиметил-9,10-секопрегна-5(E),7(E),10(19)-триена в качестве исходного материала.
Общая процедура 7
Преобразование спирта формулы II в бромид формулы III (Препараты 20 и 21)
Трифенилфосфин (507 мг, 1,93 мМ) и пиридин (0,64 мл, 7,73 мМ) добавлялись к раствору спирта (около 1,5 мМ) в дихлорометане (10 мл) при 0oC в атмосфере аргона. После этого по каплям добавлялся раствор четырехбромистого углерода (640 мг, 1,93 мМ) в дихлорметане (10 мл) с перемешиванием. После перемешивания в течение 1 часа при температуре 25oC растворитель удалялся при пониженном давлении и остаток промывался этилацетатом/петролейным эфиром (2: 8) (2 х 20 мл), чтобы удалить большую часть Ph3PO. Органический слой промывался водой и рассолом, высушивался над MgSO4 и концентрировался. Остаток очищался хроматографией (30 г силикагеля, 5% этилацетата в петролейном эфире в качестве элюанта) с получением нужного соединения в виде масла.
Препарат 20
I(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(2'- бромоэтил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 36)
Используемый спирт является соединением 4 (0,90 г).
Соединение 36: δ 0,05 (м, 12H), 0,57 (с, 3H), 0,85 (с, 9H), 0,90 (с. 9H), 0,85-0,32 (д, 3H), 1,00-2,50 (м, 17H), 2,55 (дд, 1H), 2,88 (м, 1H), 3,30-3,58 (м, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,94 (м, 1H), 4,98 (м, 1H), 5,82 (д, 1H), 6,45 (д, 1H).
Препарат 21
I(S), 3(R)-бис-трет-бутилдиметилсилилокси-20(S)-(3'-бромо-1 -пропил)-9,10-секопрегна-5(E),7(E),10(19)-триен (Соединение 37)
Используемый спирт является соединением 7 (0,90 г).
Препарат 22 - Соединение 38
После Общей Процедуры 4, способ B, R-XH представляет собой этилмеркаптоацетат (0,23 мл) и соединением III является соединение 36 (918 мг). Соединение 38: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,85 (с, 9H), 0,90 (с, 9H), 0,85-0,92 (д, 3H), 1,28 (т, 3H), 1,15-2,10 (м, 16H), 2,30 (ш. д, 1H), 2,55 (м, 2H), 2,72 (м, 1H), 2,86 (м, 1H), 3,20 (с, 2H), 4,18 (, 2H), 4,20 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м. 14), 5,82 (д, 1H), 6,44 (д, 1H).
Препарат 23 - Соединение 39
После Общей Процедуры 5, сложным эфиром V является соединение 38 (200 мг), и метил-органический реагент MeMgBr (3 М раствор в эфире, 0,8 мл). Соединение 39: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,85 (с, 9H), 0,86 (д, 3H), 0,89 (с, 9H), 1,26 (с, 6H), 1,10-2,07 (м, 16H), 2,30 (бд, 1H), 2,36 (бс, 1H), 2,65 (с, 2H), 2,45 - 2,72 (м.3H), 2,87 (м, 1H), 4,21 (м, 1H), 4,52 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H).
Препарат 24 - Соединение 26
После Общей Процедуры 5, соединением 33 является эстер V (164 мг) и метил-органический реагент - это Et MgBr (3 М раствор в эфире, 0,64 мл). Соединение 26: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,86 (с, 9H), 0,90 (с, 9H), 0,84-0,90 (м, 9H), 1,15-2,10 (м, 20H), 2,15 (с, 1H), 2,3O (бд, 1H), 2,40-2,72 (м, 5H), 2,87 (м, 1H), 4,21 (м, 1H), 4,52 (м, 1H), 4,94 (м, 1H), 4,98 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H).
Препарат 25 - Соединение 40
После общей Процедуры 6, соединением V является соединение 39, и хроматографические условия были таковы: 30 г силикагеля, 5% с увеличением до 10% этилацетата в петролейном эфире в качестве элюанта. Соединение 40: δ 0,05 (м, 12H), 0,53 (с, 3H), 0,86 (с, 18H), 0,87 (д, 3H), 1,25 (с, 6H), 1,10-2,05 (м, 16H), 2,20 (дд, 1H), 2,38 (ш. с, 1H), 2,64 (с, 2H), 2,30-2,70 (м, 3H), 2,81 (м, 1H), 4,18 (м, 13), 4,36 (м, 1H), 4,85 (м, 1H), 5,17 (м, 1H), 6,00 (д, 1H), 6,22 (д, 1H).
Препарат 26 - Соединение 27
После Общей Процедуры 6, соединение V является соединением 26, и хроматографические условия были следующими: 30 г силикагеля, 2% с увеличением до 5% этилацетата в петролейном эфире в качестве элюанта. Соединение 27: δ 0,05 (м, 12H), 0,53 (с, 3H), 0,87 (с, 18H), 0,75-1,00 (м, 9H), 1,05-2,07 (м, 20H), 2,17 (ш. с, 1H), 2,20 (дд, 1H), 2,40-2,70 (м, 5H), 2,81 (м, 1H), 4,20 (м, 1H), 4,36 (м, 1H), 4,85 (м, 1H), 5,16 (м, 1H), 6,00 (д, 1H), 6,22 (д, 1H).
Препарат 27 - Соединение 41
После Общей Процедуры 3, используемым спиртом является соединение 7 (1,54 г). Соединение 41: δ 0,05 (м, 12H), 0,52 (с, 3H), 0,85 (с, 9H), 0,85 (д, 3H), 0,89 (с, 9H), 1,47 (с, 9H), 1,05-2,05 (м, 16H), 2,30 (ш. д, 1H), 2,55 (дд, 1H), 2,86 (м, 1H), 3,48 (м, 2H), 3,93 (с, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,93 (м, 1H), 4,97 (м, 1H), 5,81 (д, 1H), 6,44 (д, 1H).
Препарат 28 - Соединение 42
После Общей Процедуры 5, эстером V является соединение 41 (219 мг), и метанол-органический реагент - это MeMoCl (3 М раствор в эфире (1,0 мл). Соединение 42: 0,05 (м, 12H), 0,53 (с, 3H), 0,85 (с, 9H), 0,85 (д, 3H), 0,89 (с, 9H), 1,1 - 2,05 (м, 26H включая 1,19 (с,6H)), 2,31 (ш.д, 1H), 2,33 (с, 1H), 2,55 (дд, 1H), 2,87 (м,1H), 3,22 (с, 2H), 3,45 (т, 2H), 4,21 (м, 1H), 4,53 (м, 1H), 4,92 (м, 1H), 4,97 (м, 1H),5,81 (д, 1H), 6,44 (д, 1H).
Препарат 29 - Соединение 43
После Общей Процедуры 6, соединением V является соединение 42, и хроматографические условия были следующими: 30 г силикагеля, 10% эфира в петролейном эфире в качестве элюанта. Соединение 43: δ 0,05 (м, 12H), 0,54 (с, 3H), 0,85 (д, 3H), 0,87 (с, 18H), 1,19 (с, 6H), 1,10-2,05 (м, 18H), 2,20 (дд, 1H), 2,33 (с, 1H), 2,44 (дд, 1H), 2,82 (м, 1H), 3,22 (с, 2H), 3,45 (т, 2H), 4,18 (м, 1H), 4,36 (м, 1H), 4,86 (м, 1H), 5,17 (м. 1H), 6,01 (д, 1H), 6,23 (д, 1H).
Общая Процедура 8A:
Преобразование соединение VI в соответствующее соединение I десилилированием тетра-н-бутиламмонийфторидом (Примеры 1-6)
Раствор соединения VI(0,3 мМ) и тетра-н-бутиламмоний фторида тригидрата (1,2 мМ) в ТГФ (10 мл) в N2 перемешивался 1 час при 60oC. После охлаждения реакционная смесь разделялась между этилацетатом и 2 % раствором бикарбоната натрия. Обработка и очистка хроматографией дали соединение I.
Общая Процедура 8B
Преобразование Соединение VI в соответствующее соединение I десилилированием HF (Примеры 7 и 8)
Соединение V (около 0,2 г) растворялось в этилацетате (0,6 мл) и ацетонитрил (8 мл) добавлялся с энергичным перемешиванием. Добавлялся раствор 5% фтористоводородной кислоты в ацетонитриле/воде 8:1 (4,0 мл) и реакционная смесь перемешивалась в азоте при комнатной температуре 90 минут. Был добавлен в избытке 4N водный раствор NaOH и реакционная смесь обрабатывалась этилацетатом. Остаток очищался хроматографией о получением соединения.
Пример 1
1(S), 3(R)-Дигидрокси-20(S)-[2-(2-гидрокси-2-метил-1-пропокси) этил] -9,10-секо-прегна-5(z),7(E),10(19)-триен (Соединение 101)
С проведением процедуры 3A: соединение VI становится соединением 21, и хроматографические условия были следующими: 30 г силикагеля; 60% этилацетат в петролейном эфире в качестве элюанта. Соединение 101: δ 0,56 (с, 3H), 0,86 (д, 3H), 1,20 (с, 6H), 1,10-2,40 (м, 20H), 2,60 (д, 1H), 2,83 (м, 1H), 3,23 (м, 2H), 3,50 (м, 2H), 4,23 (м. 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м, 1H), 6,02 (д, 1H), 6,38 (д, 1H).
Пример 2
1(S), 3(R)-Дигидрокси-20(S)-[2-(2-гидрокси-2-этил-1- бутокси)этил] -9,10-секо-прегна-5(Z), 7(E), 10(19)-триен (Соединение 102)
С проведением процедуры 8A: соединение VI становится соединением 22, и хроматографические условия были следующими: 30 г силикагеля; 60% этилацетат в петролейном эфире в качестве элюанта. Соединение 102: δ 0,56 (с, 3H), 0,85 (д, 3H), 0,86 (т, 6H), 1,15-2,10 (м, 22H), 2,15 (с, 1H), 2,31 (дд, 1H), 2,60 (дд, 1H), 2,83 (м, 1H), 3,26 (м, 2H), 3,47 (м, 2H), 4,23 (м, 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м, 1H), 6,02 (д, 1H), 6,38 (д, 1H).
Пример 3
1(S), 3(R)-Дигидрокси-20(S)-[2-(3-гидрокси-3-этил-1-пентокси) этил] -9,10-секо-прегна-5(Z), 7(E), 10(19)-(Соединение 103)
После процедуры 8A соединение VI становится соединением 23, и хроматографические условия были следующими: 30 г силикагеля; 60% этилацетат в петролейном эфире в качестве элюанта. Соединение 103: δ 0,55 (с, 3H), 0,85 (д, 3H), 0,86 (т, 6H), 1,72 (т, 2H), 1,15-2,25 (м, 22H), 2,31 (дд, 1H), 2,60 (дд, 1H), 2,83 (м, 1H), 3,24 (ш.с, 1H), 3,44(м. 2H), 4,23 (м, 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м,1H), 6,01 (д, 1H), 6,37 (д.1H).
Пример 4
1(S),3(R)-Дигидрокси-20(S)-[2-(3-гидрокси-3-этил-2,2-дифтор-1- пентокси)этил]-9,10-секо-прегна-5-(Z),7(E),10(19)-триен (Соединение 104)
После процедуры 8A: соединение VI становится соединением 24, и хроматографические условия были следующими: 30 г силикагеля; 60% этилацетат в петролейном эфире в качестве элюанта. Соединение 104: δ 0,54 (с, 3H), 0,85 (д, 3H), 0,93 (т, 6H), 1,15-2,10 (м, 22H), 2,29 (дд, 1H), 2,59 (м, 1H), 2,63 (с, 1H), 2,81 (м, 1H), 3,57 (м, 2H), 3,79 (м, 1H), 4,22 (м, 1H), 4,42 (м, 111), 4,99 (м, 1H), 5,31 (м, 1H). 6.00 (д, 1H), 6,36 (д, 1H).
Пример 5
1(S), 3(R)-Дигидрокси-20(S)-[2-(2-гидрокси-2-метил-1-пропилтио) этил]-9,10-секо-прегна-5(Z),7(E),10(19)-триен (Соединение 107)
После процедуры 8A: соединение VI становится соединением 40, и хроматографические условия были следующими: 15 г силикагеля; 60% этилацета в петролейном эфире в качестве элюанта. Соединение 107: δ 0,56 (с, 3H), 0,86 (д, 3H), 1,27 (с, 6H), 1,10-2,07 (м, 18H), 2,31 (дд, 1H), 2,40 (ш.с, 1H), 2,66 (с, 2H), 2,45-2,72 (м, 3H), 2,83 (м, 1H), 4,23 (м, 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м, 1H),6,02 (д, 1H), 6,37 (д, 1H).
Пример 6
1(S), 3(R)-Дигидрокси-20(S)-[2-(2-гидрокси-2-этил-1- бутилтио)этил] -9,10-секо-прегна-5(Z),7(E),10(19)-триен (Соединение 106)
После процедуры 8A: соединение VI становится соединением 27, и хроматографические условия были следующими: 15 г силикагеля; 60% этилацетат в качестве элюанта. Соединение 106: δ 0,55 (с, 3H), 0,86 (д, 3H), 0,88 (т, 6H), 1,15-2,20 (м, 23H), 2,31 (дд, 1H), 2,45-2,70 (м, 5H), 2,83 (м, 1H), 4,23 (м, 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м, 1H), 6,02 (д, 1H), 6,38 (д, 1H).
Пример 7
1(S), 3(R)-Дигидрокси-20(S)-[3-(2-гидрокси-2-метил-1-пропокси) -проп-1E-ен-1-ил]-9,10-секо-прегна-5(Z),7(Е),10(19)-триен (Соединение 105)
После процедуры 8B: соединение VI становится соединением 25, и хроматографические условия были следующими: 30 г силикагеля; этилацетат в качестве элюанта. Соединение 105: δ 0,51 (с, 3H), 0,93 (д, 3H), 1,17 (с, 6H), 1,10-2,15 (м, 17H), 2,29 (ш.д, 1H), 2,56 (дд, 1H), 2,80 (ш.д, 1H), 3,21 (с, 2H), 3,96 (м, 2H), 4,20 (м, 1H), 4,41 (м, 1H), (м, 1H), 4,98 (ш.т, 1H), 5,30 (м, 1H), 5,45 (м, 1H), 5,55 (м, 1H), 5,99 (д, 1H), 3,35 (д, 1H).
Пример 8
1(S),3(R)-Дигидрокси-20(S)-[3-(2-гидрокси-2-метил-1-пропокси) проп-1-ил] -9,10-секо-прегна-5(Z),7(E),10(19)- (Соединение 108)
После процедуры 8B: соединение VI становится соединением 43, и хроматографические условия были следующими: 30 г силикагеля; этилацетат в качестве элюанта. Соединение 108: δ 0,54 (с, 3H), 0,85 (д, 3H), 1,10-2,06 (м, 26H, включая 1,20 (с, 6H)), 2,31 (м,1H), 2,32 (с, 1H), 2,60 (дд, 1H), 2,83 (м, 1H), 3,23 (с, 2H), 3,45 (т, 2H), 4,23 (м, 1H), 4,43 (м, 1H), 5,00 (м, 1H), 5,33 (м, 1H), 6,02 (д, 1H), 6,38 (д, 1H).
Пример 9
Капсулы, содержащие Соединение 105
Соединение 105 растворялось в арахисовом масле до окончательной концентрации в 10 мкг соединения 105 мл масла. 10 вес. ч. желатина, 5 вес. ч. глицерина, 0,08 вес. ч. сорбата калия и 14 вес. ч. дистиллированной воды смешивались вместе с нагреванием и формовались в мягкие желатиновые капсулы. Каждая из них заполнялась 100 мкл соединения 105 в масляном растворе, так что каждая капсула содержала 1 мкг соединения 105.
Пример 10
Дерматологический крем, содержащий Соединение 105
В 1 г миндального масла растворялось 0,5 мг соединения 105. К этому раствору добавлялось 40 г минерального масла и 20 г самоэмульгирующегося пчелиного воска. Смесь нагревалась до разжижения. После добавления 40 мл горячей воды смесь тщательно смешивалась. Полученный крем содержит приблизительно 5 мкг соединения 105 на грамм крема.


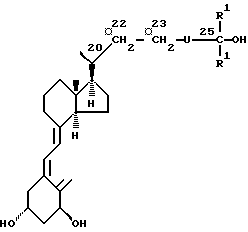
Изобретение относится к неизвестному до сих пор классу соединений, которые обладают противовоспалительными и иммуномодулирующими действиями, к фармацевтическим препаратам, содержащим эти соединения, к способу лечения и к способу получения вышеуказанных соединений. Соединения формулы (I), где U -группа-(СН2)n -У-(СН2)m -, n = 0,1 или 2, m = 1 или 2, У - кислород или сера, при этом 22- или 23-метилен может быть заменен кислородом, или 22- или 23-метилен может быть заменен группой -СН = СН-; R1-метил или этил, а атом углерода, непосредственно связанный с С-25 атомом, может быть замещен одним или несколькими атомами фтора; имеющиеся гидроксигруппы могут быть защищены с помощью групп, способных отщепляться in vivo. Способ получения соединений формулы (I), где гидроксигруппа модифицирована путем взаимодействия с трет-бутилбромацетатом в присутствии основания и катализатора в растворителе с последующим взаимодействием полученного сложного эфира с метил- или этилмагнийгалогенидом с получением соединения, которое подвергают изомеризации в произвольной последовательности при помощи УФ-света в присутствии триплетного активатора и удалению силильных групп тетра-н-бутиламмоний-фторидом или гидрофторидом с образованием соединения формулы (I), где Y и U - кислород. Способ профилактики и лечения патологических состояний D3-витаминотерапией заключается в введении фармкомпозиции, содержащей эффективное количество соединения формулы (I). 5 с.п. и 3 з.п.ф-лы, 2 табл.
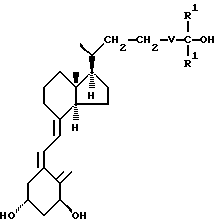
где V - группа - (CH2)n - Y - (CH2)m - ;
n = 0, 1 или 2;
m = 1 или 2;
Y - кислород или сера,
при этом 22-метилен- или 23-метилен может быть заменен кислородом или группой -CH = CH- ;
R1 - метил или этил,
а атом углерода, непосредственно связанный с C-25 атомом, может быть замещен одним или несколькими атомами фтора; имеющиеся гидроксигруппы могут быть защищены с помощью групп, способных отщепляться in vivo.
| Система охлаждения судового дизеля | 1971 |
|
SU450743A1 |
| Огнеупорная бетонная смесь | 1974 |
|
SU474517A1 |
| US 5486509 A, 1996 | |||
| Тринус Ф.П | |||
| Фармако-терапевтический справочник | |||
| - Киев Здоровья, 1989, с.288. | |||
Авторы
Даты
1999-03-27—Публикация
1993-11-01—Подача