Болезнь Альцгеймера (БА) представляет собой дегенеративное расстройство функции головного мозга, клинически характеризующееся прогрессирующей потерей памяти, познавательной способности, рассудка здравомыслия, эмоциональной уравновешенности, что постепенно приводит к полному умственному истощению и, в конечном итоге, к смерти. БА является распространенной причиной прогрессирующего умственного расстройства (слабоумия) пожилых людей и, как полагают, находится на четвертом месте среди наиболее часто встречающихся медицинских причин смерти в США. БА распространена в разных рассовых и этнических группах всего мира и представляет собой серьезную проблему общественного здоровья настоящего времени и будущего. Только в США по подсчетам на сегодняшний день подвержено этому заболеванию приблизительно от двух до трех миллионов человек. Доказано, что в настоящее время БА неизлечима.
Заболевание головного мозга БА проявляется в нейронной деградации и характерных повреждениях, которые определяют как амилоидогенные бляшки, васкулярную амилоидную болезнь кровеносных или/и лимфатических сосудов и связывание тонких нервных волокон в цитоплазме нейрона и его отростках. Большое количество этих поражений, особенно амилоидогенные бляшки и связывание нервных волокон в цитоплазме нейрона, у больных БА, как правило, обнаруживают в некоторых областях головного мозга, которые важны для функции памяти и мышления. Меньшее количество этих поражений и в более ограниченном анатомическом распространении находят в головном мозге пожилых людей, которые не страдают клинической формой БА. Амилоидогенные бляшки и васкулярная болезнь кровеносных и лимфатических сосудов также характерны для головного мозга пациентов с заболеванием Trisomy 21 (синдром Дауна) и наследственным внутримозговым кровоизлиянием с амилоидной дистрофией Dutch - типа (HCHWA-D). В настоящее время для точного диагноза необходимо, как правило, обнаружение вышеуказанных поражений в ткани головного мозга умершего больного пациента или, реже, в небольшом образце ткани головного мозга, взятого на биопсию посредством нейрохирургической операции.
Некоторые линии ясно показывают, что прогрессирующее церебральное отложение отдельных амилоидогенных протеинов, β- амилоиды протеинов, (βAP), играет роль зародыша в патогенезе БА и может предшествовать симптомам расстройства познавательной способности за годы и десятилетия (см., Selkoe, (1991) Neuron 6:487). Недавно было показано, что AP выделяется из нейронных клеток, выращенных в культуре, и присутствует в спинномозговой жидкости (CSF) как здоровых пациентов, так и больных БА (см. Seubert et al., (1992) Nature 359: 325-327).
Возможная корреляция бляшечной патологии разрабатывалась несколькими группами, показывающими прямую βAP-нейротоксичность в отношении выращенных нейронов. Прямая нейротоксичность βAP, как сообщалось ранее, ослабляется сообработкой с TGF-β (Chao et al., Soc. Neurosci. Abs., 19: 1251 (1993)).
Позднее, помимо прямой нейротоксичности, к патологии БА была отнесена воспалительная реакция в головном мозге больных БА, возможно обусловленная βAP. Ограниченное клиническое испытание с NSAID-индометацином продемонстрировало замедление прогрессирования слабоумия Альцгеймера (Rogerset et al., Science, 260: 1719 - 1720 (1993)).
Несмотря на прогресс в изучении и объяснении механизма БА сохраняется необходимость в разработке композиций и способов лечения этого заболевания. Способы лечения БА могли бы успешно основываться на лекарствах, которые способны увеличивать выработку в головном мозге TGF-β, снижая таким образом нейротоксичность, проводимую β-амилоидными пептидами, и уменьшая интенсивность воспалительной реакции, связанной с БА.
Данное изобретение предлагает способы ингибирования болезни Альцгеймера, которые включают введение человеку при необходимости такого лечения эффективного количества соединения формулы I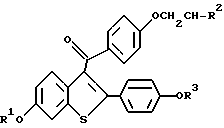
где R1 и R3, независимо друг от друга, - водород, -CH3, 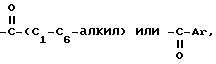
где Ar - необязательно замещенный фенил,
R2 выбирается из группы, состоящей из пирролидино, гексаметиленимино и пиперидино,
и его фармацевтически приемлемой соли и сольвата.
Данное изобретение предлагает способ увеличения выделения TGF-β в головном мозге, включающий введение человеку при необходимости лечения эффективного количества соединения формулы I.
Данное изобретение предлагает также способ ингибирования нейротоксичности, проводимой β- амилоидными пептидами, и воспалительной реакции, связанной с болезнью Альцгеймера (БА), включающий введение человеку при необходимости лечения эффективного количества соединения формулы I.
Данное изобретение связано с открытием того факта, что выбранная группа бензотиофенов формулы I является полезной для ингибирования последствий болезни Альцгеймера и в особенности того, что соединения, как полагают, ингибируют воспалительную реакцию, связанную с этой болезнью, посредством увеличения выделения TGF-β в головной мозг. Изобретение включает способы практического применения посредством введения человеку при необходимости лечения дозы соединения формулы I или фармацевтически приемлемой соли или сольвата, эффективной для ингибирования болезни Альцгеймера. Способы охватывают как терапевтическое, так и профилактическое применение.
Термин "ингибирование" используется в его общепринятом значении, которое включает запрещение, предупреждение, сдерживание, ослабление, остановку, реверсию прогрессирования, ослабления тяжести или симптома заболевания или его последствия.
Термин "эффективное количество" означает количество соединения, необходимое для ингибирования болезни Альцгеймера или любого ее симптома, ингибирование нейротоксичности, проводимой β-амилоидными пептидами, или воспалительной реакции, связанной с болезнью Альцгеймера, или увеличения выделения TGF-β в головном мозге.
Как правило, соединение включается в композицию с обычными носителями, наполнителями, разбавителями, и спрессовывается в таблетки или изготавливается в форме эликсиров или растворов для удобного перорального введения, либо для введения внутримышечно или внутривенно. Соединения могут быть введены трансдермально и могут быть изготовлены в форме с контролируемым выделением действующего вещества и т.п.
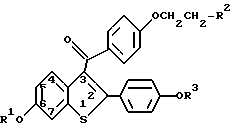
Соединения, использованные в способах данного изобретения, могут быть получены согласно известным методикам или методами, схожими с ними, такими, как подробно описанные в патентах США NN 4133814, 4418068 и 4380635, которые включены в список литературных ссылок данного изобретения. Получение, как правило, начинается с исходного бензо(в)тиофена, имеющего в положении 6 гидроксильную группу, а в положении 2- 4-гидроксифенил. В исходное вещество вводят защитную группу, ацилируют, после чего защитную группу удаляют с получением соединений формулы I. Примеры получения таких соединений приведены в патентах США, указанных выше, и в примерах данного изобретения. Необязательно замещенный фенил включает фенил и фенил, содержащий в качестве заместителя одну или две группы C1-C2-алкил, C1-C4-алкокси, гидрокси, нитро, хлор, фтор или трихлор или фторметил.
Одним из соединений данного изобретения является ралоксифен (raloxifene), строение которого представлено ниже: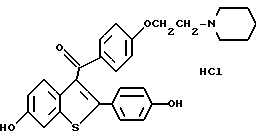
Соединения, применяемые в способах данного изобретения образуют фармацевтически приемлемые кислотно-аддитивные и основно-адитивные соли с широким спектром органических и неорганических кислот и оснований, которые включают физиологически приемлемые соли, часто используемые в фармахимии. Такие соли являются частью данного изобретения. Обычные неорганические кислоты, используемые для таких солей, включают соляную бромводородную, йодводородную, азотную, серную, фосфорную, гипофосфорную и т.п. Соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты и гидроксиалкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты, также могут использоваться. Эти фармацевтически приемлемые соли включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафтали-2-бензоат, бромид, изобутират фенилбутират, -гидроксибутират, бутин-1,4-диат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликлят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, тетрафталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат (propiolate), пропионат, фенилпропионат, салицилат, себацат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензол-сульфонат, п-бромфенилсульфонат, хлорбегзолсульфат, этансульфонат, 2-гидроксиэтансульфаонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфаонат, ксилолсульфонат, тартарат и т.п. Предпочтительной солью является гидрохлорид.
Фармацевтически приемлемые кислотно-аддитивные соли обычно получают реакцией соединения формулы I с эквимолярным количеством или избытком кислоты. Реагенты соединяют в растворителе, взаимно приемлемом для обоих реагентов, таком как диэтиловый эфир или бензол. Соль обычно выпадает в осадок из раствора в пределах временного интервала от 1 часа до 10 часов и может быть выделена фильтрованием, или растворитель отгонят общепринятыми способами.
Основания, используемые обычно для получения основно-адитивных солей, включают гидроокись аммония и гидроокиси щелочных и щелочноземельных металлов, карбонаты, а также алифатические первичные, вторичные и третичные амины, алифатические диамины. Основания, особенно полезные для получения аддитивных солей, включают гидроокись аммония, карбонат калия, метиламин, диэтиламин, этилендиамин и циклогексиламин.
Фармацевтически приемлемые соли обычно обладают лучшими характеристиками растворимости по сравнению с соединениями, из которых они получены, и поэтому часто более удобны для приготовления композиций в виде растворов или эмульсий.
Фармацевтические композиции могут быть изготовлены хорошо известными способами. Например, соединения могут быть введены в композиции с общепринятыми наполнителями, разбавителями или носителями, и изготовлены в форме таблеток, капсул, суспензий, порошков и т.п. Примерами наполнителей, разбавителей и носителей, пригодных для применения в таких композициях, являются: наполнители или разбавители, такие как крахмал, сахара, маннитол и кремниевые производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажнители, такие как глицерин; диспергаторы, такие как карбонат кальция и бикарбонат натрия; агенты замедления растворения, такие как парафин; ускорители ресорбции, такие как четвертичные аммониевые производные; поверхностно-активные агенты, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит; смазывающие агенты, такие как тальк, стеарат кальция и стеарат магния, твердые полиэтиленгликоли.
Соединения могут быть изготовлены в виде эликсиров или растворов для удобного перорального введения или в виде растворов для парентерального введения, например внутримышечно, подкожно или внутривенно. Кроме того, соединения пригодны для изготовления форм с контролируемым выделением действующего вещества и т.п. То есть композиции могут быть составлены таким образом, что они выделяют активный ингредиент только или предпочтительно отдельными частями, возможно через какой-то период времени. Покрытия, обертки и защитные матрицы могут изготавливаться, например, из полимерных веществ или восков.
Соединения формулы I могут вводиться для профилактики и/или для терапевтического лечения болезни Альцгеймера. При терапевтическом применении соединения вводятся пациенту, уже страдающему этим заболеванием.
Конкретная доза соединения формулы I согласно данному изобретению будет зависеть от тяжести заболевания, способа введения и других факторов, которые будут учитываться лечащим врачом. В общем случае, приемлемые и эффективные ежедневные дозы будут составлять от приблизительно 0,1 до приблизительно 1000 мг/день, более типично от приблизительно 50 до приблизительно 200 мг/день. Такие дозы будут вводиться пациенту при необходимости лечения от одного до приблизительно трех раз в день или более часто для обеспечения эффективного лечения.
Часто будет необходимо или обязательно вводить фармацевтические композиции прямо или опосредованно в головной мозг. Прямые методы обычно включают введение катетера с лекарством в вентрикулярную систему пациента для обхода гематоэнцефалического барьера. Непрямые методы, которые являются предпочтительными, включают изготовление композиций для обеспечения латентиирования лекарства путем конверсии гидрофильных лекарств в липид-растворимые лекарства. Латентиация достигается через блокирование гидроксильных, карбоксильных и первичных аминных групп, имеющихся в лекарстве, для повышения липидной растворимости лекарства и его способности преодолевать гематоэнцефалитический барьер. Согласно другому способу, доставка гидрофильных лекарств может быть повышена внутриартериальным вливанием гипертонических растворов, которые могут временно снимать гематоэнцефалитический барьер.
Обычно предпочтительными для применения являются соединения формулы I в форме кислотно-аддитивной соли, которая наиболее распространена для лекарственных средств, имеющих основную группу, такую как пиперидиновый цикл. Для этих целей приемлемыми являются следующие формы.
Композиции
В приведенных ниже композициях термин "Активный ингредиент" означает соединение формулы I.
Композиция 1: Желатиновые капсулы
Твердые желатиновые капсулы получают с использованием следующих компонентов:
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 0,1 - 1000
Крахмал, NF - 0 - 650
Крахмал в виде текучего порошка - 0 - 650
Жидкий силикон 350 сантистокс - 0 - 15
Ингредиенты смешивают, пропускают через сито размером 45 меш (США) и наполняют ими желатиновые капсулы.
Примеры конкретных композиций в форме капсул, которые содержат соединение формулы I, где R2 - пиперидино, (ралоксифен), представлены ниже.
Композиция 2: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Ралоксифен - 1
Крахмал, NF - 112
Крахмал в виде текучего порошка - 225,3
Жидкий силикон, 350 сантистокс - 1,7
Композиция 3: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Ралоксифен - 5
Крахмал, NF - 108
Крахмал в виде текучего порошка - 225,3
Жидкий силикон, 350 сантистокс - 1,7
Композиция 4: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Ралоксифен - 10
Крахмал, NF - 103
Крахмал в виде текучего порошка - 225,3
Жидкий силикон, 350 сантистокс - 1,7
Композиция 5: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Ралоксифен - 50
Крахмал, NF - 150
Крахмал в виде текучего порошка - 397
Жидкий силикон, 350 сантистокс - 3,0
Конкретные композиции, представленные выше, могут быть изменены в соответствии с необходимостью.
Композицию в форме таблеток получают с использованием ингредиентов, представленных ниже.
Композиция 6: Таблетки
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 0,1 - 1000
Микрокристаллическая целлюлоза - 0 - 650
Двуокись кремния - 0 - 650
Стеарат кислоты - 0 - 15
Компоненты смешивают и спрессовывают в формы таблеток.
Таблетки, содержащие каждая 0,1 - 1000 мг активного ингредиента, изготавливают другим способом, представленным ниже:
Композиция 7: Таблетки
Ингредиент - Количество (мг/таблетка)
Активный ингредиент - 0,1 - 1000
Крахмал - 45
Микрокристаллическая целлюлоза - 35
Поливинилпирролидон (в виде 10%-ного раствора в воде) - 4
Натриевая карбоксиметилцеллюлоза - 4,5
Стеарат магния - 0,5
Тальк - 1
Активный ингредиент, крахмал и целлюлозу пропускают через сито размером 45 меш (США) и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученным порошком, после чего образованную смесь пропускают через сито размером 14 меш (США). Полученные таким образом гранулы сушат при температуре 50-60oC и пропускают через сито размера 18 меш (США). Карбоксиметилцеллюлозу натрия, стеарат магния и тальк, предварительно просеянные через сито размером 60 меш (США), добавляют к гранулам, которые после смешения спрессовывают с получением таблеток.
Суспензии, содержащие 0,1 - 1000 мг лекарственного средства в 5 мл, изготавливают следующим образом:
Композиция 8: Суспензии
Ингредиент - Количество (мг/5 мл)
Активный ингредиент - 0,1 - 1000 мг
Натриевая карбоксиметилцеллюлоза - 50 мг
Сироп - 1,25 мг
Раствор бензойной кислоты - 0,10 мл
Вкусовое вещество - г.о.
Краситель - г.о.
Очищенная вода - До 5 мл
Лекарственное средство пропускают через сито размером 45 меш (США) и смешивают с натриевой карбоксиметилцеллюлозой и сиропом с образованием густой пасты. Раствор бензойной кислоты, вкусового вещества и красителя разводят в некотором количестве воды и добавляют при перемешивании. После этого добавляют необходимое количество воды до получения требуемого объема.
Испытания
План испытаний.
Для испытаний 1 и 2 предлагается следующий план эксперимента.
Амилины (amylins) могут быть куплены в Bachen, Inc. (Torrance, California), Peninsula Laboratories, Inc. 3 Belmont, California или могут быть синтезированы как описано ниже. Амилоид -β(1-40) и противоположный β- амилоидный пептид (40-1) могут быть куплены в Bachem, Inc. β2- микроглобулин может быть получен из Sigma Chemical (St. Louis, Missouri).
Маточные растворы пептидов (1μM) вновь приготавливают в стерильной очищенной от пирогена воде и разбавляют до указанных концентраций в определенных культуральных средах. Культуры гипокампа крысы (10 - 14 дней in vitro) обрабатывают пептидами или растворителем в течение 4 дней. Жизнеспособность кортикальных культур крысы визуально оценивают фазово-контрастной микроскопией и количественно оценивают измерением количества лактатдегидрогеназы (LDH), выделенной в культурированную среду.
Испытание 1
Первичные нейроны гипокамна крысы культурируют in vitro стандартными методами выращивания клеток. Амилоид-бета (Aβ)- пептид добавляют к культурированным клеткам при нормальной токсичной концентрации 25 - 50 мМ. Спустя 4 дня после обработки жизнеспособность культуры оценивают измерением количества лактатдегирогеназы, выделенной в культурированную среду. Лактатдегироненазы (LDH) измеряют в 20 мл аликвотах, выдержанных в DMEM, используя стандартную 340 пн кинетическую оценку (Sigma Catalog Number 228 - 20) в 96-ячеечном формате. Опыты осуществляют при 37oC в РС-управляемом считывающем устройстве марки Microplate Biokinetics plate reader (Bio-Tek Instruments) с использованием Delta Soft II software (v. 3.30, Biomet. Inc.) для анализа данных. Качество контрольных стандартов, содержащих нормальный и повышенный уровни сыворотки LDH (например, Sigma Enzyme Controls 2N L 2E), просматривают с каждым испытанием. Результаты представлены в виде единицы (LDH) на литр, где 1 единица определяется как количество энзима, которое будет катализировать образование 1 микромоля пикотинамидадениндинуклеотида в минуту в условиях испытания. Для защиты исследования соединение формулы I добавляют в культуру до и/или одновременно с амилиодом-β.
Активность соединений формулы I демонтируется уменьшением выделения LDH в среду (индикатор нейротоксичности) по сравнению с контролем.
Испытание 2
От пяти до пятидесяти крыс подвергают окклюзии четырех сосудов на 15 минут для индуцирования общей ишемии. Соединение данного изобретения вводят экспериментальным и контрольным животным до, в процессе окклюзии и/или в течение нескольких часов после 15-минутной окклюзии. Спустя 3 дня животных обезглавливают после ишемического инсульта и нейронного поражения в гиппокапусе и неостриатуме и исследуют визуально стандартными гистологическими методами.
Активность соединений формулы I демонтируется уменьшением нейронного поражения.
Испытание 3
От 5 до пятидесяти женщин выбирают для клинического исследования. Женщин являются постклимактерическими, то есть с прекращением менструации за 6 - 12 месяцев до начала исследования, с диагнозом легкой стадии болезни Альцгеймера (БА) и, как ожидается, с ухудшающимся симптомами БА в период исследования, но здоровые во всех других отношениях. Исследование проводят с плацебо-контрольной группой, то есть женщин делят на две группы, одна из которых принимает активный агент данного изобретения, а другая принимает плацебо. У пациентов отмечаются исходные симптомы, характерные для БА, то есть ухудшение памяти, познавательной способности, мыслительной способности и т.д. Женщины опытной группы получают от 50 до 200 мг активного агента в день перорально. Продолжительность курса терапевтического лечения составляет 6 - 36 месяцев. Точное регистрирование исходных симптом сохраняется в продолжении изучения в обоих группах, а в конце изучения эти результаты сравниваются. Сравнение результатов проводят между членами каждой группы и для каждого пациента относительно уровня симптом до начала изучения. Активность исследуемого лекарства иллюстрируется замедлением типичного ослабления познавательной способности и/или нарушений в поведении, связанных с БА.
Полезность соединений формулы I доказывается активностью по меньшей мере в одном из описанных выше испытаний.
Изобретение относится к медицине, конкретно к фармакологии. Предложено средство для ингибирования нейротоксичности, вызываемой β-амилоидными пептидами. В качестве такого средства предложено соединение общей формулы (I), ранее известное как антиэстроген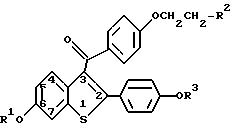
где R1 и R2 независимо друг от друга представляют собой водород; 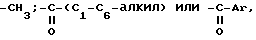
где Ar - необязательно эамещенный фенил; R2 выбирается из группы, состоящей из пирролидино и пиперидино,
или его фармацевтически приемлемой соли или сольвата. Изобретение расширяет арсенал средств указанного назначения. 1 з.п.ф-лы.
где R1 и R3 независимо друг от друга представляют собой водород, 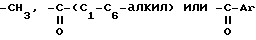
Ar - необязательно замещенный фенил;
R2 выбирается из группы, состоящей из пирролидино и пиперидино,
или его фармацевтически приемлемой соли или сольвата для ингибирования нейротоксичности, опосредуемой β-амилоидными пептидами.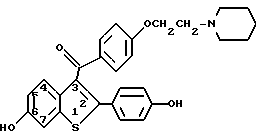
или его гидрохлорид.
| US 4133814 A, 09.01.79 | |||
| Кон Р.М., Рот К.С | |||
| Ранняя диагностика болезней обмена веществ | |||
| - М.: Медицина, 1986, 1986, с.75 - 617. |
Авторы
Даты
1999-04-20—Публикация
1994-12-19—Подача