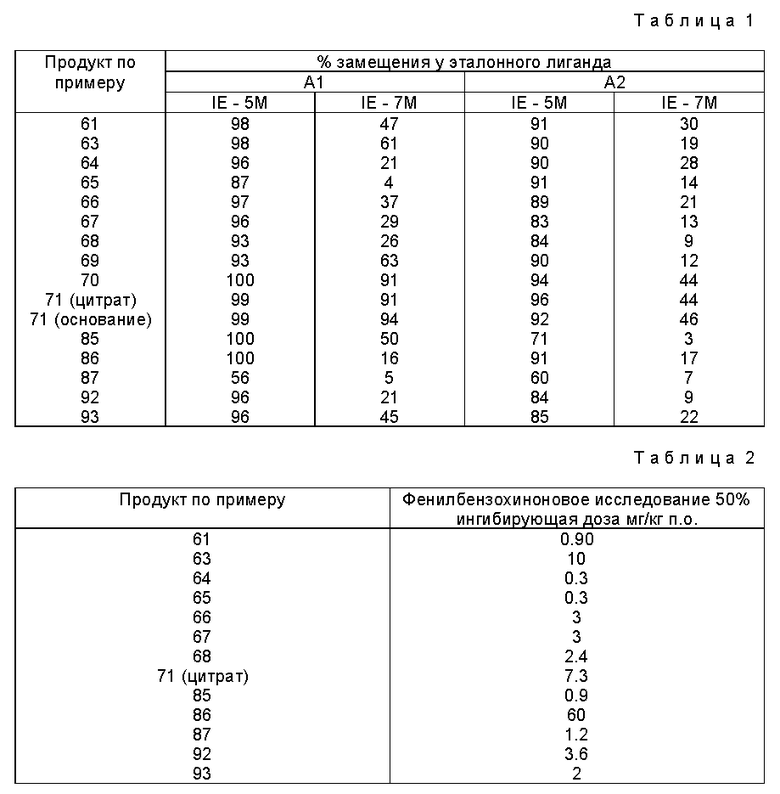
Настоящее изобретение относится к производным аденозина общей формулы I, представленной ниже, в качестве новых соединений и, если возможно, к их солям прибавления, в частности к фармацевтически приемлемым солям.
Предложенные соединения имеют очень ценный фармакологический профиль, поскольку они обладают, с одной стороны, в частности, анальгетическими свойствами, с другой стороны, антигипертензивными свойствами.
Настоящее изобретение относится далее к способу получения указанных продуктов, к синтезу промежуточных продуктов и к применению этих продуктов в терапии.
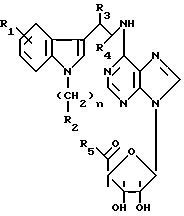
Эти производные аденозина имеют общую формулу I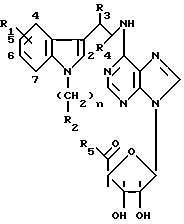
в которой R1 - атом водорода, атом галогена, низший алкильный радикал, низший O-алкильный радикал, низший S-алкильный радикал или фенильный радикал, и может находиться во 2-, 4-, 5-, 6- или 7- положении индола;
n = 0 - 4 целое число;
R2 - низший алкильный радикал, низший алкенильный радикал, низший алкинильный радикал, C3-C7-циклоалкильный радикал или низший O-алкильный радикал, фенильный радикал, незамещенный или замещенный от 1 до 4 одинаковыми или различными заместителями, выбранными из атома галогена, нитро, низшей алкильной, низшей O-алкильной или низшей S-алкильной группы и группы -NR7R8, R7 и R8 являются атомом водорода или низшим алкильным радикалом, гетероциклический радикал, выбранный из пиридина и тиофена, незамещенных иди замещенных от 1 до 4 одинаковыми или различными заместителями, выбранными из атома галогена, нитро, низшей алкильной, низшей O-алкильной или низшей S-алкильной группы, - или, кроме того, когда n равно 2, 3 или 4, группа -NR9R10, R9 и R10 одновременно являются низшим алкильным радикалом или образуют вместе с атомом азота, к которому они присоединены, гетероцикл, выбранный из морфолина, пиперидина и пирролидина,
R3 и R4, одинаковые или различные, являются атомом водорода или низшим алкильным радикалом;
R5 - группа -NHR11, R11 является низшим алкильным радикалом, C3-C7-циклоалкильным радикалом или низшей алкильной цепочкой, обладающей спиртовой или эфирной функциональной группой, или, кроме того, группа -(CH2)n-NR9R10, где n, R9 и R10 определены выше.
Преимущественно производными согласно изобретению являются производные формулы I, в которой R1 - атом водорода, атом галогена, низший алкильный радикал, низший O-алкильный радикал, низший S-алкильный радикал или фенильный радикал, и может находиться во 2- или 5-положении индола, n = 0, 1 или 2, R2 - низший алкильный радикал, низший алкенильный радикал, низший алкинильный радикал, C3-C7-циклоалкильный радикал или низший O-алкильный радикал, фенильный или нафтильный радикал, незамещенный или замещенный от одного до четырех одинаковыми или различными заместителями, выбранными из атома галогена, нитро, низшей алкильной или низшей O-алкильной группы и группы -NR7R8, R7 и R8 являются атомом водорода или низшим алкильным радикалом, гетероциклический радикал, выбранный из пиридина и тиофена, незамещенных или замещенных атомов галогена, или, кроме того, когда n = 2, группа -NR9R10, где R9 и R10 одновременно являются низшим алкильным радикалом или образуют вместе с атомом азота, к которому они присоединены, гетероцикл, выбранный из морфолина, пиперидана и пирролидина, R3 и R4, одинаковые или различные, являются атомом водорода или низшим алкильным радикалом, и R5 - группа -NHR11, где R11 является низшим алкильным радикалом, C3-C7-циклоалкильным радикалом или низшей алкильной цепочкой, обладающей спиртовой или эфирной группой.
В описании и в форму изобретения под низшим алкильным радикалом подразумевают прямую или разветвленную углеводородную цепочку, имеющую от 1 до 6 атомов углерода. Низшим алкильным радикалом является например, радикал метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, гексил или изогексил.
В описании и в формуле изобретения под низшим алкенильным радикалом подразумевают прямую или разветвленную углеводородную цепочку, имеющую от 1 до 6 атомов углерода и обладающую двойной связью, такой, как, например, этенильный радикал, и под низшим алкинильным радикалом подразумевают прямую или разветвленную углеводородную цепочку, имеющую от 1 до 6 атомов углерода и обладающую тройной связью, такой, как например, этинильная группа.
Под C3-C7-циклоалкильным радикалом подразумевают насыщенный циклический радикал, предпочтительно радикал циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Под галогеном подразумевают атом хлора, брома, иода или фтора.
Под низшей алкильной цепочкой, обладающей опиртовой функциональной группой, подразумевают низшую цепочку, в которой один из атомов водорода замещен гидроксильной группой. Такой цепочкой, например, является цепочка 1-гидрокси-2-метилпропан-2-ил.
Под низшей алкильной цепочкой, обладающей эфирной функциональной группой, подразумевают низшую алкильную цепочку, в которой один из атомов водорода замещен низшей O-алкильной группой. Такой цепочкой, например, является цепочка 2-метоксиэтил.
Что касается терапевтических возможностей самого аденозина, то многие производные этого нуклеозида были описаны в литературе. Следующие работы могут быть указаны в качестве примеров: Journal of Medical Chemistry 1973, vol. 16, no. 4, pages 358 - 64; FR 2 154 527; EP 0 267 878; WO 88/03 148; WO 88/03 147; WO 86/00 310; WO 92/05 177; Biochemical Pharmacology 1974, vol. 23, pages 2283-89; US 4, 167, 565; EP 0 232 813; US 5, 023, 244.
Среди этого множества работ были указаны по существу только два производных с индолом в 6-положении аденозина.
Таким образом, статья, опубликованная в Journal of Medical Chemistry, и патент FR 2 154 527 оба описывают один и тот же продукт:
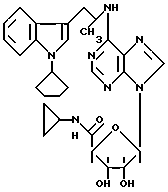
N-6-[2-(индол-3-ил)этил]аденозин (производное A):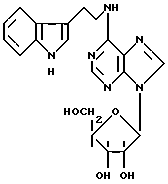
Статья в Biochemical Pharmacoloigy описывает один 5-метокситриптамин, который также указан в документе FR 2 154 527 (производное B):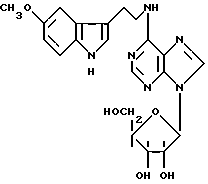
Можно отметить, что статья в Journal of Medical Chemistry описывает производное A как обладающее ингибирующей аггрегацию тромбоцитов активностью, тогда как французский патент упоминает о действии на центральную нервную систему, кровообращение и сердце без дальнейшего уточнения, определяет, что производное B обладает антилиполитической активностью.
Можно указать, что в описанных соединениях, с одной стороны, индольные производные никогда не замещены у атома азота индола, и, с другой стороны, сахар у аденозина не затронут.
В настоящее время заявителем обнаружено, что удивительным образом и неожиданно замещение у атома азота индольного кольца вместе с преобразованием первичного спирта сахара в амидную функциональную группу дает продукты, особенно ценного фармакологического профиля, особенно в области анальгетических средств.
В одном варианте R1 является атомом водорода; в другом варианте R1 является метильным радикалом; в другом варианте R1 является метоксильным радикалом.
В одном варианте n = 0; в другом варианте n = 1; в другом варианте n = 2.
В одном варианте R2 является метоксильным радикалом; в другом варианте R2 является циклопентановым радикалом; в другом варианте R2 является изопропильным радикалом; в другом варианте R2 является 2,5-диметилфенильным радикалом; в другом варианте R2 является пиперидинильным радикалом.
В одном варианте R3 является атомом водорода.
В одном варианте R4 является атомом водорода: в другом варианте R4 является метильным радикалом.
В одном варианте R5 является - циклопропиламиновым радикалом.
Особенно предпочтительные соединения по изобретению выбраны из производных формул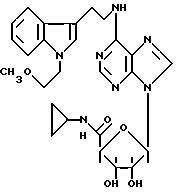
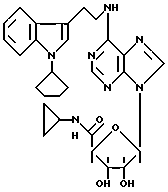
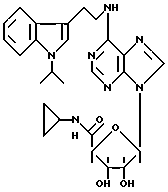
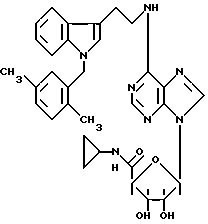
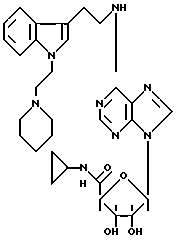
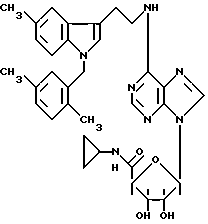
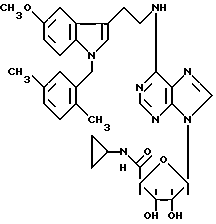
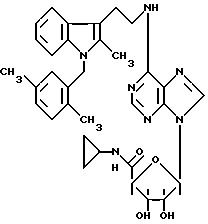
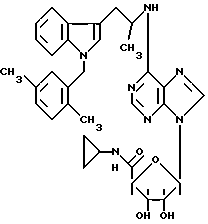
Согласно изобретению соединения формулы I могут быть синтезированы следующим образом.
Взаимодействие амина формулы II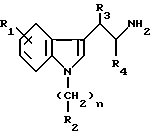
в которой R1, R2, R3, и R4 и n определены выше,
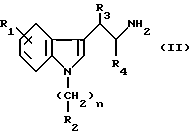
с 6-галогенпуриновым рибозидом формулы III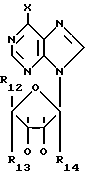
в которой X является атомом галогена, предпочтительно хлором или бромом;
R12 является группой COR5, где R5 определено выше, или группой CH2OH;
R13 и R14 являются защитными группами для спиртовой функциональной группы, такой, как, например, ацетил, бензоил или бензил, или могут вместе образовывать другую защитную группу, например, диоксолановой структуры, в растворителе, таком, как, например, спирт, или в апротонном растворителе, таком, как диметилформамид, в присутствии основания, такого, как триэтиламин, пиридин или карбонат натрия, калия или кальция, или, кроме того, в присутствии двух эквивалентов амина формулы II при 20-140oC,
приведет к получению соединения формулы IV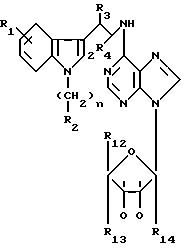
в которой R1 - R14 и n определены выше.
Если индоламинные производные формулы II имеют центр асимметрии, соединения следует рассматривать либо в рацемической форме, либо в оптически активной форме. Если желательно получить оптически активное производство, будет уделено внимание разделению стереоизомеров на стадии индоламина, перед соединением с 6-галогенпуриновыми рибозидами формулы III, обычными способами разделения оптических изомеров, известными специалистам, например, перекристаллизацией солей, образованных с оптически активной виноградной кислотой. После разделения оптически активных тартратов, оптически активное основание, освобожденное от его виноградной кислоты, будет связываться с 6-галогенпуриновыми рибозидами формулы III.
В том случае, когда радикал R12 является CH2OH-группой, она может быть окислена триоксидом хрома способом, описанным R.R.Schmidt and H.J. Fritz, Chem. Ber. 1970, 103, 1897, или перманганатом калия по способу, описанному P. J. Harper and A.Hampton, J.Org. Chem. 1970, 35, N 5, 1688, полученную рибоуроновую кислоту затем преобразуют в хлорангидрид кислоты взаимодействием, например c тионилхлоридом, и затем в амид взаимодействием с амином способами, известными специалистам. Снятие защитной группы у вторичных спиртов OR13 и OR14 можно осуществить различными способами, например, в основной среде, такой, как нашатырный спирт, или в кислой среде, такой, как обычный раствор соляной кислоты или раствор муравьиной кислоты при температуре, варьируемой от 0 до 70oC в зависимости от природы защитной группы.
Последовательность этих реакций может сделать возможным преобразование производных формулы IV в производные формулы I.
Соединения формулы II могут быть получены либо прямым алкилированием производных индоэтиламина формулы V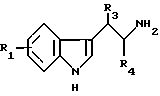
в которой R1, R3 и R4 определены выше, и которые являются коммерчески доступными, или синтез которых описан в следующей литературе: P.L. Julian, E.W. Meyer and H.C. Printy, Heterocylic Compounds, John Wiley and Sons, Inc. New York, 1952, vol.3, chapter I, p. 51-57, и J.Harley-Mason and A.H.Jackson, J. Chem. Soc. 1954, 1165, с производными формулы VI
R2 - (CH2)n - Y,
в которой R2 и n определены выше;
Y является атомом галогена, предпочтительно хлором или бромом,
в присутствии содержащего металл агента, такого, как натрий или литий гидрид, или алколята натрия или калия, в органическом растворителе, таком, как спирт или диметилформамид или N-метилпирролидон, при температуре между 0 и 60oC,
или алкилированием 3-форминдола формулы VII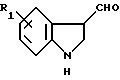
в которой R1 определен выше,
с указанными производными формулы VI в присутствии металлсодержащего агента, такого, как натрий или литий гидрид, или алколята натрия или калия, в органическом растворителе, таком, как спирт или диметилформамид, с получением производных формулы VIII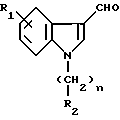
в которой R1 и R2 и n определены выше.
Эти производные подвергают затем взаимодействию с соответствующим нитроалканом в присутствии ацетата аммония с получением нитровинилиндолов формулы IX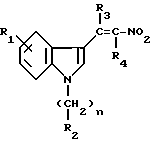
в которой R1 - R4 и n определены выше.
Эти производные восстанавливают затем каталитическим гидрированием в присутствии никеля Ренея или в присутствии литийалюминийгидрида с получением соединения формулы II.
Другие способы синтеза производных индолэтиламина в основном описаны в литературе и могут использоваться. Например, можно отметить способ синтеза, который включает взаимодействие оксалилхлорида с соответствующим индолом, в соответствии со следующими ссылками: M.E.Speeter and W.C.Anthony, J. Am. Chem. Soc. 1954, 76, 6208, и далее амидирование продукта и взаимодействие амидной функциональной группы с литийалюминийгидридом.
3-формилиндолы формулы (VII), используемые в этих синтезах, являются коммерчески доступными или известны специалистам в этой области, например, из следующих ссылок: Organic Syntheses Coll, vol. IV, 539, или могут быть получены способами, описанными в литературе, например, в Organic Syntheses Coll., vol. IV, 542.
6-Галогенпурины формулы III получены из инозина способами, описанными в следующей литературе:
R. R. Schmid and H.T. Fritz, Chem. Ber. 1970, 103, 1867; H.M.Kissman and M. J. Weiss, T.Org. Chem. 1956, 21, 1053; B.R. Baker, K. Hewson, H.J. Thomas and T. A. Johnson Jr, T.Org. Chem. 1957, 22, 954; J.Zemlicka and F.Sorm, Coll. Czech. Chem. Commun. 1985, 30, (6), 1880.
Соединения формулы I, как описано выше, и их соли прибавления, в частности, фармацевтически приемлемые соли, обладают хорошим сродством к аденозиновым рецепторам. Это сродство приводит затем к хорошей анальгетической активности, а также гипертензивным свойствам.
Этими свойствами вызывается применение производных формулы I в терапии, и изобретение далее относится к продуктам, указанным выше формулы I, в качестве лекарств, к их солям прибавления и, в частности, к фармацевтически приемлемым солям.
Таким образом, изобретение также охватывает фармацевтическую композицию, содержащую фармацевтически эффективное количество по крайней мере одного соединения формулы I, представленной выше, или одной из его фармацевтически приемлемых солей прибавления, которая может быть объединена или не объединена с фармацевтически приемлемой добавкой, растворителем или носителем.
Эти композиции могут назначаться пероральным, ректальным, парентеральным, подкожным или глазным способом введения.
Эти соединения могут быть твердыми или жидкими и могут быть в фармацевтических формах, обычно используемых в медицине для человека, такие, как, например, простые или покрытые таблетки, желатиновые капсулы, суппозитории, препараты для инъекций. Они получаются обычными способами. Активная основа, которая содержит фармацевтически эффективное количество по крайней мере одного соединения формулы I, указанной выше, или одной из его фармацевтически приемлемых солей, может быть смешана с добавками, обычно используемыми в этих фармакологических композициях, такими, как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, поливидон, производные целлюлозы, масло какао, полусинтетические глицериды, водные или неводные растворители, жировые вещества животного или растительного происхождения, гликоли, различные смачивающие агенты, диспергенты или эмульгаторы, силиконовые гели, некоторые полимеры или сополимеры, защитные вещества, ароматизаторы или красители.
Изобретение также охватывает фармацевтическую композицию с анальгетической активностью, особенно успешно применяемую при болях, которая содержит фармацевтически эффективное количество по крайней мере одного соединения формулы I, представленной выше, или одной из его фармацевтически приемлемых солей, которая может быть объединена или не объединена с фармацевтически приемлемой добавкой, растворителем или носителем.
Изобретение также охватывает фармацевтическую композицию с антигипертензивной активностью, успешно применяемую при гипертонии, которая содержит фармацевтически эффективное количество по крайней мере одного соединения формулы I, представленной выше, или одной из его фармацевтически приемлемых солей, которая может быть объединена или не объединена с фармацевтически приемлемой добавкой, растворителем или носителем.
Изобретение также охватывает способ получения фармацевтической композиции, который включает подмешивание фармацевтически эффективного количества по крайней мере одного соединения формулы I, представленной выше, или одной из фармацевтически приемлемых солей к фармацевтически приемлемой добавке, растворителю или носителю. При одном осуществлении полученная фармацевтическая композиция с анальгетической активностью особенно успешно применяется при болях; при другом осуществлении полученная фармацевтическая композиция с антигипертензивной активностью особенно успешно применяется при гипертонии.
В другом варианте осуществления фармацевтическая композиция составлена в виде желатиновых капсул или таблеток, содержащих от 5 до 300 мг активного ингредиента, или в качестве препаратов для инъекций, содержащих от 0,1 до 100,0 мг активного ингредиента. Могут также применяться составы в виде суппозиториев, растирок, кремов, гелей или аэрозольных препаратов.
Изобретение охватывает также способ терапевтического лечения млекопитающих, который включает назначение этим млекопитающим терапевтически эффективного количества, по крайней мере, одного соединения формулы I, как указано выше, или одной из его фармацевтически приемлемой соли. В одном варианте этого способа лечения соединение формулы I либо самостоятельно, либо в сочетании с фармацевтически приемлемой добавкой используют в виде желатиновых капсул или таблеток, содержащих от 5 мг до 300 мг активного ингредиента для орального применения или в виде препаратов для инъекций, содержащих от 0,1 до 100,0 мг активного ингредиента, или, кроме того, в виде суппозиториев, растирок, кремов, гелей или аэрозольных препаратов.
При лечении человека или животного соединения формулы I или его соли могут назначаться сами по себе или в сочетании с физиологически приемлемой добавкой в любой форме, в частности, в форме желатиновых капсул или таблеток для орального применения или в форме инъекционного раствора для парентерального введения. Могут быть рассмотрены и другие формы для применения при лечении, такие, как суппозитории, растирки, кремы, гели или аэрозольные препараты.
Как станет ясно из фармакологических испытаний, представленных в конце описания, соединения по изобретению могут применяться при лечении человека при вышеуказанных показаниях, орально в форме таблеток или желатиновых капсул, содержащих от 5 до 300 мг активного ингредиента, или парентерально в форме препаратов для инъекций, содержащих от 0,1 до 100,0 мг активного ингредиента, при одном или более приеме в день для взрослого со средним весом от 60 до 70 кг.
При лечении животных дневная доза, которая может быть применена, обычно будет между 0,1 и 50,0 мг на 1 кг при оральном пути введения и между 0,01 и 1,0 мг на 1 кг при внутривенном введении.
Дальнейшие характеристики и преимущества изобретения будут понятны более ясно из последующего описания некоторых примеров, которые не предполагают ограничение изобретения, но даны только с целью его иллюстрации.
Пример 1. β- D-Рибофурануронамидо-1-(6-хлор-9Н-пурин-9-ил)-N- циклопропил-1-деокси-2,3-O-(1-метил-этилиден)
Формула III: X - Cl;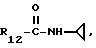
R13 и R14 - изопропилиден
20 г 2',3'-O-Изопропилиден-6-хлорпурин-5'-уроновой кислоты, полученной согласно Schidt R.R. and H.J. Fritz, Chem. Ber. 1970, 103(6), 1867-71, в 50 мл безводного CHCl3, стабилизированного амиленом, кипятят с обратным холодильником в течение 5 ч в присутствии 86 мл SOCl2 в 10 мл безводного ДМФ.
Избыток SOCl2 и растворители отгоняют. Остаток обрабатывают 200 мл безводного хлороформа и добавляют по каплям в азоте к смеси 150 мл CHCl3 и 41 мл циклопропиламина, предварительно охлажденной до 5oC. В течение прибавления хлорангидрида кислоты температуру реакционной смеси поддерживают ниже 10oC.
Смесь оставляют реагировать в течение следующих 30 мин и затем промывают 3 раза разбавленным раствором HCl и затем раствором бикарбоната натрия. В заключение промывают водой, затем высушивают и упаривают растворитель, получается 26,3 г коричневого масла.
Очистка хроматографией на силикагеле (элюент: CH2Cl2 90%/ацетон 10%) дает 15,7 г β- D-рибофурануронамидо-1-(6-хлор-9Н-пурин-9-ил)-N-циклопропил-1-деокси- 2,3-O-(1-метилэтилиден) в виде аморфного твердого продукта.
Соединения примеров 2-4 были получены по способу примера 1 с использованием соответствующих аминов.
Пример 2. β- D-Рибофурануронамидо-1-(6-хлор-9Н-пурин-9-ил)- 1-деокси-N-этил-2,3-O-(1-метилэтилиден).
Формула III: X - Cl; 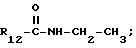
R13 и R14 - изопропилен.
Желтоватое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%) дает твердый продукт, плавящийся при 91oC.
Пример 3. β- D-Рибофурануронамидо-1-(6-хлор-9Н-пурин-9-ил)- 1-деокси-N-(1-гидрокси-2-метилпропан-2-ил)-2,3-O-(1-метилэтилиден).
Формула III: X - Cl; 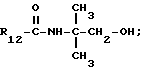
R13 и R14 - изопропилиден.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Пример 4. β- D-Рибофурануронамидо-1-(6-хлор-9Н-пурин-9-ил)- 1-деокси-N-изопропил-2,3-O-(1-метилэтилиден).
Формула III: X - Cl; 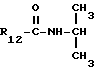
R13 и R14 - изопропилиден.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: CHCl3 90%/ацетон 10%).
Пример 5. 1-(4-Хлорбензил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - 4-хлорфенил.
Раствор 58 г 3-форминдола, 55,9 г K2CO3 и 70,9 г п-хлоробензилхлорида в 200 мл ДМФ кипятят с обратным холодильником в течение 2 ч. После охлаждения смесь выливают в 2 л воды и растирают. Полученный осадок отфильтровывают, промывают водой и затем обрабатывают изопропанолом, отфильтровывают, отжимают и промывают пентаном с получением 120 г окрашенного в кремовый цвет твердого продукта.
Очистка перекристаллизацией из этанола дает 84,4 г 1-(4-хлорбензил)-3-формилиндола, плавящегося при 122oC.
Следующие соединения примеров 6-16 были получены по способу примера 5.
Пример 6. 1-Бензил-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - фенил.
Перекристаллизация из этанола.
Точка плавления 111oC (литература: 113-114oC - A.Kalir and S.Szara, J. Med.Chem. (1966), vol. 9, p. 793).
Пример 7. 1-(2,6-Дихлорбензил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - 2,6-дихлорфенил.
Перекристаллизация из 2-метоксиэтанола.
Точка плавления 160oC.
Пример 8. 1-(Нафт-1-илметил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - нафтил.
Сырой твердый продукт используют как таковой на следующей стадии.
Пример 9. 3-Формил-1-(пирид-3-ил)индол.
Формула VIII: R1 - H; n = 1; R2 - пирид-3-ил.
Очистка хроматографией на силикагеле (элюент: CHCl3 95%/метанол 5%).
Точка плавления 88oC.
Пример 10. 1-(4-Метилбензил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - 4-метилфенил.
Сырой твердый продукт используют как таковой на следующей стадии.
Точка плавления 118oC.
Пример 11. 1-(3,4-Диметилбензил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - 3,4-диметилфенил.
Коричневое масло используют как таковое на следующей стадии.
Пример 12. 1-(2,5-Диметилбензил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - 2,5-диметилфенил.
Сырой твердый продукт используют как таковой на следующей стадии.
Точка плавления 139oC.
Пример 13. 1-(2-Метоксиэтил)-3-формилиндол.
Формула VIII: R1 - H; n = 1; R2 - метокси.
Коричневое масло используют как таковое на следующей стадии.
Пример 14. 1-Циклопентил-3-формилиндол.
Формула VIII: R1 - H; n = 0; R2 - циклопентил.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Пример 15. 3-Формил-1-изопропилиндол.
Формула VIII: R1 - H; n = 0; R2 - изопропил.
Коричневое масло используют как таковое на следующей стадии.
Пример 16. 3-Формил-1-(2-N-морфолиноэтил)индол.
Формула VIII: R1 - H; n = 1; R2 - N-морфолино.
Твердый продукт используют как таковой на следующей стадии.
Точка плавления 80oC.
Пример 17. 1-(4-Хлорбензил)-3-(2-нитровинил)индол.
Формула VIII: R1 - H; n = 1; R2 - 4-хлорфенил, R3-R4 - H.
80,9 г 1-(4-Хлорбензил)-3-формилиндол, полученный в примере 5, 18 г ацетата аммония и 300 мл нитрометана кипятят с обратным холодильником в течение 30 мин.
После охлаждения появляется оранжевый остаток. Его отфильтровывают и промывают водой и затем изопропанолом и гексаном с получением 81,1 г оранжевых кристаллов 1-(4-хлорбензил)-3-(2-нитровинил)индола.
Точка плавления 178oC.
Нитровинилиндолы примеров 18-28 были получены по способу примера 17.
Пример 18. 1-Бензил-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 - фенил; R3-R4 - H.
Точка плавления 130oC.
Пример 19. 1-(2,6-Дихлорбензил)-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 - 2,6-дихлорфенил, R3 = R4 - H,
Точка плавления: 170oC.
Пример 20. 1-Нафтилметил-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 - нафтил, R3 = R4 - H.
Точка плавления 196oC.
Пример 21. 1-(Пирид-3-илметил)-3-(2-нитровенил)-индол.
Формула IX: R1 - H; n = 1; R2 - пирид-3-ил; R3 = R4 - H.
Точка плавления 165-170oC.
Пример 22. 1-(Метилбензил)-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 - 4-метилфенил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле(элюент:хлороформ 95%/изопропиламин 5%).
Пример 23. 1-(3,4-Диметилбензил)-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 = 3,4-диметилфенил; R3=R4 - H.
Точка плавления 135oC.
Пример 24. 1-(2,5-Диметилбензил)-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 = 2,5-диметилфенил; R3 = R4 - H.
Точка плавления 145oC.
Пример 25. 1-(2-Метоксиэтил)-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 2; R2 - метокси, диметилфенил; R3 = R4 - H.
Точка плавления 132oC.
Пример 26. 1-Циклопентил-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле. Элюент: метиленхлорид.
Пример 27. 1-Изопропил-3-(2-нитровинил)индол.
Формула IX: R1 - H; n = 0; R2 - изопропил, R3 = R4 - H.
Оранжевое масло используют как таковое на следующей стадии.
Пример 28. 1-(2-N-Морфолиноэтил)-3-(2-нитровинил)-индол.
Формула IX: R1 - H; n = 2; R2 - N-морфолино; R3 = R4 - H.
Точка плавления 114oC.
Пример 29. 1-(4-Хлорбензил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - 4-хлорфенил; R3 = R4 - H.
52,5 г LiA1H4 добавляют небольшими порциями к 500 мл безводного ТГФ. Температуре позволяют подняться до 50oC. Не охлаждая этот раствор, вводят по каплям раствор 78,2 г 1-(4-хлорбензил)-3-(2-нитровинил)индола, полученного по примеру 17, в 1000 мл безводного ТГФ.
Смесь кипятят с обратным холодильником 1 ч 30 мин и охлаждают. Насыщенный водный раствор Na2SO4 вводят по каплям, и смесь фильтруют на целите 545. После декантации органическую фазу концентрируют с получением оранжевого масла.
Соединение очищают сначала дистилляцией (точка кипения 180-188oC при 0,1 мм рт. ст. ) и затем перекристаллизовывают из этанола с получением 38,1 г гидрохлорида 1-(4-хлорбензил)-3-(2-аминоэтил)индола.
Точка плавления основания 87oC.
Точка плавления гидрохлорида 212oC.
Пример 30. 1-(4-Хлорбензил)-3-(2-аминоэтил)индол.
Формула III: R1 - H; n = 1; R2 -4-хлорфенил; R3 = R4 - H.
10 г 3-аминоэтилиндола растворяют в 50 см3 ДМФ. Затем добавляют 5,6 г NaH (60%).
Смесь перемешивают при комнатной температуре в течение 30 мин.
Добавляют по каплям раствор 11,2 г п-хлорбензилхлорида в 10 мл ДМФ. Смесь нагревают при 55oC в течение 2 ч и охлаждают. Нерастворимый материал отфильтровывают. Фильтрат концентрируют в вакууме и остаток обрабатывают метиленхлоридом и промывают водой. После высушивания органическую фазу концентрируют с получением 20,4 г коричневого масла.
Очистка хроматографией на силикагеле (элюент: CHCl3 95%/ изопропиламин 5%) дает 9,7 г 1-(4-хлорбензил)-3-(2-аминоэтил)индол.
Точка плавления гидрохлорида 214oC.
Следующие соединения примеров 31-45 были получены по одному из способов примеров 29-30.
Пример 31. 1-Бензил-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - фенил; R3 = R4 - H.
Гидрохлорид очищают перекристаллизацией из изопропанола.
Точка плавления 176-178oC.
Пример 32. 1-(2,6-Дихлорбензил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - 2,6-дихлорфенил; R3=R4 - H.
Точка плавления 68oC.
Пример 33. 1-Нафтилметил-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - нафтил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент:хлороформ 95%/изопропиламин 5%).
Пример 34. 1-(Пирид-3-илметил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - пирид-3-ил; R3 = R4 -H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент:хлороформ 95%/изопропиламин 5%).
Пример 35. 1-(4-Метилбензил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - 4-метилфенил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 36. 1-(3,4-Диметилбензил)-3-(2-аминоэтил)-индол.
Формула II: R1 - H; n = 1; R2 - 3,4-диметилфенил; R3 = R4 - H.
Бесцветное масло, очищенное хроматографией на силикагеле (элюент: метиленхлорид 95%/изопропиламин 5%).
Пример 37. 1-(2,5-Диметилбензил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: метиленхлорид 95%/изопропиламин 5%).
Пример 38. 1-(2-Метоксиэтил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 2; R2 - метокси; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 90%/изопропиламин 10%).
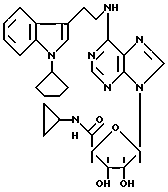
Пример 39. 1-Циклопентил-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - H.
Желтоватое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
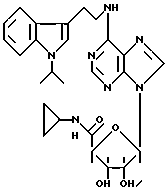
Пример 40. 1-Изопропил-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 0; R2 - изопропил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 41. 1-(2-N,N-Диметиламиноэтил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 2; R2 - N,N-диметиламино; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюента: хлороформ 95%/изопропиламин 5%).
Пример 42. 1-(2-N-Морфолиноэтил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 2; R2 - N-морфолино; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 43. 1-(2-N-Пиперидиноэтил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 2; R2 - N-пиперидино; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: метиленхлорид 95%/изопропиламин 5%).
Пример 44. 1-(N-Пирролидиноэтил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 2; R2 - N-пирролидино; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: метиленхлорид 95%/изопропиламин 5%).
Пример 45. 1-(3.4-Дихлорбензил)-3-(2-аминоэтил)индол.
Формула II: R1 - H; n = 1; R2 - 3,4-дихлорфенил; R3 = R4 - H.
Точка плавления 196oC.
Пример 46. β- D-Рибофурануронамидо-1-/6-//2-/2-(4-хлорбензил)индол-3-ил/этил/амино/- 9H-пурин-9-ил/-N-циклопропил-1-деокси-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - H-хлорфенил; R3 = R4 - H;.
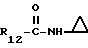
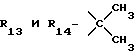
В атмосфере азота суспендируют в 100 мл этанола 49 г гидрохлорида 1-(4-хлорбензил)-3-(2-аминоэтил)индола, полученного одним из способов примеров 29 или 30. Суспензию нейтрализуют 5,1 мл триэтиламина, затем добавляют 4,1 г β- D-рибофурануронамидо-1-(6-хлор-9H-пурин-9-ил)-N-циклопропил-1-деокси- 2,3-O-(1-метилэтилидена), полученного по примеру 1.
Все кипятят с обратным холодильником в течение 7 ч и оставляют стоять всю ночь. Растворитель упаривают и остаток обрабатывают хлороформом, промывают водой, высушивают и концентрируют. Полученный твердый остаток хроматографируют на силикагеле (элюент: хлороформ 90%/метанол 10%) с получением 7,2 г аморфного твердого продукта.
Производные примеров 47-59 были получены в виде аморфных твердых продуктов по способу примера 1.
Пример 47. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-метоксиэтил) индол-3-ил/этил/амино/-9H-пурин-9-ил/2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 2; R2 - метокси; R3 = R4 - H;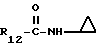
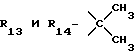
Пример 48. β- D-Рибофурануронамидо-1-/6-//2-/1-циклопентил-индол-3-ил/этил/амино/-9H-пурин-9-ил/- N-циклопропил-1-деокси-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - H;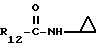
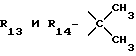
Пример 49. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-изопропилиндол-3-ил/- этил/амино/-9H-пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 0; R2 - изопропил; R3 = R4 - H;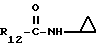
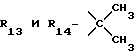
Пример 50. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(4-метилбензил)индол- 3-ил/этил/амино/-9H-пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 4-метилфенил; R3 = R4 - H;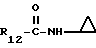
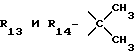
Пример 51. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(3,4-диметилбензил)- индол-3-ил/-этил/амино/-9H-пурин-9-ил/2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 3,4-диметилфенил; R3 = R4 - H;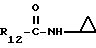
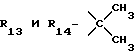
Пример 52. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2,5-диметилбензил)- индол-3-ил/-этил/амино/-9H-пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H: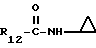
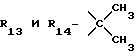
Пример 53. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/(2-N-морфолиноэтил)индол- 3-ил/этил/-амино/-9H-пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - морфолино; R3 = R4 - H;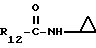
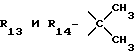
Пример 54. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2-N, N-диметиламиноэтил)индол-3-ил/этил/амино/-9H- пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 2; R2 - N,N-диметиламино; R3 = R4 - H;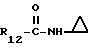
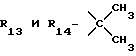
Пример 55. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-2,3- O-(1-метилэтилиден)-1-/6-//2-/1-(2-N-пиперидиноэтил)индол-3- ил/этил/амино/-9H-пурин-9-ил/.
Формула IV: R1 - H; n = 2; R2 - N-пиперидино; R3 = R4 - H;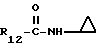
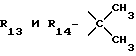
Пример 56. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-2,3- O-(1-метилэтилиден)-1-/6-//2-/1-(2-N-пирролидиноэтил)индол-3- ил/этил/амино/-9H-пурин-9-ил/.
Формула IV: R1 - H; n = 2; R2 - N-пирролидино; R3 = R4 - H;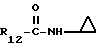
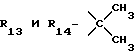
Пример 57. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(3,4-дихлорбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/- 2,3-O-(1-метилэтилиден),
Формула IV: R1 - H; n = 2; R2 - 3,4-дихлорфенил, R3 = R4 - H;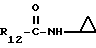
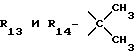
Пример 58. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-2,3- O-(1-метилэтилиден)-1-/6-//2-/1-(пирид-3-илметил)индол-3- ил/этил/амино/-9H-пурин-9-ил/.
Формула IV: R1 - H; n = 2; R2 -пирид-3-ил; R3 = R4 - H;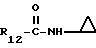
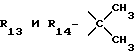
Пример 59. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-2,3- O-(1-метилэтилиден)-1-/6-//2-/1-(нафт-1-илметил)индол-3- ил/этил/амино/-9H-пурин-9-ил/.
Формула IV: R1 - H; n = 1; R2 - нафт-1-ил; R3 = R4 - H;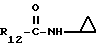
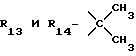
Соединения примера 60 были получены по способу примера 46, используя уронамид, полученный по примеру 3.
Пример 60. β- D-Рибофурануронамидо-1-/6-//2-/1- (4-хлорбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/-1-деокси- N-(1,1-диметил-2-гидроксиэтил)-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 2; R2 - 4-хлорфенил; R3 = R4 - H;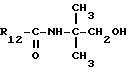
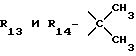
Пример 61. β- D-Рибофурануронамидо-1-/6-//2-/1- (4-хлорбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/-N-циклопропил-1- деокси.
Формула IV: R1 - H; n = 1; R2 - хлорфенил; R3 = R4 - H;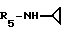
7,2 г Пурина, полученного в примере 46, помещают в 135 мл 1н HCl. Смесь нагревают при 60oC в течение 36 ч и охлаждают. Раствор декантируют для отделения водной фазы от более или менее вязкой образовавшейся смолы. Водную фазу нейтрализуют раствором бикарбоната натрия и экстрагируют хлороформом. Органические фазы объединяют с ранее полученной смолой. Смесь промывают водой, высушивают и концентрируют с получением 7 г окрашенного в кремовый цвет твердого остатка.
Соединение очищают хроматографией на силикагеле (элюент : хлороформ 95%/метанол 5%) с получением 3,7 г β- D-Рибофурануронамидо-1-/6-//2-/1-(4-хлорбензил)индол- 3-ил/этил/амино/-9H-пурин-9-ил/-N-циклопропил-1-деокси.
Эмпирическая формула C30H30ClN7O4.
Точка плавления 225oC.
То же соединение 61 может быть получено гидролизом в среде муравьиной кислоты (212 мл 50%-ного раствора) при нагревании при 70oC в течение 75 мин.
Соединения примеров 62 - 75 были получены согласно примеру 61.
Пример 62. β- D-Рибофурануронамидо-1-/6-//2-/1- (4-хлорбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/-1-деокси- N-(1,1-диметил-2-гидроксиэтил).
Формула I: R1 - H; n = 1; R2 - 4-хлорфенил; R3 = R4 - H;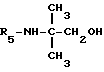
Очистка хроматографией дважды последовательно на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула: C31H34ClN7O5.
Точка плавления 189oC.
Пример 63. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2-метоксиэтил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 2; R2 - метокси; R3 = R4 - H;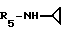
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 5%).
Эмпирическая формула C26H31N7O5.
Точка плавления 132oC.
Пример 64. β- D-Рибофурануронамидо-1-/6-//2-/1- /циклопентилиндол-3-ил/этил/амино/-9H-пурин-9-ил/-N- циклопропил-деокси.
Формула I: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - H;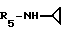
Очистка хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Эмпирическая формула C28H33N7O4.
Точка плавления 141oC.
Пример 65. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-изопропилиндол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - H;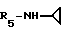
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C26H31N7O4.
Точка плавления 135oC.
Пример 66. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-(1-метилбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 - 4-метилфенил; R3 = R4 - H;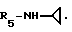
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C31H33N7O4
Точка плавления 144oC.
Пример 67. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(3,4-диметилбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 - 3,4-диметилфенил; R3 = R4 - H;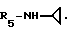
Очистка хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Эмпирическая формула C32H35N7O4 • H2O.
Точка плавления 134oC.
Пример 68. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,3-диметилбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H;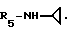
Очистка хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Эмпирическая формула C32H35N7O4 • 0,5 H2O.
Точка плавления 130oC.
Пример 69. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2-N-морфолиноэтил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 2; R2 - N-морфолино; R3 = R4 - H;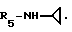
Очистка хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Эмпирическая формула C29H36N8O5 • 0,5 H2O.
Точка плавления 109 - 110oC.
Пример 70. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-N,N -диметиламиноэтил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 2; R2 - N,N-диметиламино; R3=R4 - H;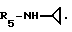
Очистка хроматографией на силикагеле (элюент : хлороформ 80%/изопропиламин 20%).
Эмпирическая формула: C27H34N8O4 • 0,5H2O.
Точка плавления 112oC.
Пример 71. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-N -пиперидиноэтил)индол-3-ил/этил-амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 2; R2 - N-пиперидино; R3 = R4 - H;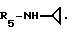
Очистка хроматографией на силикагеле (элюент : хлороформ 80%/метанол 20%).
Эмпирическая формула C30H38N8O4.
Точка плавления 109oC.
Раствор 11 г соединения, полученного этим путем, в 100 мл этанола вводят по каплям в раствор 3,7 г лимонной кислоты в 40 мл этанола. Смесь перемешивают в течение 1 ч при комнатной температуре. Образующийся твердый продукт отфильтровывают, промывают этанолом и высушивают с получением 10,6 г цитрата β- D-рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-N-пиперидиноэтил) индол-3-ил/этил/амино/-9H-пурин-9-ила/.
Эмпирическая формула C30H38N8O4 • C6H8O7.
Точка плавления 138oC.
Пример 72. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-N-пирролидиноэтил) индол-3-/этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 2; R2-N-пирролидино; R3 = R4 - H;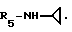
Очистка хроматографией на силикагеле (элюент: хлороформ 80%/метанол 20%).
Эмпирическая формула C29H36N8O4 • 5H2O
Точка плавления 126oC.
Пример 73. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(3,4-дихлорбензил) индол-3-ил/-/этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 1; R2 - 3,4-дихлорфенил; R3 = R4 - H;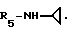
Очистка хроматографией на силикагеле (элюент: хлороформ 80%/метанол 5%).
Эмпирическая формула C30H29Cl2N7O4 • 0,8H2O.
Точка плавления 141oC.
Пример 74. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(пиридин-3-илметил) индол-3-ил/-/этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 1; R2 - пиридин-3-ил; R3 = R4 - H;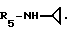
Очистка перекристаллизацией из 2-метоксиэтaнола.
Эмпирическая формула C29H30N8O4 • 0,5 CH3OCH2CH2OH.
Точка плавления 239oC.
Пример 75. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(нафт-1-илметил) индол-3-ил- /этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 1; R2 - нафт-1-ил; R3 = R4 - H;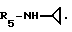
Очистка хроматографией на силикагеле (элюент : хлороформ 95%/метанол 5%) с получением перекристаллизацией из изопропанола.
Эмпирическая формула: C34H33N7O4.
Точка плавления 168oC.
Пример 76. N6-/2-/1-(4-Хлорбензил)индол-3-ил/этил/аденозин.
Формула IV: R1-H; n = 1; R2 - 4-хлорфенил; R3 = R4 - H; R12 - CH2OH; R13 = R14 - H.
4,5 г 1-(4-Хлорбензил)-3-(2-аминоэтил)индол гидрохлорид, полученный по примеру 29 или 30, помещают в 100 мл этанола. Добавляют 2,1 г триэтиламина и затем 2 г 6-хлораденозина.
Все кипятят с обратным холодильником в течение 6 ч, охлаждают. Полученный остаток отфильтровывают и промывают этанолом и затем эфиром.
Перекристаллизация из этанола дает 2,5 г N6-/2-/1-(4-хлорбензил)индол-3-ил/этил/аденозина.
Точка плавления 181oC.
Соединения примеров 77 и 78 были получены согласно примеру 76.
Пример 77. N6-/2-/1-Бензилиндол-3-ил/этил/аденозин.
Формула IV: R1-H; n = 1; R2 - фенил; R3 = R4 - H; R12 - CH2OH; R13 = R14 - H.
Очистка перекристаллизацией из этанола.
Точка плавления 158oC.
Пример 78. N6-/2-/1-(2,6-Дихлорбензил)индол-3-ил/этил/- аденозина.
Формула IV: R1 - H; n = 1; R2 - 2,6-дихлорфенил; R3=R4-H; R12-CH2OH; R13 = R14 - H.
Очистка перекристаллизацией из этанола.
Точка плавления 192oC.
Спирты примеров 76 - 78 могут быть окислены до кислот взаимодействием с окислительным агентом, таким, как триоксид хрома в ацетоне в присутствии серной кислоты или перманганат калия в воде в присутствии аммиака. Они будут последовательно образовывать соответствующий хлорангидрид кислоты после взаимодействия с тионилхлоридом и затем производные рибофурануронамида того же типа, что и по примерам 61, 62, 73 или 75 путем взаимодействия с соответствующими аминами.
Соединения примеров 79 - 100 были получены согласно примеру 61.
Пример 79. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(пирид-2-илметил)индол -3-ил/-этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H: n = 1; R2 - пирид-2-ил; R3 = R4 - H;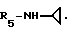
Очистка на трех последовательных колонках (элюент: хлороформ 90%/метанол 10%, хлороформ 80%/изопропиламин 20% и метиленхлорид 90%/метанол 10% соответственно).
Эмпирическая формула C29H30N8O4.
Точка плавления 122oC.
Пример 80. β- D-Рибофурануронамидо-1-/6-//2-/1-(4-хлоробензил)-5-хлориндол -3-ил/этил/-амино/-9H-пурин-9-ил/-N-циклопропил-1-деокси.
Формула I: R1-5-Cl; n = 1; R2 - 4-хлорфенил; R3= R4 - H;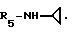
Очистка кристаллизацией из изопропанол/эфирной смеси.
Эмпирическая формула C30H29Cl2N7O4.
Точка плавления 154oC.
Пример 81. β- D-Рибофурануронамидо-1-/6-//2-/1-(2,5-диметилбензил)-5-хлориндол -3-ил/энтил/-амино/-9H-пурин-9-ил/-N-циклопропил-1-деокси.
Формула I: R1-5-Cl; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H;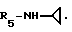
Перекристаллизация из этанола с обработкой животным углем.
Эмпирическая формула C32H34ClN7O4 • 1,1H2O.
Точка плавления 139oC.
Пример 82. β- D-Рибофурануронамидо-1-/6-//2-/1-(4-хлорбензил) индол-3-ил/этил/амино/-9H-пурин-9-ил/-1-деокси-N-(2-метоксиэтил).
Формула I: R1-H; n = 1; R2 - 4-хлорфенил; R3 = R4 - H; R5 - -NH-CH2-CH2-OCH3.
Очищен обработкой горячим этанолом.
Эмпирическая формула C30H32ClN7O5.
Точка плавления 193oC.
Пример 83. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-аллилиндол -3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1-H; n = 1; R2 - -HC=CH2; R3 = R4 - H;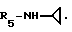
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/ метанол 10%).
Эмпирическая формула C26H29N7O4 • 9 H2O.
Точка плавления 117oC.
Пример 84: β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1/(проп-2-инил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2-C≡CH; R3 = R4 - H;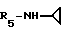
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C26H27N7O4• H2O.
Точка плавления 123oC.
Пример 85: β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)-5-метилиндол-3-ил/этил/амино/-9H- пурин-9-ил/.
Формула I: R1 - 5-CH3; n = 1; R2 = 2,5-диметилфенил; R3 = R4 - H;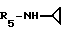
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C33H37N7O4 • 0,8 H2O.
Точка плавления 129oC.
Пример 86. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)-5-метокси-индол-3-ил/этил/амино/-9H- пурин-9-ил/.
Формула I: R1 - 5 - OCH3; n = 1; R2 - 2,5-диметилфенил; R3=R4 - H;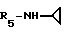
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/ метанол 10%).
Эмпирическая формула C33H37N7O5 • 0,1 H2O.
Точка плавления 182oC.
Пример 87. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)-2-метилиндол-3-ил/этил/амино-9H-пурин-9-ил/.
Формула I: R1- 2 - CH3; n=1; R2 - 2,5-диметилфенил; R3=R4 - H;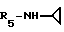
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/ метанол 10%).
Эмпирическая формула: C33H37N7O4 • 0,7 H2O.
Точка плавления 144oC.
Пример 88. β- D-Рибофурануроамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(4-метоксибензил)индол-3-ил/-этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 - 4 - OCH3-фенил; R3=R4 - H;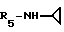
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C31H33N7O5 • 0,8 H2O.
Точка плавления 134oC.
Пример 89. β- D-Рибофурануронамидо-1-/6-//2-/1-циклопентил-2- метилиндол-3-ил/этил/амино/-9H-пурин-9-ил/-N-O циклопропил-1-деокси.
Формула I: R1 - 2 - CH3; n=0; R2-циклопентил; R3=R4 - H;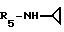
Очистка хроматографией на силикагеле (элюент : хлороформ 90%/метанол 10%).
Эмпирическая формула C29H35N7O4.
Точка плавления 140oC.
Пример 90. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1-(2-N,N- диметиламинобензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n=1; R2 - 2 - N,N-диметиламинофенил; R3=R4 - H;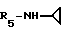
Очистка хроматографией на силикагеле (элюент : хлороформ 90%/ метанол 10%).
Эмпирическая формула: C32H36N8O4.
Точка плавления 128-129oC.
Пример 91. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1- (3-нитробензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n=1; R2 - 3 - NO2-фенил; R3=R4 - H;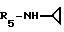
Очистка хроматографией дважды последовательно на силикагеле(элюент : хлороформ 90%/ метанол 10% и метиленхлорид 90%/ метанол 10%, соответственно).
Эмпирическая формула: C30H30N8O4•0,3H2O.
Точка плавления 129oC.
Пример 92. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1-/6-//2-/1- (2,5-диметилбензил)индол-3-ил/пропан- 2-ил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 -2,5-диметилфенил; R3=R4 - CH3;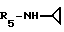
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C33H37N7O4.
Точка плавления 135oC.
Пример 93. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-1-/1-циклопентилиндол-3-ил/пропан-2-ил/амино/-9H-пурин-9-ил/.
Формула I: R1 - H; n = 0; R2 - циклопентил; R3 - H; R4 - CH3;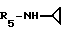
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C29H35N7O4.
Точка плавления 130oC.
Пример 94. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)индол-3-ил/пропан-2-ил/амино/- 9H-пурин-9-ил/.
Формула I: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - CH3; R4 - H;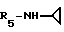
Очистка хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Эмпирическая формула: C33H37N7O4.
Точка плавления 137oC.
Пример 95. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)-2- фенилиндол-3-ил/этил/амино-9H-пурин-9-ил/.
Формула I: R1 - 2 - фенил; n = 1; R2 - 2,5 -диметилфенил; R3=R4 - H;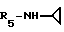
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/метанол 10%).
Эмпирическая формула C38H39N7O4.
Точка плавления 136oC.
Пример 96. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)-5-тиометилиндол-3-ил/этил/амино-9H- пурин-9-ил/.
Формула I: R1 - 5 - SCH3; n = 1; R2 - 2,5 - диметилфенил; R3=R4 - H;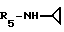
Очистка хроматографией на силикагеле (элюент: хлороформ 90%/ метанол 10%).
Эмпирическая формула: C33H37N7O4S•8H2O.
Точка плавления 137oC.
Пример 97. β- D-Рибофурануронамидо- 1-/6-//2-/1-(5-хлоротиен-2-ил)индол-3-ил/этил/амино-9H- пурин-9-ил/-N-циклопропил-1-деокси.
Формула I: R1 - H; n = 1; R2 - 5 - хлортиен-2-ил; R3=R4 - H;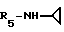
Очищено хроматографией на силикагеле (элюент: хлороформ 90%/ метанол 10%).
Эмпирическая формула: C28H28ClN7O4S• 1H2O.
Точка плавления 137oC.
Пример 98. β- D-Рибофурануронамидо-N-циклопропил- 1-/6-//2-/1-(циклопропилметил)индол-3-ил/этил/амино-9H- пурин-9-ил/-1-деокси.
Формула I: R1 - H; n = 1; R2 - циклопропил; R3=R4 - H;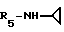
Эмпирическая формула C27H31N7O4• 5H2O.
Точка плавления 134oC.
Производные по примерам 99-118 были получены в виде аморфных твердых продуктов по способу примера 46, используя соответствующий уронамид формулы III.
Пример 99. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(пирид-2-илметил)индол-3-ил/ этил/амино/-9H-пурин-9-ил/-2,3,0-(1-метилэтилиден).
Формула IV: R1 - H; n=1; R2-пирид-2-ил; R3=R4 - H;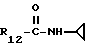
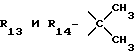
Пример 100. β- D-Рибофурануронамидо-1-/6-//2-/1-(4-хлорбензил)- 5-хлориндол-3-ил/этил/амино/-9H-пурин-9-ил/-N-циклопропил-1-деокси- 2,3, O-(1-метилэтилиден).
Формула IV: R1 - 5 - Cl; n=1, R2 - 4-хлорфенил; R3 = R4 - H;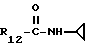
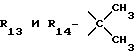
Пример 101. β- D-Рибофурануронамидо-1-/6-//2-/1-(2,5- диметилбензил)-5-хлориндол-3-ил/этил/амино/-9H-пурин-9-ил/-N- циклопропил-1-деокси-2,3-O-(1-метилэтилиден).
Формула IV: R1 - 5 - Cl; n=1; R2 - 2,5-диметилфенил; R3=R4 - H;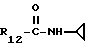
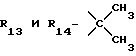
Пример 102. β- D-Рибофурануронамидо-1-/6-//2-/1-(4-хлорбенил)- индол-3-ил/этил/амино/-9H-пурин-9-ил/-1-деокси-N-(2-метоксиэтил)-2,3- O-(1-метилэтилиден).
Формула IV: R1 - H; n=1; R2 - 4-хлорфенил; R3=R4 - H;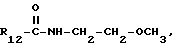
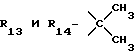
Пример 103. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-аллилиндол-3-ил/этил/амино/-9H-пурин-9-ил/-2,3-O- (1-метилэтилиден).
Формула IV: R1 - H; n=1; R2 -этенил; R3=R4 - H;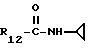
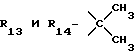
Пример 104. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-пропаргилиндол-3-ил/этил/амино/-9H-пурин-9-ил/-2,3-O- (1-метилэтилиден).
Формула IV: R1 - H; n=1; R2 -этинил; R3=R4 - H;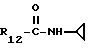
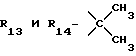
Пример 105. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6//2-/1-(2,5-диметилбензил)-5-метилиндол-3-ил/этил/амино-9H- пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - 5 - CH3; n=1; R2 - 2,5-диметилфенил; R3=R4 - H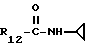
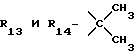
Пример 106. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)-5-метоксииндол-3-ил/этил/амино/-9H- пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - 5 - OCH3; n=1; R2 - 2,5- диметилфенил; R3=R4 - H;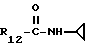
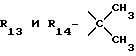
Пример 107. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/1-(2,5-диметилбензил)-2-метилиндол-3-ил/этил/амино-9H-пурин- 9-ил/-2,3-O-(1-метилэтилиден).
Формулa IV: R1 - 2 - CH3; n=1; R2 - 2,5-диметилфенил; R3=R4 - H;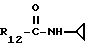
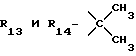
Пример 108. β- D-Рибофурануронамидо-N-циклопропил-1-деокси-1- /6-//2-/-1-(4-метоксибензил)индол-3-ил/-этил/амино/-9H-пурин-9-ил/- 2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n=1; R2 - 4 - OCH3-фенил; R3=R4 - H;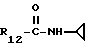
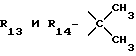
Пример 109. β- D-Рибофурануронамидо-1-/6-//2-/1-циклопентил-2- метилиндол-3-ил/этил/амино/-9H-пурин-9-ил/-N-циклопропил-1-деокси- 2,3-O-(1-метилэтилиден).
Формула IV: R1 - 2 - CH3; n=0; R2 -циклопентил; R3=R4 - H;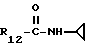
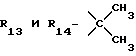
Пример 110. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2-N, N-диметилламинобензил)-индол-3-ил/этил/амино/-9Н- пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 2-N,N-диметилламинофенил; R3=R4 - H;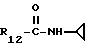
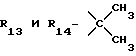
Пример 111. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(3-нитробензил)индол-3-ил/этил/амино/-9Н-пурин-9-ил/- 2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 3-нитрофенил; R3=R4 - H;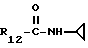
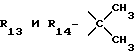
Пример 112. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)индол-3-ил/пропан-2-ил/амино/-9Н- пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - H; R4 - CH3;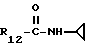
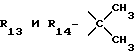
Пример 113. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//1-/1-(1-циклопентилиндол-3-ил/пропан-2-ил/амино/-9Н-пурин- 9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 0; R2 - циклопентил; R3 - H; R4 - CH3;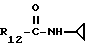
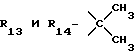
Пример 114. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)-индол-3-ил/пропил/амино/-9Н-пурин- 9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - CH3; R4 - H;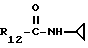
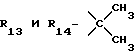
Пример 115. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)-2-фенилиндол-3-ил/этил/амино/-9Н-пурин- 9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - 2-фенил; n = 1; R2 - 2,5-диметилфенил; R3=R4 - H;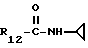
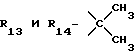
Пример 116. β- D-Рибофурануронамидо-N-циклопропил-1-деокси- 1-/6-//2-/1-(2,5-диметилбензил)-5-тиометилиндол-3-ил/пропан-2-ил/амино/- 9Н-пурин-9-ил/-2,3-O-(1-метилэтилиден).
Формула IV: R1 - 5-SCH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H;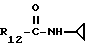
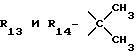
Пример 117. β- D-Рибофурануронамидо-1-/6-//2-/1-(5-хлортиен- 2-ил)индол-3-ил/этил/амино/-9Н-пурин-9-ил/-N-циклопропил-1-деокси- 2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 5-хлортиен-2-ил; R3 = R4 - H;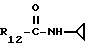
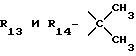
Пример 118. β- D-Рибофурануронамидо-N-циклопропил-1-/6-//2-/1- (циклопропилметил)индол-3-ил/этил/амино/-9Н-пурин-9-ил/-2,3-O- (1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - циклопропил; R3 = R4 - H;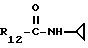
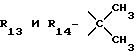
Следующие соединения примеров 119-138 были получены по одному из способов примеров 29 или 30:
Пример 119. 3-(2-Аминоэтил)-5-хлор-(2,5-диметилбензил)индол.
Формула II: R1 - 5-Cl; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 120. 3-(2-Аминоэтил)-1-аллилиндол.
Формула II: R1 - H; n = 1; R2 - этенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 121. 3-(2-Аминоэтил)-1-(пирид-2-илметил)-индол.
Формула II: R1 - 5-Cl; n = 1; R2 - пирид-2-ил; R3 = R4 - H.
Очищенное хроматографией на силикагеле (элюент: CHC13 95%/изопропиламин 5%).
Точка плавления 237oC.
Пример 122. 3-(2-Аминоэтил)-1-5-хлор-(4-хлорбензил)индол.
Формула II: R1 - 5-Cl; n = 1; R2 - 4-хлорфенил; R3 = R4 - H.
Гидрохлорид, очищенный перекристаллизацией из этанола.
Точка плавления 204oC.
Пример 123. 3-(2-Аминоэтил)-1-пропаргилиндол.
Формула II: R1 - H; n = 1; R2 - этинил; R3=R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 124. 3-(2-Аминоэтил)-1-(2,5-диметилбензил)-5-метилиндол.
Формула II: R1 - 5-CH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Гидрохлорид, очищенный кристаллизацией из эфира.
Точка плавления 198oC.
Пример 125. 3-(2-Аминоэтил)-1-(2,5-диметилбензил)-5-метоксииндол.
Формула II: R1 - 5-OCH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Аморфный белый твердый продукт, очищенный хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 126. 3-(2-Аминоэтил)-1-(2,5-диметилбензил)-2-метилиндол.
Формула II: R1 - 2-CH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Гидрохлорид, очищенный хроматографией из эфира.
Точка плавления 250oC.
Пример 127. 3-(2-Аминоэтил)-1-(4-метоксибензил)индол.
Формула II: R1 - H; n = 1; R2 - 4-OCH3-фенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 128. 3-(2-Аминоэтил)-1-циклопентил-2-метилиндол.
Формула II: R1 - 2-CH3; n = 0; R2 - циклопентил; R3 = R4 - H.
Неочищенное оранжевое масло, используемое как таковое в последующей стадии.
Пример 129. 3-(2-Аминоэтил)-2-фенилиндол.
Формула V: R1 - 2-фенил; R3 = R4 - H.
Гидрохлорид, очищенный кристаллизацией из изопропанола.
Точка плавления 266oC.
Пример 130. 3-(2-Аминоэтил)-1-(2,5-диметилбензил)-2- фенилиндол.
Формула II: R1 - 2-фенил; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 131. 3-(2-Аминоэтил)-1-(2-N,N-диметиламинобензил)индол.
Формула II: R1 - H; n = 1; R2 - 2-N,N-диметиламинофенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 132. 3-(2-Аминоэтил)-1-(3-нитробензил)индол.
Формула II: R1 - H; n = 1; R2 - 3-NO2-фенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 133. 3-(2-Аминопропил)-1-(2,5-диметилбензил)-индол.
Формула II: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - H; R4 - CH3.
Белый твердый продукт, очищенный кристаллизацией из изопропилового эфира.
Точка плавления 87oC.
Пример 134. 3-(2-Аминопропил)-1-циклопентилиндол.
Формула II: R1 - H; n = 0; R2 - циклопентил; R3 = R4 - CH3.
Неочищенное оранжевое масло, используемое как таковое в последующей стадии.
Пример 135. 3-(2-Аминопропан-2-ил)-1-(2,5-диметилбензил)индол.
Формула II: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - CH3; R4 - H.
Масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%). Гидрохлорид кристаллизуют из изопропанола.
Эмпирическая формула; C20H24N2 • HCl.
Точка плавления 178oC.
Пример 136. 3-(2-Аминоэтил)-1-/(5-хлортиен-2-ил)метил/индол.
Формула II: R1 - H; n = 1; R2 - 5-хлортиен-2-ил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 137. 3-(Аминоэтил)-1-(циклопропилметил)индол.
Формула II: R1 - H; n = 1; R2 - циклопропил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Пример 138. 3-(2-Аминоэтил)-1-(2,5-диметилбензил)-5- тиометилиндол.
Формула II: R1 - 5-SCH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Нитровинилиндолы примеров 139 - 143 были получены по способу примера 17.
Пример 139. 1-(2,5-Диметилбензил)-2-метил-3-(2-нитровинил)индол.
Формула IX: R1 - 2-CH3; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H.
Оранжевое масло, используемое как таковое в последующей стадии.
Точка плавления 180oC.
Пример 140. 1-(Циклопентил)-2-метил-3-(2-нитровинил)индол.
Формула IX: R1 - 2-CH3; n = 1; R2 - циклопентил; R3 = R4 - H.
Оранжевое масло, очищенное хроматографией на силикагеле (элюент: хлороформ).
Пример 141. 2-Фенил-3-(2-нитровинил)индол.
Формула IX: R1 - 2-фенил; n = 0; R2 - H; R3 = R4 - H.
Оранжевое масло, используемое как таковое в последующей стадии.
Точка плавления 180oC.
Соединения примеров 142 и 143 были получены по способу примера 17, используя нитроэтан вместо нитрометана.
Пример 142. 1-(2,5-Диметилбензил)-3-(2-метил-2-нитровинил)индол.
Формула IX: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 - H; R4 - CH3.
Желтый твердый продукт кристаллизуют из воды.
Точка плавления 160oC.
Пример 143. 1-Циклопентил-3-(2-метил-2-нитровинил)индол.
Формула IХ: R1 - H; n = 0; R2 - циклопентил; R3 - H, R4 - CH3.
Желтый твердый продукт кристаллизуют из изопропанола.
Точка плавления 160oC.
Следующие продукты примеров 144 - 146 были получены по способу примера 5 исходя из соответствующих замещенных 3-формилиндолов:
Пример 144. 1-(2,5-Диметилбензил)-3-формил-2-метилиндол.
Формула VIII: R1 - 2-CH3; n = 1; R2 - 2,5-диметилфенил.
Желтый твердый продукт кристаллизуют из эфира и используют в таком виде на следующей стадии.
Точка плавления 155oC.
Пример 145. 1-(Циклопентил)-3-формил-2-метилиндол.
Формула VIII: R1 - 2-CH3; n = 0; R2 - циклопентил.
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/метанол 5%).
Пример 146. 3-Формил-2-фенилиндол.
Формула VIII: R1 - 2-фенил; n = 0; R2 - H.
Твердый продукт кремового цвета используемый как таковой на следующей стадии и полученный по способу 6, описанному в J. Med. Chem. (1964), 7, 735.
Точка плавления 253oC.
Пример 147. β- D-Рибофурануронамидо-1-(6-хлор-9H- пурин-9-ил/-1-деокси-N-(2-метоксиэтил)-2,3-O-(1-метилэтилиден).
Формула III: X - Cl;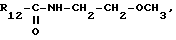
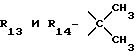
Коричневое масло, очищенное хроматографией на силикагеле (элюент: хлороформ 95%/изопропиламин 5%).
Соединение примера 148 было получено в форме аморфного твердого продукта по способу примера 46, используя уронамид примера 2.
Пример 148. β- D-Рибофурануронамидо-1-деокси-1-/6-//2- /1-(2,5-диметилбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/- N-этил-2,3-O-(1-метилэтилиден).
Формула IV: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H;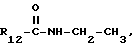
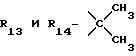
Соединение примера 149 было получено методом примера 61.
Пример 149. β- D-Рибофурануронамидо-1-деокси-1-/6-//2- /1-(2,5-диметилбензил)индол-3-ил/этил/амино/-9H-пурин-9-ил/- N-этил.
Формула IV: R1 - H; n = 1; R2 - 2,5-диметилфенил; R3 = R4 - H; R5 = -NH-CH2-CH3.
Эмпирическая формула C31H35N7O4 • 4 H2O.
Точка плавления 133oC.
Типовые фармацевтические композиции, содержащие соединение по изобретению:
Пример 150.
А) Желатиновые капсулы с дозой 50 мг активного начала.
Компоненты. -β- D-Рибофурануронамид, N-циклопропил-1-деокси-1-[6-[[2-[1-(2,5-диметилбензил)-5-метилиндол-3-ил] этил]амин]-9H-пирин-9-ил] - 50 мг; стеарат магния - 10 мг; лактоза - 140 мг; капсула - размер N 1.
Пример 151.
Б) Таблетки с дозой 50 мг активного начала.
Компоненты: -β- D-Рибофурануронамид, N-циклопропил-1-деокси-1-[6-[[2-[1-(2,5-диметилбензил)-5-метилиндол-3-ил] этил]амин]-9H-пирин-9-ил] - 50 мг; микрокристаллическая целлюлоза - 400 мг; предварительно покрытый желатиной крахмал - 47,5 мг; стеарат магния - 2,5 мг.
Пример 152.
В) Препараты для инъекций с дозой 10 мг активного начала.
Компоненты: -β- D-Рибофурануронамид, N-циклопропил-1-деокси-1-[6-[[2-[1-(2,5-диметилбензил)5-метилиндол- 3-ил]этил]амин]-9H-пирин-9-ил] - 10 мг; инозит - 100 мг; бензиловый спирт - 20 мг.
Пример 153.
Г) Свечи с дозой 100 мг активного начала.
Компоненты: -β- D-Рибофурануронамид, N-циклопропил-1-деокси-1[6-[[2-[1-(2,5-диметилбензил)-5-метилиндол- 3-ил] этил] амин]-9H-пирин-9-ил] - 100 мг; воск для свечей AML - 1900 мг.
Пример 154.
Д) Глазные капли с дозой 1 мг/мл активного начала.
Компоненты: -β- D-рибофурануронамид, N-циклопропил-1-[6-[1-(2,5-диметилбензил)5-метилиндол-3-ил] этил]амин]- 9H-пирин-9-ил] - 1 мг/мл; двухосновный фосфат натрия - 10,4 мг/мл; одноосновный фосфат натрия - 2,4 мг/мл; оксипропанолметилцеллюлоза - 5 мг/мл; дистиллированная вода - достаточное количество для 1 мл; сода 1N - достаточное количество для pH 7,4.
Фармацевтические композиции, содержащие другие соединения по изобретению.
Пример 155.
А) Желатиновые капсулы с дозой 50 мг активного начала.
Компоненты: -β- D-рибофурануронамид, N-циклопропил-1-деокси-1-[6-[[2-[1-(2-N-пиперидинэтил)индол-3-ил] этил]амин]-9H-пирин-9-ил] 50 мг; стеарат магния - 10 мг; лактоза - 140 мг; желатиновые капсулы, размер N 1.
Пример 156.
Б) Другие желатиновые капсулы с дозой 50 мг активного начала.
Компоненты: -β- D-рибофурануронамид, 1-[6-[[2-[1-циклопентилиндол-3-ил] этил] амин]-9H-пирин-9-ил]-N-циклопропил- 1-деокси - 50 мг; стеарат магния - 10 мг; лактоза - 140 мг; желатиновая капсула - размер N 1.
Фармакологическая активность продуктов по примерам оценивалась двумя различными подходами: связыванием с аденозиновыми рецепторами и/или демонстрацией анальгетической активности в фенилбензохиноновом испытании.
I Способ.
1. Связывание с аденозиновыми рецепторами.
Принцип.
Сродство продуктов по примерам к центральным A1 и A2 аденозинергическим рецепторам определяют сравнительной методикой, использующей специфическое лигандное связывание каждого с A1-рецептоpами (/3H PIA) или с A2-рецептоpами (/3H/NECA).
Метод.
Метод получения A1-рецепторов.
Приготовление мембраны.
После того как животное забивают декапитацией, быстро удаляют мозг и промывают холодным изотоническим раствором. Разделяют две полусферы и взвешивают, каждую затем вводят в полиалломерную пробирку, содержащую 25 объемов холодного гомогенизированного буфера. Гомогенизацию осуществляют, используя Ultra-Turrax, в течение 30 с (3 раза по 10 с с 10-секундными интервалами, 70% от максимума скорости). Полученный стандартный материал центрифугируют при 1000 g (≈ 3000 rpm) в течение 10 мин при 4oC.
Супернатант вновь центрифугируют при 48000 g (≈20000 rpm) в течение 20 минут при 4oC.
Когда эта стадия завершена, осадок обрабатывают 4 объемами гомогенизирующего буфера, вновь суспендируют, используя Vortex, и гомогенизируют, используя UItra-Turrax. Добавляют аденозиновую деаминазу со скоростью 1 U/мл, т.е. 1 мкл/мл гомогената, используя 1-мкл шприц Гамильтона.
После обработки гомогенат встряхивают в течение 30 мин при комнатной температуре и затем центрифугируют при 80000 g (≈ 20000 rpm) в течение 30 мин при 4oC.
Полученный осадок вновь суспендируют в 10 объемах гомогенизирующего буфера и пропускают через Ultra-Turrax в течение 20 с (2 раза по 10 с с 10-секундными интервалами, 70% от максимума скорости).
Гомогенат, полученный таким образом, используют в сравнительных тестах. Его хранят при 4oC, если исследования проводят несколько дней и длительно при -20oC в виде 10 мл частей.
Сравнительное исследование.
После оттаивания гомогената при комнатной температуре его пропускают через мельницу Поттера (6 ручных движений вперед - назад, скорость 6), разбавляют 2/5 инкубационным буфером и помещают в водяную баню, термостатированную при 4oC, при встряхивании до конца эксперимента.
50 мл /3H/ PIA при 100 нМ, т.е. 2,5 нМ в конечной реакционной среде, позволяющей достичь разбавления 1/40 и 50 л продукта по примеру при рассматриваемой концентрации (10-5 М и 10-7 М) вводят в реакционные пробирки. Реакцию инициируют добавлением 1 мл гомогената и 900 мкл инкубационного буфера. Способ идентичен для всех бета-блокирующих излучений.
Пробирки встряхивают и ингибируют на водяной бане при 20oC в течение 30 минут. Когда инкубация завершена, содержимое пробирок фильтруют на бумаге Ватман GF/B. Каждую пробирку дважды промывают 2 мл промывочного буфера и затем отфильтровывают и промывают 3 мл того же буфера.
Фильтры затем переносят в счетные колбы и добавляют 10 мл жидкого сцинциллятора (Ready Solv Hp/b, Beckman).
После встряхивания колбы хранят в холодильнике всю ночь и затем определяют радиоактивность в жидком сцинцилляционном счетчике.
Проводят по 3 опыта для каждой изучаемой концентрации. Неспецифическое связывание /3H/ PIA оценивают путем измерения количества радиоактивности, оставшейся на фильтре в присутствии 10-5 М фенилизопропиладенозина (PIA). Величину неспецифического связывания систематически вычитают из данных по испытанию.
Метод изучения A2-рецепторов.
Приготовление мембраны.
После того как животное забивают декапитацией, быстро удаляют мозг и промывают холодным изотоническим раствором. Разделяют две полусферы и от каждой отделяют striatum (Bruns et al., 1986), взвешивают и вводят в полиалломерную пробирку, содержащую IG объемов холодного гомогенизированного буфера. Ткань гомогенизируют, используя Ultra-Turrax, в течение 30 с (3 раза по 10 с с 10-секундными интервалами, 70% от максимума скорости). Полученный стандартный материал центрифугируют при 50000 g (≈ 20000 rpm) в течение 10 мин при 4oC.
Полученный осадок вновь суспендируют в 10 объемах гомогенизирующего буфера, используя Vortex, и гомогенизируют, используя Ultra-Turrax (5-10 с, 70% от максимума скорости).
Добавляют аденозиновую деаминазу со скоростью 1 U/мл, т.е. 1 мкл/мл гомогената, используя 1-мкл шприц Гамильтона. Гомогенат, полученный таким образом, встряхивают в течение 30 мин.
Когда инкубация завершена, гомогенат центрифугируют при 50000 g (≈ 20500 rpm) в течение 10 минут при 4oC.
Осадок обрабатывают 5 объемами холодного гомогенизирующего буфера и пропускают через Ultra-Turrax (2 раза по 10 с с 10-секундными интервалами, 70% от максимума скорости), и гомогенат, полученный таким образом, в заключение замораживают при -70oC.
Сравнительное исследование
После оттаивания гомогената при комнатной температуре добавляют 15 объемов инкубационного буфера. Гомогенат встряхивают на Vortex, пропускают через мельницу Поттера (6 ручных движений вперед-назад, скорость 6), разбавляют 1/10 инкубационным буфером и, наконец, помещают в водяную баню, термостатированную при 4oC, при встряхивании до конца эксперимента.
50 мл /3H/ NECA при 160 нМ, то есть 3 нМ в конечный реакционной среде, позволяющей достичь разбавления 1/40, и 50 мл продукта по примеру при рассматриваемой концентрации (10-5 М и 10-7 М) вводят в реакционные пробирки. Реакцию инициируют добавлением 1 мл гомогената и 900 мкл инкубационного буфера. Способ похож для всех исследуемых соединений.
Пробирки встряхивают и ингибируют на водяной бане при 25oC в течение 60 мин. Когда инкубация завершена, содержимое пробирок фильтруют на бумаге Ватман GF/B. Каждую пробирку дважды промывают 2 мл промывочного буфера и затем отфильтровывают и промывают 3 мл того же буфера перед занесением в счетные колбы.
Добавляют 10 мл жидкого сцинциллятора (Ready Solv HP/b Beckman) во все колбы. Их встряхивают и хранят в холодильнике всю ночь. Радиоактивность определяют в жидкой сцинцилляционном счетчике.
Проводят по 3 опыта для каждой изучаемой концентрации. Неспецифическое связывание /3H/ NECA определяют путем измерения количества радиоактивности, оставшейся на фильтре в присутствии 5 мкМ N-этилкарбоксамидоаденозина (NECA). Величину неспецифического связывания систематически вычитают из данных по испытанию.
Обработка данных.
Результаты выражают для каждого продукта в виде процента замещения (n = 3) высвобождаемого лиганда при концентрации 10-5 М и 10-7 М.
2. Фенилбензохиноновое исследование.
Способ.
Внутрибрюшинная инъекция фенилбензохинона вызывает скрючивающие и тянущие движения у мышей. Анальгетики предупреждают или уменьшают этот синдром, который можно рассматривать как эктериоризацию или диффузию брюшной боли.
0,02%-ного раствора фенилбензохинона в воде вводят в объеме 1 мл/100 г.
Продукты по примерам вводят орально за час до инъекции фенилбензохинона.
Скрючивающие и тянущие движения считают для каждой мыши при наблюдении за период в 5 мин.
II. Результаты.
Результаты экспериментов показывают сродство продуктов по примерам для аденозиновых рецепторов, а их анальгетические свойства представлены в табл. 1 и 2 соответственно.
III. Токсикология.
Толерантность продуктов по примерам оцениваются на крысах после орального введения. Обнаружено, что все в порядке до дозы в 100 мг/кг.
IV. Выводы.
Продукты по примерам, описанным в настоящем изобретении, обладают особенно ценными анальгетическими свойствами, чей истинный механизм действия является результатом взаимодействия с аденозиновыми рецепторами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2116308C1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛОПИРИМИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ К РЕЦЕПТОРАМ АНГИОТЕНЗИНА II | 1992 |
|
RU2103270C1 |
| ПРОИЗВОДНЫЕ β-КАРБОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1999 |
|
RU2210571C2 |
| ДИАРИЛМЕТИЛИДЕНФУРАНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2189979C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗГИДРИЛОКСИЭТИЛПИПЕРАЗИНА | 1987 |
|
RU2032680C1 |
| НОВЫЕ АЦИКЛИЧЕСКИЕ НУКЛЕОЗИДФОСФОНАТНЫЕ ПРОИЗВОДНЫЕ, ИХ СОЛИ И СПОСОБ ПОЛУЧЕНИЯ ЭТИХ СОЕДИНЕНИЙ | 2002 |
|
RU2266294C2 |
| ПРОИЗВОДНЫЕ 2,6-ДИАМИНОПУРИН-β-D-РИБОФУРАНУРОНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМСОСТАВ ДЛЯ ПОДАВЛЕНИЯ АКТИВНОСТИ ЛЕЙКОЦИТОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ПОДАВЛЕНИЯ АКТИВНОСТИ ЛЕЙКОЦИТОВ | 1994 |
|
RU2129561C1 |
| β-D-2'-ДЕЗОКСИ-2'-α-ФТОР-2'-β-С-ЗАМЕЩЕННЫЕ-2-МОДИФИЦИРОВАННЫЕ-N6-ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ НУКЛЕОТИДЫ ДЛЯ ЛЕЧЕНИЯ ВЫЗВАННЫХ HCV ЗАБОЛЕВАНИЙ | 2016 |
|
RU2764767C2 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |
| ПРОИЗВОДНЫЕ СЛОЖНОЭФИРНЫХ ЛИПИДОВ НУКЛЕОТИДОВ | 2004 |
|
RU2347786C2 |
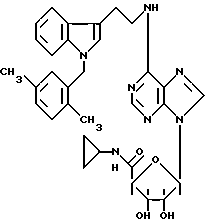
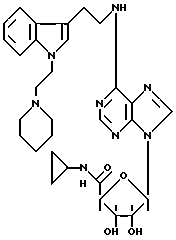
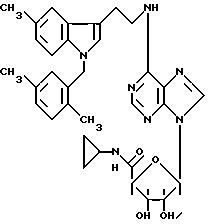
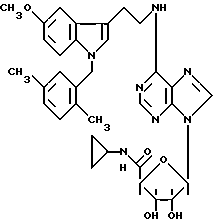
Изобретение относится к производным аденозина общей формулы I, где R1 - атом водорода, атом галогена, низший алкил, низший О-алкил, низший S-алкил или фенил, и может находиться во 2- или 5-положении индола; n = 0, 1 и 2, R2 - низший алкил, низший алкенил, низший алкинил, С3-С7-циклоалкил или низший О-алкил, фенил, возможно замещенный 1-4 заместителями, выбранными из атома галогена, нитро, низшей алкильной или О-алкильной группы или группы -NR6R7, где R6 и R7 атом водорода, низший алкил; пиридил; тиенил, нафтил, и в случае, когда n = 2, R2 - группа -NR8R9, где R8 и R9 одновременно являются низшим алкилом или образуют вместе с атомом азота, к которому они присоединены, гетероцикл, выбранный из морфолина, пиперидина; R3 и R4 одинаковые или различные, - атом водорода или низший алкил, проявляющим анальгетическую и антигипертензивную активность. Способ получения соединений формулы (I) заключается в том, что амин общей формулы (II) подвергают взаимодействию с 7-галогенпуриновым рибозидом общей формулы (III), где Х - атом галогена, R11 - СОR5, где R5 имеет указанное значение или СН2ОН, а R12 и R13 - защитные группы, такие как ацетил, бензоил, или вместе образуют диоксолановую группу, в растворителе, таком как спирт или диметилформамид, в присутствии основания, такого как триэтиламин, пиридин или карбонат натрия, или, кроме того, в присутствии двух эквивалентов амина при 20 -140oC, после чего снимают защитные группы в основной среде раствором гидроксида аммония или в кислой среде с нормальным раствором соляной кислоты при 0 - 70oС в зависимости от природы защитной группы. Описываются также фармацевтические композиции на базе соединения формулы (I), проявляющие анальгетическую и/или антигипертензивную активность. 6 с. и 7 з. п. ф-лы, 2 табл. 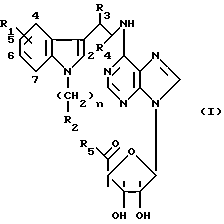
где R1 - атом водорода, атом галогена, низший алкил, низший О-алкил, низший S-алкил или фенил, и может находиться во 2- или 5-положении индола;
n = 0, 1 и 2;
R2 - низший алкил, низший алкенил, низший алкинил, C3 - C7-циклоалкил или низший О-алкил, фенил, возможно замещенный 1 - 4 заместителями, выбранными из атома галогена, нитро, низшей алкильной или О-алкильной группы или группы -NR6R7, где R6 и R7 - атом водорода, низший алкил; пиридил: пирролидин; тиенил, возможно замещенный атомом галогена; нафтил; и в случае, когда n = 2, R2 - группа -NR8R9, где R8 и R9 одновременно являются низшим алкилом или образуют вместе с атомом азота, к которому они присоединены, гетероцикл, выбранный из морфолина, пиперидина;
R3 и R4, одинаковые или различные, - атом водорода или низший алкил;
R5 - NHR10 - низший алкил, C3 - C7-циклоалкил.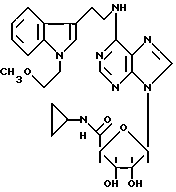
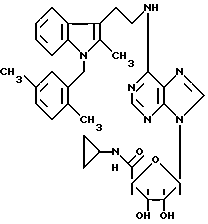
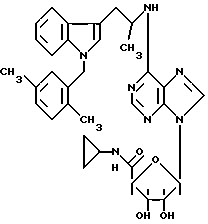
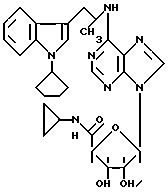
8. Способ получения соединений общей формулы I по любому из пп.1 - 7, отличающийся тем, что амин общей формулы II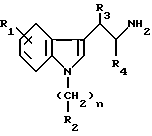
где R1 - R4 и n имеют указанные значения,
подвергают взаимодействию с 7-галогенпуриновым рибозидом общей формулы III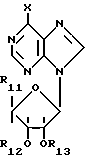
где X - атом галогена;
R11 - COR5, где R5 имеет указанное значение, или CH2OH;
R12 и R13 - защитные группы, такие, как ацетил, бензоил, или вместе образуют диоксолановую группу,
в растворителе, таком, как спирт или диметилформамид, в присутствии основания, такого, как триэтиламин, пиридин или карбонат натрия, или кроме того, в присутствии двух эквивалентов амина при 20 - 140oС, после чего снимают защитные группы в основной среде раствором гидроксида аммония или в кислой среде с нормальным раствором соляной кислоты при 0 - 70oС в зависимости от природы защитной группы.
| J.of Med | |||
| Chem | |||
| Приспособление для склейки фанер в стыках | 1924 |
|
SU1973A1 |
| WO 9205177, 1992 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.1, с.439-441 | |||
| Виноградов В.М., Мухин Е.А., Фролов С.Ф | |||
| Фармакология с рецептурой | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
Авторы
Даты
1999-04-27—Публикация
1992-12-29—Подача