Изобретение касается новых производных β-карболина, способа их получения и применения в качестве лекарственных средств.
Мелатонин, N-ацетил-5-метокситриптамин, представляет собой гормон, образуемый шишковидным телом, выделенный Лернером (Lerner) и др. (J.Am.Chem. Soc. , 80, 1958, 2587), и составляет предмет многочисленных исследований вследствие своего циркадного действия на периодичность сна, его влияний на производство тестостерона, действия на гипоталамус и при психиатрических нарушениях.
Таким образом, исследовано применение мелатонина и его аналогов, в особенности для лечения депрессии и психиатрических расстройств, в частности стресса, тревоги, депрессии, бессонницы, шизофрении, психозов и эпилепсии, а также для лечения нарушений сна, связанных с путешествием ("запаздывание реакции" = "jet lag"), нейродегенеративных заболеваний центральной нервной системы, таких как болезнь Паркинсона или болезнь Альцгеймера, для лечения рака или в других случаях применение в качестве контрацептива или аналгетика.
Однако непосредственное применение мелатонина in vivo не обеспечивает по настоящему удовлетворительных результатов из-за того, что при первом проходе через печень экстрагируется более 90% активного начала, и не показано очевидного снотворного действия мелатонина.
Описаны различные аналоги мелатонина, демонстрирующие два пути исследования, которые касаются либо заместителей мелатонина (WO-A-89/01472, US-A-5283343, US-A-5093352 и WO-A-93/11761), либо ароматического кольца при замене индолильной группы нафтильной группой (FR-A-2658818, FR-A-2689124).
Авторы показали, что мелатонин не проявляет снотворного действия, но представляет собой биопредшественник ацетилированных метаболитов, которые вызывают сон.
Настоящая патентная заявка предлагает новый способ разработки новых производных карболина, которые являются аналогами эндогенных ацетилированных метаболитов мелатонина.
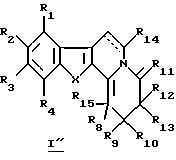
Настоящее изобретение касается новых производных карболина общей формулы I (I' и I'')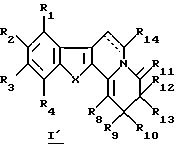
в которых Х представляет собой бивалентный радикал формулы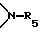
или -R6C=CR7-;
R1, R2, R3 и R4 каждый независимо от других представляет собой атом водорода, гидроксильный радикал, низший алкил, низший циклоалкил, низший алкокси, арилокси, низший аралкилокси, галоген или нитрорадикал, или ненасыщенную алифатическую цепь, формил, низший алкилкарбонил, низший алкилкарбонилокси, галоген(низший)алкилкарбонил, галоген(низший)алкилкарбонилокси, галоген(низший)алкил, галоген(низший) алкилокси, низший алкоксикарбонил, карбоксил, необязательно замещенный карбоксамид, причем два соседних радикала R1, R2, R3 и R4 могут вместе образовывать 2,3-дигидропиранильную группу, которая, возможно, несет оксогруппу; также R1, R2, R3 и R4 представляют собой независимо друг от друга пергалоген(низший)алкил, арил, аралкил, низший циклоалкокси, полигалогеналкокси, тиол-радикал, низший алкилтио, низший циклоалкилтио, моно- или полигалогеналкилтио, арилтио, аралкилтио, формиат, низший циклоалкилкарбонилокси, арилкарбонилокси, аралкилкарбонилокси, низший диалкиламиноалкил, аминоалкил, низший алкиламиноалкил, ариламиноалкил, диариламиноалкил, арилалкиламиноалкил, амино, алкиламино, диалкиламино, ариламино, диариламино, аралкиламино, диаралкиламино, формамид, низший алкилкарбониламино, низший циклоалкилкарбониламино, галоген(низший)алкилкарбониламино, полигалоген(низший)алкилкарбониламино, арилкарбониламино, низший аралкилкарбониламино, низший циклоалкилкарбонил, полигалоген(низший)алкилкарбонил, арилкарбонил, аралкилкарбонил, низший циклоалкоксикарбонил, галогеналкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, низший алкилсульфонил, низший циклоалкилсульфонил, галоген(низший)алкилсульфонил, пергалоген(низший)алкилсульфонил, арилсульфонил, аралкилсульфонил, цианорадикал.
R5 представляет собой атом водорода, низший алкил, циклоалкил, арил, низший аралкил, низший алкокси, низший алкилкарбонил, галоген(низший)алкилкарбонил, низший алкилоксикарбонил, амино, алкиламино, диалкиламино, алкилариламино, диариламино, галоген(низший)алкилсульфонил, алкилсульфонил или арилсульфонил.
R5 также представляет собой галоген(низший)алкил, пергалоген(низший)алкил, гидроксильный радикал, низший циклоалкокси, арилокси, аралкилокси, тиол-радикал, низший алкилтио, низший циклоалкилтио, арилтио, аралкилтио, диалкиламиноалкил, ариламино, аралкиламино, диаралкиламино, необязательно замещенный карбоксамид, формамид, формил, низший циклоалкилкарбонил, пергалоген(низший)алкилкарбонил, арилкарбонил, аралкилкарбонил, низший циклоалкоксикарбонил, галогеналкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, низший циклоалкилсульфонил, пергалоген(низший)алкилсульфонил, аралкилсульфонил, цианорадикал.
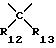
R6, R7, R9, R10, R12, R13, R14 и R15 представляют собой независимо друг от друга атом водорода, низший алкил, низший циклоалкил, галоген(низший)алкил, пергалоген(низший)алкил, арил, аралкил, низший алкокси, низший циклоалкокси, моно- или полигалогеналкокси, арилокси, аралкилокси, гидроксиалкил, алкилоксиалкил, низший алкилтио, низший циклоалкилтио, моно- или полигалогеналкилтио, арилтио, аралкилтио, формиат, низший алкилкарбонилокси, низший циклоалкилкарбонилокси, галоген(низший)алкилкарбонилокси, арилкарбонилокси, аралкилкарбонилокси, диалкиламиноалкил, диалкиламино, диариламино, диаралкиламино, необязательно замещенный карбоксамид, формамид, низший алкилкарбониламино, низший циклоалкилкарбониламино, галоген(низший)алкилкарбониламино, пергалоген(низший)алкилкарбониламино, низший арилкарбониламино, низший аралкилкарбониламино, формил, низший алкилкарбонил, низший циклоалкилкарбонил, галоген(низший)алкилкарбонил, пергалоген(низший)алкилкарбонил, арилкарбонил, аралкилкарбонил, карбоксил, низший алкоксикарбонил, низший циклоалкоксикарбонил, галогеналкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, низший алкилсульфонил, низший циклоалкилсульфонил, галоген(низший)алкилсульфонил, пергалоген(низший)алкилсульфонил, арилсульфонил, аралкилсульфонил, галоген, циано- или нитрорадикал.
R8 представляет собой низший алкил, низший циклоалкил, гидроксиалкил, алкилоксиалкил, галоген(низший)алкил, пергалоген(низший)алкил, арил, низший алкиларил, галогенарил, низший алкоксиарил, нитроарил, аминоарил, ди(низший)алкиламиноарил, пиридил, аралкил, низший алкокси, низший циклоалкокси, моно- или полигалогеналкокси, арилокси, аралкилокси, низший алкилтио, низший циклоалкилтио, моно- или полигалогеналкилтио, арилтио, аралкилтио, низший алкилкарбонилокси, низший циклоалкилкарбонилокси, галоген(низший)алкилкарбонилокси, арилкарбонилокси, аралкилкарбонилокси, диалкиламиноалкил, диалкиламино, диариламино, диаралкиламино, необязательно замещенный карбоксамид, формамид, низший алкилкарбониламино, низший циклоалкилкарбониламино, галоген(низший)алкилкарбониламино, полигалоген(низший)алкилкарбониламино, арилкарбониламино, низший аралкилкарбониламино, формил, низший алкилкарбонил, низший циклоалкилкарбонил, галоген (низший)алкилкарбонил, пергалоген(низший)алкилкарбонил, арилкарбонил, аралкилкарбонил, карбоксил, низший алкоксикарбонил, низший циклоалкоксикарбонил, галогеналкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, низший алкилсульфонил, низший циклоалкилсульфонил, галоген(низший)алкилсульфонил, пергалоген(низший)алкилсульфонил, арилсульфонил, аралкилсульфонил, галоген, циано- или нитрорадикал.
R6, R7, R8, R9, R10, R12, R13, R14 и R15 могут представлять собой, но не одновременно R8 и R15, R9 и R10, R12 и R13, гидроксильный радикал, тиолрадикал, амино, алкиламино, ариламино, аралкиламино, алкокси, низший циклоалкокси, моно- или полигалогеналкокси, арилокси, аралкилокси, низший алкилтио, низший циклоалкилтио, моно- или полигалогеналкилтио, арилтио, аралкилтио, алкиламино, ариламино.
Кроме того,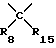
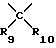
могут также представлять собой карбонильную группу С=O, тиокарбонильную группу C=S, радикал C=N-R16 или радикал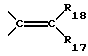
R11 представляет собой атом кислорода или серы;
R16 представляет собой атом водорода, низший алкил, низший циклоалкил, арил, аралкил, гидроксильный радикал, низший алкокси, алкилкарбонил, арилкарбонил, аралкилкарбонил, амино, алкиламино, диалкиламино, ариламино, диариламино, аралкиламино, алкилкарбониламино, арилкарбониламино.
R17 и R18 представляют собой независимо друг от друга атом водорода, низший алкил, низший циклоалкил, арил, аралкил, низший алкокси, низший циклоалкокси, арилокси, аралкилокси, низший алкилтио, арилтио, аралкилтио, низший алкилкарбонилокси, низший циклоалкилкарбонилокси, арилкарбонилокси, аралкилкарбонилокси, диалкиламино, арилалкиламино, диариламино, необязательно замещенный карбоксамид, формамид, низший алкилкарбониламино, низший циклоалкилкарбониламино, арилкарбониламино, формил, низший алкилкарбонил, низший циклоалкилкарбонил, арилкарбонил, аралкилкарбонил, карбоксил, низший алкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, низший алкилсульфонил, арилсульфонил.
R1-R2, R2-R3 и R3-R4 могут составлять часть другого ароматического или неароматического кольца, с гетероатомом или без такового, и необязательно несущего карбонильную или тиокарбонильную группу.
Соединения, соответствующие настоящему изобретению, могут содержать от одного до трех центров асимметрии, такие соединения будут существовать в виде оптических изомеров (энантиомеров).
Настоящее изобретение касается рацемических смесей, чистых энантиомеров или смесей таких веществ в любых пропорциях, и их терапевтически приемлемых солей.
Более конкретно, атом углерода, несущий группу R8, может представлять собой центр асимметрии, настоящее изобретение включает все такие энантиомеры и смеси.
Выражения "низший алкил", "низший алкокси" или "пергалоген(низший)алкил" обычно понимают как относящиеся к радикалам, алкильный остаток которых включает от 1 по 6 атомов углерода.
Предпочтительно это линейные или разветвленные C1-C4 алкильные остатки, более конкретно, выбранные из метильной, этильной, н-пропильной, изопропильной, н-бутильной, изобутильной и трет-бутильной групп. Выражение "ненасыщенная алифатическая цепь" предпочтительно понимают как относящееся к ненасыщенной C2-C6 углеводородной цепи.
Термин "арил" обычно обозначает ароматические и гетероароматические группы, в частности арилы, выбранные из фенильной, тиенильной, фуранильной, пиридильной и нафтильной групп. Арильные радикалы также могут быть замещены одной группой или более, в частности, выбранной из атома водорода, низшего алкила, низшего циклоалкила, галоген(низшего)алкила, пергалоген(низшего)алкила, арила, аралкила, гидроксильного радикала, низшего алкокси, низшего циклоалкокси, моно- или полигалогеналкокси, арилокси, аралкилокси, тиола, низшего алкилтио, низшего циклоалкилтио, моно- или полигалогеналкилтио, арилтио, аралкилтио, формиата, низшего алкилкарбонилокси, низшего циклоалкилкарбонилокси, галоген(низший)алкилкарбонилокси, арилкарбонилокси, аралкилкарбонилокси, диалкиламиноалкила, амино, алкиламино, диалкиламино, ариламино, диариламино, аралкиламино, диаралкиламино, необязательно замещенного карбоксамида, формамида, низшего алкилкарбониламино, низшего циклоалкилкарбониламино, галоген(низший)алкилкарбониламино, пергалоген(низший)алкилкарбониламино, низшего арилкарбониламино, низшего аралкилкарбониламино, формила, низшего алкилкарбонила, низшего циклоалкилкарбонила, галоген (низший)алкилкарбонила, пергалоген(низший)алкилкарбонила, арилкарбонила, аралкилкарбонила, карбоксила, низшего алкоксикарбонила, низшего циклоалкоксикарбонила, галогеналкоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, низшего алкилсульфонила, низшего циклоалкилсульфонила, галоген(низший) алкилсульфонила, пергалоген(низший)алкилсульфонила, арилсульфонила, аралкилсульфонила, галогена, циано- или нитрорадикалов.
Выражение "низший аралкил" будем понимать как относящееся к комбинации низшего алкила и арила, определенных выше. Это предпочтительно бензильный радикал, который необязательно имеет заместитель.
Галогенрадикалы предпочтительно выбирают из атомов фтора, хлора, брома и иода. Пергалогенрадикалы предпочтительно являются перфторрадикалами.
Если R1-R2, R2-R3 и R3-R4 составляют часть другого ароматического кольца, с гетероатомом или без такового, это другое ароматическое кольцо предпочтительно представляет собой необязательно замещенное бензольное кольцо или необязательно замещенное пиридильное кольцо.
Если R1-R2, R2-R3 и R3-R4 составляют часть другого неароматичесгого кольца, они предпочтительно образуют вместе бивалентный радикал формулы -O-(СН2)m-, где m = 2 или 3, который необязательно замещен, или бивалентный радикал формулы -О-(СН2)р-O-, где p = 1 или 2, который необязательно замещен. Если производные включают, по меньшей мере, один асимметрический углерод, то настоящее изобретение касается соответствующих рацемических смесей, а также их чистых энантиомеров в любых пропорциях.
Терапевтически приемлемые соли производных, соответствующих данному изобретению, являются обычными для данной области органическими или неорганическими солями, в частности гидрохлоридами, тозилатами, мезилатами и цитратами, а также сольватами, такими как гидраты или полугидраты соединений общей формулы I.
По сравнению с производными, описанными в WO 96/08490, производные, соответствующие данному изобретению, отличаются тем, что содержат группу R8, которая существенным образом повышает стабильность таких соединений в кислой среде желудка и допускает оральное применение.
Не привязываясь к какой-либо теории, в настоящее время обнаружено, что группа, ответственная за снотворное действие соединений настоящего изобретения, представляет собой енамидную или дигидроенамидную группу. Эта енамидная или дигидроенамидная группа является группой, обозначенной как Ca-N-Сb в формуле I.
Производными, соответствующими настоящему изобретению и представляющими особый интерес, являются такие, в которых:
R11 предпочтительно является атомом кислорода или серы,
R2 является гидроксильным или низшим алкоксирадикалом, предпочтительно R2 является метоксирадикалом,
R14 является атомом водорода или низшей алкоксикарбонильной группой.
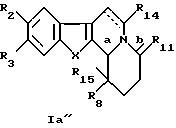
Более конкретно, настоящее изобретение касается производных общей формулы Ia (Ia' и Ia'')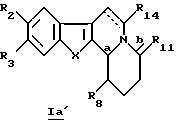
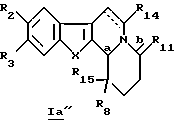
Если Ia представляет собой Ia', то R8 представляет собой алкильный радикал, необязательно замещенный алкилом, галогеном, аминогруппой, алкоксигруппой, алкилоксикарбонилом; арильный радикал, необязательно замещенный алкилом, галогеном, нитрогруппой, диалкиламиногруппой, алкоксигруппой, алкилоксикарбонилом, алкиламиногруппой, при этом арильный радикал является, например, фенильной группой, пиридилом.
Если Iа представляет собой Iа'' и если R15 является атомом водорода, то R8 предпочтительно представляет собой радикал этил, гексил, изопропил, фенил, фторфенил, метоксифенил, аминофенил, диметиламинофенил, нитрофенил, толил, этоксикарбонил, пиридил.
Если R15 отличен от атома водорода, то R8 и R15 идентичны и представляют собой алкильные или арильные радикалы, необязательно замещенные алкилом, галогеном, аминогруппой, алкоксигруппой.
Х представляет собой бивалентный радикал формулы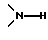
или -HC=CH-,
(R5=R6=R7=H)
R11 предпочтительно является атомом кислорода или серы.
R2 является гидроксильным или низшим алкоксирадикалом, предпочтительно метоксирадикалом.
R3 является атомом водорода или алкильным радикалом, предпочтительно метильным радикалом.
В частности, настоящее изобретение касается производных общей формулы Ib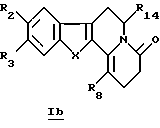
в которой R2, R3, R8, R14 и X определены выше.
Производное формулы Ib можно получить непосредственно по реакции соединения общей формулы IIа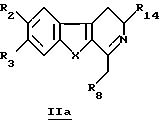
в которой R2, R3, R8, R14 и X определены выше, с карбоновой кислотой (такой как акриловая кислота) в присутствии или в отсутствие дифенилфосфорилазида или с акрилонитрилом.
Для получения производных общей формулы IIa проводят реакцию Бишлера-Напиральски (Bischler-Napieralski) посредством взаимодействия соединений общей формулы IIIa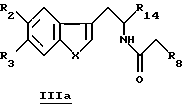
в которой R2, R3, R8, R14 и X определены выше, с пентоксидом фосфора (P2O5) или с оксихлоридом пятивалентного фосфора (РОСl3) в подходящем растворителе, например толуоле, ксилоле, дихлорметане.
Эти производные IIa можно также получить путем окисления перманганатом производных общей формулы IIb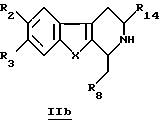
в которой R2, R3, R8, R14 и X определены выше.
Для получения производных общей формулы IIb проводят реакцию Пиктета-Спенглера (Pictet-Spengler) посредством взаимодействия производных общей формулы IIIb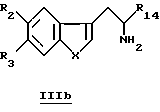
для которой R2, R3, R14 и X определены выше, с соединениями формулы R8-CH2-CHO или их химическими эквивалентами, такими как кеталь, простой эфир енола, сложный эфир енола или нитрил формулы R8-CH2-CN, в восстановительных условиях, при этом R8 такой, как определено выше.
Производные формулы IIIa можно получить, проводя ацилирование при помощи ацилирующего агента (хлорангидрида кислоты, ангидрида кислоты, сложного эфира) производных формулы IIIb, для которой R2, R3, R14 и X определены выше.
Также, если X=NR5, то производные формулы IIIa можно получить по реакции Фишера с подходящим замещенным фенилгидразином общей формулы IV и удобным альдегидом или скрытым альдегидом, таким как кеталь, общей формулы V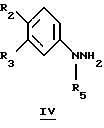
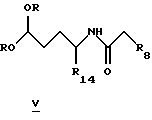
для которых R2, R3, R14 и X определены выше, и R5 представляет собой водород или низший алкил.
В конкретном случае производных общей формулы Iс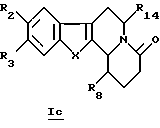
для которой R2, R3, R8, R14 и X определены выше, такое производное формулы Iс можно получить путем прямого каталитического восстановления соединения общей формулы Ib водородом в присутствии палладия на угле.
В конкретном случае производных общей формулы Id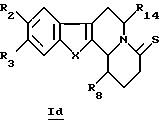
для которой R2, R3, R8, R14 и X определены выше, такие производные общей формулы Id можно получить путем непосредственного воздействия реагента Лавессона (Lawesson) или P2S4 на соединения общей формулы Ib.
В конкретном случае производных общей формулы Iе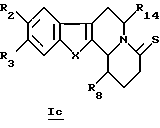
для которой R2, R3, R8, R14 и X определены выше, такое производное формулы Iе можно получить путем непосредственного воздействия реагента Лавессона (Lawesson) или P2S4 на соединение общей формулы Iс.
В конкретном случае производных общей формулы If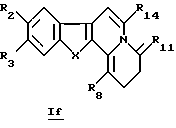
для которой R2, R3, R8, R14 и X определены выше, такое производное формулы If можно получить путем непосредственного воздействия окислителя (такого как О2 в щелочной среде) на соединение общей формулы Ib или Id.
Производные, соответствующие формуле Iа, в которых R8 и R15 идентичны, можно получить, проводя реакцию производных общей формулы IIIb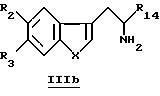
с соединениями формулы EtO-CO-C(R8) (R15)-COH или их химическими эквивалентами в восстановительных условиях.
Производные данного изобретения можно применять в качестве лекарственных средств для лечения заболеваний, связанных с нарушениями активности мелатонина. Производные данного изобретения проявляют миорелаксирующие свойства, а также их можно применять для лечения депрессии и психиатрических расстройств, в частности стресса, тревоги, депрессии, бессонницы, шизофрении, психозов и эпилепсии, а также для лечения нарушений сна, связанных с путешествием ("запаздывание реакции" = "jet lag"), нейродегенеративных заболеваний центральной нервной системы, таких как болезнь Паркинсона или болезнь Альцгеймера, для лечения рака или в других случаях применение в качестве контрацептива или аналгетика. Они оказывают снотворное и седативное действия.
Стабильность в кислой среде и фармакологическая активность
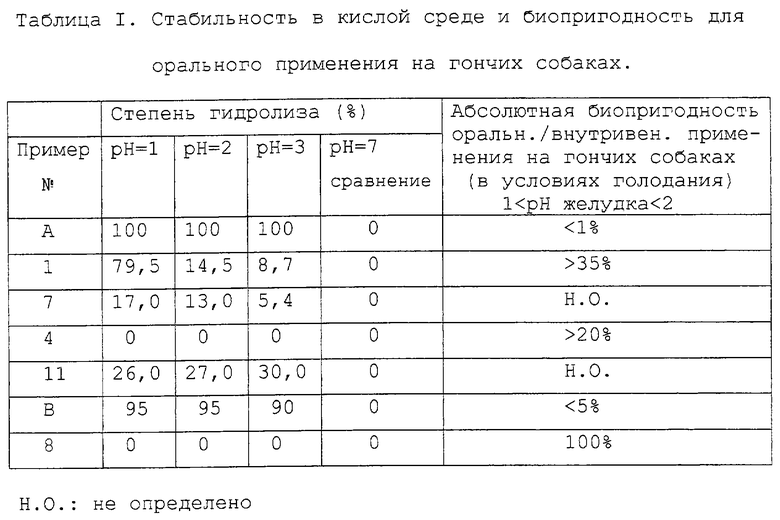
1. Стабильность в кислой среде и биопригодность для гончих собак.
Для исследования влияния группы R8 на стабильность цикла А при сравнении соединений (примера) А и (примера) В (R8 = атом водорода) с соединениями примера 1, примера 4, примера 7, примера 8 и примера 11 растворяют 30 мкл каждого из этих соединений в 5 мл буфера с рН 1, или рН 2, или рН 3, или рН 7 (сравнение). Растворы перемешивают в течение 15 минут при 37oС. Затем выполняют определение количеств негидролизованных соединений, применяя способ высокоэффективной жидкостной хроматографии.
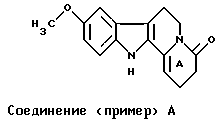
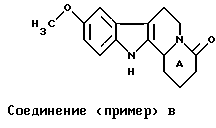
Результаты, представленные в Таблице I, даны в виде процентного содержания гидролизованных соединений, при сравнении с соединениями (примера) А и (примера) В, которые полностью гидролизованы в диапазоне от рН 1 до рН 3.
Соединения 1, 4, 7, 8 и 11 стабильны при рН от 2 и выше, так как при рН≥2 эти соединения гидролизованы менее чем на 27 процентов.
В заключение, соединения, в которых группа R8 (в общей формуле I) отлична от атома водорода, не подвергаются полному гидролизу цикла А. Стабильность таких соединений, как соединения примеров 1, 4, 8, в кислой среде желудка допускает их применение оральным способом. Фармакокинетические исследования этих соединений (Таблица I) проводили на гончих собаках; соединения 1, 4, 8 демонстрируют абсолютную биопригодность орального способа применения относительно внутривенного, соответственно, выше 35% (соединение 1), 20% (соединение 4) и равную 100% (соединение 8), притом что абсолютная биопригодность соединений (примера) А и (примера) В ниже 1% (пример А) и 5% (пример B).
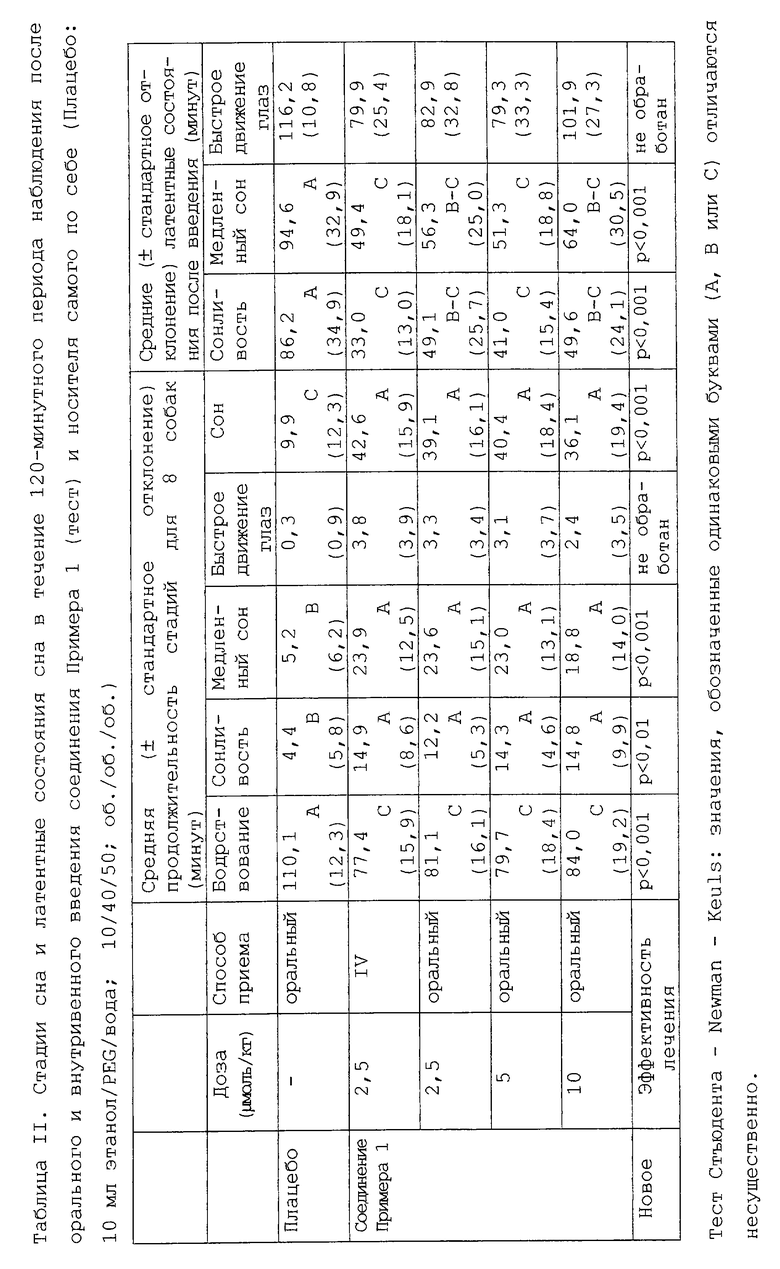
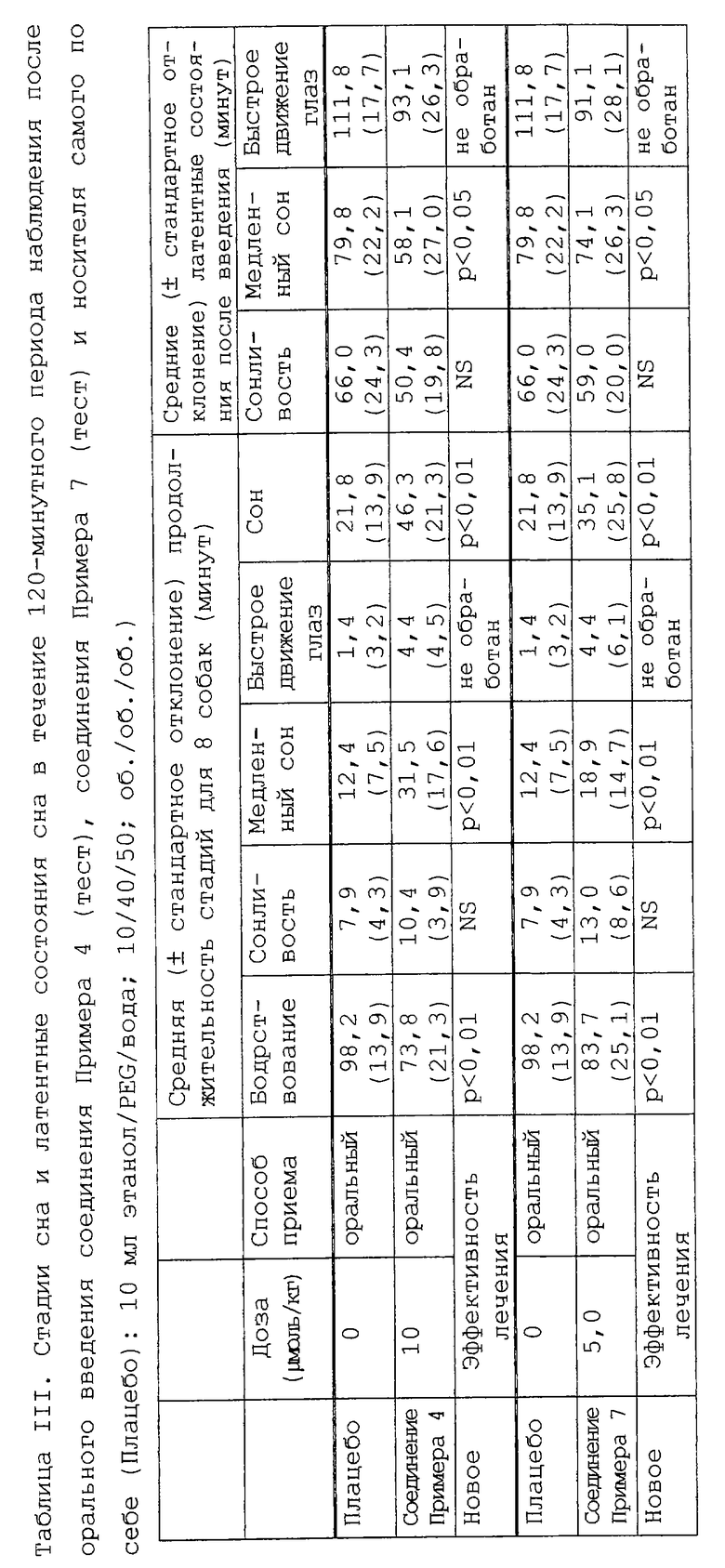
Соединение 1 (см. Таблицу II), а также соединения 4 и 7 (см. Таблицу III) проявляют существенное снотворное действие при оральном введении гончим собакам.
2. Снотворное действие на примере гончих собак: влияние на состояния бодрствования/сна у гончих собак.
Гончих собак содержат в металлической клетке, соединенной посредством гибкого кабеля с 2 Schwartzer ED 24 Polygraph, с программным обеспечением BRAINLAB®.
Исследуемые и контрольные продукты вводят оральным или внутривенным способом при помощи желудочных трубок. Регистрацию производят с периодом 30 секунд для активного бодрствования, сонливости, медленного сна (легкий сон + глубокий сон) и быстрого сна. Согласно Шелтону и др. (SHELTON J., NISHINO S. , VAUGHT J. , DEMENT W.C. и MIGNOT Е. Comparative effects of modafinil and amphetamine on daytime sleepiness and cataplexy of narcoleptic dogs. Sleep 19(1); 29-38, 1996), эти критерии основаны на частоте и амплитуде диаграмм: кортикальной элекроэнцефалограммы (EEG, лобно-фронтальная), электромиограммы (EMG верхних мышц шеи) и EOG (билатеральная). В течение каждого периода в 120 минут непрерывно следят за поведением животных. Предварительная акклиматизация собак длится 5 дней; и, имитируя аналогичный стресс, вызванный введением желудочных трубок, вместе с внутривенной инъекцией вводят орально смесь воды/полиэтиленгликоля (PEG) {50/50, объем/объем}.
Бодрствование: включает все эпизоды с диаграммой при низком напряжении и смешанной частоте, в которой EMG не ингибируется. Во время бодрствования собаки стоят, сидят или лежат, и глаза у них открыты.
Сонливость: состояние дремоты отмечают, если собаки тихо лежат с закрытыми глазами (50% или более в течение одного определения), и кортикальная EEG показывает ряд относительно медленных волн (4-7 Гц), не обнаруживая сонных веретен. Синхронные волны при 4-7 Гц и 50 -100 мкВ появляются на фоне активности быстрого сна при низком напряжении.
EMG умеренно снижена по сравнению со стадией бодрствования.
Легкий глубокий сон: медленный сон (SWS) (легкий сон + глубокий сон): собаки расслаблены в позе лежа ничком. Графики EEG имеют большую, чем на предыдущей стадии, амплитуду и сонные веретена (10-14 Гц), и/или в легком сне могут присутствовать К-комплексы, так как EOG показывает медленные движения глаз или отсутствие движения. Глубокий сон отмечают, если медленные дельта-волны (<4 Гц) составляют 20 процентов или более за период во время глубокого сна.
REM: сон с быстрым движением глаз отмечают, если собаки лежат, глаза закрыты с явными прерывистыми быстрыми подергиваниями мышц. Диаграмму EEG при низком напряжении и смешанной частоте наблюдают вместе с быстрыми движениями глаз и снижением EMG активности.
Разделение и продолжительность состояний бодрствования/сна определяют у гончих собак после орального (и внутривенного для соединения примера 1) введения Плацебо (наполнитель = 10 мл смеси этанол/PEG 400/вода, 10/40/50; об./об./об.), соединений примера 1, примера 4 и примера 7.
Результаты представлены в Таблицах II и III как Продолжительность и Латентное состояние каждой стадии.
Соединения примера 1, примера 4 и примера 7 демонстрируют сильное снотворное действие, вызывая сон, отличающийся высокой долей медленного сна. Что касается продолжительности и латентных состояний стадий бодрствования, дремоты и медленного сна, эти 3 соединения индуцируют существенный снотворный эффект.
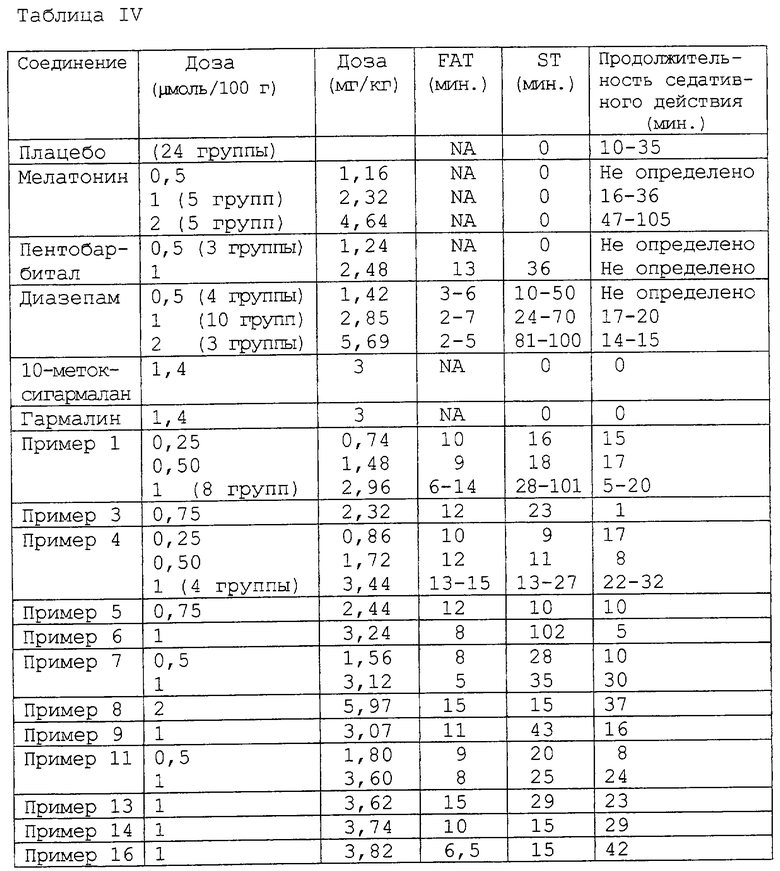
3. Снотворные и седативные эффекты у цыплят.
Гипнотические и седативные эффекты полученных выше производных, соответствующих данному изобретению (результаты исследования которых приведены ниже в Таблице IV}, у 10-14-дневных цыплят (штамм JA657) сравнивали с эффектами трех указанных продуктов: диазепама, пентобарбитала натрия и мелатонина, а также с эффектами двух соединений-психостимуляторов с галлюциногенными свойствами: 10-метоксигармалана и гармалина, которые представляют собой 3,4-дигидро-β-карболины. Животных выдерживают в условиях чередующейся освещенности: 12 часов темноты (с 20.00 до 8.00 ч) и 12 часов света (с 8.00 до 20.00 ч). Комнатная температура составляет 25oС в течение первой недели содержания цыплят и 22oС, начиная со второй недели и далее. Освещение в течение дня обеспечивает галогенная лампа (300 Вт), размещенная на высоте 30 см от пола вивария. Во время исследования живой вес цыплят составлял от 85 до 120 г. Исследования проводят между 14.00 и 15.00 ч. Цыплят делят на 3 группы и размещают по одинаковым вивариям, 30 см х 50 см х 30 см. Исследуемые продукты вводят внутримышечно (IM) в большую грудную мышцу в виде раствора в смеси этанол/PEG 400/вода = 25/50/25 (об./об./об.) в количестве 0,2 мл раствора на 100 г живого веса. Вводимые дозы исследуемых продуктов (новых соединений данного изобретения и сравнительных веществ) составляют от 0,25 до 2 мкмоль на 100 г живого веса. Плацебо представляет собой 0,2 мл смеси этанол/PEG 400/вода = 25/50/25 (об./об./об.).
Растворы исследуемых продуктов в смеси этанол/PEG 400/вода = 25/50/25 (об. /об. /об.) готовят во время использования посредством последовательного разбавления основного раствора, полученного из 2,5-20 мкмоль точно отвешенного продукта, к которому последовательно добавляют 0,5 мл чистого этанола и затем 1 мл PEG 400 при перемешивании ультразвуком, а потом доводят объем раствора до 2 мл, добавляя 0,5 мл дистиллированной воды для инъекций. В Таблице IV приведены результаты, полученные после внутримышечного (IM) введения доз 0,25-2 мкмоль исследуемых продуктов, растворенных в 0,2 мл смеси этанол/PEG 400/вода = 25/50/25 (об./об./об.), на 100 г живого веса. Для каждого цыпленка вводимый объем регулируют в зависимости от действительного живого веса до значения 0,2 мл на 100 г живого веса.
Наблюдаемыми параметрами являются двигательная активность и сознательное состояние цыпленка в течение 2 ч, то есть эквивалент 6 теоретических циклов бодрствования/сна для цыпленка такого возраста, их регистрируют видеокамерой в течение 90 минут, первые 30 минут являются временем адаптации к прибору.
Ниже в Таблице IV приведены снотворные и седативные эффекты исследуемых продуктов на дневную активность 10-14-дневных цыплят, выдержанных до исследования в условиях непрерывной освещенности с рождения в течение 48 часов и затем в условиях чередующейся освещенности: 12 часов дневного света (8.00 - 20.00 ч) и 12 часов темноты (20.00 - 8.00 ч). Исследования проводят в течение дня между 14.00 и 15.00 ч.
Для каждого исследуемого продукта проводят несколько серий определений на группах из 3 животных, каждая указанная величина является средней для каждой группы из 3 цыплят. Если количество групп больше или равно 2, то указанные числа являются средними пределами наблюдаемых значений.
В условиях проведения исследования (время введения в фазе, когда животные находятся на свету, между 14.00 и 15.00 ч) мелатонин не оказывает снотворного действия.
Путем последовательного воздействия на цыплят чередующимся или непрерывным освещением авторы экспериментально показали, что мелатонин не оказывает прямого снотворного действия, что свойственно его структуре. Его снотворное действие зависит от активности фермента N-ацетилтрансферазы (NAT) в шишковидном теле цыпленка во время введения мелатонина. NAT является ферментом ацетилирования. В присутствии фермента NAT в шишковидном теле цыпленка внутримышечное введение мелатонина вызывает снотворный эффект большой интенсивности (время сна от 250 до 300 минут для дозы, равной 1 мкмоль мелатонина на 100 г живого веса). Таким образом, мелатонин является предшественником ацетилированных метаболитов с прямым снотворным действием. Соединения данного изобретения представляют собой аналоги снотворных ацетилированных метаболитов мелатонина.
В противоположность мелатонину все производные данного изобретения, описанные выше, оказывают прямое снотворное и седативное действие, которое не зависит от времени введения, то есть от уровня фермента N-ацетилтрансферазы в центральной нервной системе.
Полученные для производных данного изобретения результаты показывают, что их снотворное действие сильнее, чем действие сравнительных продуктов (пентобарбитала, мелатонина) и эквивалентно или даже превосходит действие диазепама.
Таким образом, производные, соответствующие данному изобретению, особо полезны для лечения нарушений сна и заболеваний, связанных с нарушениями активности мелатонина.
Примеры
Пример 1: ETCARBO7
Формула: C18H20N2O2; M = 296,36 г•моль-1
Структура: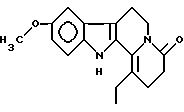
9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]-хинолизин-4-он
Получение:
Параметоксифенилгидразин сульфонат (5 г, 20,7 ммоль) и N-(4,4-диэтоксибутил)бутанамид (4,8 г, 20,7 ммоль) смешивают в коммерческом ТГФ (85 мл) в колбе на 500 мл. Затем среду нагревают до кипения ТГФ с обратным холодильником и добавляют по капле уксусную кислоту (25%, 35 мл). Прозрачную желтую смесь перемешивают в течение 6 часов при температуре в интервале от 80 до 85oС. После охлаждения реакционную смесь переносят в колбу Эрленмейера на 2 л и подщелачивают, добавляя насыщенный раствор карбоната натрия (~100 мл), рН>7. Органическую фазу декантируют, а водную фазу дважды экстрагируют этилацетатом (2 х 100 мл). Органические фазы объединяют, последовательно промывают насыщенным раствором карбоната натрия (70 мл) и водой (70 мл), полученную органическую фазу сушат над МgSO4 и выпаривают растворитель при пониженном давлении до появления кристаллов (~5 мл этилацетата). После разбавления диэтиловым эфиром (50 мл) этот раствор оставляют на ночь в холодильнике. Кристаллы получают фильтрованием, промывают диэтиловым эфиром и сушат в вакууме. Затем получают N1-(2-(5-метокси-1Н-3-индолил)этил)бутанамид (3,3 г, R=61%).
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)бутанамиде приводит к получению 1-пропил-6-метокси-3,4-дигидро-2-карболина.
Способ 1.
Акриловую кислоту (0,71 мл, 1,1 экв.) добавляют к раствору 1-пропил-6-метокси-3,4-дигидро-2-карболина (2,34 г) в диметилформамиде (ДМФ) (20 мл). Затем добавляют по капле дифенилфосфорилазид (2,1 мл, 1,06 экв.), растворенный в ДМФ (3 мл), а потом триэтиламин (2,85 мл, 2,1 экв.). После перекристаллизации из этилацетата получают 9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он (1,6 г, 56%).
Способ 2.
Акриловую кислоту (1 экв.), растворенную в ксилоле, добавляют к раствору 1-пропил-6-метокси-3,4-дигидро-2-карболи-на в ксилоле. Реакционную колбу снабжают ловушкой для воды и нагревают среду до кипения ксилола с обратным холодильником в течение 24 часов. Затем ксилол отгоняют при пониженном давлении. Продукт чистят, как описано выше.
ЯМР 1H (CDCl3): 1,29 (т, 3Н); 2,44 и 2,54 (2 м, 6Н); 2,86 (т, 2Н); 3,86 (с, 3Н); 4,08 (т, 2Н); 6,87 (дд 2,4 и 8,7 Гц, 1Н); 6,95 (д 2,4 Гц, 1Н); 7,27 (д 8,7 Гц, 1Н); 8,04 (широкий с, 1Н).
Масс-спектр: m/z 296 (M+.), 281 (100).
Точная масса: рассчитано 296,1524; найдено 296,1545.
Температура плавления: 223oС.
Пример 2: HECARBO7
Формула: C22H28N2O2; M = 352,47 г•моль-1
Структура: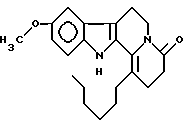
9-метокси-1-гексил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)октанамиде приводит к получению 1-гептил-6-метокси-3,4-дигидро-2-карболина.
Акриловую кислоту (1 экв.), растворенную в ксилоле, добавляют к раствору 1-гептил-6-метокси-3,4-дигидро-2-карболина в ксилоле. Реакционную колбу снабжают ловушкой для воды и нагревают реакционную среду до кипения ксилола с обратным холодильником в течение 48 часов. Затем ксилол отгоняют при пониженном давлении. Продукт перекристаллизовывают из этил-ацетата.
ЯМР 1H (CDCl3): 0,92 (т, 3Н); 1,42 (м, 8Н); 2,40 (т, 2Н); 2,50 (м, 4Н); 2,56 (т, 2Н); 3,86 (с, 3Н); 4,08 (т, 2Н); 6,87 (дд 2,4 и 8,7 Гц, Н); 6,94 (д 2,4 Гц, 1Н); 7,23 (д 8,7 Гц, 1Н); 8,04 (широкий с, 1Н).
Масс-спектр: m/z 352 (М+.), 281 (100).
Температура плавления: 140oС.
Пример 3: IPCARBO7
Формула: C19H22N2O2; М = 310,39 г•моль-1
Структура: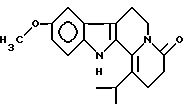
9-метокси-1-изопропил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] -хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)-3-метилбутанамиде приводит к получению 1-изобутил-6-метокси-3,4-дигидро-2-карболина.
Акриловую кислоту (1 экв.), растворенную в ксилоле, добавляют к раствору 1-изобутил-6-метокси -3,4-дигидро-2-карболина в ксилоле. Реакционную колбу снабжают ловушкой для воды и нагревают реакционную среду до кипения ксилола с обратным холодильником в течение 48 часов. Затем ксилол отгоняют при пониженном давлении. Продукт перекристаллизовывают из этил-ацетата.
ЯМР 1H (CDCl3): 1,20 (д, 6Н); 2,35 и 2,47 (2м, 4Н); 2,87 (т, 2Н); 3,38 (м, 1Н); 3,86 (с, 3Н); 4,06 (т, 2Н); 6,87 (дд 2,4 и 9 Гц, 1Н); 6,95 (д 2,4 Гц, 1Н); 7,32 (д 9 Гц, 1Н).
Масс-спектр: m/z 310 (М+.), 295(100).
Температура плавления: 251-252oС.
Пример 4: PHCARBO7
Формула: C22H20N2O2; М = 344,41 г•моль-1
Структура: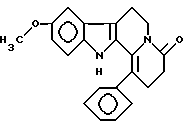
9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)-2-фенилацетамиде приводит к получению 1-бензил-6-метокси-3,4-дигидро-2-карболина.
Акриловую кислоту (0,75 мл, 1,1 экв.) добавляют к раствору 1-бензил-6-метокси-3,4-дигидро-2-карболина (2,8 г) в ДМФ (20 мл). Затем добавляют по капле дифенилфосфорилазид (2,1 мл, 1,06 экв.), растворенный в ДМФ (3 мл), а после этого триэтиламин (2,85 мл, 2,1 экв.). После деления на силикагеле (элюент хлороформ/метанол) получают 9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он (1,6 г, 56%).
ЯМР 1H (CDCl3): 2,71 (м, 4Н); 2,91 (т, 2Н); 3,83 (с, 3Н); 4,20 (т, 2Н); 6,76 (дд 2,4 и 8,7 Гц, 1Н); 6,84 (д 8,7 Гц, 1Н); 6,90 (д 2,4 Гц, 1Н); 6,93 (широкий с, 1Н); 7,42 и 7,50 (м, 5Н).
Масс-спектр: m/z 344 (М+.) (100), 253.
Температура плавления: 235oС.
Пример 5: CO2ETCARBO7
Формула: C19H20N2O4; M = 340,37 г•моль-1
Структура: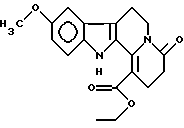
1-карбэтокси-9-метокси-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хиолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на 3-((2-(5-метокси-1Н-3-индолил)этил)амино)-3-оксопропаноате ведет к получению соответствующего карболина.
К раствору полученного карболина (800 мг) в бензоле (10 мл) добавляют раствор гидроксида натрия (1N, 3 мл) а затем гидросульфат тетрабутиламмония (0,1 экв. ). После этого добавляют акрилоилхлорид (0,27 мл) при 0oС и смеси дают нагреться до комнатной температуры в течение ночи. Продукт делят на силикагеле (хлороформ/метанол) и получают, таким образом, 1-карбэтокси-9-метокси-2,3,4,6,7,12-гексагидроиндоло-[2,3-а]хинолизин-4-он.
ЯМР 1H (CDCl3): 1,42 (т, 3Н); 2,60 (т, 2Н); 2,85 (т, 2Н); 2,97 (т, 2Н); 3,89 (с, 3Н); 4,30 (т, 2Н); 4,35 (квартет, 2Н); 6,96 (д 2,1 Гц, 1Н); 7,01 (дд 2,1 и 7,5 Гц, 1Н); 7,35 (д 7,5 Гц, 1Н).
Масс-спектр: m/z 340(М+.), 294 (100).
Температура плавления: 174-175oС.
Пример 6: 6ETETCARBO7
Формула: C20H24N2O2; М = 324,42 г•моль-1
Структура: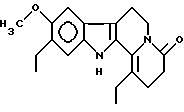
9-метокси-1,10-диэтил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] -хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-6-этил-1H-3-индолил)этил)бутанамиде ведет к получению 7-этил-1-пропил-6-метокси-3,4-дигидро-2-карболина.
К раствору 7-этил-1-пропил-6-метокси-3,4-дигидро-2-карболина (764 мг) в ДМФ (20 мл) добавляют акриловую кислоту (0,22 мл, 1,1 экв.). Затем добавляют по капле дифенилфосфорилазид (1,06 экв.), растворенный в ДМФ (3 мл), и после триэтиламин (2,1 экв.). После деления на силикагеле (элюент хлороформ/метанол) получают 9-метокси-1,10-диэтил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он (28%).
ЯМР 1H (CDCl3): 1,26 (м, 6Н); 2,41 и 2,58 (2м, 6Н); 2,70 (квартет, 2Н); 2,87 (т, 2Н); 3,87 (с, 3Н); 4,07 (т, 2Н); 6,88 (1с, 1Н); 7,19 (с, 1Н); 8,33 (широкий с, 1Н).
Масс-спектр: m/z 324 (М+.), 309 (100).
Температура плавления: 204oС.
Пример 7: ETCARBO7S
Формула: C18H20N2OS; M = 312,42 г•моль-1
Структура: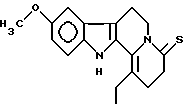
9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-тион
Получение:
Реагент Лавессона (Lawesson) (0,5 ммоль) добавляют порциями при 110oС к раствору 9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло [2,3-а]хинолизин-4-она (300 мг, 1,01 ммоль) в безводном толуоле (15 мл). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола продукт хроматографируют на силикагеле (элюент хлороформ/метанол = 99/1) и получают, таким образом, 9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-тион (выход 60%).
ЯМР 1H (CDCl3): 1,32 (т, 3Н); 2,32 (т, 2Н); 2,65 (квартет, 2Н); 2,98 (т, 2Н); 3,08 (т, 2Н); 3,89 (с, 3Н); 4,80 (т, 2Н); 6,91 (дд 2,4 и 8,7 Гц, 1Н); 6,98 (д 2,4 Гц, 1Н); 7,34 (д 8,7 Гц, 1Н); 8,11 (широкий с, 1Н).
Масс-спектр: m/z 312(М+.) (100), 297.
Температура плавления: 118oС.
Пример 8: ETDHCARBO7
Формула: C18H22N2O2; M = 298,38 г•моль-1
Структура: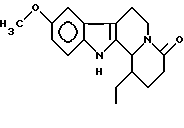
9-метокси-1-этил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] -хинолизин-4-он
Получение:
К раствору 9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (500 мг) в этаноле последовательно добавляют бикарбонат натрия (500 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-этил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а]хинолизин-4-он (76%).
ЯМР 1H (CDCl3): 0,79 (т, 3Н); 1,13 (2м, 2Н); 1,95 (м, 2Н); 2,20 (м, 1Н); 2,45 (м, 2Н); 2,77 (м, 2Н); 3,87 (с, 3Н); 4,88 (с, 1Н); 5,09 (м, 1Н); 6,78 (дд 2,4 и 8,7 Гц, 1Н); 6,92 (д 2,4 Гц, 1Н); 7,25 (д 8,7 Гц, 1Н); 8,77 (широкий с, 1Н).
Температура плавления: 207oС.
Пример 9: ETNAPH7
Формула: C20H21NO2; M = 307,39 г•моль-1
Структура: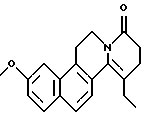
11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-он
Получение:
К кипящему с обратным холодильником раствору N(2-(7-метокси-нафт-1-ил)этил)бутанамида (2,27 г, 11,1 ммоль) в толуоле (80 мл) добавляют РОСl3 (4,6 мл). Через 3 часа толуол удаляют при пониженном давлении. Остаток переносят в раствор КОН (40%). Эту смесь затем экстрагируют EtOAc (х 3). После сушки органической фазы над МgSO4 удаляют растворитель. Сырой продукт реакции растворяют в ДМФ (5 мл) и добавляют акриловую кислоту (0,94 мл, 1,2 экв. ). Затем добавляют по капле дифенилфосфорилазид (2,7 мл, 1,1 экв.), растворенный в ДМФ (3 мл), а потом триэтиламин (3,67 мл, 2,6 экв.). Перекристаллизацией из смеси EtOAc/P. E. = 20/80 получают 11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f]пиридо[2,1-а]-изохинолин-8-он (329 мг).
ЯМР 1H (CDCl3): 1,17 (т, 3Н); 2,38 (м, 4Н); 2,58 (т, 2Н); 3,16 (т, 2Н); 3,82 (т, 2Н); 3,95 (с, 3Н); 7,17 (дд, 1Н); 7,29 (д, 1Н); 7,33 (д, 1Н); 7,66 (д, 1Н); 7,76 (д, 1Н).
Температура плавления: 105-107oС.
Пример 10: PHNAPH7
Формула: C24H21NO2; М = 355,43 г•моль-1
Структура: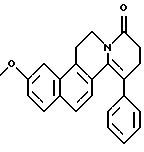
3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо-[2,1-а] изохинолин-8-он
Получение:
К кипящему с обратным холодильником раствору N-(2-(7-метокси-нафт-1-ил)этил)фенилацетамида (600 мг) в толуоле (100 мл) добавляют РОСl3 (1,4 мл). Через 3 часа толуол удаляют при пониженном давлении. Остаток переносят в раствор КОН (40%). Эту смесь экстрагируют EtOAc (х 3). После сушки органической фазы над МgSO4 удаляют растворитель. Сырой продукт реакции растворяют в ДМФ (4,5 мл) и добавляют акриловую кислоту (0,15 мл, 1,1 экв.). Затем добавляют по капле дифенилфосфорилазид (0,45 мл), растворенный в ДМФ (1 мл), а потом триэтиламин (0,55 мл, 2,1 экв. ). Получают 3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-он (170 мг, выход 25%).
ЯМР 1H (CDCl3): 2,70 (м, 4Н); 3,32 (т, 2Н); 3,88 (т, 2Н); 3,94 (с, 3Н); 6,74-7,60 (10Н).
Температура плавления: 152-154oС.
Пример 11: PHCARBO7S
Формула: C22H20NOS; M = 360,47 г•моль-1
Структура: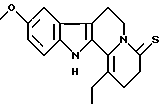
9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] [бета] хинолизин-4-тион
Получение:
Реагент Лавессона (Lawesson) (180 мг, 0,47 ммоль) добавляют порциями при 110oС к раствору 9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (164 мг, 0,47 ммоль) в безводном толуоле (10 мл). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола продукт хроматографируют на силикагеле (элюент хлороформ) и получают, таким образом, 9-метокси-1-фенил-2,3,4,-6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-тион (130 мг, выход 76%).
ЯМР 1H (CDCl3): 1,32 (т, 3Н); 2,32 (т, 2Н); 2,65 (квартет, 2Н); 2,98 (т, 2Н); 3,08 (т, 2Н); 3,89 (с, 3Н); 4,80 (т, 2Н); 6,91 (дд 2,4 и 8,7 Гц, 1Н); 6,98 (д 2,4 Гц, 1Н); 7,34 (д 8,7 Гц, 1Н); 8,11 (широкий с, 1Н).
Температура плавления: 180oС.
Пример 12: DEETCARBO7S
Формула: C18H18N2OS; M = 310,41 г•моль-1
Структура: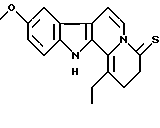
9-метокси-1-этил-2,3,4,12-тетрагидроиндоло[2,3-а]хинолизин-4-тион
Получение:
К раствору 9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-тиона (500 мг, 1,6 ммоль) в ДМФ (42 мл) добавляют третбутоксид калия (665 мг, 5,9 ммоль). После составления реакционной смеси в вакууме ее перемешивают в течение ночи при нормальном кислородном давлении. Затем последовательно добавляют воду (15 мл) и концентрированную соляную кислоту (3 мл). Этот раствор хранят в холодильнике в течение 4 часов. После фильтрования получают 9-метокси-1-этил-2,3,4,12-тетрагидроиндоло[2,3-а]хинолизин-4-тион (150 мг, выход 30%).
ЯМР 1H (CDCl3): 1,38 (т, 3Н); 2,93 (квартет, 2Н); 3,06 (т, 2Н); 3,90 (с, 3Н); 5,06 (т, 2Н); 7,03 (д+с, 2Н); 7,19 (д, 1Н), 7,38 (д, 1Н); 7,62 (д, 1Н); 8,43 (широкий с, 1Н).
Масс-спектр: m/z 310 (М+.), 295, 155.
Температура плавления: 212oС.
Пример 13: FPHCARBO7
Формула: C22H19N2O2F; M = 362,40 г•моль-1
Структура: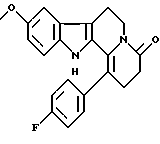
9-метокси-1-(пара-фторфенил)-2,3,4,6,7,12-гексагидроиндоло-[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N-[2'-(5-метокси-1Н-3-индолил)этил] -2-(пара-фторфенил)ацетамиде (1,15 г, 3,5 ммоль) дает 1-(пара-фторбензил)-6-метокси-3,4-дигидро-2-карболин (1,06 г), который растворяют непосредственно в безводном диметилформамиде (ДМФ) (10 мл).
Эту смесь охлаждают до 0oС и добавляют последовательно акриловую кислоту (0,24 мл, 3,5 ммоль), по капле дифенилфосфорилазид ((PhO)2P(O)N3) (0,74 мл, 3,5 ммоль) в растворе в ДМФ (2 мл) и триэтиламин (1 мл, 7,8 ммоль). После деления на силикагеле (хлороформ) получают 9-метокси-1-(пара-фторфенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он.
ЯМР 1H (CDCl3): 2,71 (м, 4Н); 2,89 (т, 2Н); 3,82 (с, 3Н); 4,19 (т, 2Н); 6,77 (дд 9 Гц и 3 Гц, 1Н); 6,9-7,20 и 7,38 (3м, 7Н).
Масс-спектр: m/z 362 (М+.), 319, 253.
Температура плавления: 191oС.
Пример 14: ANCARBO7
Формула: С23Н22N2O3; М = 374,43 г•моль-1
Структура: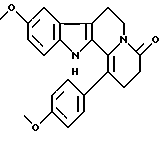
9-метокси-1-(пара-метоксифенил)-2,3,4,6,7,12-гексагидроиндо-ло[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N-[2'-(5-метокси-1Н-3-индолил)этил] -2-(пара-метоксифенил)ацетамиде (800 мг, 2,1 ммоль) дает 1-(пара-метоксибензил)-6-метокси-3,4-дигидро-2-карболин (1,06 г), который растворяют непосредственно в безводном диметилформамиде (ДМФ) (10 мл).
Эту смесь охлаждают до 0oС и добавляют последовательно акриловую кислоту (0,15 мл, 2,2 ммоль), по капле дифенилфосфорилазид ((PhO)2P(O)N3) (0,45 мл, 2 ммоль) в растворе в ДМФ (2 мл) и триэтиламин (0,53 мл, 4 ммоль). После деления на силикагеле (хлороформ) получают 9-метокси-1-(пара-метоксифенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он (213 мг, выход 27%).
ЯМР 1H (CDCl3): 2,67 (м, 4Н); 2,90 (т, 6 Гц, 2Н); 3,83 (с, 3Н); 3,91 (с, 3Н); 4,20 (т, 6 Гц, 2Н); 6,77, 6,88, 7,04 и 7,33 (м, 7Н).
Масс-спектр: m/z 374 (М+. 100), 359, 253, 187.
Температура плавления: 154-155oС.
Пример 15: DMACARBO7
Формула: C24H25N3O2; М = 387,48 г•моль-1
Структура: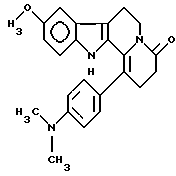
9-метокси-1-(пара-диметиламинофенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N-[2'-(5-метокси-1Н-3-индолил)этил]-2-(пара-диметиламинофенил)-ацетамиде дает 1-(пара-диметиламинобензил)-6-метокси-3,4-дигидро-2-карболин (1,06 г), который растворяют непосредственно в безводном диметилформамиде (ДМФ).
Эту смесь охлаждают до 0oС и добавляют последовательно акриловую кислоту, по капле дифенилфосфорилазид ((PhO)2P(O)N3) в растворе в ДМФ и триэтиламин. После деления на силикагеле (хлороформ) получают 9-метокси-1-(пара-диметиламинофенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-он.
ЯМР 1H (CDCl3): 2,69 (м, 4Н); 2,89 (т, 2Н); 3,04 (с, 6Н); 3,82 (с, 3Н); 4,20 (т, 2Н); 6,80 (м, 3Н); 6,89 (м, 2Н); 7,25 (д, 2Н); 7,29 (широкий с, 1Н).
Масс-спектр: m/z 387 (М+.), 194, 142, 134 (100).
Пример 16: PYRCARBO7
Формула: C21H19N3O2; M = 345,40 г•моль-1
Структура: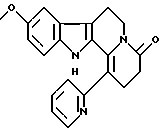
9-метокси-1-(пирид-2'-ил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)-2-(пирид-2'-ил)-ацетамиде (1,2 г, 3,9 ммоль) дает 1-(2-пиридилметил)-6-метокси-3,4-дигидро-2-карболин. К раствору 1-(2-пиридилметил)-6-метокси-3,4-дигидро-2-карболина (760 мг, 2,6 ммоль) в ДМФ (9 мл) добавляют акриловую кислоту (0,18 мл). Затем добавляют по капле дифенилфосфорилазид (0,55 мл) в растворе в ДМФ (3 мл), а потом триэтиламин (0,75 мл). После деления на силикагеле (хлороформ/метанол) получают 9-метокси-1-(пирид-2'-ил)-2, 3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-он (230 мг, выход 17,5%).
ЯМР 1H (CDCl3): 2,73 (м, 2Н); 2,85 (м, 2Н); 2,94 (т, 2Н); 3,18 (с, 3Н); 4,24 (т, 2Н); 6,85 (дд 2,4 и 9 Гц, 1Н); 6,93 (д 2,4 Гц, 1Н); 7,10 (д 9 Гц, 1Н); 7,30 (дд, 1Н); 7,45 (д, 1Н); 7,80 (дд, 1Н); 8,75 (д, 1Н).
Масс-спектр: m/z 345 (М+., 100), 330, 316, 302.
Температура плавления: >260oС.
Пример 17: NPHCARBO7
Формула: С23Н19N3O4; М = 389,41 г•моль-1
Структура: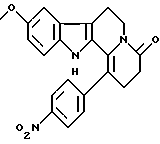
9-метокси-1-(пара-нитрофенил)-2,3,4,6,7,12-гексагидроиндоло-[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)-2-(пара-нитрофенил)-ацетамиде (360 мг, 1 ммоль) дает 1-(пара-нитробензил)-6-метокси-3,4-дигидро-2-карболин. К раствору 1-(пара-нитробензил)-6-метокси-3,4-дигидро-2-карболина в ДМФ (10 мл) добавляют акриловую кислоту (0,07 мл). Затем добавляют по капле дифенилфосфорилазид (0,21 мл), а потом триэтиламин (0,26 мл). После деления на силикагеле (элюент AcOEt/EP - 50/50), получают 9-метокси-1-(пара-нитрофенил)-2,3,4,6,7,12-гексагидро-индоло[2,3-а]хинолизин-4-он (163 мг, выход 41%).
ЯМР 1H (CDCl3): 2,75 (м, 4Н); 2,92 (т, 2Н); 3,82 (с, 3Н); 4,17 (т, 2Н); 6,80 (дд 3 и 9 Гц, 1Н); 6,90 (д 3 Гц, 1Н); 6,92 (д 9 Гц, 1H); 7,59 (д 9 Гц, 1Н); 8,32 (9 Гц, 1Н).
Температура плавления: 138-140oС.
Пример 18: TOLCARBO7
Формула: С23Н22N2O2; М = 358,43 г•моль-1
Структура: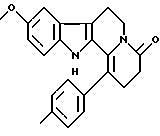
9-метокси-1-(пара-толил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(2-(5-метокси-1Н-3-индолил)этил)-2-(пара-толил)-ацетамиде (2,12 мг, 6,6 ммоль) дает 1-(пара-метилбензил)-6-метокси-3,4-дигидро-2-карболин. К раствору 1-(пара-метилбензил)-6-метокси-3,4-дигидро-2-карболина в ДМФ (15 мл) добавляют акриловую кислоту (0,46 мл). Затем добавляют по капле дифенил-фосфорилазид (1,4 мл), а потом триэтиламин (1,75 мл). После деления на силикагеле (элюент хлороформ/метанол) получают 9-метокси-1-(пара-толил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]-хинолизин-4-он.
ЯМР 1H (CDCl3): 2,46 (с, 3Н); 2,73 (м, 4Н); 2,88 (т, 2Н); 3,82 (с, 3Н); 4,20 (т, 2Н); 6,75 (дд 2 и 9 Гц, 1H); 6,84 (д 9 Гц, 1H); 6,88 (д 2 Гц, 1H); 7,03 (большой с, 1H); 7,30 (м, 4Н).
Температура плавления: 198oС.
Пример 19: PHDHCARBO7
Формула: C22H22N2O2; M = 346,42 г•моль-1
Структура: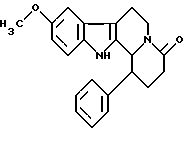
9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] -хинолизин-4-он
Получение:
К раствору 9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (2,4 г) в смеси этилацетат/этанол 1/1 (160 мл) последовательно добавляют бикарбонат натрия (900 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а]хинолизин-4-он (2,3 г, выход 95%).
ЯМР 1H (CDCl3): 2,05 (м, 1Н); 2,28 (м, 1Н); 2,47 (м, 2Н); 2,74 (м, 1Н); 2,97 (м, 2Н); 3,81 (м+с, 4Н); 5,18 (м, 2Н); 6,71 (дд 2,4 Гц и 9 Гц, 1Н); 6,89 (д 2,4 Гц, 1Н); 6,93 (д 9 Гц, 1Н); 7,25 (м, 5Н); 7,5 (широкий с, 1Н).
Масс-спектр: m/z 346 (М+.), 242, 200.
Температура плавления: 162oС.
Пример 20: FPHDHCARBO7
Формула: C22H22N2FO2; M = 364,41 г•моль-1
Структура: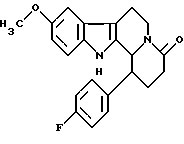
9-метокси-1(пара-фторфенил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он
Получение:
К раствору 9-метокси-1-(пара-фторфенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (64 мг) в этилацетате последовательно добавляют бикарбонат натрия (50 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-(пара-фторфенил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он (21 мг, выход 33%).
ЯМР 1H (CDCl3): 2,05 (м, 1H); 2,40 (м, 3Н); 2,74 (м, 1Н); 2,90 (м, 2Н); 3,80 (1с+1м, 4Н); 5,19 (м, 2Н); 6,71 (дд 2,4 и 9 Гц, 1H); 6,92 (м, 3Н); 6,97 (д 8,7 Гц, 1H); 7,18 (м, 2Н); 7,52 (широкий с, 1H).
Масс-спектр: m/z 346 (М+.), 242, 200.
Температура плавления: 162-166oС.
Пример 21: PHDHNAPH7
Формула: C24H23NO2; М = 357,45 г•моль-1
Структура: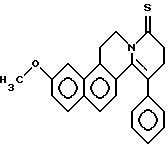
3-метокси-11-фенил-5,8,9,10,11,11a-гексагидро-6Н-бензо[f] -пиридо[2,1-а] изохинолин-8-он
Получение:
К раствору 3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-она (30 мг) в этилацетате (15 мл) последовательно добавляют бикарбонат натрия (20 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 3-метокси-11-фенил-5,8,9,10,11,11a-гексагидро-6Н-бензо[f] пиридо[2,1-а]изохинолин-8-он (25 мг, выход 83%).
ЯМР 1H (CDCl3): 2,14 (м, 1Н); 2,48-3,16 (м, 5Н); 3,13 (д 15,6 Гц, 1Н); 3,94 (м + с, 4Н); 5,16 (ддд 12,8 Гц, 5,1 Гц и 2,1 Гц, 1Н); 5,28 (д 4,4 Гц, 1Н); 6,89-7,13 (м, 8Н); 7,55 (д 8,5 Гц, 1Н); 7,62 (д 9,6 Гц, 1Н).
Масс-спектр: m/z 357 (М+.), 329, 253, 211.
Температура плавления: 175oС.
Пример 22: ETDHNAPH7
Формула: C20H23NO2; M = 309,40 г•моль-1
Структура: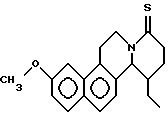
11-этил-3-метокси-5,8,9,10,11,11a-гексагидро-6Н-бензо[f] -пиридо[2,1-а] изохинолин-8-он
Получение:
К раствору 11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-она (74 мг) в этилацетате (25 мл) последовательно добавляют бикарбонат натрия (30 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 3-метокси-11-этил-5,8,9,10,11,11a-гексагидро-6Н-бензо[f] пиридо[2,1-а]изохинолин-8-он (50 мг, выход 67%).
ЯМР 1H (CDCl3): 0,73 (т, 6,8 Гц, 3Н); 1,08 (м, 2Н); 2,05 (м, 2Н); 2,30-3,05 (м, 5Н); 3,16 (д, 16,0 Гц, 1Н); 3,96 (с, 3Н); 5,02 (широкий с, 1Н); 5,17 (ддд, 12,4 Гц, 4,4 Гц и 16 Гц, 1Н); 7,12-7,21 (м, 3Н); 7,67 (д, 8,6 Гц, 1Н); 7,73 (д, 8,6 Гц, 1Н).
Масс-спектр: m/z 309 (М+.), 253, 225, 211.
Температура плавления: 206oС.
Пример 23: ANIDHCARBO7
Формула: C22H23N3O2; М = 361,45 г•моль-1
Структура: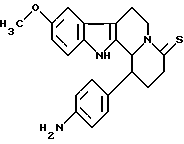
9-метокси-1-(пара-аминофенил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он
Получение:
К раствору 9-метокси-1-(пара-нитрофенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (91 мг) в этилацетате последовательно добавляют бикарбонат натрия (50 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-(пара-аминофенил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а]хинолизин-4-он (37 мг, выход 44%).
ЯМР 1H (CDCl3): 1,95 (м, 1Н); 2,28 (м, 1Н); 2,40 (м, 2Н); 2,90 (м, 2Н); 3,70 (м, 1Н); 3,80 (м, 3Н); 4,20 (широкий с, 2Н); 5,20 (м, 2Н); 6,49 (д, 8,3 Гц, 1Н); 6,65 (дд, 8,7 Гц, 2,4 Гц, 1Н); 6,83 (д, 2,4 Гц, 1Н); 6,90 (д, 8,4 Гц, 1Н); 6,95 (д, 8,7 Гц, 1Н).
Масс-спектр: m/z 361 (М+.), 242, 200, 181.
Температура плавления: 165-166oС.
Пример 24: PHDHCARBO7S
Формула: C22H22N2OS; M = 362,48 г•моль-1
Структура: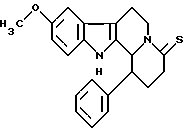
9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] -хинолизин-4-тион
Получение:
К раствору 9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она (520 мг) в безводном толуоле (50 мл) добавляют небольшими порциями при 110oС реагент Лавессона (Lawesson) (640 мг). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола выделяют продукт способом колоночной хроматографии на SiO2 (элюент хлороформ/метанол, 99/1), и получают 9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а]хинолизин-4-тион (160 мг, выход 30%).
ЯМР 1H (CDCl3): 1,95 (м, 1Н); 2,20 (м, 1Н); 2,72 (дд, 12 Гц и 2,8 Гц, 1Н); 2,97 (м, 3Н); 3,41 (м, 1Н); 3,80 (м+с, 4Н); 5,33 (д, 4 Гц, 1Н); 5,93 (дд, 5,1 Гц и 1,3 Гц, 1Н); 6,71 (дд, 8,7 Гц и 2,4 Гц, 1Н); 6,83 (д, 2,4 Гц, 1Н); 6,94 (д, 8,7 Гц, 1Н); 7,20 (м, 5Н).
Температура плавления: 242-244oС.
Пример 25: ETNAPH7S
Формула: C20H21NOS; М = 323,45 г•моль-1
Структура: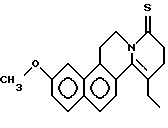
11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-тион
Получение:
К 11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f]пиридо [2,1-а]изохинолин-8-ону (45 мг) в безводном толуоле (10 мл) добавляют небольшими порциями при 110oС реагент Лавессона (Lawesson) (70 ммоль). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола выделяют продукт способом колоночной хроматографии на SiO2 (элюент дихлорметан), получают 11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f]пиридо[2,1-а]изохинолин-8-тион (32 мг, выход 70%).
ЯМР 1H (CDCl3): 1,14 (т, 7,3 Гц, 3Н); 2,35 (м, 4Н); 3,13 (т, 7,7 Гц, 2Н); 3,25 (т, 6 Гц, 2H); 3,99 (с, 3Н); 4,27 (т, 6 Гц, 2Н); 7,19 (дд, 8,5 и 2,4 Гц, 1Н); 7,28 (м, 2Н); 7,67 (д 8,5 Гц, 1H); 7,76 (д, 8,9 Гц, 1Н).
Температура плавления: 164-166oС.
Пример 26: PHNAPH7S
Формула: C24H21NOS; M = 371,49 г•моль-1
Структура: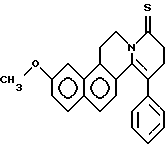
3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-тион
Получение:
К 3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f]пиридо[2,1-а]изохинолин-8-ону (50 мг) в безводном толуоле (10 мл) добавляют при 110oС небольшими порциями реагент Лавессона (Lawesson) (66 мг). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола выделяют продукт способом колоночной хроматографии на SiO2 (дихлорметан), получают 3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо [f] пиридо[2,1-а] изохинолин-8-тион (37 мг, выход 74%).
ЯМР 1H (CDCl3): 2,71 (т, 7,8 Гц, 1H); 3,36 (м, 4Н); 3,97 (с, 3Н); 4,36 (т, 6,2 Гц, 1H); 6,68 (д, 8,5 Гц, 1H); 7,18 (м, 8Н); 7,63 (д, 8,7 Гц, 1H).
Температура плавления: 136oС.
Пример 27: ETDHCARBO7S
Формула: C18H22N2OS; М = 314,44 г•моль-1
Структура: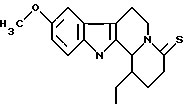
1-этил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] -хинолизин-4-тион
Получение:
К 1-этил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло-[2,3-а] хинолизин-4-ону (262 мг) в безводном толуоле (20 мл) добавляют небольшими порциями при 110oС реагент Лавессона (Lawesson) (208 мг). После кипячения с обратным холодильником в течение 30 минут и выпаривания толуола выделяют продукт способом колоночной хроматографии на SiO2 (элюент хлороформ/метанол, 99/1), получают 1-этил-9-метокси-1/2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-тион (30 мг, выход 11,5%).
ЯМР 1H (CDCl3): 0,81 (т, 3Н); 1,06 (м, 2Н); 1,90 (м, 2Н); 2,30 (м, 1Н); 2,80 (м, 5Н); 3,85 (с, 3Н); 4,94 (с, 1Н); 6,08 (м, 1Н); 6,87 (дд, 2,4 и 8,7 Гц, 1Н); 6,96 (д, 2,4 Гц, 1Н); 7,26 (д, 8,7 Гц, 1Н); 7,82 (большой с, 1Н).
Температура плавления: 124oС.
Пример 28: CO2ETDHCARBO7
Формула: C19H22N2O4; M = 342,39 г•моль-1
Структура: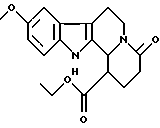
1-карбэтокси-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло-[2,3-а] хинолизин-4-он
Получение:
К раствору 1-карбэтокси-9-метокси-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она (50 мг) в этилацетате последовательно добавляют бикарбонат натрия (10 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 1-карбэтокси-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он (30 мг, выход 60%).
ЯМР 1H (CDCl3): 1,02 (т, 3Н); 2,15 (м, 2Н); 2,85 (м, 8Н); 3,35 (м, 1Н); 3,85 (с, 3Н); 4,05 (т, 2Н); 5,08 (м, 2Н); 6,82 (дд, 8,7 и 2,4 Гц, 1Н); 6,92 (д, 2,4 Гц, 1Н); 7,21 (д, 8,7 Гц, 1Н); 8,24 (широкий с, 1Н).
Масс-спектр: m/z 342 (М+.), 286, 269, 240, 199.
Температура плавления: 213oС.
Пример 29: TOLDHCARBO7
Формула: C23H24N2O2; М = 360,46 г•моль-1
Структура: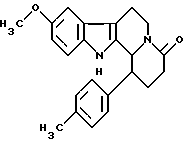
9-метокси-1-(пара-толил)-1,2,3,4,6,7,12,12b-октагидроиндоло-[2,3-а] хинолизин-4-он
Получение:
К раствору 9-метокси-1-(пара-толил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она (55 мг) в этилацетате последовательно добавляют бикарбонат натрия (50 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-(пара-толил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а]хинолизин-4-он (32 мг, выход 58%).
ЯМР 1H (CDCl3): 2,04 (м, 1Н); 2,23 (м, 1Н); 2,29 (с, 3Н); 2,46 (м, 2Н); 2,74 (м, 1Н); 2,94 (м, 2Н); 3,70 (м, 1Н); 3,80 (с, 3Н); 5,20 (м, 1Н); 5,24 (д, 1Н); 6,71 (дд, 2,4 Гц и 8,7 Гц, 1Н); 6,87 (д, 2,4 Гц, 1Н); 6,93 (д, 8,7 Гц, 1Н); 7,08 (д, 8,0 Гц, 2Н); 7,16 (д, 8,0 Гц, 2Н); 7,2 (1Н, NH).
Пример 30: ANDHCARBO7
Формула: С23Н24N2О3; М = 376,46 г•моль-1
Структура: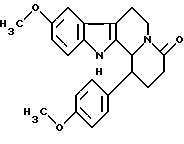
9-метокси-1-(пара-анизил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он
Получение:
К раствору 9-метокси-1-(пара-анизил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а]хинолизин-4-она (43 мг) в этилацетате последовательно добавляют бикарбонат натрия (50 мг) и палладий на угле и смесь перемешивают в течение ночи в атмосфере водорода. После фильтрования и выпаривания растворителя сырой продукт перекристаллизовывают из этилацетата. Таким образом, получают 9-метокси-1-(пара-анизил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он (24 мг, выход 56%).
ЯМР 1H (CDCl3): 2,05 (м, 1Н); 2,25 (м, 1Н) ; 2,46 (м, 2Н); 2,74 (д, 1Н); 2,54 (м, 2Н); 3,68 (м, 1Н); 3,75 (с, 3Н); 3,80 (с, 3Н); 5,14 (м, 1Н); 5,23 (д, 5,5 Гц, 1Н); 6,72 (дд, 2,4 и 8,7 Гц, 1Н); 6,82 (д, 8,7 Гц, 2Н); 6,87 (д, 2,4 Гц, 1Н); 6,96 (д, 8,7 Гц, 1Н); 7,17 (д, 8,7 Гц, 2Н).
Температура плавления: 242oС.
Пример 31: DIETCARBO7
Формула: С20Н26N2O2; М = 326,43 г•моль-1
Структура: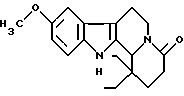
1,1-диэтил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он
Получение:
5-метокситриптамин (494 мг, 2,59 ммоль) и этил(4-этил-4-формил)капроат (522 мг, 2,61 ммоль) смешивают в коммерческом толуоле (27 мл) в колбе на 50 мл. Затем реакционную среду нагревают до кипения толуола с обратным холодильником в течение 2 часов. После охлаждения толуол выпаривают при пониженном давлении и добавляют уксусную кислоту (1 мл).
Затем реакционную среду нагревают до кипения уксусной кислоты с обратным холодильником в течение 2 часов. После охлаждения добавляют воду (25 мл), и осаждается твердое вещество. Это твердое вещество разбавляют этилацетатом и промывают водой. Полученную органическую фазу сушат над сульфатом магния и выпаривают растворитель при пониженном давлении.
После деления на силикагеле (элюент хлороформ/метанол - 97,5/2,5) получают 1,1-диэтил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-он (200 мг, выход 23%).
ЯМР 1H (CDCl3): 0,73 (т, 7,5 Гц, 3Н); 1,02 (квартет 7,5 Гц, 1Н); 1,18 (т, 7,5 Гц, 3Н); 1,50 (квартет 7,5 Гц, 1Н); 1,60 (м, 1Н); 1,80 (м, 4Н); 2,49 (м, 1Н); 2,76 (м, 3Н); 3,85 (с, 3Н); 4,83 (с, 1Н); 5,17 (м, 1Н); 6,84 (дд, 2,3 и 8,7 Гц, 1Н); 6,85 (д, 2,3 Гц, 1Н); 7,24 (д, 8,7 Гц, 1Н); 7,77 (широкий с, 1Н).
Температура плавления: 229oС.
Пример 32: ETCARBO7TL
Формула: C21H24N2O4; М = 368,43 г•моль-1
Структура: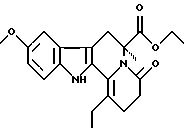
(6S)-6-карбэтокси-9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-он
Получение:
Реакция Бишлера-Напиральски (Bischler-Napieralski) на N1-(бутирил)-5-метокси-(L)-триптофан-этиловом эфире (2,1 г) дает (3S)-1-пропил-3-карбэтокси-6-метокси-3,4-дигидро-2-карболин (1,5 г). К раствору (3S)-1-пропил-3-карбэтокси-6-метокси-3,4-дигидро-2-карболина (1,5 г) в ДМФ (20 мл) добавляют последовательно по капле акриловую кислоту (0,35 мл), дифенилфосфорилазид (1 мл) и триэтиламин (2 мл). После деления на силикагеле (элюент этилацетат/петролейный эфир 30/70) получают (6S)-6-карбэтокси-9-метокси-1-этил-2,3,4,6, -7,12-гексагидроиндоло[2,3-а] хинолизин-4-он (400 мг, выход 17%).
ЯМР 1H (CDCl3): 1,1 (т, 3Н); 1,25 (т, 3Н); 2,3 (м, 1Н); 2,62 (м, 5Н); 3,08 (дд, 6 и 16 Гц, 1Н); 3,53 (д, 16 Гц, 1Н); 3,85 (с, 3Н); 4,03 (м, 2Н); 6,00 (д, 6 Гц, 1Н); 6,85 (дд, 2,3 и 8,7 Гц, 1Н); 6,94 (д, 2,3 Гц, 1Н); 7,24 (д, 8,7 Гц, 1Н); 8,13 (широкий с, 1Н).
Температура плавления: 192oС.
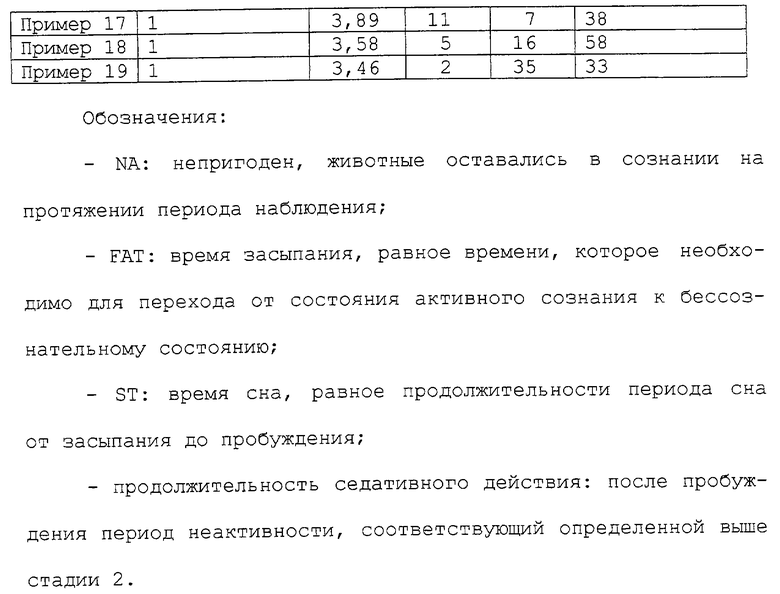
Описываются новые производные β-карболина общих формул Iа' и Ia'', где R2 - С1-С6 алкоксильный радикал, предпочтительно метоксирадикал; R3 - атом водорода или С1-С6 алкильный радикал, предпочтительно метильный радикал; R8 - C1-С6 алкильный радикал, необязательно замещенный алкилом, фенильный радикал, незамещенный или замещенный С1-С6 алкилом, галогеном, нитрогруппой, ди(С1-С6) алкиламиногруппой, С1-С6 алкоксигруппой или аминогруппой, алкоксикарбонилрадикал или пиридилрадикал; Х - бивалентный радикал формулы; R11 - атом кислорода или серы; R14 - атом водорода или С1-С6 алкоксикарбонил; R15 - атом водорода или С1-С6 алкил, или их рацемические смеси, чистые энантиомеры, их смеси и их терапевтически приемлемые соли; способы их получения и получения промежуточных соединений и лекарственное средство, обладающее гипнотической и седативной активностью. 10 с. и 2 з.п. ф-лы, 4 табл.
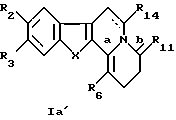
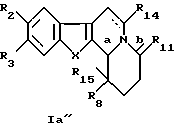
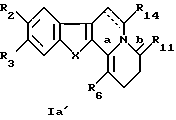
в которых R2 - C1-С6алкоксильный радикал, предпочтительно метоксирадикал;
R3 - атом водорода или C1-С6алкильный радикал, предпочтительно метильный радикал;
R8 - C1-С6алкильный радикал, необязательно замещенный алкилом; фенильный радикал, необязательно замешенный C1-С6алкилом, галогеном, нитрогруппой, диC1-С6алкиламиногруппой, C1-С6алкоксигруппой или аминогруппой; алкилоксикарбонильный радикал или пиридильный радикал;
Х - бивалентный радикал формулы
или -HC= CH-;
R11 - атом кислорода или серы;
R14 - атом водорода или C1-С6алкоксикарбонил:
R15 - атом водорода, C1-С6алкил;
или его рацемические смеси, чистые энантиомеры, их смеси во всех пропорциях и их терапевтически приемлемые соли.
9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-гексил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] -хинолизин-4-она,
9-метокси-1-изопропил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] -хинолизин-4-она,
1-карбэтокси-9-метокси-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1,10-диэтил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-тиона,
9-метокси-1-этил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-она,
3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-она,
9-метокси-1-фенил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] -[бета] хинолизин-4-тиона,
9-метокси-1-этил-2,3,4,12-тетрагидроиндоло[2,3-а] хинолизин-4-тиона,
9-метокси-1-(парафторфенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-(параметоксифенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-(парадиметиламинофенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-(пирид-2'-ил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-(паранитрофенил)-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-паратолил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-(парафторфенил)-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
3-метокси-11-фенил-5,8,9,10,11,11а-гексагидро-6Н-бензо-[f] пиридо[2,1-а] изохиколин-8-она,
11-этил-3-метокси-5,8,9,10,11,11а-гексагидро-6Н-бензо[f)пиридо[2,1-а] изо-хинолин-8-она,
9-метокси-1-парааминофенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-фенил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-тиона,
11-этил-3-метокси-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-тиона,
3-метокси-11-фенил-5,8,9,10-тетрагидро-6Н-бензо[f] пиридо[2,1-а] изохинолин-8-таона,
1-этил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-тиона,
1-карбэтокси-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-пара-толил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
9-метокси-1-пара-анизил-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
1,1-диэтил-9-метокси-1,2,3,4,6,7,12,12b-октагидроиндоло[2,3-а] хинолизин-4-она,
(6S)-6-карбэтокси-9-метокси-1-этил-2,3,4,6,7,12-гексагидроиндоло[2,3-а] хинолизин-4-она.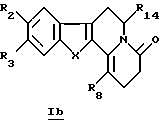
где R2, R3, R8, R14 и X принимают значения, определенные в п. 1,
включающий прямое взаимодействие соединения общей формулы IIа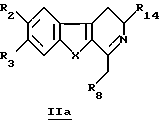
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
с карбоновой кислотой в присутствии или в отсутствие дифенилфосфорилазида или с акрилонитрилом.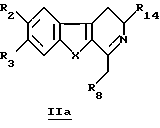
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий реакцию Бишлера-Напиральски соединений общей формулы IIIа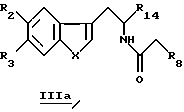
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
с пятиокисью фосфора (Р2O5) или с оксихлоридом фосфора (РОСl3) в подходящем растворителе.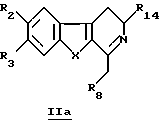
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий окисление перманганатом производных общей формулы IIb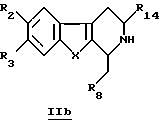
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1.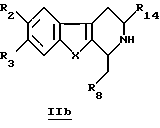
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий реакцию Пиктета-Спенглера производных общей формулы IIIb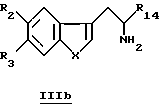
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
с соединениями формулы R8-CH2-COH или их химическими эквивалентами в восстановительных условиях.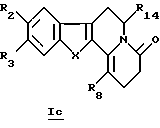
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий каталитическое восстановление водородом в присутствии палладия на угле соединения общей формулы Ib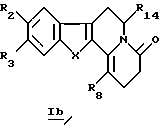
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1.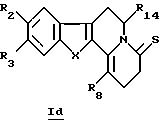
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий реакцию реагента Лавессона или P2S4 с соединениями общей формулы Ib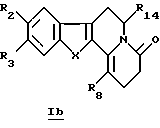
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1.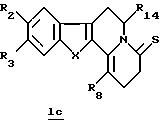
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий реакцию реагента Лавессона или Р2S4 с соединениями общей формулы Iс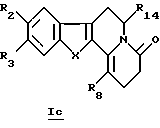
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1.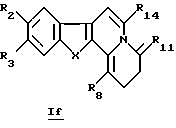
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1,
включающий реакцию окислителя (такого, как О2 в щелочной среде) с соединением общей формулы Ib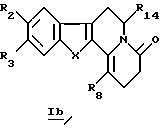
или Id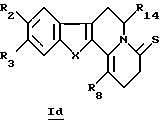
где R2, R3, R8, R14 и Х принимают значения, определенные в п. 1.
| WO 9608490 A, 21.03.1996 | |||
| US 5283343 A, 01.02.1994 | |||
| RU 2056423 С1, 20.03.1996 | |||
| ПРОИЗВОДНЫЕ ЛАКТАМА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЯВЛЯЮЩАЯСЯ АНТАГОНИСТОМ 5-ОКСИТРАПТАМИНА /5-НТ/ НА 5- НТ -РЕЦЕПТОРАХ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СОЛОВАТЫ | 1992 |
|
RU2067980C1 |
| ПРОИЗВОДНЫЕ 3,4-ДИГИДРО- ИЛИ 1,2,3,4-ТЕТРАГИДРО- β -КАРБОЛИНОВ ИЛИ ИХ СОЛИ С ОРГАНИЧЕСКИМИ ИЛИ НЕОРГАНИЧЕСКИМИ КИСЛОТАМИ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 1994 |
|
RU2068847C1 |
Авторы
Даты
2003-08-20—Публикация
1999-03-17—Подача