Изобретение относится к области медицины, а в частности, к лечению и предупреждению гипогликемических состояний, а также других состояний, при которых желательно повышение активности амилина, включая состояния, обусловленные недостаточностью инсулина, например, такие, как сахарный диабет. Более конкретно, настоящее изобретение относится к получению и использованию аналогов-агонистов пептидного гормона амилина.
Сахарный диабет является заболеванием, характеризующимся грубым нарушением обмена веществ с хронически повышенными уровнями глюкозы в крови (гипергликемия). Это состояние гипергликемии является результатом относительного или абсолютного отсутствия активности пептидного гормона, инсулина. Инсулин продуцируется и секретируется β-клетками поджелудочной железы, Известно, что инсулин стимулирует усвоение глюкозы тканями, синтез белков и образование и сохранение нейтральных липидов. Глюкоза, являющаяся основным источником углеводной энергии, содержится в организме в виде гликогена, т.е., полимеризованной формы глюкозы, которая может быть снова превращена в глюкозу в соответствии с потребностями метаболизма. В нормальных условиях инсулин секретируется как на базальном уровне, так и на повышенных уровнях после стимуляции сахарной нагрузкой, и все эти уровни секретиуются для поддержания метаболического гомеостаза путем превращения глюкозы в гликоген.
Термин "сахарный диабет" охватывает несколько различных гипергликемических состояний. Такими состояниями являются диабет Типа 1 (инсулин-зависимый сахарный диабет или ИЗСД) и диабет Типа 2 (инсулин-независимый сахарный диабет или ИНСД). Наличие гипергликемии у людей с диабетом Типа 1 связано с отсутствием инсулина, либо с пониженным его уровнем, недостаточным для поддержания уровней глюкозы в крови в требуемых физиологических пределах. Лечение диабетов Типа 1 заключается во введении восполняющих доз инсулина, обычно, парентерально. Наличие гипергликемии у людей о диабетом Типа 11 на ранней стадии ассоциируется с нормальным или повышенным уровнем инсулина; однако, у этих людей отмечается неспособность к поддержанию метаболического гомеостаза, обусловленная состоянием резистентности к инсулину в периферических тканях и печени, а по мере развития заболевания, эта неспособность к поддержанию гомеостаза обусловлена прогрессирующим разрушением β-клеток поджелудочной железы, которые являются ответственными за секретирование инсулина. Таким образом, предварительная терапия пациентов с диабетом Типа 2 может быть основана на диете и режиме, подкрепленных пероральным приемом гипогликемических средств, таких, как сульфонилмочевины. При заболеваниях этого типа часто требуется инсулинотерапия, однако, обычно, она назначается лишь в более поздних стадиях болезни в целях устранения гипергликемии и минимизации возникающих осложнений. Таким образом, в итоге, многие пациенты с диабетом типа 2 нуждаются в приеме препаратов инсулина.
Амилоидом называют внеклеточные отложения волокон β- складок белков. Эти накопления амилоидного материала были обнаружены в поджелудочной железе пациентов, страдающих сахарным диабетом Типа 2. Другие исследования показали, что степень амилоидных отложений возрастает со степенью гипергликемии у человека и тяжести диабета Типа 2. Химический анализ амилоида поджелудочной железы неожиданно привел к открытию пептидного гормона, амилина. Clark A. и др. , Lancet 11: 231- 234 (1987). Было обнаружено, что этот пептид содержит 37 аминокислот, ни одна из которых не является кислотным остатком, и имеет дисульфидную связь между цистеиновыми остатками в положениях 2 и 7, и амидированный C-конец. Амилин является основным белковым компонентом амилоида, который, как было установлено, находится в островках Лангерганса поджелудочной железы у пациентов, страдающих сахарным диабетом Типа 2.
Было установлено, что присутствие как внутримолекулярного цистеинового мостика, так и карбокси-концевой амидной группы в пептидной структуре синтетической молекулы способствует наибольшей биологической активности в игнибировании синтеза гликогена в скелетной мышце. См., например. Cooper, G.J. S. , и др., Proc. Natl. Acad. Sci, (USA) 84: 8628-8632 (1987); Cooper G.J.S. и др., в Diabetes 1988, изд. Larkins R., Zimmet, P. и Chisholm, D. (Elsevier, Амстердам, стр, 493-496 (1989)). Аминокислотная последовательность амилина (см. фиг. 1) имеет 46% гомологии с последовательностью пептида 2, связанного с геном кальцитонина (CGPP-2).
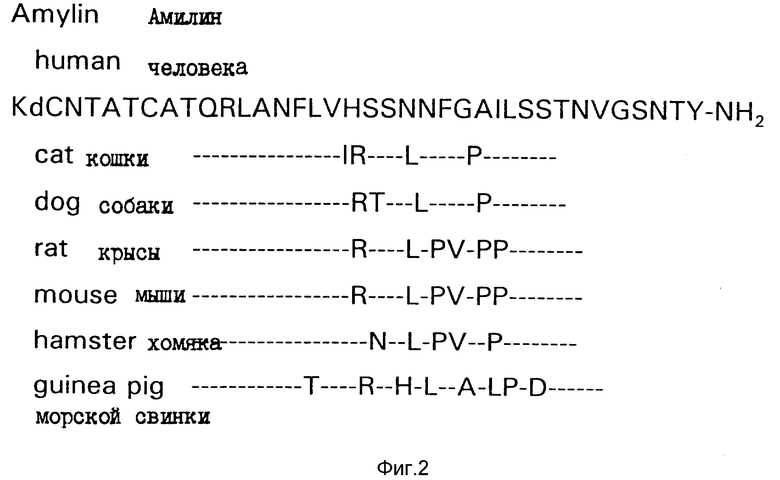
В одной из работ указывается, что ограниченный сегмент молекулы амилина, а именно, остатки 20-29, является возможным участником в образовании фибрилл амилоида в островках Лангерганса при сахарном диабете Типа 2. См., Glenner и др. , Biochem Biophys.. Res. Commur. 155:608-614 (1988). Сообщалось также, что в указанной области аминокислотные последовательности амилинов, происходящих от некоторых видов млекопитающих, отличаются друг от друга, и дальнейшее исследование было направлено на идентификацию остатков, связанных с образованием амилоида. См., Westermark и др., Proc. Natl. Acad. Soc. (USA) 87: 5036-5040 (1990). В своей работе, Westermark и др. сообщают о своих попытках синтезировать различные 20-29-аминокислотные сегменты амилиновых последовательностей от различных видов, с последующим сравнением их способности образовывать амилоидные фибриллы. Было высказано предположение, что наиболее амилоидогенными являются остатки 25-29 амилина человека, и что замещение серина на пролин в положении 28, как это имеет место у некоторых видов грызунов, способствует значительному ингибированию образования фибриллов в исследованных декапептидах.
Амилин представляет собой сложный пептид, и синтез биоактивных препаратов амилина является трудоемкой операцией. Было также обнаружено, что амилин имеет ограниченную растворимость и ограниченную стабильность в растворе. Авторами данной заявки было установлено, что амилин крыс обладает более высокой растворимостью и стабильностью в растворе, чем амилин человека. В некоторой мере, это может быть обусловлено, хотя еще и не доказано, различными агрегационными свойствами амилинов от различных видов. Указывалось, что только амилины человека, приматов кроме человека, и кошек способны к агрегации с образованием амилоида островков in vivo. В настоящей работе была выделена последовательность амилина от различных видов, которая показана на фиг. 2.
У больных диабетом Типа 1 уровни амилина значительно снижены или вовсе отсутствуют по сравнению с нормальными контрольными уровнями. У пациентов с сахарным диабетом Типа 1 β-клетки, которые продуцируют инсулин и амилин, являются разрушенными аутоиммунным процессом. В соответствии с этим, было предположено, что амилин может быть использован для лечения сахарного диабета и гипогликемии, включая инсулин-индуцированную гипогликемию. Было также предположено, что совместное введение инсулина с амилином является преимущественным по сравнению с обычно практикуемым введением одного лишь инсулина, и что совместное введение амилина с глюкагоном для лечения гипогликемии является преимущественным по сравнению с обычно практикуемым введением одного лишь глюкагона. Отсюда следует, что для указанных и других целей предпочтительно использовать менее сложные соединения, которые обладали бы активностью нативного амилина человека, а также соединения, которые имели бы повышенную растворимость и/или стабильность по сравнению с нативным амилином человека. Такие соединения описаны и заявлены в настоящей работе.
Настоящее изобретение относится к новым аналогам пептидного гормона амилина. Эти соединения обладают активностью амилина и могут быть квалифицированы как агонисты амилина или как аналоги-агонисты амилина.
Настоящее изобретение относится к фармацевтическим композициям, содержащим агонисты-аналоги настоящего изобретения, и к способам лечения и предупреждения гипогликемических состояний и других нарушений, при которых желательна повышенная активность амилина, включая состояния, обусловленные недостаточностью инсулина, такие, как сахарный диабет; причем указанные способы предусматривают введение животному аналога-агониста амилина (отдельно или в сочетании с инсулином или гликагоном).
Определения
Если это не оговорено особо, то используемые в настоящем описании термины имеют следующие значения:
Термин "алкил" относится к прямым или разветвленным алкильным группам. Термин "низший алкил" относится к прямым или разветвленным группам, имеющим в целом от 1 до 6 атомов углерода, и представляющим собой первичные, вторичные и третичные алкильные группы. Типичными примерами таких групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, т-бутил, н-пентил, н-гексил и т.п.
Термин "арил" относится к карбоциклическим ароматическим группам с 6-14 атомами углерода, таким, как фенил и нафтил, а также к гетероциклическим ароматическим группам, содержащим 1-3 гетероатома (азот, кислород, сера и т.п. ), таким, как пиридил, триазолопиразин, пиримидин и т.п.
Термин "аралкил" относится к "арильной" группе с 6-10 атомами углерода, непосредственно связанной с "алкильной" группой с 1-4 атомами углерода, и означает, например, бензил, п-хлоробензил, п-метилбензил, и 2-фенилэтил.
Термин "циклоалкил" относится к циклическим алкильным группам с 5-8 атомами углерода.
На фиг.1 изображена аминокислотная последовательность амилина человека.
На фиг. 2 показано сравнение аминокислотных последовательностей амилинов, выделенных от нескольких млекопитающих.
На фиг. 3 изображена аминокислотная последовательность новых пептидов-агонистов амилина.
В соответствии с настоящим изобретением были получены новые аналоги-агонисты амилина. Эти аналоги могут быть использованы в качестве агонистов амилина, например, в качестве гипергликемических средств, и их структура показана на фиг. 3.
В одном из своих вариантов настоящее изобретение относится к аналогам-агонистам, представленным на фиг. 3, где A1 является водородом, Lys, Ser, Ala, дез-α-амино-Lys, или ацетилированным Lys; B1 является Ala, Ser или Thr; C1 является Val, Leu или lle; D1 является His или Arg,; E1 является Ser или Thr; F1 является Ser, Thr, Gln или Asn; G1 является Asn, Gln или His; H1 является Phe, Leu или Ter; I1 является Ala или Pro; J1 является lle, Val, Ala или Leu; K1 является Leu, Pro, Leu, lle или Thr; L1 является Ser, Pro или Thr; M1 является Asn, Asp или Gln; X и Y являются независимо выбранными остатками, имеющими боковые цепи, которые химически связаны друг с другом и образуют внутримолекулярную связь; а Z является гидрокси, амино, алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси; при условии, что (a) если A1 является Lys, B1 является Ala, C1 является Val, D1 является His, E1 является Ser, F1 является Ser, G1 является Asn, H1 является Phe, I1 является Ala, J1 является lle, K1 является Ser, L1 является Leu, а M1 является Asn; (b) если A1 является Lys; B1 является Ala, C1 является lle, D1 является Arg, E1 является Ser, F1 является Ser, G1 является Asn, H1 является Leu, I1 является Ala, J1 является lle, K1 является Ser, L1 является Pro, а M1 является Asn; (c) если A1 является Lys, B1 является Ala, C1 является Val, D1 является Arg, E1 является Thr, F1 является Ser, G1 является Asn, H1 является Leu, I1 является Ala, J1 является lle, K1 является Ser, L1 является Pro, а M1 является Asn; (d) если A1 является Lys, B1 является Ala, C1 является Val, L1 является Arg, E1 является Ser, F1 является Ser, G1 является Asn, H1 является Leu, I1 является Pro, J1 является Val, K1 является Pro, L1 является Pro, а M1 является Asn; (e) если A1 является Lys, B1 является Ala, C1 является Val, D1 является His, E1 является Ser, F1 является Asn, G1 является Asn, H1 является Leu, I1 является Pro, J1 является Val, K1 является Ser, L1 является Pro, а M1 является Asn; или (f) если A1 является Les, B1 является Thr, C1 является Val, D1 является Arg, E1 является Ser, F1 является Ser, G1 является His, H1 является Leu, I1 является Ala, J1 является Ala, K1 является Leu, L1 является Pro, а M1 является Asp; то один или несколько из любых A1-M1 не является L-аминокислотой, a Z не является амино.
Подходящими боковыми цепями для X и Y являются группы, происходящие от алкилсульфидрилов, которые могут образовывать дисульфидные связи; алкилкислоты и алкиламины, которые могут образовывать циклические лактамы; алкилальдегиды или алкилгалогениды и алкиламины, которые могут быть конденсированы с образованием алкиламинового мостика; или боковые цепи, которые могут быть связаны с образованием алкиловой, алкениловой, алкиниловой, эфирной или тиоэфирной связи. Предпочтительными алкиловыми цепями являются низшие алкильные группы, имеющие от около 1 до около 6 атомов углерода.
В еще одном варианте настоящее изобретение относится к аналогам-агонистам, представленным на фиг. 3, которые не имеют мостиковой связи, и в которых X и Y независимо выбирают из Ala, Ser, Cys, Val, Leu и lle, либо из алкиловых, ариловых или аралкиловых сложных эфиров и простых эфиров Ser или Cys.
Настоящее изобретение также включает в себя биологически активные производные аналогов-агонистов, представленных на фиг. 3, в которых стереохимия отдельных аминокислот может быть инвертирована из 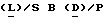 в одном или нескольких специфических сайтах.
в одном или нескольких специфических сайтах.
В объем настоящего изобретения также входят аналоги-агонисты, модифицированные путем гликозилирования остатков Asn, Ser и/или Thr.
В объем настоящего изобретения также входят биологически активные аналоги-агонисты амилина, которые имеют менее пептидный характер. Такие псевдопептиды могут иметь, например, одно или несколько из следующих замещений -CO-NН-амидных связей: депсипептиды (-CO-O-), иминометилены (-CH2-NH-), транс-алкены (-CH=CH-), β- энаминонитрилы (-C(=CH-CN)-NH-), тиоамиды (-CS-NH-), тиометилены (-S-CH2- или -CH2-S-), метилены (-CH2-CH2-) и ретро-амиды (-NH-CO-).
Соединения настоящего изобретения образуют соли с различными неорганическими и органическими кислотами и основаниями, Эти соли могут быть получены с такими органическими и неорганическими кислотами, как, например, HCl, HBr, H2SO4, H3PO4, трифторуксусная кислота, уксусная кислота, муравьиная кислота, метансульфоновая кислота, толуолсульфоновая кислота, мелеиновая кислота, фумаровая кислота и камфорсульфоновая кислота. Примерами солей, которые могут быть получены с использованием оснований, являются соли аммония, соли щелочных металлов (такие как натриевые и калиевые соли) и соли щелочноземельных металлов (такие, как кальциевые и магниевые соли). Предпочтительными солями являются гидрохлорид и трифторацетат.
Указанные соли могут быть получены традиционными методами, например, с помощью реакции свободной кислоты или основания продукта с одним или более эквивалентами соответствующего основания или кислоты в растворителе или среде, в которой эта соль не растворяется, или в растворителе, таком, как вода, который затем удаляют в вакууме или путем осушки вымораживанием, либо путем обмена ионов присутствующей соли другими ионами на соответствующей ионообменной смоле.
Соединения настоящего изобретения могут существовать в виде различных стереоизомеров. В предпочтительных соединениях настоящего изобретения хиральными центрами на пептидном остове являются все S.
Соединения настоящего изобретения могут быть получены с помощью некоторых стандартных реакций синтеза, хорошо известных специалистам по пептидам. Аналоги настоящего изобретения могут быть получены путем последовательного присоединения нужной аминокислоты к растущей пептидной цепи. Обычно, α-N-карбамоил-защищенную аминокислоту и аминокислоту, связанную с растущей пептидной цепью на полимере-носителе, подвергают реакции при комнатной температуре в инертном растворителе, таком, как N-метилпирролидон, диметилформамид или метиленхлорид в присутствии сшивающего агента, такого, как дициклогексилкарбодиимид и 1-гидроксибензотриазол, в присутствии основания, такого, как диизопропилэтиламин. α- N-карбамоильную защитную группу удаляют из полученного пептида с использованием такого реагента, как трифторуксусная кислота или пиперидин, и указанную реакцию присоединения повторяют со следующей N-защищенной аминокислотой. Подходящие N-защитные группы хорошо известны специалистам, причем, предпочтительной является т-булилоксикарбонильная группа.
Некоторые предпочтительные методы синтеза описаны в переуступленной находящейся на одновременном рассмотрении и переуступленной патентной заявке рег. N 667040 ("Syntetic Preparation of Amylin and Amylin Analogs", поданной 8 марта 1991). Эти методы относятся к твердофазному синтезу пептида, содержащего амилин или аналог амилина, который имеет повышенную биологическую активность и, в основном, не содержит делеций и других примесных пептидов; причем указанный пептид синтезируют с использованием последовательных циклов синтеза, где в каждом таком цикле нужную аминокислоту присоединяют к растущей пептидной цепи, связанной с нерастворимым полимерным носителем путем образования пептидной связи между α- аминогруппой растущей пептидной цепи и α- карбоксилом нужной аминокислоты; и где каждый цикл синтеза включает в себя; (a) обработку растущей пептидной цепи в условиях α- амино-разблокирования с удалением α- амино-группы; (b) активирование α- карбоксильной группы α- амино-защищенной нужной аминокислоты; (c) взаимодействие растущей пептидной цепи и нужной аминокислоты в условиях реакции присоединения с образованием пептидной связи между свободной α- аминогруппой пептидной цепи и активированной α- карбоксильной группы нужной аминокислоты; и (d) повторение стадий (b) и (c), в случае, если эффективность синтеза стадии (с) составляет менее, чем около 97%. Стадии (b) и (c) предпочтительно повторять, если эффективность синтеза составляет менее чем 99%. В другом предпочтительном варианте осуществления настоящего изобретения стадии (b) и (c) повторяют в каждом цикле синтеза. Эффективность синтеза обычно измеряют, хотя это и необязательно, после каждой стадии присоединения.
Соответствующие условия синтеза предусматривают использование системы растворителей, которая максимизирует набухание твердого носителя, минимизирует элементы вторичной структуры пептидной цепи в течение циклов синтеза, а также минимизирует внутрипептидное и межпептидное связывание водорода. Предпочтительно, если цикл синтеза включает в себя стадию блокирования после стадии(стадий) присоединения, где непрореагировавшие α-аминогруппы пептидной цепи становятся нереакционноспособными. Цикл синтеза затем повторяют с использованием соответствующей защищенной α-аминокислоты, в результате чего получают амилин или аналог амилина определенной последовательности. После завершения последовательных циклов синтеза указанный амилин или аналог амилина отщепляют от твердого носителя. Предпочтительно, чтобы цистеиновые остатки пептидной цепи были избирательно разблокированы, а внутримолекулярная дисульфидная связь образовывалась перед тем, как будет отщеплена пептидная связь от твердого носителя.
Подходящими α- амино защитными группами являются т-бутоксикарбонил и 9-флуоренилметоксикарбонил. В одном из предпочтительных вариантов настоящего изобретения, если в качестве α- амино-защитной группы используют т-бутоксикарбонил, то α- карбоксильные группы активируют с использованием дициклогексил карбодиимида и 1-гидроксибензотриазола с образованием сложных эфиров 1-гидроксибензотриазола. Особенно предпочтительной системой растворителей является система, содержащая N-метилпирролидон.
В Примерах 1-17 настоящей заявки приводится описание получения некоторых аналогов-агонистов. Кроме того, другие аналоги-агонисты, которые могут быть получены в соответствии с вышеуказанными процедурами (см таблицу 2). Соединения настоящего изобретения могут быть также получены с помощью техники рекомбинантных ДНК, хорошо известной специалистам. См., например, Sambrook и др. , Molecular Cloning: A Laboratory Manual, 2-ое изд., Gold Spring Harbor (1989).
Номенклатура соединений настоящего изобретения может быть использована для обозначения пептида, из последовательности которого было получено соединение, и модификаций, введенных в пептидную последовательность амилина, такого, как амилин человека. Аминокислота с предшествующим надстрочным индексом означает, что эта аминокислота замещает обычно присутствующую в основной аминокислотной последовательности аминокислоту в положении, указанном данным индексом. Например, запись "18Arg-25,28Pro-ч.амилин" означает, что данный пептид был получен из последовательности "ч.амилина" (амилина человека), имеющего следующие замещения: His был заменен на Arg в положении 18, Ala был заменен на Pro в положении 25, а Ser был заменен на Pro в положении 28. Термин "дез-1Lys-ч. амилин" относится к пептиду, полученному из последовательности амилина человека, с делетированной первой (или N-концевой) аминокислотой,
Аналоги-агонисты амилина настоящего изобретения обладают ценными фармакологическими свойствами. В частности, соединения настоящего изобретения являются активными агонистами амилина, о чем свидетельствуют анализ на связывание с рецептором и анализ с использованием камбаловидной мышцы, описанные ниже в Примерах 18 и 19, соответственно. Амилин-агонистическая активность соединений может быть также оценена путем выявления способности индуцировать гиперлактемию и/или гипергликемию у млекопитающих, В дополнение к описанию соединений, изображенных на Фиг. 3, в Таблице I представлены некоторые предпочтительные соединения. Все из указанных предпочтительных соединений, а именно: дез-1lys-ч.амилин, 28Pro-ч.амилин, 25,28,29Pro-ч.амилин, 18Arg25,28Pro-ч. амилин, и дез-1Lys18Arg25,28Pro-ч. амилин, обнаруживали амилиновую активность in vivo в испытуемых животных, у которых они индуцировали гиперлактемию, а затем гипергликемию. Было обнаружено, что помимо обладания активностью, характерной для амилина, соединения настоящего изобретения обладают также лучшей растворимостью и стабильностью по сравнению с амилином человека. Такими предпочтительными соединениями являются 25Pro26Val28,29Pro-ч.амилин, 25,28,29Pro-ч.амилин и 18Arg25,28Pro-ч.амилин.
Особенно предпочтительными соединениями настоящего изобретения являются 18Arg25,28Pro-ч. амилин, дез-1Lys18Arg25,28Pro-ч.амилин, 18Arg25,28,29Pro-ч. амилин, дез-1Lys18Arg25,28,29Pro-ч. амилин, 25,28,29Pro-ч. амилин, дез-1Lys25,28,29Pro-ч. амилин и 25Pro26Val25,28Pro-ч. амилин. Дополнительные пептидные соединения-агонисты амилина представлены в Таблице 2. Этими соединениями являются:
23Leu25Pro26Val28,29Pro-ч.амилин;
23Leu25Pro26Val28Pro-ч.амилин;
des1Leu23Leu25Pro26Val28Pro- ч.амилин;
18Arg23Leu25Pro26Val28Pro- ч.амилин;
18Arg23Leu25,28,29Pro-ч.амилин;
18Arg23Leu25,28Pro-ч.амилин;
17lle23Leu25,28,29Pro-ч.амилин;
17lle25,28,29Pro-ч.амилин;
des-1Lys17lle23Leu25,28,29Pro- ч.амилин;
17lle18Arg23Leu-ч.амилин;
17lle18Arg23Leu26Val29Pro-ч.амилин;
17lle18Arg23Leu25Pro26Val28,29Pro-ч.амилин;
13Thr21His23Leu26Ala28Leu29Pro31Asp-ч.амилин;
13Thr21His23Leu26Ala29Pro31Asp-ч.амилин;
des-1Lys13Thr21His23Leu26Ala28Pro31Asp-ч.амилин;
13Thr18Arg21His23Leu26Ala29Pro31Asp-ч.амилин;
13Thr18Arg21His23Leu25Pro26Ala28,29Pro31Asp-ч.амилин;
13Thr18Arg21His23Leu25Pro26Ala28,29Pro31Asp-ч.амилин.
Соединения настоящего изобретения могут быть смешаны с фармацевтическими носителями в целях получения фармацевтических лекарственных форм, подходящих для парентерального введения. Результаты экспериментов, проведенных с использованием указанных соединений, указывают на возможность клинического применения таких фармацевтических композиций при лечении сахарного диабета и других состояний, обусловленных недостаточностью инсулина, а также для предупреждения и лечения приступов гипогликемии. Соединения настоящего изобретения могут быть также использованы в сочетании с инсулином в целях лечения сахарного диабета и других нарушений, связанных с недостаточностью инсулина. Термин "инсулин" означает полипептид или его эквивалент, необходимый для регулирования уровней глюкозы в крови. Общее описание инсулинов проводится в Goodman and Gilman The Pharmacological Basis of Therapeutic, 8-ое изд., Pergamon Press (1990). Такие инсулины могут быть гормонами быстрого действия, промежуточного действия или пролонгированного действия. В настоящем изобретении могут быть использованы различные производные инсулина. См. , например, патенты США NN 5 049 547, 5 028 587 и 5 016 643. Могут быть также использованы пептиды инсулина (см, например, патент США N 5 008 241) в качестве аналогов (см., например, патенты США N 4 992 417 и 4 992 418). Указанные композиции могут быть введены любым традиционным способом, включая введение через нос (см., например, патенты США N 4 988 512 и 4 985 242, и 2 Bio World Today, N 125 (1991)). Соединения настоящего изобретения могут быть также использованы в сочетании с глюкагоном для предупреждения и лечения гипогликемии. [См., Young и др., заявка США рег. N 07/640478, поданная 10 января 1991 г. под названием "Hyperglycemic Compositions" ("гипергликемические композиции"), которая вводится в настоящее описание посредством ссылки].
Композиции или продукты настоящего изобретения могут быть получены в виде растворов, пригодных для парентерального (включая внутривенное, внутримышечное и подкожное введение), назального или перорального введения. В большинстве случаев аналог-агонист амилина предпочтительно использовать вместе с инсулином или глюкагеном в одной композиции или растворе. В других случаях может оказаться более предпочтительным вводить инсулин или глюкагон отдельно от указанного аналога-агониста. Подходящий режим введения лекарственного средства лучше всего может быть определен самим лечащим врачом для каждого пациента индивидуально. Подходящие фармацевтически приемлемые носители и их состав описаны в монографиях по технологии изготовления лекарственных средств, см. , например, Remington's Pharmaceutica Science. Martin E. W., См., также Wang Y.J. и Hanson M.A. "Parenteral Formulation of Proteins and Peptides: Stability and Stabilizers", Journal of Parenteral Science and Technologi Technical Report N 10, Supp. 42:2S (1988). Подходящие препараты, содержащие инсулин или глюкагон, хорошо известны специалистам.
Препараты агонистов настоящего изобретения могут быть стабилизированы при нейтральном pH. Поскольку продукты настоящего изобретения являются амфотерными, то они могут быть использованы в виде свободных оснований, в виде кислых аддитивных солей или в виде солей металлов. Само собой разумеется, что эти соли должны быть фармацевтически приемлемыми; причем, в качестве солей металлов могут быть использованы соли щелочных и щелочно-земельных металлов, например, соли натрия или калия. Как указывалось выше, в целях настоящего изобретения могут быть использованы фармацевтически приемлемые кислые аддитивные соли широкого ряда. Эти соли могут быть получены с помощью органических и неорганических кислот, предпочтительно минеральных кислот. Типичными примерами кислот, которые могут быть использованы в целях настоящего изобретения, являются лимонная, янтарная, молочная, хлористоводородная и бромистоводородная кислоты. Указанные продукты могут быть легко получены с помощью стандартных процедур, хорошо известных специалистам.
Продукты настоящего изобретения, в основном, предназначены для введения в виде парентеральных композиций путем инъекций или вливаний. Они могут быть, например, суспендированы в инертном масле, желательно в растительном масле, таком, как кунжутное масло, арахисовое масло или оливковое масло. Альтернативно, эти продукты могут быть суспендированы в водном изотоническом буферном растворе при pH от около 5,6 до 7,4. Подходящими буферами являются цитрат натрия - лимонная кислота и фосфат натрия - фосфорная кислота. Могут быть также использованы препараты пролонгированного действия или так называемые "депонированные" препараты медленного высвобождения, такие, что терапевтически эффективные количества лекарственного средства, содержащегося в этом препарате, поступают в кровоток в течение многих часов или дней после их подкожной инъекции.
Необходимая изотоничность может быть сообщена с помощью хлорида натрия или других фармацевтически приемлемых средств, таких, как декстроза, борная кислота, тартрат натрия, пропилен гликоль, полиолы, такие, как маннит и сорбит, или другие неорганические или органические вещества. Из буферов, содержащих ионы натрия, особенно предпочтительным является хлорид натрия.
Если необходимо, то растворы вышеуказанных композиций могут быть загущены с использованием таких загустителей, как метилцеллюлоза. Они могут быть получены в эмульгируемой форме либо в виде эмульсии "вода в масле", либо в виде эмульсии "масло в воде". Может быть использован любой агент из широкого ряда имеющихся фармацевтически приемлемых эмульгаторов, включая, например, порошкообразную аравийскую камедь, неионогенное поверхностно-активное вещество (такое, как Твин) или ионогенное поверхностно-активное вещество (такое, как основные соли сульфатов или сульфонатов полиэфироспиртов, например, Тритон).
Терапевтически ценные композиции настоящего изобретения получают путем смешивания ингредиентов в соответствии с традиционными процедурами. Например, выбранные компоненты могут быть просто смешаны в смесителе или в другом стандартном устройстве для получения концентрированной смеси, которая может быть затем доведена до конечной концентрации и вязкости путем добавления воды или загущающего агента, и возможно, буфера для регулирования pH, или дополнительных растворимых веществ для регулирования тоничности.
Для использования лечащим врачом композиции настоящего изобретения могут быть изготовлены в виде унифицированной стандартной лекарственной формы, содержащей некоторое количество соединения-агониста, взятого отдельно или в сочетании с инсулином или глюкагоном, которое при его введении в разовой или многократной дозе является эффективным для регулирования или восстановления содержания сахара в крови на нужном уровне. Терапевтически эффективные количества аналога-агониста амилина настоящего изобретения для лечения гипогликемии соответствуют таким количествам, которые способствуют повышению уровня сахара в крови, и предпочтительно составляют до около 80 мг/дл. Терапевтически эффективными количествами указанных аналогов-агонистов для лечения сахарного диабета и других нарушений, связанных с недостаточностью инсулина, являются количества, достаточные для снижения случаев петедозировки или нежелательной гипогликемии. Как известно специалистам, эффективное количество терапевтического агента может варьироваться в зависимости от многих факторов, таких, как возраст и вес пациента, его физическое состояние, уровень сахара в крови, и других факторов. В основном, стандартные дозы для лечения гипогликемии содержат около 0,5-1,0 мг соединения-агониста амилина и, если это необходимо, обычно используемое, или меньшее количество глюкагона.
Как указывалось выше, композиции, используемые в целях настоящего изобретения, могут быть изготовлены с использованием стандартной техники. Эти композиции могут быть также введены традиционными методами. Нужные дозы могут быть легко определены специалистом, исходя из вышеуказанных примеров.
Для более ясного понимания настоящего изобретения ниже представлены примеры, в которых описаны результаты серий экспериментов. Однако, представленные ниже примеры не должны рассматриваться как некое ограничение изобретения, и в него могут быть внесены различные изменения, которые описаны ранее, или будут описаны ниже, в соответствии с существом и объемом изобретения, определенных в нижеследующей формуле изобретения.
Примеры
Пример 1
Получение 28Pro-чел.амилина
Твердофазный синтез указанного аналога человеческого чел. амилина о использованием метилбензгидриламин-связанного полиполимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза, 2,7-[дисульфид]амилин-MBHA-полимер был получен путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифторуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой фтористоводородной кислоты (HF) в присутствии диметилсульфида и анизола, 28Pro ч.амилин очищали с помощью препаративной ВЭЖХ. Гомогенность пептида определяли с помощью аналитической ВЭЖХ и капиллярного электрофореза, а структуру подтверждали с помощью аминокислотного анализа и анализа последовательности. Полученный продукт имел нужную массу иона. FAB-масс-спект.: (М + 1)/e=3914.
Пример 2
Получение 25Pro26Val28,29-чел.амилина
Твердофазный синтез указанного аналога амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] амилин-MBHA-полимер был получен путем обработки трифторацетатом талия(111) в трифторуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. 25Pro26Val28,29Pro-чел.амилин очищали с помощью препаративной ВЭЖХ. С помощью аналитической ВЭЖХ и капиллярного электрофореза была установлена гомогенность пептида, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу иона. FAB-масс-спект.: M+1/e=3936.
Пример 3
Получение 2,7цикло-[2Asp,7Lys]-чел.амилина
Твердофазный синтез указанного аналога амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2Asp и 7Lys были введены с Boc-2Asp (Fmoc)-OH и Boc-7Lys (Fmoc)-OH. После избирательного разблокирования боковой цепи с использованием пиперидина осуществляли циклизацию "боковая цепь - боковая цепь" 2Asp-7Lys с помощью гексафторофосфата бензотриазол-лил-окси-трис диметиламино фосфония (BOP-реагент). Описание циклизации имеется в Do Maio, J. и др., J. Med.chem. 33: 661-667 1990; Felix A. M. и др. , Int J. Pent. Prot. Res. 32: 441 (1988). 2,7цикло-[2Asp,7Lys] амилин-MBHA-полимер, полученный после циклизации, расщепляли жидкой HF в присутствии диметилсульфида и анизола. 2,7цикло-[2Asp7Lys]-чел.амилин очищали с помощью препаративной ВЭЖХ. С помощью аналитической ВЭЖХ и капиллярного электрофореза была установлена гомогенность пептида, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу иона. FAB-масс спект.: (M + 1)/e=3925.
Пример 4
Получение дез-1Lys-чел.амилина
Твердофазный синтез дез-1Lys-чел. амилина (также представленного как 2-37чел. амилин с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза, 2,7-[дисульфид] амилин-MBHA-полимер был получен путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. Дез-1Lys-чел. амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. С использованием аналитической ВЭЖХ и капиллярного электрофореза была установлена гомогенность пептида, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Продукт имел нужную массу иона. FAB-масс-спектр.: (М + Н)+ = 3775.
Пример 5
Получение 1Ala-чел.амилина
Тверодофазный синтез 1Ala-чел.амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид]амилин-MBHA- полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифторуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. 1Ala-чел.амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Этот продукт имел нужную массу иона. FAB-масс-спектр.: (М + Н)+= 3847.
Пример 6
Получение 1Ser-чел.амилина
Твердофазный синтез 1Ser-чел.амилина с использованием метилбензгидгриламин-cвязанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] амилин- MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола, 1Ser-чел.амилин очищали с использованием препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Этот продукт имел нужную массу иона. FAB-масс-спектр.: (М + Н)+ = 3863.
Пример 7
Получение 29Pro-чел.амилина
Твердофазный синтез этого аналога человеческого амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] амилин-MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. 29Pro-чел.амилин очищали с помощью препаративной ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Продукт имел нужную массу иона. FAB-масс-спектр.: (М + Н)+= 3916.
Пример 8
Получение 25,28-чел.амилина
Твердофазный синтез 25,28-чел.амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид амилин-MBHA- полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. 25,28Pro-чел.амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Продукт имел нужную массу иона. FAB-масс-спек.: (М + Н)+=3939.
Пример 9
Получение дез-1Lys25,28-чел.амилина
Твердофазный синтез дeз-1Lys25,28Pro-чeл.aмилинa с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7[дисульфид]амилин-MBHA- полимер получали путем обработки Acm-защищенных цистеинов трифторофосфатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. Дез-1Lys25,28Pro-чел.амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спект.: (М + Н)+ = 3811.
Пример 10
Получение 18-Arg25,28Pro-чел.амилина
Твердофазный синтез 18Arg25,28Pro-чел. амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7[дисульфид]амилин-MBHA- полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. 18-Arg25,28Pro-чел.амилин очищали с использованием препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спектр.: (M + Н)+ = 3959.
Пример 11
Получение дез-1Lys18Arg25,28Pro- чел.амилина
Твердофазный синтез дез-1Lys18Arg25,28Pro- чел.амилина с использованием метилбеизгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] - амилин-MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF присутствии диметилсульфида и анизола. Дез-1Lys18Arg25,28-чел. амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спектр: (М + Н)+ = 3832.
Пример 12
Получение 18Arg25,28,29Pro-чел.амилина
Твердофазный синтез 18Arg25,28,29Pro-чел. амилина с использованием метилбензгидриламин-связанного полимера и защиты Na-Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] амилин-MBHA- полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. 18Arg25,28,29Pro-чел. амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофороза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спектр: (М + Н)+ = 3971.
Пример 13
Получение дез-1Lys18Arg25,28,29Pro- чел.амилина
Твердофазный синтез дез-1Lys18Arg25,28,29Pro- чел.амилина с использованием метилбензгидриламин-связанного полимера и защиты NaBoc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7-[дисульфид] амилин-MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. Дез-1Lys18Arg25,28,29Pro-чел. амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спектр: (М + Н)+= 3843.
Пример 14
Получение 25,28,29Pro-чел.амилина
Твердофазный синтез 25,28,29Pro-чел. амилина с использованием метилбензгидриламин-связанного полимера и защиты Na Boc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7[дисульфид]амилин-MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифторацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. 25,28,29Pro-чел.амилин очищали о помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности, полученный продукт имел нужную массу ионов. FAB- масс-спектр: (М + Н)+ = 3949.
Пример 15
Получение дез-1Lys25,28,29Pro-чел.амилина
Твердофазный синтез дез1Lys25,28,29Pro-чел. амилина с использованием метилбензгидриламин-связанного полимера и защиты NaBoc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7[дисульфид] амилин-MBHA-полимер получали путем обработки Acm-защищенных цистеинов трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. Дез-1Lys25,28,29Pro-чел. амилин очищали с помощью препаративной обращенно-фазовой ВЭЖХ. Гомогенность пептида была установлена с помощью аналитической ВЭЖХ и капиллярного электрофореза, а его структура была подтверждена с помощью аминокислотного анализа и анализа его последовательности. Полученный продукт имел нужную массу ионов. FAB-масс-спектр: (М + Н)+ = 3823.
Пример 16
Получение дез-1Lys25Pro26Val28,29Pro-чел.амилина
Твердофазный синтез этого аналога чел.амилина с использованием метилбензгидриламин-связанного полимера и защиты NaBoc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 2,7[дисульфид]амилин-MBHA- полимер получали путем обработки трифтороацетатом таллия(111) в трифтороуксусной кислоте. После завершения циклизации полимер и защитные группы боковой цепи отщепляли с помощью жидкой HF в присутствии диметилсульфида и анизола. После этого дез-1Lys25Pro26Val28,29Pro- чел.амилин очищали с помощью препаративной ВЭЖХ.
Пример 17
Получение [(D)-11Arg]-амилина
Твердофазный синтез этого аналога человеческого амилина с использованием метилбензгидриламина-связанного полимера и защиты NaBoc/бензильной боковой цепи осуществляли стандартными способами пептидного синтеза. 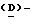 11Arg вводили с Boc
11Arg вводили с Boc 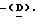 11Arg(Mtr)-OH. 2,7-[дисульфид]амилин-MBHA-полимер, полученный путем обработки трифтороацетатом таллия(111) в трифтороуксусной кислоте, циклизовали, а полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола.
11Arg(Mtr)-OH. 2,7-[дисульфид]амилин-MBHA-полимер, полученный путем обработки трифтороацетатом таллия(111) в трифтороуксусной кислоте, циклизовали, а полимер и защитные группы боковой цепи отщепляли с использованием жидкой HF в присутствии диметилсульфида и анизола. 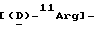 амилин затем очищали с помощью препаративной ВЭЖХ.
амилин затем очищали с помощью препаративной ВЭЖХ.
Пример 18
Анализ на связывание с рецептором
Оценку соединений настоящего изобретения на связывание с рецепторами амилина осуществляли следующим образом. 1251-амилин крыс (Bolton-Hunter, меченный у N-концевого лизина) получали от Amersham Corporation (Arlington Heights, 1L). Специфические активности в период использования составляли в пределах от 1950 до 2000 Ku/мМ. Немеченные пептиды получали от BACHEM lnc. (Torrance, CA) и Peninsula Laboratories (Belmont, CA).
Самцов крыс Sprague-Dawley (200-250 грамм) умерщвляли путем декапитации. Мозг удаляли и помещали в холодный фосфатно-буферный раствор (PBS). От вентральной поверхности были сделаны разрезы рострально к гипоталамусу, которые с одной стороны были ограничены обонятельными трактами, и которые простирались от этих трактов медиально под углом 45o. Этот базальный передний мозг, содержащий базальные ядра и окружающие области, взвешивали и гомогенизировали в охлажденном льдом буфере HEPES (20 мМ HEPES-кислоты, pH доводили до 7,4 с помощью NaOH при 23oC). Мембраны промывали три раза в свежем буфере путем центрифугирования при 48000 x г в течение 15 минут. Конечный осадок ресуспендировали в 20 мМ HEPES - буфере, содержащем 0,2 мМ фенилметилсульфонилфторида (PMSF).
Для оценки связывания 1251-амилина, мембраны, имеющие от 4 мг исходного мокрого веса ткани, инкубировали с 1251-амилином при 12-16 пМ в 20 мМ HEPE - буфера, содержащего 0,5 мг/мл бацитрацина, 0,5 мг/мл альбумина бычьей сыворотки, и 0,2 мМ PMSF. Растворы инкубировали в течение 60 минут при 23oC. Инкубацию завершали фильтрованием через фильтры из стекловолокна GF/B (Whatman Inc. , Clifton, N.J.), которые предварительно погружали на 4 часа в 0,3% полиэтиленимин в целях снижения неспецифического связывания радиоактивно меченных пептидов. Непосредственно перед фильтрацией фильтры промывали 5 мл холодного PBS, а сразу после фильтрации 15 мл холодного PBS. Затем фильтры удаляли, и радиоактивность оценивали с помощью гамма-счетчика при эффективности счета 77%. Кривые конкурентного связывания строили путем измерения связывания в присутствии 10-12-10-6 немеченного испытуемого соединения, и анализировали методом нелинейной регрессии, используя логическое уравнение с 4 параметрами (программа Inplot, Graph-PAD Software, San Diego).
В этом анализе очищенный амилин человека связывался со своим рецептором при IC50 которая по измерениям составляла около 50 пМ. Результаты, полученные для испытуемых соединений настоящего изобретения и представленные в Таблице 1, показали, что каждое из указанных соединений обладает значительной активностью при связывании с рецептором.
Пример 19
Анализ с использованием камбаловидной мышцы
Оценку активности соединений настоящего изобретения в качестве агонистов амилина проводили с использованием камбаловидной мышцы (Soleus mucle) следующим образом. Для поддержания массы выделенной камбаловидной мышцы менее, чем 40 мг, использовали крыс-самцов (Harlan Sprague-Dawley) с массой приблизительно 200 г. За 4 часа перед умерщвлением путем декапитации животным не давали пищу. Кожу снимали от нижней конечности, которую затем раскатывали на пробковой доске. Ахиллово сухожилие (tendo achilles) разрезали как раз над пяточной костью (os calcis), а икроножную мышцу (M. gastrocnemius) обнажали от задней поверхности большеберцовой кости. Затем свободно отделяли камбаловидную мышцу (M.soleus) (небольшую, 14-20 мм длиной, плотную плоскую мышцу на костной поверхности икроножной мышцы) и очищали ее от перимизия с помощью тонких ножниц и пинцетов. После этого камбаловидную мышцу разделяли на равные части с помощью лезвия скальпеля, делая разрезы от передней до задней части брюшка мышцы, в результате чего получали всего 4 мышечных полоски от каждого животного. После рассечения мышцы животного, ее выдерживали в течение короткого периода времени в физиологическом растворе. При этом, нет никакой необходимости выдерживать мышцу в условиях натяжения, так как это не оказывает какого-либо иллюстративного действия на внедрение радиоактивно меченной глюкозы в глюкоген.
Мышцы помещали в 50 мл колбы Эрленмейера, содержащие 10 мл предварительно газированного бикарбонатного буфера Кребса-Рингера, включающего в себя (каждый литр): 118,5 мМ (6,93 г) NaCl, 5,94 мМ (443 мг) KCl, 2,54 мМ (282 мг) CaCl2, 1,19 мМ (143 мг), 1,19 мМ (162 мг) KH2PO4, 25 мМ (2,1 г) NaHCO3, 5,5 мМ (1 г) глюкозы и рекомбинантный инсулин человека Humulin-R, Eli Lilly (IN); испытуемое соединение, как более подробно описано ниже. pH при 37oC поддерживали в пределах 7,1-7,4. Мышцы распределяли по различным колбам таким образом, что 4 куска мышцы от каждого животного равномерно распределяли по анализам с различными условиями. Инкубационную среду слегка газировали, продувая карбогеном (95% O2, 5% CO2) над поверхностью, и постоянно размешивая, при этом, в водяной бане-шейкере при 37oC. После получасового "прединкубационного" периода в каждую колбу добавляли 0,5 мк Ku U-14C-глюкозы, и эти колбы инкубировали еще в течение 60 минут. После этого каждый кусок мышцы быстро удаляли, блотировали и замораживали в жидком N2, затем взвешивали и хранили для последующего определения 14C-гликогена.
Определение 14C-гликогена осуществляли в 7-миллилитровом сцинтилляционном флаконе. Каждый образец замороженной мышцы помещали во флакон и гидролизовали в 1 мл 60% гидроксида калия при 70oC в течение 45 минут и в условиях размешивания. Растворенный гликоген осаждали во флаконе путем добавления 3 мл абсолютного этанола и охлаждения при -20oC в течение ночи. Супернатант удаляли путем осторожного отсасывания, гликоген опять промывали этанолом и отсасывали, а преципитат осушали в вакууме. Во избежание тушения флуоресценции во время подсчета импульсов весь этанол выпаривали. Оставшийся гликоген снова растворяли в 1 мл воды и 4 мл сцинтилляционной жидкости, и подсчитывали 14C.
Степень включения глюкозы в гликоген (выраженную в мкМ/г в час) определяли исходя из специфической активности 14C-глюкозы в 5,5 мМ глюкозы инкубационной среды и полного числа 14C, оставшегося в гликогене, экстрагированном из каждой мышцы. Кривые "доза-ответ" строили по логической модели с 4 параметрами с использованием итеративного алгоритма наименьших квадратов (ALLFIT, версия 2,7, NIH, MD), и получали в результате EC50. Поскольку EC50 имеют логарифмически нормальное распределение, то их выражали в логарифмах ± ср. кв. отклонение. Попарное сравнение осуществляли с использованием стандартной программы SYSTAT, основанной на т-критерии Стьюдента (Wilkinson, "SYSTAT: the system for statistics" SYSTAT Inc., EvanstonlL (1989)).
Дозозависимые кривые строили с использованием мышц, добавленных в среды, содержащие 7,1 нМ (1000 мкЕд/мл) инсулина и каждое испытуемое соединение, добавленное в конечных (номинальных) концентрациях 0, 1, 3, 10, 30, 100, 300 и 1000 нМ. В каждом анализе также использовали внутренний позитивный контроль, состоящий из одной партии архивного крысиного амилина, лиофилизованного и хранимого при -70oC.
Человеческий амилин представляет собой известный гипергликемический пептид; и величины EC50 препаратов амилина, измеренные в анализе с использованием камбаловидной мышцы, составляют обычно от около 1-10 нМ, хотя некоторые коммерческие препараты, которые имеют чистоту менее 90%, показывают более высокие EC50 из-за присутствия в них загрязнений, приводящих к снижению измеряемой активности. Результаты, полученные для испытуемых соединений и представленные в Таблице 1, показали, что все указанные соединения обладают амилиновой активностью.
Пример 20
Получение 23Ser,25,28,29Pro-человеческого амилина.
Твердофазный синтез указанного аналога человеческого амилина проводят на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-фенокси-ацетамид- норлейцинметилбензгидриламиновой смоле (Novabiochem. 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.). В целом в процессе синтеза используются циклы с одинарным сочетанием, и применяется способ HATU (0-(7-азабензотриазол-1-ил)-1,1,3,3- тетраметилуран гексафторфосфат) в присутствии диизопропилэтиламина с использованием N-метил-пирролидина в качестве растворителя. Однако в некоторых позициях сочетание происходит менее эффективно, чем ожидается, и требуются двойные сочетания. В частности остатки Pro29, Pro28, Pro25, Asn22, Asn21 Asn3 и Cys2 - все требуют двойного сочетания. N-конец завершается с помощью (бис-tBoc)-лизина в цикле окончательного сочетания. Окончательное удаление защитных групп у готового пептидного полимера достигали с помощью смеси триэтилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) с применением стандартных способов (см. "Introduction to Cleavage Techniques", Applied Biosystems, Inc.). Пептид осаждают в смеси эфира с водой (50 мл) и центрифугируют. Осадок обрабатывают ледяной уксусной кислотой и лиофилизируют, а полученный неочищенный пептид повторно растворяют в воде и обрабатывают трис-карбоэтокси-фосфином, чтобы обеспечить полную генерацию свободных тиолов. Обработка феррицианидом калия при pH 6,5 вызывает циклизацию до образования пептида с монодисульфидными мостиками. В результате подкисления и обработки анионообменной смолой Biorad AG4X4 удаляют все остатки ионов Fe2+ и Fe3+. После лиофилизации получают неочищенный пептид.
На этапах очистки и анализа используют Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN).
Раствор, содержащий пептид, наносят на препаративную колонку C-18 и подвергают очистке (от 10% до 40% Растворителя Б в Растворителе А свыше 40 минут). Чистоту фракций определяют изократно с использованием аналитической колонки C-18. Чистые фракции сливают, получая вышеуказанный пептид. Анализ лиофизилованного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) позволяет определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 13Ser25,28,29Pro-чел.-амилина(M): вычисленное значение 3965.5.
Пример 21
Получение 13Thr25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems. Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 13Thr25,28,29-ч.-амилина(M): вычисленное значение 3979.5.
Пример 22
Получение 17Leu25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems. Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 17Leu25,28,29Pro-ч.-амилина(M): вычисленное значение 3963.5.
Пример 23
Получение 17IIe25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 17Leu25,28,29Pro-ч.-амилина(M): вычисленное значение 3963.5.
Пример 24
Получение 19Thr25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems. Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 19Thr25,28,29Pro-ч.-амилина(M): вычисленное значение 3963.5.
Пример 25
Получение 20Thr25,28,29Pro-чел.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 20Thr25,28,29Pro-ч.-амилина(M): вычисленное значение 3963.5.
Пример 26
Получение 20Gln25,28,29Pro-чел.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1 % трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 20Gln25,28,29Pro-ч.-амилина(M): вычисленное значение 3990.5.
Пример 27
Получение 20Asn25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 20Asn25,28,29-чел.-амилина(M): вычисленное значение 3976.5.
Пример 28
Получение 21Gln25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 21Gln25,28,29-чел.-амилина(M): вычисленное значение 3963.5.
Пример 29
Получение 21His25,28,29-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 21His25,28,29Pro-ч.-амилина(M): вычисленное значение 3973.5.
Пример 30
Получение 23Leu25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 23Leu25,28,29Pro-чел.-амилина(M): вычисленное значение 3915.5.
Пример 31
Получение 23Tyr25,28,29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 23Tyr25,28,29Pro-ч.-амилина(M): вычисленное значение 3965.5.
Пример 32
Получение 25Pro26Ala28,29-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25Pro26Ala28,29Pro-ч.-амилина(M): вычисленное значение 3907.5.
Пример 33
Получение 25Pro26Leu28,29Pro- ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25Pro26Leu28,29-ч.-амилина(M): вычисленное значение 3949.5.
Пример 34
Получение 25Pro28Leu29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-фенокси- ацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25Pro28Leu29Pro-ч.-амилина(M): вычисленное значение 3965.5.
Пример 35
Получение 25Pro28IIe29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25Pro28IIe29Pro-ч.-амилина(M): вычисленное значение 3965.5.
Пример 36
Получение 25Pro28Thr29Pro-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25Pro28Thr29Pro-ч.-амилина (М): вычисленное значение 3953.5.
Пример 37
Получение 25,28Pro29Thr-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил- феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem. 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems. Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученногопептида.Электрораспылительнаямасс-спектрометрия25,28Pro29Thr-ч.-амилина(M): вычисленное значение 3953.5.
Пример 38
Получение 25,28,29Pro31Asn-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25,28,29Pro31Asn-ч.-амилина(M): вычисленное значение 3950.5.
Пример 39
Получение 25,28,29Pro31Gln-ч.-амилина
Твердофазный синтез указанного аналога человеческого амилина осуществляют на 4-(2'-4'-диметоксифенил)-Fmoc аминометил-феноксиацетамид-норлейцин-метилбензгидриламиновой смоле (Novabiochem, 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems, Inc.), отщепленных от полимера, в отношении которых провели удаление защитных групп и очистку таким же образом, как описано в Примере 20. При проведении анализов использовали Растворитель А (0,1% трифторуксусная кислота в воде) и Растворитель Б (0,1% трифторуксусная кислота в ACN). Затем провели анализ лиофилизированного пептида с применением ВЭЖХ с обращенной фазой (градиент с 30% до 60% Растворителя Б в Растворителе А свыше 30 минут) с целью определить время удержания полученного пептида. Электрораспылительная масс-спектрометрия 25,28,29Pro31Gln-чел.-амилина(M): вычисленное значение 3963.5.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ САХАРНОГО ДИАБЕТА ТИПА II АГОНИСТАМИ АМИЛИНА | 1996 |
|
RU2166958C2 |
| НОВЫЕ КОМПОЗИЦИИ АГОНИСТОВ ЭКСЕНДИНА И СПОСОБЫ ИХ ВВЕДЕНИЯ | 2000 |
|
RU2242244C2 |
| СПОСОБ ЛЕЧЕНИЯ ОЖИРЕНИЯ | 1998 |
|
RU2207871C2 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ОЖИРЕНИЯ | 2002 |
|
RU2314121C9 |
| СПОСОБЫ ПОДАВЛЕНИЯ ГЛЮКАГОНА | 2000 |
|
RU2247575C9 |
| ПЕПТИД, ОБЛАДАЮЩИЙ СВОЙСТВАМИ АМИЛИНА (ВАРИАНТЫ), И ЕГО ПРИМЕНЕНИЕ (ВАРИАНТЫ) | 2005 |
|
RU2385878C2 |
| СПОСОБЫ РЕГУЛИРОВАНИЯ МОТОРИКИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 1994 |
|
RU2177331C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ДИАБЕТА И СНИЖЕНИЯ МАССЫ ТЕЛА | 2006 |
|
RU2421237C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| АГОНИСТЫ ОКСИТОЦИНОВЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2539692C2 |



Аналог-агонист амилина имеет аминокислотную последовательность общей формулы I:
A1-X - Asn - Thr - 5Ala - Thr - Ala - Thr - 10Gln - Arg - Leu-B1 - Asn - 15Phe - Leu - C1 - D1 - E1 - 20F1 - G1 - Asn - H1 - Gly - 25J1 - J1 -Leu - K1 - L1 - 30Thr - M1 - Val - Gly - Ser - 35Asn - Thr - Tyr - Z,
где A1 - M1 представляют собой остатки аминокислот, указанные в п. I формулы изобретения.
Композиция на основе соединения формулы I проявляет свойство агониста амилина. 2 с. и 8 з.п. ф-лы, 3 ил., 1 табл.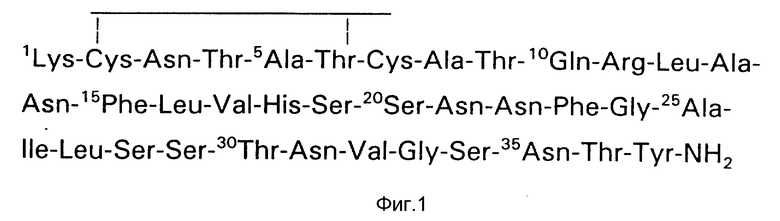
'A1-X-Asn-Thr-5Ala-Thr-y-Ala-Thr-10Gln-Arg-Leu-B1-Asn-15Phe-Leu-C1-D1-E1-20F1-G1-Asn-H1-Gly-25J1-J1-Leu-K1-L1-30Thr-M1-Val-Gly-Ser-35Asn-Thr-Tyr-Z,
A1 представляет собой Lys, Ala, Ser или водород;
B1 представляет собой Ala, Ser или Thr;
C1 представляет собой Val, Leu или Jle;
D1 представляет собой His или Arg;
E1 представляет собой Ser или Thr;
F1 представляет собой Ser, Thr, Gln или Asn;
G1 представляет собой Asn, Gln или His;
H1 представляет собой Phe, Leu или Tyr;
J1 представляет собой Ala или Pro;
J1 представляет собой Jle, Val, Ala или Leu;
K1 представляет собой Ser, Pro, Leu, Jle или Thr;
L1 представляет собой Ser, Pro или Thr и
M1 представляет собой Asn, Asp, Gln
где по крайней мере два из J1, K1, L1 представляют собой Pro, X и Y являются независимо выбранными аминокислотными остатками, имеющими боковые цепи, которые химически связаны друг с другом, образуя внутримолекулярную дисульфидную или амидную связь, Z представляет собой аминогруппу, при условии, что когда
a) A1= Lys, B1=Ala, C1=Val, D1=Arg, E1=Ser, F1=Ser, G1=Asn, H1=Leu, J1= Pro, J1=Val, K1=Pro, L1=Pro, M1=Asn или
b) A1= Lys, B1=Ala, C1=Val, D1=His, E1=Ser, F1=Asn, G1=Asn, H1=Leu, J1= Pro, J1=Val, K1=Ser, L1=Pro, M1=Asn,
тогда один или более из A1-M1 не является L-аминокислотой.
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| ОПТИЧЕСКИЙ СПОСОБ КОНТРОЛЯ НЕСООСНОСТИ ОТВЕРСТИЙ С ПРИМЕНЕНИЕМ ИЗВЕСТНОЙ ОПТИЧЕСКОЙ СИСТЕМЫ | 0 |
|
SU289287A1 |
| РАБОЧИЙ ОРГАН К МАШИНЕ ДЛЯ РАЗРАБОТКИ МЕРЗЛОГОГРУНТА | 0 |
|
SU309100A1 |
| КОМПЕНСАЦИОННЫЙ СТАБИЛИЗАТОР НАПРЯЖЕНИЯ ПОСТОЯННОГО ТОКА | 0 |
|
SU408294A1 |
| US 5120712 A 1992 | |||
| US 5124314 A 1992 | |||
| Journal of Parenteral Science and Technology Technical Report | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| p | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Способ получения пептидов или их солей или амидов или сложных бензиловых эфиров | 1973 |
|
SU651691A3 |
Авторы
Даты
1999-05-20—Публикация
1992-11-19—Подача