По настоящей заявке испрашивается приоритет по предварительной заявке США №60/543,275, поданной 11 февраля 2004, и по предварительной заявке США №60/550,447, поданной 3 марта 2004, каждая из которых включена здесь в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым соединениям и способам их получения и применения. Эти соединения могут быть использованы для лечения или профилактики состояний, таких как метаболические нарушения, сосудистые нарушения, нарушения функции почек и/или нарушения работы желудочно-кишечного тракта. Состояние, которое можно привести в качестве примера, представляет собой состояние, при котором важно уменьшить потребление пищи или калорий, например ожирение, диабет II типа, пищевого расстройства, метаболический синдром и синдром инсулинорезистентности.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
К настоящему времени была проведена большая работа по амилину, кальцитонину и пептиду, генетически родственному кальцитонину (CGRP), для понимания их структуры и функции. В таблице 1 суммированы некоторые биологические эффекты CGRP, кальцитонина и амилина, опубликованные Wimalawansa, S.J. (1997) Critical Reviews in Neurobiology, 11; 167-239.
Сообщалось, что амилин регулирует опорожнение желудка и подавляет секрецию глюкагона и усвоение пищи, таким образом регулируя скорость появления глюкозы в кровотоке. По-видимому, он дополняет действия инсулина, который регулирует скорость исчезновения глюкозы из кровотока и ее поглощения периферическими тканями. Эти действия подтверждаются экспериментальными данными у грызунов и людей, указывающими на то, что амилин дополняет эффекты инсулина в регуляции глюкозы после приема пищи, по меньшей мере, с помощью трех независимых механизмов, каждый из которых влияет на скорость появления глюкозы. Во-первых, амилин подавляет секрецию глюкагона после приема пищи. По сравнению со здоровыми взрослыми пациентами у пациентов с диабетом 1 типа амилин не циркулирует, а у пациентов с диабетом 2 типа концентрации амилина после приема пищи снижены. Кроме того, инфузионное введение специфических моноклональных антител к амилину, которые связывают циркулирующий амилин, снова приводит к значительному повышению концентраций глюкагона по сравнению с контролем. Оба этих результата указывают на физиологическую роль эндогенного амилина в регуляции секреции глюкагона после приема пищи. Во-вторых, амилин замедляет моторику желудочно-кишечного тракта и опорожнение желудка. Наконец, было показано, что внутригипоталамические инъекции амилина крыс снижают питание у крыс и изменяют метаболизм нейротрансмиттеров в гипоталамусе. В некоторых исследованиях поглощение пищи значительно снижалось вплоть до восьми часов после внутригипоталамической инъекции амилина крыс и CGRP крыс. В испытаниях на людях было показано, что аналог амилина, прамлинтид, снижает массу тела или увеличение массы тела. Амилин может быть эффективен при лечении метаболических состояний, таких как диабет и ожирение. Амилин также может быть использован при лечении боли, заболеваний костей, гастрита, для модуляции липидов, в частности триглицеридов, или для воздействия на состав тканей тела, например, предпочтительной потери жировой ткани и сохранения нежировой ткани.
Гормон кальцитонин (СТ) был назван по его секреции в ответ на индуцированную гиперкальциемию и его быстрому гипокальциемическому эффекту. Он продуцируется и секретируется из нейроэндокринных клеток щитовидной железы, которые в связи с этим были названы С-клетками. Хорошо изученным действием СТ(1-32) является его воздействие на остеокласты. In vitro эффекты СТ включают в себя быструю потерю поврежденных краев и сниженное высвобождение лизосомальных ферментов. В конечном итоге, ингибирование функции остеокластов под действием СТ в результате приводит к снижению резорбции кости. Однако ни постоянное снижение СТ в сыворотке в случае тиреоидэктомии, ни повышенный уровень СТ в сыворотке, обнаруженный при медуллярном раке щитовидной железы, по-видимому, не связаны с изменениями содержания кальция в сыворотке крови или костной массе. Таким образом, наиболее вероятно, что основной функцией СТ(1-32) является борьба с острой гиперкальциемией в экстремальных ситуациях и/или защита скелета в периоды «кальциевого стресса», таких как рост, беременность и лактация. (Обзор в Becker, JCEM, 89 (4): 1512-1525 (2004) и Sexton, Current Medicinal Chemistry 6: 1067-1093 (1999)). Согласно этому, в недавних сведениях, полученных при изучении гена кальцитонина мышей «knockout», который удаляет и кальцитонин, и CGRP-I пептиды, сообщается, что у этих мышей были нормальные уровни значений, связанных с базальным кальцием, но повышенный кальциемический ответ (Kurihara H, et al, Hypertens Res. 2003 Feb; 26 Suppl:S 105-8).
CT оказывает воздействие на уровни кальция в плазме и ингибирует функции остеокластов и широко используется при лечении остеопороза. Терапевтически CT лосося, по-видимому, увеличивает плотность кости и снижает частоту возникновения переломов с минимальными побочными эффектами. CT также успешно использовался на протяжении 25 лет в качестве лекарственного средства при болезни костей Педжета, которая представляет собой хроническое заболевание скелета, результатом которого является увеличение и деформация костей в одном или нескольких участках скелета. Также широко используется анальгетический эффект CT при болях в костях, испытываемых при остеопорозе, хотя механизм этого эффекта до конца не понят.
Пептид, генетически родственный кальцитонину (CGRP), представляет собой нейропептид, рецепторы которого распространены повсеместно в организме, в том числе в нервной системе и сердечно-сосудистой системе. Этот пептид, по-видимому, модулирует чувствительную нейрональную передачу и является одним из наиболее сильных эндогенных вазодилятационных пептидов, открытых к настоящему времени. Описанные биологические эффекты CGRP включают в себя: модуляцию вещества Р при воспалении, модуляцию активности никотиновых рецепторов в нейромышечном синапсе, стимуляцию секреции ферментов поджелудочной железы, снижение секреции желудочного сока, периферическую вазодилятацию, учащение пульса, нейромодуляцию, регуляцию метаболизма кальция, остеогенную стимуляцию, секрецию инсулина, повышение температуры тела и снижение потребления пищи. (Wimalawansa, Amylin, calcitonin gene-related peptide, calcitonin and ADM: a peptide superfamily. Crit Rev Neurobiol. 1997; 11 (2-3): 167-239). Важной ролью CGRP является регуляция притока крови к различным органам вследствие его сильного сосудорасширяющего действия, что доказывается снижением среднего артериального давления после внутривенного введения CGRP. Сосудорасширяющие действия также подтверждаются недавним исследованием гомозиготных мышей «knockout CGRP», в котором продемонстрирована повышенная резистентность периферических сосудов и высокое кровяное давление, вызванное повышенной активностью периферической симпатической нервной системы (Kurihara H, et al, Targeted disruption of ADM and alphaCGRP genes reveals their distinct biological roles. Hypertens Res. 2003 Feb; 26 SuppliS 105-8). Таким образом, CGRP, по-видимому, вызывает сосудорасширяющие эффекты, гипотензивные эффекты и повышение частоты сердечных сокращений наряду с другими действиями.
Длительная инфузия CGRP пациентам с застойной сердечной недостаточностью показала длительный благоприятный эффект на гемодинамические функции без побочных эффектов, предполагая применение при сердечной недостаточности. Другие показания для применения CGRP включают в себя почечную недостаточность, острую и хроническую ишемию коронарных артерий, лечение сердечной аритмии, других заболеваний периферических сосудов, таких как феномен Рейно, субарахноидальная геморрагия, гипертензия и легочная гипертензия. Преэкламптическая токсемия беременных и преждевременные роды также теоретически поддаются лечению. (Wimalawansa, 1997). Последние терапевтические применения включают в себя применение антагонистов CGRP для лечения головных болей при мигрени.
Существует много полезных свойств каждого пептида, которые могут быть использованы отдельно или в комбинации для лечения или профилактики различных состояний. Было бы полезным создать новые и эффективные пептиды, обладающие многими функциями, придающими улучшенные характеристики, которыми не обладают существующие пептиды. Например, в исследованиях потребления пищи было показано, что амилин имеет быстрое начало, в течение 30 минут, но его эффект уменьшается через 60 минут. Наоборот, было показано, что кальцитонин лосося имеет замедленное действие, с максимальными уровнями, сохраняющимися в течение 240 минут. Новые соединения, которые могут имитировать эффекты амилина и/или кальцитонина и обладают быстрым проявлением активности, подобно амилину, с замедленной активностью кальцитонина, могут повысить активность и эффективность каждого отдельно взятого соединения. Более того, комбинация некоторых физико-химических характеристик амилина, кальцитонина и/или CGRP в одно средство может облегчить воздействие в различных точках при дисфункциональном метаболическом цикле. Эти новые соединения объединяют желательные функции или свойства для превосходного лекарственного средства, что в результате дает соединения, имеющие, по меньшей мере, одно желаемое свойство, например, более высокую эффективность, большую активность, большую биодоступность, меньше побочных эффектов, несложное производство, стабильность и/или растворимость.
Все соединения, которые упоминаются здесь, включены в качестве ссылки в настоящую заявку, как будто полностью изложенные здесь.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, по меньшей мере частично, к новым пептидам семейства амилина или к соединению. В основном аспекте, эти новые соединения (также называемые соединениями по данному изобретению) имеют по меньшей мере один петлевой фрагмент амилина или кальцитонина и их аналогов; а-спиральный участок по меньшей мере части α-спирального участка кальцитонина или его аналогов или α-спиральный участок, имеющий часть α-спирального участка амилина и α-спирального участка кальцитонина или их соответствующих аналогов; и С-концевой хвост амилина или кальцитонина или их аналогов, при условии, что С-концевой хвост кальцитонина или аналога кальцитонина не является пролином (Pro), гидроксипролином (Hyp), гомосерином (Hse) или производными Hse.
Используемый здесь «аналог» относится к пептиду, последовательность которого происходит из последовательности основного эталонного пептида, например амилина и кальцитонина, и включает в себя вставки, замены, удлиняющие сегменты и/или делеции эталонной аминокислотной последовательности, предпочтительно имеющей по меньшей мере 50 или 55% идентичность аминокислотной последовательности с основным пептидом, более предпочтительно имеющей по меньшей мере 70%, 80%, 90% или 95% идентичность аминокислоты с основным пептидом. В одном варианте осуществления такие аналоги могут содержать консервативные или неконсервативные аминокислотные замены (в том числе неприродные аминокислоты и L и D формы). Аналоги включают в себя соединения с агонистической и соединения с антагонистической активностью. Аналоги в соответствии с данным здесь определением также включают в себя производные.
«Производное» определено здесь как эталонный пептид или аналоги, описанные выше, имеющее химическую модификацию одной или нескольких боковых групп аминокислот, α-углеродных атомов, концевых аминогрупп или группы концевой карбоновой кислоты. Химическая модификация включает в себя, но не только, добавление химически функциональных групп, образование новых связей и удаление химически функциональных групп. Модификации боковых групп аминокислот включают в себя, без ограничения, ацилирование ε-аминогрупп лизина, N-алкилирование аргинина, гистидина или лизина, алкилирование карбоксильной группы глутаминовой или аспарагиновой кислоты, и дезаминирование глутамина или аспарагина. Модификации концевой аминогруппы включают в себя без ограничения дезамино, N-низший алкил, N-ди-низший алкил и N-ацил модификации. Модификации концевой аминогруппы включают в себя, без ограничения, дезамино, N-низший алкил, N-ди-низший алкил и N-ацил модификации, такие как алкилацилы, разветвленные алкилацилы, алкиларил-ацилы. Модификации концевой карбоксигруппы включают в себя, без ограничения, амид, низший алкиламид, диалкиламид, ариламид, алкилариламид и низший алкиловый эфир модификации. Низший алкил представляет собой С1-С4 алкил. Кроме того, одна или несколько боковых групп или концевых групп могут быть защищены защитными группами, известными специалисту в области химического синтеза, α-углерод аминокислоты может быть моно- или диметилированным.
В некоторых вариантах осуществления новые соединения имеют петлевой фрагмент амилина или аналога амилина, по меньшей мере часть α-спирального участка кальцитонина или аналога кальцитонина, и С-концевой хвост амилина или аналога амилина. В других вариантах осуществления новые соединения имеют петлевой фрагмент кальцитонина или аналога кальцитонина, по меньшей мере, часть α-спирального участка кальцитонина или аналога кальцитонина, и С-концевой хвост амилина или аналога амилина. В других вариантах осуществления новые соединения имеют петлевой фрагмент амилина или аналога амилина, по меньшей мере, часть α-спирального участка амилина или аналога амилина и, по меньшей мере, часть α-спирального участка кальцитонина или аналога кальцитонана и С-концевой хвост амилина или аналога амилина. В других вариантах осуществления новые соединения имеют петлевой фрагмент кальцитонина или аналога кальцитонина, по меньшей мере часть α-спирального участка амилина или аналога амилина и по меньшей мере часть α-спирального участка кальцитонина или аналога кальцитонина и С-концевой хвост амилина или аналога амилина. В других вариантах осуществления новые соединения имеют петлевой фрагмент амилина или аналога амилина, часть α-спирального участка или кальцитонина, или аналога кальцитонина, или, по меньшей мере часть α-участка амилина, или аналога амилина и, по меньшей мере, часть α-спирального участка кальцитонина или аналога кальцитонина и С-концевой хвост кальцитонина или аналога кальцитонина.
В некоторых вариантах осуществления петлевой фрагмент новых соединений может дополнительно содержать не более одной, двух, трех или четырех модификаций, включая замены, вставки или делении петли амилина или кальцитонина и их аналогов. Дополнительно предполагается, что новые соединения могут иметь дополнительные модификации N-концевого участка петли, содержащей N-кэп участок, который может обладать гидрофобными или гидрофильными свойствами, такой как ацетил, изокапроил, 3,6-диоксиоктановая кислота или 1-амино-4,7,10-триокса-13-тридеканаминсукциниминовая кислота. Модификации могут дополнительно включать одну, две, три или более дополнительных аминокислот. В этой области возможно слишком много модификаций для упоминания, но понятных специалисту в данной области на основании примеров, приведенных в настоящей заявке далее.
В основном, в отношении аминокислотной последовательности термин «модификация» включает в себя замены, вставки, элонгации, делеции и получение производных отдельных или в комбинации. Новые соединения по данному изобретению могут содержать одну или несколько модификаций «второстепенного» аминокислотного остатка. В контексте данного изобретения «второстепенный» аминокислотный остаток представляет собой остаток, который может быть изменен, т.е. удален или замещен, в новой аминокислотной последовательности без прекращения или существенного снижения агонистической активности аналогичного полипептида.
Замены включают в себя консервативные аминокислотные замены. «Консервативная аминокислотная замена» представляет собой замену, в которой аминокислотный остаток замещен аминокислотным остатком, имеющим похожую боковую цепь, или физико-химические свойства (например, электростатические, водородные связи, изостерические, гидрофобные особенности). Аминокислоты могут быть природными или неприродными. Семейства аминокислотных остатков, имеющих похожие боковые цепи, хорошо известны в данной области. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагировая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, метионин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан), β-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Замены также могут включать в себя неконсервативные замены.
Соединения по данному изобретению также могут быть получены с помощью химических изменений, таких как амидирование, гликозилирование, ацилирование, сульфатирование, фосфорилирование, ацетилирование и циклизация. Такие химические изменения могут быть получены с помощью химических или биохимических методик, а также способами in-vivo или с помощью любых комбинаций этих способов. Производные соединений по данному изобретению также могут включать в себя конъюгацию с одним или несколькими полимерами или низкомолекулярными заместителями. Один тип полимерной конъюгации представляет собой связывание или присоединение полимеров полиэтиленгликоля («ПЭГ»), полиаминокислот (например, поли-his, поли-arg, поли-lys и т.д) и/или цепей жирных кислот различной длины к N- или С-концу или аминокислотному остатку боковых цепей аналога AFP-6. Низкомолекулярные заместители включают в себя короткие алкилы и изогнутые алкилы (например, разветвленные, циклические, конденсированные, адамантил) и ароматические группы. Кроме того, основные остатки, такие как R и К, могут быть замещены на гомоR и гомоК, цитриллин или орнитин для улучшения метаболической стабильности пептида. Соединения по данному изобретению также включают в себя кислотные, а также амидные формы пептидов.
В некоторых вариантах осуществления α-спиральный участок новых соединений содержит по меньшей мере четыре следующих друг за другом аминокислоты α-спирального участка кальцитонина или аналога кальцитонина. В другом варианте осуществления α-спиральный участок содежит, по меньшей мере, 5, 6, 7 или 8 смежных аминокислот α- спирального участка кальцитонина или аналога кальцитонина. В других вариантах осуществления α спиральный участок содержит, по меньшей мере, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или более следующих друг за другом аминокислот α-спирального участка кальцитонина или аналога кальцитонина. В некоторых вариантах осуществления, в тех случаях, когда количество следующих друг за другом аминокислот составляет меньше 8, считается, что α спиральный участок дополнительно содержит по меньшей мере 4, 5, 6, 7, 9, 10, 11 или более следующих друг за другом аминокислот α-участка амилина или аналога амилина. В некоторых вариантах осуществления предусматривается, что чем меньше аминокислот кальцитонина или аналога кальцитонина, тем больше аминокислот амилина или аналога амилина может быть обнаружено в α-спиральном участке новых соединений. Количество аминокислот, входящих в состав α-участка, может быть примерно от 10 до 23 аминокислот. Соответственно α- спиральный участок может быть длиной 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 аминокислоты. Кроме того, аминокислоты должны обеспечивать примерно от трех до шести α спиральных витков. Кроме того, подразумевается, что α-спиральный участок новых соединений может дополнительно содержать не более одного, двух, трех, четырех, пяти, шести, семи, восьми или 10 модификаций, в том числе замен, вставок или делеций α-спирального участка кальцитонина и/или амилина и их аналогов.
В некоторых вариантах осуществления С-концевой хвост новых соединений содержит по меньшей мере последние шесть, пять или четыре аминокислоты либо амилина, либо кальцитонина и их аналогов. В некоторых вариантах осуществления С-концевой хвост новых соединений содержит по меньшей мере часть С-конца, имеющего виток β-спирали. В некоторых вариантах осуществления виток β спирали введен в комбинацию аминокислот Gly-Ser. Соответственно новые соединения могут иметь С-конец, содержащий часть С-концевого хвоста амилина или кальцитонина (и их аналогов), имеющий Gly-Ser или начинающийся с Gly-Ser.
В некоторых вариантах осуществления С-концевой хвост новых соединений дополнительно может содержать не более одной, двух или трех модификаций, в том числе замен, вставок или делеций петли амилина или кальцитонина и их аналогов. Также предполагается, что новые соединения могут иметь дополнительные модификации С-концевой части С-концевого хвоста, которые могут включать в себя L-октилглицин, 4ABU (4-аминомасляную кислоту), 9Anc (9 аминононановую кислоту), 3,6-диоксиоктановую кислоту или 1-амино-4,7,10-триокса-13-тридеканаминсукциниминовую кислоту. Модификации дополнительно могут включать в себя одну, две, три или более дополнительных аминокислот. Типы модификаций, рассматриваемых в данной области, будут понятны специалисту в данной области исходя из примеров, приведенных далее в настоящей заявке.
В одном аспекте петлевой фрагмент определен как участок, находящийся на N-конце, содержащий по меньшей мере от 5 до 8 аминокислот, где первая и последняя аминокислоты способны образовывать связь, например, остатки в положениях 2-7 амилина или остатки в положениях 1-7 кальцитонина и соответствующие им участки соответствующих аналогов. В другом аспекте α-спиральный участок определен как внутренняя часть амилина или кальцитонина, фланкированная петлевым фрагментом, и С-концевой хвост, который структурно образует α-спираль, например, остатки в положениях 8-23 амилина или остатки в положениях 8-27 кальцитонина и соответствующие им участки соответствующих аналогов. Еще в одном аспекте, С-концевой хвост определен как участок после α-спирали, например, остатки в положениях 33-37 амилина или более длинный, например, остатки в положениях 27-37 или остатки в положениях с 27 или 28 по 32 кальцитонина. Включенные в соединения по данному изобретению представляют собой как амидные, так и кислотные формы описанных соединений.
Амилин и кальцитонин, определенные здесь, включают в себя все природные и видовые варианты. Примеры амилина и кальцитонина включают в себя, но не только:
амилин человека (hАмилин) KCNTATCATQRLANFLVHSSNNFGAILSSTNVGSNTY (SEQ ID NO: 1)
амилин крыс (rАмилин) KCNTATCATQRLANFLVRSSNNLGPVLPPTNVGSNTY (SEQ ID NO: 2)
кальцитонин лосося (sCT) CSNLSTCVLGKLSQELHKLQTYPRTNTGSGTP(SEQ ID NO: 3)
кальцитонин человека (hCT) CGNLSTCMLGTYTQDFNKFHTFPQTAIGVGAP (SEQ ID NO: 4).
Под «аминокислотой» и «аминокислотным остатком» подразумевают природные аминокислоты, неприродные аминокислоты и модифицированные аминокислоты. Не утверждая обратное, любая ссылка на аминокислоту в общем виде или на конкретное название включает в себя ссылку как на D, так и на L стереоизомеры, если их структура допускает такие стереоизомерные формы. Природные аминокислоты включают в себя аланин (Ala), аргинин (Arg), аспарагин (Asn), аспарагиновую кислоту (Asp), цистеин (Cys), глутамин (Gin), глутаминовую кислоту (Glu), глицин (Gly), гистидин (His), изолейцин (Ile), лейцин (Leu), лизин (Lys), метионин (Met), фенилаланин (Phe), пролин (Pro), серин (Ser), треонин (Thr), триптофан (Trp), тирозин (Tyr) и валин (Val). Неприродные аминокислоты включают в себя, но не только, гомолизин, гомоаргинин, гомосерин азетидинкарбоновую кислоту, 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, бета-аланин, аминопропионовую кислоту, 2-аминомасляную кислоту, 4-аминомасляную кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, третичный бутилглицин, 2,4-диаминоизомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, алло-гидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, алло-изолейцин, N-метилаланин, N-метилглицин, N-метилизолейцин, N-метилпентилглицин, N-метилвалин, нафталанин, норвалин, норлейцин, орнитин, пентилглицин, пипеколиновую кислоту и тиопролин. Дополнительные неприродные аминокислоты включают в себя модифицированные аминокислотные остатки, которые химически блокированы, обратимо или необратимо, или химически модифицированы по N-концевой аминогруппе или их боковым цепям, как, например, N-метилированные D и L аминокислоты или остатки, где фунциональные группы боковых цепей химически модифицированы в другую функциональную группу. Например, модифицированные аминокислоты включают в себя метионин сульфоксид; метионин сульфон; (сложный бета-метиловый эфир) аспарагиновой кислоты, модифицированные аминокислоты аспарагиновой кислоты; N-этилглицин, модифицированную аминокислоту глицин; или аланин карбоксамид, модифицированную аминокислоту аланина. Дополнительные остатки, которые могут быть включены, описаны в публикации Sandberg et al., J. Med. Chem. 41: 2481-91, 1998.
В общем аспекте соединения данного изобретения содержат, по меньшей мере, петлевой фрагмент, α-спиральный участок и С-концевой хвост. Петлевой фрагмент содержит аминокислотную последовательность, включающую в себя формулу Х-Хаа1 последовательность-Y, где Х и Y способны образовать связь и представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи, такой как дисульфидные связи; амидная связь; алкиловые кислоты и алкиламины, которые могут образовывать циклические лактамы; алкилальдегиды или алкилгалиды и алкиламины, которые могут быть конденсированы и восстановлены с образованием алкиламинового или иминового мостика; или боковые цепи, которые могут быть соединены с образованием алкильной, алкенильной, алкинильной, эфирной или тиоэфирной связи. Алкильные цепи могут включать в себя низшие алкильные группы, имеющие примерно от 1 примерно до 6 атомов углерода. В некоторых вариантах осуществления внутримолекулярная связь может представлять собой дисульфидную, амидную, иминную, аминную и алкенную связь. В некоторых вариантах осуществления, Х и Y независимо выбраны из Ser, Asp, Glu, Lys, Orn или Cys. В некоторых вариантах осуществления, Х и Y представляют собой Cys и Cys. В других вариантах осуществления, Х и Y представляют собой Ser и Ser. В других вариантах осуществления Х и Y представляют собой Asp и Lys или Lys и Asp.
Последовательность Xaa1 включает в себя аминокислотную последовательность 3, 4, 5 или 6 аминокислот между Х и Y. В некоторых вариантах осуществления последовательность Xaa1 включает в себя аминокислотную последовательность, имеющую участок с одним или несколькими замещенными или незамещенными остатками, содержащими гидроксил, после Y, например, участок с гидроксилсодержащим остатком может иметь, по меньшей мере, 2 из 3 аминокислот, смежных с Y, которые представляют собой либо Ser, либо Thr. Другие аминокислоты в последовательности Xaa1 могут представлять собой любую аминокислоту. В некоторых вариантах осуществления последовательность Xaa1 представляет собой 3 аминокислоты. В других вариантах осуществления последовательность Xaa1 представляет собой 4 аминокислоты. В других вариантах осуществления последовательность Xaa1 представляет собой 5 аминокислот. Еще в других вариантах осуществления последовательность Xaa1 представляет собой 6 аминокислот. Соответственно Xaa1 может быть представлена в виде Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7 (SEQ ID NO: 5). В некоторых вариантах осуществления, Хаа2, Хаа3 и/или Хаа4 могут отсутствовать. В некоторых вариантах осуществления Хаа5, Хаа6 и Хаа7 включают в себя участок с гидроксилсодержащим остатком. По существу, по меньшей мере две из трех аминокислот могут представлять собой Ser, hSer, Thr, аллоТhr, d-Thr или другие их неприродные аналоги. Хаа2 может представлять собой любую аминокислоту или отсутствовать, Хаа3 может представлять собой любую аминокислоту или отсутствовать, Хаа4 может представлять собой любую аминокислоту или отсутствовать, Хаа5 может представлять собой любую аминокислоту, если Хаа6 представляет собой Ser или Thr, a Хаа7 представляет собой Ser или Thr, Хаа6 может представлять собой любую аминокислоту, если Хаа5 представляет собой Ser или Thr, a Хаа7 представляет собой Ser или Thr, Хаа7 может представлять собой любую аминокислоту, если Хаа5 представляет собой Ser или Thr, а Хаа6 представляет собой Ser или Thr. Соответственно в определенном варианте осуществления Xaa1 может быть представлен в виде: Хаа2 отсутствует, Хаа3 предствляет собой Ala, Gly, Ser, Asp или отсутствует, Хаа4 представляет собой Asn, Ala, Asp, Gly или отсутствует; Хаа5 представляет собой Ala, Leu, Thr или Ser; Хаа6 представляет собой Ala, Ser или Thr; a Хаа7 представляет собой Ala, Ser, Val, Hse, (S)-2-амино-3-гидрокси-метилбутановую кислоту (Ahb), (2S, 3R)-2-амино-3-гидрокси-метилпентановую кислоту (Ahp), D-Thr, Thr или их производные. В других вариантах осуществления Xaa1 может быть представлен в виде: Хаа2 отсутствует, Хаа3 представляет собой Ser, Gly или отсутствует, Хаа4 представляет собой Asn или Asp, Хаа5 представляет собой Ala, Ser, Thr или Leu, Хаа6 представляет собой Ala, Thr или Ser, a Хаа7 представляет собой Ser, D-Thr, аллоТhr или Thr. В некоторых вариантах осуществления, петлевой фрагмент включает в себя вышеуказанные описания Xaa1, где Хаа3 представляет собой Ala, где Хаа3 представляет собой Ser, или где Хаа3 представляет собой Gly. Альтернативно или дополнительно петлевой фрагмент включает в себя описанные выше обозначения Xaa1, где Хаа4 представляет собой Ala, где Хаа4 представляет собой Asn, где Хаа4 представляет собой Asp, или где Хаа4 представляет собой Gly. Альтернативно или дополнительно петлевой фрагмент включает в себя описанные выше обозначения Xaa1, где Хаа5 представляет собой Ala, где Хаа5 представляет собой Thr, или где Хаа5 представляет собой Leu. Альтернативно или дополнительно, петлевой фрагмент включает в себя описанные выше обозначения Xaa1, где Хаа6 представляет собой Ser или где Хаа6 представляет собой Ala. Альтернативно или дополнительно петлевой фрагмент включает в себя описанные выше обозначения Xaa1, где Хаа7 представляет собой Thr, или где Хаа7 представляет собой D-Thr. Дополнительно предполагается, что не более одной, двух или трех модификаций, таких как замены, вставки, делеции и/или получение производных, могут быть сделаны в отношении петлевого фрагмента.
Следует отметить, что по всей заявке альтернативы написаны в группах Маркуша, например, каждое положение аминокислоты, которое содержит больше одной возможной аминокислоты. В частности, предполагается, что каждый член группы Маркуша следует рассматривать отдельно, тем самым включая другой вариант осуществления изобретения, и группу Маркуша не следует принимать за одну единицу.
Примеры петлевого участка по данному изобретению включают в себя, но не только, C-N-T-A-T-C (SEQ ID NO: 6); С-А-Т-А-Т-С (SEQ ID NO: 7); C-D-T-A-T-C (SEQ ID NO: 8); C-G-T-A-T-C (SEQ ID NO: 9); C-N-A-A-T-C (SEQ ID NO: 10); C-N-T-S-T-C (SEQ ID NO: 11); C-N-T-A-dThr-C (SEQ ID NO: 12); C-N-T-A-T(OPO3H2)-С (SEQ ID NO: 13); C-N-T-A-S-C (SEQ ID NO: 14); C-N-T-A-A-C (SEQ ID NO: 15); C-N-T-A-V-C (SEQ ID NO: 16); C-N-T-A-Hse-C (SEQ ID NO: 17); C-N-T-A-Ahb-C (SEQ ID NO: 18); C-N-T-A-Ahp-C (SEQ ID NO: 19); C-S-N-L-S-T-C (SEQ ID NO: 20); C-G-N-L-S-T-C (SEQ ID NO: 21); C-A-N-L-S-T-C (SEQ ID NO: 22); C-S-A-L-S-T-C (SEQ ID NO: 23); C-S-N-A-S-T-C (SEQ ID NO: 24); C-S-N-L-A-T-C (SEQ ID NO: 25); и C-S-N-L-S-A-C (SEQ ID NO: 26). Как отмечалось ранее, дополнительно предполагается, что не более одной, двух или трех модификаций, таких как замены, вставки, делеции и/или получение производных, может быть сделано в отношении петлевого участка.
Петлевой участок новых соединений дополнительно может включать в себя модификации или добавочные аминокислоты на N-конце. Такие модификации включают в себя добавление таких соединений, как Lys, Ala, Phe, lie, Ser, октилглицин, изокап, Fmoc-3,6-диоксиоктановая кислота, Fmoc-1-амино-4,7,10-триокса-13-тридеканаминсукциниминовая кислота, ацетил и/или группы для растворимости, доставки, передачи сигнала. Примеры модифицированных петель включают в себя добавление Lys к последовательности Xaa1, или добавление Ilе к последовательности Xaa1. Например, модифицированный петлевой фрагмент может представлять собой K-C-N-T-A-T-C (SEQ ID NO: 27). В некоторых вариантах осуществления добавления и/или модификации на N-конце петлевого фрагмента могут изменять петлевой фрагмент. Например, петлевой фрагмент по данному изобретению может быть модифицирован следующим образом: цикло(2,7) 1-7 hАмилин, цикло (2Asp 7Lys) 1-7 hАмилин, N-изокапроил 1-7 hАмилин, N-3,6 диоксаоктаноил 1-7 hАмилин, L-Октилглицин 1-7 hАмилин, Ацетил (2Agy, 7Agy) 1-7 hАмилин, где Agy представляет собой аллилглицин, Ацетил (1Ala) 1-7 hАмилин, (lThr 3Asp) 1-7 hАмилин, Изокап (7Ala) 5-7 sCT, ацетил (2Agy, 7Agy) 1-7 sCT и цикло (1,7) (1Asp 7Lys) 1-7 sCT. Следовательно, беря в пример Isocap (7Ala) 5-7 sCT, отдельные варианты осуществления данного изобретения включают в себя модификацию на N-концевом участке петлевого фрагмента данного изобретения, так, что аминокислоты с Хаа2 по Хаа5 отсутствуют.
По всей заявке аминокислотные последовательности могут быть названы аминокислотами в положении от а до положения b, примыкающими к эталонному пептиду. В настоящей заявке эталонным пептидом является амилин и кальцитонин, последовательности которых приведены в SEQ ID NOS:1-4, например, в предыдущем абзаце, 1-7 hАмилин относится к аминокислотной последовательности от положения 1 до положения 7, включительно, амилина человека (SEQ ID NO: 1). Модификации в отношении эталонного пептида могут быть показаны как: положение модификации вместе с модификацией. Например (2Asp 7Lys) 1-7 hАмилин представляет аминокислотную последовательность в положениях 1-7 амилина человека с изменением Cys на Asp в положении 2 и изменением а Суs на Lys в положении 7.
α-спиральный участок нового соединения может быть длиной примерно от 8 до 23 аминокислот. В некоторых вариантах осуществления α-петлевой участок содержит примерно от 3 до 6 витков спирали. В некоторых вариантах осуществления α-спиральный участок содержит 3, 4, 5 или 6 витков спирали. В других вариантах осуществления α- спиральный участок представляет собой жесткую структуру, эквивалентную примерно 3, 4, 5 или 6 виткам спирали. Примером идеальной спирали является LLQQLQKLLQKLKQY (SEQ ID NO: 28). В некоторых вариантах осуществления α-спираль представляет собой амфипатическую структуру. Соответственно могут быть выбраны свойства желаемых аминокислот, которые бы обеспечил данный тип структуры.
Было обнаружено, что α-спиральный участок кальцитонина, комбинация α-спирального участка амилина и кальцитонина или их частей, и/или некоторых элементов CGRP целесообразны в α-спиральном участке новых соединений. Предполагается, что, как и в случае петлевого фрагмента, α-спиральный участок может быть из любого амилина или кальцитонина или их аналогов. Соответственно в некоторых вариантах осуществления α-спиральный участок представляет собой, по меньшей мере, часть α-спирального участка кальцитонина или аналога кальцитонина. В других вариантах осуществления α-спиральный участок представляет собой по меньшей мере часть α-спирального участка кальцитонина или аналога кальцитонина и, по меньшей мере, часть α- спирали амилина или аналога амилина. В других вариантах осуществления α-спиральный участок новых соединений содержит элементы CGRP. Также предполагается, что новые соединения могут иметь не более одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти дополнительных модификаций, таких как замены, вставки, делеции и/или получение производных.
В некоторых вариантах осуществления α-спиральный участок по данному изобретению может содержать аминокислоты от положения 8 sCT до положения 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 sCT. Кроме того, α-спиральный участок может содержать более одной части α- спирального участка кальцитонина или аналога кальцитонина одного и того же или различных видов, например, 8-21 sCT 19-27 sCT; 8-21 sCT 18-27 sCT; или 8-16 hCT 17-27 sCT; или (11Arg) 8-16 hCT (18Arg) 17-27 sCT. Альтернативно, или дополнительно, описанная выше α-спираль от 8-18 sCT до 8-27 sCT может дополнительно содержать замены одного или нескольких из (10Aib), (11Arg), (11Orn), (11hArg), (11Cit), (11hLys), (11Lys(for)), (17Aib), (18Arg), (18Orn), (18hArg), (18Cit), (18hLys), (18Lys(for)), (18Lys(PEG5000)), (22Leu), (24Pro) или их комбинаций.
В одном варианте осуществления α-спиральный участок по данному изобретению может быть представлен в виде (α-спиральный участок тип I) R1-VL Xaa10 Xaa11 LSQ Xaa15 L Хаа17 Хаа18 LQT Xaa22 P Xaa24 TNT-R1 (SEQ ID NO: 29), где
Xaa10 представляет собой Gly или Aib;
Xaa11 представляет собой Lys, Arg, Orn, hArg, Cit, hLys или Lys(for);
Xaa15 представляет собой Glu или Phe;
Хаа17 представляет собой His или Aib;
Хаа18 представляет собой Lys, Arg, Orn, hArg, Cit, hLys, Lys(for), Lys(PEG 5000);
Xaa22 представляет собой Try или Leu;
Хаа24 представляет собой Arg или Pro; или
R1 представляет, отсутствует или содержит 1-4 дополнительных аминокислот.
Еще раз следует напомнить, что каждый член группы Маркуша, или их комбинация, представляет собой другой вариант осуществления изобретения и не должен рассматриваться как одна единица. Существует быстрый способ точно определить, в качестве примера, варианты осуществления данного изобретения включают в себя формулу α- спирального участка типа I, где Хаа18 может представлять собой Lys, Arg, Orn, hArg, Cit, hLys или Lys(for), и каждый вариант является отдельным вариантом осуществления данного изобретения. Соответственно формула α-спирального участка I типа имеет один вариант осуществления, где Хаа18 представляет собой Lys. Она имеет другой вариант осуществления, где Хаа18 представляет собой Arg, и так далее. Дополнительно предполагается, что α-спиральный участок может содержать не более одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти модификаций, таких как замены, вставки, делеции и/или получение производных. Соответственно соединения α-спирального участка I типа могут иметь дополнительные делеции на С-конце. В некоторых вариантах осуществления аминокислоты R1 способны образовывать виток α-спирали.
Примеры α-спирального участка I типа по данному изобретению включают в себя, но не только 8-18 sCT, 8-21 sCT, 8-24 sCT, 8-27 sCT, (11Arg) 8-18 sCT, (18Arg) 8-18 sCT, (11Arg 18Arg) 8-18 sCT, (11Orn 18rn) 8-18 sCT, (11Arg 18Cit) 8-18 sCT, (11Arg 18hArg) 8-18 sCT, (11Arg 18Orn) 8-18 sCT, (11Cit 18Arg) 8-18 sCT, (11Cit 18Cit) 8-18 sCT, (11hLys 18hLys) 8-18 sCT, (10Aib 11Arg 17Aib 18Arg) 8-18 sCT, (11Lys(for) 18Lys(for)) 8-18 sCT, (10Aib 11Lys(for) 17Aib 18Lys(for)) 8-18 sCT, (11Arg 18Lys(PEG 5000)) 8-18 sCT, (11Arg) 8-21 sCT, (18Arg) 8-21 sCT, (11Arg 18Arg) 8-21 sCT, (11Orn 18Orn) 8-21 sCT, (11Arg 18Cit) 8-21 sCT, (11hArg 18hArg) 8-21 sCT, (11Arg 18Orn) 8-21 sCT, (11Cit 18Arg) 8-21 sCT, (11Cit 18Cit) 8-21 sCT, (11hLys 18hLys) 8-21 sCT, (10Aib 11Arg 17Aib 18Arg) 8-21 sCT, (11Lys(for) 18Lys(for)) 8-21 sCT, (10Aib 11Lys(for) 17Aib 18Lys(for)) 8-21 sCT, (11Arg 18Lys(PEG 5000)) 8-21 sCT, (11Arg) 8-24 sCT, (18Arg) 8-24 sCT, (11Arg 18Arg) 8-24 sCT, (11Arg 18Arg 22Leu) 8-24 sCT, (11Arg 18Arg 24Pro) 8-24 sCT, (11Orn 18Orn) 8-24 sCT, (11Arg 18Cit) 8-24 sCT, (11hArg 18hArg) 8-24 sCT, (11Arg 18Orn) 8-24 sCT, (11Cit 18Arg) 8-24 sCT, (11Cit 18Cit) 8-24 sCT, (11hLys 18hLys) 8-24 sCT, (10Aib 11Arg 17Aib 18Arg) 8-24 sCT, (11Lys(for) 18Lys(for)) 8-24 sCT, (10Aib 11Lys(for) 17Aib 18Lys(for)) 8-24 sCT, (11Arg 18Lys(PEG 5000)) 8-24 sCT, (11Arg) 8-27 sCT, (18Arg) 8-27 sCT, (11Arg 18Arg) 8-27 sCT, (11Arg 18Arg 22Leu) 8-27 sCT, (11Arg 18Arg 24Pro) 8-27 sCT, (11Orn 18Orn) 8-27 sCT, (11Arg 18Cit) 8-27 sCT, (11hArg 18hArg) 8-27 sCT, (11Arg 18Orn) 8-27 sCT, (11Cit 18Arg) 8-27 sCT, (11Cit 18Cit) 8-27 sCT, (11hLys 18hLys) 8-27 sCT, (10Aib 11Arg 17Aib 18Arg) 8-27 sCT, (11Lys(for) 18Lys(for)) 8-27 sCT, (10Aib 11Lys(for) 17Aib 18Lys(for)) 8-27 sCT, (11Arg 18Lys(PEG 5000)) 8-27 sCT, (11Arg 18Arg) 8-21 sCT-19-27 sCT и (11Arg 18Arg) 8-21 sCT-(18Leu) 18-27 sCT.
В некоторых вариантах осуществления α-спиральный участок по данному изобретению может включать в себя часть α-спирального участка амилина или аналога амилина и часть α-спирального участка кальцитонина или аналога кальцитонина. α-спиральный участок по данному изобретению может включать в себя аминокислоты от положения 8 hАмилина до 11, 12, 13, 14, 15, 16, 17, 18 или 19 hАмилина и аминокислоты от положения 13, 14, 15, 16, 17, 18 и 19 sCT до положения 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 sCT. Альтернативно или дополнительно, описанный выше α-спиральный участок амилина или кальцитонина может дополнительно содержать замены одного или нескольких из (8Val), (9Leu), (9Met), (10Gly), (10His), (12Thr), (13Thr), (13Asn), (13Phe), (13Tyr), (14Arg), (14Ala), (14Asp), (14Glu), (14Gln), (14Thr), (14Gly), (15Leu), (15Ser), (15Glu), (15Ala), (15Tyr), (16Asp), (17Ser), (17Phe), (18Arg), (17Aib), (18Arg), (18Orn), (18hArg), (18Cit), (18hLys), (18Lys(for)), (18Lys(PEG5000)), (19Phe), (20His), (21Asn), (22Met), (22Val), (22Phe), (22Leu), (24Pro) или любых их комбинаций. В некоторых вариантах осуществления количество аминокислот в α-спиральном участке по данному изобретению составляет, по меньшей мере, 10 аминокислот. В других вариантах осуществления количество аминокислот в α-спиральном участке по данному изобретению составляет 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23. В других вариантах осуществления количество аминокислот в α-спиральном участке по данному изобретению составляет 24 или более.
В одном варианте осуществления α-спиральный участок данного изобретения может быть представлен в виде (α-спиральный участок типа II) R1 - Хаа8 Хаа9 Xaa10 R Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Р Хаа24 TNT - R1 (SEQ ID NO: 30), где
Хаа8 представляет собой Ala или Val;
Хаа9 представляет собой Thr, Met или Leu;
Xaa10 представляет собой Gln, Gly, His;
Хаа12 представляет собой Leu или Thr;
Хаа13 представляет собой Ala, Thr, Asn, Phe, Tyr, Ser или Thr;
Хаа14 представляет собой Asn, Arg, Ala, Asp, Glu, Gin, Thr или Gly;
Хаа15 представляет собой Phe, Leu, Ser, Glu, Ala, Asp или Tyr;
Хаа16 представляет собой Leu или Asp;
Хаа17 представляет собой Val, His, Ser, Phe или Aib;
Хаа18 представляет собой His, Arg, Lys, Orn, hArg, Cit, hLys, Lys(for) или Lys(PEG5000);
Хаа19 представляет собой Leu, Ser или Phe;
Хаа20 представляет собой Gln или His;
Хаа21 представляет собой Thr или Asn;
Хаа22 представляет собой Tyr, Val, Phe, Leu или Met;
Хаа24 представляет собой Arg или Pro; и
R1 отсутствует или содержит 1-4 дополнительных аминокислот.
Еще раз следует напомнить, что каждый член в группе Маркуша или их комбинация представляют собой другой вариант осуществления изобретения и не должен рассматриваться как одна единица. Также предполагается, что α-спиральный участок может содержать не более одной, двух, трех, четырех, пяти, шести семи, восьми, девяти или десяти модификаций, таких как замены, вставки, делеции и/или получение производных соединений, описанных здесь. Например, в некоторых вариантах осуществления соединения α-спирального участка II типа могут иметь делеции на С-конце, что приводит к делеции положений 27, 26, 25, 24 или 22. В других вариантах осуществления, однако, делеции не удаляют аминокислоты положений 19, 20, 21 или 22.
Примеры α-спирального участка II типа включают в себя, но не только (8Val 9Leu 10Gly) 11-15 hАмилин 16-27 sCT, (8Val 9Leu 10Gly) 11-15 hАмилин (18Arg) 16-27 sCT, 8-12 hАмилин (18Arg) 13-27 sCT, 8-18 hАмилин 19-23 sCT, 8-18 hАмилин 19-27 sCT, (15Glu 18Arg) 8-18 hАмилин 19-24 sCT, (14Arg 15Ser) 8-18 hАмилин 19-22 sCT (13Ala 14Ala 15Ala) 8-18 hАмилин 19-27 sCT, (13Ala 14Asp 15Ala) 8-18 hАмилин 19-22 sCT, (13Ala 14Asp) 8-18 hАмилин 19-23 sCT, (13Ala 14Asp) 8-18 hАмилин 19-27 sCT, (13Ala 14Ala) 8-18 hАмилин 19-22 sCT (13Ala 14Glu) 8-18 hАмилин 19-22 sCT, (13Thr 14Asp 15Tyr) 8-18 hАмилин 19-22 sCT, (13Ala 14Gln) 8-18 hАмилин 19-22 sCT, (13Asn 14Glu 15Tyr) 8-18 hАмилин 19-27 sCT, (13Phe 14Asp) 8-18 hАмилин 19-27 sCT, (13Ala 14Asp) 8-18 hАмилин (15Glu 18Arg) 8-18 hАмилин 19-24 sCT, (19Phe 22Phe) 19-27 sCT, (13Ala 14Asp) 8-18 hАмилин (19Phe 20His 22Phe) 19-27 sCT, (13Ala 14Asp) 8-18 hАмилин (19Phe 22Phe) 19-27 sCT, (9Thr 10His) 8-18 hАмилин 19-22 sCT, (9Thr 10His 14Gly 15Leu 17Ser 18Arg) 8-19 hАмилин 20-23 sCT, 8-18 hАмилин (2lAsn 22Phe 23Val) 19-23 sCT, 8-18 hАмилин (22Met) 19-27 sCT, 8-18 hАмилин (22Val) 19-27 sCT, (9Met 12Thr 13Tyr 14Thr 15Glu 16Asp 17Phe) 8-17 hАмилин (18Arg) 18-20 sCT). В других вариантах осуществления новые соединения включают в себя варианты соединений, приведенных выше в качестве примера, с α-спиралью, заканчивающейся соответственно в положениях 22, 23, 24, 25, 26 или 27 sCT. Другими словами, соединение 8-18 hАмилин 19-24 sCT также является отдельно описанным, поскольку это соединение представляет собой всего лишь 8-18 hАмилин 19-27 sCT, описанное выше, усеченное до положения 24. В качестве другого примера соединение (13А1а 14Asp 15Ala) 8-18 hАмилин 19-23 является отдельно описанным, поскольку вышеупомянутая формулировка применяется к (13А1а 14Asp 15Ala) 8-18 hАмилин 19-22.
В некоторых вариантах осуществления С-концевой хвост в соответствии с данным изобретением содержит аминокислоты от положения 27, 28, 29, 30, 31, 32, или 33 до положения 36 или 37 hАмилина. В других вариантах осуществления С-концевой хвост содержит аминокислоты от положения 27 или 28 до положения 32 sCT; однако, когда петлевой фрагмент является фрагментом кальцитонина или аналога кальцитонина, а α-спиральный участок представляет собой участок кальцитонина или аналога кальцитонина, последнее положение С-концевого хвоста не представляет собой Pro, Hyp, гомоСерин (Hse) или производные Hse. Альтернативно или дополнительно, описанная выше α спираль амилина или кальцитонина может дополнительно содержать замены одного или более из (27Tyr) hАмилина, (29Arg) hАмилина, (32Val) hАмилина, (32Thr) hАмилина, (34Glu) hАмилина, (35Lys) hАмилина, (36Phe) hАмилина, (36Ala) hАмилина, (37Phe) hАмилина, (30Asn) sCT, (32 Tyr) sCT, или любой их комбинации.
В одном варианте осуществления С-концевой хвост в соответствии с данным изобретением может быть представлен в виде Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 Хаа33 G Хаа35 Хаа36 Хаа37 Хаа38 (SEQ ID NO: 31), где
Хаа28 представляет собой Lys, Tyr или отсутствует;
Хаа29 представляет собой Ser, Pro или отсутствует;
Хаа30 представляет собой Ser, Pro Arg, или отсутствует;
Хаа31 представляет собой Thr или отсутствует;
Хаа32 представляет собой Asn или отсутствует;
Хаа33 представляет собой Val, Thr или отсутствует;
Хаа35 представляет собой Ser, Glu
Хаа36 представляет собой Asn, Lys или Gly;
Хаа37 представляет собой Thr, Phe или Ala;
Хаа38 представляет собой Tyr, Phe, Pro или отсутствует;
при условии, что когда петлевой фрагмент происходит из кальцитонина или аналога кальцитонина, а α-спиральный участок происходит из кальцитонина или аналога кальцитонина, последнее положение С-концевого хвоста не представляет собой Pro, Hyp, гомоСерин (Hse) или производные Hse.
Еще раз следует напомнить, что каждый член группы Маркуша или их комбинация представляет собой другой вариант осуществления изобретения и не должен рассматриваться как одна единица. Дополнительно предполагается, что С-концевой хвост может содержать не более одной, двух или трех модификаций, таких как замены, вставки, делеции и/или получение производных соединений, описанных в предыдущих абзацах.
Примеры С-концевого хвоста в соответствии с данным изобретением включают в себя, но не только, 27-37 rАмилин, (27Tyr 29Arg 32Thr) 27-37 rАмилин, (29Arg 32Thr) 28-37 rАмилин, 30-37 hАмилин, (32Thr) 30-37 hАмилин, (35Lys 36Ala 37Phe) 30-37 hАмилин, 30-36 hАмилин, (32Val) 30-36 hАмилин, (34Glu 36Phe) 30-36 hАмилин, 31-37 hАмилин, 31-36 hАмилин, 33-36 hАмилин, 33-7 hАмилин, 28-32 sCT, (30Asn 32Tyr) 28-32 sCT и 27-32 sCT. В других вариантах осуществления С-концевой хвост содержит аминокислотную последовательность KSNPVPTN (SEQ ID NO: 32) или SNFVPTNV (SEQ ID NO: 33).
Дополнительно предполагается, что не более одной, двух или трех модификаций, таких как замены, вставки, делеции и/или получение производных может быть сделано в С-концевом хвосте в соответствии с данным изобретением, как описано в предыдущих абзацах. С-концевой хвост новых соединений может дополнительно содержать модификации или дополнительные аминокислоты на С-конце. Такие модификации включают в себя добавление соединений, таких как Lys, вплоть до 4 Lys, L-октилглицин, 4ABU (4-аминомасляная кислота), 9Anc (9-аминонаноевая кислота) и/или групп для растворимости, стабильности или доставки. Примеры включают в себя 33-37 hАмилин L-октилглицин, 33-37 hАмилин 4ABU и 33-37 hАмилин 9Anc.
В общем аспекте соединения по данному изобретению включают в себя
(a) любой петлевой фрагмент по данному изобретению;
(b) любой α-спиральный участок по данному изобретению; и
(c) любой С-концевой хвост в соответствии с данным изобретением, при условии, что когда петлевой фрагмент происходит из кальцитонина или аналога кальцитонина, а α-спиральный участок - из кальцитонина или аналога кальцитонина, последнее положение С-концевого хвоста не представляет собой Pro, Hyp, гомоСерин (Hse) или производные Hse.
В другом общем аспекте соединения по данному изобретению содержат
(a) петлевой фрагмент, содержащий Xaa1 или Xaa1 с модификациями на N-конце;
(b) α-спиральный участок, содержащий α-спиральный участок типа I или типа II;
(c) С-концевой хвост, представленный последовательностью SEQ ID NO: 31, при условии, что когда петлевой фрагмент происходит из кальцитонина или аналога кальцитонина, а α спиральный участок - из кальцитонина или аналога кальцитонина, последнее положение С-концевого хвоста не представляет собой Pro, Hyp, гомоСерин (Hse) или производные Hse. С-конец может содержать дополнительные модификации.
Еще в одном аспекте соединения по данному изобретению содержат аминокислотную последовательность формулы I Xaa1 X Хаа3 Хаа4 Хаа5 Хаа6 Y Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 (SEQ ID NO: 34), где Xaa1 представляет собой А, С, hC, D, E, F, I, L, К, hK, R, hR, S, Hse (гомоSER), Т, G, Q, N, M, Y, W, Р, Hyp (гидроксипролин), H, V или отсутствует;
Хаа3 представляет собой А, D, E, N, Q, G, V, R, К, hK, hR, H, I, L, M, или отсутствует;
Хаа4 представляет собой А, I, L, S, Hse, Т, V, M, или отсутствует;
Хаа5 представляет собой А, S, Т, Hse, Y, V, I, L или M;
Хаа6 представляет собой Т, А, S, Hse, Y, V, I, L или M;
Хаа8 представляет собой А, V, I, L, F или M;
Хаа9 представляет собой L, Т, S, Hse, V, I или M;
Хаа10 представляет собой G, H, Q, К, R, N, hK или hR;
Xaa11 представляет собой К, R, Q, N, hK, hR или H;
Хаа12 представляет собой L, I, V, F, M, W или Y;
Хаа13 представляет собой А, F, Y, N, Q, S, Hse или Т;
Хаа14 представляет собой А, D, E, G, N, К, Q, R, H, hR или hK;
Хаа15 представляет собой А, D, E, F, L, S, Y, I, V или M;
Хаа16 представляет собой L, F, M, V, Y или I;
Хаа17 представляет собой H, Q, N, S, Hse, Т или V;
Хаа18 представляет собой К, hK, R, hR, H, u (Cit) или n (Orn);
Хаа19 представляет собой F, L, S, Hse, V, I, Т или отсутствует;
Хаа20 представляет собой H, R, К, hR, hK, N, Q или отсутствует;
Хаа21 представляет собой Т, S, Hse, V, I, L, Q, N или отсутствует;
Хаа22 представляет собой F, L, M, V, Y или I;
Хаа23 представляет собой Р или Hyp;
Хаа24 представляет собой Р, Hyp, R, К, hR, hK или H;
Хаа25 представляет собой Т, S, Hse, V, I, L, F или Y;
Хаа26 представляет собой N, Q, D или E;
Хаа27 представляет собой Т, V, S, F, I или L;
Хаа28 представляет собой G или А;
Хаа29 представляет собой S, Hse, Т, V, I, L или Y;
Хаа30 представляет собой Е, G, К, N, D, R, hR, hK, H или Q;
Хаа31 представляет собой А, Т, S, Hse, V, I, L, F или Y; или
Хаа32 представляет собой F, Р, Y, Hse, S, Т или Hyp;
где Х и Y способны образовать связь и представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярных связей, таких как дисульфидные связи; амидная связь; алкильные кислоты или алкиламины, которые могут образовывать циклические лактамы; алкилальдегиды или алкилгалиды и алкиламины, которые могут конденсироваться и быть восстановленными с образованием алкиламинового или иминового мостика; или боковые цепи которых могут быть соединены с образованием алкильной, алкенильной, алкинильной, эфирной или тиоэфирной связи. Алкильные цепи могут включать в себя алкильные группы, имеющие примерно от 1 примерно до 6 атомов углерода. В некоторых вариантах осуществления внутримолекулярная связь может быть дисульфидной, амидной, иминной, аминной, алкильной и алкенной связью. В некоторых вариантах осуществления Х и Y независимо выбраны из Ser, Asp, Glu, Lys, Orn или Cys. В некоторых вариантах осуществления, Х и Y представляют собой Cys и Cys. В других вариантах осуществления Х и Y представляют собой Ser и Ser. В других вариантах осуществления Х и Y представляют собой Asp и Lys или Lys и Asp.
Еще в одном аспекте соединения по данному изобретению содержат аминокислотную последовательность формулы II: Xaa1 Xaa2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Хаа8 Хаа9 Xaa10 Xaa11 Xaa12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Xaa25 Xaa26 Xaa27 Xaa28 Хаа29 Хаа30 Хаа31 Хаа32 (SEQ ID NO: 35), где
Xaa1 представляет собой А, С, D, F, I, К, S, Т или отсутствует;
Хаа2 представляет собой С, D, S или отсутствует;
Хаа3 представляет собой А, D, N или отсутствует;
Хаа4 представляет собой A, L, Т или отсутствует;
Хаа5 представляет собой А или S;
Хаа6 представляет собой Т, А, S или V;
Хаа7 представляет собой С, К или А;
Хаа8 представляет собой А, V, L или М;
Хаа9 представляет собой L или Т;
Хаа10 представляет собой G, Н или Q;
Xaa11 представляет собой К, R, Q или hArg;
Хаа12 представляет собой L, W или Y;
Хаа13 представляет собой A, F, N, Q, S или Т;
Хаа14 представляет собой А, D, Е, G, N, К, Q или R;
Хаа15 представляет собой А, D, Е, F, L, S или Y;
Хаа16 представляет собой L или F;
Хаа17 представляет собой Н, Q, S или V;
Хаа18 представляет собой К, R, hArg, u (Cit) или n (Orn);
Хаа19 представляет собой F, L, S или отсутствует;
Хаа20 представляет собой Н, Q или отсутствует;
Хаа21 представляет собой Т, N или отсутствует;
Хаа22 представляет собой F, L, М, V или Y;
Хаа23 представляет собой Р;
Хаа24 представляет собой Р или R;
Хаа25 представляет собой Т;
Хаа26 представляет собой N;
Хаа27 представляет собой Т или V;
Хаа28 представляет собой G;
Хаа29 представляет собой S;
Хаа30 представляет собой Е, G, К или N;
Хаа31 представляет собой А или Т; и
Хаа32 представляет собой F, Р или Y.
Еще в одном аспекте соединения по данному изобретению содержат аминокислотную последовательность формулы III; Xaa1 Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Хаа8 Хаа9 Хаа10 Xaa11 Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Хаа28 Хаа29 Хаа30 Хаа31 Хаа32, (SEQ ID NO: 36), где
Xaa1 представляет собой А, С, F, I, К, S или отсутствует;
Хаа2 представляет собой С, D или S;
Хаа3 представляет собой А, D или N;
Хаа4 представляет собой A, L или Т;
Хаа5 представляет собой А или S;
Хаа6 представляет собой Т;
Хаа7 представляет собой С или К;
Хаа8 представляет собой А или V;
Хаа9 представляет собой L или Т;
Хаа10 представляет собой G, Н или Q;
Xaa11 представляет собой К, R или hArg;
Хаа12 представляет собой L;
Хаа13 представляет собой А, F, N, S или Т;
Хаа14 представляет собой А, D, Е, G, N, Q или R;
Хаа15 представляет собой А, Е, F, L, S или Y;
Хаа16 представляет собой L;
Хаа17 представляет собой Н, S или V;
Хаа18 представляет собой К, R, hArg, u (Cit) или n (Orn);
Хаа19 представляет собой F, L или S;
Хаа20 представляет собой Н или Q;
Хаа21 представляет собой Т или N;
Хаа22 представляет собой F, L, М, V или Y;
Хаа23 представляет собой Р;
Хаа24 представляет собой Р или R;
Хаа25 представляет собой Т;
Хаа26 представляет собой N;
Хаа27 представляет собой Т или V;
Хаа28 представляет собой G;
Хаа29 представляет собой S;
Хаа30 представляет собой Е, G, К или N;
Хаа31 представляет собой А или Т; и
Хаа32 представляет собой F, Р или Y.
В общем аспекте последовательность формулы I, II или III дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более модификаций замен, вставок, делеций, элонгации и/или получения производных. В некоторых вариантах осуществления последовательность формулы I, II, или III содержит Val, вставленный между аминокислотами в положениях 22 и 23. В других вариантах осуществления последовательность формулы I, II или II содержит GIn, вставленный между положениями 22 и 23. В других вариантах осуществления последовательность формулы I, II или III содержит последовательность GIn-Thr-Tyr (SEQ ID NO: 37) между положениями 22 и 23. В других вариантах осуществления последовательность формулы I, II или III содержит последовательность Leu-Gln-Thr-Tyr (SEQ ID NO: 38) между положениями 22 и 23. В другом общем аспекте модификации формул I, II или III могут быть на N-конце. В некоторых вариантах осуществления N-концевая часть формул I, II или III имеет добавочный октилглицин. В других вариантах осуществления N-концевая часть формулы I, II или III имеет добавочный изокап. Еще в одном аспекте соединения данного изобретения содержат аминокислотную последовательность формулы IV: Xaa1 Xaa2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Хаа8 Хаа9 Xaa10 Xaa11 Xaa12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Xaa20 Хаа21 Хаа22 Хаа23 Хаа24 Xaa25 Xaa26 Xaa27 Xaa28 Xaa29 Хаа30 Хаа31 Хаа32 (SEQ ID NO: 39), где
Xaa1 представляет собой А, С, D, F, К, Т или отсутствует;
Xaa2 представляет собой А, С, D, S или отсутствует;
Хаа3 представляет собой А, D, N или отсутствует;
Хаа4 представляет собой A, L, Т или отсутствует;
Хаа5 представляет собой А или S;
Хаа6 представляет собой А, S, Т или V;
Хаа7 представляет собой А, С или К;
Хаа8 представляет собой А, L, М или V;
Хаа9 представляет собой L или Т;
Xaa10 представляет собой G, Н или Q;
Xaa11 представляет собой К, Q или R;
Хаа12 представляет собой L, W или Y;
Хаа13 представляет собой A, N, Q, S или Т;
Хаа14 представляет собой A, D, Е, G, К, N, Q или R;
Хаа15 представляет собой А, D, Е, F, L, S или Y;
Хаа16 представляет собой F или L;
Хаа17 представляет собой Н, Q, S или V;
Хаа18 представляет собой К или R;
Хаа19 представляет собой F, L, S или отсутствует;
Хаа20 представляет собой Н, К, Q или отсутствует;
Хаа21 представляет собой Q, Т или отсутствует;
Хаа22 представляет собой F, L или Y;
Хаа23 представляет собой Р;
Хаа24 представляет собой Р или R;
Хаа25 представляет собой Т;
Хаа26 представляет собой N;
Хаа27 представляет собой Т или V;
Хаа28 представляет собой G;
Хаа29 представляет собой S;
Хаа30 представляет собой Е, К или N;
Хаа31 представляет собой А или Т;
Хаа32 представляет собой F, Y или отсутствует;
В общем аспекте последовательность формулы IV дополнительно содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более модификаций замен, вставок, делеций, элонгаций и/или получения производных. В некоторых вариантах осуществления последовательность формулы I, II, III или IV содержит делецию в положении 24.
Еще в одном аспекте соединения по данному изобретению содержат аминокислотную последовательность, содержащую
a) петлевой фрагмент, содержащий Xaa1;
b) α-спиральную петлю I типа; и
c) С-концевой хвост;
где X1 содержит аминокислотную последовательность Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Y (SEQ ID NO: 5), где
Хаа2 представляет собой любую аминокислоту или отсутствует;
Хаа3 представляет собой Ala, Gly, Ser, Asp или отсутствует;
Хаа4 представляет собой Asn, Ala, Asp, Gly или отсутствует;
Хаа5 представляет собой Ala, Leu, Thr или Ser;
Хаа6 представляет собой Ala, Ser или Thr; и
Хаа7 представляет собой Ala, Ser, Val, Hse, (S)-2-амино-3-гидрокси-метилбутановую кислоту (Ahb), (2S, 3R)-2-амино-3-гидрокси-метилпентановую кислоту (Ahp), D-Thr, Thr или их производное;
Х и Y представляют собой аминокислоты, способные образовать связь, и независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи, такой как дисульфидные связи; амидная связь; алкильные кислоты и алкиламины, которые могут образовывать циклические лактамы; алкилальдегиды или алкилгалиды и алкиламины, которые могут конденсироваться и быть восстановлены с образованием алкиламинного или иминного мостика; или боковые цепи, которые могут быть соединены с образованием алкильной, алкенильной, алкинильной, эфирной или тиоэфирной связи;
α-спиральный участок I типа содержит последовательность R1-V L Xaa10 Xaa11 L S Q Xaa15 L Xaa17 Xaa18 L Q Т Хаа22 Р Хаа24 Т N T-R1 (SEQ ID NO: 29), где
Xaa10 представляет собой Gly или Aib;
Xaa11 представляет собой Lys, Arg, Orn, hArg, Cit, hLys или Lys(for);
Xaa15 представляет собой Glu или Phe;
Xaa17 представляет собой His или Aib;
Xaa18 представляет собой Lys, Arg, Orn, hArg, Cit, hLys, Lys(for), Lys(PEG 5000);
Хаа22 представляет собой Try или Leu;
Хаа24 представляет собой Arg или Pro; или
R1 отсутствует или содержит 1-4 добавочных аминокислот; и
С-концевой хвост содержит последовательность Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 Хаа33 G Хаа35 Хаа36 Хаа37 Хаа38 (SEQ ID NO: 31), где
Хаа28 представляет собой Lys, Tyr или отсутствует;
Хаа29 представляет собой Ser, Pro или отсутствует;
Хаа30 представляет собой Ser, Pro, Arg или отсутствует;
Хаа31 представляет собой Thr или отсутствует;
Хаа32 представляет собой Asn или отсутствует;
Хаа33 представляет собой Val, Thr, или отсутствует;
Хаа35 представляет собой Ser, Glu
Хаа36 представляет собой Asn, Lys или Gly;
Хаа37 представляет собой Thr, Phe или Ala;
Хаа38 представляет собой Tyr, Phe, Pro или отсутствует;
при условии, что когда петлевой фрагмент представляет собой фрагмент из кальцитонина или аналога кальцитонина, α спиральный участок - из кальцитонина или аналога кальцитонина, последнее положение С-концевого хвоста не представляет собой Pro, Hyp, гомоСерин (Hse) или производные Hse.
Еще в одном аспекте соединения данного изобретения содержат аминокислотную последовательность, содержащую
a) петлевой фрагмент, содержащий Xaa1;
b) α спиральную петлю II типа; и
c) С-концевой хвост;
где петлевой фрагмент Xaa1 содержит аминокислотную последовательность Х Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Y, где
Хаа2 представляет собой любую аминокислоту или отсутствует;
Хаа3 представляет собой Ala, Gly, Ser, Asp или отсутствует;
Хаа4 представляет собой Asn, Ala, Asp, Gly или отсутствует;
Хаа5 представляет собой Ala, Leu, Thr или Ser;
Хаа6 представляет собой Ala, Ser или Thr; и
Хаа7 представляет собой Ala, Ser, Val, Hse, (S)-2-амино-3-гидрокси-метилбутановую кислоту (Ahb), (2S, 3R)-2-амино-3-гидрокси-метилпентановую кислоту (Ahp), D-Thr, Thr или их производное;
Х и Y представляют собой аминокислоты, способные образовать связь, и независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи, такой как дисульфидные связи; амидная связь; алкильные кислоты и алкиламины, которые могут образовывать циклические лактамы; алкилальдегиды или алкилгалиды и алкиламины, которые могут конденсироваться и быть восстановлены с образованием алкиламинного или иминного мостика; или боковые цепи, которые могут быть соединены с образованием алкильной, алкенильной, алкинильной, эфирной или тиоэфирной связи;
α спиральный участок II типа содержит последовательность R1 - Хаа8 Хаа9 Xaa10 R Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Р Хаа24 TNT -R1 (SEQ ID NO: 30), где
Хаа8 представляет собой Ala или Val;
Хаа9 представляет собой Thr, Met или Leu;
Xaa10 представляет собой Gin, Gly, His;
Хаа12 представляет собой Leu или Thr;
Хаа13 представляет собой Ala, Thr, Asn, Phe, Tyr, Ser или Thr;
Хаа14 представляет собой Asn, Arg, Ala, Asp, Glu, Gln, Thr или Gly;
Хаа15 представляет собой Phe, Leu, Ser, Glu, Ala, Asp или Tyr;
Хаа16 представляет собой Leu или Asp;
Хаа17 представляет собой Val, His, Ser, Phe или Aib;
Хаа18 представляет собой His, Arg, Lys, Orn, hArg, Cit, hLys, Lys(for) или Lys(PEG5000);
Хаа19 представляет собой Leu, Ser или Phe;
Хаа20 представляет собой Gin или His;
Хаа21 представляет собой Thr или Asn;
Хаа22 представляет собой Tur, Val, Phe, Leu или Met;
Хаа24 представляет собой Arg или Pro; и
R1 отсутствует или содержит 1-4 дополнительные аминокислоты; и
С-концевой хвост содержит последовательность Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 Хаа33 G Хаа35 Хаа36 Хаа37 Хаа38 (SEQ ID NO: 31), где
Хаа28 представляет собой Lys, Tyr или отсутствует;
Хаа29 представляет собой Ser, Pro или отсутствует;
Хаа30 представляет собой Ser, Pro, Arg или отсутствует;
Хаа31 представляет собой Thr или отсутствует;
Хаа32 представляет собой Asn или отсутствует;
Хаа33 представляет собой Val, Thr или отсутствует;
Хаа35 представляет собой Ser, Glu
Хаа36 представляет собой Asn, Lys или Gly;
Хаа37 представляет собой Thr, Phe или Ala;
Хаа38 представляет собой Туг, Phe, Pro или отсутствует.
Еще в одном аспекте соединения по данному изобретению включают в себя:
SEQ ID NO: 40 KCNTATCVLGKLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 41 KCNTATCVLGRLSQELHRLQTLPRTNTGSNTY
SEQ ID NO: 42 KCNTATCVLGRLSQELHRLQTYPPTNTGSNTY
SEQ ID NO: 43 KCNTATCVLGRLSQELHRLQTYPRTNVGSNTY
SEQ ID NO: 44 KCNTATCVLGRLSQELHRLQTLPPTNVGSNTY
SEQ ID NO: 45 KCNTATCVLGRLANFLHRLQTYPRTNTGSNTY
SEQ ID NO: 46 ACNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 47 KCNAATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 48 KCNTAACVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 49 CANLSTCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 50 Изокапроил-STAVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 51 CSNASTCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 52 CSNLATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 53 CSNLSACVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 54 KCNTATCVLGRLSQELHKLQTYPRTNTGSNTY
SEQ ID NO: 55 KCNTATCVLGRLSQELHRLQTYPRTNTGSGTP
SEQ ID NO: 56 CSALSTCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 57 Ac-(Agy)SNLST(Agy)VLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 58 Ac-K(Agy)NTAT(Agy)VLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 59 Изокапроил-STAVL(Aib)RLSQELRLQTYPRTNTGSGTP
SEQ ID NO: 60 Изокапроил-STAVLG[K(For)]LSQELH[K(For)JLQTYPRTNTGSGTP
SEQ ID NO: 61 Изокапроил-STAVL(Aib)[К(For)]LSQEL(Aib)[K(For)]LQTYPRTNTGSNTY
SEQ ID NO: 62 Изокапроил-STAVL(Aib)[К(For)]LSQEL(Aib)[K(For)]LQTYPRTNVGSNTY
SEQ ID NO: 63 KCNTATCLLQQLQKLLQKLKQYPRTNTGSNTY
SEQ ID NO: 64 KCNTASCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 65 KCNTAVCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 66 KCNTATCVLGRLSQELHRYPRTNTGSNTY
SEQ ID NO: 67 KCNTATCVLGK(For)LSQELHK(For)LQTYPRTNTGSNTY
SEQ ID NO: 68 KCNTA(d-Thr)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 69 KCNTA(dAh)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 70 Ac-ACNTATCVLGRLSQELHK(PEG5000)LQTYPRTNTGSNTY
SEQ ID NO: 71 KCNTATCVLGRLSQELHRLQTLQTYPRTNTGSNTY
SEQ ID NO: 72 KCNTATCVLGRLSQELHRLQTLLQTYPRTNTGSNTY
SEQ ID NO: 73 KCNTATCVLGKLSQELHKLQTYPRTNTGSNTY
SEQ ID NO: 74 KCNTSTCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 75 KCNTATCATQRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 76 KCNTATCATQRLSQELHRLQTYPRTNVGSNTY
SEQ ID NO: 77 KCNTSTCATQRLANELVRLQTYPRTNVGSNTY
SEQ ID NO: 78 KCNTA(Hse)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 79 KCNTA(Ahb)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 80 KCNTA(Ahp)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 81 KCNTAT(OPO3H2)CVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 82 KCNTATCVLG(Orn)LSQELH(Orn)LQTYPRTNTGSNTY
SEQ ID NO: 83 KCNTATCVLG(Cit)LSQELH(Cit)LQTYPRTNTGSNTY
SEQ ID NO: 84 KCNTATCVLG(гомоК)LSQELH(гомоK)LQTYPRTNTGSNTY
SEQ ID NO: 85 L-OктилглицинKCNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 86 N-3,6-диоксаоктаноил-CNTATCVLGRLSQELHRLQTVPRTNTGSNTY
SEQ ID NO: 87 KCNTATCMLGRYTQDFHRLQTYPRTNTGSNTY
SEQ ID NO: 88 DSNLSTKVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 89 KDNTATKVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 90 CNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 91 KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY(9Anc)
SEQ ID NO: 92 KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY(L-Октилглицин)
SEQ ID NO: 93 N-Изокапроил-KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 94 KCNTATCVLG(гомоR)LSQELH(гомоR)LQTYPRTNTGSNTY
SEQ ID NO: 95 FCNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 96 KCNTATCVLGRLSQELH(Cit)LQTYPRTNTGSNTY
SEQ ID NO: 97 KCNTATCVLGRLSQELH(Orn)LQTYPRTNTGSNTY
SEQ ID NO: 98 ICNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 99 1-Октилглицин-CNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 100 Изокапроил-CNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 101 KCNTATCVLG(Cit)LSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 102 KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY(4ABU)
SEQ ID NO: 103 Изокапроил-KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY(4ABU)
SEQ ID NO: 104 KCNTSTCATQRLANELVRLQTYPRTNVGSEAF
SEQ ID NO: 105 KCNTATCVLGRLSQELHRLQTYPTNVGSEAF
SEQ ID NO: 106 KCNTATCVLGRLSRSLHRLQTYPRTNTGSNTY
SEQ ID NO: 107 KCNTATCVTHRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 108 KCNTATCVLGRLADFLHRLQTYPRTNTGSNTY
SEQ ID NO: 109 CNTATCVLGRLSQELHRLQTYPRTNTGSNT
SEQ ID NO: 110 KCNTATCVLGRLSQELHRLQNFVPRTNTGSNTY
SEQ ID NO: 111 KCNTATCVLGRLSQELHRLQTYPRTNTGSETF
SEQ ID NO: 112 ACDTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 113 KCNTATCVLGRLSQELHRLQTYPRTNTGSKAF
SEQ ID NO: 114 KCDTATCVTHRLAGLLSRSQTYPRTNTGSNTY
SEQ ID NO: 115 KCNTATCVLGRLADALHRLQTYPRTNTGSNTY
SEQ ID NO: 116 KCNTATCVLGRLAAFLHRLQTYPRTNTGSNTY
SEQ ID NO: 117 SCNTATCVLGRLADFLHRLQTYPRTNTGSNTY
SEQ ID NO: 118 KCNTATCVLGRLSQELHRLQTMPRTNTGSNTY
SEQ ID NO: 119 KCNTATCVLGRLSQELHRLQTVPRTNTGSNTY
SEQ ID NO: 120 KCNTATCVLGRLNEYLHRLQTYPRTNTGSNTY
SEQ ID NO: 121 SCNTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 122 KCNTATCVLGRLTEFLHRLQTYPRTNTGSNTY
SEQ ID NO: 123 KCNTATCVLGRLAEFLHRLQTYPRTNTGSNTY
SEQ ID NO: 124 KCNTATCVLGRLTDYLHRLQTYPRTNTGSNTY
SEQ ID NO: 125 KCNTATCVLGRLAQFLHRLQTYPRTNTGSNTY
SEQ ID NO: 126 KCNTATCVLGRLADFLHRFQTFPRTNTGSNTY
SEQ ID NO: 127 KCNTATCVLGRLADFLHRFHTFPRTNTGSNTY
SEQ ID NO: 128 KCNTATCVLGRLADFLHRFQTFPRTNTGSGTP
SEQ ID NO: 129 CNTATCVLGRLADFLHRLQTYPRTNTGSNTY
SEQ ID NO: 130 KCDTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 131 KCNTATCVLGRLFDFLHRLQTYPRTNTGSNTY
SEQ ID NO: 132 KCNTATCVLGRLAAALHRLQTYPRTNTGSNTY
SEQ ID NO: 133 TCDTATCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 134 CSNLSTCATQRLANELVRLQTYPRTNVGSNTY
SEQ ID NO: 135 KCNTATCATQRLANELVRLQTYPRTNVGSNTY
SEQ ID NO: 136 CSNLSTCVLGRLSQELHRLQTYPRTNTGSNTY
SEQ ID NO: 137 KCNTATCVLGRLSQELHRLQTYPRTNTGSNTY
В другом аспекте соединения по данному изобретению включают в себя биологически активные фрагменты SEQ ID NOS: 40 - 137. Биологически активные фрагменты могут содержать делеции 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или большего количества аминокислот. В некоторых вариантах осуществления аминокислотные последовательности SEQ ID NOs: 40 - 137 содержат по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше модификаций, таких как замены, вставки, делеции и/или получение производных. В других вариантах осуществления аминокислотные последовательности SEQ ID NOS:40 - 137 имеют не более 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 модификаций, таких как замены, вставки, делеции и/или получение производных. В другом аспекте данного изобретения соединения по данному изобретении включают в себя соединения, имеющие, по меньшей мере, 75, 80, 85, 90, 95 или 97% идентичность аминокислотной последовательности к любой из SEQ ID NOS: 40 - 137. Процент идентичности определяют анализом с помощью AlignX модуля в Vector NTI (Invitrogen; Carlsbad CA). Предполагается, что каждый описанный процент идентичности или ссылка на биологически активные фрагменты или модификации применимы к каждой SEQ ID NO: индивидуально. Например, каждый описанный вариант осуществления, фрагменты, модификация или % идентичности применимы к SEQ ID NO:40, 41, 42, 43, 44, и т.д. или к любой группе последовательностей SEQ ID NOs:. Кроме того, соединения по данному изобретению включают в себя соединения 1-127, описанные в Примере 3.
В другом общем аспекте соединения по данному изобретению могут действовать как агонисты по меньшей мере одного описанного здесь биологического эффекта кальцитонина, амилина и/или CGRP или связываться по меньшей мере с одним из рецепторов амилина, кальцитонина или CGRP.
В другом общем аспекте соединения по данному изобретению могут использоваться для уменьшения потребления пищи, снижения аппетита, могут вызывать чувство сытости, использоваться для снижения усвоения питательных веществ, могут вызывать потерю массы тела, влиять на состав тканей тела, для изменения энергоемкости организма или расхода энергии, улучшения липидного профиля (в том числе снижения уровней холестерина липидов низкой плотности и триглицеридов и/или изменения уровней холестерина липидов высокой плотности), замедления моторики желудочно-кишечного тракта, задержки опорожнения желудка, уменьшение колебания уровня глюкозы в крови после приема пищи, предупреждения или подавления секреции глюкагона и снижения кровяного давления.
Таким образом, в некоторых вариантах осуществления способы по данному изобретению применяют для лечения или профилактики состояний или нарушений, которые можно облегчить снижением усвоения питательных веществ, включающие в себя введение указанному пациенту терапевтически или профилактически эффективного количества соединения по данному изобретению. Такие состояния или нарушения включают в себя, но не только, нарушения питания, резистентность к инсулину, ожирение, аномальную гипергликемию после приема пищи, диабет любого типа, в том числе I типа, II типа, и диабет беременных, метаболический синдром, демпинг-синдром, гипертензию, дислипидемию, сердечно-сосудистое заболевание, гиперлипидемию, апноэ во сне, злокачественное заболевание, легочную гипертензию, холецистит и остеоартрит.
Неограничивающими примерами состояния или заболевания сердечно-сосудистой системы являются гипертензия, ишемия миокарда и реперфузия миокарда. Соединения по данному изобретению также можно использовать при лечении или профилактике других состояний, связанных с ожирением, в том числе при нарушении мозгового кровообращения, раке (например, эндометрия груди, предстательной железы и раке толстой кишки), заболевании желчного пузыря, апноэ во сне, сниженной фертильности и остеоартрите (смотри Lyznicki et al, Am. Fam. Phys. 63:2185, 2001). В других вариантах осуществления соединения по данному изобретению могут быть использованы для изменения состава тканей тела по эстетическим причинам, для повышения физических способностей или для получения источника постного мяса.
В другом общем аспекте, соединения по данному изобретению могут быть использованы для подавления секреции грелина. Соответственно соединения по данному изобретению могут использовать этот механизм для лечения или профилактики нарушений, связанных с грелином, таких как синдром Прадера - Вилли, диабет всех типов и их осложнения, ожирение, гиперфагия, гиперлипидемия, или других нарушений, связанных с избыточным питанием.
В другом общем аспекте в настоящее время признано, что амилин и агонисты амилина, в том числе соединения по данному изобретению, могут быть использованы для лечения или профилактики эзофагита Баррета, гастроэзофагального рефлюкса (GERD) и связанных с ними состояний. Такие состояния могут включать в себя, но не только, изжогу, изжогу, сопровождаемую отрыжкой желудочного/кишечного содержимого в ротовую полость или легкие, трудность при глотании, кашель, периодическую одышку и воспаление голосовых связок (состояния, связанные с GERD), эррозию пищевода, язву пищевода, стриктуру пищевода, метаплазию Барретта (замена нормального эпителия пищевода патологической эпителиальной тканью), аденокарциному Барретта и аспирацию легких. Амилин и агонисты амилина, в том числе соединения по данному изобретению, обладают антисекреторными свойствами, такими как ингибирование желудочных кислот, ингибирование желчных кислот и ингибирование ферментов поджелудочной железы. Кроме того, было обнаружено, что амилин обладает гастропротекторным действием. Соответственно эти свойства амилина, агонистов амилина и соединений по данному изобретению могут сделать их применимыми, в частности, при лечении или профилактике эзофагита Барретта, и/или GERD и связанных или ассоциированных состояний, описанных здесь.
В другом общем аспекте соединения по данному изобретению дополнительно могут быть использованы для лечения или профилактики панкреатита, карциномы поджелудочной железы и гастрита. Кроме того, соединения по данному изобретению могут быть использованы для лечения или профилактики панкреатита у пациентов, подвергавшихся эндоскопической ретроградной холангиопанкреатографии (ERCP). Дополнительно было обнаружено, что амилин и агонисты амилина, в том числе соединения по данному изобретению, могут обладать удивительно превосходным терапевтическим действием при комбинировании с соматостатином. Соответственно в некоторых вариантах осуществления способы лечения или профилактики панкреатита включают в себя введение пациенту амилина и агонистов амилина, в том числе соединений по данному изобретению, и введение соматостатина и агонистов соматостатина. В других вариантах осуществления способы лечения или профилактики панкреатита включают в себя введение соединений по данному изобретению и введение соматостатина и агонистов соматостатина.
В другом общем аспекте соединения по данному изобретению также могут применяться для снижения резорбции костей, снижения кальция в плазме и индукции анальгезирующего действия. Соответственно соединения по данному изобретению могут использоваться для лечения заболевания костей, таких как остеопения и остеопороз. Еще в других вариантах осуществления соединения по данному изобретению могут использоваться для лечения боли и болевой нейропатии.
Еще в одном общем аспекте соединения по данному изобретению могут быть использованы как часть комбинированной терапии. В некоторых вариантах осуществления соединения по данному изобретению могут быть использованы с другими коммерчески доступными диетическими средствами или другими средствами против ожирения, в качестве примера, пептидом YY (PYY) и агонистами PYY, глюкагоноподобным пептидом 1 (GLP-1) и агонистами GLP-1, ингибитором дипептидилпептидазы IV (DPPIV), ССК и агонистами ССК, экзендином и агонистами экзендина, и лептином и агонистами лептина. В других вариантах осуществления соединения по данному изобретению могут быть использованы с другими анальгетиками, иммуносуппрессорами или другими противовоспалительными средствами.
В другом общем аспекте описаны новые фармацевтические композиции, содержащие соединения по данному изобретению, а также и способы их применения. В некоторых вариантах осуществления фармацевтические композиции могут содержать по меньшей мере от 0,01% до 5% мас./об. В некоторых вариантах осуществления рН композиции может составлять примерно от 3,0 примерно до 6,0. В некоторых вариантах осуществления буфер может быть ацетатным, фосфатны, цитратным или глутаматным. В некоторых вариантах осуществления композиция дополнительно содержит углеводный регулятор тоничности или многоатомный спирт. В некоторых вариантах осуществления данная композиция дополнительно содержит консервант, выбранный из группы, состоящей из м-крезола, бензилового спирта, парабенов и фенола. В других вариантах осуществления данные соединения вводят в диапазоне доз примерно от 0,05 мг/кг примерно до 2 мг/кг. Например, суточная доза может составлять от 1 мкг примерно до 5 мг в день. В некоторых вариантах осуществления, способами доставки, приводимыми в качестве примера, могут быть инъекция, инфузия, абсорбция (слизистая) и ингаляция. Пути введения могут представлять собой внутримышечный, внутривенный, подкожный, чрескожный, через слизистую, пероральный, назальный или путем легочной ингаляции.
Также как часть данного изобретения рассматриваются нуклеотиды, которые кодируют описанную здесь аминокислотную последовательность, векторы, содержащие данные нуклеотиды, клетки-хозяева для репродукции нуклеотидов и/или экспрессии данных полипептидов, кодируемых данными нуклеотидами, антитела, направленные на новые соединения, и их применение в скрининге или выявлении/диагностике состояний у пациента, таких, которые описаны здесь.
Эти и другие аспекты данного изобретения будут более понятны с ссылкой на следующие предпочтительные варианты осуществления и подробное описание.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 демонстрирует дозозависимое снижение потребления пищи у мышей, не получавших пищу в течение ночи, от доз соединения по данному изобретению, приведенного в качестве примера (Анализ потребления пищи).
Фиг.2А иллюстрирует снижение потребления калорий у тучных крыс (ожирение, вызванное рационом питания, или DIO) при непрерывном периферическом введении либо носителя, либо соединений по данному изобретению, приведенных в качестве примера, на протяжении двухнедельного периода.
Фиг.2В иллюстрирует снижение массы тела на протяжении соответствующего периода времени.
На Фиг.3 изображены воздействия на состав тканей тела соединением по данному изобретению, приведенным в качестве примера.
На Фиг.4А изображены эффекты соединения по данному изобретению, приведенного в качестве примера, на опорожнение желудка.
На Фиг.4В изображен гипокальциемический эффект соединения по данному изобретению, приведенного в качестве примера.
На Фиг.5 изображены воздействия соединения по данному изобретению, приведенного в качестве примера, на триглицериды.
На Фиг.6А-6В изображено действие соединения по данному изобретению, приведенного в качестве примера, на триглицериды в динамике по времени.
На Фиг.7А-7Е изображен эффект дозы соединения по данному изобретению, приведенного в качестве примера, на триглицериды в динамике по времени.
На Фиг.8А изображено воздействие амилина на грелин.
На Фиг.8В-8С изображено воздействие амилина на грелин.
На Фиг.9А изображено действие соединения по данному изобретению, приведенного в качестве примера, на маркер функции поджелудочной железы.
На Фигуре 9В изображено действие соединения по данному изобретению, приведенного в качестве примера, на маркер функции поджелудочной железы.
На Фиг.10А изображено действие амилина на секрецию желудочного сока.
На Фиг.10В изображено дозозависимое действие амилина на секрецию желудочного сока.
На Фиг.11А изображен гастропротекторный эффект амилина.
На Фиг.11В изображен гастропротекторный эффект амилина.
На Фиг.11С изображена кривая доза-ответ амилина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям семейства амилинов или их агонистам (также называемым новыми соединениями и соединениями по данному изобретению). Эти новые соединения могут быть использованы при лечении или профилактике таких состояний, как метаболические нарушения, сосудистые нарушения, почечные нарушения и/или желудочно-кишечные нарушения. В предыдущем разделе представлена структура данных соединений. Новые соединения дополнительно могут быть описаны как имеющие желаемые характеристики, такие как сравнимая или более высокая активность при лечении и/или профилактике метаболических состояний и нарушений и нарушений, упомянутых выше, по сравнению с амилином, кальцитонином и/или CGRP. В других вариантах осуществления соединения по данному изобретению могут не обладать сравнимой или более высокой активностью, но могут иметь повышенную стабильность или растворимость, меньше побочных эффектов, комбинацию биологических эффектов, более быстрое проявление активности, более длительную продолжительность действия и/или легкое получение и составление лекарственной формы, или применение по сравнению с амилином, кальцитонином или CGRP.
Под активностью амилина подразумевается, что соединение демонстрирует физиологические свойства, сходные с амилином, такими, которые описаны в настоящей заявке, например, уменьшение потребления пищи. Соединения по настоящему изобретению могут связываться или иным образом напрямую или опосредовано взаимодействовать с рецептором амилина, или другим рецептором или рецепторами, с которыми может взаимодействовать сам амилин для того, чтобы вызвать биологический ответ, например, снижение потребления пищи.
Под активностью кальцитонина подразумевается, что соединение демонстрирует физиологические свойства, сходные с кальцитонином, такими, которые описаны в настоящей заявке, например, ингибирование функции остеокластов. Соединения по настоящему изобретению могут связываться или иным образом напрямую, или опосредовано взаимодействовать с СТ рецептором, или другим рецептором или рецепторами, с которыми сам кальцитонин может взаимодействовать для того, чтобы вызвать биологический ответ, например, ингибирование функции остеокластов.
Под активностью CGRP подразумевается, что соединение демонстрирует физиологические свойства, сходные с CGRP, такими, которые описаны в настоящей заявке, например, вызывать сосудорасширяющее действие. Соединения по настоящему изобретению могут связываться или иным образом напрямую или опосредовано взаимодействовать с CGRP рецептором или рецепторами, с которыми сам CGRP может взаимодействовать для того, чтобы вызвать биологический ответ, например, вызывать сосудорасширяющее действие.
Соединения по данному изобретению также могут включать в себя биологически активные фрагменты описанных здесь более крупных пептидов, которые сохраняют активность. Таким образом, примеры желаемых свойств, которыми обладают соединения по данному изобретению, включают в себя (1) оказание воздействия на потребление пищи, опорожнение желудка, секреторную функцию поджелудочной железы, кровяное давление, частоту сердечных сокращений или потерю массы тела, сходные с амилином, кальцитонином или CGRP, и/или (2) связывание в анализе рецепторного связывания с амилином, кальцитонином или CGRP. Некоторые исследования, которые можно привести в качестве примера, представлены в Примере 1.
Соединения по данному изобретению могут дополнительно иметь конкретный профиль связывания. Например, сообщалось, что биологические действия амилина, кальцитонина и CGRP опосредуются через связывание с двумя близкородственными рецепторами II типа, сопряженными с G белком (GPCRs), рецептором кальцитонина (CTR) и рецептором, подобным рецептору кальцитонина (CRLR). Клонирование и функциональные исследования показали, что CGRP и амилин взаимодействуют с различными комбинациями CTR или CRLR и белком, модифицирующим рецепторную активность (RAMP). Многие клетки экспрессируют RAMP и либо CTR, либо CRLR необходим для воспроизведения функциональных рецепторов к кальцитонину, CGRP и амилину. Семейство RAMP включает в себя три члена (RAMP1, -2 и -3), идентичность последовательностей которых составляет менее 30%, но они имеют общую топологическую организацию. Ко-экспрессия CRLR и RAMP1 ведет к образованию рецептора к CGRP, как и ко-экспрессия CRLR и RAMP3. Ко-экспрессия hCTR2 и RAMP1 ведет к образованию рецептора к амилину и CGRP. Ко-экспрессия hCTR2 и RAMP3 ведет к образованию рецептора к амилину.
Соответственно соединения по данному изобретению для использования в способах по настоящему изобретению могут демонстрировать аффинность к рецепторам амилина, CGRP и кальцитонина в семействе амилинов. Соединения по данному изобретению могут демонстрировать значительную аффинность для связывания с рецептором амилина, а также способность связываться с другими рецепторами, такими как рецепторы кальцитонина и CGRP. Соединения по данному изобретению могут связываться с рецептором амилина с аффинностью, превышающей 20 нМ, 10 нМ, 5 нМ, 1 нМ, и более предпочтительно с аффинностью, превышающей 0,10 нМ. Кроме того, соединения по настоящему изобретению также могут связываться со сходной аффинностью с рецепторами кальцитонина и CGRP, но с меньшей аффинностью с CGRP рецептором. В других вариантах осуществления соединения по данному изобретению могут связываться с рецептором кальцитонина с аффинностью, превышающей 20 нМ, 10 нМ или 1 нМ. В других вариантах осуществления соединения по данному изобретению могут связываться с CGRP рецептором с аффинностью, превышающей примерно 1 мкМ, 700 нМ или 500 нМ. Соединения по данному изобретению также могут связываться с разной степенью со всеми тремя рецепторами. Соответственно предполагается, что соединения по данному изобретению могут иметь профиль связывания с конкретной аффинностью связывания для каждого рецептора из тех, что описаны здесь.
Соединения по данному изобретению, в том числе соединения формулы I, II, III, IV, биологически активные фрагменты SEQ ID NOS: 40 - 137, фрагменты, имеющие, по меньшей мере 75, 80, 82 85, 87, 90, 92, 95 или 97% идентичность аминокислотной последовательности в отношении любой из SEQ ID NOS: 40 - 237, и их биологически активные фрагменты могут сохранять, по меньшей мере, около 25%, предпочтительно около 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99% биологической активности амилина, кальцитонина, CGRP или соединений, имеющих последовательность SEQ ID NOS: 40 - 137, или соединения 1-137 в Примере 3, в отношении снижения потребления пищи или одной из других описанных здесь функций, например, в Таблице 1. В другом варианте осуществления соединения по данному изобретению проявляют улучшенную биологическую активность. Предпочтительно, новые соединения демонстрируют, по меньшей мере, примерно 110%, 125%, 130%, 140%, 150%, 200%, или более, биологической активности амилина, кальцитонина, CGRP или соединений, имеющих последовательности SEQ ID NOS: 40 - 137, или соединений 1-137 в Примере 3, в отношении снижения потребления пищи или одной из других функций, описанных здесь, например, в Таблице 1. Например, желаемое соединение по данному изобретению представляет собой соединение, обладающее активностью в одном из описанных здесь исследований (потребления пищи, исследования снижения массы тела, опорожнения желудка, исследования триглицеридов, воспаления поджелудочной железы, грелина или кальция), которая выше активности амилина, кальцитонина или CGRP в том же исследовании.
Только в качестве иллюстрации ожидаемые соединения по данному изобретению могут демонстрировать способность снижать суммарное потребление пищи более чем на 5% по сравнению с введением носителя, предпочтительно более чем на 15%, более предпочтительно более чем на 25%, еще более предпочтительно более чем на 35% или 40%, наиболее предпочтительно более чем на 50% по сравнению с носителем.
Еще в одном общем аспекте соединения по данному изобретению могут использоваться для снижения потребления пищи, снижения аппетита, для индукции чувства сытости, снижения усвоения питательных веществ, для потери массы тела, воздействия на состав тканей тела, изменения энергоемкости организма или расхода энергии, улучшения липидного профиля (в том числе снижения уровней LDL холестерина и триглицеридов и/или изменения уровней HDL холестерина), замедления моторики желудочно-кишечного тракта, задержки опорожнения желудка, ослабления колебаний уровней глюкозы в крови после приема пищи, предупреждения или ингибирования секреции глюкагона и снижения кровяного давления. Исследования действий на потребление пищи, снижение массы тела, опорожнение желудка, триглицериды и состав тканей тела, приведенные в качестве примера, описаны, по меньшей мере, в Примерах 3, 4, 5, 6 и 7.
Таким образом, в некоторых вариантах осуществления способы по данному изобретению применимы для лечения или профилактики состояний или нарушений, которые можно облегчить снижением усвоения питательных веществ, включающих в себя введение указанному пациенту терапевтически или профилактически эффективного количества соединения по данному изобретению. Такие состояния и нарушения включают в себя, но не только, нарушения питания, резистентность к инсулину, ожирение, аномальную гипергликемию после приема пищи, диабет любого типа, в том числе типа I, типа II и диабет беременных, метаболический синдром, гипертензию, дислипидемию, сердечно-сосудистое заболевание, гиперлипидемию, апноэ во сне, злокачественное заболевание, легочную гипертензию, холецистит и остеоартрит.
Неограничивающими примерами состояния сердечно-сосудистой системы или заболевания являются гипертензия, ишемия миокарда и реперфузия миокарда. Соединения по данному изобретению также могут использоваться при лечении или профилактике других состояний, связанных с ожирением, в том числе нарушения мозгового кровообращения, рака (например, эндометрия груди, предстательной железы и толстой кишки), заболевания желчного пузыря, апноэ во сне, сниженной фертильности и остеоартрита (смотри Lyznicki et al, Am. Fam. Phys. 63:2185, 2001). В других вариантах осуществления соединения по данному изобретению могут быть использованы для изменения состава тканей организма по эстетическим причинам, для повышения физических способностей или для получения источника постного мяса.
В другом общем аспекте соединения по данному изобретению могут быть использованы для ингибирования секреции грелина. Соответственно соединения по данному изобретению могут использовать этот механизм для лечения или профилактики нарушений, связанных с грелином, таких как синдром Прадера - Вилли, диабет всех типов и их осложениния, ожирение, гиперфагия, гиперлипидемия или других нарушений, связанных с перееданием. Исследование воздействия на грелин, приведенное в качестве примера, описано в Примере 8.
В другом общем аспекте, в настоящее время признано, что амилин и агонисты амилина, в том числе соединения по данному изобретению, могут быть использованы для лечения или профилактики эзофагита Баррета, гастроэзофагального рефлюкса (GERD) и связанных с ними состояний. Такие состояния могут включать в себя, но не только, изжогу, изжогу, сопровождаемую отрыжкой желудочного/кишечного содержимого в ротовую полость или легкие, трудность при глотании, кашель, периодическую одышку и воспаление голосовых связок (состояния, связанные с GERD), эррозию пищевода, язву пищевода, стриктуру пищевода, метаплазию Барретта (замена нормального эпителия пищевода патологической эпителиальной тканью), аденокарциному Барретта и аспирацию легких. Амилин и агонисты амилина, в том числе соединения по данному изобретению, обладают антисекреторными свойствами, такими как ингибирование желудочных кислот, ингибирование желчных кислот и ингибирование ферментов поджелудочной железы. Соответственно эти свойства амилина, агонистов амилина и соединений по данному изобретению могут делать их, в частности, полезными при лечении или профилактике эзофагита Барретта и/или GERD и связанных или ассоциированных состояний, как описано здесь. Исследования, приведенные в качестве примера, показывающие воздействие на секрецию желудочного сока и гастропротекторный эффект, описаны в Примерах 10 и 11.
В другом общем аспекте соединения по данному изобретению могут дополнительно использоваться для лечения или профилактики панкреатита, карциномы поджелудочной железы и гастрита. Более того, соединения по данному изобретению могут использоваться при лечении и профилактике панкреатита у пациентов, подвергавшихся эндоскопической ретроградной холангиопанкреатографии (ERCP). Дополнительно было обнаружено, что амилин и агонисты амилина, в том числе соединения по данному изобретению, могут обладать удивительно превосходным терапевтическим действием при комбинировании с соматостатином. Соответственно в некоторых вариантах осуществления, способы лечения или профилактики панкреатита включают в себя введение пациенту амилина и агонистов амилина, в том числе соединений по данному изобретению, и введение соматостатина и агонистов соматостатина. В других вариантах осуществления способы лечения или профилактики панкреатита включают в себя введение соединений по данному изобретению и введение соматостатина и агонистов соматостатина. Исследование, приведенное в качестве примера, показывающее воздействие на функцию поджелудочной железы, описано в Примере 9.
В другом общем аспекте соединения по данному изобретению также могут применяться для снижения резорбции костей, снижения кальция в плазме и индукции анальгезирующего действия. Соответственно соединения по данному изобретению могут использоваться для лечения заболевания костей, таких как остеопения и остеопороз. Еще в других вариантах осуществления соединения по данному изобретению могут использоваться для лечения боли и болевой нейропатии. Исследование, приведенное в качестве примера, показывающее воздействие на уровни кальция, приведено в Примере 6.
В способах по настоящему изобретению полипептиды можно вводить отдельно или вместе с одним или несколькими другими соединениями, которые демонстрируют длительное или краткосрочное воздействие на снижение усвоения питательных веществ, включая, но не ограничиваясь, другими соединениями и композициями, которые содержат амилин или агонист аналога амилина, кальцитонин лосося, холецистокинин (ССК) или агонист ССК, лептин (ОВ белок) или агонист лептина, экзендин или агонист аналога экзендина, агонист аналога GLP-1 или GLP-1, ингибитор DPPIV, PYY или аналог PYY, AFP-6 (интермедин) или агонист AFP-6, урокортин или агонист урокортина, или адреномедуллин или агонист адреномедуллина. Подходящие агонисты амилина включают в себя, например [25, 28, 29 про-]-амилин человека (также известный как «прамлинтид» и описанный в патентах США №№5686511 и 5998367). Используемый ССК предпочтительно представляет собой октопептид ССК (ССК-8). Лептин описан, например, в публикациях (Pelleymounter, Cullen et al., Science 269: 540-543 (1995); Halaas, Gajiwala et al., Science 269: 543-6 (1995); Campfield, Smith et al., Science 269: 546-549 (1995)). Подходящие экзендины включают в себя экзендин-3 и экзендин-4, а соединения агонисты экзендина включают в себя, например, соединения, описанные в публикациях РСТ WO 99/07404, WO 99/25727 и WO 99/25728. Подходящие PYY полипептиды и аналоги включают в себя те, которые описаны в заявке США №: [№№ в реестре патентных поверенных 18528.662 и 18528.663].
Хотя «ожирение» обычно определяется как индекс массы тела выше 30, в настоящем описании любой пациент, в том числе пациент с индексом массы тела менее 30, который нуждается в снижении массы тела или желает снизить массу тела, включен в объем понятия «страдающий ожирением».
Получение соединений по данному изобретению
Соединения по данному изобретению, описанные здесь, могут быть получены с использованием стандартных рекомбинантных технологий или технологий химического синтеза пептидов, известных в данной области, например, с использованием автоматизированного или полуавтоматизированного пептидного синтезатора или обоих. Подобным образом, производные полипептидов по данному изобретению могут быть получены с использованием стандартных химических, биохимических или in vivo методик.
Соединения по данному изобретению могут быть синтезированы в растворе или на твердой подложке в соответствии с общепринятыми методиками. Различные автоматические синтезаторы коммерчески доступны и могут быть использованы в соответствии с известными протоколами. Смотри, например, Stewart and Young, Solid Phase Peptide Synthesis, 2d. ed., Pierce Chemical Co. (1984); Tam et al., J. Am. Chem. Soc. 105: 6442 (1983); Merrifield, Science 232: 341-7 (1986); и Barany and Merrifield, The Peptides, Gross and Meienhofer, eds., Academic Press, New York, 1-284 (1979). Твердофазный пептидный синтез можно проводить с помощью автоматического синтезатора пептидов (например. Model 430A, Applied Biosystems Inc., Foster City, California) с использованием системы NMP/HOBt (Option 1) и tBoc или Fmoc химии (смотри, Applied Biosystems User's Manual for the ABI 430A Peptide Synthesizer, Version 1.3B July 1, 1988, section 6, pp.49-70, Applied Biosystems, Inc., Foster City, California) с кэппированием. Пептиды могут быть собраны с помощью синтезатора Advanced ChemTech (Model MPS 350, Louisville, Kentucky). Пептиды могут быть очищены с помощью RP-HPLC (препаративной и аналитической), используя, например, систему Waters Delta Prep 3000 и препаративную колонку С4, С8 или С18 (10 µ, 2,2×25 cm; Vydac, Hesperia, California). Активный белок может быть легко синтезирован, а затем подвергнут скринингу в скрининговых анализах, предназначенных для идентификации реакционноспособных пептидов.
Помимо классического пошагового синтеза, конвергентный твердофазный пептидный синтез (также известный как гибридный подход или метод конденсации фрагментов) был разработан для получения комплексных и трудных пептидов и малых белков. В соответствии с этим способом пептидные фрагменты, защищенные соответствующим образом, вытянутые по всей пептидной последовательности и полученные на твердой фазе, конденсируют либо на твердой подложке, либо в растворе, с получением целевого пептида. Доступность новых смол и смоляных основ открыла возможность для быстрого синтеза полностью защищенных пептидных сегментов с помощью твердофазной методики. Данный подход особенно привлекателен для производства крупных молекул, поскольку объединяет преимущества как твердофазного способа синтеза, так и синтеза в жидкой фазе. Время цикла получения короткое, по сравнению с методиками синтеза в жидкой фазе, а выходы и чистота зачастую выше. Кроме того, в промышленном масштабе гораздо легче и позволяет избежать многих агрегационных проблем, часто встречающихся в твердофазном синтезе длинных пептидов.
В другом варианте осуществления в стратегии синтеза используют конвергентную конденсацию фрагментов. Конвергентная конденсация фрагментов представляет собой превосходный способ получения крупных пептидов высокого качества по сравнению со стандартным твердофазным синтезом или стандартным синтезом в жидкой фазе. Такими способами фрагмент может быть синтезирован, одновременно сокращая время для синтеза, а также для обеспечения качества. По мере роста пептидов больше существует риск побочных реакций и неполного синтеза. Было установлено, что пептидные последовательности по данному изобретению могут иметь идеально расположенные глицин и пролин, которые способствуют подходу фрагментов, поскольку эти две аминокислоты не способны к рацемизации во время соединения фрагментов и демонстрируют очень эффективные степени конденсации. Помимо того факта, что прямой твердофазный синтез представляет основные проблемы в промышленно масштабе и, следовательно, вероятно, не подходит для синтеза в большом масштабе, фрагментный подход является гораздо более контролируемым и обеспечивает возможность очистки промежуточных соединений. Дисульфидный мостик расположен только в первом фрагменте и, следовательно, может образоваться на стадии фрагмента полностью защищенным предшественником. Поскольку этот подход дает много преимуществ в плане методики и масштаба, уменьшится время синтеза, поскольку все фрагменты могут быть синтезированы одновременно. Это прекрасный способ свести к минимуму риск и снизить расходы. Следующие фрагменты представлены для того, чтобы показать скелетную структуру желаемых фрагментов, где имеется возможность реализации этой стратегии:
Фрагмент 1: Вос-Х (Вос)-Х-Х (Trt)-X (tBu)-X-X(tBu)-X-X-X-Gly-OH
Циклический (циклизация имела бы место перед соединением фрагментов)
Фрагмент 2: Fmoc-K(Pbf)-X-X(tBu)-X(Trt)-X(OtBu)-X-X(Trt)-X(Pbf)-X-X(Trt)-X(tBu)-X(tBu)-Pro-OH
Фрагмент 3: Fmoc-X(Pbf)-X(tBu)-X(Trt)-X(tBu)-X-X(tBu)-X(Trt)-Thr(tBu)-OH
Фрагмент 4: H-Tyr(tBu)-NH2
Исходя из этих сведений специалисту в данной области будет понятно, какие соединения по данному изобретению были бы идеальны для такого синтеза. Развивающая технология может сделать это возможным только для трех фрагментов, т.е. 4й фрагмент должен создаваться отдельно от 3го.
Соединения по настоящему изобретению альтернативно могут быть получены с помощью рекомбинантных технологий, хорошо известных в данной области. Смотри, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor (1989). Эти полипептиды, полученные с помощью рекомбинантных технологий, могут быть экспрессированы из полинуклеотида. Эти полинуклеотидные последовательности могут включать в себя кодоны, облегчающие транскрипцию и трансляцию мРНК в микробных хозяевах. Такие производящие последовательности могут быть легко сконструированы в соответствии со способами, хорошо известными в данной области. Смотри, например, WO 83/04053. Указанные выше полинуклеотиды также могут необязательно кодировать N-концевой остаток метионина. Непептидные соединения, используемые в настоящем изобретении, могут быть получены способами, известными в уровне техники. Например, фосфатсодержащие аминокислоты и пептиды, содержащие такие аминокислоты, могут быть получены с использованием способов, известных в данной области. Смотри, например, Bartlett and Landen, Bioorg. Chem. 14: 356-77 (1986).
Разнообразные экспрессионные системы вектор/хозяин могут быть использованы для включения и экспрессии кодирующей последовательности новых соединений. Эти системы включают в себя, но не только, микроорганизмы, такие как бактерии, трансформированные рекомбинантным бактериофагом, плазмидой или космидой, ДНК, экспрессирующими векторами; дрожжевые клетки, трансформированные дрожжевыми векторами экспрессии; системы клеток насекомых, инфицированных вирусными векторами экспрессии (например, бакуловирус); системы клеток растений, трансфектированных вирусными векторами экспрессии (например, вирус мозаики цветной капусты, CaMV; вирус табачной мозаики, TMV) или трансформированных бактериальными векторами экспрессии (например, Ti или pBR322 плазмида); или системы клеток животных. Клетки млекопитающих, которые используют в получении рекомбинантных белков, включают в себя, но не только клетки VERO, клетки HeLa, клеточные линии овоцитов китайского хомячка (СНО), клетки COS (такие как COS-7), клетки WI 38, ВНК, HepG2, 3Т3, RIN, MDCK, A549, РС12, К562 и 293. Протоколы, приводимые в качестве примера, для рекомбинантной экспрессии белка описаны здесь ниже.
По существу, полинуклеотидные последовательности, предлагаемые данным изобретением, используют при получении новых и пригодных плазмидных ДНК векторов, новых и пригодных трансформированных и трансфектированных прокариотических и эукариотических клеток-хозяев (в том числе бактериальных клеток, клеток дрожжей и млекопитающих, выращенных в культуре), и новых и эффективных способов для культурального роста таких клеток-хозяев, способных экспрессировать полипептиды по настоящему изобретению. Полинуклеотидные последовательности, кодирующие новые соединения, здесь также могут быть использованы для генной терапии.
Настоящее изобретение также относится к способам для рекомбинантной ДНК продукции новых соединений. Предложен способ получения полипептидов из клетки-хозяина, содержащей нуклеиновые кислоты, кодирующие новые соединения, включающий в себя: (а) культивирование клетки-хозяина, содержащей полинуклеотиды, кодирующие такие полипептиды в условиях, облегчающих экспрессию такой молекулы ДНК; и (b) получение новых соединений.
Клетки-хозяева могут быть прокариотическими или эукариотическими и включают в себя клетки бактерий, млекопитающих (такие как овоциты китайского хомячка, клетки обезьян, клетки почек детенышей хомяка, злокачественные клетки или другие клетки), клетки дрожжей и клетки насекомых.
Системы клеток-хозяев млекопитающих для экспрессии рекомбинантного белка также хорошо известны специалистам в данной области. Штаммы клеток-хозяев могут быть выбраны по специфической способности к процессу экспрессии белка или производить определенные посттрансляционные модификации, которые будут использоваться для обеспечения активности белка. Такие модификации полипептида включают в себя, но не только ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацетилирование. Посттрансляционный процессинг, который расщепляет «препро» форму белка, также может иметь большое значение для правильной вставки, укладки и/или функции. Различные клетки-хозяева, такие как СНО, HeLa, MDCK, 293, WI38 и подобные, имеют специфический клеточный аппарат для таких посттрансляционных функций и могут быть выбраны для обеспечения правильной модификации и процессинга введенного чужеродного белка.
Альтернативно дрожжевая система может быть использована для получения новых соединений по данному изобретению. Кодирующая область ДНК, кодирующей новое соединение, амплифицируют с помощью ПЦР. ДНК, кодирующая пре-про-альфа-лидерную последовательность дрожжей, амплифицируют из геномной ДНК дрожжей в рекации ПЦР с использованием одного праймера, содержащего нуклеотиды 1-20 альфа-скрещиваемого фактора гена и другого праймера, комплементарного нуклеотидам 255-235 этого гена (Kurjan and Herskowitz, Cell, 30: 933-43 (1982)). Пре-про-альфа-лидерная кодирующая последовательность и фрагменты кодирующей последовательности нового соединения лигируют в плазмиду, содержащую алкогольдегидрогеназный (ADH2) промотор дрожжей, так что данный промотор направляет экспрессию слитого белка, состоящего из пре-про-альфа фактора, слитого со зрелым новым соединением. По данным Rose and Broach, Meth. Enz. 185: 234-79, Goeddel ed., Academic Press, Inc., San Diego, California (1990), данный вектор дополнительно включает в себя ADH2 терминатор транскрипции ниже клонирующего сайта, «2-микронную» область начала репликации у дрожжей (yeast "2-micron" replication origin), leu-2d ген дрожжей, гены REP1 и REP2 дрожжей, ген β-лактамазы Е.coli и репликатор Е.coli. β-лактамазный и leu-2d гены обеспечивают селекцию бактерий и дрожжей соответственно. Ген leu-2d также обеспечивает повышенное число копий плазмиды в дрожжах для индукции более высоких уровней экспрессии. Гены REP1 и REP2 кодируют белки, участвующие в регуляции числа копий плазмиды.
ДНК конструкцию, описанную в предыдущем абзаце, трансформируют в дрожжевые клетки, используя известный способ, например, обработку ацетатом лития (Steams et al., Meth. Enz. 185; 280-97 (1990)). ADH2 промотор индуцируется при истощении глюкозы в ростовой среде (Price et al., Gene 55: 287 (1987)). Пре-про-альфа последовательность влияет на секрецию слитого белка из клеток. Параллельно, дрожжевой белок КЕХ2 отщепляет пре-про последовательность из готовых соединений по данному изобретению (Bitter et al., Proc. Natl. Acad. Sci. USA 81: 5330-4 (1984)).
Соединения по данному изобретению также могут быть рекомбинантно экспрессированы в дрожжах с использованием коммерчески доступной экспрессионной системы, например, Pichia Expression System (Invitrogen, San Diego, California), в соответствии с инструкциями производителя. Эта система также основывается на пре-про-альфа последовательности для направления секреции, но транскрипцию вставки направляет алкогольоксидазный (АОХ1) промотор при индукции метанолом.
Секретированное новое соединение очищают из ростовой среды дрожжей, например, способами, используемыми для очистки нового соединения из супернатантов бактериальных клеток или клеток млекопитающих.
Альтернативно ДНК, кодирующая новые соединения, может быть клонирована в бакуловирусный вектор экспрессии pVL1393 (PharMingen, San Diego, California). Этот вектор, содержащий новое соединение, затем используют в соответствии с указаниями производителя (PharMingen) для инфицирования клеток Spodoptera frugiperda в среде, не содержащей белок sF9, и для получения рекомбинантного белка. Этот белок очищают и концентрируют из среды с использованием колонки гепарин-Сефароза (Pharmacia, Piscataway, New Jersey) и колонок для последовательного распределения молекул по размеру (Amicon, Beverly, Massachusetts), и ресуспендируют в PBS. SDS-PAGE анализ показывает одну полосу и подтверждает размер белка, и секвенирование методом Эдмана на пептидном секвенаторе Proton 2090 Peptide Sequencer подтверждает его N-концевую последовательность.
Например, ДНК последовательность, кодирующая желаемое новое соединение, может быть клонирована в плазмиду, содержащую желаемый промотор и, необязательно, лидерную последовательность (смотри, например, Better et al., Science 240: 1041-3 (1988)). Последовательность этой конструкции может быть установлена с помощью автоматизированного секвенирования. Эту плазмиду затем трансформируют в Е.coli, штамм МС1061, используя стандартные методики с применением CaCl2 инкубации и обработки бактерий методом теплового шока (Sambrook et al., supra). Трансформированные бактерии выращивают в среде LB, дополненной карбенициллином, и продукцию экспрессируемого белка индуцируют выращиванием в подходящей среде. При наличии лидерной последовательности она будет влиять на секрецию готового нового соединения и расщепляться во время секреции. Секретированный рекомбинантный белок очищают из бактериальной культуральной среды способом, описанным ниже.
Альтернативно, полипептиды по настоящему изобретению могут быть экспрессированы в инсекционной системе. Инсекционные системы для экспрессии белка хорошо известны специалистам в данной области. В одной такой системе, вирус ядерного полиэдроза совки калифорнийской люцерновой (Autographa californica) (AcNPV) используют в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в Trichoplusia larvae. Кодирующую последовательность новых соединений клонируют в неосновную область вируса, такую как ген полигедрина, и помещают под контроль полигедринового промотора. Успешная вставка нового соединения переведет ген полигедрина в неактивное состояние и будет продуцироваться рекомбинантный вирус, лишенный белка оболочки. Рекомбинантные вирусы затем используют для заражения клеток S.frugiperda или Trichoplusia larvae, в которых экспрессируется данный полипептид (Smith et al., J. Virol. 46: 584 (1983); Engelhard et al., Proc. Natl. Acad. Sci. USA 91: 3224-7 (1994)).
В другом примере последовательность ДНК, кодирующая новое соединение, может быть амплифицирована с помощью ПЦР и клонирована в соответствующий вектор, например, pGEX-3Х (Pharmacia, Piscataway, New Jersey). Вектор pGEX предназначен для получения слитого белка, содержащего глутатион-S-трансферазу (GST), кодируемого этим вектором, и белок, кодируемый фрагментом ДНК, вставленным в клонирующий сайт вектора. Праймеры для ПЦР могут быть получены для включения, например, соответствующего сайта расщепления. Рекомбинантный слитый белок затем может быть отщеплен от GST части слитого белка. Полипептидную конструкцию pGEX-3Х/аналог PYY трансформируют в Е.coli XL-1 Blue cells (Stratagene, La Jolla, California) и выделяют отдельные трансформированные клетки и выращивают при 37°С в среде LB (дополненной карбенициллином) до оптической плотности 0,4 при длине волны 600 нм с последующей дополнительной инкубацией в течение 4 часов в присутствии 0,5 мМ изопропил β-D-тиогалактопиранозида (Sigma Chemical Co., St. Louis, Missouri). Плазмидную ДНК из отдельных трансформированных клеток очищали и частично секвенировали с использованием автоматизированного секвенатора для подтверждения наличия вставки желаемого гена в соответствующей ориентации.
Ожидается, что слитый белок продуцируется в виде нерастворимого внутриклеточного тельца в бактерии, может быть очищен следующим образом. Клетки собирают центрифугированием; промывают в 0,15 М NaCl, 10 мМ Tris, pH 8, 1 мМ EDTA и обрабатывают лизоцимом 0,1 мг/мл (Sigma Chemical Co.) в течение 15 мин при комнатной температуре. Лизат освобождают от взвешенных частиц с помощью ультразвука, и клеточный дебрис осаждают центрифугированием в течение 10 мин при 12000 × g. Осадок, содержащий слитый белок, ресуспендируют в 50 мМ Tris, pH 8, и 10 мМ EDTA, наслоенной на 50% глицерин, и центрифугируют в течение 30 мин при 6000 × g. Осадок ресуспендируют в стандартном фосфатном буферном растворе (PBS), свободном от ионов Mg++ и Са++. Слитый белок дополнительно очищают фракционированием ресуспендированного осадка в денатурирующем SDS полиакриламидном геле (Sambrook et al., supra). Этот гель пропитывают погружением в 0,4 М KCl для визуализации белка, который вырезают и электроэлюируют в гель разделяющем буфере (gel-running buffer) без SDS. В том случае, если слитый белок GST/новое соединение получают в бактериях в виде растворимого белка, его можно очистить с использованием GST Purification Module (Pharmacia Biotech).
Слитый белок можно подвергнуть ферментации для отщепления GST от готового нового белка. Реакционную смесь для ферментации (20-40 мкг слитого белка, 20-30 единиц тромбина человека) (4000 Ед/мг (Sigma) в 0,5 мл PBS) инкубируют 16-48 часов при комнатной температуре и загружают на денатурирующий SDS-PAGE гель для фракционирования продуктов реакции. Гель пропитывают погружением в 0,4 М KCl для визуализации белковых полос. Идентичность белковой полосы соответствующей ожидаемой молекулярной массе нового соединения может быть подтверждена анализом части аминокислотной последовательности с использованием автоматизированного секвенсера (Applied Biosystems Model 473A, Foster City, California).
В особенно предпочтительном способе рекомбинантной экспрессии новых соединений клетки 293 могут быть ко-трансфектированы плазмидами, содержащими ДНК нового соединения в вектор pCMV (5' CMV промотор, 3' HGH поли А последовательность) и pSV2neo (содержащий ген резистентности neo) с помощью кальцийфосфатного метода. Предпочтительно векторы должны быть линеаризированы SeaI до трансфекции. Подобным образом, может быть использована альтернативная конструкция, использующая похожий вектор pCMV с включенным в него геном neo. Стабильные клеточные линии выбирают из единичных клеточных клонов методом предельных разведений в ростовой среде, содержащей 0,5 мг/мл G418 (антибиотик, подобный неомицину) в течение 10-14 дней. Клеточные линии подвергают скринингу на экспрессию нового соединения с использованием твердофазного иммуноферментного анализа (ELISA) или Вестерн блота, и высокоэкспрессирующие клеточные линии наращивают для выращивания в большом масштабе. Предпочтительно, чтобы трансформированные клетки использовались в течение длительного времени, желателен высокий выход получаемого белка и по существу стабильная экспрессия. После трансформации таких клеток векторами, содержащими селектируемые маркеры наряду с подходящей экспрессионной кассетой, клетки могут расти в течение 1-2 дней в обогащенной среде до их переноса на селективную среду. Селектируемый маркер предназначен для придания резистентности к селекции, и его присутствие позволяет выращивать и восстанавливать клетки, которые успешно экспрессируют вставленные последовательности. Резистентные кластеры стабильно трансформированных клеток могут быть размножены с использованием технологий тканевых культур, соответственно данной клетке.
Ряд селекционных систем может быть использован для восстановления клеток, трансформированных для получения рекомбинантного белка. Такие селекционные системы включают в себя, но не только, гены HSV тимидинкиназы, гипоксантин-гуанин фосфорибозилтрансферазы и аденин фосфорибозилтрансферазы, в tk-, hgprt- или aprt- клетках соответственно. Также антиметаболитная резистентность может быть использована как основа для отбора dhfr, придающего резистентность к метотрексату; gpt, придающего резистентность к микофеноловой кислоте; neo, который придает резистентность к аминогликозиду, G418; также который придает резистентность к хлорсульфурону; и hygro, который придает резистентность к гидромицину. Дополнительные селектируемые гены, которые могут быь использованы, включают в себя trpB, который дает возможность клеткам использовать индол вместо триптофана, или hisD, который дает возможность клеткам использовать гистинол вместо гистидина. Маркеры, которые дают визуальную индикацию для идентификации трансформированных клеток, включают в себя антоцианины, β-глюкоронидазу и ее субстрат, GUS, и люциферазу и ее субстрат, люциферин.
Многие из новых соединений по данному изобретению могут быть получены с использованием комбинации и автоматического пептидного синтеза, и рекомбинантных технологий. Например, соединение по данному изобретению может содержать комбинацию модификаций, включающих в себя делецию, замену и вставку с помощью ПЭГилирования. Такие соединения могут быть получены поэтапно. На первой стадии промежуточная форма нового соединения, содержащая модификации делеции, замены, вставки и любой их комбинации, может быть получена с помощью описанных рекомбинантных технологий. Затем после необязательной стадии очистки, описанной ниже, промежуточный полипептид ПЭГилируют посредством химической модификации соответствующим ПЭГилирующим реактивом (например, от Nectar Transforming Therapeutics, San Carlos, California) с получением на выходе желаемого соединения. Специалисту в данной области будет понятно, что вышеописанные процедуры могут быть обобщены применительно к новому соединению, содержащему комбинацию модификаций, выбранных из делеции, замены, вставки, получения производных и других способов модификации, хорошо известных в уровне техники и рассматриваемых настоящим изобретением.
Может быть целесообразным очистить новые соединения, полученные в соответствии с настоящим изобретением. Методики очистки белка хорошо известны специалистам в данной области. Эти методики включают в себя, на одном уровне, предварительное фракционирование клеточной среды на полипептидные и неполипептидные фракции. Отделив данные полипептиды от других белков, полипептиды, представляющие интерес, могут быть дополнительно очищены с использованием хроматографических и электрофоретических методов для достижения частичной или полной очистки (или очистки до гомогенности). Аналитическими методами, особенно подходящими для получения чистого пептида, являются ионобменная хроматография, гельпроникающая хроматография, электрофорез в полиакриламидном геле и изоэлектрофокусирование. Особенно эффективным методом очистки белков является ВЭЖХ с обращенной фазой, с последующим определением свойств очищенного продукта с помощью жидкостной хроматографии/масс-спектрометрии (LC/MS) и лазерной десорбции-ионизации в присутствии матрицы (MALDI) масс-спектрометрии. Дополнительное подтверждение чистоты получают с помощью анализа определения аминокислот.
Некоторые аспекты настоящего изобретения касаются очистки и, в конкретных вариантах осуществления, существенной очистки кодируемого белка или пептида. Различные методики, подходящие для использования при очистке белка, будут хорошо известны специалистам в данной области. Эти методики включают в себя, например, преципитацию сульфатом аммония, ПЭГ, антителами и подобным; тепловую денатурацию с последующим центрифугированием; хроматографические стадии, такие как ионный обмен, гель-фильтрация, обращенная фаза, гидроксиапатитная и аффинная хроматография; изоэлектрофокусирование; гель-электрофорез; и комбинация этих и других методов. Как общеизвестно в уровне техники, считается, что порядок проведения различных стадий очистки может быть измене, или что некоторые стадии могут быть опущены, и тем не менее в результате может быть получен подходящий способ получения по существу очищенного белка или пептида. Способы очистки полипептида можно найти в патенте США №5849883. Эти документы описывают приведенные в качестве примера специфические способы для выделения и очистки G-CSP композиций, которые могут использоваться при выделении и очистке новых соединений по данному изобретению. Давая описания этих патентов, является очевидным то, что специалист в данной области хорошо осведомлен о многочисленных методах очистки, которые могут быть использованы для очистки полипептидов из данного источника. Также предполагается, что комбинация анионобменной и иммуноаффинной хроматографии может быть использована для получения очищенных соединений по данному изобретению.
Соответственно фраза «выделенный полипептид или пептид» относится к полипептиду или пептиду, который по существу свободен от клеточного материала или других загрязняющих белков из клетки или источника ткани, из которого данный белок получен, или по существу свободен от химических предшественников или других химических веществ при химическом синтезе. Выражение «по существу свободен от клеточного материала» включает в себя препараты белка, в которых данный белок отделен от клеточных компонентов клеток, из которых он выделен или рекомбинантно получен. Таким образом, белок, который по существу свободен от клеточного материала, включает в себя препараты белка, имеющие примерно менее 30%, 20%, 10% или 5% (по массе сухого вещества) гетерологичного белка (также называемого здесь «загрязняющим белком»). Когда белок, пептид или их фрагмент получают рекомбинантным путем, он также предпочтительно по существу свободен от культуральной среды, т.е. культуральная среда представляет примерно менее 20%, 10% или 5% объема белкового препарата. В тех случаях, когда белок получают методом химического синтеза, он предпочтительно является по существу свободным от химических предшественников или других химических веществ, т.е. отделен от химических предшественников или других химических веществ, которые принимают участие в синтезе этого белка. Соответственно такие препараты белка содержат примерно менее 30%, 20%, 10%, 5% (по массе сухого вещества) химических предшественников или соединений, отличных от полипептида, представляющего интерес. В предпочтительных вариантах осуществления очищенные или выделенные препараты не будут содержать загрязняющих белков того же животного, из которого данный белок обычно получают, что может достигаться рекомбинантной экспрессией, например, белок человека в клетке, не относящейся к организму человека.
Некоторые предпочтительные способы синтеза описаны в общедоступной патентной заявке с серийным №454533 (подана 6 декабря 1999), полный текст которой включен здесь в качестве ссылки.
По всем показаниям новые соединения можно вводить периферически в дозе, примерно, от 1 мкг примерно до 5 мг в день в единичных или дробных дозах или с контролируемым непрерывным высвобождением или примерно от 0,01 мкг/кг примерно до 500 мкг/кг на дозу, более предпочтительно, примерно от 0,05 мкг/кг примерно до 250 мкг/кг, наиболее предпочтительно примерно ниже 50 мкг/кг. Дозы можно вводить один, два, три или четыре раза в день. Дозы в этих диапазонах будут изменяться в зависимости от активности каждого аналога или производного, разумеется, и могут быть определены специалистом в данной области.
В способах по настоящему изобретению полипептиды можно вводить отдельно или вместе с одним или несколькими другими соединениями и композициями, которые проявляют длительное или кратковременное действие, направленное на уменьшение усвоения питательных веществ, в том числе, но не только, другими соединениями и композициями, которые содержат амилин или агонист аналога амилина, кальцитонин лосося или агонист кальцитонина лосося, холецистокинин (ССК) или агонист ССК, лептин (OB белок) или агонист лептина, экзендин или агонист аналога экзендина, или GLP-1 или агонист аналога GLP-1 или PYY или аналог PYY, или полипептид, родственный PYY. Подходящие агонисты амилина включают в себя, например, [25, 28, 29 про-]-амилин человека (также известный как «прамлинтид» и описанный в патентах США №№5686511 и 5998367). Используемый ССК предпочтительно представляет собой октопептид ССК (ССК-8). Лептин описывается, например, в (Pelleymounter, Cullen et al., Science 269: 540-543 (1995); Halaas, Gajiwala et al., Science 269: 543-6 (1995); Campfield, Smith et al., Science 269; 546-549 (1995)). Подходящие экзендины включают в себя экзендин-3 и экзендин-4, а соединения агониста экзендина включают в себя, например, соединения, описанные в публикациях РСТ WO 99/07404, WO 99/25727 и WO 99/25728. Подходящие полипептиды PYY и аналоги включают в себя те, которые описаны в заявке США №.: [№№ в реестре патентных поверенных 18528740 и 18528.723].
Фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически или профилактически эффективное количество, по меньшей мере, одного соединения по данному изобретению, или их фармацевтически приемлемой соли, вместе с фармацевтически приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями, используемыми при доставке новых соединений. Такие соединения могут включать в себя разбавители с различным буфером (например, ацетатным, цитратным, тартратным, фосфатным, ТРИС), рН и ионной силой; добавки, такие как поверхностно-активные вещества и солюбилизирующие компоненты (например, сорбитан моноолеат, лецитин, плуроникс, Твин 20 & 80, полисорбат 20 & 80, пропиленгликоль, этанол, ПЭГ-40, додецилсульфат натрия), антиоксиданты (например, монотиоглицерол, аскорбиновая кислота, ацетилцистеин, соли серной кислоты (бисульфит и метабисульфит), консерванты (например, фенол, метакрезол, бензиловый спирт, парабены (метил, пропил, бутил), хлорид бензалкония, хлорбутанол, тимерсол, соли фенилртути (ацетат, борат, нитрат) и агенты для установления тоничности/наполнители (глицерин, хлорид натрия, манит, сахароза, трегалоза, декстроза), включение вещества в конкретные препараты полимерных соединений, таких как полимолочная кислота, полигликолевая кислота и т.д., или совместно с липосомами. Такие композиции будут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость выведения in vivo соединений по настоящему изобретению. Смотри, например. Remington's Pharmaceutical Sciences 1435-712, 18th ed., Mack Publishing Co., Easton, Pennsylvania (1990).
В основном, соединения по настоящему изобретению будут использоваться так же, как амилин, принимая во внимание его фармакологические свойства. Одним предпочтительным применением является периферическое введение этих новых соединений для лечения или профилактики метаболических состояний и нарушений. В частности, соединения по данному изобретению обладают активностью в качестве действующих веществ для уменьшения усвоения питательных веществ, уменьшения потребления пищи и обеспечения потери массы тела.
Новые соединения могут быть получены для периферического введения, включая получение состава для инъекций, перорального введения, назального введения, пульмонального введения, местного введения или других видов введения, известных специалистам в данной области. Примеры составов можно найти в патенте США 6410511 и патентной заявке №10/159,779, включенных здесь в качестве ссылки в полном объеме. Более конкретно, введение фармацевтических композиций по настоящему изобретению может осуществляться любым обычным путем, пока целевая ткань доступна через этот путь. В предпочтительном варианте осуществления фармацевтические композиции можно вводить пациенту любым общепринятым периферическим способом, например, внутривенным, внутрикожным, внутримышечным, внутрь молочной железы, интраперитонеальным, интратекальным, ретробульбарным, внутрилегочным (например, периодическое высвобождение); пероральным, сублингвальным, назальным, анальным, вагинальным или чрескожным путем введения или посредством хирургической имплантации в конкретное место. Лечение может состоять из единичной дозы или множественных доз на протяжении периода времени. Также рассматривается контролируемое непрерывное высвобождение композиций по настоящему изобретению. Примеры технологии микросфер можно найти в патенте США 6458387 и патенте США 5578708, включенных здесь в качестве ссылки в полном объеме.
Фармацевтические составы могут быть жидкими или могут быть твердыми, например, лиофилизированными, для восстановления. Водные композиции по настоящему изобретению содержат эффективное количество новых соединений, растворенных или диспергированных в фармацевтически приемлемом носителе или водной среде. Фраза «фармацевтически или фармакологически приемлемый» относится молекулярным образованиям и композициям, которые не дают нежелательных, аллергических или других неблагоприятных реакций при введении животному или человеку. Используемый здесь «фармацевтически приемлемый носитель» включает в себя любой и все растворители, дисперсионную среду, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и подобное. Применение такой среды и агентов для фармацевтически активных веществ хорошо известно в данной области. За исключением несовместимости какой-либо обычной среды или агента с активным веществом, рассматривается его использование в терапевтических композициях. Дополнительные активные ингредиенты также могут быть включены в данные композиции. В некоторых случаях будет уместно предоставлять соединение по данному изобретению и другой агент, уменьшающий потребление пищи, снижающий уровень глюкозы в плазме или изменяющий уровень липидов в плазме, такой как амилин, аналог агониста амилина, ССК или агонист ССК, или лептин или агонист лептина, или экзендин или аналог агониста экзендина, или PYY или аналог PYY, в одной композиции или растворе для совместного введения. В других случаях более предпочтительным может быть введение дополнительного агента отдельно от нового соединения.
Соединения по данному изобретению могут быть получены для введения в виде растворов свободного основания или фармакологически приемлемых солей в воде, соответствующим образом смешанных с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Используемая здесь фраза «фармацевтически приемлемые соли» относится к солям, полученным из фармацевтически приемлемых, предпочительно нетоксичных кислот и оснований, в том числе неорганических и органических кислот и оснований, включающих в себя, но не только, серную, лимонную, малеиновую, уксусную, щавелевую, соли гидрохлорид, гидробромид, гидриодид, нитрат, сульфат, бисульфит, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, глюконат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемые соли включают в себя соли, образованные свободными аминогруппами, такие как, но не только, соли, полученные из соляной, фосфорной, уксусной, щавелевой и винной кислот. Фармацевтически приемлемые соли также включают в себя соли, образованные свободными карбоксильными группами, например, но не только, соли, полученные из натрия, калия, аммония, натрия-лития, кальция, гидроксидов железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина и прокаина. В обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов.
В одном варианте осуществления фармацевтические композиции по настоящему изобретению получают таким образом, чтобы они подходили для парентерального введения, например, путем инъекции или инфузии. Предпочительно, новое соединение суспендируют в водном носителе, например, в изотоническом буферном растворе при рН примерно от 3,0 примерно до 8,0, предпочтительно при рН примерно от 3,0 примерно до 7,4, от 3,5 до 6,0 или от 3,5 примерно до 5,0. Подходящие буферы включают в себя ацетатнатриевый/уксусная кислота, лактат натрия/молочная кислота, аскорбиновая кислота, цитрат натрия/лимонная кислота, бикарбонат натрия/карбоновая кислота, сукцинат натрия/янтарная кислота, гистидин, бензоат натрия/бензойная кислота и фосфаты натрия, и Трис(гидроксиметил)аминометан. Форма депонирования или «депо» препарата с медленным высвобождением может быть использована так, что фармацевтически эффективные количества препарата доставляются в кровоток на протяжении многих часов или дней после чрескожной инъекции или доставки.
Фармацевтические композиции, подходящие для инъекционного применения, включают в себя стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного приема. Во всех случаях данная форма должна быть стерильной и текучей для легкого набора в шприц. Также желательно для PPF полипептида по данному изобретению, чтобы она была стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, сорбит, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и подобные), диметилацетамид, креморфор EL, их подходящие смеси и масла (например, соевое, кунжутное, касторовое, масло семян хлопка, этилолеат, изопропилмиристат, гликофурол, кукурузное). Нужную текучесть можно установить, например, используя покрытия, такие как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Защиту от действия микроорганизмов можно осуществить различными антибактериальными и противогрибковыми агентами, например, метакрезолом, бензиловым спиртом, парабенами (метил, пропил, бутил), хлорбутанолом, фенолом, солями фенилртути (ацетат, борат, нитрат), сорбиновой кислотой, тимеросалом и подобным. Во многих случаях будет предпочтительным включать агенты для регуляции тоничности (например, сахара, хлорид натрия). Длительную абсорбцию инъецируемых композиций можно осуществить использованием в данных композициях агентов, задерживающих абсорбцию (например, моностеарата алюминия и желатина). Фармацевтическая композиция, приводимая в качестве примера, может представлять собой 0,1-5% соединение по данному изобретению в водной системе наряду приблизительно с 0,02 примерно 0,5% (мас./об) ацетатного, фосфатного, цитратного или глутаматного буфера до рН конечной композиции приблизительно от 3,0 примерно до 6,0, а также приблизительно от 1,0 до 10% (мас./об) углеводного регулятора тоничности или многоатомного спирта; и, необязательно, приблизительно от 0,005 до 1,0% (мас./об) консерванта, выбранного из группы, состоящей из м-крезола, бензилового спирта, парабенов и фенола.
Стерильные инъекционные растворы могут быть получены включением активных соединений в нужном количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, по необходимости, с последующей фильтрационной стерилизацией. В основном, дисперсии готовят путем включения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются методы вакуумной сушки и сушки вымораживанием с получением на выходе активного ингредиента в виде порошка плюс любой дополнительный необходимый ингредиент из его раствора, предварительно стерилизованный фильтрованием.
В основном, терапевтически или профилактически эффективное количество новых соединений по настоящему изобретению будет определяться возрастом, массой тела и состоянием или тяжестью заболеваний или метаболических состояний пациента. Смотри, например, Remington's Pharmaceutical Sciences 697-773. See also Wang and Hanson, Parenteral Formulations of Proteins and Peptides: Stability and Stabilizers, Journal of Parenteral Science and Technology, Technical Report No. 10, Supp. 42:2S (1988). Обычно может быть использована доза примерно от 0,001 мкг/кг массы тела в сутки примерно до 1000 мкг/кг массы тела в сутки, но может быть использована большая или меньшая дозы на усмотрение лечащего врача. Дозирование может быть один или несколько раз в день, или реже, и может быть в сочетании с другими композициями, как описано здесь. Следует отметить, что настоящее изобретение не ограничивается указанными здесь дозами.
Соответствующие дозировки можно определить путем использования установленных методов анализа для определения уровня метаболических состояний или нарушений совместно с соответствующими данными доза-ответ. Конечный режим дозирования будет определяться лечащим врачом с учетом факторов, которые модифицируют действие лекарственных средств, например, специфической активности лекарственного средства, тяжести поражения и чувствительности пациента, возраста, состояния, массы тела, пола и режима питания пациента, тяжести какой-либо инфекции, времени введения и других клинических факторов. После проведения исследования дополнительная информация будет выяснена относительно соответствующих уровней доз и продолжительности лечения для отдельных заболеваний и состояний.
Эффективная доза обычно находится в диапазоне примерно от 1 до 30 мкг примерно до 5 мг/день, предпочтительно примерно от 10 до 30 мкг примерно до 2 мг/день и более предпочтительно примерно от 5 до 100 мкг примерно до 1 мг/день, наиболее предпочтительно примерно от 5 мкг примерно до 500 мкг/день, введенная в единичной дозе или дробных дозах. Дозировки могут составлять примерно от 0,01 примерно до 500 мкг/дозу. Предполагается, что соединения по данному изобретению можно вводить 1, 2, 3, 4 или более раз в день. Соответственно дозы, приводимые в качестве примера, можно получить из общего количества лекарственного средства, вводимого за сутки и количества введенных доз. Например, дозы, приводимые в качестве примера, могут находиться в диапазоне примерно от 0,125 мкг/дозу (0,5 мкг вводимые четыре раза в день) примерно до 5 мг/дозу (5 мг введенные один раз в день). Другие дозировки могут составлять примерно от 0,01 примерно до 100 мкг/кг/дозу. Другие дозы, приводимые в качестве примера, могут составлять 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мкг/дозу. Точную вводимую дозу может определить специалист в данной области, и она зависит от активности конкретного соединения, а также от возраста, массы тела и состояния конкретного человека. Введение следует начинать всякий раз, когда нужно ослабить усвоение питательных веществ, уменьшить потребление пищи, снизить массу тела, уровень глюкозы в крови или липидов в плазме, например, при первых признаках симптомов или вскоре после диагностирования ожирения, сахарного диабета или синдрома резистентности к инсулину. Введение можно осуществлять любым путем, например, инъекционно, предпочтительно подкожно или внутримышечно, перорально, назально, чрескожно и т.д. Дозировки для конкретных путей введения, например перорального введения, могут быть увеличены с учетом желаемой биодоступности, например, примерно в 5-100 раз.
В одном варианте осуществления, в котором фармацевтические композиции вводят парентерально, композицию составляют таким образом, чтобы доставляемая доза новых соединений находилась в интервале от 01 мкг/кг до 100 мг/кг массы тела в день, предпочтительно в интервале доз от 10 мкг/кг примерно до 50 мг/кг массы тела в день. Парентеральное введение можно проводить сначала болюсно с последующей инфузией для поддержания терапевтических циркулирующих уровней лекарственного продукта. Специалистам в данной области легко установить оптимальные эффективные дозировки и режимы введения, определяемые хорошей медицинской практикой и клиническим состоянием конкретного пациента.
Частота дозирования будет зависеть от фармакокинетических параметров действующих веществ и путей введения. Оптимальные фармацевтические составы будут определяться специалистом в данной области в зависимости от пути введения и необходимой дозировки. Смотри, например. Remington's Pharmaceutical Sciences, supra, страницы 1435-1712. Такие составы могут оказывать влияние на физическое состояние, стабильность, скорость высвобождения in vivo и скорость выведения in vivo введенных действующих веществ. В зависимости от пути введения подходящие дозы могут быть рассчитаны в соответствии с массой тела, площадью поверхности тела или размера органа. Дальнейшее уточнение расчетов, необходимое для определения соответствующей лечебной дозы, обычно проводится специалистом в данной области без проведения дополнительных экспериментов, особенно в свете описанной информации по дозам и методам анализа, а также фармакокинетических данных, наблюдаемых в испытаниях на животных и в клинических испытаниях на людях.
Будет понятно, что фармацевтические композиции и способы лечения по данному изобретению могут использоваться в области медицины и ветеринарии. Таким образом, пациентом, которому проводят лечение, может быть млекопитающее, предпочтительно, человек или другое животное. Для ветеринарных целей пациенты включают в себя, например, сельскохозяйственных животных, в том числе, коров, овец, свиней, лошадей и коз, домашних животных-спутников, таких как собаки и кошки, экзотических и/или животных зоопарка, лабораторных животных, в том числе мышей, крыс, кроликов, морских свинок и хомячков; и домашнюю птицу, например, цыплят, индеек, уток и гусей.
Для лучшего понимания настоящего изобретения включены следующие Примеры. Эксперименты, относящиеся к данному изобретению, не следует рассматривать как конкретно ограничивающие данное изобретение и такие варианты изобретения, известные к настоящему времени или разработанные позже, которые были бы в компетенции специалиста в данной области, считаются подпадающими под объем данного изобретения, описанного здесь и заявленного далее.
ПРИМЕРЫ
Пример 1: Синтез полипептидов, снижающих потребление калорий
Следующие полипептиды могут быть синтезированы с использованием стандартных способов синтеза полипептидов. Такие способы описаны ниже в патенте США 6610824 и патенте США 5686411 и в патентной заявке с серийным номером 454533 (подана 6 декабря 1999), полные тексты которых включены здесь в качестве ссылки.
Полипептиды собирают на 4-(2'-4'-диметоксифенил)-Fmoc аминометилфеноксиацетамид норлейцин МВНА-смоле (Novabiochem, 0,55 ммоль/г) используя Fmoc-защищенные аминокислоты (Applied Biosystems, Inc.). В основном, циклы одного соединения используют на протяжении всего синтеза и используют Fast Моc (HBTU активация) химию. Однако в некоторых положениях соединение может быть менее эффективным, чем ожидается и требуются двойные соединения. Снятие защиты (удаление Fmoc группы) растущей пептидной цепи с использованием пиперидина также не всегда может быть эффективным и требуется двойное снятие защиты. Конечное снятие защиты с завершенного пептида на смоле достигается с использованием смеси триэтилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными способами (Introduction to Cleavage Techniques, Applied Biosystems, Inc.) пептиды осаждают в простом эфире/воде (50 мл) и центрифугируют. Осадок восстанавливают в ледяной уксусной кислоте и лиофилизируют. Лиофилизированные пептиды растворяют в воде. Затем определяют приблизительную чистоту. Растворитель А (0,1% TFA в воде) и Растворитель В (0,1% TFA в ACN) используют на стадиях очистки и анализа.
Растворы, содержащие различные полипептиды, наносят на препаративную колонку С-18 и очищают (10%-40% Растворителя В в Растворителе А на протяжении 40 минут). Чистоту фракций определяют изократически с использованием аналитической колонки С-18. Чистые фракции собирают, получая вышеопределенный пептид. Аналитическая RP-HPLC (градиент 30%-60% Растворитель В в Растворителе А на протяжении 30 минут) лиофилизированного пептида для определения времени задержки.
Пример 2: Анализы рецепторного связывания
Вначале полипептиды могут быть использованы в исследованиях для определения способности связывания с рецепторами амилина, кальцитонина и CGRP. Анализы связывания для определения взаимодействий с рецептором амилина, рецептором кальцитонина и рецептором CGRP описаны, например, в патенте США №5264372, полное содержание которого включено здесь в качестве ссылки.
Более подробно, оценку связывания соединений по данному изобретению с амилиновыми рецепторами можно проводить следующим образом. 125I-амилин крыс (Bolton-Hunter меченный на N-концевом лизине) приобретали на фирме Amersham Corporation (Arlington Heights, Ill.). Немеченые пептиды получены от ВАСНЕМ Inc. (Torrance, Calif.) и Peninsula Laboratories (Belmont, Calif).
Самцов крыс Sprague-Dawley® (200-250) грамм скарифицировали декапитацией. Головной мозг помещали в холодный фосфатный буфер (PBS). С вентральной поверхности делают ростральные разрезы до гипоталамуса, ограниченные латерально обонятельными путями и продолжающиеся под углом 45 градусов медиально от этих путей. Эту ткань базальных отделов переднего мозга, содержащую прилежащее ядро и окружающие участки, взвешивают и гомогенизируют в ледяном буфере 20 мМ HEPES (20 мМ HEPES кислоты, рН доводят до 7,4 используя NaOH при 23С). Мембраны промывают три раза в свежем буфере центрифугированием в течение 15 минут при 48000 g. Конечный мембранный осадок ресуспендируют в 20 мМ HEPES буфере, содержащем 0,2 мМ фенилметилсульфонилфторида (PMSF).
Для измерения связывания 125I-амилина мембраны от 4 мг исходной сырой массы ткани инкубируют с 125I-амилином при 12-16 пМ в 20 мМ HEPES буфере, содержащем 0,5 мг/мл бацитрацина, 0,5 мг/мл бычьего сывороточного альбумина и 0,2 мМ PMSF. Растворы инкубируют в течение 60 минут при 2С. Инкубирования завершают фильтрацией через стекловолоконные фильтры GF/B (Whatman Inc., Clifton, N.J.), которые предварительно пропитывают в течение 4 часов в 0,3% полиэтиленимине для уменьшения неспецифического связывания радиоактивно меченных полипептидов. Фильтры промывают непосредственно перед фильтрацией, используя 5 мл холодного PBS, и сразу после фильтрации с использованием 15 мл холодного PBS. Фильтры удаляют и радиоактивность определяют в гамма-счетчике с эффективностью счета 77%. Конкурентные кривые получают измерением связывания в присутствии 10-12-10-6 M немеченого тестируемого соединения и анализируют методом нелинейной регрессии, используя 4-параметрическое логистическое уравнение (Inplot program; GraphPAD Software, San Diego).
В этом анализе очищенный амилин человека связывается со своим рецептором при измеренной IC50 примерно от 50 пМ. Результаты по тестируемым соединениям данного изобретения, представленные в приведенной ниже таблице, показывают, что каждое из соединений обладает значительной рецепторсвязывающей активностью.
Оценка связывания соединений по данному изобретению с CGRP рецепторами проводят главным образом, как описано для амилина, только используют 125I hCGRP и мембраны получают из клеток SK-N-MC, которые, как известно, экспрессируют CGRP рецепторы (Muff R. et.al. Ann NY Acad. Sci. 1992: 657, 106-16). Анализ связывания проводили, как описано для амилина, только используют 13500 имп. в мин. 125I-hCGRP/лунку или 21,7 пМ/лунку (Amersham).
Связывание с рецептором кальцитонина можно изучать, используя СНО клетки или T47D клетки, которые также экспрессируют рецептор кальцитонина (Muff R. et.al, Ann N Y Acad Sci. 1992, 657:106-16 и Kuestner R.E. et. al. Mol Pharmacol. 1994, 46:246-55), как известно в данной области.
Пример 3: Действие полипептидов на потребление пищи
Самок мышей NIH/Swiss (в возрасте 8-14 недель) содержали группами с 12:12 часовым светотемновым циклом. Вода и стандартный гранулированный корм для мышей доступен без ограничения, за исключением тех случаев, когда указано иначе. Животные голодают, начиная, приблизительно, через 1500 часов, 1 день до эксперимента.
Во время = 0 мин все животные получают интраперитонеальную инъекцию носителя или полипептида в объеме 200 мкл/мышь и сразу же получают предварительно взвешенное количество (10-15 г) стандартного корма. Пищу убирают и взвешивают через 30, 60, 120 и 180 минут для определения количества потребленного корма. Результаты данного воздействия на потребление пищи выражают как % изменения по сравнению с контролем.
Как видно на Фиг.1, соединение 2, в дозах от 25 до 300 нмоль/кг, дозозависимо снижало потребление пищи через 30 минут после инъекции. Приведенная ниже таблица показывает сниженное потребление пищи под действием полипептидов, введенных периферически (интраперитонеальная инъекция) в дозах 25 нмоль/кг. Данные в моменты времени 30, 60, 120 и 180 минут представляют снижение общего потребления пищи по сравнению с носителем.
Пример 4: Действие соединений по данному изобретению на снижение массы тела и потребление калорий
Самцов крыс Sprague-Dawley® (350 г; 12-ч светотемновой цикл), размещенных по отдельности, держали на рационе с высоким содержанием жира (58% ккал от жиров) в течение 4 недель. В конце периода откорма 14-дневные осмотические насосы (Durect Corp.) имплантировали в межлопаточную область под анастезией. Крысы с насосами постоянно получали носитель (50% DMSO) или полипептид в дозе 2,9 нмоль/кг/день. Измерения потребления пищи и массы тела проводили еженедельно. На Фигурах 2А и 2В показано, что полипептиды соединения 3, соединения 4 или соединения 5 вызывали снижение потребления калорий и снижение прибавки массы тела на протяжении всего 14-дневного периода испытания.
Приведенная ниже таблица представляет процент потери массы тела на 1 и 2 неделе для нескольких соединений.
Пример 5: Состав тканей тела
Самцов крыс Sprague-Dawley® (420 г; 12-ч светотемновой цикл), размещенных по отдельности, держали на рационе с высоким содержанием жира (58% ккал от жиров) в течение 4 недель. В конце периода откорма 14-дневные осмотрические насосы (Durect Corp.) имплантировали в межлопаточную область под анастезией. Крысы с насосами постоянно получали носитель (50% DMSO) или соединение 1 в дозе 70 нмоль/кг/день. Животных скарифицировали на 12 день. Тела сразу же замораживали и состав тканей тела (жир и белок) определяли химическим анализом (Covance Laboratories, Madison, WI). На фиг.3 показано, как процент от общей массы тела, что содержание жира было снижено у крыс, получавших соединение 1, по сравнению с контрольными животными. Кроме того, соединение 1 увеличивало процент содержания безжировой массы.
Пример 6: Опорожнение желудка и ионы кальция
Опорожнение желудка контролировали измерением появления в плазме меченной тритием глюкозы, введенной через желудочный зонд. Испытуемые самцы крыс Sprague Dawley® (возраст 7-9 недель, 12:12 ч светотемновой цикл) пребывали в сознании, имели свободный доступ к пище и воде до начала эксперимента. Перед введением доз пищу и воду убирали. В момент времени t=-5 мин пептид или носитель (200 мкл солевого раствора) вводили подкожно. В момент времени t=0 мин раствор 1 мл стерильной воды, содержащей 5 мкКю D-[3-3H] глюкозы (Dupont, Wilmington, DE, USA) вводили через ротоглоточную трубку. В момент времени t=20 мин на кончик хвоста наносили местный анестетик (Hurricaine®, 20% жидкого бензокаина). В момент времени t=40 мин, кончик хвоста пережимали скальпелем и ~250 мкл крови собирали в гепаринизированные пробирки. Затем плазму сразу анализировали на содержание кальция в ионной форме с использованием анализатора Ciba/Corning 634 Са/рН (Ciba/Corning, Inc., Medfield, MA). 10 мкл образца плазмы переносили пипеткой в подготовленные сцинтилляционные флаконы (0,5 мл воды +2 мл сцинтиллятора (Ecolite scintillation cocktail ICN, Costa Mesa, CA)), встряхивали и определяли счет в β-счетчике (1209 Rack-beta; LKB-Wallac, Gaithersburg, MD) в течение 1 минуты/флакон.
На фиг.4А точки представляют среднее значение ± sd 6 крыс SD (получающие кормление, находящиеся в сознании). Указанные дозы пептида вводили подкожно в момент времени t=0. Кровь собирали через 35 минут после определения имп. в мин. *Все точки р<0,001 по сравнению с контрольным солевым раствором; ANOVA, тест Даннетта. Из нелинейной регрессии: ED50 = 2,3 мкг/кг. Нижнее значение = 25 имп. в мин/10 мкл; Верхнее значение = 328 имп. в мин/10 мкл. Максимальное снижение в плазме имп. в мин: -92%. Критерий согласия: r2 = 0,9992.
На фиг.4В точки представляют среднее ± sd 6 крыс SD (получающие кормление, находящиеся в сознании). Указанные дозы пептида вводили подкожно в момент времени t=0. Кровь собирали через 35 минут после определения имп. в мин. *Все точки р<0,001 по сравнению с контрольным солевым раствором; ANOVA, тест Даннетта. Из нелинейной регрессии: ED50 = 1,1 мкг/кг. Нижнее значение = 1,2 ммоль/л; верхнее значение = 1,3 ммоль/л. Максимальное снижение в плазме iCa:-14% Критерий согласия: r2 = 0,9936.
Пример 7 Триглицериды
В исследовании 1 самок крыс Harlan Sprague-Dawley® (HSD; HarlanTeklad, Indianapolis, IN), исключенных из разведения, кормили рационом с высоким содержанием жира (40% калорий из жира; Diet #TD95217, HarlanTeklad) в течение 9 недель до начала исследования, оставляя на этой диете на протяжении всего экспериментального периода. Одна группа крыс получала корм ad libitum на протяжении всего исследования для проверки метаболических эффектов соединения 1, типичного соединения данного изобретения, обработка (n=10) по сравнению с контролем, интактные крысы (n=10). Для определения метаболических эффектов соединения 1 при определении ограничения пищи («соблюдение диеты») вторая группа крыс получала 75% от исходного уровня потребления пищи до исследования каждый день в течение 10 дней до введения соединения 1 (n=10) или носителя (n=10) (~5% потеря массы тела по сравнению с предварительным снижением массы тела). В это время всем крысам хирургическим путем имплантировали осмотические насосы Alzet® (Durect, Cupertino, CA) в межлопаточную область подкожно под анастезией изофлураном. Насосы готовили для доставки либо соединения 1 (101 мкг/кг/день), либо носителя (50% диметилсульфоксида [DMSO] в воде) непрерывно в течение 21 дня. Крысам, ограниченным в пище, продолжали давать 75% от исходного уровня потребления пищи каждый день. Через 21 день после воздействия образцы крови брали в гепаринизированные шприцы посредством пункции сердца крыс, анастезированных изофлураном, после всасывания (~2-4 часа голодавших до полудня) и получали плазму для проведения аналитического анализа. Триглицериды плазмы определяли с использованием стандартного автоматического анализа для клинической химии (LabCorp, Inc., San Diego, CA).
В исследовании 2 самцов крыс, склонных к полноте породы Levin крыс HSD (Charles River, Wilmington, MA), кормили рационом с высоким содержанием жира (32% калорий из жиров; Diet #12266В, Research Diets, Inc., New Brunswick, NJ) в течение 6 недель до начала исследования и оставляли на этой диете на протяжении всего экспериментального периода. Начало воздействия начинали с размещения подкожно осмотических насосов, содержащих соединение 1 или DMSO носитель, как в исследовании 1, и продолжали в течение 3 недель (21 день). Метаболические параметры сравнивали между крысами, получавшими соединение 1 (303 мкг/кг/день; n=10), контрольными, получавшими носитель (n=10), и группой с одинаковым кормлением (n=10), получавшей ежедневное количество пищи, потребляемой крысами, получавшими соединение 1. Сбор крови и анализ концентрации триглицеридов в плазме проводили, как в исследовании 1, но используя сбор крови из хвостовой вены на 1 неделе и на 2 неделе.
Исследование 3 проводили, как исследование 2, только воздействие на животных осуществляли в течение 8 недель (56 дней) и другими дозами соединения 1. Через 28 дней воздействия использованные насосы заменяли новыми осмотическими насосами. Насосы готовили для доставки соединения 1 в дозах 1, 3, 10 или 100 мкг/кг/день (n=10/группу) или DMSO носителя (контрольные, n=10). Дополнительная группа получающих одинаковое кормление (n=10) получала носитель и ежедневное количество пищи, потребляемое группой, получающей 100 мкг/кг/день соединения 1. Сбор крови и анализ концентрации триглицеридов в плазме для исходного уровня, 2, 4 и 6 недели получали от сознательно питающихся крыс через хвостовую вену в гепаринизированные пробирки; сбор крови и анализ концентрации триглицеридов в плазме на 8 неделе проводили у крыс, получавших питание при анестезии изофураном, в гепаринизированные шприцы путем пункции сердца, используя стандартный метод анализа триглицеридов (Cobas Mira Plus, Roche Diagnostics).
Различия между средними уровнями триглицеридов в плазме во время воздействия для заданных временных точек исследования оценивали однофакторным дисперсионным анализом (ANOVA), а затем критерием множественного сравнения Даннетта (Prism v. 4.01, GraphPad Software, San Diego, CA). Различия рассматривались как статистически значимые при р<0,05.
Как указано на Фиг.5-7Е, исследования 1, 2 и 3 соответственно введение соединения 1 на протяжении 1-8 недель в результате приводило к значительному снижению концентрации триглицеридов. На фиг.5 показана концентрация триглицеридов в плазме у самок крыс, исключенных из разведения, после 21 дня воздействия соединения 1 путем непрерывной подкожной (п.к.) инфузии. У крыс, которым вводили соединение 1, были показаны значительно более низкие уровни триглицеридов по сравнению с контрольными животными, получавшими неограниченное кормление: этот эффект наблюдался независимо от того, вводили ли соединение 1 в условиях неограниченного питания или в условиях ограничения питания. *р<0,05, **р<0,01 по сравнению с контрольными животными, получавшими носитель и неограниченное питание.
На фиг.6А-6С показана концентрация триглицеридов в плазме у самцов крыс Levin, с ожирением, вызванным рационом питания (DIO) в течение 3 недель воздействия соединением 1 посредством непрерывной п.к. инфузии. На графиках представлены значения, полученные из образцов крови, собранных на (А) 1 неделе, (В) 2 неделе и (С) 3 неделе лечения. *р<0,05, **р<0,01 по сравнению с контрольными животными, получавшими носитель.
На фиг.7А-7Е показано исследование доза - ответ соединения 1, где уже дозы 1 мкг/кг/день в результате приводили к снижению концентраций триглицеридов в плазме по сравнению с контрольным носителем на 2, 4, 6 и 8 неделе (Фиг.7В, С, D и Е соответственно). *р<0,05, **р<0,01 с контрольными животными, получавшими носитель. Испытуемые группы указаны в комментариях к графикам.
Пример 8: анализ грелина
Этот пример представляет иллюстративный анализ определения действия соединений по данному изобретению на грелин.
Самцов крыс Harlan Sprague Dawley® (HSD) содержали при 22,8+/-0,8°С в 12:12-часовом светотемновом цикле. Все эксперименты проводили в световой цикл. Животные голодали приблизительно в течение 20 часов перед проведением эксперимента. Все животные имели свободный доступ к воде до начала эксперимента. Хвосты животных анестезировали 20% бензокаином (Hurricaine, Beutlich Pharmaceutical, Waukegan, IL) и образцы крови собирали из хвостовой вены. Концентрации общего и активного грелина измеряли, используя наборы Linco RIA GHRA-89HK и GHRA-88HK соответственно.
В исследовании 1 у крыс HSD периодически брали образцы крови из анестезированного хвоста и анализировали уровни грелина. В момент времени t=0 крысам (n=6) подкожно вводили 125 мкг/кг пентагастрина (Sigma) для стимуляции секреции желудочного сока (PG=0 мин на Фиг.1) и 20 мин спустя им подкожно вводили 10 мкг амилина крыс. Образцы крови анализировали на общий и активный (ацилированный) грелин (Linco). Как показано на Фиг.8А, амилин снижал содержание активного грелина на ~50% в течение 1 часа.
Исследование 2 проводили для определения, ингибирует ли экзогенный амилин секрецию грелина независимо от стимуляции пентагастрином. Голодным крысам вводили подкожно либо солевой раствор, либо 30 мкг/кг амилина крыс, либо вводили подкожно солевой раствор, либо 125 мкг/кг пентагастрина (Sigma, Lot#050K1525) в момент времени = 0 мин. Амилин крыс (АС0128, lot #AR2081-42A, Amylin Pharmaceuticals), в дозе 30 мкг/кг в 100 мкл солевого раствора, либо только носитель (n=5,5 соответственно), вводили подкожно в момент времени 20 мин. Образцы плазмы крови собирали, по меньшей мере, в моменты времени 0, 10, 20, 30, 60 и 90 мин. Обе фиг.8В и 8С показывают снижение общего грелина плазмы при введении амилина по сравнению с контрольным солевым раствором, а Фиг.8В подтверждает, что грелин плазмы снижался по сравнению с контролем в присутствии одного амилина, т.е. без пентагастрина. Пентагастрин, по-видимому, усиливает эффект амилина в отношении снижения грелина.
Пример 9: Функция поджелудочной железы
Вводили канюли в бедренную артерию и вену голодным анестезированным крысам HSD (массой 320-350 г) и оставляли для стабилизации на 90 минут. В момент времени t=-30, начинали инфузионное введение солевого раствора (1 мл/ч) или соединения 1 (1 мл/ч). В момент времени t=0 крысы получали имп инъекцию церулеина, 10 мкг/кг. Образцы на амилазу, липазу плазмы собирали в различные временные точки от t=-30 до t=240.
Как показано на фиг.9А и 9В, воздействие соединением 1 ослабляло повышение активности панкреатических ферментов в крови в моделе острого панкреатита у крыс, давая возможность предположить, что агонисты амилина могут быть перспективными кандидатами лекарственных средств для профилактики и лечения панкреатита.
Пример 10: Воздействие амилина на секрецию желудочного сока
Самцов крыс Harlan Sprague Dawley ® содержали при 22,8±0,8°С при 12:12-часовом светотемновом цикле. Эксперименты проводили во время светового цикла. Крысы, получающие крысиный корм (Teklad LM 485, Madison, WI), голодали приблизительно в течение 20 часов до проведения эксперимента. Им давали воду без ограничения до начала эксперимента.
Крысам (возраст 9-14 недель, масса тела 264-395 г) хирургическим путем накладывали парные желудочные фистулы (Zivic Miller, Catalog number SCA03.00). Во время лапаротомии под анастезией галотаном прокладку в форе трубки с двумя просветами вшивали в стенку желудка. Две силастиковые канюли с внутренним диаметром 2,3 мм (вход и выход), соединенные с прокладкой и сообщающиеся с просветом желудка, прокладывали через брюшную стенку, подкожно к межлопаточной области, где их по отдельности выводили на поверхность тела. Лапаротомическую рану закрывали зажимом, крыс помещали в нагретые послеоперационные клетки на один день со свободным доступом к воде. В дальнейшем крыс содержали по одиночке со свободным доступом к воде и крысиному корму до голодания в течение ночи для экспериментов, которые проводили на находящихся в сознании крысах примерно через 10-15 дней после хирургического вмешательства.
Желудочные катетеры вскрывали и присоединяли к гибкому шлангу РЕ240 для введения инъекций и взятия образцов. Для обеспечения проходимости катетеров инъекционно вводили 2-3 мл солевого раствора при комнатной температуре и сразу же вынимали из желудка. Это повторяли до легкого прохождения жидкости и прозрачного экссудата. Секрецию желудочного сока измеряли с 10-минутными интервалами путем введения 5 мл солевого раствора и 2 мл воздуха через один катетер, затем сразу же выводя их через другой катетер. Таким путем ошибки вследствие аспирации небольшого секретируемого объема могли быть сведены к минимуму. Три мл содержимого каждого желудка титровали до рН 7,0 0,01 н гидроксидом натрия с использованием рН метра (Beckman модель номер PHI34 Fuller-ton, СА). Количество основания, необходимое для каждого титрования, с поправкой на общий объем содержимого, использовали для расчета молей кислоты в каждом образце.
После сбора исходных образцов и записи собранного объема животным подкожно вводили 125 мкг/кг пентагастрина (Peninsula Laboratories номер лота 019945 и 034686) и через 10 мин продолжали сбор образцов желудочного сока в течение еще 2 часов. Через сорок минут после введения пентагастрина к этому времени наблюдалось стабильное плато секреции желудочного сока, крысам вводили подкожно солевой раствор (n=6) или амилин крыс (серийный номер AR905-80, Amylin Pharmaceuticals Inc., San Diego, СА) в дозах 0,01, 0,1, 1,0, 10,0 или 100 мкг (n=3, 3, 4, 5, 5 соответственно).
Как показано на Фиг.10А, пентагастрин стимулировал секрецию желудочного сока в 4,6 раз от основного уровня примерно от 13.8±2.2 мкмоль/10 мин примерно до 63,4±3,3 мкмоль/10 мин, через 40 минут после введения пентагастрина (общее среднее; Р<0.0001). Амилин, введенный через 40 минут после пентагастрина, дозозависимым образом ингибировал продукцию желудочного сока с периодами полувыведения во время проявления действия 8,6, 10,4, 5,8 и 6,3 мин для доз 0,1, 1, 10 и 100 мкг соответственно. Самая высокая доза (100 мкг) амилина снижала секрецию желудочного сока, стимулированную пентагастрином, на 93,4±2,6% через час после введения амилина (Р<0,001 для доз 0,1-100 мкг). Этот уровень секреции составил только 32% от основного уровня, который предшествовал введению пентагастрина (Р<0,01, t-тест, поправка Велча). Ответ на дозу для ингибирования амилином секреции желудочного сока, стимулированной пентагастрином, показан на Фиг.10В. ED50 для кислотно-суппрессирующего действия амилина составила 0,05 мкг/крысу ± 0,15 логарифмических единиц (41 пмоль/кг).
Пример 11: Гастропротекторые эффекты амилина
Голодным самцам крыс с массой тела 163-196 г вводили подкожно 0,1 мл солевого раствора (n=12) или тот же объем, содержащий амилин крыс в дозах 0,001, 0,01, 0,1, 0,3, 1, 3 или 10 мкг (n=5, 5, 5, 9, 9, 5, 6 соответственно) за 20 мин до введения через зонд 1 мл абсолютного этанола (этиловый спирт-200 стойкий дегидратированный спирт, USP, Spectrum Quality Products/ Inc. Gardena, CA). Через тридцать мин после введения через зонд каждую крысу анестезировали 5% галотаном, желудок оперативно удаляли, вскрывали вдоль малой кривизны и выворачивали для обнажения слизистой оболочки. Вывернутые желудки осторожно промывали солевым раствором и сразу распределяли по повреждению слизистой по каждому из 10 наблюдений независимо от экспериментальной обработки. Шкалу распределения ограничивали от нуля (повреждения не наблюдаются) до 5 (100% поверхности слизистой оболочки геперемировано, покрыто язвами или отторгающимися некротическими массами) по сравнению с 0-5 балльной системой используемой другими, например, Guidobono F. et al. Br J Pharmacol 120:581-586 (1997). Фиг.11А показывает результаты повреждения в баллах как процент повреждения, вызванного этанолом.
Чтобы определить, можно ли гастропротекторный эффект амилина приписать амилинспецифичному механизму, 4 крысам вводили внутривенно 3,0 мг селективного антагониста амилина, АС187 (Amylin Pharmaceuticals, Inc. San Diego, CA), за 25 мин до введения этанола через желудочный зон, затем 5 мин спустя (в момент времени t=-20 мин от введения через желудочный зонд) 0,3 мкг амилина крыс вводили подкожно. Желудки отделяли и располагали по степени повреждения через 30 мин после введения этанола через желудочный зонд, как описано выше. Результат представлен в предпоследнем столбце Фиг.11А. Последний столбец показывает результаты введения 3,0 мг АС187 без инъекции амилина крыс. Выборочно эти результаты показаны на Фиг.11В.
Фиг.11С показывает, что амилин, введенный подкожной инъекцией за 5 мин до введения этанола через желудочный зонд, дозозависимым образом защищал желудок от повреждения слизистой оболочки (Р<0,05 с дозами 0,1 мкг и выше). Амилин снижал повреждение в баллах на 67% в дозах 0,3 мкг и выше. ED50 для гастропротекторного эффекта амилина в этой экспериментальной системе составила 0,036 мкг (31 пмоль/кг) ± 0,40 логарифмических единиц.
Для дальнейшего исследования мог ли гастропротекторный эффект амилина происходить в ответ на стимулированную глюкозой секрецию эндогенного амилина, эффект предварительного интраперитонеального введения глюкозы в отношении индуцированного этанолом гастрита (250 мг/0,5 мл D-глюкозы; t=-30 мин от введения через зонд; n=9) сравнивали с повреждением, наблюдаемым у крыс, получавших носитель (n=23). Желудки удаляли и располагали по степени повреждения через 30 мин после введения этанола через желудочный зонд, как описано выше, и брали кровь для измерения глюкозы в плазме. Повреждающее действие также определяли у крыс, получавших глюкозу, вводимую совместно с 3 мг внутривенно болюсно с АС187 (n=9).
Предварительное введение D-глюкозы, которое повышало уровень глюкозы в плазме в момент времени t=+30 мин позже до 123 мг/дл (vs 76 мг/дл в контроле), и ранее было показано, что повышает концентрации эндогенного амилина в плазме у голодных крыс Sprague Dawley до 4,8±0,6 пМ, значительно снижало степень повреждения желудка на 18,5±4,6% (Р<0,0005). Однако предварительное введение АС187 не оказывало воздействия на степень повреждения у крыс, получавших глюкозу.
Все публикации и патентные заявки, упомянутые в данном описании указывают на уровень квалификации специалистов в данной области, к которым данное изобретение имеет отношение. Все публикации и патентные заявки включены здесь в качестве ссылок в одинаковой степени как каждая отдельная публикация или патентная заявка, указанная в особенности и индивидуально, включена в качестве ссылки.
Хотя вышеизложенное изобретение было описано в некоторых деталях для иллюстрации и в примерах для лучшего понимания, очевидно, что определенные изменения и модификации можно осуществить в пределах объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОДАВЛЕНИЯ ГЛЮКАГОНА | 2000 |
|
RU2247575C9 |
| ЛЕЧЕНИЕ ДИАБЕТА И МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2010 |
|
RU2537181C2 |
| ПЕПТИДНЫЕ АНТАГОНИСТЫ ПЕПТИДНЫХ ГОРМОНОВ ИЗ СЕМЕЙСТВА КАЛЬЦИТОНИНА (CGRP) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2742826C2 |
| ПЕПТИДНЫЕ АНТАГОНИСТЫ ПЕПТИДНЫХ ГОРМОНОВ ИЗ СЕМЕЙСТВА КАЛЬЦИТОНИНА (КАЛЬЦИТОНИН ГЕН-РОДСТВЕННЫХ ПЕПТИДОВ (CGRP)) И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2624016C2 |
| Аналоги инсулина с пониженной аффинностью к рецептору инсулина и их применение | 2017 |
|
RU2764197C1 |
| КОМПОЗИЦИЯ И МИКРОСФЕРА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ ЭКЗЕНДИНА И СПОСОБ ПОЛУЧЕНИЯ МИКРОСФЕРЫ | 2008 |
|
RU2463040C2 |
| АНТИБАКТЕРИАЛЬНЫЕ ПЕПТИДЫ | 2007 |
|
RU2468033C2 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| ПОЛИПЕПТИДЫ АНАЛОГА АМИЛИНА ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2839688C2 |
| Конъюгат физиологически активного вещества длительного действия и его применение | 2018 |
|
RU2773823C2 |
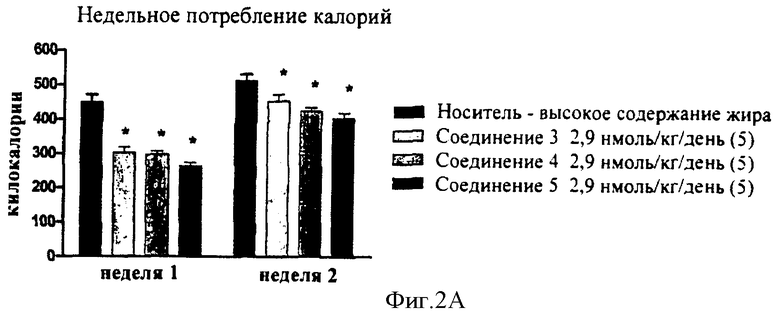
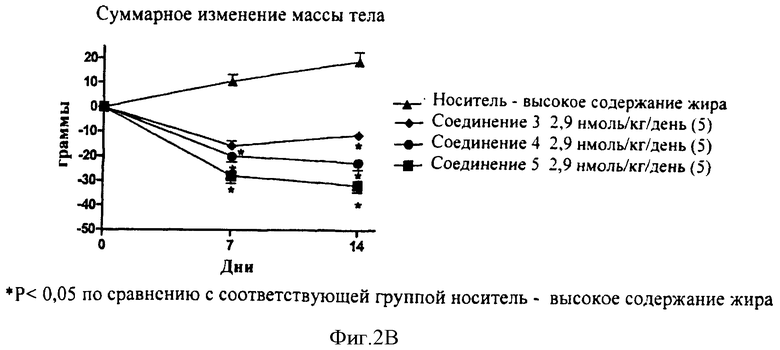
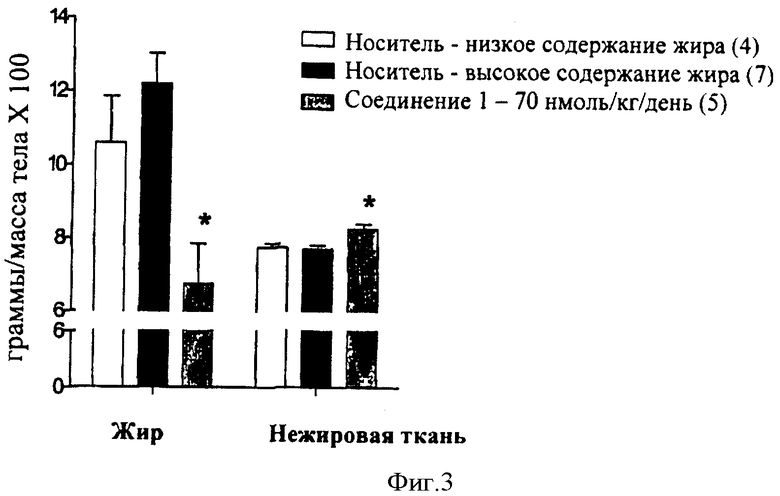
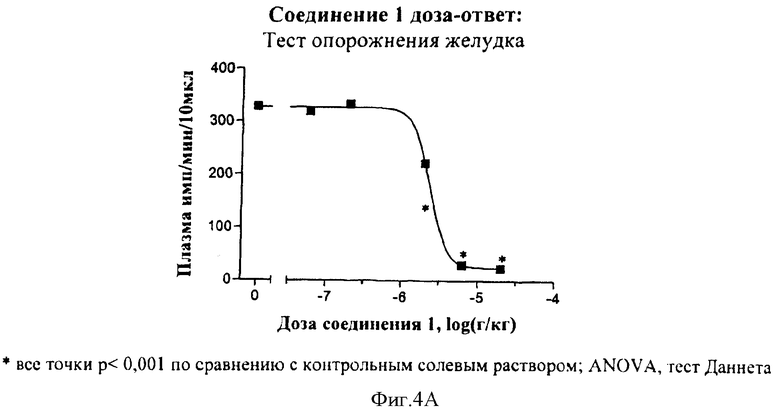
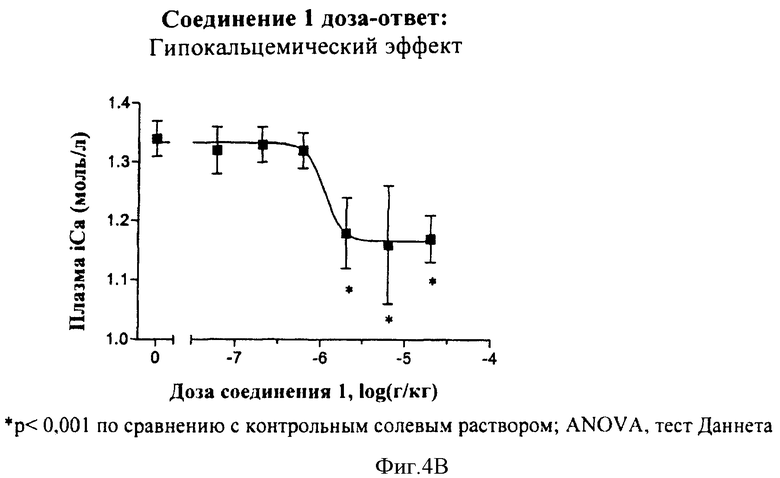
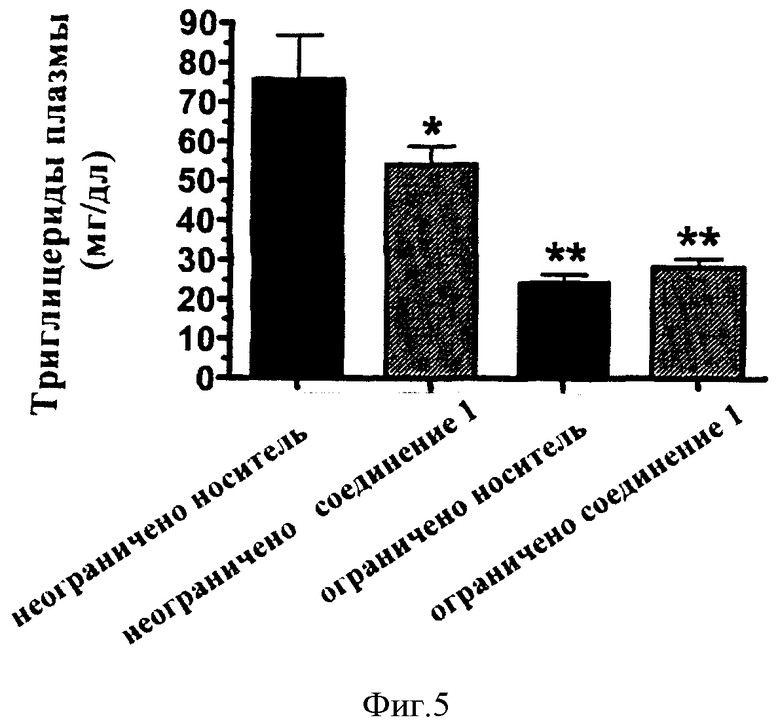
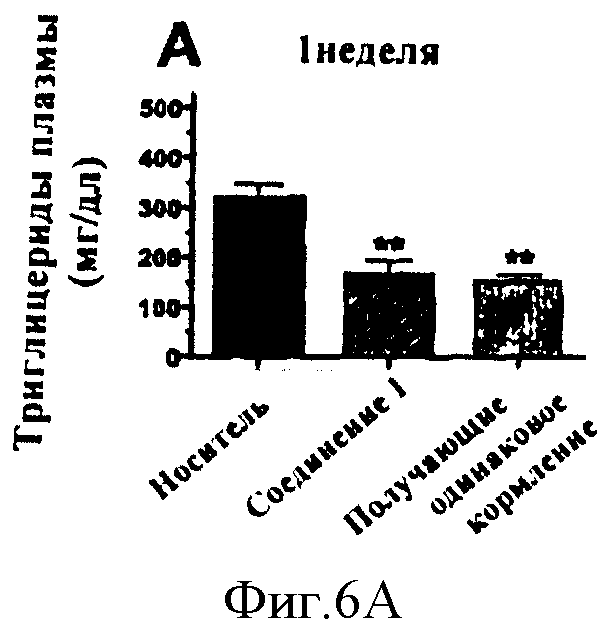
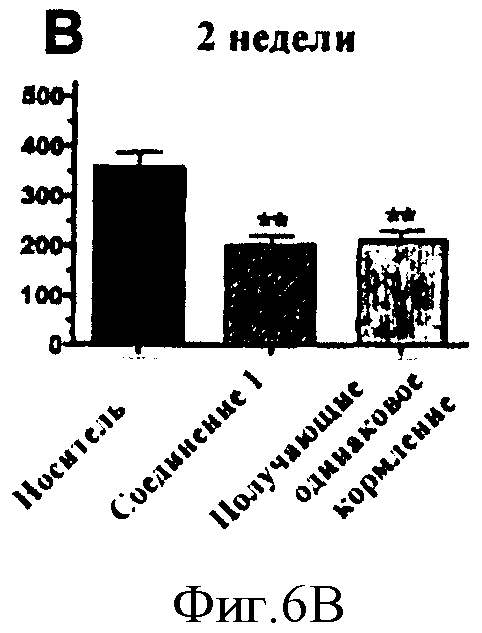
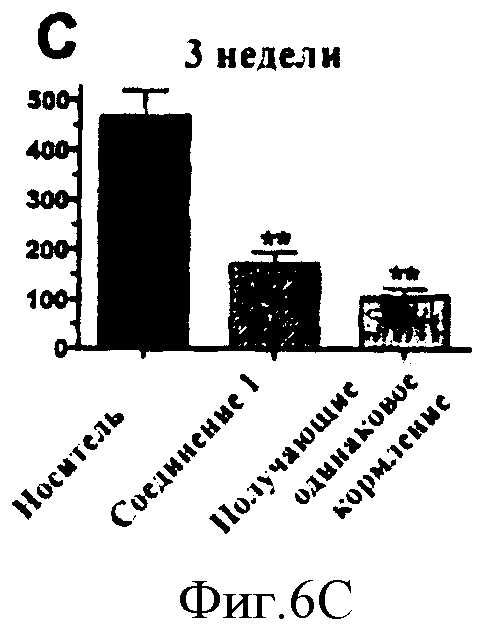
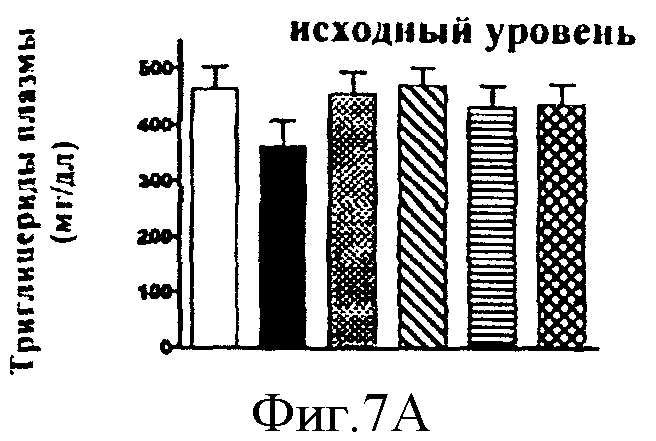
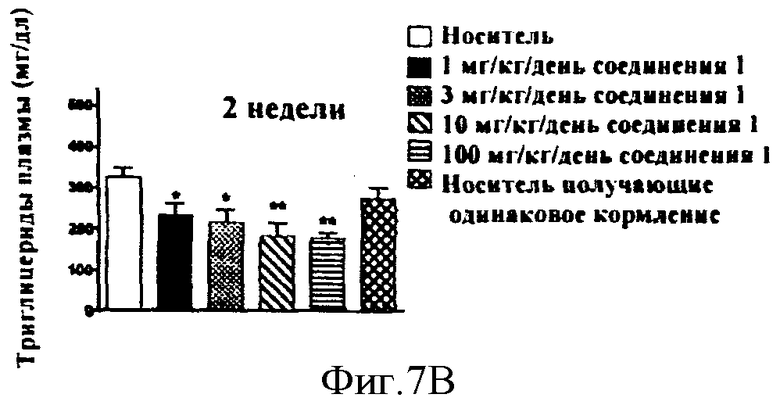
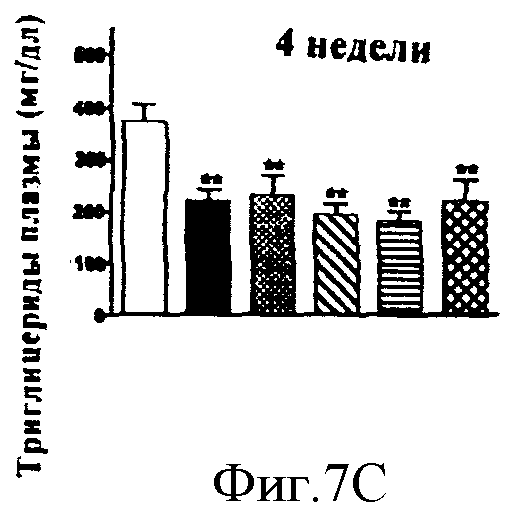
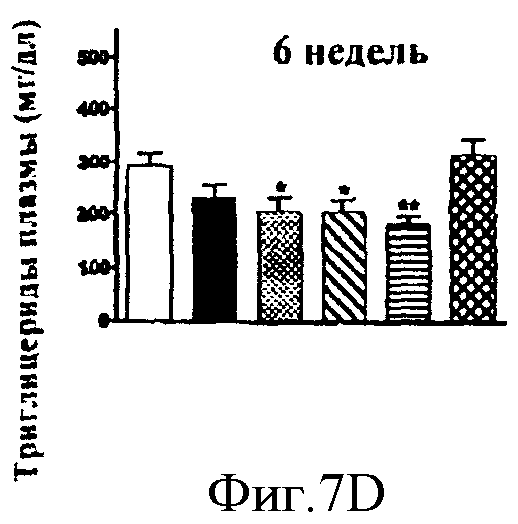

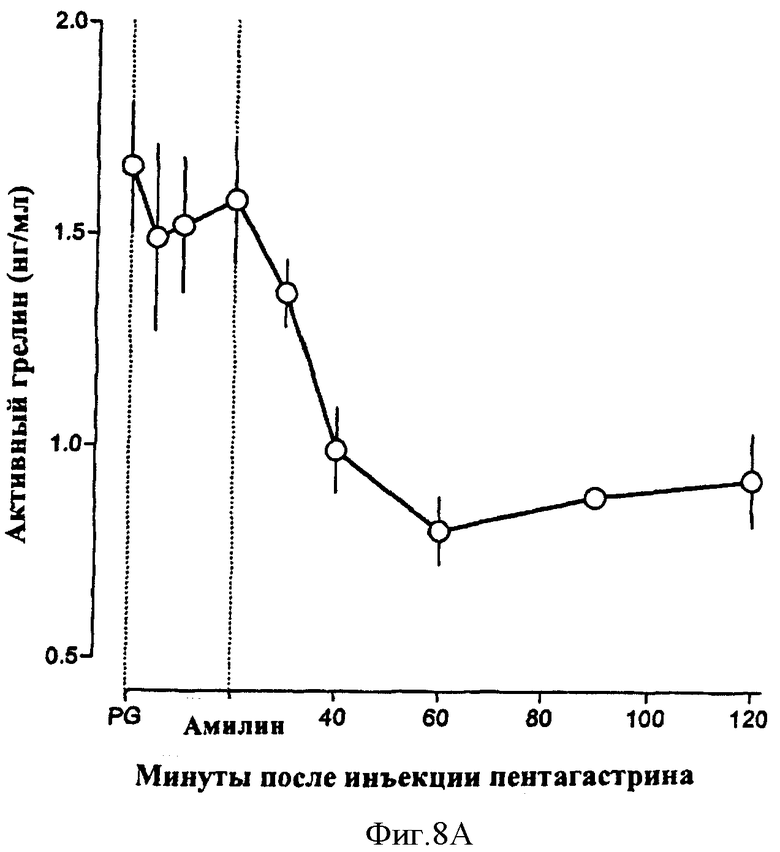
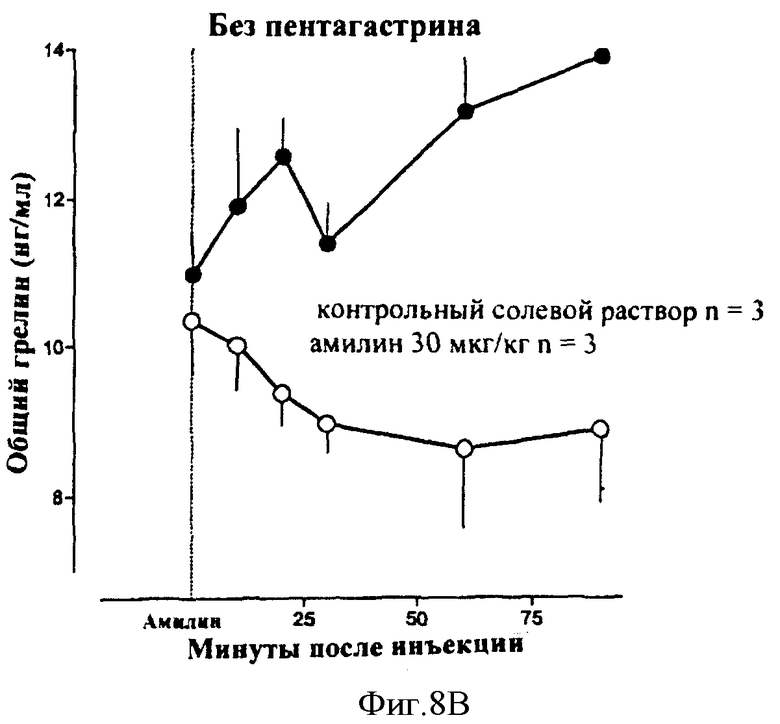
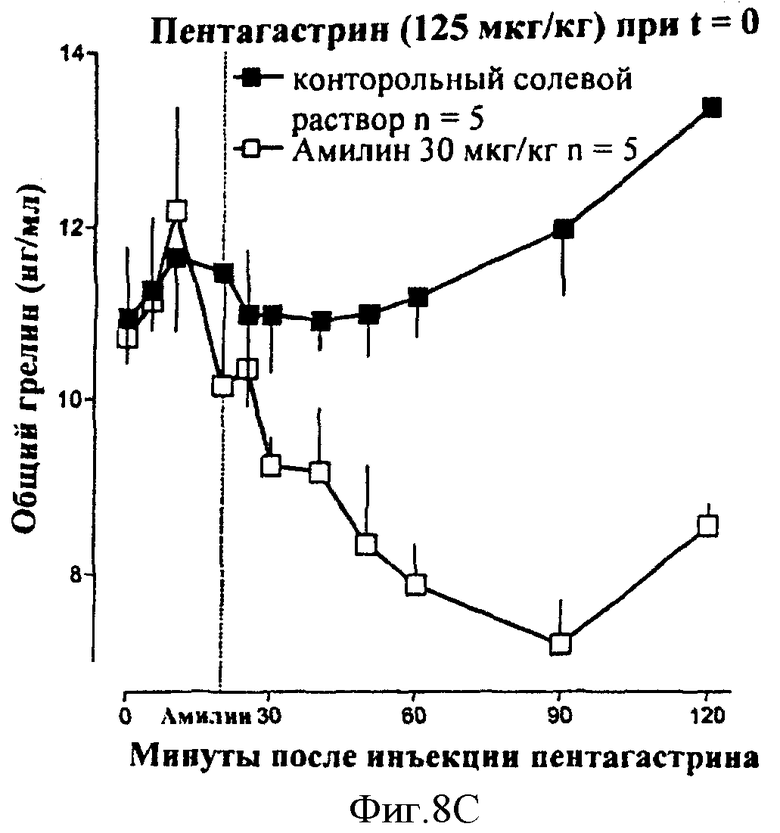
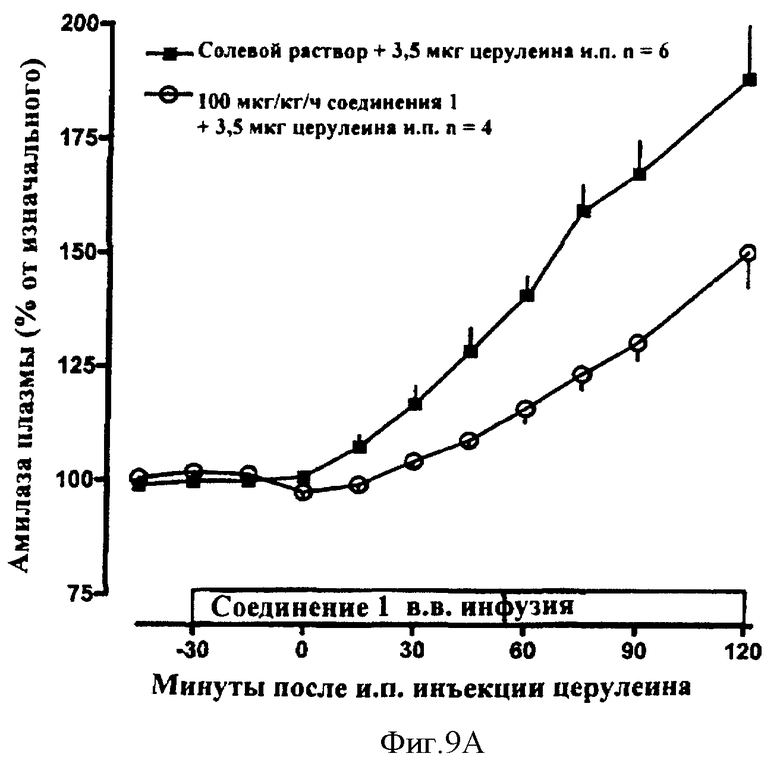
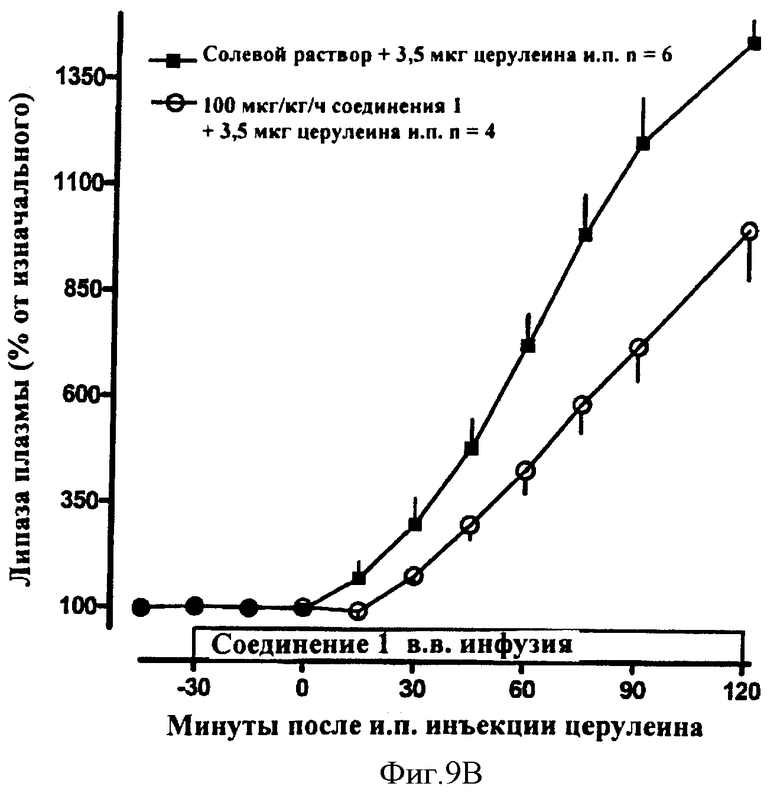
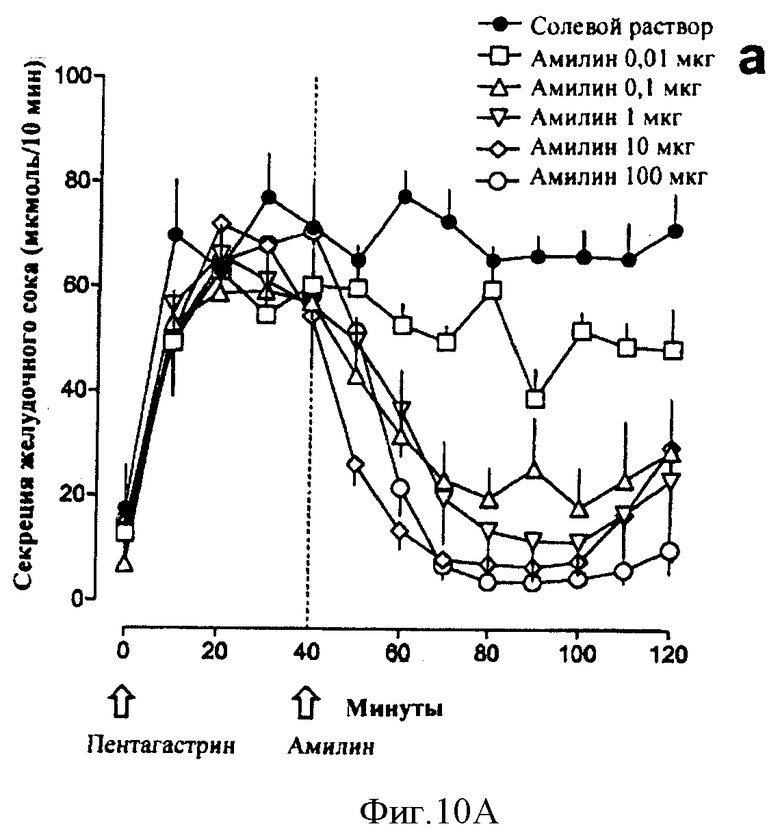
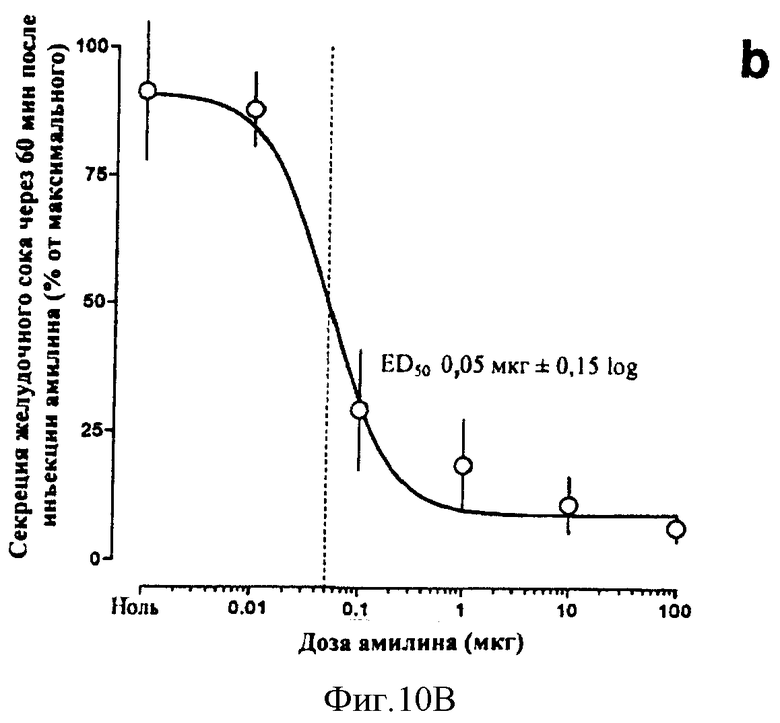
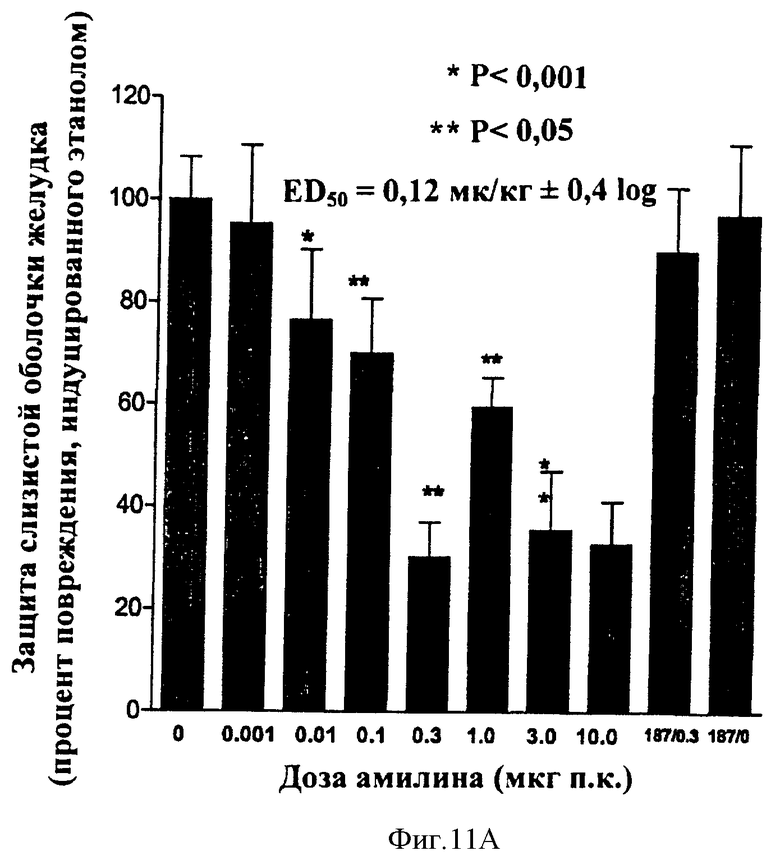
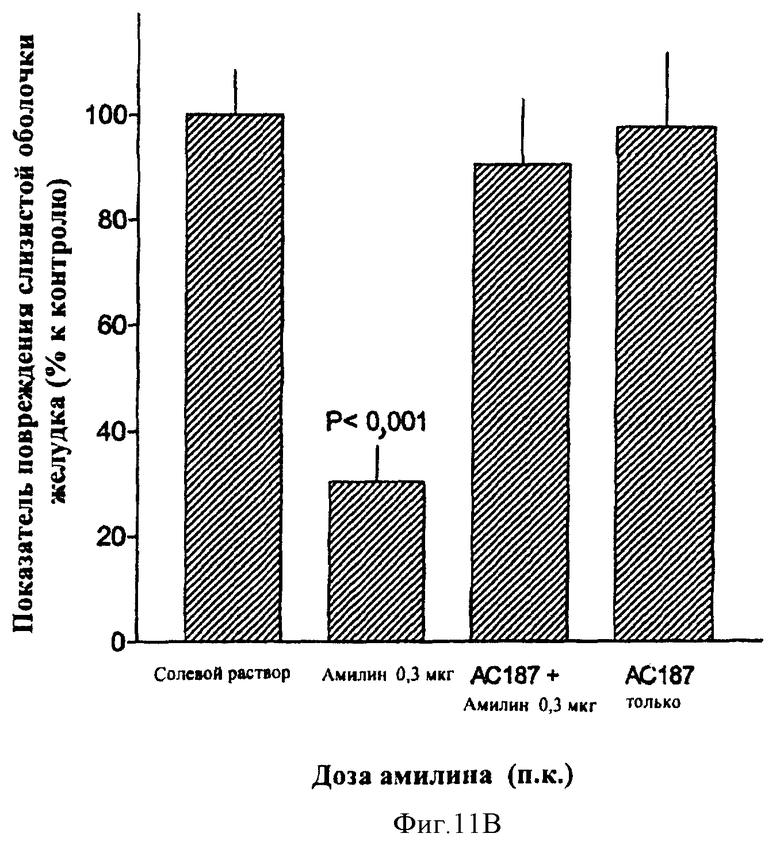
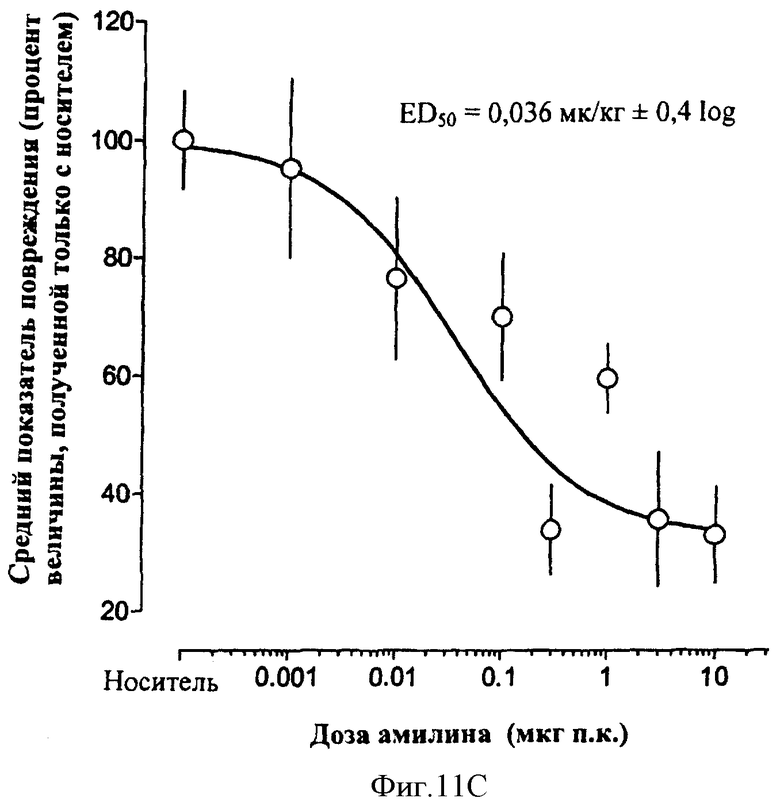
Изобретение относится к области биотехнологии, конкретно к получению пептида, обладающего свойствами амилина, и может быть использовано в медицине. Рекомбинантным путем получают модифицированный пептид. Полученный пептид эффективен в использовании для лечения и профилактики метаболических нарушений, таких как ожирение, диабет и повышенный риск сердечно-сосудистых заболеваний. 10 н. и 6 з.п. ф-лы, 11 ил., 3 табл.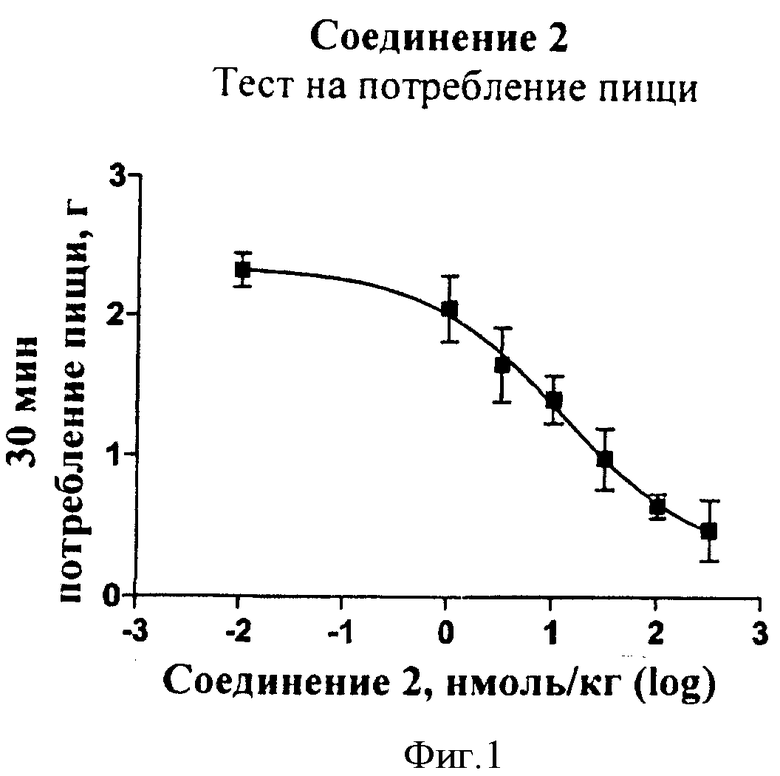
1. Пептид, обладающий свойствами амилина, содержащий аминокислотную последовательность формулы I Xaa1 X Хаа3 Хаа4 Хаа5 Хаа6 Y Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Xaa18 Xaa19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 (SEQ ID NO: 34),
где Xaa1 представляет собой А, С, hC, D, E, F, I, L, К, hK, R, hR, S,
Hse(гомоSER), Т, G, Q, N, M, Y, W, P, Hyp (гидроксипролин), Н, V или отсутствует;
Хаа3 представляет собой А, D, E, N, Q, G, V, R, К, hK, hR, Н, I, L, M, или отсутствует;
Хаа4 представляет собой A, I, L, S, Hse, Т, V, M, или отсутствует;
Хаа5 представляет собой А, S, Т, Hse, Y, V, I, L или M;
Хаа6 представляет собой Т, А, S, Hse, Y, V, I, L или M;
Xaa8 представляет собой А, V, I, L, F или M;
Xaa9 представляет собой L, Т, S, Hse, V, I или M;
Xaa10 представляет собой G, Н, Q, К, R, N, hK или hR;
Xaa11 представляет собой К, R, Q, N, hK, hR или Н;
Xaa12 представляет собой L, I, V, F, M, W или Y;
Хаа13 представляет собой А, F, Y, N, Q, S, Hse, или Т;
Хаа14 представляет собой А, D, E, G, N, К, Q, R, Н, hR или hK;
Хаа15 представляет собой А, D, E, F, L, S, Y, I, V или M;
Хаа16 представляет собой L, F, M, V, Y или I;
Хаа17 представляет собой Н, Q, N, S, Hse, Т или V;
Хаа18 представляет собой К, hK, R, hR, Н, u (Cit) или n (Orn);
Хаа19 представляет собой F, L, S, Hse, V, I, Т, или отсутствует;
Хаа20 представляет собой Н, R, К, hR, hK, N, Q, или отсутствует;
Хаа21 представляет собой Т, S, Hse, V, I, L, Q, N, или отсутствует;
Хаа22 представляет собой F, L, М, V, Y или I;
Хаа23 представляет собой Р или Hyp;
Хаа24 представляет собой Р, Hyp, R,K, hR, hK или Н;
Хаа25 представляет собой Т, S, Hse, V, I, L, F или Y;
Хаа26 представляет собой N, Q, D или Е;
Хаа27 представляет собой Т, V, S, F, I или L;
Хаа28 представляет собой G или А;
Хаа29 представляет собой S, Hse, Т, V, I, L или Y;
Хаа30 представляет собой Е, G, К, N, D, R, hR, hK, Н или Q;
Хаа31 представляет собой А, Т, S, Hse, V, I, L, F или Y; и
Хаа32 представляет собой F, Р, Y, Hse, S, Т или Hyp;
где Х и Y способны образовать связь и представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи.
2. Пептид по п.1, отличающийся тем, что указанная внутримолекулярная связь Х и Y представляет собой дисульфидную, амидную, иминную, аминную, алкильную, алкенную, алкинильную, алкенильную, эфирную или тиоэфирную связь.
3. Пептид по п.1, содержащий аминокислотную последовательность формулы II: Xaa1 Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Хаа8 Хаа9 Xaa10 Xaa11 Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 (SEQ ID NO: 35),
где Xaa1 представляет собой А, С, D, F, I, К, S, Т, или отсутствует;
Хаа2 представляет собой С, D, S, или отсутствует;
Хаа3 представляет собой A, D, N, или отсутствует;
Хаа4 представляет собой A, L, Т, или отсутствует;
Хаа5 представляет собой А или S;
Хаа6 представляет собой Т, А, S или V;
Хаа7 представляет собой С, К или А;
Хаа8 представляет собой А, V, L или М;
Хаа9 представляет собой L или Т;
Хаа10 представляет собой G, Н или Q;
Xaa11 представляет собой К, R, Q или hArg;
Хаа12 представляет собой L, W или Y;
Хаа13 представляет собой A, F, N, Q, S или Т;
Хаа14 представляет собой А, D, Е, G, N, К, Q или R;
Хаа15 представляет собой А, D, Е, F, L, S или Y;
Хаа16 представляет собой L или F;
Хаа17 представляет собой Н, Q, S или V;
Хаа18 представляет собой К, R, hArg, u (Cit) или n (Orn);
Хаа19 представляет собой F, L, S, или отсутствует;
Хаа20 представляет собой Н, Q, или отсутствует;
Хаа21 представляет собой Т, N, или отсутствует;
Хаа22 представляет собой F, L, М, V или Y;
Хаа23 представляет собой Р;
Хаа24 представляет собой Р или R;
Хаа25 представляет собой Т;
Хаа26 представляет собой N;
Хаа27 представляет собой Т или V;
Хаа28 представляет собой G;
Хаа29 представляет собой S;
Хаа30 представляет собой Е, G, К или N;
Хаа31 представляет собой A or Т; и
Хаа32 представляет собой F, Р или Y.
4. Пептид по п.1, содержащий аминокислотную последовательность формулы III: Xaa1 Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Хаа8 Хаа9 Xaa10 Xaa11 Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Хаа28 Хаа29 Хаа30 Хаа31 Хаа32, (SEQ ID NO: 36),
где Xaa1 представляет собой А, С, F, I, К, S, или отсутствует;
Хаа2 представляет собой С, D или S;
Хаа3 представляет собой А, D или N;
Хаа4 представляет собой A, L или Т;
Хаа5 представляет собой А или S;
Хаа6 представляет собой Т;
Хаа7 представляет собой С или К;
Хаа8 представляет собой А или V;
Хаа9 представляет собой L или Т;
Xaa10 представляет собой G, Н или Q;
Xaa11 представляет собой К, R или hArg;
Хаа12 представляет собой L;
Хаа13 представляет собой А, F, N, S или Т;
Хаа14 представляет собой А, D, Е, G, N, Q или R;
Хаа15 представляет собой А, Е, F, L, S или Y;
Хаа16 представляет собой L;
Хаа17 представляет собой Н, S или V;
Хаа18 представляет собой К, R, hArg, u (Cit) или n (Orn);
Хаа19 представляет собой F, L или S;
Хаа20 представляет собой Н или Q;
Хаа21 представляет собой Т или N;
Хаа22 представляет собой F, L, М, V или Y;
Хаа23 представляет собой Р;
Хаа24 представляет собой Р или R;
Хаа25 представляет собой Т;
Хаа26 представляет собой N;
Хаа27 представляет собой Т или V;
Хаа28 представляет собой G;
Хаа29 представляет собой S;
Хаа30 представляет собой Е, G, К или N;
Хаа31 представляет собой А или Т; и
Хаа32 представляет собой F, Р или Y.
5. Пептид по п.1, отличающийся тем, что петлевой фрагмент содержит следующую аминокислотную последовательность:
Х Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Y (SEQ ID NO: 5), в которой
Хаа2 представляет собой любую аминокислоту или отсутствует;
Хаа3 представляет собой А, G, S, D или отсутствует;
Хаа4 представляет собой N, А, D, G или отсутствует;
Хаа5 представляет собой A, L, Т или S;
Хаа6 представляет собой А, S или Т;
Хаа7 представляет собой А, S, V, Hse, Ahb, Ahp, D-Thr, T или их производные;
где Х и Y способны образовать связь и представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи;
α спиральный участок содержит следующую аминокислотную последовательность:
R1 V L Xaa10 Xaa11 L S Q Xaa15 L Xaa17 Xaa18 L Q T Xaa22 Р Хаа24 Т N T R1 (SEQ ID NO: 29), в которой
Xaa10 представляет собой G или Aib;
Xaa11 представляет собой К, R, Orn, hArg, Cit, hLys или Lys(для);
Xaa15 представляет собой Е или F;
Xaa17 представляет собой Н или Aib;
Xaa18 представляет собой К, R, Orn, hArg, Cit, hLys, Lys(для) или Lys(PEG 5000);
Хаа22 представляет собой Y или L;
Хаа24 представляет собой R или Р; и
R1 отсутствует или содержит 1-4 дополнительно аминокислоты; и
С-концевой хвост содержит следующую аминокислотную
последовательность:
Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 Хаа33 G Хаа35 Хаа36 Хаа37 Хаа38 (SEQ ID NO: 31), в которой
Хаа28 представляет собой К, Y или отсутствует;
Хаа29 представляет собой S, Р или отсутствует;
Хаа30 представляет собой S, Р, R или отсутствует;
Хаа31 представляет собой Т или отсутствует;
Хаа32 представляет собой N или отсутствует;
Хаа33 представляет собой V, Т или отсутствует;
Хаа35 представляет собой S или Е;
Хаа36 представляет собой N, К или G;
Хаа37 представляет собой Т, F или А;
Хаа38 представляет собой Y, F, Р или отсутствует.
6. Пептид по п.1, отличающийся тем, что петлевой фрагмент содержит следующую аминокислотную последовательность: Х Хаа2 Хаа3 Хаа4 Хаа5 Хаа6 Хаа7 Y (SEQ ID NO: 5), в которой
Хаа2 представляет собой любую аминокислоту или отсутствует;
Хаа3 представляет собой А, G, S, D или отсутствует;
Хаа4 представляет собой N, А, D, G или отсутствует;
Хаа5 представляет собой А, L, Т или S;
Хаа6 представляет собой А, S или Т;
Хаа7 представляет собой А, S, V, Hse, Ahb, Ahp, D-Thr, T или их производные;
где Х и Y способны образовать связь и представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи;
α спиральный участок содержит следующую аминокислотную последовательность:
R1 V L Xaa8 Xaa9 Xaa10 R Хаа12 Хаа13 Хаа14 Хаа15 Хаа16 Хаа17 Хаа18 Хаа19 Хаа20 Хаа21 Хаа22 Р Хаа24 Т N Т R1 (SEQ ID NO: 30), в которой
Xaa8 представляет собой А или V;
Xaa9 представляет собой Т, М или L;
Xaa10 представляет собой Q, G или Н;
Хаа12 представляет собой L или Т;
Хаа13 представляет собой А, Т, N, F, Y, S или Т;
Хаа14 представляет собой N, R, A, D, Q, Е, Т или G;
Хаа15 представляет собой F, L, S, Е, А, D или Y;
Хаа16 представляет собой L или D;
Хаа17 представляет собой V, Н, S, F или Aib;
Хаа18 представляет собой Н, R, К, Оrn, hArg, Cit, hLys, Lys(для) или Lys(PEG 5000);
Хаа19 представляет собой L, S или F;
Хаа20 представляет собой Q или Н;
Хаа21 представляет собой Т или N;
Хаа22 представляет собой Y, V, F, L или М;
Хаа24 представляет собой R или Р; и
R1 отсутствует или содержит 1-4 дополнительно аминокислоты; и
С-концевой хвост содержит следующую аминокислотную последовательность:
Хаа28 Хаа29 Хаа30 Хаа31 Хаа32 Хаа33 G Хаа35 Хаа36 Хаа37
Хаа38 (SEQ ID NO: 31), в которой
Хаа28 представляет собой К, Y или отсутствует;
Хаа29 представляет собой S, Р или отсутствует;
Хаа30 представляет собой S, Р, R или отсутствует;
Хаа31 представляет собой Т или отсутствует;
Хаа32 представляет собой N или отсутствует;
Хаа33 представляет собой V, Т или отсутствует;
Хаа35 представляет собой S или Е;
Хаа36 представляет собой N, К или G;
Хаа37 представляет собой Т, F или А;
Хаа38 представляет собой Y, F, Р или отсутствует.
7. Пептид, обладающий свойствами амилина, содержащий последовательность, обладающую, по меньшей мере, 90% идентичностью последовательности, выбранной из группы, состоящей из SEQ ID NO: 40-66 и 69-137.
8. Пептид по п.7, отличающийся тем, что указанный пептид обладает последовательностью, выбранной из группы, состоящей из SEQ ID NO: 40-66 и 69-137.
9. Применение пептида по п.1 для производства лекарственного средства для лечения заболевания или состояния, выбранного из группы, состоящей из пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
10. Применение пептида по п.4 для производства лекарственного средства для лечения заболевания или состояния, выбранного из группы, состоящей из пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
11. Применение пептида по п.3 для производства лекарственного средства для лечения заболевания или состояния, выбранного из группы, состоящей из пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
12. Применение пептида по п.7 для производства лекарственного средства для лечения заболевания или состояния, выбранного из группы, состоящей из пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
13. Применение пептида по п.1 для лечения пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
14. Применение пептида по п.4 для лечения пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
15. Применение пептида по п.3 для лечения пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
16. Применение пептида по п.7 для лечения пищевых расстройств, резистентности к инсулину, ожирения, аномальной гипергликемии после приема пищи, диабета любого типа, в том числе I типа, II типа, и диабета беременных, метаболического синдрома, демпинг-синдрома, гипертензии, дислипидемии, сердечно-сосудистого заболевания, гиперлипидемии, апноэ во сне, рака, легочной гипертензии, холецистита и остеоартрита.
| HILTON J.M | |||
| et al | |||
| Identification of key components in the irreversibility of salmon calcitonin binding to calcitonin receptors | |||
| J | |||
| Endocrinol | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| КОМПОЗИЦИЯ ФИТОЧАЯ | 1999 |
|
RU2166258C2 |
Авторы
Даты
2010-04-10—Публикация
2005-02-11—Подача