Настоящая заявка заявляет приоритет предварительной патентной заявки США 60/116380, озаглавленной "Новые препараты агонистов экзендина и способы их введения", поданной 14 января 1999 года (и соответствующей заявки РСТ, поданной 14 января 2000 года, серийного номера [пока не присвоен]), предварительной патентной заявки США 60/132017, озаглавленной "Способы подавления глюкагона", поданной 30 апреля 1999 года, и предварительной патентной заявки США 60/[номер пока не присвоен], озаглавленной "Применение экзендинов и его агонистов для модуляции уровней триглицеридов и лечения дислипидемии", поданной 10 января 2000 года: их содержание в полном объеме включено здесь для сведения в виде библиографических ссылок.
Область техники, к которой относится изобретение
Настоящее изобретение касается способов подавления и/или снижения уровня глюкагона у субъекта, включающих введение экэендина, агониста экзендина или модифицированного экэендина или агониста экзендина, у которых пептид экзендина или агониста экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другим соединением, используемыми для снижения почечного клиренса исходного пептида. Такие способы применимы, например, для лечения гиперглюкагонемии и других состояний, при которых приносит пользу снижение уровней глюкагона или подавление секреции глюкагона.
Предпосылки
Нижеследующее описание содержит информацию, которую можно использовать для понимания настоящего изобретения. Это не является признанием того, что любая из представляемой здесь информации является прототипом для заявляемого здесь изобретения, равно как и любая из публикаций, которая непосредственно или предположительно упоминается в данном тексте, является прототипом для изобретения.
Экзендины являются пептидами, которые обнаруживаются в слюнных выделениях жилатье (гильского ядозуба) и эскорпиона (мексиканского ядозуба) - ящериц, обитающих в Аризоне и на севере Мексики. Экзендин-3 [SEQ ID NO 1: His Ser Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2] присутствует в слюнных выделениях Heloderma horridum (эскорпион, мексиканский ядозуб), а экзендин-4 [SEQ ID NO 2: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe lle Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2] присутствует в слюнных выделениях Heloderma suspectum (жилатье, гильский ядозуб) (J.Eng et al., 1990, J. Biol. Chem., 265, 20259-20262; J.Eng et al., 1992, J. Biol. Chem., 267, 7402-7405). Аминокислотная последовательность экзендина-3 показана на фигуре 1. Аминокислотная последовательность экзендина-4 показана на фигуре 2. Вначале считалось, что экзендин-4 является (потенциально токсичным) компонентом яда. Сейчас представляется, что экзендин-4 не связан с токсичностью, а на самом деле образуется в слюнных железах гильского ядозуба.
Экзендины проявляют определенную степень сходства с некоторыми членами семейства глюкагоно-подобных пептидов при наибольшем уровне гомологии - 53%- с пептидом GLP-1[7-36]NH2 [SEQ ID NO 3] (Goke et al., 1993, J. Biol. Chem., 268, 19650-19655). GLP-1[7-36]HN2, также иногда обозначаемый как проглюкагон [78-107] или просто как "GLP-1", что наиболее часто используется в данном тексте, обладает инсулинотропным действием, стимулирующим секрецию инсулина бета-клетками поджелудочной железы; GLP-1 так же, как было сообщено, подавляет секрецию глюкагона альфа-клетками поджелудочной железы (Orsov et al., 1993, Diabetes, 42, 658-661; D'Alessio et al., 1996, J. Clin. Invest., 97, 133-138). Как сообщалось, GLP-1 подавляет опорожнение желудка (B.Willms et al., 1996, К. Clin. Endocrinol. Metab., 81 (1), 327-332; A.Wettergren et al., 1993, Dig. Dis. Sci., 38 (4), 665-673) и секрецию желудочной кислоты (B.T.Schjoldager et al., 1989, Dig. Dis. Sci., 34 (5), 703-708; D.J.O'Halloran et al., 1990, J. Endocrinol., 126 (1), 169-173; A.Wettergren et al., 1993, Dig. Dis. Sci., 38 (4), 665-673). GLP-1[7-37], который включает дополнительный остаток глицина по своему С-концу, как сообщалось, стимулирует секрецию инсулина у человека (Orskov et al., 1993, Diabetes, 42, 658-661). Трансмембранный связанный с аденилатциклазой G-белковый рецептор, считающийся ответственным по крайней мере за часть инсулинотропного действия GLP-1, был клонирован из линии бета-клеток (Thorens, 1992, Proc. Natl. Acad. Sci. USA, 89, 8641-8645). GLP-1 находился в фокусе интенсивных исследований в последние годы благодаря сообщению о его действии на интенсификацию простимулированной выработки инсулина (M.M.Byrne, B.Goke, "Lessons from human studies with glucagon-like peptide-1: Potential of the gut hormone for clinical use", In: H.C.Fehmann, B.Goke, "Insulinotropic Gut Hormone Glukagon-Like Peptide 1", Basel, Switzerland, Karger, 1997, pp. 219-233).
Другие сообщения касаются подавления опорожнения желудка. Укороченный GLP-1 (проглюкагон 78-107-амид) подавляет функции желудка и поджелудочной железы у человека (A.Wettergren et al. 1993, Dig. Dis. Sci., 38 (4), 665-673), подавляет секрецию глюкагона (W.O.C.Creutzfeldt et al., 1996, "Glucagonostatic actions and reduction of fasting hyperglycemia by exogenous glucagon-like peptide 1(7-36) amide in type I diabetic patients". Diabetes Care, 19 (6), 580-586) и предположительно участвует в контроле аппетита (M.D.Turton et al., 1996, "A role for glucagon-like peptide-1 in the central regulation of feeding". Nature, 379 (6560), 69-72).
Также было сообщено, что GLP-1 восстанавливает чувствительность островков Лангерганса к глюкозе у стареющих крыс с увеличением у них переносимости глюкозы до уровней, характерных для молодых крыс (J.M.Egan et al., 1997, "Glucagon-like peptide-1 restores acute-phase insulin release to aged rats", Diabetologia, 40 (suppl. 1), A130). Однако короткая продолжительность биологического действия GLP-1 in vivo является тем свойством пептида, которое затрудняет его использование в качестве лекарственного средства. Для увеличения времени полужизни GLP-1 или GLP-1(7-37) были испробованы различные способы, включая попытки изменить их аминокислотную последовательность и доставить их с использованием различных форм препаратов (см., например, европейскую патентную заявку, озаглавленную "Пролонгированная доставка пептидов", поданную Darley et al., номер публикации 0-619322-А2, касающуюся включения полиэтиленгликоля в состав препаратов, содержащих GLP-1(7-37)).
Фармакологические исследования на материале диспергированных ацинозных клеток поджелудочной железы морской свинки и париетальных клеток желудка привели к сообщениям о том, что экзендин-4 может действовать на рецепторы GLP-1 на некоторых инсулин-секретирующих клетках; также сообщалось о том, что пептид стимулирует секрецию соматостатина и подавляет секрецию гастрина в изолированных желудках (Goke et al., 1993, J. Biol. Chem., 268, 19650-19655; Schepp et al., 1994, Eur. J. Pharmacol., 69, 183-191; Eissele et al., 1994, Life Sci., 55, 629-634). Было обнаружено, что экзендин-3 и экзендин-4 стимулируют выработку цАМФ в ацинозных клетках поджелудочной железы и секрецию ими амилазы (R.Malhotra et al., 1992, Regulatory Peptides, 41, 149-156; Raufman et al., 1992, J. Biol. Chem., 267, 21432-21437; Singh et al., 1994, Regul. Pept., 53, 47-59). Кроме того, экзендин-4 обладает существенно более продолжительным действием по сравнению с GLP-1. Например, в одном эксперименте снижение уровня глюкозы действием экзендина-4 у мышей с диабетом, как сообщалось, продолжалось в течение нескольких часов, а в зависимости от дозы вплоть до 24 часов (J.Eng, 1996, "Prolonged effect of exendin-4 on hyperglycemia of db/db mice". Diabetes, 45 (suppl. 2), 152A (abstract 554)). С учетом их инсулинотропной активности предполагалось использование экзендина-3 и экзендина-4 для лечения сахарного диабета и профилактики гипергликемии (Eng, патент США 5424286).
Результаты изучения того, являются ли экзендины гомологами GLP-1 млекопитающих, опубликованы Chen & Drucker, которые клонировали ген экзендина гильского ядозуба (J. Biol. Chem., 272 (7), 4108-4115 (1997)). Обнаружение того, что у гильского ядозуба также имеются самостоятельные гены проглюкагонов (из которых образуется GLP-1), которые в большей степени сходны с проглюкагоном млекопитающих, чем экзендин, указывает на то, что экзендины не являются единственными гомологами GLP-1 у данных видов.
К настоящему времени средства, которые служат для задержки опорожнения желудка, в целом находят свое место в медицине в качестве диагностических средств при рентгенологических исследованиях желудочно-кишечного тракта. Например, глюкагон является полипептидным гормоном, который вырабатывается альфа-клетками островков Лангерганса поджелудочной железы. Он является гипергликемическим агентом, который мобилизует глюкозу за счет активации гликогенолиза в печени. Он способен в меньшей степени стимулировать секрецию панкреатического инсулина. Глюкагон используют в лечении вызванной инсулином гипогликемии, например, тогда, когда внутривенное введение глюкозы невозможно. Однако, поскольку глюкагон ослабляет перистальтику желудочно-кишечного тракта, его также используют в качестве диагностического средства при проведении рентгенологических исследований желудочно-кишечного тракта. Также глюкагон был использован в нескольких исследованиях по лечению различных заболеваний желудочно-кишечного тракта, характеризующихся сильной болью, вызванной спазмами. Сообщалось (Daniel et al., 1974, Br. Med. J., 3, 720) о более быстром ослаблении симптомов острого дивертикулита у больных, в лечении которых использовали глюкагон, по сравнению с больными, которых лечили с помощью аналгетиков или спазмолитических средств. В обзоре (Glauser et al., 1979, J. Am. Coll. Emergency Physicians, 8, 228) описывалось ослабление острой пищевой закупорки пищевода после лечения глюкагоном. В другом исследовании глюкагон в значительной степени ослаблял боль и болезненность у 21 больного с болезнью желчного протока по сравнению с 22 больными, которым давали плацебо (M.J.Stower et al., 1982, Br. J. Surg., 69, 591-592).
Способы регуляции перистальтики желудочно-кишечного тракта с использованием агонистов амилина описаны в принадлежащей тем же заявителям международной патентной заявке № PCT/US 94/10225, опубликованной 16 марта 1995 г.
Способы регуляции перистальтики желудочно-кишечного тракта с использованием агонистов экзендина описаны в принадлежащей тем же заявителям патентной заявке США серийного №08/908867, поданной 8 августа 1997 г., озаглавленной "Способы регуляции перистальтики желудочно-кишечного тракта", причем заявка является частично продолжающей патентную заявку США серийного №08/694954, поданную 8 августа 1996 г.
Способы снижения потребления пищи с использованием агонистов экзендина описаны в принадлежащей тем же заявителям патентной заявке США серийного №09/003869, поданной 7 января 1998 г., озаглавленной "Применение экзендина и его агонистов для снижения потребления пищи", которая заявляет приоритет предварительных патентных заявок США №№60/034905, поданной 7 января 1997г., 60/055404, поданной 7 августа 1997 г., 60/065442, поданной 14 ноября 1997 г., и 60/066029, поданной 14 ноября 1997 г.
Новые соединения-агонисты экзендина описаны в принадлежащей тем же заявителям заявке РСТ серийного №PCT/US 98/16387, поданной 6 августа 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет патентной заявки США серийного №60/055404, поданной 8 августа 1997 г.
Другие новые агонисты экзендина описаны в принадлежащей тем же заявителям заявке РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет предварительной патентной заявки США №60/065442, поданной 14 ноября 1997 г.
Следующие новые агонисты экэендина описаны в принадлежащей тем же заявителям заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет предварительной патентной заявки США №60/066029, поданной 14 ноября 1997 г.
Другие недавние достижения в технологии, основывающейся на использовании экзендина, описаны в предварительной патентной заявке США серийного №60/075122, поданной 13 февраля 1998 г., озаглавленной "Инотропное и мочегонное действие экзендина и GLP-1", и в предварительной патентной заявке США серийного №60/116380, поданной 14 января 1998 г., озаглавленной "Новые препараты агонистов экзендина и способы их введения".
Модифицирование терапевтических пептидов и белков полиэтиленгликолем (ПЭГ) может приводить и к преимуществам, и к недостаткам. В то время как ПЭГ-модификация может приводить к улучшению времени циркуляции, снижению антигенности и иммуногенности, улучшенной растворимости, устойчивости к протеолитическому расщеплению, повышенной биологической доступности, сниженной токсичности, улучшенной стабильности и более простому приготовлению препаратов таких пептидов (см. Francis et al., 1998, International Journal of Hematology, 68, 1-18), в большинстве случаев проблемой, сопровождающей "ПЭГирование", является существенное снижение биологической активности (цит. там же). Кроме того, в большинстве способов используют линкеры, которые характеризуются различными типами неблагоприятных побочных эффектов, включая иммуногенность, нестабильность, токсичность и реактивность (цит. там же).
Глюкагонома (опухоль клеток, секретирующих глюкагон) в дополнение к непереносимости глюкозы обусловливает специфическое состояние кожи - некролитическую мигрирующую эритему. Это проявляется в появлении слущиваемой красной сыпи, иногда образовании волдырей и, возможно, струпьев, расположенных на лице, животе, конечностях и в промежности. Также она может быть связана с воспалением языка и рта, поражении ногтей и истончении волос. Сообщалось, что данное состояние реагирует на октреотид - аналог глюкагоностатического гормона. Соединения, описанные в данном тексте, также применимы в качестве глюкагоностатических средств и, соответственно, в лечении данного заболевания, которое впервые было описано в 1966 году (L.K.Kaplan, "Endocrine Tumors of the Gastrointestinal Tract and Pancreas", Ch. 262, p.1392, In "Harrison's Principles of Internal Medicine", 12th edition, McGraw-Hill Inc., New York, 1991). Соединения, описанные здесь как применимые для снижения уровней глюкагона и/или подавления секреции глюкагона, включают экзендин, агонисты экзендина и модифицированные экзендины и агонисты экзендина, а также родственные препараты и дозированные препараты.
Содержание упоминавшихся выше статей, патентов и патентных заявок и всех других документов, упоминаемых или цитируемых в данном тексте, в полном их объеме включено здесь для сведения в виде библиографических ссылок. Заявители сохраняют право на физическое включение в данную заявку любого и в полном объеме материала и информации из любых таких статей, патентов, патентных заявок или других документов, упоминающихся или цитируемых в данном тексте.
Краткое содержание изобретения
Настоящее изобретение касается способов снижения уровней глюкагона и/или подавления секреции глюкагона у субъекта. Также оно касается лечения гиперглюкагонемии и состояний, при которых пользу приносит введение глюкагоностатических средств, включая, но тем самым не ограничиваясь, некролитическую мигрирующую эритему.
Таким образом, в одном аспекте изобретение касается применения экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина, в котором экзендин или агонист экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другими молекулами, повышающими молекулярную массу, с целью снижения уровней глюкагона у субъекта.
В другом аспекте изобретение касается применения экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина, в котором экзендин или агонист экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другими соединениями, применяемыми для снижения почечного клиренса исходного пептида, с целью подавления секреции глюкагона у субъекта.
Еще в одном аспекте изобретение касается применения экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина, в котором экзендин или агонист экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другими молекулами, повышающими молекулярную массу, для лечения состояний, связанных с гиперглюкагонемией.
В следующем аспекте изобретение касается применения экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина, в котором экзендин или агонист экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другими молекулами, повышающими молекулярную массу, для лечения субъекта с глюкагономой или некролитической мигрирующей эритемой.
В предпочтительных вариантах экзендином является экзендин-4. В других предпочтительных вариантах модифицированный экзендин или агонист экзендина имеет молекулярную массу, которая больше молекулярной массы экзендина или агониста экзендина (предпочтительно больше на 10%, 50% или 90%), модифицированный экзендин или агонист экзендина имеет отрицательный заряд, который больше отрицательного заряда экзендина или агониста экзендина (предпочтительно больше на 10%, 50% или 90%), модифицированный экзендин или агонист экзендина характеризуется меньшим почечным клиренсом по сравнению с почечным клиренсом экзендина или агониста экзендина (предпочтительно меньше на 10%, 50% или 90%), время полужизни модифицированного экзендина или агониста экзендина больше времени полужизни экзендина или агониста экзендина (предпочтительно больше на 10%, 50% или 90%), иммуногенность/антигенность модифицированного экзендина или агониста экзендина меньше, чем иммуногенность/антигенность экзендина или агониста экзендина, растворимость модифицированного экзендина или агониста экзендина больше растворимости экзендина или агониста экзендина (предпочтительно больше на 10%, 50% или 90%), скорость протеолитического расщепления модифицированного экзендина или агониста экзендина меньше скорости протеолиза экзендина или агониста экзендина (предпочтительно меньше на 10%, 50% или 90%), токсичность модифицированного экзендина или агониста экзендина меньше токсичности экзендина или агониста экзендина, стабильность модифицированного экзендина или агониста экзендина выше стабильности экзендина или агониста экзендина и проницаемость/биологическая функциональность модифицированного экзендина или агониста экэендина больше или меньше, чем проницаемость/биологическая функциональность экзендина или агониста экзендина (предпочтительно больше или меньше на 10%, 50% или 90%).
Экзендин или агонист экзендина может быть соединен с одним, двумя или тремя полимерами полиэтиленгликоля. Полимеры полиэтиленгликоля предпочтительно могут иметь молекулярную массу в диапазоне 500-20000. В предпочтительном варианте модифицированным экзендином или агонистом экзендина является одно из соединений 201-217, более предпочтительно одно из соединений 209, 210 и 213 или одно из соединений 201 и 202, или одно из соединений 216 и 217 (см. пример 4 ниже).
Полимеры полиэтиленгликоля предпочтительно присоединяют к аминогруппе, карбоксильной группе или тиогруппе и могут быть присоединены по N- или С-концу к боковым цепям лизина, аспарагиновой кислоты, глутаминовой кислоты или цистеина, или, как альтернатива, полимеры полиэтиленгликоля могут быть присоединены с помощью диаминовых и дикарбоксильных групп. Предпочтительно экзендин или агонист экзендина соединяют с полимерами полиэтиленгликоля через -аминогруппу аминокислоты лизина в составе экзендина или агониста экзендина.
Под "агонистом экзендина" понимается соединение, которое имитирует действие экзендинов, например, на перистальтику кишечника и опорожнение желудка (а именно соединение, которое эффективно связывается с рецептором, в отношении которого проявляют свою активность собственно экзендины, влияя на перистальтику кишечника и опорожнение желудка, предпочтительно производное или аналог экзендина) или соединение, которое, например, имитирует действие экзендина по снижению потребления пищи за счет связывания с рецептором или рецепторами, через которые экзендин опосредует свое действие. Предпочтительными соединениями-агонистами экзендина являются те соединения, которые описаны в патентной заявке США серийного №90/003869, озаглавленной "Применение экзендина и его агонистов для снижения потребления пищи", поданной 7 января 1998 г. (и в приоритетных для нее заявках), права собственности, на которую принадлежат заявителям настоящей заявки и которая включена в настоящую заявку в полном объеме в качестве библиографической ссылки. Эффекты экзендинов и агонистов экзендинов могут быть выявлены, оценены или подвергнуты скринингу с использованием описанных здесь способов или других способов, известных в данной области техники в связи с установлением эффектов экзендина.
В другом аспекте терапевтически эффективное количество агониста амилина также вводят субъекту. В предпочтительном аспекте агонистом амилина является аналог амилина или аналог агониста амилина, такой как 25,28,29проамилин человека (также известный как "прамлинтид", а ранее обозначавшийся как "АС-137" и описанный в патенте США №5686511 "Пептиды-агонисты амилина и их использование", выданном 11 ноября 1997 г.) или кальцитонин лосося.
Предпочтительно субъектом является позвоночное животное, более предпочтительно - млекопитающее и наиболее предпочтительно - человек. В предпочтительных аспектах экзендин, агонист экзендина или модифицированный экзендин или агонист экзендина по настоящему изобретению вводят парентерально, более предпочтительно - с помощью инъекции. В наиболее предпочтительном аспекте инъекцией является периферическая инъекция. Предпочтительно в день вводят от примерно 1-30 мкг до примерно 5 мг модифицированного экзендина или агониста экзендина по настоящему изобретению. Более предпочтительно в день вводят от примерно 1-30 мкг до примерно 2 мг или от примерно 1-30 мкг до примерно 1 мг модифицированного экзендина или агониста экзендина по настоящему изобретению. Наиболее предпочтительно в день вводят от примерно 3 мкг до примерно 500 мкг модифицированного экзендина или агониста экзендина по настоящему изобретению.
Предпочтительными экзендинами или агонистами экзендина для модифицирования и использования являются:
экзендин-4 (1-30) [SEQ ID NO 4: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly];
экзендин-4 (1-30)-амид [SEQ ID NO 5: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe He Glu Trp Leu Lys Asn Gly Gly-NH2];
экзендин-4 (1-28)-амид [SEQ ID NO 6: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn-NH2];
14Leu,25Phe-экзендин-4-амид [SEQ ID NO 7: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe lle Glu Phe Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NH2];
14Leu,25Phe-экзендин-4-(l-28)-амид, [SEQ ID NO 8: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Phe lle Glu Phe Leu Lys Asn-NH2]; и
14Leu, 22Ala, 25Phe-экзендин-4-(1-28)-амид [SEQ ID NO 9: His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Leu Glu Glu Glu Ala Val Arg Leu Ala Ile Glu Phe Leu Lys Asn-NH2].
Определения
В соответствии с настоящим изобретением и по использованию в данном тексте следующие термины определяются как имеющие далее указанные значения, если это специально не оговаривается дополнительно.
Термин "аминокислота" обозначает природные аминокислоты, ненативные аминокислоты и аналоги аминокислот и все их D- и L-стереоизомеры, если их структура позволяет существовать таким стереоизомерным формам. Природными аминокислотами являются аланин (Ala), аргинин (Arg), аспарагин (Asn), аспарагиновая кислота (Asp), цистеин (Cys), глутамин (Gln), глутаминовая кислота (Glu), глицин (Gly), гистидин (His), изолейцин (Ile), лейцин (Leu), лизин (Lys), метионин (Met), фенилаланин (Phe), пролин (Pro), серин (Ser), треонин (Thr), триптофан (Trp), тирозин (Tyr) и валин (Val). Ненативными аминокислотами являются, тем самым не ограничиваясь, азетидинкарбоновая кислота, 2-аминоадипиновая кислота, 3-аминоадипиновая кислота, -аланин, аминопропионовая кислота, 2-аминомасляная кислота, 4-аминомасляная кислота, 6-аминокапроновая кислота, 2-аминогептановая кислота, 2-аминоизомасляная кислота, 3-аминоизомасляная кислота, 2-аминопимелиновая кислота, трет-бутилглицин, 2,4-диаминоизомасляная кислота, десмозин, 2,2'-диаминопимелиновая кислота, 2,3-диаминопропионовая кислота, N-этилглицин, N-этиласпарагин, гомопролин, гидроксилизин, аллогидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, аллоизолейцин, N-метилаланин, N-метилглицин, N-метилизолейцин, N-метилпентилглицин, N-метилвалин, нафтилаланин, норвалин, норлейцин, орнитин, пентилглицин, пипеколиновая кислота и тиопролин. Аналогами аминокислот являются природные и ненативные аминокислоты, которые химически, обратимо или необратимо, заблокированы или модифицированы по их N-концевой аминогруппе или по группам их боковых цепей, как, например, метионинсульфоксид, метионинсульфон, S-(карбоксиметил)-цистеин, S-(карбоксиметил)-цистеинсульфоксид и S-(карбоксиметил) -цистеинсульфон.
Термин "аналог аминокислоты" обозначает аминокислоту, у которой С-концевая карбоксильная группа, N-концевая аминогруппа или функциональная группа боковой цепи была химическим путем модифицирована в другую функциональную группу. Например, -метиловый сложный эфир аспарагиновой кислоты является аминокислотным аналогом аспарагиновой кислоты; N-этилглицин является аналогом аминокислоты глицина или аланинкарбоксамид является аналогом аминокислоты аланина.
Термин "аминокислотный остаток" обозначает радикалы, имеющие структуру: (1)-С(O)-R-NH-, где R обычно представляет -CH(R')-, где R' является боковой цепью аминокислоты, обычно Н или содержащим углерод заместителем; или (2)
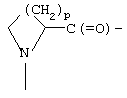
где р равно 1, 2 или 3, что представляет остатки азетидинкарбоновой кислоты, пролина или пипеколиновой кислоты соответственно.
Термин "низший", используемый в данном тексте в отношении органических радикалов, таких как алкильные группы, определяет такие группы, которые включают до и включительно 6 атомов углерода, предпочтительно до и включительно 4 и преимущественно 1 или два атома углерода. Такими группами могут быть прямая цепь или разветвленная цепь.
"Фармацевтически приемлемая соль" охватывает соли соединений по настоящему изобретению, производные от сочетания таких соединений с органической или неорганической кислотой. На практике использование солевой формы равнозначно использованию формы основания. Соединения по настоящему изобретению применимы и в форме основания, и в форме соли, при том что обе такие формы рассматриваются как входящие в объем настоящего изобретения.
Кроме того, указанные сокращения обозначают следующее:
"ACN" или "CH3CN" обозначает ацетонитрил.
"Boc", "tBoc" или "Tboc" обозначает трет-бутоксикарбонил.
"DCC" обозначает N,N'-дициклогексилкарбодиимид.
"Fmoc" обозначает флуоренилметоксикарбонил.
"HBTU" обозначает 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат.
"HOBt" обозначает 1-гидроксибензотриазолмоногидрат.
"homoP" или "hPro" обозначает гомопролин.
"MeAla" или "Nme" обозначает N-метилаланин.
"naph" обозначает нафтилаланин.
"pG" или "pGly" обозначает пентилглицин.
"tBuG" обозначает трет-бутилглицин.
"ThioP" или "tPro" обозначает тиопролин.
"3Нур" обозначает 3-гидроксипролин.
"4Нур" обозначает 4-гидроксипролин.
"NAG" обозначает N-алкилглицин.
"NAPG" обозначает N-алкилпентилглицин.
"Norval" обозначает норвалин.
"Norleu" обозначает норлейцин.
Другие свойства и преимущества изобретения будут ясны из нижеследующего описания его предпочтительных вариантов, а также из формулы изобретения.
Краткое описание чертежей
На фигуре 1 приведена аминокислотная последовательность экзендина-3 [SEQ ID NO 1].
На фигуре 2 приведена аминокислотная последовательность экзендина-4 [SEQ ID NO 2].
На фигуре 3 приведены аминокислотные последовательности некоторых соединений-агонистов экзендина, применимых в настоящем изобретении [SEQ ID NO 10-40].
На фигуре 4 приведены аминокислотные последовательности некоторых соединений по настоящему изобретению - соединения 1-174.
На фигуре 5 изображен график, показывающий влияние функциональной нефрэктомии на клиренс экзендина-4.
На фигуре 6 приведен график, отображающий конечный распад плазматических уровней экзендина-4 у нефрэктомизованных и симуляционных субъектов.
Подробное описание изобретения
Настоящее изобретение касается способов подавления и/или снижения уровня глюкагона у субъекта, включающих введение экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина, в которых пептид экзендина или агониста экзендина соединен с одним или несколькими полимерами полиэтиленгликоля или другими соединениями, используемыми для повышения молекулярной массы. Такие способы применимы, например, для лечения гиперглюкагонемии и других состояний, при которых пользу принесет снижение уровней глюкагона или подавление секреции глюкагона. Такими состояниями являются, тем самым не ограничиваясь, глюкагонома и некролитическая мигрирующая эритема.
Модифицированные экзендины и агонисты экзендинов
Модифицированные экзендины и агонисты экзендинов по настоящему изобретению включают, например, один или большее число ПЭГ-полимеров, присоединенных к экзендину или агонисту экзендина, такому как встречающийся в естественных условиях экзендин, синтетический экзендин или агонист экзендина.
Экзендин-4
Экзендин-4 является встречающимся в естественных условиях пептидом, выделенным из слюнных выделений гильского ядозуба. Анализ влияния экзендина-4 на животных показал, что его способность снижать уровень глюкозы в крови сохраняется в течение нескольких часов. Экзендин-4, являющийся полипептидом, состоящим из 39 аминокислот, синтезирован с использованием твердофазного синтеза в соответствии с описанным здесь и, как было показано, такой синтетический материал идентичен нативному экзендину-4.
Как описано в данном тексте, была изучена неклиническая фармакология экзендина-4. В головном мозге экзендин-4 направленно связывается в областях area postrema и nucleus tractus solitarius заднего мозга и подсводовой области переднего мозга. Связывание экзендина-4 было выявлено в головном мозге и почках крыс и мышей. Структуры, с которыми экзендин-4 связывается в почках, не установлены.
В различных экспериментах проводили сравнение биологической активности экзендина-4 и GLP-1, и они показывают наличие более предпочтительного спектра свойств у экзендина-4. Однократное подкожное введение экзендина-4 снижало уровень глюкозы в плазме у мышей db/db (с диабетом) и ob/ob (с диабетом и ожирением) на 40%. У крыс с диабетом и ожирением Diabetic Fatty Zucker (ZDF) введение в течение 5 недель экзендина-4 приводило к снижению уровня HbA1c (мера гликозилированного гемоглобина, использованная для оценки уровней плазматической глюкозы) на 41%. Восприимчивость к инсулину также улучшалась на 76% после 5-недельного лечения крыс ZDF с ожирением. У приматов с непереносимостью глюкозы также было выявлено зависимое от дозы снижение уровня глюкозы в плазме.
Инсулинотропное действие экзендина-4 также было выявлено у грызунов с улучшением инсулинового ответа на глюкозу более чем на 100% у неголодающих крыс линии Harlan Sprague Dawley (HSD) и вплоть до примерно 10 раз у неголодающих мышей db/db. Более высокие уровни глюкозы до обработки были связаны с более выраженными эффектами по снижению уровня глюкозы. Таким образом, выявленный эффект по снижению уровня глюкозы у экзендина-4, по-видимому, является зависимым от глюкозы и минимально выражен, если животное уже характеризуется эугликемией.
Экзендин-4 в дозозависимом режиме замедлял опорожнение желудка у крыс HSD и был примерно в 90 раз более сильным по такому действию по сравнению с GLP-1. Также было показано, что экзендин-4 снижает потребление пищи у мышей линии NIH/Sw (Swiss) после периферического введения и оказывается по крайней мере в 1000 раз более сильным в этом отношении, чем GLP-1. Экзендин-4 снижал концентрации плазматического глюкагона приблизительно на 40% у крыс ZDF под наркозом при состоянии гиперинсулиновой/гипергликемической фиксации, но не влиял на концентрации плазматического глюкагона при эугликемическом состоянии у нормальных крыс. Как было показано, экзендин-4 в дозозависимом режиме снижает массу тела у крыс ZDF с ожирением, в то время как у крыс ZDF без ожирения выявленное снижение массы тела, по-видимому, носит временный характер.
Принимая во внимание эффекты по снижению уровня глюкагона и подавлению секреции глюкагона, экзендины, агонисты экзендинов и модифицированные экзендины или агонисты экзендинов на основе экзендина-4 найдут применение, например, для людей, для которых будет полезным снижение уровня глюкагона, например больных с глюкагономой и некролитической мигрирующей эритемой, а также больных с диабетом, независимо от того, сохранилась у них или не сохранилась способность секретировать инсулин: см. пример 5.
Токсикология экзендина-4 была исследована при однократном введении мышам, крысам и обезьянам, при повторных введениях (вплоть до 28 последовательных суточных доз) крысам и обезьянам и в тестах in vitro на мутагенность и хромосомные аберрации. К настоящему времени не было выявлено случаев гибели и не было обнаружено связанных с введением изменений в гематологии, клинической химии и крупных или микроскопических изменений в тканях. Было показано, что экзендин-4 не является мутагеном и не индуцирует хромосомные аберрации при исследованных концентрациях (вплоть до 5000 мкг/мл).
Для поддержки исследований неклинической фармакокинетики и метаболизма экзендина-4 был разработан ряд иммунологических тестов. Радиоиммунологический тест с ограниченной чувствительностью (примерно 100 пкМ) использовали в исходных фармакокинетических исследованиях. После этого двухсайтовый тест IRMA для экзендина-4 был отработан с меньшим пределом количественного выявления - 15 пкМ. По данным радиоиммуннологического анализа биологическая доступность вводимого подкожно экзендина-4 была определена на уровне приблизительно 50-80%. Это сходно с тем, что было установлено при внутрибрюшинном введении (48-60%). Пиковые концентрации в плазме (Сmax) наблюдались между 30-й и 43-й минутами (Тmax). Величины и Сmax, и AUC прямо зависели от дозы. Наблюдаемое конечное время полужизни для вводимого подкожно экзендина-4 составило примерно 90-110 минут. Это существенно больше, чем те 14-41 минуты, которые выявляются после внутривенного введения. Сходные результаты были получены с применением теста IRMA. Анализ разрушения экзендина-4 по сравнению с GLP-1 показывает, что экзендин-4 относительно устойчив к разрушению.
Агонисты экзендина
Взаимосвязь структуры и активности (SAR-анализ) экзендина изучали в связи со структурами, которые могут быть связаны с антидиабетической активностью экзендина, с его устойчивостью к метаболическим процессам и с улучшением его физических параметров, особенно в связи с пептидной стабильностью и доступностью для альтернативных систем доставки, в результате чего были изобретены различные соединения пептидов-агонистов экзендина. Агонисты экзендина включают пептидные аналоги экзендина, в составе которых одна или большее число нативных аминокислот удалены или заменены на другую(ие) аминокислоту(ы). Предпочтительными агонистами экзендина являются аналоги агонистов экзендина-4. Конкретно предпочтительными агонистами экзендина являются те, которые описаны в принадлежащей тем же заявителям заявке РСТ серийного PCT/US 98/16387, поданной 6 августа 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет патентной заявки США серийного №60/055404, поданной 8 августа 1997 г.; принадлежащей тем же заявителям заявки РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет предварительной патентной заявки США №60/065442, поданной 14 ноября 1997 г.; и принадлежащей тем же заявителям заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", которая заявляет приоритет предварительной патентной заявки США №60/066029, поданной 14 ноября 1997 г., все они в полном своем объеме, включая любые чертежи, включены здесь для сведения в виде библиографических ссылок.
Активность агонистов экзендина может быть определена, например, по активности в тестах, описанных здесь далее. Влияние экзендинов или агонистов экзендина на перистальтику желудка и опорожнение желудка может быть выявлено, оценено или подвергнуто скринингу с использованием способов, описанных в данной заявке, или других известных в данной области техники или эквивалентных способов определения перистальтики желудка. Негативно-рецепторные тесты или системы скрининга для соединений-агонистов экзендина или предполагаемых соединений-агонистов экзендина, такие как скрининг-тест с рецептором амилина с использованием препарата рецептора амилина в соответствии с описанным в патенте США №5264372, выданном 23 ноября 1993 г., содержание которого включено здесь для сведения в виде библиографической ссылки, скрининг-тесты с одним или несколькими рецепторами кальцитонина с использованием, например, клеток карциномы молочной железы T47D и MCF7, которые несут кальциевые рецепторы, зависимые от стимуляции аденилатциклазной активности, и/или скрининг-тест с рецептором CGRP с использованием, например, клеток SK-N-MC.
Один такой способ для использования в выявлении или оценке способности соединения ослаблять перистальтику желудка включает: (а) приведение в контакт тестируемого образца и тест-системы, где тестируемый образец включает одно или несколько анализируемых соединений, а тест-система включает систему для оценки перистальтики желудка, причем система отличается тем, что она проявляет, например, повышенный уровень глюкозы в плазме в ответ на введение в систему глюкозы или пищи; и (b) определение присутствия или степени повышения уровня плазматической глюкозы в системе. Также могут быть включены позитивный и/или негативный контроли.
Также в объем настоящего изобретения включаются фармацевтически приемлемые соли соединений формулы (I-VIII) и фармацевтические композиции, содержащие упомянутые соединения и их соли.
Формула I
Соединения-агонисты экзендина также включают те соединения, которые описаны в предварительной патентной заявке США №60/065442, включая соединения формулы (I) (SEQ ID NO 41):
Xaa1 Xaa2 Хаа3 Gly Xaa5 Хаа6 Хаа7 Xaa8 Хаа9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Хаа23 Хаа24 Xaa25 Xaa26 Xaa27 Xaa28-Z1; где
Xaa1 представляет His, Arg или Tyr;
Xaa2 представляет Ser, Gly, Ala или Thr;
Хаа3 представляет Asp или Glu;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Ala, Phe, Tyr или нафтилаланин;
Xaa7 представляет Thr или Ser;
Хаа8 представляет Ala, Ser или Thr;
Хаа9 представляет Asp или Glu;
Хаа10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Хаа11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Хаа20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Ala, Phe, Tyr или нафтилаланин;
Хаа23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Хаа24 представляет Ala, Glu или Asp;
Хаа25 представляет Ala, Trp, Phe, Tyr или нафтилаланин;
Хаа26 представляет Ala или Leu;
Хаа27 представляет Ala или Lys;
Хаа28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, или
Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2;
Хаа31, Хаа36, Хаа37 и Хаа38 независимо друг от друга представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Хаа8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala. Предпочтительными N-алкильными группами для N-алкилглицина, N-алкилпентилглицина и N-алкилаланина являются низшие алкильные группы предпочтительно с 1 до примерно 6 атомами углерода, более предпочтительно с 1-4 атомами углерода.
Предпочтительными соединениями-агонистами экзендина являются те, у которых Xaa1 представляет His или Tyr. Более предпочтительно Xaa1 представляет His.
Предпочтительными являются те соединения, в которых Хаа2 представляет Gly.
Предпочтительными являются те соединения, в которых Хаа14 представляет Leu, пентилглицин или Met.
Предпочтительными являются те соединения, в которых Xaa25 представляют Trp или Phe.
Предпочтительными являются те соединения, в которых Хаа6 представляет Phe или нафтилаланин; Xaa22 представляет Phe или нафтилаланин и Хаа23 представляет Ile или Val.
Предпочтительными являются те соединения, в которых Хаа31, Хаа36, Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина и N-алкилаланина.
Предпочтительно Z1 представляет -NH2.
Предпочтительно Z2 представляет -NH2.
В соответствии с одним аспектом предпочтительными являются соединения формулы (I), у которых Xaa1 представляет His или Tyr, более предпочтительно His; Xaa2 представляет Gly; Хаа6 представляет Phe или нафтилаланин; Xaa14 представляет Leu, пентилглицин или Met; Хаа22 представляет Phe или нафтилаланин; Хаа23 представляет Ile или Val; Хаа31, Хаа36, Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина. Более предпочтительно Z1 представляет -NH2.
В соответствии с особенно предпочтительным аспектом особенно предпочтительными соединениями являются те соединения формулы (I), в которых Xaa1 представляет His или Arg; Хаа2 представляет Gly или Ala; Хаа3 представляет Asp или Glu; Xaa5 представляет Ala или Thr; Xaa6 представляет Ala, Phe или нафтилаланин; Xaa7 представляет Thr или Ser; Xaa8 представляет Ala, Ser или Thr; Хаа9 представляет Asp или Glu; Хаа10 представляет Ala, Leu или пентилглицин; Хаа11 представляет Ala или Ser; Xaa12 представляет Ala или Lys; Xaa13 представляет Ala или Gln; Xaa14 представляет Ala, Leu или пентилглицин; Xaa15 представляет Ala или Glu; Xaa16 представляет Ala или Glu; Xaa17 представляет Ala или Glu; Xaa19 представляет Ala или Val; Xaa20 представляет Ala или Arg; Xaa21 представляет Ala или Leu; Хаа22 представляет Phe или нафтилаланин; Хаа23 представляет Ile, Val или трет-бутилглицин; Хаа24 представляет Ala, Glu или Asp; Xaa25 представляет Ala, Trp или Phe; Хаа26 представляет Ala или Leu; Xaa27 представляет Ala или Lys; Xaa28 представляет Ala или Asn; Z1 представляет -ОН, -NH2, Gly-Z2, Gly Gly-Z2, Gly Gly Xaa31-Z2, Gly Gly Xaa31 Ser-Z2, Gly Gly Xaa31 Ser Ser-Z2, Gly Gly Xaa31 Ser Ser Gly-Z2, Gly Gly Xaa31 Ser Ser Gly Ala-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Хаа37 Xaa38-Z2; Xaa31, Хаа36, Хаа37 и Хаа38 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; и Z2 представляет -ОН или -NH2; предусматривая, что не более трех из Хаа3, Xaa5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala. Особенно предпочтительными соединениями являются те соединения, которые перечислены в патентной заявке РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", идентифицированные в ней как соединения 2-23.
В соответствии с особенно предпочтительным аспектом предусматриваются соединения, в которых Xaa14 представляет Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, a Xaa25 представляет Phe, Tyr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Данные соединения будут менее чувствительны к окислительной деструкции и in vitro, и in vivo, а также в ходе синтеза соединения.
Формула II
Соединения-агонисты экзендина также включают те соединения, которые описаны в предварительной патентной заявке США №60/066029, включая соединения формулы (II) [SEQ ID NO 42]:
Xaa1 Xaa2 Хаа3 Хаа4 Xaa5 Xaa6 Хаа7 Хаа8 Хаа9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Хаа23 Xaa24 Xaa25 Хаа26 Хаа27 Xaa28-Z1; где
Xaa1 представляет His, Arg, Tyr, Ala, Norval, Val или Norleu;
Xaa2 представляет Ser, Gly, Ala или Thr;
Хаа3 представляет Ala, Asp или Glu;
Xaa4 представляет Ala, Norval, Val, Norleu или Gly;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Phe, Tyr или нафтилаланин;
Хаа7 представляет Thr или Ser;
Хаа8 представляет Ala, Ser или Thr;
Хаа9 представляет Ala, Norval, Val, Norleu, Asp или Glu;
Хаа10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Хаа11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Хаа14 представляет Ala, Leu, lle, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Phe, Tyr или нафтилаланин;
Хаа23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Хаа24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp, Phe, Туг или нафтилаланин;
Хаа26 представляет Ala или Leu;
Хаа27 представляет Ala или Lys;
Хаа28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Xaa38-Z2; или
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38 Хаа39-Z2;
Хаа31, Хаа36, Хаа37 и Хаа38 независимо друг от друга представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Хаа4, Xaa5, Xaa6, Хаа8, Хаа9, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Хаа26, Хаа27 и Хаа28 представляют Ala; и предусматривая также, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере одна из Хаа3, Хаа4 и Хаа9 представляет Ala.
Предпочтительными N-алкильными группами для N-алкилглицина, N-алкилпентилглицина и N-алкилаланина являются низшие алкильные группы предпочтительно с 1 до примерно 6 атомами углерода, более предпочтительно с 1-4 атомами углерода. Подходящими соединениями формулы (II) являются те соединения, которые описаны в заявке серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", идентифицированные в ней в примерах 1-89 ("соединения 1-89" соответственно), а также те соединения, которые соответствуют соединениям, идентифицированным в ней в примерах 104 и 105.
Предпочтительными соединениями-агонистами экзендина являются те соединения, в которых Xaa1 представляет His, Ala или Norval. Более предпочтительно Xaa1 представляет His или Ala. Наиболее предпочтительно Xaa1 представляет His.
Предпочтительными являются те соединения формулы (II), в которых Xaa2 представляет Gly.
Предпочтительными являются те соединения формулы (II), в которых Хаа3 представляет Ala.
Предпочтительными являются те соединения формулы (II), в которых Хаа4 представляет Ala.
Предпочтительными являются те соединения формулы (II), в которых Хаа9 представляет Ala.
Предпочтительными являются те соединения формулы (II), в которых Xaa14 представляет Leu, пентилглицин или Met.
Предпочтительными соединениями формулы (II) являются те соединения, в которых Хаа25 представляет Trp или Phe.
Предпочтительными соединениями формулы (II) являются те соединения, в которых Хаа6 представляет Ala, Phe или нафтилаланин; Xaa22 представляет Phe или нафтилаланин; и Хаа23 представляет Ile или Val.
Предпочтительными являются соединения формулы (II), в которых Хаа31, Хаа36, Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина и N-алкилаланина.
Предпочтительно Z1 представляет -NH2.
Предпочтительно Zz представляет -NH2.
В соответствии с одним аспектом предпочтительными являются соединения формулы (II), в которых Xaa1 представляет Ala, His или Tyr, более предпочтительно Ala или His; Хаа2 представляет Ala или Gly; Хаа6 представляет Phe или нафтилаланин; Xaa14 представляет Ala, Leu, пентилглицин или Met; Xaa22 представляет Phe или нафтилаланин; Хаа23 представляет Ile или Val; Xaa31, Хаа36, Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина и N-алкилаланина; и Хаа39 представляет Ser или Tyr, более предпочтительно Ser. Более предпочтительно Z1 представляет -NH2.
В соответствии с особенно предпочтительным аспектом особенно предпочтительными соединениями являются те соединения формулы (II), в которых: Xaa1 представляет His или Ala; Xaa2 представляет Gly или Ala; Хаа3 представляет Ala, Asp или Glu; Хаа4 представляет Ala или Gly; Xaa5 представляет Ala или Thr; Хаа6 представляет Phe или нафтилаланин; Хаа7 представляет Thr или Ser; Хаа8 представляет Ala, Ser или Thr; Хаа9 представляет Ala, Asp или Glu; Хаа10 представляет Ala, Leu или пентилглицин; Хаа11 представляет Ala или Ser; Xaa12 представляет Ala или Lys; Xaa13 представляет Ala или Gln; Xaa14 представляет Ala, Leu, Met или пентилглицин; Xaa15 представляет Ala или Glu; Хаа16 представляет Ala или Glu; Xaa17 представляет Ala или Glu; Xaa19 представляет Ala или Val; Xaa20 представляет Ala или Arg; Xaa21 представляет Ala или Leu; Хаа22 представляет Phe или нафтилаланин; Хаа23 представляет Ile, Val или трет-бутилглицин; Хаа24 представляет Ala, Glu или Asp; Xaa25 представляет Ala, Trp или Phe; Хаа26 представляет Ala или Leu; Xaa27 представляет Ala или Lys; Xaa28 представляет Ala или Asn; Z1 представляет -ОН, -NH2, Gly-Z2, Gly Gly-Z2, Gly Gly Xaa31-Z2, Gly Gly Xaa31 Ser-Z2, Gly Gly Xaa31 Ser Ser-Z2, Gly Gly Хаа31 Ser Ser Gly-Z2, Gly Gly Хаа31 Ser Ser Gly Ala-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2, или Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38 Хаа39-Z2; Хаа31, Хаа36, Хаа37 и Хаа38 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; и Z2 представляет -ОН или -NH2; предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Хаа8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Хаа16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Хаа26, Xaa27 и Хаа28 представлены Ala; и предусматривая также, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере одна из Хаа3, Хаа4 и Хаа9 представляет Ala. Особенно предпочтительными соединениями формулы (II) являются те соединения, которые описаны в заявке серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина, как характеризующиеся приведенными в ней аминокислотными последовательностями SEQ ID NO 5-93.
В соответствии с особенно предпочтительным аспектом предусматриваются соединения формулы (II), в которых Хаа14 представляет Ala, Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, а Xaa25 представляет Ala, Phe, Tyr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Данные соединения будут менее чувствительны к окислительной деструкции и in vitro, и in vivo, а также в ходе синтеза соединения.
Формула III
Также в объем настоящего изобретения попадают более узкие классы соединений, включающие пептиды различной длины, например классы соединений, которые не включают пептиды, имеющие в длину 28, 29 или 30 аминокислотных остатков соответственно. Кроме того, настоящее изобретение охватывает более узкие классы соединений, описанные в заявке РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", и характеризующиеся конкретными аминокислотными последовательностями, например соединения формулы (III) [SEQ ID NO 43]:
Xaa1 Xaa2 Хаа3 Gly Xaa5 Xaa6 Xaa7 Xaa8 Хаа9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa18 Xaa19 Xaa20 Xaa21 Хаа22 Хаа23 Xaa24 Xaa25 Xaa26 Xaa27 Xaa28-Z1;
где
Xaa1 представляет His или Arg;
Xaa2 представляет Gly или Ala;
Хаа3 представляет Asp или Glu;
Xaa5 представляет Ala или Thr;
Хаа6 представляет Ala, Phe или нафтилаланин;
Хаа7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Хаа9 представляет Asp или Glu;
Хаа10 представляет Ala, Leu или пентилглицин;
Хаа11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu или пентилглицин;
Xaa15 представляет Ala или Glu;
Хаа16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Хаа20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Хаа22 представляет Phe или нафтилаланин;
Хаа23 представляет Ile, Val или трет-бутилглицин;
Хаа24 представляет Ala, Glu или Asp;
Хаа25 представляет Ala, Trg или Phe;
Хаа26 представляет Ala или Leu;
Хаа27 представляет Ala или Lys;
Хаа28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, или
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2;
Хаа31, Хаа36, Хаа37 и Xaa38 независимо друг от друга выбирают из группы, которая включает Pro, гомопролин, тиопролин или N-метилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala; и их фармацевтически приемлемые соли.
Формула IV
Кроме того, настоящее изобретение охватывает более узкие классы пептидных соединений, описанных в заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", как имеющие конкретные аминокислотные последовательности, например соединения формулы (IV) [SEQ ID NO 44]:
Xaa1 Xaa2 Хаа3 Хаа4 Xaa5 Xaa6 Xaa7 Хаа8 Хаа9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa18 Xaa19 Xaa20 Xaa21 Xaa22 Хаа23 Хаа24 Хаа25 Хаа26 Хаа27 Xaa28-Z1; где
Xaa1 представляет His или Ala;
Xaa2 представляет Gly или Ala;
Хааз представляет Ala, Asp или Glu;
Xaa4 представляет Ala или Gly;
Хаа5 представляет Ala или Thr;
Хаа6 представляет Phe или нафтилаланин;
Хаа7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Хаа9 представляет Ala, Asp или Glu;
Хаа10 представляет Ala, Leu или пентилглицин;
Хаа11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Met или пентилглицин;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Хаа20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Хаа22 представляет Phe или нафтилаланин;
Хаа23 представляет Ile, Val или трет-бутилглицин;
Хаа24 представляет Ala, Glu или Asp;
Хаа25 представляет Ala, Trg или Phe;
Хаа26 представляет Ala или Leu;
Хаа27 представляет Ala или Lys;
Хаа28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2;
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38 Ser-Z2;
Хаа31, Хаа36, Хаа37 и Хаа38 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Хаа15, Хав16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Хаа26, Хаа27 и Хаа28 представляют Ala и предусматривая, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере одна из Хаа3, Хаа4 и Хаа9 представляет Ala и их фармацевтически приемлемые соли.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Xaa1 представляет His, Ala, Norval или 4-имидазопропионил. Предпочтительно Xaa1 представляет His или 4-имидазопропионил, или Ala, более предпочтительно His или 4-имидазопропионил.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа2 представляет Gly.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа4 представляет Ala.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа9 представляет Ala.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа14 представляет Leu, пентилглицин или Met.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа25 представляет Trg или Phe.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа6 представляет Ala, Phe или нафтилаланин; Хаа22 представляет Phe или нафтилаланин и Хаа23 представляет Ile или Val.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Z1 представляет -NH2.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Xaa31, Хаа36, Хаа37 и Хаа38 независимо выбирают из группы, которая включает Pro, гомопролин, тиопролин и N-алкилаланин.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Хаа39 представляет Ser или Tyr, предпочтительно Ser.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Z2 представляет -NH2.
Предпочтительными соединениями формулы (IV) являются те 42 соединения, в которых Z1 представляет -NH2.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых Xaa21 представляет Lys-NH6R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью.
Предпочтительными соединениями формулы (IV) являются те соединения, в которых X1 представляет Lys Asn, Lys-NH6R Asn или Lys-NH6-R Ala, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью. Предпочтительными соединениями формулы (IV) являются те соединения, которые характеризуются аминокислотной последовательностью, описанной в заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", как выбранные из SEQ ID NO 95-110 этой заявки.
Формула V
Также предусматриваются соединения, описанные в заявке РСТ PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", включая соединения формулы (V) [SEQ ID NO 45]:
Xaa1 Xaa2 Хаа3 Gly Xaa5 Хаа6 Хаа7 Xaa8 Xaa9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Хаа23 Хаа24 Xaa25 Xaa26 X1 -Z1; где
Xaa1 представляет His, Arg или Tyr, или 4-имидазопропионил;
Хаа2 представляет Ser, Gly, Ala или Thr;
Хаа3 представляет Asp или Glu;
Хаа5 представляет Ala или Thr;
Хаа6 представляет Ala, Phe, Туг или нафтилаланин;
Хаа7 представляет Thr или Ser;
Xaa8 представляет Ala/ Ser или Thr;
Хаа9 представляет Asp или Glu;
Хаа10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Хаа11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Хаа16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala, Leu или Lys-NH6-R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Хаа22 представляет Phe, Tyr или нафтилаланин;
Хаа23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp, Phe, Tyr или нафтилаланин;
Хаа26 представляет Ala или Leu;
X1 представляет Lys Asn, Asn Lys, Lys-NH6-R Asn, Asn Lys-NH6-R, Lys-NH6-R Ala, Ala Lys-NH6-R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, или
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2;
где
Хаа31, Хаа36, Хаа37 и Xaa38 независимо выбирают из группы, которая включает Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Хаа8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Хаа20, Xaa21, Xaa24, Xaa25 и Xaa26 представляют Ala. Также в объем настоящего изобретения попадают фармацевтически приемлемые соли соединений формулы (V) и фармацевтические композиции, содержащие упомянутые соединения и их соли.
Предпочтительными соединениями-агонистами экзендина формулы (V) являются те соединения, в которых Xaa1 представляет His, Tyr или 4-имидазопропионил. Более предпочтительно Xaa1 представляет His.
Предпочтительными являются те соединения формулы (V), в которых Xaa1 представляет 4-имидазопропионил.
Предпочтительными являются те соединения формулы (V), в которых Хаа2 представляет Gly.
Предпочтительными соединениями формулы (V) являются те соединения, в которых Xaa14 представляет Leu, пентилглицин или Met.
Предпочтительными соединениями формулы (V) являются те соединения, в которых Xaa25 представляет Trg или Phe.
В соответствии с одним аспектом предпочтительными являются соединения формулы (V), в которых Хаа6 представляет Phe или нафтилаланин; и Хаа22 представляет Phe или нафтилаланин; и Хаа23 представляет Ile или Val. Более предпочтительно Z1 представляет -NH2. В соответствии с одним аспектом особенно предпочтительными являются такие соединения формулы (V), в которых Xaa31, Хаа36, Хаа37 и Хаа38 независимо друг от друга выбирают из группы, которая включает Pro, гомопролин, тиопролин и N-алкилаланин. Более предпочтительно Z2 представляет -NH2.
Предпочтительными соединениями формулы (V) являются те соединения, в которых X1 представляет Lys Asn, Lys-NHε-R Asn или Lys-NIε-R Ala, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью. Предпочтительными соединениями формулы (V) являются соединения, описанные в заявке РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", и идентифицированные в ней как соединения №№62-69.
Такими предпочтительными соединениями-агонистами экзендина являются те соединения, в которых Xaa1 представляет His, Ala или Norval. Более предпочтительно Xaa1 представляет His или Ala. Наиболее предпочтительно Xaa1 представляет His.
Предпочтительными являются те соединения формулы (V), в которых Хаа2 представляет Gly.
Предпочтительными являются те соединения формулы (V), в которых Хаа3 представляет Ala.
Предпочтительными являются те соединения формулы (V), в которых Хаа4 представляет Ala.
Предпочтительными являются те соединения формулы (V), в которых Хаа9 представляет Ala.
Предпочтительными являются те соединения формулы (V), в которых Xaa14 представляет Leu, пентилглицин или Met.
Предпочтительными соединениями формулы (V) являются те соединения, в которых Xaa25 представляет Trg или Phe.
Предпочтительными соединениями формулы (V) являются те соединения, в которых Хаа6 представляет Ala, Phe или нафтилаланин; Хаа22 представляет Phe или нафтилаланин и Хаа23 представляет Ile или Val.
Предпочтительными являются соединения формулы (V), в которых Хаа31, Хаа36, Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина и N-алкилаланина.
Предпочтительно Z1 представляет -NH2.
Предпочтительно Z2 представляет -NH2.
В соответствии с одним аспектом предпочтительными являются соединения формулы (V), в которых Xaa1 представляет Ala, His или Tyr, более предпочтительно Ala или His; Xaa2 представляет Ala или Gly; Xaa6 представляет Phe или нафтилаланин; Xaa14 представляет Ala, Leu, пентилглицин или Met; Хаа22 представляет Phe или нафтилаланин; Хаа23 представляет Ile или Val; Хаа31, Xaa36,Хаа37 и Хаа38 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина; и Хаа39 представляет Ser или Tyr, более предпочтительно Ser. Более предпочтительно Z1 представляет -NH2.
В соответствии с особенно предпочтительным аспектом особенно предпочтительными соединениями являются те соединения формулы (V), в которых Xaa1 представляет His или Ala; Хаа2 представляет Gly или Ala; Хаа3 представляет Ala, Asp или Glu; Xaa4 представляет Ala или Gly; Xaa5 представляет Ala или Thr; Хаа6 представляет Phe или нафтилаланин; Хаа7 представляет Thr или Ser; Xaa8 представляет Ala, Ser или Thr; Хаа9 представляет Ala, Asp или Glu; Хаа10 представляет Ala, Leu или пентилглицин; Хаа11 представляет Ala или Ser; Xaa12 представляет Ala или Lys; Xaa13 представляет Ala или Gln; Xaa14 представляет Ala, Leu, Met или пентилглицин; Xaa15 представляет Ala или Glu; Xaa16 представляет Ala или Glu; Xaa17 представляет Ala или Glu; Xaa19 представляет Ala или Val; Xaa20 представляет Ala или Arg; Xaa21 представляет Ala или Leu; Xaa22 представляет Phe или нафтилаланин; Хаа23 представляет Ile, Val или трет-бутилглицин; Хаа24 представляет Ala, Glu или Asp; Хаа25 представляет Ala, Trp или Phe; Хаа26 представляет Ala или Leu; Хаа27 представляет Ala или Lys; Хаа28 представляет Ala или Asn; Z1 представляет -ОН, -NH2, Gly-Z2, Gly Gly-Z2, Gly Gly Xaa31-Z2, Gly Gly Xaa31 Ser-Z2, Gly Gly Xaa31 Ser Ser-Z2, Gly Gly Xaa31 Ser Ser Gly-Z2, Gly Gly Xaa31 Ser Ser Gly Ala-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Xaa37-Z2, Gly Gly Xaa31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2 или Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38 Xaa39-Z2; Хаа31, Хаа36, Хаа37 и Хаа38 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; и Z2 представляет -ОН или -NH2; предусматривая, что не более чем три из Хаа3, Xaa5, Xaa6, Xaa8, Хаа10, Хаа11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27, Xaa28 представляют Ala; и предусматривая также, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере одна из Хаа3, Хаа4 и Хаа9 представляет Ala. Особенно предпочтительными соединениями формулы (V) являются те соединения, которые были описаны в заявке РСТ серийного №PCT/US 98/24210, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", и характеризующиеся аминокислотными последовательностями, идентифицированными в ней как SEQ ID NO 5-93.
В соответствии с особенно предпочтительным аспектом представляются соединения формулы (V), в которых Xaa14 представляет Ala, Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, a Xaa25 представляет Ala, Phe, Tyr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Данные соединения будут менее чувствительны к окислительной деструкции и in vitro, и in vivo, а также в ходе синтеза соединения.
Формула VI
Также предусматриваются пептидные соединения, описанные в заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", включая соединения формулы (VI) [SEQ ID NO 46]:
Xaa1 Хаа2 Хаа3 Хаа4 Хаа5 Xaa6 Xaa7 Xaa8 Хаа9 Хаа10 Хаа11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Хаа23 Xaa24 Xaa25 Хаа26 X1-Z1; где
Xaa1 представляет His, Arg, Tyr, Ala, Norval, Val, Norleu или 4-имидазопропионил;
Хаа2 представляет Ser, Gly, Ala или Thr;
Хаа3 представляет Ala, Asp или Glu;
Хаа4 представляет Ala, Norval, Val, Norleu или Gly;
Xaa5 представляет Ala или Thr;
Хаа6 представляет Phe, Tyr или нафтилаланин;
Хаа7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Хаа9 представляет Ala, Norval, Val, Norleu, Asp или Glu;
Хаа10 представляет Ala, Leu, He, Val, пентилглицин или Met;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Хаа20 представляет Ala или Arg;
Xaa21 представляет Ala, Leu или Lys-NHε-R, где R представляет Lys, Агд, C1-10-алканоил с прямой или разветвленной цепью или циклоаллеилалканоил;
Хаа22 представляет Phe, Tyr или нафтилаланин;
Хаа23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Хаа24 представляет Ala, Glu или Asp;
Хаа25 представляет Ala, Trg, Phe, Tyr или нафтилаланин;
Хаа26 представляет Ala или Leu;
X1 представляет Lys Asn, Asn Lys, Lys-NHε-R Asn, Asn Lys-NHε-R, Lys-NHε-R Ala, Ala Lys-NHε-R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Хаа31 Ser-Z2,
Gly Gly Хаа31 Ser Ser-Z2,
Gly Gly Хаа31 Ser Ser Gly-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37-Z2,
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38-Z2,
или
Gly Gly Хаа31 Ser Ser Gly Ala Хаа36 Хаа37 Хаа38 Хаа39-Z2;
где
Xaa31, Хаа36, Хаа37 и Хаа38 независимо выбирают из группы, которая включает Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
предусматривая, что не более чем три из Хаа3, Хаа4, Xaa5, Хаа6, Xaa8, Xaa9, Хаа10, Хаа11, Xaa12, Хаа13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Хаа26 представляют Ala; и предусматривая также, что, если Xaa1 представляет His, Arg, Tyr или 4-имидазопропионил, то по крайней мере одна из Хааз, Хаа4 и Xaa9 представляет Ala.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Xaa1 представляет His, Ala, Norval или 4-имидазопропионил. Предпочтительно Xaa1 представляет His или 4-имидазопропионил, или Ala, более предпочтительно His или 4-имидазопропионил.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа2 представляет Gly.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа4 представляет Ala.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа9 представляет Ala.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Xaa14 представляет Leu, пентилглицин или Met.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Xaa25 представляет Trg или Phe.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа6 представляет Ala, Phe или нафтилаланин; Хаа22 представляет Phe или нафтилаланин и Хаа23 представляет Ile или Val.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Z1 представляет -NH2.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа31, Хаа36, Хаа37 и Xaa38 независимо выбирают из группы, которая включает Pro, гомопролин, тиопролин и N-алкилаланин.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Хаа39 представляет Ser или Tyr, предпочтительно Ser.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Z2 представляет -NH2.
Предпочтительными соединениями формулы (VI) являются те 42 соединения, в которых Z1 представляет -NH2.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых Xaa21 представляет Lys-NHε-R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью.
Предпочтительными соединениями формулы (VI) являются те соединения, в которых X1 представляет Lys Asn, Lys-NHε-R Asn или Lys-NHε-R Ala, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью.
Предпочтительными соединениями формулы (VI) являются те соединения, которые описаны в заявке РСТ серийного №PCT/US 98/24273, поданной 13 ноября 1998 г., озаглавленной "Новые соединения-агонисты экзендина", как характеризующиеся аминокислотной последовательностью, выбранной из тех, которые идентифицированы в этой заявке как SEQ ID NO 95-110.
Формула VII
Соединениями, конкретно применимыми в соответствии с настоящим изобретением, являются соединения-агонисты экзендина, описанные в патентной заявке США серийного №09/003869, поданной 7 января 1998 г., озаглавленной "Применение экзендинов и их агонистов для снижения потребления пищи", включая соединения формулы (VII) [SEQ ID NO 47]:
Xaa1 Хаа2 Хаа3 Gly Thr Xaa4 Xaa5 Хаа6 Xaa7 Xaa8
Ser Lys Gin Хаа9 Glu Glu Glu Ala Val Arg
Leu Хаа10 Хаа11 Xaa12 Xaa13 Leu Lys Asn Gly Gly
35
Xaa14 Ser Ser Gly Ala Xaa15 Xaa16 Xaa17 Xaa18-Z,
где Xaa1 представляет His, Arg или Tyr; Xaa2 представляет Ser, Gly, Ala или Thr; Хааз представляет Asp или Glu; Xaa4 представляет Phe, Туг или нафтилаланин; Xaa5 представляет Thr или Ser; Xaa6 представляет Ser или Thr; Хаа7 представляет Asp или Glu; Xaa8 представляет Leu, Ile, Val, пентилглицин или Met; Хаа9 представляет Leu, Ile, пентилглицин, Val или Met; Хаа10 представляет Phe, Tyr или нафтилаланин; Хаа11 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met; Xaa12 представляет Glu или Asp; Xaa13 представляет Trg, Phe, Tyr или нафтилаланин; Xaa14, Xaa15, Xaa16 и Xaa17 независимо представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; Xaa18 представляет Ser, Thr или Tyr; и Z представляет -ОН или -NH2 при условии, что соединение не имеет формулы SEQ ID NO 1 или 2. Предпочтительными N-алкильными группами для N-алкилглицина, N-алкилпентилглицина и N-алкилаланина являются низшие алкильные группы предпочтительно с 1 до примерно 6 атомами углерода, более предпочтительно с 1-4 атомами углерода. Подходящими соединениями являются те соединения, которые характеризуются аминокислотными последовательностями SEQ ID NO 10-40. Также в настоящем изобретении применимы фармацевтически приемлемые соли соединений формулы (VII).
Предпочтительными соединениями-агонистами экзендина являются те соединения, в которых Xaa1 представляет His или Tyr. Более предпочтительно Xaa1 представляет His.
Предпочтительными являются те соединения, в которых Хаа2 представляет Gly.
Предпочтительными являются те соединения, в которых Хаа9 представляет Leu, пентилглицин или Met.
Предпочтительными являются те соединения, в которых Хаа13 представляет Trp или Phe.
Также предпочтительными являются соединения, в которых Хаа4 представляет Phe или нафтилаланин; Хаа11 представляет Ile или Val, a Xaa14, Xaa15, Xaa16 и Xaa17 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина. Предпочтительно N-акилаланин имеет N-алкильную группу, включающую от 1 до примерно 6 атомов углерода.
В соответствии с особенно предпочтительным аспектом Xaa15, Xaa16 и Xaa17 являются одинаковыми аминокислотными остатками.
Предпочтительными являются соединения, в которых Xaa18 представляет Ser или Tyr, более предпочтительно Ser.
Предпочтительно Z представляет -NH2.
В соответствии с одним аспектом предпочтительными являются соединения формулы (VII), в которых Xaa1 представляет His или Tyr, более предпочтительно His; Xaa2 представляет Gly; Хаа4 представляет Phe или нафтилаланин; Хаа9 представляет Leu, пентилглицин или Met; Хаа10 представляет Phe или нафтилаланин; Хаа11 представляет Ile или Val; Xaa14, Xaa15, Xaa16 и Xaa17 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина; и Xaa18 представляет Ser или Tyr, более предпочтительно Ser. Более предпочтительно Z представляет -NH2.
В соответствии с особенно предпочтительным аспектом особенно предпочтительными соединениями являются те соединения формулы (VII), в которых Xaa1 представляет His или Arg; Хаа2 представляет Gly; Хаа3 представляет Asp или Glu; Хаа представляет Phe или нафтилаланин; Xaa5 представляет Thr или Ser; Хаа6 представляет Ser или Thr; Хаа7 представляет Asp или Glu; Xaa8 представляет Leu или пентилглицин; Хаа9 представляет Leu или пентилглицин; Хаа10 представляет Phe или нафтилаланин; Хаа11 представляет Ile, Val или трет-бутилглицин; Xaa12 представляет Glu или Asp; Xaa13 представляет Trp или Phe; Xaa14, Xaa15, Xaa16 и Xaa17 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; Xaa18 представляет Ser или Tyr и Z представляет -ОН или -NH2 при условии, что соединение не имеет формулу SEQ ID NO 1 или 2. Более предпочтительно Z представляет -NH2. Особенно предпочтительными соединениями являются те соединения, которые имеют аминокислотную последовательность SEQ ID NO 10, 11, 22, 23, 24, 27, 29, 36, 37 и 40.
В соответствии с особенно предпочтительным аспектом предусматриваются соединения, в которых Хаа9 представляет Leu, Ile, Val или пентилглицин, более предпочтительно Leu или пентилглицин, a Xaa13 представляет Phe, Tyr или нафтилаланин, более предпочтительно Phe или нафтилаланин. Данные соединения, как считается, проявят преимущественную продолжительность действия и будут в меньшей степени подвержены окислительной деструкции и in vitro, и in vivo, a также в ходе синтеза соединения.
Формула VIII
Также представляются соединения, описанные в заявке РСТ серийного PCT/US 98/16387, поданной 6 августа 1998 г., озаглавленной "Новые соединения-агонисты экзендина", включая соединения формулы (VIII) [SEQ ID NO 48]:
Xaa1 Xaa2 Хаа3 Gly Thr Xaa4 Xaa5 Xaa6 Xaa7 Xaa8
Ser Lys Gln Xaa9 Glu Glu Glu Ala Val Arg
Leu Хаа10 Хаа11 Xaa12 Xaa13 Leu X1 Gly Gly Xaa14
35
Ser Ser Gly Ala Xaa15 Xaa16 Xaa17 Xaa18-Z,
где Xaa1 представляет His, Arg, Tyr или 4-имидазопропионил; Хаа2 представляет Ser, Gly, Ala или Tyr; Хаа3 представляет Asp или Glu; Хаа4 представляет Phe, Tyr или нафтилаланин; Xaa5 представляет Thr или Ser; Хаа6 представляет Ser или Thr; Хаа7 представляет Asp или Glu; Xaa8 представляет Leu, Ile, Val, пентилглицин или Met; Хаа9 представляет Leu, Не, пентилглицин, Val или Met; Хаа10 представляет Phe, Tyr или нафтилаланин; Хаа11 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met; Xaa12 представляет Glu или Asp; Xaa13 представляет Trp, Phe, Tyr или нафтилаланин; X1 представляет Lys Asn, Asn Lys, Lys-NHε-R Asn, Asn Lys-NHε-R, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил; Xaa14, Xaa15, Xaa16 и Xaa17 независимо представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; Xaa18 представляет Ser, Thr или Tyr и Z представляет -ОН или -NH2; при условии, что соединение не имеет формулы SEQ ID NO 1 или 2. Подходящими соединениями формулы (VIII) являются соединения, описанные в заявке РСТ серийного №PCT/US 98/16387, поданной 6 августа 1998 г., озаглавленной "Новые соединения-агонисты экзендина", характеризующиеся имеющимися в ней аминокислотными последовательностями SEQ ID NO 37-40.
Предпочтительными соединениями-агонистами экзендина формулы (VIII) являются те соединения, в которых Xaa1 представляет His, Tyr или 4-имидазопропионил. Более предпочтительно Xaa1 представляет His или 4-имидазопропионил.
Предпочтительными являются те соединения формулы (VIII), в которых Хаа2 представляет Gly.
Предпочтительными являются те соединения формулы (VIII), в которых Хаа9 представляет Leu, пентилглицин или Met.
Предпочтительными являются те соединения формулы (VIII), в которых Хаа13 представляет Trp или Phe.
Предпочтительными являются те соединения формулы (VIII), в которых X1 представляет Lys Asn или Lys-NHε-R Asn, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью.
Также предпочтительными являются соединения формулы (VIII), в которых Хаа4 представляет Phe или нафтилаланин; Хаа10 представляет Phe или нафтилаланин; Хаа11 представляет Ile или Val, a Xaa14, Xaa15, Хаа16 и Xaa17 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина. В соответствии с особенно предпочтительным аспектом Xaa18 представляет Ser или Tyr. Предпочтительными являются такие соединения, в которых Xaa18 представляет Ser. Предпочтительно Z представляет -NH2.
В соответствии с одним предпочтительным аспектом предпочтительными являются соединения формулы (VIII), в которых Хаа4 представляет Phe или нафтилаланин; Хаа10 представляет Phe или нафтилаланин; Хаа11 представляет Ile или Val; X1 представляет Lys Asn или Lys-NHε-R Asn, где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью, Хаа14, Xaa15, Xaa16 и Xaa17 независимо выбирают из Pro, гомопролина, тиопролина или N-алкилаланина.
Получение модифицированных экзендинов и агонистов экзендина
Модифицированные экзендины и агонисты экзендина по настоящему изобретению могут быть получены путем присоединения одного или нескольких полимеров полиэтиленгликоля к экзендину или агонисту экзендина. Синтез экзендинов и агонистов экзендина, таким образом, описан вначале, после чего описана методология присоединения полимера(ов) полиэтиленгликоля к экзендину или агонисту экзендина.
Получение экзендинов и агонистов экзендина
Экзендины и соединения-агонисты экзендина, такие как аналоги экзендина и производные экзендина, описанные в данном тексте, могут быть получены методом очистки белков в соответствии с описанным, например, у Eng et al., 1990, J. Biol. Chem., 265, 20259-20262 и Eng et al., 1992, J. Biol. Chem., 267, 7402-7405, что включено здесь для сведения в виде библиографических ссылок. Как альтернатива, экзендины и пептиды-агонисты экзендина могут быть получены с помощью подходов, известных специалистам в данной области техники, например, в соответствии с описанным у Raufman et al., 1992, J. Biol. Chem., 267, 21432-21437, что включено здесь для сведения в виде библиографической ссылки, на основе использования стандартных методов твердофазного пептидного синтеза и предпочтительно с помощью автоматического или полуавтоматического пептидного синтезатора. Соединения, которые являются активными компонентами препаратов и дозированных форм по настоящему изобретению, могут быть получены с использованием стандартных методов твердофазного пептидного синтеза и предпочтительно с помощью автоматического или полуавтоматического пептидного синтезатора. Обычно при использовании таких методов защищенную -N-карбамоилом аминокислоту и аминокислоту, присоединенную к растущей пептидной цепочке на полимере, сочетают при комнатной температуре в инертном растворителе, таком как диметилформамид, N-метилпирролидинон или метиленхлорид, в присутствие связывающих агентов, таких как дициклогексилкарбодиимид и 1-гидроксибензотриазол, в присутствии основания, такого как диизопропилэтиламин. Защитную -N-карбамоильную группу удаляют из образовавшейся связки пептида с полимером с использованием такого реагента, как трифторуксусная кислота или пиперидин, и реакцию сочетания повторяют со следующей желательной N-защищенной аминокислотой, которая должна быть добавлена к пептидной цепочке. Подходящие N-защитные группы хорошо известны в данной области техники, среди которых предпочтительными являются трет-бутоксикарбонил (tBoc) и флуоренилметоксикарбонил (Fmoc).
Растворители, производные аминокислот и 4-метилбензгидриламиновый полимер, используемые в пептидном синтезаторе, можно закупить в Applied Biosystems Inc. (Foster City, CA). Следующие защищенные по боковым цепям аминокислоты могут быть приобретены у фирмы Applied Biosystems Inc.: BSD-112344.1 - Arg(Pmc), Boc-Thr(Bzl), Fmoc-Thr(t-Bu), Boc-Ser(Bzl), Fmoc-Ser(t-Bu), Boc-Tyr(BrZ), Fmoc-Tyr(t-Bu), Boc-Lys(Cl-Z), Fmoc-Lys(Boc), Boc-Glu(Bzl), Fmoc-Glu(t-Bu), Fmoc-His(Trt), Fmoc-Asn(Trt) и Fmoc-GIn (Trt). Boc-His(BOM) можно приобрести у Applied Biosystems Inc. или у Bachem Inc. (Torrance, CA). Анизол, диметилсульфид, фенол, этандитиол и тиоанизол можно получить от Aldrich Chemical Co. (Milwaukee, WI). Air Products & Chemicals (Allentown, PA) поставляет HF. Этиловый эфир, уксусную кислоту и метанол можно закупить у Fisher Scientific (Pittsburgh, PA).
Твердофазный пептидный синтез может быть осуществлен на автоматическом пептидном синтезаторе (модель 430А: Applied Biosystems Inc., Foster City, CA) с использованием системы NMP/HOBt (Option I) и химии tBOC и Fmoc (см. руководство пользователя Applied Biosystems для пептидного синтезатора ABI 430A, vers. 1.3B от 1 июля 1988 г., раздел 6, стр. 49-70: Applied Biosystems Inc., Foster City, CA) с блокированием активных групп. Комплексы Вос-пептида с полимером можно расщепить с помощью HF (от -50 до 0°С в течение 1 часа). Пептид может быть экстрагирован с полимера с помощью смены воды и уксусной кислоты с последующей лиофилизацией фильтратов. Комплексы Fmoc-пептида и полимера можно расщепить с помощью стандартных методов (Introduction to Cleavage Techniques, Applied Biosystems Inc., 1990, pp.6-12). Пептиды также можно собрать с использованием синтезатора Advanced Chem Tech (модель MPS-350; Louisville, KE).
Пептиды могут быть очищены с помощью ОФ-ВЭЖХ (препаративной и аналитической) с использованием системы Waters Delta Prep 3000. Препаративная колонка с пришитым С4, С8 или С18 (10 мкм, 2,225 см; Vydac, Hesperia, CA) может быть использована для выделения пептидов, а чистоту можно определить с использованием аналитической колонки С4, С8 или С18 (5 мкм, 0,4625 см; Vydac). Растворители (А=0,1% ТФУ/вода и В=0,1% ТФУ/СН3CN) могут быть внесены в аналитическую колонку со скоростью потока 1,0 мл/мин, а в препаративную колонку - 15 мл/мин. Аминокислотный анализ может быть проведен в системе Waters Pico Tag с обработкой данных в программе Maxima. Пептиды можно гидролизовать методом гидролиза в парах кислоты (115°С, 20-24 часа). Гидролизаты могут быть дериватизованы и проанализированы стандартными методами (Cohen et al., 1998, "The Pico Tag Method: A Manual of Advanced Techniques for Amino Acid Analysis", pp. 11-52, Millipore Corporation, Milford, MA). Анализ с помощью бомбардировки быстрыми атомами может быть проведен с помощью M-Scan Incorporated (West Chester, PA). Калибровку масс можно осуществить с использованием иодида цезия или иодида цезия/глицерина. Анализ методом плазматической десорбционной ионизации с использованием определения времени полета можно провести на масс-спектрометре Applied Biosystems Bio-Ion 20. Масс-спектроскопия с электрораспылением может быть осуществлена на устройстве VG-Trio.
Пептидные соединения, применимые в препаратах и дозированных формах по настоящему изобретению в качестве активных компонентов, также могут быть получены с использованием технологии рекомбинантных ДНК с использованием методов, известных в данной области техники в настоящее время: см., например, Sambrook et al., 1989, "Molecular Cloning: A Laboratory Manual", 2d ed., Cold Spring Harbor. Как альтернатива, такие соединения могут быть получены методами пептидного синтеза в гомогенной фазе. Непептидные соединения, применимые в настоящем изобретении, могут быть получены с помощью методов, известных в данной области техники. Например, содержащие фосфат аминокислоты и пептиды, включающие такие аминокислоты, могут быть получены с использованием методов, известных в данной области техники: см., например, Bartlett & Landen, 1986, Bioorg. Chem., 14, 356-377.
Присоединение полимеров полиэтиленгликоля
Существует несколько стратегий присоединения ПЭГ к пептидам/белкам: см. Int. J. Hematology, 68, 1 (1998); Bioconjugate Chem., 6, 150 (1995) и Crit. Rev. Therap. Drug Carrier Sys., 9m 249 (1992): все они в полном объеме включены здесь для сведения в виде библиографических ссылок.
Следовательно, специалист в данной области техники сможет применить такие хорошо известные методы для присоединения одного или нескольких полиэтиленгликолевых полимеров к экзендинам и агонистам экзендина, описываемым в данном тексте. Подходящие полимеры полиэтиленгликоля обычно имеются в продаже или могут быть изготовлены с помощью методов, хорошо известных специалистам в данной области техники. Предпочтительно полимеры полиэтиленгликоля имеют молекулярные массы от 500 до 20000 и могут являться полимерами с прямой или разветвленной цепью.
Присоединение ПЭГ к интактному пептиду или белку может быть осуществлено путем сочетания с аминогруппами, карбоксильными группами или тиоловыми группами. Обычно такие группы должны быть N- и С-концевыми или находиться на боковых цепях таких природных аминокислот, как лизин, аспарагиновая кислота, глутаминовая кислота и цистеин. Поскольку экзендин-4 и другие экзендины и агонисты экзендина могут быть получены с помощью методов твердофазной пептидной химии, то для целей присоединения ПЭГ могут быть внесены различные составляющие, содержащие диаминогруппы и дикарбоксильные группы с ортогональными защитными группами.
Также настоящее изобретение представляет присоединение экзендина или агониста экзендина к одному или нескольким полимерам, отличающимся от полиэтиленгликоля, которые способны регулировать почечный клиренс по механизму, сходному с таковым у полиэтиленгликоля. Примерами таких полимеров являются альбумин и желатин: см. Gombotz & Pettit, 1995, Bioconjugate Chem., 6, 332-351, что в полном объеме включено здесь для сведения в виде библиографической ссылки.
Применение
Препараты и дозированные формы, описываемые здесь, применяются исходя из их фармакологических свойств. В частности, описанные здесь соединения проявляют активность в качестве средств для снижения уровней глюкагона и подавления секреции глюкагона, что подтверждается способностью снижать уровни глюкагона у животных и человека. Они могут быть использованы для лечения состояний или заболеваний, при которых можно добиться облегчения в результате снижения уровней глюкагона и подавления секреции глюкагона.
Перечисленные выше соединения могут образовывать соли, взаимодействуя с различными неорганическими и органическими кислотами и основаниями. Такими солями являются соли, полученные с помощью органических и неорганических кислот, например, HCl, HBr, H2SO4, Н3PO4, трифторуксусной кислоты, уксусной кислоты, муравьиной кислоты, метансульфоновой кислоты, толуолульфоновой кислоты, малеиновой кислоты, фумаровой кислоты и камфорсульфоновой кислоты. Солями, полученными с помощью оснований, являются аммонийные соли, соли щелочных металлов, например соли натрия и калия, и соли щелочноземельных металлов, например соли кальция и магния. Предпочтительными являются ацетатные, гидрохлоридные и трифторацетатные соли. Соли могут быть получены стандартными способами путем взаимодействия свободной кислоты или основания, в которых продукт взаимодействует с 1 или более эквивалентов подходящих основания или кислоты в растворителе или среде, в которой соль будет нерастворимой, или в растворителе, таком как вода, который затем удаляют в вакууме, или замораживанием-высушиванием, или путем замены ионов у уже существующей соли на другой ион на подходящей ион-обменной смоле.
Приготовление композиций и введение
Препараты (композиции) и дозированные формы модифицированного экзендина или агониста экзендина по настоящему изобретению применимы с точки зрения их экзендино-подобных действий и могут быть стандартным образом приготовлены в форме препаратов, пригодных для парентерального (включая внутривенное, внутримышечное и подкожное) введения. Также в данной заявке описываются препараты и дозированные формы, применимые для альтернативных путей доставки, включая пероральное, назальное, трансбуккальное, подъязычное и легочное введение.
Осуществимость альтернативных путей доставки экзендина-4 была испытана путем измерения уровней экзендина-4 в циркулирующей крови параллельно с наблюдением за биологическим ответом, таким как снижение уровня плазматической глюкозы после введения у животных с диабетом. Было исследовано проникновение экзендина-4 через несколько поверхностей - в дыхательном тракте (пути через носовую полость, трахею и легкие) и пищеварительной системе (подъязычный путь, желудочный и интрадуоденальный путь). Биологическое действие и появление экзендина-4 в крови наблюдали при каждом способе введения через дыхательный тракт и при введении пептида в пищеварительный тракт подъязычно и через желудок. Были описаны все пути введения внутритрахейное введение, назальное введение, введение через кишечник и введение под язык.
В некоторых случаях подходящим подходом является представление модифицированного экзендина или агониста экзендина и другого антиглюкагонового средства, такого как амилин или агонист амилина, в общей композиции или растворе для совместного введения. В других случаях большее преимущество может иметь введение другого антиглюкагонового средства отдельно от экзендина, агониста экзендина и модифицированного экзендина или агониста экзендина. Еще в некоторых случаях пользу может приносить представление экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина либо в общей композиции, либо отдельно от других средств снижения уровня глюкагона, таких как амилин. Подходящая схема введения наилучшим образом может быть определена практикующим врачом для каждого больного индивидуально. Подходящие фармацевтически приемлемые носители и их использование в приготовлении препаратов описаны в стандартных фармацевтических курсах, например "Remington's Pharmaceuticals Sciences", E.W.Martin; также см. Y.J.Wang & M.A.Hanson, "Parenteral Formulations of Proteins and Peptides: Stability and Stabilizers", Journal of Parenteral Science and Technology, Technical Report No. 10, suppl. 42:2S (1988).
Соединения, применимые в настоящем изобретении, могут быть представлены в виде парентеральных композиций для инъекции или инфузии. Они могут быть, например, суспендированы в инертном масле, например растительном масле, таком как кунжутовое, арахисовое, оливковое масло, или другом подходящем носителе. Предпочтительно они могут быть суспендированы в водном носителе, например в изотоническом буферном растворе при рН примерно от 5,6 до 7,4. Данные композиции могут быть стерилизованы с помощью стандартных методов стерилизации или могут быть стерилизованы фильтрованием. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как рН-контролирующие буферные агенты. Применимыми буферами являются, например, натрийацетатные/уксуснокислотные буферы. Форма "депо" с медленной секрецией препарата может быть использована таким образом, чтобы терапевтически эффективные количества препарата попадали в кровяное русло в течение многих часов или дней после трансдермальной инъекции или доставки.
Желательная изотоничность может быть достигнута с использованием хлорида натрия или других фармацевтически приемлемых агентов, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль, полиспирты (такие как маннит и сорбит) или иные неорганические или органические растворенные вещества. Предпочтительным является хлорид натрия, в частности, для буферов, содержащих ионы натрия.
Заявляемые соединения также могут быть включены в препарат в виде фармацевтически приемлемых солей (например, кислотодобавочных солей) и/или их комплексов. Фармацевтически приемлемыми солями являются соли, нетоксичные при тех концентрациях, при которых их вводят. Получение таких солей может облегчить фармакологическое применение за счет изменения физико-химических свойств композиции без утраты композицией ожидаемого от нее физиологического действия. Примерами используемых изменений физических свойств являются снижение точки плавления для облегчения введения через слизистые и повышение растворимости для облегчения введения более высоких концентраций лекарственного средства.
Фармацевтически приемлемыми солями являются кислото-добавочные соли, такие как те соли, которые включают сульфат, гидрохлорид, фосфат, сульфамат, ацетат, цитрат, лактат, тартрат, метансульфонат, этансульфонат, бензолсульфонат, -толуолсульфонат, циклогексилсульфамат и хинат. Фармацевтически приемлемые соли могут быть получены с помощью таких кислот, как соляная кислота, серная кислота, фосфорная кислота, сульфаминовая кислота, уксусная кислота, лимонная кислота, молочная кислота, тартаровая кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, -толуолсульфоновая кислота, циклогексилсульфаминовая кислота и хинная кислота. Такие соли могут быть получены, например, путем взаимодействия свободной кислоты или основания, в которых продукт взаимодействует с 1 или более эквивалентов подходящих основания или кислоты в растворителе или среде, в которой соль будет нерастворимой, или в растворителе, таком как вода, который затем удаляют в вакууме, или замораживанием-высушиванием, или путем замены ионов у уже существующей соли на другой ион на подходящей ион-обменной смоле.
Носители или наполнители также могут быть использованы для облегчения введения соединения. Примерами носителей и наполнителей являются карбонат кальция, фосфат кальция, различные сахара, такие как лактоза, глюкоза или сахароза, или сорта крахмала, производных целлюлозы, желатина, растительных масел, полиэтиленгликолей и физиологически совместимых растворителей. Композиции или фармацевтическая композиция могут быть введены различными путями, включая внутривенный, внутрибрюшинный, подкожный и внутримышечный, пероральный, локальный пути или через слизистую.
Если желательно, растворы указанных выше композиций могут быть уплотнены с помощью уплотняющего агента, такого как метилцеллюлоза. Они могут быть приготовлены в форме эмульсии, как водно-масляной, так и эмульсии масло в воде. Любой из широкого круга фармацевтически приемлемых эмульгирующих агентов может быть использован, включая, например, акациевый порошок, неионное поверхностно-активное вещество (такое как Твин) или ионное поверхностно-активное вещество (такое как щелочные сульфаты или сульфонаты полиэфирных спиртов, например, Тритон).
Композиции, применимые в настоящем изобретении, приготавливают путем смешивания компонентов в соответствии с общепринятыми процедурами. Например, отобранные соединения могут быть обычным путем смешаны в смесителе или другом стандартном устройстве с получением концентрированной смеси, которую затем можно откорректировать до конечной концентрации и вязкости путем добавления воды или уплотняющего агента и, возможно, буфера для контроля рН или дополнительного растворенного вещества для контроля тоничности.
Для применения врачом соединения должны быть представлены в форме стандартных доз, содержащих некое количество экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина с другим антиглюкагоновым средством или без него. Терапевтически эффективными количествами экзендина, агониста экзендина или модифицированного экзендина или агониста экзендина для использования в контроле глюкагона и состояний, при которых преимущество имеет снижение или регуляция уровней глюкагона, являются те количества, которые желательным образом снижают уровни глюкагона в крови после приема пищи. У больных с диабетом или непереносимостью глюкозы уровни глюкагона в плазме могут быть выше, чем у здоровых людей. У таких пациентов может быть достигнуто имеющее преимущество снижение или "сглаживание" уровней глюкагона в крови после приема пищи. Как будет ясно специалистам в данной области, эффективное количество лекарственного средства будет варьироваться в зависимости от многих факторов, включая возраст и массу тела больного, физическое состояние больного, уровень глюкагона или уровень подавления глюкагона, которого надо достичь, и другие факторы.
Такие фармацевтические композиции применимы в случаях, когда у больного нужно снизить уровень глюкагона, и могут быть использованы также и при других заболеваниях, при которых пользу может принести снижение уровня или подавление глюкагона.
Эффективная суточная антиглюкагоновая доза соединений обычно будет находиться в диапазоне от 0,01 или 0,03 до примерно 5 мг/день, предпочтительно от примерно 0,01 или 0,5 до 2 мг/день или более предпочтительно от примерно 0,01 или 0,1 до 1 мг/день для больного массой 70 кг, при введении единой дозой или раздельными дозами. Точную дозу, которую необходимо ввести, определяет лечащий врач, и она зависит от того, попадает ли конкретное соединение в указанные выше диапазоны, а также от возраста, массы тела и состояния пациента. Введение должно начинаться при появлении первых симптомов или спустя короткое время после постановки диагноза, например, сахарного диабета, проявляющегося в повышенном уровне глюкагона. Введение может быть осуществлено с помощью инъекции, предпочтительно подкожной или внутримышечной. Перорально активные соединения можно вводить перорально, однако дозировки должны быть повышены в 5-10 раз.
В целом, при лечении и профилактике повышенных, несоответствующих или нежелательных уровней глюкагона в крови после приема пищи соединения по настоящему изобретению могут быть введены больным, нуждающимся в таком лечении, в диапазонах доз, сходных с теми, которые указаны выше, однако соединения вводят более часто, например один, два или три раза в день. Конкретно предпочтительными являются препараты экзендина и агониста экзендина, а также дозировки и пути их введения, описанные в принадлежащей тем же заявителям предварительной патентной заявке США 60/116380, озаглавленной "Препараты новых агонистов экзендина и способы их введения", поданной 14 января 1999 г. (и в соответствующей заявке РСТ, заявляющей ее приоритет, поданной 14 января 2000 г., серийный № пока не присвоен)) и в предварительной патентной заявке США 60/(пока не присвоен), озаглавленной "Применение экзендинов и их агонистов для модуляции уровней триглицеридов и лечения дислипидемии", поданной 14 января 1999 г., приоритет которой заявляет настоящая заявка, и содержание этой заявки включено здесь для сведения в виде библиографической ссылки в полном ее объеме, если она полностью здесь воспроизведена.
Оптимальный препарат и путь введения больному соединений по настоящей заявке зависит от факторов, известных в данной области техники, таких как конкретное заболевание или расстройство, желательный эффект и тип больного. Хотя соединения обычно будут использоваться для лечения людей, также их можно использовать для лечения сходных или идентичных заболеваний у других позвоночных животных, таких как другие виды приматов, сельскохозяйственные животные, такие как свинья, крупный рогатый скот и домашняя птица, а также спортивные животные и домашние животные, такие как лошади, кошки и собаки.
Для помощи в понимании настоящего изобретения нижеследующие примеры включены для того, чтобы описать результаты серии экспериментов. Эксперименты, касающиеся настоящего изобретения, понятно, не должны рассматриваться как в чем-либо ограничивающие изобретение, и такие варианты настоящего изобретения, уже известные или разработанные позже, которые будут охватываться кругозором специалистов в данной области техники, рассматриваются как попадающие в объем настоящего изобретения в соответствии с описанным выше и заявленным далее в формуле изобретения.
Пример 1
Получение экзендина-3
His Ser Asp Gly Thr Phe Thr Ser Asp Leu Ser Lys Gin Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NHz [SEQ ID NO I].
Указанный выше амидированный пептид был собран на 4-(2'-4'-диметоксифенил)-Fmoc-аминометилфеноксиацетамиднорлейцин-МВНА-полимере (Novabiochem; 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems Inc.). В целом, одиночные циклы реакции сочетания использовали в ходе синтеза, применяя химию Fast Moc (активация с помощью HBTU). Снятие защиты (удаление группы Fmoc) с растущей пептидной цепи проводили с помощью пиперидина. Окончательное снятие защиты с завершенного пептида на полимере проводили с использованием смеси триэилсилана (0,2 мл), этандитиола (0,2 мл), анизола (0,2 мл), воды (0,2 мл) и трифторуксусной кислоты (15 мл) в соответствии со стандартными методами (Introduction to Cleavage Techniques, Applied Biosystems Inc.). Пептид преципитировали в эфире/воде (50 мл) и центрифугировали. Преципитат разводили в ледяной уксусной кислоте и лиофилизовали. Лиофилизованный пептид растворяли в воде. Начальная чистота составила примерно 75%.
На стадиях очистки и анализа использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN).
Раствор, содержащий пептид, загружали на препаративную колонку С-18 и очищали (10%-40% растворителя В в растворителе А в течение 40 минут). Чистоту фракций определяли в тех же условиях с использованием аналитической колонки С-18. Чистые фракции объединяли с получением в конце указанного выше пептида. Аналитическая ОФ-ВЭЖХ (градиент 30-60% растворителя В в растворителе А в течение 30 минут) лиофилизованного пептида дала пептидный продукт, выявленное время удерживания которого составило 19,2 минуты.
Пример 2
Получение экзендина-4
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gin Met Glu Glu Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser Ser Gly Ala Pro Pro Pro Ser-NHz [SEQ ID NO 2].
Указанный выше амидированный пептид был собран на 4-(2'-4'-диметоксифенил)-Fmoc-аминометилфеноксиацетамиднорлейцин-МВНА-полимере (Novabiochem; 0,55 ммоль/г) с использованием Fmoc-защищенных аминокислот (Applied Biosystems Inc.), отделен от полимера, освобожден от защиты и очищен таким же путем, что и экзендин-3, в соответствии с описанным в примере 1. В анализе использовали растворитель А (0,1% ТФУ в воде) и растворитель В (0,1% ТФУ в ACN). Аналитическая ОФ-ВЭЖХ (градиент 36-46% растворителя В в растворителе А в течение 30 минут) лиофилизованного пептида дала пептидный продукт, выявленное время удерживания которого составило 14,9 минуты. Масс-спектрометрия с электрораспылением (М): рассчитано 4186,6; найдено - 4186,0-4186,8 (четыре пробы).
Пример 3
Почечный клиренс
Почки могут играть ключевую роль в выведении некоторых молекул (лекарственных средств, пептидов, белков). Для некоторых молекул такой процесс начинается тогда, когда почки фильтруют кровь в клубочках с получением описываемого далее ультрафильтрата. Клубочковый фильтр работает не только на основе молекулярной массы, но также действует как отрицательно заряженный селективный барьер, способствующий сохранению анионных соединений. Свободная фракция молекул в плазме (не связанная с белками), имеющих молекулярную массу менее 5 кД и эффективный радиус менее 15  , легко отфильтровываются. В случае молекул с большей молекулярной массой их фильтрация происходит на более ограничивающей основе, где учитываются молекулярная масса, структура и общий заряд. Точка отсечки для клубочковой фильтрации проходит между альбумином (67 кД), который сохраняется, и гемоглобином (68 кД), который отфильтровывается. Альбумин, эффективный радиус которого составляет примерно 36
, легко отфильтровываются. В случае молекул с большей молекулярной массой их фильтрация происходит на более ограничивающей основе, где учитываются молекулярная масса, структура и общий заряд. Точка отсечки для клубочковой фильтрации проходит между альбумином (67 кД), который сохраняется, и гемоглобином (68 кД), который отфильтровывается. Альбумин, эффективный радиус которого составляет примерно 36  , отфильтровывается клубочком менее чем на 1%.
, отфильтровывается клубочком менее чем на 1%.
Попав в клубочек, молекула продвигается в проксимальный каналец, где она либо реадсорбируется, либо проходит в петлю Хенле к дистальному канальцу, откуда прямой почечный проток направляет фильтрат в мочевой пузырь. Отфильтрованные белки и пептиды обычно расщепляются ферментами щеточной каемки в проксимальном канальце, откуда они эффективно извлекаются с участием натрий/аминопереносчиков ("насосы-уборщики"). С другой стороны, полярные, ионизованные молекулы и молекулы с большой молекулярной массой не реадсорбируются. С помощью данного процесса метаболизирующие ферменты коркового вещества почки (проксимальные канальцы) также могут разрушать молекулу на более полярные молекулы, тем самым повышая вероятность ее выделения с мочой. Многие пептидные гормоны (например, амилин, кальцитонины) разрушаются, проходя через почечную циркуляцию, предположительно за счет доставляемых в плазму сосудистых эктоферментов, причем независимо от процесса клубочковой фильтрации. В данных примерах темп пептидного клиренса из плазмы сходен с темпом прохождения плазмы через почки, который втрое выше, чем темп клубочковой фильтрации.
Исследования, проведенные с целью идентификации циркулирующих в плазме метаболитов экзендина-4, дали очень мало свидетельств протеолитического расщепления; после крупномасштабного внутривенного введения животным ВЭЖХ-анализ плазмы показал присутствие только интактного экзендина и появление незначительных "дочерних" пиков, указывающих на образование продуктов разрушения. Это контрастирует с другими исследованными пептидами (например, амилином и GLP-1), у которых исчезновение "родительского" ВЭЖХ-пика было ассоциировано с появлением "дочерних" ВЭЖХ-пиков, впоследствии идентифицированных как субпептидные продукты разрушения. Отсутствие в плазме продуктов разрушения экзендина указывает на незначительный протеолиз по любому сайту, включая почечную циркуляцию, или на его полное отсутствие. Это означает, что любой клиренс с участием почек происходит непротеолитическим путем, а именно за счет фильтрации или активного выведения (как это происходит с парааминогиппуратом).
Исходные измерения клиренса экзендина у человека (120-130 мл/мин), обезьян (примерно 9 мл/мин) и крыс (3,2-4,4 мл/мин) соответствуют опубликованным величинам темпа клубочковой фильтрации у этих видов. Для анализа того, может ли почечная фильтрация являться ключевым путем выведения экзендина, были проведены исследования на самцах крыс с удаленными почками, голодавших в течение ночи, при постоянном уровне инфузии экзендина. Постоянный уровень экзендина-4 в плазме резко возрастал у нефрэктомизованных крыс по сравнению с крысами, сохранявшими нормальные почки. Полученные данные показали, что почки ответственны по крайней мере за 80% от общего уровня клиренса экзендина-4 (см. фиг.5 и 6). Темпы клиренса экзендина у интактных крыс опять-таки были сходными со скоростью клубочковой фильтрации, ожидаемой у таких крыс (4,2 мл/мин). После обобщения эти результаты показывают, что в организме в целом метаболизм экзендина-4 крайне ограничен и что основная часть его клиренса происходит путем почечной фильтрации (но не за счет протеолиза внутри сосудов почек). Низкое количество иммунореактивного полноразмерного экзендина в моче согласуется с тем, что он расщепляется ферментами щеточной каемки в проксимальном канальце после отфильтровывания.
Пример 4
Экзендин-4 снижает секрецию глюкагона при гипергликемической фиксации у крыс Zucker с диабетом и ожирением.
Абсолютная или относительная гиперглюкагонемия часто является признаком, например, сахарного диабета 1-го и 2-го типов и подавление избыточной секреции глюкагона при этих и других состояниях, описанных или упоминаемых здесь, потенциально может принести пользу в лечении с использованием глюкагоностатических средств. В данном примере влияние экзендина-4 на секрецию глюкагона анализировали у самцов крыс Zucher с диабетом и с ожирением (ZDF), находящихся под наркозом. С применением протокола фиксации гиперинсулинемии и гипергликемии поддерживали постоянными факторы, имеющие тенденцию влиять на секрецию глюкагона. Глюкагон в плазме фиксировали на уровне примерно 34 мМ за 60 минут перед началом внутривенных введений физиологического раствора (n=7) или экзендина-4 (0,21 мкг+2,1 мкг/мл/час: n=7). Концентрации плазматического глюкагона, замеренные перед этими введениями, были сходными в обеих группах (306±30 пкМ против 252±32 пкМ соответственно: различие недостоверно).
Средняя концентрация глюкагона в плазме у крыс, которым вводили глюкагон, была примерно вполовину ниже, чем у крыс, которым вводили физиологический раствор, в последние 60 минут фиксации (165±18 пкМ против 298±26 пкМ соответственно: Р<0,002). Протокол гипергликемической фиксации также позволил определить чувствительность к инсулину. Темп глюкозного введения в ходе фиксации увеличивался на 111±7% у крыс, которым вводили экзендин-4, по сравнению с контрольными особями (Р<0,001). Другими словами, экзендин-4 проявлял глюкагоностатический эффект у крыс ZDF в анализе с гипергликемической фиксацией, и этот эффект будет приносить пользу при лечении диабета у людей.
Пример 5
Метаболические действия экзендина-4 на секрецию глюкагона у людей с диабетом 2-го типа
В данном примере безопасность, переносимость и эффективность синтетического экзендина-4 оценивали в группе из 8 мужчин-пациентов с диабетом 2-го типа (без инсулиновой терапии), которым прервали другое лечение от диабета как минимум на 7 дней. Каждый пациент получал подкожные (п/к) инъекции плацебо (РВО) и 0,1, 0,2 и 0,3 мкг/кг экзендина-4 с 48 часовом интервалом в перекрестной схеме плацебо-контролируемого, простого слепого эксперимента с возрастанием дозы. Пять пациентов также получили дозу 0,4 мкг/кг. Концентрации глюкозы, инсулина и глюкагона в плазме оценивали при голодании и в ответ на прием Sustacal® (7 ккал/кг), вводимого одновременно с инъекцией экзендина-4/РВО. Опорожнение желудка оценивали путем измерения концентраций ацетаминофена в сыворотке после перорального введения 20 мг/кг жидкого ацетаминофена, вводимого вместе с Sustacal®. He было обнаружено каких-либо проблем с безопасностью, на что указывали данные регистрируемых негативных проявлений, ЭКГ и лабораторного контроля безопасности. Дозы 0,3 и 0,4 мкг/кг вызвали зависимое от дозы усиление тошноты, а при наивысшей дозе отмечена рвота.
Концентрации глюкозы в плазме снижались при всех дозах экзендина-4 по сравнению с РВО, хотя концентрации инсулина на статистически значимом уровне не различались. Среднее ± s.e. изменение содержания плазматической глюкозы АИС по сравнению с базовым уровнем через 8 часов составило +391±187, -263±108, -247±64, -336±139 и -328±70 мг·час/дл соответственно для доз РВО 0,1, 0,2, 0,3 и 0,4 мкг/кг. Изменения количества плазматического глюкагона через 3 часа составили +128,0±19,2, -5,6±10,5, -29,4±18,6, -40,5±24,5 и +6,9±38,6 пкг·час/мл соответственно. Скорость опорожнения желудка снизилась при всех дозах, и средний уровень поглощенного за 6 часов ацетаминофена снизился на 51%, 50%, 57 и 79% по сравнению с РВО для доз 0,1, 0,2, 0,3 и 0,4 мкг/кг соответственно. В целом, инъекция п/к экзендина-4 пациентам показала отсутствие проблем с безопасностью, была переносимой при дозах 0,3 мкг/кг, снижала содержание глюкозы и глюкагона в плазме и снижала скорость опорожнения желудка. Данные наблюдения подтверждают использование экзендина для лечения состояний, при которых полезным является снижение уровней глюкагона и/или подавление глюкагона, включая, но тем самым не ограничиваясь, сахарный диабет 1-го и 2-го типов.
Пример 6
ПЭГ-модифицированный экзендин-4
В случае с экзендином-4 - состоящим из 39 аминокислот пептидом, имеющим молекулярную массу 4187, модификации, которые увеличивают его размер и/или повышают его анионную природу, должны снизить его способность отфильтровываться почками. Поскольку клиренс экзендина-4 в основном происходит в почках, это будет эффективно повышать время его полужизни. Другие свойства "ПЭГирования" (повышенное время полужизни в плазме благодаря уклонению от таких механизмов почечного и/или клеточного клиренса, которые могут существовать; сниженная иммуногенность и антигенность; повышенная растворимость; устойчивость к протеолитическому расщеплению; сниженная токсичность (избегание пикового потенциала дозы); улучшенная термо- и механическая стабильность; улучшенная проницаемость через слизистые или эпителиальные клеточные слои и избирательный контроль над специфической биологической функцией) также будут давать потенциальное преимущество экзендину-4 и агонистам экзендина.
В частности, поскольку авторами были выявлены многочисленные фармакологические проявления (по-видимому, вызванные существованием множественных рецепторных субтипов), различные спектры биологических активностей экзендина-4 могут быть выбраны путем размещения ПЭГ в соответствующих положениях. Утрата или изменение биологической активности были описаны для "ПЭГированных" белков, которые могут быть обусловлены присутствием самой цепочки ПЭГ, конкретным сайтом, занятым цепочкой ПЭГ, или условиями сочетания, обладающими негативным влиянием на белок.
Первичными факторами в случае ПЭГ-модификации с точки зрения почечной фильтрации экзендина и агонистов экзендина являются размер и заряд. Будучи немодифицированным, экзендин-4 имеет молекулярную массу примерно 4,2 кД и является по природе анионным при величине общего заряда приблизительно -2 при физиологическом рН. Один, два или три ПЭГ-компонента могут быть ковалентным образом присоединены к экзендину-4 или аналогу экзендина-4, например, при том, что предпочтительным является наличие одного ПЭГ-компонента. Размер ПЭГ может варьироваться по молекулярной массе от 500 до 20000, предпочтительно от 5000 до 12000.
Во многих способах ковалентного присоединения ПЭГ используют -аминогруппу лизина. В составе экзендина-4 имеются два остатка лизина, которые можно модифицировать присоединением ПЭГ. Аланиновое сканирование АС3177 (Leu14, Phe25 (1-28)-экзендин-4) - укороченного аналога экзендина-4 - указало на положения, которые чувствительны к замене на аланин. Два остатка лизина в положениях 12 и 27 в слабой степени подавляются такой заменой: это подтверждает, что утрата специфичной для лизина R-группы боковой цепи (метиленовая цепь плюс -аминогруппа) допустима. Что касается полноразмерного пептида - экзендина-4, то для присоединения ПЭГ подходят два положения лизина (см. соединения 1 и 2). Кроме того, в зависимости от химии, применяемой для присоединения ПЭГ, -аминогруппы по данным положениям могут быть замаскированы, что приведет к усилению анионной природы пептида.
(201) HGEGTFTSDLSK(PEG)QMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(202) HGEGTFTSDLSKQMEEEAVRLFIEWLK(PEG)NGGPSSGAPPPS-NH2
Основываясь на результатах аланинового сканирования, другие вероятные положения, которые можно модифицировать вставкой Lys-ПЭГ или эквивалента, например, таковы:
(203) HK(PEG)EGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(204) HGEGK(PEG)FTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(205) HGEGTFTKtPEODLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(206) HGEGTFTSDK(PEG) SKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(207) HGEGTFTSDLK(PEG)KQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(208) HGEGTFTSDLSKK (PEG) MEEEAVRLFIEWLKNGGPSSGAPPPS-NH2
(209)*HGEGTFTSDLSKQMEK(PEG)EAVRLFIEWLKNGGPSSGAPPPS-NH2
(210)*HGEGTFTSDLSKQMEEK(PEG)AVRLFIEWLKNGGPSSGAPPPS-NH2
(211) HGEGTFTSDLSKQMEEEAK(PEG)RLFIEWLKNGGPSSGAPPPS-NH2
(212) HGEGTFTSDLSKQMEEEAVRK(PEG)FIEWLKNGGPSSGAPPPS-NH2
(213)*HGEGTFTSDLSKQMEEEAVRLFIK(PEG)WLRNGGPSSGAPPPS-NH2
(214) HGEGTFTSDLSKQMEEEAVRLFIEK(PEG)LKNGGPSSGAPPPS-NH2
(215) HGEGTFTSDLSKQMEEEAVRLFIEWLKK(PEG)GGPSSGAPPPS-NH2
Три положения, отмеченные выше *, в норме включающие глутаминовую кислоту, которые указаны для модификации К(ПЭГ), также могут быть модифицированы путем присоединения к карбоксильной группе боковой цепи глутаминовой кислоты Е(ПЭГ).
Другой аналог, к которому может быть добавлен Lys-ПЭГ, приходится на предполагаемый поворот GlyGly:
(216) HGEGTFTSDLSKQMEEEAVRLFIEWLKNK(PEG)GPSSGAPPPS-NH2
(217) HGEGTFTSDLSKQMEEEAVRLFIEWLKNGK(PEG)PSSGAPPPS-NH2
Положения 29-39 экзендина-4 могут не являться ключевыми для активности по снижению уровня глюкозы, на что указывают параметры АС 3177, имеющего практически эквипотентную активность по сравнению с экзендином-4, и любое из них, по отдельности или в сочетании, может быть замещено на К(ПЭГ) или эквивалент.
Для специалиста в данной области техники должно быть очевидно, что настоящее изобретение полностью адаптировано к достижению его объектов и получению преимуществ, описанных выше, а также того, что им присуще. Молекулярные комплексы и способы, процедуры, обработки, молекулы, конкретные соединения, описанные в данном тексте, в данном случае представляют предпочтительные варианты, служат примерами и не призваны служить ограничениями объема настоящего изобретения. Изменения в нем и другие пути применения, которые будут приходить в голову специалисту в данной области техники, которые соответствуют сущности изобретения, определяются как входящие в объем настоящего изобретения.
Специалисту в данной области техники должно быть понятно, что различные замены и модификации могут быть внесены в заявленное здесь изобретение без отклонения от объема и сущности изобретения.
Все патенты и публикации, упоминаемые в заявке, определяются на том уровне, который понятен специалистам в данной области техники, к которым обращено настоящее изобретение. Все патенты и публикации включены здесь в качестве ссылок в той же степени, что и каждая отдельная публикация индивидуально и конкретно определена, как включаемая для сведения в виде библиографической ссылки.
Изобретение, иллюстративно описанное здесь, соответствующим образом может быть реализовано на практике в отсутствие любого элемента или элементов, ограничения или ограничений, которые конкретным образом не оговорены здесь. Так, например, в каждом случае здесь любой из терминов "включающий", "по существу включающий" и "состоящий из" может быть заменен на любой из двух других терминов. Термины и выражения, которые были использованы здесь, использовались с точки зрения описания, а не ограничения, и не было намерений использовать такие термины и выражения для исключения каких-либо эквивалентов свойств, показанных и описанных здесь, или их частей, но при этом понятно, что различные модификации возможны в пределах объема заявляемого изобретения. Таким образом должно быть понятно, что, хотя настоящее изобретение было конкретным образом описано в виде предпочтительных вариантов и зависящих от усмотрения свойств, специалист в данной области техники может прибегнуть к модификации и изменению описанных здесь концепций и такие модификации и изменения рассматриваются как входящие в объем настоящего изобретения в соответствии с определенным в прилагаемой формуле изобретения.
Кроме того, когда свойства или аспекты настоящего изобретения описываются в терминах групп Маркуша, для специалиста в данной области техники должно быть понятно, что изобретение тем самым также описывается в терминах любого индивидуального члена или подгруппы членов из группы Маркуша. Например, если "X" описан как выбранный из группы, которая включает бром, хлор и иод, то полностью учитывается заявление того, что Х представляет бром, и заявление того, что Х представляет бром и хлор.
В данной заявке изобретение было описано в широком и общем смысле. Каждый из более узких объектов и подклассов, входящих в состав общего описания, также образует часть настоящего изобретения. Это включает общее описание изобретения при условии или негативном признаке, удаляющими любой материал из заявляемого класса объектов, независимо от того, упоминался ли конкретный удаляемый материал в данном тексте или нет.
Другие варианты попадают в объем нижеследующей формулы изобретения.




























































































































































































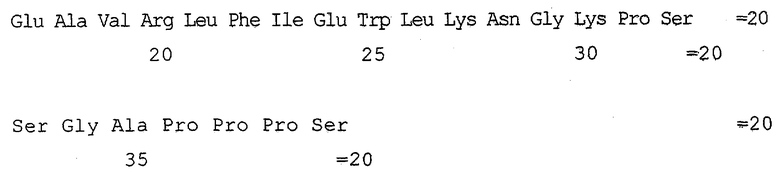
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ДИАБЕТА И СНИЖЕНИЯ МАССЫ ТЕЛА | 2006 |
|
RU2421237C2 |
| СПОСОБЫ ДОСТАВКИ НЕЙРОПРОТЕКТИВНОГО ПОЛИПЕПТИДА В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2017 |
|
RU2790566C2 |
| КОМПОЗИЦИЯ И МИКРОСФЕРА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ ЭКЗЕНДИНА И СПОСОБ ПОЛУЧЕНИЯ МИКРОСФЕРЫ | 2008 |
|
RU2463040C2 |
| НОВЫЕ КОМПОЗИЦИИ АГОНИСТОВ ЭКСЕНДИНА И СПОСОБЫ ИХ ВВЕДЕНИЯ | 2000 |
|
RU2242244C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2004 |
|
RU2543350C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2004 |
|
RU2353383C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2014 |
|
RU2763796C2 |
| Соединения и способы для подавления транспорта фосфатов | 2014 |
|
RU2771808C2 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| Аналоги инсулина с пониженной аффинностью к рецептору инсулина и их применение | 2017 |
|
RU2764197C1 |


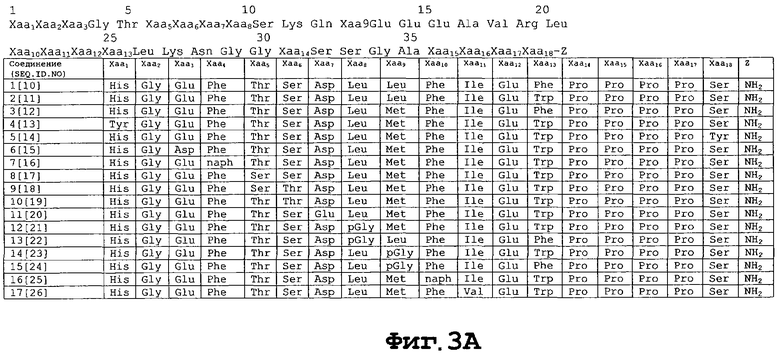
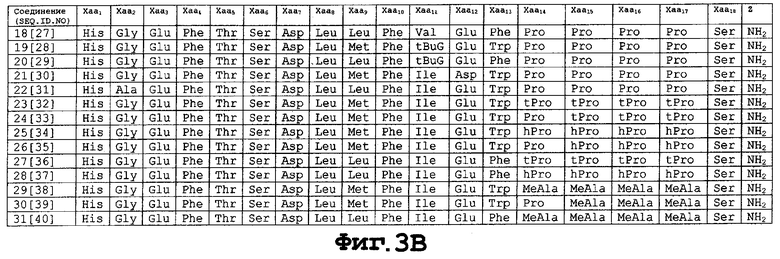




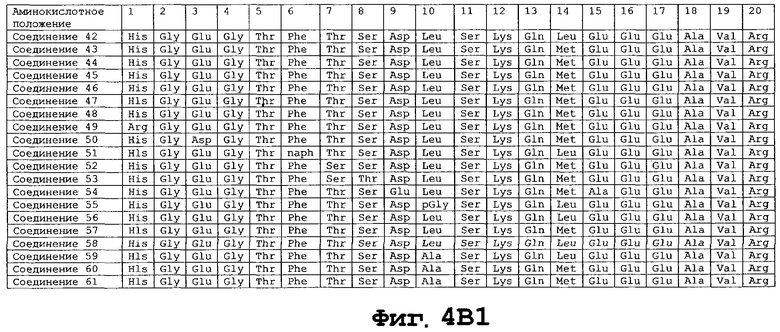




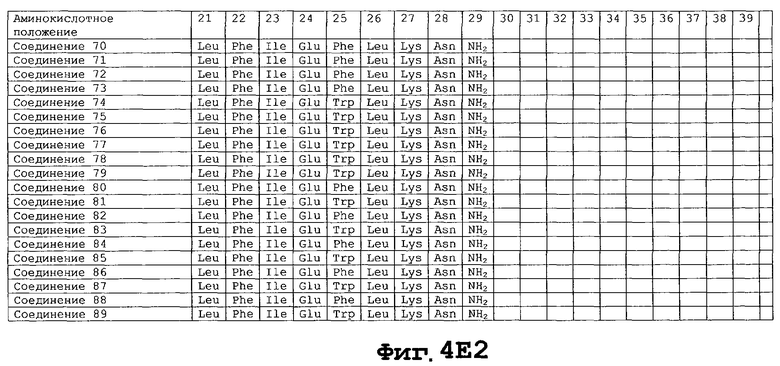


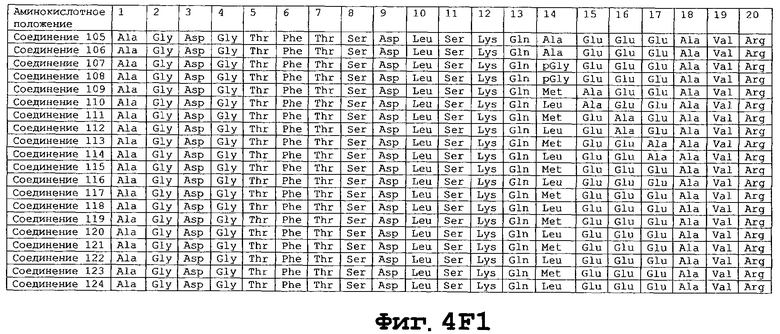

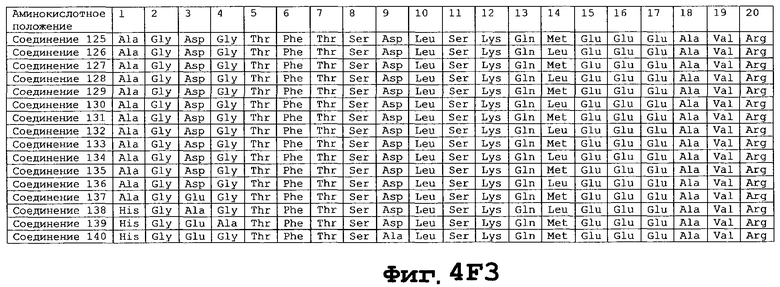
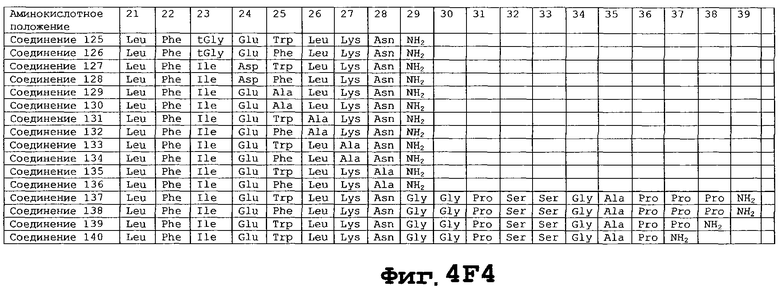
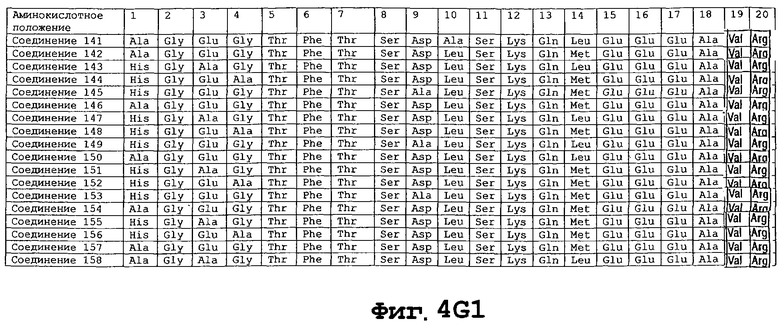




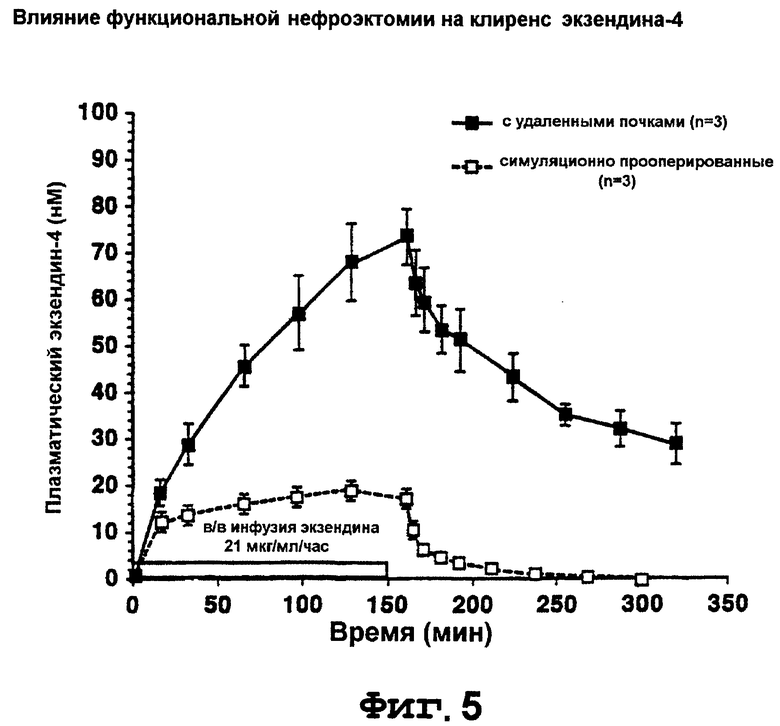
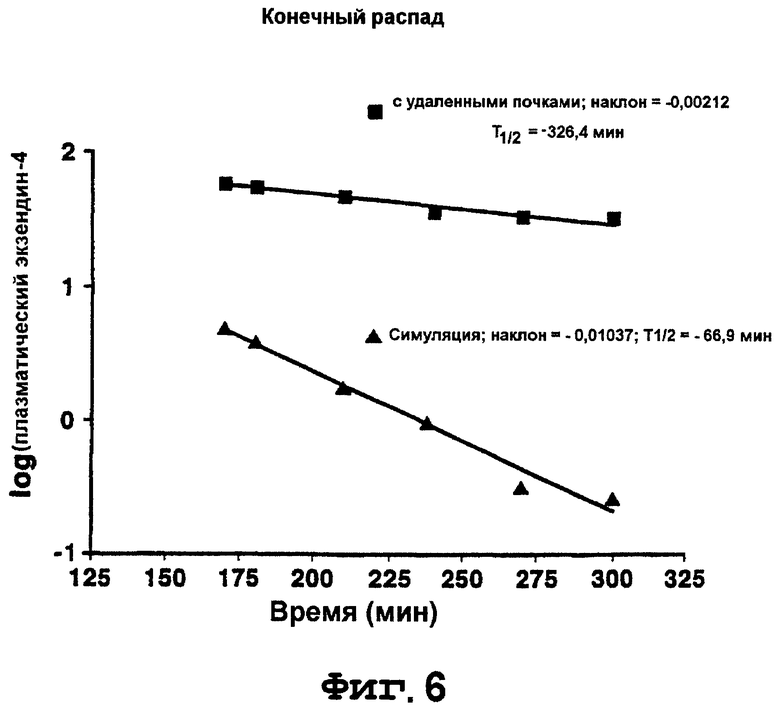
Изобретение относится к медицине, в частности к фармацевтическому соединению для использования в получении лекарственного средства для снижения уровня глюкагона в плазме у пациента, выбранного из группы, состоящей из экзендина, аналога экзендина, модифицированного экзендина и модифицированного аналога экзендина, где указанное соединение включает, по крайней мере, 31 встречающийся в природе или модифицированный аминокислотный остаток. Изобретение обеспечивает снижение уровней глюкагона и/или подавление глюкагона как при диабете 1-го типа, так и при диабете 2-го типа. 10 н. и 5 з.п. ф-лы, 27 ил.
Xaa1 Xaa2 Xaa3 Gly Xaa5 Xaa6 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Xaa27 Xaa28-Z1,
где Xaa1 представляет His, Arg или Tyr;
Xaa2 представляет Ser, Gly, Ala или Thr;
Xaa3 представляет Asp или Glu;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Ala, Phe, Tyr или нафтилаланин;
Xaa7 представляет Thr или Ser;
Хаа8 представляет Ala, Ser или Thr;
Xaa9 представляет Asp или Glu;
Xaa10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Ala, Phe, Tyr или нафтилаланин;
Xaa23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp, Phe, Tyr или нафтилаланин;
Xaa26 представляет Ala или Leu;
Xaa27 представляет Ala или Lys;
Xaa28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2, или
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2,
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо друг от друга представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa5, Xaa6, Xaa8, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala.
Xaa1 Xaa2 Xaa3 Xaa4 Xaa5 Xaa6 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Xaa27 Xaa28-Z1,
где Xaa1 представляет His, Arg, Tyr, Ala, Norval, Val или Norleu;
Xaa2 представляет Ser, Gly, Ala или Thr;
Xaa3 представляет Ala, Asp или Glu;
Xaa4 представляет Ala, Norval, Val, Norleu или Gly;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Phe, Tyr или нафтилаланин;
Xaa7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Xaa9 представляет Ala, Norval, Val, Norleu, Asp или Glu;
Xaa10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Phe, Tyr или нафтилаланин;
Xaa23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp, Phe, Tyr или нафтилаланин;
Xaa26 представляет Ala или Leu;
Xaa27 представляет Ala или Lys;
Xaa28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2; или
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38 Ser-Z2,
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо друг от друга представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa4, Xaa5, Xaa6, Xaa8, Xaa9, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala; и также при условии, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере один из Xaa3, Xaa4 и Xaa9 представляет Ala.
Xaa1 Xaa2 Xaa3 Gly Xaa5 Xaa6 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Xaa27 Xaa28-Z1,
где Xaa1 представляет His или Arg;
Xaa2 представляет Gly или Ala;
Xaa3 представляет Asp или Glu;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Ala, Phe или нафтилаланин;
Xaa7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Xaa9 представляет Asp или Glu;
Xaa10 представляет Ala, Leu или пентилглицин;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu или пентилглицин;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Phe или нафтилаланин;
Xaa23 представляет Ile, Val или трет-бутилглицин;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp или Phe;
Xaa26 представляет Ala или Leu;
Xaa27 представляет Ala или Lys;
Xaa28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2, или
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2,
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо друг от друга выбирают из группы, которая включает Pro, гомопролин, тиопролин или N-метилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa5, Xaa6, Xaa8, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala;
и их фармацевтически приемлемые соли; и характеризуется тем, что указанное использование является использованием для получения лекарственного средства для снижения уровня глюкагона в плазме у субъекта.
Xaa1 Xaa2 Xaaз Xaa4 Xaa5 Xaa6 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Xaa27 Xaa28-Z1,
где Xaa1 представляет His или Ala;
Xaa2 представляет Gly или Ala;
Xaaз представляет Ala, Asp или Glu;
Xaa4 представляет Ala или Gly;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Phe или нафтилаланин;
Xaa7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Xaa9 представляет Ala, Asp или Glu;
Xaa10 представляет Ala, Leu или пентилглицин;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Met или пентилглицин;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala или Leu;
Xaa22 представляет Phe или нафтилаланин;
Xaa23 представляет Ile, Val или трет-бутилглицин;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp или Phe;
Xaa26 представляет Ala или Leu;
Xaa27 представляет Ala или Lys;
Xaa28 представляет Ala или Asn;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2;
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38 Ser-Z2;
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо представляют Pro, гомопролин, тиопролин или N-метилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa5, Xaa6, Xaa8, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26, Xaa27 и Xaa28 представляют Ala; и при условии, что, если Xaa1 представляет His, Arg или Tyr, то по крайней мере один из Xaa3, Xaa4 и Xaa9 представляет Ala;
и их фармацевтически приемлемые соли.
Xaa1 Xaa2 Xaa3 Gly Xaa5 Xaa5 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Х1-Z1,
где Xaa1 представляет His, Arg или Tyr, или 4-имидазопропионил;
Xaa2 представляет Ser, Gly, Ala или Thr;
Xaa3 представляет Asp или Glu;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Ala, Phe, Tyr или нафтилаланин;
Xaa7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Xaa9 представляет Asp или Glu;
Xaa10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala, Leu или Lys-NHε-R,
где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Xaa22 представляет Phe, Tyr или нафтилаланин;
Xaa23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 представляет Ala, Glu или Asp;
Xaa26 представляет Ala или Leu;
X1 представляет Lys Asn, Asn Lys, Lys-NHε-R Asn, Asn Lys-NHε-R, Lys-NHε-R Ala, Ala Lys-NHε-R,
где R представляет Lys, Arg, C1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Z1 представляет -OH;
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2; или Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2,
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо выбирают из группы, которая включает Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa5, Xaa6, Xaa8, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25 и Xaa26 представляют Ala; и характеризуется тем, что указанное использование является использованием для получения лекарственного средства для снижения уровня глюкагона в плазме у субъекта.
Xaa1 Xaa2 Xaa3 Xaa4 Xaa5 Xaa6 Xaa7 Xaa8 Xaa9 Xaa10 Xaa11 Xaa12 Xaa13 Xaa14 Xaa15 Xaa16 Xaa17 Ala Xaa19 Xaa20 Xaa21 Xaa22 Xaa23 Xaa24 Xaa25 Xaa26 Х1-Z1,
где Xaa1 представляет His, Arg, Tyr, Ala, Norval, Val, Norleu или 4-имидазопропионил;
Xaa2 представляет Ser, Gly, Ala или Thr;
Xaa3 представляет Ala, Asp или Glu;
Xaa4 представляет Ala, Norval, Val, Norleu или Gly;
Xaa5 представляет Ala или Thr;
Xaa6 представляет Phe, Tyr или нафтилаланин;
Xaa7 представляет Thr или Ser;
Xaa8 представляет Ala, Ser или Thr;
Xaa9 представляет Ala, Norval, Val, Norleu, Asp или Glu;
Xaa10 представляет Ala, Leu, Ile, Val, пентилглицин или Met;
Xaa11 представляет Ala или Ser;
Xaa12 представляет Ala или Lys;
Xaa13 представляет Ala или Gln;
Xaa14 представляет Ala, Leu, Ile, пентилглицин, Val или Met;
Xaa15 представляет Ala или Glu;
Xaa16 представляет Ala или Glu;
Xaa17 представляет Ala или Glu;
Xaa19 представляет Ala или Val;
Xaa20 представляет Ala или Arg;
Xaa21 представляет Ala, Leu или Lys-NHε-R,
где R представляет Lys, Arg, С1-10-алканоил с прямой или разветвленной цепью или циклоаллеилалканоил;
Xaa22 представляет Phe, Tyr или нафтилаланин;
Xaa23 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa24 представляет Ala, Glu или Asp;
Xaa25 представляет Ala, Trp, Phe, Tyr или нафтилаланин;
Xaa26 представляет Ala или Leu;
X1 представляет Lys Asn, Asn Lys, Lys-NHε-R Asn, Asn Lys-NHε-R, Lys-NHε-R Ala, Ala Lys-NHε-R,
где R представляет Lys, Arg, С1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Z1 представляет -ОН,
-NH2,
Gly-Z2,
Gly Gly-Z2,
Gly Gly Xaa31-Z2,
Gly Gly Xaa31 Ser-Z2,
Gly Gly Xaa31 Ser Ser-Z2,
Gly Gly Xaa31 Ser Ser Gly-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37-Z2,
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38-Z2,
или
Gly Gly Xaa31 Ser Ser Gly Ala Xaa36 Xaa37 Xaa38 Xaa39-Z2;
где Xaa31, Xaa36, Xaa37 и Xaa38 независимо выбирают из группы, которая включает Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин; и
Z2 представляет -ОН или -NH2;
при условии, что не более чем три из Xaa3, Xaa4, Xaa5, Xaa6, Xaa8, Xaa9, Xaa10, Xaa11, Xaa12, Xaa13, Xaa14, Xaa15, Xaa16, Xaa17, Xaa19, Xaa20, Xaa21, Xaa24, Xaa25, Xaa26 представляют Ala;
и также при условии, что, если Xaa1 представляет His, Arg, Tyr или 4-имидазопропионил, то по крайней мере одна из Xaa3, Xaa4 и Xaa9 представляет Ala; и характеризуется тем, что указанное использование является использованием для получения лекарственного средства для снижения уровня глюкагона в плазме у субъекта.
Xaa1 Xaa2 Xaa3 Gly Thr Xaa4 Xaa5 Xaa6 Xaa7 Xaa8 Ser Lys Gln Xaa9 Glu Glu Glu Ala Val Arg Leu Xaa10 Xaa11 Xaa12 Xaa13 Leu Lys Asn Gly Gly Xaa14 Ser Ser Gly Ala Xaa15 Xaa16 Xaa17 Xaa18-Z,
где Xaa1 представляет His, Arg или Tyr,
Xaa2 представляет Ser, Gly, Ala или Thr;
Xaa3 представляет Asp или Glu;
Xaa4 представляет Phe, Tyr или нафтилаланин;
Xaa5 представляет Thr или Ser;
Xaa6 представляет Ser или Thr;
Xaa7 представляет Asp или Glu;
Xaa8 представляет Leu, Ile, Val, пентилглицин или Met;
Xaa9 представляет Leu, Ile, пентилглицин, Val или Met;
Xaa10 представляет Phe, Tyr или нафтилаланин;
Xaa11 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa12 представляет Glu или Asp;
Xaa13 представляет Trp, Phe, Tyr или нафтилаланин;
Xaa14, Xaa15, Xaa16 и Xaa17 независимо представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин;
Xaa18 представляет Ser, Thr или Tyr; и Z представляет -ОН или -NH2; при условии, что соединение не имеет формулы SEQ ID NO 1 или 2.
Xaa1 Xaa2 Xaa3 Gly Thr Xaa4 Xaa5 Xaa6 Xaa7 Xaa8 Ser Lys Gln Xaa9 Glu Glu Glu Ala Val Arg Leu Xaa10 Xaa11 Xaa12 Xaa13 Leu X1 Gly Gly Xaa14 Ser Ser Gly Ala Xaa15 Xaa16 Xaa17 Xaa18-Z,
где Xaa1 представляет His, Arg, Tyr или 4-имидазопропионил;
Xaa3 представляет Ser, Gly, Ala или Tyr;
Xaa3 представляет Asp или Glu;
Xaa4 представляет Phe, Tyr или нафтилаланин;
Xaa5 представляет Thr или Ser;
Xaa6 представляет Ser или Thr;
Xaa7 представляет Asp или Glu;
Xaa8 представляет Leu, Ile, Val, пентилглицин или Met;
Xaa9 представляет Leu, Ile, пентилглицин, Val или Met;
Xaa10 представляет Phe, Tyr или нафтилаланин;
Xaa11 представляет Ile, Val, Leu, пентилглицин, трет-бутилглицин или Met;
Xaa12 представляет Glu или Asp;
Xaa13 представляет Trp, Phe, Tyr или нафтилаланин;
X1 представляет Lys Asn, Asn Lys, Lys-NHε-R Asn, Asn Lys-NHε-R, где R представляет Lys, Arg, С1-10-алканоил с прямой или разветвленной цепью или циклоалкилалканоил;
Xaa14, Xaa15, Xaa16 и Xaa17 независимо представляют Pro, гомопролин, 3Нур, 4Нур, тиопролин, N-алкилглицин, N-алкилпентилглицин или N-алкилаланин;
Xaa18 представляет Ser, Thr или Tyr; и
Z представляет -ОН или -NH2;
при условии, что соединение не имеет формулы SEQ ID NO 1 или 2.
| US 5424286 А, 13.06.1995 | |||
| М.И.Балаболкин | |||
| Эндокринология | |||
| - М.: Универсум паблишинг, 1998, с.381-383 | |||
| Устройство для закрепления изделий | 1977 |
|
SU619322A1 |
Авторы
Даты
2005-03-10—Публикация
2000-01-14—Подача