Изобретение относится к терапевтическим пептидам.
Было предпринято несколько попыток продлить активность биологически активных пептидов. Например, пептиды модифицировались химически путем синтетического добавления сахарной среды для увеличения периода, в течение которого пептид является активным (Сандоз, WO 88/02756; Сандоз, WO 89/09786; DE 3910667 Al, EP 374089 A2 (1990); и Брейпол, патент США N 4861755 (1989)). Добавление катионных анкеров (EP 0363589 A2 (1990)) и липидной среды (Уиттейкер, WO 91/09837; Джанг, патент США N 4837303 (1989)) также использовалось для увеличения времени жизни пептида.
В общем смысле, настоящее изобретение позволяет создавать производные биологически активных пептидов, которые содержат один или несколько заместителей, отдельно соединенных с аминогруппой, размещенной на N-оконечном конце или боковой цепочке пептидной среды. В этом модифицированном виде производные имеют более высокую и продленную биологическую активность, чем соответствующий немодифицированный пептид.
Производные пептидов выгодны тем, что они недороги, в высшей степени биологически совместимы, лишены вредных побочных эффектов и совместимы с разными видами терапевтического приема. В частности, многие производные, имеющие соматостатин в качестве пептидной среды, значительно улучшили сильнодействие и селективность по сравнению с немодифицированным соматостатином.
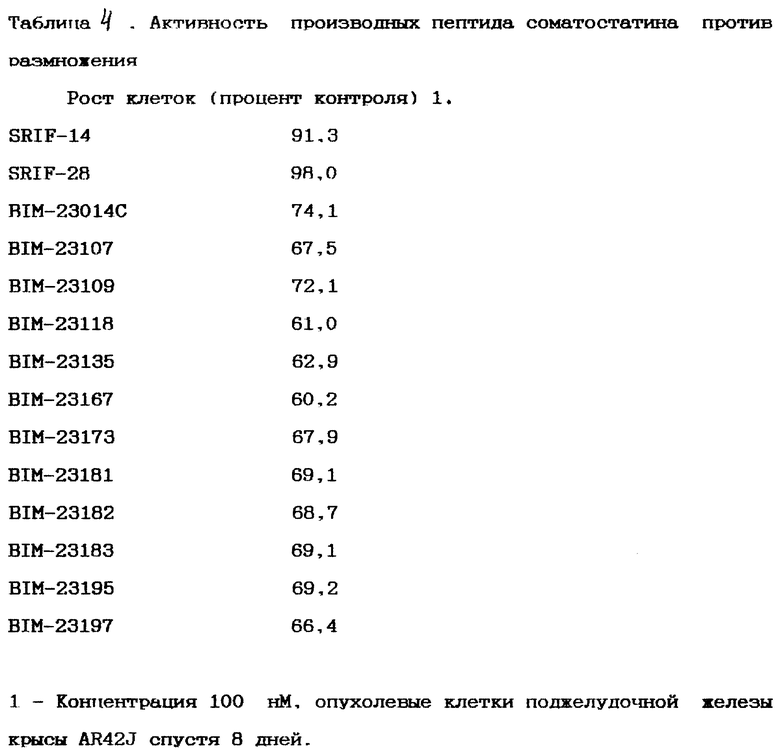
В одном аспекте изобретение характеризуется производной пептида, содержащей биологически активную пептидную среду и как минимум один заместитель, прикрепленный к пептидной среде; заместитель выбирается из группы, включающей соединения I, II и III, где соединение I - это: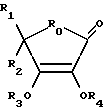
где RO - это O, S или NR5, где R5 - это H или (C1-C6)алкил; каждое R1 и R2, независимо, - это H, (CH2)mOR6 или CH(OR7)CH2OR8, где R6 - это H или (C2-C7)ацил, и каждое R7 и R8, независимо, - это H, (C2 -C7)ацил или C(R9)(R10), где каждое R9 и R10, независимо, - это H или (C1 -C6)алкил; или каждое R1 и R2 - это =CHCH2OR11, где в R11 каждое R1 и R2, независимо, - это H или (C2-C7)ацил, и m - это целое число между 1 и 5 включительно; и одно из R3 или R4 - это (CH2)nR12 или (CH2)nCH(OH)R12, где R12 - это CO, CH2 или SO2 и n - это целое число между 1 и 5 включительно; и остающиеся R3 или R4 - это H, (C1 - C6)гидроксиалкил или (C2-C7)ацил; и
соединение II - это;
где каждое R13, R14 и R15, независимо, - это H или (C2-C24)ацил;
R16 - это NH или отсутствует;
R17 - это CO, O или отсутствует;
R18 - это CO, CH2, SO2 или отсутствует; и
m - это целое число между 1 и 5 включительно; и n - это целое число между 0 и 5 включительно; и
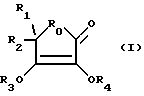
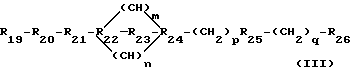
соединение III - это
где R19 - это H, NH2, ароматическая функциональная группа, OH, (C1-C6)гидроксиалкил, H(R27)(R28), SO3H или отсутствует, где каждое R27 и R28, независимо, - это H или (C2 -C6)алкил;
R20 - это O или отсутствует;
R21 - это (C1-C6)алкил или отсутствует;
-R22 - это N, CH, O или C;
-R23 - это (C1-C6)алкил или отсутствует;
R24 - это N, CH или C;
R25 - это NH, O, или отсутствует;
R26 - это SO2, CO, CH2 или отсутствует;
m - это целое число между 0 и 5 включительно;
n - это целое число между 0 и 5 включительно;
p - это целое число между 0 и 5 включительно; и
q - это целое число между 0 и 5 включительно.
В соединениях I, II и III пептидная среда прикреплена к каждому из заместителей посредством связи CO-N, CH2-N или SO2-N между заместителем и атомом азота N-окончания или боковой цепочкой этой пептидной среды.
В предпочтительных примерах осуществления изобретения -R23- - это (C1-C6)алкил; R22 - это N, C или CH; и R24 - это C.
В качестве альтернативы, R22 - это О; R19, R20, R21, -R23- отсутствуют; и сумма m и n - это 3, 4 или 5.
В других предпочтительных примерах осуществления изобретения заместитель - это соединение I; в этом примере R12 - это предпочтительно CH2 или SO2. В качестве альтернативы, заместитель может быть соединением II, и в этом случае R18 - это предпочтительно CH2 или SO2; R13, R14, R15 - это H; и R17 отсутствует. В особенно предпочтительных примерах осуществления заместитель - это (HOCH2)3C-NH-(CH)2-SO2 или (HOCH2)2C-CH2.
В еще других примерах осуществления изобретения заместитель - это соединение III: предпочтительно в этом примере -R23- отсутствует и, как минимум, одно из R22 и R24 - это N. В качестве альтернативы, оба R22 и R24 могут быть N.
В других примерах заместитель - это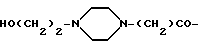
или
Предпочтительно пептидная среда выбирается из группы, включающей в себя: соматостатин, бомбесин, кальцитонин, пептид, связанный с геном кальцитонина (CGRP), амилин, гормон паратироид (PTH), высвобождающий гастрин пептид (GRP), стимулирующий меланоцит гормон (MSH), адренокортикотрофный гормон (ACTH), связанный с паратироидом пептид (PTHrP), лютеинизирующий высвобождающий гормон гормон (LHRH), высвобождающий гормон роста фактор (GHRF), высвобождающий гормон роста пептид (GHRP), холецистокинин (CCK), глюкагон, Брадикинин, глюкагон-подобный пептид (GLP), гастрин, энкефалин, нейромедины, эндотелин, вещество P, нейропептид Y (NPY), пептид YY (PYY), вазоактивный кишечный пептид (VIP), гуанилин, полипептид, активирующий слизистую аденилатную циклазу (PACAP), бета-клеточный тропин, адреномедулин и их производные, фрагменты и аналоги.
Пептидная среда - это предпочтительно самостатин или его производная, фрагмент или аналог. Наиболее предпочтительный аналог самостатина - это одно из: H-D-Phe-c[Cys-Tyr-D-Trp-Lys-Abu-Cys]-Thr-NH2, H-D-Phe-c[Cys-Tyr-D-Trp-Lys-Thr-Cys] -Nal-NH2 и H-D-Nal-c[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2. В качестве альтернативы, пептидная среда - это бомбесин или его производная, фрагмент или аналог.
В еще других предпочтительных примерах осуществления производная пептида это
или
В другом аспекте изобретение предполагает димерную производную пептида, содержащую две биологически активные пептидные среды и, как минимум, один заместитель, прикрепленный к каждой из этих пептидных сред.
Заместитель выбирается из группы, состоящей из соединений IV и V, где соединение IV имеет общую ("родовую") структуру, эквивалентную соединению I, а соединение V имеет общую структуру, эквивалентную соединению III. В димере каждая из пептидных сред присоединена к заместителям посредством связи CO-N, CH2-N или SO2-N между заместителем и атомом азота N-окончании или боковой цепочкой одной из пептидных сред.
В еще одном аспекте изобретение включает в себя способ лечения заболевания, такого как рак, у пациента; этот способ включает этап принятия пациентом терапевтического количества описанных здесь производных пептида. В предпочтительных примерах осуществления пептидная среда, используемая при лечении, - это соматостатин.
Под используемым здесь понятием "биологически активный" имеется в виду встречающийся в природе рекомбинантный и синтетический пептид, имеющий физиологическую или терапевтическую активность. В общем смысле этот термин включает в себя все производные, фрагменты и аналоги биологически активных пептидов, проявляющих качественно аналогичный или противоположный эффект эффекту, производимому немодифицированным пептидом.
Сущность изобретения поясняется чертежом, на котором изображен график двух кривых роста клеток AR42J в присутствии разных производных соматостатина.
Производные пептидов
В общем случае, производные пептидов согласно этому изобретению содержат два отдельных компонента: 1) биологически активный пептид; и 2) как минимум, один заменитель, имеющий структуру соединений I, II и III. Производные пептидов, полученные согласно описанным здесь способам, включают следующие вещества.
Производные на основе соединения I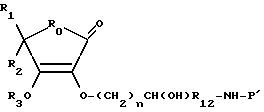
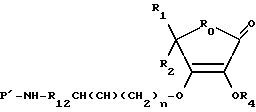


где R0, R1, R2, R3, R4, R12 и n - это те, которые здесь были определены, а NH-P' - это биологически активная пептидная среда.
В этих примерах осуществления группа NH размещена на N-оконечном конце или боковой цепочке пептида и P' представляет собой остаток пептида.
Производные на основе соединения II
где R13, R14, R15, R16, R17, R18, m, n и NH-P' - это те, что здесь определяются.
Производные на основе соединения III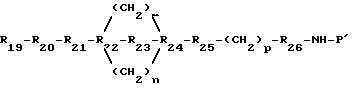
где R19, R20, R21, R22, R23, R24, R25, R26, m, n, p и NH-P' - это те, что определяются здесь.
В добавление к показанным выше структурам соединения, получаемые согласно изобретению, включают пептидные производные, содержащие два или большее число заместителей, прикрепленных к одной пептидной среде. Эти примеры осуществления изобретения являются производными биологически активных пептидов, имеющих более чем одну свободную аминогруппу, например радикал лисина.
Это изобретение также предполагает наличие димерных производных пептидов, содержащих две пептидные среды, связанные с одним заместителем, например два аналога Брадыкинина, связанные с заместителем соединения V.
Производные пептидов этого изобретения - это производные биологически активных пептидов, выбираемых из следующей группы: соматостатин, бомбесин, кальцитонин, пептид, связанный с геном кальцитонина (CGRP), амилин, гормон паратироида (PTH), высвобождающий гастрин пептид (GRP), стимулирующий меланоцит гормон (MSH), адренокортикотропный гормон (ACTH), связанный с паратироидом пептид (PTHrP), лютеинизирующий высвобождающий гормон гормон (LHRH), высвобождающий гормон роста фактор (GRF), высвобождающий гормон роста пептид (GHRP), холецистокинин (CCK), глюкагон, брадыкинин, глюкагон-подобный пептид (GLP), гастрин, энкефалин, нейромедины, эндотелин, вещество P, нейропептид Y (NPY), пептид YY (PYY), вазоактивный кишечный пептид (VIP), гуанилин, активирующий слизистую аденалатную циклазу полипептид (PACAP), бета-клеточный тропин, адреномедулин или производные, фрагменты или аналоги вышеприведенных.
В особенно предпочтительных примерах осуществления пептидная среда - это соматостатин или производная, фрагмент или аналог соматостатина. Аналоги соматостатина, которые можно использовать в связи с этим изобретением, включают в себя следующие вещества, не ограничиваясь ими (см. в конце описания).
Перечисленные выше пептидные соединения описаны в следующих ссылках:
Заявка EP N P5 164 EU; Ван-Бинст Г. и др. "Исследования пептидов" 5:8 (1992): Хорват А. и др. Реферат "Структуры аналогов соматостатина, имеющих противоопухолевую активность", 22-й Европейский симпозиум по пептидам, 13 - 19 сентября 1992, Интерлакен, Швейцария; заявка РСТ WO 91-09056 (1991); заявка EP 0363589 A2 (1990); заявка EP 0203031 A2 (1986); патенты США NN 4904642; 4871717; 4853371; 4725577; 4684620; 4650787; 4603120; 4585755; 4522813; 4486415; 4485101; 4435385; 4395403; 43691794; 4360516; 4358439; 4328214; 4316890; 4310518; 42910224; 4238481; 4235886; 4224190; 4211693; 4190648; 4146612 и 4133782.
В перечисленных выше аналогах соматостатина каждый радикал аминокислоты имеет структуру NH-C(R)H-CO-, в которой R - это боковая цепочка; черточки между радикалами аминокислоты представляют собой пептидные связи, которые соединяют аминокислоты. Когда радикал аминокислоты оптически активен, он имеет конфигурацию формы L, которая предполагается, если только однозначно не указана форма D. Когда два радикала Cys присутствуют в пептиде, дисульфидный "мостик" образуется между двумя средами. Однако эта связь не показана в перечисленных радикалах.
Дополнительно предпочтительные аналоги соматостатина согласно изобретению имеют следующую формулу:
где A1 - это D - или L-изомер β- Nal, Trp, β- пиридил-Ala, Phe, замещенный Phe или отсутствует; и каждое A2 и A7, независимо, - это Cys, Asp или Lys. Эти среды ковалентно связаны друг с другом посредством дисульфидного "мостика" или амидного "мостика". Кроме того, A3 - это β- Nal, Phe или о-, m- или p-замещенное X-Phe, где X - это галоген, OH, NH2 NO2 или (C1 - C3 алкил; A6 - это Val, Thr, Ser, Ala, Phe, β- Nal, Abu, Ile, Nle, или Nva; и A8 - это Phe, Thr, Tyr, Trp, Ser, β- Nal, или группа спиртов, или отсутствует; каждое R1 и R2, независимо - это H, нижний ацил или нижний алкил; и R3 - это OH, NH2 или отсутствует. Предпочтительно, когда одно из A2 и A7 - это Cys, другое тоже Cys; когда A8 - это альфа-аминоспирт, R3 отсутствует; и когда ни A2 и ни A7 - это не Cys, A2 отлично от A7.
Особенно предпочтительными аналогами соматостатина в этом примере осуществления изобретения являются:
Me-D-Phe-Cys-Tyr-Tyr-D-Trp-Lys-Val-Cys-Thr-NH2;
H-D-Nal-Cys-Tyr-D-Trp-Lys-Thr-Cys-Nal-NH2;
H-D-Nal-Cys-Tyr-D-Trp-Lys-Thr-Cys-Thr-NH2;
H-D-Phe-Cys-Tyr-D-Trp-Lys-Abu-Cys-Thr-NH2;
H-D-Phe-Cys-Tyr-D-Trp-Lys-Thr-Cys-Nal-NH2;
H-D-Phe-Cys-Tyr-D-Trp-Lys-Thr-Cys-Thr-ol.
В других примерах осуществления линейные аналоги соматостатина этого изобретения имеют следующую структуру: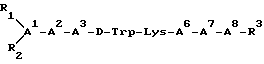
где A1 - это D- или L- изомер Ala, Leu, Ile, Val, Nle, Thr, Ser, β- Nal, β- пиридил-Ala, Trp, Phe, 2,4-дихлоро-Phe, пентафторо-Phe, p-X-Phe или o-X-Phe, где X - это CH3, Cl, Br, F, OH, OCH3 или NO2;
A2 - это Ala, Leu, Ile, Val, Nle, Phe, β- Nal, пиридил - Ala, Trp, 2,4-дихлоро-Phe, пентафторо-Phe, o-X-Phe, или p-X-Phe, где X - это CH3, Cl, Br, F, OH, OCH3 или NO2;
A3 - это пиридил-Ala, Trp, Phe, β-Nal, 2,4-дихлоро-Phe, пентафторо-Phe, o-X-Phe, или p-X-Phe, где X - это CH3, Cl, Br, F, OH, OCH3 или NO2;
A6 - это Val, Ala, Leu, Ile, Nle, Thr, Abu или Ser;
A7 - это Ala, Leu, Ile, Val, Nle, Phe, β-Nal, пиридил-Ala, Trp, 2,4-дихлоро-Phe, пентафторо-Phe, p-X-Phe или o-X-Phe, где X - это CH3, Cl, Br, F, OH, OCH3 или NO2;
A8 - это D- или L-изомер Ala, Leu, Ile, Val, Nle, Thr, Ser, Phe, β-Nal, пиридил-Ala, Trp, 2,4-дихлоро-Phe, пентафторо-Phe, p-X-Phe или o-X-Phe, где X - это CH3, Cl, Br, F, OH, OCH3 или NO2 или их спирт; и
каждое R1 и R2, независимо, - это H, нижний ацил или нижний алкил; и R3 - это OH, NH2 или вычеркнуто. Предпочтительно, как минимум, одно из A1 и A8 и одно из A2 и A7 должно быть ароматической аминокислотой; и когда A8 - это спирт, R3 вычеркнуто. Кроме того, A1, A2, A7 и A8 не могут все быть ароматическими аминокислотами. К числу особенно предпочтительных аналогов в этом аспекте изобретения относятся:
H-D-Phe-p-chloro-Phe-Tyr-D-Trp-Lys-Thr-Phe-Thr-NH2;
H-D-Phe-p-NO2-Phe-Tyr-D-Trp-Lys-Val-Phe-Thr-NH2;
H-D-Nal-p-chloro-Phe-Tyr-D-Trp-Lys-Val-Phe-Thr-NH2;
H-D-Phe-Phe-Phe-D-Trp-Lys-Thr-Phe-Thr-NH2;
H-D-Phe-Phe-Tyr-D-Trp-Lys-Val-Phe-Thr-NH2;
H-D-Phe-p-chloro-Phe-Tyr-D-Trp-Lys-Val-Phe-Thr-NH2;
и
H-D-Phe-Ala-Tyr-D-Trp-Lys-Val-Ala-D -β- Nal-NH2.
В еще других предпочтительных примерах осуществления пептидная среда - это бомбесин или его производная, фрагмент или аналог. К числу аналогов бомбесина, которые можно использовать для осуществления этого изобретения, относятся, не ограничиваясь этим, Нейромедин C, Нейромедин B, литорин и высвобождающий гастрин пептид (GRP), имеющий следующую последовательность аминокислот:
H-Ala-Pro-Val-Ser-Val-Gly-Gly-Gly-Thr-Val-Leu-;
Ala-Lys-Met-Tyr-Pro-Arg-Cly-Asn-His-;
Trp-Ala-Val-Gly-His-Leu-Met-NH2.
Другие аналоги бомбесина, которые можно использовать в этом изобретении, включают в себя соединения, описанные в следующих ссылках:
Кой и др. "Пептиды. Труды 11-го Американского симпозиума по пептидам", под ред. Ривьера и др. ESCOM, стр. 65 - 67 (1990); Уэнг и др. J. Biol. Chem. 265: 15695 (1990); Махмуд и др. "Исследования в области рака", 51:1798 (1991);
Уэнг и др. "Biochemistry", 29:616 (1990); Хаймбрук и др. "Синтетические пептиды. Подходы к биологическим проблемам", "UCLA Symposium on Mol. and Cell. Biol. New Series", vol. 86, под ред. Тэма и Кайзера; Мартинес и др. J. Med. Chem. 28: 1874 (1985); Гагорский и др. Biochem. J. 247:427 (1987): Дюбрей и др. "Конструирование и выдача лекарств", том 2:49, Harwood Academic Publishers, GB (1987); Хейккила и др. J. Biol. Chem. 262:16456 (1987); Караникас и др. J. Med. Chem. 25:1313 (1982); Сейид и др. "Пептиды" 10:597 (1989); Роселл и др. "Тенденции в фармакологических науках" 3:211 (1982); Ландберг и др. "Proc. Nat. Aca. Sci. " 80:1120, (1983); Энгберг и др. "Nature" 293:222 (1984); Миэрахи и др. "Euro.J. Pharma." 82:101 (1982); Линдер и др. "Nature" 294:467 (1981); Уолл и др. "Biochem. Biophys. Res. Comm." 155: 359 (1988); Ривьер и др. "Biochem." 17:1766 (1978); Каттитта и др. "Обзоры раковых болезней" 4:707 (1985); Омилас и др. "Int.J. Peptide Res." 30:596 (1987); Сепешхази и др. "Исследования в области рака" 51:5980 (1991); Йенсен и др. "Trends Pharmacol. Sci". 12:13 (1991); патенты США NN 5028692; 4943561; 4207311; 5068222; 5081107; 5084555; заявки EP NN 0315367 A2 (1989); 0434979 A2 (1991); 0468497 A2 (1992); 0313158 A2 (1989); 0339193 A1 (1989); заявки PCT NN WO 90/01037 (1990); 90/02545 (1992); заявка Англии GB 1231051 A (1990).
Пептиды этого изобретения могут получаться в виде фармацевтически приемлемых солей. Примерами предпочтительных солей являются те соли, которые имеют терапевтически приемлемые органические кислоты, например уксусную, молочную, малеиновую, лимонную, маловую, аскорбиновую, сукциновую, бензойную, салициловую, метансульфокислоту, толуолсульфокислоту или памоиновую кислоту, а также полимерные кислоты, такие как дубильная кислота, или карбоксиметилцеллюлоза и соли с неорганическими кислотами, такими как гидрогальные кислоты, включая соляную кислоту, серную кислоту и фосфорную кислоту.
Теперь описывается синтез соединений I, II и III.
При описании синтеза соединений согласно этому изобретению используются следующие сокращения:
Nal - нафтилаланин (1 или 2),
Abu - альфа-аминомасляная кислота,
D - правовращающий,
L - левовращающий,
HOAC - уксусная кислота,
BOP - бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторо-фосфат,
BOC - терт-бутилоксикарбонил,
DCC - дициклогексил карбодиимид,
EDC - 1-(3-диметиламинопропил)-3-этилкарбодиимид,
DEPC - диэтилцианофосфонат,
DMF - диметилформамид,
CH2Cl2 - дихлорметан,
MeOH - метанол,
EtOH - этанол,
DIEA - N,N-диизопропилэтиламин,
HOBT - 1-гидроксибензотриазол,
HBTU - O-бензотриазол-1-ил,N,N,N',N'-тетраметилуроний гексафторофосфат,
THF - тетрагидрофуран,
TFA - трифтороуксусная кислота.
Исходные и промежуточные материалы для получения соединений I, II и III доступны коммерчески. В качестве альтернативы, исходные материалы можно легко приготовить методами, которые хорошо известны и содержатся в литературе. Например, химию производных, связанных с аскорбиновой кислотой, можно найти в "J. Chem. Soc. ". Perkin Trans. 1:1220 (1974); "Carbohyd. Res." 67:127 (1978); Yakugaku Zasshi, 86:376 (1966); в патенте США N 4552888; "J. Med. Chem", 31: 793 (1988); там же 34:2152 (1991); и 35:1618 (1992). Химию этих трис-связанных производных можно найти в "Arch. Biochem. Biophy.", 96, 653 (1962), "Biochem.", 5, 467 (1996).
Синтез производных пептидов
В общем смысле, присоединение соединений I, II или III к соответствующей свободной аминогруппе защищенной аминокислоты или пептида можно достичь согласно хорошо известным методам, используемым для синтеза пептидов (например, DCC, DCC-HOBT, DIC-HOBT PPA, EDC-HOBT, DEPT, BOP, HBTU) с использованием основы (например, DIEA) в инертном растворителе (например, DMF, THF или CH2Cl2 этил ацетат или их комбинация). Деблокирование защищенных групп тоже может производиться хорошо известными методами (например, удалением группы путем добавления кислоты или основы, TFA, диоксан-HCl, аммиака, NaOMe, пиперидина). В большинстве случаев температура реакции должна быть в диапазоне от -30oC до комнатной температуры.
В основном, первый этап синтеза предполагает реакцию между эпоксидом и свободной аминогруппой защищенной аминокислоты или пептида; комплексацию и снятие защиты можно достичь с использованием хорошо известных методов, таких как описанные Мак-Мэнусом и др. "Synth Communications 3, 177 (1973). После синтеза очистку промежуточных веществ и продуктов можно достичь обычными методами, такими как хроматография или HPLC. Соединения можно идентифицировать обычными способами, такими как NMR, анализ аминокислот и масс-спектрометрия.
Следующие примеры показывают предпочтительные способы образования соединений этого изобретения.
Пример 1. Синтез производных соматостатина.
Следующая производная соматостатина, называемая здесь BIM-23118, была синтезирована в соответствии с этим изобретением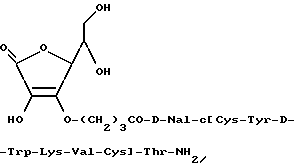
Пример 1,1. 3-O-(Бензилоксикарбонилметил)-2,5,6-триацетиласкорбиновая кислота.
Ангидрид уксусной кислоты (6 мл) добавлялся по каплям к раствору 3-O-(бензилоксикарбонилметил)-аскорбиновой кислоты (2,2 г) в пиридине (30 мл); затем смесь перемешивалась половину суток при комнатной температуре. Пиридин испарялся при пониженном давлении, оставляя остаток, который затем разделялся между этилацетатом и 1 н. HCl. Слой этилацетата промывался 1 н. HCl и затем водой. После сушки (MgSO4) этилацетат испарялся при пониженном давлении; следы пиридина и ангидрида уксусной кислоты, которые еще оставались, удалялись многократным совместным испарением с толуолом. Получавшаяся 3-O-(бензилоксикарбонилметил)-2,5,6-триацетиласкорбиновая кислота просушивалась в вакууме, давая вязкий гель, остававшийся в остатке (2,4 г). TLC (силикагель: CHCl3/ацетон [9:1], Rf=0,52).
Пример 1,2. 3-O-(Карбоксиметил)-2,5,6-триацетиласкорбиновая кислота.
Суспензия Pd-C (100 мг) в воде (2 мл) добавлялась к раствору 3-O-(бензилоксикарбонилметил)-2,5,6-триацетиласкорбиновой кислоты (2,4 г) в этаноле (30 мг) и суспензия встряхивалась в водороде (17 фунтов на кв.дюйм) в течение 6 часов.
Затем катализатор удалялся фильтрацией через целитовую прокладку и фильтрат испарялся при пониженном давлении с получением 3-O-(карбоксиметил)-2,5,6-триацетиласкорбиновой кислоты. TLC (силикагель: CHCl3/MeOH/HOAC [9:1:0,1], Rf =0,2).
Пример 1,3. 5,6-О-Изопропилиденеаскорбиновая кислота.
Ацетилхлорид (0,67 мл) добавлялся в быстро перемешиваемую суспензию аскорбиновой кислоты (8,0 г) в ацетоне (80 мл) и смесь перемешивалась половину суток при комнатной температуре. Осадок собирался фильтрацией, промывался этилацетатом и высушивался при пониженном давлении с получением 8,29 г 5,6-О-изопропилиденеаскорбиновой кислоты в виде бесцветного твердого вещества. TLC (силикагель: CHCl3/MeOH/HOAC [3:1:0,1], Rf=0,54).
Пример 1,4. 3-O-(Этоксикарбонилпропил)-5,6-изопропилиденаскорбиновая кислота.
Раствор 5,6-изопропилиденаскорбиновой кислоты (2,0 г) в 10 мл DMF добавлялся по каплям в суспензию NaH (0,44 г 50% дисперсии минерального масла NaH, промытой несколько раз гексаном) в 5 мл DMF. После прекращения выделения газа раствор 1,43 мл этила 4-бромобутирата в 5 мл DMF добавлялся по каплям и смесь перемешивалась при комнатной температуре половину суток. Растворитель испарялся при пониженном давлении и получившийся остаток хроматографировался на силикагеле (55 г) с использованием CHCl3/MeOH (19:1) в качестве элюента. Соответствующие фракции отстаивались и растворители удалялись при пониженном давлении, давая вязкий осадок, содержащий 3-O-(этоксикарбонилпропил)-5,6-изопропилиденаскорбиновую кислоту (1,1 г).
Пример 1,5. 3-O-(Карбоксипропил)-5,6-изопропилиденаскорбиновая кислота.
4,6 мл 2 н. NaOH добавлялось в раствор 3-O-(этиоксикарбонилпропил)-5,6-изопропилиденаскорбиновой кислоты (1,02 г) в 15 мл EtOH. Спустя 1 час большая часть этанола была удалена при пониженном давлении и остаток разводился водой (10 мл) и подкислялся дил-HCl (pH 3). Затем раствор насыщался NaCl и экстрагировался несколько раз этилацетатом; осажденные экстракты затем высушивались с использованием MgSO4. Растворитель испарялся при пониженном давлении с получением вязкого остатка, содержащего 3-O-(карбоксипропил)-5,6-изопропилиденаскорбиновую кислоту (0,84 г). TLC: (силикагель: CHCl3/MeOH/HOAC [5:1:0,1], Rf=0,55).
Пример 1,6. D-Nal-c[Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys]-Thr-NH2.
Раствор ди-тербутил дикарбоната (0,36 г) в 10 мл DMF добавлялся по каплям в раствор D-Nal-c[Cys-Tyr-D-Trp-Lys-Val-Cys] -Thr-NH2 ацетата (2 г, BIM-23014) в 45 мл DMF. Спустя 2 часа при комнатной температуре растворитель удалялся при пониженном давлении, давая остаток, который затем хроматографировался на силикагеле (150 г) с использованием CHCl3/MeOH (9 : 1) в качестве элюента. Соответствующие фракции собирались и растворители удалялись при пониженном давлении с получением остатка, содержащего D-Nal-c[Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys] -Thr-NH2 (1,45 г). TLC (силикагель: CHCl3/MeOH [3:1], Rf=0,52).
Пример 1,7.
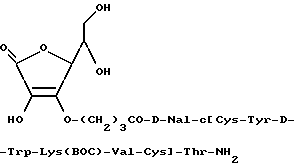
0,2 мл Диизопропилэтиламина добавлялось к раствору D-Nal-цикло- [Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys] -Thr-NH2 (300 мг), 3-O-(карбоксипропил)-5,6-изопропилиденаскорбиновой кислоты (56 мг) в 5 мл DMF. Затем смесь перемешивалась при комнатной температуре половину суток и растворитель удалялся при пониженном давлении. Остаток разделялся между смесью этилацетата/MeOH и насыщенным водным раствором NaCl, и слой этилацетата промывался насыщенным водным NaCl, затем насыщенным водным NaHCO3 и высушивался (MgSO4). Растворитель испарялся при пониженном давлении, и остаток подвергался подготовительному TLC с использованием смеси CHCl3/MeOH (8:1) в качестве развивающего растворителя. Соответствующая УФ-положительная зона изолировалась и экстрагировалась с CHCl3/MeOH. Растворители удалялись при пониженном давлении с получением вышеуказанного продукта (0,20 г). TLC (силикагель: CHCl3/MeOH[5: 1], Rf=0,54).
Пример 1,8. Удаление группы ВОС.
Производная аскорбиновой кислоты, содержащая D-Nal-c [Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys]-Thr-NH2 (95 мг), показанную выше, обрабатывалась 25% TFA в CHCl3 в течение 45 мин при комнатной температуре. Летучие вещества удалялись при пониженном давлении с получением высушенного остатка, который очищался с использованием Vydac C18 HPLC и CH3CN/0,1% водного TFA. Конечный выход составлял 90 мг (FAB-MS (m/e) 1341).
Пример 1,9. Другие примеры осуществления.
Следующие производные соматостатина синтезировались аналогичным образом:


Пример 2. Синтез BIM-23107.
Следующая производная соматостатина, называемая BIM-23107, синтезировалась в соответствии с этим изобретением. (AcO-CH2)3-C-NH-CO-(CH2)2-CO-D-Nal-c [Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2.
Пример 2,1. (AcO-CH2)3-C-NH-CO-(CH2)2-CO-D-Nal-c [Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys]-Thr-NH2.
0,03 мл DIEA добавлялось к охлажденному во льду раствору 2-N-(сукцинил)амино-2-(ацетоксиметил)-1,3-пропандиол-диацетата (83 мг) и HBTU (92 мг) в 2 мл DMF. После перемешивания при 0 - 5oC в течение 30 минут добавлялся раствор D-Nal-c [Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys]-Thr-NH2 (100 мг) в 2 мл DMF, содержащий 0,03 мл DIEA. Смесь сначала перемешивалась при 0 - 5oC в течение 1 часа и затем перемешивалась при комнатной температуре половину суток. Растворитель удалялся при пониженном давлении, давая высушенный остаток, который разделялся между этилацетатом и водным насыщенным NaCl, и слой EtOAc промывался 5% водного NaHCO и наконец водным насыщенным NaCl; затем полученный раствор высушивался с использованием MgSO4. Растворитель испарялся при пониженном давлении, оставляя остаток, содержащий (AcO-CH2)3-C-NH-CO-(CH2)2-CO-D-Nal-c [Cys-Tyr-D-Trp-Lys(BOC)-Val-Cys] -Thr-NH2 (0,14 мг). TLC (силикагель: CHCl3/MeOH/HOAC = 4:1:0,1, Rf=0,82).
Пример 2,2. Удаление группы BOC.
30 мг Вышеуказанного соединения обрабатывалось 50% TFA в CHCl3 45 минут при комнатной температуре; затем летучие вещества удалялись при пониженном давлении, давая остаток. Следы TFA совместно испарялись с этанолом несколько раз, и остаток титровался эфиром и затем высушивался с получением 30 мг продукта. TLC (силикагель: CHCl3/MeOH/HOAc = 3:1:1. Rf = 0,24).
Пример 2,3. Другие примеры осуществления.
Следующие производные соматостатина синтезировались аналогичным образом.
(HO-CH2)3-C-NH-CO-(CH2)2-CO-D-Nal-c [Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2
BIM-23158
(HO-CH2)3-C-NH-CO-(CH2)2-CO-D-Phe-c [Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2
BIM-23167
(HO-CH2)3-C-NH-CO-(CH2)2-CO-D-Phe-c [Cys-Tyr-D-Trp-Lys-Abu-Cys]-Thr-NH2
BIM-23173
(HO-CH2)3-C-NH-CH2-CO-D-Phe-c [Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2
BIM-23179
(HO-CH2)3-C-NH-CH2-CO-D-Phe-c [Cys-Tyr-D-Trp-Lys-Abu-Cys]-Thr-NH2
BIM-23182
Пример 3. Синтез BIM-23201.
Следующая производная соматостатина, называемая (BIM-23201), синтезировалась в соответствии с эти изобретением.
(HO-CH2)3-C-CH2-D-Phe-c [Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2.
Пример 3,1. (HO-CH2)3-C-CH2-D-Phe-c [Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2.
2 г Прошедшего молекулярное сито (фильтр) в  NaCNBH3 (36 мг) добавлялись порционно с периодами 15 минут в раствор D-Phe-c[Cys-Tyr(OBt)-D-Trp-Lys(BOC)-Thr(OBt) Cys] -Nal-NH2 (250 мг) и трис(ацетоксиметил)ацетальдегида (120 мг), полученный окислением триацетил-пента-эритриола дихроматом пиридиния или DMCO/оксалил хлорид/триэтиламин) в метаноле (10 мл), содержащем 10% уксусной кислоты. Затем смесь перемешивалась при комнатной температуре 30 минут и нагревалась 4 часа.
NaCNBH3 (36 мг) добавлялись порционно с периодами 15 минут в раствор D-Phe-c[Cys-Tyr(OBt)-D-Trp-Lys(BOC)-Thr(OBt) Cys] -Nal-NH2 (250 мг) и трис(ацетоксиметил)ацетальдегида (120 мг), полученный окислением триацетил-пента-эритриола дихроматом пиридиния или DMCO/оксалил хлорид/триэтиламин) в метаноле (10 мл), содержащем 10% уксусной кислоты. Затем смесь перемешивалась при комнатной температуре 30 минут и нагревалась 4 часа.
После фильтрации остаток разделялся между этилацетатом и водой. Слой этилацетата промывался водой, затем водным NaHCO3 и потом высушивался (MgSO4). Растворитель испарялся при пониженном давлении с получением остатка (0,4 г), который затем растворялся в метаноле (5 мл), обрабатывался раствором NaOMe/MeOH (pH 10), перемешивался в течение 1 часа и наконец нейтрализовался 1 н. HCl до pH 5-6. После испарения растворителя остаток растворялся в 90% водном TFA (5 мл) и перемешивался 30 минут. Летучие вещества удалялись при пониженном давлении, и следы TFA и воды в получившемся остатке удалялись совместным испарением со спиртом (2x). Остаток высушивался, затем титровался эфиром и, наконец, очищался HPLC с использованием условий, аналогичных описанным ранее, давая 41 мг (HO-CH2)3-C-CH2-D-Phe-c [Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2 в качестве бесцветного твердого вещества. MS (m/e) 1262,8.
Пример 3,2. Другие примеры осуществления.
Следующая производная соматостатина, называемая BIM-23195, была синтезирована аналогичным образом
(HО-CH2)3-C-CH2-D-Phe-c [Cys-Tyr-D-Trp-Lys-Abu-Cys]-Thr-NH2
BIM-23195
Пример 4. Синтез BIM-23197.
Следующая производная соматостатина, называемая BIM-23197, синтезировалась в соответствии с этим изобретением.
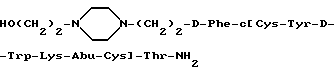
Пример 4,1. 2-Бромоэтансульфонил хлорид
Na 2-бромоэтансульфонат (4,0 г) обрабатывался PCl5 (11,8 г) при охлаждении в ледяной ванне. После достижения жидкой фазы раствор нагревался при 90-120oC в течение 1,5 часов в масле, охлаждался до комнатной температуры, выливался в 50 г раздробленного льда и затем перемешивался 15 мин. Смесь экстрагировалась CH2Cl2 (3х30 мл) и комбинированные экстракты промывались H2O (2х), 5% NaHCO3 (2х) и снова H2O (2х). Высушивание над безводным MgSO4 и дистилляция при пониженном давлении давали 2-бромоэтансульфонил хлорид в виде бесцветной жидкости (1,95 г, 42-44oC/1 мм Hg).
Пример 4,2. Br-(CH2)2-SO2-D-Phe-c[Cys- Tyr(tBu)-D-Trp-Lys(BOC)-Abu-Cys] -Thr(tBu)-NH(1-циклопропил-1-метил)-этил.
Раствор 2-бромэтан-сульфонил-хлорида (30 мг) в DMF (1 мл) добавлялся по каплям в раствор H-D-Phe-c[Cys-Tyr(tBu)-D-Trp-Lys(Boc)- Abu-Cys]-Thr(tBu)-(1-циклопропил-1-метил)-этила (150 мг) и DIEA (55 мг) в DMF (2 мл) при N2 и 0oC. Реакционная смесь перемешивалась при 0-5oC 3 часа; затем растворитель удалялся при пониженном давлении. Остаток растворялся в этилацетате и промывался 5% лимонной кислотой (2х), 5% NaHCO3 (2х) и рапой (2х). Затем раствор высушивался над безводным MgSO4, фильтровался и конденсировался до степени сухости при пониженном давлении. Затем продукт очищался на короткой колонне силикагеля, элюированного этилацетатом. Фракции, содержащие продукт, собирались, и растворитель удалялся при пониженном давлении, давая 105 мг Br-(CH2)2-SO2-D-Phe-c[Cys-Tyr(tBu)-D-Trp- Lys(BOC)-Abu-Cys]-Thr(tBu)-NH(1-циклопропил-1-метил)-этил в виде слегка желтого твердого тела. (Силикагель: CHCl3/MeOH/HOAc (9:1:0,1), Rf=0,36).
Пример 4.3.
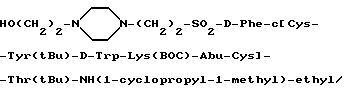
Раствор Br-(CH2)2-SO2-D-Phe-c[Cys-Tyr(tBu)- D-Trp-Lys(Boc)-Abu-Cys] -Thr(tBu)-NH(1-циклопропил-1-метил)-этила (100 мг) и 2-гидроксиэтилпиперазина (55 мг) в 2 мл 1-пропанола орошался при N2 в течение 2,5 часов. Затем раствор охлаждался до комнатной температуры и растворитель удалялся при пониженном давлении. Затем остаток растворялся в этилацетате, содержащем 5% MeOH, и промывался рапой (3х). Наконец, раствор высушивался над безводным MgSO4, фильтровался и конденсировался до состояния сухости при пониженном давлении с получением 110 мг вышеуказанного твердого вещества. Без дальнейшей очистки это соединение использовалось непосредственно на следующем этапе.
Пример 4.4.
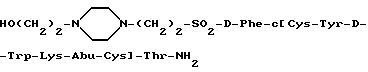
110 мг Защищенной производной соматостатина, полученной на предыдущем этапе, растворялось в 10 мл водного раствора 90% TFA и перемешивалось при комнатной температуре при N2 в течение 1 часа. TFA и H2O удалялись при пониженном давлении, и остаток титровался холодным эфиром (3х10 мл). Получалось слегка желтоватое твердое вещество; этот материал далее очищался на подготовительной обратной фазе HPLC, элюируясь: 1) водным раствором NH4OAc; и 2) водным раствором HOAc.
Лиофилирование собранных фракций, содержащих вышеуказанный продукт, дало белое твердое вещество (18 мг ESI-MS ((m+1)/e) 1252,7).
Пример 4.5. Другие примеры осуществления
Следующие производные соматостатина синтезировались аналогичным образом:

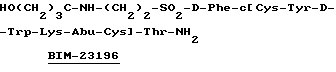

Пример 5. Синтез производных бомбесина.
Следующая производная бомбесина, также называемая BIM-26333, синтезировалась способом, аналогичным описанному выше:
Другие производные пептидов согласно этому изобретению можно синтезировать аналогичным образом с использованием известных в технике синтетических модификаций.
Результаты анализа испытуемых пептидов.
Пример 6. Анализ образования связей.
Для демонстрации связующего химического сродства аналогов соматостатина (SRIF) с рецептором соматостатина описанные выше очищенные соединения испытывались в анализах образования связей соматостатина, включающих измерения в пробирке торможения образования связей [125I-Tyr11 SRIF-14] с мембранами поджелудочной железы крыс AR42J. Как показывает таблица 1, очищенные аналоги соматостатина согласно этому изобретению показали высокое связующее химическое сродство с этими рецепторами. Кроме того, молекулярный вес, определенный масс-спектрометрией и оцененный из молекулярной структуры, представлен в таблице 1 для каждой производной соматостатина.
Аналогичным образом, описанный выше очищенный аналог бомбесина испытывался в опыте на образование связей бомбесином. Анализ образования связей состоял из измерений в пробирке торможения образования связей [125I-Tyr11] бомбеcина с мембранами поджелудочной железы крыс AR34J; из анализа определилось, что связующее химическое сродство аналога бомбесина с рецептором GRP составляло около 21 нМ.
Пример 7. Анализ торможения гормона роста (GH).
Группы 5-ти самцов крыс Sprague Dawley (каждая имела вес 250-300 г) инъецировались в нормальных условиях производной соматостатина или физиологическим раствором. 30 минут до выбранных периодов времени после приема лекарств, показанных в таблице 2 (2 часа, 4 часа, 6 часов, 8 часов) крысы анестезировались Nembutal i.p. (50 мг/кг).
Через 15 минут после анестезии кратное количество крови выбиралось проколом в области сердца над гепарином для измерения основного GH. Кроме того, производилась инъекция в нормальных условиях D-Ala2-GRF (10 мкг/кг). Спустя 15 минут кровь отбиралась, чтобы квантировать стимулированный GH, который измерялся в плазме с использованием радиоиммуноанализа, предоставленного NIADDKD. Процентное отношение торможения GH рассчитывалось из разности, полученной между значениями основного и стимулированного GH.
В таблице 2 показано воздействие различных очищенных аналогов соматостатина как функция времени. Действенность D-Phe-c[Cys-Tyr-D-Trp-Lys-Thr-Cys] -Nal-NH2 (BIM-23060) в торможении гормона роста у крыс сравнивается с действенностью других производных соматостатина (BIM-23167, BIM-23179 и BIM-23181) этого изобретения. Все производные показывают удивительную продленную длительность действия, которая уменьшается в зависимости от времени.
Дополнительные эксперименты проводились на D-Phe-c[Cys-Tyr-D-Trp-Lys-Abu-Cys] -Thr-NH2, аналоге соматостатина, и BIM-23190, BIM-23195 и BIM-23197 для определения ED50 (т.е. концентрации каждого соединения, требуемой для торможения высвобождения 50% гормона роста после определенного периода времени) соответствующего соединения. Эксперименты проводились в диапазоне доз от 25 до 0,25 мкг/кг. В таблице 3 показано удивительное улучшение действия производных соматостатина по сравнению с немодифицируемым пептидом на разных временных интервалах, что показывает зависимое от времени торможение стимулированного высвобождения GH соединениями этого изобретения.
Пример 8. Анализ активности против размножения.
Два описанных выше очищенных аналога соматостатина также испытывались на активность против быстро размножающихся клеток. В таблице 4 показано воздействие этих пептидов на рост опухолевых клеток поджелудочной железы крысы AR42J. В отличие от природного соматостатина, производные этого изобретения показывают значительную активность против размножения. Как видно из чертежа, как BIM-23014C (аналог соматостатина), так и BIM-23118 (производная BIM-23014) тормозят рост клеток опухоли поджелудочной железы крыс AR42J в зависимости от концентрации, причем BIM-23118 является более эффективным из двух соединений. Оба соединения тормозят рост опухолевых клеток в большей степени, чем немодифицированные аналоги соматостатина при эквивалентных концентрациях.
Пример 9. Анализ поглощения тимидина.
В этом опыте культуры привоя швейцарских клеток ЗТЗ выращиваются в модифицированной орлиной среде Далбекко (Dulbecco's Modified Eagles Medium - DMEM) и дополняются 10% сывороткой утробного плода теленка в увлажненной атмосфере 10% CO2 и 90% воздуха при 37oC. Затем клетки засеивались в групповые лотки с 24 отстойниками и использовались 4 дня после последней смены среды. Чтобы задержать клетки в фазе G1/G0 клеточного цикла, использовалась свободная от сыворотки DMEM за 24 часа до анализа поглощения тимидина; затем клетки дважды промывались 1 мл кратными DMEM (- сыворотка, 0,5 мкМ) и [метил-3H] тимидином (20 Ci/ммоль, New England Nuclear). Производные бомбесина вначале испытывались при 0,001, 0,01, 0,1, 1, 10, 100, 100 нм. Спустя 28 часов при 37oC анализировалось включение [метил-3H] тимидина в нерастворимых в кислоте отстойниках следующим образом.
Сначала клетки промывались дважды ледяным 0,9% NaCl (кратные 1 мл); затем растворимая в кислоте радиоактивность удалялась выдержкой в термостате в течение 30 минут при 40oC с 5% трихлороуксусной кислотой (TCA). Затем культуры промывались один раз (1 мл) 95% этанолом и делались растворимыми 30-минутной выдержкой в термостате с 1 мл 0,1 н. NaOH. Ставший растворимым материал переносился к пузырькам, содержащим 10 мл ScintA (Packard), и радиоактивно определялся жидкой сцинтилляционной спектрометрией. Этот анализ показал способность производных бомбесина стимулировать поглощение тимидина клетками. EC50 рассчитывалось и составляло 0,48 нм, что показывало, что производные бомбесина этого изобретения являются сильными симуляторами поглощения тимидина.
Методы использования.
Производные пептидов согласно этому изобретению могут приниматься млекопитающим, особенно человеком, одним из традиционных способов (например, через рот, парентерно, через кожу или через слизистую) в составе с поддерживаемым высвобождением с использованием био-деградирующего, био-совместимого полимера или введением на месте (например, в случае производных противоракового бомбесина или соматостатина, в легкие) с использованием мицелл, гелей и липосом. Дозы обычно те же самые, что и используемые сейчас в случае терапевтических пептидов для людей.
Кроме того, производные пептидов этого изобретения пригодны для улучшенного лечения заболеваний, поддающихся лечению соответствующим немодифицированным пептидом. В частности, описанные выше производные соматостатина пригодны для лечения рака, акромегалии, панкреатита, вызванного травмой размножения, диабета, диабетической ретинопатии, следующей за рестенозом ангиопластии, СПИДа, нейрогенного воспаления, артерита и гастрокишечных проблем, включая диаррею.








Производное пептида, содержащее остаток соматостатина, или бомбезина, или их производного, фрагмента или аналога, и заместитель формулы I, II или III (значения радикалов см. в п.1 формулы изобретения) имеет более высокую и продленную биологическую активность по сравнению с немодифицированным соматостатином. 2 с. и 15 з.п. ф-лы, 4 табл., 1 ил.



где R0 - кислород;
R1 и R2 каждый независимо - H, (CH2)mOR6; CH2(OR7)CH2OR8, где R6 - H и R7 и R8 каждый независимо - H;
m = 1 - 5, целое число,
одно из R3 и R4 - (CH2)nR12, где R12 - CO, n = 1 - 5, целое число, а другое из R3 и R4 - H, (C1 - C6)гидроксиалкил;
соединение II
где R13 - R15 каждый независимо - H или (C2 - C4)ацил;
R16 - NH или отсутствует;
R17 - CO или отсутствует;
R18 - CO, SO2 или отсутствует;
m = 0 или 1;
n = 0 - 5, целое число;
соединение III
где R19 - H, OH, (C1 - C6)гидроксиалкил;
R20 - кислород или отсутствует;
R21 - (C1 - C6)алкил или отсутствует;
R22 - N или CH;
R23 - отсутствует;
R24 - N, CH, C;
R25 - отсутствует;
R26 - CH2, SO2 или отсутствует;
m = 0 - 5, целое число;
n = 0 - 5, целое число;
p = 0 - 5, целое число;
q = 0 - 5, целое число,
при этом остаток соматостатина, или бомбезина, или их производного, фрагмента или аналога присоединен к каждому из заместителей связью CO-N, CH2-N между заместителем и атомом азота N - окончания или боковой цепочки пептидного остатка.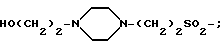

12. Производное по п.10, отличающееся тем, что содержит остаток соматостатина или его производного, фрагмента или аналога.
H-D-Phe-c[Cys-Tyr-D-Trp-Lys-Abu-Cys]-Thr-NH2,
H-D-Phe-c[Cys-Tyr-D-Trp-Lys-Thr-Cys]-Nal-NH2
или
H-D-Nal-c[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2.
или
16. Способ лечения рака у пациента, включающий в себя принятие пациентом терапевтического количества производного пептида, отличающийся тем, что в качестве производного пептида используют соединение по п.1.
| Способ получения производных соматостатина | 1974 |
|
SU586837A3 |
| RU 94021684 A1, 20.06.97 | |||
| Шланговое соединение | 0 |
|
SU88A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| US 4837303 A, 1989 | |||
| РОТОРНО-ДИСКОВЫЙ ЭКСТРАКТОР | 0 |
|
SU374089A1 |
| DE 3910667 A1, 1989. | |||
Авторы
Даты
1999-07-20—Публикация
1994-08-08—Подача