Изобретение относится к N-, N'-замещенным асимметричным имидодикарбонимидным диамидам, получаемым из гидроксиламинов, и к их производным и к способам их получения.
Родственные производные триазина (Onori, E. and Majori, G. Recent acquisitions on chemotherapy and chemoprophylaxis of malaria. Ann ist Super Sanita. 25:659-74)
(1989) плохо абсорбируются и, как было показано, менее эффективны, при оральном введении по сравнению с инъекцией, в излечении обезьян aotns, зараженных малярией. Родственные производные триазина приходится вводить с помощью инъекции для получения активности, сравнимой с активностью других известных антималярийных лекарств или превосходящих активность этих лекарств.
(Knight, D. J. and Peters, W. The antimalarial activity of N-benzylaxy dihydrotriazines. I. Ann. Tropical Med. Parasitol. 74:393-404 (1980). The antimalarial activity of N-benzyl-oxydihydrotriazines. IV. Ann. Trop. Med. Parasitol. 76: 9-14. Knight, D. J. and Willramson, P. (1982), U.S. Pat, 4.232.022, U.S. Pat. 4,179,562).
Кроме того, такие триазины, как сообщалось, плохо переносимы при даче их оральным путем (Knight, D.J. and Williamson, P. (1982) supra).
ДЕ-А 824942 на имя Империал Кемикал Индастриз раскрывает антималярийные арильные бигуаниды, в которых арильная группа соединена непосредственно с одним из бигуанидных азотов.
Предлагаются новые фармацевтически активные соединения формулы:
и все ее таутомеры, такие как, например:

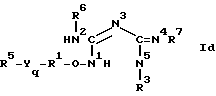
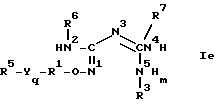
причем все они описаны общей формулой I.
Любая из этих формул, используемая здесь, должна рассматриваться как эквивалент ее и включает другие.
В формуле I:
R1 представляет собой замещенную или незамещенную двухвалентную алифатическую группу с 1-16 атомами углерода; в которой заместители являются моно- или поли- и выбраны из группы, состоящей из низшего алкила, арила или аралкила,
R3 выбран из группы, состоящей из той же группы значений, что и R5, и может также образовывать с азотом, к которому он присоединен, насыщенный гетероцикл с 4-8 атомами углерода,
R5 выбран из группы, состоящей из замещенного и незамещенного алкила с 1-10 атомами углерода, циклоалкила, гетероциклоалкила с 3-8 атомами углерода, моно- и поликарбоциклоарила с 4-7 атомами в кольце, в котором заместители являются моно или поли и выбраны из группы, состоящей из низшего алкила, низшего галоидалкила, циклоалкила с 3-8 атомами углерода, низшего алкенила, низшего алкинила, нитро-, низшего алкокси, низшего алкоксикарбонила, низшего алкилфенила, фенила, моно- и полигалоидфенила, фенокси, моно и полигалоидфенокси и галогена, при условии, однако, что такое замещение имеет место в моно- и поликарбоциклоариле с 4-7 атомами в кольце,
R6 и R7 могут быть одинаковыми или различными, когда R6 - водород, алканоил или алкоксиалканоил, и могут быть также образовывать с азотом, к которому они присоединены, насыщенный гетероцикл с 4-8 атомами углерода,
R7 может быть также выбран из группы, состоящей из той же группы значений, что и R5,
Y представляет собой кислород или серу,
m представляет собой 0 или 1,
q представляет собой 0 или 1, при условии, что, если не указано иное, приставка "алк" обозначает части молекулы, представляющие собой прямую цепь или разветвленную цепь, и термин "низший" обозначает 1-6 атомов углерода, а термин "алк" без приставок обозначает 1-24 атомов углерода, их фармацевтически приемлемые соли, аддитивные соли, гидраты указанных солей и аддитивных солей и их моно- и диацилпроизводные соединения.
Соединения в объеме настоящего изобретения имеют антимикробную антипаразитическую активность различного рода, включая антималярийную активность, и обеспечивают новую фармакологическую активностью, так как, в отличие от вышеупомянутых производных триазина, родительское соединение и его производные, описанные здесь, высоко биодоступны благодаря их способности легко абсорбироваться при оральном введении.
Раскрывается способ синтеза новых соединений согласно настоящему изобретению путем взаимодействия соответствующим образом замещенного гидроксиламина, тиомина или изостерического амина с замещенным дицианодиамидом в присутствии кислотного катализатора с образованием двузамещенного имидодикарбонимидного диамида с заместителями при N и N'. Эти продукты могут быть затем переведены в соль и далее подвергаться взаимодействию для получения дополнительных заместителей в бигуаниде.
Вышеупомянутые замещенные гидроксиламины могут быть синтезированы следующим образом: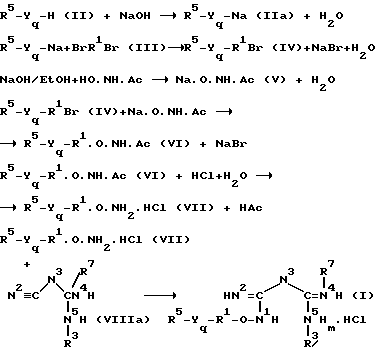
Вышеприведенный способ осуществим, когда Yq является кислородом, или серой и R7 является водородом, алканоилом или алкоксиалканоилом. Однако, когда R7 выбран из группы R5, желателен иной способ получения соединения (VII) и затем (I).

Также предлагаются способы защиты субъектов (подверженных нижеуказанным инфекциям) от инфекций, вызываемых организмами, выбранными из группы, состоящей из Plasmodium sp., Mycobacterium sp and Pneumocystis cacinii, которые предусматривают введение субъекту, подверженному инфекции при контакте его с такими организмами, профилактически эффективного количества соединения вышеуказанной формулы.
1. Также предлагаются способы снижения уровня инфекции у субъектов, страдающих от инфекций, вызванных организмом, выбранным из вышеуказанной группы, которые предусматривают введение таким субъектам эффективного количества соединения формулы I.
Предлагаются также профилактические и лечебные композиции для вышеуказанных целей, которые включают в себя профилактическое или эффективное для снижения инфекции количество соединения формулы I и фармацевтически приемлемый носитель. Такие композиции могут быть составлены для орального введения, причем при таком способе введения эти соединения и композиции хорошо абсорбируются, особенно в виде таблеток или капсул.
Предлагаются фармацевтически активные соединения формулы I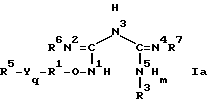
где R1 представляет собой замещенную или незамещенную двухвалентную алифатическую группу с 1-16 атомами углерода, предпочтительно низший алкил, такой как метил, этил, н-пропил, изо-пропил, изобутил, н-пентил, н-децил, или циклоалкил, такой как циклопентил, циклогексил, циклогептил. Заместители суть моно или поли и выбраны из группы, состоящей из низшего алкила, такого как метил, этил, н-пропил, изо-пропил, изобутил, н-пентил, н-децил, или циклоалкил, такого как циклопентил, циклогексил, циклогептил, арила, например, фенила, нафтила, тетрагидронафтила, инданила, инденила, бензофуранила и аралкила, такого как бензил и фенэтил,
R3 выбран из группы, состоящей из той же группы значений, что и R5 и, если это желательно, он может также образовывать с азотом, к которому он присоединен, насыщенный гетероцикл из 4-8 атомов углерода, такой как пирролидил, пиперидинил или пирролидинил,
R5 выбран из группы, состоящей из замещенного или незамещенного алкила с 1-10 атомами углерода, такого как метил, этил-, н-пропил, изо-пропил, изобутил, н-пентил, н-децил, или циклоалкила, такого как циклопентил, циклогексил, циклогептил, арила, предпочтительно фенила, нафтила, тетрагидронафтила, инданила, инденила, бензофуранила, бензопиранила, бифенилила, гетероциклоалкила, такого как тетрагидрофуран, пирролидинил, пиперидил и морфолинил, где заместители суть моно или поли и выбраны из группы, состоящей из низшего алкила, такого как метил, этил, -н-пропил, изо-пропил, изобутил, н-пентил, низшего галоидалкила, такого как трифторметил, или циклоалкила, такого как циклопентил, циклогексил или циклогептил, низшего алкенила, такого как этенил, -н-пропенил, изопропенил, изобутенил, н-пентенил, низшего алкинила, такого как этинил, н-пропинил, изо-пропинил, изобутинил, н-пентинил, нитро, низшего алкокси, такого как метокси, этокси, н-пропокси, изо-пропокси, изобутокси, н-пентокси, низшего алкоксикарбонила, такого как формилокси, ацетокси, пропионилокси и бутирилокси, низшего алкилфенила, такого как бензил, фенила, фенокси, моно и полигалоидфенила, моно- и полигалоидфенокси, где галоидгруппа представляет собой фтор, хлор или бром, которые могут также служить моно- и полизаместителями для вышеуказанных арильных частей молекулы.
R6 и R7 могут быть одинаковыми или различными и являются водородом или алканоилом, например, формилом, ацетилом, пропионилом и бутирилом. Если нужно, они могут также образовывать с азотом, к которому присоединены, насыщенный гетероцикл с 4-8 атомами углерода, такой как пирролино, пиперидино или пирролидино,
Y представляет собой кислород или серу,
m представляет собой 0 или 1,
q представляет собой 0 или 1,
фармацевтически приемлемые соли и аддитивные соли соединения и гидраты указанных солей и аддитивных солей.
Также предлагаются моно- и диацилпроизводные этих соединений, например алканоил- или аралканоилпроизводные, такие как ацетил- и бензоилпроизводные.
Соединения формулы I настоящего изобретения могут быть синтезированы рядом способов путями, из которых нижеследующие являются наиболее часто применяемыми и предпочтительными. В этом многостадийном способе некоторые промежуточные соединения могут быть коммерчески доступны, однако для полноты описания нижеследующее описание способа начинается с исходных материалов, которые легко можно приобрести.
В тех случаях, когда цель состоит в получении соединения где Y представляет собой кислород или серу и q равно 1, исходным материалом является алканол, фенол или меркаптан (II). Когда в качестве исходного материала применяют алканол, берется избыток алканола, и количество его, необходимое для реакции, обрабатывают одним эквивалентом раствора щелочного металла для образования соли щелочного металла в алканольном растворе.
В случае меркаптанов или фенолов, используется избыток водного раствора щелочи, например гидроксида натрия, которая образует соответствующую натриевую соль при температуре окружающей среды в течение нескольких минут. Затем добавляют избыток, предпочтительно 2-кратный избыток дигадоилалкана по отношению к рассчитанному количеству соли щелочного металла, причем положение галоидных групп определяется длиной части молекулы, обозначаемой R1. Смесь кипятят с обратным холодильником в течение прибл. от 1 до 4 часов. Добавляют еще избыток щелочи и реакционную смесь поддерживают при температуре от 50 до 70oC в течение прибл. 1/2 часа. Смесь охлаждают, нижний органический слой отделяют, промывают и перегоняют под пониженным давлением, получая воду, непрореагировавший дигалоидалкан и целевой R5 окси или тиоалкилгалоид (IV).
Ацетогидроксамовую кислоту превращают в соответствующий гидроксамат щелочного металла (V) добавлением алканольного, предпочтительно этанольного, раствора гидроксида щелочного металла, такого как гидроксид натрия или калия. Затем прибавляют окси или тиоалкилгалоид (IV), полученный как описано выше, и смесь кипятят с обратным холодильником, предпочтительно в течение от прибл. 4 до прибл. 8 часов, и охлаждают. Осажденную соль галоид щелочного металла удаляют фильтрацией, растворители удаляют под пониженным давлением, а остаток растворяют в полярном, смешивающемся с водой, органическом растворителе, предпочтительно в растворе ацетона, снова фильтруют и концентрируют под пониженным давлением, получая в результате соответствующий окси- или тиоалкилацетогидроксамат (VI).
Когда q равно 0, например, когда R5 - R1 представляет собой бензил, то соответствующее R5 - R1 галоид соединение (IV) может быть получено в промышленности, такое как бензилбромид, которое вводят в реакцию непосредственно с ацетогидроксаматом, как описано выше.
Ацетогидроксамат (VI) растворяют в алканоле, к которому добавляют избыток разбавленной минеральной кислоты, предпочтительно хлористоводородной кислоты, смесь кипятят с обратным холодильником в течение прибл. от 2 до прибл. 6, предпочтительно от 4 часов, растворители удаляют под пониженным давлением и остаток экстрагируют сухим диэтиловым эфиром. Растворитель затем удаляют под пониженным давлением, а остаток перекристаллизовывают из алканола, предпочтительно этанола или изопропанола, получая заданный алкилоксиамин гидрохлорид (VII).
Алкилоксиамингидрохлорид (VII) растворяют в алканоле и обрабатывают концентрированной водной хлористоводородной кислотой до тех пор, пока раствор не станет определенно кислым. Добавляют в избытке соответствующий омега-замещенный дициандиамид, например низший алкилдициандиамид (VIII). Смесь кипятят с обратным холодильником в течение от прибл. 2 до прибл. 6 часов, растворители удаляют выпариванием под пониженным давлением с получением желаемого гидрохлорида алкокси омега-замещенного иминодикарбонимидного диамида (I). Это масло, после обработки и растирания с безводным эфиром, дает твердый осадок, который может быть перекристаллизован, предпочтительно из этилацетата, как гидрат.
Когда реагент (VIII) представляет собой моно-омега-замещенный дициандиамид, не несущий ни одного заместителя на остающемся имино-азоте, тогда R7 в соединении (VIII) является водородом, и таким образом полученный продукт формулы I не будет иметь заместителей при азотах N2 и N4, то есть R6 и R7 будут водородом. Когда оба азота иминогрупп замещены, тогда R7 будет иным, нежели водород.
Когда нужно либо ввести одинаковые заместители у азотов N2 и N4, либо, если R7 отличен от водорода, ввести иной заместитель у азота N2, гидрохлоридгидрат (I) суспендируют в подходящем органическом растворителе, не смешивающемся с водой и инертном для реакции, предпочтительно в этилацетате, встряхивают с избытком водного раствора щелочи, предпочтительно водным раствором гидрокси натрия, отделяют органический слой, сушат и нагревают с обратным холодильником в течение от прибл. 1 до прибл. 4 часов с избытком подходящего ацилирующего агента, например ацетилхлоридом. После окончания реакции, летучие компоненты удаляют под пониженным давлением, получая заданное N2 - ацилированное соединение.
Как показано выше, когда R7 имеет значение, выбранное из группы R5, желателен иной путь синтеза. О методологии см. Curd, F.H.S. et al J. Chem. Sor. 1630-45 (1948) and Davidson, J.S., Chemistry and Industry, 1977-8 (1965).
К суспензии цианамида натрия в алканоле, например, этаноле, прибавляют R3 изотиоцианат (XXXI), получая осадок натриевой соли N-циано-N1-R3-тиомочевины (XXXII), который отфильтровывают, промывают алканолом. Добавляют при быстром перемешивании при температуре окружающей среды метилиодид. Продукт разделяют. Суспензию охлаждают на ледяной бане, твердые вещества отфильтровывают и промывают водой и сушат, получая N-циано-N1-R3-S-метилизотиомочевину (XXXIII).
Изотиомочевину (XXXIII) прибавляют к алканольному раствору R7 амина, и смесь нагревают в течение 4 часов в толстостенной склянке при температуре прибл. 50oC. Получающийся в результате прозрачный раствор постепенно разбавляют водой (75 см3) и продукт кристаллизуется, давая дициано - R3, R7 - диамид (XXXIV). Последний может быть затем введен в реакцию с гидроксиламин-гидрохлоридной солью (VIII), как описано ранее, с получением желаемого соединения (I).
Соединения согласно настоящему изобретению могут быть получены в форме моногидрогалоидных кислотно-аддитивных солей и/или сольватированного соединения, например, гидрохлоридгидрата или гидробромида. Однако, другие соли могут быть получены простой реакций основания с кислотой и могут быть полезны для модификации свойств продукта, таких как его токсичность, вкус, физическая форма или скорость выделения в тело. Например, соединения могут быть получены в форме пикрата, сахарината, ацетата, кислого малеата, кислого фталата, сукцината, фосфата, нитро-бензоата, стеарата, манделата, N-ацетилглицината, памоата, сульфоната, ди-сульфоната, циклогексилсульфамата, цитрата, тартрата или глюконата.
Устойчивые соли обычно получаются при соотношении одна молекула N,N'-полизамещенных имидодикарбонимидных диамидов на 1 или 2 молекулы одноосновной кислоты (или более чем одна молекула соединения 1 в случае многоосновных кислот), но возможность иметь основные группы в качестве заместителей в R5, например, означает, что в некоторых случаях могут быть соединены с двузамещенным имидодикарбонимидным диамидом и большие количества кислоты. Кроме того, вышеуказанные молекулы могут содержать различные гидратированные формы с молекулами воды или другим растворителем, включенным в молекулярную формулу устойчивой структурной единицы.
Присутствие иминобигуанидных азотов в молекуле создает возможность образования ацилпроизводных путем реакции с подходящими субстратами.
Раскрывается усовершенствованный способ профилактики и лечения инфекций, вызванных одним или более чем одним плазмодием, микобактериями, токсоплазмозными и пневмоцистозными организмами, и агентами, вызывающими нокардиозные инфекции. N, N'-замещенные асимметричные бигуаниды формулы I согласно настоящему изобретению и/или их соли и/или производные имеют противомалярийную и противобактериальную активность, а также эффективны против некоторых грибков, простейших, паразитов и вирусов. Кроме того, N'' и N'''-замещенные производные формулы I проявляют подобную же активность. В частности, эти N, N'-замещенные асимметричные бигуаниды и соли, а также их N'' и N''' замещенные производные проявляют активность против паразитов, включая плазмодии малярии, P. falciparum проявляют противомикробную активность против микобактерий, включая, но не ограничиваясь, этим M.avium infercellulare, M.avium complex, M. tuberculosis, M.leprae and Toxopiasma gondii и пневмоцистозные организмы, такие как P.carinii связанные (но не ограниченные ими), с пациентами с ослабленной иммунной системой. Кроме того, эти соединения имеют активность против нокардиозных инфекций. Эти соединения имеют активность против нокардиозных инфекций. Эти соединения могут также быть потенциированы в комбинации с сульфонамидами или сульфонами для улучшения биологического спектра и возможностей этих соединений формулы I.
Наши данные об использовании подтверждены дополнительными обширными исследованиями, проведенными на животных, при поддержке Министерства обороны США.
Мы нашли, что новые соединения согласно настоящему изобретению показывают высокие уровни эффективности при оральном введении, по сравнению с родственными производными триазина, о которых известно, что они плохо адсорбируются. В отличие от родственных производных триазина, этот новый ряд соединений не требует введения с помощью инъекции для проявления активности, сравнимой с другими известными противомалярийными лекарствами или превосходящей активность указанных лекарств.
Примеры биологической активности изобретения.
Биологическая активность против Plasmodium falciparum.
Метод испытания активности против малярийных паразитов человека описан подробно в: L.H. Schmidt, Am. J. Trop. Med. Sr Hygiene, 1978, 27: 718-737.
Подробные методы включают все аспекты лечения животных, инфекции и оценки эффективности лекарств.
Испытание проводится с помощью скрининга in vivo в системе, принятой как стандарт для идентификации эффективных антималярийных соединений в человеке. Тест-система использует ночных обезьян (Aotus, Trivergatus), родина которых Колумбия. Обезьян инфицируют различными отобранными штаммами малярии посредством внутривенной инокуляции 5•106 трофозоитов. Эти трофозоиты получают непосредственно из инфекций P.falciparum, выделенных из человека, и инфекционные организмы хорошо охарактеризовывают в отношении их ответа на лекарственную терапию. Система Aotus уникальна в том, что она делает возможным оценку малярии человека, вызванную falciparum. Лекарства вводятся обезьянам через желудочную трубку, и обычная схема исследования включает дачу ежедневных доз подопытным животным в течение семи дней. Активность определяют по очищению или уничтожению малярийной инфекции.
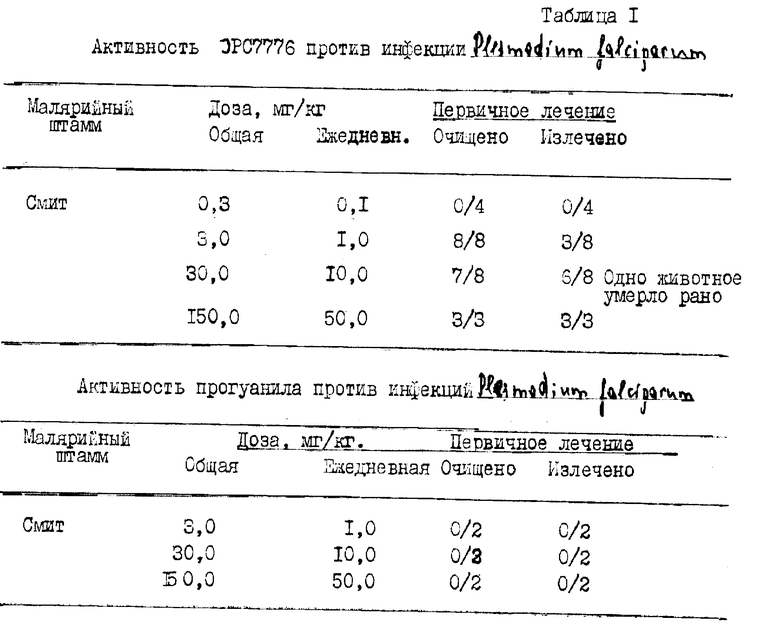
В таблице 1 (табл. 1 - 8 см. в конце описания), активность титульного соединения JPC7776, N-[3-(2,4,5-трихлоро-фенокси)пропокси]-N'-(1-метилэтил)- имидодикарбонимидного диамида, сравнивается с двумя известными антималярийными лекарствами и приводятся результаты сравнительных испытаний в весьма стойком к лекарствам Вьетнамском Смитовском штамме Plasmodia falciparum JPC7776 вызывал четкий ответ на дозу у 8/8 животных, которым вводили 3,0 мг/кг в день в течение трех дней, что указывает на очищение от паразитов (100%-ный ответ). Три из восьми подопытных животных были излечимы (37,5%). Более высокие дозы приводили к более высокому проценту излечения, составлявшему 75% и 100% соответственно при дозах 30,0 и 150,0 мг/кг. Сравнение с прогуанилом и циклогуанилом до 150 мг/кг в течение трех дней показало отсутствие активности (0% ответ).
Активность прогуанила против инфекций Plasmodium falciparum
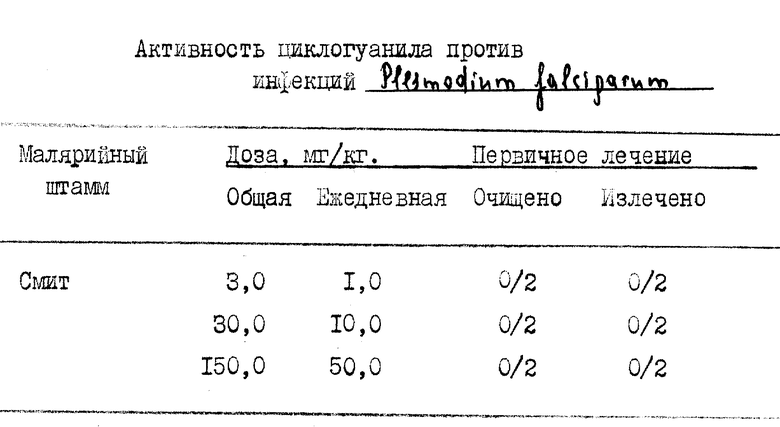
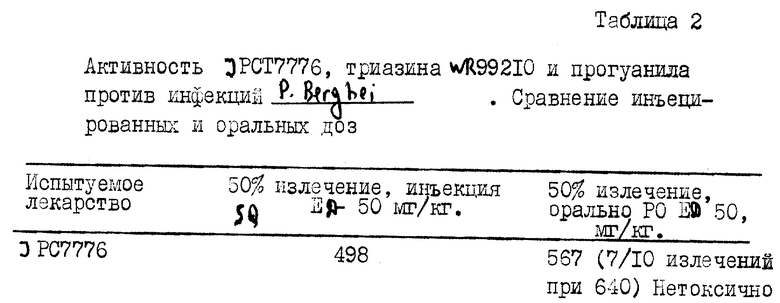
Проведены сравнительные испытания in vivo на мышах против Plеsmodium. Подтверждающие испытания, проведенные под эгидой Министерства обороны США, демонстрируют благоприятную оральную активность. Результаты демонстрируют превосходную биологическую доступность и эффективность JPC7776 при оральном способе введения по сравнению с соответствующим ему триазином WR99210 и противомалярийным прогуанилом. Эти данные в таблице 2 показывают количество извлечений и эффективную дозу, излечивающую 50% зараженных животных (ED-50), когда лекарства вводились в арахисовом масле подкожно (SQ) или когда вводились в качестве однократной оральной дозы (PO). Преждевременные смерти животных (раньше, чем через пять дней после заражения) рассматриваются как указания на токсичность. Таблица 2 приводит данные о пониженной токсичности JPC7776 в этом скрининг-тесте и превосходную оральную эффективность.
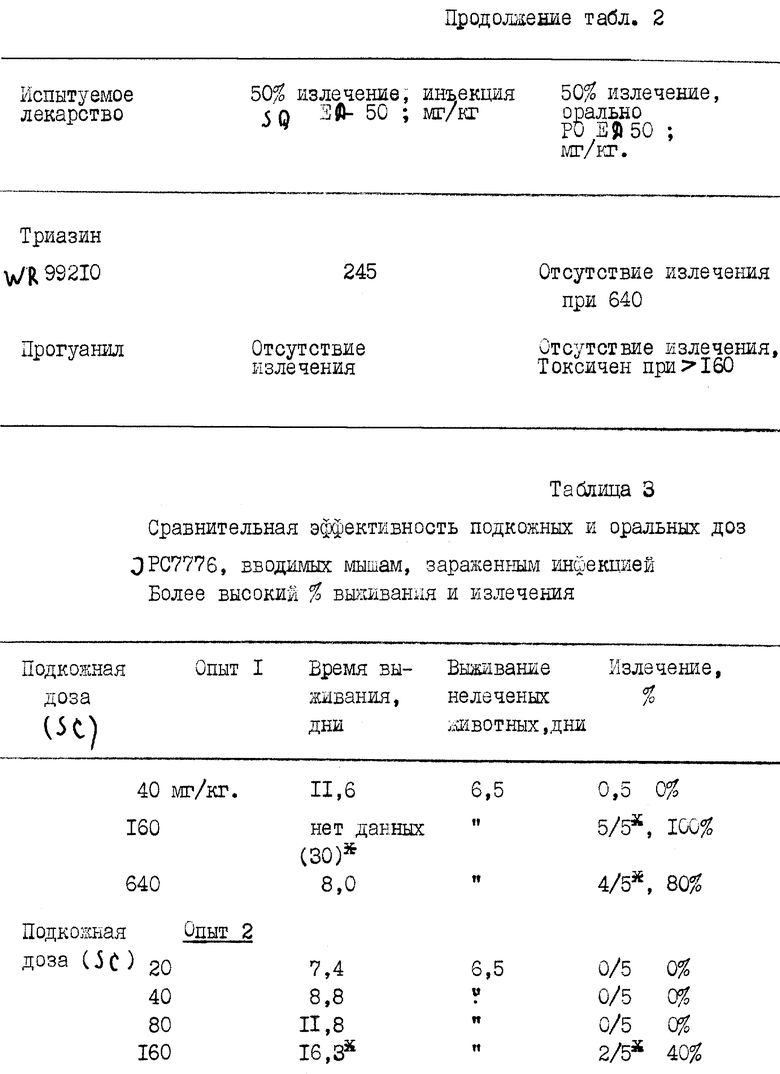
Также представлен (в таблице 3) второй широко признанный стандартный тест, демонстрирующий непосредственное сравнение подкожного (SQ) и орального (PO) введения доз P.Berghei мышам. Эти тестсистемы подробно описаны в публикациях L.Rone and D.S.Rane, 9th Int. Congr. Trop. Med. Malaria. (1973) 1: 281 (#406) and (2) T.S. Osdedne, P.B.Russell and L.Rane, J. Med. Chem. 1967, 10: 431.
Согласно этим методам, группы в 5 или 10 мышей инфицируют стандартным инокулятом индуцированной кровью инфекции P.berghei и лечат однократной подкожной дозой (9 нг/кг) испытуемого лекарства, суспендированного в арахисовом масле, или однократной оральной дозой испытуемого лекарства, суспендированного в гексаметилцеллюлозе и Tвeен (Tween). Животные затем наблюдаются в течение максимум тридцати дней. Контрольные животные обычно живут 6-7 дней. Чтобы лекарство считалось эффективным, подопытные животные должны прожить по меньшей мере вдвое дольше, чем нелеченые зараженные контрольные животные. Животные, которые проживут тридцать дней, рассматриваются как излеченные.
Таблица 4 представляет сравнительные данные по эффективности JPC7776 против различных штаммов малярии, испытанного in vitro с сульфонамидом или без него для определения преимуществ, если таковые есть, такого совместного введения с соединениями, являющимися предметом настоящего изобретения. Результаты, показанные ниже, измеренные in vitro в качестве дозы для ингибирования 50% роста (ID-50) малярийных паразитов в стандартной культуре (C.S.Genther and C.C.Smith, J. Med. Chem. 1977. 20: 237-W243). представлены в нанограммах на миллилитр (нг/мл). Эти данные показывают, что внутренне присущая активность JPC7776 возрастает от 4 до 19 раз (см. значения ID-50) благодаря сульфонамидам в присутствии определенных паразитов, устойчивых к лекарству.
Биологическая активность против Pneumocystis corinii.
Оценка лекарств по их активности против Pneumoсystis carinii проводится по широко признанной и хорошо определенной испытательной системе, разработанной и опубликованной Др. Уолтером Т. Хью (Walter T. Hugbes).
На нее широко ссылаются, и она представляет собой общепринятый метод, четко определенный в литературе относительно содержания животных, инфекций, протокола лечения и оценки эффективности по вскрытию и выживаемости. Описание методологии, описанной У. Хью и др. можно найти в: Antimicrob. Agents Chemother. 1988, 32: 623-625.
Согласно этому методу, иммунную систему крыс подавляли большими дозами глюкокортикостероидов, одновременно защищая их от бактериальной инфекции введением антибиотического тетрациклина. Стандартный метод оценки предусматривает подавление иммунной системы животных стероидами и введение различных доз испытуемых соединений в течение шести недель, за это время в незащищенных животных разовьется пневмоцистозную первичную ацилтическую пневмонию. Процент незаболевших животных представляет собой эффективность выбранной дозы испытуемого лекарства.
Когда животных подвергают иммунносуспрессии и лечению в соответствии с принятой методологией, обычно наблюдают, что у 75% или более испытуемых животных спонтанно развивается пневмоцистоз. Обычный метод вызвать пневмоцистоз в животных предусматривает введение 2 мг. дексаметазона и 50 мг тетрациклина гидрохлорида на литр питьевой воды. Испытуемые соединения подмешиваются в пищу. Положительное лечение обеспечивается контрольным соединением сульфаметоксазол-триметоприм (SMX/ТМР), которое вполне эффективно защищает животных от пневмоцистоза при дозах в 250 мг/кг МХ в комбинации с 50 мг/кг ТМР. Другим широко применяемым эффективным соединением является Дапсон при дозе 125 мг/кг. (Dapsone).
Таблица 5 демонстрирует эффективность JPC7776 в сравнении с теми известными активными методами лечения, которые применяются для лечения и предупреждения пневмоцистозных инфекций у человека.
JPC7776 эффективен на 100%, и также эффективен как Дапсон, который является рекомендуемым антипневмоцистозным лекарством для человека.
Активность против микобактериальных инфекций.
Испытание новых лекарств на активность против микобактериальных инфекций проводится in vitro и in vivo согласно хорошо разработанным лабораторным процедурам, которые широко опубликованы. Методы, используемые для испытания биологической активности против растущего Mycobacterium avium complex (MAC), Mycobacterium tuberculosis (MTB) and Mycobacterium Kanasii (MK) описаны Гонзалезом и др. : A.H.Gonzolez et al. in J.Antimicrob. Chemother. 1989, 24: 19-22; S. Majumder and M.H. Cynamon. Amer. Soc. for Microbiology Mtds, V-4, May 1992, abstract.
Активность in vitro определялась против клинических изолятов MAC, MTB и MK с использованием метода разбавления бульона. Микобактерии выращивались в течение нескольких дней в 7H10 бульона, pH 6,6, с 10%-ным обогащением по OADC и 0,05% Твин. 80. Последовательные двукратные разбавления антимикробных лекарств готовились в 7H10 бульоне при 128 мкг/мл и менее. Культуры, содержащие окончательную концентрацию прибл. от 2,5 • 104 до 6,3 • 105 KOE/мл, инкубировали на вращающемся встряхивателе при 37oC в течение 7 дней и снимались показания, при этом минимальная ингибирующая концентрация определялась как MIC при самой низкой концентрации без видимого помутнения. JPC7776 в этих опытах сравнивали с известными активными антимикробными лекарствами Прогуанилом (PG), Циклогуанилом (CG), Сульфаметазином (SM) и/или Дапсоном (DDS). Результаты рассматриваются как благоприятные при концентрациях ниже 64 мкг/мл и показаны в таблице 6. JPC7776 показал превосходство над другими лекарствами.
Фармацевтические композиции.
Настоящее изобретение предлагает также фармацевтические композиции, содержащие в качестве активного ингредиента соединение согласно настоящему изобретению вместе с фармацевтически приемлемым носителем.
Водорастворимость гидрохлорида родительского соединения и большинства других солей не очень велика, так что когда требуются растворы, часто приходится добавлять солюбилизирующие агенты в воду, выбирать неводные растворители или находить более растворимую соль или готовить очень разбавленные растворы.
Предпочтительны составы для орального введения, и настоящее изобретение имеет то преимущество над родственными продуктами, что соединения, предлагаемые им, легко поглощаются млекопитающимися на достаточном уровне, что делает соединения согласно настоящему изобретению орально активными в качестве терапевтических агентов. Составы для инъекций или орального применения основаны на достаточной растворимости, чтобы позволить терапевтическому агенту войти в раствор в желудке или во вспрыскиваемой среде. Лекарственные формы включают таблетки, пилюли, капсулы, мешочки, гранулы, порошки, жевательные резинки, суспензии, эмульсии и растворы: особенно предпочтительны для орального применения таблетки и капсулы во всех вариантах и стерильные растворы для инъекции или инфузии. Там, где это уместно или необходимо, составы могут включать разбавители, связующие агенты, диспергирующие агенты, поверхностно-активные вещества, смазывающие агенты, покрывающие материалы, ароматизирующие агенты, красящие агенты, составы с регулируемым выделением активного вещества, подсластители или любые другие фармацевтически приемлемые добавки, например, желатин, крахмальный глюколат натрия, лактозу, крахмал, тальк, стеарат магния, микрокристаллическую целлюлозу, Повидон, гидрогенизованные или ненасыщенные масла, полигликоли, сиропы или другие водные растворы.
В случае таблеток или капсул и т.п. композиции могут быть представлены в виде предварительно отмеренных единичных доз или в упаковках лекарственных доз для многократного приема, из которых может отбираться подходящая единичная доза.
Формой, применимой для инъекций, может быть водный или неводный раствор, суспензия или эмульсия в фармацевтически приемлемой жидкости, например, стериальной апирогенной воде или парентерально приемлемых маслах или смеси жидкостей, которые могут содержать бактериостатические агенты, антиоксиданты или другие консерванты и стабилизаторы, буферные смеси (предпочтительно, но не ограничиваясь этим, в физиологических пределах pH от 6,5 до 7,7), растворенные вещества для придания раствору изотоничности с кровью, загустители, суспендирующие агенты или другие фармацевтически приемлемые добавки.
Такие формы будут представлены в виде единичной дозы, такой как ампулы или одноразовые устройства для инъекций, или в виде форм для многократных доз, таким как бутылочка, из которой может отбираться подходящая доза, или в твердом виде или в виде концентрата, который может быть использован для быстрого приготовления композиции для инъекции. Все составы для инъекции предпочтительно стерильны и апирогенны. Суппозитории, содержащие соединение, также содержат подходящие носители, например масло какао-бобов, полигликоли или другие носители, известные в современной практике.
Помимо стандартных фармацевтических добавок в рецептуру соединения могут быть включены другие терапевтические агенты, в частности другие антималярийные средства и дезинфектанты.
Предпочтительный диапазон дозировок составляет от 0,5 до 10 мг/кг/день. Диапазон довольно обширен, потому что врач сам должен решать, является ли дозировка профилактической, и, если она введена инфицированному субъекту, каков уровень инфекции. Если лекарство дается в таблетках, то таблетки могут содержать от 25 до 250 мг активного материала.
Пример 1.
N-[3-(2,4,5-трихлорфенокси)пропокси] -N'-(1-метилэтил)- имидодикабонимидный диамид гидрохлорид (XV)
Смесь 39,5 г (0,20 моля) 2,4,5-трихлорфенола и 33 мл 25%-ного водного раствора гидроксида натрия объединяют и перемешивают при температуре окружающей среды в течение 15 минут, в течение которых добавляют 80 г (40,7 мл, 0,4 моля) 1,3 дибромпропана. Реакционную смесь кипятят с обратным холодильником в течение 2 часов, в течение которых добавляют дополнительно 51 мл 14-процентного водного раствора гидроксида натрия, и реакционную смесь поддерживают при 50-70oC в течение 30 минут. После охлаждения нижний слой отделяют и промывают пять раз водой. Остаточный органический слой перегоняют при 1 мм. рт.ст. получая различные фракции - дистилляционную воду и дибромпропан при 30-40oC и продукт, который перегоняют в температурном интервале от 120 до 157oC. Было собрано 5 г бесцветного масла, которое затвердевает при стоянии, давая 70%-ный выход 3-(2,4,5-трихлорфенокси)пропилбромида (XII).
Ацетогидроксамовую кислоту (8,5 г, 0,13 моля) прибавляют к 110 мл этанольного раствора гидроксида натрия (4,0 г, 0,1 моля). Прибавляют 3-(2,4,5-трихлорфенокси)пропилбромида (XII) (31,8 г, 0,1 моля) и смесь кипятят с обратным холодильником в течение 6 часов и охлаждают до комнатной температуры. Раствор фильтруют и выпаривают, остаток растворяют в 100 мл ацетона и раствор фильтруют и концентрируют, получая 16,0 г (51%) 3-(2,4,5-трихлорфенокси)пропилацетогидроксамата (XIII), т.пл. 102-104oC.
Ацетогидроксамат (XIII) (31,3 г, 0,1 моля) растворяют в 120 мл метанола. Прибавляют хлористоводородную кислоту (30 мл 12%-ного раствора) и смесь кипятят с обратным холодильником в течение 4 часов. Остаток выпаривают досуха под вакуумом, промывают сухим диэтиловым эфиром и перекристаллизовывают из изопропилового спирта (90 мл), получая (15,5 г 58,7%) 3-(2,4,5-трихлорфенокси)пропилоксиамина гидрохлоридам (XIV), т.пл. 158-168oC.
Гидроксиламин гидрохлорид (XIV) (10 г, 0,0267 моля) в 160 мл этанола обрабатывают 6 н. водной HCl, пока раствор не становился кислым. Прибавляют изопропил-дипиано-диамид (4,4 г, 0,0347 моля) и смесь кипятят с обратным холодильником в течение 4 часов, в течение которых растворитель испаряется. Полученный твердый материал растворяют в воде и этилацетате и образовавшееся масло обрабатывают безводным эфиром, получая твердый осадок, который отфильтровывают, промывают эфиром и сушат. Полученное в результате твердое вещество, перекристаллизованное из этилацетата, после очистки на активированном угле, дает 2,0 грамм титульного соединения (XV) в виде моногидрата с т.пл. 100oC.
В соответствии с вышеприведенной процедурой, но там, где вместо 1,3-дибромпропана используют метилендибромид, 1,2-дибромэтан, 1,4-дибромбутан или 1,5-дибромпентан. получают соответственно метокси-, этокси-, бутокси- или пентокси-аналог.
В соответствии с вышеприведенной процедурой, но там, где вместо 1,3-дибромпропана используют 1,2-дибромпропан, 1,3-дибром-2-метоксипропан, 1,4-дибром-2-этоксибутан или 1,5-дибром-3-этоксипентан, получают соответственно 2-метилэтиловый, 2-метоксипропокси-, 2-этоксибутокси- или 3-этоксипентокси-аналог.
Пример 2.
N-[3-(2,5-дихлортиофенокси)пропокси] -N'-(1-метилэтил)- имидодикарбонимидный диамид гидрохлорид (XVII)
Подобно синтезу (XV) 2,5-дихлортиофенол (35,8 г, 0,2 моля) обрабатывают гидроксидом натрия (40 мл, 20%-ного водного раствора) и затем объединяют с 1,3-дибромпропаном (160 г, 0,8 моля) и кипятят с обратным холодильником в течение 4 часов. Смесь охлаждают, водный слой отделяют и нейтрализуют 20%-ным раствором гидроксида натрия, а нижний слой промывают пять раз водой и перегоняют при 1 мм. рт.ст. Основную фракцию собирают в интервале температур от 130 до 145oC в виде бесцветного масла (50 г, 84%) 2,5-дихлортиофеноксипропилбромида (XVI), который подвергают дальнейшему взаимодействию с ацетогидроксамовой кислотой, как описано ранее в примере 1, и гидролизуют для получения 3-(2,5-дихлортиофенокси)пропилоксиамина гидрохлорида (XVII), который затем подвергают реакции с изопропилдицианодиамидом, как описано ранее в примере 1, получая титульное соединение (XVIII).
В соответствии с вышеприведенной методикой, но там, где вместо 2,5-дихлортиофенола используют н-пропилмеркаптан, циклогексилмеркаптан и 3-тетрагидропиранол, получают соответствующий N-3-(1-пропилтио-, циклогексилтио- и N-3-тетрагидропиранилокси)пропилокси-N'-(1-метилэтил)- имидодикарбонимидный диамид гидрохлорид.
Пример 3.
N-3-(4-хлортиофенокси)пропилокси-N'-(1-метилэтил)- имидодикарбонидный диамид гидрохлорид (XXII)
Подобно синтезу соединения (XV) 4-хлортиофенол (28,9 г, 0,2 моля) обрабатывают гидроксидом натрия (40 мл 20%-ного водного раствора) и затем объединяют с 1,3-дибромпропаном (160 г, 0,8 моля) и кипятят с обратным холодильником в течение 4 часов. Смесь охлаждают, водный слой отделяют и нейтрализуют 20%-ным раствором гидроксида натрия, а нижний слой промывают пять раз водой и перегоняют при 1 мм. рт.ст.
Основную фракцию собирают в температурном интервале от 120 до 130oC в виде бесцветного масла (47,5 г, 90%), которое кристаллизуется при стоянии, образуя 4-хлортиофеноксипропилбромид (XIX), который затем подвергают дальнейшему взаимодействию с ацетогидроксамовой кислотой, как описано ранее в примере 1, и гидролизуют с получением 3-(4-хлортио-фенокси)-пропилоксиамина гидрохлорида (XX). Последний в свою очередь вводят в реакцию с изопропилдицианодиамидом, как описано в примере 1, с получением титульного соединения (XXI).
В соответствии с вышеприведенной процедурой, но там, где вместо изопропилдицианодиамида используют N''-фенил-N-изопропилдицианодиамид или другой N''-заместитель, такой как метил, этил или фенилметил, получают соответствующий N-3-(4-хлортиофенокси)пропокси N'''-фенил или метил, этил или фенилэтил, - N'-(1-метилэтил)имидодикарбоимидный диамид гидрохлорид.
Если желательно получить N'',N'''-диалканоил или соответствующие моноалканоильные производные вышеуказанных ненасыщенных производных в формуле I, последние обрабатывают таким же образом, как указано в примере 4 ниже, с тем чтобы соответствующее молярное соотношение 1:1 хлорангидрида кислоты или ангидрида для монозамещенных или молярное соотношение 2:1 для дизамещенных производных обеспечило бы получение продукта.
Пример 4.
N''-ацетокси-N-3-(2,4,5-трихлортиофенокси)пропокси] -N'-(1-метилэтил)имидодикарбонимидный диамид гидрохлорид (XXII)
N-[2-(2,4,5-трихлорфенокси)пропокси] -N'-(1-метилэтил)- имидодикарбонимидный диамид гидрохлорид гидрат (XV) (1,0 г, 0,002 моля) суспендируют в этилацетате (20 мл) и встряхивают с 0,1 мл 25%-ного водного раствора гидроксида натрия. Органический слой отделяют и сушат (сульфат магния), добавляют 0,1 мл ацетилхлорида и смесь нагревают в течение 2 часов. В последующем смесь концентрируют с получением 0,5 грамма (47%) титульного соединения (XXII) в виде белых кристаллов, т.пл. 160-170oC.
Пример 5.
N-[3-(2,4,5-трихлортиофенокси)этокси]-N'- (1-метилэтил)имидодикарбонимидный диамид гидрохлорид (XXVI)
Смесь 39,5 г (0,20 моля) 2,4,5-трихлорфенола растворяют в 40 мл 20%-ного водного раствора гидроксида натрия и по каплям прибавляют в течение 1 часа к дибромэтану (85,8 мл, 1 моль) нагреваемому с обратным холодильником. Смесь кипятят с обратным холодильником 2 часа и оставляют охлаждаться до комнатной температуры. После охлаждения нижний слой отделяют и промывают четыре раза водой. Оставшийся органический слой перегоняют при 1 мм. рт.ст. с получением основной фракции в температурном интервале от 145 до 155oC в виде бесцветного масла (51,4 г, 85%), которое было 2-(2,4,5-трихлорфенокси)-этилбромид (XXIII),
Трихлорфеноксиэтилбромид (XXIII) (30,4 г, 0,1 моля) прибавляют к ацето-гидроксамовой кислоте (8,5 г, 0,13 моля) в 110 мл этанольного раствора гидроксида натрия (4,0 г, 0,1 моля), как описано выше в примере 1, и смесь кипятят с обратным холодильником в течение 6 часов, охлаждают до комнатной температуры, фильтруют, этанол выпаривают и остаток растворяют в ацетоне (100 мл), раствор фильтруют и концентрируют с получением 19,2 г (68%) 2-(2,4,5-трихлорфенокси)этилацетогидроксамата (XXIV). т.пл. 160-162oC.
Ацетогидроксамат (XXIV) гидролизуют до 2-(2,4,5-трихлорфенокси)этоксиамина гидрохлористого (XXV), как описано для соответствующего пропилацето-гидроксамата (XIII). Этоксамин гидрохлорид подвергают реакции с изопропилдицианодиамидом, как описано ранее в примере 1, с получением N-[2-(2,4,5-трихлорфенокси)этокси]-N'-(1-метилэтил)имидокарбонимидного диамида гидрохлорида (XXVI).
Пример 6.
N-(2,4,5-трихлорбензокси)-N'-(1-метилэтил)имидокарбонимидный диамид гидрохлорид (XXX)
2,4,5-Трихлорбензилбромид (XXVII) (16,1 г, 0,1 моля) прибавляют к ацетогидроксамовой кислоте (8,5 г, 0,13 моля) в 110 мл этанольного раствора гидроксида натрия (4,0 г, 0,1 моля), как описано ранее в примере 1, и смесь кипятят с обратным холодильником в течение 6 часов, охлаждают до комнатной температуры и фильтруют. Этанол выпаривают, а остаток растворяют в ацетоне (100 мл), раствор фильтруют и концентрируют, получая 2-(2,4,5-трихлорбензи)ацетогидроксамат (XXVIII).
Ацетогидроксамат (XXVIII) гидролизуют до 2,4,5-трихлорбензоксиамина гидрохлорида (XXIX), как описано для соответствующего пропилацетогидроксамата (XIII). Бензоксиамин гидрохлорид (XXIX) вводят в реакцию с изопропил-дициано-диамидом, как описано ранее в примере 1, с получением -N-(2,4,5-трихлорбензокси)-N'-(1-метилэтил)имидодикарбонимидного диамида гидрохлорида (XXX).
Пример 7.
N-3-(2,4,5-трихлорфенокси)пропокси-N'- (П-хлорфенил)-N''-метил-имидодикарбонимидный диамид (XXVa).
п-Хлорфенилизотиоцианат (XXXIa) (50,7 г) прибавляют при перемешивании к суспензии цианамида натрия (19,2 г) в этаноле (30 мл), который медленно растворяется и осаждает натриевую соль N-циано-N'-п-хлорфенилтиомочевины (XXXIIa), которую отфильтровывают, промывают этанолом и сушат, получая 36,2 г, которые суспендируют в 200 мл этанола и объединяют с 37,6 г метилиодида при быстром перемешивании при комнатной температуре. При выделении тепла продукт отделяется. Суспензию охлаждают в ледяной бане, твердые частицы отфильтровывают, промывают водой и сушат, получая N-циано-N'-п-хлорфенил-S-метилизотиомочевину (XXXIIIa).
В соответствии с вышеприведенной методикой, но там, где вместо п-хлорфенилизотиоцианата используют соответствующее метильное, этильное, изо-пропильное, пропильное и бензильное производное, получают соответственно N-циано-N'-метил-, этил-изо-пропил-, пропил- и бензил-S-метилизотиомочевину.
S-метилизотиомочевину (XXXIIIa), приготовленную, как указано выше, прибавляют к этанольному раствору метиламина (79,4 мл, содержащие 4,2 г метиламина) и смесь нагревают 4 часа в толстостенной склянке при 50oC. Получающийся в результате прозрачный раствор постепенно разбавляют водой (75 см3) и продукт выкристаллизовывается, его отфильтровывают и получают желаемый дициандиамид (XXXIVa).
В соответствии с вышеприведенной методикой, но там, где вместо метиламина используют соответствующий фенил-, этил-, изо-пропил-, пропил- и бензиламин, получают соответственно дициан-N'-фенил-, этил-, изо-пропил-, пропил- и бензилдиамид.
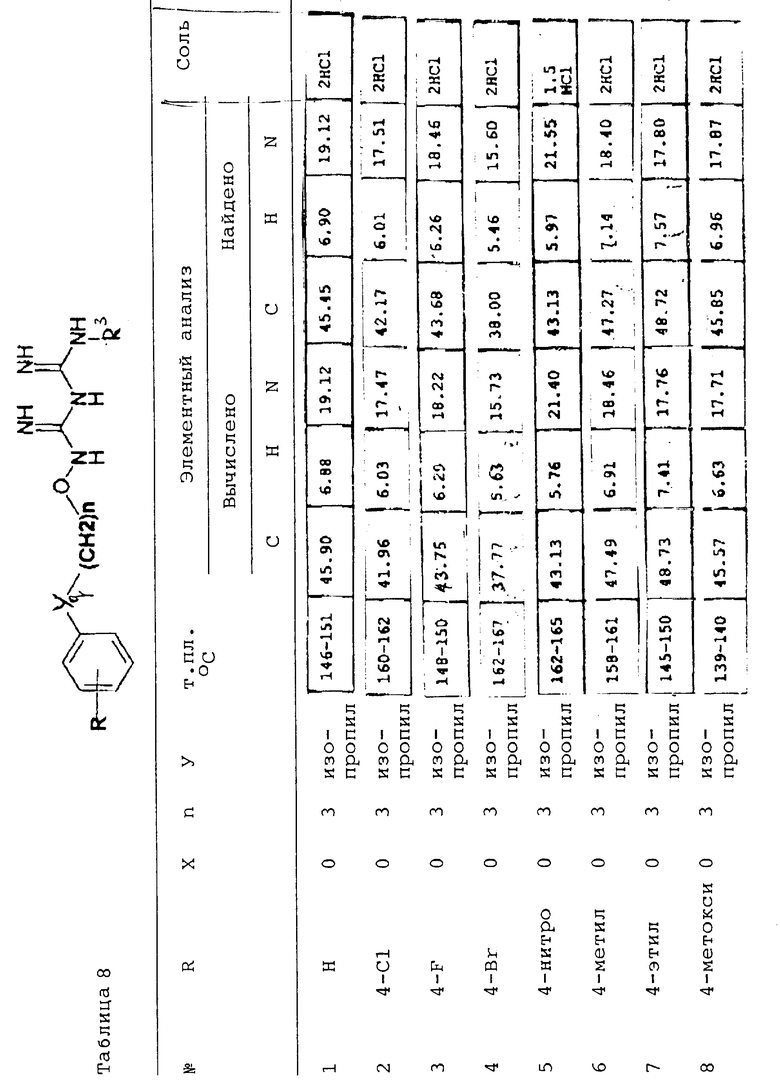
Дицианодиамид (XXXIVa) затем подвергают реакцию с N-3-(2,4,5-трихлорфенокси)пропоксиамином гидрохлоридом (XIV), как описано ранее в примере 1, получая титульное соединение. Характеристики других полученных соединений представлены в таблице 8.
Пример 8.
Фармацевтическая композиция.
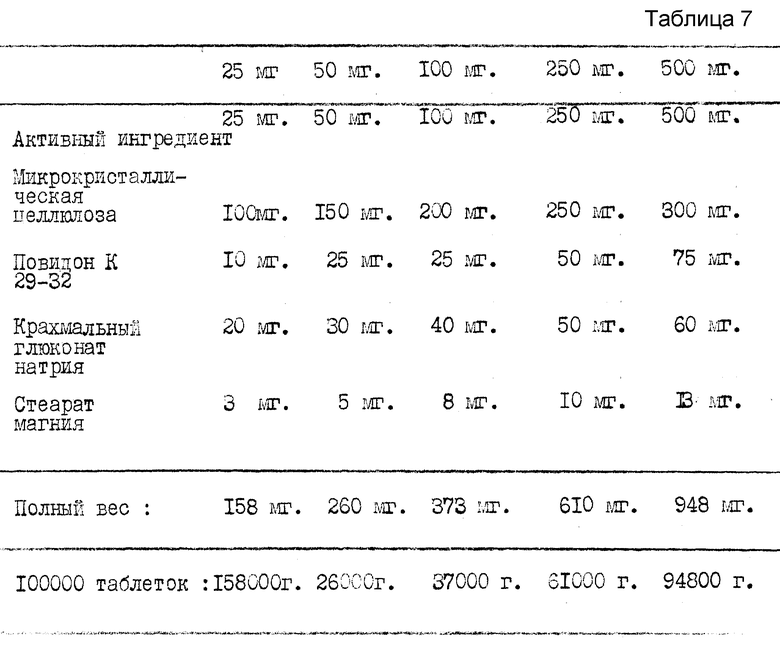
Таблетки N-[3-(1,4,5-трихлорфенокси)пропокси]-N'-(1,3- метилэтил)имидодикарбонимидного диамида гидрохлорида гидрата (см. табл. 7).
Одна таблетка содержит 25 мг - 500 мг активного ингредиента, в зависимости от того, на какой конкретно организм производится воздействие, из-за различной чувствительности болезнетворного микроба.
Рецептура разработана для производства 100000 таблеток (15,8 - 94,8 кг). Таблетки будут покрыты гидроксипропилметилцеллюлозой, красящим веществом, диоксидом титана, полиэтиленгликолем 6000 и карнаубским воском. Вес покрытия составит приблизительно 2-5% от веса таблетки.







Описываются новые N, N' - замещенные имидокарбонимидные диамиды общей формулы I, в которой R1 является двухвалентной незамещенной низшей алифатической группой; R3 является С1-С10-алкилом, который замещен низшим алкилом, или фенилом, который замещен галогеном; R5 является фенилом или бензилом, который может быть моно- или поли-замещен галогеном; нитрогруппой, низшим алкилом, низшей алкоксигруппой; или нафтилом; R6 является водородом; R7 является водородом, С1-С10 - алкилом, алканоилом; Y является кислородом или серой; q равно l; m равно 1, их фармацевтически приемлемые аддитивные соли или гидраты указанных солей. Вышеуказанные соединения проявляют антипаразитическую и антимикробную активность. Описывается профилактическая и композиция для снижения уровня инфекций у пациентов на основе соединений формулы I. 3 с. и 18 з.п.ф-лы, 8 табл.

в которой R1 является двухвалентной незамещенной низшей алифатической группой;
R3 является C1-C10-алкилом, который замещен низшим алкилом, или фенилом, который замещен галогеном;
R5 является фенилом или бензилом, который может быть моно- или поли-замещен галогеном, нитрогруппой, низшим алкилом, низшей алкоксигруппой; или нафтилом;
R6 является водородом;
R7 является водородом, C1-C10 - алкилом, алканоилом;
Y является кислородом или серой;
q равно 1;
m равно 1,
их фармацевтически приемлемые аддитивные соли или гидраты указанных солей.
в которой ⊘ представляет собой фенил;
n является целым числом от 1 до 4;
R3 является изопропилом,
его таутомеры, нетоксичная кислотно-аддитивная соль.
| SU 4232022 А, 1980 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1985, ч.2, с.с.210-211.DE 1957769 А, 1970 | |||
| US 4179562 А, 1979 | |||
| Способ получения замещенных бигуанидов | 1972 |
|
SU535903A3 |
Авторы
Даты
1999-07-27—Публикация
1993-01-19—Подача