Область техники
Изобретение относится к новым производным индола и их фармацевтически приемлемым солям, которые являются полезными в качестве лекарственных средств.
Предпосылки изобретения
До настоящего времени, например, тимололмалеат и изопропилунопростон являются известными как соединения, которые используются в качестве агентов для снижения внутриглазного давления.
Недавно разработан в качестве средств для лечения глаукомы гидрохлорид буназозина, который оказывает блокирующее действие на α1-адренорецепторы (называемое далее как α1-блокирующее действие), совершенно отличное от действия вышеуказанных соединений, и привлекает внимание общественности.
Однако гидрохлорид буназозина прежде всего разработан в качестве агента для лечения гипертензии. Следовательно, гидрохлорид буназозина оказывает сильное действие на кровяное давление, и полагают, что он может вызывать побочные эффекты, такие как гипотензия и ортостатическая гипотензия.
Обычно большинство средств, предназначенных для снижения внутриглазного давления, применяют местно в виде глазных капель. Даже в этом случае активное вещество распределяется кровотоком по всему организму и оказывает системное действие. Поэтому желательно свести до минимума возможное системное побочное действие даже при местном применении.
Соединения, которые абсорбируются в глазах сразу же после применения и действуют в течение продолжительного времени, являются наиболее предпочтительными, чтобы действовать как можно более местно.
Поэтому соединения, которые оказывают сильное снижающее внутриглазное давление действие с меньшей вероятностью возникновения побочных эффектов, таких как гипотензия и ортостатическая гипотензия, быстро абсорбируются в глазах после введения и действуют в течение длительного периода, больше всего рекомендуются в качестве агентов для снижения внутриглазного давления.
Описание изобретения
Настоящее изобретение относится к производному индола общей формулы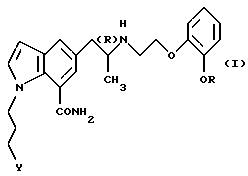
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу при условии, что Y обозначает пивалоилоксигруппу, когда R является 2,2,2-трифторэтильной группой, и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или к его фармацевтически приемлемым солям.
Настоящее изобретение относится к фармацевтической композиции, включающей производное индола общей формулы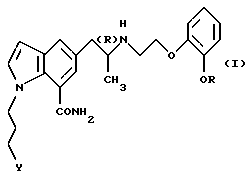
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу при условии, что Y обозначает пивалоилоксигруппу, когда R является 2,2,2-трифторэтильной группой, и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.
Настоящее изобретение относится к средству для снижения внутриглазного давления, которое включает в качестве активного ингредиента производное индола общей формулы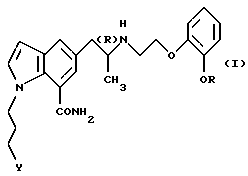
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.
Настоящее изобретение относится к средству для предотвращения или лечения глаукомы или внутриглазной гипертензии, которое включает в качестве активного ингредиента производное индола общей формулы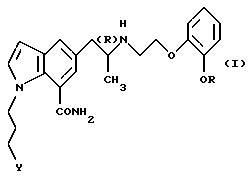
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.
Настоящее изобретение относится к способу предотвращения или лечения глаукомы или внутриглазной гипертензии, который включает введение терапевтически эффективного количества производного индола общей формулы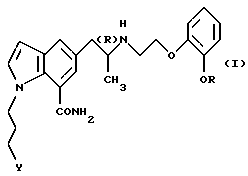
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли.
Настоящее изобретение относится к применению производного индола общей формулы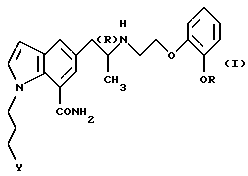
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли для производства фармацевтической композиции для предотвращения или лечения глаукомы или внутриглазной гипертензии.
Настоящее изобретение относится к применению производного индола общей формулы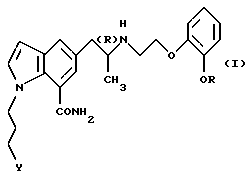
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли в качестве средства для предотвращения или лечения глаукомы или внутриглазной гипертензии.
Кроме того, настоящее изобретение относится к способу получения фармацевтической композиции для предотвращения или лечения глаукомы или внутриглазной гипертензии, характеризующемуся использованием в качестве неотъемлемого составляющего указанной фармацевтической композиции производного индола общей формулы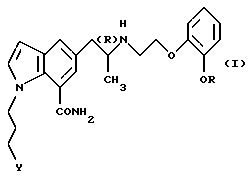
где R обозначает этильную группу или 2,2,2-трифторэтильную группу; Y обозначает гидроксигруппу или пивалоилоксигруппу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли.
Наилучший способ осуществления изобретения
Авторы настоящего изобретения провели исследования с целью поиска лекарственных средств, которые обладают сильным и продолжительным α1-блокирующим действием с меньшими побочными эффектами, такими как гипотензия и ортостатическая гипотензия, и характеризуются высокой способностью проникать в глаза. В результате было найдено, что (R)-1-(3-гидроксипропил)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил]амино]пропил]-1Н-индол-7-карбоксиамид (называемый далее соединением А), одно из производных индола, которые ранее разрабатывались в качестве средств для лечения дизурии, оказывающих избирательное супрессивное действие на сокращения мочеиспускательного канала и в меньшей степени влияющих на кровяное давление (опубликованная заявка на патент Японии (Kokai) Hei 7-330726), и гидрохлорид (R)-5-[2-[[2-(2-этоксифенокси)-этил] амино]пропил]-1-(3-гидроксипропил)-1Н-индол-7-карбоксамида (называемого далее соединением В) оказывают чрезвычайно сильное α1-блокирующее действие, которое в 70 раз сильнее, чем гидрохлорид буназозина, при менее выраженном проявлении побочных эффектов, таких как гипотензия и ортостатическая гипотензия, и ожидается, что эти соединения действуют в течение длительного периода вследствие низкой скорости экскреции после проникновения в глаза и являются полезными в качестве предпочтительных средств для снижения внутриглазного давления.
Кроме того, поскольку соединения А и В плохо проникают через мембраны, такие как роговица, авторы настоящего изобретения провели исследования, чтобы найти производные, которые обладают высокой способностью проникать через мембрану и быстро превращаются после проникновения в плохо проницаемые для мембраны соединения А или В. В результате найдено, что сложноэфирные производные пиваловой кислоты общей формулы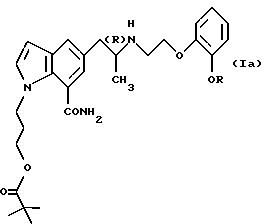
где R обозначает этильную группу или 2,2,2-трифторэтильную группу и атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
обладают исключительно высокой способностью проникать через мембрану и после проникновения быстро превращаются под действием гидролазы в соединения А или В, плохо проникающие через мембрану, и являются весьма стабильными в водном растворе, который имеет обычную форму глазных капель, что и образует основу настоящего изобретения.
А именно, авторы настоящего изобретения обнаружили, что соединения А и В оказывают сильное α1-блокирующее действие и являются предпочтительными соединениями в качестве средств для снижения внутриглазного давления. Однако эти соединения плохо проникают через роговицу, и их концентрация во внутриглазной жидкости является довольно низкой, когда эти соединения применяются местно в виде глазных капель. Поэтому авторы настоящего изобретения провели обширные исследования, чтобы найти способ получить полную концентрацию лекарственного средства во внутриглазной жидкости даже при применении в виде глазных капель.
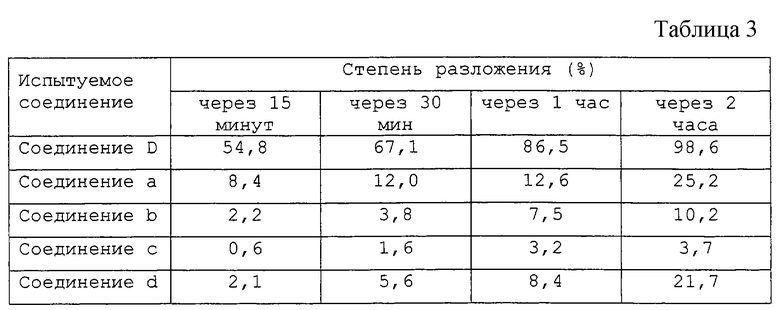
Чтобы найти производное соединений А или В, которые легко превращаются в соединения А или В после проникновения через роговицу или во внутриглазную жидкость и способны быстро оказывать лечебное действие, авторы настоящего изобретения превращали соединения А или В в различные их производные и оценивали способность их расщепления эндогенной гидролазой с помощью измерения степени конверсии их в соединения А или В в крови с течением времени. В результате было найдено, например, что степень конверсии некоторых сложноэфирных производных соединения А в соединение А в крови спустя 30 минут является крайне низкой, составляя соответственно около 12% для соответствующего производного 2-этилбутирата, около 4% для соответствующего производного 2,2-диметилвалерата, около 2% для соответствующего производного α,α-диметилфенилацетата и около 6% для соответствующего производного 2,2-диметилбутирата. При этом соответствующее пивалатное производное превращается в соединение А в количестве около 67% через 30 минут и почти полностью через 2 часа. Таким образом, авторы настоящего изобретения нашли, что пивалатные производные общей формулы (Iа) согласно настоящему изобретению отличаются от других карбоксилатных производных и являются специфическими соединениями, которые очень легко превращаются в соединения А или В в роговице или внутриглазной жидкости под действием эндогенной гидролазы.
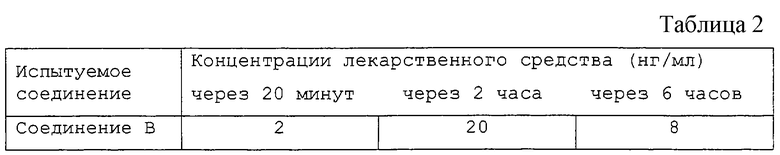
Для определения степени проникновения через роговицу данного пивалатного производного авторы настоящего изобретения измеряли концентрацию лекарственного средства во внутриглазной жидкости в зависимости от времени после закапывания в глаза кролика. Например, при закапывании в глаза пивалатного производного соединения В концентрация соединения В во внутриглазной жидкости была примерно в 70 раз выше через 20 минут и примерно в 27 раз выше через 2 часа, чем в случае закапывания гидрохлорида соединения В. Таким образом, пивалатные соединения общей формулы (Iа) настоящего изобретения являются превосходными соединениями по способности проникновения через роговицу и продолжительности действия.
Кроме того, в вышеописанном эксперименте было установлено, что пивалатное производное соединения В быстро превращается в соединение В после проникновения через роговицу или во внутриглазную жидкость и не может быть обнаружено во внутриглазной жидкости даже через 20 минут. Таким образом, пивалатные производные общей формулы (Iа) настоящего изобретения легко проникают через роговицу и быстро превращаются в соединения А или В. Поэтому они являются весьма предпочтительными соединениями, обеспечивающими быстрое и надежное действие соединения А или В. С помощью эксперимента с использованием кроликов было доказано, что пивалатные производные общей формулы (Iа) обладают очень сильным и продолжительным действием, снижающим внутриглазное давление. Пивалатные производные общей формулы (Iа) являются исключительно полезными соединениями в качестве глазных капель для профилактики (предотвращения) или лечения глаукомы или внутриглазной гипертензии.
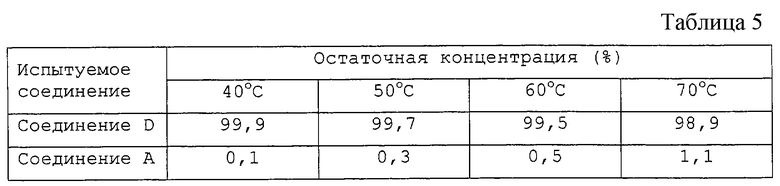
Кроме того, пивалатные производные общей формулы (Iа) настоящего изобретения почти не разлагаются в растворе глазных капель при высокой температуре и являются исключительно устойчивыми соединениями. Например, когда пивалатное производное соединения А оставляли стоять примерно в течение 1 месяца при 40oС в водном растворе, только около 0,1% этого соединения превратилось в соединение А. Аналогичным образом лишь около 1,1% этого соединения превращалось в соединение А даже при 70oС. Таким образом, пивалатные производные общей формулы (Iа) согласно настоящему изобретению являются исключительно стабильными соединениями в виде водного раствора и глазных капель, содержащих указанные соединения, и характеризуются великолепной стабильностью при длительном хранении. Поэтому пивалатные производные общей формулы (Iа) настоящего изобретения являются весьма подходящими для местного применения в виде глазных капель.
Соединения представленной выше общей формулы (I) согласно настоящему изобретению можно получить, например, с помощью защиты обычным образом вторичного атома азота производного индолина общей формулы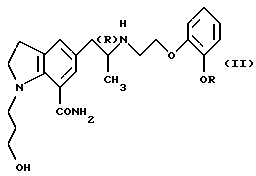
где R и атом углерода, помеченный символом (R), имеют указанные выше значения,
такой защитной группой, как трет-бутоксикарбонильная группа, и окисления индолинового кольца, полученного в результате соединения в присутствии металлического катализатора, такого как палладий на угле и формиат аммония, с получением производного индола общей формулы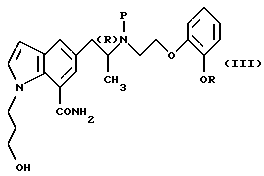
где Р означает аминозащитную группу и R, и атом углерода, помеченный символом (R), имеют указанные выше значения,
которое подвергают взаимодействию с пивалоилгалогенидом в присутствии основания в зависимости от потребности и удаляют защитную группу обычным путем.
Пивалатные производные общей формулы (Iа) можно также получить из соединений общей формулы (I) настоящего изобретения с помощью защиты вторичного атома азота производного индолина общей формулы (II) такой защитной группой, как трет-бутоксикарбонильная группа, обычным способом и подвергания полученного соединения взаимодействию с пивалоилгалогенидом в присутствии основания с получением производного индолина общей формулы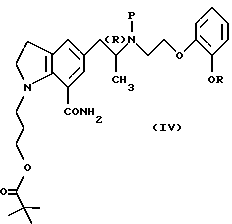
где Р, R и атом углерода, помеченный символом (R), имеют указанные выше значения,
окисления индолинового кольца полученного соединения в присутствии металлического катализатора, такого как палладий на угле и формиат аммония, и удаления защитной группы обычным способом.
Производные индола общей формулы (I) настоящего изобретения могут превращаться обычным способом в их фармацевтически приемлемые соли. Примерами таких солей являются кислотно-аддитивные соли с минеральными кислотами (например, хлористоводородной кислотой, бромистоводородной кислотой, иодистоводородной кислотой, серной, азотной, фосфорной кислотой и аналогичными) и соли с органическими кислотами (такими как муравьиная кислота, уксусная кислота, метансульфокислота, бензолсульфокислота, п-толуолсульфокислота, пропионовая, лимонная, янтарная, винная, фумаровая, масляная, щавелевая, малоновая, малеиновая, молочная, яблочная, салициловая, бензойная, адипиновая, угольная, глутаминовая кислота, аспарагиновая кислота и аналогичные).
Производные индола общей формулы (I) настоящего изобретения и их фармацевтически приемлемые соли, используемые в лечебной практике, можно вводить в виде разных лекарственных форм. Из этих форм наиболее предпочтительным является местное введение в виде глазных капель. Глазные капли могут быть подходящим образом получены в виде готовых форм в соответствии с известными способами. Например, глазные капли можно получить добавлением пивалатных производных общей формулы (Iа) настоящего изобретения к стерильной очищенной воде, растворением путем добавления подходящих фармацевтических добавок, таких как антисептики, изотонические растворы и буферы, и, если необходимо, подогреванием и фильтрованием для удаления частиц пыли и/или микробов.
Дозу лекарственного средства определяют соответственно в зависимости от пола, возраста, веса тела, степени симптомов каждого пациента и других факторов. Например, в случае глазных капель предпочтительно закапывание в глаза 0,001-0,5% раствора 1-3 раза в день.
Настоящее изобретение далее более подробно иллюстрируется нижеследующими справочными примерами, примерами и примерами испытаний. Настоящее изобретение не ограничивается ими.
СПРАВОЧНЫЙ ПРИМЕР 1. (R)-3-[7-Циано-5-[2-[[2-(2-этоксифенокси)этил] амино]пропил]-2,3-ди-гидро-1Н-индол-1-ил]пропилбензоат.
К раствору карбоната калия (32,3 г) в дистиллированной воде (120 мл) добавляют этилацетат (120 мл) и к смеси при перемешивании порциями добавляют L-тартрат (R)-3-[5-(2-аминопропил)-7-циано-2,3-дигидро-1Н-индол-1-ил]пропилбензоата (12,0 г). После реакции в течение 1 часа реакционную смесь экстрагируют этилацетатом и этилацетатный слой последовательно промывают 10% водным раствором карбоната калия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, получая (R)-3-[5-(2-аминопропил)-7-циано-2,3-дигидро-1Н-индол-1-ил]пропилбензоат (8,98 г) в виде коричневого масла.
Полученный (R)-3-[5-(2-аминопропил) -7-циано-2,3-дигидро-1Н-индол-1-ил] пропилбензоат (8,98 г) растворяют в трет-бутаноле (43 мл). К раствору добавляют 2-(2-этоксифенокси)этилметансульфонат (7,02 г) и карбонат натрия (2,86 г) и нагревают смесь с обратным холодильником в течение ночи. Реакционную смесь концентрируют в вакууме, добавляют к остатку насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Этилацетатный слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, остаток очищают хроматографией на колонке из силикагеля (элюент: этилацетат и этилацетат/метанол=100/6). Полученное маслянистое вещество концентрируют в азеотропных условиях, получая (R)-3-[7-циано-5-[2-[[2-(2-этоксифенокси)этил] амино]пропил]-2,3-дигидро-1Н-индол-1-ил] пропилбензоат (7,46 г) в виде коричневого масла.
1Н ЯМР (CDCl3), δ (миллионные доли): 1,4 (д, J=6,0 Гц, 3Н), 1,41 (т, J= 6,9 Гц, 3Н), 2,10-2,20 (м, 2Н), 2,42 (дд, J=13,6, 6,9 Гц, 1Н), 2,63 (дд, J= 13,6, 6,0 Гц, 1Н), 2,80-3,10 (м, 5Н), 3,50-3,60 (м, 2Н), 3,75 (т, J=7,3 Гц, 2Н), 4,00-4,15 (м, 4Н), 4,40-4,50 (м, 2Н), 6,85-7,00 (м, 6Н), 7,40-7,50 (м, 2Н), 7,50-7,60 (м, 1Н), 8,00-8,10 (м, 2Н).
Удельное вращение [α]
СПРАВОЧНЫЙ ПРИМЕР 2. (R)-5-[2-[[2-(2-Этоксифенокси)этил]амино]пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбонитрил.
(R)-3-[7-Циано-5-[2-[[2-(2-этоксифенокси)этил] амино] пропил]-2,3-дигидро-1Н-индол-1-ил] пропилбензоат (7,23 г) растворяют в метаноле (46 мл) и раствор добавляют к раствору гидроксида калия (1,54 г) в дистиллированной воде (9,2 мл). После нагревания с обратным холодильником в течение 1 часа реакционную смесь концентрируют в вакууме. К остатку добавляют дистиллированную воду (100 мл) и полученную смесь экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, остаток растворяют в толуоле (30 мл) и толуол удаляют в вакууме, получая (R)-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил ]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбонитрил (6,06 г) в виде бледно-коричневого масла.
1H ЯМР (CDCl3), δ (миллионные доли): 1,05 (д, J=6,0 Гц, 3Н), 1,41 (т, J= 6,9 Гц, 3Н), 1,50-1,90 (м, 1Н), 1,85-2,00 (м, 2Н), 2,43 (дд, J=13,6, 6,9 Гц, 1Н), 2,63 (дд, J=13,6, 6,3 Гц, 1Н), 2,80-3,10 (м, 5Н), 3,50-3,60 (м, 2Н), 3,67 (т, J=7,3 Гц, 2Н), 3,75-3,85 (м, 2Н), 4,00-4,15 (м, 4Н), 6,85-7,30 (м, 6Н).
Удельное вращение [α]
СПРАВОЧНЫЙ ПРИМЕР 3. (R)-5-[2-[[2-(2-Этоксифенокси)этил]амино]пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбоксамид.
(R)-5-[2-[[2-(2-Этоксифенокси)этил] амино]пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбонитрил (5,95 г) растворяют в диметилсульфоксиде (16,4 мл) и к раствору добавляют 5 н. раствор гидроксида натрия (0,25 мл). К смеси добавляют 30% перекись водорода (1,55 мл), поддерживая температуру внутри ниже 25oС, и смесь перемешивают в течение ночи при температуре внутри 25-30oС. К реакционной смеси добавляют раствор сульфита натрия (2,39 г) в дистиллированной воде (82 мл) и смесь экстрагируют этилацетатом. Этилацетатный слой последовательно промывают насыщенным водным раствором бикарбоната натрия, дистиллированной водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, остаток перекристаллизовывают из этилацетата, получая (R)-5-[2-[[2-(2-этоксифенокси)этил] амино] пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбоксамид (4,72 г).
1Н ЯМР (СDСl3), δ (миллионные доли): 1,07 (д, J=6,2 Гц, 3Н), 1,37 (т, J= 7,0 Гц, 3Н), 1,60-1,85 (м, 3Н), 2,54 (дд, J=13,6, 6,5 Гц, 1Н), 2,68 (дд, J= 13,6, 6,4 Гц, 1Н), 2,85-3,10 (м, 6Н), 3,19 (т, J=6,6 Гц, 2Н), 3,35-3,45 (м, 2Н), 3,75 (т, J= 5,4 Гц, 2Н), 3,95-4,20 (м, 4Н), 5,70 (шс, 1Н), 6,66 (шс, 1Н), 6,80-6,95 (м, 4Н), 7,02 (с, 1Н), 7,16 (с, 1Н).
Удельное вращение [α]
СПРАВОЧНЫЙ ПРИМЕР 4. трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил] -1-метилэтил] -N-[2-(2-этоксифенокси)этил] карбамат.
(R)-5-[2-[[2-(2-Этоксифенокси)этил] амино]пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбоксамид (10,9 г) растворяют в метиленхлориде (100 мл) и при перемешивании при охлаждении льдом к раствору по каплям добавляют раствор ди-трет-бутилдикарбоната (5,87 г) в метиленхлориде. После перемешивания в течение 30 минут в тех же условиях реакционную смесь перемешивают в течение 10 часов при комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток растворяют в этилацетате (150 мл). Раствор последовательно промывают 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, получая бледно-коричневый аморфный трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил]-1-метилэтил]-N-[2-(2-этоксифенокси)этил]карбамат (10,2 г).
1H ЯМР (CDCl3), δ (миллионные доли): 1,20-1,50 (м, 15Н), 1,70-1,85 (м, 2Н), 2,50-4,40 (м, 18Н), 5,75 (шг, 1Н), 6,63 (шс, 1Н), 6,80-7,20 (м, 6Н).
Удельное вращение [α]
ПРИМЕР 1. (R)-5-[2-[[2-(2-Этоксифенокси)этил] амино]пропил]-1-(3-гидроксипропил)-1Н-индол-7-карбоксамид (соединение В).
трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил] -1-метилэтил] -N-[2-(2-этоксифенокси) -этил] карбамат (4,93 г) растворяют в метаноле (150 мл) и добавляют к раствору 10% палладий на угле (490 мг) и формиат аммония (2,96 г). После того как смесь нагревают с обратным холодильником в течение 36 часов и охлаждают, нерастворимое вещество отфильтровывают. Растворитель удаляют в вакууме и остаток растворяют в метаноле (150 мл). К раствору добавляют 10% палладий на угле (490 мг) и формиат аммония (2,96 г). После того как смесь нагревают с обратным холодильником в течение 24 часов и охлаждают, нерастворимое вещество отфильтровывают. Фильтрат концентрируют в вакууме и остаток растворяют в этилацетате. Раствор промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, получая белый аморфный трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-1Н-индол-5-ил] -1-метилэтил] -N-[2-(2-этоксифенокси)этил]карбамат (4,55 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,05-1,50 (м, 15Н),
1,90-2,10 (м, 2Н), 2,70-3,00 (м, 3Н), 3,30-3,75 (м, 4Н), 3,80-4,65 (м, 7Н), 5,75-5,95 (м, 1Н), 6,40-6,65 (м, 2Н), 6,75-7,55 (м, 7Н).
Удельное вращение [α]
трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-1Н-индол-5-ил] -1-метилэтил] -N-[2-(2-этоксифенокси)этил] карбамат (4,45 г) растворяют в изопропаноле (50 мл) и при перемешивании и охлаждении льдом к раствору порциями добавляют концентрированную хлористоводородную кислоту (25 мл). После того как смесь перемешивают в течение 3 часов при комнатной температуре, при охлаждении льдом к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме и остаток очищают хроматографией на колонках из аминопропилсиликагеля (элюент: метиленхлорид/метанол=20/1), получая белый аморфный (R)-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил]-1-(3-гидроксипропил)-1H-индол-7-карбоксамид (1,27 г). Неочищенную смесь далее очищают хроматографией на колонке из аминопропилсиликагеля (элюент: этилацетат/этанол= 7/1) и очищенный продукт объединяют с ранее очищенным продуктом, получая белый аморфный (R)-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил]-1-(3-гидроксипропил)-1Н-индол-7-карбоксамид (2,39 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,11 (д, J=6,3 Гц, 3Н), 1,25 (т, J= 7,0 Гц, 3Н), 1,95-2,10 (м, 2Н), 2,70-3,20 (м, 6Н), 3,52 (т, J=5,6 Гц, 2Н), 3,93 (кв, J= 7,0 Гц, 2Н), 4,00-4,20 (м, 2Н), 4,38 (т, J=7,0 Гц, 2Н), 5,90 (шс, 1Н), 6,38 (шс, 1Н), 6,49 (д, J=3,2 Гц, 1Н), 6,75-6,95 (м, 4Н), 7,11 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,5 Гц, 1Н) 7,53 (д, J=1,4 Гц, 1Н).
Удельное вращение [α]
ПРИМЕР 2. Гидрохлорид (R)-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил] -1-(3-гидроксипропил)-1Н-индол-7-карбоксамида (гидрохлорид соединения В).
(R)-5-[2-[[2-(2-Этоксифенокси)этил] амино]пропил]-1-(3-гидроксипропил)-1Н-индол-7-карбоксамид (862 мг) растворяют в этаноле (5 мл) и к раствору добавляют 2 н. раствор хлористоводородной кислоты (985 мкл). Растворитель удаляют в вакууме, остаток растворяют в этаноле (3 мл) и к раствору добавляют этилацетат (12 мл). После того как смесь оставляют выстаиваться, образующиеся кристаллы собирают фильтрованием, получая гидрохлорид (R) -5-[2-[[2-(2-этоксифенокси)этил] амино] пропил] -1-(3-гидроксипропил)-1Н-индол-7-карбоксамида (821 мг).
1H ЯМР (ДМСО-d6), δ (миллионные доли): 1,19 (д, J=6,4 Гц, 3Н), 1,26 (т, J=7,0 Гц, 3Н), 1,70-1,85 (м, 2Н), 2,65-2,80 (м, 1Н), 3,20-3,55 (м, 5Н), 3,64 (шс, 1Н), 4,02 (к, J=7,0 Гц, 2Н), 4,20-4,40 (м, 4Н), 4,55 (т, J=5,0 Гц, 1Н), 6,45 (д, J=3,1 Гц, 1Н), 6,85-7,15 (м, 5Н), 7,36 (д, J=3,1 Гц, 1Н), 7,49 (д, J=1,3 Гц, 1Н) 7,60 (шс, 1Н), 7,99 (шс, 1Н), 9,05-9,30 (м, 2Н).
Удельное вращение [α]
ПРИМЕР 3. (R)-3-[7-Карбамоил-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил]-1Н-индол-1-ил]пропилпивалат (соединение С).
трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил]-1-метилэтил]-N-[2-(2-этоксифенокси)этил]карбамат (6,24 г)растворяют в сухом пиридине (9,4 мл) и к раствору добавляют пивалоилхлорид (1,54 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре и добавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом и этилацетатный слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме и остаток очищают хроматографией на колонке из аминопропилсиликагеля (элюент: гексан/этилацетат= 1/1), получая бесцветный аморфный (R)-3-[5-[2-N-(трет-бутоксикарбонил)-N-[2-(2-этоксифенокси)этил] амино]пропил]-7-карбамоил-2,3-дигидро-1Н-индол-1-ил]пропилпивалат (4,30 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,15-1,50 (м, 24Н), 1,85-2,00 (м, 2Н), 2,55-3,20 (м, 6Н), 3,30-3,60 (м, 4Н), 3,85-4,40 (м, 7Н), 5,52 (шс, 1Н), 6,80-7,40 (м, 7Н).
Удельное вращение [α]
(R)-3-[5-[2-N-(трет-Бутоксикарбонил)-N-[2-(2-этоксифенокси)этил] амино] пропил]-7-карбамоил-2,3-дигидро-1Н-индол-1-ил]пропилпивалат (8,53 г) растворяют в метаноле (280 мл) и к раствору добавляют 10% палладий на угле (853 мг) и формиат аммония (3,97 г). Смесь нагревают с обратным холодильником в течение 13 часов и катализаторы отфильтровывают. Растворитель удаляют в вакууме, получая бледно-зеленый аморфный (R)-3-[5-[2-[N-(трет-бутоксикарбонил)-N-[2-(2-этоксифенокси)этил] амино]пропил ]-7-карбамоил-1Н-индол-1-ил] пропилпивалат (8,20 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,05-1,50 (м, 24Н), 1,90-2,10 (м, 2Н), 2,70-3,05 (м, 2Н), 3,30-3,75 (м, 2Н), 3,85-4,70 (м, 9Н), 5,66 (шс, 1Н), 6,35-6,50 (м, 2Н), 6,75-7,55 (м, 7Н).
Удельное вращение [α]
(R)-3-[5-[2-N-(трет-Бутоксикарбонил)-N-[2-(2-этоксифенокси)этил] амино] пропил] -7-карбамоил-1Н-индол-1-ил] пропилпивалат (7,81 г) растворяют в изопропаноле (78 мл) и при перемешивании и охлаждении льдом к раствору в течение 10 минут по каплям добавляют концентрированную хлористоводородную кислоту (39 мл). После того как смесь перемешивают в течение 4 часов при комнатной температуре и реакционную смесь доводят до рН 8 добавлением порошка бикарбоната натрия при перемешивании и охлаждении льдом. Смесь разбавляют водой (200 мл) и экстрагируют этилацетатом. Этилацетатный слой последовательно промывают насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме и остаток очищают хроматографией на колонке из аминопропил-силикагеля (элюент: этилацетат) и перекристаллизовывают из смеси эфира и гексана (2/1), получая (R)-3-[7-карбамоил-5-[2-[[2-(2-этоксифенокси)этил] амино] пропил]-1Н-индол-1-ил]пропилпивалат (5,21 г) в виде бесцветных кристаллов.
1H ЯМР (CDCl3), δ (миллионные доли): 1,11 (д, J=6,2 Гц, 3Н), 1,21 (с, 9Н), 1,27 (т, J=7,0 Гц, 3Н), 1,90-2,10 (м, 2Н), 2,75 (дд, J=13,6, 6,4 Гц, 1Н), 2,85 (дд, J=13,6, 6,6 Гц, 1Н), 2,95-3,10 (м, 3Н), 3,85-4,00 (м, 4Н), 4,00-4,20 (м, 2Н), 4,35-4,45 (м, 2Н), 5,55-5,65 (шс, 1Н), 6,05-6,20 (шс, 1Н), 6,47 (д, J=3,2 Гц, 1Н), 6,75-6,95 (м, 4Н), 7,06 (д, J=3,2 Гц, 1Н), 7,21 (д, J=1,5 Гц, 1Н) 7,54 (д, J=1,5 Гц, 1Н).
Удельное вращение [α]
ПРИМЕР 4.
Следующее соединение получали по способу, аналогичному описанному в примере 3, используя трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил] -1-метилэтил] -N-[2-[2-(2,2,2-трифторэтокси)фенокси] этил] карбамат вместо трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил] -1-метилэтил]-N-[2-(2-этоксифенокси) этил]карбамата.
(R)-3-[7-Карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил]амино] пропил]-1Н-индол-1-ил]пропилпивалат(соединение D).
1Н ЯМР (СDСl3), δ (миллионные доли): 1,11 (д, J=6,2 Гц, 3Н), 1,21 (с, 9Н), 2,00-2,10 (м, 2Н), 2,73 (дд, J=13,5, 6,5 Гц, 1Н), 2,84 (дд, J=13,5, 6,8 Гц, 1Н), 2,95-3,15 (м, 3Н), 3,90-4,00 (м, 2Н), 4,00-4,30 (м, 4Н), 4,35-4,45 (м, 2Н), 5,73 (шс, 1Н), 6,10 (шс, 1Н), 6,47 (д, J=3,2 Гц, 1Н), 6,80-7,05 (м, 4Н), 7,07 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,4 Гц, 1Н) 7,54 (д, J=1,4 Гц, 1Н).
Удельное вращение [α]
ПРИМЕР 5. Гидрохлорид (R)-3-[7-карбамоил-5-[2-[[2-(2-этоксифенокси)этил] амино]пропил]-1Н-индол-1-ил]пропилпивалата (гидрохлорид соединения С).
К раствору (R)-3-[7-карбамоил-5-[2-[ [2-(2-этоксифенокси)этил] амино] пропил] -1Н-индол-1-ил] пропилпивалата (6,07 г) в этаноле (58 мл) по каплям добавляют 1 н. хлористоводородную кислоту (11,6 мл) при охлаждении льдом и перемешивании и смесь перемешивают в течение 15 минут в тех же условиях. Реакционную смесь концентрируют в вакууме и к остатку добавляют этанол. После азеотропного удаления воды остаток растворяют в этаноле (6 мл) и добавляют к раствору этилацетат (60 мл). После того как смесь оставляют стоять в течение 16 часов при комнатной температуре получают бесцветные сырые кристаллы (5,14 г). После того как кристаллы объединяют с другими сырыми кристаллами, полученными аналогичным способом, перекристаллизация объединенных кристаллов (8,12 г) из этанола/этилацетата (15/1) дает гидрохлорид (R)-3-[7-карбамоил-5-[2-[[2-(2-этоксифенокси)этил]амино]пропил]-1Н-индол-1-ил]пропилпивалата (7,46 г) в виде бесцветных кристаллов.
1H ЯМР (CDCl3), δ (миллионные доли): 1,21 (с, 9Н), 1,29 (т, J=7,0 Гц, 3Н), 1,45 (д, J=6,5 Гц, 3Н), 1,95-2,10 (м, 2Н), 3,12 (дд, J=14,0, 7,2 Гц, 1Н), 3,30-3,60 (м, 3Н), 3,85-4,05 (м, 5Н), 4,30-4,50 (м, 4Н), 5,87 (с, 1Н), 6,40 (д, J=3,2 Гц, 1Н), 6,80-7,00 (м, 4Н), 7,05 (д, J=3,2 Гц, 1Н), 7,33 (д, J= 1,5 Гц, 1Н), 7,36 (с, 1Н), 7,50 (д, J=1,5 Гц, 1Н), 9,10-9,30 (шс, 1Н), 9,50-9,65 (шс, 1Н).
Удельное вращение [α]
СПРАВОЧНЫЙ ПРИМЕР 5. (R)-3-[7-Карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино] пропил] -1Н-индол-1-ил] пропил-2-этилбутират (соединение а).
К раствору (R)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси]этил]амино]пропил]-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-7-карбоксамида (3,0 г) в метиленхлориде (50 мл) при охлаждении льдом добавляют ди-трет-бутилдикарбонат (1,32 г) и смесь перемешивают в течение 30 минут при охлаждении льдом и в течение ночи при комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток растворяют в этилацетате (50 мл). Раствор последовательно промывают 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, получая бледно-коричневый аморфный трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил]-1-метилэтил]-N-[2-[2-(2,2,2-трифторэтокси)фенокси]этил]карбамат (2,99 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,20-1,50 (м, 12Н), 1,70-1,85 (м, 2Н), 2,50-4,50 (м, 18Н), 5,89 (шс, 1Н), 6,69 (шс, 1Н), 6,80-7,20 (м, 6Н).
Удельное вращение [α]
трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-2,3-дигидро-1Н-индол-5-ил] -1-метилэтил]-N-[2-[2-(2,2,2-трифторэтокси)фенокси]этил]карбамат (12,0 г) и формиат аммония (12,7 г) растворяют в метаноле (300 мл) и к раствору осторожно добавляют 10% палладий на угле (1,20 г). Смесь нагревают с обратным холодильником в течение ночи и растворитель удаляют в вакууме. К остатку добавляют воду и смесь экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме, получая аморфный трет-бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-1Н-индол-5-ил] -1-метилэтил]-N-[2-[2-(2,2,2-трифторэтокси)фенокси]этил]карбамат (12,2 г).
1H ЯМР (СDСl3), δ (миллионные доли): 1,1-1,4 (м, 12Н), 1,95-2,1 (м, 2Н), 2,7-3,0 (м, 2Н), 3,25-3,7 (м, 4Н), 3,8-4,2 (м, 3Н), 4,3-4,6 (м, 4Н), 5,91 (шс, 1Н), 6,45-6,6 (м, 2Н), 6,75-7,6 (м, 7Н).
Удельное вращение [α]
трет-Бутил-(R)-N-[2-[7-карбамоил-1-(3-гидроксипропил)-1Н-индол-5-ил] -1-метилэтил] -N-[2-[2-(2,2,2-трифторэтокси)фенокси] этил] карбамат (2,00 г) растворяют в сухом пиридине (3 мл) и к раствору добавляют 2-этилбутирилхлорид (0,54 г), полученный из 2-этилмасляной кислоты и оксалилхлорида. После того как смесь перемешивают в течение ночи при комнатной температуре к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. Этилацетатный слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель удаляют в вакууме и остаток очищают хроматографией на колонке из силикагеля (элюент: гексан/этилацетат= 2/1), получая белый аморфный (R)-3-[5-[2-[N-(трет-бутоксикарбонил)-N-[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино]пропил]-7-карбамоил-1Н-индол-1-ил]пропил-2-этилбутират (1,66 г).
1H ЯМР (СDСl3), δ (миллионные доли): 0,90 (т, J=7,4 Гц, 6Н), 1,10-1,40 (м, 12Н), 1,45-1,70 (м, 4Н), 1,90-2,10 (м, 2Н), 2,15-2,30 (м, 1Н), 2,70-3,00 (м, 2Н), 3,30-3,70 (м, 2Н), 3,80-4,70 (м, 7Н), 4,36 (к, J=8,4 Гц, 2Н), 5,62 (шс, 1Н), 6,40-6,50 (м, 2Н), 6,85-7,40 (м, 6Н), 7,45-7,55 (м, 1H).
Удельное вращение [α]
(R)-3-[5-[2-[N-(трет-Бутоксикарбонил)-N-[2-[2-(2,2,2-трифторэтокси)фенокси]этил]амино]пропил]-7-карбамоил-1Н-индол-1-ил]пропил-2-этилбутират (1,56 г) растворяют в изопропаноле (10 мл) и к раствору при охлаждении льдом и перемешивании по каплям добавляют концентрированную хлористоводородную кислоту (5,0 мл). После того как смесь перемешивают в течение 4 часов при комнатной температуре к реакционной смеси добавляют при охлаждении льдом насыщенный водный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. Этилацетатный слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель удаляют в вакууме, остаток очищают хроматографией на колонке из силикагеля (элюент: метиленхлорид/метанол=20/1) и перекристаллизовывают из смеси диэтилового эфира и гексана, получая (R)-3-[7-карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино]пропил] -1Н-индол-1-ил]пропил-2-этилбутират (1,10 г) в виде белых кристаллов.
1H ЯМР (СDСl3), δ (миллионные доли): 0,90 (т, J=7,4 Гц, 6Н), 1,11 (д, J= 6,2 Гц, 3Н), 1,45-1,70 (м, 4Н), 2,00-2,10 (м, 2Н), 2,15-2,25 (м, 1Н), 2,65-2,90 (м, 2Н), 2,95-3,15 (м, 3Н), 3,99 (т, J=6,3 Гц, 2Н), 4,00-4,30 (м, 4Н), 4,41 (т, J=6,9 Гц, 2Н), 5,64 (шс, 1Н), 6,07 (шс, 1Н), 6,47 (д, J=3,2 Гц, 1Н), 6,80-7,05 (м, 4Н), 7,08 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,6 Гц, 1Н), 7,54 (д, J=1,6 Гц, 1Н).
Удельное вращение [α]
СПРАВОЧНЫЙ ПРИМЕР 6.
Следующие соединения получают по способу, аналогичному описанному в справочном примере 5, используя соответствующий галогенангидрид кислоты вместо 2-этилбутирилхлорида.
(R)-3-[7-Карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил]амино] пропил]-1Н-индол-1-ил]пропил-2,2-диметилвалерат (соединение b).
1H ЯМР (СDСl3), δ (миллионные доли): 0,90 (т, J=7,3 Гц, 3Н), 1,11 (д, J= 6,2 Гц, 3Н), 1,18 (с, 9Н), 1,19-1,28 (м, 2Н), 1,49-1,53 (м, 2Н), 2,03-2,06 (м, 2Н), 2,73 (дд, J= 13,5, 6,5 Гц, 1Н), 2,84 (дд, J=13,5, 6,8 Гц, 1Н), 3,00-3,10 (м, 3Н), 3,96 (т, J=6,2 Гц, 2Н), 4,07-4,23 (м, 4Н), 4,40 (т, J=6, 9 Гц, 2Н), 5,66 (шс, 1Н), 6,09 (шс, 1Н), 6,47 (д, J=3,2 Гц, 1Н), 6,84-7,03 (м, 4Н), 7,07 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,6 Гц, 1Н), 7,54 (д, J=1,6 Гц, 1Н).
Удельное вращение [α]
(R)-3-[7-Карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил]амино] пропил]-1Н-индол-1-ил]пропил-α,α-диметилфенилацетат (соединение с).
1H ЯМР (СDСl3), δ (миллионные доли): 1,10 (д, J=6,2 Гц, 3Н), 1,60 (с, 6Н), 1,80-1,96 (м, 2Н), 2,71 (дд, J=13,7, 6,4 Гц, 1Н), 2,82 (дд, J=13,5, 6,7 Гц, 1Н), 2,96-3,10 (м, 3Н), 3,90 (т, 2Н), 4,03-4,28 (м, 6Н), 5,58 (шс, 1Н), 6,00 (шс, 1Н), 6,37 (д, J=3,1 Гц, 1Н), 6,84-7,03 (м, 4Н), 6,68 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,6 Гц, 1Н), 7,54 (д, J=1,6 Гц, 1Н).
Удельное вращение [α]
(R)-3-[7-Карбамоил-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил]амино] пропил]-1Н-индол-1-ил]пропил-2,2-диметилбутират (соединение d).
1H ЯМР (СDСl3), δ (миллионные доли): 0,85 (т, J=7,5 Гц, 3Н), 1,12 (д, J= 6,2 Гц, 3Н), 1,17 (с, 6Н), 1,57 (к, J=7,5 Гц, 4Н), 2,00-2,10 (м, 2Н), 2,70-2,90 (м, 2Н), 2,95-3,15 (м, 3Н), 3,97 (т, J=6,2 Гц, 2Н), 4,00-4,40 (м, 4Н), 4,40 (т, J=7,0 Гц, 2Н), 5,70 (шс, 1Н), 6,12 (шс, 1Н), 6,47 (д, J=3,2 Гц, 1Н), 6,80-7,05 (м, 4Н), 7,07 (д, J=3,2 Гц, 1Н), 7,19 (д, J=1,6 Гц, 1Н), 7,54 (д, J=1,6 Гц, 1Н).
Удельное вращение [α]
ПРИМЕР ИСПЫТАНИЯ 1. Измерение действия, блокирующего α1-адренорецептор.
У самцов крыс Wistar (вec около 300 - 350 г) удаляли семявыводящие протоки (на расстоянии примерно 1,5 см от стороны яичка). После удаления кровеносного сосуда и соединительной ткани каждый препарат вертикально суспендировали в ванне Магнуса, содержащей 10 мл раствора Кребса-Хенслейта, поддерживаемого при 37oС, и обрабатывали смесью 95% кислорода и 5% углекислого газа при напряжении покоя, равном 1 г. В ванну Магнуса добавляли раствор смеси, содержащей пропанолол и иохимбин (конечная концентрация: пропанолол 1 мкМ и иохимбин 0,1 мкМ). Через 30 минут в ванну Магнуса добавляли норэпинефрин с конечной концентрацией 10 мкМ до тех пор, пока не будет достигнуто максимальное сокращение, и каждый препарат промывали. Эту процедуру повторяли несколько раз до тех пор, пока показатели сокращения не были стабильными. Каждый препарат за 30 минут до испытания предварительно обрабатывали раствором испытуемого соединения и измеряли сократительный ответ обработкой 10 мкМ норэпинефрином. Сокращение каждого препарата без обработки испытуемым соединением принимали равным 100%. Блокирующее действие испытуемого соединения на α1-адренорецепторы оценивали в виде молярной концентрации соединения, необходимой для 50% ингибирования сокращения до добавления норэпинефрина (то есть значение IC50). Результаты приведены в таблице 1.
ПРИМЕР ИСПЫТАНИЯ 2. Измерение концентрации лекарственного средства во внутриглазной жидкости.
(1) Методика
Кроликам породы "японский белый" (вес около 3 кг; Japan SCL) закапывали в глаза 0,1% раствор гидрохлорида (R)-5-[2-[[2-(2-этоксифенокси)этил]амино] пропил]-1-(3-гидроксипропил)-1Н-индол-7-карбоксамида (гидрохлорид соединения В) (50 мкл) и по истечении времени собирали внутриглазную жидкость. К собранной внутриглазной жидкости (0,1 мл) добавляли (R)-3-хлор-1-(3-гидроксипропил)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино]пропил]-1Н-индол-7-карбоксамид (10 нг) в качестве внутреннего стандарта и к смеси добавляли 0,1 М фосфатный буфер (рН 7,6) и хлорид натрия (около 1 г). Полученную смесь экстрагировали диэтиловым эфиром (5 мл) и диэтиловоэфирный слой концентрировали в токе азота. Остаток растворяли в подвижной фазе (200 мкл), 100 мкл раствора исследовали высокоэффективной жидкостной хроматографией и определяли соединение В в нижеследующих условиях. Результаты приведены в таблице 2.
(2) Условия ВЭЖХ
Аналитическая колонка: Intersil ODS-3 (4,6 х 250 мм).
Подвижная фаза: ацетонитрил/0,1% фосфорная кислота + 2 мМ лаурилсульфат натрия=1/1.
Температура колонки 50oС.
Скорость потока 1,0 мл/минуту.
Флуорометрия: длина волны возбуждения 270 нм, длина волны излучения 435 нм.
ПРИМЕР ИСПЫТАНИЯ 3. Определение скорости гидролиза под действием эндогенного фермента.
(3) Методика
К цельной крови (0,5 мл), взятой у самцов крыс Wistar в качестве гепаринизированной крови, добавляли соответственно сложноэфирное производное (1 мкг) (R)-1-(3-гидроксипропил)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси]этил] амино] пропил] -1Н-индол-7-карбоксамид (соединение А) и внутренний стандарт [(R)-3-хлор-1-(3-гидроксипропил)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино]пропил]-1Н-индол-7-карбоксамид] (1 мкг) и смесь инкубировали при 37oС. Через 15 минут, 30 минут, 1 час и 2 часа к каждой пробе добавляли 0,7 М водный раствор фторида натрия (0,5 мл) в качестве ингибитора эстеразы для прекращения реакции. К смеси добавляли 0,1 М фосфатный буфер (рН 7,6) и хлорид натрия (около 1 г), полученную смесь экстрагировали диэтиловым эфиром (5 мл) и диэтиловоэфирный слой концентрировали в потоке азота. После того как остаток растворяли в подвижной фазе (300 мкл), 10 мкл раствора исследовали высокоэффективной жидкостной хроматографией и определяли испытуемое соединение и соединение А в нижеследующих условиях. Результаты приведены в таблице 3.
(2) Условия ВЭЖХ
Аналитическая колонка: Intersil ODS-3 (4,6 x 250 мм).
Подвижная фаза: ацетонитрил/20 мМ ацетатный буфер=40/60 (pH 5,0).
Температура колонки 50oС.
Скорость потока 1,0 мл/минуту.
Флуорометрия: длина волны возбуждения 270 нм, длина волны излучения 435 нм.
ПРИМЕР ИСПЫТАНИЯ 4. Измерение концентрации лекарственного средства во внутриглазной жидкости (2).
(1) Методика
Кроликам породы "японский белый" (вес около 3 кг; Japan SCL) закапывали в глаза 0,1% раствор (50 мкл) гидрохлорида (R)-3-[7-карбамоил-5-[2-[[2-(2-этоксифенокси)этил] амино] пропил]-1Н-индол-1-ил]пропилпивалата (гидрохлорид соединения С) и по истечении определенного периода времени собирали внутриглазную жидкость. К собранной внутриглазной жидкости (0,1 мл) добавляли (R)-3-хлор-1-(3-гидроксипропил)-5-[2-[[2-[2-(2,2,2-трифторэтокси)фенокси] этил] амино] пропил]-l-lH-индол-7-карбоксамид (10 нг) в качестве внутреннего стандарта, 0,1 М фосфатный буфер (рН 7,6) и хлорид натрия (около 1 г). Полученную смесь экстрагировали диэтиловым эфиром (5 мл) и диэтиловоэфирный слой концентрировали в потоке азота. После того как остаток растворяли в подвижной фазе (200 мкл), 100 мкл раствора исследовали высокоэффективной жидкостной хроматографией и определяли соединение С и (R)-5-[2-[[2-(2-этоксифенокси)этил] амино] пропил] -1-(3-гидроксипропил)-1Н-индол-7-карбоксамид (соединение В) в следующих условиях. Результаты приведены в таблице 4.
(2) Условия ВЭЖХ
Аналитическая колонка: Intersil ODS-3 (4,6 x 250 мм).
Подвижная фаза: ацетонитрил/0,1% фосфорная кислота + 2 мМ лаурилсульфат натрия=1/1.
Температура колонки 50oС.
Скорость потока 1,0 мл/минуту.
Флуорометрия: длина волны возбуждения 270 нм, длина волны излучения 435 нм.
ПРИМЕР ИСПЫТАНИЯ 5. Испытание на стабильность.
Испытуемые соединения растворяли в 0,1 М ацетатном буфере (рН 5,0) для получения 0,1% растворов. Каждый 0,1% раствор оставляли стоять в темноте в течение 28 дней соответственно при 40, 50, 60 и 70oС. Результаты приведены в таблице 5.
ПРИМЕР ИСПЫТАНИЯ 6. Испытание на острую токсичность.
Самцов крыс SD в 7-недельном возрасте (n=5; вес 190-210 г) не кормили в течение 18 часов. Гидрохлорид (R)-3-[7-карбамоил-5-[2-[[2-(2-этоксифенокси)этил] амино]пропил]-1H-индол-1-ил]пропилпивалата, суспендированный в 0,5% водном растворе метилцеллюлозы при концентрации 100 мг/мл, перорально вводили крысам в дозе 1000 мг/кг. Гибель крыс не обнаруживалась в течение 24 часов после введения.
Приложение
Дополнительные данные по биологической активности
Определение действия по снижению внутриглазного давления
Испытуемое соединение - гидрохлорид (R)-3-[7-карбомоил-5-[2-[[2-этоксифенокси)этил] амино] пропил]-1Н-индол-1-ил]пропилпивалата (гидрохлорид соединения С) растворяли в физиологическом растворе для получения 0,1% раствора, который затем использовали в качестве 0,1% глазных капель для подтверждения эффективности по снижению внутриглазного давления следующим методом.
Использовали 6 самцов цветных кроликов породы Dutch в возрасте 17-19 недель и прошедших акклиматизацию в течение более чем двух недель. За две недели и одну неделю до введения испытуемого раствора измеряли внутриглазное давление для подтверждения отсутствия каких-либо отклонений циркадного ритма внутриглазного давления или значений внутриглазного давления как такового. Затем для испытаний были произвольно отобраны 5 животных (одно животное оставили для контроля).
Затем, в 11:00, 50 мкл указанного раствора вводили в один глаз и 50 мл контрольного (физиологического) раствора в другой глаз. Внутриглазное давление измеряли с помощью аппланометра (Alcon Japan Ltd.) в 11:00 (сразу после ведения), в 13: 00 (через два часа после введения), в 15:00 (через 4 часа после введения) и в 19:00 (через 8 часов после введения) при анестезировании поверхности роговой оболочки глаза с помощью глазных капель, содержащих 0,4% гидрохлорид оксибупрокана. Средние значения различий (среднее + стандартная ошибка) для каждого значения времени внутриглазных давлений при обработке испытуемым соединением и контролем были вычислены с использованием t-критерия. Результаты приведены в таблице 6.
Как видно из таблицы, соединения настоящего изобретения проявили максимальное снижающее внутриглазное давление действие через 2 часа после закапывания, продолжительность которого сохраняется даже через 8 часов после закапывания.
Таким образом, соединения настоящего изобретения обладают очень сильным и продолжительным действием, снижающим внутриглазное давление.
Пример препаративной формы фармацевтической композиции
Глазные капли. 0,1 г гидрохлорида (R)-3-[7-карбомоил-5-[2-[[2-этоксифенокси)этил] амино] пропил] -1Н-индол-1-ил]пропилпивалата (гидрохлорид соединения С) растворяют в соответствующем количестве воды и добавляют 0,6 г уксусной кислоты, 0,4 г NaCl и 0,005 г хлорида бензалкония. Затем добавляют соответствующее количество 1 моль/л раствора гидрохлорида натрия для доведения значения рН до 5,0 и добавляют очищенную воду, чтобы довести общий объем до 100 мл. Полученный раствор подвергают стерилизации фильтрацией и заполняют им стерильный сосуд для глазных капель.



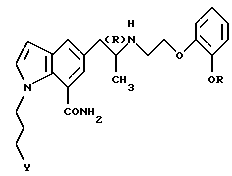
Изобретение относится к новым производным индола формулы I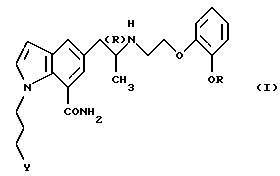
где R обозначает этильную или 2,2,2-трифторэтильную группу; Y - гидрокси- или пивалоилоксигруппа; атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации, или его фармацевтически приемлемым солям. Соединения I снижают внутриглазное давление, что позволяет использовать их в фармацевтической композиции, обладающей блокирующей активностью в отношении α-адренорецепторов, полезной также для профилактики или лечения глаукомы. 6 с. и 7 з.п.ф-лы, 6 табл.
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу, при условии, что Y обозначает пивалоилоксигруппу, когда R является 2,2,2-трифторэтильной группой;
атом углерода, помеченный символом (R), является атомом углерода в (R) -конфигурации),
или его фармацевтически приемлемая соль.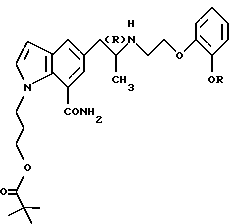
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации),
или его фармацевтически приемлемая соль.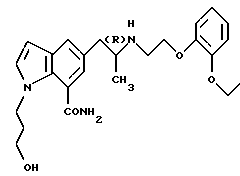
где атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации),
или его фармацевтически приемлемая соль.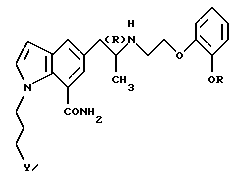
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу, при условии, что Y обозначает пивалоилоксигруппу, когда R является 2,2,2-трифторэтильной группой;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации),
или его фармацевтически приемлемая соль, полезные в качестве средства для профилактики или лечения глаукомы или внутриглазной гипертензии.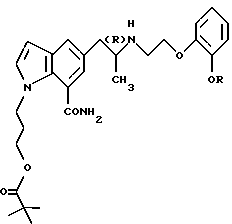
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации),
или его фармацевтически приемлемая соль, полезные в качестве средства для профилактики или лечения глаукомы или внутриглазной гипертензии.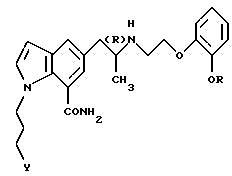
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации),
или его фармацевтически приемлемую соль.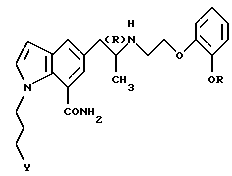
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу при условии, что Y обозначает пивалоилоксигруппу, когда R является 2,2,2-трифторэтильной группой;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.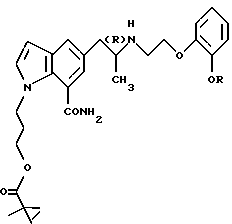
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.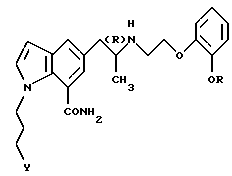
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли.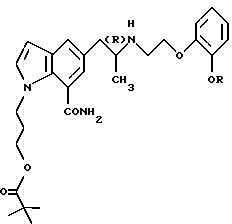
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли.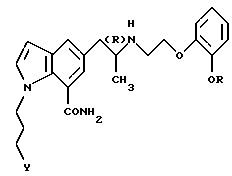
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
Y обозначает гидроксигруппу или пивалоилоксигруппу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемой соли, используемых в качестве неотъемлемого компонента указанной фармацевтической композиции, к одному или более фармацевтически приемлемым добавкам.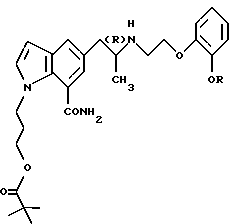
где R обозначает этильную группу или 2,2,2-трифторэтильную группу;
атом углерода, помеченный символом (R), является атомом углерода в (R)-конфигурации,
или его фармацевтически приемлемую соль.
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| RU 2052457 C1, 20.01.1996. | |||
Авторы
Даты
2003-09-20—Публикация
1999-02-19—Подача