Настоящее изобретение относится к новым пептидным соединениям и их фармацевтически приемлемым солям.
Оно, в частности, относится к новым пептидным соединениям и их фармацевтически приемлемым солям, которые обладают фармакологической активностью такой, как антагонизм по отношению к тахикинину, в частности, антагонизм по отношению к веществу P, антагонизм по отношению к нейрокинину A, антагонизм по отношению к нейрокинину B и т.п., способу их получения и содержащей их фармацевтической композиции, а также к их использованию в качестве медицинского средства.
Целью настоящего изобретения являются новые и полезные пептидные соединения и их фармацевтически приемлемые соли, которые обладают фармакологической активностью такой, как антагонизм по отношению к тахикинину, в частности, антагонизм по отношению к веществу P, антагонизм по отношению к нейрокинину A, антагонизм по отношению к нейрокинину B и т.п.
Еще одной целью настоящего изобретения является способ получения указанных пептидных соединений и их солей.
Следующей целью настоящего изобретения является фармацевтическая композиция, включающая в качестве активного ингредиента указанные пептидные соединения или их фармацевтически приемлемые соли.
Наконец, еще одной целью настоящего изобретения является использование указанных пептидных соединений или их фармацевтически приемлемых солей в качестве антагониста тахикинина, в частности, антагониста вещества P, антагониста нейрокинина A или антагониста нейрокинина B, полезного для лечения или предотвращения болезней, в которых посредником является тахикинин, например респираторных заболеваний, таких как астма, бронхит, ринит, кашель, отхаркивание и т. п. ; глазных болезней, таких как конъюнктивит, весенний конъюнктивит и т. п. ; кожных заболеваний, таких как контактный дерматит, диффузный нейродермит, крапивница и других видов экзематозного дерматита и т.п.; воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит и т.п.; болей и приступов боли (в частности, мигрени, головной боли, зубной боли, боли при раке, боли в спине и т.д.) и т.п. у человека или животных.
Целевые соединения по настоящему изобретению могут быть представлены следующей общей формулой I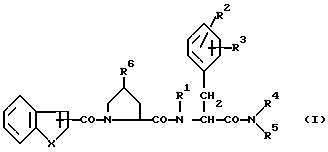
где
R1 обозначает атом водорода или низший алкил;
R2 обозначает низший алкил или атом галогена;
R3 обозначает атом водорода, низший алкил или атом галогена;
R4 обозначает низший алкил;
R5 обозначает ар(низший)алкил;
R6 обозначает аминогруппу или необязательно замещенную гидроксильную группу;
X обозначает атом кислорода, серы или группу N-R7, где R7 обозначает N, N-ди(низший)алкиламино(низший)алкил.
В соответствии с настоящим соединением, новые пептидные соединения I могут быть получены способами, которые поясняются схемами на фиг.1 - 4,
где
R1, R2, R3, R4, R5, R6, R7 и X имеют указанное значение;
R
L обозначает остаток аминокислоты;
M обозначает щелочной металл.
Что касается исходных соединений II, III и IV, то некоторые из них являются и могут быть получены обычным способом по методикам, приведенным в препаратах и примерах, приведенных далее.
В тексте настоящего описания аминокислоты, пептиды, защитные группы, конденсирующие агенты и т.п. указываются в виде аббревиатур в соответствии с номенклатурой IUPAC - IUB (Комиссии по номенклатуре биологических соединений), которые являются общепринятыми в данной области техники.
Кроме того, если специально не оговаривается, подразумевается, что аминокислоты и их остатки, представленные в виде аббревиатур, являются соединениями с L-конфигурацией и их остатками.
Подходящими фармацевтически приемлемыми солями исходных и целевых соединений являются обычные нетоксичные соли, которые включают кислотно-аддитивную соль, такую как соль органической кислоты (в частности, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, формиат, толуолсульфонат и т.п.), соль неорганической кислоты (в частности, хлорид, бромид, иодид, сульфат, нитрат, фосфат и т.п.), или соль с аминокислотой (в частности, аргинином, аспарагиновой кислотой, глютаминовой кислотой и т.п.), или соль с металлом, такую как соль щелочного металла (в частности, соль натрия, соль калия и т.д.) и соль щелочноземельного металла (в частности, соль кальция, соль магния и т.д.), соль аммония, соль органического основания (в частности, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N-дибензилэтилендиамина и т.п.) и т.д.
Приведенные выше и далее по тексту описания настоящего изобретения соответствующие примеры и пояснения различных определений, которые должны быть включены в объем притязаний по настоящему изобретению, подробно разъясняются ниже.
Термин "низший" использован, если не сделано дополнительных оговорок, для обозначения группы, содержащей от 1 до 6, преимущественно от 1 до 4 атомов углерода.
Подходящим "низшим алкилом" может быть алкильная группа с прямой или разветвленной цепью, например, метил, этил, пропил, изо-пропил, бутил, изо-бутил, трет-бутил, пентил, гексил и т.д., из которых наиболее предпочтительным является метил.
Подходящим "щелочным металлом" может быт натрий, калий и т.п.
Подходящим "кислотным остатком" может быть атом галогена (в частности, фтора, хлора, брома, иода), ацилоксигруппа (в частности, тозилоксигруппа, мезилоксигруппа и т.д.) и т.п.
Подходящий "ар(низший)алкил" может быть обычной группой, которая используется в химии аминокислот и пептидов, такой как моно-, ди- или трифенил(низший)алкил (в частности, тритил, бензгидрил, бензил, фенэтил и т.д.) и т.п.
Термин "галоген" обозначает фтор, хлор, бром, иод.
Термин подходящим образом "необязательно защищенный гидроксил" означает, что гидроксильная группа может быть защищена обычной защитной группой, такой как ацил (в частности, ацетил, мезил и т.д.) и т.п.
Подходящий "N,N-ди(низший)алкиламино(низший)алкил" может включать N,N-диметиламинометил, N,N-диметиламиноэтил и т.п.
Наиболее предпочтительными значениями групп R1, R2, R3, R4, R5, R6 и X являются следующие:
R1 обозначает атом водорода или низший алкил (в частности, метил и т.п. ),
R2 обозначает низший алкил (в частности, метил, трет-бутил) или атом галогена (в частности, хлора);
R3 обозначает атом водорода, низший алкил (в частности, метил и т.п.) или атом галогена (в частности, хлора),
R4 обозначает низший алкил (в частности, метил и т.п.),
R5 обозначает моно-, или ди, или трифенил(низший)алкил (в частности, бензил и т.п.),
R6 обозначает аминогруппу или гидроксильную группу,
X обозначает атом кислорода, атом серы или группу N-R7, где R7 обозначает N, N-ди(низший)алкиламино(низший)алкил (в частности, N,N-диметиламиноэтил и т.п.).
Способ получения целевого соединения I детально поясняется далее.
Способ 1. Целевое соединение I или его соль можно получить в результате взаимодействия соединения II или его реакционноспособного производного по аминогруппе или его соли с соединением III или его реакционноспособным производным по карбоксильной группе или его солью.
Подходящим реакционноспособным производным по аминогруппе соединения II может быть основание Шиффа в иминной форме или его изомер таутомерного типа в енаминной форме, которые образуется при взаимодействии соединения II с карбонильным соединением, таким как альдегид, кетон и т.п.; силильное производное, образуемое при взаимодействии соединения II с силильным производным, таким как бис(триметилсилил)ацетамид, моно(триметилсилил)ацетамид, бис(триметилсилил)мочевина и т.п.; производное, получаемое при взаимодействии соединения II с треххлористым фосфором или фосгеном.
Подходящими солями соединения II и его реакционноспособного производного могут быть те же соли, что и рассмотренные ранее для соединения I.
Подходящим реакционноспособным производным по карбоксильной группе соединения III может быть галогенангидрид кислоты, ангидрид кислоты, активированный амид, активированный эфир и т.п. Подходящим примером реакционноспособного производного может служить хлорангидрид кислоты; азид кислоты; смешанный ангидрид кислоты с такой кислотой, как замещенная фосфорная кислота (в частности, диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галогензамещенная фосфорная кислота и т.д.), диалкилфосфорная кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфокислота (в частности, метансульфокислота и т.п.), алифатическая карбоновая кислота (в частности, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, пиваловая кислота, пентановая кислота, изо-пентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и т.п.) или ароматическая карбоновая кислота (в частности, бензойная кислота и т.п.); симметричный ангидрид кислоты; активированный амид с имидазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом или тетразолом; или активированный сложный эфир (в частности, цианометиловый эфир, метоксиметиловый эфир, диметилиминометиловый [(CH3)2N+=CH-] эфир, виниловый эфир, этиловый эфир, пропаргиловый эфир, n-нитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фенилтиоэфир, n-нитрофенилтиоэфир, n-крезилтиоэфир, карбоксиметилтиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир, 8-хинолилтиоэфир и т.п.), или сложный эфир с N-гидроксильным соединением (в частности, N,N-диметилгидроксиламином, 1-гидрокси-2(2H)-пиридоном, N-гидроксисукцинимидом, N-гидроксифталимидом, 1-гидрокси-1H-бензотриазолом и т. п. ) и т.д. Эти реакционноспособные производные могут быть выбраны из приведенных ранее в зависимости от типа используемого соединения III.
Подходящими солями соединения III или его реакционноспособного производного может быть соль с основанием, такая как соль щелочного металла (в частности, соль натрия, соль калия и т.п.), соль щелочноземельного металла (в частности, соль кальция, соль магния и т.д.), соль аммония, соль органического основания (в частности, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и т.п.) и т.д. и кислотно-аддитивная соль, рассмотренная ранее для соединения I.
Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (в частности, метанол, этанол и т.п.), ацетон, диоксан, ацетонитрил, хлороформ, хлористый метилен, хлористый этилен, тетрагидрофуран, этилацетат, N, N-диметилформамид, пиридин, или в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции. Эти обычные растворители могут использоваться также в смеси с водой.
В том случае, если соединение III используют в виде свободной кислоты или ее соли, реакцию проводят в присутствии стандартного конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид; N-циклогексил-N'-морфолиноэтилкарбодиимид; N-циклогепксил-N'-(4-диэтиламиноциклогексил)карбодиимид; N, N'-диэтилкарбодиимид, N,N'-диизо-пропилкарбодиимид; N-этил-N'-(3-диметиламинопропил)-карбодиимид; N,N'-карбонил-бис-(2-метилимидазол); пентаметиленкетон-N-циклогексилимин; дифенилкетен-N-циклогексилимин; этоксиацетилен; 1-алкокси-1-хлорэтилен; триалкилфосфит; этилполифосфат, изо-пропилполифосфат, хлорокись фосфора (хлористый фосфороил); треххлористый фосфор; хлористый тионил; хлористый оксалил; низший алкилгалогенформиат (в частности, этилхлорформиат, изо-пропилхлорформиат и т.п.); трифенилфосфин; соль 2-этил-7-гидроксибензилоксазолиния; внутримолекулярная соль гидроокиси 2-этил-5-(m-сульфофенил)изоксазолиния; 1-(n-хлорбензолсулфонилокси)-6-хлор-1H-бензотриазол; так называемый реагент Вильсмейера, получаемый по реакции N,N-диметилформамида с хлористым тионилом, фосгеном, трихлорметилхлорформиатом, хлорокисью фосфора и т.п., и т.д.
Реакцию можно также проводить в присутствии органического основания, такого как бикарбонат щелочного металла, три(низший)алкиламин, пиридин, N-(низший)алкилморфолин, N,N-ди(низший)алкиланилин и т.д.
Температура реакции не имеет большого значения; реакцию можно проводить как при охлаждении, так и при нагревании.
Способ 2. Целевое соединение I-a или его соль можно получить в результате взаимодействия соединения IV или его соли с соединением V.
Реакцию обычно проводят в присутствии основания, такого как алкиллитий (в частности, п-бутиллитий и т.п.), гидрид щелочного металла (в частности, гидрид натрия, гидрид калия и т.п.), три(низший)алкиламин (в частности, триметиламин, триэтиламин и т.п.), пиридин или его производное (в частности, пиколин, лутидин, 4-диметиламинопиридин и т.п.) и т.д.
Указанную реакцию обычно проводят в таком растворителе, как диоксан, диметилсульфоксид, диметилформамид, диэтилформамид, диметилацетамид, бензол, тетрагидрофуран, или в любом другом растворителе, который не оказывает вредного воздействия на ход реакции.
В том случае, если основание, которое собираются использовать, является жидкостью, оно также может служить растворителем.
Температура реакции не имеет большого значения; реакцию можно проводить, как при охлаждении, при комнатной температуре, так и при кипячении.
Способ 3. Целевое соединение (I-c) или его соль можно получить, подвергая соединение (I-b) или его реакционноспособное производное по гидроксильной группе или соль реакции введения защиты гидроксильной группы.
Эту реакцию можно осуществлять в основном так же, как и по способу 1, а поэтому тип реакции и условия ее проведения (в частности, растворитель, температура реакции и т.п.) следует выбрать их тех, что уже описаны для способа 1.
Способ 4-(i). Целевое соединение VII или его соль можно получить в результате взаимодействия соединения I-c или его соли с соединением VI.
Реакцию обычно проводят в стандартном растворителе, таком как диметилсульфоксид, или любом другом растворителе, который не оказывает вредного воздействия на ход реакции.
Температура реакции не является критической и реакцию можно проводить, как при нагревании, так и при кипячении.
Способ 4-(ii). Целевое соединение I-d или его соль можно получить, гидрируя соединение VII или его соль. Указанную реакцию обычно проводят в присутствии трифенилфосфина, палладия на угле и т.п.
Реакцию обычно проводят в стандартном растворителе, таком как спирт (в частности, метанол, этанол и т.д.), или любом другом растворителе, который не оказывает вредного воздействия на ход реакции.
Температура реакции не является критической и реакцию можно проводить, как при охлаждении, так и при кипячении.
Соединения, получаемые по указанным выше процессам, могут быть выделены и очищены обычными способами, такими как пульверизация, перекристаллизация, колоночная хроматография, переосаждение и т.п.
Следует отметить, что соединение I и другие соединения могут включать вследствие наличия асимметрического атома углерода один или большее количество стереоизомеров, и все такие изомеры и их смеси входят в объем притязаний по настоящему изобретению.
Целевые соединения I и их фармацевтически приемлемые соли обладают фармакологической активностью, такой как антагонизм по отношению к тахикинину, в частности, антагонизм по отношению к веществу P, антагонизм по отношению к нейрокинину A, антагонизм по отношению к нейрокинину B, а потому, полезны для лечения или предотвращения болезней, в которых посредником является тахикинин, например
респираторных заболеваний, таких как астма, бронхит, ринит, кашель, отхаркивание и т.п.;
глазных болезней, таких как конъюктивит, весенний конъюктивит и т.п.;
кожных заболеваний, таких как контактный дерматит, диффузный нейродермит, крапивница и других видов экзематозного дерматита и т.п.;
воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит и т.п.;
болей и приступов боли (в частности, мигрени, головной боли, зубной боли, боли при раке, боли в спине и т.д.) и т.п.
Далее ожидается, что целевое соединение I по настоящему изобретению полезно для лечения или предотвращения глазных болезней, таких как глаукома, увеит и т.п.; желудочно-кишечных заболеваний таких, как язва, язвенный колит, слизистый колит, пищевая аллергия и т.п.; воспалительных заболеваний, таких как нефрит и т.п.; болезней органов кровообращения, таких как гипертония, стенокардия, инфаркт миокарда, тромбоз и т.п.; эпилепсии; паралича; учащенного мочеиспускания; слабоумия; болезни Альцгеймера; шизофрении; хореи Хантингтона; карциноидного синдрома и т.д., а также полезно в качестве иммунодепрессанта.
Для терапевтического назначения целевое соединение I и его фармацевтически приемлемую соль по настоящему изобретению используют в форме обычных фармацевтических препаратов, содержащих в качестве активного ингредиента одно из указанных соединений в смеси с обычными фармацевтически приемлемыми носителями, такими как органические или неорганические твердые или жидкие наполнители, которые пригодны для орального, парентерального, наружного, энтерального, внутривенного, внутримышечного, внутриносового и внутрисуставного назначения или для ингаляции. Фармацевтическими препаратами могут быть капсулы, таблетки, драже, гранулы, растворы, суспензии, эмульсии, мази и т.п. В случае необходимости, в указанные выше препараты могут быть введены вспомогательные вещества, стабилизаторы, смачивающие или эмульгирующие средства, буферные добавки и другие обычно используемые добавки.
Хотя дозировка соединения I будет зависеть от возраста и состояния пациента, средняя стандартная доза соединения I, составляющая приблизительно 0,1, 1, 10, 50, 100, 250, 500 и 1000 мг, может быть эффективной при лечении астмы и аналогичных заболеваний. В общем случае можно назначать в день приблизительно от 0,1 мг/вес тела до приблизительно до 1000 мг/вес тела.
С целью проиллюстрировать полезность целевого соединения I, ниже приведены данные фармакологического испытания отдельного выбранного соединения I.
Испытуемое соединение: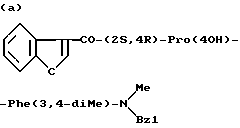
(1) Тест по связыванию рецептора вещества P, содержащего метку трития
Метод испытания:
(a) Получение сырого мембранного препарата
Самцов морских свинок вида Hartly забивают, отсекая голову. Удаляют трахею и легкие и гомогенизируют их в буфере (0,25 М сахарозы, 50 мМ Tris-HCl с pH 7,5; 0,1 мМ ЭДТК) с помощью установки Polytoron (от фирмы Kinematica). Гомогенизат центрифугируют (1000 • g, 10 минут) для удаления сгустков тканей, а жидкость над осадком центрифугируют (14000 • g, 20 минут), получая таблетки. Таблетки вновь суспендируют в буфере (5 мМ Tris-HCl с pH 7,5), гомогенизуют в тефлоновом гомогенизаторе и центрифугируют (14000 • g, 20 минут), получая таблетки, которые используют в качестве сырых мембранных фракций. Полученные таблетки хранят до использования при температуре минус 70oC).
(б) Связывание вещества P, содержащего метку трития, с мембранным препаратом
Замороженные сырые мембранные фракции оттаивают и ресуспендируют в Среде 1 (50 мМ Tris-HC1 с pH 7,5, 5 мМ хлорида марганца (II), 0,02% бычьего сывороточного альбумина, 2 мкг/мл химостатина, 4 мкг/мл лейпептина, 40 мкг/мл бацитрацина). Вещество P, содержащее метку трития (1 нМ) выдерживают в термостате вместе с 100 мкл мембранного препарата в Среде 1 при температуре 4oC в течение 30 минут, разбавив смесь до конечного объема 500 мкл. По окончании инкубационного периода реакционную смесь быстро отфильтровывают на стеклянном фильтре Whatman GF/B (предварительно обработанном перед использованием 0,1%-ным полиэтиленимином в течение 3 час) в условиях аспирации. Фильтры промывают четыре раза 5 мл буферной смеси (50 мМ Tris-HC1 с pH 7,5). Радиоактивность определяют в объеме в мл Aquazol-2 в сцинтилляционном счетчике (Packerd TRI - CARB 4530).
Испытуемое соединение (0,1 мкг/мл) - Ингибирование (%)
(а) - 96,3
Следующие примеры приведены с целью более детального пояснения настоящего изобретения.
В приведенных примерах, наряду с сокращениями, принятыми по номенклатуре IUPAC-IUB, используются следующие аббревиатуры.
Ac: - ацетил
Boc: - трет-бутоксикарбонил
t-Bu: - трет-бутил
Bzl: - бензил
ДМФА: - диметилформамид
ДМСО: - диметилсульфоксид
Me: - метил
TFA - трифторуксусная кислота
ТГФ - тетрагидрофуран
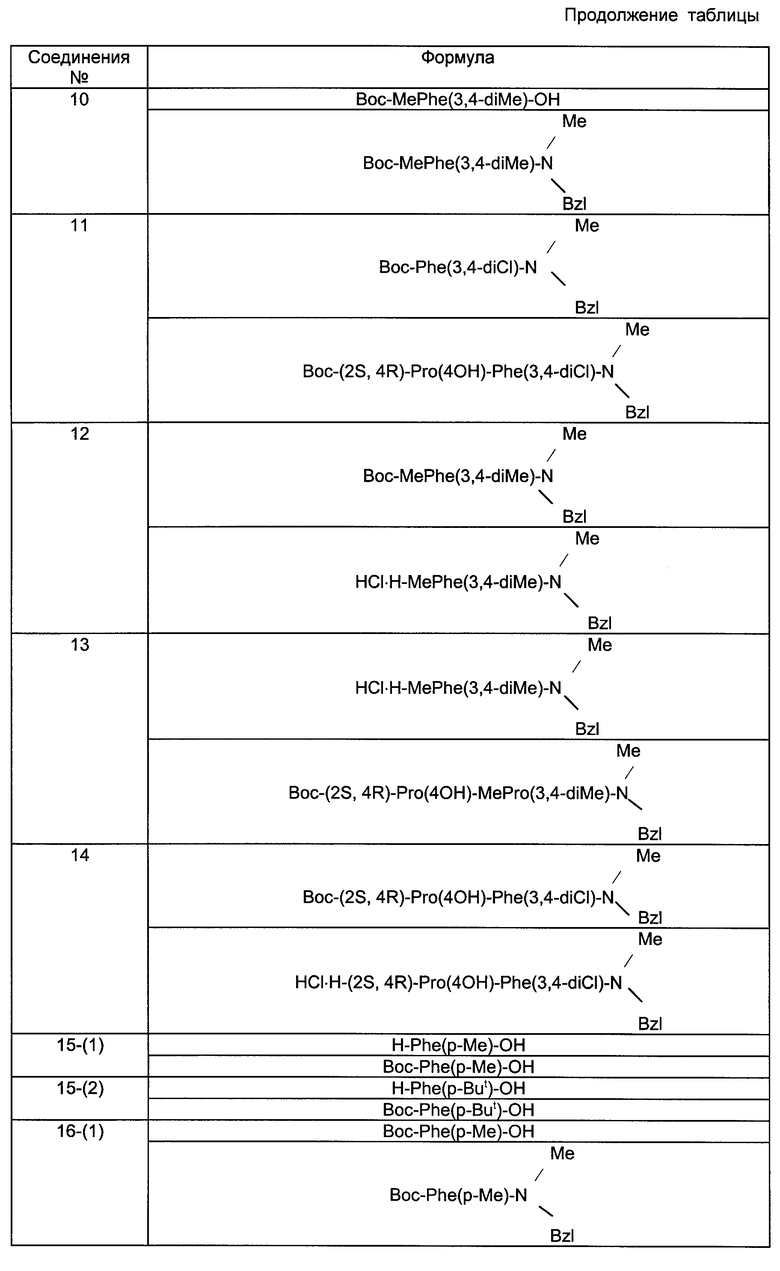
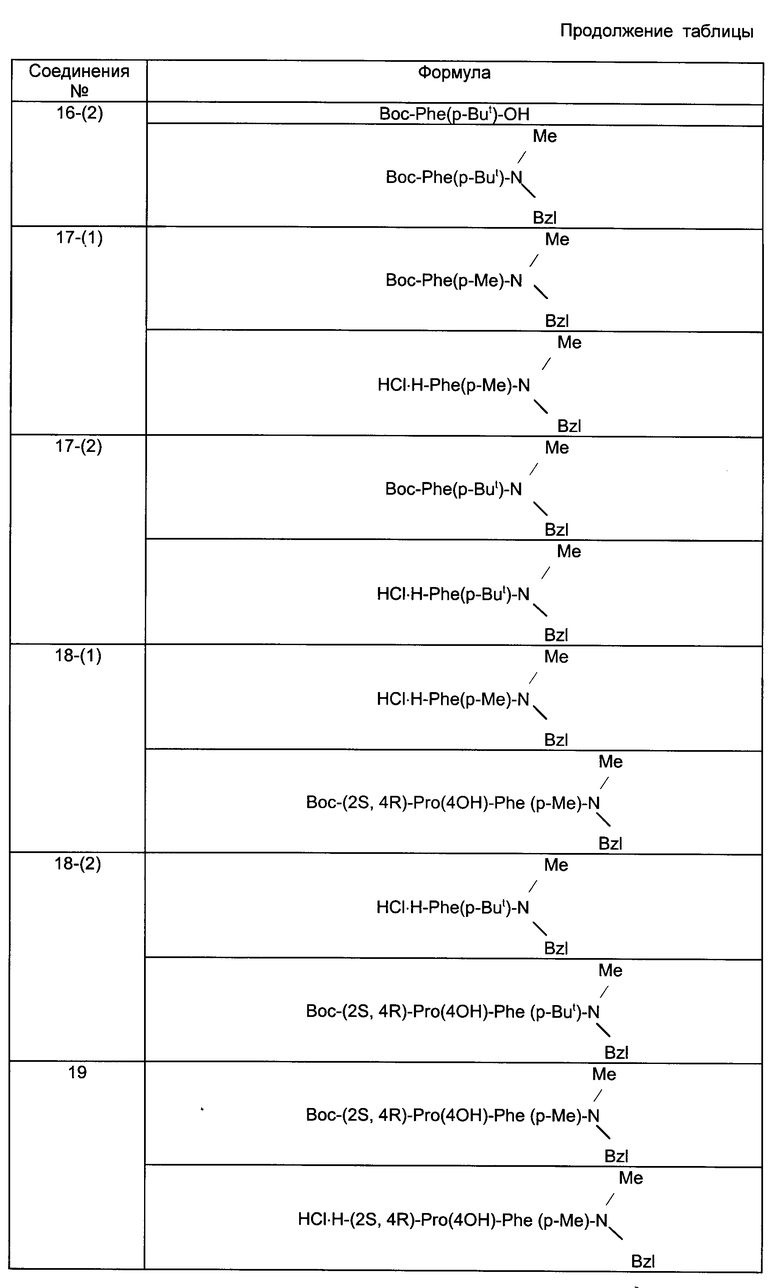
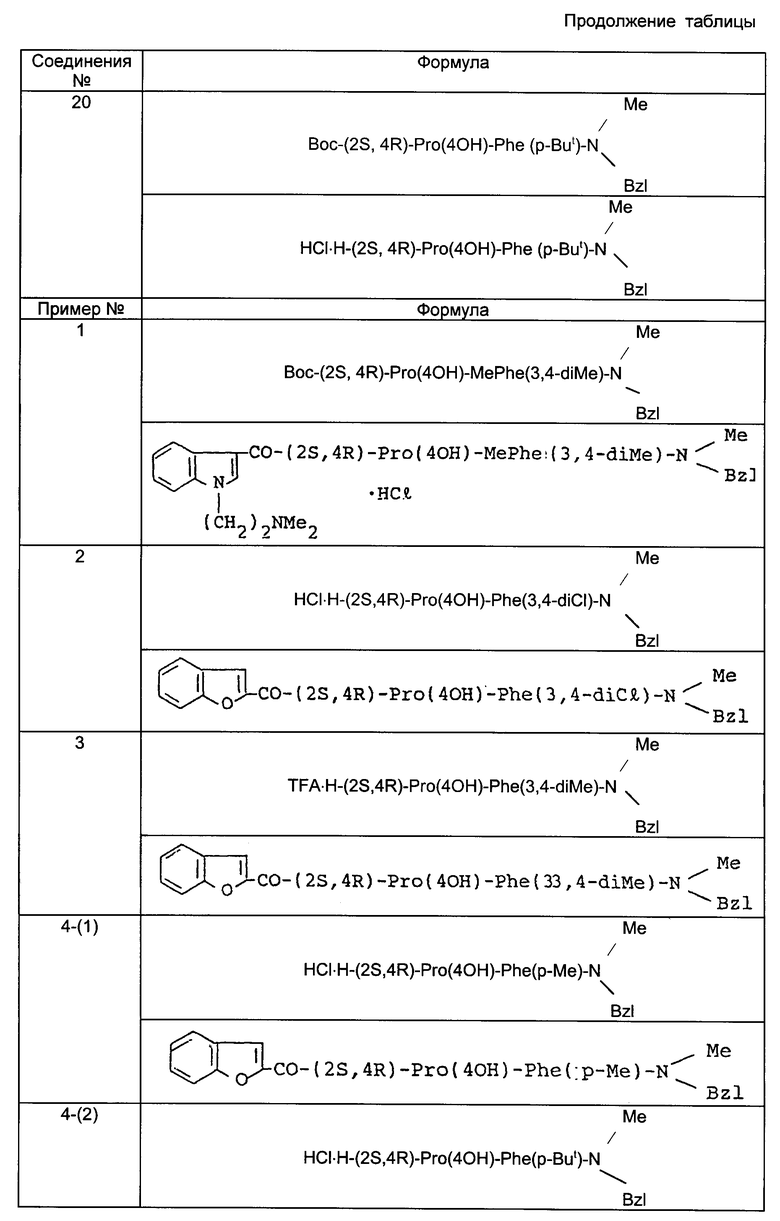
Используемые исходные соединения и целевые соединения, получаемые по приведенным далее примерам, представлены в таблице, в которой, соответственно, формулы предшественников приведены выше, а формулы производных соединений приведены ниже.
Приготовление 1. К суспензии исходного соединения (20,0 г) в смеси воды (200 мл) и ацетона (50 мл) добавляют триэтиламин (31,8 мл) при охлаждении на бане со льдом. К полученному раствору добавляют раствор ди-трет-бутилдикарбоната (27,9 г) в ацетоне (50 мл) и перемешивают при комнатной температуре в течение 2,5 час. Ацетон удаляют, добавляют воду и водный слой промывают один раз эфиром. Водную фазу подкисляют до значения pH 2 добавлением 6N соляной кислоты и экстрагируют этилацетатом. Экстракт промывают водным раствором хлорида натрия и сушат над сульфатом магния. После упаривания остаток отфильтровывают и сушат, получая целевое соединение (23,4 г).
ИК спектр (хлороформ): 3470, 1725, 17153, 1500 см-1.
Спектр ПМР (DMCO-d6, δ): 1,33 (9H, синглет), 2,17 (6H, синглет), 2,65 - 3,0 (2H, мультиплет), 3,95 - 4,1 (1H, мультиплет), 6,9 - 7,05 (4H, мультиплет), 12,46 (1H, уширенный синглет).
Приготовление 2. Исходное соединение (21,9 г) и триэтиламин (11,4 мл) растворяют в хлористом метилене (200 мл). Раствор охлаждают в бане со льдом и по каплям добавляют пивалоилхлорид (9,88 г); перемешивают в течение 30 минут при той же температуре. К полученному раствору при указанной температуре в течение двадцати минут добавляют N-метилбензиламин (9,6 мл). Полученную смесь перемешивают при той же температуре еще в течение часа, а затем еще в течение часа при комнатной температуре. Раствор последовательно промывают водой, раствором бикарбоната натрия, водой, 1N раствором соляной кислоты и насыщенным раствором соли, а затем сушат над сульфатом магния. Упариванием растворителя получают целевое соединение в виде масла (30,7 г).
ИК спектр (пленка): 3450, 3320, 1710, 1640, 1365 см-1.
Спектр ПМР (DMCO-d6, δ): 1,2 - 1,4 (9H, мультиплет), 2,1 - 2,2 (6H, мультиплет), 2,65 - 2,95 (5H, мультиплет), 4,3 - 4,7 (3H, мультиплет), 6,75 - 7,4 (9H, мультиплет).
Приготовление 3. К охлаждаемому льдом раствору исходного соединения (30,5 г) в этилацетате (152 мл) добавляют 4N раствор хлористого водорода (192 мл) в этилацетате. Раствор перемешивают при той же температуре в течение 10 минут, а затем еще в течение полчаса при комнатной температуре. Нерастворимые вещества отфильтровывают и фильтрат упаривают при пониженном давлении. Остаток перекристаллизовывают из смеси эфира (100 мл) и этилацетата (6 мл) при охлаждении льдом. Кристаллический продукт отделяют фильтрованием, сушат и получают целевое соединение (19,5 г) с т.пл. 96 - 104oC.
ИК% спектр (вазелиновое масло): 3440, 1650, 1610, 1490, 1450, 1280 см-1.
Спектр ПМР (DMCO-d6 δ): ) 2,1 - 2,25 (6H, мультиплет), 2,62 (синглет) и 2,69 (3H, синглет), 2,85 - 3,2 (2H, мультиплет), 4,0 - 4,1 и 4,35 - 4,65 (3H, мультиплет), 6,9 - 7,4 (8H, мультиплет), 8,49 (3H, уширенный синглет).
Приготовление 4. К охлажденному в бане со льдом раствору исходного соединения (12,1 г), Boc-(2S, 4R)-Pro (4OH)-OH (17,4 г) и N-гидроксибензотриазола (7,6 г) в хлористом метилене 120 мл) добавляют 1-этил-3-(3'-диметиламинопропил)карбодиимида (8,06 г). Раствор перемешивают при той же температуре в течение часа, а затем оставляют перемешиваться на ночь. После упаривания смесь экстрагируют этилацетатом и органический слой последовательно промывают водным раствором бикарбоната натрия, водой, 0,5N раствором соляной кислоты, водой и водным раствором хлорида натрия, а затем сушат над сульфатом магния. После упаривания получают целевой продукт (27,4 г) в виде аморфного вещества.
ИК спектр (хлороформ): 3450 - 3300, 1690 - 1650, 1645 - 1625, 1450, 1155 см-1.
Спектр ПРМ (DMCO-d6 δ): ) 1,2 - 1,45 (9H, мультиплет), 1,6 - 1,85 (1H, мультиплет), 1,9 - 2,2 (7H, мультиплет) 2,7 - 3,0 (5H, мультиплет) 3,15 - 3,5 (2H, мультиплет) 4,1 - 5,1 (6H, мультиплет) 6,7 - 7,35 (8H, мультиплет), 8,25 - 8,35 (1H, мультиплет).
Приготовление 5. К охлажденному в бане со льдом раствору исходного соединения (27 г) в хлористом метилене ( 54 мл) добавляют трифторуксусную кислоту (136 мл). Раствор перемешивают при той же температуре в течение десяти минут, а затем в течение сорока минут при комнатной температуре. После упаривания остаток перекристаллизовывают из эфира, продукт отделяют фильтрованием и сушат, получая целевое соединение (0,90 г) с т.пл. 164 - 167oC.
ИК спектр (хлороформ): 3450 - 3200, 1680, 1640, 1565, 1455 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,7 - 1,9 (1H, мультиплет), 2,1 - 2,4 (7H, мультиплет), 2,65 - 3,15 (5H, мультиплет), 3,25 - 3,5 (2H, мультиплет), 4,2 - 5,1, 5,55 - 5,65 (6H, мультиплет), 6,8 - 7,4 (8H, мультиплет), 9,1 - 9,3 (1H, мультиплет), 8,65 (1H, уширенный синглет), 10,0 (1H, уширенный синглет).
Приготовление 6. К суспензии исходного соединения (18,0 г) в воде (90 мл) добавляли 1N водный раствор едкого натра (65,8 мл). Полученный раствор нагревают до 37oC и доводят pH до 8,0 добавлением 1N раствора соляной кислоты. К раствору добавляют гексагидрат хлорида кобальта (II) (90 мг) и ацилазу (торговое название: Acylase Amano 15000) (900 мг). Полученную реакционную смесь оставляют перемешиваться на ночь при температуре 37oC. Остаток оделяют фильтрованием, промывают водой и сушат, получая целевое соединение (4,75 г) с т.пл. 192oC.
ИК спектр (вазелиновое масло): 3400, 1605, 1584, 1512, 888, 840 см-1.
Спектр ПМР (D2O + NaOD, δ): 2,65 - 3,15 (2H, мультиплет), 3,49 (1H, дублет дублетов, J=7,38 Гц, J=5,72 Гц), 7,12 (1H, дублет дублетов, J=8,24 Гц, 1,70 Гц), 7,36 (1H, дублет, J=1,6 Гц), 7,42 (1H, дублет, J=8,22 Гц).
Приготовление 7. К охлажденному в бане со льдом раствору исходного соединения (4,58 г) и иодистого метила (7,8 мл) в ТГФ (40 мл) в атмосфере азота добавляют 60%-ный гидрид натрия (1,87 г). Оставляют смесь перемешиваться при комнатной температуре на ночь. Добавляют воду и ТГФ упаривают. Добавляют эфир и воду и водный слой отделяют. Органически слой вновь промывают водой. Водные вытяжки объединяют и подкисляют до значения pH 2 добавлением 6N раствора соляной кислоты и выделившееся масло экстрагируют этилацетатом. Экстракт промывают водным раствором хлорида натрия, сушат над сульфатом магния и упаривают, получая целевое соединение в виде масла (4,20 г).
ИК спектр (хлороформ): 2600, 1700 см-1.
Спектр ПМР (DMCO-d6 δ): )1,34 и 1,41 (9H, синглет), 2,22 (6H, синглет) 2,69 и 2,76 (3H, синглет), 2,9 - 3,3 (2H, мультиплет), 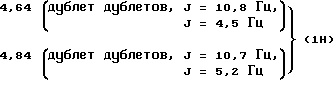 6,9 - 7,1 (3H, мультиплет), 8,83 (1H, синглет).
6,9 - 7,1 (3H, мультиплет), 8,83 (1H, синглет).
Приготовление 8. Целевое соединение получают аналогично методике, приведенной для приготовления 1.
Т.пл. 119,0 - 121,5oC.
ИК спектр (вазелиновое масло): 3370, 1718, 1690, 1526, 818 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,26, 1,31 (9H, синглет), 2,70 - 3,15 (2H, мультиплет), 4,00 - 4,10 (1H, мультиплет), 7,10 - 7,30, 7,45 - 7,60 (4H, мультиплет) 12,70 (1H, уширенный синглет).
Приготовление 9. К охлажденному в бане со льдом раствору исходного соединения (5,00 г) в хлористом метилене (50 мл) добавляют триэтиламин (2,29 мл) и пивалоилхлорид (2,03 мл). Полученную смесь перемешивают в течение 35 минут при той же температуре и добавляют N-метилбензиламин (1,81 г). Полученную смесь перемешивают при охлаждении в бане со льдом в течение 25 минут, а затем еще в течение 1,5 час при комнатной температуре. Раствор упаривают, к остатку добавляют воду и этилацетат, органический слой отделяют и последовательно промывают водным раствором бикарбоната натрия, водой, 0,5N раствором соляной кислоты и насыщенным раствором соли, а затем сушат над сульфатом магния. Упаривают, кристаллический продукт (7,10 г) промывают диизопропиловым эфиром, отделяют продукт фильтрованием, сушат и получают целевое соединение (5,29 г) с т.пл. 103,0 - 106oC.
ИК спектр (вазелиновое масло): 3390, 1690, 1638, 814, 730, 710 см-1 .
Спектр ПМР (DMCO-d6 δ): ) 1,21, 1,32 (9H, синглет), 2,90, 2,94 (3H, синглет), 2,70 - 3,05 (2H, мультиплет), 4,40 - 4,75 (3H, мультиплет), 7,05 - 7,65 (9H, мультиплет).
Приготовление 10. Целевое соединение получают аналогично методике, приведенной для приготовления 2.
Т.пл. 126 - 127oC.
ИК спектр (вазелиновое масло): 1680, 1645 см-1.
Спектр ПМР (хлороформ-d δ): 1,05, 1,19, 1,22 b 1,37 (9H, синглет), 2,18, 2,20 и 2,22 (6H, синглет), 2,83, 2,85 и 2,89 (6H, синглет), 2,9 - 3,25 (2H, мультиплет), 4,36 - 4,75 (2H, мультиплет), 4,95 - 5,03 и 5,30 - 5,45 (1H, мультиплет), 6,85 - 7,3 (8H, мультиплет).
Приготовление 11. К охлажденному льдом раствору исходного соединения (2,00 г) в этилацетате (7,5 мл) добавляют 4N раствор хлористого водорода (15 мл) в этилацетате. Раствор перемешивают при той же температуре в течение 35 минут и упаривают. К остатку добавляют хлористый метилен и водный раствор бикарбоната натрия и органический слой отделяют, сушат над сульфатом магния и упаривают до объема 5 мл (раствор 1).
К охлажденному в бане со льдом раствору Boc-(2s, 4R)-Pro(4OH)-OH (1,06 г) в хлористом метилене (15 мл) другом реакционном сосуде добавляют триэтиламин (0,70 мл) и пивалоилхлорид (0,62 мл) и перемешивают смесь при указанной температуре в течение 15 минут. Этот раствор добавляют к полученному ранее раствору (раствор 1) и полученную смесь перемешивают в течение часа при охлаждении в бане со льдом, а затем оставляют перемешиваться на ночь при комнатной температуре.
Добавляют N, N-диметил-1,3-пропандиамин (0,23 мл) и смесь перемешивают при комнатной температуре в течение часа. Упаривают, к остатку добавляют этилацетат и воду, органический слой отделяют, последовательно промывают водным раствором бикарбоната натрия, водой, 0,5N раствором соляной кислоты, водой и насыщенным раствором соли, а затем сушат над сульфатом магния. Упаривают и получают целевое соединение (2,43 г) в виде аморфного вещества.
ИК спектр (хлороформ): 3400 - 3260, 2960, 2930, 1625 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,19, 1,38 (9H, синглет), 1,50 - 2,10 (2H, мультиплет), 2,70 - 3,10 (5H, мультиплет), 3,15 - 3,50 (2H, мультиплет), 4,05 - 5,05 (6H, мультиплет), 7,00 - 7,65 (8H, мультиплет), 8,25 - 8,40 (1H, мультиплет).
Масс-спектр: M+ 550.
Приготовление 12. Целевое соединение получают аналогично первой половине методике, приведенной для приготовления 11.
Т.пл. 219-221oC.
ИК спектр (вазелиновое масло): 2750, 1650, 1550 см-1.
Спектр ПМР DMCO-d6δ): 2,15 (3H, синглет), 2,19 (3H, синглет), 2,5 (6H, мультиплет), 2,85-3,0 (1H, мультиплет), 3,17 - 3,35 (1H, мультиплет,
4,65 (1H, дублет дублетов, J=4,5 Гц, J=9,3 Гц), 6,9 - 7,1 (5H, мультиплет), 7,3 (3H, мультиплет), 9,5 (2H, широкий сигнал).
Приготовление 13. Целевое соединение получают аналогично второй половине методики, приведенной для приготовления 11.
ИК спектр (хлороформ): 3450, 1690, 1660 (плечо), 1640 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,09, 1,21, 1,27, 1,28, 1,37 и 1,38 (9H, синглет), 1,2 - 1,4, 1,4 - 1,5, 2,0 - 2,2 (2H, мультиплет), 1,99 и 2,13 (6H, синглет), 2,6 - 2,8 (4H, мультиплет), 3,0 (3H, мультиплет), 3,2 - 3,45 (3H, мультиплет), 4,1 - 4,7 (4H, мультиплет), 5,0 (1H, мультиплет), 5,4 - 5,6 (1H, мультиплет),
6,8 - 7,3 (8H, мультиплет).
Приготовление 14. К охлаждаемому льдом раствору исходного соединения (2,20 г) в этилацетате (7,5 мл) добавляют 4N раствор хлористого водорода (15 мл) в этилацетате. Раствор перемешивают при той же температуре в течение 2 час. Упаривают при пониженном давлении, остаток перекристаллизовывают из эфира и получают целевое соединение (1,59 г) с т.пл. 168,0 - 175,0oC.
ИК спектр (вазелиновое масло): 3270, 1640 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,60 - 1,90, 2,10 - 2,40, (2H, мультиплет), 2,80, 2,93 (3H, синглет), 2,70 - 3,40 (4H, мультиплет), 4,05 - 4,75 (4H, мультиплет), 4,85 - 5,10 (1H, мультиплет), 5,50 - 5,60 (1H, мультиплет), 7,00 - 7,65 (8H, мультиплет), 8,30 - 8,80, 9,60 - 10,15 (2H, уширенный синглет), 9,17 (1H, дублет, J=8,08 Гц).
Приготовление 15. Целевые соединения получают аналогично методике, приведенной для приготовления 1.
(1) ИК спектр (вазелиновое масло): 3350, 1720, 1690, 1530, 1415, 1240 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,32 (9H, синглет), 2,25 (3H, синглет), 2,7 - 3,0 (2H, мультиплет), 3,95 - 4,1 (1H, мультиплет), 6,85 - 7,15 (4H, мультиплет), 12,57 (1H, уширенный синглет).
Масс-спектр: M+ 1,280, M+279.
(2) ИК спектр (вазелиновое масло): 2960, 1720, 1510 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,25, 1,31 (18H, синглет), 2,65 - 3,05 (2H, мультиплет), 3,95 - 4,15 (1H, мультиплет), 7,00 - 7,35 (5H, мультиплет), 12,58 (1H, уширенный синглет).
Масс-спектр: M+ 321.
Приготовление 16. Целевые соединения получают аналогично методике, приведенной для приготовления 2.
(1) Т.пл. 74 - 77oC.
ИК спектр (вазелиновое масло): 3390, 1691, 1642 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,23, 1,28, 1,38 (9H, синглет), 2,24, 2,26 (3H, синглет), 2,65 - 2,95 (5H, мультиплет), 4,30 - 4,70 (3H, мультиплет), 6,90 - 7,40 (10H, мультиплет).
Масс-спектр: M+ 382.
(2) ИК спектр (хлороформ): 3310, 2960, 1708, 1640 см-1.
Спектр ПМР (DMCO-d6 δ):) 1,25, 1,33 (18H, синглет), 2,70 - 2,90 (5H, мультиплет), 4,35 - 4,65 (3H, мультиплет), 6,95 - 7,40 (10H, мультиплет).
Масс-спектр: М+ 424.
Приготовление 17. Целевые соединения получают аналогично методике, приведенной для приготовления 3.
(1) Т.пл. 135-138oC.
ИК спектр (вазелиновое масло): 3450, 1651, 1610 см-1.
Спектр ПМР (DMCO-d6 δ): ) 2,28, 2,31 (3H, синглет), 2,61, 2,68 (3H, синглет), 2,85 - 3,20 (2H, мультиплет), 3,90 - 4,05, 4,35 - 4,70 (3H, мультиплет), 7,05 - 7,40 (9H, мультиплет), 8,48 (3H, синглет).
(2) ИК спектр (вазелиновое масло): 1645, 1580 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,23, 1,29 (9H, синглет), 2,54 (3H, синглет), 2,85 - 3,20 (2H, мультиплет), 4,25 - 4,65 (3H, мультиплет), 7,05 - 7,40 (9H, мультиплет), 8,47 (3H, уширенный синглет).
Приготовление 18. Целевые соединения получают аналогично методике, приведенной для приготовления 4.
(1) ИК спектр (хлороформ): 3320, 2900, 1680, 1640 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,25, 1,39 (9H, синглет), 1,55 - 2,10 (2H, мультиплет), 2,26 (3H, синглет), 2,77, 2,85 (3H, синглет), 2,65 - 3,10 (2H, мультиплет), 3,15 - 3,50 (2H, мультиплет), 4,05 - 5,05 (6H, мультиплет), 6,90 - 7,35 (9H, мультиплет), 8,25 - 8,40 (1H, мультиплет).
Масс-спектр: M+ 495.
(2) ИК спектр (хлороформ): 3420, 3320, 2970, 1690-1630 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,24, 1,39 (18H, синглет), 1,55 - 2,05 (2H, мультиплет), 2,65 - 3,05 (2H, мультиплет), 3,15 - 3,45 (2H, мультиплет), 4,05 - 5,00 (6H, мультиплет), 6,95 - 7,35 (9H, мультиплет), 8,25 - 8,35 (1H, мультиплет).
Масс-спектр: M+ 537.
Приготовление 19. К охлаждаемому льдом раствору исходного соединения (3,00 г) в хлористом метилене (12 мл) добавляют 12 мл 4N раствора хлористого водорода в этилацетате. Раствор перемешивают при той же температуре в течение полутора часов. Растворитель упаривают и остаток растирают с эфиром. Осадок отфильтровывают, промывают эфиром и сушат в вакууме, получая целевое соединение (2,81 г).
ИК спектр (вазелиновое масло): 3350 - 3200, 1641, 1566, 1548 см-1.
Спектр ПМР (DMCO-d6 δ): ) 1,65 - 1,90, 2,20 - 2,40 (2H, мультиплет) 2,27 (3H, синглет), 2,76, 2,84 (3H, синглет), 2,70 - 3,45 (4H, мультиплет), 4,20 - 4,60 (4H, мультиплет), 4,80 - 5,05 (1H, мультиплет), 5,55 (1H, уширенный синглет), 6,95 - 7,40 (9H, мультиплет), 8,59 (1H, уширенный синглет), 9,15 (1H, дублет, J=7,6 Гц), 10,04 (1H, уширенный синглет).
Приготовление 20. Целевое соединение получают аналогично методике, приведенной для приготовления 19.
ИК спектр (вазелиновое масло): 3350 - 3200, 1675, 1640, 1561, 1541 см-1.
Спектр ПМР (DMCO-d6, δ): 1,25, 1,26 (9H, синглет), 1,70 - 1,95, 2,20 - 2,40 (2H, мультиплет), 2,75 - 2,80 (3H, синглет), 2,80 - 3,40 (4H, мультиплет), 4,20 - 4,65 (4H, мультиплет), 4,80 - 5,00 (1H, мультиплет), 5,57 (1H, уширенный синглет), 7,00 - 7,40 (9H, мультиплет), 8,61 (1H, уширенный синглет), 9,16 (1H, дублет, J = 7,6 Гц), 10,01 (1H, уширенный синглет).
Пример 1. Исходное соединение (2,42 г) растворяют в этилацетате (15 мл) и охлаждают в бане со льдом. К полученному раствору добавляют 4N раствор хлористого водорода в этилацетате (30 мл) и смесь перемешивают при той же температуре в течение сорока минут. После упаривания остаток растворяют в хлористом метилене (50 мл). Этот раствор промывают насыщенным раствором бикарбоната и органический слой отделяют. Водный слой вновь экстрагируют хлористым метиленом, органические вытяжки объединяют, промывают насыщенным раствором соли и сушат над сульфатом магния. После упаривания получают раствор производного исходного соединения с защищенной аминогруппой (0,0826 ммол/г). Порцию этого раствора объемом 24 мл добавляют к раствору 1-(N,N-диметиламиноэтил)индол-3-карбоновой кислоты (537 мг) и N-гидроксибензотриазола (270 мг) в диметилформамиде (15 мл). Смесь охлаждают в бане со льдом и добавляют гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида (420 мг). Смесь перемешивают при той же температуры в течение полутора часов, а затем при комнатной температуре в течение 6 час. Добавляют к смеси триэтиламин (0,14 мл) и оставляют перемешиваться на ночь при комнатной температуре. Смесь упаривают и остаток разбавляют водой и раствором бикарбоната натрия. Дважды экстрагируют хлористым метиленом, органические вытяжки объединяют, промывают насыщенным раствором соли и сушат над сульфатом магния. После упаривания остаток подвергают хроматографической очистке на колонке с силикагелем (25 г), элюируя смесью хлороформа и метанола (градиентно от 2% до 5%). Основную фракцию упаривают и остаток (0,25 г) растворяют в ТГФ (9 мл). Охлаждают в бане со льдом, добавляют 4N раствор хлористого водорода в этилацетате (0,20 мл) и смесь упаривают. Остаток растирают с эфиром, отфильтровывают и сушат, получая целевое соединение (0,23 г).
Спектр ПМР (DMCO-d6, δ): 1,5 - 2,0 (2H, мультиплет), 2,14 (6H, синглет), 2,7 - 2,9 (9H, мультиплет), 3,12 и 3,16 (3H, синглет), 3,6 - 4,0 (4H, мультиплет), 4,3 - 4,6 (3H, мультиплет), 4,73 (2H, уширенный синглет), 5,1 (1H, мультиплет), 5,5 (1H, мультиплет), 6,87 - 7,3 (10H, мультиплет), 7,7 (1H, мультиплет), 8,05 (2H, мультиплет), 19,91 (1H, уширенный синглет).
Масс-спектр: M+ 517.
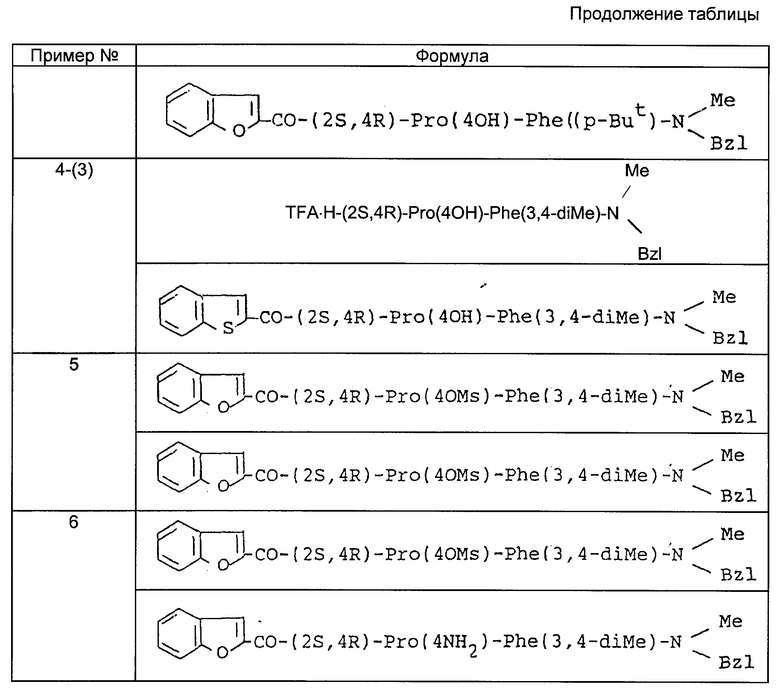
Пример 2. К охлаждаемому в бане со льдом раствору бензофуран-2-карбоновой кислоты (0,15 г), исходного соединения (0,45 г) и N-гидроксибензотриазола (0,12 г) в 9 мл хлористого метилена добавляют 1-этил-3-(3'-диметиламинопропил)карбодиимид (0,17 мл). Смесь перемешивают при той же температуре в течение полутора часов, а затем оставляют на ночь перемешиваться при комнатной температуре. Добавляют к смеси N,N-диметил-1,3-пропандиамин (0,05 мл) и перемешивают еще в течение 2 час. Смесь упаривают и остаток разбавляют водой и экстрагируют этилацетатом. Органический слой последовательно промывают насыщенным раствором бикарбоната натрия, водой, 0,5N раствором соляной кислоты и насыщенным раствором соли и сушат над сульфатом магния. После упаривания сырой продукт подвергают хроматографической очистке на колонке с силикагелем (20 г), элюируя смесью хлороформа и метанола (градиентно от 1 до 2,5%). Упаривают фракции и пульверизуют в диизо-пропиловом эфире, получая целевое соединение (0,40 г).
ИК спектр (вазелиновое масло): 3300, 1630, 1565 см-1.
Спектр ПМР (DMCO-d6, δ): ) 1,85 - 2,15 (2H, мультиплет), 2,15 - 3,10 (2H, мультиплет), 2,76, 2,77 и 2,89 (3H, синглет), 3,60 - 5,20 (8H, мультиплет), 6,85 - 7,80 (13H, мультиплет), 8,50 - 8,80 (1H, мультиплет).
Масс-спектр: M+ 594.
Пример 3. К суспензии бензофуран-2-карбоновой кислоты (0,31 г) и N-гидроксибензотриазола (0,26 г) в хлористом метилене (10 мл) добавляют при комнатной температуре гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида (0,37 г). Полученный раствор перемешивают в течение тридцати минут. В это время, в отдельном сосуде охлаждают в бане со льдом раствор исходного соединения (1,0 г) и триэтиламина (0,29 мл) в хлористом метилене (10 мл). Обе реакционные смеси смешивают при комнатной температуре и оставляют перемешиваться на ночь при комнатной температуре. Упаривают, остаток разбавляют водой и экстрагируют этилацетатом. Органический слой последовательно промывают насыщенным раствором бикарбоната натрия, водой, 1N раствором соляной кислоты и насыщенным раствором соли и сушат над сульфатом магния. После упаривания сырой продукт подвергают хроматографической очистке на колонке с силикагелем (54 г), элюируя смесью хлороформа и метанола (градиентно от 50 : 1 до 20 : 1). Очищенный продукт перекристаллизовывают из смеси этилацетата и ди-изо-пропилового эфира, получая целевое соединение (0,77 г) с т.пл. 137 - 139oC
ИК спектр (вазелиновое масло): 3400, 3250, 3100, 1630, 1570, 1420 см-1.
Спектр ПМР (DMCO-d6, δ): 1,7 - 1,9 (1H, мультиплет), четыре синглета при 2,05, 2,10, 2,11 и 2,17 (1H), 2,2 - 2,4 (1H, мультиплет), четыре синглета при 2,60, 2,64, 2,73 и 2,79 (3H), 2,8 - 3,5 (2H, мультиплет), 3,6 - 4,1 (2H, мультиплет), 4,3 - 5,2 (6H, мультиплет), 6,6 - 7,8 (14H, мультиплет), 8,54 и 8,73 (1H, дублет, J=8 Гц).
Масс-спектр: M+ 553.
Пример 4. Целевое соединение получают аналогично методике, приведенной в примере 3.
(1) ИК спектр (вазелиновое масло): 3300, 1625, 1560 см-1.
Спектр ПМР (DMCO-d6, δ): 1,70 - 2,20 (2H, мультиплет), 2,25 (3H, синглет), 2,20 - 3,10 (5H, мультиплет), 3,50 - 5,25 (8H, мультиплет), 6,70 - 7,90 (14H, мультиплет), 8,45 - 8,80 (1H, мультиплет).
Масс-спектр: M+ 539.
(1) ИК спектр (вазелиновое масло): 3280, 1620, 1560, 1508 см-1.
Спектр ПМР (DMCO-d6, δ): 1,21, 1,22, 1,24 (9H, синглет), 1,60 - 2,45 (2H, мультиплет), 2,58, 2,72, 2,77 (3H, синглет), 2,75 - 3,10 (2H, мультиплет), 3,60 - 3,70, 3,75 - 4,10, 4,20 - 5,25 (8H, мультиплет), 6,75 - 7,85 (14H, мультиплет), 8,45 - 8,80 (1H, мультиплет).
Масс-спект: M+ 581.
(3) Т.пл. 171 - 173oC.
ИК спектр (вазелиновое масло): 3400, 3250, 1667, 1630, 1561 см-1.
Спектр ПМР (DMCO-d6, δ): 1,70 - 2,35 (1H, мультиплет), 2,12, 2,17 (6H, синглет), 2,60, 2,73, 2,79 (3H, синглет), 2,65 - 3,10 (2H, мультиплет), 3,60 - 5,20 (8H, мультиплет), 6,50 - 8,10 (13H, мультиплет), 8,50 - 8,85 (1H, мультиплет).
Масс-спектр: M+ 569.
Пример 5. К раствору исходного соединения (3,20 г) в хлористом метилене (32 мл) при охлаждении в бане со льдом добавляют триэтиламин (1,61 мл). К полученному раствору, поддерживая температуру не выше 6oC, добавляют раствор хлористого мезила (0,45 мл) в хлористом метилене (5 мл). Перемешивают в течение трех часов, добавляют триэтиламин (1,61 мл) и по каплям раствор хлористого мезила (0,45 мл) в хлористом метилене (5 мл). Смесь перемешивают еще в течение полутора часов, а затем промывают водой. Органический слой сушат над сульфатом магния, упаривают и получают целевое соединение (3,61 г) в виде аморфного вещества.
ИК спектр (хлороформ): 3300, 1680, 1630, 1175 см-1.
Спектр ПМР (DMCO-d6, δ): 1,9 - 2,3 (2H, мультиплет), 2,10, 2,12 и 2,17 (6H, синглет), 2,64, 2,74, 2,78 (3H, синглет), 2,6 - 3,3 (2H, мультиплет), 3,26 и 3,30 (3H, два синглета), 3,8 - 5,0 (5H, мультиплет), 5,1 - 5,4 (2H, мультиплет), 6,5 - 7,8 (13H, мультиплет), 8,67 и 8,81 (1H, дублет, J = 8 Гц).
Пример 6. К раствору исходного соединения (3,60 г) в DMCO (18 мл) добавляют азид натрия (0,74 г). Раствор нагревают до 70oC в течение 16,5 час. Охлаждают, добавляют этилацетат (100 мл) и раствор промывают водой (три раза) и насыщенным водным раствором соли. Органический слой сушат над сульфатом магния и упаривают, получая концентрат промежуточного соединения (около 50 мл). К этому раствору добавляют трифенилфосфин (1,49 г) и нагревают до 50oC в течение 2 час. Добавляют воду (0,31 мл) и смесь нагревают до 65oC в течение 4,5 час. Выпавший осадок отфильтровывают и очищают хроматографически на колонке с силикагелем (150 г), элюируя смесью хлороформ-метанол (градиентно от 20 : 1 до 5 :1). Основные фракции упаривают и получают целевое соединение (1,97 г).
Исходное соединение (0,43 г) при нагревании растворяют в этаноле. Охлаждают в бане со льдом, добавляют 4N раствор хлористого водорода в диоксане (0,21 мл) и раствор упаривают. Остаток распыляют в диизопропиловом эфире, отфильтровывают и сушат, получая целевое соединение (0,40 г) с т.пл. 130oC.
ИК спектр (вазелиновое масло): 3450, 3250, 1625, 1565 см-1.
Спектр ПМР (DMCO-d6, δ): 1,6 - 2,2 (2H, мультиплет), 2,10, 2,13 и 2,18 (6H, синглет), 2,66 и 2,76 (3H, два синглета), 2,6 - 3,0 (2H, мультиплет), 3,7 - 5,3 (7H, мультиплет), 6,6 - 7,9 (13H, мультиплет), 8,39 (3H, синглет), 9,04 (1H, мультиплет).
Пример 7. Капсулы
Соединение примера 3 - 1 мг
Лактоза - 39 мг/40 мг
Компоненты тщательно перемешивают и полученной смесью заполняют стандартные сухие желатиновые капсулы.
Пример 8. Суспензия
Соединение примера 3 - 1 мг
Диметилсульфоксид - 100 мл
Для приготовления суспензии используют стандартную методику диспергирования.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛОПЕПТИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2108342C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2128172C1 |
| СОЕДИНЕНИЯ ЦЕФЕМА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2081874C1 |
| ПРОИЗВОДНЫЕ ЭТАНОЛАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2125983C1 |
| ПРОИЗВОДНЫЕ N-(3-ПИПЕРИДИНИЛКАРБОНИЛ)-БЕТА-АЛАНИНА В КАЧЕСТВЕ АНТАГОНИСТОВ ФАКТОРА АКТИВАЦИИ ТРОМБОЦИТОВ (ФАТ), СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2161155C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
| ПОЛИПЕПТИДНОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2165423C2 |
| ПОЛИПЕПТИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ/И ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ | 1994 |
|
RU2164230C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2021990C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АЛКАНСУЛЬФОНАНИЛИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1988 |
|
RU2012557C1 |
Назначение: в медицине, как обладающие антагонизмом по отношению к тахикинину. Сущность изобретения: производные пептидов формулы I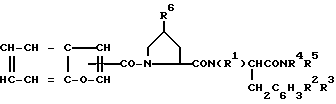
где R1 - водород, (низш.)алкил; R2 - (низш)алкил, галоген; R3 - водород, (низш. )алкил, галоген; R4 - (низш)алкил; R5 - арил(низш)алкил, R6 - NH2 или необязательно замещенная гидроксильная группа, или их фармацевтически приемлемые соли. Соединения формулы I получают путем взаимодействия соединения II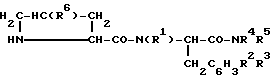
или его реакционноспособного производного по аминогруппе и соединения III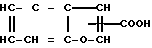
или его реакционноспособного производного по аминогруппе; фармацевтическая композиция, содержащая в качестве активного начала эффективное количество производного пептида формулы I или его фармацевтически приемлемой соли, способ ингибирования действия тахикинина путем воздействия на тахикининовые рецепторы - производного пептида формулы I в эффективном количестве. Соединения по изобретению могут найти применение при лечении или предотвращении болезней, в которых посредником является тахикинин, например респираторных заболеваний, таких как астма, бронхит, ринит, кашель, отхаркивание и т. п.; глазных болезней, таких как конъюктивит, весенний конъюктивит и т.п.; кожных заболеваний, таких как контактный дерматит, диффузный нейродермит, крапивница и т.п.; воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит и т.п.; болей и приступов боли (мигрени, головной, зубной боли, боли при раке, боли в спине и т.п.) у человека или животных. 4 с. и 2 з.п. ф-лы, 1 табл., 4 ил.
где R1 обозначает атом водорода или низший алкил;
R2 обозначает низший алкил или атом галогена;
R3 обозначает атом водорода, низший алкил или атом галогена;
R4 обозначает низший алкил;
R5 обозначает арил (низший) алкил;
R6 обозначает аминогруппу или необязательно замещенную гидроксильную группу;
X обозначает атом кислорода,
или их фармацевтически приемлемые соли.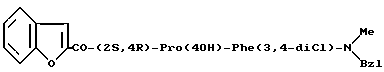
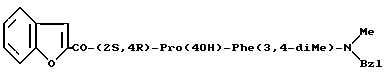
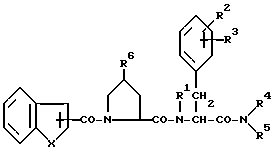
4. Способ получения соединения формулы I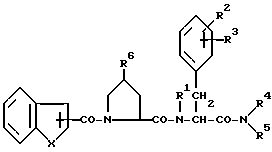
где R1 обозначает атом водорода или низший алкил;
R2 обозначает низший алкил или атом галогена;
R3 обозначает атом водорода, низший алкил или атом галогена;
R4 обозначает низший алкил;
R5 обозначает арил (низший) алкил;
R6 обозначает аминогруппу или необязательно замещенную гидроксильную группу;
X обозначает атом кислорода,
и его фармацевтически приемлемой соли, отличающийся тем, что соединение формулы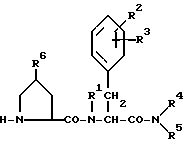
где R1, R2, R3, R4, R5, R6 каждый имеют указанное значение,
его реакционноспособное производное по аминогруппе, или его соль вводят во взаимодействие с соединением
где значение X указано выше,
или его реакционноспособным производным по карбоксильной группе или его солью.
| Шредер Э., Любке К | |||
| Пептиды | |||
| -М.: Мир, 1967, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения бензидиновых оснований | 1921 |
|
SU116A1 |
| Шлихта для искусственных волокон | 1972 |
|
SU443132A1 |
Авторы
Даты
1998-10-10—Публикация
1993-04-09—Подача