Изобретение относится к химии углеводов и касается способа получения биологически активных водорастворимых полисахаридов из сырья растительного происхождения, в частности, бурых водорослей. Эти полисахариды могут быть использованы в медицине, в том числе в химико-фармацевтической промышленности, рыбоводстве, микробиологии и т.д.
Бурые водоросли являются одним из наиболее богатых и легко возобновляемых источников широко известных, интересных по структуре и биологической активности водорастворимых полисахаридов: ламинаранов, фукоиданов [1-13]. Так, например, ламинараны являются криопротекторами [6], антираковыми препаратами [7] , активируют иммунную систему рыб [2], фукоиданы обладают антираковой, антикоагулянтной, антитромбической, антивирусной активностями, в том числе против ВИЧ, вирусов гепатита и герпеса и т.д. [3-5, 7, 14].
Химическое строение водорастворимых полисахаридов бурых водорослей весьма разнообразно [1-13]. Ламинараны - низкомолекулярные 1 → 3; 1 → 6β-D- глюканы, гетерогенные по молекулярным массам, расположению и содержанию β -1--->6-связанных остатков глюкозы. Фукоиданы представляют собой семейство сульфатированных гомо- и гетерополисахаридов, где основным моносахаридным остатком является L-фукоза, а кроме L-фукозы в их составе обнаружены галактоза, манноза, ксилоза и глюкуроновая кислота. Фукоиданы гетерогенны по молекулярным массам, моносахаридному составу, степени сульфатирования. Содержание и структурные характеристики этих полисахаридов значительно изменяются в зависимости от источника, а также внутри одного источника в зависимости от сезона сбора и возраста водоросли [1, 8].
В связи с необходимостью установления связи структура - биологическое действие, получения лекарственных препаратов на основе биологически-активных фракций встает проблема разделения ламинаранов, фукоиданов и их фракционирования.
В литературе практически не описаны методы комплексного получения водорастворимых полисахаридов: выделения ламинаранов и фукоиданов из одного и того же экстракта. Это, возможно, связано с тем, что для получения, например, фукоиданов предпочитают использовать водоросли, не содержащие ламинаранов. Так, бурая водоросль Fucus vesiculosus, фукоидан из которой в настоящее время является коммерческим препаратом, и именно его биологическое действие и структурные характеристики наиболее широко изучаются, практически не содержит ламинарана [14] . В случае необходимости получения ламинарана фукоиданы, содержащиеся в значительных количествах во всех исследованных бурых водорослях, удаляют из раствора в виде нерастворимых солей с тяжелыми металлами или нерастворимых комплексов с цетавлоном (цетилтриметиламмонием бромистым) [12, 16]. Извлечение фукоидана из этих комплексов является трудоемким процессом, связанным с большими потерями целевого вещества.
Анализ известных в настоящее время способов выделения и фракционирования водорастворимых полисахаридов бурых водорослей показывает, что процессы выделения их состоят из нескольких общих стадий [12, 14, 16, 17]:
1. Удаление низкомолекулярных веществ экстракцией различными растворителями [12, 16]; эту стадию опускают очень редко [14, 17]. Обычно для выделения полисахаридов используют высушенную водоросль.
2. Экстракция при повышенной температуре (иногда при различных температурах - 20-25o и 60 - 90oC) водорастворимых полисахаридов из измельченной водоросли или деионизированной и обезжиренной водоросли водой или водой с добавлением CaCl2, либо слабыми кислотами с добавлением формальдегида для удаления полифенолов, либо без него [12, 14, 16, 17].
3. Разделение ламинарана и фукоидана либо осаждением фукоидана в виде комплексов его с цетавлоном, либо с помощью анионообменных смол, на которых фукоидан сорбируется. Ламинаран, если он содержится в водоросли, и в первом и во втором случае остается в растворе [12, 16].
Наиболее близкий предлагаемому решению способ, позволяющий одновременно выделять и фракционировать водорастворимые полисахариды, разработан для бурой водоросли Laminaria cichorioides [16]. Эта водоросль содержит примерно одинаковые количества ламинаранов и фукоиданов и является наилучшим объектом для разработки способа комплексного получения ламинаранов и фукоиданов. Способ - прототип включает: фракционную экстракцию водоросли L. cichorioides различными растворителями (метанолом, хлороформом, этанолом) при различных температурах с целью удаления низкомолекулярных веществ. Последовательную экстракцию полисахаридов 2%-ным водным раствором CaCl2 при 20oC и 0.1 N HCl при 70oC. Разделение ламинаранов и фукоиданов цетавлоном, при этом ламинаран остается в растворе, из которого его после диализа осаждают водным этанолом (80%-ным). Разрушение комплекса фукоиданов с цетавлоном проводят 3 М CaCl2 при 60oC. Фукоиданы после диализа фракционируют, используя анионообменную смолу DEAE-сефадекс А-25 (Cl-форма). Фукоиданы элюируют с ионообменника и одновременно фракционируют по содержанию сульфатов повышающимся градиентом хлористого натрия в воде (1.25, 1.5, 1.75 и 3 М растворами NaCl). Способ позволяет разделять ламинараны и фукоиданы и фракционировать фукоиданы по степени сульфатирования.
К недостаткам способа можно отнести многостадийность и трудоемкость процесса, связанного с использованием цетавлона и анионообменных смол, а именно, разрушением цетавлоновых комплексов, необходимостью проведения диализа растворов. Это все приводит также к потерям фукоиданов, кроме того низкосульфатированные фракции фукоиданов не высаждаются цетавлоном и также теряются. Как показано в работе [14], где предложен способ выделения и фракционирования водорастворимых полисахаридов из F. vesiculosus, с помощью ионнообменной хроматографии, часть фукоиданов из F. vesiculosus не сорбируется на анионообменной смоле, которую используют в способе-прототипе, причем именно эта часть обладает действием против ВИЧ-инфекции. В способе-прототипе также отсутствует фракционирование ламинарана. Предлагаемый нами способ показан на фиг.1 и включает:
1. Последовательную обработку сухой (50%-ным водным этанолом) или, предпочтительнее, свежей или свежезамороженной бурой водоросли этанолом (1:1, по весу), ацетоном и хлороформом, куда уходят соли, частично полифенолы, низкомолекулярные вещества (в том числе маннит, моно-, олигосахариды, аминокислоты, пептиды, пигменты, липиды, йодсодержащие вещества, витамины А, В и т. д.). В растворители экстрагируется около 30-40% веществ от сухого веса водоросли. Далее спиртовый экстракт бурых водорослей может непосредственно применяться в косметической промышленности и медицине как йодсодержащий препарат, средство для лечения ангины, заболеваний слизистых. Вещества, экстрагируемые ацетоном и хлороформом, также могут применяться в косметической промышленности [16].
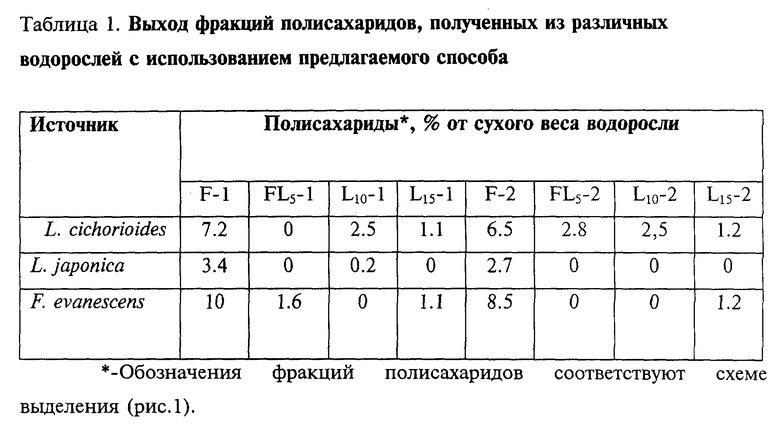
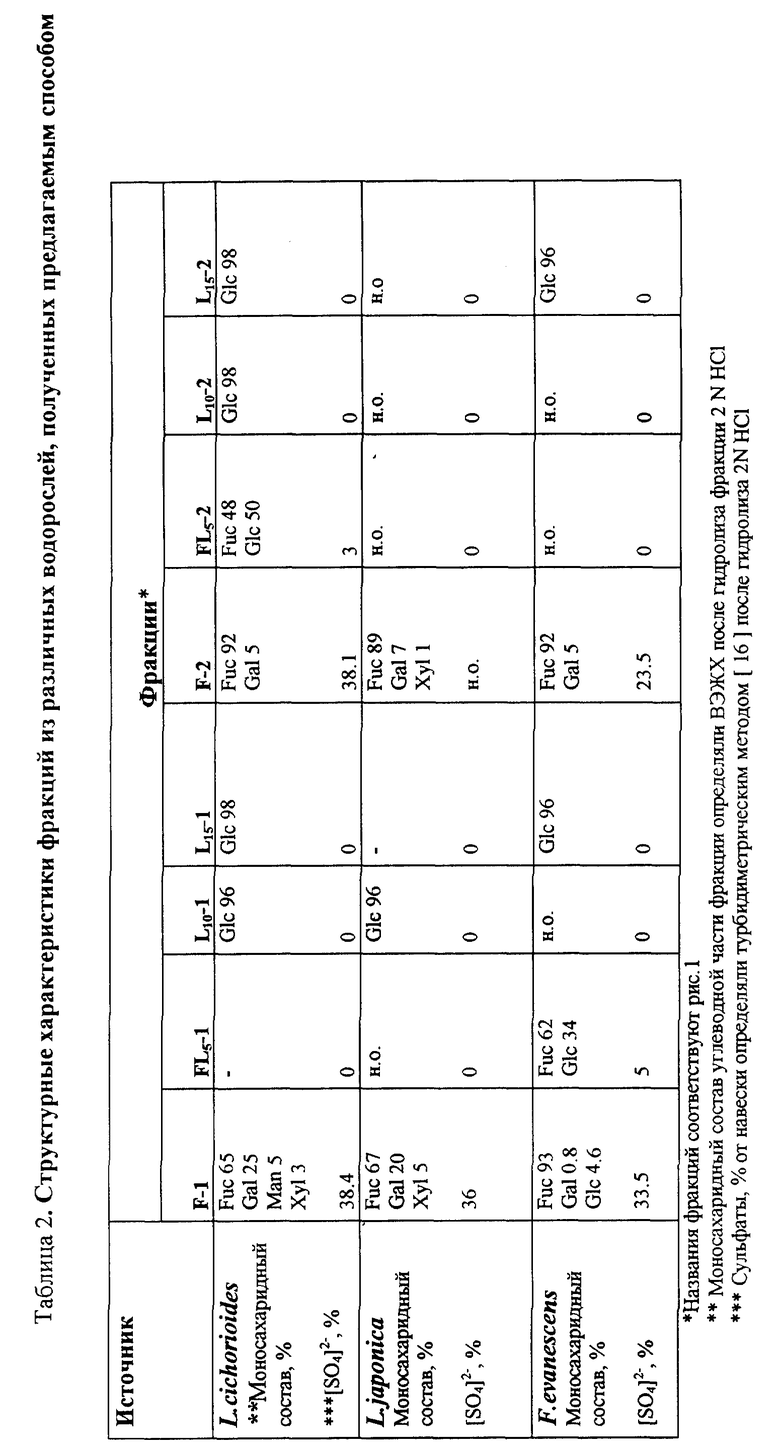
2. Последовательную экстракцию полисахаридов из остатка водоросли 0.1 N HCl с добавлением (1 мл/л) 40%-ного формальдегида при комнатной температуре и водой при повышенной температуре (60 - 70oC). Последовательная экстракция при различных температурах позволяет уже на стадии выделения расфракционировать основные углеводные компоненты по молекулярным массам, степени разветвленности [13] , фукоиданы - по моносахаридному составу (табл. 1, 2). Так, фракция F-1 из L. cichorioides состояла из фукозы (65%), галактозы (25%), маннозы (5%), рамнозы (3%) и ксилозы (2%), фракция F-2 из L. cichorioides состояла из фукозы (92%) и галактозы (5%).
3. Полученные экстракты раздельно наносят на колонки с гидрофобным носителем (политетрафторэтилен). Ламинаран адсорбируется гидрофобным носителем. Высокосульфатированные фукоиданы легко элюируют водой (табл.1, 2, фиг. 2, А). Ступенчатым градиентом спирта в воде элюируют с носителя ламинаран в смеси с низкосульфатированным фукоданом (5%-ный водный этанол, табл. 1,2 содержание сульфатов не более 5%) и фракции ламинарана (10-, 15-%-ный водный этанол, табл. 1, 2, фиг.2, В).
4. Фукоиданы из раствора высаждают полностью 80%-ым водным этанолом, либо последовательно 60- и 80%-ным водным этанолом. Фракции, элюируемые с Полихрома-1 5-, 10- или 15%-ным водным этанолом, высушивают лиофильно. Выход водорастворимых полисахаридов составляет в зависимости от вида водоросли от 10 до 25% от сухого веса водоросли (табл. 1).
5. Гидрофобный носитель регенерируют этанолом, которым с колонки элюируются более гидрофобные, чем ламинаран, вещества, составляющие около 20-30% от сухого веса водоросли. При необходимости (например, в случае сильной пигментации носителя после пропускания экстрактов) проводят дополнительную регенерацию 0.5-1.0 М растворами щелочи и/или соляной кислоты в зависимости от природы пигмента.
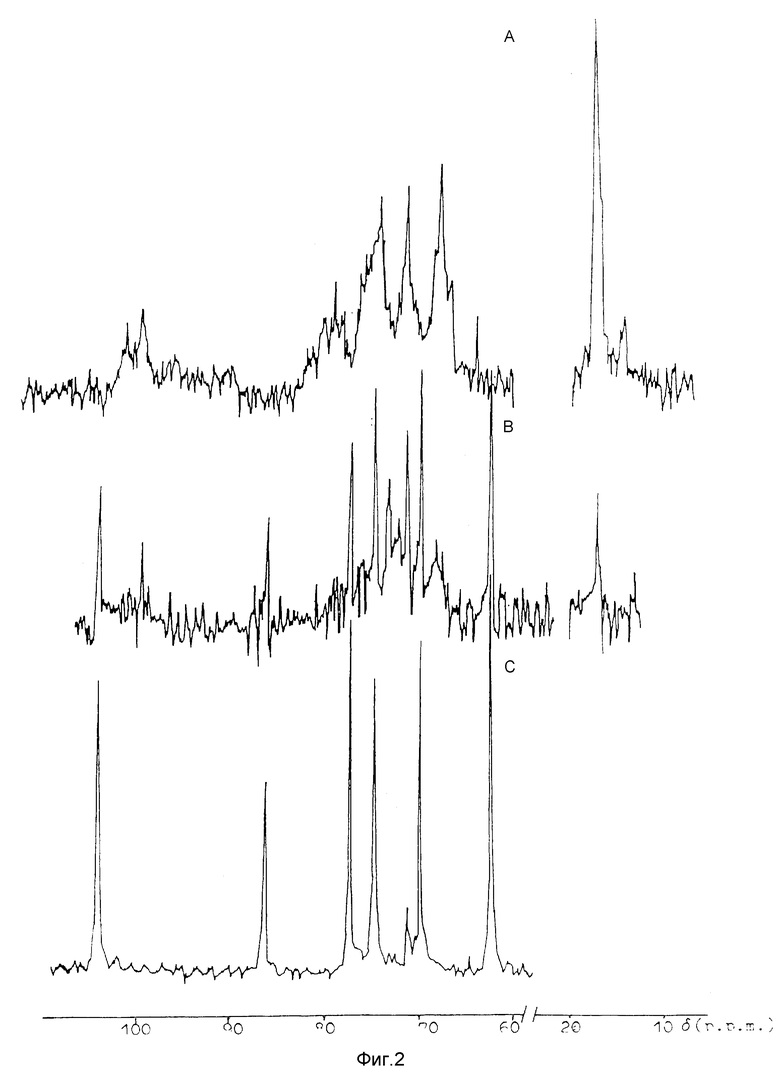
Идентификацию полученных фракций проводили с помощью следующих методов. Моносахаридный состав фракций определяли после гидролиза 2 N HCl (100oC, 1 час) углеводным анализатором "Biotronik", Германия. Полисахариды во фракциях идентифицировали также с помощью 13C-ЯМР-спектроскопии. Спектры ЯМР-13C позволяют отнести полисахариды к определенному типу [4, 13, 16]. Так, для ламинаранов характерными являются сигналы C1 (103-104 м.д.), C3 (β - 1,3, 85-87 м. д.) и C6 атомов (61-62 м.д.). В спектрах ЯМР-13C фукоиданов характерными являются сигналы C1 атомов (96-100 м.д.), интенсивные сигналы около 68 и 72 м.д. и 73-78 м.д., относящиеся к кольцевым C-атомам несульфатированным и негликозилированным и сульфатированным и гликозилированным, соответственно, и сигналов C6 атомов (17,9-18,3 м.д.). Для альгиновых кислот характерны сигналы C1 (100-102 м.д.) C6 (175-178 м.д.). Спектры ЯМР-13C получены на приборе Bruker WM-250 в D2O при 40oC. В качестве внутреннего стандарта использовался метанол (50, 15). На фиг.2 приведены C13-ЯМР-спектры, характерные для фракций F (фукоиданы), низкосульфатированных фракций FL (смесь фукоидана и ламинарана) и L (ламинараны). Как видно из табл. 2, новый способ впервые дает возможность получения из природной смеси низкосульфатированных фракций FL. Тонкая структура полисахаридов этих фракций представляет предмет для дальнейшего исследования.
Ранее нами был предложен способ извлечения ламинаранов из экстрактов сухих водорослей с помощью гидрофобного носителя - Полихрома-1 (политетрафторэтилена) [17], но способ не предполагает выделения фукоиданов, равно как и ступенчатого фракционирования фукоиданов и ламинаранов с целью получения стандартных фракций этих биологически активных, гетерогенных полисахаридов. Способ также не предусматривает обработку водоросли растворителями, что возможно при получении ламинарана, но нежелательно в случае использования гидрофобного носителя для создания технологии комплексной переработки водоросли, т. е. не только для получения ламинарана, но и для получения других водорастворимых полисахаридов.
Предлагаемый нами способ был применен для выделения и фракционирования водорастворимых полисахаридов из бурых водорослей L. cichorioides (пример 1), L.japonica (пример 2) и F. evanescens (пример 3). Эти водоросли являются широко распространенными на Дальнем Востоке и, как известно, значительно отличаются друг от друга содержанием и структурами входящих в их состав полисахаридов. Наибольшее содержание (до 12%) ламинарана характерно для L. cichorioides, наименьшее (менее 1%) - для L. japonica, для F. evanescens содержание ламинарана около 3-5% [12, 13, 16, 17].
Фракции фукоиданов, полученные данным способом, несколько отличаются по структурным характеристикам от фракций, полученным по способу-прототипу, а также друг от друга в зависимости от вида водоросли и типа экстракции (табл. 2). В ИК-спектрах фракций фукоиданов, полученных из L.cichorioides предлагаемым способом имеется полоса поглощения при 840 см-1, указывающая на аксиальное положение сульфатной группы (т.е. при C4). Для фракций, выделенных из F. evanescens характерна полоса при 820 см-1 свидетельствующая о наличии сульфатной группы в экваториальном положении (т.е. при C2 или C3). Такое отличие является существенным, так как проявление различного биологического действия фукоиданов зависит от наличия и положения сульфатов в данных полисахаридах.
Пример 1 (фиг. 1, 2, табл. 1, 2).
5 кг измельченной свежей водоросли L.cichorioides заливают 5 кг этанола и выдерживают при комнатной температуре не менее суток, водоросль отделяют и заливают последовательно ацетоном (5 кг) и хлороформом (5 кг), в каждом случае выдерживая смесь при комнатной температуре не менее суток при перемешивании.
После обработки растворителями проводят последовательную экстракцию полисахаридов из остатка водоросли 0.1 N HCl с добавлением (1 мл/л) 40%-ного формальдегида (5л; 4-5часов) при перемешивании при комнатной температуре (холодная экстракция) и водой (5 л: 4-5 часов) при повышенной температуре (50 - 60oC; горячая экстракция). Полученные экстракты раздельно наносят на колонки (9х70 см) с гидрофобным носителем Полихромом-1 (политетрафторэтиленом). Фукоидан элюируют водой (около 10 л) до отрицательной реакции на сахара (фенол-сернокислотный метод) [18]. Ступенчатым градиентом спирта в воде элюируют фракции ламинарана в смеси с фукоиданом (5%-ный водный этанол; около 3 л) и ламинаранов (10-, 15%-ный водный этанол, примерно по 2.5 л), каждый раз отмывая носитель до отрицательной реакции на сахара. Фукоидан из раствора высаждают последовательно 60- и 80%-ным водным этанолом. Осадки фукоиданов промывают спиртом и ацетоном и сушат на воздухе. Растворы ламинаранов, элюируемые с Полихрома-1 5-, 10- или 15%-ным водным этанолом высушивают лиофильно. Носитель регенерируют этанолом (5 л), которым с колонки элюируются более гидрофобные, чем ламинаран, вещества, составляющие около 20-30% от сухого веса водоросли, и водой (7-10 л). При необходимости (например, в случае сильной пигментации носителя после пропускания экстрактов) проводят дополнительную регенерацию 0.5-1.0 М растворами щелочи и/или соляной кислоты. Выходы ламинарана и фукоидана составляют, соответственно, 10.1 и 13.7% от сухого веса водоросли L.cichorioides. Выходы отдельных фракций полисахаридов от сухого веса водоросли приведены в таблице 1.
Пример 2 (фиг. 1, табл. 1, 2).
5 кг измельченной свежей водоросли L.japonica заливают 5 кг этанола и выдерживают при комнатной температуре не менее суток, водоросль отделяют и заливают последовательно ацетоном (5 кг) и хлороформом (5 кг), в каждом случае выдерживая смесь при комнатной температуре не менее суток при перемешивании.
После обработки растворителями проводят последовательную экстракцию полисахаридов из остатка водоросли 0.1 N HCl с добавлением (1 мл/л) 40%-ного формальдегида (5 л; 4-5 часов) при перемешивании при комнатной температуре (холодная экстракция) и водой (5 л; 4-5 часов) при повышенной температуре (50 - 60oC; горячая экстракция). Полученные экстракты раздельно наносят на колонки (9х70 см) с Полихромом-1. Фукоидан элюируют водой (около - 10 л) до отрицательной реакции на сахара (фенол-сернокислотный метод [18]). Ступенчатым градиентом спирта в воде элюируют фракции ламинарана в смеси с фукоиданом (5%-ный водный этанол; около 3 л) и ламинаранов (10-, 15%-ный водный этанол, примерно по 2.5л), каждый раз отмывая носитель до отрицательной реакции на сахара. Фукоидан из раствора высаждают полностью 80%-ным водным этанолом. Осадки фукоиданов промывают спиртом и ацетоном и сушат на воздухе. Растворы ламинаранов, элюируемые с Полихрома-1 5-, 10- или 15%-ным водным этанолом, высушивают лиофильно. Носитель регенерируют этанолом (5 л), которым с колонки элюируются более гидрофобные, чем ламинаран, вещества, составляющие около 20-30% от сухого веса водоросли и водой (7-10 л). При необходимости (например, в случае сильной пигментации носителя после пропускания экстрактов) проводят дополнительную регенерацию 0.5-1.0 М растворами щелочи и/или соляной кислоты. Выходы ламинарана и фукоидана составляют, соответственно, 0.5 и 5.3% от сухого веса водоросли L.japonica. Выходы отдельных фракций полисахаридов от сухого веса водоросли приведены в таблице 1.
Пример 3 (фиг. 1, табл. 1,2).
5 кг измельченной свежезамороженной водоросли F.evanescens заливают 5 кг этанола и выдерживают при комнатной температуре не менее суток, водоросль отделяют и заливают последовательно ацетоном (5 кг) и хлороформом (5 кг), в каждом случае выдерживая смесь при комнатной температуре не менее суток при перемешивании.
После обработки растворителями проводят последовательную экстракцию остатка водоросли 0.1 N HCl с добавлением (1 мл/л) 40%-ного формальдегида (5 л; 4-5 часов) при перемешивании при комнатной температуре (холодная экстракция) и водой (5 л; 4-5 часов) при повышенной температуре (50 - 60oC; горячая экстракция). Полученные экстракты раздельно наносят на колонки (9х70 см) с Полихромом-1. Фукоидан элюируют водой (около 10 л) до отрицательной реакции на сахара (фенол-сернокислотный метод [18]). Ступенчатым градиентом спирта в воде элюируют фракции ламинарана в смеси с фукоиданом (5%-ный водный этанол; около 3 л) и ламинаранов (10-, 15%-ный водный этанол, примерно по 2.5 л), каждый раз отмывая носитель до отрицательной реакции на сахара. Фукоидан из раствора высаждают последовательно 60- и 80%-ным водным этанолом. Осадки фукоиданов промывают спиртом и ацетоном и сушат на воздухе. Растворы ламинаранов, элюируемые с Полихрома-1 5-, 10- или 15%-ным водным этанолом, высушивают лиофильно. Носитель регенерируют этанолом (5 л), которым с колонки элюируется более гидрофобные, чем ламинаран, вещества, составляющие около 20-30% от сухого веса водоросли и водой (7-10л). При необходимости (например, в случае сильной пигментации носителя после пропускания экстрактов) проводят дополнительную регенерацию 0.5-1.0 М растворами щелочи и/или соляной кислоты. Выходы ламинарана и фукоидана составляют, соответственно, 3.9 и 18.5% от сухого веса водоросли F.evanescens. Выходы отдельных фракций полисахаридов от сухого веса водоросли приведены в таблице 1.
Пример 4 (фиг. 1, табл. 1, 2).
500 г сухой водоросли L. cichorioides заливают 5 кг 50%-ного водного этанола и выдерживают при комнатной температуре не менее суток, водоросль отделяют и заливают последовательно ацетоном (5кг) и хлороформом (5 кг), в каждом случае выдерживая смесь при комнатной температуре не менее суток при перемешивании.
После обработки растворителями проводят последовательную экстракцию остатка водоросли 0.1 N HCl с добавлением (1 мл/л) 40%-ного формальдегида (5 л; 4-5 часов) при перемешивании при комнатной температуре (холодная экстракция) и водой (5 л; 4-5 часов) при повышенной температуре (50 - 60oC; горячая экстракция). Полученные экстракты раздельно наносят на колонки (9 х 70 см) с Полихромом-1. Фукоидан элюируют водой (около 10 л) до отрицательной реакции на сахара (фенол-сернокислотный метод [18]). Ступенчатым градиентом спирта в воде элюируют фракции ламинарана в смеси с фукоиданом (5%-ный водный этанол; около 3 л) и ламинаранов (10-, 15%-ный водный этанол, примерно по 2.5 л), каждый раз отмывая носитель до отрицательной реакции на сахара. Фукоидан из раствора высаждают последовательно 60- и 80%-ным водным этанолом. Осадки фукоиданов промывают спиртом и ацетоном и сушат на воздухе. Растворы ламинаранов, элюируемые с Полихрома-1 5-, 10- или 15%-ным водным этанолом, высушивают лиофильно. Носитель регенерируют этанолом (5 л), которым с колонки элюируется более гидрофобные, чем ламинаран, вещества, составляющие около 20-30% от сухого веса водоросли и водой (7-10 л). При необходимости (например, в случае сильной пигментации носителя после пропускания экстрактов) проводят дополнительную регенерацию 0.5-1.0 М растворами щелочи и/или соляной кислоты. Выходы ламинарана и фукоидана составляют, соответственно, 11 и 12.5% от сухого веса водоросли L.cichorioides.
Подписи к чертежам
Фиг. 1. Схема выделения и фракционирования водорастворимых полисахаридов бурых водорослей.
Фиг. 2. 13C-ЯМР-спектры различных фракций (А - F-2, В - FL5-2, С - L15-2), полученных из L. cichorioides предлагаемым способом
Литература.
1. T.J. Painter, Pure Appl. Chem., 55 (1983) 677.
2. М. И. Киселева, Т. Н. Звягинцева, Л.А. Елякова, Патент N 2081575, опубл. БИ N17 (1997).
3. Т. Nishino, Y. Aizu and Т. Nagumo, Thrombosis Research, 64 (1991) 723.
4. Т. Nishino and Т. Nagumo, Carbohydr. Res., 211 (1991) 77.
5. M. O. Mcclure, J.P. Moore, D.F. Blanc et al, AIDS Research and Human Retroviruses, 8 (1992) 19.
6. Г. Н. Лихацкая, Д.Л. Аминин, Т.Н. Звягинцева, Л.А. Елякова, Патент N 2034026, Опубл. БИ N12 (1995).
7. Remedium-Журнал о российском рынке лекарств, N4 (1992) 49.
8. E. Percival, R.H. McDowell, Chemistry and Enzymology of Marine Algae Polysaccharides. N.Y-L.: Acad. Press, 1967, p.53.
9. S. Patankar, S. Oehniger, T. Barnett et al, J. Biol. Chem., 268 (1993) 21770.
10. T. Nishino, С. Nishioka, H. Ura and T. Nagumo, Carbohydr. Res., 255 (1994) 213.
11. T. Nishino, Y. Takabe and T. Nagumo, Carbohydr. Polymers, 23 (1994) 165.
12. T.N. Zvyagintseva, L.A. Elyakova, Carbohydr. Res., 34 (1974) 241.
13. Т. Н. Звягинцева, Н.И. Широкова, Л.А. Елякова, Биоорган. химия, 20 (1994) 1349.
14. A. Beress, 0. Wassermann, T. Bruhn, L. Beress, E.L. Kraiselburd, L. V. Gonzalez, G.E. de Motta, P.I. Chavez, J. of natural products, 56 (1993) 478.
15. А. Л. Войцеховская, И. И. Вольфензон, Косметика сегодня, Москва, "Химия", 1988, С.260.
16. А.И. Усов, А.В. Кирьянов, Биоорган, химия, 20 (1994) 1342.
17. Т.Н. Звягинцева, Е.В. Сундукова, Л.А. Елякова, Патент SU 1642725 БИ N 22 (1996).
18. М. Dubois, K.A.Gilles, J.K. Hamilton, P.A. Reibers, F. Smith, Anal. Chem.28(1956)350.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВЫХ ИНГИБИТОРОВ ГЛЮКАНАЗ | 1999 |
|
RU2162708C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО КИСЛОГО СУЛЬФАТИРОВАННОГО ПОЛИСАХАРИДА ИЗ МОРСКИХ ВОДОРОСЛЕЙ - ФУКОИДАНА | 2001 |
|
RU2240329C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1 -> 3, 1 -> 6-БЕТА-D-ГЛЮКАНА, ОБЛАДАЮЩЕГО ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 1993 |
|
RU2095417C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ БУРЫХ ВОДОРОСЛЕЙ С ПОЛУЧЕНИЕМ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНЫ И КОСМЕТОЛОГИИ | 2003 |
|
RU2240816C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИКОАГУЛЯНТНЫМ И ИММУНОТРОПНЫМ ДЕЙСТВИЕМ | 2002 |
|
RU2247574C2 |
| СПОСОБ ПЕРЕРАБОТКИ БУРЫХ ВОДОРОСЛЕЙ | 2008 |
|
RU2360545C1 |
| ШТАММ БАКТЕРИЙ PSEUDOALTEROMONAS ISSACHENKONII КММ 3549 - ПРОДУЦЕНТ ФУКОИДАН-ГИДРОЛАЗЫ И ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ЕГО КУЛЬТИВИРОВАНИЯ | 2002 |
|
RU2207370C1 |
| Способ комплексной переработки бурых водорослей | 2018 |
|
RU2676271C1 |
| Способ получения полисахаридов из шрота (отходов переработки) бурых водорослей | 2022 |
|
RU2793805C1 |
| СПОСОБ ПЕРЕРАБОТКИ МОРСКИХ ВОДОРОСЛЕЙ И ФУНКЦИОНАЛЬНЫЕ ПРОДУКТЫ (ВАРИАНТЫ) | 2008 |
|
RU2385654C2 |
Изобретение относится к химии углеводов и касается комплексного получения биологически активных водорастворимых полисахаридов, в частности ламинаранов и фукоиданов. Способ предусматривает обработку свежих, или свежезамороженных, или сухих водорослей растворителями с целью удаления низкомолекулярных веществ, экстракцию полисахаридов 0,1 N соляной кислотой при комнатной температуре и водой при 50 -60°С. Разделение ламинаранов и фукоиданов и последующее их фракционирование осуществляют с помощью гидрофобной хроматографии. Последовательно полученные экстракты полисахаридов наносят на колонки раздельно. В качестве гидрофобного сорбента используют полихром-1. Технический результат - упрощение процесса и увеличение выхода целевого продукта. 2 з.п. ф-лы, 2 табл., 2 ил.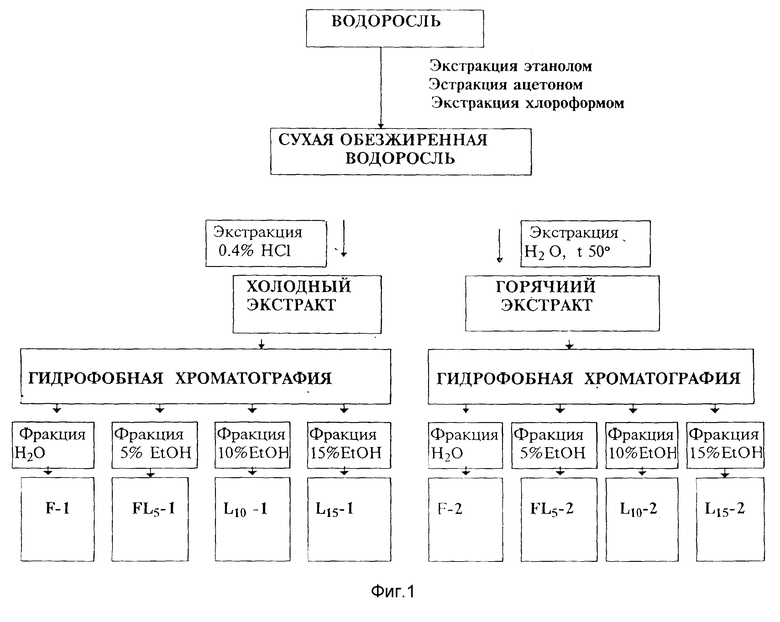
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| SU 16427125 A1, 10.08.96 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Усов А.И., Кирьянов А.В | |||
| Биоорганич | |||
| химия | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Звягинцева Т.Н., Широкова Н.И., Елякова Л.А | |||
| Биоорганич | |||
| химия | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Прибор для определения долготы места | 1923 |
|
SU1349A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| T.Nishino et al | |||
| Carbohydrate Research, (1994), V | |||
| Гудок | 1921 |
|
SU255A1 |
| Кулиса для фотографических трансформаторов и увеличительных аппаратов | 1921 |
|
SU213A1 |
Авторы
Даты
1999-08-27—Публикация
1998-06-17—Подача