Настоящее изобретение относится к новому способу сульфинилирования гетероциклических соединений. Сульфинилирование гетероциклических соединений, т.е. введение группы RS(O)-, классически осуществляют путем воздействия продукта формула RSX (где R и X имеют нижеуказанные значения) на гетероциклическое соединение, содержащее атом водорода у замещаемого углерода. Эта реакция, следовательно, приводит к сульфенил-гетероцикличекому соединению, которое нужно окислять для получения целевого сульфинильного соединения. Однако, оказывается, что эта стадия окисления часто затруднительна. Более того, соединение RSX в некоторых случаях найдено очень токсичным, например, соединение CF3SCl, с которым нужно очень осторожно обращаться. Другой классический способ состоит в прохождении через стадию получения промежуточного дисульфидного соединения, расщепляемого на уровне S-S - связи с помощью соединения R X, которое дает сульфенильное соединение, которое затем окисляют до сульфинильного соединения. В этом способе избегают применения соединения RSX, но не избегают стадии последующего окисления.
Следовательно, предметом настоящего изобретения является избежание двух вышеуказанных недостатков (затруднительное окисление и токсичность реагента) за счет предложения прямого способа сульфинилирования путем воздействия RS(O)X на гетероциклические соединения без ухудшения общего выхода реакции и путем уменьшения числа реакционных стадий. В настоящее время найден, и это составляет предмет настоящего изобретения, способ, который полностью или частично отвечает достижению этих целей: легкости осуществления, рентабельности и безопасности.
В европейских заявках на патенты EP 0295117, 0460940, 0484165 приводятся многочисленные примеры получения гетероциклических сульфинилированных соединений. В таком случае имеют место два типа способов:
Первая группа способов состоит в получении сульфенильного соединения, которое впоследствии нужно окислять для получения целевого соединения. Получение сульфенилированных соединений осуществляют либо путем прямого воздействия реагента RSX на гетероциклическое соединение, содержащее атом водорода в сульфенилируемом положении, либо путем воздействия магнийорганических соединений или соединений R'I, B'Bч (где R' обозначает алкильную или галогеналкильную группу) на тиоцианатогетероциклическое соединение, либо, наконец, путем восстановления дисульфидов в присутствии соединений R'I. Эти различные способы описываются в европейской заявке EP A-0295117 (см. способ (b), (d1), (d2) и (d3) на с. 11-I2). Другой способ, где используют дисульфидные соединения, описывается в европейском патенте EP B-1374061.
Вторая группа способов заключается во введении во взаимодействие сульфинилированного соединения с особым соединением, такого рода, что продукт этой реакции образуется за счет циклизации гетероциклического сульфинилированного соединения. В отношении подробностей этих способов снова нужно сослаться на европейскую заявку ЕР A-0295117 (см. способы "a" и "c" на с. 11).
Кроме того, в ароматическом и негетероциклическом ряду известны рекомендации осуществления прямого сульфинилирования ароматических углеводородов (фенильный цикл). Например, в Ви-11. Chem. Soc. Jpn., 46 (1973) 3615, описывается реакция сульфинилирования метоксибензола с помощью п-метилфенилсульфинилхлорида в присутствии катализатора AlCl3. Другая реакция этого типа описывается в ЖОХ, 17, (9) (1981) 1800. Реакцию здесь проводят в присутствии реактива Гриньяра, который представляет собой параметилбензолмагнийбромид, воздействуя им на нафтилсульфинилхлорид.
Изобретение относится к новому способу сульфинилирования гетероциклических соединений, который состоит во взаимодействии: производного формулы RS(O)X, в которой R обозначает алкильную группу с 1-4 C-атомами, линейную или разветвленную, замещенную одним или несколькими, одинаковыми или разными, атомами галогена, и X обозначает атом галогена, гидроксильную группу или одну из ее солей, диалкиламино-группу NR2, R3, где R2 и R3 представляют собой алкильные или галогеналкильные группы с 1-4 C-атомами, или арилокси-группу, в которой арильная часть предпочтительно соответствует фенильной группе, в случае необходимости замещенной одним или несколькими атомами галогена или алкильными или галогеналкильными группами с 1-4 C-атомами; с гетероциклическим соединением Гет, выбираемым в группе, включающей пирролы, пиразолы, имидазолы, оксазолы, изоксазолы, изотиазолы, тиазолы, триазолы, причем все эти гетероциклы Гет в случае необходимости замещены одним или несколькими атомами или группами, выбираемыми среди галогенов, амино-, моно- или диалкил-амино-, нитрильных, арильных групп, замещенных одним или несколькими атомами галогенов и/или одной или несколькими алкильными, галогеналкильными группами или SF5 арильных групп; при условии, что R отличен от н-бутила, когда Гет обозначает пиррол, и R отличен от метила, когда Гет обозначает 2,5-диметилпиррол.
Предпочтительный способ заключается в выборе гетероцикла Гет в группе, включающей пирролы, пиразолы, имидазолы, и в этом случае соединение C, выбираемое в группе, включающей тозилаты, хлоргидраты, мезилаты диметиламина, пиридина, триметиламина, диэтиламина, изопропиламина или любого другого первичного, вторичного или третичного амина, или газообразный хлороводород, в случае необходимости в присутствии примерно эквимолярного количества п-толуолсульфокислоты, можно добавлять для завершения реакции.
Реагент, выбираемый в группе, включающей фосген COCl2, хлорформиаты, PCl5 или SOCl2, в случае необходимости может быть использован для осуществления вышеуказанных реакций.
Предпочтительно выбирают гетероцикл, замещенный аминогруппой. Эта группа тогда реагирует с RS(O)X, давая сульфинамидное соединение, которое затем подвергают перегруппировке для получения гетероциклического соединения, содержащего аминогруппу, которая находится у атома углерода, и сульфинильную группу RS(O) на вицинальном углероде.
Согласно одному предпочтительному варианту осуществления изобретения, используют соединение CF3 S(O)X, в котором X обозначает атом хлора. Известно, что в этом случае соединение CF3S(O)Cl менее токсично, чем соединение CF3SCl, которое использовали ранее, что составляет одно из преимуществ настоящего изобретения. Кроме этого, также избегают, и об этом уже говорилось, стадии последующего окисления. Более того, CF3SCl представляет собой газообразное при комнатной температуре соединение, тогда как CF3S(O)Cl является жидкостью, что облегчает работу с этим соединением.
Согласно другому предпочтительному варианту осуществления изобретения, используют соединение CF3S(O)X, в котором X обозначает группу N(CH3)2 или N(C2H5)2.
Согласно третьему предпочтительному варианту осуществления изобретения, используют соединение CF3(O)X, в котором X обозначает гидроксильную группу OH или ONa, и в этом случае реакцию проводят в присутствии фосгена COCl2 или SOCl2.
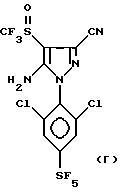
Способ со всеми его предпочтительными вариантами осуществления особенно хорошо пригоден, если гетероцикл Гет представляет собой соединение следующих формул A или B: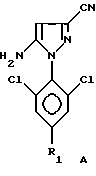
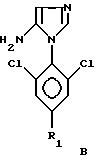
в которых R1 обозначает атом галогена, предпочтительно фтор; или алкильную или галогеналкильную группу, предпочтительно CF3, или группу SF5.
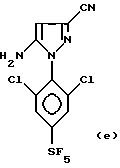
Кроме того, изобретение относится к способу получения 4-сульфинилпиразолов формул: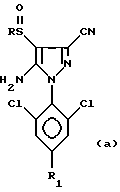
в которых R обозначает алкильную группу с 1-4 C-атомами, линейную или разветвленную, замещенную одним или несколькими, одинаковыми или разными, атомами галогена; и R1 обозначает атом галогена, предпочтительно фтор, или алкильную или галогеналкильную группу, предпочтительно CF3 или группу SF5, из соединения формул: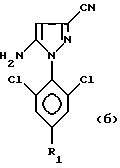
путем воздействия реагента формулы RS(O)X, в которой R обозначает линейную или разветвленную алкильную группу с 1-4 C-атомами, замещенную одним или несколькими, одинаковыми или разными, атомами галогена, и X обозначает атом галогена, гидроксильную группу или одну из ее солей, диалкиламино-группу NR2, R3, где R2 и R3 обозначают алкильные или галогеналкильные группы с 1-4 C-атомами, или арилокси-группу, в которой арильная часть предпочтительно соответствует фенильной группе, в случае необходимости замещенной одним или несколькими атомами галогена или алкильными или галогеналкильными группами с 1-4 C-атомами. Работают с молярным избытком реагента RS(O)X по отношению к вышеуказанному 4-H-пиразольному соединению. Этот избыток составляет величину порядка 10-50%, предпочтительно 20-30%.
Для завершения вышеуказанной реакции предпочтительно используют соединение C, выбираемое в группе, включающей тозилаты, хлоргидраты, мезилаты диметиламина, пиридина, триметиламина, диэтиламина, изопропиламина или любого другого первичного вторичного или третичного амина. Это соединение C также может представлять собой газообразный хлороводород, в случае необходимости в присутствии примерно эквимолярного количества паратолуолсульфокислоты. Молярное соотношение между соединением C и гетероциклическим соединением предпочтительно составляет 0,5 - 2 и особенно 1 - 2. Кроме того, реакцию проводят в органической среде в растворителе, выбираемом в группе, включающей толуол, 1,2-дихлорэтан, дихлорметан. Температура реакции составляет 0-100oC, предпочтительно 3-60oC, еще более предпочтительно 30-55oC.
Реагент, выбираемый в группе, включающей фосген COCl2, хлорформиаты, PCl5 или SOOCl2, в случае необходимости может быть использован для осуществления вышеуказанных реакций.
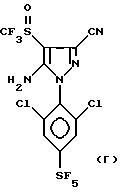
Способ сульфинилирования вышеуказанных пиразолов еще более предпочтительно пригоден для получения 4-сульфинилпиразолов формул: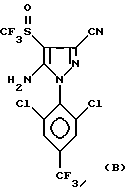
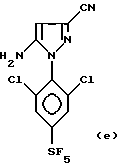
Тогда либо CF3S(O)Cl, CF3S(O)N(CH3)2 или CF3S(O)N(C2H5)2, либо CF3S(O)OH или CF3S(O)ONa с фocгеном или SOCl2 или CICO2C2H5, согласно способу и его предпочтительным описанным вариантам, вводят во взаимодействие с 4-H-пиразольным соединением одной из нижеприведенных формул: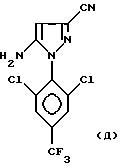
Кроме того, изобретение относится к промежуточным сульфинамидным соединениям, получаемым тогда, когда гетероциклическое соединение содержит группу NH2, формул RS(O)NH-Гет, в которых Гет обозначает гетероциклический радикал, выбираемый в группе, включающей пирролы, пиразолы, имидазолы, оксазолы, изоксазолы, изотиазолы, тиазолы, триазолы, причем все эти гетероцилы Гет в случае необходимости замещены одним или несколькими атомами или группами, выбираемыми среди галогенов, амино-, моно- или диалкиламино-, нитрильных, арильных групп, замещенных одним или несколькими атомами галогена и/или одной или несколькими алкильными, галогеналкильными группами или SF5 арильных групп.
Более предпочтительно, соединения RS(O)NH-Гет, где Гет обозначает пиразольный гетероцикл, в случае необходимости замещенный одним или несколькими атомами или группами, выбираемыми среди галогенов, амино-, моно- или диалкиламино-, нитрильных, арильных групп; арильных групп, замещенных одним или несколькими атомами галогенов и/или одной или несколькими алкильными, галогеналкильными группами или SF5, и где сульфинамидная группа находится в положении 5 этого гетероцикла, составляют часть настоящего изобретения.
Еще более предпочтительно, изобретение относится к соединениям: 5-(N-трифторметилсульфинил)амино-3-циано-1-[2,6-дихлор- (4-CF3)фенил] -4-H-пиразолу и 5-(N-трифторметилсульфиннл)амино- 3-циано-1-[2,6-дихлор-(4-SF5)фенил] -4-H-пиразолу.
Следующие примеры, данные в качестве не ограничивающих объема охраны изобретения, иллюстрируют изобретение и показывают его осуществление на практике.
Пример 1. Сульфинилирование с помощью CF3S(O)Cl: синтез 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилоульфинил-пиразола.
8,06 г. (25 ммоль) 5-Амино-3-циано-1-(2,6-дихлор-4- трифторметил-фенил)-пиразола и 8,15 г (38 ммоль) диметиламинтозилата суспендируют в 50 мл толуола. К этой смеси быстро добавляют трифторметилсульфинилхлорид (5 г, или 32 ммоля). Реакционную смесь затем нагревают до 50oC. После протекания реакции в течение 8 часов при этой температуре, реакционную смесь продувают током аргона. Затем реакционную среду охлаждают до 20oC. Добавляют в нее 20 мл воды, после чего осадок отфильтровывают, промывают водой, затем толуолом.
Полученный продукт сушат при нагревании в вакууме. Таким образом получают 9.77 г. (или выход = 88%) 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилсульфинил-пиразола с чистотой выше 95% (определено с помощью ВЭЖХ). Физические и спектральные характеристики полученного соединения следующие:
Т. пл. = 196- 198oC.
ЯМР - анализ: 1H-ЯМР - спектр (CDCl3, ТМС): 5,1 м.д. (C., 2H), 7,8 м.д. (с., 2H).
13C-ЯМР-спектр (ацетон-d6, ТМС): фенильная группа: C1: 135,4 м.д.; C2: 137,5 м.д.; C3: 127,6 м.д; C(CF3): 123 м.д. пиразольная группа:
C3: 126,7 м. д. ; C4: 94,6 м.д.; C5: 152,3 м.д.; C (СП): 111,7 м.д.; C(CF3): 126,3 м.д.
Масс-анализ : E1 + : М = 436 (35 Cl)
Пример 2. Сульфинилирование с помощью CF3S(O)Cl : синтез 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилсульфинил-пиразола.
0,81 г. (2,5 ммоль) 5-Амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-пиразола и 0,29 г. (2,5 ммоль) пиридин-хлоргидрата растворяют в 5 мл 1,2-дихлорэтана.
К этой смеси добавляют трифторметилсульфинилхлорид (0,5 г. или 3,2 ммоля). Реакционную смесь затем нагревают при 50oC в течение 10 часов. Поступают затем как описано в предыдущем примере. Выход, определенный в расчете на 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-4-трифторметилсульфинил-пиразол, составляет 74%.
Пример 3. Сульфинилирование с помощью CF3S(O)NMe2: синтез 5-амино-3-циано-1-(2,6-дихдор-4-трифторметилфенил)-4- трифторметилсульфинил-пиразола.
0,81 г. (2,5 ммоль) 5-Амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-пиразола и 0,55 г. (2,5 ммоль) сухой (безводной) п-толуолсульфокислоты суспендируют в 5 мл толуола. В среду добавляют N,N - диметилтрифторметилсульфиниламин (0,53 г, или 3,2 ммоля), затем раствор HCl в толуоле (или 2,5 ммоль). Смесь нагревают в течение 8 часов при 50oC. Далее поступают как в примере 1.
Выход, определенный в расчете на 5-амино-3-пиано-1-(2,6- дихлор-4-трифторметилфенил)-4-трифторметилсульфинил-пиразол, составляет 72%.
Пример 4. Синтез 5-(N-трифторметилсульфинил)амино-3-циано-1- (2,6-дихлор-4-трифторметилфенил)пиразола.
Пиразолсульфинамид, включаемый в настоящее изобретение, может быть получен и выделен согласно следующим условиям:
3,23 г. (10 ммоль) 5-Амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-пиразола и 3,25 г. (15 ммоль) диметиламинтозилата суспендируют в 20 мл толуола. Температуру доводят до 5oC. Быстро добавляют трифторметилсульфинилхлорид (2 г, или 13 ммоль). Затем добавляют толуольный раствор диметиламина (5 ммоль).
Реакционную смесь выдерживают в течение 30 минут при перемешивании при 5oC. После этого добавляют 50 мл простого метил-трет-бутилового эфира. Образовавшийся осадок удаляют путем отфильтровывания, затем промывают его. Фильтрат рекуперируют и промывают путем экстракции 2 раза по 10 мл ледяной водой. Органическую фазу концентрируют. Полученный остаток кристаллизуют из толуола. Таким образом получают 1,75 г. 5-(N-трифторметилсульфинил) амино-3-циано-1-(2,6-дихлор-4-трифторметилфеннл)пиразола. физические и спектральные характеристики полученного соединения следующие: Т. пл. = 123 - 124oC;
ЯМР-анализ: 1H - ЯМР-спектр (ацетон-d6, ГМДС): 7,06 м.д. (C., 1H); 8,06 м.д. (c., 2H);
13C-ЯМР - спектр (ацетон-d6, ТМС): фенильная группа, C1: 136,2 м.д.; C2: 237 м.д.; C3: 127,4 м.д.; C4: 135,2 м.д., C(CF3): 123,3 м.д.
пиразольная группа: C3: 128,5 м. д.; C4: 105,7 м.д.; C5: 140,7 м.д.; C(СП): 113,5 м.д.; C (CF3): 124,5 м.д.
Пример 5. Синтез 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-4-трифторметилсульфинил-пиразола путем перегруппировки пиразолсульфинамида примера 4.
0,109 г. (0,25 ммоль) Пиразолсульфинамида, полученного в примере 4, и 0,075 г. (0,33 ммоль) диметиламинтозилата суспендируют в толуоле. Добавляют раствор хлороводорода в толуоле (или 0,25 ммоль HCl). Реакционную смесь нагревают в течение 10 часов при 50oC. Выход, в расчете на 5-амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)-4-трифторметилсульфинилпиразол, составляет 80%.
Пример 6. Сульфинилирование с помощью CF3S(O)ONa, синтез 5-амино- -3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4- трифторметилсульфинилпиразола.
0,81 г. (2,5 ммоль) 5-Амино-3-циано-1-(2,6-дихлор-4- трифторметилфенил)пиразола, 0,815 г. (3,8 ммоль) диметиламинтозилата и 0,51 г. (6,25 ммоль) натриевой соли трифторметансульфиновой кислоты суспендируют в 5 мл толуола. К этой, охлажденной до 5oC смеси добавляют SOCl2, затем перемешивают около 1 часа при комнатной температуре. Реакционную среду после этого нагревают при 50oC в течение 8 часов. Затем поступают как в примере 1. Выход, в расчете на 5-амино-3-циано-1-)2,6-дихлор-4-трифторметилфенил)-4- трифторметилсульфинил-пиразол, составляет 66%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЗАЩИТЫ РАСТЕНИЙ И СРЕДА ДЛЯ ВЫРАЩИВАНИЯ РАСТЕНИЙ | 1999 |
|
RU2212796C2 |
| ПРОИЗВОДНЫЕ 3-ЦИАНО-5-АЛКОКСИ-1-АРИЛПИРАЗОЛОВ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1990 |
|
RU2037488C1 |
| ПРОИЗВОДНЫЕ 1-АРИЛПИРРОЛОВ, ИНСЕКТОАКАРИЦИДОНЕМАТОЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ | 1991 |
|
RU2092479C1 |
| ПРОИЗВОДНЫЕ 1-АРИЛ-5-(ЗАМЕЩЕННОГО МЕТИЛИДЕНИМИНО)ПИРАЗОЛА, СПОСОБ БОРЬБЫ С ВРЕДНЫМИ НАСЕКОМЫМИ И ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2088576C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРПЕРГАЛОГЕНАЛКИЛТИОЭФИРОВ | 1989 |
|
RU2045517C1 |
| ПРОИЗВОДНЫЕ N-КАРБОНИЛАНИЛИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2128164C1 |
| ФЕНИЛ- И АМИДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ | 1989 |
|
RU2041874C1 |
| ОПТИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ 2-ИМИДАЗОЛИН-5-ОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ ОБРАБОТКИ КУЛЬТУР | 1994 |
|
RU2126390C1 |
| ПРОИЗВОДНЫЕ 1-АРИЛИМИДАЗОЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИНСЕКТОАКАРИЦИДОНЕМАТОЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ, КЛЕЩАМИ И НЕМАТОДАМИ | 1991 |
|
RU2072992C1 |
| СПОСОБ БОРЬБЫ С ЧЛЕНИСТОНОГИМИ | 1986 |
|
RU2106783C1 |
Описывается способ сульфинилирования гетероциклических соединений, отличающийся тем, что производные формулы RS(O)X, в которой R обозначает линейную или разветвленную алкильную группу с 1 - 4 C-атомами, замещенную одним или несколькими, одинаковыми или разными атомами галогена, и X обозначает атом галогена, гидроксильную группу или одну из ее солей, диалкиламино-группу NR2 R3, причем R2 и R3 представляет собой алкильные или галогеналкильные группы с 1 - 4 C-атомами; или арилокси-группу, в которой арильная часть предпочтительно соответствует фенильной группе, в случае необходимости замещенной одним или несколькими атомами галогена или алкильными или галогеналкильными группами с 1 - 4 C-атомами; вводят во взаимодействие с гетероциклическим соединением Гет, выбираемым в группе, включающей пирролы, пиразолы, имидазолы, оксазолы, изоксазолы, изотиазолы, тиазолы, триазолы, причем все эти гетероциклы Гет в случае необходимости замещены одним или несколькими атомами, или группами, выбираемыми среди галогенов, амино-, моно- или диалкиламино-, нитрильных, арильных групп, арильных групп, замещенных одним или несколькими атомами галогена и/или одной или несколькими алкильными, галогеналкильными группами или SF5, при условии, что R отличен от н-бутила, когда Гет обозначает пиррол, и R отличен от метила, когда Гет обозначает 2,5-диметилпиррол. Описываются также сульфинамидные соединения и способ получения 4-сульфинилпиразолов. Технический результат - упрощение процесса без ухудшения общего выхода реакции. 3 с. и 13 з.п. ф-лы.
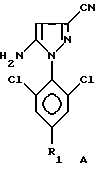
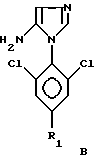
в которых R1 обозначает атом галогена, предпочтительно фтор, или алкильную или галогеналкильную группу, предпочтительно CF3, или группу SF5.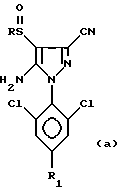
в которых R обозначает алкильную, линейную или разветвленную, группу с 1 - 4 С-атомами, замещенную одним или несколькими атомами галогена, одинаковыми или разными, и R1 обозначает атом галогена, предпочтительно фтор, или алкильную или галогеналкильную группу, предпочтительно CF3, или группу SF5, отличающийся тем, что с соединением формул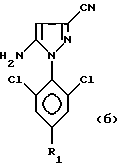
вводят во взаимодействие реагент формулы RS(O) X, в которой R обозначает линейную или разветвленную алкильную группу с 1 - 4 С-атомами, замещенную одним или несколькими атомами галогена, одинаковыми или разными, и Х обозначает атом галогена, гидроксильную группу или одну из ее солей, диалкиламино- группу NR2 R3, причем R2 и R3 обозначают алкильные или галогеналкильные группы с 1 - 4 С-атомами, или арилокси- группу, в которой арильная часть предпочтительно соответствует фенильной группе, в случае необходимости замещенной одним или несколькими атомами галогена или алкильными или галогеналкильными группами с 1 - 4 С-атомами.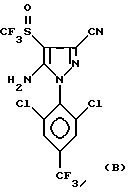
путем воздействия либо CF3 S(O) Cl, CF3 S(O) N (CH3)2 или CF3 S(O) N(C2H5)2; либо CF3 S(O) OH или CF3 S(O) ONa с фосгеном или SOCl5 или ClCO2C2H5: на 4-Н-пиразольное соединение формул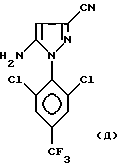
13. Сульфинамидные соединения формулы RS(O)NH - ГеТ, где R обозначает линейную или разветвленную алкильную группу с 1 - 4 c-атомами, замещенную одним или несколькими, одинаковыми или разными атомами галогена, а Гет представляет собой пиразольный гетероцикл, в случае необходимости замещенный одним или несколькими атомами или группами, выбираемыми из галогенов, амино-, моно- или диалкиламино-, нитрильных групп, фенильной группы, фенильной группы, замещенной одним или несколькими атомами галогена и/или несколькими алкильными, галогеналкильными группами с 1 - 4 c-атомами, или SF5.
| SU 13009909 A3, 1987 | |||
| Способ получения производных N-фенилпиразола | 1984 |
|
SU1422997A3 |
| РЕГУЛЯТОР ТЕМПЕРАТУРЫ | 0 |
|
SU295117A1 |
| EP 0295482 A1, 1988 | |||
| ПРОГРАММНОЕ УСТРОЙСТВО ДЛЯ РЕГУЛЯТОРОВ СКОРОСТИ с ИМПУЛЬСНЫМИ ДАТЧИКАМИ СКОРОСТИ | 0 |
|
SU296381A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИФТОРАЛКЕНИЛ(АЛКИЛ) ГАЛО ГЕНСИЛАНОВ( ГЕРМАНОВ) | 0 |
|
SU301338A1 |
Авторы
Даты
1999-09-10—Публикация
1995-02-21—Подача