Изобретение относится к биотехнологии, в частности к генной инженерии.
Известен метод генетической трансформации Drosophila melanogaster. Для этого используются мобильные элементы типа P или hobo из Drosophila melanogaster в комбинации с генами устойчивости к антибиотикам, например, ген NeoR устойчивости к неомицину (Spradling А. С., P-element-mediated transformation, A practical approach, Oxford, 1986). Однако трансгенез насекомых недрозофилиной группы сопряжен со значительными трудностями. В основном это обусловлено отсутствием подходящих векторов для трансформации. Эти проблемы относятся и к Musca domestica. Нам не известно ни одной работы, где получены трансгенные Musca domestica.
Целью изобретения является получение трансгенных домашних мух Musca domestica.
Поставленная цель достигается тем, что эмбрионы подсушивают 10-15 минут при 28oC и в период 45-90 мин после откладки микроинъецируют системой генно-инженерных векторов, состоящей из интегрируемой конструкции pHerm[NeoR], содержащей чужеродные гены, на основе мобильного элемента Hermes в комбинации с селективным маркером NeoR под контролем промотора белка теплового шока Hsp70 и конструкции-помощника pHlpHt, а селекцию потомства микроинъецируемых особей осуществляют на твердой агаризованной среде с содержанием аналога неомицина - искусственного антибиотика генетицина G418 (фирма Sigma, США) в количестве 200-1000 мкг/мл.
Для создания трансгенных Musca domestica мы сочли целесообразным сконструировать селективную систему на основе мобильного элемента Hermes, выделенного из Musca domestica, в комбинации с маркерным геном NeoR. Такой вариант селекционной системы ранее не использовался для трансгенеза насекомых.
На рис.1 изображена схема интегративной конструкции pHerm[NeoR] на основе мобильного элемента Hermes и селективного гена устойчивости к антибиотику неомицину NeoR (схема приведена без учета масштаба). Hermes L и Hermes R - участки мобильного элемента Hermes содержащие специфические инвертированные повторы, обеспечивающие интеграцию. Hsp70 - промотор белка теплового шока. Adh рА - последовательность полиаденилирования, обеспечивающая правильный процессинг РНК гена. NeoR.
Основой плазмиды pHerm[NeoR] является вектор pBS+ (фирма Stratagen, США). В нее клонированы фланговые участки мобильного элемента Hermes (Warren et al., Genet.res. 64, 1994). 5' концевой участок элемента Hermes (Hermes L) содержит 707 пар оснований, а 3' концевой участок (Hermes R) - 520 пар оснований. Эти участки содержат специфические инвертированные повторы, обеспечивающие эффективную интеграцию конструкции, заключенной между ними, в геном домашних мух в присутствии транспозазы, кодируемой вектором-помощником pHlpHt. Для придания трансформированным особям селективного преимущества в интегрируемый участок конструкции pHerm[WeoR] между фланговыми участками мобильного элемента Hermes клонирован бактериальный ген устойчивости к неомицину NeoR под контролем промотора белка теплового шока Hsp70 Drosophila melanogaster и последовательности полиаденилирования после конца открытой рамки считывания гена NeoR. Для клонирования в конструкцию интегрируемых чужеродных генов могут использоваться уникальные сайты рестрикции Cla I и Sal I, находящиеся между Hermes R и Hsp70 (см. чертеж).
Плазмида pHlpHt содержит последовательность длиной 1,9 тыс.пар. нуклеотидов, содержащую нативную открытую рамку считывания, кодирующую транспозазу мобильного элемента Hermes под контролем промотора белка теплового шока Hsp70 Drosophila melanogaster, а также последовательность полиаденилирования после конца открытой рамки считывания. Отсутствие инвертированных повторов в векторе помощнике исключает его интеграцию в геном и создание ситуации нестабильной интеграции конструкции pHerm[NeoR].
Пример 1.
Изначально для трансформации Musca domestica была создана конструкция pHermes[Luc] , состоящая из концевых повторов мобильного элемента Hermes и гена люциферазы. Эмбрионы микроинъецировали смесью конструкций pHermes[Luc] и pHlpHt в соотношении концентраций 5:1. Общий объем вводимого раствора составлял 10-50 пл. Эмбрионы микроинъецировали через 60, 90 и 120 минут после откладки без предварительной обработки. От выживших после микроинъекции мух получали потомство и проверяли его на наличие экспрессии люциферазы в реакции с люциферином. Было проанализировано 256 первичных особей и их потомство. Положительный сигнал был обнаружен только у самца N 927, который не дал потомства. Исследование каждой из первичных особей было трудоемким. Исходя из этого был сделан вывод о неэффективности этой конструкции для получения трансгенных Musca domestica.
Пример 2.
На основании мирового опыта по трансформации Drosophila melanogaster для придания трансгенным особям селективного преимущества перед нетрансгенными был выбран бактериальный ген устойчивости к неомицину NeoR (Spradling А. С., P-element- mediated transformation, A practical approach, Oxford, 1986). Для проверки функциональности полученной конструкции проводили трансформацию культуры эмбриональных клеток Drosophila melanogaster методом кальцийфосфатной трансфекции. Были получены клоны клеток, устойчивых к аналогу неомицина - искусственному антибиотику генетицину G418 (фирма Sigma, США). На основании этого было заключено, что конструкция функционально активна в клетках насекомых.
Пример З.
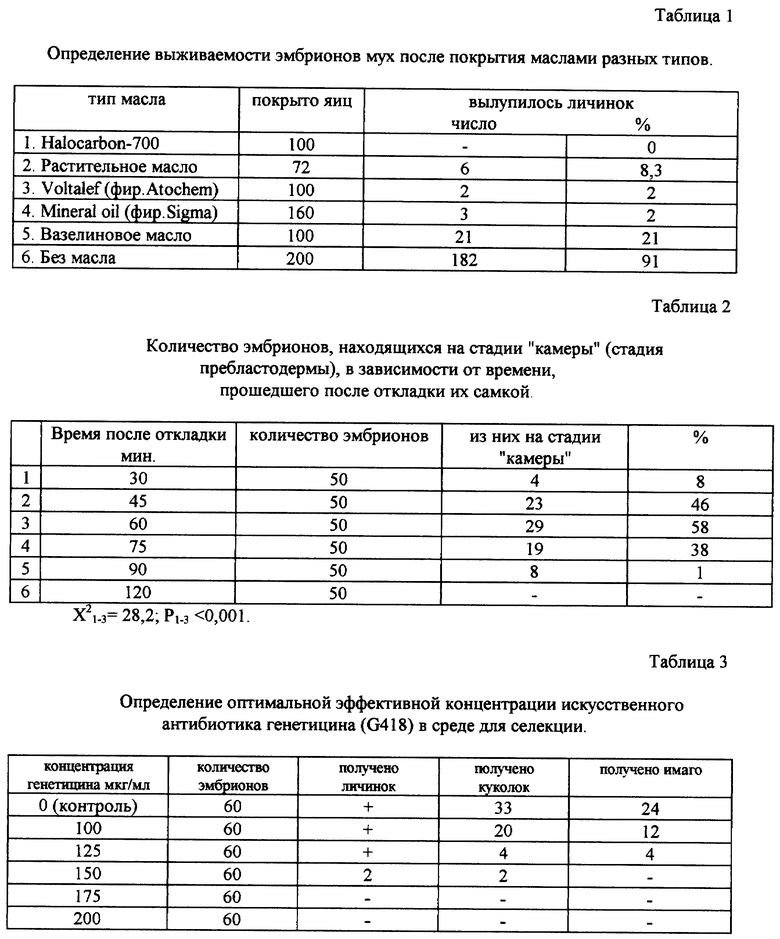
При разработке технологии инъецирования эмбрионов Musca domestica за основу приняли общеизвестную технику микроинъецирования Drosophila melanogaster. В нее входит: освобождение эмбрионов от твердой защитной оболочки - хориона; подсушивание эмбрионов; покрытие их маслом для защиты от пересыхания; микроинъецирование на стадии "камеры"; помещение на субстрат для развития личинок (Spradling А.С., P-element-mediated transformation, A practical approach, Oxford, 1986). В ходе экспериментов по отработке методики было установлено, что а) при удалении хориона с эмбрионов Musca domestica они всегда гибнут; б) оптимальное время подсушивания эмбрионов перед инъекцией 10-15 мин; в) при покрытии любыми типами масел жизнеспособность эмбрионов сильно снижается (таблица 1); г) стадия "камеры" наступает в период 45-90 мин. после откладки эмбрионов (таблица 2).
На основе опытных данных предложена следующая методика микроинъецирования: эмбрионы раскладывают в ряд на покровном стекле и подсушивают 10-15 мин при комнатной температуре (при этом эмбрионы прилипают к стеклу, что облегчает микроинъекцию), затем быстро микроинъецируют иглами, вводя 30-100 пл раствора конструкций в концентрации 0,1-0,5 мг/мл в соотношении 5:1, после его помещают во влажную камеру на 5-10 слоев фильтровальной бумаги пропитанной молочно-дрожжевой смесью.
Пример 4.
При отработке системы селекции потомства микроинъецированных особей использовали твердую агаризованную среду с искусственным антибиотиком генетицином G418 (фирма Sigma, США). Для выбора оптимальной концентрации антибиотика, при которой все нетрансгенные особи погибают, проверяли выживаемость личинок диких мух на средах с несколькими концентрациями генетицина (таблица 3). Гибель всех личинок диких мух начинается при концентрации генетицина в среде 175 мкг/мл. Для обеспечения гарантированной гибели нетрансгенных личинок при селекции приняли рабочую концентрацию генетицина 200-300 мкг/мл среды.
Пример 5.
Микроинъецирование смеси векторов pHerm[NeoR] и pHlpHt проводили в стандартном буфере (5mM KCl, 0,1mM Na2H2PO4, pH=6,8) в каудальный конец пребластодермальных эмбрионов домашней мухи на стадии синцития (45-70 мин после откладки эмбрионов) в концентрации 0,2 мг/мл в соотношении 5:1. 186 эмбрионов из 11240 проинъецированных развились до стадии имаго (F0) (таблица 4). Затем каждую выжившую особь скрестили с особями дикого типа и их потомство поместили на селективную среду с аналогом неомицина - генетицином (G418) в концентрации 250 мкг/мл и прогревали в течение 2 ч один раз в три дня для активации промотора Hsp70. В результате 18 из 186 особей дали потомство (F1), выжившее на селективной среде. Контроль интеграции проводили методом полимеразной цепной реакции. Проведенные исследования интеграции показали наличие вставки во всех отобранных линиях, то есть эффективность селекции составила 100%.
Изобретение применимо в научных исследованиях, получении трансгенных мух-продуцентов ценных биологически активных веществ и управлении природными популяциями насекомых.

Изобретение относится к биотехнологии, в частности к генной инженерии. Создана система генно-инженерных векторов из пары плазмид: pHerm[NeoR], состоящей из вектора-основы pBS+, фланговых участков мобильного элемента Hermes и гена устойчивости к антибиотику неомицину NeoR под контролем промотора белка теплового шока Hsp 70 Dzosophila melanogaster, и плазмиды рНl, рНt, содержащей нативную последовательность транспозазы мобильного элемента Hermes. Разработана техника введения смеси плазмид pHerm[NeoR] и pHlpHt в пребластодермальные эмбрионы Musca domestica. Система предназначена для введения чужеродных генов, встраиваемых в pHerm[NeoR], в эмбрионы Musca domestica для получения трансгенных линий домашних мух. Личинки мух с интеграцией генной конструкции в геном приобретают устойчивость к синтетическому антибиотику генетицину /G-418/. Культивирование личинок на среде с генетицином в концентрации 200-1000 мкг/мл обеспечивает выживание только трансгенных особей. Изобретение позволяет получить трансгенных мух-продуцентов ценных биологически активных веществ и управлять природными популяциями насекомых. 1 ил., 4 табл.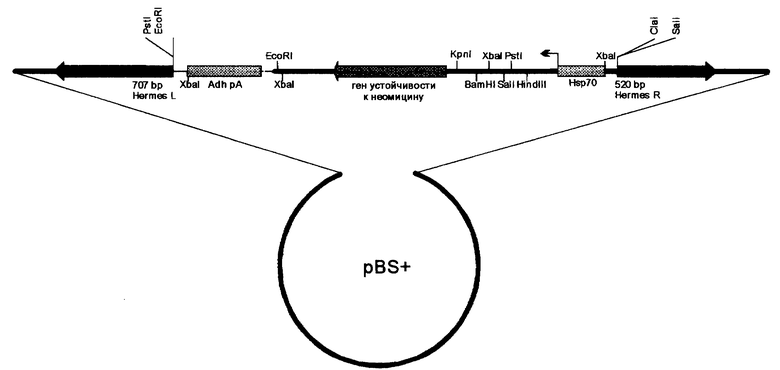
Способ получения трансгенных домашних мух Musca domestica, включающий получение эмбрионов, микроинъецирование их системой конструкций, содержащих чужеродные гены, селекцию трансгенного потомства микроинъецированных особей, отличающийся тем, что эмбрионы микроинъецируют в период 45 - 90 мин после откладки, в качестве системы конструкций используют пару генно-инженерных векторов, состоящую из интегрируемой конструкции pHerm[NeoR], содержащей чужеродные гены, сконструированной на основе мобильного элемента Hermes в комбинации с селективным маркером NeoR под контролем промотора белка теплового шока и конструкции-помощника pHlpHt, а селекцию потомства микроинъецируемых особей осуществляют на твердой агаризованной среде с содержанием генетицина (G 418) в количестве 200 - 1000 мкг/мл.
| Spradling A.C | |||
| P-element-mediated transformation | |||
| A practical approach | |||
| Oxford, 1986. |
Авторы
Даты
1999-09-20—Публикация
1998-09-16—Подача