Изобретение относится к способу и набору для обнаружения присутствия каталитически активных рибозимов в среде. Способ и набор данного изобретения можно использовать в рамках способа и набора для обнаружения присутствия специфических биомолекул в тестируемой пробе.
Обнаружение присутствия специфических биомолекул, таких как сегменты ДНК или РНК, белки, антигены, антитела и т.д., в пробе необходимо для множества экспериментальных, диагностических и терапевтических целей. Существует большое число тестов для обнаружения белковых молекул, таких как гель-электрофорез, ВЭЖХ, аффинная хроматография, а также другие тесты, которые выполняют с использованием соответствующим образом меченого зонда. Хотя такие тесты являются удовлетворительными, когда детектируемая белковая биомолекула присутствует в достаточно больших количествах, они иногда являются недостаточно чувствительными для детектирования малых количеств биомолекул.
Последовательности ДНК или РНК могут быть обнаружены при помощи меченого зонда. Если последовательности ДНК или РНК, которые должны быть обнаружены, присутствуют лишь в очень малых количествах, их можно амплифицировать такими способами, как ЛЦР (лигазная цепная реакция), СРП (самоподдерживаемая репликация последовательности) или ПЦР (полимеразная цепная реакция).
Хотя способы амплификации, такие как ПЦР, оказали чрезвычайно большое влияние на фундаментальные исследования, они медленно переносились в клинические условия. Первичной причиной этого является то, что необходимость автоматизации в сочетании с клиническими условиями взятия проб приводила к процессам, которые являются сложными, медленными и дорогостоящими. Необходимость применения белковых ферментов с их высокой чувствительностью в отношении факторов окружающей среды требует строго контролируемых условий, в которых они должны работать. Как правило, клиническая проба содержит много компонентов, которые могут мешать способности фермента проявлять его каталитическую активность. Кроме того, стандартные способы, применяемые для приготовления проб для выделения нуклеиновых кислот, такие как гуанидинтиоцианатный способ или фенольная экстракция, непригодны для ферментативной активности на основе белка и, следовательно, необходимо удалять целевую нуклеиновую кислоту из препарата пробы.
Рибозимы представляют собой в типичном случае молекулы РНК, имеющие ферментподобные каталитические активности, такие как активности расщепления, сплайсинга или лигирования последовательностей нуклеиновых кислот. Известными субстратами для рибозимов являются молекулы РНК, хотя есть некоторые указания на то, что рибозимы могут действовать на молекулы ДНК и белки.
Природные рибозимы, участвующие во внутриклеточных реакциях (цис-действующие), катализируют только единственный цикл и обычно самомодифицируются во время реакции. Однако можно сконструировать рибозимы для транс-действия истинно каталитическим образом, с оборачиваемостью, большей, чем один цикл, и без самомодификации. В рибозиме можно идентифицировать два отличающихся района: связывающий район, который придает рибозиму его специфичность благодаря гибридизации со специфической последовательностью нуклеиновой кислоты (и, возможно, со специфическими белками), и каталитический район, который наделяет рибозим активностью расщепления, лигирования или сплайсинга. Каждый класс рибозимов расщепляет отличающуюся последовательность нуклеотидов с использованием отличающегося механизма действия. Кроме того, каждый класс отличается числом нуклеотидных оснований, которые существенны для его каталитической активности, и степенью специфичности рибозима и последовательностью-мишенью (Roberts Н. Annual Review of Biochemistry, 61, pp. 641-671, (1992)).
Недавно было предложено использовать рибозимы для лечения заболеваний или генетических расстройств путем расщепления РНК-мишени, такой как вирусная РНК или матричная РНК, транскрибируемые с генов, которые должны быть выключены. Этот способ предложен в качестве альтернативы блокированию транскрипции РНК с использованием антисмысловых последовательностей. Благодаря каталитической природе рибозима одна молекула рибозима расщепляет много молекул РНК-мишени и, следовательно, терапевтическая активность достигается в относительно меньших концентрациях, чем концентрации, требующиеся в лечении с применением антисмысловых последовательностей (WO 96/23569).
Использование рибозимов для диагностических целей упоминалось лишь изредка. В WO 94/13833 описан способ обнаружения молекул нуклеиновых кислот в растворе путем конструирования специфической молекулы рибозима, имеющей два района, один, комплементарный детектируемой нуклеиновой кислоте, и другой, комплементарный сопутствующей молекуле-мишени, несущей детектируемую метку. Рибозим способен специфически и обратимо связываться как с выбранной последовательностью нуклеиновой кислоты-мишени, так и с меченой ко-мишенью. После связывания как мишени, так и ко-мишени рибозим подвергается конформационному изменению, которое делает его активным и способным отщеплять метку от ко-мишени, после чего свободную метку можно детектировать. При отщеплении ко-мишени рибозим способен повторно связываться с дополнительной ко-мишенью с отщеплением дополнительной метки и дополнительным продуцированием детектируемых сигналов.
Хотя авторы WO/94/13833 назвали изобретение "амплификацией сигнала", в действительности происходит не амплификация количества продуцируемых рибозимов, а скорее имеет место чисто ферментативная реакция, в которой каталитическое вещество (в этом случае рибозим) расщепляет субстрат (в этом случае ко-мишень) и затем диссоциирует и расщепляет другой субстрат. Это не является истинной амплификацией количества активных рибозимов, участвующих в реакции.
Ниже дан словарь специальных терминов, использованных в следующем далее описании и формуле изобретения. Однако этот словарь не должен рассматриваться отдельно и для полного понимания различных терминов и значений, которые эти термины имеют в контексте данного изобретения, словарь специальных терминов следует читать вместе с остальным описанием.
Рибозим - молекула нуклеиновой кислоты, которая обладает ферментподобной каталитической активностью. Термин "рибозим" в применении в данной области знаний в общем относится к молекулам РНК, имеющим каталитическую активность, хотя в контексте данного изобретения этот термин используют для обозначения как правило каталитически активного (ферментподобного) олигонуклеотида. Таким образом, рибозим данного изобретения может быть молекулой РНК, может быть олигонуклеотидом, содержащим dNTP или состоящим целиком из dNTP, и может также содержать различные природно не встречающиеся нуклеотиды, такие как IsoG или IsoC 5'-O-(1-тиотрифосфат)нуклеозиды и 5-O-метилнуклеотиды. Рибозим, который может быть использован в соответствии с данным изобретением, может состоять исключительно из описанных выше нуклеиновых кислот или может требовать кофактора для его каталитической активности. Рибозимы могут иметь каталитическую активность расщепления, лигирования или сплайсинга (удаления) олигонуклеотидной последовательности, добавления групп к олигонуклеотидам, реаранжировки последовательностей нуклеиновых кислот и т.д.
Анализируемая (тестируемая) биомолекула - молекула, присутствие которой в тест-пробе должно быть определено. Она может быть олигонуклеотидом или членом пары узнавания, такой как рецептор/лиганд, антитело/антиген, лектин/гликопротеин, и т.д. Инициирующий рибозим - рибозим, который инициирует реакцию, в которой продуцируется больше рибозимов, что со временем приводит к генерированию детектируемой метки. При использовании способа данного изобретения для обнаружения биомолекул инициирующий рибозим является частью системы детектирования (см. ниже) и служит в качестве репортера для присутствия тестируемой биомолекулы, так как только в присутствии тестируемых биомолекул он либо образуется, либо становится каталитически активным. Присутствие активного инициирующего рибозима активирует каталитическую систему (см. ниже).
Система детектирования - комбинация молекул и реагентов, которая позволяет продуцировать или активировать каталитически активный инициирующий рибозим, который служит в качестве репортера для присутствия тестируемых биомолекул в тест-пробе. Другими словами, в присутствии тестируемых биомолекул, после реакции или каскада реакций, в конечном итоге образуется каталитически активный инициирующий рибозим. Присутствие инициирующего рибозима подтверждается в каталитической системе (см. ниже), где он приводит к образованию большего количества активных рибозимов амплифицирующим образом (затем сами рибозимы или продукт их каталитической активности, например, свободная метка, определяют в конечной стадии теста).
Неактивный рибозим - потенциально каталитически активный рибозим, который не может проявлять его каталитическую активность (расщепление, сплайсинг, лигирование и т.д.), пока он не будет модифицирован или пока условия в среде не будут изменены на такие, в которых он становится активным.
Активация - превращение неактивного рибозима в каталитически активный посредством какого-либо типа каталитического действия (расщепления, сплайсинга, лигирования, присоединения групп, реаранжировки) или путем изменения внешних условий (например, путем добавления ионов магния).
Ингибиторная часть молекулы - часть молекулы, которая может иногда присутствовать во второй комплексной молекуле (см. ниже) и которая в случае ее присутствия делает инициирующий рибозим неактивным. Ингибиторный эффект ингибиторной части молекулы может быть прекращен ее модификацией или удалением из комплексной молекулы.
Комплексная молекула - молекула, которая образует часть системы детектирования в соответствии с вариантом данного изобретения, называемым здесь "вариантом активации". В одном способе проведения варианта активации используют "первую комплексную молекулу", содержащую инициирующий рибозим, который a priori каталитически неактивен (например, благодаря отсутствию ионов магния в среде), соединенный с последовательностью, способной отщепляться активным инициирующим рибозимом, и содержащую, кроме того, биомолекулу узнавания (см. ниже). В другом способе проведения варианта активации используют "вторую комплексную молекулу", содержащую инициирующий рибозим, который a priori каталитически неактивен и соединен с последовательностью, способной отщепляться активным инициирующим рибозимом, и содержащую, кроме того, биомолекулу узнавания (см. ниже). Кроме того, вторая комплексная молекула содержит ингибиторную часть молекулы.
Биомолекула узнавания - молекула, способная специфически узнаваться и связываться с тестируемой биомолекулой. Если тестируемая биомолекула является олигонуклеотидной последовательностью, биомолекула узнавания является комплементарной последовательностью. Если тестируемая молекула является членом пары узнавания (такой как антигенантитело), то биомолекула узнавания является другим членом этой пары.
Первый олигонуклеотид - олигонуклеотид, обычно молекула ДНК, который содержит в направлении от 3'к 5': двухцепочечный функциональный промотор, одноцепочечную последовательность, которая кодирует последовательность, комплементарную последовательности инициирующих рибозимов, одноцепочечную последовательность, идентичную (с необходимыми заменами U на Т) последовательности РНК, способной расщепляться каталитически активным инициирующим рибозимом, и одноцепочечную последовательность, комплементарную 5'-части детектируемой олигонуклеотидной последовательности.
Второй олигонуклеотид - олигонуклеотид, обычно молекула ДНК, который содержит в направлении от 3'к 5': одноцепочечную 3'-часть, комплементарную детектируемой олигонуклеотидной последовательности, и триггерную олигонуклеотидную матрицу (см. ниже).
Триггерная олигонуклеотидная матрица - олигонуклеотидная последовательность, которая является частью второго олигонуклеотида, продукт транскрипции которой способен гибридизоваться с обратной промоторной конструкцией (см. ниже).
Триггерная олигонуклеотидная последовательность - продукт транскрипции триггерной олигонуклеотидной матрицы, способный гибридизоваться с обратной промоторной конструкцией (см. ниже) и после дополнения обратного промотора до функционального промотора может приводить к транскрипции олигонуклеотидной последовательности, к которой он присоединен.
Олигонуклеотид с нематричной цепью - продукт транскрипции олигонуклеотидного гибрида, полученного гибридизацией анализируемой последовательности нуклеиновой кислоты, первого олигонуклеотида и второго олигонуклеотида, который содержит в направлении от 3'к 5': триггерную олигонуклеотидную последовательность, последовательность, комплементарную тестируемой биомолекуле, последовательность, комплементарную последовательности, расщепляемой инициирующим рибозимом, и последовательность, комплементарную инициирующему рибозиму.
Обратная промоторная конструкция - одноцепочечная промоторная последовательность, присоединенная к одноцепочечной последовательности, способной гибридизоваться с триггерной олигонуклеотидной последовательностью. После гибридизации с триггерной олигонуклеотидной последовательностью и при действии подходящей ДНК-полимеразы создается функциональный двухцепочечный промотор, который в присутствии системы транскрипции (см. ниже) способен продуцировать конечный олигонуклеотидный транскрипт (см. ниже).
Конечный олигонуклеотидный транскрипт - продукт транскрипции олигонуклеотидных гибридов, полученных после гибридизации обратной промоторной конструкции, олигонуклеотида с нематричной цепью (после дополнения этого промотора подходящей ДНК-полимеразой до двухцепочечного функционального промтора), который содержит в направлении от 5' к 3': последовательность инициирующего рибозима, последовательность, способную отщепляться инициирующим рибозимом, последовательность, кодирующую комплемент детектируемой последовательности на тестируемой биомолекуле, и последовательность, кодирующую комплемент триггерной олигонуклеотидной матрицы. Инициирующий рибозим в этом конечном олигонуклеотидном транскрипте может отщеплять смежную последовательность, высвобождаясь таким образом и давая свободный, полностью активный инициирующий рибозим.
Третья олигонуклеотидная последовательность - последовательность нуклеиновой кислоты, комплементарная 5'-части детектируемой последовательности в тестируемой биомолекуле.
Третья композиционная молекула - молекула, используемая в "варианте сборки" данного изобретения, которая содержит третью олигонуклеотидную последовательность, соединенную с частью инициирующего рибозима. Она также необязательно содержит последовательность, отщепляемую активным инициирующим рибозимом.
Четвертая олигонуклеотидная последовательность - олигонуклеотидная последовательность, комплементарная 3'-части детектируемой последовательности тестируемой биомолекулы.
Четвертая композиционная молекула - молекула, используемая в "варианте сборке" данного изобретения, которая состоит из четвертой олигонуклеотидной последовательности, соединенной с частью инициирующего рибозима, требуемой для дополнения части, присутствующей в третьей композиционной молекуле, для получения полного каталитически активного рибозима. Она также необязательно содержит последовательность, отщепляемую активным инициирующим рибозимом.
Каталитическая система - ансамбль молекул и реакционных смесей, который в присутствии каталитически активного рибозима продуцирует детектируемый сигнал. Этот ансамбль молекул содержит комбинацию композиционных молекул, включающую рибозим, который a priori неактивен. В одном варианте каталитическая система содержит реагенты и комбинацию первой композиционной молекулы и второй композиционной молекулы (см. ниже), включающих в себя первый и второй рибозим (неактивный) соответственно. Первый и второй рибозимы априорно неактивны и каждый или оба могут активироваться каталитически активным инициирующим рибозимом. Активный первый рибозим может активировать неактивные молекулы второго рибозима и активные молекулы второго рибозима могут активировать неактивный первый рибозим, амплифицируя количество активного рибозима по принципу положительной обратной связи. Альтернативно, первый и второй рибозимы могут быть иммобилизованы или пространственно отделены друг от друга и отщепление одного или обоих инициирующим рибозимом вызывает их высвобождение в среду. Будучи высвобожденными, свободные рибозимы могут высвобождать иммобилизованные вторые рибозимы, а свободные вторые рибозимы могут в свою очередь высвобождать свободный первый рибозим, вызывая каскад самоамплифицирующей реакции, который быстро приводит к амплификации числа активных рибозимов по способу положительной обратной связи.
Каталитическая система может также включать, согласно другому варианту, только один вид композиционных молекул, которые иммобилизованы или пространственно отделены друг от друга, в реакционном сосуде, которые априорно неактивны. Инициирующий рибозим активирует неактивный рибозим или высвобождает рибозим из композиционной молекулы и молекулы активного или высвобожденного рибозима действуют затем, соответственно активируя неактивные или высвобождая иммобилизованные другие рибозимы, вызывая затем каскад самоамплифицирующей реакции, который быстро приводит к амплификации числа активных рибозимов по принципу положительной обратной связи.
В результате активации или высвобождения рибозима продуцируется детектируемый сигнал, который указывает на присутствие инициирующего рибозима в среде.
Первая композиционная молекула содержит первый рибозим (см. ниже), необязательно меченный, соединенный со второй последовательностью нуклеиновой кислоты (см. ниже).
Вторая композиционная молекула содержит второй рибозим (см. ниже), необязательно меченный, соединенный с первой последовательностью нуклеиновой кислоты (см. ниже).
Первая последовательность нуклеиновой кислоты - олигонуклеотидная последовательность, которая является частью второй композиционной молекулы и которая является мишенью для каталитической активности первого рибозима (см. ниже). После воздействия каталитической активности первого рибозима на первую последовательность нуклеиновой кислоты второй рибозим (см. ниже) либо высвобождается в среду, либо становится каталитически активным.
Вторая последовательность нуклеиновой кислоты - олигонуклеотидная последовательность, которая является частью первой композиционной молекулы и которая является мишенью для каталитической активности второго рибозима (см. ниже). После воздействия каталитической активности второго рибозима на вторую последовательность нуклеиновой кислоты первый рибозим (см. ниже) либо высвобождается в среду, либо становится каталитически активным.
Первый рибозим - часть первой композиционной молекулы - способен отщеплять первую последовательность нуклеиновой кислоты и идентичен по его каталитической активности инициирующему рибозиму. Он является необязательно меченным.
Второй рибозим - часть второй композиционной молекулы - способен отщеплять вторую последовательность нуклеиновой кислоты и является необязательно меченным.
Третий рибозим - рибозим, который может образовать часть каталитической системы в соответствии с его другим вариантом. Третьи рибозимы являются исходно неактивными. Инициирующий рибозим активирует третий рибозим с проявлением в отношении него своей каталитической активности (как будет объяснено ниже) и активированный рибозим может затем активировать другой третий рибозим в каталитической системе.
Система транскрипции - ансамбль олигонуклеотидов, нуклеотидов, РНК-полимеразы и реагентов, которые в присутствии олигонуклеотидной матрицы приводят к транскрипции олигонуклеотидного транскрипта.
Четвертый рибозим - рибозим, который является частью каталитической системы в соответствии с ее вариантом и который после его превращения в каталитически активный рибозим может лигировать две части пятого рибозима (см. ниже) с образованием каталитически активного пятого рибозима. Четвертый рибозим состоит по меньшей мере из двух компонентов, которые первоначально разделены и которые лигируются вместе пятым рибозимом (когда он каталитически активен). После такого лигирования четвертый рибозим становится каталитически активным.
Пятый рибозим - рибозим, который является частью каталитической системы, содержащей четвертый рибозим, и который после его превращения в каталитически активный рибозим может лигировать вместе две части четвертого рибозима с образованием каталитически активного четвертого рибозима. Пятый рибозим состоит по меньшей мере из двух компонентов, которые первоначально разделены и которые лигируются вместе четвертым рибозимом. После такого лигирования пятый рибозим становится каталитически активным.
Шестой рибозим - специфический пример третьего рибозима, в котором неактивный рибозим несет дополнительную последовательность нуклеиновой кислоты и активируется при отщеплении или сплайсинге (то-есть, удалении) этой последовательности.
Седьмой рибозим - рибозим, в котором тестируемая последовательность нуклеиновой кислоты дополняет отсутствующую часть, существенную для его каталитической активности и, следовательно, он становится каталитически активным при комбинировании с тестируемой последовательностью.
Данное изобретение обеспечивает способ амплификации сигнала на основе рибозима, который является простым в выполнении, быстрым и недорогим. В противоположность доступным до сих пор способам детектирования-амплификации способ данного изобретения пригоден также для тестирования точки лечения (a point-of-care (РОС) testing).
Одним из преимуществ способа данного изобретения является то, что рибозимы являются активными при условиях, обнаруживаемых в клиническом окружении, например, в биологических жидкостях. Кроме того, как будет показано далее ниже, способ амплификации сигнала в соответствии с данным изобретением не требует соблюдения специфических условий для обеспечения специфичности (строгое соблюдение специфических условий является недостатком предшествующих способов амплификации сигнала). Кроме того, рибозимы функциональны в различных смесях препаратов проб, например, в 1М гуанидинтиоцианатном препарате, а также в препарате с насыщенным фенолом, который обычно ингибирует функционирование других систем детектирования-амплификации.
Рибозимы состоят из последовательностей нуклеиновых кислот и, следовательно, тестируемые последовательности и последовательности зондов могут быть включены в молекулу рибозима. Кроме того, можно увеличить специфичность способа амплификации путем конструирования рибозима таким образом, что для проявления рибозимом его каталитической активности будет необходима часть самой тестируемой последовательности.
Очень сильнодействующий способ, называемый в данной области "эволюцией in vitro", был успешно применен к рибозимам для получения рибозима с разнообразными каталитическими активностями и специфичностями. При помощи подобных способов огромный ряд потенциальных рибозимов подвергают скринингу на активность. Рибозимы, которые обнаруживают активность, очищают для дальнейших циклов отбора и после повторных циклов остаются только наиболее сильные кандидаты. В традиционных способах амплификации, после выбора фермента, среда, в которой должен действовать данный фермент, т.е. содержащая пробу среда, должна быть модифицирована для возможности проявления требуемой активности фермента. В случае рибозима, с использованием эволюции in vitro, можно выбрать рибозим, который высокоактивен в желаемой клинической (биологической) среде, путем проведения эволюции in vitro в элективной среде, которая идентична по ее составу клинической пробе.
Данное изобретение обеспечивает чувствительный способ обнаружения каталитически активного рибозима (называемого здесь "инициирующим рибозимом") в среде. Обнаружение присутствия каталитически активного инициирующего рибозима само по себе может быть целью, хотя обычно каталитически активный инициирующий рибозим служит в качестве репортера для присутствия других биомолекул в тест-пробе. Как только среду, содержащую активный инициирующий рибозим, вводят в каталитическую систему в соответствии с данным изобретением, в ней происходит каскад каталитических реакций, который приводит к экспоненциальной амплификации числа активных рибозимов. Каталитическая система содержит рибозимы, которые либо неактивны, либо пространственно отделены друг от друга, так что они не могут проявлять их каталитическую активность; инициирующий рибозим высвобождает или активирует рибозимы каталитической системы, которые в свою очередь высвобождают или активируют соответственно дальнейшие рибозимы системы. Рибозимы либо несут детектируемую метку, либо их каталитическая активность вызывает образование детектируемой метки, которая затем служит указанием на каталитический каскад, который имел место в этой системе.
Согласно вариантам данного изобретения, в которых рибозимы исходно иммобилизованы, присутствие свободных рибозимов в реакционной среде может само собой служить в качестве детектируемого сигнала. В соответствии с другим вариантом, каждый активный рибозим создан для несения или продуцирования детектируемой метки и эти метки служат затем в качестве детектируемого сигнала.
Согласно способу данного изобретения, существует очень небольшой ложный положительный сигнал, то-есть, низкий уровень фона; кроме того, способ данного изобретения позволяет детектировать несколько биомолекул в одной тест-системе.
Таким образом, данное изобретение обеспечивает способ обнаружения присутствия каталитически активного инициирующего рибозима в среде, предусматривающий стадии:
(a) обеспечение каталитической системы, содержащей:
(aa) рибозимы, которые априорно каталитически неактивны или пространственно ограничены таким образом, что они не могут проявлять их каталитическую активность в отношении их мишени; при этом мишенью этих рибозимов являются другие рибозимы каталитической системы и их каталитическая активность в отношении таких других рибозимов вызывает:
(i) либо активацию неактивных рибозимов,
(ii) либо высвобождение пространственно ограниченных рибозимов, позволяющее им достигать их мишеней;
причем по меньшей мере некоторые из рибозимов этой каталитической системы являются мишенью каталитической активности инициирующего рибозима и каталитическая активность инициирующего рибозима в отношении некоторых указанных рибозимов является активностью, указанной в (i) и (ii) выше; и включающей
(ab) детектируемую метку, имеющую детектируемые свойства, так что каталитическая активность рибозимов вызывает изменение детектируемых свойств;
(b) контактирование среды с этой каталитической системой;
(с) обеспечение условий, позволяющих каталитически активному инициирующему рибозиму и каталитически активным рибозимам каталитической системы проявлять их каталитическую активность, в результате чего присутствие каталитически активного инициирующего рибозима приводит к каскаду реакций, в которых рибозимы каталитической системы активируются или высвобождаются в среду; и
(d) детектирование детектируемых свойств, причем изменение этих свойств является указанием на присутствие активного инициирующего рибозима в данной среде.
Важнейшее применение способа обнаружения рибозима данного изобретения находится в рамках теста, предназначенного для обнаружения присутствия биомолекулы, такой как: специфическая последовательность нуклеиновой кислоты, член пары связывания, такой как антитело-антиген, сахар-лектин и т.д., в биологической пробе. Такой анализ концептуально может быть представлен как содержащий два отличающихся компонента (хотя эти компоненты могут быть физически включены в один реакционный сосуд): систему детектирования и каталитическую систему. В таком анализе присутствие тестируемой биомолекулы приводит к образованию (как описано далее ниже) каталитически активного инициирующего рибозима в среде. Затем каталитически активный инициирующий рибозим действует как репортерная молекула в каталитической системе, приводя, после каскада реакций, который амплифицирует ряд активных рибозимов, к появлению детектируемой метки в реакционной среде, как описано выше. Таким образом, появление такой детектируемой метки в среде каталитической системы указывает на присутствие тестируемой биомолекулы в исходной тестируемой биологической пробе.
Согласно данному изобретению, обеспечено новое использование рибозимов. В наиболее общем смысле каталитическая система, содержащая рибозимы, используется для обнаружения присутствия каталитически активного инициирующего рибозима в тестируемой среде. Обнаружение присутствия каталитически активного инициирующего рибозима в тестируемой среде само может быть целью, например, в способе получения рибозимов, называемом эволюцией in vitro. Кроме того, в соответствии с предпочтительным вариантом данного изобретения, каталитически активный инициирующий рибозим служит в качестве репортера для присутствия тестируемой биомолекулы (отличающейся от инициирующего рибозима) в тестируемой биологической пробе.
Рибозимы, используемые в соответствии с данным изобретением, могут состоять целиком из РНК. Иногда можно также заменить некоторые из рибонуклеотидов ("rNTP") в РНК дезоксинуклеотидами ("dNTP") или некоторыми другими природно-встречающимися или не встречающимися в природе нуклеотидами, такими как IsoG или IsoC 5'-O-(1- тиотрифосфат)нуклеозидами и 5-O-метилнуклеотидами. Такая замена иногда является желательной, например, для увеличения стабильности рибозима к РНКазе, присутствующей почти во всех биологических пробах. Хотя это не будет специально упоминаться, каждый раз подразумевается, что термин "рибозим" обозначает каталитические нуклеотиды, состоящие целиком из rNTP, или каталитические олигонуклеотиды, в которых некоторая часть rNTP была заменена dNTP или другими нуклеотидами. Рибозим может также целиком состоять из ДНК (Breaker et al., Chemistry and Biology, 1(4):223-229, 1994).
Рибозимы данного изобретения могут содержать последовательности нуклеиновых кислот, описанные выше, в комплексе с молекулой, не являющейся нуклеиновой кислотой, такой как белок, полипептид, жирная кислота, краситель, антибиотик или углевод. Не являющаяся нуклеиновой кислотой часть, образующая комплекс с рибозимом, может служить в качестве кофактора для каталитической активности рибозима.
В дальнейшем, будет использоваться термин "олигонуклеотид". Олигонуклеотиды, в зависимости от контекста, могут быть ДНК-олигонуклеотидом (состоящим целиком из dNTP) или РНК-олигонуклеотидом (состоящим целиком из rNTP). Однако конкретно в случае РНК-олигонуклеотидов иногда желательно заменить некоторые или все rNTP на dNTP или другие природные и неприродные нуклеотиды.
Данное изобретение обеспечивает, в его самом широком смысле, способ обнаружения присутствия в тестируемой среде каталитически активного инициирующего рибозима. Под "каталитически активным" подразумевают рибозим, способный проводить каталитическую реакцию, такую как расщепление, сплайсинг, лигирование, присоединение специфических групп, таких как фосфат, к молекулам, реаранжировку последовательностей нуклеиновых кислот и т.п.
Каталитическая система в соответствии с одним вариантом проведения изобретения содержит два вида рибозимов, которые априорно являются неактивными, но становятся каталитически активными в результате воздействия на них каталитической активности. Например, каждый рибозим может иметь разрыв или прерывание в части, существенной для его активности, и, следовательно, для его активации требуется предварительное лигирование этого разрыва или прерывания. В этом случае каталитическая система содержит два вида рибозимов, каждый из которых a priori разорван на два компонента и поэтому исходно неактивен. Активный рибозим одного вида способен лигировать эти два компонента второго вида рибозима, делая его активным, а активный рибозим второго вида рибозима способен лигировать два компонента первого вида, делая его активным. Затем эта активация продолжается перекрестным лигированием амплифицирующим образом по принципу положительной обратной связи.
Первый активный рибозим одного вида может быть образован инициирующим рибозимом, который является продуктом системы детектирования, одним из двух путей.
Согласно первому пути, некоторые из рибозимов первого вида априорно являются собранными, но не могут легировать части рибозимов второго вида, поскольку они пространственно отделены от них, например, в результате иммобилизации их при помощи пористой мембраны и т.д. Инициирующий рибозим отщепляет молекулы иммобилизованного, полностью собранного первого вида рибозима, и свободный первый вид рибозима затем легирует второй вид рибозимов, которые в свою очередь легируют члены первого вида рибозима, которые не являются априорно собранными, и т.д.
Согласно второму пути, инициирующий рибозим сам является легирующим рибозимом, который легирует из его частей по меньшей мере один вид из двух рибозимов каталитической системы, инициируя таким образом каскад перекрестного легирования. В таком случае нет необходимости в пространственном разделении различных членов каталитической системы, так как до тех пор, пока инициирующий рибозим не введен в реакционную смесь, каталитический процесс не может начаться.
Другим примером являются рибозимы, которые имеют избыточную последовательность, которая делает рибозим неактивным и, следовательно, должна быть либо отщеплена, либо удалена сплайсингом для активации рибозима. Следующим примером являются рибозимы, которые требуют реаранжировки последовательности или присоединения специфических групп для активации. Еще одним примером являются рибозимы, которые требуют обращенного сплайсинга экзонов, т.е. присоединения последовательности интрона к рибозиму.
Один вид рибозимов в его активной форме может активировать неактивные рибозимы второго вида, и наоборот, когда он обладает каталитическими свойствами (легирование, расщепление, сплайсинг, peaранжировка и т.д.), необходимыми для модификации другого вида рибозима из неактивной в активную форму. Эти два рибозима могут потенциально обладать одним и тем же типом каталитической активности (например, оба являются легирующими рибозимами или оба являются расщепляющими рибозимами и т.д.) или они могут обладать разными типами каталитических активностей.
Один или оба вида априорно неактивных рибозимов активируются каталитически активным инициирующим рибозимом. Перед введением инициирующего рибозима в среду каталитическая система является по существу молчащей, так как нет никакой каталитической активности. В присутствии такого инициирующего рибозима начинается каскад амплификации рибозимов, так как каждый активный рибозим генерирует в свою очередь больше активных рибозимов по способу положительной обратной связи. Активные рибозимы порождают сигнал, который может быть детектирован, как описано ниже, и такой сигнал является указанием на присутствие исходного каталитически активного инициирующего рибозима в среде.
Каталитическая система согласно другому варианту проведения данного изобретения содержит два вида композиционных молекул, каждая из которых содержит рибозим, связанный с отщепляемой последовательностью нуклеиновой кислоты. Рибозим в одном виде композиционных молекул способен отщеплять последовательность нуклеиновой кислоты в другом виде композиционных молекул, так что возможно, в принципе, перекрестное расщепление между двумя видами композиционных молекул, тогда как саморасщепления не происходит. Однако до введения инициирующего рибозима в среду перекрестного отщепления не происходит, так как эти два вида композиционных молекул конструируют таким образом, чтобы предотвратить взаимодействие между ними, в то время как отщепленные рибозимы способны взаимодействовать с другими композиционными молекулами в тест-сосуде и продолжать высвобождать рибозимы в среду по принципу положительной обратной связи.
Предотвращение взаимного действия может быть достигнуто, например, иммобилизацией каждого вида композиционных молекул на противолежащих сторонах реакционных сосудов; связыванием каждого вида композиционных молекул с различными гранулами или различными коллоидными частицами, имеющими свойства, например, размер или иные свойства, например, одинаковый электрический заряд (который отталкивает гранулы друг от друга), которые предотвращают какой-либо тип взаимодействия между молекулами, прикрепленными к одной из частиц, с молекулами, прикрепленными к другой частице, связыванием композиционных молекул с молекулярными частицами, имеющими один и тот же электрический заряд, так что электрическое отталкивание между этими молекулярными частицами будет препятствовать любому взаимодействию между двумя композиционными молекулами; помещением каждого вида композиционных молекул на разных сторонах пористой мембраны, которая не позволяет проходить через нее полным композиционным молекулам, но позволяет свободное прохождение отщепленного рибозима.
Каталитически активный инициирующий рибозим, либо присутствующий в тест-среде заранее, либо продуцируемый в результате присутствия другой биомолекулы в биологической пробе (такой как рибозим в этом случае) ("репортерный рибозим"), способен отщеплять специфическую нуклеиновую кислоту, присутствующую в одном или обоих видах композиционных молекул, высвобождая таким образом рибозимы каталитической системы. Отщепленные рибозимы способны свободно взаимодействовать в реакционном сосуде с рибозимами из другого вида композиционных молекул, которые в свою очередь могут опять отщеплять рибозимы из первого вида композиционных молекул, создавая тем самым перекрестное расщепление рибозимов типа "пинг-понга". Такое перекрестное отщепление рибозимов действует по принципу положительной обратной связи, вызывая значительную амплификацию этой реакции. Любой или оба вида рибозимов обычно несут детектируемые метки. Детектирование отщепленных меток указывает на присутствие каталитически активного инициирующего рибозима в реакционной смеси. Если инициирующий рибозим является репортерным рибозимом, обнаружение свободной метки указывает на присутствие тестируемой биомолекулы в реакционной смеси.
Каталитическая система может содержать, в соответствии с другим вариантом, только один вид неактивных рибозимов или один вид композиционных молекул, содержащих рибозим и последовательность нуклеиновой кислоты, отщепляемую этим рибозимом при превращении в свободную или активную форму. Аналогично способу, описанному выше, для одного такого варианта каждая отдельная молекула этого рибозима является неактивной, пока в среду не вводят каталитически активный инициирующий рибозим; например, каждая неактивная молекула находится в форме замкнутого кольца, которое может быть открыто отщеплением или сплайсингом отрезка нуклеотидов каталитически активным инициирующим рибозимом. Активированные (открытые) рибозимы затем открываются и активируют другие такие молекулы в виде замкнутого кольца данной каталитической системы.
Аналогично описанному выше, для другого второго варианта каждый один вид композиционной молекулы может содержать рибозим, расположенный в ориентации, которая препятствует самоотщеплению смежной последовательности нуклеиновой кислоты, например, помещением этой последовательности непосредственно рядом с рибозимом. Тот факт, что нет промежуточных последовательностей между рибозимом и отщепляемой последовательностью, стерически ингибирует цис-отщепление. (Отщепляемая последовательность может также иметь обращенную ориентацию, и цис-отщепление будет, следовательно, невозможным). Однако, освобожденный рибозим может иметь доступ к последовательности нуклеиновой кислоты в правильной ориентации и отщеплять ее, освобождая больше рибозимов в среду. Для предотвращения самопроизвольного транс-отщепления невысвобожденных рибозимов можно обеспечить пространственное разделение, как указано выше.
Обнаружение присутствия активированных рибозимов в каталитической системе может принимать разные формы в зависимости от типа каталитической активности рибозима. В том случае, например, когда активность является расщеплением или сплайсингом, метка может быть соединена с частью, которая должна быть отщеплена или удалена сплайсингом, и детектирование такой освобожденной метки является затем указанием на присутствие каталитически активного инициирующего рибозима в среде.
В некоторых случаях активация рибозима приводит к изменению расстояния между двумя районами рибозима, например, когда два удаленных района соединяются легированием или реаранжировкой, сплайсингом мешающего района, или когда два исходно смежных района отделяются, например, открытием замкнутого кольца. В таком случае можно присоединить флуоресцентный маркер на одном участке рибозима и молекулярную частицу, такую как родамин, который гасит эмиссию света из флуоресцентного маркера, на другом участке рибозима. Родамин обладает гасящим действием на эмиссию света флуоресцентной метки, когда два этих участка являются смежными, и не оказывает такого действия, когда эти два участка разделены. Путем мониторинга изменения в эмиссии света флуоресцентной метки можно определить, являются ли эти два района смежными (например, в случае неактивного рибозима с замкнутым кольцом) или разделенными (когда рибозим был открыт или активирован).
Метка может также находиться на субстрате, который не связан с рибозимом и на котором каталитически активный рибозим может проявлять его каталитическую активность. Например, метку может нести последовательность нуклеиновой кислоты, которая отщепляется или удаляется сплайсингом в результате активности рибозима, в результате чего метка высвобождается в среду. Детектирование будет в этом случае основано на присутствии свободной метки в среде.
Перекрестная "пинг-понг"-активация путем перекрестного отщепления, перекрестного легирования, перекрестного сплайсинга, перекрестной реаранжировки или чередующихся циклов различных каталитических действий, по существу, амплифицирует реакцию, приводя к сигналу, который указывает за короткое время, присутствовал ли в среде каталитически активный инициирующий рибозим. В то время как прежние способы амплификации-детектирования, такие как ПЦР или ЛЦР, требуют нескольких часов для завершения, способ амплификации-детектирования данного изобретения завершается в течение гораздо более короткого периода времени.
В том случае, когда каталитически активный инициирующий рибозим служит в качестве репортерного рибозима для указания на присутствие других биомолекул, требуется система детектирования, в которой каталитически активный инициирующий рибозим образуется только в присутствии анализируемой биомолекулы. Это может быть выполнено в одном из следующих вариантов, называемых здесь "вариантом активации", "вариантом транскрипции", "вариантом сборки" и "вариантом дополнения (комплектования)".
Согласно варианту активации, инициирующий (репортерный) рибозим является априорно неактивным. Это отсутствие активности может быть результатом отсутствия ионов магния, которые необходимы для каталитической активности рибозима в среде; это может быть результатом присутствия ингибиторной части молекулы в среде; это может быть результатом присутствия в среде олигонуклеотида, который гибридизуется с последовательностью, которая должна быть отщеплена, либо для активации, либо для высвобождения рибозима в систему, причем это отщепление невозможно, пока эта последовательность является двухцепочечной, и т.д. Согласно этому варианту, рибозим соединен с биомолекулой узнавания, которая способна специфически узнавать биомолекулу, которая должна быть определена в пробе и связываться с ней. Например, в случае, когда тестируемая биомолекула является олигонуклеотидной последовательностью, биомолекула узнавания является комплементарной последовательностью; когда тестируемая биомолекула является ферментом, биомолекулой узнавания может быть субстрат; когда тестируемая биомолекула является антигеном, биомолекула узнавания может быть антителом, специфически взаимодействующим с этим антигеном, и т.д.
Рибозиму, соединенному с молекулой узнавания, позволяют затем взаимодействовать с тестируемыми биомолекулами, и несвязанные рибозимы затем отделяют и удаляют промыванием. Такое разделение можно проводить на основе различия в размерах между комплексами связанных рибозимов и тестируемых биомолекул и свободными рибозимами; при помощи предварительной иммобилизации тестируемых биомолекул и последующего вымывания свободных молекул рибозимов; и т.д. После указанного разделения условия изменяют таким образом, чтобы активировать рибозим, например, добавлением отсутствующих ионов магния; модификацией или удалением ингибиторной части для прекращения ее ингибиторной активности; расплавлением двухцепочечной неотщепляемой последовательности до одноцепочечной отщепляемой последовательности; и т.д. Только в случае присутствия тестируемой биомолекулы рибозимы, которые связаны с ней, сохраняются и только эти сохраненные рибозимы активируются при подходящем изменении условий.
Можно использовать вариант транскрипции данного изобретения, в котором тестируемая биомолекула является последовательностью нуклеиновой кислоты. Фазу детектирования этого варианта можно проводить, в общем, как описано в Israel Patent Application Nos. 105894 and 111857 (and their counterpart PCT Applications Nos. WO/94/29481 and) с "триггерным олигонуклеотидом", представляющим собой инициирующий рибозим. Система детектирования этого варианта содержит две олигонуклеотидные молекулы, первая из которых содержит последовательность, комплементарную 5'-части тестируемой последовательности нуклеиновой кислоты, а вторая содержит последовательность, комплементарную 3'-части тестируемой последовательности нуклеиновой кислоты. Первая олигонуклеотидная молекула содержит против хода транскрипции от последовательности, комплементарной тестируемой биомолекуле, функциональный промотор, последовательность, кодирующую последовательность инициирующего рибозима, и последовательность, которая способна отщепляться детектирующим рибозимом (также по существу ДНК-последовательность). Вторая олигонуклеотидная молекула содержит, по ходу транскрипции от комплементарной 3'-части тестируемой последовательности, триггерную олигонуклеотидную матрицу, продукт транскрипции которой способен запускать транскрипцию последовательностей инициирующих рибозимов, как будет подробно объяснено далее.
Если тестируемая биомолекула не присутствует в тест-пробе, то триггерная олигонуклеотидная последовательность не транскрибируется, так как только присутствие тестируемой биомолекулы сводит вместе две молекулы, необходимые для образования подходящей матрицы триггерной олигонуклеотидной последовательности; а именно, первую олигонуклеотидную молекулу, несущую функциональный промотор, и вторую олигонуклеотидную молекулу, несущую триггерную олигонуклеотидную матрицу. Если тестируемые биомолекулы присутствуют, и в присутствии системы транскрипции образуется триггерная последовательность, которая в свою очередь способна вызвать образование транскриптов, содержащих инициирующий рибозим, связанный с последовательностью, отщепляемой им. После саморасщепления эти транскрипты высвобождают в среду каталитически активный инициирующий рибозим.
Согласно варианту сборки данного изобретения, в случаях, когда тестируемой биомолекулой является последовательность нуклеиновой кислоты, система детектирования должна содержать третий олигонуклеотид, включающий в себя последовательность, комплементарную 5'-части тестируемой последовательности нуклеиновой кислоты, и четвертый олигонуклеотид, включающий в себя последовательность, комплементарную остальной, 3'-части тестируемой последовательности нуклеиновой кислоты. Каждый из этих олигонуклеотидов содержит только одну часть (например, половину) рибозима и обе части вместе составляют полный, функционально активный рибозим.
Согласно этому варианту, функция тестируемой последовательности нуклеиновой кислоты заключается в сведении вместе этих двух олигонуклеотидов с образованием функционально активного инициирующего рибозима. Таким образом, в присутствии тестируемой последовательности нуклеиновой кислоты в пробе будет образовываться функциональный инициирующий рибозим, который можно детектировать в каталитической системе данного изобретения.
В соответствии с вариантом дополнения (комплектования) данного изобретения, система детектирования содержит седьмой олигонуклеотид, и тестируемая последовательность образует комплекс с седьмым олигонуклеотидом с образованием каталитически активного инициирующего рибозима. Например, тестируемая последовательность может образовывать часть каталитического кора (ядра) рибозима. Таким образом, в соответствии с этим вариантом, рибозим априорно является неполным, и только в присутствии тестируемой последовательности он становится полным, каталитически активным рибозимом, который затем может быть детектирован в каталитической системе.
Тестируемая последовательность может дополнять (комплектовать) рибозим гибридизацей на его 3'-конце с последовательностью на одной стороне недостающей части рибозима и гибридизацией на его 5'-конце с последовательностью на другой стороне недостающей части рибозима, присоединяя таким образом недостающую часть и создавая функциональный инициирующий рибозим.
Тестируемая последовательность может также быть способной дополнять недостающую часть рибозима "обратным сплайсингом экзона", при котором тестируемая последовательность встраивается в рибозим посредством соответствующих реакций расщепления и легирования. Этот "обратный сплайсинг экзона" может проводиться другими рибозимами, присутствующими в среде.
Для уменьшения уровня "фона" способа изобретения и уменьшения ложных положительных результатов можно комбинировать два или более вариантов изобретения для двойной гарантии того, что каталитически активный инициирующий рибозим не образуется в отсутствие тестируемых биомолекул. Например, можно комбинировать варианты сборки и активации данного изобретения, в результате чего каталитически активные рибозимы будут образовываться только как результат двух накапливающих условий: сборки полного рибозима из двух частей в смеси без магния и после вымывания свободных неполных рибозимов активации полного рибозима добавлением ионов магния.
Рибозимы, используемые в большинстве вариантов системы детектирования данного изобретения, являются в большинстве случаев универсальными, т.е. можно использовать один и тот же рибозим для обнаружения различных анализируемых биомолекул, так как специфичность приобретается путем присоединения биомолекулы узнавания (в варианте активации) или создается первой и второй олигонуклеотидными молекулами (в варианте транскрипции) или третьей и четвертой олигонуклеотидными последовательностями (в варианте сборки). Пятый олигонуклеотид в случае варианта дополнения (комплектования) данного изобретения должен быть сконструирован для каждой специфической анализируемой нуклеиновой кислоты, поскольку последовательность, узнающая тестируемую последовательность, является частью самого рибозима.
Данное изобретение обеспечивает также реагенты, необходимые для проведения описанного выше способа, а также набор, содержащий эти реагенты.
Далее изобретение будет описано со ссылкой на некоторые не ограничивающие изобретение чертежи и примеры.
В чертежах используются различные символы, которые в контексте данного изобретения имеют значения, приведенные в конце описания.
Фиг. 1 показывает вариант каталитической системы изобретения, содержащей два вида композиционных молекул, активируемых перекрестным отщеплением;
фиг. 2(a) и 2(b) показывают каталитическую систему в соответствии с вариантом изобретения, содержащую один вид композиционной молекулы, активируемый перекрестным отщеплением или перекрестным сплайсингом, где рибозим изображен в форме замкнутого кольца (фиг. 2(а)); где рибозим нуждается в сплайсинге, чтобы стать активным (фиг. 2(b));
фиг. 3 показывает различные способы, при помощи которых композиционные молекулы могут быть отделены друг от друга: иммобилизацией с различными местами реакционного сосуда (3A); связыванием с крупными гранулами (3B); при помощи связи с заряженными молекулярными частицами (3C); и помещением каждого вида композиционных молекул на противоположных сторонах пористой мембраны (3D);
фиг. 4 показывает пример системы детектирования согласно варианту активации данного изобретения, в котором рибозим активируется добавлением ионов магния;
фиг. 5 показывает другой пример системы детектирования согласно варианту активации данного изобретения, в котором рибозим активируется модификацией ингибиторной части молекулы;
фиг. 6 показывает систему детектирования в соответствии с вариантом транскрипции данного изобретения;
фиг. 7 показывает систему детектирования согласно варианту сборки данного изобретения, где последовательность узнавания рибозима гибридизуется с анализируемой последовательностью нуклеиновой кислоты (фиг. 7(а)); или где открытый стебель-II рибозима гибридизуется с анализируемой последовательностью (фиг.(b));
фиг. 8 показывает пример каталитической системы данного изобретения, содержащей два вида рибозимов, активируемых перекрестным легированием;
фиг. 9 показывает другой пример системы детектирования в соответствии с вариантом активации данного изобретения, в котором рибозим активируется превращением отщепляемой последовательности в одноцепочечную;
фиг. 10 показывает результаты расщепления системы детектирования, содержащей рибозим с открытым стеблем-II фиг. 7(b);
фиг. 11 показывает результаты расщепления каталитической системы, содержащей композиционную молекулу в виде замкнутого круга фиг.2(b);
фиг. 12 показывает результаты расщепления рибозима в присутствии необработанной крови и денатурирующих агентов.
Каталитическая система.
Сначала будет рассмотрена фиг. 1, показывающая один из способов конструирования каталитической системы данного изобретения. Каталитическая система содержит два вида композиционных молекул 10 и 11. Композиционная молекула 10 содержит один тип меченого рибозима, который будет назван рибозимом A (12), связанного с последовательностью РНК, обозначаемой b (13). Композиционная молекула 11 содержит другой тип меченого рибозима, который будет назван рибозимом B (14), и последовательность РНК а (15). Рибозим B в молекуле 11 способен отщеплять последовательность b в молекуле 10, а рибозим A в молекуле 10 способен отщеплять последовательность а в молекуле 11. Исходно молекулы 10 и 11 неспособны взаимодействовать, так как они иммобилизованы в различных местах реакционного сосуда. Инициирующий рибозим 16 также способен отщеплять последовательность b в молекуле 10.
Если инициирующий рибозим присутствует в реакционной смеси, то последовательность b отщепляется с высвобождением свободного рибозима A (12) в реакционную смесь. Каждый рибозим A (12) способен диффундировать в реакционном сосуде для расщепления молекулы 11, высвобождая таким образом в реакционную смесь свободный рибозим B (14). Свободный рибозим B (14) опять способен мигрировать через реакционный сосуд для расщепления молекулы 10 с высвобождением вновь свободного рибозима A (12), и этот цикл повторяется вновь и вновь по принципу положительной обратной связи. Поскольку оба рибозима A и В являются мечеными, детектирование каждого или обоих в супернатанте свидетельствует о присутствии инициирующего рибозима 16 в реакционной смеси.
Далее следует пример молекулы 10, содержащей рибозим 12 типа головки молотка, соединенный с последовательностью 13, которую затем метят на 3'-конце биотином (заглавные буквы: 2'-O-метилированные; маленькие буквы: РНК)
5'CCA cugauga gGCC GAAA GGCc gaa acGUguc CGU AAA-
Далее следует пример молекулы 11, содержащей другой рибозим 14 типа головки молотка, который способен отщеплять последовательность 13, присутствующую в молекуле 10. Рибозим 14 соединен с последовательностью 15, отщепляемой рибозимом 12 молекулы, которую затем метят на ее 3'-конце биотином (заглавные буквы: 2'-O-метилированные; маленькие буквы: РНК)
5'-GAG ACG cugauga gGCC GAAA GGCc gaa acAC guc UGG AAA
Хотя рибозимы A и B называют различными рибозимами и а и b называют различными последовательностями, оба рибозима и обе последовательности могут быть на самом деле идентичными. В таком случае саморасщепления в каждой молекуле 10 и 11 избегают связыванием рибозима с присоединенной к нему последовательностью в такой близости, которая делает невозможным цис-расщепление, тогда как свободные рибозимы способны транс-расщеплять композиционные молекулы. Это может быть сделано связыванием рибозима непосредственно рядом с его потенциально отщепляемой последовательностью. Это связано с тем, что рибозим должен находиться на расстоянии нескольких нуклеотидов от потенциально отщепляемой им последовательности для эффективного отщепления. Таким образом, когда рибозим в композиционной молекуле связан непосредственно без промежутка с отщепляемой последовательностью, то цис-расщепление невозможно и последовательности могут быть расщеплены только в транс-расщеплении, что делает возможным только транс-расщепление.
Теперь рассматривается фиг. 2(а), которая показывает альтернативу, где только один вид композиционных молекул присутствует в реакционном сосуде. Каталитическая система содержит один вид молекул 17', каждая из которых содержит рибозим C' (18') и отщепляемую последовательность с' (19'). Молекула 17' находится в форме замкнутого кольца и, следовательно, рибозим 18' исходно является неактивным.
Если каталитически активный инициирующий рибозим 16' присутствует в среде, он способен отщеплять последовательность с' и раскрывать рибозим, делая его активным. Раскрытый рибозим 18' может в свою очередь раскрывать путем отщепления дополнительные композиционные молекулы 17', делая их активными. Детектирование можно проводить с применением флуоресцентной метки (F) и родамина (Rd). Когда они являются смежными, как это имеет место в замкнутой молекуле, эмиссия света флуоресцентной метки гасится, а когда они отделяются, как это имеет место в последовательности раскрытой молекулы, эмиссия света флуоресцентной метки становится более сильной.
Далее описывается фиг. 2(b), который показывает еще одну альтернативу каталитической системы, содержащей только один вид композиционной молекулы. Рибозим 17'' имеет в его центральной части (коре) дополнительную нуклеотидную последовательность 18'', которая делает рибозим неактивным. На конце этой экстра-последовательности находится блокирующая группа 19'', которая препятствует самопроизвольному легированию открытого конца.
Инициирующий рибозим 16''', который имеет каталитическую активность сплайсинга, способен отщеплять как дополнительную последовательность 18'', так и блокирующую группу 19'' и затем легировать свободные концы с образованием функционального рибозима. Затем функциональный рибозим способен сплайсировать другие рибозимы в реакционной среде, вызывая амплификацию реакции. Детектирование согласно одному выбору (Выбор 1) проводят, в основном, как описано в фиг. 2(а), но в этом случае родамин (Rd) и флуоресцентная группа (F) исходно разделены и только при активации рибозима они становятся смежными, так что активный рибозим детектируют по гашению эмиссии света. Согласно второму способу детектирования (Выбор 2), сплайсированная в среду группа, содержащая свободную дополнительную последовательность 18'' и блокирующую группу 19'', несет детектируемую метку.
Преимущество способа фиг. 2(b) состоит в очень низком уровне "фона", так как для того, чтобы неактивный рибозим стал самопроизвольно активным (без присутствия инициирующего рибозима), должны иметь место два самопроизвольных события: самопроизвольное расщепление (при вероятности 10-6-/мин в 10 мМ MgCl2 при физиологическом pH и при температуре 37oC) и самопроизвольное легирование (при вероятности 107/мин), что дает очень малую вероятность самопроизвольной активации (1013/мин).
Метка, присоединенная к любому или к обоим рибозимам A, B или C (фиг. 1), может быть любой детектируемой меткой, известной в данной области, такой как радиоактивный изотоп, флуоресцентная метка, фермент, способный в присутствии субстрата давать цветную реакцию, и т.д.
Фиг. 3 показывает различные способы, при помощи которых две композиционные молекулы 10 и 11 первого варианта помещают таким образом, чтобы избежать взаимодействия их друг с другом, но сделать возможным взаимодействие между свободными рибозимами 12 и 14 и композиционными молекулами. Должно быть понятно, что те же самые принципы используются для другого способа конструирования каталитической системы данного изобретения, т.е., когда присутствует только один вид композиционной молекулы, представленный на фиг. 2.
На фиг. 3(Ф) молекулы 10 и 11 иммобилизованы на различных и отделенных сторонах реакционного сосуда 18, тогда как рибозимы 12 и 14 свободно диффундируют в реакционной смеси.
Фиг. 3(B) показывает молекулы 10 и 11, которые иммобилизованы на гранулах 19, размер которых препятствует взаимодействию между этими молекулами. Однако, свободные рибозимы 12 и 14 способны свободно диффундировать в реакционном сосуде и взаимодействовать с иммобилизованными композиционными молекулами.
Фиг. 3(C) показывает другой пример разделения композиционных молекул, в котором композиционные молекулы 10 и 11 присоединены к заряженным молекулярным частицам, несущим одинаковый заряд 37. Электрическое отталкивание между соединенными с ними молекулярными частицами исключает возможность взаимодействия между молекулами 10 и 11. Однако свободные рибозимы 12 и 14, которые по существу не имеют заряда, способны взаимодействовать с композиционными молекулами.
Фиг. 3(D) показывает еще один пример разделения композиционных молекул 10 и 11 помещением их на противоположных сторонах пористой мембраны 34, которая служит в качестве сита, блокируя прохождение больших молекул 10 и 11, но позволяя проходить меньшим свободным рибозимам 12 и 14.
Другим способом гарантии, что две композиционные молекулы 10 и 11 не взаимодействуют друг с другом, является использование блокирующих молекул, которые комплементарны специфической последовательности и делают ее двухцепочечной. Согласно этому способу, композиционная молекула 10 содержит блокирующую молекулу, которая делает отщепляемую молекулу b и часть каталитического района рибозима A двухцепочечными. В частично двухцепочечной композиционной молекуле 10 рибозим неактивен вследствие того, что его каталитический район является двухцепочечным. Композиционная молекула 11 блокируется подобным образом. Если в реакционной смеси присутствует инициирующий рибозим, он вытесняет часть блокирующей молекулы, присутствующей на композиционной молекуле 10, и тогда инициирующая молекула способна отщеплять последовательность b. После отщепления последовательности b рибозим A также становится активным, поскольку частично вытесненная блокирующая молекула полностью отпадает от композиционной молекулы 10, превращая ее каталитический район в одноцепочечный и активный. Затем активный рибозим A вытесняет блокирующую молекулу композиционной молекулы 11 способом, описанным выше, отщеплением последовательности а, превращением рибозима B в одноцепочечный и активный. Затем рибозим B активирует композиционную молекулу 10 способом, сходным с активацией инициирующего рибозима, описанной выше, и после этого может происходить перекрестная активация двух композиционных молекул.
Далее описывается фиг. 8, которая показывает другую альтернативу для конструирования каталитической системы данного изобретения. Эта каталитическая система содержит два вида рибозимов 80 и 81, которые активны при их полной сборке, но неактивны, когда они отделены от их частей 80a, 80b и 81a, 81b соответственно. Полный рибозим 80 способен легировать части рибозима 81a и 81b с образованием полного и активного рибозима 81. Полный рибозим 81 способен легировать части рибозима 80a и 80b с образованием полного и активного рибозима 80, так что происходит перекрестная активация посредством перекрестного легирования.
Инициирующий рибозим 86 или 86' способен создавать полный и активный рибозим 80 либо отщеплением полного, но иммобилизованного рибозима от его местоположения, где он пространственно отделен от частей рибозима 81a и 81b, например, одним из способов, описанных в фиг. 3 (фиг. 8, вверху слева), либо благодаря способности легировать части 80a и 80b с образованием полного и активного рибозима 80 (фиг. 8, вверху справа).
Система детектирования.
При применении способа изобретения для облегчения детектирования биомолекул, иных чем рибозимы, изобретение включает в себя также систему детектирования, способную продуцировать каталитически активный инициирующий рибозим только в присутствии анализируемой молекулы.
Фиг. 4 показывает один пример варианта активации данного изобретения. В этом примере анализируемой биомолекулой является иммобилизованная последовательность нуклеиновой кислоты A (41), например, последовательность ДНК. Иммобилизацию можно выполнять в соответствии с любым известным в данной области способом, например, при помощи сшивающего агента или улавливанием анализируемой молекулы нуклеиновой кислоты между двумя пористыми мембранами, пропускающими молекулы меньшего размера. Если анализируемой молекулой является белок, он может быть иммобилизован на гранулах, несущих подходящие улавливающие агенты, такие как подходящие иммобилизованные антитела, направленные против районов, которые не требуются для детектирования, и т.д. Альтернативно, анализируемая биомолекула может быть иммобилизована на слое нитроцеллюлозы и другой белок, такой как альбумин, должен быть затем нанесен на нитроцеллюлозу для насыщения всех вакантных мест слоя нитроцеллюлозы во избежание, в следующей стадии, неспецифической адсорбции.
Эта система детектирования содержит также первую комплексную молекулу 42, содержащую рибозим 43, соединенный с отщепляемой последовательностью с' (44), способной отщепляться активным рибозимом, и, кроме того, содержит последовательность а' (45), комплементарную анализируемой последовательности A (41). Рибозим 43 не расщепляет самостоятельно, так как молекула 42 находится в реакционной среде без магния, что исключает каталитическую активность рибозимов. Это может быть достигнуто, например, хранением комплексной молекулы 42 в реакционной среде с ЭДТК без магния.
Пример рибозима 43, соединенного с отщепляемой последовательностью с' (44), типа головки молотка (заглавные буквы: 2'-O- метилированные; маленькие буквы: РНК; подчеркнутые: ДНК)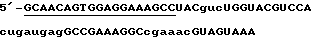
Молекулам 41 и 42 дают гибридизоваться с образованием иммобилизованного гибрида 46. Свободные молекулы 42 удаляют промыванием и к иммобилизованному гибриду 46 добавляют ионы магния в концентрации, достаточной для активации рибозимов. В присутствии такой концентрации иона магния рибозим 43 способен отщеплять последовательность с', высвобождаясь в реакционную смесь, оставляя расщепленный гибрид 47 иммобилизованным. Свободный и каталитически активный рибозим 43 может служить в качестве инициирующего рибозима в каталитической системе.
Фиг. 5 показывает другой пример варианта активации данного изобретения. Анализируемую биомолекулу 51, которая содержит последовательность нуклеиновой кислоты A, например, последовательность ДНК, иммобилизуют, как описано выше. Система детектирования содержит вторую комплексную молекулу 52, содержащую рибозим 53, соединенный с последовательностью с' (54), которая может отщепляться каталитически активным рибозимом, и последовательность а'(55), комплементарную последовательности A анализируемой биомолекулы. Эта комплексная молекула содержит также ингибиторную часть молекулы 58, которая, если она присутствует в ее немодифицированной форме, ингибирует каталитическую активность рибозима 53. Примером ингибиторной молекулы является последовательность нуклеиновой кислоты, комплементарная части рибозима. В присутствии такой последовательности рибозим складывается в неактивную трехмерную форму.
Молекулам 51 и 52 дают гибридизоваться с образованием иммобилизованного гибрида 56 и свободные молекулы 52 удаляют промыванием. К отделенному гибриду 56 добавляют модифицирующие вещества, которые способны взаимодействовать с ингибиторной частью молекулы 58 и модифицировать ее в неингибирующую форму. Например, если ингибиторная часть молекулы представляет собой последовательность нуклеиновой кислоты, вызывающая складывание рибозима, модифицирующим веществом может быть последовательность, комплементарная ингибиторной части молекулы, которая гибридизуется с ингибиторной частью и блокирует ее, позволяя рибозиму переукладываться в его активную форму. Альтернативно, модифицирующими веществами могут быть вещества, способные удалять или отщеплять ингибиторную часть молекулы, прекращая ее ингибиторное действие. Затем добавляют активный рибозим, способный отщеплять последовательность с' с высвобождением его из иммобилизованного расщепленного гибрида 57. Каталитически активный свободный рибозим 53 служит затем в качестве инициирующего рибозима в каталитической системе.
Далее рассматривается фиг. 9, которая показывает другой пример варианта активации данного изобретения. Молекула 91 содержит последовательность инициирующего рибозима 90, соединенную с последовательностью с, отщепляемую рибозимом, и с последовательностями а и b, которые способны гибридизоваться с анализируемой биомолекулой, представляющей собой, например, молекулу 94 анализируемой последовательности ДНК. Кроме того, молекула 91 содержит блокирующую последовательность ДНК 92, которая содержит последовательности B и C, способные гибридизоваться с последовательностями b и с молекулы 91 соответственно с образованием двухцепочечной структуры. Блокирующая последовательность ДНК 92 присоединена через линкерную последовательность 93. Рибозим 90 не способен отщеплять последовательность с, так как район его последовательности является двухцепочечным (благодаря гибридизации с блокирующей последовательностью 92).
Затем в реакционную смесь вводят анализируемую молекулу 94. Если анализируемая биомолекула комплементарна а и b молекулы 91, то блокирующая последовательность 92 вытесняется анализируемой молекулой 94 с образованием гибридной молекулой 95. В гибридной молекуле 95 отщепляемая последовательность с является одноцепочечной, что позволяет рибозиму отщеплять ее и таким образом высвобождаться в реакционную среду в виде каталитически активного рибозима 96, который служит в качестве инициирующего рибозима в каталитической системе.
Согласно этому варианту, условия, такие как температура, длина части узнавания биомолекулы b, которая является двухцепочечной, и т.д., должны быть выбраны тщательно, так чтобы анализируемая молекула была способна вытеснять блокирующую молекулу 92 только в том случае, если последовательности A и B анализируемой биомолекулы точно подобраны для последовательностей узнавания а и b.
Далее описана фиг. 6, которая показывает вариант транскрипции системы детектирования данного изобретения, пригодный в том случае, когда биомолекула является последовательностью нуклеиновой кислоты. Согласно этому характерному варианту, точная ДНК-матрица, которая в конце концов приводит к транскрипции инициирующего рибозима, собирается из ее частей только в присутствии анализируемой последовательности нуклеиновой кислоты. Эта система детектирования содержит первую олигонуклеотидную молекулу 61, являющуюся в основном ДНК, содержащую в направлении от 3'к 5': двухцепочечный промотор, последовательность R, кодирующую комплементарную последовательность инициирующего рибозима, последовательность C, кодирующую последовательность, отщепляемую каталитически активным рибозимом, и последовательность D1, комплементарную 5'-части анализируемой последовательности нуклеиновой кислоты. Система детектирования содержит, кроме того, вторую олигонуклеотидную молекулу 62, являющуюся в основном ДНК, содержащую в направлении от 3' к 5': последовательность D2, комплементарную 3'-части анализируемой последовательности нуклеиновой кислоты, и триггерную олигонуклеотидную матрицу (TRIG). В случае присутствия анализируемой последовательности нуклеиновой кислоты 63 и при подходящих для гибридизации условиях, последовательность D1 молекулы 61 и последовательность D2 молекулы 62 гибридизуются с последовательностями D1' и D2' соответственно анализируемой последовательности нуклеиновой кислоты с образованием гибрида 64.
В присутствии системы транскрипции продуцируется нематричная цепь олигонуклеотида 65, содержащая в направлении от 3'к 5': триггерную олигонуклеотидную последовательность trig, последовательности d2' и d1', последовательности с', г', комплементарные отщепляемым последовательностям нуклеиновой кислоты и инициирующему рибозиму соответственно.
К реакционной смеси добавляют молекулы обратной промоторной конструкции 66, содержащие одноцепочечный ДНК-промотор, соединенный с последовательностью, способной гибридизоваться с олигонуклеотидной триггерной последовательностью TRIG. При подходящих условиях обратная промоторная конструкция 66 гибридизуется с молекулой 65 с образованием гибрида 66. В присутствии ДНК-полимеразы одноцепочечный промотор дополняется с образованием функционального двухцепочечного промотора в гибриде 68.
Гибрид 68 может служить, в присутствии реагентов транскрипции, в качестве матрицы для образования конечного олигонуклеотидного транскрипта 69, содержащего, начиная от его 5'-конца: последовательность инициирующего рибозима r и отщепляемую последовательность с, способную отщепляться этим рибозимом.
Рибозим r отщепляет отщепляемую последовательность c с высвобождением его в окружающую среду в виде свободного рибозима 70. Свободный рибозим 70 может служить в качестве каталитически активного инициирующего рибозима в каталитической системе.
Один из способов варианта сборки показан на фиг. 7(а). Система детектирования содержит анализируемую биомолекулу 71, содержащую последовательность нуклеиновой кислоты A1 A2. Кроме того, система детектирования содержит часть рибозима 72, включающую олигонуклеотидную последовательность а1', комплементарную последовательности A1 и другую часть рибозима 73, содержащую олигонуклеотидную последовательность a2' комплементарную последовательности A2. Эти части рибозима 72 и 73 вместе составляют полный рибозим при сборке этих двух частей.
В случае присутствия анализируемой молекулы 71 в среде она может гибридизоваться с a1 части рибозима 72 и с az части рибозима 73, сводя эти две части вместе с образованием гибрида 76 функционального рибозима и анализируемой последовательности, который может служить в качестве инициирующего рибозима в каталитической системе, например, в результате отщепления молекулы 77, которое может быть необходимым для инициации каскада амплификации в каталитической системе.
Другой способ варианта сборки данного изобретения показан на фиг. 7(b).
Был сконструирован рибозим 79 типа головки молотка, в котором стебель-11 был укорочен так, чтобы он имел только один комплементарный нуклеотид (представленный одной линией на фиг. 2b) и остальную часть стебля раскрывали с образованием плеч а и b. Рибозим 79 способен гибридизоваться с последовательностью 70 с образованием стеблей I и III и затем проявлять каталитическую активность, например, отщепления последовательности 70. Однако априорно рибозим 79 неспособен отщеплять отщепляемую последовательность 70, так как его стебель-II является раскрытым и неактивным. Плечи а и b открытой центральной части были сконструированы таким образом, чтобы они были комплементарны последовательностям A и B анализируемой последовательности, например, ДНК-последовательности 80.
В присутствии анализируемой ДНК-последовательности 80 плечи а и b стебля-II рибозима 79 гибридизуются с анализируемой последовательностью с образованием полностью двухцепочечного стебля-II и таким образом рибозим становится каталитически активным и может служить в качестве инициирующего рибозима в каталитической системе, где, например, отщепляемая последовательность 70 является частью фермента в каталитической системе, требующей отщепления для его активации.
Пример 1. Обнаружение анализируемой последовательности нуклеиновой кислоты при помощи рибозима с открытым стеблем-II.
Рибозим HH8 рассекали на две части при петле стебля-II. Каждая из двух половин рибозима HH8 (HH8-3 и HH8-5) имеет отличающуюся от другой хвостовую последовательность из дополнительных 17 оснований, комплементарную LAMTAR0 целевой молекулы ДНК. В присутствии этой мишени две половины сводятся вместе и образуют активный рибозим. В мишени LAMTAR0 эти две последовательности, комплементарные половинкам рибозима, являются непрерывными. В других молекулах LAMTAR (LAMTAR1 - LAMTAR4) эти две последовательности разделены 1-4 некомплементарными основаниями соответственно. Субстратом рибозима является SB8-24, который содержит последовательность, узнаваемую HH8.
(a) Способ:
1. Последовательности:
Олигодезоксирибонуклеотиды были синтезированы на ДНК-синтезаторе Applied Biosystem 381A согласно протоколу, рекомендуемому изготовителем. Для всех синтезов РНК использовали набор (Ampliscribe (Epicenter Technologies). [α32-P] UTP [3000 Ки/ммоль] приобретали в Rotem Industry Ltd., Israel.
ДНК-мишени:
LAMTAR0: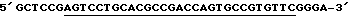
LAMTAR1: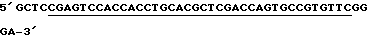
LAMTAR2: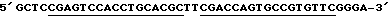
LAMTAR3: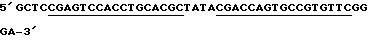
LAMTAR4: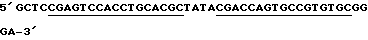
Подчеркнутые - комплементарны половине рибозима;
Жирные - некомплементарная дополнительная последовательность.
РНК-транскрипты:
SB-24 (субстрат для HH8):
5'GGUCACAAUGUCGGUCGAGUUCCA-3'
HH8-3 (половина рибозима):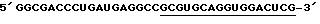
HH8-5 (половина рибозима):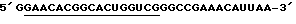
Подчеркнутые - комплементарны мишени.
2. Получение РНК.
ДНК-олигонуклеотиды синтезировали согласно (1) выше. Олигонуклеотиды очищали электрофорезом на 15% полиакриламидном геле с 7 М мочевиной, просматривали в УФ и элюировали в течение ночи при комнатной температуре в 0,5 М Трис-Cl (pH 7,0), 0,1% ДСН и 0,1 мМ ЭДТК. Элюированную ДНК осаждали 0,1 объемами 3 М ацетата натрия и 3 объемами этанола, ресуспендировали в 1 мМ Трис-Cl (pH 7,0) и 0,1 мМ ЭДТК и хранили при -20oC до использования. Очищенные олигонуклеотиды отжигали с комплементарным нематричным промоторным олигонуклеотидом РНК-полимеразы T7 (TAA TAG GAC TCA CTA TAG G) при 20 мМ каждого инкубированием при 95oC в течение 15 с и при 70oC, 60oC, 55oC, 50oC, 45oC, 40oC и 37oC в течение 5 мин (при каждой температуре). Реакционная смесь транскрипции (50 мл) содержала 2 мг отожженной ДНК, 1х реакционный буфер, 10 мМ дитиотреитол, 2 мМ ATP, CTP и GTP, 1 мМ UTP, 25 мКи [α32P] UTP и 1, мМ MgCl2. Смесь инкубировали в течение 1 ч при 37oC и затем в течение 5 мин при 80oC для дезактивации фермента. РНК осаждали, как описано ранее. Транскрипты очищали электрофорезом на 15% полиакриламидном геле с 7 М мочевиной. Местоположение РНК определяли авторадиографически и РНК элюировали, как описано выше. Элюированную РНК осаждали, как описано выше, ресуспендировали в 0,1х ТЭ и считали в сцинтилляционном счетчике (Luma LSC).
3. Реакция расщепления.
Реакции (10 мл) обычно проводили в присутствии 0,5 пмоль рибозима, 50 мМ Трис-Cl (pH 7,5), 1 мМ ЭДТК (pH 7,5), 0,05% ДСН и 30 мМ MgCl2. Реакции предынкубировали при 95oC в течение 1 мин для исключения альтернативных конформаций РНК, которые могли образоваться во время хранения при -20oC. Реакции инкубировали при 37oC в течение 1 ч и останавливали добавлением раствора красителя, содержащего 10 М мочевину и 10 мМ ЭДТК, и помещали на лед. Пробы денатурировали при 80oC в течение 5 мин и подвергали разделению на 15% полиакриламидном геле с 7 М мочевиной.
(b) Результаты:
Результаты анализа в полиакриламидном геле показаны на фиг. 10. Рибозим без мишени не давал приемлемого расщепления. При добавлении мишени получали усиленное расщепление. Усиление было наивысшим в тестах с рибозимами LAMTAR4.
Пример 2. Каталитическая система, содержащая композиционную молекулу в форме замкнутого кольца.
SLS-предшественник рибозима (Rz) является кольцевым Rz со стеблем-II длиной 11 п. н. Два плеча узнавания соединены в тандеме с разделяющим их дополнительным основанием расщепления. Таким образом, этот рибозим не имеет активности, но служит в качестве матрицы для активных рибозимов. При его расщеплении "раскрытый" рибозим становится активным (как показано схематически на фиг. 2(b)). Для инициации каталитической системы должен присутствовать инициирующий рибозим. Спонтанное расщепление РНК происходит при скорости 1 событие на 106 молекул в минуту в 30 мМ MgCl2 при 37oC. Кольцевой рибозим, самопроизвольно расщепленный в сайте расщепления, становится активным и способен служить в качестве триггера.
(a) Способ:
1. Последовательности:
Олигодезоксирибонуклеотиды синтезировали на синтезаторе ДНК Applied Biosystem 381A в соответствии с протоколом, рекомендованным изготовителем. Для всего синтеза РНК применяли набор Ampliscribe (Epicenter Technologies). [α32P] UTP [3000 Ки/ммоль] приобретали в Rotem Industries Ltd., Israel.
Последовательности предшественника РНК (SLS) были: 5' GGU CAG CAG UCG AA [плечо узнавания I] X [плечо узнавания III] CUG AUG AGA CUG CUG ACC A 3'(см. таблицу).
2. Получение РНК.
Получение РНК выполняли, как описано в примере 1.
3. Реакция самопроизвольного расщепления.
Реакции (10 мкл) обычно проводили в присутствии 5 пмоль предшественника рибозима (SLS-транскриптов), 50 мМ Трис-Cl (pH 7,5), 1 мМ ЭДТА (pH 7,5), 0,05% ДСН и 300 мМ MgCl2. Реакции предынкубировали при 95oC в течение 1 мин для исключения альтернативных конформаций РНК, которые могли быть образованы во время хранения при -20oC. Реакции инкубировали при 37oC в течение 1 ч или в течение ночи и останавливали добавлением раствора красителя, содержащего 10 М мочевину и 10 мМ ЭДТК, и помещали на лед. Пробы денатурировали при 80oC в течение 5 мин и подвергали электрофорезу в 15% полиакриламидном геле с 7 М мочевиной.
(b) Результаты:
Результаты этого полиакриламидного геля показаны на фиг. 11. Панель 8 различных кольцевых рибозимов испытывали на каскадную активность. Каскад инициировали самопроизвольным расщеплением, как описано выше. Как показано на фиг. 1, один из рибозимов (N 313) показал действующий каталитический каскад, приводящий к амплификации по принципу положительной обратной связи.
Пример 3. Ингибирование рибозима кровью и различными материалами, используемыми для получения ДНК.
Все способы амплификации требуют стадии подготовки проб для выделения нуклеиновых кислот и исключения ингибирования реакций компонентами крови. Некоторые вещества, такие как ДСН, фенол и гуанидиний, используются в этих способах получения. Реакция амплификации должна проводиться без необходимости стадии подготовки проб. Испытывали активность рибозимов в присутствии крови с высвобождающими нуклеиновые кислоты агентами и без них. Испытывали как только РНК-рибозимы, так и модифицированные рибозимы.
(a) Способ:
1. Олигонуклеотиды:
Олигодезоксирибонуклеотиды приобретали в отделе молекулярной биологии Haddassa Hospital, Mount Scopus, Jerusalem. Модифицированный рибозим был синтезирован RPI, Boulder, Co. Для всего синтеза РНК использовали набор для транскрипции Ampliscribe T7 (Epicenter Technologies). [γ-32P] ATP [6000 Ки/ммоль] и [α32P] UTP [3000 Ки/ммоль] покупали в Rotem Industries Ltd., Israel. Полинуклеотидкиназу T7 покупали в NEB, Beverly, Ma.
2. Рибозимы:
DS-LS-RzA3-6: 5'
Маленькие буквы - рибонуклеотиды;
заглавные буквы - 2'-O-метилированные модификации;
подчеркнутые буквы - дезоксирибонуклеотиды.
HH8 (РНК-транскрипт):
5' GGCGACCCUGAUGAGGCCGAAAGGCCGAAACAUUAA 3'.
3. Мечение модифицированного рибозима:
50 пмоль рибозима, 10 единиц полинуклеотидкиназы T7 и 20 мкКи [γ32P] ATP инкубировали в 1х реакционном буфере в общем объеме 10 мкл при 25oC в течение 1 часа. Реакцию останавливали инкубированном при 60oC в течение 10 мин.
4. Получение РНК:
Матричный ДНК-олигонуклеотид HH8 очищали электрофорезом на 15% полиакриламидном геле с 7 М мочевиной, просматривали в УФ и элюировали в течение ночи при комнатной температуре в 0,5 М Трис-Cl (pH 7,5), 0,1% ДСН и 0,1 мМ ЭДТК. Элюированную ДНК осаждали 0,1 объемом 3 М ацетата натрия и 3 объемами этанола, ресуспендировали в 0,1х ТЭ (1 мМ Трис-Cl pH 7,0 и 0,1 мМ ЭДТК) и хранили при -20oC до использования. Очищенный олигонуклеотид отжигали с комплементарным нематричным промоторным олигонуклеотидом РНК-полимеразы T7 (TAATACGACTCACTATAGO) при 20 мкМ каждого инкубированием при 95oC в течение 15 с и при 70oC, 60oC, 55oC, 50oC, 45oC, 40oC и 37oC в течение 5 мин (при каждой температуре). Реакционная смесь для транскрипции (50 мкл) содержала 2 мкМ отожженную ДНК, 1х буфер для реакции, 10 мМ дитиотреитол, 2 мМ ATP, CTP и GTP, 1 мМ UTP, 25 мКи [α32P] UTP и 1,1 мМ MgCl2. Смесь инкубировали в течение 1 ч при 37oC и затем в течение 5 мин при 80oC для дезактивации фермента. РНК осаждали, как описано выше. Транскрипты очищали электрофорезом на 15% полиакриламидном геле с 7 М мочевиной. Положение РНК определяли авторадиографией и РНК элюировали, как описано выше. Элюированную Рнк осаждали, как описано выше, ресуспендировали в 0,1х ТЭ и считали в сцинтилляционном счетчике (Luma LSC).
5. Реакция расщепления:
Реакции (10 мкл) обычно проводили в присутствии 0,5 пмоль модифицированного рибозима или HH8, 50 мМ Трис-Cl (pH 7,5), 1 мМ ЭДТК (pH 7,5), 0,05% ДСН и 30 мМ MgCl2. Добавляли 1 мкл цельной крови или 0,2 мкл цельной крови и дополнительный компонент (см. фиг. 1). Реакции инкубировали при 37oC в течение 1 ч и останавливали добавлением раствора красителя, содержащего 10 М мочевину и 10 мМ ЭДТК, и помещали на лед. Пробы денатурировали при 80oC в течение 5 мин и подвергали электрофорезу на 15% полиакриламидном геле с 7 М мочевиной.
(b) Результаты:
Эти результаты показаны на фиг. 12, где в каждой пробе присутствовали 0,5 пмоль рибозимов, и 1 мкл крови смешивали либо с 10% ДСН, либо с гуанидинизоцианатом, либо со смесью фенол/хлороформ (1:1), добавляли к реакционному тесту по 1 мкл обработанной пробы крови или только агента. Результаты активности рибозима не ингибировались ни 1% ДСН, ни 0,35 М гуанидином, ни 5% смесью фенол/хлороформ (ни в присутствии крови, ни без нее). Необработанная кровь разрушает РНК-часть рибозимов. Эти результаты показывают одно из преимуществ способа детектирования на основе рибозимов данного изобретения, заключающееся в том, что денатурирующие агенты, используемые в получении каталитической пробы, не ингибируют каталитическую активность рибозима.

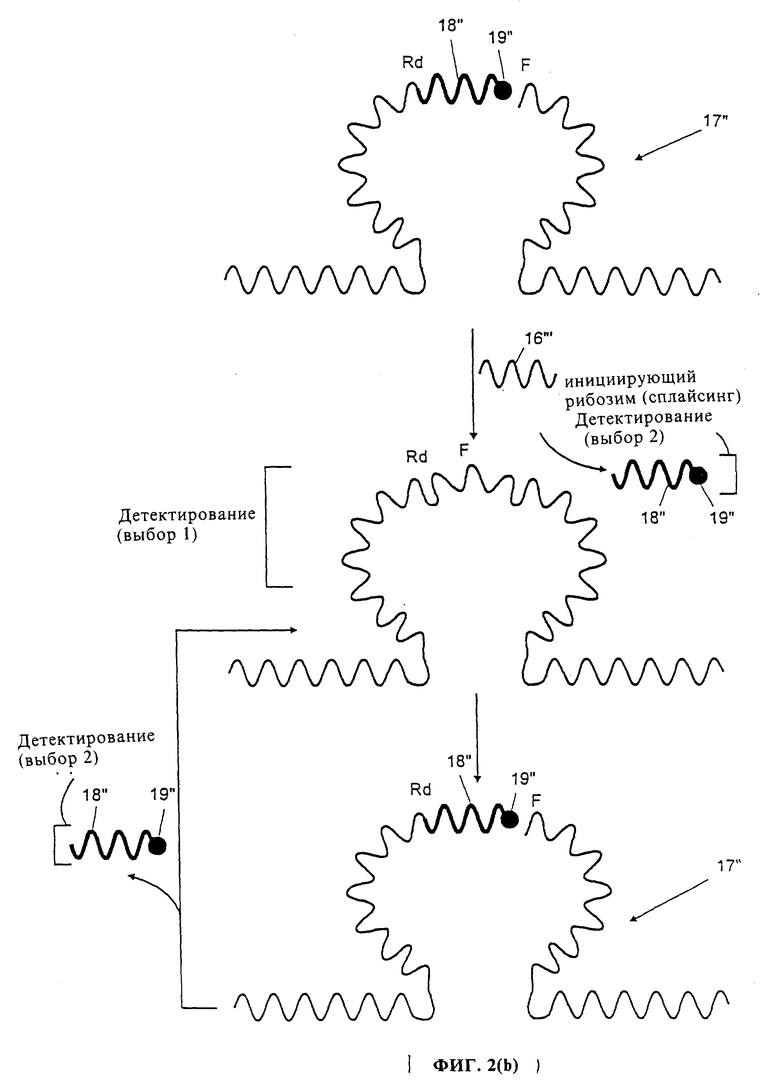
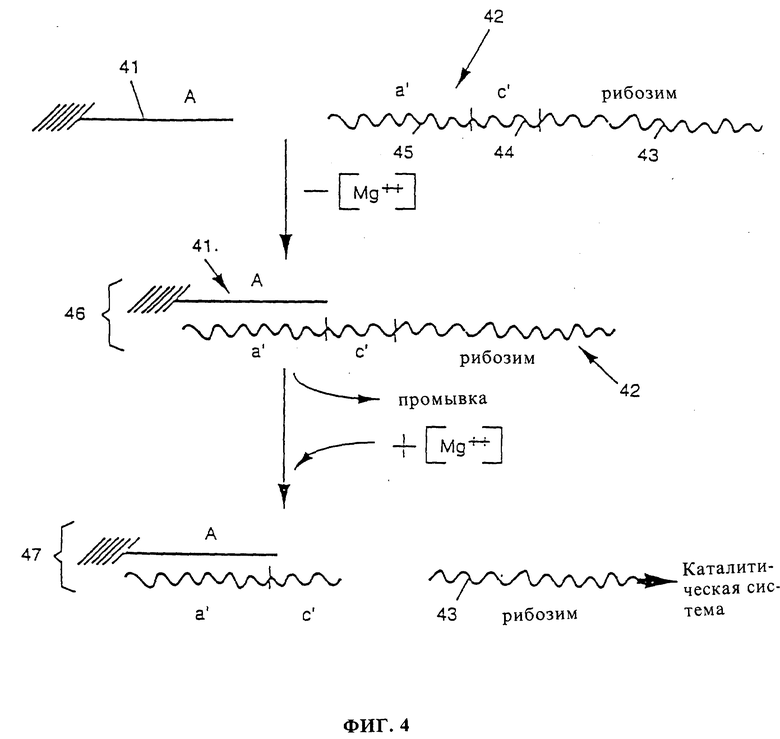
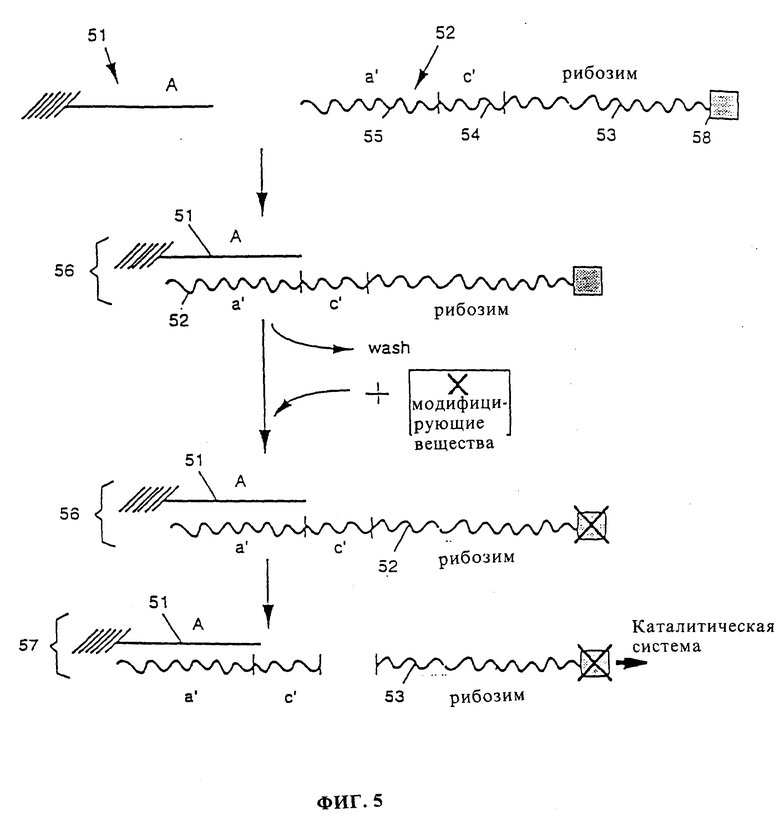
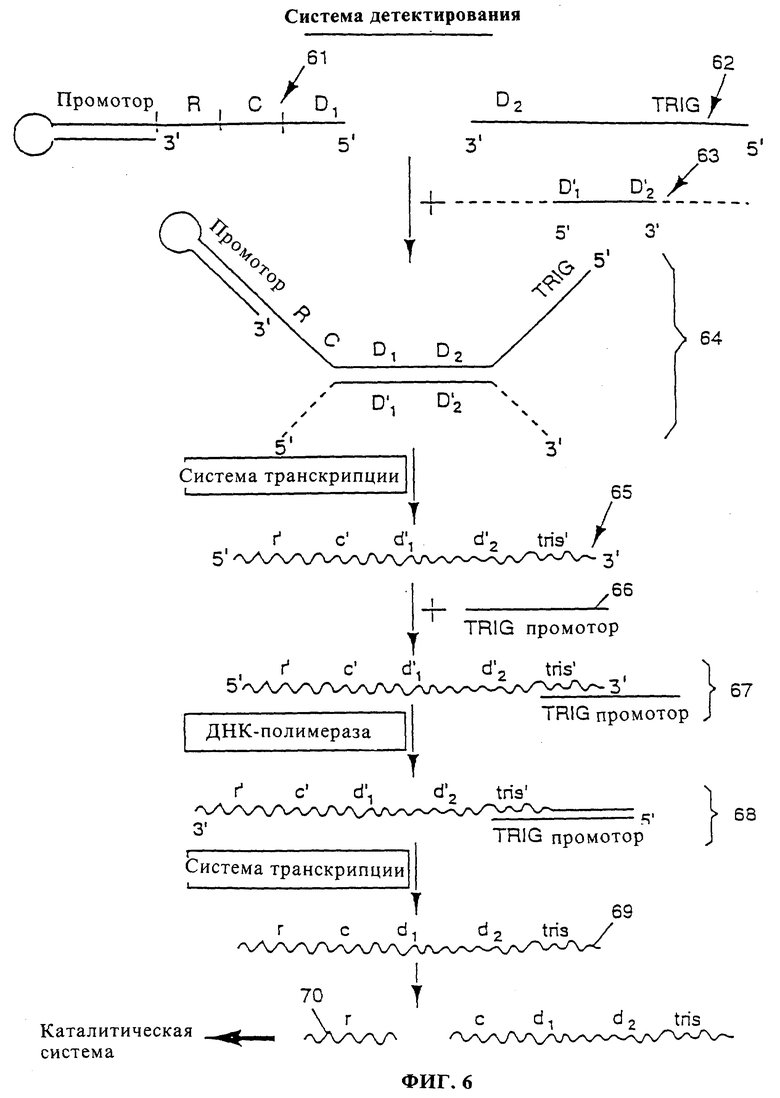
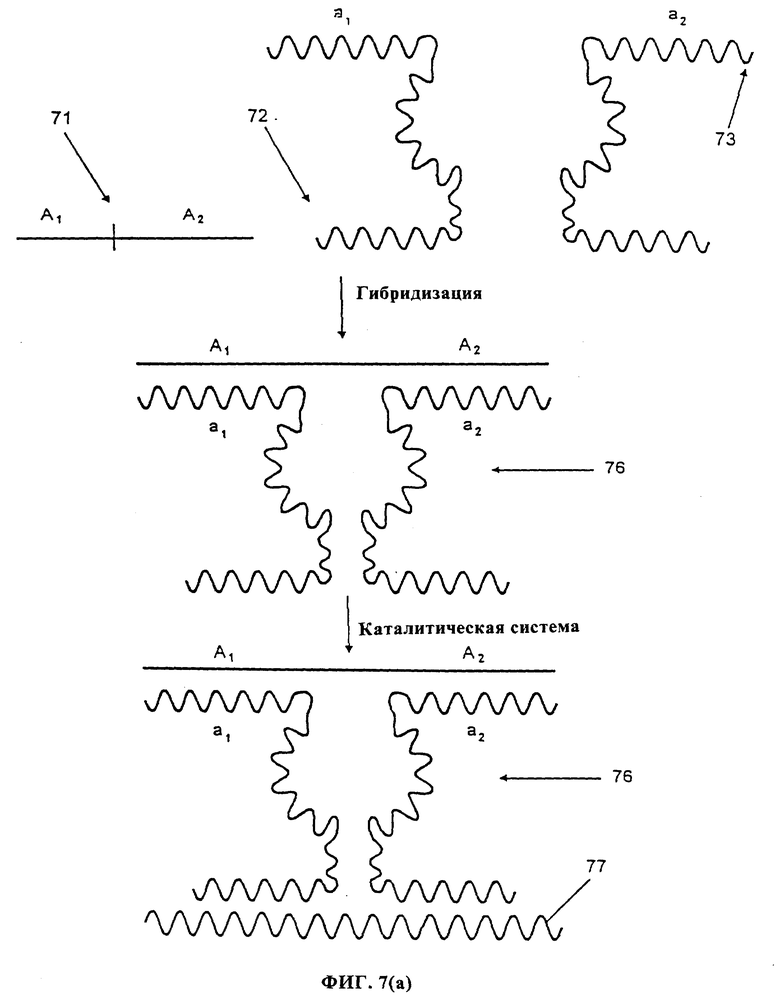
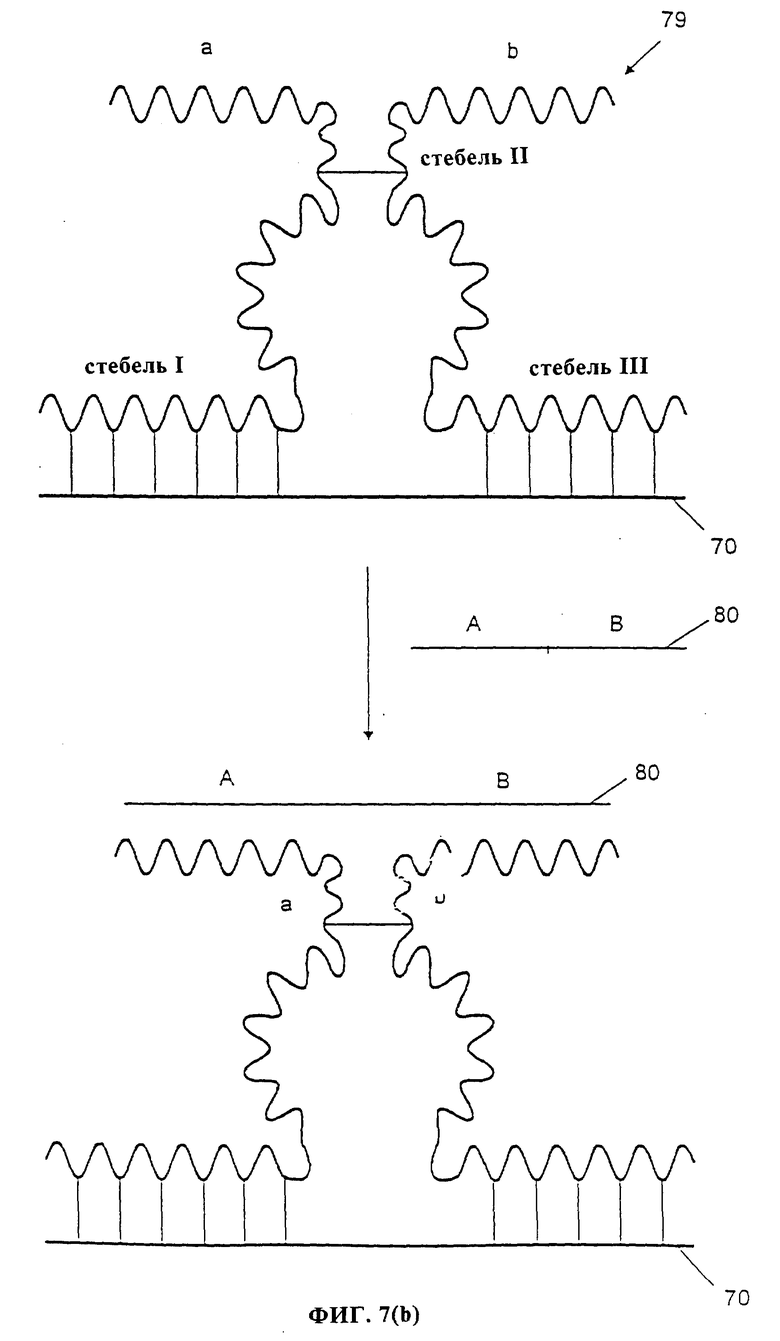
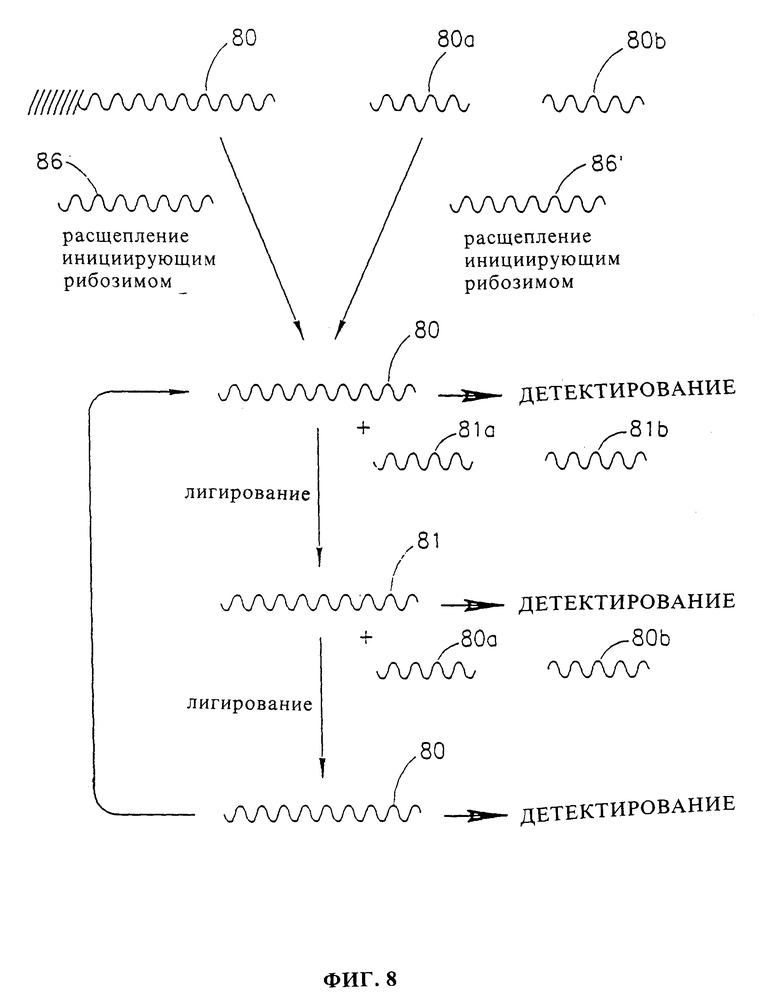
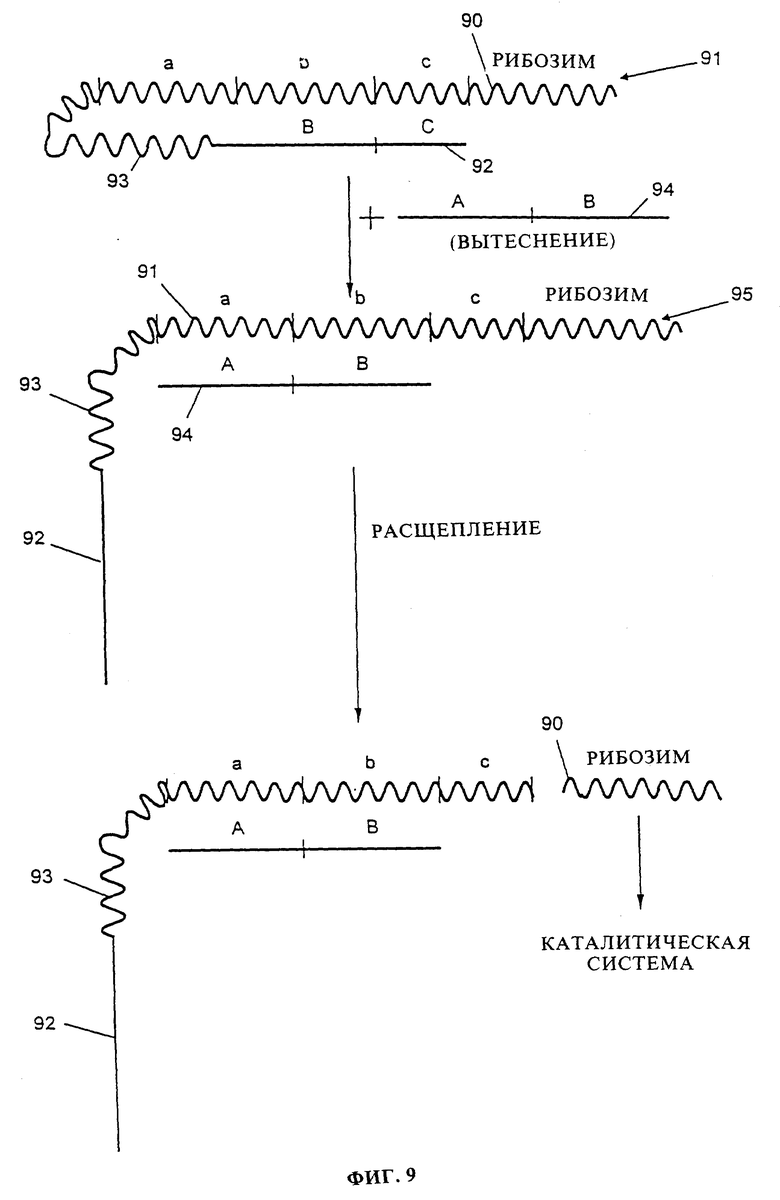
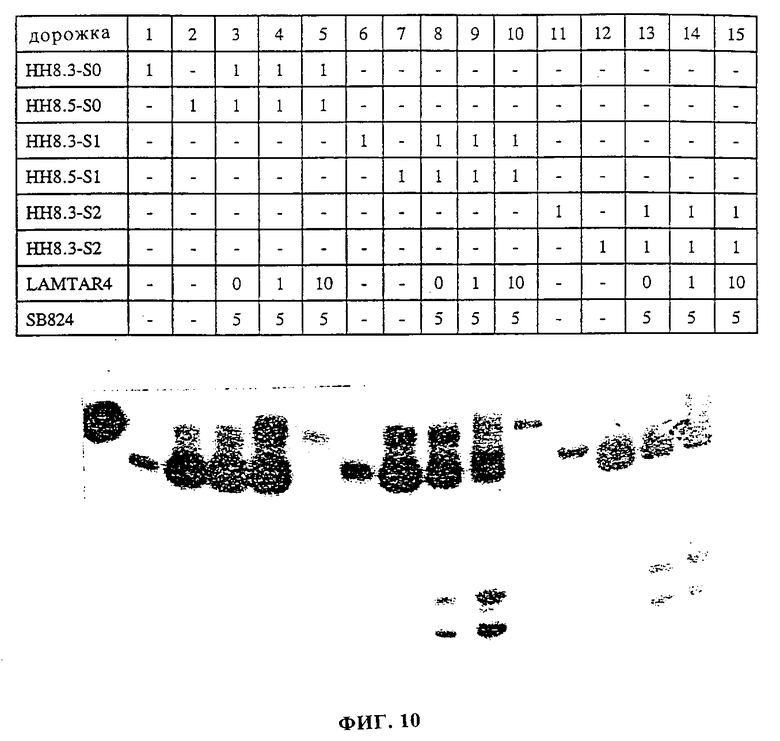
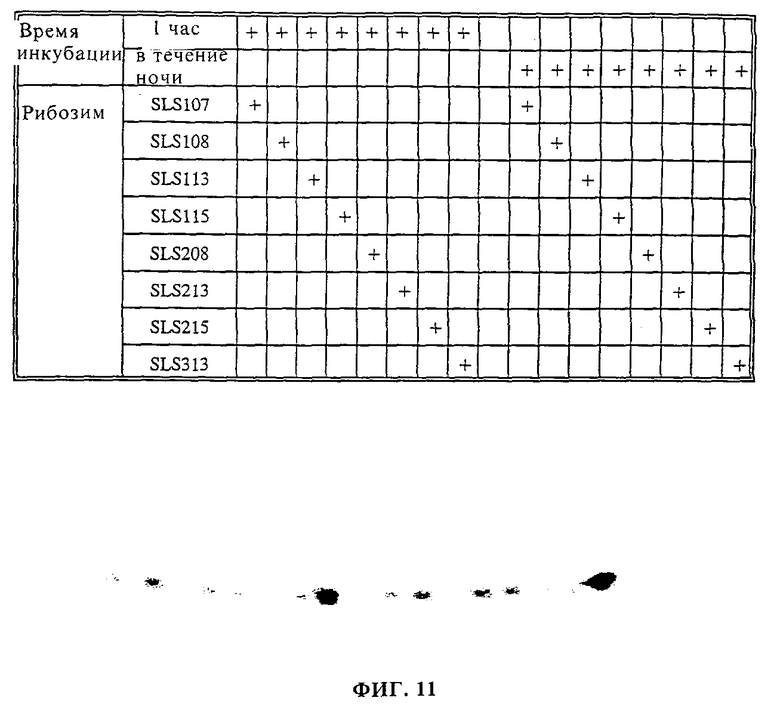
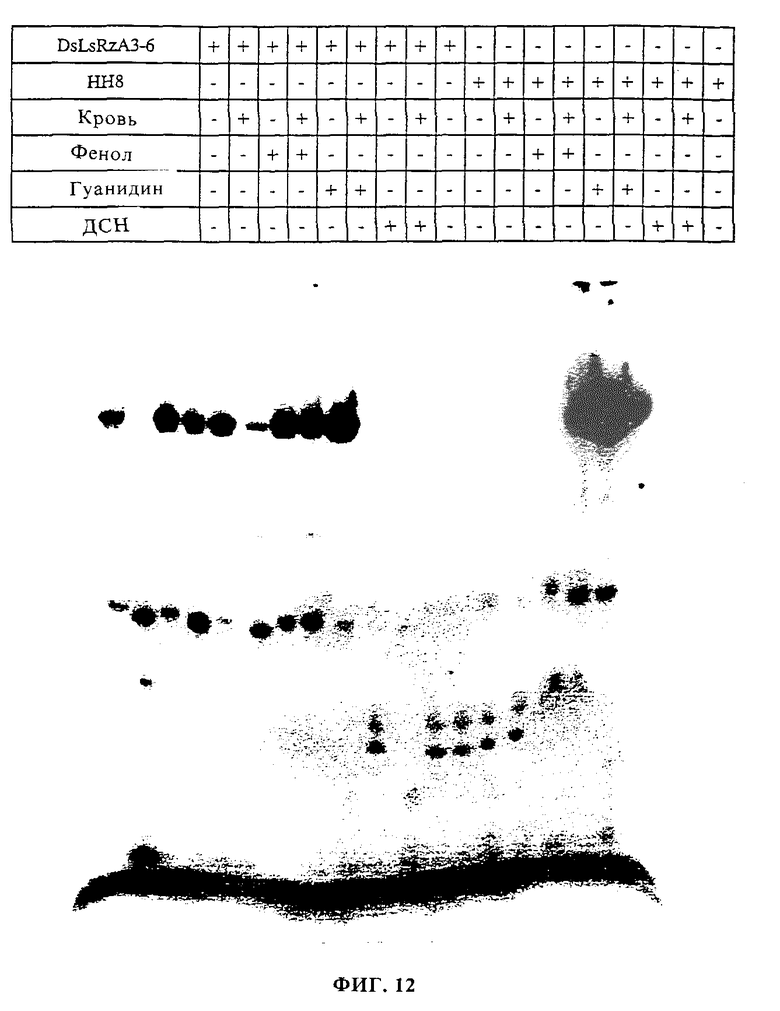
Данное изобретение относится к способу обнаружения присутствия каталитически активного рибозима в среде. Обнаружение каталитически активного рибозима может служить в качестве репортера для присутствия других биомолекул в анализируемой пробе. Детектирование можно проводить в каталитической системе, в которой присутствие активного рибозима вызывает образование другого активного рибозима амплифицирующим образом по принципу положительной обратной связи. Охарактеризовано устройство, применяемое для осуществления способов. Применение изобретения позволяет упростить получение амплификации сигнала и позволяет непосредственно определить точку лечения. 3 с. и 26 з.п. ф-лы, 1 табл., 12 ил.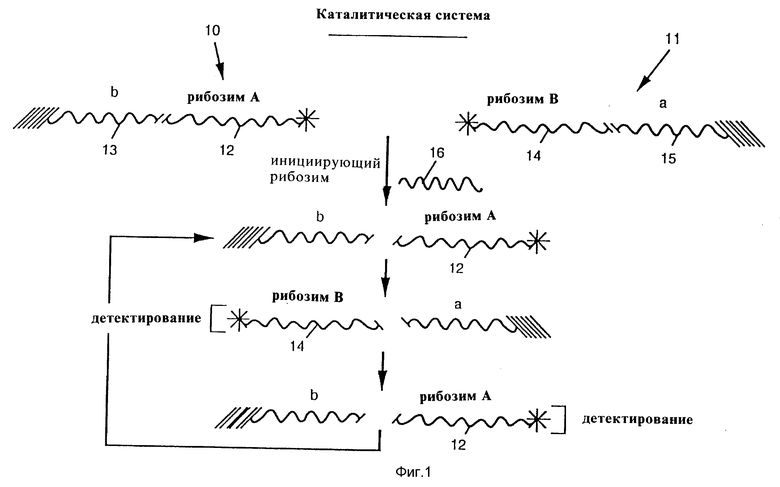
Приоритет по пунктам:
27.02.95 по пп.1 - 16, 18 - 22, 25 - 29;
26.10.95 по пп.17, 23 и 24.
| Экономайзер | 0 |
|
SU94A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Способ определения нуклеотидной последовательности ДНК и устройство для его осуществления | 1991 |
|
SU1794088A3 |
Авторы
Даты
1999-10-10—Публикация
1996-02-27—Подача