Изобретение относится к области биохимии и может быть использовано в медицине и пищевой промышленности.
В настоящее время очень повысился интерес к антиоксидантам, так как известно, что продукты свободнорадикальных реакций вызывают нарушение работы биологических мембран в первую очередь вследствие развития процессов перекисного окисления мембранных липидов. Это приводит к развитию в организме многих патологических состояний [1]. Применение антиоксидантов позволяет затормозить активацию свободнорадикальных реакций при действии неблагоприятных факторов внешней среды. Введение антиоксидантов в пищевые продукты защищает липидную фазу от перекисной деградации.
Известны естественные антиоксиданты, ингибирующие развитие свободнорадикальных состояний. Большинство из них, такие как α- токоферол, убихинон, каротиноиды, не растворимы в воде, что затрудняет их использование [2].
Наиболее известным водорастворимым антиоксидантом является аскорбиновая кислота (прототип) [2]. Это единственный естественный гидрофильный антиоксидант, широко используемый в медицине и пищевой промышленности.
Задачей настоящего изобретения является предложение нового водорастворимого антиоксиданта.
Поставленная задача решается применением в качестве антиоксиданта алкалоида амарантина, который получают из растений рода Amaranthus.
Амарантин растворим в воде, состоит из агликона бетанидина и углеводной части, имеет красно-фиолетовый цвет и может использоваться также как пищевой краситель [3] . Для доказательства антиоксидантного действия амарантина его испытывали в модельных системах, обычно используемых в этих целях.
Пример 1. Антиоксидантную активность определяли в модельной системе на основе H2O2-люминол - с использованием полиморфно-ядерных лейкоцитов (ПМЛ), выделенных из периферической крови доноров [4], взятую в объеме 8-10 мл, кровь, стабилизированную гепарином из расчета 20 Ед/мл, помещали в силиконизированные пробирки и оставляли для отстаивания на 40-60 мин. Плазму крови после отстаивания осторожно наслаивали на раствор фиколл-верографина с плотностью 1,077 г/см3 и центрифугировали при 400 g в течение 30 мин. Полученный супернатант сливали, а к осадку для лизиса примеси эритроцитов добавляли 10 мл 0,83% раствора NH4Cl, осадок ресуспендировали 5 мин, после чего суспензию центрифугировали при 400 g 10 мин. Полученные ПМЛ дважды отмывали в фосфатно-солевом растворе (2,7 мМ KCl, 136,7 мМ NaCl, 1,5 мМ KH2PO4, 8,1 мМ Na2HPO4, pH 7,45). Отмытые клетки ресуспензировали в растворе Ненкса и использовали при хранении на холоду в течение 5 час.
Для измерения люминолзависимой хемилюминесценции (ЛХЛ) ПМЛ в кювету люминомера вносили 105 гранулоцитов, 0,1 мл 1 мМ раствора люминола и доводили объем реакционной среды до 2 мл раствором Хенкса. После регистрации в течение 2-3 мин спонтанной ХЛ клетки стимулировали, вводя 0,05 мл оксонизированного зимозана (2 мг/мл) и регистрировали стимулированную ЛХЛ. Уровень функциональной активности ПМЛ определяли как разность между максимальным значением стимулированной и спонтанной ЛХЛ. Амарантин в определенной концентрации (2, 3, 4, 6, 8, 10 мкМ) вводили в суспензию ПМЛ, инкубировали 3-5 мин, после чего добавляли в кювету стимулятор фагоцитов и измеряли хемилюминесцентный ответ.
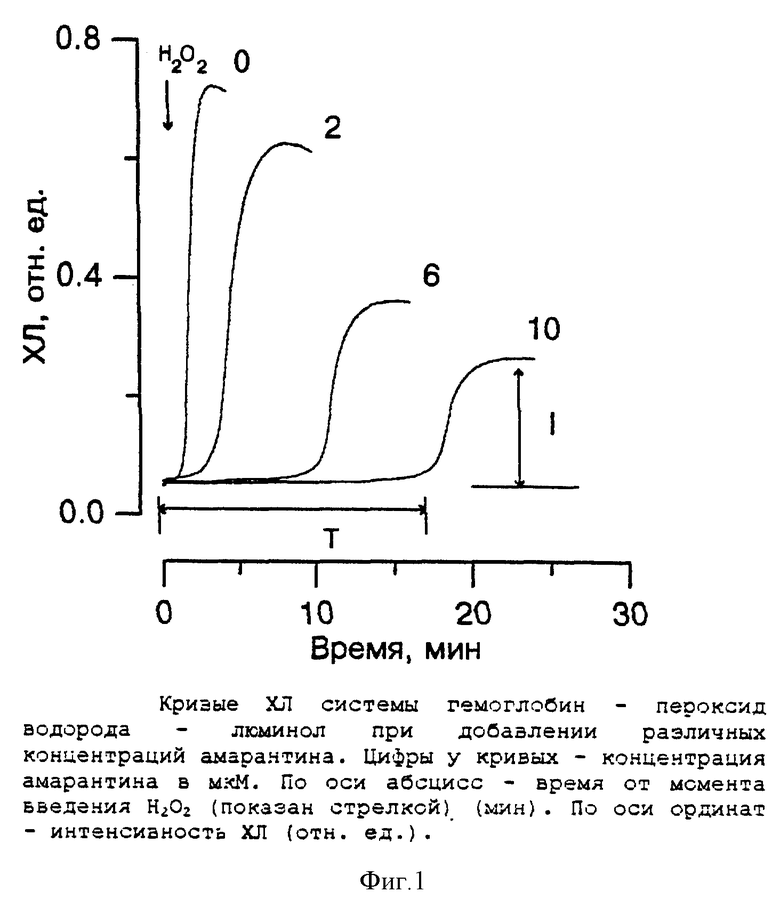
Было обнаружено, что добавление H2O2 в реакционную среду сопровождалось развитием ХЛ (фиг. 1, кривая 1). При этом свечение развивалось примерно через 1 мин, после введения H2O2 (латентный период), достигая максимальных значений на 5-7 минутах, и далее постепенно уменьшалось. Введение в модельную систему амарантина приводило к изменению параметров кинетики ее ХЛ: понижению интенсивности свечения и увеличению латентного периода (τ).
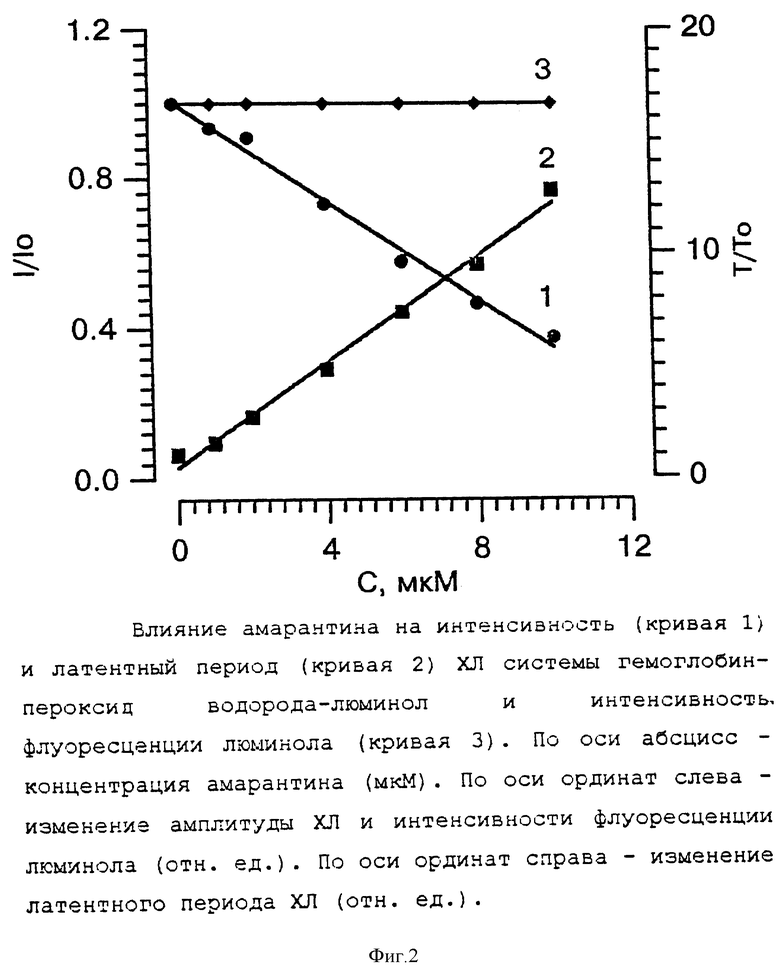
На фиг. 2 представлены результаты титрования амарантином модельной системы. Видно, что амарантин, подобно аскорбату, пропорционально концентрации увеличивал длительность лантентного периода хемилюминограммы и при концентрации 10 мкМ τ увеличивалась в ~15 раз. Одновременно, подобно СОД и другим белкам, амарантин тушил интенсивность ЛХЛ модельной системы. При этом обнаруживалась также пропорциональность тушения от концентрации препарата, но в меньшей степени по отношению к τ. Так при концентрации амарантина 10 мкМ амплитуда ЛХЛ уменьшалась всего на 60%. Тушение амарантином ЛХЛ может быть следствием двух причин:
1. Перехвата свободных радикалов, образующих в модельной системе;
2. Уменьшение квантового выхода излучательного перехода люминола, который используется в данной модельной системе в качестве активатора тушения.
В отдельном опыте определяли влияние амарантина на фотолюминисценцию (квантовый выход излучательного перехода) люминола (фиг. 2, кривая 3). Как видно из чертежа, амарантин не влияет на интенсивность фотолюминесценции люминола. Следовательно, все тушение ЛХЛ модельной системы, которое оказывает амарантин во всем интервале использованных концентраций (0 - 10 мкМ), обусловлено его способностью к перехвату радикалов, образующихся в данной модельной системе.
Пример 2. В качестве модельной системы для излучения антиоксидантных свойств амарантина использовали модельную систему, включающую ионы двухвалентного железа и липосомы. Влияние амарантина на свободнорадикальные реакции (СРР) перекисного окисления липидов изучали, измеряли Fe2+, индуцированную ХЛ, суспензии многослойных липосом, сформированных из суммарной фракции фосфолипидов желтка куриных яиц [5], используя в качестве активатора свечения кумарин в конечной концентрации 0,1 М. В кювету люминомера помещали 5 мл суспензии липосом в концентрации 0,4 мг/мл по фосфолипиду в 20 мМ трис-HCl-буфере, pH 7,4. После регистрации свободного свечения в реакционную смесь через отдельный ввод добавляли раствор FeSO4 до конечной концентрации 20 мкМ и регистрировали кинетику ХЛ, характерную для всех структурированных липидов.
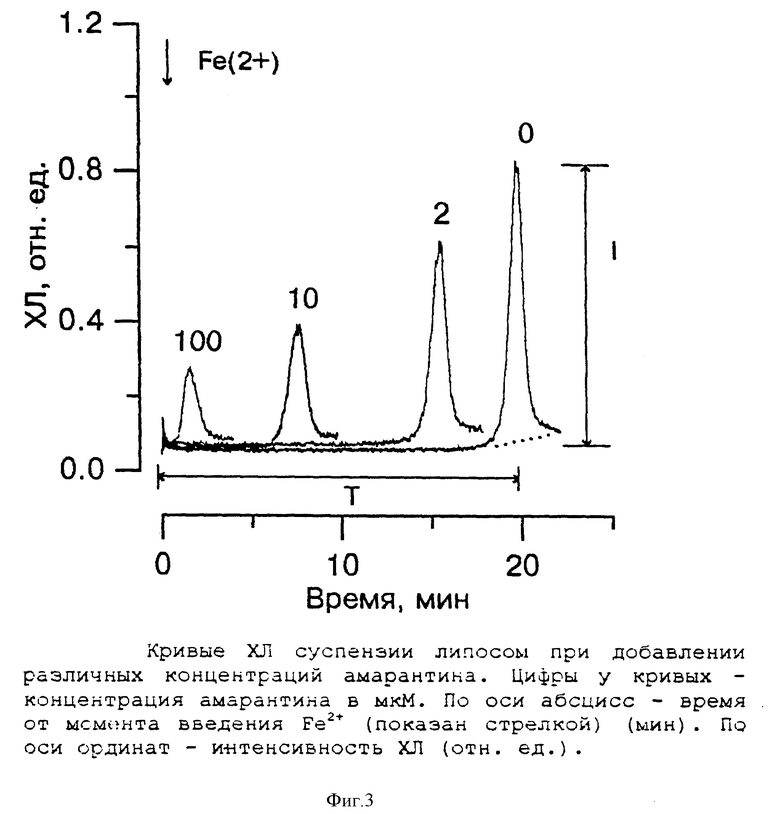
В такой модельной системе регистрируется ХЛ, характерная для всех структурированных фосфолипидов: мембран и липопротеинов, на который можно выделить два параметра (фиг.3, кривая 0): интенсивность медленного свечения (J) и длительность латентного периода (τ). Увеличение концентрации вводимого железа сопровождается возрастанием длительности латентного периода, обусловленным увеличением времени достижения т. н. "критической концентрации" ионов Fe2+ в системе [6]. Интенсивность медленного свечения при этом практически не изменялась. Следовательно, все вещества, способные влиять на концентрацию ионов двухвалентного железа: окислять или хелатировать - должны уменьшать длительность латентного периода, а вещества - перехватчики радикалов липидов - уменьшать интенсивность медленного свечения.
При введении амарантина (от 2 до 100 мкМ) было обнаружено укорочение длительности латентного периода и уменьшение интенсивности медленного свечения.
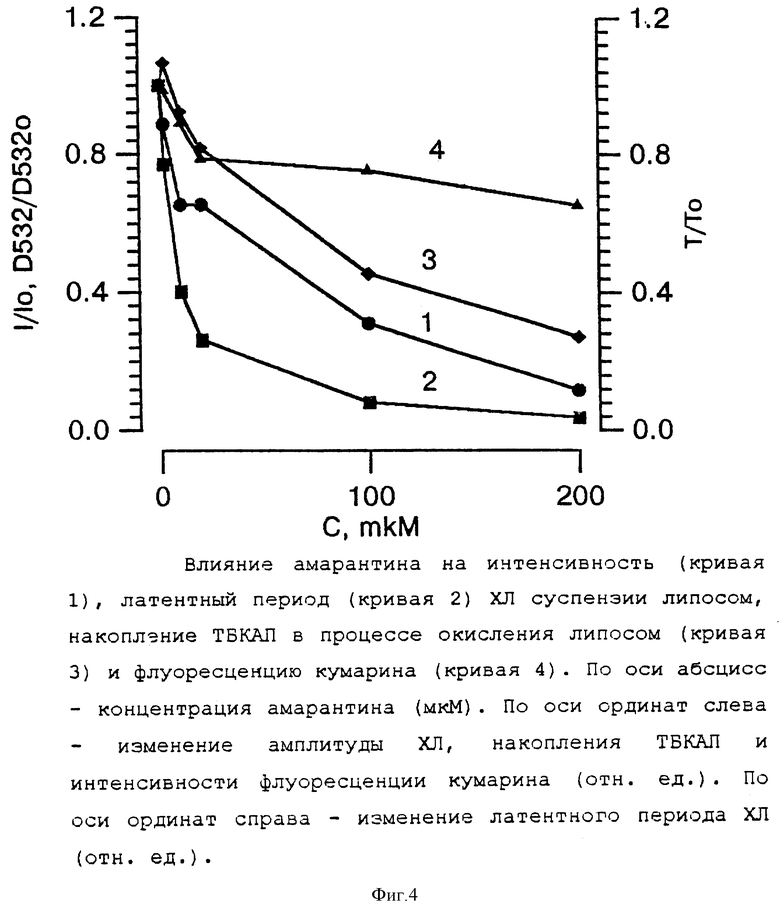
Результаты титрования приведены на фиг. 4. Наиболее яркий эффект амарантина проявился в изменении τ хемилюминограммы. Уже в концентрации 15 - 20 мкМ длительность латентного периода уменьшилась по отношению к контролю с 1,0 до 0,25, то есть в 4 раза. Уменьшение интенсивности хемилюминесценции, обнаруженное при титровании липосом амарантином, совпадало с динамикой накопления вторичных продуктов перекисного окисления липидов липосом, измеренных в аликвотах, взятых из кюветы хемилюминомера на момент времени достижения амплитуды медленного свечения. Это свидетельствует о том, что амарантин, кроме Fe2+ хелатирования, является перехватчиком пероксильных радикалов, образующихся в липидной фазе мембран липосом.
Таким образом можно заключить:
1. Амарантин является эффективным перехватчиком водорастворимых радикалов кислорода с активностью, равной активности аскорбата.
2. Амарантин является ингибитором свободнорадикальных реакций перекисного окисления липидов мембран липосом.
3. Амарантин является активным хелатором или восстановителем ионов двухвалентного железа.
Литература
1. Биленко Н.Б. Ишемические и реперфузионные повреждения органов.// М.: Медицина. 1989.
2. Капитанов А.Б., Пименов А.М. Каротиноиды как антиоксидантные модуляторы клеточного метаболизма.// Ж. Успехи современной биологии. 1996. -Т. 116. -Вып. 2. -С. 179-173.
3. Кононков П.Ф., Гинс В.К., Гинс М.К. Амарант - перспективное растение XXI века.// М.: Дом Федорова, 1997. -С. 160.
4. Клебанов, Теселкин Ю.О., Бабенкова, Любицкий О.Б. и др. Влияние карнозина и его составляющих на свободнорадикальные реакции.// Биологические мембраны, 1998. -Т. 15, N 1, -C. 72-82.
5. Дремина Е.С., Шаров В.С., Владимиров Ю.А.//Биофизика, 1993. - Т. 38. N 6. -С. 1047-1052.
6. Владимиров Ю.А., Аргаков А.И. Перекисное окисление липидов биологических мембран.// М.: Наука, 1972.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ СТАХИСЕЛ | 1999 |
|
RU2185829C2 |
| СРЕДСТВО ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ С РОСТСТИМУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2001 |
|
RU2214710C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ - ПРОБИОТИКОВ | 2001 |
|
RU2233322C2 |
| СПОСОБ ОБОГАЩЕНИЯ СЕЛЕНОМ ОВОЩЕЙ | 2001 |
|
RU2218764C2 |
| СПОСОБ ОБОГАЩЕНИЯ ЧЕСНОКА И КОРНЕПЛОДОВ СЕЛЕНОМ | 1997 |
|
RU2189155C2 |
| СЕПАРАТОР ДЛЯ ОЧИСТКИ КОРНЕКЛУБНЕПЛОДОВ | 1993 |
|
RU2093976C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЗИСНЫХ ГИБРИДОВ ОГУРЦА | 1994 |
|
RU2073970C1 |
| УСТРОЙСТВО ДЛЯ ПРЕДВАРИТЕЛЬНОГО ОПРЕДЕЛЕНИЯ ВСХОЖЕСТИ СЕМЯН | 1993 |
|
RU2060638C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2007 |
|
RU2377008C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУММАРНОЙ АНТИОКСИДАНТНОЙ АКТИВНОСТИ КРОВИ | 1999 |
|
RU2157531C1 |
Изобретение предназначено для использования в медицине и пищевой промышленности. В качестве антиоксиданта применяют алкалоид амарантина, который получают из растений рода Amaranthus. 4 ил.
Применение алколоида амарантина в качестве антиоксиданта.
| Капитанов А.Б., Пименов А.М | |||
| Каротиноиды как антиоксидантные модуляторы клеточного метаболизма | |||
| - Успехи современной биологии | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| Кононков П.Ф | |||
| и др | |||
| Амарант - перспективное растение XXI века | |||
| - М.: Дом Федорова, 1997, с.56. | |||
Авторы
Даты
1999-10-27—Публикация
1998-04-22—Подача