Изобретение относится к медицине, а именно к иммунологии, и касается получения нового иммуностимулирующего препарата на основе комплекса природных иммунопептидов, регулирующих процессы воспаления и регенерации.
Иммунопептиды являются универсальными регуляторами клеточных функций, играют ключевую роль в развитии практически всех типов иммунных реакций, воспалительных и регенераторных процессов. Препараты на основе цитокинов с успехом применяются при лечении опухолей, вирусных, бактериальных инфекций, лимфопролиферативных заболеваний.
В последние годы показаны преимущества иммуномодулирующего действия комбинации природных иммунопептидов по сравнению с рекомбинантными пептидами, оказывающими токсические побочные эффекты даже в лечебных дозах.
Известны способы получения препаратов иммунопептидов из крови доноров. Так, отечественный препарат интерферонов и сопутствующих цитокинов - лейкинферон - получен из культур лейкоцитов крови здоровых доноров при стимуляции вирусом Сендай (Кузнецов В.П. "Интерфероны, как средство иммуномодуляции". Иммунология 4: 30 - 34, 1987).
Однако, способ получения лейкинферона из культуры вирусиндуцированных лейкоцитов донорской крови не лишен недостатков. При получении каждой серии препарата используются клетки более 50 доноров. В настоящее время в связи с широким распространением вируса иммунодефицита (ВИЧ) и вирусов гепатита и отсутствием методов 100%-го выявления этих вирусов в крови человека требуется обязательная диагностика донорской крови на их наличие. При этом спектр иммунопептидов, определяемых в лейкинфероне (ИФН -α, ИЛ-1, ИЛ-6, ФНО -α, МИФ и ЛИФ), ограничен и регулирует первую фазу иммунного ответа (Кузнецов В.П., Караулов А. В. "Лейкинферон - механизмы терапевтического действия и тактика иммунокоррекции". International Journal on Immunorehabilitation N 10, 66 - 74, 1998). Данный способ принят за ближайший аналог.
В последние годы разрабатываются схемы получения биопрепаратов свиного происхождения, т. к. установлена высокая степень гомологии между трансплантационными антигенами и структурой цитокинов человека и свиньи. Показано, что цитокины свиньи эффективно действуют на клетки человека (патент N 1494274 от 20.03.97. "Способ получения фактора, ингибирующего миграцию макрофагов и лейкоцитов", Ганковская Л.В., Ковальчук Л.В.). Однако в данном способе продуцентами иммунопептидов являются мононуклеарные клетки периферической крови, выделяемые с использованием дорогостоящих импортных реактивов, а спектр иммунопептидов ограничен факторами, ингибирующими миграцию фагоцитов.
Технический результат изобретения состоит в получении стабильного, высокоактивного комплекса природных иммунопептидов, регулирующих функциональную активность клеток фагоцитарного ряда и управляющих течением процессов воспаления и регенерации.
Технический результат достигается за счет использования в качестве источника иммунопептидов лейкоцитов периферической крови свиньи или человека, а в качестве стимулирующего фактора - митогенного лектина (фитогемагглютинина - ФГА, или конканавалина А - Кон А), который индуцирует выработку широкого спектра иммунопептидов, регулирующих течение раневого процесса.
Средства для иммунностимуляции получают следующим образом: берут кровь человека или свиньи с гепарином, в стерильных условиях выделяют лейкомассу. Клетки отмывают, центрифугируя их в физиологическом растворе и затем стимулируют ФГА или Кон А в дозе 10 - 15 мкг/мл в течение 3 ч. После чего стимулятор удаляют, а клетки культивируют в бессывороточной культуральной среде (возможно среда-199) в течение 20 - 24 часов. По окончании культивирования надосадочную жидкость концентрируют известными способами и фракционируют на колонке с сефадексом G-100. Полипептидную фракцию с молекулярной массой менее и равной 40 кД собирают, лиофилизируют и проводят антивирусную обработку. Затем готовят разведение препарата и определяют концентрацию белка и биологическую активность в тесте торможения миграции макрофагов и хемилюминисценцией макрофагов. Для увеличения сроков хранения целесообразно проводить лиофилизацию конечного продукта.
Получение иммуностимулятора на основе комплекса природных иммунопептидов (КПИ).
Стадия 1. Получение супернатанта, содержащего иммунопептиды.
1.1. Выделение лейкоцитов из периферической крови. Источником КПИ являются лейкоциты гепаринизированной крови свиньи или человека (25 ед. гепарина на 1 мл крови). Периферическую кровь смешивают в соотношении 1:5 с 10% раствором желатина. Кровь отстаивают в течение 30 мин при комнатной температуре, затем 30 мин в термостате при 37oC. Лейкомассу собирают шприцем. Клетки дважды отмывают 0,9% раствором NaCl, центрифугируя их в течение 10 мин при 200g.
Подсчет выделенных клеток проводят в камере Горяева. Концентрацию клеток доводят до 25 • 106 кл/мл средой 199, содержащей гентамицин (40 мкг/мл).
1.2. Индукция выработки иммунопептидов. Для стимуляции лейкоцитов используют митогенный лектин (ФГА или Кон А в дозе 10 - 15 мкг/мл клеточной суспензии). Стимуляцию лейкоцитов проводят в течение 3 ч в термостате при 37oC. Через 3 ч стимулятор удаляют, клетки отмывают трижды в 10-кратном объеме 0,9% раствора NaCl, проводя последовательно центрифугирование (10 мин при 200 g). Это позволяет наиболее полно удалить стимулятор из среды культивирования.
1.3. Культивирование стимулированных лейкоцитов. Клетки вновь помещают в чистые флаконы со свежей культуральной средой в концентрации 25 • 106 кл/мл, культивируют при 37oC в течение 20 - 24 ч. После окончания культивирования надосадочную жидкость отделяют от клеток центрифугированием в течение 15 мин при 400 g.
Стадия 2. Биохимическая очистка.
2.1. Надосадочную жидкость культуры лейкоцитов концентрируют лиофилизацией.
2.2. Фракционирование концентрированных супернатантов проводят на хроматографической колонке размером 2,5х100 см ("Whatman", Великобритания), заполненной сефадексом G-100, уравновешенной дистиллированной водой. Скорость элюции - 30 мл/ч, время сбора фракций - 10 мин. Элюцию проводят в восходящем токе воды.
2.3. Полипептидную фракцию в области выхода молекулярных масс менее и равной 40 кД собирают, лиофилизируют. Затем готовят разведение препарата в дистиллированной воде (100 мкг/мл), проводят биологическую фильтрацию (фильтры "Millipore-QS", США, диаметр пор 0,22 мкм), определяют концентрацию белка по Лоури и биологическую активность в тесте торможения миграции макрофагов и хемилюминисценции макрофагов.
2.4. Определение биологической активности КПИ проводят по определению МИФ-активности. С помощью Мигроскрин - устройства для формирования клеточных микрокультур (НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН) по стандартной методике. Порядок выполнения:
1. Лунки 96-луночного планшета заполняют культуральной средой, кроме 4 угловых лунок. Культуральная среда включает RPMI-1640 с 2мМ L-глутамином, 5% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина, Hepes - 10 мМ.
2. В лунки добавляют по 50 мкл образцов предварительно раститрованных (каждое разведение в 4 параллелях). В качестве контроля в лунки добавляют культуральную среду (в 4 параллелях).
3. Готовят клеточную суспензию (перитонеальные макрофаги мышей) с концентрацией 10•106 клеток/мл. Клеточную суспензию набирают автоматической пипеткой в наконечники по 5 мкл в каждый. Наконечники ополаскивают от избытка клеток однократным опусканием в среду 199.
4. Собирают системы Мигроскрин, вставляя ножки штатива в угловые лунки планшета. Наконечники с клеточной суспензией вставляют вертикально в гнезда штатива системы. Заполненный штатив с наконечниками выдерживают при комнатной температуре в течение 1 ч на строго горизонтальной поверхности. За это время происходит оседание клеток суспензии на дно лунок, где формируются стандартные клеточные микрокультуры.
5. Штатив с наконечниками осторожно снимают с планшета. Планшет с микрокультурой клеток помещают в строго горизонтальном положении в CO2-инкубатор, где культивируют в течение 20 ч. В ходе культивирования клетки мигрируют по дну лунки.
6. Количественный учет результатов после инкубации проводят на бинокулярной лупе, визуально определяют размер колонии по шкале внутри окуляра. Микрокультуры имеют форму круга, поэтому определяют диаметр в одном направлении. Индекс миграции (ИМ) рассчитывают по формуле: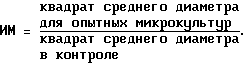
Вычисление ИМ в процентах:
ИМ = +(До/Дк-1) • 100.
КПИ считают активным, если при разведениях 1:100 ИМ ≤ 0,8.
Определение биологической активности КПИ проводят также в тесте люминол-зависимой хемилюминисценции (ЛХЛ). Регистрацию ЛХЛ производят на хемилюминометре ХЛМ-З в термостатированной при 37oC кювете при постоянном перемешивании. Образец содержит 1 • 106 клеток перитонеального экссудата крыс, 1 мл бесцветного раствора Хенкса и 2 • 10-5 М люминола ("Serva") (конечная концентрация в кювете). В течение 3 с регистрируют спонтанную хемилюменисценцию клеток перитонеального эксудата. Затем к клеткам добавляют стимулятор - опсонизированный зимозан ("Serva") в концентрации 0,025 мг/млн клеток и регистрируют индуцированную ЛХЛ.
При изучении влияния КПИ на кислородный метаболизм клетки предварительно инкубируют в силиконизированных флаконах в среде 199, содержащей антибиотик, в присутствии КПИ в дозах от 0,1 до 50 мкг/мл в течение 3 ч. После этого клетки дважды отмывают в бесцветном растворе Хенкса (pH 7,4) и регистрируют спонтанную и индуцированную ЛХЛ.
Влияние КПИ на ЛХЛ оценивают по индексу предстимуляции (ИП), где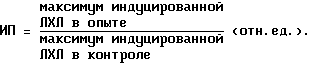
КПИ считается активным, если его разведение в 20-10 раз (концентрация по белку 5-10 мкг/мл) стимулирует хемилюминесцентный ответ МФ (индекс предстимуляции равен 2,0 ± 0,5).
Из одного литра крови выделяли (7500 ± 50) • 106 лейкоцитов, после культивирования которых получали 300 мл бесклеточного супернатанта. В результате проведения гельфильтрации и лиофилизации был получен 1 г белка полипептидов. Удельная активность КПИ в пересчете на 1 мг белка, определяемая методом хемилюминисцентного анализа, равнялась 104 у.е. (1 мкг КПИ стимулировал ХЛ-ответ в 2,2 раза, что соответствовало 1 у.е.). Сроки хранения активного КПИ после лиофилизации увеличивались с 10-15 дней до одного года при 4oC.
Характеристика иммуностимулятора на основе комплекса природных цитокинов.
Гетерогенность КПИ была подтверждена данными ступенчатого горизонтального электрофореза в полиакриламидном геле с SDS по Лэммли (U.K. Laemmli; Nature, 1970, v. 227, N 8, p. 680-685).
Результаты представлены на фиг. 1. Во всех сериях КПИ всегда определяются белки с молекулярной массой 10,2 кД, 12,0 кД, которые составляют 90% всех белков, входящих в состав КПИ. Также выявлялись белки с М.м < 40 кД.
Определение биологической активности КПИ.
Учитывая результаты о гетерогенности КПИ, а также данные литературы по кинетике выработки цитокинов в культуре лейкоцитов, стимулированных ФГА, были проведены эксперименты по выявлению активности известных цитокинов в КПИ.
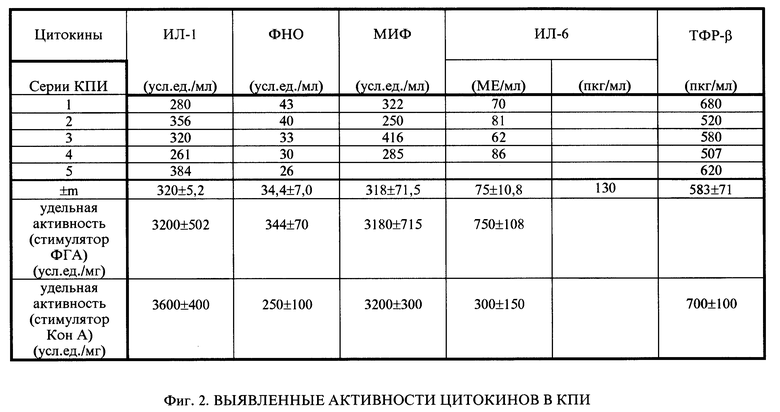
Активность ИЛ-1 определяли в пролиферативном тесте на тимоцитах мышей CH3/Hej при костимуляции ФГА (Mizel, 1982). КПИ обладал активностью ИЛ-1 (КА= 3,2 ± 0,25). Определение количества единиц активности ИЛ-1 в исследуемом препарате проводили с помощью пробит-анализа. За единицу активности ИЛ-1 принималась такая его концентрация в мл, которая вызывала 50% от максимального усиление пролиферации тимоцитов, вызываемого субоптимальной дозой пектина в данной тест-системе. Число единиц ИЛ-1 в препарате определяли, умножая на 10 обратную величину соответствующего разведения образца. КПИ содержит 320 ± 50,2 ед./мл. Удельная активность составила 3200 ± 502 уд.ед. /мг.
Тестирование активности ФНО -α проводили в цитотоксическом тесте на клетках мышиных фибробластов L929 в присутствии актиномицина Д. За условную единицу активности принимали обратное значение максимального разведения образца, вызывающего 50% лизис клеток-мишеней. В качестве стандарта использовали рекомбинантный человеческий ФНО -α, полученный в лаборатории химии генов Института биоорганической химии им. Н.И. Шемякина (зав. лаб. д.б.н. Коробко В.Г.), с активностью 5 • 106 условных единиц на мл. Активность ФНО -α в КПИ составила 34,4 ± 7,0 усл.ед./мл, что соответствует 6 • 10-3 ед. активности рекомбинантного человеческого ФНО -α. Удельная активность ФНО -α в КПИ составила 344 ± 70 уд.ед./мг белка.
Определение активности ИЛ-6 проводили в пролиферативном тесте ИЛ-6-зависимой гетерогибридомы Д6С8. В 100 мкг/мл КПИ содержится 7,5 ± 1,0 ед. биологической активности ИЛ-6, что соответствует 130 пг стандартного препарата ИЛ-6 (code88/514), предоставленного National Institute For Biological Standart and Control. Удельная активность ИЛ-6 составила 750 ± 108 уд.ед./мг белка.
Определение активности фактора, ингибирующего миграцию макрофагов в препарате, проводили в тесте с помощью Мигроскрин - устройства для формирования клеточных микрокультур (НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМП) по стандартной методике.
КПИ обладает активностью МИФ. В 1 мл (концентрация по белку 100 мкг) содержится 320 ± 70 ед. МИФ-активности. Из результатов 4 опытов в пересчете на 1 мг белка это 3180 ± 715 уд.ед./мг.
Определение содержания в препарате ТФР -β проводили с помощью иммуноферментного анализа с использованием иммуноферментного набора для определения ТФР -β1 производства Quantikine, RD-sistem (США). В препарате была выявлена активность ТФР -β1, составлявшая 583 ± 76. Активность цитокинов, выявленных в КПИ, представлена на фиг. 2. Концентрация белка всегда доводилась до 100 мкг в 1 мл, затем определялись активности известных цитокинов.
В КПИ, полученным данным способом наряду с активностью провоспалительных цитокинов (ИЛ-1, ИЛ-6, ФНО) определен основной цитокин, регулирующий раневой процесс - TФРβ в концентрации 583 ± 71 пкг/мл, что существенным образом отличает КПИ от лейкинферона. Полный состав КПИ до конца не идентифицирован; не исключено наличие в КПИ ряда ферментов, простагландинов и др. веществ. Отличий в активности иммунопептидов, полученных при культивировании лейкоцитов человека или свиньи, не выявлено.
Влияние КПИ на функциональную активность фагоцитарных клеток.
Влияние КПИ на фагоцитарную функцию нейтрофилов периферической крови человека.
Активность клеток фагоцитарной системы определяет развитие воспаления и регенерации. Поэтому было целесообразно оценить влияние КПИ на функциональную активность макрофагов и нейтрофилов в модельных системах in vitro.
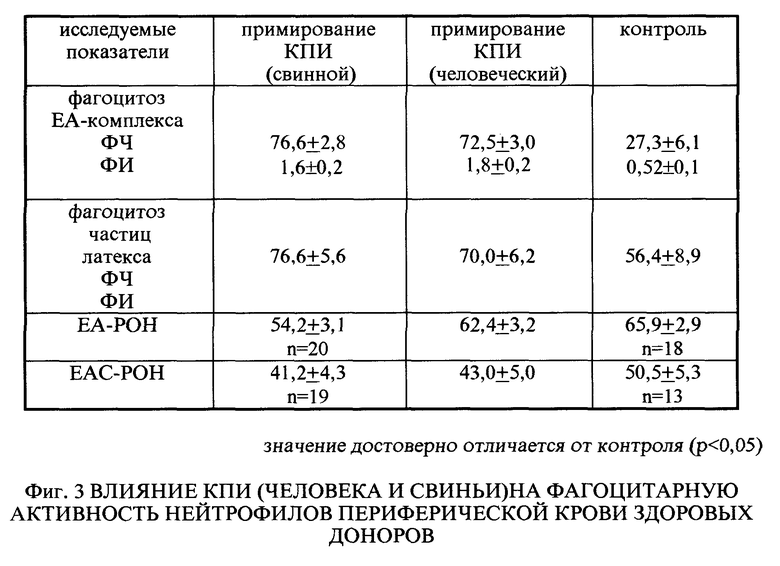
Оценивали влияние КПИ на фагоцитарную активность нейтрофилов периферической крови человека. Фагоцитарную активность тестировали в реакции Fc-опосредованного фагоцитоза по поглощению нейтрофилами частиц EA-комплекса, в реакции фагоцитоза латекса, а также, определяя относительное содержание нейтрофилов, несущих Fc и C3-рецепторы.
Поглотительную способность нейтрофилов в реакции Fc-опосредованного фагоцитоза оценивали по показателям фагоцитарного числа (процент нейтрофилов с фагоцитированным материалом) и фагоцитарного индекса (количества поглощенных частиц, приходящихся на 1 нейтрофил), определяемым при постановке микротеста. На промытое покровное стекло с прикрепленными нейтрофилами наносили 0,2 мл 0,5%-ного используемого в качестве объекта фагоцитоза EA-комплекса (эритроциты быка, опсонизированные кроличьей антиэритроцитарной сывороткой), инкубировали 30 мин. При 37oC во влажной камере промывали в растворе Хенкса для удаления непоглощенных частиц, высушивали, фиксировали в метаноле, окрашивали гематоксилином Караччи и эозином, помещали в канадский бальзам. При учете реакции подсчитывали не менее 200 клеток. Исследуемые фракции (опыт) или раствор Хенкса (контроль) в объеме 0,1 мл наносили на монослой нейтрофилов и выдерживали при 37oC во влажной камере в течение 1 ч до начала инкубации с объектом фагоцитоза (0,2 мл 1%-ного EA-комплекса).
Экспрессию Fc и C3-рецепторов на поверхности нейтрофилов оценивали по результатам учета реакции розеткообразования нейтрофилов с EA- или EAC-комплексами. В качестве индикаторных частиц для EA-POH использовали эритроциты быка, опсонизированные кроличьей антисывороткой в субаглютинирующем разведении, полученной на высоте вторичного ответа, а для EAC-POH - эритроциты быка, опсонизированные кроличьей AC, получали свежую сыворотку крови мышей в разведении 1:10 (как источник комплемента).
Одновременное добавление КПИ вместе с частицами латекса не изменяло фагоцитарную активность нейтрофилов. Часовая инкубация с КПИ в дозе 10 мкг/мл приводила к повышению поглотительной способности нейтрофилами частиц латекса. Фагоцитарное число увеличивалось в среднем на 20 - 25% с 56,4 ± 8,9 до 76,64 ± 5,6. Предстимуляция КПИ значительно увеличивала процент клеток, фагоцитировавших EA-комплекс с 27,3 ± 6,1 до 76,6 ± 2,8. Возрос и фагоцитарный индекс в 2-2,3 раза (фиг. 3)
Культивирование моноцитов с препаратом КПИ в течение 24 ч приводило к повышению уровня активности ИЛ-1 в среде 2 - 2,5 раза, что было оценено в пролиферативном тесте мышей CH3/Hej (фиг. 4).
Влияние КПИ на противоопухолевую цитотоксичность макрофагов.
Было проведено изучение влияния КПИ на индукцию противоопухолевой цитотоксичности МФ в сравнении с рекомбинантными цитокинами: ИЛ-1, ИЛ-2, ФНО-α и их различными комбинациями. Определение противоопухолевой цитотоксичности МФ проводили по методу Kos (1989), основанному на степени включения радиоактивной метки 3H-тимидина в клетки-мишени. КПЭ в концентрации 2 • 106 в 1 мл среды 199, содержащей 1% фетальную сыворотку теленка, вносили по 100 мкл в плоскодонные 96-ти луночные планшеты "Limbro". По окончании часовой инкубации неприлипшие клетки удаляли двукратным отмыванием средой 199. Для индукции цитотоксической активности к МФ добавляли КПИ в различных разведениях и культивировали в течение 24 ч в полной среде RPMI-1640, после чего МФ дважды отмывали от КПИ теплой бессывороточной средой 199 и добавляли клетки-мишени. В качестве клеток-мишеней использовали опухолевые клетки меланомы В16, адаптированные в условиях in vitro. Активированные МФ и клетки-мишени в соотношении 10: 1 инкубировали в течение 24 часов. После инкубации МФ отмывали от неприлипших и погибших клеток и в каждую лунку вносили по 100 мкл культуральной среды, содержащей 6,25 MСu/мл 3H-тимидина с удельной активностью 5 Cu/мМоль. После 24 часов инкубации среду удаляли и вносили в лунки по 200 мкл 0,25% трипсина и культивировали 1 час при 37oC. Затем клетки собирали на стекловолоконные фильтры типа "Whatman" с помощью клеточного харвестера. Радиоактивность фильтров определяли на сцинтилляционном счетчике "Beckman". Индекс цитотоксичности рассчитывали по формуле
ИЦТ = (cpm1 - cpm2):cpm1•100%,
где cpml - среднее число импульсов за 1 мин в триплете в контроле; cpm2 - среднее число импульсов за 1 мин в триплете в опыте.
В качестве контроля использовали МФ, необработанные цитокинами, плюс В16, в качестве опыта - МФ, примированные цитокинами, плюс В16. Малые дозы КПИ не влияли существенным образом на противоопухолевую активацию резидентных МФ. Наиболее эффективным были дозы КПИ 50 мкг/мл и 100 мкг/мл, ИЦТ= 47,7 ± 4,1 и 57,5 ± 2,9.
На основании полученных результатов можно сделать вывод, что КПИ, полученный данным способом из культур лейкоцитов периферической крови, является мощным стимулятором различных функций фагоцитов. КПИ не обладает видовой специфичностью по отношению к клеткам-мишеням.
КПИ, полученный из периферической крови человека и свиньи, не отличался по биологическому действию на фагоцитарные клетки (фиг. 3; фиг. 4).
Изучение действия иммуностимулятора на раневой процесс в эксперименте.
Моделирование гнойной раны выполняли на морских свинках обоего пола весом 200 - 400 г по методике, описанной Николаевой А.А. (3). Микробным агентом был St. aureus штамм Р209. КПИ, полученный по указанному способу, наносился на рану ежедневно в концентрации 100 мкг белка/мл в количестве 0,2 - 0,3 мл в течение 10 - 15 дней.
Критериями оценки раневого процесса служили:
1. Макроскопическое состояние раны:
а) сроки появления грануляции;
б) сроки появления краевой эпителизации;
в) сроки очищения раны от гнойно-некротических тканей;
г) сроки полной эпителизации.
2. Планиметрические показатели.
3. Бактериологический контроль.
Количественное определение микробных тел в 1 г ткани на 3, 5, 7, 9 сутки по методу, предложенному Кузиным М.И. (5). Критерием очищения раны от бактериальной обсемененности было количество микробных тел на 1 г ткани меньше 105.
4. Гистологическое исследование проводилось на 3, 7, 10, 19 сутки.
Животные были разделены на 2 группы по 6 свинок в каждой со стандартными гнойными ранами (200 см2).
1-я группа (опытная) - на рану наносился иммуностимулятор в течение 15 дней.
2-я группа (контрольная) - на рану наносилась среда 199 с антибиотиками.
Препарат наносился с 1-го дня после моделирования раны. Проводилось бактериологическое и гистологическое исследование. Результаты исследования приведены на фиг. 5.
В опытной группе гнойно-воспалительные явления были менее выражены, раневой процесс проходил более абортивно, особенно фаза гидратации. С первых дней края раны были умеренно гиперемированы, с незначительным отеком. Площадь раны начинала сокращаться с первых суток, через 2 дня появлялись активные грануляции, через 3-е суток - краевая эпителизация, к 7-м суткам рана представляла собой чистую гранулирующую поверхность без признаков активного воспаления, с хорошей краевой эпителизацией.
В контрольной группе отмечалось выраженное воспаление, с резким стеком окружающих тканей, инфильтрацией, гиеремией, обильной эксудацией. Площадь раны в первые сутки несколько увеличивалась в размере и практически начинала сокращаться с 3-х суток. Полная эпителизация наступала через 19 суток с грубыми рубцовыми изменениями, тогда как в опытной группе - эпителизация на 15-е сутки с образованием нежного мягкого рубца. При этом площадь эпителизации в опытной группе была в 1,5-2,0 раза больше, чем в контрольной (фиг. 5).
Таким образом, иммуностимулятор на основе природных иммунопептидов при применении наружно в дозе 100 мкг белка/мл при лечении гнойно-воспалительного процесса у экспериментальных животных:
1) оказывает бактерицидное действие, которое можно объяснить активацией фагоцитарной функции нейтрофилов и макрофагов;
2) ускоряет образование и созревание грануляционной ткани;
3) ускоряет эпителизацию раневого дефекта;
4) предупреждает развитие грубого рубцевания ран;
5) при комбинированном применении усиливает терапевтический эффект мазевых препаратов.
На основании вышеизложенного можно сказать, что применение в клинической практике иммуностимулятора на основе комплекса природных иммунопептидов перспективно при лечении и профилактики гнойно-воспалительных заболеваний и других состояниях лиц с скомпрометированной иммунной системой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТЕРАПИИ ОСТРОЙ ПНЕВМОНИИ | 1995 |
|
RU2118159C1 |
| СПОСОБ ТЕРАПИИ ХРОНИЧЕСКИХ СИНУСИТОВ | 1998 |
|
RU2164422C2 |
| СПОСОБ ПЕРСОНИФИЦИРОВАННОЙ ИММУНОТЕРАПИИ | 2009 |
|
RU2414228C1 |
| СПОСОБ ТЕРАПИИ ХРОНИЧЕСКИХ ТОНЗИЛЛИТОВ И ФАРИНГИТОВ | 1996 |
|
RU2123362C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО БРОНХИТА | 2005 |
|
RU2286795C1 |
| СПОСОБ ТЕРАПИИ ПОЛЛИНОЗА | 1996 |
|
RU2139742C1 |
| СПОСОБ ЛЕЧЕНИЯ ЯЗВЕННО-ЭРОЗИВНЫХ ПОРАЖЕНИЙ ГАСТРОДУОДЕНАЛЬНОЙ ЗОНЫ С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯТОРА СУПЕРЛИМФ | 2004 |
|
RU2260443C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРИРОДНЫХ ЦИТОКИНОВ | 1999 |
|
RU2149643C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРЕЖДЕВРЕМЕННЫХ РОДОВ ПРИ УРОГЕНИТАЛЬНОЙ ИНФЕКЦИИ | 2006 |
|
RU2334233C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСЛОЖНЕНИЙ ПОСЛЕ ЭКСТРАКЦИИ КАТАРАКТЫ | 1993 |
|
RU2085158C1 |


Изобретение относится к медицине и может быть использовано для получения нового иммуностимулирующего средства на основе комплекса природных иммунопептидов, регулирующих процесс воспаления и регенерации. Средство включает в себя комплекс иммунопептидов, полученных культивированием стимулированных лейкоцитов периферической крови млекопитающих с последующим выделением целевого продукта. В качестве исходного сырья для получения заявленного средства используют лейкоциты свиньи или человека. Стимуляцию лейкоцитов осуществляют с помощью вещества из группы митогенных лектинов, в частности фитогемагглютинина или конканавалина А. Лектин затем удаляют из системы центрифугированием. Культивирование проводят в течение 20 - 24 ч, после чего получают супернатант. Из полученного супернатанта выделяют целевой продукт с молекулярной массой, равной или менее 40 кД, фракционированием. Целевой продукт может быть получен в лиофилизованном виде. Средство активирует клетки фагоцитарного ряда, регулирует процессы воспаления и регенерации, является перспективным в лечении и профилактике воспалительных заболеваний у лиц с поврежденной иммунной системой. 2 з.п. ф-лы, 5 ил.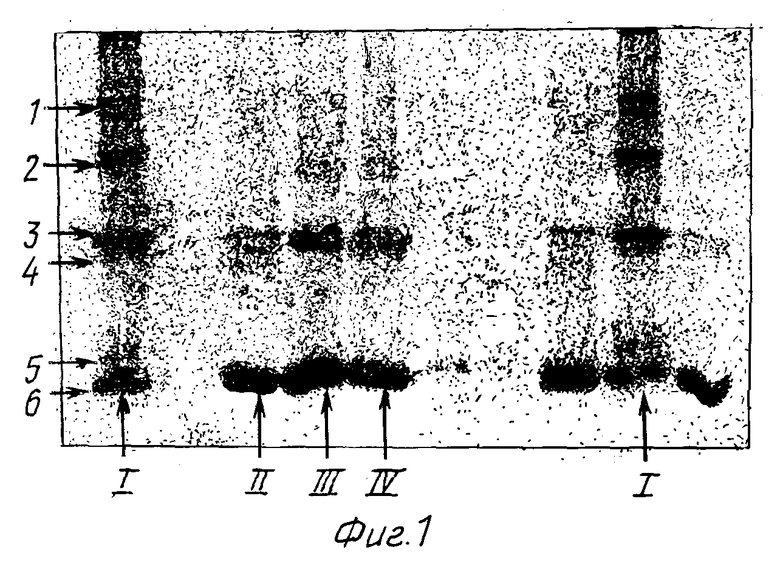
| Кузнецов В.П | |||
| и др | |||
| Лейкинтерферон - механизмы терапевтического действия и тактика иммунокоррекции | |||
| Int.J.on Immunorehabilitation | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 4618494 A, 21.10.86 | |||
| US 4464355 A, 07.08.84 | |||
| US 5462733 A, 31.10.95 | |||
| Укрытие | 1978 |
|
SU763543A1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 1990 |
|
RU1744811C |
Авторы
Даты
2000-02-20—Публикация
1998-11-23—Подача