Настоящее изобретение относится к областям фармацевтической химии и фармакологического лечения и предусматривает новый способ лечения недержания у людей, использующий ряд 3-арилоксипропиламинов, в частности далоксетин.
Недержание мочи представляет собой обычное состояние и часто является настолько серьезным, что составляет затруднения и даже обуславливает потерю трудоспособности. Оно является частой причиной заключения старых людей в дома престарелых и в другие покровительственные условия. Хотя недержание мочи в любом возрасте чаще встречается среди женщин, чем среди мужчин, от него страдает значительное количество людей обоего пола. Хорошо известно, что многие дети проходят через обычный возраст ночного энуреза и приучения к туалету и менее часто от дневного недержания мочи, и также хорошо известно, что для пожилых людей по мере старения довольно вероятно развитие недержания мочи. Однако некоторые исследования сообщали о дневном недержании среди не менее 17% молодых, по всей видимости, здоровых женщин.
Таким образом, понятно, что надежные и безопасные способы лечения недержания мочи серьезно необходимы. Эта необходимость в настоящее время не удовлетворена адекватно.
Недержание мочи представляет собой проявление нарушения управления мышцами мочевого сфинктера и мочевого пузыря. Эти мышцы находятся в равновесии, когда система работает соответствующим образом. Мочевой сфинктер должен быть достаточно сильным для того, чтобы сдерживать давление, оказываемое мышцами мочевого пузыря, за исключением того момента, когда человек сознательно расслабляет сфинктер для того, чтобы помочиться.
Недержание происходит, когда давление внутри пузыря слишком велико как результат избыточной силы, оказанной мышцами мочевого пузыря, или, когда мочевой сфинктер слишком слаб для того, чтобы сдерживать нормальное давление внутри мочевого пузыря. Недержание в широком смысле классифицируется как позывное недержание (вызываемое избыточным давлением внутри мочевого пузыря) и недержание мочи во время напряжения, стресса (вызываемое слабым уретральным сфинктером). Часто наблюдают пациентов как с позывным недержанием мочи, так и с недержанием мочи во время напряжения, состояние, которое называют смешанным недержанием.
Недержание мочи, проявляясь у различных типов пациентов, имеет ряд различных причин или предполагаемых причин, включая болезнь Паркинсона, рассеянный склероз, поражение церебральной сердечно-сосудистой системы, церебральный артериосклероз, поражения центральной нервной системы и инфекции мочевого пузыря. Активность мышц мочевого пузыря или уретры может иметь много причин, а интерстициальный цистит может привести к подвижности мышц мочевого пузыря и к особенно болезненной и неприятной разновидности позывного недержания мочи.
Неврологические расстройства, включая болезнь Паркинсона, болезнь Альцгеймера и рассеянный склероз, часто приводят к позывному недержанию мочи, имеющему место вследствие повышенной активности мышц мочевого пузыря. Недержание мочи представляет собой ранний симптом болезни Паркинсона и в действительности часто усугубляется лекарствами против болезни Паркинсона.
Хорошо известно, что дети часто страдают ночным недержанием мочи. Сообщалось, что ночное недержание мочи имеет место у 30% 4-летних детей и у 10% 6-летних детей. Это состояние представляет собой разновидность позывного недержания и является хорошо известным источником эмоционального беспокойства как у детей, так и у их родителей.
Много старых людей страдают от недержания, которое может являться результатом многих причин и включать как недержание мочи во время напряжения, так и позывное недержание, а также смешанное недержание, являющееся результатом комплекса причин. Позывное недержание является наиболее обычным у старых людей и обычно вызывается ненормальными нервной или мышечной реакциями мочевого пузыря. Недержание мочи во время напряжения, относительно редкое у старых мужчин, но более обычное у старых женщин может являться результатом хирургического вмешательства, пониженного мышечного тонуса и анатомических изменений в тазовых органах, деградации уретры и ухудшения нервно-мышечной восприимчивости уретры. Возрастные болезни, особенно болезнь Альцгеймера, также часто приводят к недержанию.
Таким образом, понятно, что недержание мочи сегодня является одной на основных болезней. Полагают, что только в Соединенных Штатах от нее страдают приблизительно 12 миллионов человек, и что она имеет место у от 15 до 30% населения старше 60 лет. Лечение недержания в настоящее время совершенно неудовлетворительно.
Возможно, большинство пациентов совсем не лечат, но они используют пеленки и другие вспомогательные средства, оставаясь в большинстве случаев вблизи от дома в состоянии затруднения и изоляции. Некоторые виды недержания могут быть улучшены посредством хирургического вмешательства при высокой стоимости и некотором риске. Улучшение обычно является временным, причем средний пациент получает 2, 3 хирургические операции за время своей жизни. Используются несколько лекарств, включая, в частности, имипрамин и другие антихолинергические и антиспазматические средства. До некоторой степени используют бензидиазепиновые антидепрессанты, эфедрин и фенилпропаноламин.
Все лекарства, используемые в настоящее время для недержания мочи, имеют тот недостаток, что они обладают многочисленными фармакологическими активностями и поэтому вызывают нежелательные реакции у пациентов. Антихолинергическое действие бензодиазапинов и имипрамина особенно значительно и, по-видимому, дает побочные результаты, которые требуют воздержания от лекарственного средства или приводят к нарушению режима пациентом.
Таким образом, понятно, что очень нужны лекарственные средства, эффективные для лечения недержания мочи и не дающие нежелательных побочных результатов. Настоящее изобретение предусматривает такие лекарственные средства.
Настоящее изобретение предусматривает способ лечения недержания мочи у человека, нуждающегося в таком лечении, включающий введение указанному человеку эффективной снижающей недержание дозы венлафаксина или соединения формулы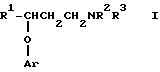
где: R1 представляет собой C5-C7 циклоалкил, тиенил, галогентиенил, (C1-C4алкил)тиенил, фуранил, пиридил или тиазолил; Ar представляет собой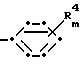
или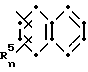
каждый из R2 и R3, независимо, представляет собой водород или метил; каждый R4, независимо, представляет собой галоген, C1-C4 алкил, C1-C3 алкокси или трифторметил;
каждый R5, независимо, представляет собой галоген, C1-C4 алкил или трифторметил;
m составляет 0, 1 или 2;
n составляет 0 или 1; или
его фармацевтически приемлемой соли, полученной присоединением кислоты.
Изобретение также предусматривает фармацевтический продукт для лечения недержания мочи у человека, причем указанный продукт включает венлафаксин или соединение формулы I в виде фармацевтического препарата, дополнительно включающего фармацевтически приемлемый наполнитель в сочетании с упаковочным материалом, пригодным для фармацевтического препарата, причем указанный упаковочный материал включает инструкции по использованию фармацевтического препарата для лечения недержания мочи.
Настоящее изобретение также предусматривает использование венлафаксина или соединения формулы I для лечения недержания мочи у человека, нуждающегося в таком лечении.
Далее, изобретение предусматривает использование венлафаксина или соединения формулы I для производства лекарственного препарата для лечения недержания мочи.
Фиг. 1 - действие введения далоксетина на емкость мочевого пузыря.
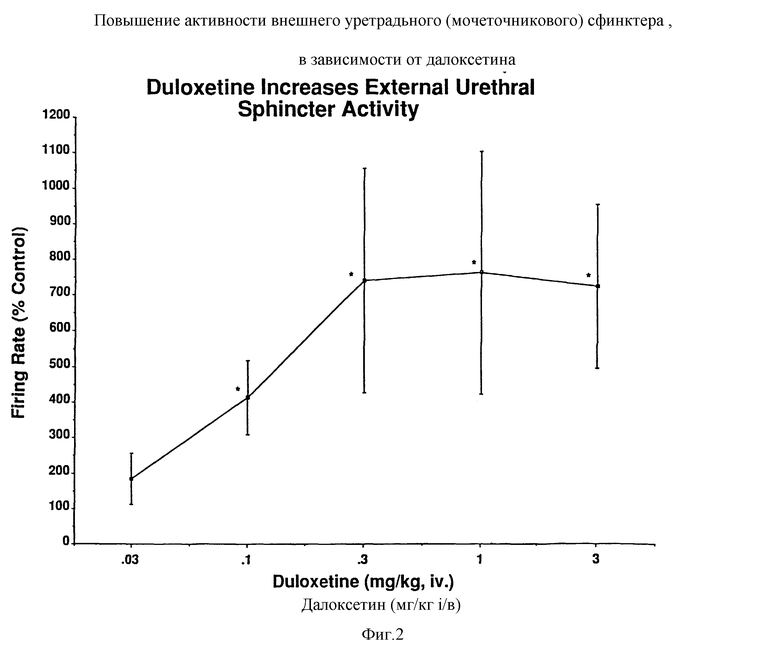
Фиг. 2 - действие далоксетина на активность наружных мышц уретрального сфинктера, измеренное при помощи EMG(электромиграммы) активности.
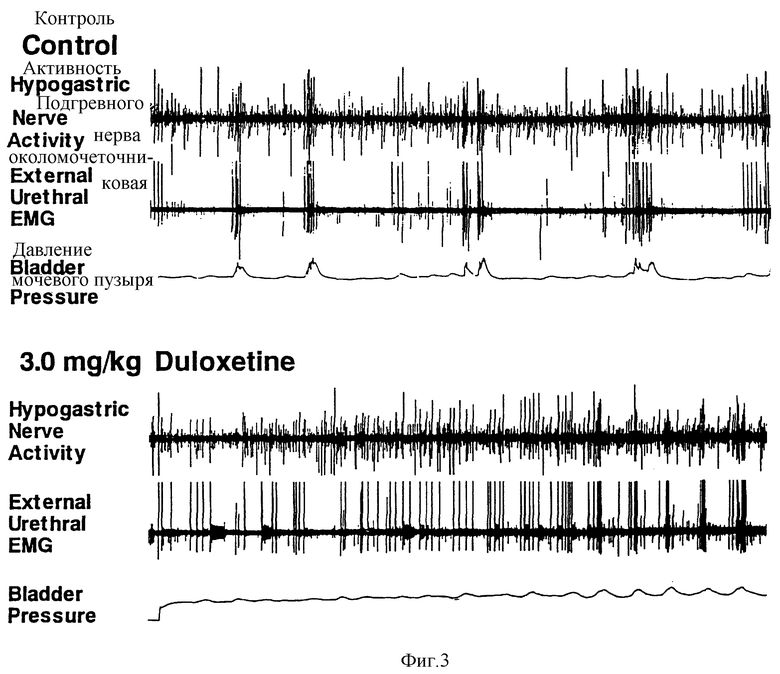
Фиг. 3 - действие далоксетина на подчревную нервную активность, наружную уретральную EMG и давление в мочевом пузыре.
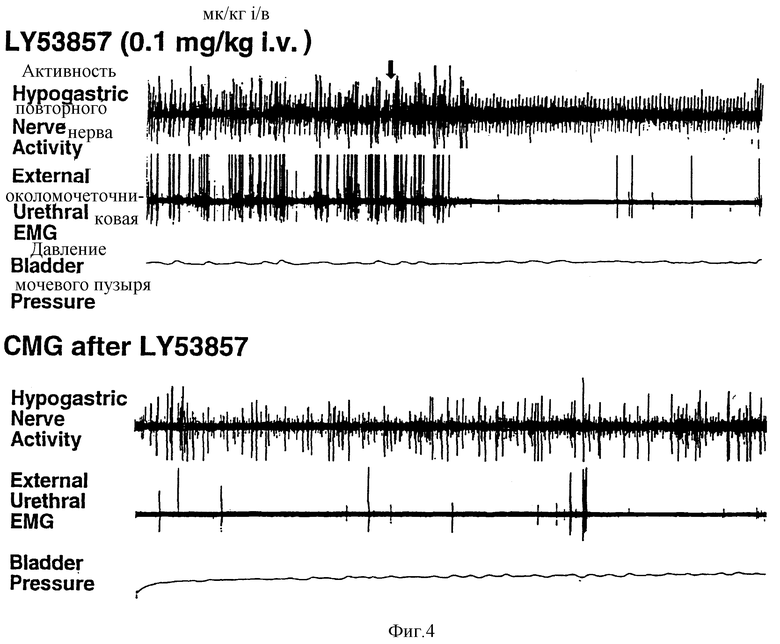
Фиг. 4 - действие LY 53857 для сравнения с фиг. 3; LY 53657 вводили во время, указанное стрелкой.
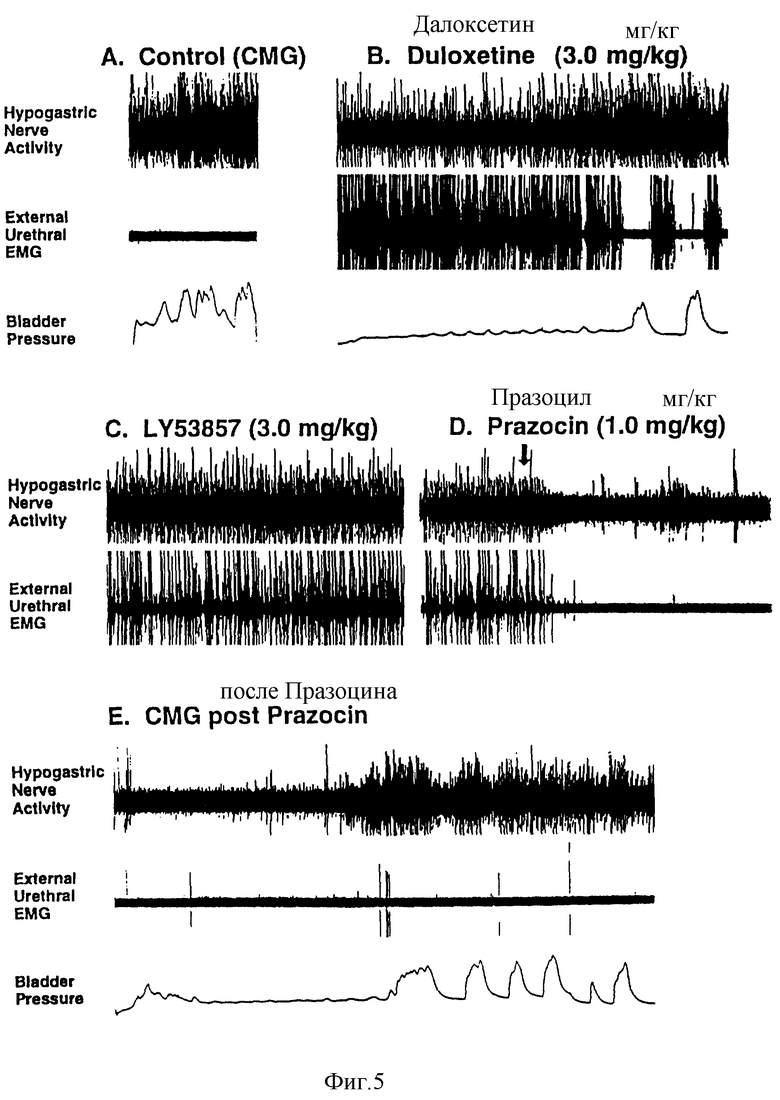
Фиг. 5 - действие далоксетина на подчревную нервную активность, наружную уретральную EMG и давление в мочевом пузыре в сравнении с LY 53857 и празоцином.
В этом описании все температуры будут указываться в градусах Цельсия, а все указания процента, соотношения, концентрации и т.п., если не оговорено особо, будут выражены в весовых измерениях.
Соединения, полезные в настоящем изобретении, являются селективными ингибиторами повторного поглощения как серотонина, так и норепинефрина и, по существу, не оказывают другого фармакологического действия. Другими словами, любые другие фармакологические действия, которые могут оказывать эти соединения, имеют место только при концентрациях или дозах, по крайней мере в 10 и обычно в 100 раз превышающих эффективные концентрации или дозы, при которых эти соединения ингибируют поглощение серотонина и норепинефрина. Таким образом, эти соединения, по существу, не способны оказать нежелательные побочные действия на пациентов, которым эти соединения вводят.
Венлафаксин представляет собой известное в литературе соединение, а способ его синтеза и его активность в качестве ингибитора поглощения серотонина и норепинефрина описывается патентом США N 4,761,501. Венлафаксин в этом патенте, который включен в настоящее описание ссылкой, идентифицируется как соединение А. В столбце 9 этого патента утверждается, что соединение А не обладает мускариновой антихолинергической активностью.
Соединения формулы I были описаны в патенте США N 4,956,388, который также включен в настоящее описание ссылкой. Наиболее предпочтительным соединением формулы I является далоксетин, (+)-N-метил-3-(1-нафталинокси)-3-(2-тиенил)пропиламин, обычно применяемый в виде солянокислой соли. Далоксетин получают в примере 2 вышеупомянутого патента в виде оксалата, который демонстрирует высокую эффективность в ингибировании поглощения серотонина и норепинефрина в столбце 16.
Поскольку соединения формулы I полностью описываются в патенте США N 4,956,383, изучить способы синтеза и полное описание этих соединений можно из этого патента. Однако некоторые из этих соединений являются предпочтительными для использования в настоящем изобретении, и группы этих предпочтительных соединений будут здесь упомянуты. Будет понятно, что предпочтительные группы, описанные ниже, могут быть произвольно объединены для описания других, более ограниченных подгрупп, которые также являются особенно предпочтительными при выполнении на практике настоящего изобретения.
а) R1 представляет собой тиенил;
b) R1 представляет собой тиенил, галогентиенил или (C1-C4алкил)тиенил;
с) R1 представляет собой C5-C7 циклоалкил;
d) R1 представляет собой фуранил, пиридил или тиазолил;
e) Ar представляет собой фенил или замещенный фенил;
f) Ar представляет собой нафтил или замещенный нафтил;
d) Ar представляет собой незамещенный фенил или незамещенный нафтил;
h) R2 представляет собой метил, а R3 представляет собой водород;
i) R2 и R3 оба представляют собой метил.
Читатель поймет, что соединения формулы I, а также венлафаксин содержат асимметрический атом углерода и что они, по-видимому, существуют в виде индивидуальных стереоизомеров, а также в виде рацемической смеси. Когда в настоящем описании не указывается стереоизомерная форма соединения, будет понятно, что подразумеваются обе возможные изомерные формы, а также рацемат. Когда указывается индивидуальный стереоизомер, как в случае далоксетина, изомерная форма будет указываться в виде части названия.
Например, следующие конкретные соединения иллюстрируют соединения формулы I, которые рассматриваются в объеме настоящего изобретения.
N-Метил-3-(1-нафталинокси)-3-(3-тиенил)-пропиламин фосфат;
(+)-N-Метил-3-(2-нафталинокси)-3-(циклогексил)-пропиламин цитрат;
(+)-N,N-Диметил-3-(4-хлор-1-нафталинокси)-3-(3-фуранил)пропиламин гидрохлорид;
N-Метил-3-(5-метил-2-нафталинокси)-3-(2-тиазолил)пропиламин гидробромид;
-Метил-3-[3-(трифторметил)-1-нафталинокси]-3-(3-метил-2-тионил) пропиламин оксалат;
(-)-N-Метил-3-(6-иод-1-нафталинокси)-3-(4-пиридил)пропиламин малеат;
N,N-Диметил-3-(1-нафталинокси)-3-(циклогептил)пропиламин формиат;
(-)-N,N-Диметил-3-(2-нафталинокси)-3-(2-пиридил)пропиламин;
(+)-N-Метил-3-(1-нафталинокси)-3-(2-фуранил)пропиламин сульфат;
(+)-N-Метил-3-(4-метил-1-нафталинокси)-3-(4-тиазолил)пропиламин оксалат;
N-Метил-3-(2-нафталинокси)-3-(2-тиенил)пропиламин гидрохлорид;
(-)- N, N-Диметил-3-(6-иод-2-нафталинокси)-3-(4-бром-3-тионил) пропил малонат;
(-)-N,N-Диметил-3-(1-нафталинокси)-3-(3-пиридил)пропиламин гидроиодид;
N,N-Диметил-3-(4-метил-2-нафталинокси)-3-(3-фуранил)пропиламин малеат;
(+)-N-Метил-3-(2-нафталинокси)-3-(циклогексил)пропиламин капрат;
(-)-N-Метил-3-(6-н-пропил-1-нафталинокси)-3-(3-изопропил-2- тиенил)пропиламин цитрат;
(+)-N, N-Диметил-3-(2-метил-1-нафталинокси)-3-(4-тиазолил)- пропиламин вторичный кислый фосфат;
3-(1-Нафталинокси)-3-(5-этил-3-тиенил)пропиламин сукцинат;
3-[3-(Трифторметил)-1-нафталинокси]-3-(пиридил) пропиламин ацетат;
(-)-N-Метил-3-(6-метил-1-нафталинокси)-3-(4-хлор-2-тиенил)- пропиламин тартрат;
3-(2-Нафталинокси)-3-(циклопентил)пропиламин;
(-)-N-Метил-3-(4-н-бутил-1-нафталинокси)-3-(3-фуранил)пропиламин метансульфонат;
(+)-3-(2-Хлор-1-нафталинокси)-3-(5-тиазолил)пропиламин оксалат;
(+)-N-Метил-3-(1-нафталинокси)-3-(3-фуранил)пропиламин тартрат;
N,N-Диметил-3-(фенокси)-3-(2-фуранил)пропиламин оксалат;
N, N-Диметил-3-[4-(трифторметил)фенокси] -3-(циклогексил)пропиламин гидрохлорид;
N-Метил-3-(4-метилфенокси)-3-(4-хлор-2-тиенил)пропиламин пропионат;
(-)-N-Метил-3-(фенокси)-3-(3-пиридил)пропиламин оксалат;
3-[2-Хлор-4-(трифторметил)фенокси]-3-(2-тиенил)пропиламин;
(+)-N, N-Диметил-3-(3-метоксифенокси)-3-(3-бром-2-тиенил)- пропиламин цитрат;
N-Метил-3-(4-бромфенокси-3-(4-тиазолил)пропиламин малеат;
(-)-N,N-Диметил-3-(2-этилфенокси)-3-(5-метил-3-тиенил)пропиламин;
N-Метил-3-(2-бромфенокси)-3-(3-тиенил)пропиламин сукцинат;
(-)-N-Метил-3-(2,6-диметилфенокси)-3-(3-метил-2-тиенил)пропиламин ацетат;
3-[-(Трифторметил)фенокси]-3-(3-фуранил)пропиламин оксалат;
(-)-N-Метил-3-(2,5-дихлорфенокси)-3-(циклопентил)пропиламин;
3-[4-(Трифторметил)фенокси]-3-(2-тиазолил)пропиламин;
(+)-N-Метил-3-(фенокси)-3-(5-метил-2-тиенил)пропиламин цитрат;
(+)-3-(4-(Метоксифенокси)-3-(4-пиридил)пропиламин гидрохлорид;
N,N-Диметил-3-(3-метил-5-бромфенокси)-3-(3-тиенил)пропиламин;
N-Метил-3-(3-н-пропилфенокси)-3-(2-тиенил)пропиламин гидрохлорид;
(+)-N-Метил-3-(фенокси)-3-(3-тиенил)пропиламин фосфат;
(-)-N-Метил-3-(4-метокcифенокси)-3-(циклогептил)пропиламин цитрат;
3-(2-Хлорфенокси)-3-(5-тиазолил)пропиламин пропионат:
3-[2-Хлор-4-(трифторметил)фенокси]-3-(3-тиенил)пропиламин оксалат;
3-(фенокси)-3-(4-метил-2-тиенил)пропиламин;
(+)-N,N-Диметил-3-(4-этилфенокси)-3-(3-пиридил)-пропиламин малеат;
(-)-N,N-Диметил-3-[4-(трифторметил)фенокси]-3-(2-пиридил)- пропиламин.
Особенно предпочтительный синтез особенно предпочтительного соединения, далоксетина, будет изложен ниже.
Приготовление 1
(S)-(-)-N,N-Диметил-3-гидрокси-3-(2-тиенил)пропиламин
Смесь 8,18 г 2-ацетилтиофена, 6,66 г диметиламин гидрохлорида, 2,9 г параформальдегида и 0,31 г концентрированной соляной кислоты в 20 мл изопропанола нагревали до обратного стекания жидкости и перемешивали в течение 6 часов. Смесь затем охлаждали до 0o и перемешивали в течение еще одного часа. Суспензию затем фильтровали, и твердое вещество промывали холодным этанолом. Промытое твердое вещество сушили в течение 16 часов при 50o, получая 12,5 г 2-тиенил-2-диметиламиноэтилкетон гидрохлорида в виде белого твердого вещества. Часть этого промежуточного продукта весом в 12,0 г перемешивали в 40 мл этанола при температуре окружающей среды и pH раствора поднимали до 11-12 посредством медленного добавления гидроксида натрия. Добавляли порцию борогидрида натрия весом в 1,03 г и смесь перемешивали при температуре окружающей среды в течение 4 часов. Затем добавляли 7,5 мл ацетона, и смесь перемешивали в течение еще 20 минут. Смесь затем концентрировали посредством выпаривания до белой суспензии и добавляли 120 мл метил-трет-бутилового эфира. Смесь подкисляли до pH 1-1,5 посредством добавления концентрированной соляной кислоты, и раствор перемешивали в течение 10 минут; pH затем делали основным до pH 12 посредством медленного добавления гидроксида натрия.
Слои затем разделяли, водную фазу экстрагировали 30 мл метил-трет-бутилового эфира, а органические фазы смешивали и один раз промывали при помощи 50 мл воды. Органическую фазу концентрировали посредством выпаривания до 118 мл и нагревали до 50o.
В отдельном объеме 4,18 г (S-(+)-миндальной кислоты растворяли в 12 мл этанола при 50o, и раствор миндальной кислоты медленно добавляли к предыдущему раствору. Получающуюся суспензию затем нагревали до обратного стекания жидкости и перемешивали в течение 45 минут. Суспензию затем охлаждали до температуры окружающей среды, перемешивали в течение одного часа и фильтровали, а твердое вещество промывали метил-трет-бутуловым эфиром. Твердое вещество затем сушили в вакууме при 50o, получая 7,29 г соли целевого продукта и миндальной кислоты, которую выделяли в виде несвязанного амина посредством растворения в воде, подщелачивания раствором гидроксида натрия, экстракции в органический растворитель и выпаривания для удаления органического растворителя.
Приготовление 2
Соль (S)-(+)-N, N-диметил-3-(1-нафталинокси)-3-(2-тиенил) пропиламина и фосфорной кислоты
Порцию (S)-(-)-N,N-диметил-3-гидрокси-3-(2-тиенил)пропиламина весом 13,5 г растворяли в 80 мл диметилсульфоксида при 25o. К раствору медленно добавляли 3 г гидрида натрия в виде 60% дисперсии в вазелиновом масле при энергичном перемешивании. После 15 минут перемешивания добавляли 1,17 г бензоата калия, и перемешивание продолжали при почти постоянной температуре в течение еще 15 минут. Затем к реакционной смеси медленно добавляли 12,8 г 1-фторнафталина и после того, как добавление завершалось, смесь нагревали и перемешивали в течение 2,5 часов при 60-65o. Смесь затем медленно выливали в 190 мл холодной воды, и pH доводили до 4,8 посредством добавления уксусной кислоты. Температуру смеси доводили до 25o, добавляли 75 мл гексана, и перемешивание продолжали в течение 10 минут. Слои затем разделяли, и водную фазу снова перемешивали с 75 мл гексана, и фазы разделяли. pH водной фазы доводили до 10,2 посредством добавления водного гидроксида натрия и добавляли 75 мл этилацетата. Эту смесь перемешивали при 25o в течение 15 минут, и двухфазную смесь фильтровали в вакууме через набивку фильтровального средства. Фазам фильтрата давали разделиться, и водную фазу экстрагировали 75 мл этилацетата. Экстракт смешивали с ранее полученным этилацетатным слоем, и эту смесь промывали 100 мл воды. Органический слой перемешивали при 25o и к нему добавляли по каплям 7 г 85% фосфорной кислоты. После того, как добавление завершилось, смесь перемешивали в течение еще 20 минут и затем охлаждали до 0oC и перемешивали 1 час при этой температуре. Суспензию затем фильтровали, и твердые вещества три раза промывали 20 мл порциями холодного этилацетата. Твердое вещество сушили при 60o, получая 24,19 г обозначенного в заголовке соединения в виде белого твердого вещества, с 98,1% содержанием активного вещества, предельным выходом 79,6% и экологической эффективностью 91%.
Методика анализа
Продукт анализировали посредством жидкостной хроматографии высокого разрешения, используя прибор Spectra Physics SP 8800, снабженный интегратором SP 4400 и детектором Spectroflow 757, установленный на 230 нм при чувствительности 0,5 абсорбционных единиц со временем установления фильтра 1 секунда. Колонка представляла собой Dupont Zorbax Rx C8, 4,6 мм х 25 см. Элюат представлял собой 70% ацетонитрила, 30% 0,01 М фосфатного буферного раствора при pH 6, скорость потока 1,0 мл/мин, объем пробы 20 микролитров. Образцы готовили, разбавляя 0,1 до 0,3 г реакционной смеси или экстракта до 50 мл смесью ацетонитрил:вода - 1:1: пик продукта выходит на 13-17 минутах; исходное вещество на 6-8 минутах; фторнафталин на 5-6 минутах; диметилcульфоксид на 2-3 минутах и бензоат калия на 2-2,5 минутах.
Когда необходимо было провести хиральный анализ, то же самое оборудование устанавливали на 280 нм и чувствительность 0,1 абсорбционной единицы и использовали колонку Chiralcel OD. Элюат для хиральных анализов представлял собой 2% изопропанола, 0,2% диэтиламина и 97,8% гексана. Использовали ту же самую пробу и параметры потока. Образцы готовили, разбавляя 0,1-0,3 г реакционной смеси или экстракта до 5 мл хлористым метиленом, промывая смесь при помощи около 5 мл воды и высушивая органическую фазу над сульфатом натрия. Получающийся раствор фильтровали и разбавляли элюатом до 25 мл. Целевой энантиомер выходит на 5-5,5 минутах, нежелательный энантиомер на 6-6,5 минутах, а фторнафталин на 3-4 минутах.
Приготовление 3
(+)-N-метил-3-(1-нафталинокси)-3-(2-тиенил)пропиламин гидрохлорид
Пять г продукта приготовления 2 перемешивали в смеси 40 мл толуола и 40 мл воды при 40o и добавляли 2,5 мл 30% раствора гидроксида аммония. Смесь перемешивали в течение 10 минут при постоянной температуре, и слои разделяли. Органическую фазу промывали водой, сушили сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме до половины объема и нагревали до 55o. Затем добавляли 0,16 г диизопропилэтиламина с последующим добавлением по каплям 2,39 г фенилхлорформиата. Смесь перемешивали при 55o в течение 1,25 часа и добавляли 50 мл 1% раствора бикарбоната натрия. Смесь перемешивали в точение 10 минут при 40-50o, и фазы разделяли. Органическую фазу дважды промывали 0,5 H соляной кислотой и затем промывали 1% раствором бикарбоната натрия. Промытую органическую фазу делили пополам, одну аликвоту испаряли в вакууме и к остатку добавляли 26 мл диметилсульфоксида. Смесь нагревали до 45o и по каплям добавляли 1 г гидроксида натрия и 6 мл воды. Основную смесь перемешивали в течение 18 часов при 50o, разбавляли 17 мл воды, подкисляли до pH 5,0-5,5 посредством добавления уксусной кислоты. Затем добавляли 20 мл гексана, смесь перемешивали в течение 10 минут, и фазы разделяли. Водную фазу делали щелочной до pH 10,5 посредством добавления 50% водного гидроксида натрия и добавляли 17 мл этилацетата. После перемешивания в течение 10 минут фазы разделяли, и водный слой экстрагировали еще 17 мл этилацетата. Смешанные органические экстракты промывали водой и концентрировали до 10 мл в вакууме. К остатку добавляли 0,46 г концентрированной соляной кислоты, затем затравочный кристалл и добавляли дополнительные 10 мл этилацетата. Смесь перемешивали в течение еще 30 минут, и раствор концентрировали в вакууме до 10 мл. Остаток перемешивали в течение 1 часа при комнатной температуре и 1 часа при 0o с получением суспензии, которую фильтровали. Твердое вещество промывали охлажденным этилацетатом, получая 1,32 г целевого продукта, который представлял собой далоксетин в виде белого твердого вещества с содержанием активного компонента 99,8%.
Болезнь и ее лечение
Способ настоящего изобретения используют для лечения и регулирования недержания мочи любого из типов, позывного или недержания при напряжении, или обоих типов у пациентов любого возраста, нуждающихся в таком лечения. Причина недержания мочи при напряжении, позывного или смешанного не является определяющей для успешного осуществления настоящего изобретения. Недержания, вызванные деградацией центральной нервной системы, периферической нервной системы, мышц мочевого пузыря или уретры и инфекции мочевого пузыря или уретры, все эффективно лечатся посредством способа настоящего изобретения.
Все типы недержания мочи, которые были вызваны или причиной которых явились активность мышц, интерстициальный цистит и ночной энурез или первичного, или вторичного типа, включаются или в недержание мочи при напряжении, или в позывное недержание и эффективно лечатся посредством способа настоящего изобретения. Более того, недержание мочи, вызванное тазовыми хирургическими операциями, анатомическими изменениями в геометрии мочевого пузыря и уретры, уретральной деградацией в результате прекращения выработки эстрогена и повышенной активности мочевого пузыря, все эффективно лечатся.
Последующими примерами биологических испытаний будет показано, что способ настоящего изобретения обладает удивительной способностью увеличивать эффективный объем мочевого пузыря и одновременно увеличивать сократительную способность и регулирование нервной системой мышц, которые управляют уретрой. Соответственно понятно, что настоящее изобретение регулирует как позывное недержание, увеличивая эффективный объем мочевого пузыря и снижая непроизвольную активность мышц вокруг мочевого пузыря, так и недержание мочи при напряжении, увеличивая сознательное регулирование уретрального сфинктера и улучшая тонус уретральной мускулатуры.
Соответственно способ настоящего изобретения осуществляют просто посредством введения снижающей недержание дозы соединения формулы I или венлафаксина пациенту, нуждающемуся в таком лечении. Эффективная доза непостоянна и всегда будет определяться лечащим пациента врачам. Кроме того, следует отметить, что может быть необходимым регулировать дозу соединения, когда его применяют в виде соли, такой, например, как лаурат, сольобразующая составляющая которой имеет значительный молекулярный вес. Однако, как правило, область эффективных доз составляет от около 1 до около 50 мг/день на пациента. Предпочтительная область дозы составляет от около 5 до около 20 мг/кг в день. Конечно, часто практикуется вводить дневную дозу лекарственного соединения частями в различные часы дня.
Способ введения соединения настоящего изобретения не является определяющим. Эти соединения абсорбируются из пищеварительного тракта и поэтому обычно предпочтительным является вводить их для удобства перорально. Однако их можно вводить любым фармацевтически приемлемым способом, если это желательно в конкретном случае.
Соединения настоящего изобретения обычно применяются в виде фармацевтических композиций, которые в сочетании с надлежащими инструкциями по применению композиции с тем, чтобы обеспечить лечение недержания, являются важными и новыми вариантами осуществления настоящего изобретения. Патенты, которые описывают соединения, также обсуждают фармацевтические композиции. Могут быть использованы все обычные типы фармацевтических композиций, включая таблетки, таблетки для жевания, капсулы, растворы, парентеральные растворы, суспензии, суппозитории и пастилки. Композиции обычно составляются таким образом, что они содержат дневную дозу или удобную часть дневной дозы в единице дозы, которая может представлять собой отдельную твердую форму, например таблетку, или может являться удобным объемом жидкости или полужидкости. Активность соединений не зависит от композиций, в которых они применяются, или от концентрации композиции и, таким образом, композиции выбираются и составляются единственно по причинам удобства и экономичности использования. Из любых соединений могут быть легко составлены таблетки, капсулы и т. п.; из водорастворимых солей этих соединений, очевидно, предпочтительным является готовить растворы, такие, например, как для инъекций.
Как правило, все композиции получают в соответствии со способами, обычными в фармацевтической химии. Ниже будет упомянута группа обычных составов композиций, но принципы подобных препаратов настолько хорошо известны, что подробное обсуждение не предусматривается.
Препарат 1
Твердые желатиновые капсулы готовят, используя следующие компоненты: - Количество - (мг/капсула)
Далоксетин гидрохлорид - 5
Крахмал, высушенный - 445
Стеарат магния - 10
Всего - 460 мг
Препарат 2
Таблетку получают, используя нижеследующие компоненты: - Количество - (мг/капсула)
(+)-N-метил-3-(1-нафталинокси)-3-(2-тиазолил)пропиламин оксалат - 10
Целлюлоза, микрокристаллическая - 640
Диоксид кремния, тонкоизмельченный - 10
Стеариновая кислота - 5
Всего - 665 мг
Компоненты смешивают и прессуют, получая таблетки, каждая весом 665 мг.
Препарат 3
Готовят аэрозольный раствор, содержащий следующие компоненты: - Вес
N-метил-3-[4-(трифторметил)фенокси] -3-(2-фуранил)пропиламин малеат - 0,25
Этанол - 29,75
22 (Хлордифторметан) - 70,00
Всего - 100,00
Активное соединение смешивают с этанолом, и смесь добавляют к части газа-вытеснителя 22, охлаждают до -30oC, и переносят в заполняющее устройство. Требуемое количество затем загружают в контейнер из нержавеющей стали и разбавляют оставшимся газом-вытеснителем. Контейнер затем снабжается клапанными элементами.
Препарат 4
Таблетки, каждая из которых содержит 20 мг активного компонента, готовят следующим образом:
N, N-диметил-3-(4-метил-1-нафталинокси)-3-(2-тиенил)пропиламин фосфат - 20 мг
Крахмал - 85 мг
Микрокристаллическая целлюлоза - 36 мг
Поливинилпирролидон (в виде 10% раствора в воде) - 4 мг
Натрий карбоксиметил крахмал - 4,5 мг
Стеарат магния - 0,5 мг
Тальк - 1 мг
Всего - 150 мг
Активный компонент, крахмал и целлюлозу пропускают через сито N 45 и тщательно смешивают. Водный раствор, содержащий поливинилпирролидон, смешивают с получающимся порошком, и смесь затем пропускают через сито N 14. Полученные таким образом гранулы сушат при 50o и пропускают через сито N 18. Натрий карбоксиметил крахмал, cтеарат магния и тальк, предварительно пропущенные через сито N 60, затем добавляют к гранулам, которые после смешивания прессуют в таблеточном устройстве, получая таблетки, каждая из которых весит 150 мг.
Препарат 5
(-)-N, N-диметил-3-(1-нафталинокси)-3-(циклогексил)-пропиламин оксалат - 6 мг
Крахмал - 134 мг
Микрокристаллическая целлюлоза - 59 мг
Стеарат магния - 2 мг
Всего - 200 мг
Активный компонент, целлюлозу, крахмал и стеарат магний смешивают, пропускают через сито N 45 и загружают в твердые желатиновые капсулы в количестве 200 мг.
Препарат 6
Суппозитории, каждый из которых содержат 10 мг активного компонента, получают следующим образом:
(+)-N-метил-3-(1/нафталинокси)-3-(3-пиридил)-пропиламин гидрохлорид - 10 мг
Насыщенные глицериды жирных кислот - 2000 мг
Всего - 2010 мг
Активный компонент пропускают через сито N 60 и суспендируют в насыщенных глицеридах жирных кислот, предварительно расплавленных с использованием минимального необходимого тепла. Смесь затем выливают в форму для суппозиториев номинальной емкостью 2 г и дают ей охладиться.
Препарат 7
Суспензии, каждая из которых содержит 10 мг активного компонента на 5 мл дозы, получают следующим образом:
N,N-диметил-3-(4-метоксифенокси)-3-(2-тиенил)-пропиламин цитрат - 10 мг
Натрий карбоксиметил целлюлоза - 50 мг
Сироп - 25 мг
Раствор бензойной кислоты - 0,10 мл
Отдушка - q.v.
Краситель - q.v.
Очищенная вода до общего количества - 5 мл
Активный компонент пропускают через сито N 45 и смешивают с натрий карбоксиметил целлюлозой и сиропом, получая мягкую пасту. Раствор бензойной кислоты, отдушку и краситель разбавляют частью воды и добавляют при перемешивании. Затем добавляют достаточно воды, чтобы получить требуемый объем.
Препарат 8
Внутривенный препарат может быть получен следующим образом:
(-)-N;N-Диметил-3-(4-хлорфенокси)-3-(4-хлор-2-тиенил)пропиламин сукцинат - 100 мг
Изотонический раствор - 1000 мг
Раствор вышеуказанных компонентов, как правило, вводят человеку внутривенно с дозой 1 мл в минуту.
Количество активного компонента, включенного в препарат настоящего изобретения, не является определяющим; только концентрация должна находиться в области, достаточной для того, чтобы позволить легкое введение препарата в количестве, которое доставит желаемое количество активного компонента.
Пример терапевтического действия
Здесь представлены испытания, показывающие значительное действие предпочтительного соединения при лечении как позывного недержания мочи, так и недержания при напряжении. Будет понятно, что представленные здесь результаты характеризуют достоинства настоящего изобретения в его полном объеме.
Семь кошек (2,5 - 3,5 кг) анестезировали альфа-хлоразолом (50-75 мг/кг внутривенно) с последующим наркозом изофлураном. Канюлю вводили в трахею. Один катетер вводили в сонную артерию для измерения общего кровяного давления, другой помещали в радиальную вену для впрыскивания лекарств.
Цистометрограммы (CMG) осуществляли через катетер (РЕ90), введенный через свод мочевого пузыря и используемый как для вливания солевого раствора, так и для регистрации внутрипузырного давления. EMG-электроды помещали в околомочеточниковую поперечно-полосатую мышцу. Скорости вливания CMG-изменяли от 0,3 мл/мин до 1 мл/мин для достижения сокращений мочеиспускания в пределах 10 минут от начального вливания. Сокращения мочеиспускания сопровождались высвобождением содержимого мочевого пузыря, которое измерялось посредством сбора жидкости в цилиндре, связанном с силовым датчиком. После достижения порога мочеиспускания вливание раствора продолжали, что приводило к ритмическим сокращениям мочевого пузыря при сохраняющихся высвобождениях его содержимого. В течение периода ритмической активности мочевого пузыря вводили далоксетин и отмечали его воздействие на ритмические сокращения. Через пять минут после введения далоксетина мочевой пузырь опустошали и осуществляли другую CMG.
У трех из семи кошек эфферентный подвод в мочевой пузырь активировали посредством электростимулирования тазового нерва квадратно-волновыми импульсами с параметрами 0,05 мс, 10 Гц, субмаксимальной интенсивностью (0,5-8 В) и регистрировали получающееся увеличение давления.
Далоксетин растворяли в 14% этаноле (10 мг/мл) и разбавляли солевым раствором, чтобы получить соответствующий дозовый инъекционный раствор в объеме 0,1-0,3 мл/кг, вводимый внутривенно. Празозин, антагонист α1 адренорецептора (Sigma, St. Louis, MO) растворяли в разбавленной HCl до концентрации 1 мг/мл и разбавляли солевым раствором до концентрации 0,1 мг/мл. LY 53857, 6-метил-1-(1-метилэтил)эрголин-8-карбоновую кислоту, 2-гидрокси-1-метилпропиловый эфир (Z)-2-бутендикарбоновой кислоты, антагонист рецептора 5НТ2 растворяли в солевом растворе при мягком перемешивании.
Далоксетин давал зависящие от дозы увеличения емкости мочевого пузыря у всех семи кошек, до около пятикратного увеличения, по сравнению с емкостью, наблюдаемой в контрольных условиях (фиг. 1, 2, 4 и 5). Дозы в 10 мг/кг (n = 3) полностью устраняли сокращения мочеиспускания (вливания прекращали после достижения тонусовой части в характеристике CMG, что указывало на то, что достигаются пределы эластичности мочевого пузыря). Увеличение емкости мочевого пузыря не сопровождалось изменениями амплитуды или продолжительности сокращений при достижении объемов порога мочеиспускания (фиг. 2, 3, 4 и 5). Аналогично, не наблюдалось увеличения в остаточном объеме мочевого пузыря (рассчитанном посредством вычитания количества высвобожденного содержимого из количества влитого). Далоксетин также уменьшал частоту сокращений мочеиспускания (20% контрольной частоты при 3 мг/кг) и пропорционально увеличивал количество мочи, высвобождаемой с каждым сокращением (в 5 раз при 3 мг/кг). Действие далоксетина на активность мочевого пузыря наблюдалось в течение 4 минут от его введения. Не наблюдалось действие далоксетина на сокращения мочевого пузыря, вызванные максимальным электростимулированием эфферентных волокон в тазовом нерве. LY 53857 (3 мг/кг, внутривенно) сам по себе или в сочетании с празозином (300 мкг/кг, внутривенно) не аннулировал действие далоксетина на активность мочевого пузыря.
В контрольных условиях (фиг. 3 и 5) наблюдалась очень незначительная EMG-активность околомочеточниковой мышцы во время фазы заполнения CMG.
В течение 4 минут от введения далоксетина наблюдалось зависящее от дозы увеличение в EMG-активности околомочеточниковой мышцы, регистрируемое во время ритмических сокращений мочевого пузыря, получаемых при помощи непрерывного вливания. Во время фазы заполнения CMG-активность возрастала (фиг. 2, 3, 4 и 5) до 8-кратных контрольных уровней при доза 0,3 мг/кг, причем более значительные дозы в среднем но оказывали большего воздействия. Активность также возрастала приблизительно в 8 раз за промежуток времени непосредственно после сокращения мочеиспускания. У 4 кошек, исходно демонстрирующих околомочеточниковую активность во время сокращений мочеиспускания, сохранялись скачкообразные периоды латентности (т.е. разрывные характеристики). У тех трех кошек, которые не проявляли уретральной EMG-активности во время сокращений мочевого пузыря в контрольных условиях, отмечалось заметное ингибирование околомочеточниковой активности сфинктера во время сокращений мочевого пузыря. Другими словами, у этих 3 последних кошек, несмотря на увеличение околомочеточниковой EMG-активности во время фазы заполнения CMG, сохранялся синергизм между сокращением мочевого пузыря и расслаблением сфинктера (фиг. 3).
У 4 из 6 кошек увеличение EMG-околомочиточниковой активности сфинктера полностью устранялось при помощи LY 53857 (100-300 мкг/кг, внутривенно), антагониста рецептора 5НТ2 (фиг. 4). У других 2 из 6 кошек LY 53857 (100 мкг/кг, внутривенно) снижал околомочеточниковую EMG-активность сфинктера до 50% и 33% от вызванных далоксетином уровней активности соответственно, а более значительные дозы (до 3 мг/кг) не давали дальнейшего уменьшения (фиг. 5). Последующее введение празозина (100 мкг/кг, внутривенно) не устраняло околомочеточниковой EMG-активности сфинктера (фиг. 5).
Результаты показывают, что далоксетин увеличивает емкость мочевого пузыря и околомочеточниковую (т.е. сфинктерную) активность поперечно-полосатых мышц.
Одновременно с увеличением околомочеточниковой EMG-активности далоксетин также ингибирует активность мочевого пузыря, увеличивая объем мочевого пузыря, необходимый для того, чтобы вызвать мочеиспускание. Хотя емкость увеличивалась, не наблюдалось воздействия на амплитуду или продолжительность сокращений после того, как они были инициированы. Это указывает на то, что далокcетин увеличивает порог чувствительности, необходимый для того, чтобы вызвать сокращение мочеиспускания, но не действует на двигательную реакцию сокращения после того, как пройден увеличенный порог мочеиспускания. Это открытие и, что более важно, обнаружение того, что отсутствовало действие далоксетина на сокращения мочевого пузыря, вызванные стимулированием периферических эфферентных нейритов тазового нерва, указывает на то, что ингибирующие воздействия далоксетина на активность мочевого пузыря осуществлялись через группу нервных клеток, выполняющих определенную функцию. Также важно отметить, что хотя далоксетин увеличивал уретральную активность сфинктера, сохранялось синергическое взаимодействие между сокращением мочевого пузыря и активностью сфинктера.
Увеличение емкости мочевого пузыря при помощи далоксетина указывает на полезность для лечения позывного недержания, тогда как увеличение тонизирующей околомочеточниковой EMG-активности сфинктера указывает на полезность для недержания мочи при напряжении. Поскольку в настоящее время нет единого эффективного лечения для обоих типов недержания мочи, подобное соединение представляет значительное медицинское преимущество для таких пациентов. Поскольку далоксетин не оказывал воздействия на величину сокращений мочевого пузыря после того, как достигнут порог мочеиспускания, мочеиспускание происходило настолько эффективно, насколько оно имело место до медикаментозного лечения, это является важным в свете того факта, что имеющиеся в настоящее время лекарства против недержания (в основном, антихолинергики) называют пониженную эффективность мочеиспускания и увеличения количества остаточной мочи из-за того, что подвергается опасности сократительная способность мочевого пузыря.
Изобретение относится к области медицины. Недержание мочи у людей лечат посредством применения венлафаксина или соединения, выбранного из ряда арилоксипропиламинов. Предложенное средство не имеет нежелательных побочных результатов. 8 з.п.ф-лы, 5 ил.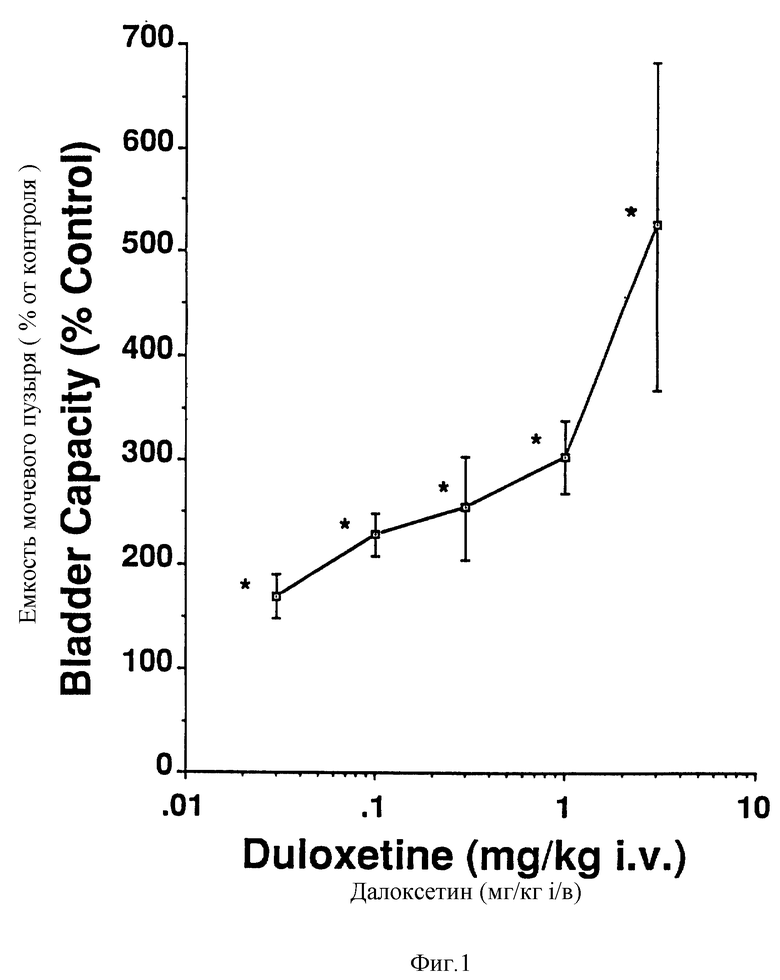
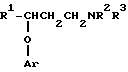
где R1 представляет собой С5 - С7 циклоалкил, тиенил, галотиенил, (С1 - С4 алкил)тиенил, фуранил, пиридил или тиазолил;
Ar представляет собой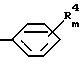
или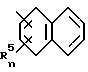
каждый из R2 и R3 независимо представляет собой водород или метил;
каждый R4 независимо представляет собой галоген, С1 - С4-алкил, С1 - С3-алкокси или трифторметил;
каждый R5 независимо представляет собой галоген, С1 - С4-алкил или трифторметил;
m составляет 0, 1 или 2;
n составляет 0 или 1,
или его фармацевтически приемлемой соли, полученной присоединением кислоты в качестве средства для лечения недержания мочи у человека.
| Способ получения четвертичной аммониевой соли D-(+)-1-(3-оксифенил)-2-аминопропана | 1977 |
|
SU973018A3 |
| US 4956388 A, 09.11.1990 | |||
| US 5236956 A, 17.08.1993 | |||
| DE 3912232 A1, 30.11.1988 | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| БУЯНОВ М.И | |||
| Основы психотерапии детей и подростков | |||
| - Киев, 1990, с | |||
| Заслонка для русской печи | 1919 |
|
SU145A1 |
Авторы
Даты
2000-07-20—Публикация
1994-11-23—Подача