Изобретение относится к области микробиологической и медицинской промышленности и может быть использовано для создания лекарств.
Создание высокоэффективного штамма-продуцента стафилокиназы позволит получить наиболее мощный, по сравнению с существующими фибрино- и тромболитическими аналогами, препарат, характеризующийся сильным сродством к фибрину, малой иммуногенностью, а также относительно дешевым способом биотехнологического производства на базе Escherichia coli.
Стафилокиназа (Sak) - белок, секретируемый некоторыми штаммами Staphylococcus aureus. Клинический интерес к этому бактериальному белку вызван благодаря его способности превращать плазминоген, неактивный профермент системы фибринолиза, в плазмин. В настоящее время стафилокиназа находится в процессе клинических испытаний, направленных на изучение механизма лизиса кровяного сгустка в лечении тромбоваскулярных заболеваний. В частности, ее использование распространяется на пациентов с острым инфарктом миокарда, периферической артериальной окклюзией и другими патологиями, сопровождающимися нарушением реологических и свертывающих свойств крови. Ряд клинических экспериментов убедительно продемонстрировал более высокое, чем у широко применяемых сегодня фибринолитических факторов (например, урокиназы, активатора плазминогена /t-PA/ или стрептокиназы), сродство к фибрину. Кроме того, в условиях пастеризации она более термостабильна, чем вышеуказанные аналоги, поэтому ее использование как фармацевтического препарата более чем оправдано.
В связи с вышеописанными свойствами стафилокиназы многими исследователями были разработаны штаммы-продуценты для наработки рекомбинантного аналога этого белка (ЕР 0077664, 1983; ЕР 052252, 1993; EP 0563385, 1992; ЕР 0721982, 1996: WO 93/13209; WO 95/27048; WO 96/21016).
Наиболее близкой по технической сущности и достигаемому результату является рекомбинантная ДНК, ее штамм-продуцент на базе E.coli, которые пригодны для промышленного получения стафилокиназы (ЕР 0077664, 1983).
Известная рекомбинантная ДНК содержит часть последовательности стафилокиназы и лидерный пептид и продуцируется на базе E.coli.
Однако использование неполной последовательности стафилокиназы может привести к ослаблению ферментативной активности Sak по отношению к плазминогену.
Задачей настоящего изобретения является создание рекомбинантной плазмидной ДНК, содержащей последовательность стафилокиназы, обладающей активностью, сходной с таковой у природного варианта этого белка и поддающейся несложному процессу выделения и очистки. Другой задачей изобретения является создание ее штамма-продуцента на базе E.coli.
Поставленная задача решается описываемой рекомбинантной плазмидной ДНК, содержащей полную последовательность стафилокиназы и лидерный пептид с блоком из шести гистидиновых остатков.
Поставленная задача решается также созданием штамма-продуцента SA9325.
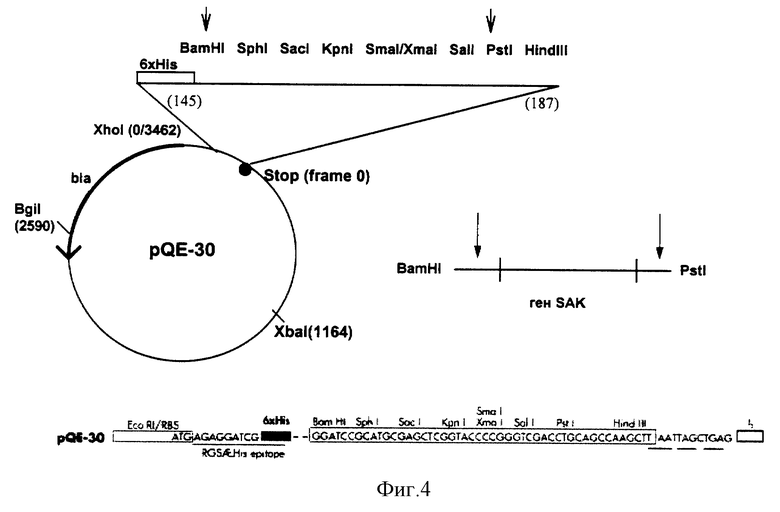
Для получения рекомбинантной ДНК был использован вектор pQE30.
Синтезированы праймеры, фланкирующие ген sak, содержащие сайты рестрикции эндонуклеаз, необходимых для клонирования последовательности синтезированного ампликона в составе выбранного вектора pQE30.
Методом полимеразной цепной реакции (ПЦР) с ДНК-матрицы отобранного штамма S. aureus на полученных праймерах синтезирован ампликон, несущий в своем составе ген sak.
Клонирована синтезированная последовательность гена sak в составе векторной плазмиды pQE30. Затем ДНК рекомбинантной плазмиды была трансформирована в клетки E.coli, и из полученных трансформантов был отобран клон, обладающий оптимальной стафилокиназной активностью. После этого в штамм - продуцент был введен ген - репрессор (lac 1) лактозного оперона, обеспечивающий в данной системе индуцибельность синтеза клонированного белка.
В результате был получен вариант гибридного белка, содержащий лидерную последовательность с блоком из 6 гистидиновых остатков и последовательность гена Sak, кодирующего полную стафилокиназу (фиг. 1).
Пространственная структура стафилокиназы приведена на фиг. 2.
Пример реализации изобретения
Синтез ампликонов sak-гена
Из базы данных Entez извлечены 10 последовательностей гена стафилокиназы как хромосомного, так и фагового происхождения. Четыре из них содержали также последовательности прилегающих регионов.
Все 10 полученных последовательностей были обработаны в программе DNASIS для оценки консервативности изучаемой области. Степень гомологии всех интересующих участков оказалась весьма высокой и не зависела от источника гена (хромосома или ДНК конвертирующего фага). Высокая степень гомологии нуклеотидных последовательностей гена sak и прилегающих регионов свидетельствует о консервативности данного участка генома, следовательно для получения клонируемого гена мог быть использован метод ПЦР.
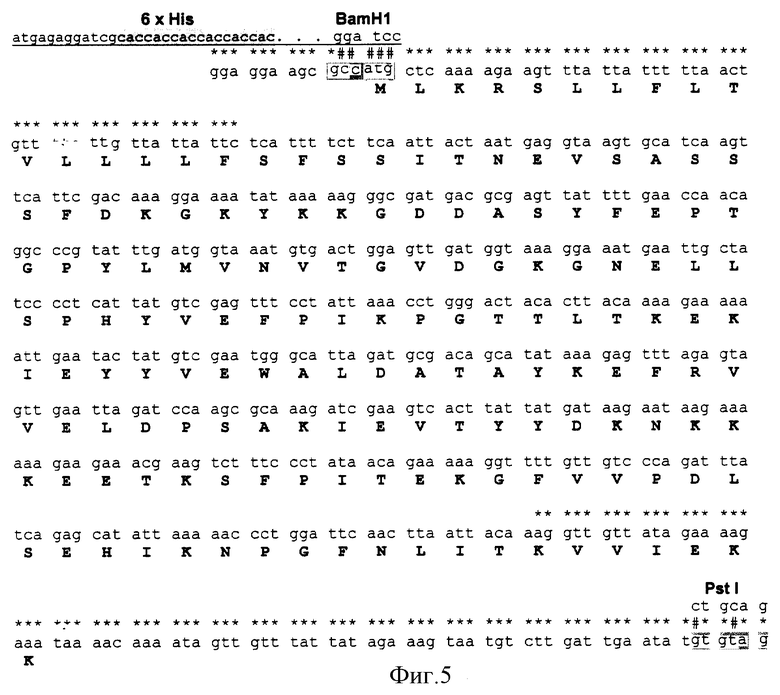
На основании этих данных провели расчет оптимальных последовательностей ДНК, фланкирующих ген sak, которые могли быть использованы в качестве праймеров, для будущего синтеза ампликона. Для каждого из праймеров (правого и левого от гена) рассчитали оптимальные "замены" нуклеотидов для введения сайтов рестрикции, необходимых для клонирования ампликона в плазмиду pQE30 (см. табл. А).
Как видно из фиг. 3, замена 5 нуклеотидов в "левом" праймере обеспечивает появление сайта рестрикции для эндонуклеазы BamHI, а замена 2-х у "правого" - для эндонуклеазы Pst1. Выбор этих рестриктаз обусловлен наличием сайтов их рестрикции в полилинкере векторной плазмиды pQE30. Эти праймеры были синтезированы ПЦР.
Полимеразную цепную реакцию проводили в стандартном буфере: 50 mM KCl, 10 mM Tris-HCI, pH 9,0, 2,5 mM MgCl2.
ПЦР проводили с использованием в качестве матрицы гена sac ДНК шести штаммов S. aureus, которые обладали стафилокиназной активностью. В качестве отрицательного контроля использовали хромосомную ДНК E.coli. Хромосомную ДНК выделяли, как описано в Silhavy et al., 1984, Cold Spring Harbor, NY.
Постановка реакции. Для большей специфичности реакции использовался примитивный "горячий старт": добавление Taq- полимеразы (в половине объема буфера с MgCl2) в прогретые до 95oC пробирки с остальными компонентами реакционной смеси (содержавшей по 10 пМоль каждого праймера, 9 мкл буфера, по 25 мкМ каждого дезоксирибонуклеотида и 5 мкл ДНК Staphylococcus aureus). Фрагмент ожидаемой длины обнаружен во всех пробах, кроме контрольной, содержавшей ДНК E.coli.
Далее в работе использовали все полученные ампликоны гена sak.
Клонирование sak-гена в мультикопийном векторе под сильным промотором.
Рестрикцию и лигирование ДНК ампликонов и ДНК вектора проводили стандартными методами (Т.Маниатис, 1984). Схема конструирования рекомбинантной плазмиды представлена на фиг. 4.
Полученными лигированными смесями, содержащими ДНК рекомбинантной плазмиды, трансформировали клетки штамма хозяина E.coli SG13009.
Используемая система предусматривает, что реципиентный штамм SG13009 (NalS StrS rifS, lac- ara- gal- mtl- F- recA+ uvr+) должен содержать плазмиду pREP4, несущую ген репрессора лактозного оперона - lacl и маркер устойчивости к канамицину (ген - kan). Продукт этого гена подавляет работу промотора, под контролем которого в составе мультикопийного вектора pQE30 будет находится клонированный ген. Эффект репрессии обусловлен тем, что промоторная область pQE30 помимо промотора фага Т5 несет две lac-операторные последовательности, являющиеся объектом действия белка-репрессора Lacl. Действие репрессора в индуцибельных системах снимается работой индуктора, которым, в данном случае, может быть лактоза или ИПТГ.
Используемая система обеспечивает высокий уровень синтеза белков. Кроме того, нуклеотидная последовательность плазмиды pQE30 содержит дополнительные кодоны для синтеза в составе продуцируемой белковой молекулы 6-й дополнительных гистидинов (His). Вектор pQE30 содержит в своем составе маркер для селекции - ген bla, кодирующий устойчивость к ампициллину (ApR).
Получение штамма-продуцента
На первом этапе работы для трансформации использовали штамм E.coli GC13009 без плазмиды, кодирующей репрессор. Условия конститутивного синтеза белков облегчают отбор клонов Sac+.
Трансформацию проводили следующим методом: клетки штамма хозяина SG13009 выращивали до ранней log фазы в L-бульоне (см. Дж.Миллер 1976), затем осаждали центрифугированием при 1 тыс. оборотов в течение 10 минут при 4oC, ресуспендировали в 1/10 объема буфера TSB (L-бульон pH 6,1 с 10% ПЭГ мол. веса 3,350, 5% DMSO и 20 mM Mg+2 (10 mM MgCl2 + 10 mM MgSO4) и инкубировали 2 часа во льду при 4oC, затем компетентную культуру разливали по 0,1 мл и хранили при -70oC.
По мере необходимости компетентную культуру использовали следующим образом. К 0,1 мл культуры добавляли необходимое количество лигированной смеси или плазмидной ДНК и смесь инкубировали на ледяной бане при 4oC 5-30 мин. Далее добавляли 0,9 мл TSB с 20 mM глюкозы и инкубировали при 37oC в течение часа, затем высевали на чашки с селективной средой: L - agar, содержащий 50 мкг/мл ампициллина.
Через сутки инкубации выросшие ApR (ампициллинрезистентные) клоны были однократно расчищены на селективной среде и подвергнуты дальнейшему анализу.
Анализ трансформантов
Полученные трансформанты проверили на стафилокиназную активность (Sak+). Для этого ночные культуры исследуемых клонов, выращенные в питательном бульоне при 37oC, наносили на плотный питательный агар в виде капельных рассевов и инкубировали в течение ночи. Поскольку литературные данные свидетельствуют, что белок, кодируемый геном sak, в клетках E.coli находится в основном в периплазме клеток (T.Sako, Eur. J. Biochem. 14. 557-563, 1985), чашки Петри с выросшими "каплями" обработали парами хлороформа для увеличения проницаемости мембран бактерий. Далее, лизированные клетки методом реплик переносили на питательный агар, содержащий 30% плазмы крови человека (плазму перед добавлением в агар выдерживали 20 минут при 56oC). Для контроля таким же образом на агар, содержащий плазму, нанесли суспензии клеток, не обработанные парами хлороформа. После суток инкубации сделанных рассевов установлено, что часть исследуемых клонов трансформантов как обработанных, так и необработанных (т.е. живых) образовала вокруг капельного рассева зоны лизиса. Этот положительный сигнал свидетельствовал о том, что трансформанты унаследовали интактную копию гена sak, кодирующую активную форму стафилокиназы (белка плазминогенактиватора). Этот факт свидетельствует о том, что часть белка стафилокиназы выводится клетками штамма E.coli SG13009 во внешнюю среду. В связи с этим, дальнейшая проверка у исследуемых клонов фенотипа Sak осуществлялась на живых, не обработанных парами хлороформа клетках кишечной палочки.
Для количественного сравнения белка в периплазме и супернатанте три из полученных трансформантов были выращены в жидкой питательной среде с необходимыми контролями S.aureus и E.coli 13009. Клетки осаждали центрифугированием, а полученный надосадок использовали для количественного определения белка. Кроме того, из суспензии ресуспендированных клеток получали препараты периплазматической фракции, которую так же исследовали на наличие белка (процедуру см. ниже). На высушенном препарате в SDS/PAGE были выявлены четкие полосы рекомбинантного белка в периплазматической фракции на дорожках 7,8,9. В супернатантах дорожки 1,2,3 белок практически не определяется. На дорожках 4,5 - супернатанты S.aureus, 6 - контрольный штамм E.coli/pQE30, 10,11 - периплазматическая фракция S.aureus, 12 - периплазматическая фракция E.coli/pQE30.
По результатам анализа для дальнейшей работы был отобран 1 клон, который показал максимальную зону лизиса.
Для дополнительной проверки полученных результатов (т.е. того факта, что зоны лизиса, образованные живыми растущими клетками, действительно образуются за счет частичного вывода белка Sak во внешнюю среду) в жидкой питательной среде вырастили клетки: исходного клинического изолята S.aureus, ДНК которого послужила матрицей для синтеза ампликона, штамма E.coli - хозяина вектора pQE30 и отобранного штамма- трансформанта, содержащего рекомбинантную плазмиду с клонированным геном sak. В этом эксперименте мы определили активности стафилокиназы в супернатантах и в периплазматической фракции клеток, которую получали после процедуры осмотического шока (T.Sako, 1985). Было установлено, что клетки штамма-продуцента SA9-32 (это название получил отобранный клон) действительно частично продуцируют активный белок во внешнюю среду. В результате экспериментов были четко видны зоны лизиса, образующиеся от растущих клеток исходного S.aureus и от клеток штамма-продуцента SA9-32.
Для количественной оценки рекомбинантного белка, содержащегося в периплазматической фракции исследуемого штамма, использовали программу MClCD - М4 (v 3.0 - Rev5) фирмы "Imaging research Inc".
Было установлено, что количество определяемого белка составляет 20-26% от общего количества белков в клетках. Количественный разброс можно объяснить различной плотностью выросших суспензий клеток.
Созданная нами система работает в условиях конститутивного синтеза белка. Для создания системы индуцибельного синтеза плазмидная ДНК (pQE30) штамма продуцента SA9-32 была трансформирована в клетки реципиентного штамма E. coli SG13009, несущего плазмиду pREP4 с геном lacl, кодирующим белок-репрессор лактозного оперона (как описано выше).
Четыре из полученных трансформантов, отобранных на среде с канамицином (маркер плазмиды pREP4) и ампициллином, были проверены на стафилокиназную активность в условиях присутствия и отсутствия индуктора (ИПТГ). Эти клоны были выращены в жидкой питательной среде, содержащей оба антибиотика. Затем пересеяны в ту же среду 1:10 и подрощены в течение 2-х часов, далее каждую пробу делили на две равные части и в одну из них добавляли ИПТГ в концентрации 5•10-4 и подращивали еще 1,5 - 2 часа при 37oC. Выросшие суспензии наносили на питательный агар с антибиотиками, содержащий плазму человеческой крови. Все исследуемые клоны, выращенные с индуктором, образуют зоны лизиса, что свидетельствует о наличии активного белка стафилокиназы. В то же время клоны, выращенные в отсутствии ИПТГ, не образуют зон лизиса, т.е. не продуцируют стафилокиназу.
Полученный штамм-продуцент Escherichia coli характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. На arape "Дифко" клетки образуют круглые гладкие колонии с ровными краями. При росте в жидкой питательной среде образуют интенсивную ровную муть.
Физико-химические признаки. Клетки растут в температурном диапазоне от 8o до 40oC, оптимум pH 7,4. В качестве источников азота, углерода и других необходимых компонентов используются минеральные соли, казеин, пептон, дрожжевой автолизат и т.д.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к канамицину и ампициллину.
Полученный штамм проверен на стабильное сохранение плазмид pQE30 и pREP4. Показано, что плазмида pQE30 стабильно наследуется в клетках штамма SG13009, а плазмида pREP4 в отсутствии селективного давления (канамицина в среде) теряется за один пассаж в 98% случаев. Следовательно, для стабильного сохранения индуцибельной системы необходимо выращивать культуру в присутствии антибиотика канамицина в концентрации 20-25 мкг/мл.
Таким образом, получен штамм-продуцент гибридного белка, обладающего стафилокиназной активностью и названный нами E.coli SA9325.
В соответствии с вышеизложенным предложенное изобретение решило задачу создания рекомбинантной ДНК, кодирующей белок, обладающей стафилокиназной активностью, который может быть легко выделен с использованием металлхелатирующей аффинной хроматографии из-за наличия 6 гистидинов в лидерной части. Кодирующая последовательность стафилокиназы приведена на фиг. 5.
Кроме того, изобретением решена задача создания штамма-продуцента стафилокиназы E.coli SA9325, позволяющего получить 20- 26% рекомбинантного белка по отношению к общему количеству белков.



Изобретение относится к области микробиологической и медицинской промышленности и может быть использовано для создания лекарств, в частности для создания рекомбинантных форм стафилокиназы. Предложена рекомбинантная ДНК, содержащая полную последовательность стафилокиназы и лидерный пептид с блоком из 6 гистидиновых остатков. Штамм Е. coli SA 9325 - продуцент рекомбинантного белка, содержащего полную последовательность стафилокиназы из S.aureus. Изобретение позволяет получить высокоактивный белок, обладающий фибринолитической активностью. Выход рекомбинантного белка составил 20-26% от общего количества белков. 2 с.п.ф-лы, 5 ил., 1 табл.
| US 4532211 А, 30.07.1985 | |||
| EP 0721982 А1, 17.07.1996 | |||
| WO 9621016 А2, 11.07.1996. |
Авторы
Даты
2000-09-20—Публикация
1999-02-03—Подача