Настоящая заявка представляет собой частично продолжающуюся заявку от родственной заявки на Патент США, серийный N 487984 от 5.02.1990, каковая в свою очередь является частично продолжающейся заявкой на Патент США, серийный N 533933 от 5.06.1990. Обе заявки упомянуты здесь для сведения.
Область техники, к которой относится изобретение
Настоящее изобретение относится, в основном, к оксипуриновым нуклеозидам, включая гуанозин, дезоксигуанозин, инозин, ксантозин, дезоксиксантозин и дезоксиинозин, к родственным этим нуклеозидам соединениям и к ацильным производным этих нуклеозидов и родственных им соединений, а также к использованию этих соединений в профилактических и терапевтических целях. Настоящее изобретение относится также к назначению этих соединений отдельно или в комбинациях с неионогенными поверхностно-активными веществами или другими агентами или без них, животным. Настоящие соединения способны изменять гемопоэз у нормальных здоровых животных и у животных с нарушенным или недостаточным гемопоэзом в результате облучения, химиотерапии, отравления, заболевания или т.п. Соединения по изобретению улучшают также лейкоцитную иммунную защиту организма против инфекций.
Характеристика аналогов изобретения
Основным осложнением в результате химиотерапии рака, антивирусной химиотерапии или облучения ионизирующим излучением является разрушение клеток костного мозга или подавление их функций. В частности, химиотерапия и облучение ионизирующим излучением разрушают или уничтожают гемопоэтические (кровотворные) родоначальные клетки, находящиеся, главным образом, в костном мозге и селезенке, что нарушает продуцирование новых клеток крови (гранулоцитов, лимфоцитов, эритроцитов, моноцитов, тромбоцитов и т.п.). Лечение раковых больных с помощью циклофосфамидов или 5-фторурацила, например, разрушает лейкоциты (лимфоциты и/или гранулоциты) и может привести к повышенной подверженности пациента инфекционным заболеваниям. Многие раковые больные умирают от инфекционных заболеваний или других последствий нарушения гемопоэза в результате химиотерапии или лучевой терапии. Химиотерапия может привести и к ненормальному образованию тромбоцитов, из-за чего возникает предрасположенность к кровотечениям. Аналогичным образом, отравление горчичным газом приводит к нарушению гемопоэза, увеличивая подверженность инфекционным заболеваниям. Подавление продуцирования эритроцитов может привести к анемии. Неспособность выживающих клеток ствола костного мозга к достаточно быстрым пролиферированию и дифференцировке (в результате чего не успевают возобновляться популяции лейкоцитов) приводит к неспособности животного противостоять патогенным инфекционным организмам. Различные болезненные состояния, такие как нейтропения, включая идиопатические формы, также связаны с нарушением отдельных компонентов системы гемопоэза.
Соединения, которые улучшают гемопоэз или способствуют его восстановлению после нарушения или подавления функционирования костного мозга в результате химиотерапии, лучевой терапии, заболеваний или других патологических состояний, связанных с недостаточным гемопоэзом, являются очень нужными терапевтическими и профилактическими средствами.
Известно несколько полипептидных гемопоэтических факторов (продуцируемых, преимущественно, посредством технологии рекомбинантных ДНК). Описано использование этих гемопоэтических факторов, которые включают эритропоэтин (ЭПО), интерлейкины (особенно Интерлейкин-1, Интерлейкин-3 и Интерлейкин-6) и факторы, стимулирующие рост колоний (такие как фактор, стимулирующий рост колоний гранулоцитов, фактор, стимулирующий рост колоний гранулоцитов/макрофагов, или фактор, стимулирующий рост колоний клеток ствола мозга), для улучшения гамопоэза. Некоторые вещества, определяемые широким термином "модификаторы биологических реакций" (МБРы), тоже могут повышать некоторые показатели гемопоэза, МБРы, изменяющие гемопоэз, включают такие вещества, как бактериальный эндотоксин, двухцепочную РНК, азимексон, глюканы и другие дрожжевые и бактериальные полисахариды, сульфат декстрана, полианион дивинилового эфира малеиновой кислоты (МВЭ2), и факторы, вызывающие некроз опухоли.
Д. В. Беннет и А.Н. Друри J. PHYSIOl 72:288 (1931) описали, как назначение кроликам 100 мг гуанозина, вводимого путем интраперитональной инъекции, привело к интенсивному снижению количества лейкоцитов. Начальные уровни содержания лейкоцитов составляли 7700 на мм3, но после назначения гуанозина количество лейкоцитов упало до 500 - 1000 на мм3. Через 10 часов и в течение последующих 24 часов наблюдался лейкоцитоз (11000 на мм3).
Д. Г. Райт "BLOOD", 69: 334-337 (1987) описал воздействие гуанозина и гуанина на культуры специфически-человеской линии лейкозных клеток костного мозга (HL-60). Преобразование незрелых бластнохных клеток в зрелые in vitro вызывали различные химические вещества (включая ретиновую кислоту, диметилформамид и тиазофурин). Инкубация клеток HL-60 с гуанином или гаунизином предотвращала их вынужденное созревание в функциональные нейтрофилы; инкубация с инозином не влияла на вынужденное созревание.
В работе А. К. Ошита и др. "BLOOD" 49:585-591 (1977) высказано предположение о том, что циклические нуклеотиды (напр., 3',5'-цикло-аденозин-монофосфат (ЦАМФ) или 3',5'-цикло-гуанозин-монофосфат (ЦГМФ)) могут участвовать в регулировании клеточной пролиферации. В культуре клеток костного мозга мыши ЦГМФ дал увеличение числа колоний, образовавшихся под стимулирующим влиянием сыворотки крови, взятой у мышей, которым был введен эндотоксин. В отсутствие пост-эндотоксинной сыворотки крови ЦГМФ не оказал никакого влияния, 5'-гуанозин-монофосфат и ЦАМФ активности не проявили.
В работе Белянского и др., CANCER TREAT. REP. 67:611-619 (1983) описано, как частичный гидролиз рибосомной РНК E. coli давал короткие (приблизительно с 40 основаниями) олигонуклеотиды, которые обладали некоторой лейкопоэтической активностью в организмах кроликов, которым был введен циклофосфамид. Авторы предположили, что олигонуклеотиды действовали в качестве праймеров репликации в процессе синтеза ДНК в клетках костного мозга. Они сообщили также, что полирибонуклеотиды: полигуанозин-монофосфат, полиаденозин-монофосфат и нуклеотиды сополимера аденина и гуанина не стимулировали образование лейкоцитов.
В работе Т. Сугахара и др., "Вrookhaven Symposia in Biology" 284-302 (1968) сообщается, что гидролизат дрожжевой РНК, смеси аденозина, цитидина, гуанозина, уридина и их соответствующих 3'-рибонуклеозид-монофосфатов не повышали выживаемость после облучения летательными дозами ионизирующего излучения. Соединения повышали выживаемость мышей, только когда их вводили периодически в процессе повторного облучения сублетальными дозами гамма-излучения. Авторы утверждают, что лекарственные препараты не улучшали пролиферацию или дифференцировку выживавших клеток столба мозга, но продляли жизнь поврежденных зрелых клеток. Гидролизат, рибонуклеозиды и рибонуклеозид-монофосфаты снижали число клеток, содержащих ядра, и число колоний гемопоэтических клеток (элементов, образующих колонии) в селезенке и в костном мозге (основных участках гемопоэза) по сравнению с облученными контрольными мышами, не подвергавшимися лечению.
В работе Гудмана и др. (Патенты США N 4539205, 4849411 и 4643992) описано использование производных альдозил-гуанина, имеющих заместители, которые обладают более сильной способностью забирать электроны, чем атом водорода в 8 положении гуанинового фрагмента, благодаря чему регулируется иммунная реакция.
Были синтезированы некоторые ацильные производные оксипуриновых нуклеозидов, предназначенные для использования в качестве защищенных интермедиатов в процессе синтеза олигонуклеотидов или аналогов нуклеозидов или нуклеотидов. См. каталог 1991 г. SIGMA CHEMICAL COMPANY, стр. 1702-1704.
В работе У. А. Флеминга и Т.А. МакНейла, "J. Cell PHYSIOl", 88:323-330 (1976) сообщается о том, что неионогенные поверхностно-активные соединения "Полисорбейт 80" и "Сапонин" повышают реактивность клеток костного мозга в культуре к действию суб-оптимальных количеств факторов, стимулирующих колонии. ПАВ проявляли активность только в пределах определенных концентраций, причем максимальная активность наблюдалась при концентрации в 10 нг/мл, а минимальная - при концентрациях в десять раз больше или в десять раз меньше. Влияние ПАВ на гемопоэз in vivo изучено не было.
Цели настоящего изобретения
Основной целью настоящего изобретения является создать семейство соединений, которые эффективно усиливают или другим образом изменяют гемопоэз. Назначение таких соединений животным до, в течение или после нанесения ущерба гемопоэтической системе позволяет предотвратить или излечить гемопоэтические нарушения.
Целью настоящего изобретения является также создать семейство соединений для лечения широкого спектра гемопоэтических нарушений и других патологических состояний с низким числом клеток крови.
Целью настоящего изобретения является также создать семейство соединений, улучшающих иммунную защиту организма от инфекций посредством лейкоцитов.
Целью настоящего изобретения является также создать соединения, которые могут изменять гемопоэз и которые могут назначаться перорально или парентерально.
Краткое изложение изобретения
Эти и другие цели изобретения достигаются посредством оксипуриновых нуклеозидов, таких как гуанозин, инозин, ксантозин, дезоксиксантозин, дезоксиинозин и дезоксигуанозин, посредством родственных таким оксипуриновым нуклеозидам соединений, а также посредством ацильных производных таких оксипуриновых нуклеозидов и родственных соединений, которые могут назначаться животным, включая млекопитающих, таких как человек. Назначение таких соединений отдельно или в комбинации помогает изменять гепопоэз у животных.
Так, соединения по настоящему изобретению, применяемые отдельно или в комбинациях, помогают излечивать нарушения гемопоэза, вызванные облучением или химиотерапией; в качестве вспомогательных средств могут использоваться в процессе химиотерапии рака или вирусных инфекций; они помогают повысить иммунную защиту организма, связанную с лейкоцитами, против инфекций; они могут быть использованы в процессе лечения других патологических состояний.
Важным аспектом настоящего изобретения является открытие того, что оксипуриновые нуклеозиды, такие как гуанозин, дезоксигуанозин, инозин, ксантозин, дезоксиксантозин и дезоксиинозин, родственные им нуклеозиды и ацильные производные таких нуклеозидов и родственных им соединений, обладают не предполагавшимися ранее терапевтическими свойствами.
Изобретение включает также открытие, которое состоит в том, что поверхностно-активные соединения, назначаемые in vivo, могут повышать эффективность стимуляторов гемопоэза, включая соединения по изобретению, эритропоэтин, факторы, стимулирующие колонии или интерлейкины и другие.
Соединения по настоящему изобретению
Во всех случаях, за исключением специально оговоренных, буквы или буквы с дополнительными обозначениями, являющиеся символами переменных заместителей в химических формулах соединений по изобретению, применяются только в отношении формулы, непосредственно предшествующей данному символу.
Соединения, применимые для изменения гемопоэза, выражаются следующей формулой: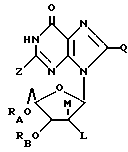
где RA = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода,
RB = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода,
Z = H, OH, =O или NHRC, где RC = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода,
L = H или ORD, где RD = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода,
M = H или ORE, где RE = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода, при условии, что по меньшей мере один из радикалов L и M является H,
Q = H, галоген, NHRF, где RF является H или ацильным или алкильным радикалом с 1 - 10 атомами углерода, S, связанная с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, затем к этому азоту присоединяется какой-либо H, S RG, где RG - H или ацильный или алкильный радикал с 1 - 10 атомами углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, и желательно, чтобы в альдозном фрагменте между положениями 2' и 3' присутствовала связь C - C.
Новые композиции по изобретению включают вышеуказанные соединения (возможно, в качестве фармацевтически приемлемых солей), в которых по меньшей мере один из радикалов RA, RB, RC, RD или RE не является H, и в тех соединениях, где Z представляет собой NH2 или NHRC, Q представляет собой H или NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, а также фармацевтически-примемлемый носитель.
Гуанозин, родственные ему соединения, а также его ацильные производные выражаются общей формулой (I):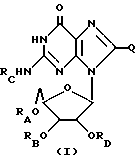
где RA, RB, RC и RD имеют одинаковые или различные значения и каждый представляет собой водород (H) или ацильный радикал, и Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, или фармацевтически приемлемая соль этого соединения.
Инозин, родственные ему соединения, а также его ацильные производные выражаются общей формулой (II):
где RA, RB и RD имеют одинаковые или различные значения и каждый представляет собой H или ацильный радикал, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода,
или фармацевтически приемлемая соль этого соединения.
Ксантозин, родственные ему соединения и его ацильные производные выражаются общей формулой (III):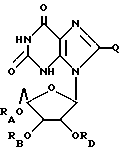
где RA, RB, и RD имеют одинаковые или различные значения, каждое из которых представляет собой H или ацильный радикал, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, или фармацевтически приемлемая соль этого соединения.
Дезоксинозин, родственные ему соединения и его ацильные производные выражаются общей формулой (IV):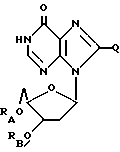
где RA и RB имеют одинаковые или различные значения, каждое из которых представляет собой H или ацильный радикал, а
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, или фармацевтически приемлемая соль этого соединения.
Дезоксигуанозин, родственные ему соединения и его ацильные производные выражаются общей формулой (V):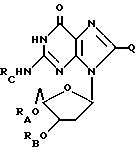
где RA, RB и RC имеют одинаковые или различные значения, каждое из которых представляет собой водород (H) или ацильный радикал, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода,
или фармацевтически приемлемая соль этого соединения.
Дезоксиксантозин, родственные ему соединения и его ацильные производные выражаются общей формулой (VI):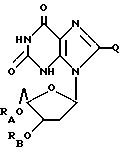
где RA и RB имеют одинаковые или различные значения, каждое из которых представляет собой H или ацильный радикал, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода,
или фармацевтически приемлемая соль этого соединения.
Инозин 2', 3'-(ациклический)диалкоголь, родственные ему соединения и его ацильные производные выражаются общей формулой (VII):
где RA, RB и RD имеют одинаковые или различные значения, каждое из которых представляет собой H или ацильный радикал, а Z представляет собой H, OH, =O или NHRC, где RC = H или ацильный радикал карбоновой кислоты с 2 - 30 атомами углерода, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода, =O или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода.
или фармацевтически приемлемая соль этого соединения.
В отношении эффективности и безопасности желательными являются следующие классы новых производных соединений по настоящему изобретению:
(1) ацильные производные гуанозина или его родственных соединений формулы: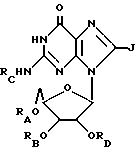
где RA, RB и RD имеют одинаковые или различные значения, каковые представляют собой водород или ацильную группу, получаемую путем замещения
a. жирной кислоты с неразветвленной цепью, с 6 - 22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3 - 22 атомами углерода,
d. циклоалкильной карбоновой кислоты, содержащей 4 - 22 атома углерода,
при условии, что не все радикалы RA, RB и RD являются водородом;
RC представляет собой водород или ацильную группу, получаемую путем замещения
i. жирной кислоты с неразветвленной цепью, с 3 - 22 атомами углерода,
ii. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
iii. дикарбоновой кислоты с 3 - 22 атомами углерода,
iv. циклоалкильной карбоновой кислоты, содержащей 4 - 22 атома углерода,
v. никотиновой кислоты или
vi. замещенной или незамещенной карбоновой кислоты с 7 - 22 атомами углерода, и
J = H или NHRI, где RI представляет собой H или ацильный или алкильный радикал, содержащий 1 - 10 атомов углерода;
(2) ацильные производные инозина или родственных ему соединений формулы: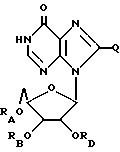
где RA представляет собой водород или ацильную группу, полученную путем замещения
a. жирной кислоты с неразветвленной цепью, с 3 - 22 атомами углерода,
b. дикарбоновой кислоты с 3 - 22 атомами углерода,
c. никотиновой кислоты,
d. циклоалкильной карбоновой кислоты, содержащей 4 - 22 атомов углерода;
где RB и/или RD представляет собой водород или ацильную группу, полученную путем замещения
a. жирной кислоты с неразветвленной цепью, с 3 - 22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3 - 22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкильной карбоновой кислоты с 4 - 22 атомами углерода, при условии, что не все значения радикалов RA, RB и RD представляют собой водород и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанную двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG - H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H,
или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(3) ацильные производные ксантозина или его родственных соединений формулы: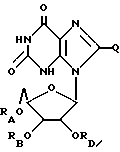
где RА, RB и RD имеют одинаковые или различные значения и являются водородом или ацильной группой, полученной путем замещения
а. жирной кислоты с неразветвленной цепью, с 3-33 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
с. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты или
e. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода, при условии, что не все радикалы RA, RB и RD являются водородом и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанную двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG - H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(4) ацильные производные дезоксинозина или родственных ему соединений формулы: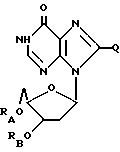
где RA и RB имеют одинаковые или разные значения, каждое из которых представляет собой водород или ацильную группу, полученную путем замещения
a. жирной кислоты с неразветвленной цепью, с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты, с 4-22 атомами углерода, при условии, что по меньшей мере один из RA и RB не является H, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал с 1-10 атомами углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG - H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или CRH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(5) ацильные производные дезоксигуанозина или родственных ему соединений формулы: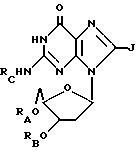
где RA, RB и RC могут иметь одинаковые или разные значения, каждое из которых водород или ацильная группа, полученная путем замещения
a. жирной кислоты с неразветвленной цепью, с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин, фенилаланин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. циклоалкилкарбоновой кислоты с 4-22 атомами углерода,
e. никотиновой кислоты
при условии, что не все радикалы RA, RB и RC являются водородом; если RC не является H, тогда RA и/или RB могут представлять собой также ацетил и
J = H или NHRI, где RI представляет собой H или ацильный или алкильный радикал с 1-10 атомами углерода;
(6) ацильные производные дезоксиксантозина или родственных ему соединений формулы: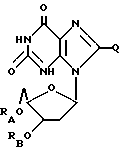
где RA и RB имеют одинаковые или различные значения водорода или ацильной группы, полученной путем замещения
a. жирной кислоты с неразветвленной цепью, с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты или
e. циклоалкилкарбоновой кислоты с 4-22 атомами углерода, при условии, что по меньшей мере один из RA и RB не является водородом и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG - H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(7) ацильные производные инозин (ациклический) 2',3' диалкоголь или родственные ему соединения формулы: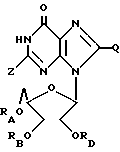
где RA, RB и RC имеют одинаковые или различные значения водорода или ацильной группы, полученной путем замещения
a. жирной кислоты с неразветвленной цепью, с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты с 4-22 атомами углерода, при условии, что не все радикалы RA, RB и RD являются водородом, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG - H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
Z представляет собой H, OH, =O или NHRC, где RC = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода.
Во всех вышеуказанных структурах, где заместитель во 2 положении пуринового основания (Z) или в 8 положении пуринового основания (O или L) присоединяется к пуриновому основанию двойной связью (например, =О или =S), соседняя двойная связь между углеродом и азотом в пуриновом основании становится простой связью между углеродом и азотом, и тогда дополнительный атом водорода находится на азоте этой связи углерода и азота.
Настоящее изобретение включает также фармацевтически приемлемые соли вышеуказанных соединений.
Краткое описание диаграмм
Фиг. 1 - сравнительная диаграмма масс селезенок мышей после введения им физиологического раствора, гуанина и гуанозина, как описано в Примере 31. (На этой диаграмме и на всех последующих значок "*" указывает на статистически-значимые отличия).
Фиг. 2 - сравнительная диаграмма числа лейкоцитов у мышей после введения им физ. раствора, гуанина и гуанозина, как описано в Примере 31.
Фиг. 3 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора, гуанина и гуанозина, как описано в примере 31.
Фиг. 4 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, "Твин-80", гуанозина, триацетилгуанозина, октаноилгуанозина, лаурилгуанозина и пальмитоилгуанозина, как описано в Примере 32.
Фиг. 5 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, "Твин-80", гуанозина, триацетилгуанозина, октаноилгуанозина, лаурилгуанозина и пальмитоилгуанозина, как описано в Примере 32.
Фиг. 6 - сравнительная диаграмма количества нейтрофилов у мышей после введения им физ. раствора, "Твин-80", гуанозина, триацетилгуанозина, октаноилгуанозина, лаурилгуанозина и пальмитоилгуанозина, как описано в Примере 32.
Фиг. 7 - график, показывающий число колоний на бедренную кость после введения циклосфосфамида, как описано в Примере 34.
Фиг. 8 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, "Твин-80" и пальмитоилгуанозина в течение различных периодов, как описано в Примере 35.
Фиг. 9 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, "Твин-80" и пальмитоилгуанозина, как описано в Примере 35.
Фиг. 10 - сравнительная диаграмма количества нейтрофилов у мышей после введения им физ. раствора, "Твин-80" и пальмитоилгуанозина, как описано в Примере 35.
Фиг. 11 - сравнительная диаграмма содержания лимфоцитов у мышей после введения им физ. раствора, "Твин-80" и пальмитоилгуанозина, как описано в Примере 35.
Фиг. 12 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 36. "5FU" - 5-фторурацил.
Фиг. 13 - сравнительная диаграмма содержания лимфоцитов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 36.
Фиг. 14 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 36.
Фиг. 15 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 36.
Фиг. 16 - диаграмма количества тромбоцитов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 37.
Фиг. 17 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 37.
Фиг. 18 - диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 37.
Фиг. 19 - диаграмма количеств лейкоцитов у мышей после введения им физ. раствора и пальмитоилгуанозина, как описано в Примере 37.
Фиг. 20 - сравнительная диаграмма масс селезенок мышей после введения им "Твин-80", пальмитоилгуанозина и пальмитоилдезоксиинозина, как описано в Примере 38.
Фиг. 21 - сравнительная диаграмма количества лейкоцитов у мышей после введения им "Твин-80", пальмитоилгуанозина и пальмитоилдезоксиинозина, как описано в Примере 38.
Фиг. 22 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им "Твин-80", пальмитоилгуанозина и пальмитоилдезоксиинозина, как описано в Примере 38.
Фиг. 23 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина, в различных концентрациях, как описано в Примере 39.
Фиг. 24 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина в различных концентрациях, как описано в Примере 39.
Фиг. 25 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина, как описано в Примере 39.
Фиг. 26 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина, как описано в Примере 40.
Фиг. 27 - диаграмма, показывающая влияние физ. раствора, "Твин-80" и октаноилгуанозина на показатель гемопоэза мышей, которым вводили циклофосфамид, как описано в Примере 40.
Фиг. 28 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина, как описано в Примере 40.
Фиг. 29 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора, "Твин-80" и октаноилгуанозина, как описано в Примере 40.
Фиг. 30 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, бензоилгуанозина и пальмитоилгуанозина, как описано в Примере 41.
Фиг. 31 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора, бензоилгуанозина и пальмитоилгуанозина, как описано в Примере 41.
Фиг. 32 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, бензоилгуанозина и пальмитоилгуанозина, как описано в Примере 41.
Фиг. 33 - сравнительная диаграмма количества тромбоцитов у мышей после введения им физ. раствора, бензоилгуанозина и пальмитоилгуанозина, как описано в Примере 41.
Фиг. 34 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, пальмитоилинозина и пальмитоилксантозина, как описано в Примере 42.
Фиг. 35 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, пальмитоилдезоксиинозина и пальмитоилксантозина, как описано в Примере 42.
Фиг. 36 - сравнительная диаграмма количества нейтрофилов у мышей после введения им физ. раствора, пальмитоилдезоксиинозина и пальмитоилксантозина, как описано в Примере 42.
Фиг. 37 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, пальмитоилксантозина, пальмитоилинозина, пальмитоилгуанозина лаурилгуанозина и октаноилгуанозина, как описано в Примере 43.
Фиг. 38 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора, пальмитоилксантозина, пальмитоилинозина, пальмитоилгуанозина, лаурилгуанозина и октаноилгуанозина, как описано в Примере 43.
Фиг. 39 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора пальмитоилксантозина, пальмитоилинозина, пальмитоилгуанозина, лаурилгуанозина и октаноилгуанозина, как описано в Примере 43.
Фиг. 40 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им "Твин-80", пальмитоилацикловира, пальмитоиларабинозилгипоксантина, пальмитоил-8-тиогуанозина, пальмитоилдезоксигуанозина, пальмитоиларабинозилгуанина, пальмитоилдезоксиинозина и монопальмитоилгуанозин-2', 3'(ациклического) диалкоголя, как описано в Примере 44.
Фиг. 41 - сравнительная диаграмма количества лейкоцитов у мышей после введения им "Твин-80", пальмитоилацикловира, пальмитоиларабинозилгипоксантина, пальмитоил-8-тиогуанозина, пальмитоилдезоксигуанозина, пальмитоиларабинозилгуанина, пальмитоилдезоксиинозина и монопальмитоилгуанозин 2',3'-(ациклического) диалкоголя, как описано в Примере 44.
Фиг. 42 - сравнительная диаграмма масс селезенок мышей после введения им "Твин-80", пальмитоилацикловира, пальмитоиларабинозилгипоксантина, пальмитоил-8-тиогуанозина, пальмитоилдезоксигуанозина, пальмитоиларабинозилгуанина, пальмитоилдезоксиинозина и монопальмитоилгуанозин 2',3'-(ациклического) диалкоголя, как описано в Примере 44.
Фиг. 43 - сравнительная диаграмма масс селезенок мышей после введения им "Твин-80", 3'-0-пальмитоилдезоксигуанозина, бутирилдезоксигуанозина, пальмитоил-N-изобутирилдезоксигуанозина, лаурилдезоксигуанозина, октаноилдезоксигуанозина и пальмитоилдезоксигуанозина, како описано в Примере 45.
Фиг. 44 - сравнительная диаграмма количества нейтрофилов у мышей после введения им "Твин-80", 3'-0-пальмитоилдезоксигуанозина, бутирилдезоксигуанозина, пальмитоил-N-изобутирилдезоксигуанозина, лаурилдезоксигуанозина, октаноилдезоксигуанозина и пальмитоилдезоксигуанозина, как описано в Примере 45.
Фиг. 45 - сравнительная диаграмма количества лейкоцитов у мышей после введения им "Твин-80", 3'-0-пальмитоилдезоксигуанозина, бутирилдезоксигуанозина, пальмитоил- N-изобутирилдезоксигуанозина, лаурилдезоксигуанозина, октаноилдезоксигуанозина и пальмитоилдезоксигуанозина, как описано в Примере 45.
Фиг. 46 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора и пальмитоилдезоксигуанозина в четырех различных дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 46.
Фиг. 47 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физиологического раствора и пальмитоилдезоксигуанозина в четырех дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 46.
Фиг. 48 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, в четырех различных дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 46.
Фиг. 49 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, пальмитоилдезоксигуанозина и пальмитоилгуанозина в четырех различных дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 47.
Фиг. 50 - сравнительная диаграмма числа лейкоцитов у мышей после введения им физ. раствора, пальмитоилдезоксигуанозина и пальмитоилгуанозина в четырех различных дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 47.
Фиг. 51 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора, пальмитоилдезоксигуанозина и пальмитоилгуанозина в четырех различных дозах: 0,2, 0,4, 1,0 и 2,0 мкМ/мышь, как описано в Примере 47.
Фиг. 52 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, пальмитоилдезоксигуанозина в шести различных дозах: 0,04 0,08, 0,2, 0,4, 0,6 или 0,8 мкМ/мышь, как описано в Примере 48.
Фиг. 53 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина в шести различных дозах: 0,04, 0,08, 0,2, 0,4, 0,6 или 0,8 мкМ/мышь, как описано в Примере 48.
Фиг. 54 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина в шести различных дозах: 0,04, 0,08, 0,2, 0,4, 0,6 или 0,8 мкМ/мышь, как описано в Примере 48.
Фиг. 55 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в Примере 49.
Фиг. 56 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в Примере 49.
Фиг. 57 - сравнительная диаграмма количества тромбоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в Примере 49.
Фиг. 58 - сравнительная диаграмма содержания лимфоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в Примере 49.
Фиг. 59 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора, пальмитоил-8-бромогуанозина, монопальмитоилгуанозин 2',2'-(ациклического) диалкоголя, пальмитоилгуанозина и пальмитоилдезоксигуанозина, как описано в Примере 50.
Фиг. 60 - сравнительная диаграмма содержания тромбоцитов у мышей после введения им физ. раствора, пальмитоил-8-бромогуанозина, монопальмитоилгуанозин 2',3'-(ациклического)диалкоголя, пальмитоилгуанозина и пальмитоилдезоксигуанозина, как описано в Примере 50.
Фиг. 61 - сравнительная диаграмма количества клеток костного мозга на каждую бедренную кость у мышей после введения им физ. раствора, пальмитоил-8-бромогуанозина, монопальмитоилгуанозин 2',3'-(ациклического)диалкоголя, пальмитоилгуанозина и пальмитоилдезоксигуанозина, как описано в Примере 50.
Фиг. 62 - сравнительная диаграмма количества тромбоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в Примере 51.
Фиг. 63 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в примере 51.
Фиг. 64 - сравнительная диаграмма количества нейтрофилов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в примере 51.
Фиг. 65 - сравнительная диаграмма количества лейкоцитов у мышей после введения им физ. раствора и пальмитоилдезоксигуанозина, как описано в примере 51.
Фиг. 66 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им "Твин-80" в различных концентрациях без пальмитоилгуанозина, как описано в примере 52.
Фиг. 67 - сравнительная диаграмма содержания нейтрофилов у мышей после введения им физ. раствора и пальмитоил-8-аминогуанозина, как описано в примере 53.
Фиг. 68 - сравнительная диаграмма масс селезенок мышей после введения им физ. раствора и пальмитоил-8-аминогуанозина, как описано в примере 53.
Чтобы полнее и яснее понять суть настоящего изобретения в целом, его объекты, признаки и преимущества, раскрытые в подробном описании изобретения, следует обращаться к соответствующим диаграммам, иллюстрирующим результаты экспериментов, описанных в примерах.
Подробное описание изобретения
Объектом настоящего изобретения являются оксипуриновые нуклеозиды, родственные этим нуклеозидам соединения, а также ацильные производные этих нуклеозидов и родственных соединений и использование указанных соединений для изменения гемопоэза у животных, включая человека.
А. Терминология
Термин "оксипуриновое основание" означает здесь пуриновое основание с экзоциклическим кислородом или гидроксильной группой в 6 положении и водородом, кислородом, гидроксильной группой или аминогруппой во 2 положении.
Термин "оксипуриновые нуклеозиды" здесь описывает оксипуриновое основание, связанное с альдозой, содержащей 5 атомов углерода, причем азот в 9 положении основания связан с 1' положением альзоды. Термин "оксипуриновые нуклеозиды" включает, в числе прочих, такие соединения, как гуанозин, инозин, дезоксиинозин, ксантозин, дезоксиксантозин и дезоксигуанозин.
Термин "родственное соединение" здесь означает оксипуриновый нуклеозид с заместителем, который присоединяется в 7 или 8 положении пуринового кольца, и/или оксипуриновый нуклеозид с дециклированной альдозой (например, гуанозин 2',3'-диалкоголь).
Термин "ацильные производные" здесь использован для обозначения производных оксипуриновых нуклеозидов или родственных соединений, в которых практически нетоксичный органический ацильный заместитель, полученный в результате замещения карбоновой кислоты, присоединен к одной или более гидроксильной группе рибозного фрагмента оксипуринового нуклеозида посредством эфирного мостика и/или в которых такой заместитель присоединен к аминному заместителю на пуриновом кольце гуанозина посредством амидной связи. Такие ацильные заместители получают из карбоновых кислот, в числе которых соединения, выбираемые из группы: молочная кислота, аминокислота, жирная кислота, никотиновая кислота, дикарбоновая кислота, пара-аминобензойная кислота, оротовая кислота. Предпочтительными ацильными заместителями являются те соединения, которые обычно присутствуют в организме животного, либо в качестве компонентов питания, либо в качестве промежуточных метаболитов.
Термин "фармацевтически приемлемые соли" используется здесь для описания продуктов присоединения кислотных остатков фармацевтически приемлемых солей к вышеуказанным производным; в числе подобных кислот серная, соляная или фосфорная кислоты.
Термин "соназначаемые" означает, что по меньшей мере два из соединений по изобретению назначаются в течение такого периода времени, что соответствующие периоды фармакологической активности этих соединений накладываются друг на друга.
Термин "аминокислоты" означает здесь в числе прочих соединений глицин, L-формы аланина, валина, лейцина, изолейцина, фенилаланина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, цистина, метионина, триптофана, аспаргиновую кислоту, глутаминовую кислоту, аргинин, лизин, гистидин, орнитин, гидроксилизин, карнитин и другие аминокислоты, встречающиеся в природе.
Термин "жирные кислоты" означает здесь алифатические карбоновые кислоты, содержание 2-22 атома углерода. Такие жирные кислоты могут быть насыщенными, частично насыщенными или полиненасыщенными.
Термин "дикарбоновые кислоты" используется здесь для обозначения жирных кислот, вторым заместителем в которых является карбоновая кислота.
Термин "терапевтически эффективное количество" обозначает такое количество, которое дает терапевтический эффект при данном состоянии больного и при указанном режиме приема или введения соединения.
B. Соединения по изобретению
Соединения по изобретению, используемые для изменения гемопоэза, имеют следующую формулу: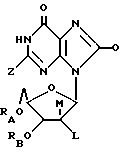
где RA = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода,
RB = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода,
Z = H, OH, = O или NHRC, где RC = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода,
L = H или ORD, где RD = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода,
M = H или ORZ, где RZ = H или ацильный радикал карбоновой кислоты с 2-30 атомами углерода, при условии, что по меньшей мере один из радикалов Z и M является H.
Q = H, галоген, NHRF, где RF представляет собой H или ациальный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ациальный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, причем желательно, чтобы между 2' и '3 положениями альдозного фрагмента существовала связь C-C.
Новые композиции по изобретению включают вышеуказанные соединения, в которых по меньшей мере один из радикалов RA, RB, RC, RD или RZ не является H, и в соединениях, где Z представляет собой NH2 или NHRC, Q тогда представляет собой H или NHRF, где RF представляет собой H или ациальный или алкильный радикал, содержащий 1-10 атомов углерода, вместе с фармацевтически приемлемым носителем.
В частности, новые соединения по изобретению включают, в числе прочих, следующие соединения:
(1) ацильное производное гуанозина или родственных ему соединений формулы:
где RA, RB и RD имеют одинаковые или различные значения, каковыми является водород или ацильная группа, полученная замещением
a. жирной кислоты с неразветвленной цепью, содержащей 6-22 атома углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы аланина, валина, лейцина, изолейцина, тирозина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода, при условии, что не все радикалы RA, RB и RD являются H;
RC представляет собой водород или ацильную группу, полученную замещением
i. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
ii. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
iii. дикарбоновой кислоты с 3-22 атомами углерода,
iv. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода,
v. никотиновой кислоты,
vi. замещенной или незамещенной ароматической карбоновой кислоты, содержащей 7-22 атома углерода,
J = H или NHRI, где RI представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(2) ацильное производное инозина или родственных ему соединений формулы: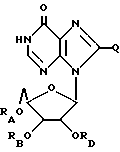
где RA представляет собой водород или ацильную группу, полученную замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. дикарбоновой кислоты с 3-22 атомами углерода,
c. никотиновой кислоты,
d. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода, где RB и/или RD представляет собой водород или ацильную группу, полученную замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода, при условии, что не все радикалы RA, RB и RD представляют собой водород, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ациальный или алкильный радикал, содержащий 1-10 атомов углерода;
(3) ацильные производные ксантозина или родственных ему соединений формулы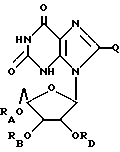
где RA, RB и RD имеют одинаковые или различные значения, каковыми являются водород или ацильное производное, полученное замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты с 4-22 атомами углерода, при условии, что не все радикалы RA, RB и RD являются водородом, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(4) ацильные производные дезоксиинозина или родственных ему соединений формулы
где RA и RB имеют одинаковые или различные значения, каковыми являются водород или ацильная группа, полученная замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода, при условии, что по меньшей мере один из радикалов RA и RB не является водородом, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(5) ацильные производные дезоксигуанозина и родственных ему соединений формулы:
где RA, RB и RC могут иметь одинаковые или различные значения, каждое из которых - водород или ацильная группа, полученная замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин, фенилаланин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода,
e. никотиновой кислоты,
при условии, что не все радикалы RA, RB и RC являются водородом, и когда RC не является H, то RA и/или RB могут представлять собой также ацетил,
J = H или NHRI, где RI представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(6) ацильные производные дезоксиксантозина или родственных ему соединений формулы: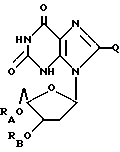
где RA и RB имеют одинаковые или различные значения, каковыми являются водород или алкильная группа, полученная замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланин, валин, лейцин, изолейцин, тирозин, пролин, гидроксипролин, серин, треонин, цистеин, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода,
при условии, что по меньшей мере один из радикалов RA и RB не является водородом, и
Q = H, галоген, NHRF, где RF представляет собой H или ацильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода;
(7) ацильные производные инозин (ациклического) 2'3'-диалкоголя или родственных ему соединений формулы: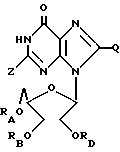
где RA, RB и RD имеют одинаковые или различные значения, каковыми являются водород или ацильная группа, полученная замещением
a. жирной кислоты с неразветвленной цепью с 3-22 атомами углерода,
b. аминокислоты, выбираемой из группы, в которую входят глицин, L-формы фенилаланина, аланина, валина, лейцина, изолейцина, тирозина, пролина, гидроксипролина, серина, треонина, цистеина, аспаргиновая кислота, глутаминовая кислота, аргинин, лизин, гистидин и орнитин,
c. дикарбоновой кислоты с 3-22 атомами углерода,
d. никотиновой кислоты,
e. циклоалкилкарбоновой кислоты, содержащей 4-22 атома углерода,
при условии, что не все радикалы RA, RB и RD являются водородом, и
Q = H, галоген, NHRF, где RF представляет собой ацильный или алкильный радикал, содержащий 1-10 атомов углерода, S, связанная двойной связью с углеродом, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, SRG, где RG представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода, O, связанный с углеродом двойной связью, в каковом случае соседняя двойная связь между углеродом и азотом становится простой связью, а затем к данному азоту присоединяется какой-либо H, или ORH, где RH представляет собой H или ацильный или алкильный радикал, содержащий 1-10 атомов углерода,
Z представляет собой H, OH, =O или NHRC, где RC = H, или ацильный радикал карбоновой кислоты, содержащей 2-30 атомов углерода.
Настоящее изобретение охватывает фармацевтически приемлемые соли вышеуказанных соединений.
Предпочтительными соединениями по настоящему изобретению являются жирнокислые сложные эфиры дезоксигуанозина, дезоксиинозина, гуанозина, инозина, дезоксиксантозина и ксантозина, особенно те из них, в которых ацильный заместитель содержит 8 или более атомов углерода. Наиболее предпочтительными соединениями являются жирнокислые сложные эфиры дезоксигуанозина или дезоксиинозина, содержащие 12-18 атомов углерода в ацильном заместителе. Соединения с полярным аминокислотным заместителем (например, лизин или аргинин) связанным либо с гидроксильной группой альдозного фрагмента, либо с экзоциклической аминогруппой гуанозина или дезоксигуанозина, а при желании и с жирной кислотой, этерифицированной на гидроксильной группе альдозного фрагмента, особенно подходят для составления композиций, содержащих водные фармацевтические носители.
В одном из вариантов осуществления изобретения пролекарства, содержащие соединения по изобретению с повышенной водорастворимостью, получают путем присоединения фосфата к свободной гидроксильной группе альдозного фрагмента пуринового нуклеозида.
В другом варианте осуществления изобретения заместители, такие как алкил с короткой цепью или замещенный алкильный радикал, например, метил, этил или пропил, присоединяются в 1, 3 и/или 7 положении оксипуринового фрагмента вышеуказанных соединений.
В следующем варианте осуществления изобретения экзоциклическая аминогруппа гуанозина, дезоксигуанозина или родственных им соединений может иметь два ацильных заместителя, которые могут быть одинаковыми или различными. В таких случаях ацильные заместители выбирают из групп ацильных радикалов, обозначенных RC в описаниях гуанозина, дезоксигуанозина и родственных им соединений.
Неионогенные поверхностно-активные вещества
Было обнаружено, что разнообразные неионогенные ПАВ, включая полиоксиэтилен-сорбитан-ацилаты, например, "Твин-80" (полиоксиэтиленсорбитан-моно-олеат), "Твин-60" (полиоксиэтилен-сорбитан-моностеарат) и т.п.; полиоксиэтиленовые эфиры, например, "Бридж-96" (полиоксиэтилен-10-олеиловый эфир) и "Тритон X-100"; конденсаты окиси этилена, например, "Нонайдет 40-P" (конденсат октифенолэтиленоксида) повышают эффективность соединений по изобретению в отношении гемопоэза in vivo. Более того, эти ПАВ сами по себе ускоряют восстановление гемопоэза после нарушений костного мозга, вызванных циторедуктивными агентами, такими как циклофосфамид (см. пример 52). Новые композиции по изобретению включают один или более из вышеуказанных ПАВ и эритропоэтин, интерлейкин, фактор, стимулирующий рост колоний, или другое соединение, способное стимулировать гемопоэз.
Композиции по изобретению
В одном из вариантов осуществления изобретения новые фармацевтические композиции включают в качестве активного вещества один или более оксипуриновый нуклеозид, выбираемый из группы, в которую входят гуанозин, инозин, ксантозин, дезоксиксантозин, дезоксиинозин, дезоксигуанозин, родственные этим оксипуриновым нуклеозидам соединения, а также ацильные производные этих оксипуриновых нуклеозидов и родственных им соединений, вместе с фармацевтически приемлемым носителем.
В другом варианте осуществления изобретения композиции по изобретению включают, помимо одного или более соединений по изобретению, по меньшей мере одно из следующих соединений, влияющих на гемопоэз: неионогенное ПАВ, интерлейкин, такой как IL -1, -2, -3, -4, -5, -6, -7, -8 (предпочтительно, IL -1, -3 и -6), фактор, стимулирующий рост колоний, например, фактор, стимулирующий рост колоний гранулоцитов (G-CSF), фактор, стимулирующий рост колоний гранулоцитов/макрофагов (GM-CSF), эритропоэтин (EPO), глюкан, полиинозин-полицитидин или любое другое вещество, благоприятно действующее на гемопоэз. Композиции, в зависимости от их предназначения, изготавливаются в виде жидкости, суспензии, таблеток, капсул, драже, в виде инъекционных растворов, растворов для местного применения или в виде свечей (см. описание рецептур, представленное ниже).
В другом варианте осуществления изобретения композиция включает, по меньшей мере, одно соединение по изобретению и соединение, защищающее от излучений.
В другом варианте осуществления изобретения композиция включает по меньшей мере одно соединение по изобретению и антивирусный агент или противоопухолевое средство, или другие фармацевтические средства, которые понижают количество клеток крови.
Применение соединений и композиций по изобретению для терапевтических целей
Соединения по изобретению применяются для изменения, улучшения или оказания помощи в процессе гемопоэза и функционирования иммунной системы животных. Соединения восстанавливают гемопоэз или количество клеток крови после нарушения или подавления функций костного мозга в результате химиотерапии, лучевой терапии или заболевания; они предохраняют костный мозг от подобных нарушений в результате химиотерапии, лучевой терапии или заболеваний; они также изменяют количество клеток крови (например, лейкоцитов и тромбоцитов) или их активность в организме животного. Соединения по изобретению применимы для лечения людей; однако настоящее изобретение не ограничивается лечением людей, оно охватывает лечение всех животных, на которых оказывает благоприятное действие использование активных соединений по изобретению.
Отмечено значительное снижение неблагоприятных воздействий лучевой терапии в тех случаях, когда соединения по изобретению использовались вместе с соединением, обеспечивающим защиту от радиации.
Далее, осуществление настоящего изобретения включает также систему назначения фармацевтического соединения или композиции, содержащей гуанозин, дезоксигуанозин, инозин, ксантозин, дезоксиксантозин, дезоксиинозин, родственные этим нуклеозидам соединения или ацильные производные таких нуклеозидов или родственных им соединений, или комбинаций таких соединений или композиций, для улучшения гемопоэза в организмах пациентов с пониженным содержанием клеток крови, нарушениями функций костного мозга или пациентов, по другим причинам испытывающих потребность в активизации гемопоэза.
Конкретные условия, при которых применение соединений, композиций и способов по изобретению дает преимущества, включают те ситуации, где требуется улучшение гемопоэза. Такие условия включают лечение животных, например, пациентов-людей, подвергшихся циторедуктивной химиотерапии рака, антивирусной химиотерации, облучению ионизирующей радиацией (в терапевтических целях или в результате несчастного случая), животных, нуждающихся в улучшении иммунной защиты организма посредством лейкоцитов, а также животных с анемией или гипоплазией в результате заболеваний или случайного отравления. Преимущества от использования соединений, композиций и способов по изобретению достигаются благодаря повышению количества лейкоцитов в организмах животных с нормальным содержанием клеток крови, например, для повышения иммунной защиты организма от инфекции, повышению количества тромбоцитов в организмах животных с нормальной формулой крови, например, для повышения свертываемости крови (например, перед хирургическим вмешательством), подготовке животных перед проведением противораковой или антивирусной химиотерапии (или лучевой терапии), подготовке доноров для трансплантаций костного мозга, ускорению или улучшению восстановления после трансплантаций костного мозга, лечению культур клеток костного мозга перед трансплантацией, лечению клеток костного мозга в культурах (для исследовательских целей или перед трансплантацией). В частности, сюда относится применение этих соединений в ветеринарной практике там, где требуется изменение формулы крови.
Цитопения
Соединения и композиции по изобретению могут использоваться для лечения различных форм цитопении, перечисленных ниже:
А. Нейтропения
Нейтропения в результате рака или противораковой химиотерапии; нейтропения в результате антивирусной химиотерапии; нейтропения в результате облучения ионизирующим излучением (в результате несчастного случая или лучевой терапии); нейтропения в результате иммунодепрессивной химиотерапии (например, лечения аутоиммунных нарушений, таких как ревматоидный артрит, с помощью цитотоксичных лекарств); нейтропения у ожоговых пациентов (нейтропения часто встречается у пациентов, пострадавших от сильных ожогов); нейтропения в результате вирусных инфекций (например, панцитопения часто встречается у зараженных СПИДом, она усиливается при лечении с помощью препаратов, подавляющих функции спинного мозга, таких как AZT); нейтропения вторичная к апластической анемии или миелодиспластическому синдрому; нейтропения в результате отравлений (например, бензолом; ряд патентованных фармацевтических препаратов включает агранулоцитоз в число побочных действий); идиопатическая нейтропения; хроническая нейтропения; нейтропения в результате лейкемий "волосатых" клеток или других лимфолейкозов; нейтропения, вызванная любыми другими причинами; нейтропения у животных (ветеринарное использование).
В. Тромбоцитопения
Низкое содержание тромбоцитов в результате химиотерапии рака; тромбоцитопения в результате антивирусной химиотерапии; тромбоцитопения в результате облучения ионизирующей радиацией (в результате несчастного случая или лучевой терапии); низкое содержание тромбоцитов в результате иммунодепрессивной химиотерапии (например, лечения аутоиммунных нарушений, таких как ревматоидный артрит, с помощью цитотоксичных лекарственных препаратов); тромбоцитопения в результате вирусных инфекций (например, панцитопения часто встречается у зараженных СПИДом, она усиливается при лечении с помощью препаратов, подавляющих функции спинного мозга, таких как AZT); тромбоцитопения вторичная к апластической анемии, миелодиспластическому синдрому или гипопластическим синдромам костного мозга; тромбоцитопения в результате любых иных причин.
С. Лимфопения
Низкое содержание лимфоцитов в результате противораковой химиотерапии; лимфопения в результате антивирусной химиотерапии; низкое содержание лимфоцитов в результате облучения ионизирующим излучением (в результате несчастного случая или лучевой терапии); низкое содержание лимфоцитов в результате иммунодепрессивной химиотерапии (например, лечение аутоиммунных нарушений, таких как ревматоидный артрит, с помощью цитотоксичных лекарственных препаратов); лимфопения, вызванная любыми другими причинами.
D. Анемия
Низкое содержание эритроцитов в результате почечного диализа; низкое содержание эритроцитов в результате повреждения почек; анемия в результате вирусной инфекции или химиотерапии с применением препаратов, подавляющих функции спинного мозга; анемия в результате инфекции или заболевания (например, малярии); анемия в результате кровотечения; анемия, вызванная любыми другими причинами.
Лечение осложнений, связанных с облучением
Клиническое использование активных соединений по изобретению для лечения осложнений в результате облучения показано в следующих трех случаях: 1) при облучении в ходе несчастного случая, как во время несчастных случаях, связанных с атомной энергией; 2) облучение в результате диагностических мероприятий с использованием рентгенографии; 3) облучение в ходе лучевой терапии, например лучевой противораковой терапии.
В первом случае, согласно одному варианту осуществления изобретения, активные соединения назначают в виде препарата, пригодного для парентеральной инъекции, после чего препарат назначают перорально или парентерально один или несколько раз в сутки в дозах, достаточных для повышения гемопоэза, например, 0,01 - 3 грамма в день.
Во втором случае при облучении рентгеновскими лучами в ходе диагностики, согласно одному из вариантов осуществления изобретения, активные соединения назначают перорально до или после облучения.
В третьем случае при облучении в ходе противораковой лучевой терапии, активные соединения позволяют эффективно восстановить функции костного мозга после нежелательного, но неизбежного подавления этих функций в ходе лучевой терапии.
Соединения по изобретению назначают до, в процессе и/или после облучения.
Соединения по изобретению применяют для предотвращения или смягчения воздействий ионизирующего излучения вместе с другими препаратами против облучения, такими как WR-2721, NAC, DDC, цистеамин, 2-меркаптоэтанол, меркаптоэтиламин, дитиотреит, глутатион, 2-меркаптоэтансульфоновая кислота, WR-1065, никотинамид, 5-гидрокситриптамин, 2-бета-аминоэтилизотиоуроний-Br-Hbr, глюканы, GLP/B04, GLP/B05, OK-432, "Биостим", PSK, "Лентинан", "Шизофиллан", "Родексман", "Леван", "Маннозим", MVE-3, MNR, MMZ, IL-1, IL-2, TNF тиминовый фактор TF-5, глутатионпероксидаза, пероксид-дисмутаза, каталаза, глутатионредуктаза, глутатионтрансфераза, селен, CdC12, MnC12, ацетат цинка, витамин A, бета-каротин, простагландины, токоферол и метиленовый синий и РАВА. Назначение этих защитных соединений вместе с соединениями по изобретению обеспечивает более высокую защиту, чем назначение тех или иных соединений по отдельности.
Лечение осложнений, связанных с противораковой химиотерапией
У пациентов, проходящих курс лечения стандартными противораковыми химическими препаратами (например такими как 5-фторурацил, фтордезоксиуридин, винкаалкалоиды, циклофосфамид и другие алкилирующие вещества, такие как бусульфан, гексален или мелфалан, даунорубицин, дозоксорубицин, метотрексат, цитозинарабинозид, 6-меркаптопурин, 6-метилмеркаптопурин, рибозид, тиогуанозин, подофиллотоксины, цисплатин, комбинации таких циторедуктивных агентов или циторедуктивные агенты плюс модуляторы, такие как лейковорин, PALA или WR-2721), часто отмечается пониженное количество лейкоцитов, в частности нейтрофилов. Ежедневное назначение перорально (или парентерально) фективной дозы (например, 0,01 - 3,0 грамма) соединения по изобретению, такого как пальмитоил- (или другое ацильное производное) дезоксигуанозина в течение ряда дней смягчает или предотвращает снижение нейтрофилов, которое в противном случае наступает через несколько дней после начала химиотерапии. Лечение химическими препаратами совместно с дезоксигуанозином эффективно повышает общее количество белых кровяных телец, включая нейтрофилы и лимфоциты, в последующие дни, по сравнению с пациентами, которые принимали только препараты, входящие в курс химиотерапии. Это снижает вероятность инфекции в ходе лечения и позволяет принимать более высокие дозы препаратов, входящих в курс химиотерапии, и/или начинать проходить повторный курс химиотерапии быстрее, чем пациенту, не принимавшему производные дезоксигуанозина.
Соединения по изобретению назначают до, в течение и/или после назначения противораковых препаратов.
Лечение осложнений, связанных с антивирусной химиотерапией
Лечение пациентов, больных СПИДом или заболеваниями, связанными со СПИДом, с помощью азидотимидина (АЗТ) и других антивирусных препаратов, осложняется анемией, нейтропенией и тромбоцитопенией. Назначение соответствующих доз соединений по изобретению, таких как пальмитоилгуанозин (или другие ацилированные формы гуанозина) в течение нескольких дней (или, в зависимости от хода антивирусной терапии, в течение курса этой терапии) значительно ослабляет нейтропению, анемию, тромбоцитопению и другие побочные действия АЗТ и/или ddC. Это снижает вероятность септических осложнений и позволяет пациентам принимать более высокие дозы антивирусных соединений в течение более короткого периода времени, по сравнению с пациентами, которых лечили только антивирусными препаратами без соединений по изобретению.
Соединение по изобретению назначают до, в течение и/или после назначения антивирусных препаратов.
Лечение осложнений, связанных с отравлениями и побочными действиями различных лекарств
Отравление бензолом или побочные действия различных веществ, включая многие прописываемые лекарства, в числе которых препараты от заболеваний щитовидной железы, сульфонамиды, фенилтиазины, фенилбутазоны и аминопирины, приводит к агранулоцитозу/нейтропении. Цитопенией называют также отравление бензолом и горчичным газом и соответствующими алкилирующими препаратами. Назначение соединений по изобретению жертвами подобных отравлений или пациентам, принимающим подобные лекарства, способствует выздоровлению, стимулируя продукцию клеток крови, таких как нейтрофилы.
Лечение цитопений, связанных с различными заболеваниями
Многие заболевания связаны с различными формами цитопении. Например, лейкоз "волосатых" клеток связан с нейтропенией. Тромбоцитопеническая пурпура и апластическая анемия связаны с пониженным содержанием тромбоцитов. Назначение соединений по изобретению увеличивает количество нейтрофилов и тромбцитов у пациентов, страдающих этими заболеваниями.
Лечение осложнений, связанных с поражением вирусом иммунодефицита человека
Пациенты, пораженные ВИЧ-инфекцией, особенно больные СПИДом, страдают многочисленными заболеваниями, возникающими в результате такого заражения, и в некоторых случаях эти заболевания ухудшают состояние и без того пораженной иммунной системы. Многим из таких пациентов назначают антивирусные химические препараты, такие как АЗТ, которые оказывают вредное воздействие на иммунные функции организма, еще более снижая сопротивление ко всевозможным инфекциям. Назначение соединений по изобретению - перорально, внутривенно или парентерально - увеличивает содержание клеток крови, которое было понижено в результате инфекции (у пациентов, больных СПИДом, часто наблюдается панцитопения). Такое лечение повышает содержание нейтрофилов, лимфоцитов и тромбоцитов, что помогает восстановить иммунную активность. Ввиду того, что повышенная подверженность инфекционным заболеваниям является тем фактором, который ограничивает дозировку и интенсивность химиотерапии больных СПИДом, лечение пациентов с применением соединений по изобретению снижает побочные действия химиотерапии (и таким образом улучшает состояние) и позволяет проводить более интенсивную химиотерапию.
Лечение осложнений, связанных с раком
Некоторые разновидности рака связаны с гематологическими цитопениями независимо от цитопений в результате циторедуктивной химиотерапии. Лейкоз "волосатых" клеток часто связан с нейтропенией. Инфильтрация новообразований в костный мозг часто нарушает гемопоэз. Назначение соединений по изобретению повышает содержание нейтрофилов и других типов клеток у больных, страдающих подобными заболеваниями. Некоторые виды гранулоцитических лейкозов характеризуются чрезмерным продуцированием незрелых недифференцирующих предшественников гранулоцитов. Как показано в примерах 35-51 ниже, соединениями по изобретению вызывают повышенную конечную дифференциацию предшественников нейтрофилов, благодаря чему эти соединения могут применяться для лечения лейкозов, таких как лейкоз гранулоцитов.
Применение соединений по изобретению для трансплантатов костного мозга
Трансплантация костного мозга используется для лечения пациентов, пострадавших от облучения в результате несчастного случая или лучевой терапии и побочных действий циторедуктивной химиотерапии (антивирусной и/или противораковой). При трансплантациях костного мозга соединения по изобретению используются самыми различными способами. Назначение соединений по изобретению донорам костного мозга повышает число различных клеток крови, таких как нейтрофилы, лимфоциты, мегакариоциты и тромбоциты в периферической крови и особенно их предшественников в самом костном мозге. Назначение соединений по изобретению реципиентам костного мозга перед, после или в течение трансплантации ускоряет восстановление гемопоэза. Кроме того, инкубация клеток костного мозга в культуре с применением соединений по изобретению перед трансплантацией улучшает приживление.
Использование соединений по изобретению для аутогемотрансфузии
Аутогемотрансфузия или накапливание определенных количеств собственной крови пациента для последующего переливания, например, перед элективным хирургическим вмешательством или в качестве меры предосторожности против неожиданных ситуаций, требующих переливания крови, является важным мероприятием, позволяющим избежать заражения через кровь доноров такими вирусами, как ВИЧ или вирус гепатита. Соединения по изобретению можно использовать для восстановления формулы крови после отбора крови пациента для хранения. Наоборот, эти соединения можно назначать до отбора крови для того, чтобы смягчить воздействие этой операции.
Профилактическое использование соединений по изобретению
В клинической и ветеринарной практике возникают самые различные ситуации, в которых желательно усилить или иным образом изменить гемопоэз в ожидании различных трудностей.
Например, во многих случаях желательно усилить сопротивляемость инфекциям, например перед хирургическим вмешательством или контактами с вирусной или бактериальной инфекцией. Назначение соединений по изобретению животным с нормальной формулой крови повышает число лейкоцитов и усиливает сопротивляемость инфекциям.
Есть много ситуаций, в которых желательно повысить свертывание крови животного, например, перед хирургическим вмешательством. Назначение соединений по изобретению перед хирургическим вмешательством повышает число тромбоцитов и, таким образом, улучшает свертывание крови.
В тех случаях, когда предполагается нанесение ущерба костному мозгу и/или системе гемопоэза, например, перед проведением противораковой или антивирусной химиотерапии или лучевой терапии, желательно улучшить или повысить гемопоэз. Предварительное назначение животным, которые должны подвергнуться подобной терапии, соединений по изобретению ускоряет продуцирование белых кровяных телец и тромбоцитов и/или смягчает ущерб, наносимый предшественниками клеток крови. Соединения приводят к положительным изменениям системы гемопоэза в профилактических целях.
Назначение соединений по изобретению донорам костного мозга перед пересадкой повышает число клеток крови различных типов, таких как нейтрофилы, лимфоциты, мегакариоциты и тромбоциты в периферийной крови и повышает число гемопоэтических клеток-предшественников в самом костном мозге.
D. Назначение и приготовление лекарственных средств, включающих соединения и композиции по изобретению
Соединения и композиции по изобретению назначают перорально, парентерально, внутривенно, местно или любыми другими способами в зависимости от условий лечения.
Соединения и композиции по изобретению назначают для постоянного приема или курсами. Соединения и композиции по изобретению назначают до, в течение или после того события, которое наносит ущерб системе гемопоэза (например, облучение или циторедуктивная химиотерапия). После указанного события соединения и композиции по изобретению назначают до и/или после того, как наступило максимальное снижение числа клеток крови или костного мозга.
Соединения по изобретению включают в состав матриц, обладающих способностью к биодеградации, биоэрозии или другим видам постепенного высвобождения соединений после введения их перорально или подкожно. Для внутривенных и внутримышечных инъекций соединения по изобретению желательно приготавливать в липосомах.
Фармакологически активные соединения желательно сочетать с подходящими фармацевтически приемлемыми носителями, в состав которых входят наполнители и вспомогательные средства, усиливающие переработку активных соединений. Препараты назначаются в виде таблеток, драже, капсул или свечей. Композиции назначают, например, перорально, ректально, вагинально или вводят трансбукально, они могут применяться в форме раствора или инъекций, перорально или местно. Композиции могут содержать от около 0,01 до 99%, предпочтительно, от около 50 до 90% активного соединения (соединений), вместе с носителем(ями).
Для парентерального введения путем инъекции или внутривенного вливания активные соединения по изобретению приготавливают в виде суспензий или растворяют в водной среде, такой как стерилизованная вода или физ.раствор. Желательно, чтобы растворы или суспензии для инъекций включали ПАВ, такое как полиоксиэтиленсорбитанэфиры, сорбитанэфиры, полиоксиэтиленэфиры или растворители, типа пропиленгликоля или этанола. Соединения по изобретению можно суспендировать или растворять в жировых эмульсиях для инъекций для назначения парентерально. Раствор или суспензия обычно содержит 0,01-5% активных соединений. Активные соединения можно растворять в фармацевтическом растительном масле для внутримышечного введения. Подобные препараты содержат от около 1% до 50% активных соединений в масле.
Подходящими наполнителями являются сахара, например лактоза, сахароза, маннитол или сорбит, целлюлозные препараты и/или фосфаты кальция, например трикальцийфосфат или кислый фосфат кальция, а также такие связующие, как крахмальная паста, изготовленная из, например, маисового крахмала, пшеничного крахмала, рисового крахмала или картофельного крахмала, желатин, трагант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза и/или поливинилпирролидон.
Вспомогательные средства включают вещества, регулирующие текучесть, и смазывающие вещества, например, двуокись кремния, тальк, стеариновая кислота или ее соли, такие как стеарат магния или стеарат кальция и/или полиэтиленгликоль. Сердцевину драже покрывают соответствующим покрытием, которое, при желании, может быть устойчиво к действию желудочного сока. Для этой цели используют концентрированные растворы сахара, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или двуокись титана, лакирующие растворы и подходящие органические растворители или смеси растворителей. Для изготовления покрытий, устойчивых к желудочному соку, приготавливают растворы подходящих препаратов целюллозы, такие как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Оболочки таблеток или драже могут содержать красители или пигменты, например, для идентификации соединений или доз.
Фармацевтические препараты по изобретению изготавливают известными способами, например, путем обычного перемешивания, гранулирования, изготовления драже, растворения или лиофилизации. Так, фармацевтические препараты для перорального применения получают путем сочетания активных соединений с твердыми наполнителями, полученную смесь можно измельчить и гранулировать, а после добавки подходящих вспомогательных средств, если необходимо, изготовить сердцевины таблеток или драже.
Другие фармацевтические препараты для перорального назначения включают выдавливающие капсулы, изготовленные из желатина, а также мягкие запечатанные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Выдавливающиеся капсулы содержат активные соединения в гранулированном виде, которые могут быть смешаны с наполнителями, такими как лактоза, связующими, такими как крахмал, и/или смазывающими веществами, такими как тальк или стеарат магния, а также стабилизаторами. В мягких капсулах активные соединения, предпочтительно, растворены или суспендированы в подходящих жидкостях, таких как нелетучие жидкие масла, жидкий парафин, полиэтиленгликоли. Помимо этого, могут быть добавлены стабилизаторы.
Фармацевтические препараты для ректального применения включают, например, свечи, состоящие из комбинации активных соединений с основным материалом, из которого изготавливают свечи. Такими материалами могут быть, например, природные или синтетические триглицериды, парафины, полиэтиленгликоли или высшие алканолы. Помимо этого могут применяться желатиновые капсулы для ректального применения, которые состоят из комбинации соединений по изобретению с соответствующим основным материалом. В числе таких материалов жидкие триглицериды, полиэтиленгликоли или парафины.
Препараты для парентерального назначения включают водные растворы активных соединений, находящихся в водорастворимом виде, например, в виде водорастворимых солей. Помимо этого могут применяться суспензии или растворы соответствующих активных соединений в составах для масляных инъекций, куда входят такие растворители, как пропиленгликоль или водно-липидные эмульсии. В числе пригодных липофильных растворителей нелетучие жирные масла, например, кунжутное масло или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды. Водные суспензии для инъекций могут включать вещества, повышающие вязкость суспензии, такими веществами могут быть, например, натрийкарбоксиметилцелллоза, сорбит и/или декстран. Суспензия может содержать стабилизаторы.
В одном из вариантов осуществления изобретения активные соединения включают в состав лосьона для кожи для местного назначения. В этом случае подходящие липофильные растворители включают нелетучие жирные масла, например, кунжутное масло или кокосовое масло, или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды.
E. Синтез соединений по изобретению
Ацилированные производные оксипуриновых нуклеозидов синтезируют путем реакции оксипуринового нуклеозида или родственного ему соединения с активированной карбоновой кислотой. Активированная карбоновая кислота - это такая карбоновая кислота, которую обработали соответствующими реагентами с тем, чтобы углерод карбоновой группы стал более подверженным разрушению нуклеофилом, чем в неактивированной карбоновой кислоте. Для синтеза соединений по изобретению могут быть использованы, например, следующие активированные карбоновые кислоты: хлориды кислоты, ангидриды кислоты, n-гидроксисукцинимидэфиры или карбоновые кислоты, активированные BOP-DC. Карбоновые кислоты могут присоединяться к оксипуриновым нуклеозидам или родственным им соединениям посредством связующих веществ, таких как дициклогексилкарбодиимид (DCC).
В процессе приготовления ацильных соединений по изобретению, когда используемая кислота имеет группы, которые могут вступить в реакции ацилирования, например, гидроксильные или аминогруппы, то перед приготовлением ангидрида эти группы блокируют с помощью защитных групп, например, трет-бутилдиметилсилил-эфиров или трет-BOC групп, соответственно. Например, молочную кислоту превращают в 2-трет-бутилдиметилсилоксипропионовую кислоту с помощью трет-бутилдиметилхлорсилана, после чего проводят гидролиз полученного силилэфира с водным раствором щелочи. Ангидрид получают посредством реакции защищенной кислоты с DCC. При использовании аминокислот приготавливают производное N-трет-BOC (используя стандартные способы), которое затем с помощью DCC превращают в ангидрид. При использовании кислот, содержащих несколько карбоновых групп (например, янтарная, фумарная или адипиновая кислота), ангидрид кислоты нужной дикарбоновой кислоты реагируют с оксипуриновым нуклеозидом или родственным соединениям в пиридине или в пиридине с диметилформамидом или с диметилацетамидом.
Аминокислоты присоединяются к экзоциклическим аминогруппам гуанозина и дезоксигуанозина и к гидроксильным группам альдозного фрагмента оксипуриновых нуклеозидов или родственных соединений посредством стандартных способов с использованием DCC в соответствующем растворителе, в частности в смеси (i) метиленхлорида и (ii) диметилацетамида или диметилформамида.
Нижеследующие примеры являются иллюстративными, ими не ограничиваются способы и композиции по изобретению. Другие модификации и варианты в различных условиях, обычно встречающихся в клинической терапии, которые очевидны для специалистов в данной области, также охвачены настоящим изобретением.
Примеры
Нижеследующие примеры относятся к способам приготовления соединений по изобретению.
Пример 1. Приготовление октаноилгуанозина.
В колбу на 100 мл помещают гуанозин (2,0 г, 7,06 ммоль) и N,N-диметил-4-аминопиридин (0,017 г, 0,14 ммоль). N,N-диметилформамид (25 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (14 мл). Суспензии дают охладиться в течение 10 мин на ледяной бане с NaCl и по капле добавляют октаноилхлорид (1,6 мл, 9,2 ммоль). Смесь перемешивают, при этом она разогревается до 25oC. По прошествии 18 часов смесь переливают в 300 мл 0,1 M ледяного раствора бикарбоната натрия, получая белое твердое вещество, которое отделяют вакуум-фильтрацией, промывают 3 раза горячей водой по 100 мл, высушивают воздухом и рекристаллизуют из горячего метанола.
Пример 2. Приготовление лауроилгуанозина
В колбу на 100 мл помещают гуанозин (2,0 г, 7,06 ммоль) и N,N-диметил-4-аминопиридин (0,017 г, 0,14 ммоль), N,N-диметилформамид (25 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (14 мл). Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl и по капле добавляют лауроилхлорид (2,12 мл, 9,2 ммоль). Смесь перемешивают, при этом она разогревается до 25oC. Через 18 часов смесь выливают в 300 мл ледяного 0,1 M раствора бикарбоната натрия, получая белое твердое вещество, которое отделяют с помощью вакуумной фильтрации, промывают 3 раза горячей водой (по 100 мл), высушивают воздухом и рекристаллизуют из горячего метанола.
Пример 3. Приготовление пальмитоилгуанозина
В колбу на 100 мл помещают гуанозин (2,0 г, 7,06 ммоль) и N,N-диметил-4-аминопиридин (0,017 г, 0,14 ммоль), N,N-диметил-формамид (25 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (14 мл). Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl и по капле добавляют пальмитоилхлорид (2,8 мл, 9,2 ммоль). Смесь перемешивают, при этом она разогревается до 25oC. Через 18 часов смесь выливают в 300 мл ледяного 0,1 M раствора бикарбоната натрия, получая белое твердое вещество, которое отделяют с помощью вакуумной фильтрации, промывают 3 раза горячей водой (по 100 мл), высушивают воздухом и рекристаллизуют из горячего 2-метоксиэтанола.
Пример 4. Приготовление бензоилгуанозина
В колбу на 100 мл помещают гуанозин (2,0 г, 7,06 ммоль) и N,N-диметил-4-аминопиридин (0,017 г, 0,14 ммоль). N,N-диметилформамид (30 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (16 мл). Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl и по капле добавляют бензоилхлорид (1,2 мл, 8,5 ммоль). Смесь перемешивают, при этом она разогревается до 25oC. Через 72 часа смесь выливают в 300 мл 0,1 M раствор бикарбоната натрия (нагретого до 60oC), получая белое твердое вещество, которое отделяют с помощью вакуумной фильтрации (используя среднюю фритту), промывают 3 раза холодной водой по 100 мл и высушивают воздухом.
Пример 5. Приготовление пальмитоилксантозина
В колбу на 100 мл помещают дигидрат ксантозина (1,0 г, 3,52 ммоль) и N, N-диметил-4-аминопиридин (0,0086 г, 0,07 ммоль). N,N-диметилформамид (16 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (8 мл). Суспензию охлаждают 10 мин на ледяной бане с NaCl и по капле добавляют пальмитоилхлорид (1,6 мл, 9,2 ммоль). Смесь перемешивают, при этом она медленно разогревается до 25oC. Через 18 часов смесь переливают в 300 мл ледяного 0,1M раствора бикарбоната натрия, получая белое твердое вещество, которое отделяют вакуумной фильтрацией, промывают 3 раза горячей водой по 100 мл, высушивают воздухом и рекристаллизуют из горячего метанола.
Пример 6. Приготовление пальмитоилинозина
В колбу на 50 мл помещают инозин (1,0 г, 3,73 ммоль) и N,N-диметил-4-аминопиридин (0,017 г, 0,074 ммоль). N,N-диметилформамид (16 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (8 мл). Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl и по капле добавляют пальмитоилхлорид (1,3 мл, 4,1 ммоль). Смесь перемешивают, при этом она медленно разогревается до 25oC. Через 18 часов смесь резко охлаждают небольшим кусочком льда, после чего растворители выпаривают, получая смолу белого цвета. Из смолы выпаривают толуол (20 мл), который затем тщательно титруют, используя 1:1 этилацетат-диэтилэфир. Всплывшее наверх вещество отделяют вакуумной фильтрацией и выпаривают растворители, получая сироп, которые после 24 часов в вакуум-эксикаторе превращается в мягкое аморфное твердое вещество.
Пример 7. Приготовление пальмитоилдезоксиинозина
В колбу на 100 мл помещают дезоксиинозин (1,5 г, 5,95 ммоль) и N,N-диметил-4-аминопиридин (0,036 г, 0,297 ммоль). N,N-диметилформамид (35 мл) добавляют через канюлю при перемешивании, колбу продувают аргоном и через канюлю добавляют пиридин (15 мл). Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl и по капле добавляют пальмитоилхлорид (2,0 мл, 6,54 ммоль). Смесь перемешивают, при этом она медленно разогревается до 25oC. Через 18 часов смесь выливают в 300 мл ледяного 0,1 M раствора бикарбоната натрия, получая белое твердое вещество, которое отделяют вакуумной фильтрацией, промывают 100 мл воды и высушивают в течение ночи в вакуум-эксикаторе, получая 2,72 г (93%) пальмитоилдезоксиинозина.
Пример 8. Приготовление (5-карбоксипентаноил)гуанозина
В 500 мг гуанозина в безводном пиридине добавляют адипиновую кислоту (5 мольных эквивалентов) и бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (BOP C) (1,0 моль. экв.). Смесь перемешивают при комнатной температуре в течение 18 часов, затем под вакуумом удаляют растворитель. Остатки добавляют в 100 мл ледяной воды и доводят pH водного слоя до 3,0, после чего трижды проводят экстракцию 60 мл этилацетата. Соединенные экстракты высушивают безводным сульфатом магния и выпаривают под вакуумом. Остаток подвергают хроматографии на силикагельной колонке и элюируют смесью хлороформэтанола, после чего элюат выпаривают под вакуумом.
Примеры 9-11. Приготовление (5-карбоксигексаноил)гуанозина, (5-карбоксигептаноил)гуанозина и (5-карбоксинонаноил)гуанозина
(5-карбоксигексаноил)гуанозин, (5-карбоксигептаноил)гуанозин и (5-карбоксинонаноил)гуанозин приготавливают из гуанозина, с пимелиновой кислотой, субериновой кислотой и себациновой кислотой, соответственно, используя способ, описанный для приготовления (5-карбоксипентаноил)гуанозина.
Пример 12. Приготовление 3',5'-O,O-бис(5-карбоксипентаноил)-гуанозина
К 500 мг гуанозина в безводном пиридине добавляют адипиновую кислоту (10 мл. экв. ) и бис(2-оксо-3-оксазолидинил)-фосфиновый хлорид (BOP C) (2,0 мол. экв.). Смесь перемешивают при комнатной температуре в течение 18 часов, затем растворитель удаляют под вакуумом. Остаток добавляют в 100 мл ледяной воды и pH водного слоя доводят до 3,0, после чего трижды экстрагируют 60 мл этилацетата. Соединенные экстракты высушивают безводным сульфатом магния и выпаривают под вакуумом. Остаток подвергают хроматографии на силикагельной колонке и элюируют смесью хлороформ-этанол, после чего элюат выпаривают под вакуумом.
Примеры 13-15. Приготовление 3',5'-O,O-бис-(5-карбоксигексаноил)гуанозина, 3', 5'-O, O-бис-(5-карбоксигептаноил)гуанозина и 3',5'-O,O-бис-(5-карбоксинонаноил)гуанозина
3',5'-O,O-бис-(5-карбоксигексаноил)гуанозин, 3',5'-O,O- бис-(5-карбоксигептаноил)гуанозин и 3',5'-O,O-бис-(5-карбоксинонаноил)гуанозин приготавливают из гуанозина с пимелиновой кислотой, субериновой кислотой и себациновой кислотой, соответственно, используя способ, описанный для приготовления (5-карбоксипентаноил)гуанозина.
Пример 16. Приготовление (Na-FMOC-Ne-CBZ-лизил)гуанозина
В 500 мг гуанозина в безводном пиридине добавляют Na-FMOC-Ne-CBZ-лизин (2 мол.экв., фирмы "Сигма") и дициклогексилкарбодиимид (DCC) (1,0 мол.экв.). Смесь перемешивают при комнатной температуре в течение 18 часов, затем растворитель удаляют под вакуумом. Остаток добавляют в 100 мл ледяной воды и pH водного слоя доводят до 3,0, после чего трижды экстрагируют 60 мл этилацетата. Соединенные экстракты высушивают безводным сульфатом магния и выпаривают под вакуумом. Остаток подвергают хроматографии на силикагельной колонке и элюируют смесью хлороформ-этанол, после чего элюат выпаривают под вакуумом.
Пример 17. Приготовление (Na-FMOC-Ne-CBZ-лизил)-2',3'-O-изопропилиденгуанозина
В 2,0 г 2',3'-O-изопропилиденгуанозина (фирмы "Сигма) в безводном пиридине добавляют Na-FMOC-Ne-CBZ-лизин (2 мол.экв., фирмы "Сигма") и дициклогексилкарбодиимид (DCC) (1,0 мол. экв. ). Смесь перемешивают при комнатной температуре в течение 18 часов, затем растворитель удаляют под вакуумом. Остаток добавляют в 100 мл ледяной воды и pH водного слоя доводят до 3,0, а затем трижды экстрагируют 60 мл этилацетата. Соединенные экстракты высушивают безводным сульфатом магния и выпаривают под вакуумом. Остаток подвергают хроматографии на силикагельных колонках и элюируют смесью хлороформ-этанол, после чего элюат выпаривают под вакуумом.
Пример 18. Приготовление (Na-FMOC-Ne-CBZ-лизил)гуанозина
Раствор 1,5 г (Na-FMOC-Ne-CBZ-лизил)-2',3'-O-изопропилиденгуанозина в 18 мл 50% водного раствора HCO2H оставляют на 20 часов при комнатной температуре. Раствор выпаривают досуха, получая осадок, который рекристаллизуют из MeOH-EtOAc.
Пример 19. Приготовление (Na-FMOC-лизил)гуанозина
Раствор (Na-FMOC-Ne-CBZ-лизил)гуанозина (1,0 г) в 150 мл диметилформамида гидрируют в течение 3,5 часов при 48 фунт/кв. дюйм в присутствии 0,7 г 10% Pd/C. Смесь фильтруют и фильтрат выпаривают, а затем обрабатывают 30 мл EtOH, после чего 20 мл H2O. Полученное твердое вещество рекристаллизуют из MeOH-EtOAc.
Пример 20. Приготовление лизилгуанозина
В перемешанный раствор 800 мг (Na-FMOC-лизил)гуанозина в безводном пиридине добавляют пиперидин (4 моль.экв.). Смесь перемешивают в течение 5 часов при 0oC, затем выпаривают досуха. Остаток растворяют в диметилформамиде и очищают, медленно добавляя раствор диметилформамида в быстроперемешиваемый раствор EtOH-Et20, получая осадок.
Пример 21. Приготовление пальмитоил-2'-дезоксигуанозина
В колбу на 250 мл помещают 2'-дезоксигуанозинмоногидрат (5,0 г, 17,5 ммоль), триэтиламин (3,13 мл, 22,4 ммоль) и N,N-диметил-4-аминопиридин (0,046 г, 0,37 ммоль). N,N-диметилформамид (130 мл) добавляют через канюлю при перемешивании и продувают колбу аргоном. Суспензию охлаждают в течение 10 мин на ледяной бане с NaCl, после чего по капле добавляют пальмитоилхлорид (6,3 мл, 20,6 ммоль). Смесь перемешивают, при этом она медленно разогревается до 25oC. Через 72 часа смесь перемеливают при перемешивании в 400 мл 1:1 смеси воды и насыщенного водного раствора бикарбоната натрия, каковую смесь предварительно нагревают до 60oC. Полученное белое твердое вещество отделяют вакуум-фильтрацией, промывают водой и высушивают.
Пример 22. Приготовление 3'-O-пальмитоил-2'-дезоксигуанозина
Для приготовления этого соединения используют способ приготовления пальмитоил-2'-дезоксигуанозина, заменяя соответствующим количеством 5'-O-диметокситритил-дезоксигуанозина 2'-дезоксигуанозинмоногидрат и освобождая от защиты гидроксильную 5' группу следующим образом: диметокситритильную группу удаляют посредством перемешивания в 80% водном растворе уксусной кислоты при 25oC в течение 1 часа, сырой продукт отделяют фильтрацией, в течение 1 часа растирают в метаноле, восстанавливают продукт фильтрацией и высушивают.
Пример 23. Приготовление 3,5'-O,O-дипальмитоил-2'-дезоксигуанозина
Это соединение получают как побочный продукт 5'-O-пальмитоил- 2'-дезоксигуанозина, приготавливаемого вышеописанным способом, и отделяют следующим образом: сырой продукт суспендируют в толуоле с силикалегем, выпаривают толуол, помещают полученное твердое вещество в колонку с силикагелем, прикрытым тонким слоем оксида алюминия, элюируют колонку хлороформ-метанолом и выпаривают соответствующие фракции.
Пример 24. Приготовление октаноил-2'-дезоксигуанозина
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующее количество пальмитоилхлорида октаноилхлоридом.
Пример 25. Приготовление лауроил-2'-дезоксигуанозина
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующее количество пальмитоилхлорида октаноилхлоридом.
Пример 26. Приготовление бензоил-2'-дезоксигуанозина
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующим количеством бензоилхлорида пальмитоилхлорид и заменяя на смесь 1:1 ледяной воды с насыщенным водным раствором бикарбоната натрия в процессе обработки.
Пример 27. Приготовление бутирил-2'-дезоксигуанозина
Настоящее соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующим количеством бутирилхлорида пальмитоилхлорид и отделяя соединение следующим образом: через 72 часа растворитель выпаривают, полученный материал перетирают в смеси 1:1 диэтилового эфира с этилацетатом и восстанавливают продукт фильтрацией.
Пример 28. Приготовление пальмитоил-8-бромо-2'-дезоксигуанозина
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующим количеством 8-бромогуанозина 2'-дезоксигуанозинмоногидрат.
Пример 29. Приготовление пальмитоил-8-меркапто-2'-дезоксигуанозина
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующим количеством 8-меркаптогуанозина 2'-дезоксигуанозинмоногидрат.
Пример 30. Приготовление пальмитоилгуанозин-2',3'-(ациклический) диалкоголя
Это соединение приготавливают так же, как пальмитоил-2'-дезоксигуанозин, заменяя соответствующим количеством гуанозин-2',3'-(ациклический) диалкоголя 2'-дезоксигуанозинмоногидрат.
Нижеследующие примеры иллюстрируют преимущества соединений по изобретению in vivo.
Пример 31. Гуанозин и гуанин улучшают восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (CP) (275 мг/кг, парентерально) вводили 30 самкам мышей Balb/C, массой приблизительно 20 г каждая. Спустя 24 часа и ежедневно в течение 6 дней мышам проводили внутрибрюшинные инъекции по 0,4 мл либо физ. раствора (контрольным экземплярам), либо гуанина (5 мкмолей/мышь/день), либо гуанозина (5 мкмолей/мышь/день). На 7-й день всем 10 мышам каждой из трех групп пустили кровь, а затем умертвили путем смещения шейных позвонков. Селезенки удалили и взвесили, провели полный анализ крови.
Введение гуанидина или гуанозина приводило к существенному увеличению массы селезенок, по сравнению с контрольными экземплярами, которым вводили физ.раствор (фиг. 1). Аналогично, введение гуанина или гуанозина приводило к значительному увеличению периферических лейкоцитов и нейтрофилов (фиг. 2 и 3). Таким образом, введение мышам гуанина или гуанозина после нанесения ущерба в результате введения циклофосфамида однозначно ускоряет регенерацию миелопоэза.
Пример 32. Влияние ацилзамещенного гуанозина на восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (CP) (275 мг/кг, парентерально) вводили 70 самкам мышей Balb/C, массой приблизительно 20 г каждая. Спустя 24 часа и ежедневно в течение 6 дней мышам проводили внутрибрюшинные инъекции либо физ. раствора (контрольным экземплярам). "Твин-80" (0,2%), гуанозин (5 мкмолей/мышь/день в 0,2% "Твин-80"), или 2,5 мкмолей на мышь в день одного из следующих ацилированных производных гуанозина в 0,2% "Твин-80": триацетилгуанозин, октаноилгуанозин, лауроилгуанозин или пальмитоилгуанозин. На 7-й день после введения циклофосфамида всем 10 животным от каждой из 7 групп пускали кровь, а затем мышей умертвляли путем смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили полный анализ крови.
Не отмечалось существенных отличий по массе селезенок между группами, которым вводили физ.раствор, "Твин-80" или неацилированный гуанозин. Однако введение мышам ацетилгуанозина, октаноилгуанозина, лауроилгуанозина или пальмитоилгуанозина приводило к значительному увеличению масс селезенок на 7-й день, по сравнению с контрольными экземплярами (фиг. 4). Введение каждого и всех этих соединений значительно повышало число лейкоцитов в крови. Однако с увеличением длины цепи ацильной группы возрастало влияние препаратов на число лейкоцитов (сравнение проводилось в пределах группы препаратов, испытанных в ходе данного эксперимента). В данном эксперименте введение пальмитоилгуанозина оказывало наибольшее влияние на общее число лейкоцитов (фиг. 5); аналогичная связь между длиной цепи ацильного радикала и изменением гемопоэза наблюдалась и в отношении общего числа нейтрофилов (фиг.6).
Пример 33. Пальмитоилгуанозин повышает выживаемость облученных мышей
Тридцать самок мышей Balb/C массой по 20 грамм каждая облучили гамма-излучением с применением кобальта-60 при мощности дозы излучения 7,3 рад/мин. Суммарная доза составляла либо 700, либо 725, либо 750 рад. Через 24 часа и ежедневно в течение 6 дней мышам проводили внутрибрюшинные инъекции либо физ.раствора (контрольным экземплярам), либо 50 мг/кг пальмитоилгуанозина. Число выживших животных в каждой группе фиксировали в течение 30 дней.
Как показано в Таблице 1, все облученные мыши, которым вводили физ.раствор, погибли в течение 30-дневного периода наблюдений, даже те мыши, которые получили минимальную дозу облучения. Наоборот, все мыши, которым вводили пальмитоилгуанозин, выжили. (Пальмитоилгуанозин вводили только мышам, получившим 2 высшие дозы облучения).
Таким образом, введение мышам пальмитоилгуанозина после облучения значительно повышает выживаемость.
Предварительное введение пальмитоилгунозина перед облучением также улучшало выживаемость.
Пример 34. Пальмитоилгуанозин повышает количество колониеобразующих единиц в костном мозге мышей, выздоравливающих после введения циклофосфамида
Семидесяти двум самкам мышей Balb/C, массой приблизительно 20 г каждая, вводили циклофосфамид (275 мг/кг) посредством внутрибрюшинных инъекций. Через 24 часа и ежедневно после этого мышам проводили внутрибрюшинные инъекции по 0,4 мл либо физ. раствора (контрольным экземплярам), либо пальмитоилгуанозина (2,5 мкмолей/мышь/день в 0,2% "Твин-80"). На 3, 5, 7 и 10-й день после введения циклофосфамида по 6 животных из каждой умертвляли посредством смещения шейных позвонков, и удаляли у каждого животного левую бедренную кость в стерильных условиях. Затем клетки костного мозга вымывали из бедренных костей с помощью среды "McCoy' 5a Modified", используя измерительную иглу N 23. Клетки из бедренных костей одной и той же группы сливали вместе, слегка взбалтывали и производили подсчет с помощью гемоцитометра. Клеточные взвеси добавляли в среду "McCoy's Modified 5a", содержащую 15% телячей сыворотки, 1х "Kanamycin", 0,3% агара и 3% сыворотки, стимулированной эндотоксином. Затем взвеси высевали на чашки с плотностью 1,2•105 клеток/мл, за исключением клеток группы 3-го дня, для которых, ввиду низкого числа клеток, плотность засева составляла 1,0•105. Клетки каждой группы высевали пять раз. Через 7 дней в культуре (при 37oC в 5% CO и увлажненном воздухе) совокупности 50 или более клеток ("колонии") были подсчитаны с помощью препаровальной лупы с 25-кратным увеличением.
По каждому моменту времени число колоний, в пересчете на одно бедро у мышей, которым вводили пальмитоилгуанозин, было намного выше числа колоний на бедро у мышей, которым вводили физ. раствор (фиг. 7 и таблица 2). Наибольшие различия между группами наблюдались на 5-й день.
Пример 35. Зависимость эффективности пальмитоилгуанозина по восстановлению гемопоэза после введения циклофосфамида от времени начала курса лечения
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 81 самке мышей Balb/C массой приблизительно 20 г каждая. Через 24 часа начинали лечение. Мышам проводили инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольные экземпляры), "Твин-80" (0,2%), либо пальмитоилгуанозина (5 мкмолей/мышь/день в 0,2% "Твин-80"). Каждой группе начинали курс лечения через различные промежутки времени. Контрольной группе делали инъекции физ. раствора в течение 1-6-го дней. Группе, предназначенной для лечения "Твин-80", проводили инъекции в 1-4-й дни, 4-6-й или 1-6-й. Мышам, предназначенным для лечения пальмитоилгуанозином, проводили инъекции в 1-2-й дни, 1-4-й, 3-5-й, 4-6-й или 1-6-й дни. Если группе мышей, предназначенных для лечения "Твин-80" или пальмитоилгуанозином, в данный день не проводили инъекции этих препаратов, то им делали внутрибрюшинно инъекции физ. раствора. Таким образом, имелось 9 групп по 9 животных в каждой группе. На 7-й день введение циклофосфамида всем животным пускали кровь и затем умертвляли их посредством смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили полный анализ крови.
Масса селезенок оказалась выше по сравнению с контрольными экземплярами у всех групп, проходивших лечение, за исключением мышей, которым делали инъекции "Твин-80" на 1-4-й дни (фиг. 8). Введение пальмитоилгуанозина в любой из периодов, включая 1 и 2-й дни, привело к значительному увеличению масс селезенок по сравнению с контрольными экземплярами (фиг. 8). Кроме того, лечение пальмитоилгуанозином (в любой из указанных периодов) приводило к увеличению масс селезенок мышей даже по сравнению с мышами, которых лечили только "Твин-80". Лечение пальмитоилгуанозином в течение 1-4 или 1-6-го дней показывало наиболее сильное влияние на изменение масс селезенок.
Отмечено повышение числа лейкоцитов в каждой группе мышей, которым вводили пальмитоилгуанозин, по сравнению с контрольными экземплярами (фиг. 9). Более того, отмечено увеличение числа лейкоцитов у всех мышей, которым вводили пальмитоилгуанозин (за исключением группы, которой вводили его только в течение 4-6-го дней), по сравнению с числом лейкоцитов у мышей, которым вводили "Твин-80" в любой из указанных периодов. Наилучшие показатели были у мышей, которым вводили пальмитоилгуанозин в течение 1-6-го дней. Количество лейкоцитов в этой группе было также значительно выше, чем во всех других группах мышей, которым вводили пальмитоилгуанозин. Те же результаты показывают и данные по числу нейтрофилов (фиг. 10): введение пальмитоилгуанозина в течение 1-6-го дней дало максимальное увеличение числа нейтрофилов. Лечение пальмитоилгуанозином только в течение 1 и 2-го дней вызвало значительное увеличение общего числа нейтрофилов по сравнению с контрольными экземплярами и с мышами, которым вводили "Твин-80".
Лечение "Твин-80" не оказало никакого влияния на число лимфоцитов ни в одни из указанных периодов времени. Только лечение пальмитоилгуанозином в течение 1-2 и 1-6 дней (в последнем случае опять наблюдались максимальные показатели) привело к увеличению количеств лимфоцитов (фиг. 11).
Пример 36. Пальмитоилгуанозин улучшает восстановление гемопоэза после введения 5-фторурацила
5-фторурацил (5-Fu) (150 мг/кг, внутрибрюшинно) вводили 40 самкам мышей Balb/C массой приблизительно 20 г каждая. Через 24 часа и ежедневно в течение 8 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземпляром), либо 5'-O-пальмитоилгуанозина (2,5 мкмолей/мышь/день в 0,2% "Твин-80"). На 6-й и на 14-й дни после введения 5-фторурацила половине животных из каждой группы пускали кровь, а затем мышей умертвляли путем смещения шейных позвонков. Селезенки удалили и взвесили, провели полный анализ крови.
На 7-й день было отмечено небольшое, но статистически-значимое увеличение масс селезенок в группе, которой вводили пальмитоилгуанозин (фиг. 12). Других отличий между контрольными и испытуемыми экземплярами на 7-й день не наблюдалось. Однако на 14-й день было отмечено, что кровь тех животных, которым вводили пальмитоилгуанозин, содержала значительно большие количества лейкоцитов, лимфоцитов, нейтрофилов и тромбоцитов, и кроме того масса селезенок этих животных была значительно больше (фиг. 13-15).
Пример 37. Пальмитоилгуанозин улучшает восстановление гемопоэза после введения 5-фторурацила
5-фторурацил (5-Fu) (150 мг/кг, внутрибрюшинно) вводили 45 самкам мышей Balb/C массой приблизительно 20 г каждая. Через 24 часа и ежедневно в течение 7 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо пальмитоилгуанозина (2,5 мкмолей/мышь/день в 0,2% "Твин-80"). На 8-й, 10-й и 12-й дни после введения 5-фторурацила девяти животным из каждой группы пускали кровь, а затем их умертвляли путем смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили полный анализ крови.
На 8-й день количество тромбоцитов в анализах крови мышей, которых лечили пальмитоилгуанозином, было значительно выше, чем количество тромбоцитов в контрольной группе (фиг. 16). Никаких других статистически-значимых отличий между группами на 8-й день не отмечалось. На 10-й день помимо повышенного количества тромбоцитов в группе, подвергавшейся лечению, отмечалось также значительное увеличение масс селезенок по сравнению с контрольной группой, которой вводили физ. раствор (фиг. 17). На 12-й день массы селезенок у мышей, проходивших курс лечения, вдвое превышали массы селезенок у мышей контрольной группы, а число нейтрофилов в крови мышей, проходивших лечение, втрое превышало число нейтрофилов в крови мышей контрольной группы (фиг. 17 и 18). На фиг. 19 представлены данные по количеству лейкоцитов.
Пример 39. Пальмитоилдезоксиинозин и пальмитоилгуанозин усиливают гемопоэз у нормальных мышей
Нормальным, т. е. не подвергавшимся никаким воздействиям, самкам мышей Balb/C приблизительно по 20 г каждая делали по 4 или 9 внутрибрюшинных инъекций (по одной инъекции в день) по 0,4 мл либо "Твин-80" (0,2%) (контрольным экземплярам), либо пальмитоилгуанозина (2,5 мкмолей/мышь/день), либо пальмитоилдезоксиинозина (2,5 мкмолей/мышь/день). Через 24 часа после 4-й или 9-й инъекции 5 или 6 животным из каждой из трех групп пускали кровь и умертвляли мышей посредством смещения позвонков. Селезенки удаляли и взвешивали, проводили полный анализ крови.
На 5-й день массы селезенок были значительно выше у мышей, которым вводили пальмитоилгуанозин и пальмитоилдезоксиинозин, по сравнению с мышами, которым вводили физ. раствор (фиг. 20). На 10-й день массы селезенок, суммарное содержание лейкоцитов и нейтрофилов были значительно выше у мышей, которым вводили пальмитоилдезоксиинозин, чем у мышей контрольной группы, которым вводили "Твин-80" (фиг. 20-22). У мышей, которым вводили пальмитоилуганозин, отмечалось также значительное повышение числа лейкоцитов по сравнению с мышами контрольной группы.
Пример 39. Влияние различных доз октаноилгуанозина на восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 45 самкам мышей Balb/C массой приблизительно 20 г каждая. Спустя 24 часа и ежедневно после этого в течение 6 дней мышам делали инъекции (внутрибрюшинно) по 0,4 мл либо физ. раствора (контрольным экземплярам), либо "Твин-80" (0,5%), либо октаноилгуанозина в одной из трех доз: 0,5, 2,5, или 5 мкмолей/мышь/день в 0,5% "Твин-80". На 7-й день после введения циклофосфамида всем 9 животным из каждой из 5 групп пустили кровь и умертвили животных посредством смещения позвонков. Селезенки удалили и взвесили, провели полный анализ крови.
Лечение мышей, подвергнутых инъекции циклофосфамида, с помощью "Твин-80" привело к некоторому увеличению масс селезенок в среднем, но лечение октаноилгуанозином в каждой из трех указанных доз привело к значительному увеличению масс селезенок по сравнению с контрольными экземплярами и к существенному увеличению масс селезенок по сравнению с мышами, которым вводили "Твин-80" (фиг. 23). У мышей, которых лечили самой высокой дозой октаноилгуанозина (10 мкмолей), массы селезенок были наибольшими (данные не представлены на диаграмме). Еще более важен тот факт, что общее число лейкоцитов и общее число нейтрофилов оказалось значительно выше, чем у контрольных экземпляров, причем увеличение этих показателей зависело от увеличения дозы (фиг. 24 и 25). Однако средняя доза (2,5 мкмолей) проявила почти такую же эффективность в отношении ускорения восстановления гемопоэза, что и самая высокая доза.
Пример 40. Гистологическое исследование селезенок мышей, которых лечили октаноилгуанозином после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 30 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и ежедневно в течение 6 последующих дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо "Твин-80" (0,5%), либо октаноилгуанозина (5,0 мкмолей/мышь/день в 0,5% "Твин-80"). На 7-й день после введения циклофосфамида всем 10 мышам из каждой группы пускали кровь, а затем умертвляли животных путем смещения шейных позвонков. Селезенки удаляли, взвешивали и помещали в 10% раствор формалина для последующего гистологического исследования. По взятой крови делали клинический анализ крови.
Лечение мышей "Твин-80" привело к незначительному увеличению масс селезенок по сравнению с контрольными экземплярами, которым вводили физ. раствор. Но лечение окатноилгуанозином дало значительное увеличение масс селезенок по сравнению с контрольными экземплярами, которым вводили физ. раствор, и по сравнению с мышами, которых лечили "Твин-80" (фиг. 26). Гистологическое исследование селезенок показало, что во всех группах, проходивших лечение, гистология тканей была нормальной, и что в селезенках мышей, которых лечили окатноилгуанозином, лимфопоэз и миелопоэз был выше (т.е. наблюдалось увеличение белой пульпы селезенки и красной пульпы селезенки), по сравнению с контрольными экземплярами, которым вводили физ. раствор, и по сравнению с мышами, которых лечили "Твин-80" (фиг. 27). Эти наблюдения указывают на то, что лечение октаноилгуанозином мышей, которым вводили циклофосфамид, ускоряет как миелопоэз, так и лимфопоэз, по крайней мере на уровне селезенки.
Лечение мышей октаноилгуанозином привело также к однозначному повышению числа периферических белых кровяных телец и нейтрофилов по сравнению с контрольными экземплярами и мышами, которых лечили "Твин-80" (фиг. 28 и 29).
Пример 41. Бензоилгуанозин улучшает восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 48 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и в течение последующих 6 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо бензоилгуанозина (2,5 мкмолей/мышь/день в 0,2% "Твин-80"), либо пальмитоилгуанозина (2,5 мкмолей/мышь/день в 0,2% "Твин-80"). На 7-й и 10-й дни после введения циклофосфамида 8 животным из каждой из трех групп пускали кровь, а затем умертвляли мышей путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 7-й день общее количество лейкоцитов, нейтрофилов и масса селезенок были значительно увеличены по сравнению с контрольными экземплярами в обеих группах мышей, проходивших лечение как бензоилгуанозином, так и пальмитоилгуанозином (фиг. 30-32, соответственно). Между этими группами никаких статистически-значимых отличий не наблюдалось. На 10-й день количество тромбоцитов в обеих группах мышей, проходивших лечение ацилированным гуанозином, было значительно выше, чем в контрольной группе (фиг. 33).
Пример 42. Пальмитоилксантозин и пальмитоилдезоксиинозин улучшают восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 36 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и ежедневно в течение последующих 4 или 6 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо пальмитоилдезоксиинозина (2,5 мкмолей/мышь), либо пальмитоилксантозина (2,5 мкмолей/мышь). На 5-й и 7-й дни после введения циклофосфамида 6 из 12 животных каждой из трех групп пускали кровь, а затем умертвляли мышей путем смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 5-й день массы селезенок, общее число лейкоцитов и нейтрофилов было значительно выше в группе, которую лечили пальмитоилдезоксиинозином по сравнению с контрольными экземплярами (фиг. 34, 35 и 36, соответственно). К этому моменту времени общее число лейкоцитов и число нейтрофилов у этой группы мышей было значительно выше, чем у мышей, которых лечили пальмитоилксантозином.
На 7-й день после введения циклофосфамида массы селезенок, общее число лейкоцитов и нейтрофилов было значительно выше, у обеих групп мышей, которых лечили пальмитоксантозином и пальмитоилдезоксиинозином, по сравнению с контрольной группой (фиг. 34, 35 и 36).
Пример 43. Пальмитоилинозин улучшает восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 48 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и в течение последующих 6 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо октаноилгуанозина (2,5 мкмолей/мышь), либо лауроилгуанозина (2,5 мкмолей/мышь), либо пальмитоилгуанозина (2,5 мкмолей/мышь), либо пальмитоилинозина (2,5 мкмолеей/мышь), либо пальмитоилксантозина (2,5 мкмолей/мышь). На 7-й день после введения циклофосфамида 8 мышам из каждой из шести групп пускали кровь, а затем умертвляли животных путем смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
Массы селезенок, общее число лейкоцитов и число нейтрофилов были значительно выше в каждой из 5 групп мышей, которых лечили, по сравнению с контрольными экземплярами (фиг. 37, 38 и 39 соответственно). К этому времени никаких статистически значимых отличий между данными пятью группами не наблюдалось.
Пример 44. Ацильные производные родственных соединений оксипуриновых нуклеозидов улучшают восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 96 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и ежедневно после этого мышам делали инъекции по 0,4 мл внутрибрюшинно либо "Твин-80" (0,2%) (контрольным экземплярам), либо пальмитоилдезоксигуанозина (2 мкмолей/мышь), либо пальмитоилдезоксиинозина (2 мкмолей/мышь), либо пальмитоилацикловира (2 мкмолей/мышь), либо пальмитоиларабинозилгуанина (2 мкмолей/мышь), либо пальмитоиларабинозилгипоксантина (2 мкмолей/мышь), либо монопальмитоилгуанозин 2', 3'-(ациклический)диалкоголя (2 мкмолей/мышь), либо пальмитоил-8-тиогуанозина (2 мкмолей/мышь). На 5-й и на 7-й дни после введения циклофосфамида 6 животным из каждой из 8 групп пускали кровь, а затем умертвляли мышей путем смещения шейных позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
Общее число нейтрофилов было значительно выше по сравнению с контрольной группой на 5-й и 7-й дни во всех группах мышей, проходивших лечение (фиг. 40*).
*На всех трех диаграммах, иллюстрирующих настоящий пример, использованы следующие сокращения:
Tw = "Твин-80"
ACV = пальмитоилацикловир
AHx = пальмитоиларабинозилгипоксантин
8TG = пальмитоил-8-тиогуанозин
PdG = пальмитоилдезоксигуанозин
AG = пальмитоиларабинозилгуанин
dI = пальмитоилдезоксиинозин
ACC = монопальмитоилгуанозин 2',3'-(ациклический) диалкоголь
Число лейкоцитов было значительно выше по сравнению с контрольной группой во всех группах, кроме одной (1-O-пальмитоилацикловир) на 5-й день и во всех 8 группах, проходивших лечение на 7-й день (фиг. 41).
На 5-й день масса селезенок была значительно выше по сравнению с контрольной группой в следующих группах:
- монопальмитоилгуанозин 2',3'-(ациклический)диалкоголь,
- пальмитоилдезоксиинозин, пальмитоилгуанозин.
Масса селезенок была значительно увеличена на 7-й день во всех группах, проходивших лечение, за исключением тех групп, которых лечили пальмитоиларабинозилгуанином и пальмитоиларабинозилгипоксантином (фиг. 42).
Пример 45. Ацильные производные дезоксигуанозина улучшают восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 88 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и ежедневно после этого мышам делали инъекции по 0.4 мл внутрибрюшинно, либо "Твин-80" (0,2%) (контрольным экземплярам), либо 3'-O-пальмитоилдезоксигуанозина (2 мкмоля/мышь), либо бутирилдезоксигуанозина (2 мкмоль/мышь), либо пальмитоил-N-изобутирилдезоксигуанозина (2 мкмоля/мышь), либо лаурилдезоксигуанозина (2 мкмоля/мышь), либо октаноилдезоксигуанозина (2 мкмоля/мышь), либо пальмитоилдезоксигуанозина (2 мкмоля/мышь). На 5-й и на 7-й дни после введения циклофосфамида 6 или 7 животным из каждой из 7 групп пускали кровь, а
затем мышей умертвляли путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 5-й день массы селезенок и общее число нейтрофилов были значительно выше (по сравнению с контрольными экземплярами) в группах, где вводили следующие соединения: 3'-O-пальмитоилдезоксигуанозин, пальмитоил-N-изобутирилдезоксигуанозин и пальмитоилдезоксигуанозин (фиг. 43 и 44). На 7-й день массы селезенок и общее число нейтрофилов были значительно выше (по сравнению с контрольными экземплярами) во всех группах, проходивших лечение.
Количество лейкоцитов было значительно выше на 5-день в группах, где применяли пальмитоилдезоксигуанозин. На 7-й день число лейкоцитов было значительно выше по сравнению с контрольными экземплярами во всех группах, подвергавшихся лечению. (фиг. 45).
Пример 46. Влияние различных доз пальмитоилдезоксигуанозина на улучшение восстановления гемопоэза после циклофосфамида
Циклофосфамид (СР) (275 мг/кг, внутрибрюшинно) вводили 85 самкам мышей Balb/C, массой приблизительно 20 г каждая. Через 24 часа и ежедневно после этого мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо пальмитоилдезоксигуанозина в одной из четырех доз: 0,2, 0,4, 1,0 или 2,0 мкмолей/мышь. На 5-й и 7-й дни после введения циклофосфамида 9 и 8 животным, соответственно, из каждой из 5 групп пускали кровь, а затем умертвляли мышей путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
Массы селезенок, число лейкоцитов и общее число нефтрофилов значительно превышали эти показатели контрольной группы на 5-й и 7-й дни во всех четырех группах, проходящих лечение, за исключением группы, которой вводили самую низкую дозу (0,2) пальмитоилгуанозина на 5-й день (фиг. 46, 47 и 48). Отмечена однозначная зависимость от доз: чем выше доза, тем больше массы селезенок и число клеток крови.
Пример 47. Сопоставление эффективности различных доз пальмитоилдезоксигуанозина и пальмитоилгуанозина для улучшения восстановления гемопоэза после введения циклофосфамида
Циклофосфамид (CP) (275 мг/кг, внутрибрюшинно) вводили 96 самкам мышей Balb/C, массой приблизительно 20 г каждая, через 24 часа и ежедневно после этого мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольным экземплярам), либо пальмитоилгуанозина в одной на четырех доз: 0,2, 0,4, 1,0 и 2,0 мкмолей/мышь, либо пальмитоилдезоксигуанозина в дозе 1,0 мкмолей/мышь. На 5-й и 7-й дни после введения циклофосфамида 8 животным из каждой из 6 групп пускали кровь, а затем умертвляли мышей путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
Массы селезенок, число лейкоцитов и общее число нейтрофилов на 5-й день были значительно выше (по сравнению с контрольными экземплярами) у мышей, которым вводили самую высокую дозу пальмитоилгуанозина (2,0 мкмолей/мышь), и у мышей, которым вводили пальмитоилдезоксигуанозин (фиг. 49, 50 и 51). Пальмитоилгуанозин в дозе 1,0 мкмолей/мышь также давал значительное увеличение общего числа нейтрофилов на 5-й день. На 7-й день массы селезенок, число лейкоцитов и общее число нейтрофилов были значительно выше, чем у контрольных экземпляров в тех группах мышей, которым делали инъекции пальмитоилгуанозина в дозах 1,0 и 2,0 мкмолей/мышь, и у мышей, которым вводили пальмитоилдезоксигуанозин. Отмечена выраженная зависимость от дозы: увеличение дозы пальмитоилгуанозина дает увеличение масс селезенок и числа клеток крови. Пальмитоилдезоксигуанозин обнаружил большую эффективность в повышении этих показателей, чем те же или даже в два раза большие дозы пальмитоилгуанозина.
Пример 48. Эффективность различных доз пальмитоилдезоксигуанозина для улучшения восстановления гемопоэза после введения циклофосфамида
Циклофосфамид (CP) (275 мг/кг, внутрибрюшинно) вводили 112 самкам мышей Balb/C, массой приблизительно 20 г каждая.
Через 24 часа и ежедневно после этого мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольная группа), либо пальмитоилдезоксигуанозина в одной из шести различных доз: 0,04, 0,08, 0,2, 0,4, 0,6 или 0,8 мкмолей/мышь. На 5-й и на 7-й дни после введения циклофосфамида 8 животным из каждой из 7 групп пускали кровь, а затем мышей умертвляли путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 5-й день массы селезенок значительно превышали массы селезенок контрольной группы во всех группах мышей, которым вводили пальмитоилдезоксигуанозин в дозах от 0,2 мкмолей/мышь и выше, а на 7-й день такая картина наблюдалась во всех группах мышей, за исключением группы, которой вводили пальмитоилдезоксигуанозин в дозе всего 0,04 мкмолей/мышь (фиг. 52).
На 5-й день количество лейкоцитов было значительно выше, по сравнению с контрольной группой, во всех группах мышей, которым вводили пальмитоилдезоксигуанозин в дозах от 0,4 мкмолей/мышь и выше (фиг. 53). На 7-й день статистически-значимые отличия наблюдались в группах, которым вводили это соединение во всех дозах.
На 5-й день и на 7-й день общее количество нейтрофилов значительно превышало показатели контрольной группы у всех мышей, которым вводили пальмитоилдезоксигуанозин во всех 6 дозах (фиг. 54).
Наблюдалась однозначная зависимость от величины дозы: чем выше доза, тем больше масса селезенки и выше число клеток крови.
Пример 49. Пальмитоилдезоксигуанозин улучшает восстановление числа нейтрофилов, тромбоцитов и лимфоцитов у крыс, которым ввели циклофосфамид
Циклофосфамид (CP) (40 мг/кг, внутрибрюшинно) ввели 16 самцам крыс F344 массой приблизительно 200 г каждый. Через 24 часа и ежедневно после этого крысам делали инъекции по 0,5 мл внутрибрюшинно либо физ. раствора (контрольной группе), либо пальмитоилдезоксигуанозина в дозе 10 мкмолей/крыса. На 5-й, 7-й и 10-й дни после введения циклофосфамида у всех 8 животных из каждой группы брали кровь и делали клинический анализ крови. На 10-й день всех крыс умертвили, селезенки удалили и взвесили.
Во все дни проведения анализов число лейкоцитов и общее число нейтрофилов у крыс, которым вводили пальмитоилдезоксигуанозин, значительно превышали аналогичные показатели у контрольной группы (фиг. 55 и 56). На 10-й день отмечалось значительное увеличение числа тромбоцитов и лимфоцитов в группе крыс, которым вводили пальмитоилдезоксигуанозин (фиг. 57 и 58). Массы селезенок у крыс, проходивших лечение, также значительно превышали массы селезенок в контрольной группе.
Результаты по крысам подтверждают вышеописанные результаты испытаний на мышах и свидетельствуют о том, что ацилированные производные пуриновых нуклеозидов эффективно улучшают восстановление гемопоэза после нарушений, вызванных химическими препаратами. Важным результатом настоящего эксперимента является наличие устойчивых повышенных уровней лейкоцитов после прекращения лечения пальмитоилдезоксигуанозином.
Пример 50. Ацильные производные соединений, родственных оксипуриновым нуклеозидам, повышают гемопоэз у нормальных мышей
Нормальным самкам мышей Balb/C массой приблизительно 20 г каждая ежедневно вводили по 0,4 мл внутрибрюшинно либо физ. раствор (контрольной группе), либо пальмитоилгуанозин (2,6 мкмолей/мышь), либо пальмитоилдезоксигуанозин (2,6 мкмолей/мышь), либо монопальмитоилгуанозин 2',3'-(ациклический)диалкоголь (2,6 мкмолей/мышь), либо пальмитоил-8-бромогуанозин (2,6 мкмолей/мышь) в течение 4 дней. На 5-й день всем 3 животным из каждой из 5 групп пускали кровь, а затем умертвляли их путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови. У каждой мыши брали костный мозг из бедренной кости и на мазках костного мозга проводили определение лейкоцитарной формулы.
На всех диаграммах, иллюстрирующих настоящий пример (фиг. 59 - 61), использованы следующие сокращения:
P8BG = пальмитоил-8-бромогуанозин
PG-CIl = монопальмитоилгуанозин 2',3'-(ациклический)диалкоголь
PG = пальмитоилгуанозин
PdG = пальмитоилдезоксигуанозин
Массы селезенок значительно превышали массы селезенок контрольной группы у мышей, которых лечили следующими соединениями: пальмитоилгуанозин 2',3'-(ациклический)диалкоголем, пальмитоилдезоксигуанозином и пальмитоилгуанозином (фиг. 59).
Число тромбоцитов было значительно выше во всех группах, проходивших лечение, за исключением группы, которой вводили пальмитоилгуанозин 2',3'-(ациклический)диалкоголь (фиг. 60).
Число миелоцитов (обязательных предшественников нейтрофилов) значительно превышало показатели контрольной группы у мышей, которым вводили монопальмитоилгуанозин 2',3'-(ациклический)диалкоголь, пальмитоилдезоксигуанозин и пальмитоил-8-бромогуанозин (фиг. 61).
Эти результаты свидетельствуют об эффективности некоторых из указанных соединений в позитивном изменении гемопоэза у здоровых животных. Они ясно говорят об эффективности настоящих соединений на уровне костного мозга.
Пример 51. Предварительное лечение мышей пальмитоилоксигуанозином улучшает восстановление гемопоэза после введения фторурацила
28 самкам мышей Balb/C массой приблизительно 20 г каждая делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольной группе), либо пальмитоилдезоксигуанозина (1 мкмоль/мышь) ежедневно в течение трех дней. На четвертый день всем 28 животным вводили 5-фторурацил (5-FU) (150 мг/кг, внутрибрюшинно). На 5-й, 8-й и 11-й дни после введения 5-фторурацила 4 (на 5-й день) или 5-ти (на 8-й и 11-й дни) животным из обеих групп пускали кровь, а затем умертвляли их путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 5-й день наблюдалось значительное увеличение числа тромбоцитов в группе, проходившей лечение, по сравнению с контрольной группой. На 8-й день массы селезенок, число тромбоцитов и общее число нейтрофилов у мышей, проходивших предварительное лечение пальмитоилдезоксигуанозином, значительно превышали аналогичные показатели в контрольной группе. На 11-й день у животных, проходивших предварительное лечение пальмитоилдезоксигуанозином, массы селезенок, число лейкоцитов, тромбоцитов, общее число нейтрофилов и число лимфоцитов значительно превосходили эти показатели в контрольной группе (фиг. 62, 63, 64 и 65).
Эти результаты показывают, что предварительное лечение животных пальмитоилдезоксигуанозином существенно смягчает воздействие 5-фторурацила на иммунную систему и число клеток крови.
Пример 52. "Твин-80" улучшает восстановление гемопоэза после введения циклофосфамида и повышает эффективность октаноилгуанозина
Циклофосфамид (CP) (275 мг/кг, внутрибрюшинно) вводили 45 самкам мышей Balb/C массой приблизительно 20 г каждая. Через 24 часа и ежедневно после этого в течение 6 дней мышам, которых разделили на семь групп, делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольной группе), либо "Твин-80" в трех концентрациях (0,02%, 0,2% и 1%), либо октаноилгуанозина (50 мг/кг/доза) в трех различных концентрациях "Твин-80" (0,02%, 0,2% и 1%). На 7-й день после введения циклофосфамида всем 9 животным из каждой из 5 групп пускали кровь, а затем умертвляли их смещением позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
Через семь дней после введения циклофосфамида число нейтрофилов во всех группах, проходивших лечение, было выше, чем у контрольной группы мышей, которым после введения циклофосфамида делали инъекции физ. раствора, и значительно отличалось (по сравнению с контрольной группой) у мышей, которых лечили только 0,1% "Твин-80", и у мышей, которых лечили октаноилгуанозином в 0,02% и 0,2% "Твин-80" (фиг. 66). Число нейтрофилов у животных, которым вводили 50 мг/кг октаноилгуанозина в 0,2%"Твин-80", было значительно выше, чем у животных, которым вводили октаноилгуанозин в той же дозе, но в 0,02% "Твин-80".
Многие другие неионогенные ПАВ, включая "Твин-20", "Твин-40", "Нонидет Р-40", "Бридж-96", "Тритон Х-100", также повышали восстановление числа клеток крови у мышей, которым вводили циклофосфамид.
Пример 53. Пальмитоил-8-аминогуанозин улучшает восстановление гемопоэза после введения циклофосфамида
Циклофосфамид (CP) (275 мг/кг, внутрибрюшинно) вводили 28 мышам Balb/C массой приблизительно 20 г каждая. Через 24 часа и в течение последующих 4 дней мышам делали инъекции по 0,4 мл внутрибрюшинно либо физ. раствора (контрольной группе), либо пальмитоил-8-аминогуанозина (25 мг/кг/день в 0,2% "Твин-80"). На-5-й и на 7-й дни после введения циклофосфамида 7 животным из каждой группы пускали кровь, а затем их умертвляли путем смещения позвонков. Селезенки удаляли и взвешивали, проводили клинический анализ крови.
На 5-й и 7-й дни количество нейтрофилов и массы селезенок у мышей, которых лечили пальмитоил-8-аминогуанозином, были значительно больше, чем у контрольной группы (фиг. 67 - 68).
Вышеприведенные примеры иллюстрируют настоящее изобретение, но не ограничивают его рамки. В рамках настоящего изобретения могут существовать различные варианты и изменения, не выходящие за пределы основных положений.
Характеризующие данные для ряда соединений в объем заявленного изобретения:
1. 3',5'-O-дигексадекансульфонил-N2-пальмитоил дезоксигуанозин, т.пл. 76 - 78oC, светло-желтый порошок;
2. N2-пальмитоил-3', 5'-O-димиристоил дезоксигуанозин, т.пл. 40 - 41oC, более твердое вещество;
3. N2-пальмитоил-3', 5'-O-дилауроил дезоксигуанозин, т.пл. 37 - 38oC, белое вязкое твердое вещество;
4. N2-пальмитоил-3', 5'-O-дипентадеканоил дезоксигуанозин, т.пл. 36 - 37oC, белое твердое вещество;
5. N2,3'-O-дипальмитоил-5'-O-тетрадеканаминокарбонил дезоксигуанозин, т. пл. 42 - 44oC, белые чешуйчатые кристаллы;
6. N2-стеароил-3', 5'-O-дипальмитоил дезоксигуанозин, т.пл. 42 - 43oC, белый порошок;
7. N2, 3'-O-дипальмитоил-5'-миристоил дезоксигуанозин, т.пл. 35 - 37oC, белый порошок;
8. N2, 3', 5'-O-тримиристоил дезоксигуанозин, т. пл. 74 - 75oC, белое кристаллическое твердое вещество;
9. N2, 3', 5'-O-тригептадеканоил дезоксигуанозин, т. пл. 53oC, белое кристаллическое твердое вещество;
10. N2,3',4'-O-трипальмитоил дезоксигуанозин, т.пл. 83 - 84oC; т.пл. полиморфной формы 48 - 51oC.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, СПОСОБЫ СТИМУЛЯЦИИ ЗАЖИВЛЕНИЙ | 1989 |
|
RU2115410C1 |
| СПОСОБЫ ЛЕЧЕНИЯ СЕПСИСА И ВОСПАЛЕНИЙ С ПОМОЩЬЮ ОКСИПУРИНОВЫХ НУКЛЕОЗИДОВ | 1995 |
|
RU2203669C2 |
| НОВЫЕ ПРОЛЕКАРСТВА НУКЛЕИНОВЫХ КИСЛОТ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2612521C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЛЕЙКОПЕНИИ И ТРОМБОЦИТОПЕНИИ | 2015 |
|
RU2702122C2 |
| ИНГИБИТОРЫ ЛЕЙКОТРИЕН А4-ГИДРОЛАЗЫ | 2014 |
|
RU2690489C2 |
| ИНГИБИТОРЫ ЛЕЙКОТРИЕН А4-ГИДРОЛАЗЫ | 2014 |
|
RU2696559C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УМЕНЬШЕННЫМ ВЫСВОБОЖДЕНИЕМ ФЕНОЛЬНЫХ ОПИОИДОВ | 2009 |
|
RU2562583C2 |
| ЛАКТАМНЫЕ СОЕДИНЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2287530C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ ИЛИ АНТАГОНИСТ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2000 |
|
RU2239455C2 |
| ТАКСОИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2144920C1 |





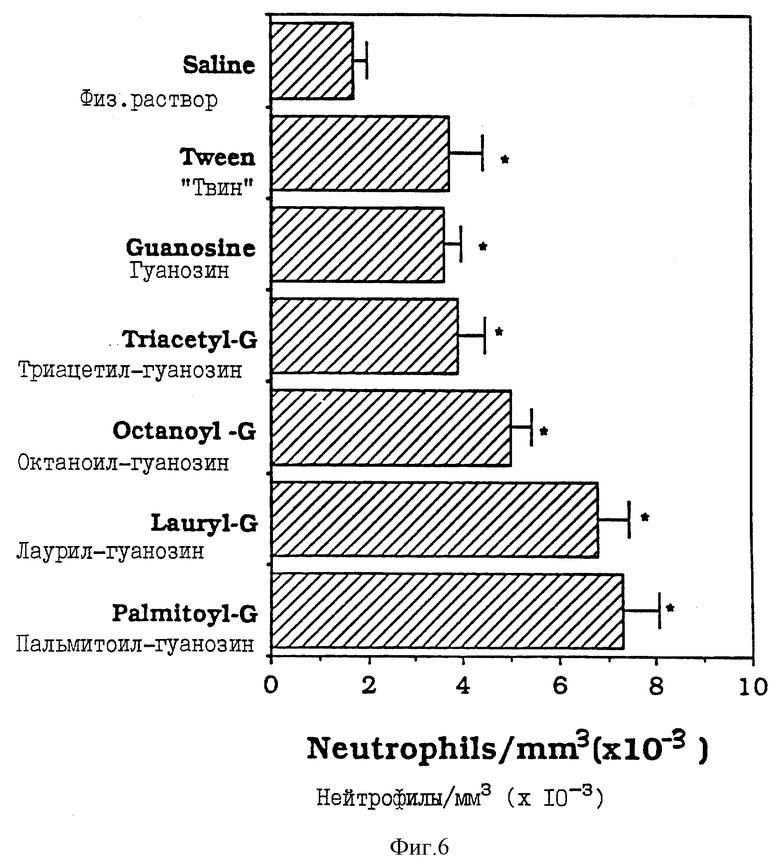
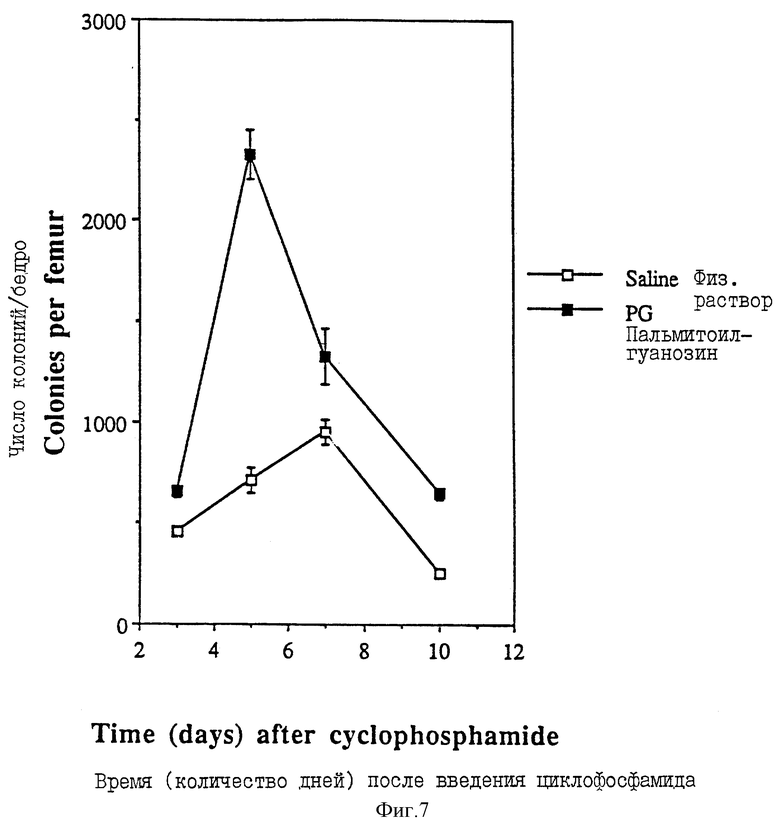
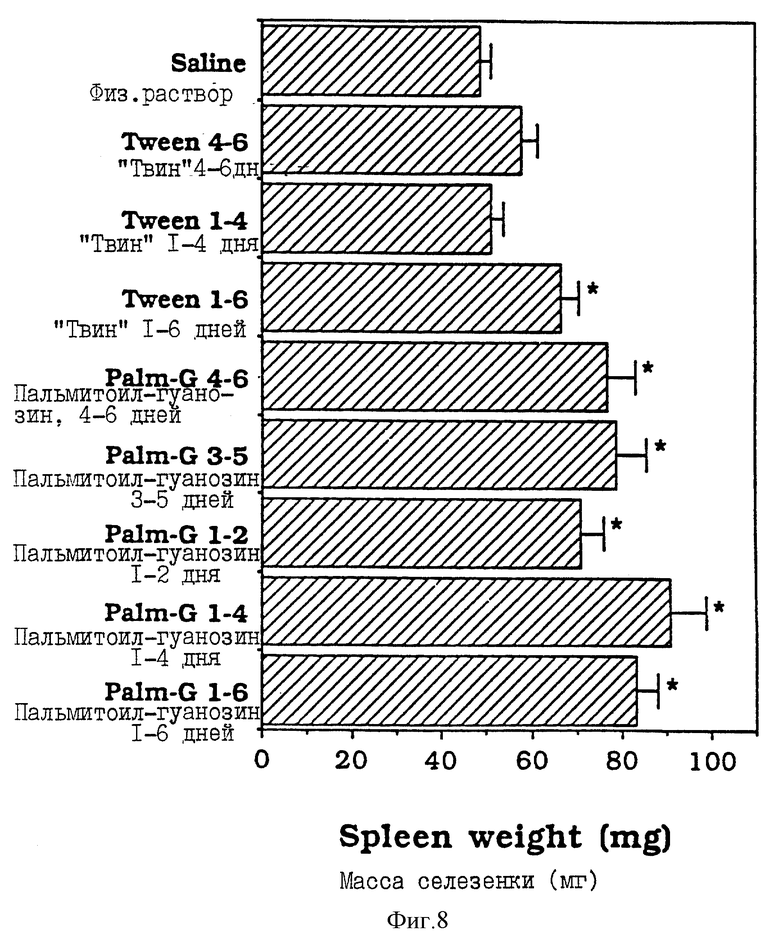
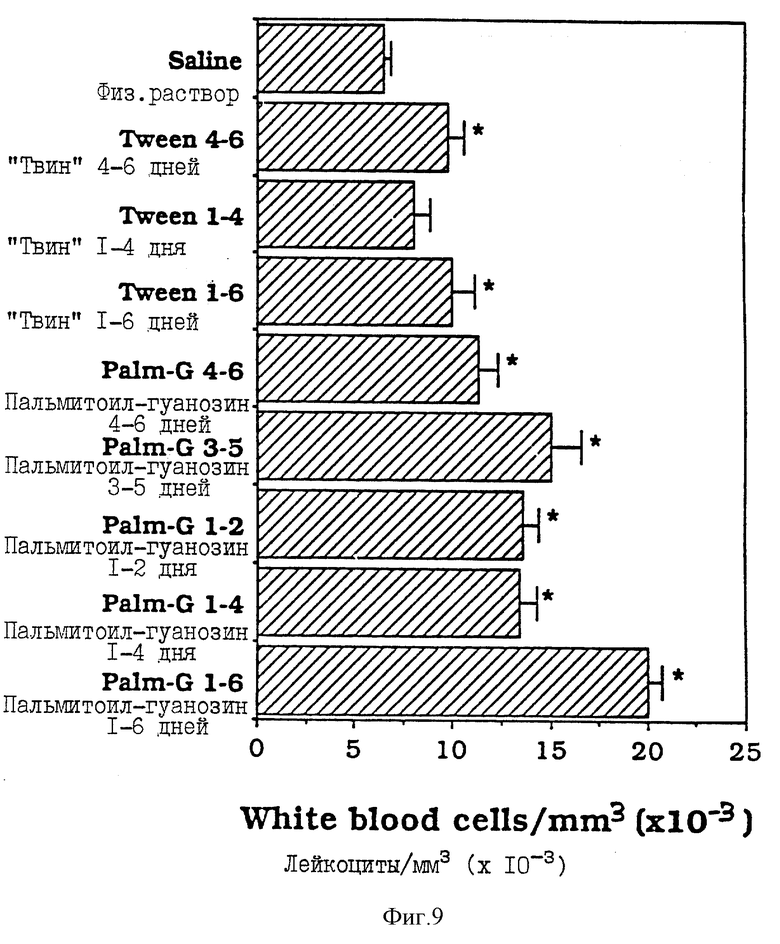
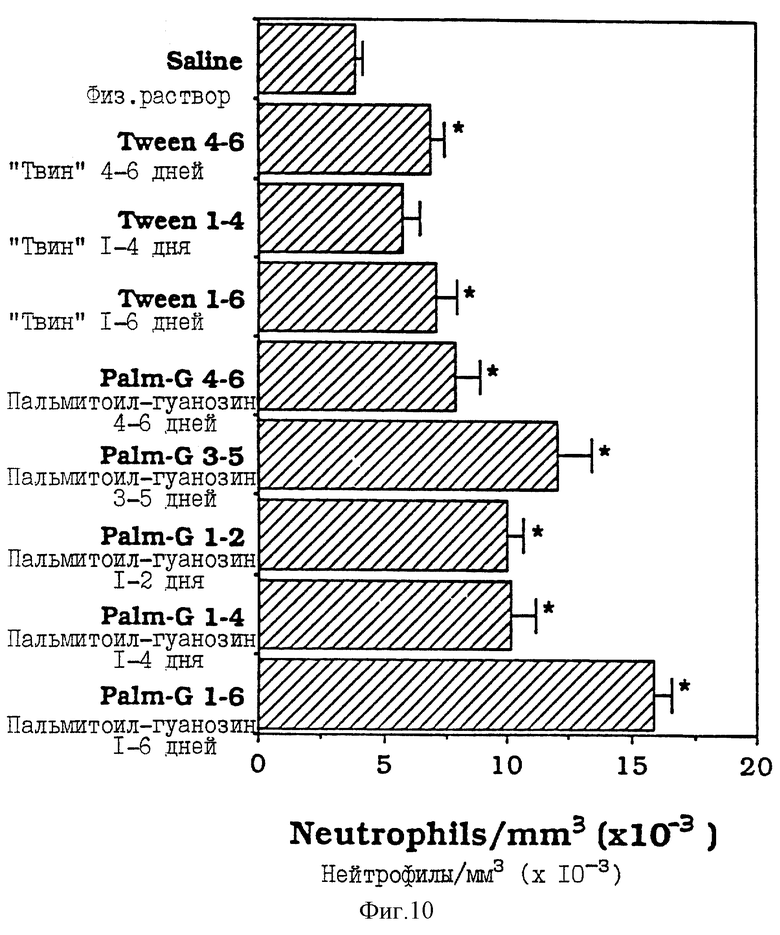
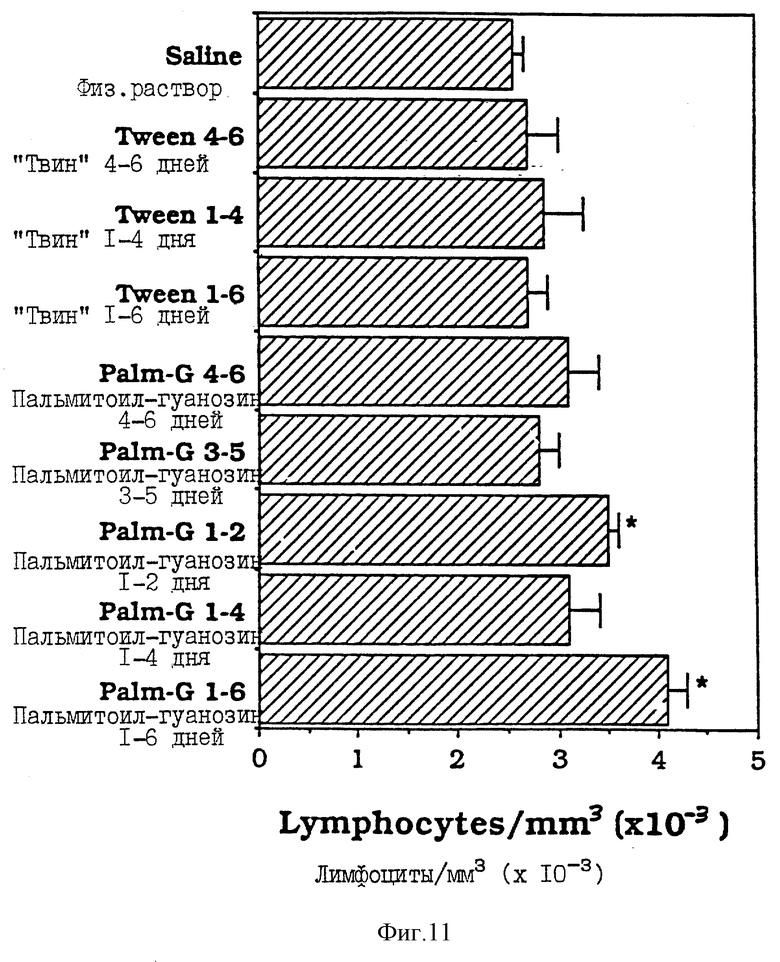
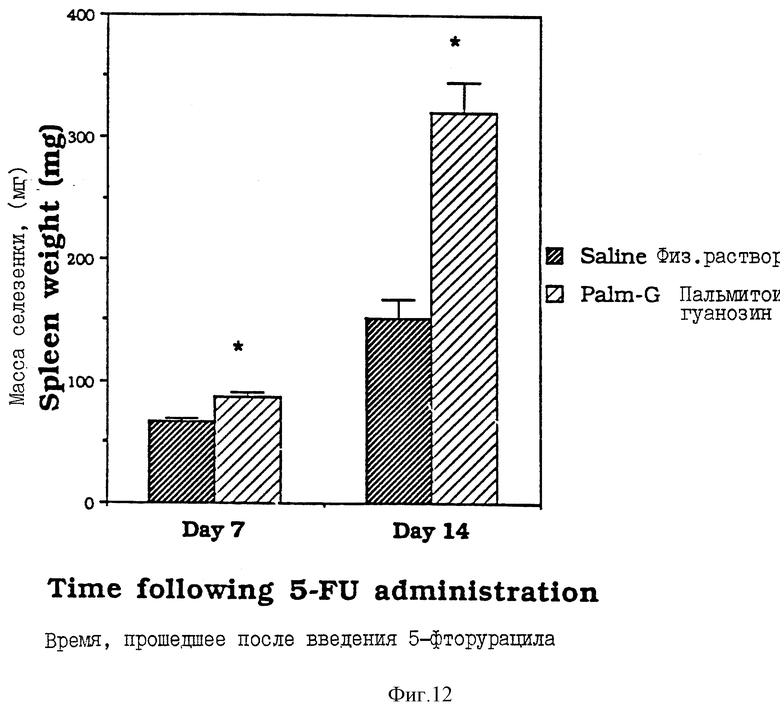
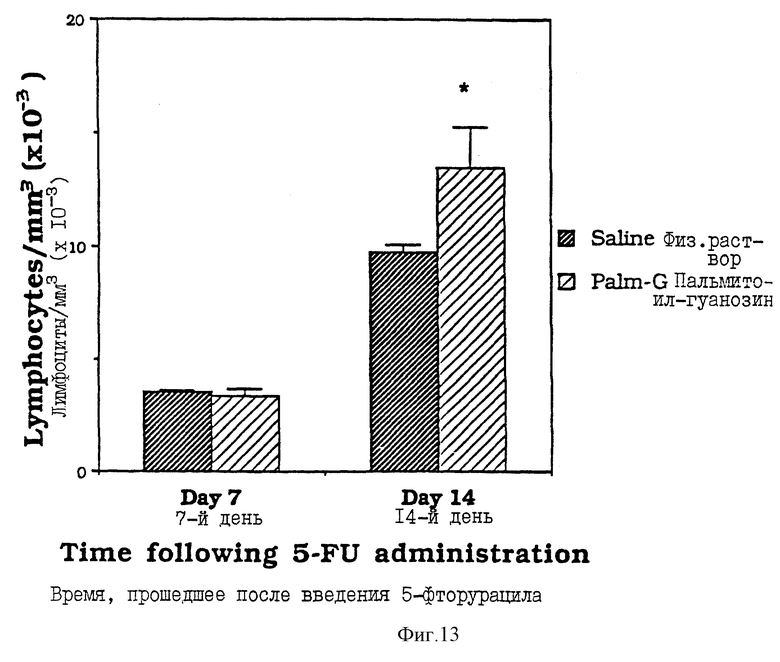
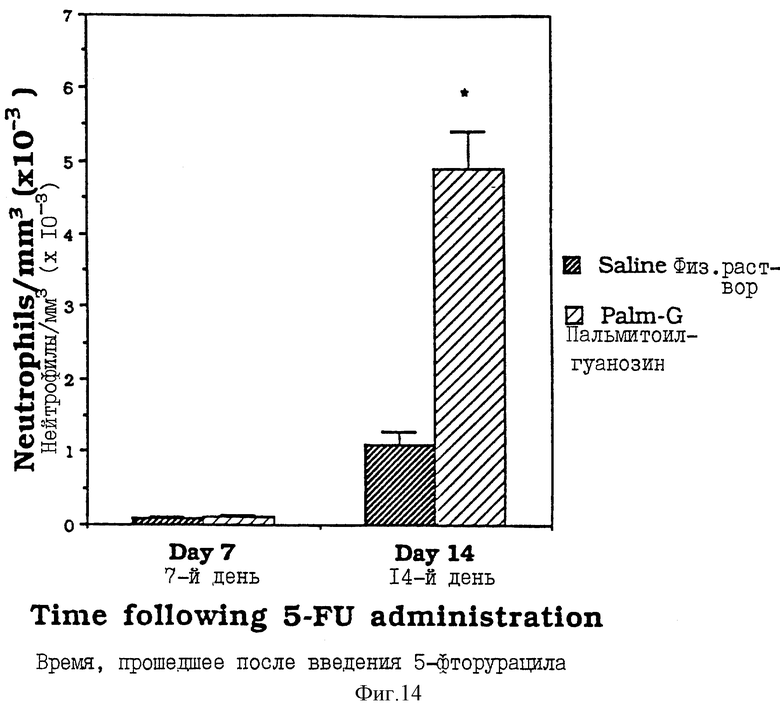

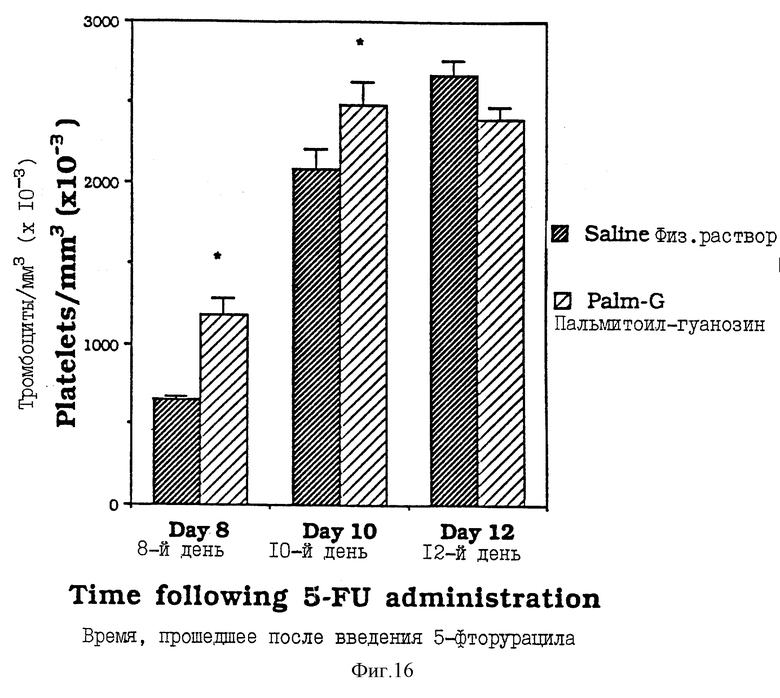
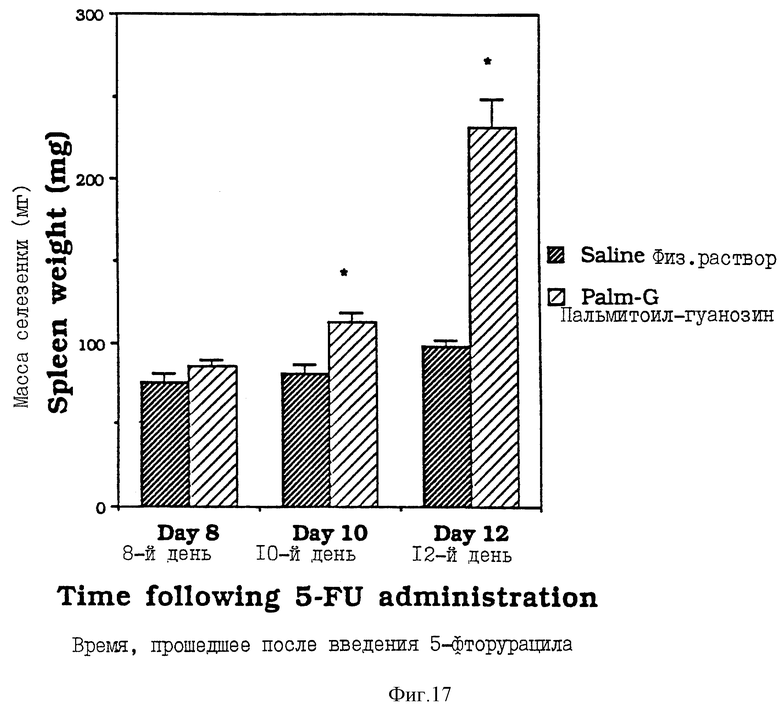


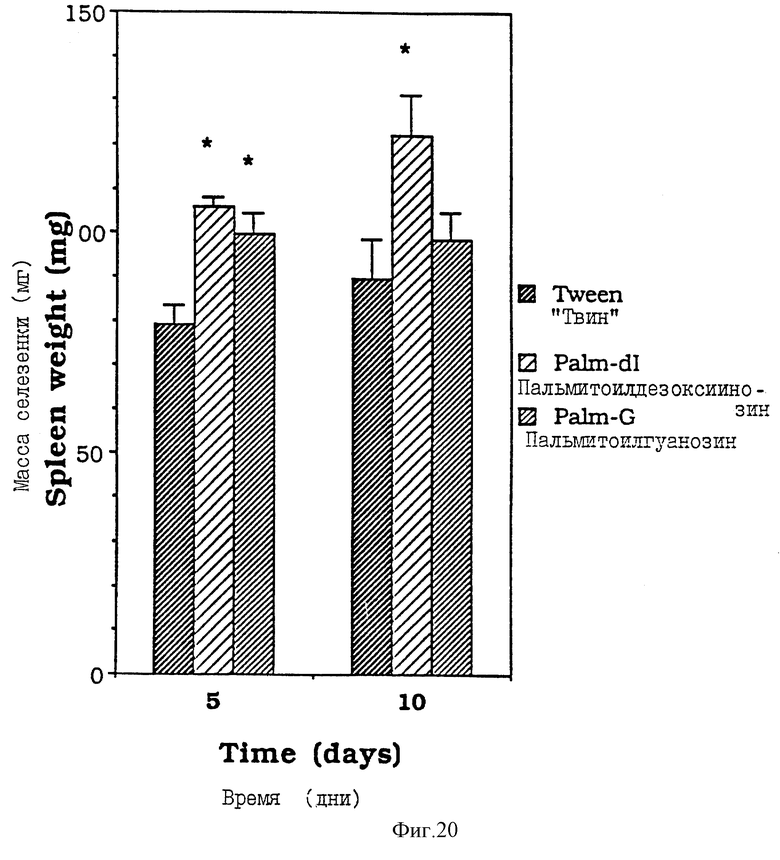
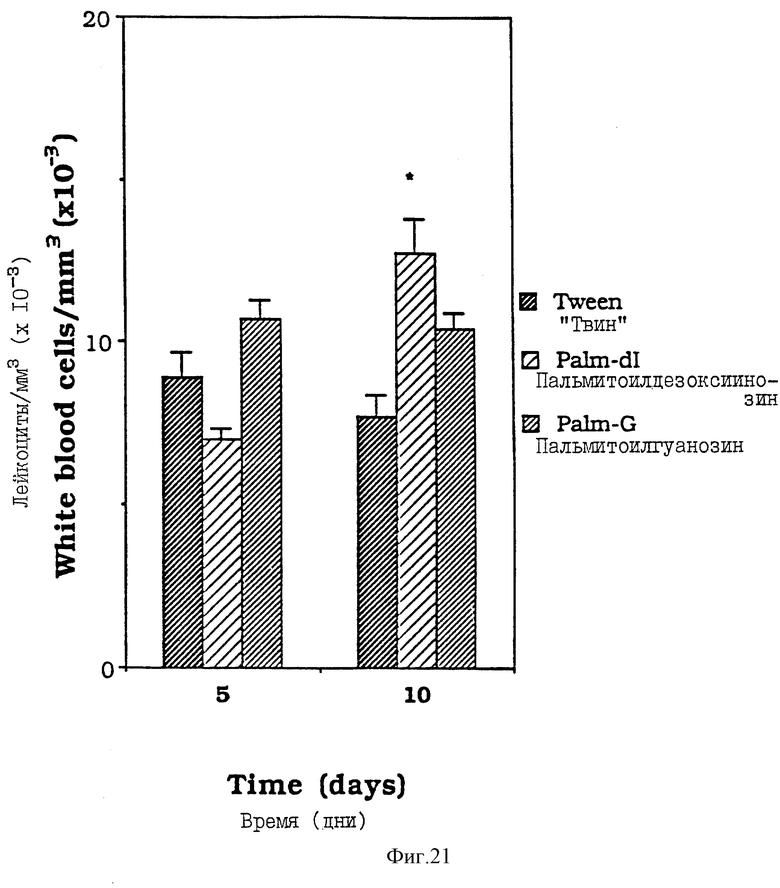
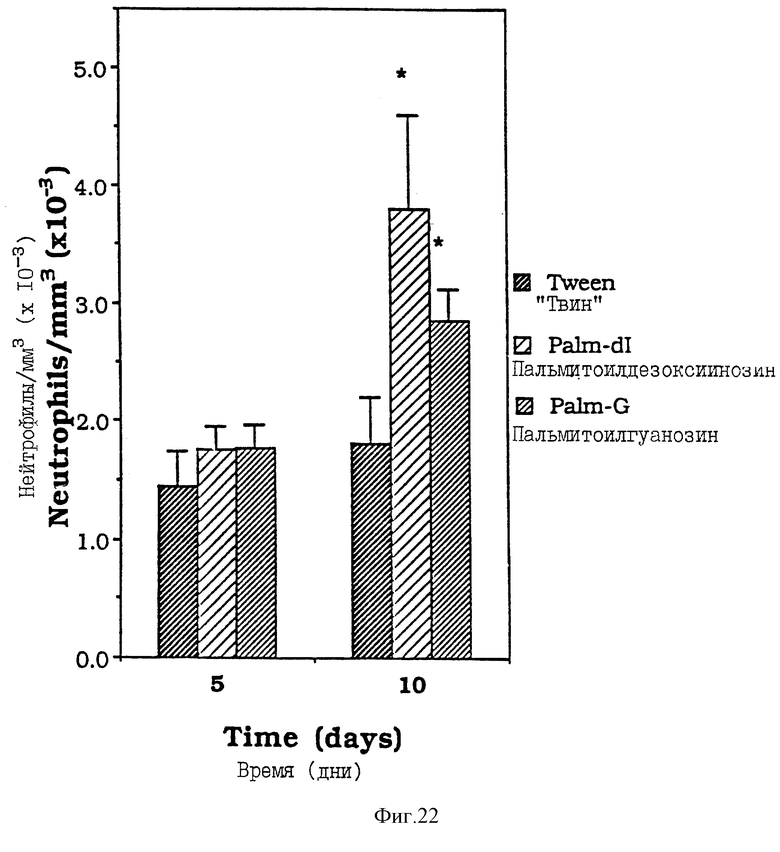
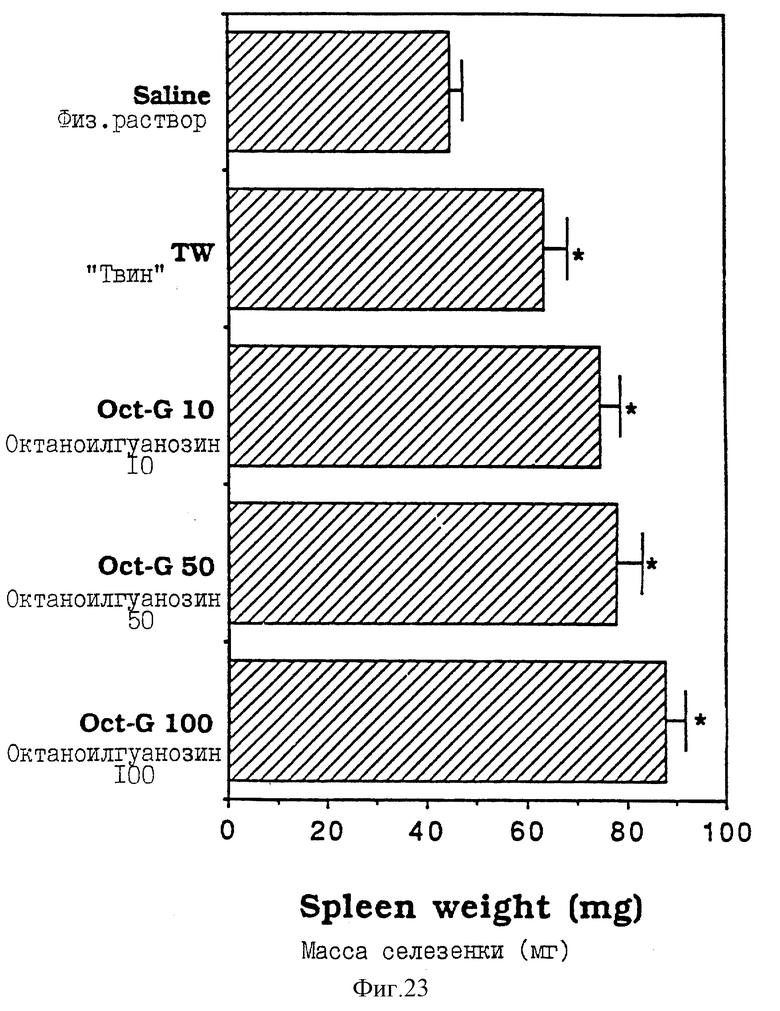
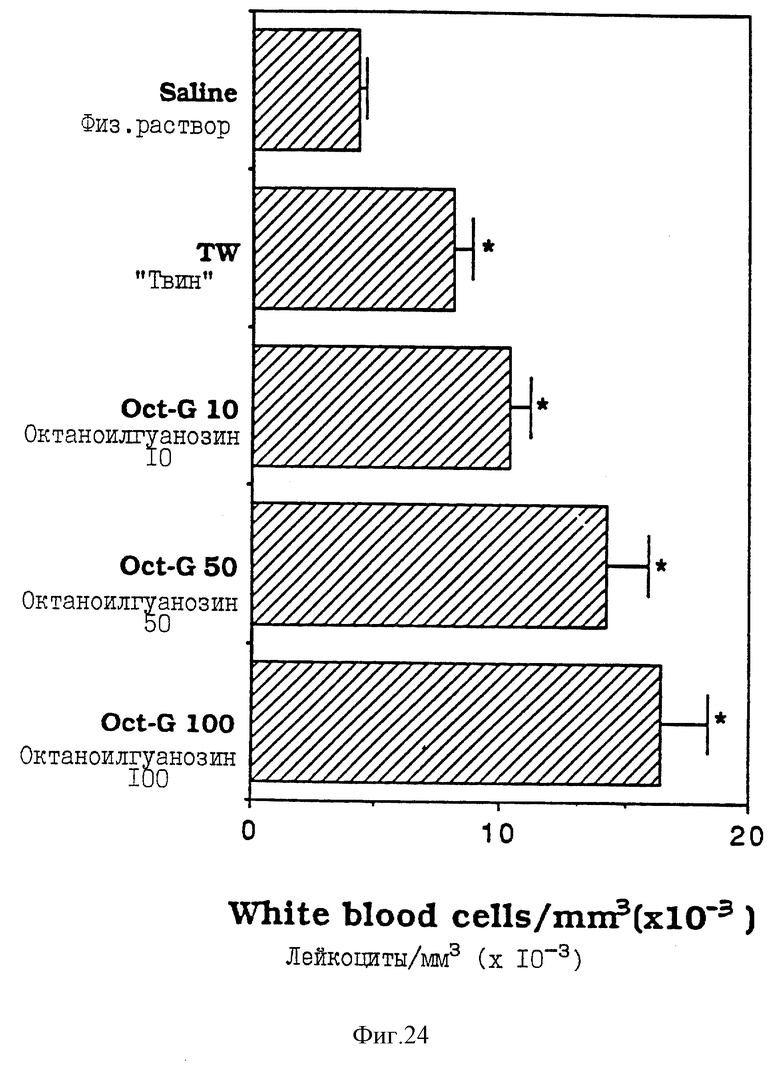
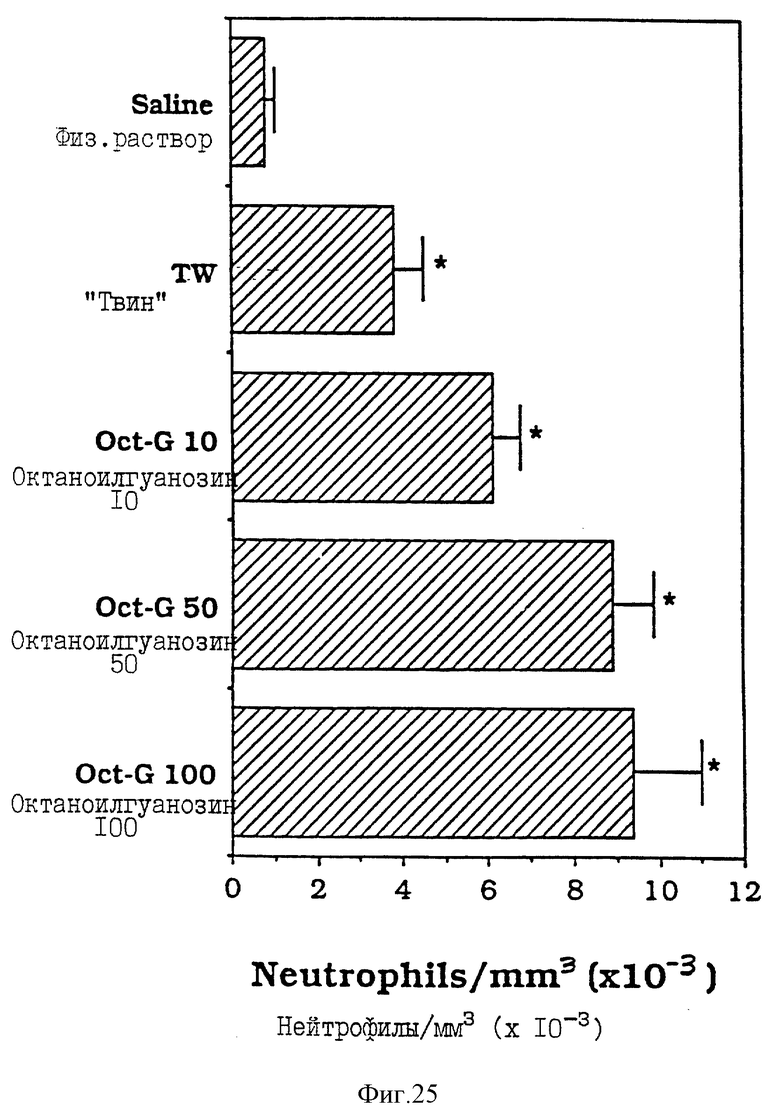
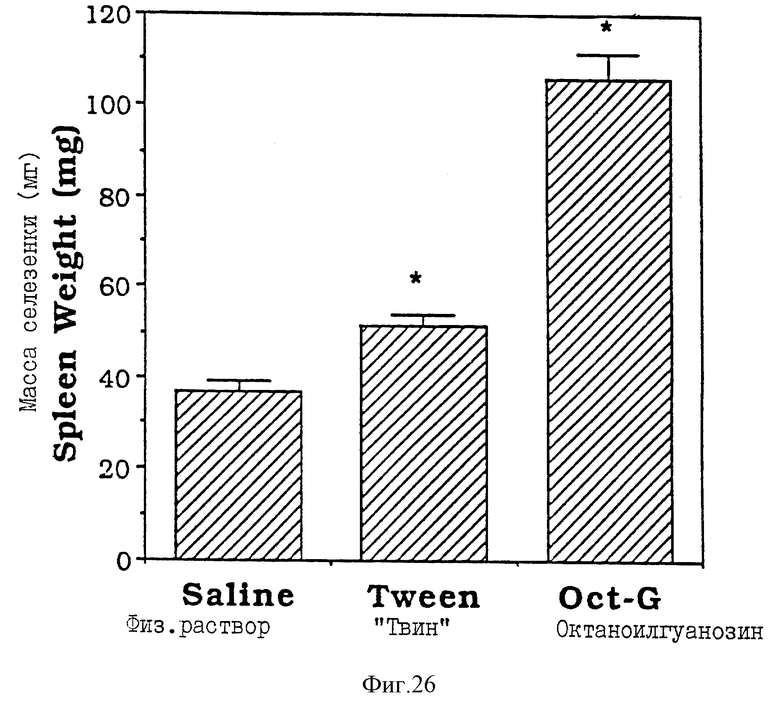


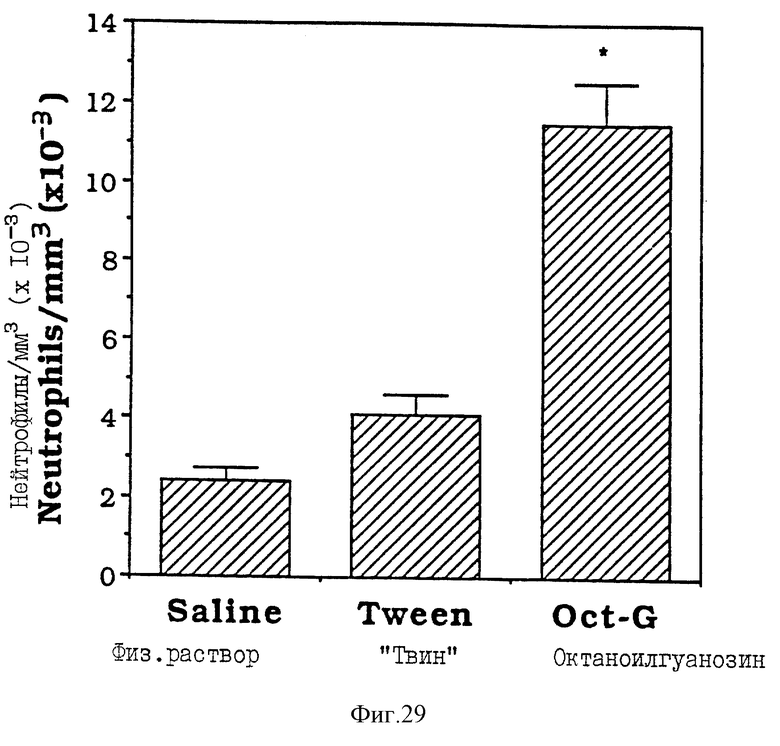
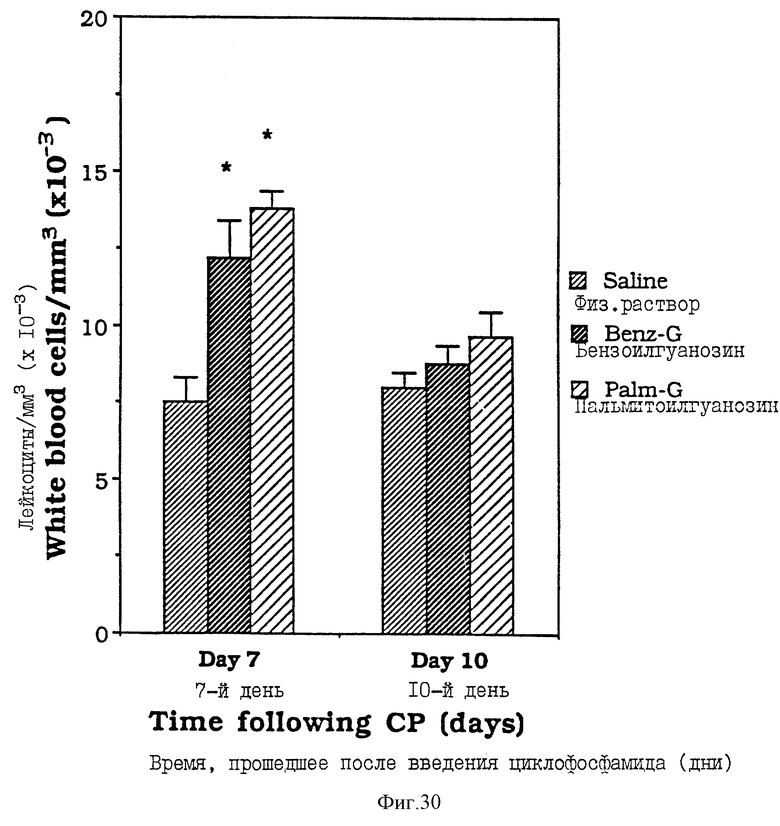

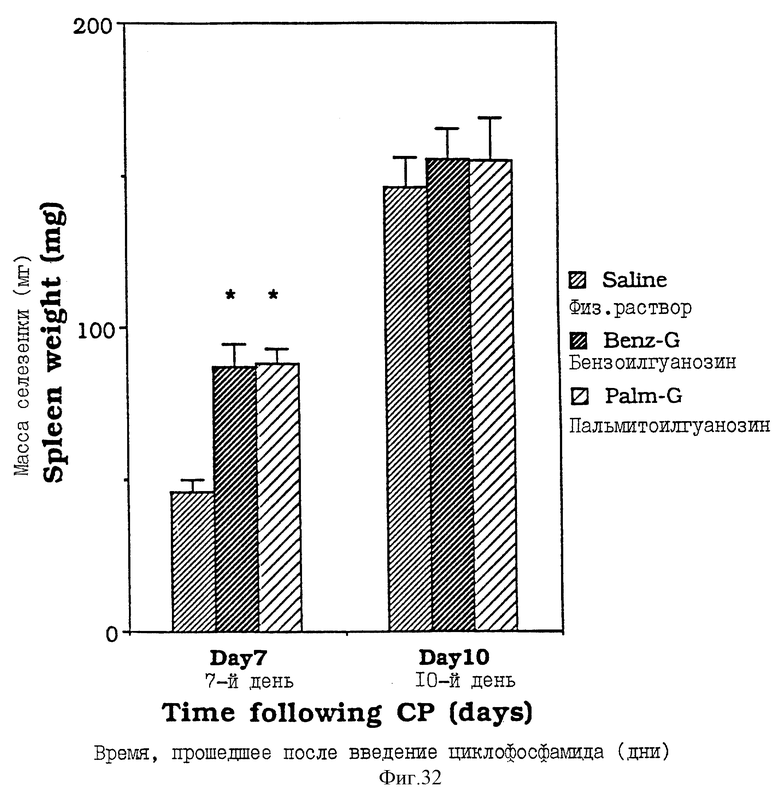
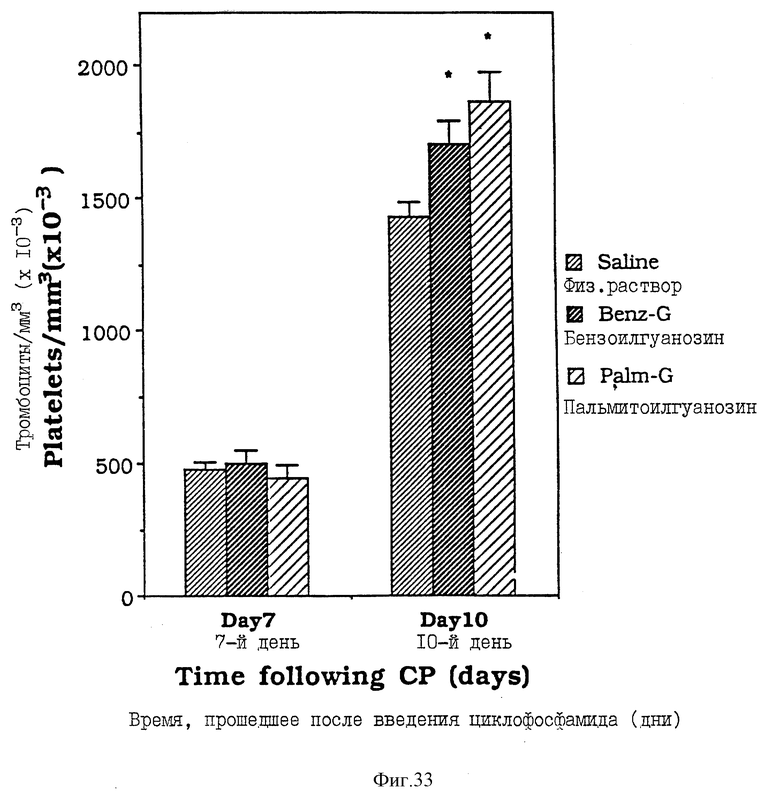
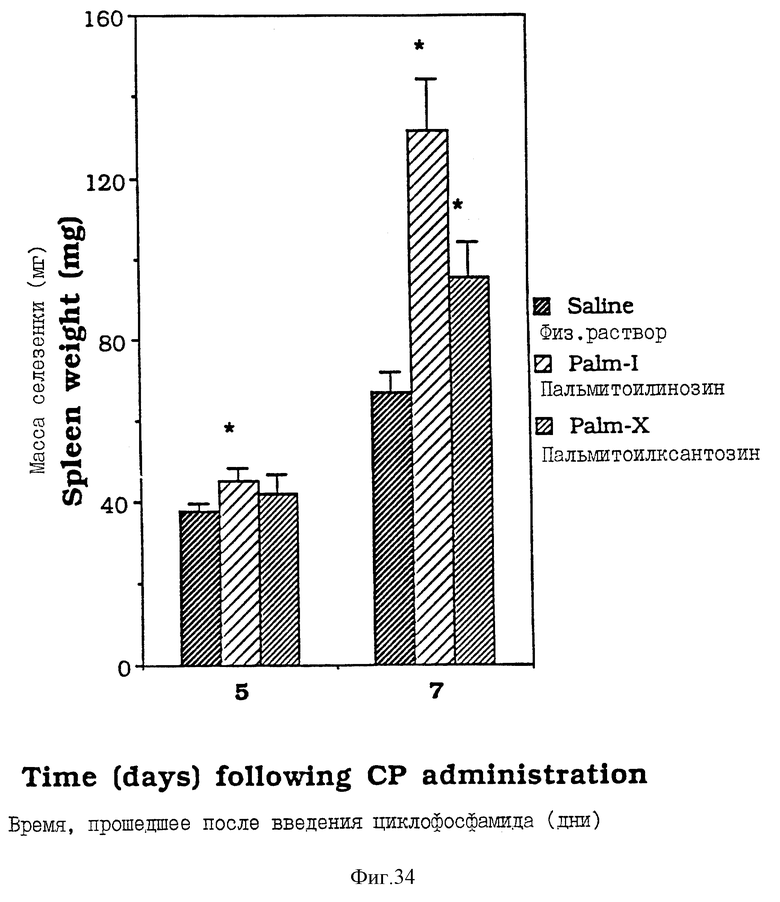
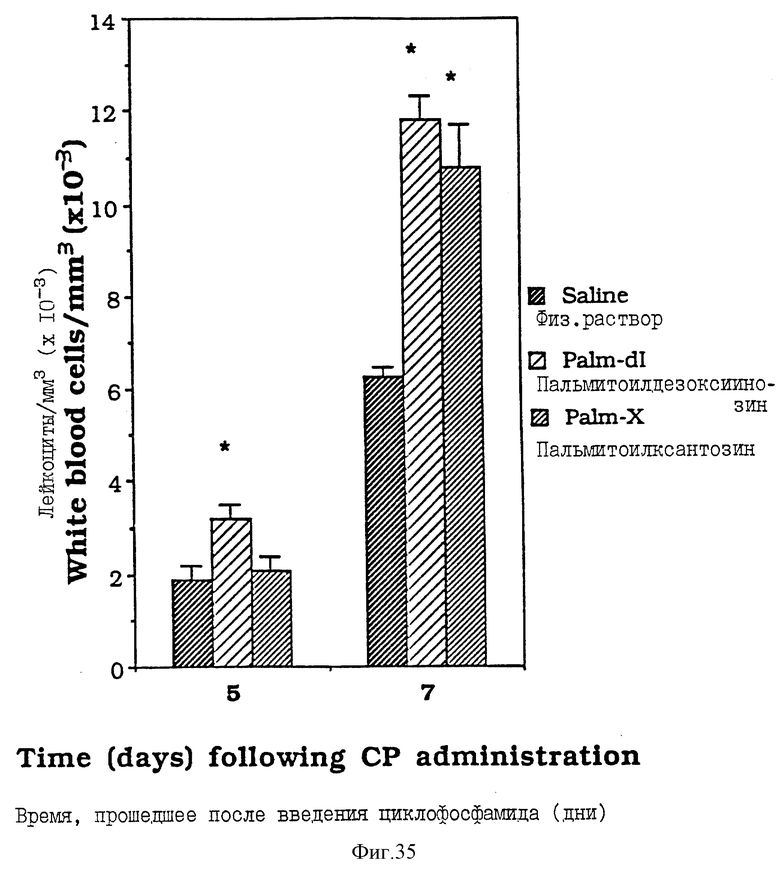
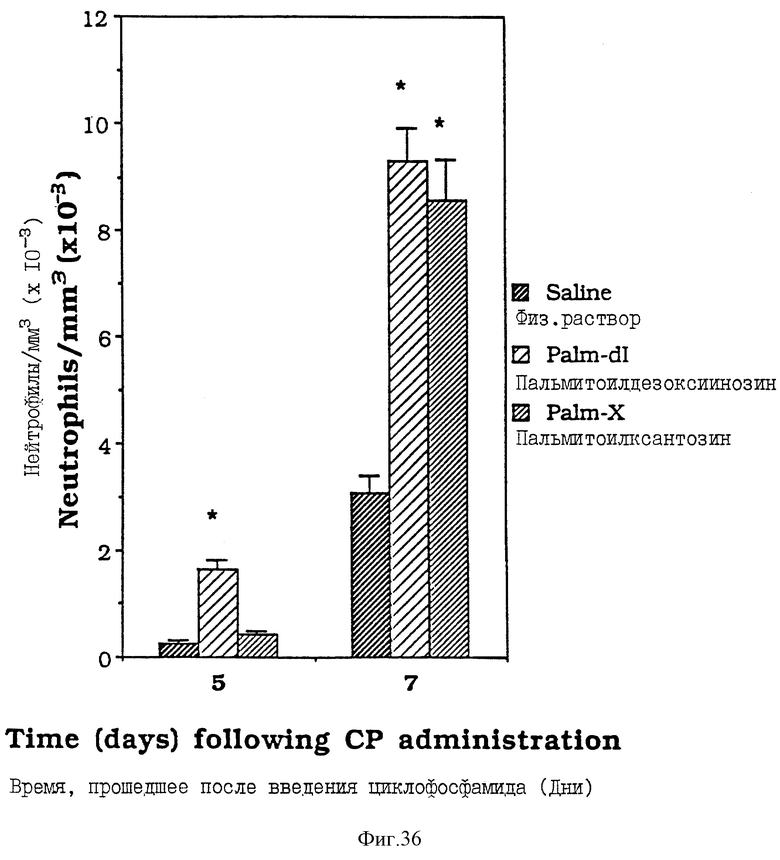
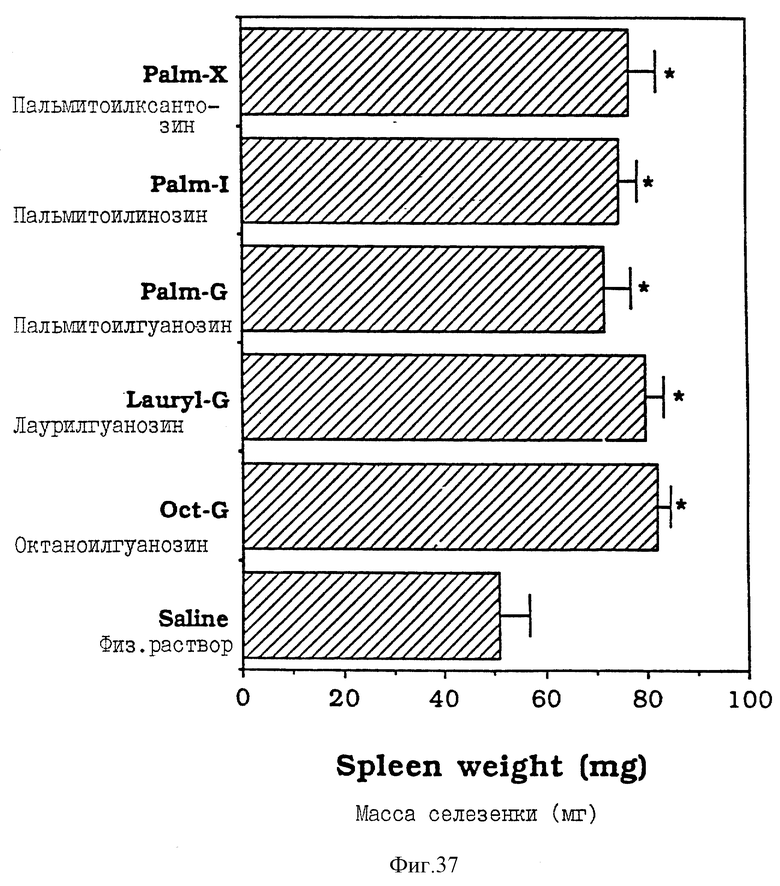
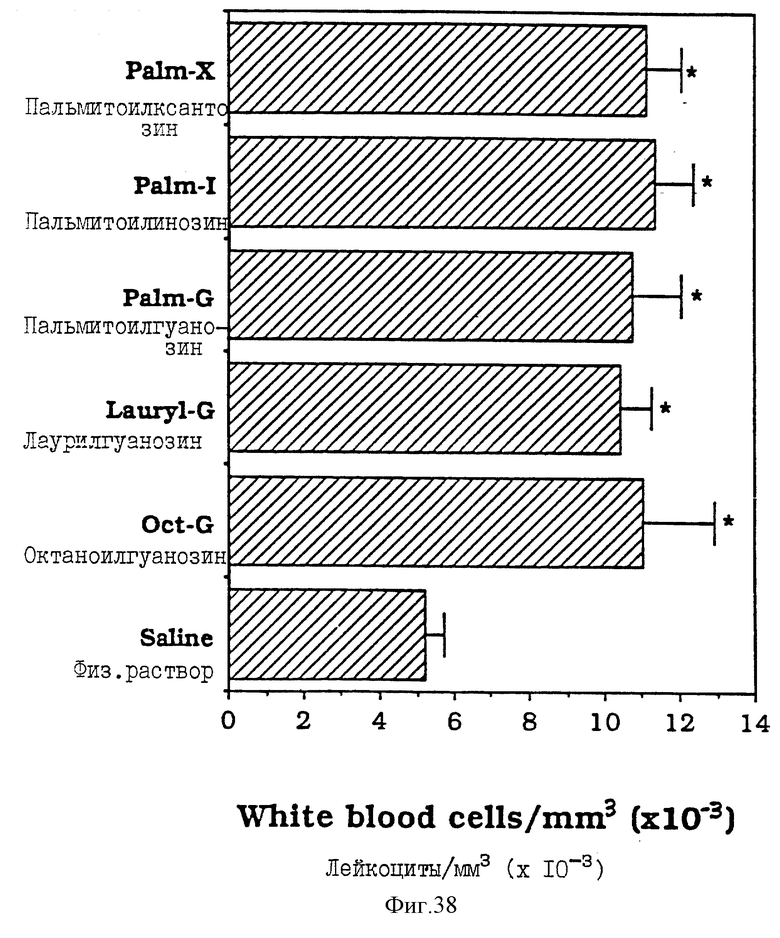
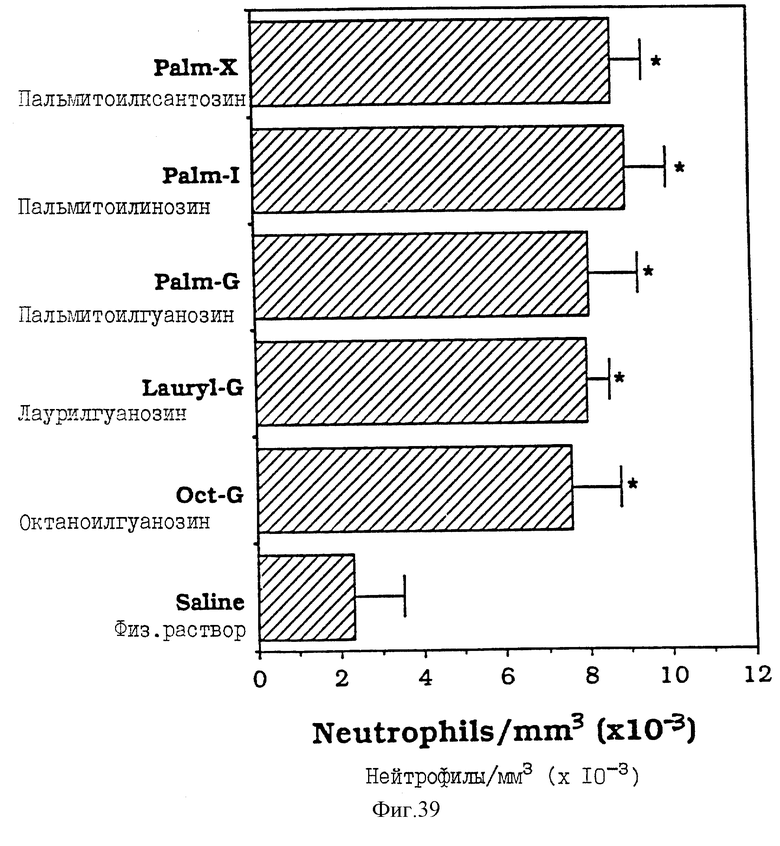
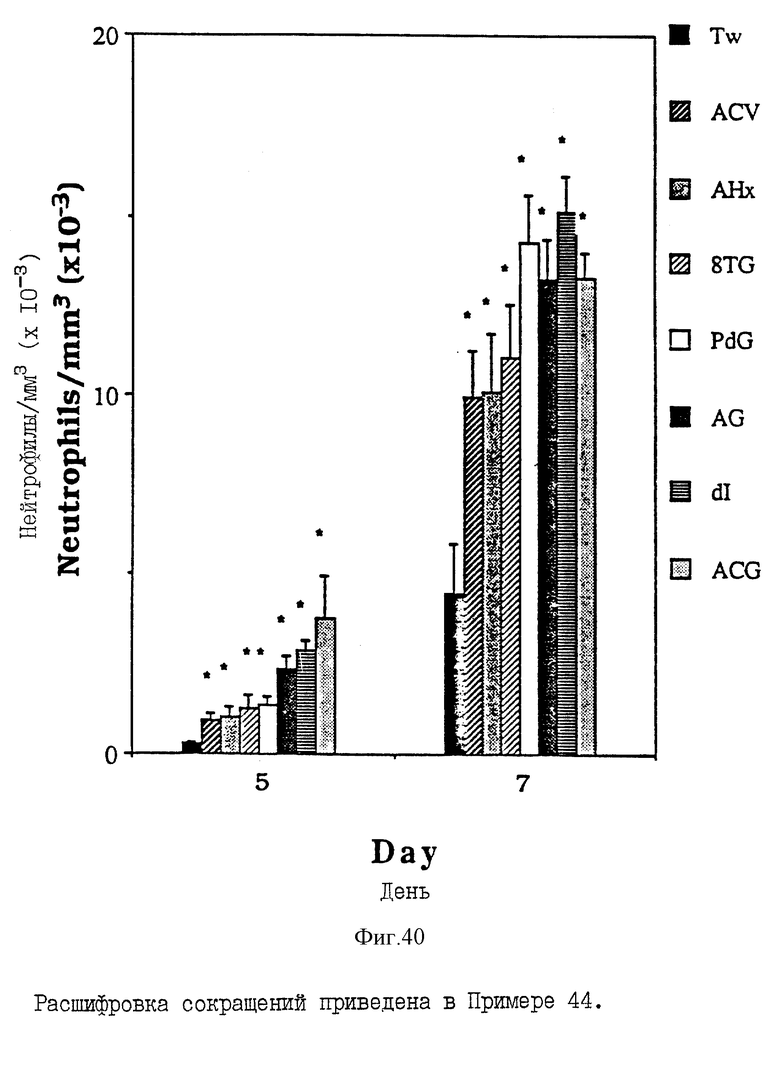
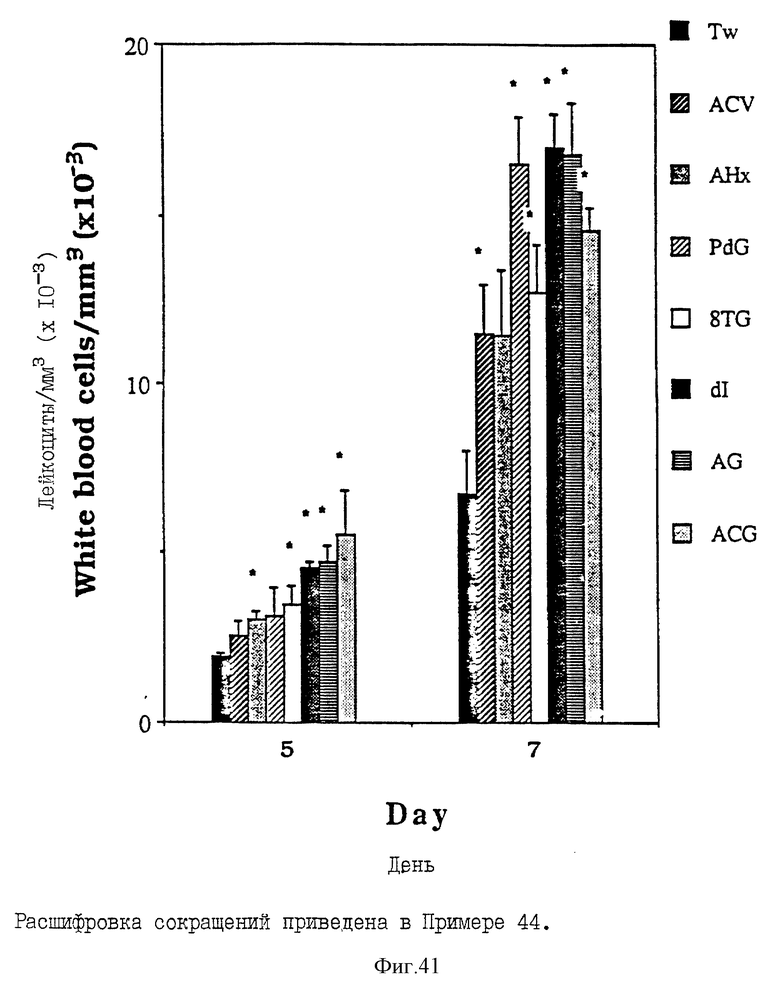
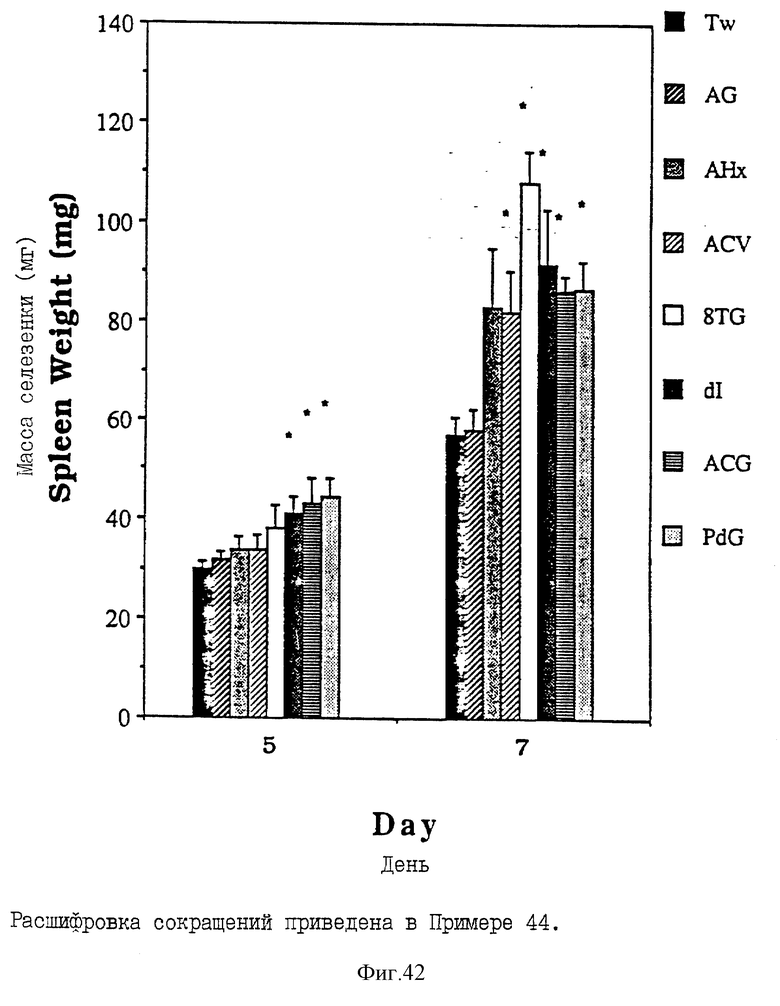

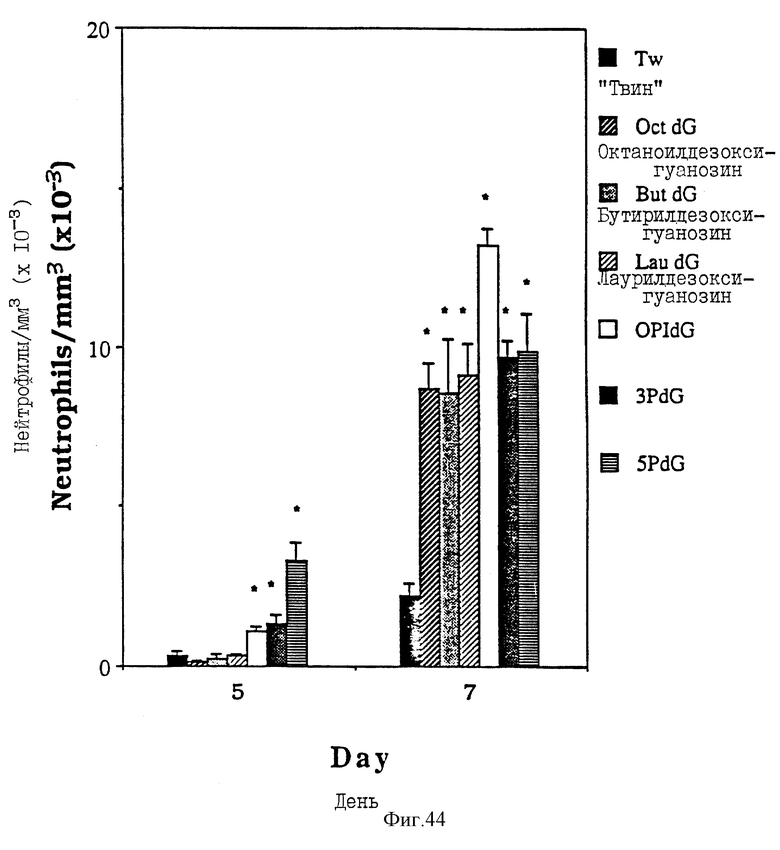
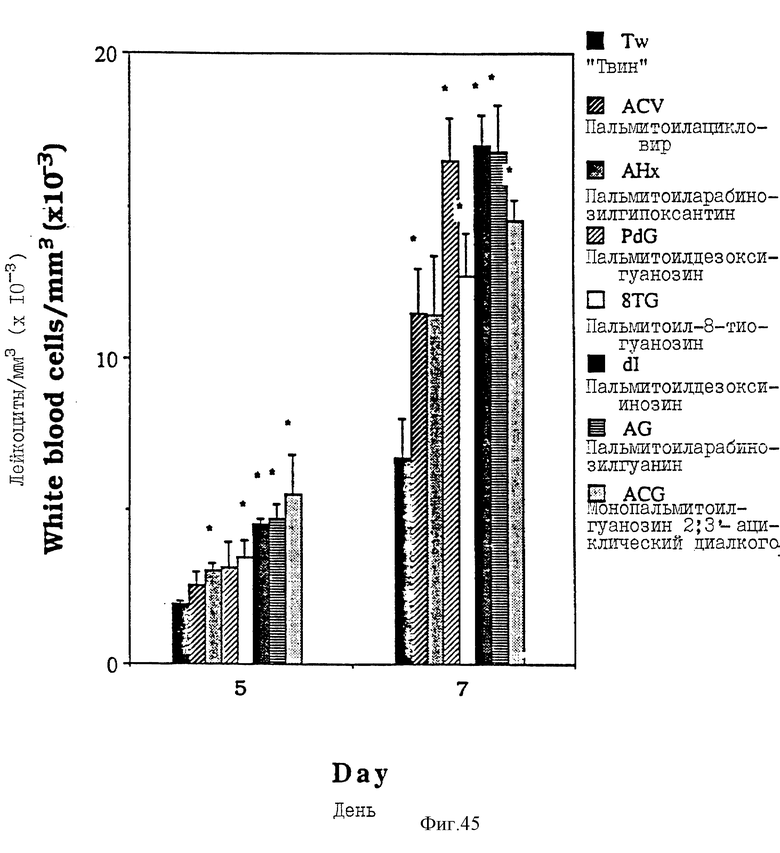
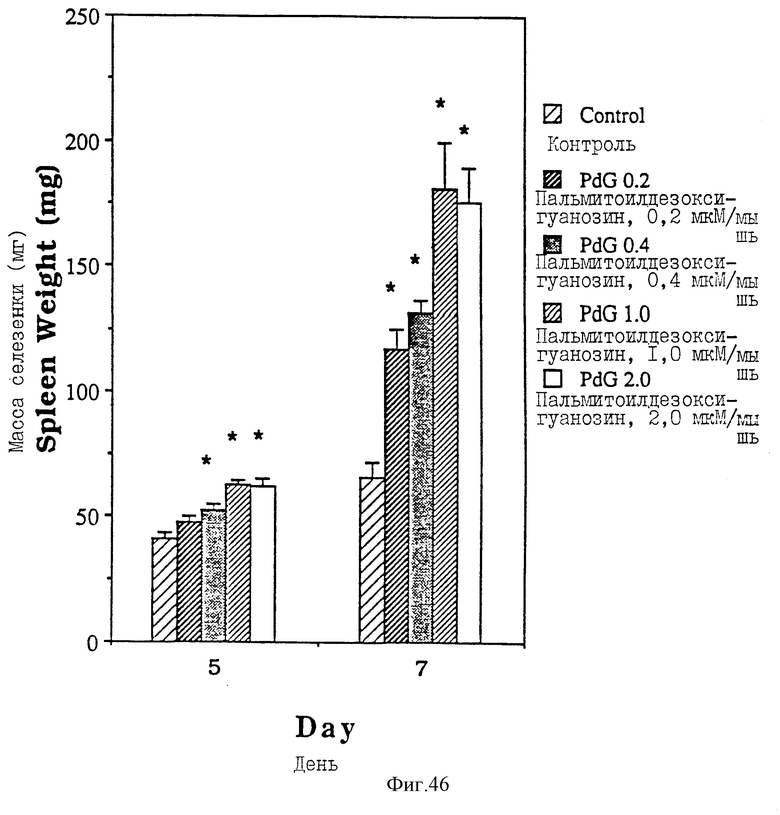
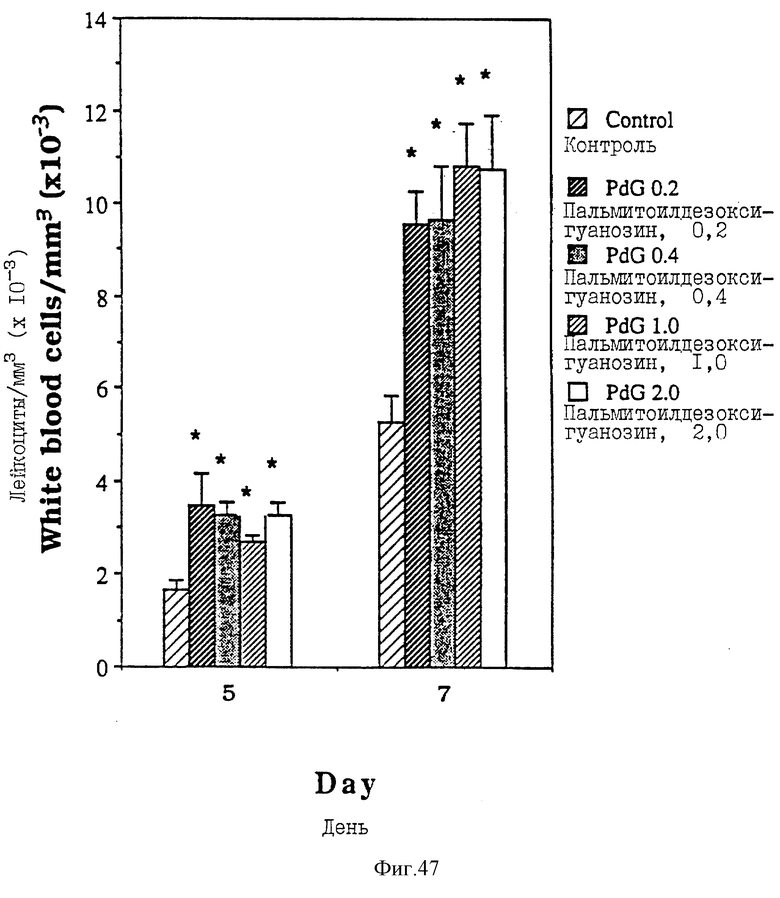

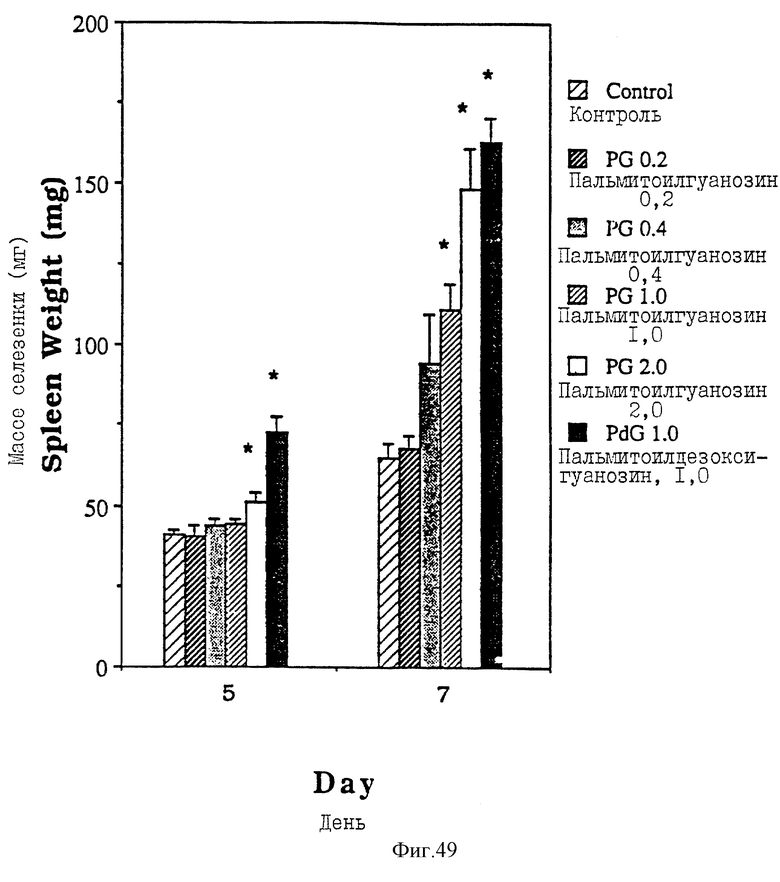
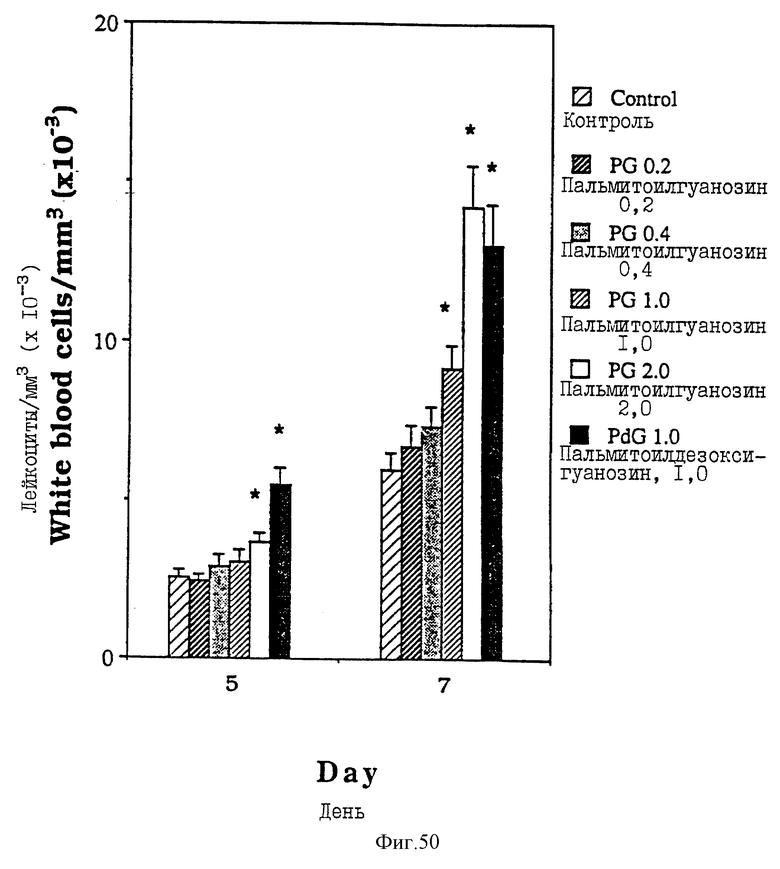
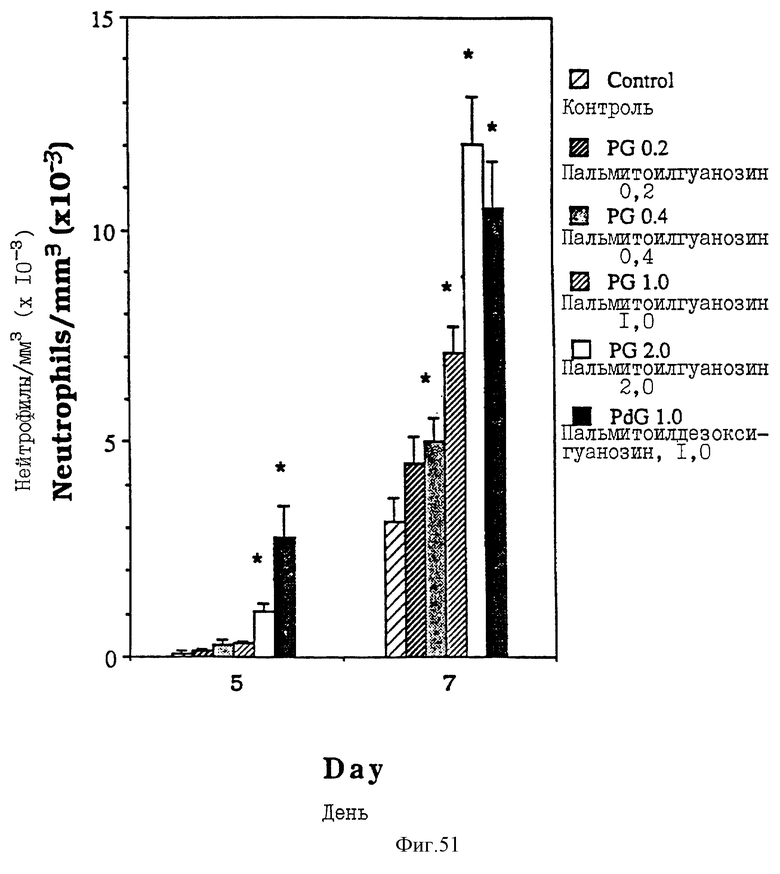
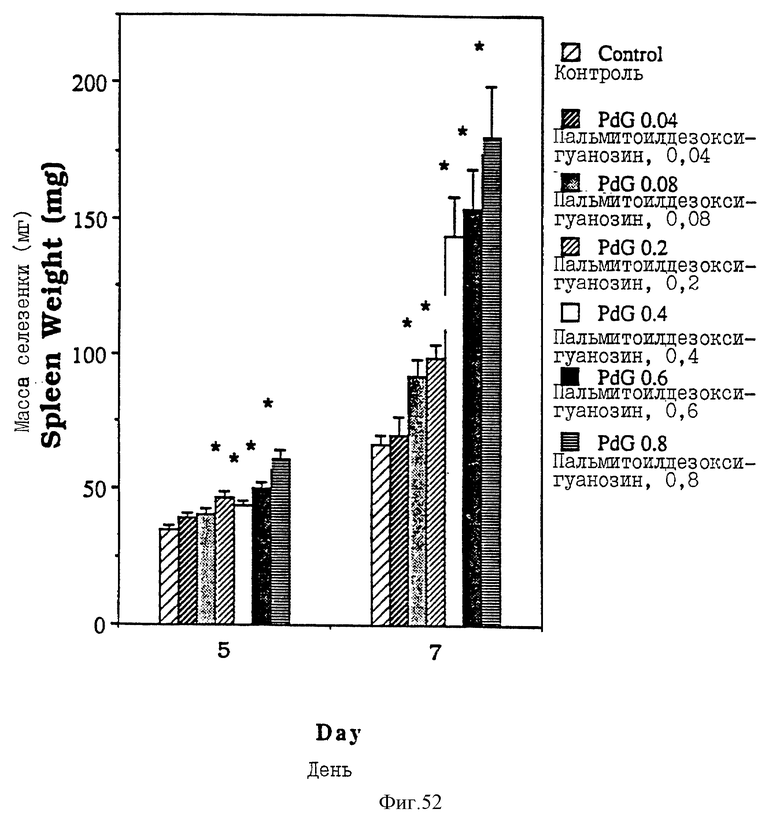
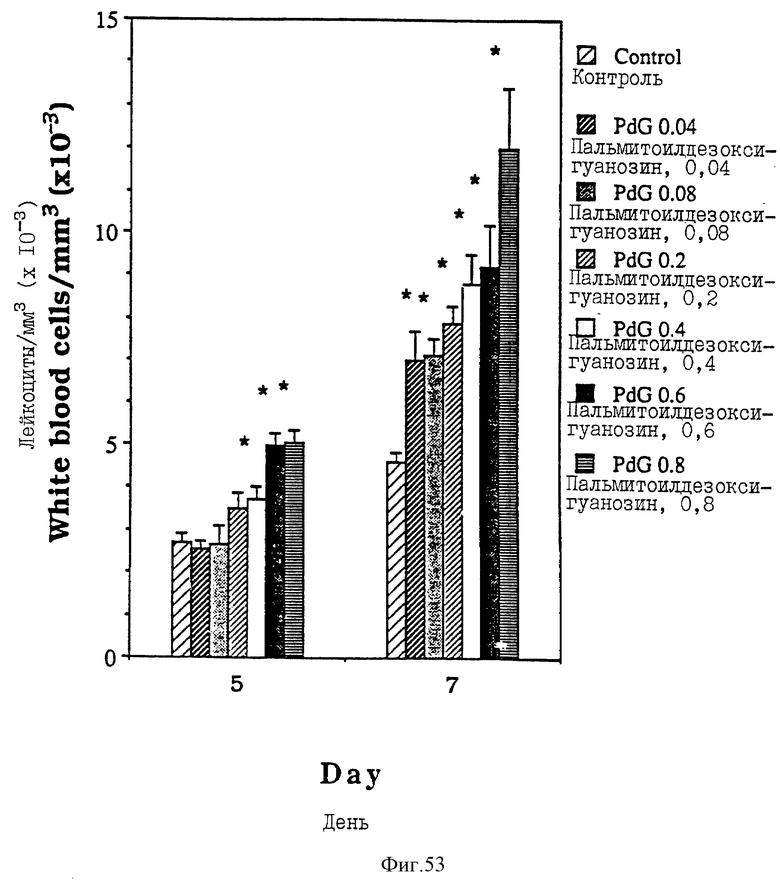
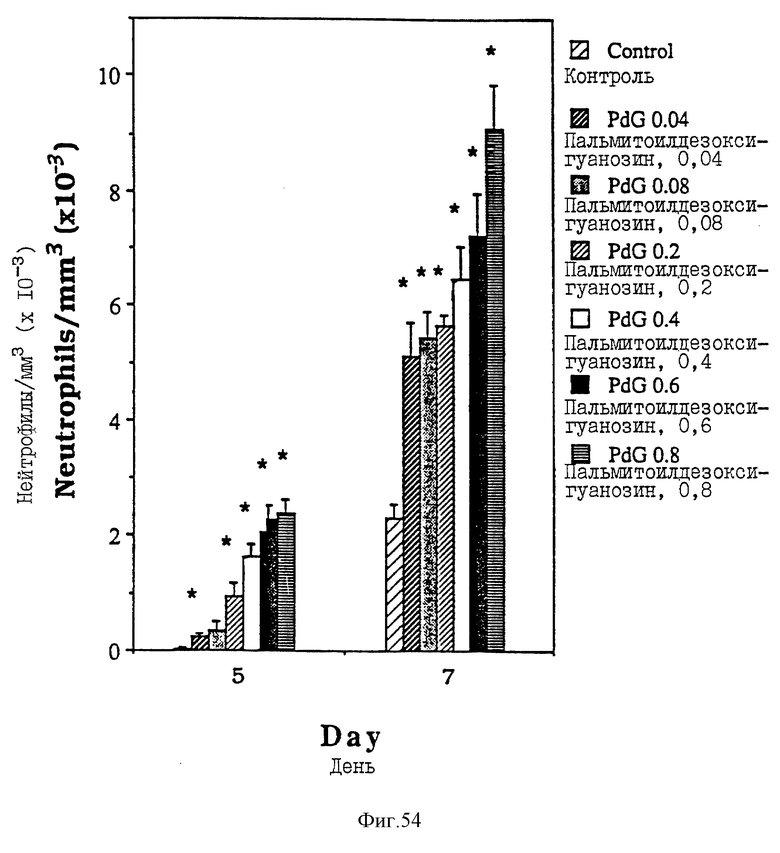


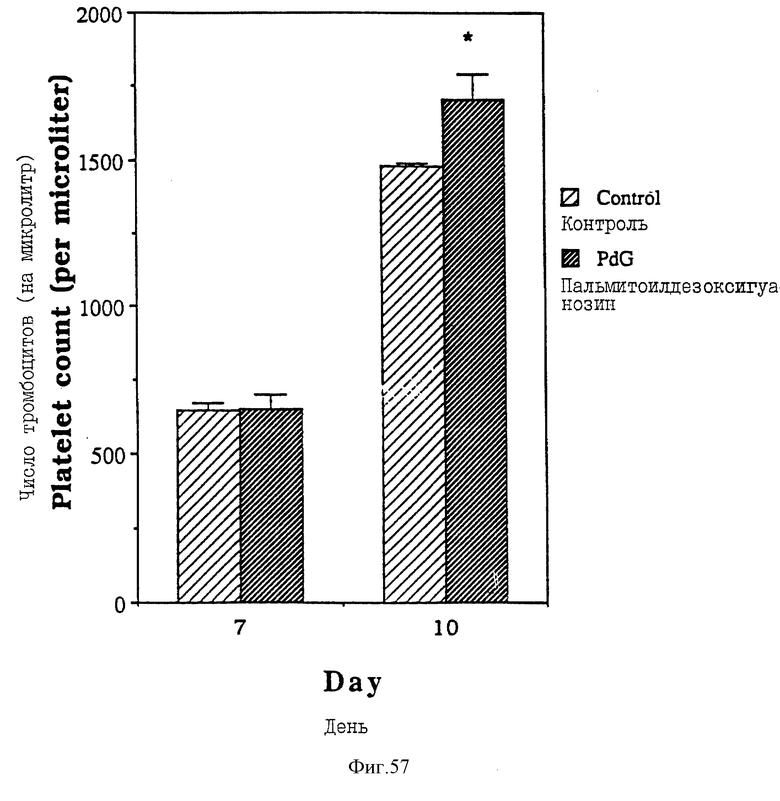
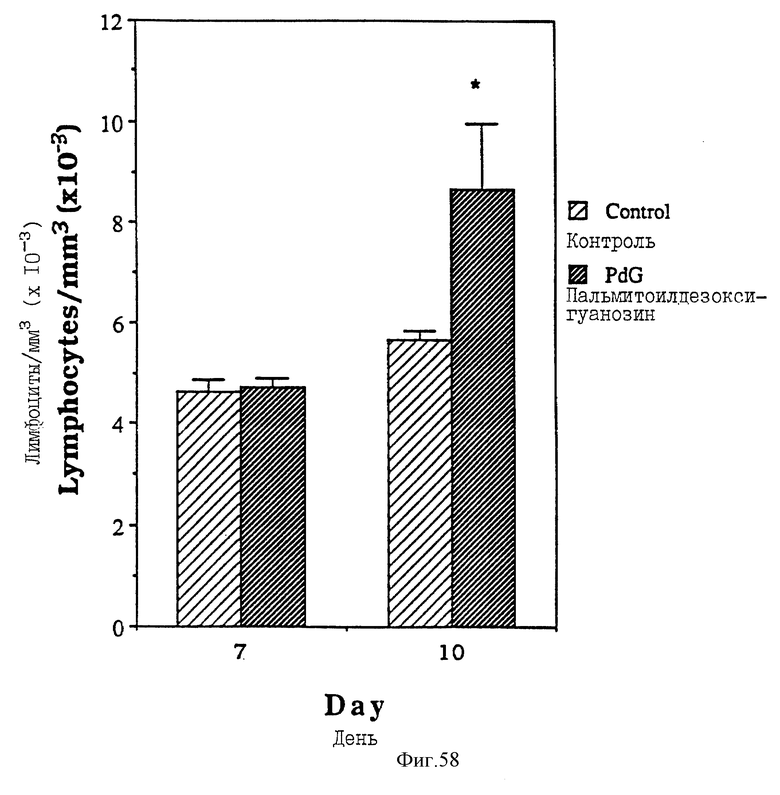
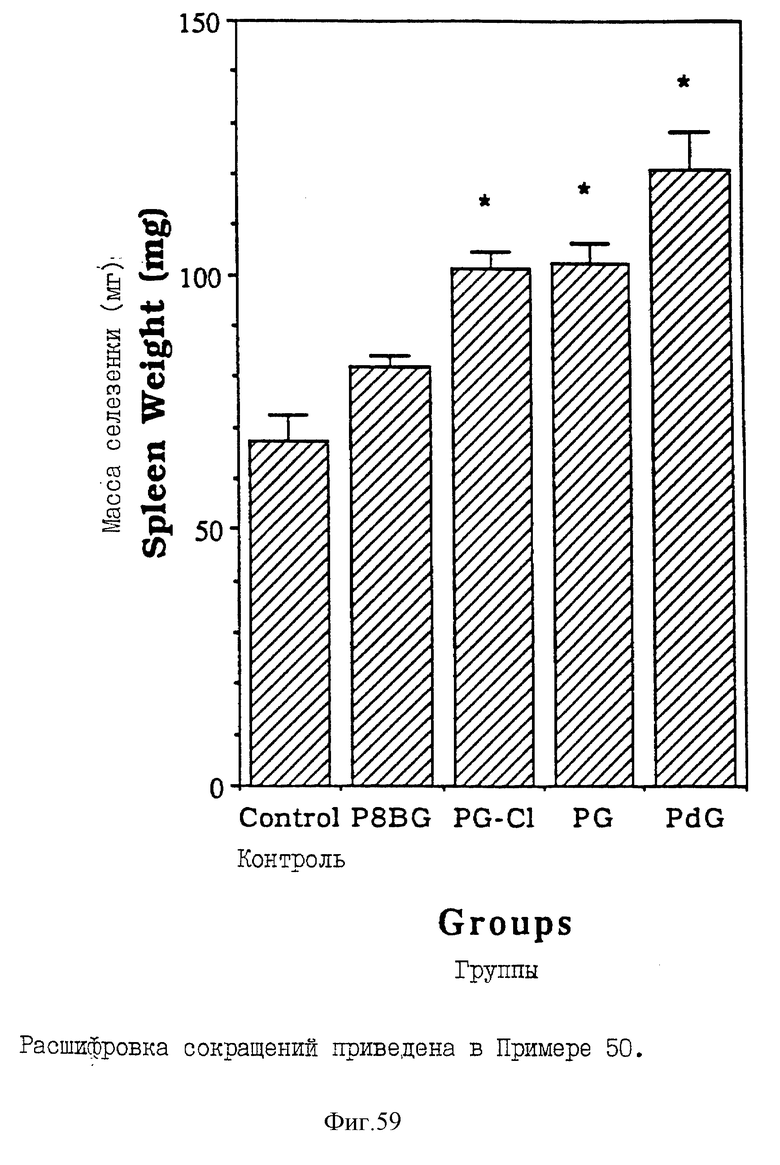
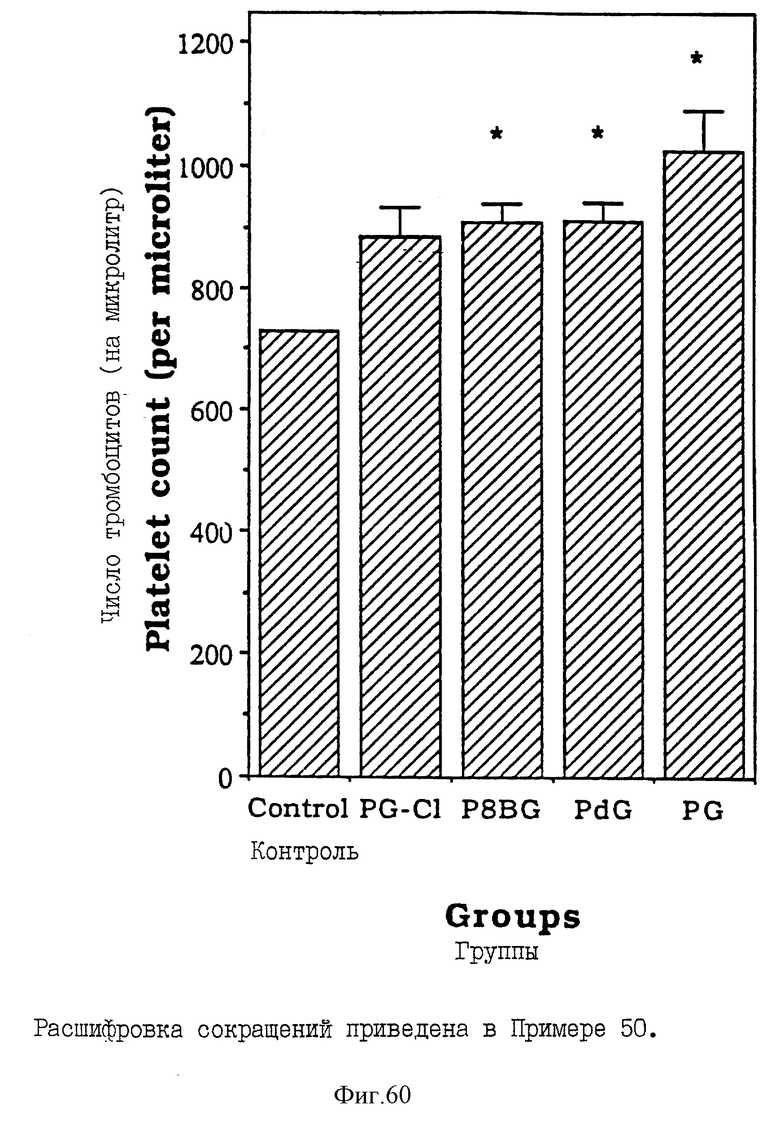
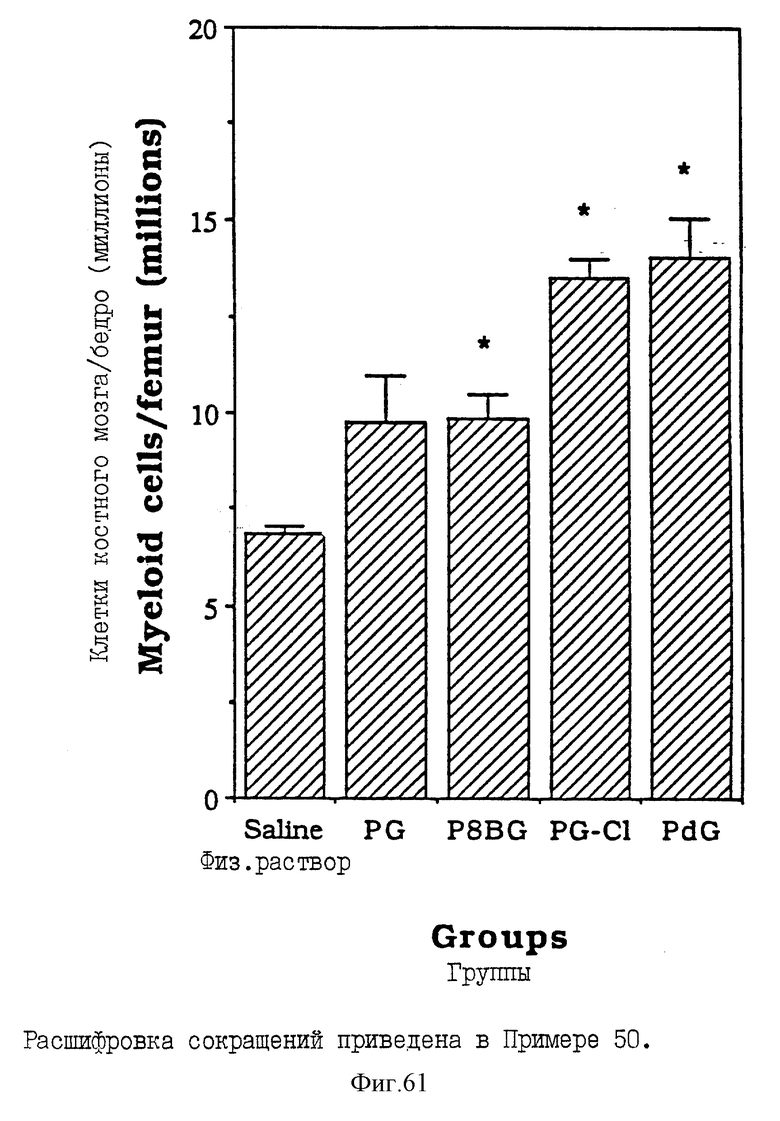
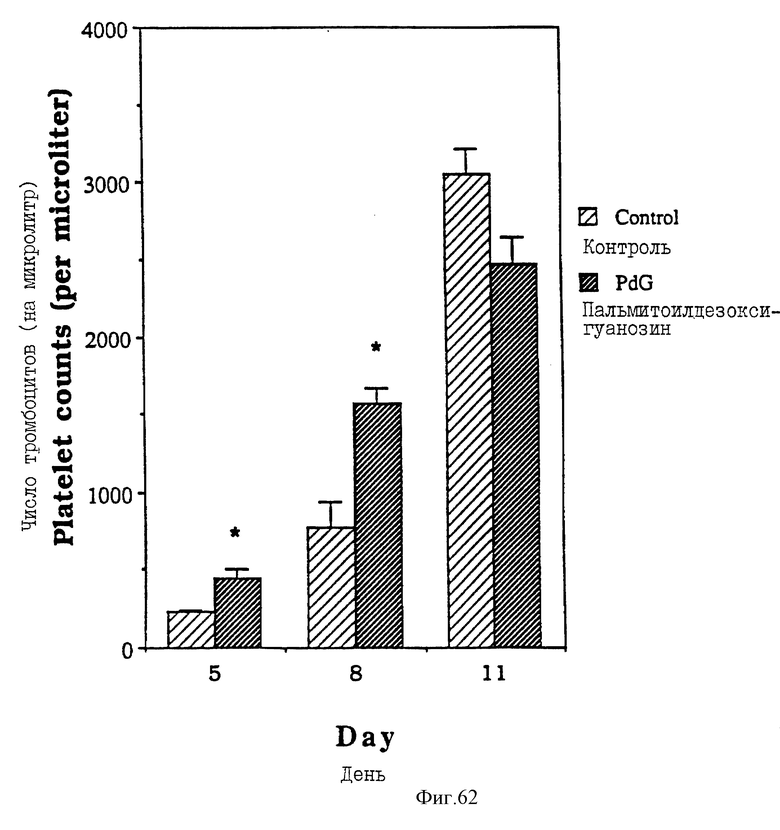
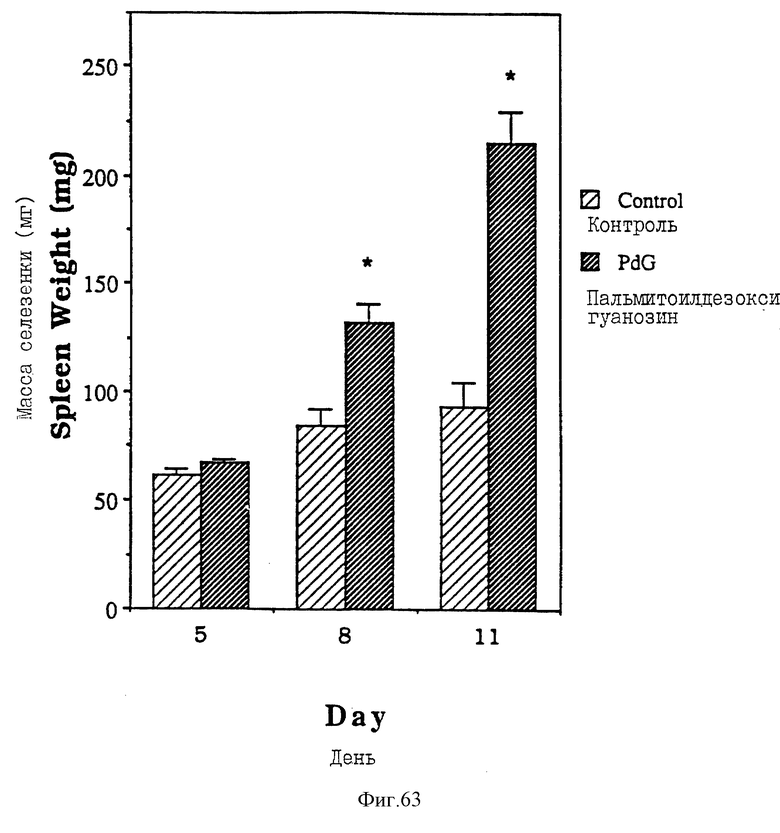
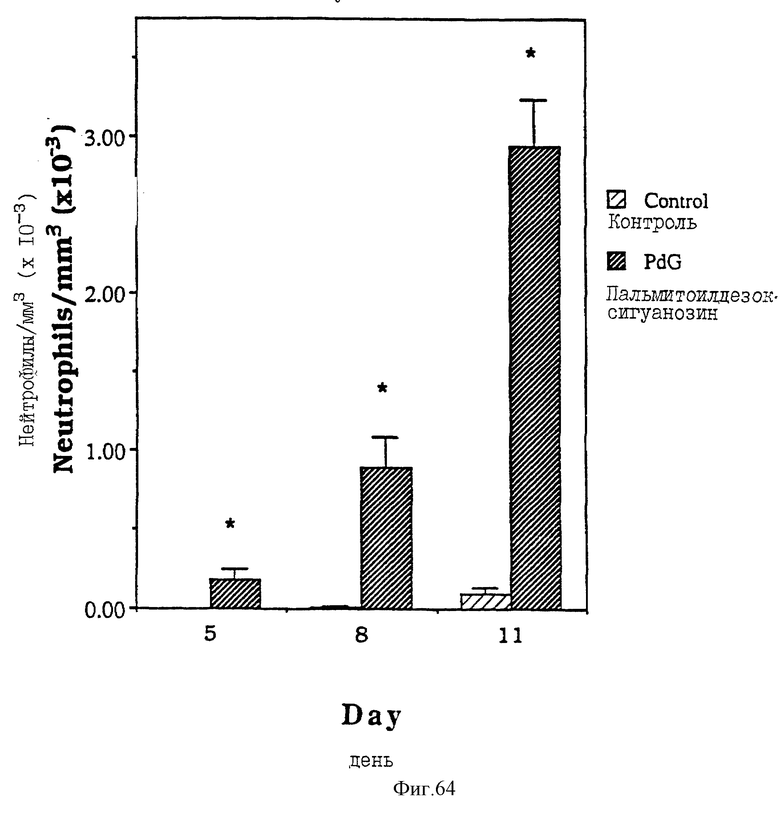
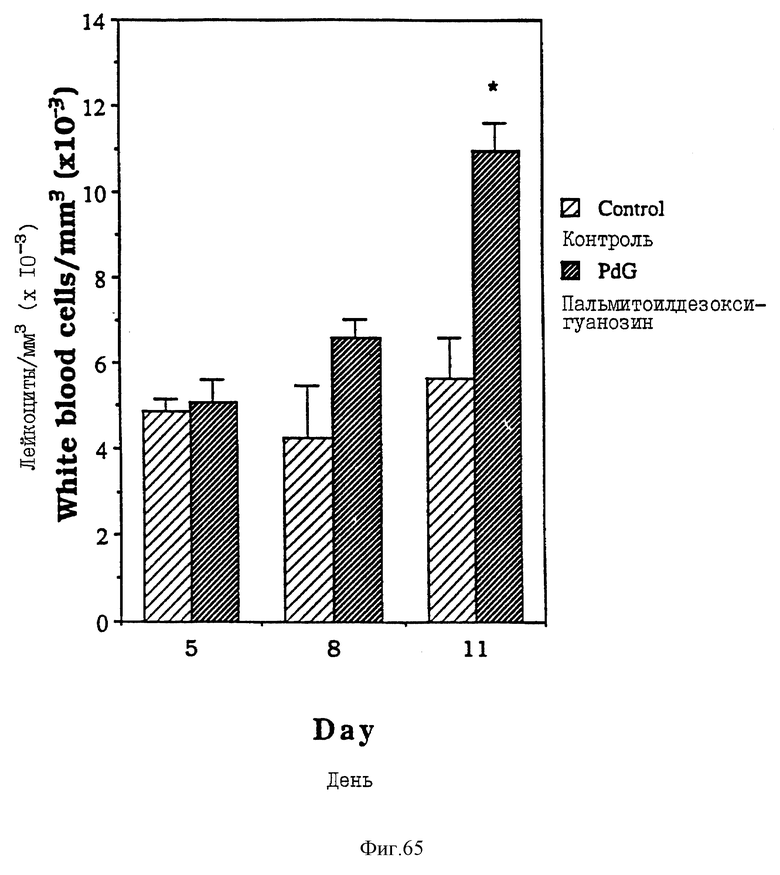
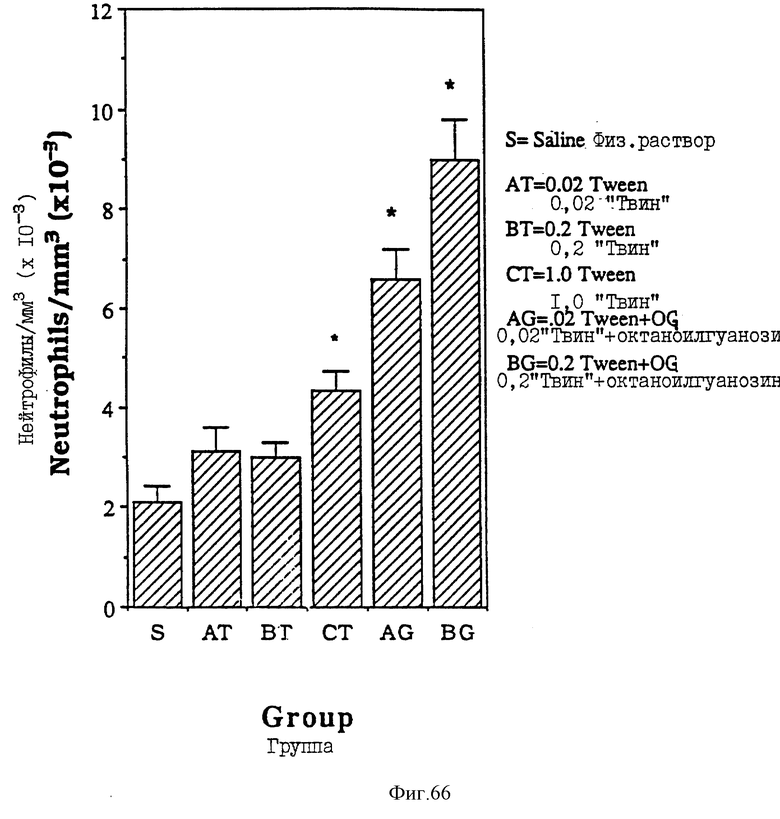
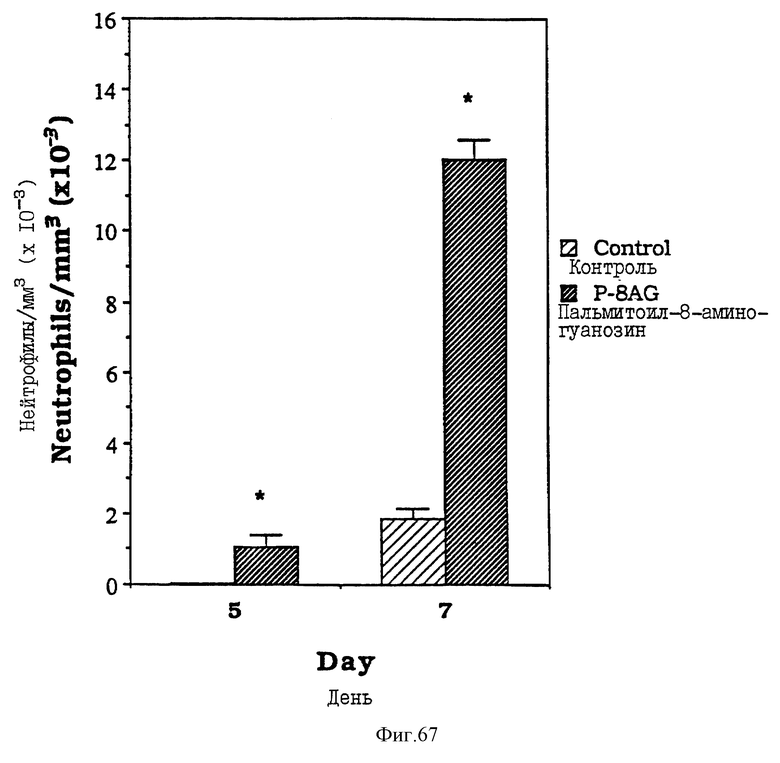
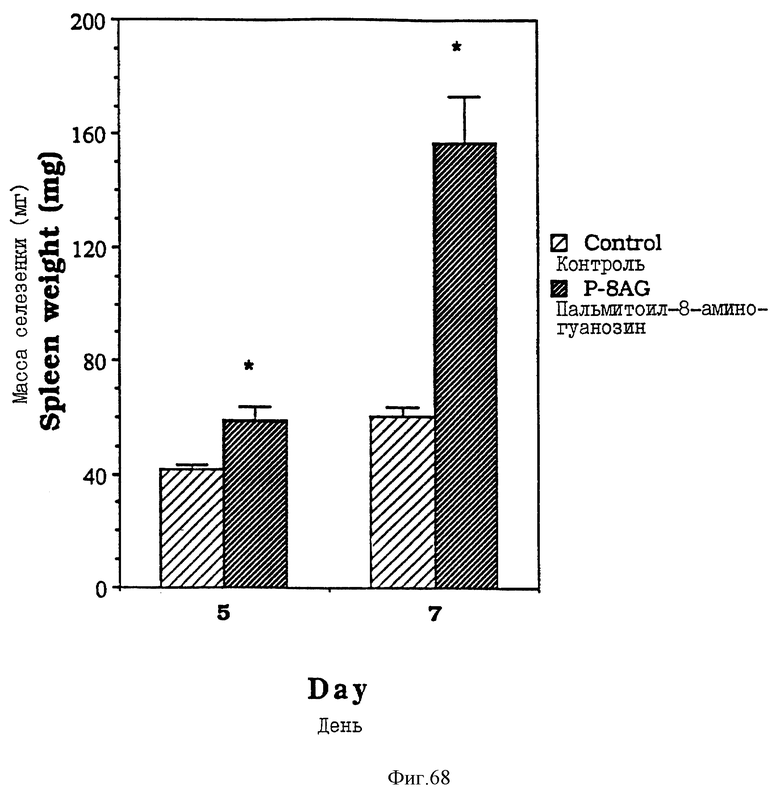
Изобретение относится к новым ацильным производным гуанозина формулы I, инозина формулы II, ксантозина формулы III, дезоксиинозина формулы IV, дезоксигуанозина формулы V, инозин- 2',3'-(ациклического)диалкоголя формулы VI или к их фармацевтически приемлемым солям. Значения радикалов RA, RB, RC, RD, Y, Q и Z представлены в соответствующих пунктах формулы изобретения. Описана фармацевтическая композиция, стимулирующая гемопоэз, содержащая в качестве действующего средства производные гуанозина или инозина или их соли. Также предложен способ лечения цитопении путем введения животному эффективного количества указанных соединений. Изобретение может быть использовано в медицинской практике для профилактики и терапии нарушений гемопоэза. 8 с. и 9 з.п.ф-лы, 68 ил., 2 табл.
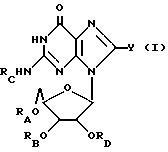
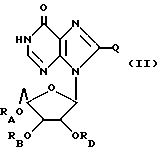
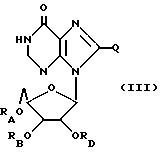
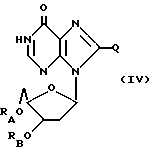

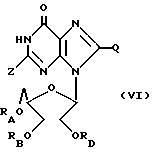
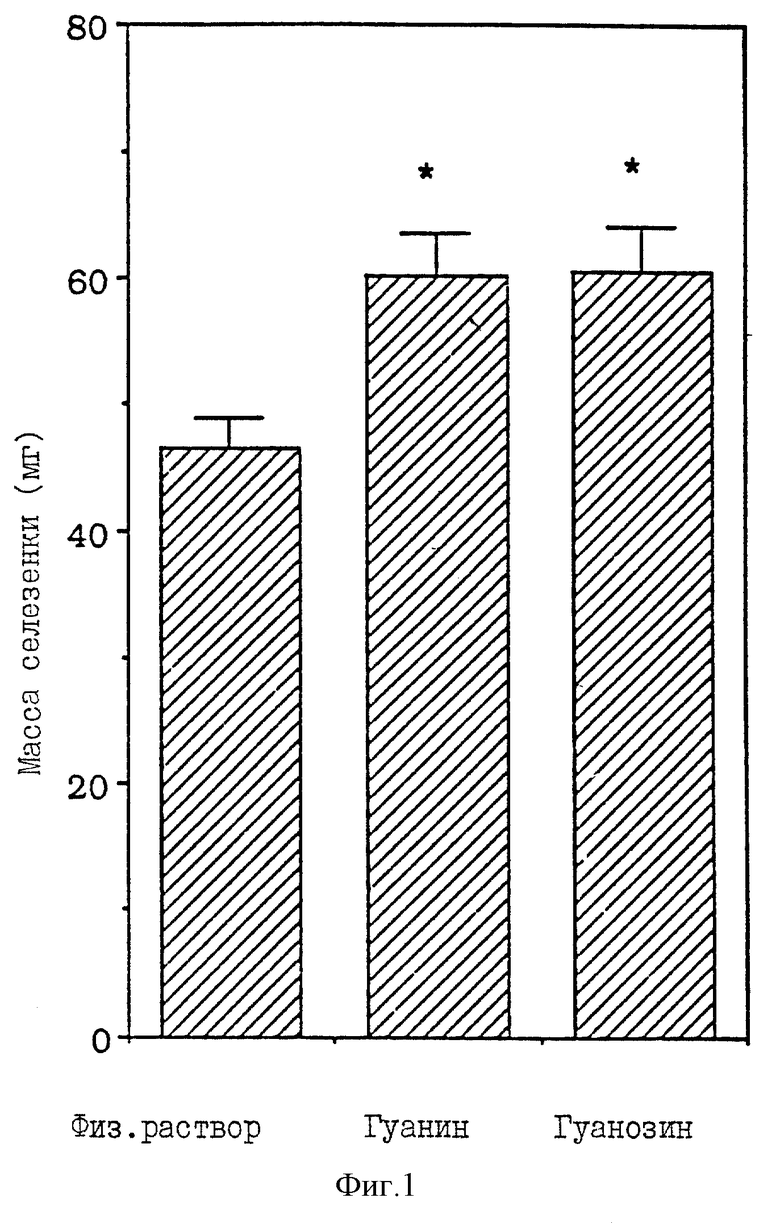
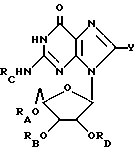
где RA, RB, RD имеют одинаковые или различные значения и представляют собой водород или ацильную группу, производную дикарбоновой кислоты с 10 - 18 атомами углерода;
RC представляет собой водород или ацильную группу, производную: жирной кислоты с неразветвленной цепью с 8 - 16 атомами углерода, либо лизина, либо дикарбоновой кислоты с 10 - 18 атомами углерода, либо незамещенной карбоновой кислоты с 7 атомами углерода;
Y представляет собой H,
или фармацевтически приемлемые соли этих соединений.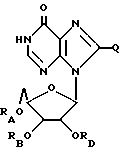
где RA, RB, RD имеют одинаковые или различные значения и представляют собой водород или ацильную группу, производную жирной кислоты и с неразветвленной цепью с 3 - 22 атомами углерода;
Q = H,
или их фармацевтически приемлемые соли.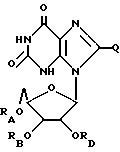
где RA, RB, RD имеют одинаковые или различные значения и представляют собой водород или ацильную группу, производную жирной кислоты с неразветвленной цепью с 3 - 22 атомами углерода;
Q = H,
или их фармацевтически приемлемые соли.
где RA и RB имеют одинаковые или различные значения и представляют собой водород или ацильную группу, производную от жирной кислоты с неразветвленной цепью с 3 - 22 атомами углерода;
Q = H,
или их фармацевтически приемлемые соли.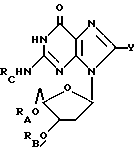
где RA, RB, RC могут иметь одинаковые или различные значения и каждый из них представляет собой водород или ацильную группу, производную жирной кислоты с неразветвленной цепью с 3 - 16 атомами углерода, либо дикарбоновой кислоты с 3 - 22 атомами углерода;
Y представляет собой H,
или фармацевтически приемлемые соли этих соединений.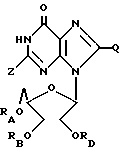
где RA, RB, RD имеют одинаковые или различные значения и представляют собой водород или ацильную группу, производную от жирной кислоты с неразветвленной цепью с 3 - 22 атомами углерода;
Q - H;
Z представляет собой H, = O,
или их фармацевтически приемлемые соли.
| US 4849411 A, 1989 | |||
| US 4962194 A, 1990 | |||
| Способ разделения дезоксинуклеозидов | 1981 |
|
SU1004403A1 |
| US 4786726 A, 1988 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1985, т.2 с.175 - 176. | |||
Авторы
Даты
2000-10-27—Публикация
1992-02-05—Подача