Область техники, к которой относится изобретение
Раскрытие имеет отношение к способам лечения, контролирования или ослабления лейкопении и/или тромбоцитопении, например, в случае проведения химиотерапевтического лечения рака, включающим введение соединения моноацетил-диацилглицерина, а также пригодных для этого композиций.
Уровень техники
Во время гемопоэза гематопоэтические стволовые клетки (HSC) в костном мозге дифференцируются в клетки-предшественники лимфоцитов (CLP) и клетки-предшественники миелоцитов (CMP). СМР дифференцируются в клетки миелоидной линии, такие как эритроциты, мегакариоциты/тромбоциты, нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги и дендритные клетки. CLP дают начало клеткам лимфоцитарного ростка, таким как Т-клетки, В-клетки и NK-клетки.
Что касается функций, клетки крови включают эритроциты, снабжающие кислородом ткани, тромбоциты, регулирующие свертывание крови, и лейкоциты, обеспечивающие защиту от инфекционных болезней и чужеродных веществ. Лейкоциты (белые клетки крови) включают лейкоциты миелоидного ростка, такие как нейтрофилы, эозинофилы, базофилы и моноциты, а также лимфоциты, такие как Т-клетки и В-клетки. В 1 мкл крови содержится приблизительно 4000-10000 лейкоцитов. Популяция лейкоцитов, как правило, состоит из 50-60% нейтрофилов, 1-6% эозинофилов, менее 1% базофилов, 2-10% моноцитов и 20-30% лимфоцитов. Однако, уровень и состав лейкоцитов может широко варьировать среди индивидуумов или у одного и того же индивидуума в течение некоторого периода времени в зависимости от таких факторов, как физическое состояние и воспалительный статус.
Если дифференцировка HSC в СМР клетки подавлена, наблюдается снижение концентрации лейкоцитов в крови ниже нормального уровня, что вызывает лейкопению. Зачастую лейкопения может быть вызвана бактериальной или вирусной инфекцией. Однако лейкопения также может быть вызвана апластической анемией, лейкемией, миелодиспластическим синдромом (MDS) или другими заболеваниями костного мозга. В то время как умеренная лейкопения может иметь своим результатом только незначительный дефицит иммунного ответа, тяжелая лейкопения может стать причиной даже сепсиса.
Поскольку нейтрофилы являются наиболее распространенными лейкоцитами, лейкопения, как правило, влечет за собой нейтропению. Нейтрофилы служат в качестве первичной защиты от инфекций, уничтожая бактерии в крови. Пациенты с нейтропенией являются более чувствительными к бактериальным инфекциям и находятся под угрозой возможного летального сепсиса, если состояние не контролируется. Абсолютное количество нейтрофилов (ANC) варьирует в зависимости от пола и возраста, при этом нормальный диапазон у взрослых составляет от 1500 до 8000 клеток на микролитр (мкл) крови, тем не менее, ANC у здоровых взрослых людей составляет обычно >2500 клеток/мкл. ANC<500 клеток/мкл считается тяжелым и очень опасным состоянием, коррелирующим с высоким риском тяжелой инфекции. Нейтропения может быть вызвана многими причинами, например, раком или другими болезнями, при которых повреждается костный мозг, врожденными заболеваниями, характеризующимися недостаточной функцией костного мозга, вирусными инфекциями, нарушающими функционирование костного мозга, аутоиммунными нарушениями, разрушающими нейтрофилы или клетки костного мозга, генерализованными инфекциями, истощающими нейтрофилы быстрее, чем они могут продуцироваться, или лекарственными средствами, разрушающими нейтрофилы или повреждающими костный мозг .Многие противоопухолевые лекарственные средства, как и лучевая терапия рака, могут вызывать прямое, зависящее от дозы подавление функции костного мозга. Другие противоопухолевые лекарственные средства стимулируют иммуно-опосредованное уничтожение клеток-предшественников в компартменте костного мозга и в некоторых случаях повышенное разрушение или уничтожение периферических нейтрофилов.
В гематопоэз вовлечены различные цитокины. Колониестимулирующий фактор гранулоцитов (G-CSF или GCSF), также известный как колониестимулирующий фактор 3 (CSF 3), представляет собой гликопротеин, стимулирующий кроветворные клетки-предшественники в костном мозге к пролиферации и дифференцировке в зрелые гранулоциты и стволовые клетки и высвобождению их в кровоток. Он также вызывает высвобождение гематопоэтических стволовых клеток (HSC) из костного мозга в кровообращение, несмотря на то, что он не может специфически стимулировать эти клетки. У людей он существует в двух активных формах, его более распространенная форма имеет 174 аминокислоты; другая форма состоит из 177 аминокислот. Фармацевтические аналоги природного G-CSF являются рекомбинантными формами человеческого пептида, состоящего из 174 аминокислот (rhG-CSF), и включают:
- филграстим (например, Нейпоген® от компании Amgen), который вырабатывается в Е. coli и обладает сходной активностью, но отличается от природного гликопротеина тем, что имеет N-концевой остаток метионина и не подвергается гликозилированию;
- ленограстим (например, Граноцит® от компании Chugai), который вырабатывается в клетках млекопитающего (клетках яичника китайского хомячка (СНО)) и поэтому является по существу неотличимым от человеческого G-CSF;
- пегфилграстим, ПЕГилированная форма филграстима (например, Неуласта® от компании Amgen и Неуластим® от компании Roche), имеющий 20 kD монометоксиполиэтиленгликолевый фрагмент, ковалентно связанный с N-концевым остатком метионина филграстима, который увеличивает растворимость и продолжительность действия по сравнению с филграстимом.
Эти лекарственные средства утверждены в США и других странах для лечения и облегчения нейтропении, в первую очередь у раковых больных, получающих химиотерапию, например, в случае одного или более из следующих показаний к применению
- для уменьшения случаев инфекции, проявляющихся лихорадочной нейтропенией, у пациентов с немиелоидными злокачественными заболеваниями, получающих миелосупрессивные противоопухолевые лекарственные средства, имеющие отношение к клинически значимым случаям лихорадочной нейтропении;
- для уменьшения времени восстановления нейтрофилов и продолжительности лихорадки, после терапии первой линии (индукционной терапии) или консолидирующей химиотерапии взрослых с острой миелоидной лимфомой;
- для уменьшения продолжительности нейтропении и связанных с нейтропенией клинических осложнений, например, лихорадочной нейтропении у пациентов с немиелоидными злокачественными заболеваниями, подвергающихся миелоаблативной химиотерапии с последующей трансплантацией костного мозга;
- для мобилизации гематопоэтических клеток-предшественников в периферической крови для сбора путем лейкафереза, которые затем могут быть трансплантированы пациенту с последующей миелоаблативной химиотерапией, что в результате может уменьшить необходимость в паллиативной терапии;
- для уменьшения числа случаев и продолжительности осложнений нейтропении (например, лихорадки, инфекций, орофарингеальных язв) у симптоматических пациентов с врожденной нейтропенией, циклической нейтропенией или идиопатической нейтропенией.
В большинстве случаев Нейпоген® назначается в дозах от 4 до 8 мкг/кг/день, вплоть до 10 мкг/кг/день. При введении больших доз (до 138 мкг/кг/день) не наблюдается токсических эффектов, однако наблюдается выравнивание кривой доза-эффект при ежедневных дозах выше 10 мкг/кг/день. Побочные действия Нейпогена ® и других форм G-CSF могут включать боль в костях, от легкой до умеренной, после повторного введения, местные кожные реакции в месте инъекции, аллергические реакции, увеличение или разрыв селезенки, альвеолярное кровотечение, острый респираторный дистресс-синдром (ARDS), гемоптизис и (у пациентов с уже существующими серповидно-клеточными нарушениями) серповидно-клеточные кризисы. G-CSF лекарственные средства не назначаются пациентам с хроническим миелолейкозом (CML) или миелодиспластическим синдромом, поскольку они потенциально могут активизировать рост раковых клеток.
Кровяные пластинки, также называемые тромбоцитами, представляют собой бесцветные клетки крови, способствующие свертыванию крови. Нормальное количество тромбоцитов у человека составляет от 130000 до 400000 тромбоцитов на микролитр (мкл) крови. Как в случае нейтропении, если дифференцировка HSC в СМР подавлена, или если тромбоциты гибнут, например, в результате аутоиммунного состояния, концентрация тромбоцитов в крови может опускаться ниже нормальных уровней (тромбоцитопения). Количество тромбоцитов <50000 тромбоцитов/мкл крови считается опасным состоянием, а при количестве <20000 тромбоцитов/мкл крови может спонтанно происходить опасное для жизни внутреннее кровотечение. Тромбоцитопения проявляется незначительным числом симптомов до тех пор, пока количество тромбоцитов не становится чрезвычайно низким, тогда на нарушение свертывания показывают спонтанные синяки, кровоподтеки после очень легкой травмы, петехия (красные или фиолетовые пятна на коже, вызванные крошечными кровоизлияниями в коже и слизистых оболочках), обильное кровотечение из небольших порезов, кровотечение из носа или при чистке зубов. Другие симптомы могут включать недомогание, усталость и общую слабость (с или без сопутствующей потери крови). Тромбоцитопения может быть вызвана, например, бактериальной или вирусной инфекцией, циррозом, химиотерапией или лучевой терапией, острым лейкозом, апластической анемией или аутоиммунными состояниями, или может являться побочным действием различных лекарственных препаратов. Подобно нейтропении, тромбоцитопения является распространенным побочным эффектом химиотерапии или лучевой терапии рака.
Тромбоцитопения может вызывать, усугублять или сопутствовать анемии. Анемия может быть вызвана активным кровотечением, например, обильным менструальным кровотечением, ранами, желудочно-кишечными язвами или раком, например, раком толстой кишки, при котором кровь может медленно сочиться, и такое кровотечение может быть вызвано или обострено тромбоцитопенией. Кроме того, анемия представляет собой обычное явление у пациентов, страдающих от хронического заболевания, недоедания и почечной недостаточности, все это может наблюдаться у раковых пациентов, получающих химиотерапию или лучевую терапию.
Множественная миелома (ММ) представляет собой рак плазматических клеток, продуцирующих антитела. Миелома препятствует нормальной выработке антител, что приводит к ослаблению иммунной системы и повышению восприимчивости пациента к инфекции, наряду с этим выработка дефектных антител может вызвать повреждение почек. Размножение миеломных клеток также препятствует нормальной выработке и функционированию красных и белых клеток крови, причем клетки миеломы, как правило, продуцируют вещества, вызывающие разрушение костей, что приводит к появлению боли в костях и/или переломам. Множественная миелома специфически индуцируется G-CSF. Острый миелобластный лейкоз (AML), также известный как острый миелоцитарный лейкоз или острый нелимфоцитарный лейкоз (ANLL), является раком миелоидной линии клеток крови, характеризующимся быстрым ростом ненормальных белых клеток крови, которые накапливаются в костном мозге и препятствуют выработке нормальных клеток крови. AML является наиболее распространенным острым лейкозом, поражающим взрослых людей. Миелодиспластические синдромы (также известные как MDS или миелодисплазия) отличаются неэффективной выработкой (или дисплазией) клеток крови миелоидного класса. У пациентов с MDS может развиваться тяжелая анемия, при которой требуется переливание крови. В некоторых случаях болезнь усугубляется и у пациентов развивается цитопения, вызванная прогрессирующей недостаточностью костного мозга. Хронический миелолейкоз (CML) представляет собой форму лейкемии, отличающуюся ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге и накоплением этих клеток в крови. CML является клональным нарушением стволовых клеток костного мозга, при котором обнаружена пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников.
Злокачественные заболевания костного мозга, такие как MM, AML, MDS и CML, могут быть индуцированы или стимулированы колониестимулирующим фактором гранулоцитов (G-CSF). В то же время, в немногих случаях, G-CSF специально используется для стимулирования пролиферации раковых клеток в этих типах рака, для того, чтобы увеличить их чувствительность к химиотерапевтическим средствам (которые в большинстве случаев «нацеливаются» на пролиферирующие клетки), препараты рекомбинантного G-CSF (например, филграстим, ленограстим или пегфилграстим) в основном не являются удовлетворительным выбором для лечения вызванной химиотерапией нейтропении у пациентов, восстанавливающихся после этих типов рака.
Например, леналидомид (Ревлимид®) является производным талидомида, используемым для лечения множественной миеломы, миелодиспластических синдромов и других видов рака. Леналидомид значительно улучшает общую выживаемость при миеломе (которая обычно имеет неблагоприятный прогноз), однако, этот лекарственный препарат является весьма токсичным. Основным проявлением дозо-лимитирующей токсичности является миелосупрессия, приводящая к тяжелой нейтропении и тромбоцитопении.
Необходимы новые подходы к лечению и управлению нейтропенией и тромбоцитопенией, например, для обеспечения возможности использования более агрессивной химиотерапии в более высоких дозах и/или в течение более длительных периодов времени, чем допустимая в настоящее время, и в частности, у пациентов с G-CSF-индуцибельными видами рака, когда нейтропения не может регулироваться с помощью G-CSF.
Оленьи рога традиционно применяют в азиатской медицине, используя высушенные неороговевшие рога оленя. Признано, что оленьи рога оказывают различные биологические воздействия, такие как стимулирующее действие на рост и развитие, способствуют кроветворной функции, способствуют лечению нервных расстройств, полезны при сердечной недостаточности, улучшают функцию пяти внутренних органов (viscera) и шести внутренностей (entrails), как описано в Dong-eui Bogam, Корейской медицинской книге, опубликованной в 1613. Сообщалось, что некоторые компоненты рогов оленя, включая рац-1-палмитоил-2-линолеоил-3-ацетилглицерин (PLAG), полученные из хлороформных экстрактов оленьих рогов, обладают рост-стимулирующим действием на гематопоэтические стволовые клетки и мегакариоциты (WO 99/26640). Также сообщалось, что производные моноацетилдиацилглицерина, представляющие собой активные компоненты оленьих рогов, являются эффективными при лечении аутоиммунных заболеваний, сепсиса, некоторых видов рака, например, рака желчных протоков, рака почки или злокачественной меланомы и т.д. (WO 2005/112912).
Раскрытие изобретения
Неожиданно было обнаружено, что моноацетилдиацилглицерины, описанные в данном документе, в частности PLAG, стимулируют выработку нейтрофилов посредством механизма, отличного от G-CSF, увеличивают выработку тромбоцитов и уменьшают миграцию нейтрофилов из крови. Вследствие этого данные соединения используются для содействия при лечении и уменьшении нейтропении и/или тромбоцитопении, например, когда она вызвана химиотерапевтическими препаратами, такими как леналидомид, в частности у пациентов, страдающих от видов рака, которые могут вызываться или усугубляться G-CSF. Более того, описанные здесь моноацетилдиацилглицерины, в частности PLAG, помогают предотвращать метастазирование таких раков крови путем снижения миграции раковых клеток из крови в лимфатические узлы. Моноацетилдиацилглицерины, описанные в данном документе, также уменьшают активность сывороточного комплемента, вследствие чего являются пригодными для защиты от опосредованного комплементом истощения тромбоцитов, например, вызванного аутоиммунным состоянием.
Настоящее раскрытие показывает, что моноацетилдиацилглицерин формулы I, описанный в данном документе, в частности, PLAG формулы 2, является эффективным для предотвращения и лечения тромбоцитопении и лейкопении, например, нейтропении, путем увеличения дифференцировки и развития HSC в СМР и подавления активности комплемента:
Формула 1
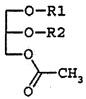
в которой R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например:
Формула 2 (PLAG)
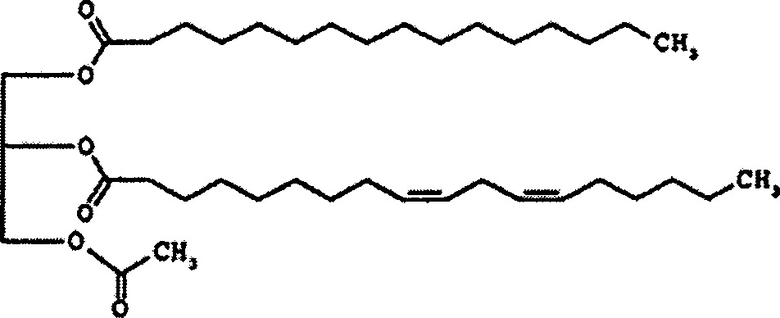
В некоторых вариантах осуществления настоящее раскрытие предоставляет способы лечения (например, ингибирование, уменьшение, контролирование, облегчение или реверсию) состояния, выбранного из лейкопении (например, нейтропении) и/или тромбоцитопении, включающие введение эффективного количества соединения формулы 1, например, PLAG, нуждающемуся в этом пациенту.
В некоторых вариантах осуществления настоящее раскрытие предоставляет способы предотвращения или подавления повышенного или активированного Комплемента (С3), включающие введение эффективного количества соединения формулы 1, например, PLAG, нуждающемуся в этом пациенту.
В некоторых вариантах осуществления настоящее раскрытие предоставляет способы лечения, контролирования или уменьшения лейкопении и усиления врожденного иммунитета, включающие введение эффективного количества соединения формулы 1, например, PLAG, нуждающемуся в этом субъекту, путем увеличения доли лейкоцитов миелоидного ростка, таких как нейтрофилы, эозинофилы, моноциты и, вместе с этим, уменьшения лимфоцитов, которые являются иммуноцитами.
В некоторых вариантах осуществления настоящее раскрытие предоставляет способы лечения рака, включающие введение нуждающемуся в этом пациенту химиотерапевтического средства в сочетании с нейтрофил- или тромбоцит-протективным количеством соединения формулы 1, например, PLAG, при этом химиотерапевтическое средство вводится в дозе, которая может вызвать, и/или в течение периода времени, в течение которого может быть вызвана нейтропения и/или тромбоцитопения у пациента, не получающего соединение формулы 1.
Настоящее раскрытие предоставляет в некоторых вариантах осуществления способы лечения, контролирования или уменьшения нейтропении и/или тромбоцитопении у пациентов, получающих химиотерапевтический препарат, например, леналидомид, для лечения рака, который стимулируется G-CSF (например, множественная миелома, острый миелоцитарный лейкоз, хронический миелолейкоз или миелодиспластический синдром), данные способы включают введение эффективного количества соединения формулы 1, например, PLAG, нуждающемуся в этом пациенту.
В некоторых вариантах осуществления данное раскрытие предоставляет способы лечения рака крови, например, выбранного из (например, множественной миеломы, острого миелоцитарного лейкоза, хронического миелолейкоза или миелодиспластического синдрома), например, рака крови, который может быть индуцирован или усугублен G-CSF, включающие совместное введение (последовательное или одновременное) химиотерапевтического средства, например, леналидомида, и соединения формулы 1.
В некоторых вариантах осуществления данное раскрытие предоставляет способ лечения (включая профилактику) нейтропении и/или мобилизации клеток-предшественников гемопоэза из периферической крови (РВРС), включающий введение (последовательное или одновременное) эффективного количества (i) соединения формулы 1, например, PLAG, и (ii) G-CSF, например, выбранного из филграстима, пегфилграстима и ленограстима, нуждающемуся в этом пациенту.
В некоторых вариантах осуществления данное раскрытие предоставляет способ уменьшения или лечения побочных действий G-CSF, например, тромбоцитопении и/или боли в костях, вызванной G-CSF, включающий совместное введение, последовательное или одновременное, соединения формулы 1, например, PLAG, нуждающемуся в этом пациенту.
В другом варианте осуществления данное раскрытие предоставляет способ лечения анемии, включающий введение эффективного количества соединения формулы 1, в частности PLAG, нуждающемуся в этом пациенту. Поскольку соединения формулы 1 способствуют дифференцировке HSC до СМР, увеличивая, таким образом, количество клеток миелоидного ростка, они используются для увеличения выработки эритроцитов, и в то же время, путем увеличения количества тромбоцитов они уменьшают хроническое кровотечение, например, из язвы желудка или избыточное менструальное кровотечение, являющееся следствием тромбоцитопении, тем самым увеличивая и сохраняя эритроциты, а также уменьшая анемию.
В дополнение к этому, настоящее раскрытие предоставляет фармацевтическую композицию, содержащую функциональное лечебное питание и включающую соединение формулы 1, предназначенную для предотвращения или нормализации лейкопении или тромбоцитопении.
Данное раскрытие дополнительно предоставляет соединения формулы 1, и фармацевтические композиции, содержащие композиции формулы 1, для использования в описанных способах и в производстве медикаментов.
В одном варианте осуществления раскрытие предоставляет новый фармацевтический продукт с однократной дозой лекарственного средства, в форме мягкой желатиновой капсулы для перорального введения, содержащей 250-1000 мг, например, 500 мг активного вещества PLAG, практически не содержащей других триглицеридов, вместе с 0,1-3 мг, например, 1 мг фармацевтически приемлемого соединения токоферола, например, α-токоферола, в качестве антиоксиданта, например, предназначенной для приема один или два раза в день, в ежедневной дозировке от 500 мг до 4,000 мг.
Дополнительные области применения настоящего изобретения станут понятны из подробного описания и примеров, предоставленных в дальнейшем. Следует понимать, что подробное описание и конкретные примеры, показывающие отдельные предпочтительные варианты осуществления изобретения, предназначаются только для иллюстративной цели и не ограничивают рамки изобретения.
Краткое описание чертежей
Фигура 1 показывает анализ по гену-репортеру транскрипционной активности STAT1 и STAT6 в PLAG-обработанных HepG2 клетках.
Фигура 2 показывает ингибирование комплемента 3 с помощью PLAG в НМС-1 клетках.
Фигура 3А подтверждает, что PLAG не влияет на размножение и гибель клеток в анализе с WST-1 в клеточной линии HepG2. Фигура 3В показывает, что экспрессия С3 снижается дозо-зависимым образом при введении PLAG. Фигура 3С показывает, что сходный результат получен при введении S6I.
Фигура 4 показывает протективное действие PLAG в отношении нейтрофилов от трех химиотерапевтических средств на мышиной модели.
Фигура 5 показывает протективное действие PLAG в отношении тромбоцитов от трех химиотерапевтических средств на мышиной модели.
Фигура 6 показывает эффект активации комплемента 3 тремя химиотерапевтическими средствами на мышиной модели и блокировку этих эффектов с помощью PLAG.
Фигура 7 показывает результаты клинических испытаний в отношении воздействия PLAG на Комплемент 3.
Фигура 8 показывает вызванную химиотерапевтическим средством тромбоцитопению (CIN), ингибированную обработкой PLAG в клиническом испытании.
Фигура 9 показывает индуцированную химиотерапевтическим средством нейтропению (CIN), ингибированную обработкой PLAG в клиническом испытании.
Осуществление изобретения
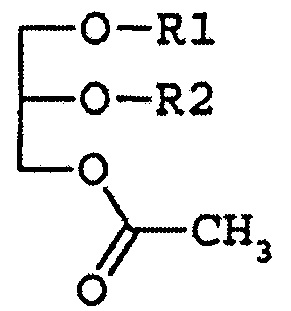
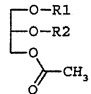
Композиции настоящего раскрытия для лечения тромбоцитопении и/или лейкопении включают производные глицерина, имеющие одну ацетильную группу и две ацильные группы следующей формулы 1:
Формула 1

в которой R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода.
В настоящем раскрытии производные глицерина формулы I иногда называются моноацетилдиацилглицеринами (MDAG). Остаток жирной кислоты имеет отношение к ацильному фрагменту, возникающему вследствие образования сложноэфирной связи при взаимодействии жирной кислоты и спирта. Таким образом, неограничивающие примеры R1 и R2 включают пальмитоил, олеоил, линолеоил, стеароил, миристоил, арахидоноил и так далее. Предпочтительные комбинации R1 и R2 (R1/R2) включают олеоил/пальмитоил, пальмитоил/олеоил, пальмитоил/линолеоил, пальмитоил/линолеоил, пальмитоил/арахидоноил, пальмитоил/стеароил, пальмитоил/пальмитоил, олеоил/стеароил, линолеоил/пальмитоил, линолеоил/стеароил, стеароил/линолеоил, стеароил/олеоил, миристоил/линолеоил, миристоил/олеоил и так далее. В рамках оптической активности производные моноацетилдиацилглицерина формулы 1 могут иметь (R)-форму, (S)-форму или быть рацемической смесью и могут включать их стереоизомеры. Когда R1 и/или R2 заместители являются остатками ненасыщенных жирных кислот, двойная связь(и) может иметь цис-конфигурацию.
В одном варианте осуществления моноацетилдиацилглицерин является соединением следующей формулы 2:
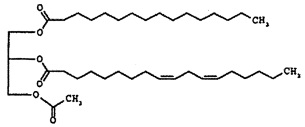
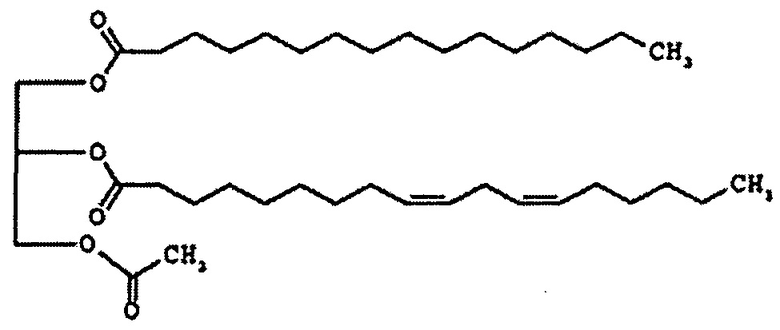
Формула 2
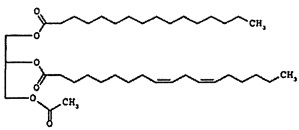
Соединение формулы 2 представляет собой 1-пальмитоил-2-линолеоил-3-ацетилглицерин, также называемый "PLAG" в этом подробном описании. R1 и R2 соединения формулы 2 представляют собой пальмитоил и линолеоил, соответственно. 2-углерод на глицериновом фрагменте является хиральным. Как правило, PLAG предоставляется в виде рацемата, причем R- и S-энантиомеры, по-видимому, обладают одинаковой активностью. Известно, что PLAG формулы 2 увеличивает выживаемость животных на экспериментальных животных с моделью сепсиса при использовании метода лигирования и пункции слепой кишки и показывает отсутствие токсичности в GLP (надлежащая лабораторная практика) тесте на токсичность. Однако, эффект соединений моноацетилдиацилглицерина, включая PLAG, на тромбоцитопению и лейкопению, в частности на нейтропению, и эффект соединений моноацетилдиацилглицерина в комбинации с G-CSF лекарственными средствами неизвестен или не раскрывается в известном уровне техники.
Соединения моноацетилдиацилглицерина могут быть выделены и экстрагированы из природных оленьих рогов или могут быть получены с помощью общепринятых методов органического синтеза. Конкретнее, оленьи рога подвергают экстракции с гексаном с последующей экстракцией остатка хлороформом, а затем удалением хлороформа с получением хлороформных экстрактов. Для этой экстракции используется такой объем растворителей, которого достаточно, чтобы погрузить оленьи рога. В общем, около 4-5 литров гексана и/или хлороформа используется на 1 кг оленьих рогов, но без ограничения. Полученные этим способом экстракты дополнительно фракционируют и очищают с использованием серии колоночных хроматографий на силикагеле и метода TLC для получения соединения моноацетилдиацилглицерина для настоящего изобретения. Растворитель для экстракции выбирают из числа хлороформ/метанол, гексан/этилацетат/уксусная кислота, но без ограничения.
Способ химического синтеза для получения соединений моноацетилдиацилглицерина показан, например, в корейских зарегистрированных патентах №10-0789323 и №10-1278874, содержания которых включаются в описание путем отсылки. Например, PLAG можно синтезировать путем ацилирования гидроксильных групп глицерина ацетильными, пальмитоильными и линолеоильными функциональными группами. Конечный продукт является аналогичным природному компоненту, идентифицированному и выделенному из оленьих рогов. Оба являются рацематами.
В настоящем изобретении термин "лечение" включает профилактику, уменьшение, облегчение или устранение состояния, которое лечат, например, подавление или отсрочку начала тромбоцитопении и лейкопении путем введения фармацевтической композиции настоящего раскрытия (иногда именуемое как предотвращение), а также улучшение тромбоцитопении и лейкопении или изменение симптомов тромбоцитопении и лейкопении до более благоприятных состояний.
In vitro фармакологические исследования на клеточных линиях показывают, что PLAG способен ингибировать PKCθ/p38/ERK путь, который вовлечен в созревание лимфоидных клеток-предшественников из HSC. Также, показана in vitro индукция повышенного колониеобразования в происходящих из костного мозга HSC. Более того, PLAG ингибирует экспрессию комплемента С3 в человеческих НМС-1 клетках. Показано, что in vivo PLAG увеличивает образование «пузырьков» в селезенке облученных мышей, которым трансплантированы сингенные HSC. Введение PLAG предотвращает индуцированную цитотоксическим средством нейтропению и улучшает уровень выживаемости у мышей, обработанных тамоксифеном.
Соединения моноацетилдиацилглицерина, в частности PLAG, способствуют дифференцировке гематопоэтических стволовых клеток (HSC) до общего миелоидного предшественника (СМР), который является предшественником (i) мегакариоцитов, которые дифференцируются в тромбоциты, и (и) миелобластов, которые дифференцируются в нейтрофилы, эозинофилы, базофилы, моноциты и т.д., а не в общие клетки-предшественники лимфоцитов (CLP), таким образом, увеличивая долю макрофагов, таких как нейтрофилы, эозинофилы, моноциты и т.д., и уменьшая долю чрезмерно вырабатываемых лимфоцитов. Они предотвращают и лечат лейкопению, и конкретнее, предотвращают, уменьшают или лечат нейтропению для усиления врожденного иммунитета.
В дополнение к повышению колониеобразования и активации дифференцировки HSC в миелоидные клетки, такие как нейтрофилы и мегакариоциты, соединения моноацетилдиацилглицерина, в частности PLAG, уменьшают активацию комплемента. Опубликованные сообщения относительно роли комплемент-зависимого механизма в нейтропении, вызванной лекарственным средством, и роли нейтрофилов в воспалении сосудов и ответе на сепсис дают основания предполагать, что активация комплемента может быть вовлечена в тромбоцитопению и лейкопению, индуцированную химиотерапией. Без ограничения какой-либо теорией, считается, что соединения подавляют С3 путем ингибирования активности STAT6, который может повышающим образом регулироваться или активироваться химиотерапией. STAT6 ингибитор вероятно блокирует сигнальную трансдукцию STAT6 в клетке с помощью IL-4, который в свою очередь может подавлять экспрессию С3.
Селективное снижение активности комплемента с помощью соединений моноацетилдиацилглицерина формулы 1, в частности PLAG, таким образом, способствует их эффективности в отношении индуцированной химиотерапией нейтропении и тромбоцитопении. Снижение активности комплемента дополнительно благоприятствует лечению нейтропении, уменьшая индуцированный комплементом выход нейтрофилов из кровообращения. Это также благоприятствует лечению тромбоцитопении, уменьшая опосредованное комплементом разрушение тромбоцитов, например, при аутоиммунной тромбоцитопении.
Соединения моноацетилдиацилглицерина формулы 1, в частности PLAG, стимулируют выработку нейтрофилов с помощью механизма, отличного от G-CSF, и таким образом усиливают эффекты G-CSF лекарственных средств, таких как филграстим, пегфилграстим и ленограстим при лечении или уменьшении нейтропении и/или мобилизации клеток-предшественников гемопоэза из периферической крови (РВРС) до степени, которая не достижима путем введения G-CSF в отдельности. Соединение моноацетилдиацилглицерина в некоторых случаях также может уменьшать побочные действия G-CSF, например, путем увеличения выработки тромбоцитов и путем уменьшения боли в костях, связанной с введением G-CSF. Соответственно, раскрытие предоставляет способ лечения нейтропении и/или мобилизации РВРС, включающий введение моноацетилдиацилглицерина, например, PLAG, нуждающемуся в этом пациенту, одновременно, последовательно или в комбинации с колониестимулирующим фактором гранулоцитов (G-CSF). Такой пациент, например, может быть пациентом, получающим химиотерапию и/или лучевую терапию, или другим пациентом, страдающим от или имеющим риск развития нейтропении, причем моноацетилдиацилглицерин, например, PLAG, может назначаться во время и/или после химиотерапии и/или лучевой терапии, для лечения возникающей в связи с этим нейтропении, и/или может назначаться заранее, чтобы смягчить эффекты такого лечения, или чтобы мобилизовать гематопоэтические клетки-предшественники в периферической крови для сбора с помощью лейкафереза и последующего использования с целью восстановления пациента после миелоаблативной химиотерапии.
Моноацетилдиацилглицерины формулы 1, в частности PLAG, стимулируют выработку нейтрофилов с помощью механизма, отличного от G-CSF. Поскольку соединения формулы 1, например, PLAG, увеличивают как уровни тромбоцитов, так и уровни нейтрофилов, можно предположить, что они способствуют пролиферации и дифференцировке выше G-CSF. Более того, соединения формулы 1, например, PLAG, уменьшают активацию комплемента, уменьшают выход нейтрофилов в лимфатические узлы в дальнейшем после стимулирования воспаления и уменьшают разрушение тромбоцитов, все эти виды активности отличаются от G-CSF.
Таким образом, соединения формулы 1, в частности PLAG, могут способствовать ослаблению нейтропении и тромбоцитопении, вызванной химиотерапевтическими средствами, такими как леналидомид, в частности, у пациентов, которые не могут использовать G-CSF, например, пациенты, страдающие от видов рака, которые могут быть индуцированы или обострены действием G-CSF. Поскольку соединения формулы 1, в частности PLAG, не конкурируют с G-CSF, а скорее усиливают эффекты G-CSF, они могут использоваться в комбинации с G-CSF для обеспечения уровня эффективности, недостижимого при использовании одного G-CSF, или уменьшения уровня G-CSF, необходимого для эффективности, например, у пациентов, испытывающих побочные действия от G-CSF.
Более того, соединения формулы 1, в частности PLAG, помогают предотвращать метастазирование таких раков крови путем уменьшения миграции злокачественных клеток из крови в лимфатические узлы. Как описано в примерах, когда мышам вводят липополисахарид (LPS) для того, чтобы вызвать иммунный ответ, в присутствии или в отсутствие PLAG, у мышей, леченых LPS и PLAG, концентрация нейтрофилов повышается, в то время как уровни нейтрофилов в лимфе являются низкими по сравнению с контрольным уровнем (один LPS). Это показывает, что наряду с тем, что PLAG увеличивает уровни нейтрофилов в крови, он также ингибирует миграцию в лимфатический узел.
Фармацевтическая композиция, содержащая моноацетилдиацилглицерины, может состоять исключительно или практически из чистых производных моноацетилдиацилглицерина формулы 1, или может включать активные компоненты (производные моноацетилдиацилглицерина формулы 1) и общепринятые фармацевтически приемлемые носители, эксципиенты или разбавители. Количество моноацетилдиацилглицерина в фармацевтической композиции может широко варьировать без специального ограничения, и в частности, составляет от 0,0001 до 100 вес. %, например, от 0,001 до 50 вес %, от 0,01 до 20 вес % или 95-99 вес % относительно общего количества композиции. Фармацевтическая композиция может быть заключена в состав твердой, жидкой, гелевой или суспензионной формы для перорального или неперорального введения, например таблетки, пилюли, порошка, гранулы, капсулы, такой как твердая или мягкая желатиновая капсула, эмульсии, суспензии, сиропа, эмульгируемого концентрата, стерилизованного водного раствора, неводного раствора, высушенной сублимацией композиции, суппозитория и так далее. При создании композиции могут использоваться общепринятые эксципиенты или разбавители, такие как наполнитель, объемообразующее вещество, связывающее вещество, увлажняющее вещество, дезинтегрирующее вещество и поверхностно-активное вещество. Твердая композиция для перорального введения включает таблетку, пилюлю, порошок, гранулу, капсулу и так далее, при этом твердая композиция может быть получена путем смешивания одного или более активных компонентов и, по меньшей мере, одного эксципиента, такого как крахмал, карбонат кальция, сахароза, лактоза, желатин и так далее. Кроме эксципиента, также может использоваться смазывающее вещество, такое как стеарат магния или тальк. Жидкая композиция для перорального применения включает эмульсию, суспензию, сироп и тому подобное и может включать общепринятые разбавители, такие как вода и жидкий парафин, или может включать различные эксципиенты, такие как увлажняющее вещество, подсластитель, ароматическое вещество и консервирующее вещество. Композиция для неперорального введения включает стерилизованный водный раствор, неводный раствор, высушенную сублимацией композицию, суппозиторий и так далее, и растворитель для такого раствора может включать пропиленгликоль, полиэтиленгликоль, растительное масло, например, оливковое масло, и сложный эфир для инъекционного шприца, такой как этилолеат. Основные материалы для суппозитория могут включать витепсол, макрогол, твин 61, масло какао, лаурин и глицеро-желатин.
Соединение моноацетилдиацилглицерина может быть введено в фармацевтически эффективном количестве. Термин "фармацевтически эффективное количество" используется для обозначения количества, являющегося достаточным для достижения желаемого результата при терапевтическом лечении. "Фармацевтически эффективное количество" может быть установлено в соответствии с категорией субъекта, возрастом, полом, тяжестью и типом болезни, активностью лекарственного средства, чувствительностью к лекарственному средству, временем введения, способом введения, интенсивностью экскреции и тому подобным.
Термин "лечение" включает профилактику, смягчение или уменьшение интенсивности, задержку или уменьшение симптомов, а также частичное или полное устранение или предотвращение симптомов тромбоцитопении и/или лейкопении путем введения композиции настоящего изобретения. Композиция настоящего раскрытия может вводиться отдельно или вместе с другими лекарственными средствами последовательно или одновременно. Когда композиции настоящего раскрытия вводится вместе с G-CSF лекарственным средством, термин "лечение" включает профилактику, смягчение или уменьшение интенсивности, задержку или уменьшение симптомов, а также частичное или полное устранение или предотвращение симптомов нейтропении и/или побочных эффектов G-CSF, путем введения моноацетилдиацилглицерина в комбинации (последовательно или одновременно) с G-CSF лекарственным средством.
Предпочтительное количество композиции настоящего раскрытия может варьировать в соответствии с состоянием и весом пациента, тяжестью болезни, типом лекарственной композиции, способом введения и периодом лечения. Общее количество, подходящее для введения в 1 день, может быть определено врачом, и как правило, составляет примерно от 0,05 до 200 мг/кг. На основе экспериментов in vivo на животных и экспериментов in vitro на клетках можно заключить, что предпочтительное общее количество для введения в день составляет от 0,1 до 100 мг/кг на взрослого человека. Например, общее количество 50 мг/кг может быть введено один раз в день или может быть введено раздельными дозами два, три или четыре раза в день.
Например, в одном варианте осуществления раскрытие предоставляет новую фармацевтическую композицию в стандартной лекарственной форме в виде мягкой желатиновой капсулы для перорального введения, содержащую 250-1000 мг, например, 500 мг, лекарственного средства PLAG, не содержащую других триглицеридов, вместе с 0,1-3 мг, например, 1 мг фармацевтически приемлемого соединения токоферола, например, α-токоферола, в качестве антиоксиданта, например, для введения один раз или два раза в день, в ежедневной дозировке от 500 мг до 4000 мг, например, 1000 мг/день вводится отдельными дозами по 500 мг утром и 500 мг вечером.
Композиция настоящего раскрытия может быть введена любому субъекту, нуждающемуся в предотвращении или лечении тромбоцитопении и лейкопении. Например, композиция настоящего раскрытия может быть введена не только человеку, но также животному, не являющемуся человеком (в частности, млекопитающим), таким как обезьяна, собака, кошка, кролик, морская свинка, крыса, мышь, корова, овца, свинья, коза и так далее. Композиция настоящего раскрытия может быть введена с помощью различных общепринятых способов, например, перорально или ректально, или с помощью внутривенной (i.v.), внутримышечной (i.m.), подкожной (s.c.) или цереброваскулярной инъекции. Так как моноацетилдиацилглицерины являются активными при пероральном введении, они в большинстве случаев вводятся перорально, например, в форме желатиновой капсулы, или в форме функционального продукта питания, то есть пищи, которая содержит эффективное количество моноацетилдиацилглицерина формулы 1.
Таким образом, раскрытие предоставляет в одном аспекте способ (Способ 1) лечения, (например, ингибирования, облегчения, контролирования, уменьшения или реверсии) состояния, выбранного из лейкопении (например, нейтропении) и/или тромбоцитопении, включающий введение нуждающемуся в этом пациенту этого эффективного количества (например, нейтрофил- или тромбоцит-протективного количества) соединения формулы I:
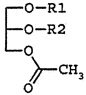
в которой R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например, PLAG; например,
1.1. Способ 1, в котором R1 и R2 независимо выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, стеароила, миристоила и арахидоноила.
1.2. Способ 1 или 1.1, в котором R1 и R2 (R1/R2) выбирают из группы, состоящей из олеоил/пальмитоила, пальмитоил/олеоила, пальмитоил/линолеоила, пальмитоил/линолеоила, пальмитоил/арахидоноила, пальмитоил/стеароила, пальмитоил/пальмитоила, олеоил/стеароила, линолеоил/пальмитоила, линолеоил/стеароила, стеароил/линолеоила, стеароил/олеоила, миристоил/линолеоила, миристоил/олеоила.
1.3. Любой предшествующий способ, в котором соединение формулы 1 является соединением формулы 2 (PLAG):
1.4. Любой предшествующий способ, в котором соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других моноацетилдиацилглицеринов, например, в которой, по меньшей мере, 95%, например, по меньшей мере, 99% всех моноацетилдиацилглицеринов в композиции являются соединениями формулы 2.
1.5. Любой предшествующий способ, в котором соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других соединений моноацетилдиацилглицеринов.
1.6. Любой предшествующий способ, в котором соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других триглицеридных соединений.
1.7. Любой предшествующий способ, в котором соединение формулы 1 выделяют и экстрагируют из природных рогов оленя.
1.8. Любой предшествующий способ, в котором соединение формулы 1 получают с помощью химического синтеза.
1.9. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции для перорального введения.
1.10. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, которая представляет собой мягкую желатиновую капсулу, содержащую соединение формулы 1 в комбинации или соединении с фармацевтически приемлемым разбавителем или носителем, например, в котором фармацевтически приемлемый разбавитель или носитель включает пищевое масло, например, растительное масло, например, оливковое масло.
1.11. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, содержащей от 0,0001 до 100,0 вес. %, например, 50-95%, или 95-99% от веса композиции.
1.12. Любой предшествующий способ, в котором композиция дополнительно содержит фармацевтически приемлемый антиоксидант, например, аскорбиновую кислоту (АА, Е300) и токоферолы (Е306), а также синтетические антиоксиданты, такие как пропилгаллат (PG, Е310), третичный бутилгидрохинон (TBHQ), бутилоксианизол (ВНА, Е320) и бутилированный гидрокситолуол (ВНТ, Е321), например, α-токоферол.
1.13. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2, введенное в форме мягкой желатиновой капсулы, содержащей 250 мг соединения формулы 2 в комбинации или сочетании приблизительно с 50 мг фармацевтически приемлемого разбавителя или носителя, например, пищевого масла, например, растительного масла, например, оливкового масла.
1.14. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме функционального питания, например, в качестве добавки или примеси в пищу, пригодную для потребления человеком.
1.15. Любой предшествующий способ, в котором соединение формулы 1 вводится один раз в день (q.d.) или дважды в день (b.i.d.).
1.16. Любой предшествующий способ, в котором общая суточная доза соединения формулы 1 составляет от 250 мг до 2000 мг/день, например, 500 мг - 1500 мг/день, например, 500 мг/день, 1000 мг/день или 1500 мг/день.
1.17. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг два раза в день, например, утром и вечером.
1.18. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг один раз в день, например, вечером.
1.19. Любой предшествующий способ, в котором соединение формулы 1 вводится в течение, по меньшей мере, двух недель, например, по меньшей мере, месяца.
1.20. Любой предшествующий способ, в котором фармацевтическая композиция может быть заключена в твердую, мягкую, гелевую или суспензионную форму для пероарального и неперорального введения.
1.21. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2 (PLAG), которое вводится в форме мягкой желатиновой капсулы для перорального введения, содержащей 500 мг лекарственного препарата PLAG и 1 мг α-токоферола в качестве антиоксиданта, и вводится один или два раза в день, при этом общая суточная доза составляет от 500 мг до 4000 мг.
1.22. Любой предшествующий способ, в котором состояние, требующее лечения, представляет собой нейтропению.
1.23. Любой предшествующий способ, в котором состояние, требующее лечения, является результатом одной из болезней, выбранной из группы, состоящей из пневмонии, ушной инфекции, пероральной инфекции десен, отравления мышьяком, гемодиализа, воздействия химического соединения, белка, противоопухолевого препарата, химиотерапии и лучевой терапии.
1.24. Любой предшествующий способ, в котором состояние, требующее лечения, вызывается одной из болезней, выбранной из группы, состоящей из пневмонии, ушной инфекции, пероральной инфекцией десен, отравления мышьяком, гемодиализа, воздействия химического соединения, белка, противоопухолевого препарата, химиотерапии и лучевой терапии.
1.25. Любой предшествующий способ, в котором состояние, требующее лечения, вызывается или обостряется соединением, выбранным из группы, состоящей из зиф-афлиберцепта, брентуксимаба ведотина, пралатрексата, ганцикловира, валганцикловира, ромидепсина, руксолитиниба, децитабина, иматиниба, топотекана, леналидомида, иринотекана, интерферонов, фенилгидразина, тамоксифена, липополисахарида, антрациклиновых антибиотиков, гемцитабина, цитоксана, паклитакселя, алкилирующего антинеопластического средства, ДНК-интеркалирующего средства, ингибитора топоизомеразы и их производных или смесей.
1.26. Любой предшествующий способ, в котором состояние, требующее лечения, включает тромбоцитопению, вызванную лекарственным средством, например, лекарственным средством, выбранным из зиф-афлиберцепта, брентуксимаба ведотина, пралатрексата, ганцикловира, валганцикловира, ромидепсина, руксолитиниба, децитабина, иматиниба, топотекана, леналидомида, иринотекана, интерферонов, фенилгидразина, тамоксифена, липополисахарида, антрациклиновых антибиотиков (например, даунорубицина, доксорубицин (= адриамицин)), гемцитабина, цитоксана, паклитакселя, алкилирующего антинеопластического средства, ДНК-интеркалирующего средства (например, алкилирующего средства, бендамустина, производного иприта (mustard)), ингибитора топоизомеразы, бортезомиба, темсиролимуса, вориностата, ифосфамида, лксабепилона и их производных.
1.27. Любой предшествующий способ, в котором состояние, требующее лечения, включает лейкопению, например, нейтропению, индуцированную лекарственным средством, например, лекарственным средством, выбранным из зиф-афлиберцепта, брентуксимаба ведотина, деферипрона, гемцитабина, пралатрексата, ганцикловира, валганцикловира, талидомида, ромидепсина, боцепревира, децитабина, иматиниба, топотекана, леналидомида, паклитакселя, оланзапина, иринотекана, палиперидона, интерферонов, липополисахарида, тамоксифена, флекаинида (класс 1С сердечных противоаритмических средств), фенитоина, индометацина, пропилтиоурацила, карбимазола, хлорпромазина, триметоприм/сульфаметоксазола (котримоксазола), клозапина, тиююдипина и их производных, циклофосфамида, мехлорэтамина, хлорамбуцила, мелфалана, кармустина (BCNU), ломустина (CCNU), прокарбазина, дакарбазина (DTIC), алтретамина, цисплатина, карбоплатина, актиномицина D, этопозида, топотекана, иринотекан, доксорубицина и даунорубицина, 6-меркаптопурина, 6-тиогуанина, идарубицина, эпирубицина, митоксантрона, азатиоприна, 2-хлордезоксиаденозина, гидроксимочевины, метотрексата, 5-фторурацила, цитозинарабинозида, азацитидина, гемцитабина, флударабина фосфата, винкристина, винбластина, винорельбина, паклитаксела, доцетаксела, тамоксифена, пеметрекседа, наб-паклитаксела, дазатиниба, паралатрексата, децитабина, ромидепсина, иматиниба, леналидомида, сунитиниба, оксалиплатина и талидомида.
1.28. Любой предшествующий способ, в котором пациент принимает или намеревается принимать химиотерапию в дозе, достаточной для того, чтобы вызвать нейтропению или тромбоцитопению при отсутствии лечения соединением формулы 1, или пациент страдает от нейтропении или тромбоцитопении, являющейся следствием химиотерапии.
1.29. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим миелосупрессивную химиотерапию.
1.30. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим миелосупрессивную химиотерапию, при этом лечение соединением формулы 1 прекращается в течение периода, по меньшей мере, 24 часов до, по меньшей мере, 24 часов после введения химиотерапии, например, для уменьшения чувствительности клеток, стимулированных соединением формулы 1, к химиотерапии.
1.31. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим трансплантат костного мозга.
1.32. Любой из предшествующих способов, в котором пациент является раковым пациентом, соединение формулы 1 вводится до начала миелоаблативной химиотерапии, чтобы увеличить уровни клеток-предшественников гемопоэза из периферической крови, которые собирают для повторного введения пациенту после миелоаблативной химиотерапии, и необязательно, соединение формулы 1 также вводится после миелоаблативной химиотерапии.
1.33. Любой из предшествующих способов, в котором пациент страдает от хронической нейтропении, например, врожденной нейтропении, циклической нейтропении или идиопатической нейтропении.
1.34. Любой из предшествующих способов, в котором состояние, требующее лечения включает нейтропению, например, в котором "нейтропенией" считается количество 2000 или меньше, например, 1700 или меньше, например, 1500 или меньше нейтрофилов на микролитр крови.
1.35. Любой из предшествующих способов, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 5000, например, по меньшей мере, 8000, например, по меньшей мере, 10000 нейтрофилов на микролитр крови.
1.36. Любой из предшествующих способов, в котором нейтропения ассоциирована с лихорадкой.
1.37. Любой из предшествующих способов, в котором соединение формулы 1 вводится в количестве эффективном для смягчения или лечения побочных эффектов G-CSF, например, тромбоцитопении и/или боли в костях.
1.38. Любой из предшествующих способов, в котором пациент страдает от или подвергается риску нейтропении или тромбоцитопении вследствие лечения одним или более химиотерапевтическими препаратами, выбранными из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина и тамоксифена.
1.39. Любой из предшествующих способов, в котором пациент страдает от или подвергается риску нейтропении или тромбоцитопении вследствие лучевой терапии.
1.40. Способ по любому из предшествующих пунктов, в котором состояние, требующее лечения, вызывается целиком или отчасти химиотерапией.
1.41. Способ по любому из предшествующих пунктов, в котором состояние, требующее лечения, вызывается целиком или отчасти лучевой терапией.
1.42. Способ по любому из предшествующих пунктов, в котором состояние, требующее лечения, включает тромбоцитопению, например, при этом тромбоцитопенией считается количество менее, чем 130000, например, менее, чем 100000, например, менее чем 50000 тромбоцитов на микролитр (мкл) крови.
1.43. Любой из предшествующих способов, в котором пациент страдает от хронической тромбоцитопении, например, вследствие рака, вирусной инфекции, апластической анемии, иммунной тромбоцитарной пурпуры (ITP), тромботической тромбоцитопенической пурпуры (ТТР) или болезни печени.
1.44. Любой из предшествующих способов, в котором состояние, которое подвергается лечению, является тромбоцитопенией, вызванной или совпадающей с состоянием, выбранным из группы, состоящей из петехии, кровотечения в желудке, гематурии (наличия крови в моче), избыточной менструации, инсульта, слепоты, идиопатической тромбоцитопенической пурпуры (ITP), гипер-активности селезенки, цирроза, гепатита (в частности, гепатита С), хронической болезни печени, лейкемии, лимфомы, волчанки, инфекции вирусом иммунодефицита человека (HIV), вызванной химическим соединением, противоопухолевым средством, белком и лучевой терапией.
1.45. Любой из предшествующих способов, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 50000, например, по меньшей мере, 100000, например, по меньшей мере, 130000 тромбоцитов на микролитр крови.
1.46. Любой из предшествующих способов, в котором состояние, которое подвергается лечению, является нейтропенией и пациент получает химиотерапевтическое средство для лечения рака, которое может быть индуцировано или стимулировано G-CSF, например, в котором химиотерапевтическое средство выбирают из одного или более из числа циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина, тамоксифена и леналидомида; например, в котором химиотерапевтическое средство является леналидомидом; например, в котором рак является множественной миеломой, хроническим миелолейкозом (CML), острым миелоцитарным лейкозом или миелодиспластическим синдромом.
1.47. Любой из предшествующих способов, в котором соединение формулы 1 вводится до миелоаблативной химиотерапии для увеличения уровней клеток-предшественников гемопоэза из периферической крови, которые собирают для повторного введения пациенту после миелоаблативной химиотерапии, и необязательно, соединение формулы 1 также вводится после миелоаблативной химиотерапии.
1.48. Любой из предшествующих способов, в котором соединение формулы 1 индуцирует дифференцировку гематопоэтических стволовых клеток (HSC) с образованием общего миелоидного предшественника (СМР), нейтрофила, эозинофила и моноцита и подавляет дифференцировку гематопоэтических стволовых клеток (HSC) с образованием общего лимфоидного предшественника (CLP) и образования общего предшественника лимфоцитов и лимфоцитов.
1.49. Любой предшествующий способ, в котором состояние, требующее лечения, является как нейтропенией, так и тромбоцитопенией.
1.50. Любой предшествующий способ, в котором лечение является профилактическим.
1.51. Любой предшествующий способ, в котором пациент является человеком.
1.52. Любой предшествующий способ, в котором у пациента ранее был диагностирован рак.
Раскрытие дополнительно предоставляет соединение формулы 1, например, PLAG, (или фармацевтическую композицию, например, как описано в документе, содержащую эффективное количество соединения формулы 1, например, PLAG) для использования при лечении, (например, ингибировании, уменьшении, контролировании, облегчении или реверсии) состояния, выбранного из лейкопении (например, нейтропении) и/или тромбоцитопении, например, для применения в любом из Способов 1, et seq.
Раскрытие дополнительно предоставляет применение соединения формулы 1, например, PLAG, в производстве медикамента для лечения, (например, ингибирования, уменьшения, контролирования, облегчения или реверсии) состояния, выбранного из лейкопении (например, нейтропении) и/или тромбоцитопении, например, в любом из Способов, et seq.
В отдельном варианте осуществления раскрытие предоставляет способ лечения рака, включающий введение нуждающемуся в этом пациенту химиотерапевтического средства в сочетании с соединением формулы 1, введенным в соответствии с любым из Способов 1, et seq., в котором химиотерапевтическое средство вводится в дозировке и/или в течение периода времени, которые могут вызвать нейтропению и/или тромбоцитопению у пациента, являющегося пациентом, не получающим соединение формулы 1.
Раскрытие дополнительно предоставляет способ улучшения качества жизни пациента, получающего химиотерапевтическое и/или лучевое лечение, включающий введение эффективного количества соединения формулы 1, в частности PLAG, например, для уменьшения вызванной химиотерапией слабости или воспаления слизистой оболочки, например, путем введения соединения формулы 1 в соответствии с любым из Способов 1, et. seq.
Раскрытие предоставляет в другом аспекте способ (Способ 2) лечения, контролирования или уменьшения нейтропении и/или тромбоцитопении у пациента, получающего химиотерапевтическое средство, например, леналидомид, для лечения рака, который стимулируется или усугубляется G-CSF (например, злокачественным заболеванием костного мозга, например, множественной миеломой, острым миелоцитарным лейкозом, хроническим миелолейкозом или миелодиспластическим синдромом), данный способ включает введение эффективного количества соединения формулы 1:
в котором R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например, PLAG, нуждающемуся в этом пациенту; например, в соответствии с любым из Способов 1, et. seq.,
например,
2.1. Способ 2, в котором R1 и R2 независимо выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, стеароила, миристоила и арахидоноила.
2.2. Способ 2 или 2.1, согласно которому соединение формулы 1 представляет собой соединение формулы 2:
2.3. Способ 2.2, согласно которому соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других моноацетилдиацилглицеринов, например, в которой, по меньшей мере, 95%, например, по меньшей мере, 99% всех моноацетилдиацилглицеринов в композиции являются соединениями формулы 2.
2.4. Любой предшествующий способ, в котором соединение формулы 1 выделяют и экстрагируют из природных рогов оленя.
2.5. Любой предшествующий способ, в котором соединение формулы 1 получают с помощью химического синтеза
2.6. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции для перорального введения.
2.7. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, которая представляет собой мягкую желатиновую капсулу, содержащую соединение формулы 1 в комбинации или соединении с фармацевтически приемлемым разбавителем или носителем, например, когда фармацевтически приемлемый разбавитель или носитель включает пищевое масло, например, растительное масло, например, оливковое масло.
2.8. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, содержащей от 0,0001 до 100,0 вес .%, например, 50-95%, или 95-99% соединения от веса композиции.
2.9. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2, введенное в форме мягкой желатиновой капсулы, содержащей 250 мг соединения формулы 2 в комбинации или сочетании приблизительно с 50 мг фармацевтически приемлемого разбавителя или носителя, например, пищевого масла, например, растительного масла, например, оливкового масла.
2.10. Любой из способов 2-2.5, в котором соединение формулы 1 вводится в форме функционального питания, например, в качестве добавки или примеси в пищу, пригодную для потребления человеком.
2.11. Любой предшествующий способ, в котором соединение формулы 1 вводится один раз в день (q.d.) или дважды в день (b.i.d.).
2.12. Любой предшествующий способ, в котором общая суточная доза соединения формулы 1 составляет от 250 мг до 2000 мг/день, например, 500 мг -1500 мг/день, например, 500 мг/день, 1000 мг/день или 1500 мг/день.
2.13. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг два раза в день, например, утром и вечером.
2.14. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг один раз в день, например, вечером.
2.15. Любой предшествующий способ, в котором соединение формулы 1 вводится с пищей, например, после обеда.
2.16. Любой предшествующий способ, в котором соединение формулы 1 вводится в течение, по меньшей мере, двух недель, например, по меньшей мере, месяца.
2.17. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2 (PLAG), которое вводится в форме мягкой желатиновой капсулы для перорального введения, содержащей 500 мг лекарственного препарата PLAG и 1 мг α-токоферола в качестве антиоксиданта, вводится один или два раза в день, при этом общая суточная доза составляет от 500 мг до 4000 мг.
2.18. Любой предшествующий способ, в котором химиотерапевтическое средство выбирают из числа одного или более из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина, тамоксифена и леналидомида.
2.19. Любой предшествующий способ, в котором химиотерапевтическое средство представляет собой леналидомид.
2.20. Любой предшествующий способ, в котором рак является множественной миеломой.
2.21. Любой предшествующий способ, в котором рак является хроническим миелолейкозом (CML).
2.22. Любой предшествующий способ, в котором рак является острым миелоцитарным лейкозом.
2.23. Любой предшествующий способ, в котором рак является миелодиспластическим синдромом.
2.24. Любой предшествующий способ, в котором пациент
01.24.1. будет получать химиотерапию в дозе, достаточной для того, чтобы вызвать нейтропению в отсутствие другого лечения, или
01.24.2. страдает от нейтропении после химиотерапии.
2.25. Любой предшествующий способ, в котором пациент является раковым пациентом, соединение формулы 1 вводится до миелоаблативной химиотерапии для увеличения уровней клеток-предшественников гемопоэза из периферической крови, которые собирают для повторного введения пациенту после миелоаблативной химиотерапии, и необязательно, соединение формулы 1 также вводится после миелоаблативной химиотерапии.
2.26. Любой предшествующий способ, в котором "нейтропенией" считается количество 2000 или меньше, например, 1700 или меньше, например, 1500 или меньше нейтрофилов на микролитр крови.
2.27. Любой предшествующий способ, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 5000, например, по меньшей мере, 8000, например, по меньшей мере, 10000 нейтрофилов на микролитр крови.
2.28. Любой предшествующий способ, в котором нейтропения ассоциирована с лихорадкой.
2.29. Любой предшествующий способ, в котором пациент страдает от или подвергается риску нейтропении или тромбоцитопении вследствие лечения одним или более из химиотерапевтических средств, выбранных из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина и тамоксифена.
2.30. Любой предшествующий способ, в котором состояние, требующее лечения включает тромбоцитопению, например, в котором тромбоцитопенией считается количество тромбоцитов менее, чем 130000, например, менее, чем 100000, например, менее, чем 50000 тромбоцитов на микролитр (мкл) крови.
2.31. Любой предшествующий способ, в котором пациент страдает от хронической тромбоцитопении, например, вследствие рака, вирусной инфекции, апластической анемии, иммунной тромбоцитарной пурпуры (ITP), тромботической тромбоцитопенической пурпуры (ТТР) или болезни печени.
2.32. Любой из предшествующих способов, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 50000, например, по меньшей мере, 100000, например, по меньшей мере, 130000 тромбоцитов на микролитр крови.
2.33. Любой из предшествующих способов, в котором соединение формулы 1 вводится в соответствии с любым из Способов 1, et seq.
Раскрытие дополнительно предоставляет соединение формулы 1, например, PLAG, (или фармацевтическую композицию, например, описанную в данном документе, содержащую эффективное количество соединения формулы 1, например, PLAG) для использования в комбинации с химиотерапевтическим средством, например, леналидомид например, для использования в любом из Способов 2, et. seq.
Раскрытие дополнительно предоставляет использование соединения формулы 1, например, PLAG, в производстве медикамента для применения в комбинации с химиотерапевтическим препаратом, например, леналидомидом, например, для использования в любом из Способов 2, et. seq.
В другом аспекте раскрытие предоставляет Способ (Способ 3) лечения рака крови, например, злокачественного заболевания костного мозга, например, рака крови, который может быть индуцирован или обострен G-CSF, например, выбранного из множественной миеломы, острого миелоцитарного лейкоза, хронического миелолейкоза и миелодиспластического синдрома, включающий совместное введение (последовательное или одновременное) эффективного количества (i) химиотерапевтического препарата, например, леналидомида, и (ii) соединения формулы 1:
в которой R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например, PLAG; нуждающемуся в этом пациенту; например,
3.1. Способ 3, в котором R1 и R2 независимо выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, линолеоила, стеароила, миристоила и арахидоноила.
3.2. Способ 3 или 3.1, в котором соединение формулы 1 представляет собой соединение формулы 2:
3.3. Способ 3.2, согласно которому соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других моноацетилдиацилглицеринов, например, в которой, по меньшей мере, 95%, например, по меньшей мере, 99% всех моноацетилдиацилглицеринов в композиции являются соединениями формулы 2.
3.4. Любой предшествующий способ, в котором соединение формулы 1 выделяют и экстрагируют из природных рогов оленя.
3.5. Любой предшествующий способ, в котором соединение формулы 1 получают с помощью химического синтеза.
3.6. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции для перорального введения.
3.7. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, которая представляет собой мягкую желатиновую капсулу, содержащую соединение формулы 1 в комбинации или соединении с фармацевтически приемлемым разбавителем или носителем, например, в котором фармацевтически приемлемый разбавитель или носитель включает пищевое масло, например, растительное масло, например, оливковое масло.
3.8. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, содержащей от 0,0001 до 100,0 вес. %, например, 50-95% соединения от веса композиции.
3.9. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2, которое вводится в форме мягкой желатиновой капсулы, содержащей 250 мг соединения формулы 2 в комбинации или соединении приблизительно с 50 мг фармацевтически приемлемого разбавителя или носителя, например, растительного масла, например, оливкового масла.
3.10. Любой из способов 3-3.5, в котором соединение формулы 1 вводится в форме функционального питания, например, в качестве добавки или примеси в пищу, пригодную для потребления человеком.
3.11. Любой предшествующий способ, в котором соединение формулы 1 вводится один раз в день (q.d.) или дважды в день (b.i.d.).
3.12. Любой предшествующий способ, в котором общая суточная доза соединения формулы 1 составляет от 250 мг до 2000 мг/день, например, 500 мг - 1500 мг/день, например, 500 мг/день, 1000 мг/день или 1500 мг/день.
3.13. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг два раза в день, например, утром и вечером.
3.14. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг один раз в день, например, вечером.
3.15. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2 (PLAG), которое вводится в форме мягкой желатиновой капсулы для перорального введения, содержащей 500 мг лекарственного препарата PLAG и 1 мг α-токоферола в качестве антиоксиданта, и вводится один или два раза в день, при этом общая суточная доза составляет от 500 мг до 4000 мг.
3.16. Любой предшествующий способ, в котором соединение формулы 1 вводится с пищей, например, после обеда.
3.17. Любой предшествующий способ, в котором соединение формулы 1 вводится в течение, по меньшей мере, двух недель, например, по меньшей мере, месяца.
3.18. Любой предшествующий способ, в котором химиотерапевтическое средство выбирают из числа одного или более из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина, тамоксифена и леналидомида.
3.19. Любой предшествующий способ, в котором химиотерапевтическое средство представляет собой леналидомид.
3.20. Любой предшествующий способ, в котором рак является множественной миеломой.
3.21. Любой предшествующий способ, в котором рак является хроническим миелолейкозом (CML).
3.22. Любой предшествующий способ, в котором рак является острым миелоцитарным лейкозом.
3.23. Любой предшествующий способ, в котором рак является миелодиспластическим синдромом.
3.24. Любой предшествующий способ, в котором пациент
.24.1. будет получать химиотерапию в дозе, достаточной для того, чтобы вызвать нейтропению в отсутствие другого лечения, или
.24.2. страдает от нейтропении после химиотерапии.
3.25. Любой из предшествующих способов, в котором пациент является раковым пациентом, соединение формулы 1 вводится до миелоаблативной химиотерапии для увеличения уровней клеток-предшественников гемопоэза из периферической крови, которые собирают для повторного введения пациенту после миелоаблативной химиотерапии, и необязательно, соединение формулы 1 также вводится после миелоаблативной химиотерапии.
3.26. Любой из предшествующих способов, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 5000, например, по меньшей мере, 8000, например, по меньшей мере, 10000 нейтрофилов на микролитр крови.
3.27. Любой из предшествующих способов, в котором соединение формулы 1 вводится в соответствии с любым из способов 1, et seq.
Раскрытие дополнительно предоставляет соединение формулы 1, например, PLAG, (или фармацевтическую композицию, например, как описано в документе, содержащую эффективное количество соединения формулы 1, например, PLAG) для использования при лечении рака крови, например, злокачественного заболевания костного мозга, например, рака крови, который может быть вызван или обострен G-CSF, например, выбранного из числа множественной миеломы, острого миелоцитарного лейкоза, хронического миелолейкоза и миелодиспластического синдрома, в сочетании с совместным введением (последовательным или одновременным) эффективного количества химиотерапевтического средства, например, леналидомида, например, для использования в любом из Способов 3, et. seq.
Раскрытие дополнительно предоставляет использование соединения формулы 1, например, PLAG, в производстве медикамента для лечения рака крови, например, злокачественного заболевания костного мозга, например, рака крови, который может быть индуцирован или обострен G-CSF, например, выбранного из числа множественной миеломы, острого миелоцитарного лейкоза, хронического миелолейкоза и миелодиспластического синдрома, в сочетании с совместным введением (последовательным или одновременным) эффективного количества химиотерапевтического средства, например, леналидомида, например, для использования в любом из Способов 3, et. seq.
В другом аспекте раскрытие предоставляет способ (Способ 4) лечения (включая профилактику) нейтропении и/или мобилизации клеток-предшественников периферической крови (РВРС), включающий введение (последовательное или одновременное) эффективного количества (i) соединения формулы 1:
в котором R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например, PLAG, и (ii) G-CSF, например, выбранного из филграстима, пегфилграстима и ленограстима, нуждающемуся в этом пациенту; например,
4.1. Способ 4, в котором R1 и R2 независимо выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, линолеоила, стеароила, миристоила и арахидоноила.
4.2. Способ 4 или 4.1, в котором соединение формулы 1 представляет собой соединение формулы 2:
4.3. Способ 4.2 согласно которому соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других моноацетилдиацилглицеринов, например, в которой, по меньшей мере, 95%, например, по меньшей мере, 99% всех моноацетилдиацилглицеринов в композиции являются соединениями формулы 2.
4.4. Любой предшествующий способ, в котором соединение формулы 1 выделяют и экстрагируют из природных рогов оленя.
4.5. Любой предшествующий способ, в котором соединение формулы 1 получают с помощью химического синтеза.
4.6. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции для перорального введения.
4.7. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, которая представляет собой мягкую желатиновую капсулу, содержащую соединение формулы 1 в комбинации или соединении с фармацевтически приемлемым разбавителем или носителем, например, когда фармацевтически приемлемый разбавитель или носитель включает пищевое масло, например, растительное масло, например, оливковое масло.
4.8. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, содержащей от 0,0001 до 100,0 вес. %, например, 50-95%, или 95-99% соединения от веса композиции.
4.9. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2, введенное в форме мягкой желатиновой капсулы, содержащей 250 мг соединения формулы 2 в комбинации или сочетании приблизительно с 50 мг фармацевтически приемлемого разбавителя или носителя, например, пищевого масла, например, растительного масла, например, оливкового масла.
4.10. Любой из способов 4-4.5, в котором соединение формулы 1 вводится в форме функционального питания, например, в качестве добавки или примеси в пищу, пригодную для потребления человеком.
4.11. Любой предшествующий способ, в котором соединение формулы 1 вводится один раз в день (q.d.) или дважды в день (b.i.d.).
4.12. Любой предшествующий способ, в котором общая суточная доза соединения формулы 1 составляет от 250 мг до 2000 мг/день, например, 500 мг - 1500 мг/день, например, 500 мг/день, 1000 мг/день или 1500 мг/день.
4.13. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг два раза в день, например, утром и вечером.
4.14. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг один раз в день, например, вечером.
4.15. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2 (PLAG), которое вводится в форме мягкой желатиновой капсулы для перорального введения, содержащей 500 мг лекарственного препарата PLAG и 1 мг α-токоферола в качестве антиоксиданта, и вводится один или два раза в день, при этом общая суточная доза составляет от 500 мг до 4000 мг.
4.16. Любой предшествующий способ, в котором соединение формулы 1 вводится с пищей, например, после обеда.
4.17. Любой предшествующий способ, в котором соединение формулы 1 вводится в течение, по меньшей мере, двух недель, например, по меньшей мере, месяца.
4.18. Любой предшествующий способ, в котором G-CSF выбирают из филграстима, пегфилграстима и ленограстима, например, в котором G-CSF представляет собой филграстим.
4.19. Любой из предшествующих способов, в котором пациент будет получать химиотерапию в дозе, достаточной для того, чтобы вызвать нейтропению в отсутствие другого лечения, или страдает от нейтропении после химиотерапии.
4.20. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим миелосупрессивную химиотерапию.
4.21. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим миелосупрессивную химиотерапию, при этом лечение соединением формулы 1 и G-CSF прекращается в течение периода, по меньшей мере, 24 часов до, по меньшей мере, 24 часов после введения химиотерапии, например, для уменьшения чувствительности клеток, стимулированных соединением формулы 1 и G-CSF, к химиотерапии.
4.22. Любой из предшествующих способов, в котором пациент является раковым пациентом, получающим трансплантат костного мозга.
4.23. Любой из предшествующих способов, в котором пациент является раковым пациентом, соединение формулы 1 и G-CSF вводятся до начала миелоаблативной химиотерапии, чтобы увеличить уровни клеток-предшественников гемопоэза из периферической крови, которые собирают для повторного введения пациенту после миелоаблативной химиотерапии, и необязательно, соединение формулы и G-CSF также вводятся после миелоаблативной химиотерапии.
4.24. Любой из предшествующих способов, в котором пациент страдает от хронической нейтропении, например, врожденной нейтропении, циклической нейтропении или идиопатической нейтропении.
4.25. Любой из предшествующих способов, в котором "нейтропенией" считается количество 2000 или меньше, например, 1700 или меньше, например, 1500 или меньше нейтрофилов на микролитр крови.
4.26. Любой из предшествующих способов, в котором лечение продолжается до тех пор, пока пациент имеет, по меньшей мере, 5000, например, по меньшей мере, 8000, например, по меньшей мере, 10000 нейтрофилов на микролитр крови.
4.27. Любой из предшествующих способов, в котором нейтропения связана с лихорадкой.
4.28. Любой из предшествующих способов, в котором соединение формулы 1 вводится в количестве, эффективном для облегчения или лечения побочных действий G-CSF, например, тромбоцитопении и/или боли в костях, вызванной G-CSF.
4.29. Любой из предшествующих способов, в котором пациент страдает от или подвергается риску нейтропении вследствие лечения одним или более химиотерапевтическими препаратами, выбранными из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина и тамоксифена.
4.30. Любой предшествующий способ, в котором соединение формулы 1 вводится в соответствии с любым из Способов 1, et seq.
Раскрытие дополнительно предоставляет способ (Способ 5) для облегчения или лечения побочных действий G-CSF, например, тромбоцитопении и/или боли в костях, вызванной G-CSF, включающий совместное введение, последовательное или одновременное, соединения формулы 1, например, PLAG, нуждающемуся в этом пациенту, например, в режиме, описанном в любом из Способов 1, et seq.
Раскрытие дополнительно предоставляет соединение формулы 1, например, PLAG, (или фармацевтическую композицию, например, описанную в данном документе, содержащую эффективное количество соединения, например, PLAG) для использования в комбинации с G-CSF, например, для использования в любом из способов 1, et. seq., Способа 4, et seq. или Способа 5.
Раскрытие дополнительно предоставляет использование соединения формулы 1, например, PLAG, в производстве медикамента для применения в комбинации с G-CSF, например, для использования в любом из способов 1, et. seq. или Способов 4, et seq. или Способа 5.
Раскрытие дополнительно предоставляет способ (Способ 6) лечения анемии, включающий введение эффективного количества соединения формулы 1:
в которой R1 и R2 независимо являются остатком жирной кислоты из 14-22 атомов углерода, например, PLAG; нуждающемуся в этом пациенту;
например,
6.1. Способ 6, в котором R1 и R2 независимо выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, линолеоила, стеароила, миристоила и арахидоноила.
6.2. Способ 6 или 6.1, в котором соединение формулы 1 представляет собой соединение формулы 2:
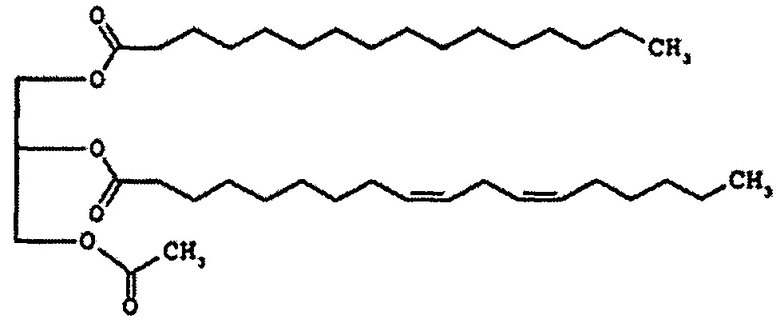
6.3. Способ 6.2, согласно которому соединение формулы 2 вводится в фармацевтической композиции, которая практически не содержит других моноацетилдиацилглицеринов, например, в которой, по меньшей мере, 95%, например, по меньшей мере, 99% всех моноацетилдиацилглицеринов в композиции являются соединениями формулы 2.
6.4. Любой предшествующий способ, в котором соединение формулы 1 выделяют и экстрагируют из природных рогов оленя.
6.5. Любой предшествующий способ, в котором соединение формулы 1 получают с помощью химического синтеза.
6.6. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции для перорального введения.
6.7. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, которая представляет собой мягкую желатиновую капсулу, содержащую соединение формулы 1 в комбинации или соединении с фармацевтически приемлемым разбавителем или носителем, например, когда фармацевтически приемлемый разбавитель или носитель включает пищевое масло, например, растительное масло, например, оливковое масло.
6.8. Любой предшествующий способ, в котором соединение формулы 1 вводится в форме фармацевтической композиции, содержащей от 0,0001 до 100,0 вес. %, например, 50-95% соединения от веса композиции.
6.9. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2, которое вводится в форме мягкой желатиновой капсулы, содержащей 250 мг соединения формулы 2 в комбинации или соединении приблизительно с 50 мг фармацевтически приемлемого разбавителя или носителя, например, растительного масла, например, оливкового масла.
6.10. Любой из способов 6-6.5, в котором соединение формулы 1 вводится в форме функционального питания, например, в качестве добавки или примеси в пищу, пригодную для потребления человеком.
6.11. Любой предшествующий способ, в котором соединение формулы 1 вводится один раз в день (q.d.) или дважды в день (b.i.d.).
6.12. Любой предшествующий способ, в котором общая суточная доза соединения формулы 1 составляет от 250 мг до 2000 мг/день, например, 500 мг - 1500 мг/день, например, 500 мг/день, 1000 мг/день или 1500 мг/день.
6.13. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг два раза в день, например, утром и вечером.
6.14. Любой предшествующий способ, в котором соединение формулы 1 вводится в дозировке 500 мг один раз в день, например, вечером.
6.15. Любой предшествующий способ, в котором соединение формулы 1 представляет собой соединение формулы 2 (PLAG), которое вводится в форме мягкой желатиновой капсулы для перорального введения, содержащей 500 мг лекарственного препарата PLAG и 1 мг α-токоферола в качестве антиоксиданта, и вводится один или два раза в день, при этом общая суточная доза составляет от 500 мг до 4000 мг.
6.16. Любой предшествующий способ, в котором соединение формулы 1 вводится с пищей, например, после обеда.
6.17. Любой предшествующий способ, в котором соединение формулы 1 вводится в течение, по меньшей мере, двух недель, например, по меньшей мере, месяца.
6.18. Любой из предшествующих способов, в котором пациент также страдает от тромбоцитопении.
6.19. Любой из предшествующих способов, в котором пациент получает химиотерапию и/или лучевую терапию.
6.20. Любой предшествующий способ, в котором анемия является нормоцитарной анемией.
6.21. Любой предшествующий способ, в котором анемия вызвана активным кровотечением, например, в результате избыточного менструального кровотечения, ран, желудочнокишечных язв, или раком, например, раком толстой кишки.
6.22. Любой предшествующий способ, в котором анемия является анемией миелодиспластического происхождения.
6.23. Любой предшествующий способ, в котором пациент имеет уровень гемоглобина менее чем 12 г/дл.
6.24. Любой предшествующий способ, в котором лечение продолжается до тех пор, пока уровень гемоглобина составляет, по меньшей мере, 12 г/дл.
6.25. Любой предшествующий способ, в котором пациент также получает дополнительное железо.
6.26. Любой предшествующий способ, в котором соединение формулы 1 вводится в соответствии с любым из Способов 1, et seq.
Раскрытие дополнительно предоставляет соединение формулы 1, например, PLAG, (или фармацевтическую композицию, например, описанную в данном документе, содержащую эффективное количество соединения формулы 1, например, PLAG) для использования при лечении анемии, например, для использования в любом из Способов 6, и т.д.
Раскрытие дополнительно предоставляет использование соединения формулы 1, например, PLAG, при производстве медикамента для лечения анемии, например, для использования в любом из Способов 6, и т.д.
Во всем документе указанные пределы используются для сокращенного описания любого значения, которое находится внутри заданного диапазона. Любое значение внутри предела может быть выбрано в качестве конечного в заданном диапазоне. Кроме того, все приведенные в данном документе ссылки полностью включаются в описание путем отсылки. В случае противоречия в определении в настоящем раскрытии и противопоставленных материалах, контроль обеспечивает настоящее раскрытие. Следует понимать, что если не указано иначе, все проценты и количества, сформулированные в подробном описании, относятся к процентам по весу. Данные о количестве основываются на активном весе вещества.
Следующие примеры предоставляются для лучшего понимания данного изобретения. Однако, это раскрытие не ограничивается данными примерами.
Пример 1. In Vitro ингибирование активности PKCθ/p38/ERK в клетках RBL-2H3
Фармакологические исследования in vitro на клеточных линиях показывают, что PLAG способен ингибировать РКСθ/р38 MAPK/ERK путь, который вовлечен в созревание лимфоидных клеток-предшественников из HSC. Дефосфорилирование р38 МАРК и ERK1/2 в клетках, обработанных PLAG RBL-2H3, определяют с помощью вестерн-блоттинга с использованием анти-фосфо-р38 и анти-фосфо-ERK1/2, соответственно. Чтобы активировать р38 и ERK1/2 в клетках RBL-2H3, клетки сенсибилизируют 50 нг/мл анти-DNP-IgE в течение ночи. После троекратной промывки PBS добавляют 20 нг/мл DNP-HSA. Клеточные лизаты для вестерн-блоттинга готовят из RBL-2H3 клеток, обработанных PLAG дозозависимым образом и инкубированных в течение того же самого времени (15 мин). β-актин используется в качестве внутренних контролей. Фосфорилирование ERK1/2 и р38 начинается сразу после стимулирования комплексом IgE-антиген и остается достаточно активированным в течение 5 минут. Однако, когда стимулирование комплексом IgE-антиген оказывает воздействие на предварительно проинкубированные с PLAG RBL-2H3 клетки, тогда ERK1/2 и р38 фосфорилирование уменьшается. Вестерн-блоттинг показывает ингибирующее действие PLAG на активацию р38 MAP киназ и ERK1/2 (МЕК1/2) в RBL-2H3 клетках, стимулированных комплексом IgE-антиген.
Пример 2. In Vitro ингибирование пути активации комплемента
Активность PLAG в отношении регулирования активности комплемента достигается подавлением выработки С3. Выработка С3 зависит от активности STAT6. Таким образом, предполагается, что PLAG подавляет активность STAT6, и тем самым подавляет выработку С3, которая повышается или активируется химиотерапией.
Дефосфорилирование STAT6 в клетках, обработанных PLAG: Дефосфорилирование STAT6 исследуется с использованием анти-фосфорилированного STAT6 в U937, А549 и клеточных лизатах Jurkat, обработанных концентрациями PLAG от 0,01 до 10 мкг/мл. Фосфорилирование STAT6 индуцируется обработкой 10 нг/мл IL-4. Дефосфорилирование STAT1 исследуется на клеточных лизатах U937 с обработкой PLAG (0,01 до 10 мкг/мл). Фосфорилирование STAT1 индуцируется обработкой 10 нг IFN-γ. Дефосфорилирование STAT1 и STAT6 исследуется через 15 мин после стимулирования IFN-γ и IL-4, соответственно, в клетках, предварительно обработанных PLAG. Вестерн-блоттинг показывает активность STAT6 и STAT1. Транскрипционная активность STAT6 понижается при дефосфорилировании STAT6. В клеточной линии U937, происходящей от лимфомы, клетках Jurkat (линия лейкемических Т-лимфоцитов) и линии эпителиальных клеток легких А549 фосфорилирование STAT6, индуцированное обработкой IL-4, ингибируется увеличением концентраций PLAG. Не наблюдается действия PLAG на фосфорилирование STAT1.
Активность STAT6: Путем использования ингибитора STAT6 (S6I) было подтверждено, что уменьшение Комплемента 3 в клетках HepG2 (линия клеток гепатоцитов человека) регулируется STAT6. При PLAG-обработке клеток HepG2 транскрипционная активность STAT6 постепенно уменьшается в соответствии с количеством PLAG, что подтвержается исследованиями активности люциферазы. Также подтверждается, что PLAG обладает селективной эффективностью на STAT6 по сравнению с STAT1. Фигура 1 представляет графики, показывающие транскрипционную активность STAT1 и STAT6 в клетках HepG2, обработанных PLAG. NC относится к нестимулированной контрольной клетке. Что касается анализа STAT1, ген-трансфицированные HepG2 (линия клеток гепатоцитов человека) обрабатывают 10 нг IFN-γ и добавляют серийно разведенный PLAG (0,01 мкг/мл, 0,1 мкг/мл, 1 мкг/мл и 10 мкг/мл, как показано), чтобы увидеть его действие на генную экспрессию в стимулированных клетках. Что касается анализа STAT6, ген-трансфицированные HepG2 клетки обрабатывают 10 нг IL-4 и вновь добавляют серийно разведенный PLAG (0,01 мкг/мл, 0,1 мкг/мл, 1 мкг/мл и 10 мкг/мл, как показано), чтобы увидеть его действие на генную экспрессию в стимулированных клетках. Анализ проводится после 12 часов инкубации обработанных клеток. PLAG не оказывает действия на экспрессию STAT1 в этом анализе, однако оказывает значимое дозо-зависимое воздействие на STAT6 экспрессию.
In Vitro ингибирование экспрессии С3 в человеческих НМС-1 клетках: Опубликованные сообщении о роли комплемент-зависимого механизма нейтропении, вызванной лекарственным средством, и роли нейтрофилов в воспалении сосудов и ответе на сепсис дают основание предполагать, что активация комплемента может быть вовлечена в тромбоцитопению и лейкопению, вызванную химиотерапией. Мы обнаружили, что PLAG может понижающим образом регулировать С3, чтобы ослабить активацию комплемента; моноциты человека, обработанные PLAG, (НМС-1) и обработанные PLAG гепатоциты (HepG2) показывают уменьшенную экспрессию С3.
Линия клеток крови НМС-1 (тучные клетки человека, American Type Culture Collection, АТСС, Rockville, MD) инкубируется и поддерживается при 37°С во влажных условиях с содержанием 5% СО2. Используется среда IMDM (Life Technologies, Karlsruhe, Германия) содержащая 10% эмбриональной телячьей сыворотки (FCS, HyClone, Logan, UT), 2 мМ L-глутамата, 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина (Life Technologies). Культивируемые НМС-1 клетки (1×106 клеток/мл) предварительно обрабатывают PLAG с использованием концентраций 0,1 и 1 мкг/мл с последующей обработкой IL-4 (5 нг) и/или TNF-α (10 нг), чтобы вызвать клеточную активность.
Экспрессированный С3 и изменение уровня его мРНК наблюдают с помощью RT-PCR (полимеразной цепной реакции с обратной транскриптазой). RT-PCR проводится как описано далее: тотальную РНК выделяют с помощью стандартного протокола и кДНК синтезируют с использованием набора AccuScript High Fidelity 1st Strand cDNA Synthesis Kit (Stratagene) по инструкциям производителя. Двухстадийная реакция RT-PCR проводится с использованием Oligo-dT праймера и обратной транскриптазы, пары праймеров и Taq-полимеразы (Takara, Shiga, Japan). Синтезированная кДНК (1 мкл) используется для проведения реакции ПЦР в объеме 20 мкл с добавлением 0,5 U ExTaq ДНК полимеразы, 1 буфера и 1 мМ смеси dNTP (Takara) и пары праймеров. ПЦР-амплификация проводится при следующих условиях с использованием системы GeneAmp PCR 2700 (Applied Biosystems, Foster city, CA, США): 5 минут при 94°C, затем 45 секунд при 94°С, 45 секунд при 56°С и 1 минута при 72°С в ходе 25-40 циклов, заключительная реакция элонгации проводится в течение 7 минут при 72°С. ПЦР-праймер, использованный для амплификации кДНК, сконструирован с помощью программы Primer3 и куплен у компании Bioneer (Daejeon, KOREA). ПЦР-продукт выделяется при помощи 1,5%-ного агарозного геля, окрашивается этидием бромидом (EtBr) и визуализируется при помощи трансиллюминатора Gel Doc 2000 UV (Bio-Rad Laboratories, Hercules, CA, USA), а экспериментальные данные анализируются с использованием программного обеспечения Quantity One software (Bio-Rad Laboratories). Вестерн-блоттинг показывает, что обработка клеток НМС-1 IL-4 и TNF-α приводит к экспрессии С3, которая подавляется PLAG зависимым от концентрации образом, что сравнимо с клетками, обработанными IL-4 и TNF-α, с последующей обработкой S6I (переносчик сигнала и ингибитор активатора транскрипции 6 (STAT6), AS 1517499, Axon Medchem, Netherlands). Ингибитор STAT6 блокирует сигнальную трансдукцию STAT6 в клетке посредством IL-4, который, в свою очередь, подавляет экспрессию С3. Эти данные подтверждают, что PLAG может действовать аналогично ингибитору STAT6.
С3 ингибирование посредством PLAG в клетках НМС-1: В отдельном эксперименте мастоциты человека (НМС-1, 1×105 клеток/мл) подвергаются обработке PLAG в различных концентрациях (1, 10 и 100 мкг/мл) в течение 2 часов. Клетки активируются в течение 72 часов с помощью 10% FBS (эмбриональная бычья сыворотка), содержащей IMDM. Уменьшение содержания/понижение уровня С3 подтверждается анализом ELISA экспрессированного белка. Как показано на фигуре 2, снижение С3 происходит пропорционально концентрации PLAG (на этой фигуре PLAG называется ЕС; единицы соответствуют мкг/мл).
Экскреция С3 из клеток линии HepG2: Клетки линии печени HepG2 (Американская коллекция типовых культур, АТСС, Rockville, MD) инкубируют и поддерживают при 37°С во влажной атмосфере с содержанием 5% СО2 в среде DMEM. Когда клетки HepG2, которые, как известно, продуцируют комплемент в культуре, обрабатывают PLAG, активность комплемента существенно уменьшается, что подтверждается реакцией RT-PCR мРНК. При проведении RT-PCR, 5×105 HepG2 клеток/мл помещают в 12-луночные планшеты и индуцируют С3 в течение 12 часов с помощью 10% FCS. Затем добавляют PLAG и дополнительно культивируют в течение 2 часов. Клетки собирают, выделяют мРНК и проводят RT-PCR со специфическим праймером С3; GAPDH используется в качестве внутреннего контроля. RT-PCR показывает, что PLAG в некоторой степени ингибирует экспрессию С3 при концентрации 1 микрограмм/мл и полностью при 10 микрограмм/мл, по сравнению с результатами, полученными при использовании 10 и 100 микрограмм/мл S6I.
Инкубированные клеточные линии HepG2 обрабатывают PLAG (1~100 мкг/мл), затем IL-4 и TNF-α, реакцию проводят в течение 1 часа, инкубируют в течение 18 часов при 37°С и отделяют супернатант. Количественная оценка содержания С3 в клеточной культуральной среде (супернатант) клеток HepG2 проводится методом ELISA с использованием коммерчески доступных моноклональных антител (mAb, R&D Systems) и протокола производителя; результаты представлены на фигуре 3. С3 спонтанно экспрессируется в условиях культивирования in vitro, при этом к клеткам HepG2, инкубированным в течение 12 часов, добавляют 10% FCS. Клетки обрабатывают разными дозами PLAG от 1 до 100 мкг/мл (Панель А, Панель В) или 10 и 100 мкг/мл S6I (Панель С), проводят реакцию с IL-4 и TNF-α в течение 1 часа и затем инкубируют в течение 18 часов при 37°С. Жизнеспособность клеток подтверждают с помощью WST-1-анализа (Панель А). Этот анализ показывает жизнеспособность клетки, измеренную по образованию флуоресцентного вещества, формазана, из соли тетразолия (WST-1) с помощью деоксигеназы в митохондриях клетки. Фигура 3А подтверждает, что PLAG не влияет на размножение и гибель клетки. Фигура 3В показывает, что экспрессия С3 понижается дозо-зависимым образом при введении PLAG и фигура 3С показывает, что сходный эффект получается при введении S6I.
Пример 3. Действие PLAG In vivo на нейтропению, тромбоцитопению и активацию комплемента in vivo у мышей
Исследование колониеобразующих единиц в селезенке (CFU) in Vivo: Для того, чтобы определить действие PLAG in vivo на восстановление гематопоэза, проводили CFU-анализ на облученных большими дозами мышах. Микроскопическое исследование селезенок мышей, обработанных PLAG в дозе 50 мг/кг/день i.p. или р.о. показало заметное увеличение количества селезеночных узелков и количества примитивных клеток-предшественников и мегакариоцитов у всех обработанных животных.
Исследование эффективности на мышах in vivo: Эффект PLAG на лечение нейтропении и тромбоцитопении, вызванной химиотерапией (CIN) оценивается на животной модели. Противоопухолевые препараты (гемцитабин 50 мг/кг, циклофосфамид 100 мг/кг или тамоксифен 50 мг/кг) вводятся ежедневно в течение 3 недель; PLAG также вводят ежедневно в дозе 50 мг/кг в течение 3 недель. Через три недели нейтрофилы собирают и подсчитывают с помощью автоматического гематологического анализатора ВС-5300. Как видно на фигуре 4, уменьшение количества нейтрофилов после химиотерапии предотвращается обработкой PLAG. У мышей, обработанных только тамоксифеном, наблюдается крайняя потеря веса, обезвоживание и потеря активности «избегания» по сравнению с группой, которую одновременно обрабатывали PLAG, в которой наблюдается быстрое улучшение активности и уровня выживаемости. В группе мышей, обработанных PLAG и гемцитабином, количество нейтрофилов значительно увеличивалось. Даже в том случае, если гемцитабин уменьшает количество нейтрофилов у животных, с самого начала получающих совместное введение PLAG, количество нейтрофилов восстанавливается до нормального и сохраняется на нормальных уровнях, при этом продолжающееся введение PLAG приводит в результате к улучшению выживаемости по сравнению с группой, обработанной одним гемцитабином. В группе мышей, обработанных PLAG и циклофосфамидом, количество нейтрофилов также значительно улучшается по сравнению с контрольной группой.
Результаты подсчета тромбоцитов представлены на фигуре 5, где видно, что PLAG оказывает аналогичный протективный эффект в отношении тромбоцитов от гемцитабина 50 мг/кг, циклофосфамида 100 мг/кг или тамоксифена 50 мг/кг.
Предполагается, что нейтропения и тромбоцитопения, вызванная действием этих средств и других химиотерапевтических препаратов, может быть результатом, по меньшей мере, отчасти, специфической токсичности, опосредованной комплементом. Это продемонстрировано на фигуре 6. Все эти средства значительно активируют Комплемент 3, и эта активность в значительной мере блокируется PLAG.
Пример 4. Защита от тромбоцитопении у мышей in vivo
Для оценки эффекта PLAG на концентрацию тромбоцитов мышей обрабатывали соединением, которое, как предполагается, вызывает уменьшение количества тромбоцитов, в частности фенилгидразином, тамоксифеном или липополисахаридом.
Мышам вводили 100 мг/кг фенилгидразина (PHZ), i.p., чтобы вызвать анемию и уменьшение тромбоцитов. Мышам перорально вводят 5 мг/кг PLAG и через 3 и 13 дней забирают образцы крови. В дополнение к этому, для сравнения в качестве контрольных групп были взяты нормальные мыши, которым не вводили фенилгидразин, и мыши, которым вводили PHZ и оливковое масло вместо PLAG. Образцы крови, взятые у мышей, обрабатывали 0.5 мл EDTA (Minicollect tube, Greiner bio-one, Австрия), концентрацию тромбоцитов измеряли с помощью автоматизированного анализатора образца крови ВС-6800 (Mindray, Shenzhen, Китай), используя показатель количество тромбоцитов на мл (к: 1,000). Результаты показаны в таблице 1.

Эксперимент повторяли с использованием тамоксифена (Tam), противоопухолевого средства, инъецируемого в количестве 100 мг/кг, или липополисахарида (LPS), индуктора воспаления, в количестве 1 мг/кг, чтобы вызвать уменьшение тромбоцитов. Концентрацию тромбоцитов измеряли через 15 часов после введения PLAG. Для сравнения вместо PLAG использовали оливковое масло и PBS, в качестве контролей, соответственно в экспериментах с тамоксифеном и липополисахаридом. Результаты показаны в таблицах 2 и 3.


Нормальная концентрация тромбоцитов составляет от 400 до 1600 k/мкл, причем она может зависеть от условий. Таблицы 1-3 показывают, что когда анемия вызывается искусственно путем введения этих соединений, концентрация тромбоцитов в крови снижается, а после введения PLAG этим пациентам концентрация тромбоцитов восстанавливается.
Пример 5. Действие PLAG на уровни нейтрофилов относительно других лейкоцитов у мышей
Нейтрофилы и лимфоциты: Чтобы выявить уровень нейтрофилов и лимфоцитов в крови мышей Balb/C, мышам вводят 1 мг/кг липополисахарида (LPS), i.p., чтобы индуцировать воспаление. 5 мг/кг PLAG вводят мышам перорально, а через 3 и 13 дней берут образцы крови. В дополнение к этому, для сравнения нормальные мыши, которые не обрабатываются PLAG, получают PBS (фосфатно-буферный солевой раствор) и оливковое масло. Образцы крови, взятые у мышей, обрабатывают EDTA 0.5 мл (Minocollect tube, Greiner bio-one, Австрия), и измеряют уровень нейтрофилов (NEU) и лимфоцитов (LYM) в процентах от общего количества лимфоцитов с помощью автоматизированного анализатора образцов крови ВС-6800 (Mindray, Shenzhen, Китай). Как показано в таблице 4, относительный уровень нейтрофилов повышается в ответ на LPS и еще более в ответ на LPS+PLAG.
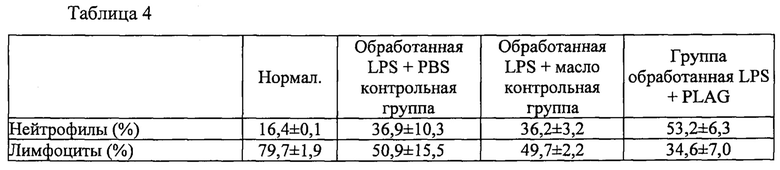
Моноциты: В этом случае вместо мышей Balb/C использовали мышей C57BL/6, мышей обрабатывали так же, как в Примере 6, определяли отношение моноцитов (Mono) к общим лейкоцитам, результаты показаны в таблице 5.

Количество нейтрофилов, лимфоцитов и эозинофилов после обработки тамоксифеном и PLAG: для того, чтобы вызвать снижение нейтрофилов использовали 100 мг/кг противоопухолевого препарата тамоксифен (Tam), с последующей обработкой 5 мг/кг PLAG, затем через 15 часов измеряли количества нейтрофилов (NEU), лимфоцитов (LYM) и эозинофилов (EOS), как в предыдущем эксперименте. Результат представлен в таблице 6.

Даже при том, что концентрация каждого вида лейкоцитов может быть изменена в зависимости от условий субъекта, в настоящих экспериментах нормальный уровень нейтрофилов в лейкоцитах составляет 7-50%, а количество лимфоцитов составляет 42-92%. Как видно из таблиц 4 и 5, после обработки LPS и PLAG, число нейтрофилов и моноцитов значительно увеличивается, тогда как число лимфоцитов снижается. Таблица 6 показывает, что PLAG, как правило, поддерживает нормальные соотношения нейтрофилов, лимфоцитов и эозинофилов, несмотря на введение тамоксифена.
Пример 6. Действие PLAG на уменьшение миграции нейтрофилов
Мышам вводили бактериальный липополисахарид (LPS), чтобы вызвать воспалительный ответ, в присутствии или в отсутствие PLAG:
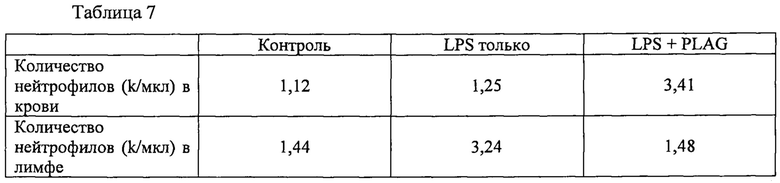
Наряду с тем, что PLAG увеличивает уровни нейтрофилов в крови, он ингибирует миграцию в лимфатические узлы.
Пример 7. Эффективность PLAG в комбинации с G-CSF на мышиной модели Мыши получали циклофосфамид (100 мг/кг веса тела, i.p.) в течение 10 дней, вместе с или без G-CSF (0,25 мг/кг веса тела, i.p.) или G-CSF (0,25 мг/кг веса тела, i.p.) плюс PLAG (25 мг/кг веса тела, р.о.):
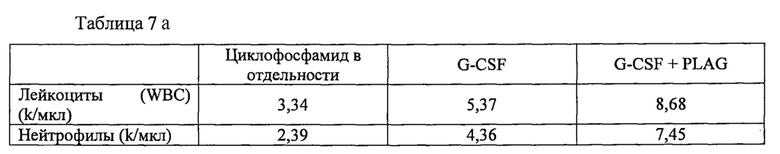
Дозировка G-CSF в этом эксперименте является эффективной дозировкой, причем существует верхний предел эффекта G-CSF вне зависимости от дозировки, а также верхний предел вследствие побочных действий. В этом эксперименте PLAG вызывает увеличение более, чем на 60% WBC, и более, чем на 70% нейтрофилов, по сравнению с G-CSF в отдельности. Таким образом, польза, полученная от PLAG плюс G-CSF, больше той, которая может быть достигнута при использовании G-CSF в отдельности, это -неожиданный и важный новый технический эффект. Добавление PLAG к G-CSF приводит уровни лейкоцитов и нейтрофилов к уровням необработанных мышей, обеспечивая практически полноценную защиту от нейтропении, индуцированной циклофосфамидом.
Пример 8. Клиническое исследование: Активность PLAG в отношении Комплемента 3
Клиническое исследование проводилось в клиническом исследовательском центре MyungJi университета Gwandong в Республике Корея с 27 здоровыми пациентами с целью исследования иммуномодулирующего эффекта PLAG. Волонтеров тестировали в течение 30 дней in vivo, используя пероральное введение 500 мг PLAG в день, на основе законного клинического одобрения. Комплемент 3 определяли с использованием набора для анализа С3. Результаты исследования показаны на фигуре 7, и изменение иммуноактивности при введении PLAG здоровым субъектам показано в таблице 8 (эффект добавления PLAG на иммунную функцию периферической крови после 4-недельного вмешательства). Как показано на фигуре 7 и в таблице 8, у большинства тех, кто потреблял PLAG в течение месяца (двадцать шесть (26) субъектов из 27 пациентов), наблюдалось повышение комплемента 3 (С3), тогда как контрольная группа, получавшая соевое масло, продемонстрировала как увеличение, так и уменьшение С3. Средняя концентрация С3 в крови показывает снижение примерно на 10 мг/дл после введения PLAG при значении р<0,001.
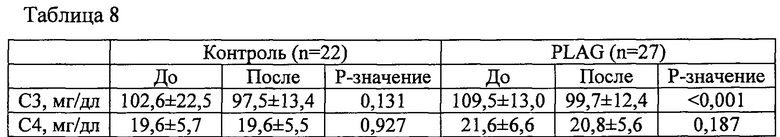
Пример 9. Пилотное исследование: Действие PLAG на тромбоцитопению и нейтропению у пациентов, получающих химиотерапию
PLAG вводили шестнадцати пациентам с раком поджелудочной железы после химиотерапии. Субъектами этого исследования были неоперабельные пациенты с раком поджелудочной железы, имеющие показатель ECOG (Многоцентровой онкологической исследовательской группы Востока США) общего состояния "0" или "1", т.е. пациенты в хорошем физическом состоянии без сильных болей, способные вести почти нормальный образ жизни и, таким образом, подходящие для проведения противоопухолевой терапии, по меньшей мере, в течение 2 месяцев. Пациенты с раком поджелудочной железы относятся к пациентам с "местнораспространенным" раком с опухолевыми метастазами в крупные сосуды вокруг поджелудочной железы или к пациентам с "отдаленными метастазами" в печень, легкое, кости и т.д. ECOG показатель общего состояния "0" относится к пациенту, необнаруживающему симптомов, полностью активному, способному выполнять всю деятельность, как до болезни, без ограничения, без болей и с отсутствием проблем, связанных с нормальным образом жизни, тогда как "1" относится к пациенту, у которого есть симптомы, но являющемуся полностью амбулаторным с небольшой болью и проблемами, связанными с нормальным образом жизни. Режим противоопухолевого лечения (комбинированное лечение гемцитабином и эрлотинибом) состоит в следующем: 1,000 мг гемцитабина вводится один раз в неделю в течение трех недель (День 1, День 8, День 15) и не вводится на последующей неделе (День 22). Следовательно, для одного цикла противоопухолевого лечения требуется 1 месяц. 100 мг эрлотиниба (Tarceva) вводится один раз в день, каждый день, перорально. 1000 мг PLAG также вводится один раз в день, перорально, начиная за 3 дня до момента последнего введения противоопухолевого лечения. Группа с введением PLAG и контрольная группа завершили по два цикла противоопухолевого лечения. Количество и режим противоопухолевого лечения в контрольной группе и группе с введением PLAG не различались.
Действие на тромбоциты: В группе с введением PLAG не было пациентов, в отношении которых возникала необходимость отложить противоопухолевую терапию или скорректировать дозировку из-за снижения количества тромбоцитов меньше 50000/мкл. Также в группе с введением PLAG не было пациентов, у которых количество тромбоцитов падало ниже 25000/мкл, что означало бы наличие клинически высокого риска кровотечения. Среди 16 пациентов в группе с введением PLAG у 7 пациентов (43,8%) наблюдалось понижение количества тромбоцитов на >50%, у 4 пациентов (25%) наблюдалось понижение на >60% и не наблюдалось понижения >70%.
В контрольной группе у 5 пациентов (15,6%) из числа получающих противоопухолевую терапию количество тромбоцитов было <50000 при наличии высокого риска кровотечения, означая, что существует необходимость отложить противоопухолевое лечение или отрегулировать дозировку, и у 1 пациента (3,1%) наблюдалось снижение количества тромбоцитов до <25000/мкл, что означает серьезную опасность критического внутреннего кровотечения. У 24 пациентов (75%) наблюдалось снижение тромбоцитов более, чем на 50%, у 14 пациентов (43,8%) наблюдалось снижение тромбоцитов более, чем на 60%, у 6 пациентов (18,8%) наблюдалось снижение тромбоцитов более, чем на 70%, и у 4 пациентов (12,5%) наблюдалось снижение тромбоцитов более, чем на 75% (Смотри фигуру 8).
Действие на нейтрофилы: В группе, получавшей PLAG, у 6 пациентов (37.5%) наблюдалось снижение нейтрофилов (абсолютное количество нейтрофилов: ANC) до менее чем 1500/мкл; у 3 пациентов (18,8%) наблюдалось снижение нейтрофилов до менее чем 1000/мкл; не было отмечено понижение менее чем до 500/мкл; у 6 пациентов (37,5%) наблюдалось снижение количества нейтрофилов до менее чем 50%; у 3 пациентов (18,8%) наблюдалось снижение количества нейтрофилов до менее чем 60%, и не наблюдалось снижения нейтрофилов ниже 75%.
В контрольной группе у 26 пациентов (81,3%) наблюдалось снижение нейтрофилов до менее чем 1500/мкл; у 13 пациентов (40,6%) наблюдалось снижение нейтрофилов до менее чем 1000/мкл; у 2 пациентов (6,3%) наблюдалось снижение нейтрофилов до менее чем 500, поэтому противоопухолевое лечение для этих пациентов было прекращено; у 29 пациентов (90,6%) наблюдалось снижение нейтрофилов более чем на 50%; у 21 пациента (65,6%) наблюдалось снижение нейтрофилов более чем на 60%; и у 12 пациентов (37,5%) наблюдалось снижение нейтрофилов более чем на 15% (Смотри фигуру 9). Было обнаружено, что в контрольной группе у 26 пациентов (81,3%) имелся высокий риск инфекции в ходе противоопухолевого лечения, при этом число нейтрофилов было меньше 1500, однако в группе с введением PLAG только у 6 пациентов (37,5%) имелся высокий риск инфекции при количестве нейтрофилов меньше 1500, что подтверждает эффективность PLAG. Кроме того, наряду с тем, что противоопухолевое лечение вызывает 75% уменьшение нейтрофилов у 12 пациентов (37,5%) в контрольной группе, не было ни одного пациента, имеющего 75% уменьшение нейтрофилов в лечебной группе с PLAG.
Это пилотное исследование имеет статистически значимое р-значение <0,05 между лечебной и контрольной группами. Результаты показывают, что уровни нейтрофилов и тромбоцитов уменьшаются при химиотерапии в обеих группах, однако значительно меньше в группе с PLAG. Пациенты в группе с PLAG не только имеют более низкий риск, связанный с тромбоцитопенией и нейтропенией, но также вследствие этого они способны лучше завершить химиотерапию, что означает, что можно ожидать более высокую вероятность выживания у этих пациентов. Таким образом, результаты показывают, что PLAG является высокоэффективным для лечения и тактики ведения тромбоцитопении и лейкопении у раковых пациентов, получающих химиотерапию.
Пример 10. Стандартная лекарственная форма.
Типичная мягкая желатиновая капсула, предназначенная для использования в описанных в документе способах, включающая (i) PLAG и (ii) α-токоферол, содержит указанную ниже композицию:

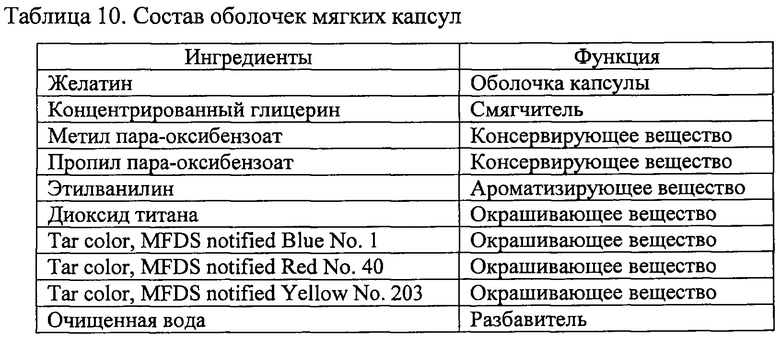
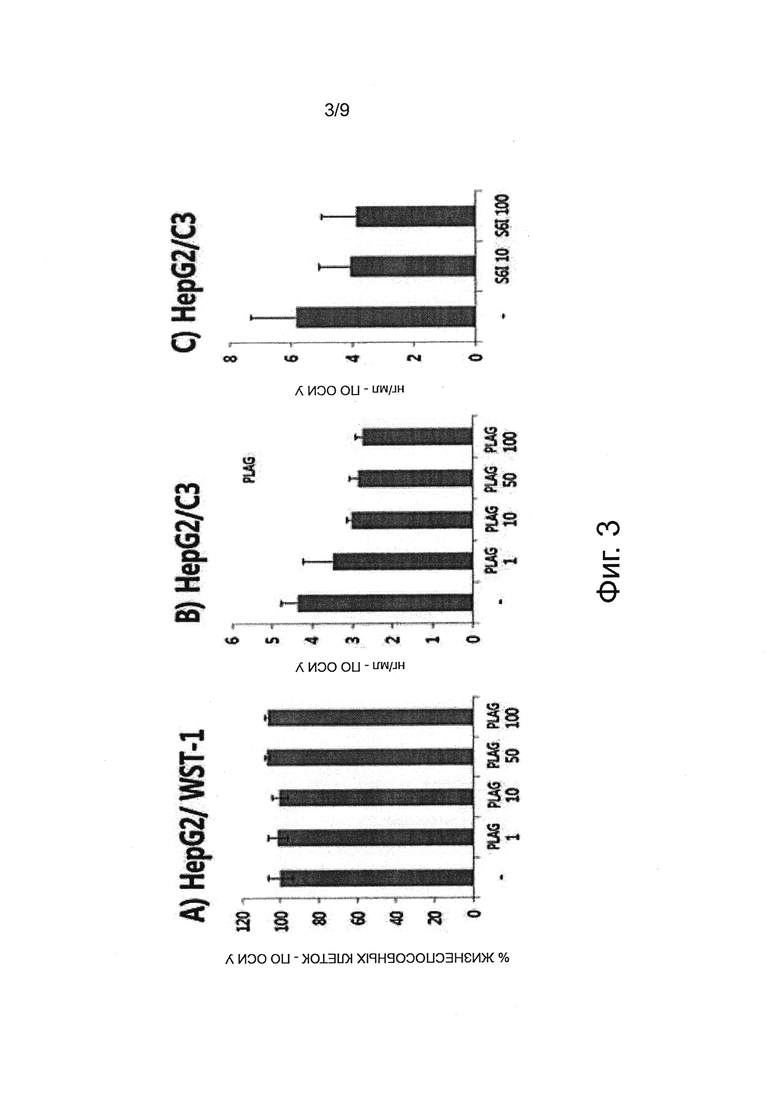
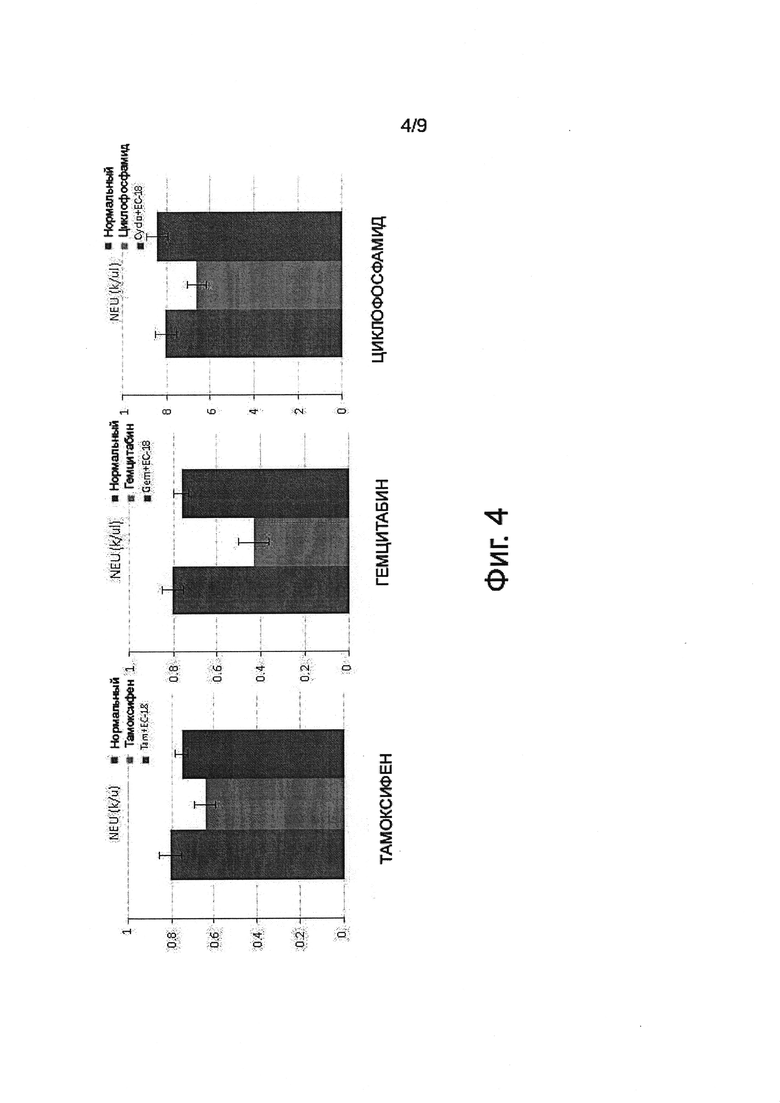
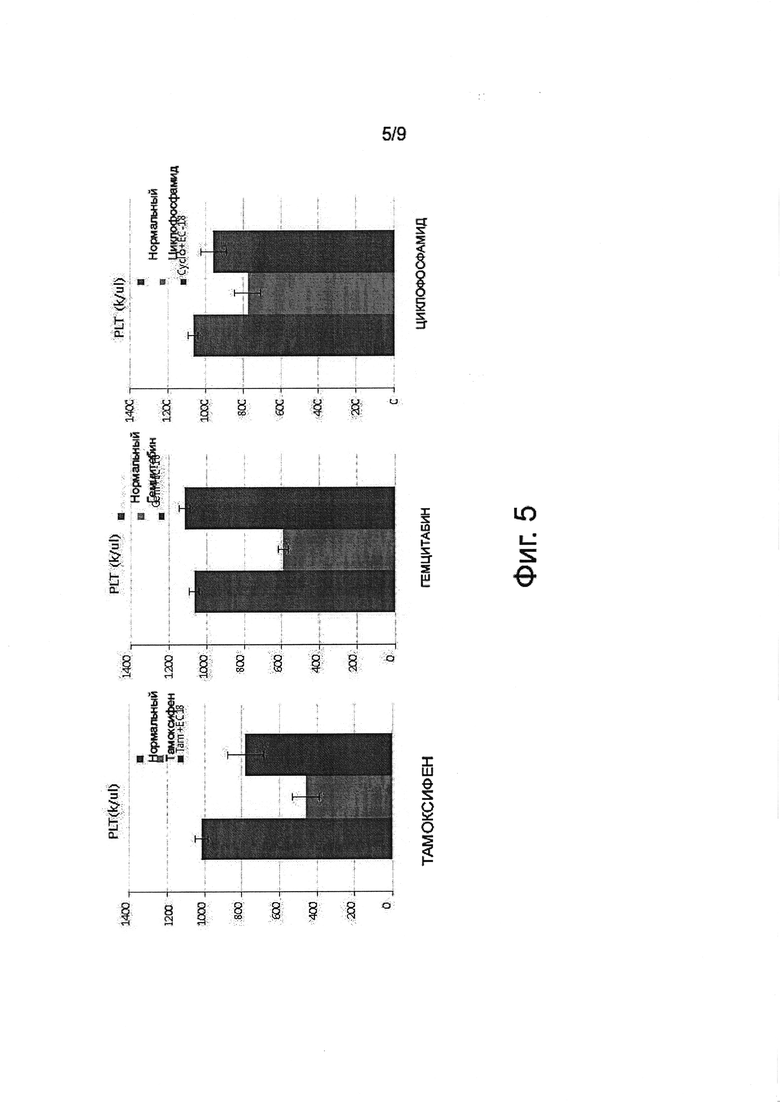
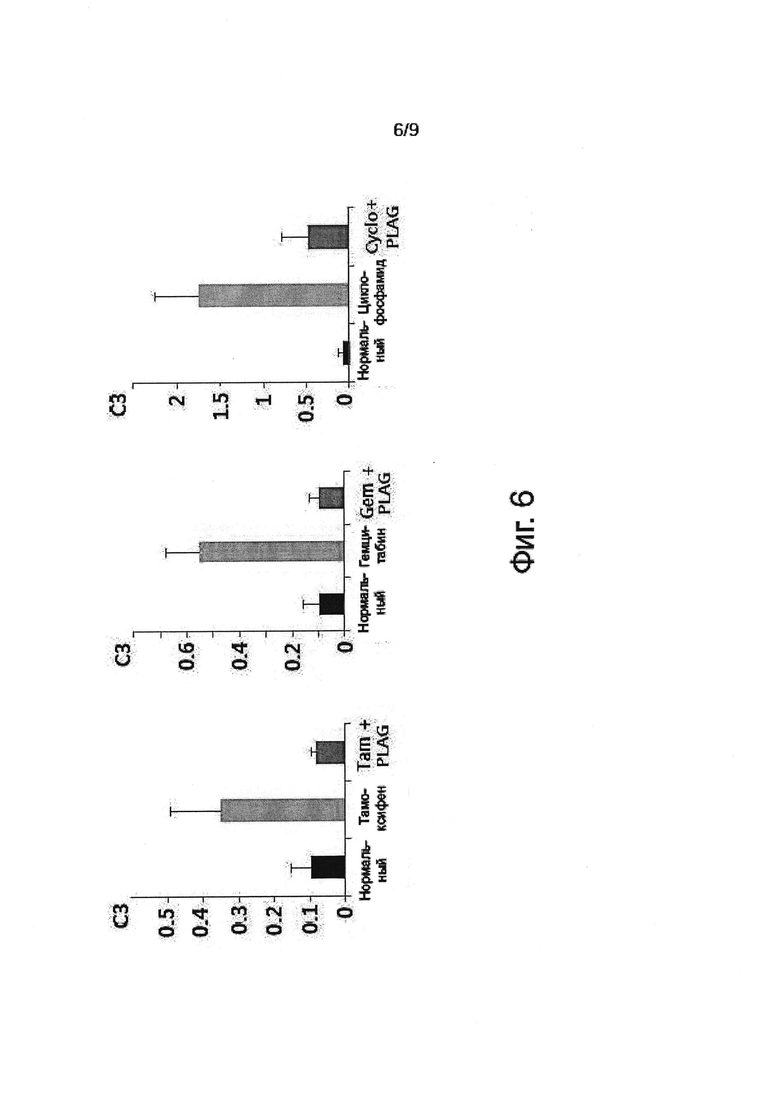
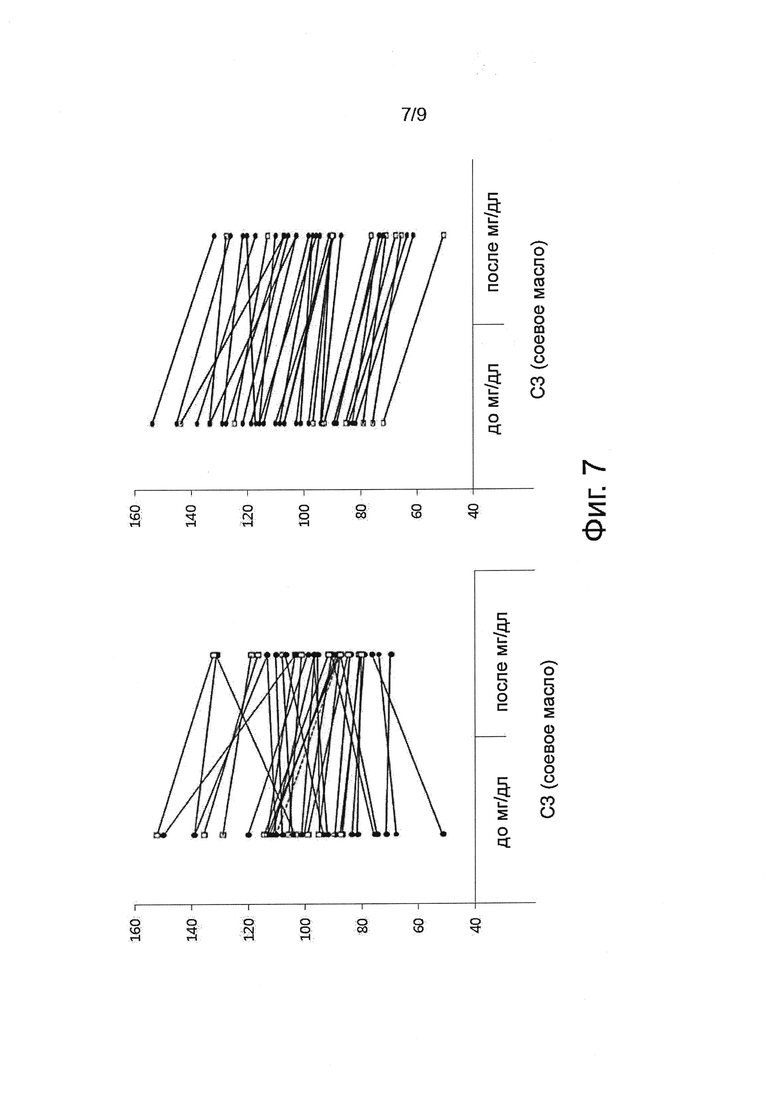
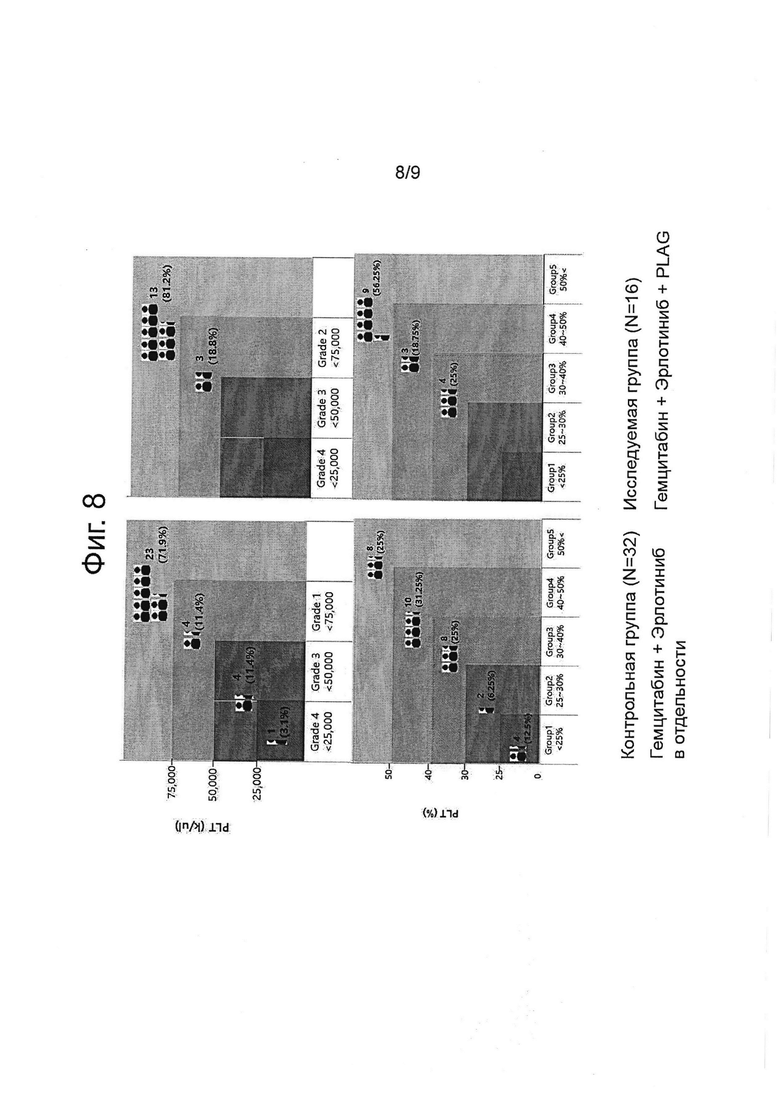

Изобретение относится к медицине и может быть использовано для приготовления медикамента для лечения индуцированной химиотерапией нейтропенией и/или тромбоцитопенией у человека, страдающего раком. При этом у человека общее количество нейтрофилов не снижается менее чем до 500/мкл или количество тромбоцитов не снижается менее чем до 25000/мкл. Для лечения вводят соединение моноацетилдиацилглицерина, описанное структурной формулой 2. Изобретение позволяет уменьшить индуцированную химиотерапией нейтропению и/или тромбоцитопению у человека, страдающего раком. 29 з.п. ф-лы, 9 ил., 10 табл., 10 пр.
1. Применение соединения формулы 2 в приготовлении медикамента для лечения состояния, выбранного из нейтропении, вызванной полностью или частично химиотерапией, и/или миелосуппрессивной индуцированной химиотерапией тромбоцитопении у человека, имеющего индуцированную химиотерапией нейтропению или у человека, проходящего химиотерапию и тем самым имеющего риск развития индуцированной химиотерапией нейтропенией, или у человека с индуцированной химиотерапией тромбоцитопенией или риском развития индуцированной химиотерапией тромбоцитопении, где соединение формулы 2 представляет собой:
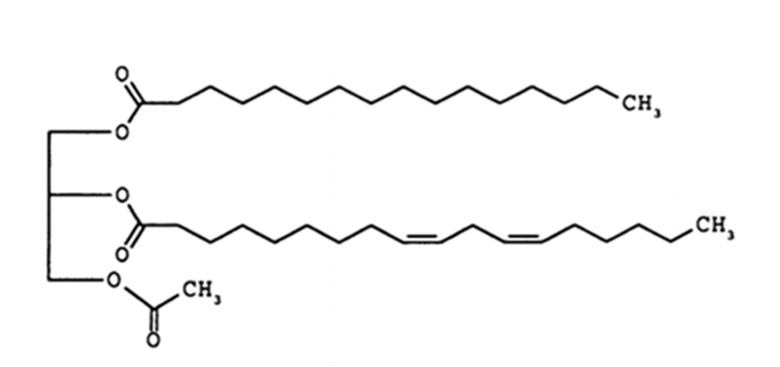 ,
,
при котором общее количество нейтрофилов у человека не снижается менее чем до 500/мкл или количество тромбоцитов не снижается менее чем до 25000/мкл.
2. Применение по п. 1, при котором соединение формулы 2 вводят в медикамент, который не содержит другого соединения моноацетилдиацилглицерина.
3. Применение по п. 2, при котором соединение формулы 2 вводится в медикамент, который не содержит триглицеридных соединений.
4. Применение по п. 1, при котором человек получает химиотерапию в дозе, достаточной, чтобы вызвать нейтропению в отсутствие другого лечения, или страдающий от нейтропении или тромбоцитопении вследствие химиотерапии.
5. Применение по п. 1, при котором человек является раковым пациентом, получающим миелосуппрессивную химиотерапию.
6. Применение по п. 1, при котором человек получает химиотерапевтическое средство для лечения рака, который может быть индуцирован или стимулирован G-CSF.
7. Применение по п. 6, при котором человек получает химиотерапевтическое средство, выбранное из одного или более циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина, тамоксифена и леналидомида.
8. Применение по п. 7, при котором химиотерапевтическое средство представляет собой леналидомид.
9. Применение по п. 6, при котором человек болен множественной миеломой, хроническим миелолейкозом (CML), острым миелоцитарным лейкозом или миелодиспластическим синдромом.
10. Применение по п. 1, дополнительно включающее введение человеку G-CSF.
11. Применение по п. 10, при котором человек страдает от или находится в зоне риска нетропении или тромбоцитопении вследствие лечения одним или более химиотерапевтическим средством, выбранным из циклофосфамида, доксорубицина, этопозида, ифосфамида, месны, цисплатина, гемцитабина и тамоксифена.
12. Применение по п. 10, при котором G-CSF выбран из филграстима, пегфилграстима и ленограстима.
13. Применение по п. 12, при котором G-CSF представляет собой филграстим.
14. Применение по п. 2, при котором медикамент составлен в твердом, жидком, гелевом состоянии или в форме суспензии для перорального использования или неперорального введения.
15. Применение по п. 14, при котором соединение формулы 2 находится в форме медикамента для перорального введения.
16. Применение по п. 15, при котором соединение формулы 2 находится в форме медикамента в мягкой желатиновой капсуле, включающей соединение формулы 2 в комбинации или в ассоциации с фармацевтически приемлемым разбавителем или носителем.
17. Применение по п. 16, при котором медикамент дополнительно содержит фармацевтически приемлемый антиоксидант.
18. Применение по п. 17, при котором фармацевтически приемлемый антиоксидант выбран из аскорбиновой кислоты (АА, Е300), токоферола (Е306), пропилгаллата (ПГ, Е310), третичного бутилгидрохинона (TBHQ), бутилатированного гидроксианизола (ВНА, Е320) и бутилатированного гидрокситолуола (ВНТ, Е321).
19. Применение по п. 18, при котором соединение формулы 2 находится в мягкой желатиновой капсуле для перорального введения, включающей 250-1000 мг соединения формулы 2, свободного от триглицеридов, вместе с 0,1-3 мг фармацевтически приемлемого соединения токоферола.
20. Применение по п. 19, при котором мягкая желатиновая капсула содержит 500 мг соединения формулы 2, свободного от триглицеридов, вместе с 1 мг фармацевтически приемлемым соединением токоферола для введения один раз или дважды в сутки.
21. Применение по п. 1, при котором снижается миграция нейтрофилов из крови после введения соединения формулы 2.
22. Применение по п. 1, при котором STAT6 активность снижается после введения соединения формулы 2.
23. Применение по п. 1, при котором лечение медикаментом прекращается в течение по меньшей мере 24 часов до и по меньшей мере 24 часов после проведения химиотерапии.
24. Применение по п. 1, при котором состояние, нуждающееся в лечении, представляет собой как нейтропению, так и тромбоцитопению.
25. Применение по п. 1, при котором лечение является профилактическим.
26. Применение по п. 1, при котором миелосуппрессивная индуцированная химиотерапией тромбоцитопения вызвана лекарственным средством, выбранным из числа зив-афлиберцепт, брентуксимаб ведотин, пралатрексат, ганцикловир, валганцикловир, ромидепсин, руксолитиниб, децитабин, иматиниб, топотекан, леналидомид, иринотекан, интерферон, фенилгидразин, тамоксифен, липополисахарид, антрациклиновый антибиотик, даунорубицин, доксорубицин, гемцитабин, цитоксан, паклитаксель, алкилированное антинеопластическое средство, ДНК-интеркалирующее средство, алкилирующее средство, бендамистин, производное иприта, ингибитор топоизомеразы, бортезомиб, темсиролимус, вориностат, ифосфамид и иксабепилон.
27. Применение по п. 1, при котором вводимое соединение формулы 2 предотвращает или подавляет повышенный или активированный комплемент 3 (C3).
28. Применение по п. 1, при котором количество тромбоцитов у человека не снижается более чем на 70%.
29. Применение по п. 1, при котором общая суточная доза соединения формулы 2 составляет 500-2000 мг.
30. Применение по п. 1, при котором общая суточная доза соединения формулы 2 составляет 1000-2000 мг.
| WO 9926640 A1, 03.06.1999 | |||
| US 2010279959 A1, 04.11.2010 | |||
| US 2010137435 A1, 03.06.2010 | |||
| RAPIDIS A.D | |||
| et al., Induction chemotherapy followed by concurrent chemoradiation in advanced squamous cell carcinoma of the head and neck: final results from a phase II study with docetaxel cisplatin and 5-fluorouracil with a four-year follow-up, Oral Oncol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2019-10-04—Публикация
2015-05-15—Подача