Настоящее изобретение касается фотосенсибилизаторов, более конкретно оно касается их использования в фотодинамической терапии.
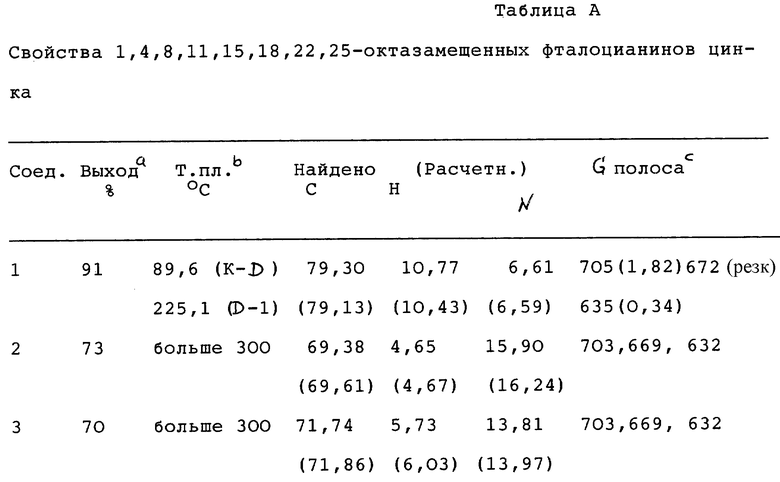
В фотодинамической терапии рака красящие соединения вводят в организм субъекта - носителя опухоли. Эти красящие вещества могут в определенной степени захватываться опухолью. Под действием избирательного излучения подходящим источником света ткань опухоли разрушается благодаря осуществляемой при посредстве красителя фотогенерации частиц типа синглетного кислорода или других цитотоксичных частиц, таких как свободные радикалы, например гидроксил или пероксид.
В качестве возможных агентов для фотодинамической терапии (PDT) был предложен ряд производных фталоцианина (Pc). Большая часть биологических исследований соединений Pc, имеющих отношение к PDT, была проведена с растворимыми в воде сульфированными металлфталоцианинами, как описано в I. Rosenthal, Photochem. Photobiol. 53(6), 859-870, 1991. Способы синтезирования этих соединений часто дают смесь соединений, содержащую ряд изомеров и/или продуктов различной степени сульфирования. Агентства по контролю лекарственных препаратов выдвигают все более строгие требования к существенно чистым соединениям, следовательно, отсутствие возможности производить существенно чистые соединения является особым недостатком в отношении их применения в фармацевтике.
Сочетание сенсибилизатора и электромагнитного излучения для лечения рака обычно называется фотодинамической терапией.
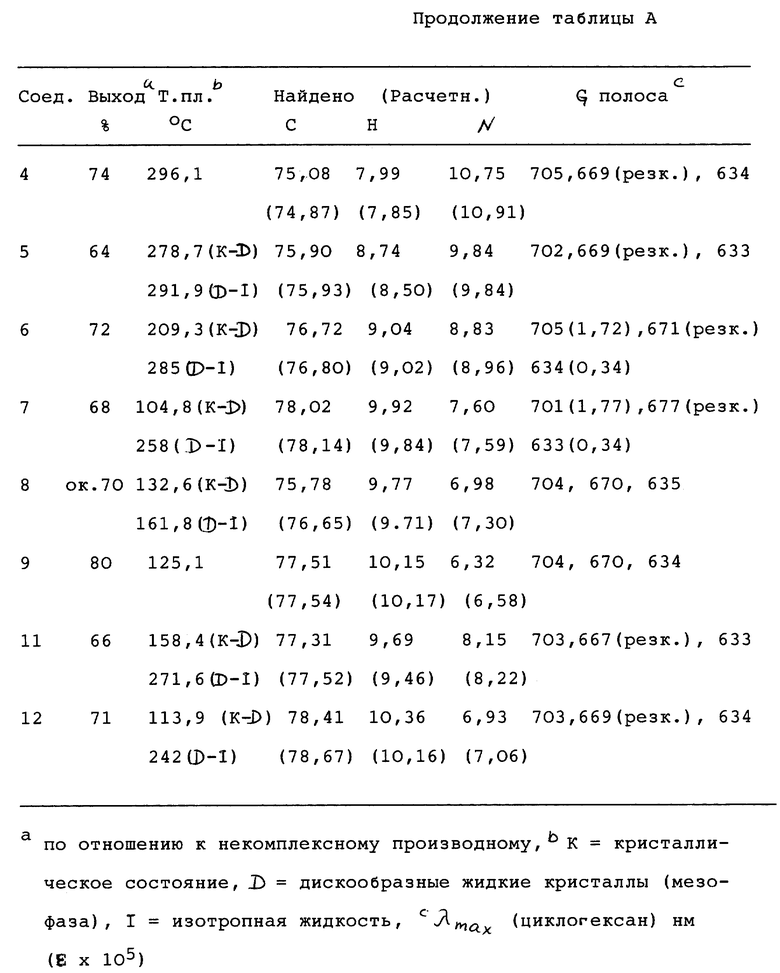
Фталоцианин имеет следующую формулу:
В вышеприведенное изображение включены также цифровые обозначения для нумерации фенильного кольца.
Было установлено, что металлфталоцианины обладают лучшей фотосенсибилизирующей активностью в сравнении с некомплексными (не содержащими металла) фталоцианинами, когда металл является диамагнитным. Наоборот, парамагнитный металл делает фталоцианин неактивным, см. I. Rosenthal и E. Ben-Hur, Phthalocyanines in photobiology, in Phthalocyanines and Application, Ed., C. C. Leznoff and A.B.P. Lever, V.C.H. Publishers 1989. Фотосенсибилизация представляет собой процесс, в котором протекание фотохимической реакции индуцируется присутствием вещества (фотосенсибилизатора), которое поглощает световое излучение, однако само по существу не изменяется к концу реакции, передавая поглощенную световую энергию основным реагентам. Например, когда водород подвергается воздействию светового излучения с длиной волны 253,6 нм, поглощения света не происходит, и водород остается полностью незатронутым. Если к водороду добавлены пары ртути, происходит возбуждение атомов ртути. Когда такой возбужденный атом ртути сталкивается с молекулой водорода, он может передать некоторое количество своей энергии водороду и вызвать его диссоциацию на атомы. Водород явно делается чувствительным к световому излучению, которое он не поглощает. В некоторых случаях фотосенсибилизатор разрушается, и образуется фотопродукт (продукт фотореакции), который также может обладать подходящими для PDT свойствами.
Подобным же образом кислород можно сделать чувствительным к электромагнитному излучению, которое он обычно не поглощает, в присутствии фталоцианинов или других сложных органических молекул; в состав некоторых из них могут входить металлы или соли металлов.
В патентной публикации WO 93/09124 описывается использование растворимых в воде солей или кислотных форм фталоцианинов переходных металлов для применения в фотодинамической терапии. В этой заявке на патент описываются фталоцианины, содержащие переходные металлы второго или третьего периода с низкоспиновой электронной конфигурацией d6. Соединения, приводимые в качестве примера в заявке на патент WO 93/09124, содержат Ru.
В европейской заявке на патент 0484027 A1 описывается использование замещенных фталоцианинов для генерирования синглетного кислорода.
Патент Великобритании GB 2229190 B касается некоторых новых замещенных фталоцианинов, способов их получения и их некоторых применений.
Имеются различные критерии, которые должны удовлетворяться, если требуется, чтобы соединение могло успешно применяться в фотодинамической терапии в качестве фотосенсибилизатора. Некоторыми из этих критериев могут являться следующие:
Высокий квантовый выход реакционноспособных (химически активных) частиц.
Относительная нетоксичность для субъекта.
Поглощение электромагнитного излучения преимущественно в красной или близкой инфракрасной области спектра.
Селективное присоединение к опухоли.
Соединение, которое испытывают для применения в PDT, может проявлять некоторые, но не обязательно все из этих свойств. К примеру, соединение может быть очень эффективным при генерации активных частиц, таких как синглетный кислород (или другие цитотоксичные частицы, например свободные радикалы), но не присоединяться селективно или вообще не присоединяться к опухолям.
Является также преимуществом, если фотосенсибилизатор поглощает в красной области электромагнитного спектра. Красное излучение обладает большей глубиной проникновения в ткани, чем более коротковолновое излучение. Предпочтительно фотосенсибилизатор поглощает лазерное излучение подходящей длины волны, например красное или близкое инфракрасное лазерное излучение.
Могут быть также использованы другие источники излучения, как например, вольфрамово-галоидная лампа.
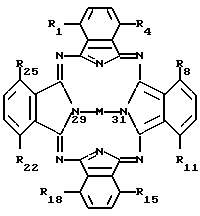
Согласно настоящему изобретению фармацевтический состав включает соединение формулы I в смеси или в ассоциации с фармацевтически приемлемым носителем или разбавителем, где формула I имеет следующий вид: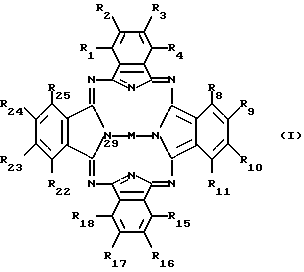
где M представляет собой атом диамагнитного металла, или соединение диамагнитного металла, или кремний, или соединение кремния, или же обозначает 2H, причем по одному атому H связано с каждым из двух атомов азота, которые изображены связанными с M (показаны в позициях 29 и 31);
радикалы R1-R25 являются одинаковыми или различными и независимо выбираются из числа следующих: C1-C20алкил, C2-C20алкенил, X-O-Y, 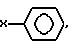 X2COOX1, X2CONR1R11 и H; где X и X2 независимо выбираются из группы, содержащей: химическую связь, -(CH2)n, где n равно целому числу от 1 до 20, и -(CH2)aCH= CH(CH2)b, где a и b независимо выбираются из целых чисел 0-20, а сумма a+b составляет от 0 до 20;
X2COOX1, X2CONR1R11 и H; где X и X2 независимо выбираются из группы, содержащей: химическую связь, -(CH2)n, где n равно целому числу от 1 до 20, и -(CH2)aCH= CH(CH2)b, где a и b независимо выбираются из целых чисел 0-20, а сумма a+b составляет от 0 до 20;
X1 независимо выбирается из группы, содержащей: C1-20алкил, C2-20алкенил и H;
R1 и R11 независимо выбираются из группы, содержащей: H, C1-20алкил, C2-20алкенил, -(CH2)n-;
Y независимо выбирается из группы, содержащей: C1-20алкил, C2-20алкенил и H;
при условии, что не все R1-R25 одновременно представляют H.
Согласно другому аспекту данного изобретения предусматривается использование соединений формулы I для приготовления медикаментов для фотодинамической терапии. Предпочтительными соединениями для использования в вышеуказанных областях являются те соединения формулы I, в которых: R1,4,8,11 ,15,18 ,22,25 все являются алкилами, а все остальные группы R представляют собой H, или
R1,4,8, 11,15,1 8,22,25 все являются OH, а все остальные группы R представляют собой H, или
R1,4,8, 11,15,18 ,22,25 все являются алкоксигруппами, а все остальные группы R представляют собой H, или
R1,4,8, 11,22,25 = алкил, а R15,18 = X2COO-алкил, или X2CONR1R11, или X2COOH, или
R1,4,8, 11,15, 18,22,25 =  или
или
R1,4,8,11 ,15,18, 22,25 = X2CONR1R11, или
R1,4,8 ,11,15, 18,22,25 = алкенил,
где X2, R1, R11, X и M имеют значения, определенные выше.
Предпочтительно X2 содержит более чем один атом углерода. Особенно предпочтительными алкильными группами для вышеупомянутой формулы I являются группы, которые представляют собой н-алкилы, содержащие 4-14 атомов углерода, еще более предпочтительны группы, содержащие 8-12 атомов углерода. Фталоцианины формулы I могут не содержать металлов (M = 2H) или, предпочтительно, M может быть атомом диамагнитного металла. Атом металла может присутствовать, например, в виде металла со степенью окисления +2 или он может присутствовать вместе с другими присоединенными к нему лигандами или анионами. Эти лиганды (или анионы) могут служить цели изменения гидрофобности молекулы в целом. Примеры подходящих анионов включают галиды, например, хлорид и бромид, другие анионы, в том числе оксиды и гидроксиды. Примерами подходящих металлов являются Ni, Pb, V, Pd, Co, Nb, Al, Sn, Zn, Cu, Mg, Ca, In, Ga, Fe и Ge. Предпочтительным металлом является цинк.
Синтез образцов этих веществ описан в патенте Великобритании GB 2229190 B, заявке на патент США, серийный номер 07/380437.
Действие описываемых в настоящем изобретении соединений в качестве фотосенсибилизаторов вызывается падающим электромагнитным излучением с подходящей длиной волны. Такое излучение включает все подходящие длины волн электромагнитного спектра. Предпочтительно электромагнитное излучение находится где-либо в диапазоне от ультрафиолетового до инфракрасного, еще более предпочтительно - в диапазоне от видимого красного до инфракрасного.
Можно достичь усиленного позиционирования соединений формулы I по отношению к подвергаемым обработке опухолям. Например соединения формулы I могут объединяться с другими химическими фрагментами. Отдельные соединения из числа описываемых формулой I могут быть соединены, например химической связью, с антителами, специально приспособленными для того, чтобы присоединяться к сайту опухоли. Антитела вырабатывают из культивируемых образцов опухоли. Примеры включают P. L. A. P. (плацентарная щелочная фосфатаза), H.M.F.G. (глобулин жира человеческого молока), C.E.A. (карциноэмбриональное антитело), H.C.G. (хорионический гонадотропин человека).
Дополнительными возможными применениями фталоцианинов (как фотосенсибилизаторов) формулы I являются следующие:
Антивирусные препараты в банках крови.
Инсектициды.
Настоящее изобретение показывает, что эти соединения активны в тестах in vitro и in vivo.
Настоящее изобретение предусматривает фармацевтическую композицию, включающую соединение формулы I в смеси или в ассоциации с фармацевтически приемлемым носителем или разбавителем. Изобретение также включает способ лечения млекопитающих, имеющих поддающуюся фотодинамическому лечению опухоль, заключающийся в том, что млекопитающему вводят эффективную дозу соединения формулы I или его фармацевтически приемлемой соли и подвергают опухоль воздействию подходящего электромагнитного излучения.
Фармацевтические составы могут быть приготовлены согласно хорошо известным правилам и могут находиться, желательно, в виде единичных дозировок, определенных в соответствии со стандартными фармакологическими методиками. Формы стандартных доз могут обеспечивать ежедневную дозировку активного соединения в виде разовой дозы или в виде некоторого числа меньших доз. Диапазоны дозировок можно установить, используя стандартные фармакологические методики, и, как ожидается, они находятся в диапазоне от 1 до 60 мг/кг веса тела. Другие активные соединения могут быть использованы в составах либо вводиться отдельно, или в курс лечения пациента может быть включена дополнительная терапия. Фармацевтические составы могут быть, желательно, в форме растворов или суспензий для инъекции или в формах для локального применения, включая, например, применение в полости рта. Возможно также применение в других полостях. Подходящие носители и разбавители хорошо известны в технологии, и составы могут включать эксципиенты и другие компоненты для обеспечения более легкого или более эффективного введения.
Вслед за введением пациенту может быть стандартным образом проведена фотодинамическая терапия с использованием источников светового излучения и систем подачи, известных в технологии, см. например Phis. Med. Biol. (1986), 31, 4, 327-360.
Далее изобретение будет описываться только при помощи примеров со ссылкой на следующие фигуры:
На фиг. 1 показана типичная микрофотография, полученная для образца опухоли, выделенного через 6 часов после PDT. Увеличение 5000x (верхний рисунок) и 6000x.
На фиг. 2 показана типичная микрофотография, полученная для образца опухоли, выделенного через 24 часа после PDT. Увеличение 7500x (верхний рисунок) и 4000x.
Пример 1.
Было получено следующее соединение (сокращенное название ZnODPc):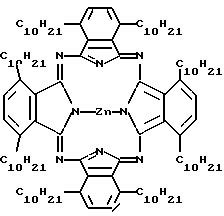
Синтез ZnODPc
Не содержащий металла 1,4,8,11,15,18,22,25-октакис-децил-фталоцианин (см. McKeown et al. , J. Chem. Soc. Perkin Trans. 1, 1169-1177, 1990.) в количестве 1,3 г (0,8 ммоль) растворяли в безводном пентан-1-оле (25 мл) при нагревании с обратным холодильником. Добавляли ацетат цинка (II) (500 мг, 2,7 ммоль) и продолжали нагревание с обратным холодильником в течение 45 минут. Растворитель удаляли при пониженном давлении и остаток очищали при помощи колоночной хроматографии на силикагеле Merck 7734 с элюентом петролейный эфир (т.кип. 40-60oC)/толуол (4:1). Перекристаллизация из смеси тетрагидрофуран-метанол дает 1,4,8,11,15,18,22,25-октакис-децилфталоцианинат цинка (ZnODPc) в виде красивых синих игольчатых кристаллов (1,24 г, 91%), т. пл. 233,8oC.
Элементный анализ - найдено; C 79,18%; H 10,51%; N 6,56%;
расчетные значения для C112H176N8Zn: C 79,13%; H 10,43%; N 6,59%.
Таким же образом, как и ZnODPc, был синтезирован ряд других образцов соединений (2-7 и 11-12), в которых длина алкильной цепи изменялась. Образцы соединений согласно примерам 2-7 и 11-12 описываются следующей общей формулой II: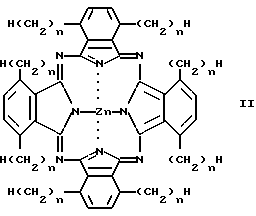
Пример 1: n = 10, ZnODPc.
Пример 2: n = 1.
Пример 3: n = 2.
Пример 4: n = 4.
Пример 5: n = 5.
Пример 6: n = 6.
Пример 7: n = 8.
Пример 11: n = 7.
Пример 12: n = 9.
Другие примеры испытывавшихся соединений включают следующие: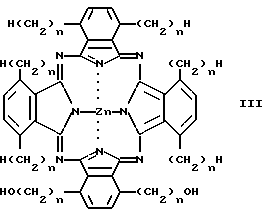
Пример 8: m = 6, n = 9,
Пример 9: m = 9, n = 10
Соединения 8 и 9 получали путем взаимодействия двух различных исходных веществ - производных фталонитрила с образованием некомплексного фталоцианина, а затем введения цинка. Далее описан синтез соединения 9.
1,4-Бис(9-гидроксинонил)-8,11,15,18,22,25-гексадецилфталоцианин
3,6-Бис[9-(тетрагидропиран-2-илокси)нонил] фталонитрил и 3,6-дидецилфталонитрил получали из фурана и тиофена соответственно, используя схемы, описанные в Chambrier, Cook, Cracknell and McMurdo, J. Mater. Chem. 1993, 3(8), 841.
3,6-Бис[9-(тетрагидропиран-2-илокси)нонил] фталонитрил (7 г, 17 ммоль) и 3,6-дидецилфталонитрил (1,21 г, 2 ммоль) нагревали до кипения (с обратным холодильником) в безводном пентан-1-оле (25 мл) и добавляли металлический литий (500 мг, 70 ммоль). Через 1 ч смеси давали остыть до комнатной температуры. Добавляли уксусную кислоту (50 мл) и продолжали перемешивание в течение 30 мин. Растворители удаляли при пониженном давлении и остаток растирали в порошок с метанолом, чтобы удалить непрореагировавшие исходные вещества и соли лития. Остаток обрабатывали тетрагидрофураном и фильтровали, чтобы удалить растворимые в воде соли, а растворитель удаляли при пониженном давлении. Полученное темно-зеленое масло хроматографировали на диоксиде кремния (элюент петролейный эфир, т. кип. 40-60oC), что давало в виде первой фракции 1,4,8,11,15,18,22,25-октадецилфталоцианин, который перекристаллизовывали из смеси тетрагидрофуран/ацетон с получением ярко-зеленых игольчатых кристаллов (2 г, 29%), т. пл. 77,5oC (K-D), 133oC (D-I). δн (400 МГц, растворитель CDCl3) 0,0 (2H, с), 0,9 (24H, т), 1,05-2,48 (128H, м), 4,43 (16H, т), 7,78 (8H, с). (Элементный анализ - найдено: C 82,23%; H 11,14%; N 6,66%; расчетные значения для C112H178N8: C 82,19%; H 10,96%; N, 6,85%). Колонку элюировали смесью петролейный эфир/дихлорметан 50:50, чтобы удалить весь остающийся октадецилфталоцианин, а затем вторую фракцию, элюированную смесью петролейный эфир (т.кип. 40-60oC)/тетрагидрофуран 9:1, собирали и четырежды повторно хроматографировали на силикагеле с элюентом циклогексан/тетрагидрофуран 9:1, что давало 1,4-бис(9-гидроксинонил)-8,11,15,18,22,25-гексадецилфталоцианин, который перекристаллизовывали из смеси тетрагидрофуран/метанол с получением темно-зеленых кубических кристаллов ((500 мг, 15%) по отношению к 3,6-бис[9-(тетрагидропиран-2-илокси)нонил] фталонитрилу), т.пл. 103oC (K-D), 125oC (D-I), δн (270 МГц, растворитель d6 бензол) -0,15 (2H, с), 0,90 (18H, т), 1,1 (78H, м), 1,42 (16H, м), 1,75 (16H, м), 2,30 (16H, м), 3,25 (4H, т), 4,70 (16H, т), 7,9 (8H, с). (Элементный анализ - найдено: C 80,43%; H 10,64%; N 6,94%; расчетные значения для C110H174N8O2: C 80,53%; H 10,69%; N 6,82%).
1,4-Бис-(9-гидроксинонил)-8,11,15,18,22,25-гексадецилфталоцианинат цинка
1,4-Бис(9-гидроксинонил)-8,11,15,18,22,25-гексадецилфталоцианин (200 мг) превращали в 1,4-бис(9-гидроксинонил)-8,11,15,18,22,25- гексадецилфталоцианинат цинка (80 мг), следуя методике, описанной для ZnODPc, (80%) т.пл. 125,1oC. (Элементный анализ - найдено: C 77,51%; H 10,15%; N 6,32%; расчетные значения для C110H172N8O2Zn: C 77,54%; H 10,17%; N 6,58%).
Соединение 8 получали согласно той же методике.
Свойства 1,4,8,11,15,18,22,25-октазамещенных фталоцианинов цинка приведены в табл.А (см. в конце описания).
Спектроскопическое свойства ZnODPc
Для ZnODPc определены следующие спектроскопические данные: было найдено, что молярный коэффициент поглощения (ε) при максимуме поглощения в 703 нм составляет приблизительно 2,3•105 дм3моль-1см-1. Максимум флуоресцентного излучения, возбужденного при 703 нм, приходится на 712 нм.
Исследование опухоли
В данном исследовании в качестве модельных подопытных животных использовали самок мышей Balb/c, 20-22 г, являющихся носителями фибросаркомы MS-2, имплантированной внутримышечно в правую заднюю ногу. На седьмой день после трансплантации, когда диаметр опухоли составлял 0,6-0,8 см и не отмечалось спонтанного некроза, мышам вводили инъекцию от 1,2 до 2,4 мг/кг ZnODPc, включенного в состав эмульсий типа Кремофор. Получение таких эмульсий и определение их свойств было описано в L.Polo et al., Canser Lett. 66: 217-223, 1992. Количество введенного ZnODPc оценивали путем разведения в тетрагидрофуране известной аликвоты фталоцианинсодержащей эмульсии и измерения оптической плотности при 701 нм (молярный коэффициент поглощения 2,01•105 дм3моль-1см-1).
Генерация синглетного кислорода
Вещество ZnODPc генерирует синглетный кислород с квантовым выходом 0,73 ± 0,06 в толуол/пиридиновом растворе. Эти данные можно сопоставить с содержащим цинк незамещенным фталоцианином в спиртовом растворе, квантовый выход для которого составляет приблизительно 0,4, см. G. Valduga et al., Photochem. Photobiol., vol. 48, page 1, 1988.
Фармакокинетические исследования.
Мышам-носителям опухоли производили инъекцию 1,2 мг/кг ZnODPc в хвостовую вену. Через 3 часа и 24 часа после введения умерщвляли группы из трех мышей путем продолжительного воздействия паров эфира, вырезали опухоль и избранные здоровые ткани (мышцы, кожа, печень и почки), промывали буферизованным соляным раствором фосфата (PBS) и испытывали на содержание фталоцианина путем спектрофлуориметрического анализа после проведения химической экстракции, см. Reddi et al., Br. J. Canser 61: 407-411, 1990: обычно взвешенное количество ткани гомогенизировали в 3 мл водного раствора додецилсульфата натрия (SDS); гомогенат выдерживали в течение 1 часа при комнатной температуре при легком перемешивании магнитной мешалкой и к 1 мл суспензии добавляли 2 мл тетрагидрофурана, центрифугировали в течение 10 мин при 3000 об/мин; собирали надосадочную жидкость и определяли для нее интенсивность флуоресценции в интервале 670-770 нм (возбуждение при 650 нм). По интенсивности флуоресценции находили концентрацию ZnODPc путем интерполяции с помощью калибровочного графика. Образцы крови брали у умерщвленных животных, центрифугировали, чтобы отделить эритроциты, и собранную таким образом сыворотку (50 мкл) разбавляли 2%-ным водным раствором SDS (700 мкл), добавляли 1,5 мл тетрагидрофурана и центрифугировали в течение 10 мин при 3000 об/мин. Концентрацию ZnODPc в надосадочной жидкости определяли при помощи флуоресцентной спектроскопии, как описано выше.
Фототерапевтические исследования.
Мышам-носителям опухоли производили инъекцию 2,4 мг/кг ZnODPc и через 24 часа облучали их светом с длиной волны 600-700 нм, который выделяли из излучения кварцево-галогенной лампы (Teclas, Lugano Switzerland) при помощи оптической фильтрации. Световой пучок фокусировали на жгут оптических волокон, конец которого находился на расстоянии 1 см от поверхности опухоли. Лампа функционировала при 230 мВт/см2 до получения общей дозы светового облучения в 400 Дж/см2.
Реакцию опухоли изучали путем визуальных наблюдений, а также путем исследования при помощи электронной микроскопии образцов опухоли, взятых через 6 и 24 часа после окончания PDT. Приготовление образцов и определение ультраструктуры проводили, как описано в Milanesi et al., Br. J. Canser 61: 846-850, 1990.
Результаты
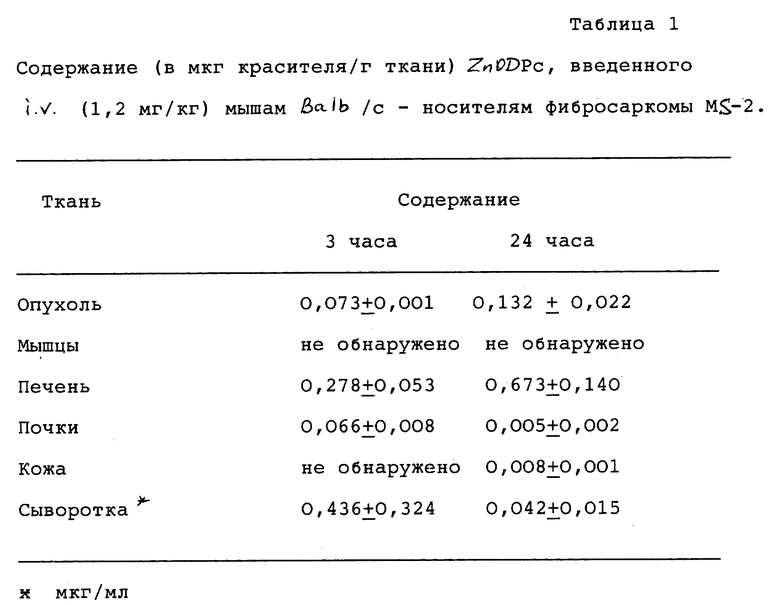
Содержание ZnODPc в сыворотке, опухоли и избранных здоровых тканях мышей Balb/c представлено в таблице 1.
Особое внимание было сосредоточено на содержании фталоцианина в мышцах, которые являются перитуморальной (непосредственно окружающей опухоль) тканью у изучавшихся в настоящем исследовании подопытных животных, и в коже - из-за частого возникновения устойчивой кожной светочувствительности у подвергаемых PDT пациентов. Измерение аккумуляции ZnODPc в печени и почках может дать полезную информацию о модальности удаления указанного соединения из организма. Анализы проводили с интервалом в 3 ч после инъекции фотосенсибилизатора и в 24 часа, обычно рассматриваемым как общепринятый интервал времени при лечении методом PDT.
Все последующие эксперименты по облучению проводили через 24 ч после инъекции, так как оказывается, что концентрация ZnODPc в опухоли в это время все еще продолжает расти. Во всех случаях у фотосенсибилизированных мышей обнаруживалось значительное замедление роста опухоли по сравнению с не подвергнутыми обработке мышами-носителями опухоли. Как показано на фиг. 1, через 6 ч после облучения можно наблюдать обширные повреждения клеток опухоли 1, особенно на цитоплазматическом уровне, в то время как оказывается, что кровеносные сосуды 2 повреждены менее сильно. Повреждения ткани существенно более обширны через 24 ч после облучения (см. фиг. 2), включая также и окружающую ядро злокачественных клеток мембрану 3, в то время как отдельные ядра являются пикнотичными 4; некоторые области ядер, как видно, являются оптически пустыми 5. В то же время часто наблюдается эндоцитоплазматическая вакуолизация 6 у некоторых полностью некротических клеток и потеря организованной структуры тканей. Оказывается, что опухоль в целом глубоко геморрагична.
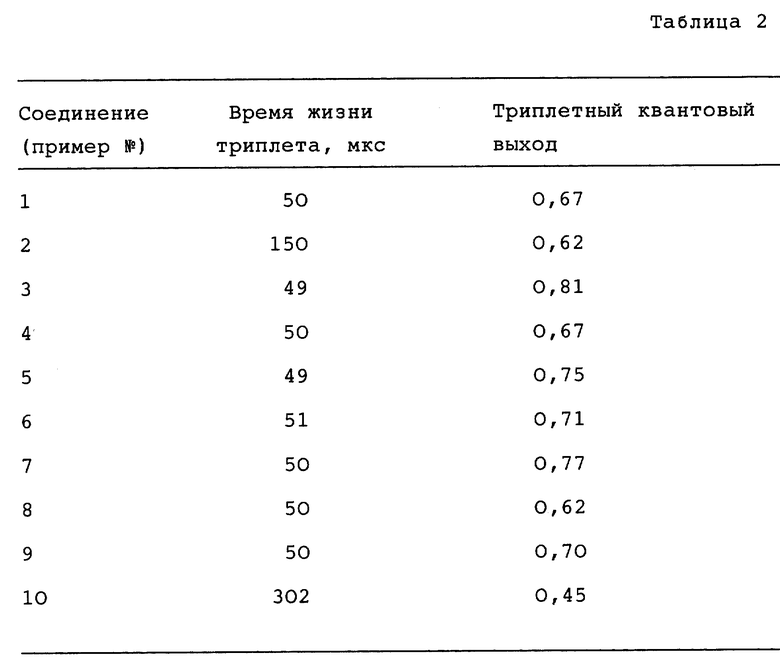
Исследования триплетного состояния проводили с использованием метода лазерного флеш-фотолиза. Были приготовлены образцы в 1% растворе пиридина в толуоле; полагают, что посредством приготовления такого раствора удается избежать агрегации фталоцианиновых ядер. Раствор готовили таким образом, что его оптическая плотность составляла 0,2-0,3 при длине волны, вызывающей возбуждение. Образцы облучали лазером на красителях с накачкой эксимерным лазером при 355 нм и следили за переходными состояниями при помощи кварцево-галогенной лампы. Триплетные квантовые выходы рассчитывали с использованием ZnTPP (трифенилфосфат цинка) и ZnPc в качестве стандартов. Результаты представлены в таблице 2. Триплетный квантовый выход представляет собой квантовый выход процесса перехода возбужденного синглетного состояния в триплетное состояние.
Соединением в примере 10 является незамещенный фталоцианин цинка (ZnPc); он включен в таблицу как образец для сравнения.
Данные в табл. 2 являются средними по не менее чем четырем независимым испытаниям, исключая соединения 8 и 9, которые были испытаны однократно.
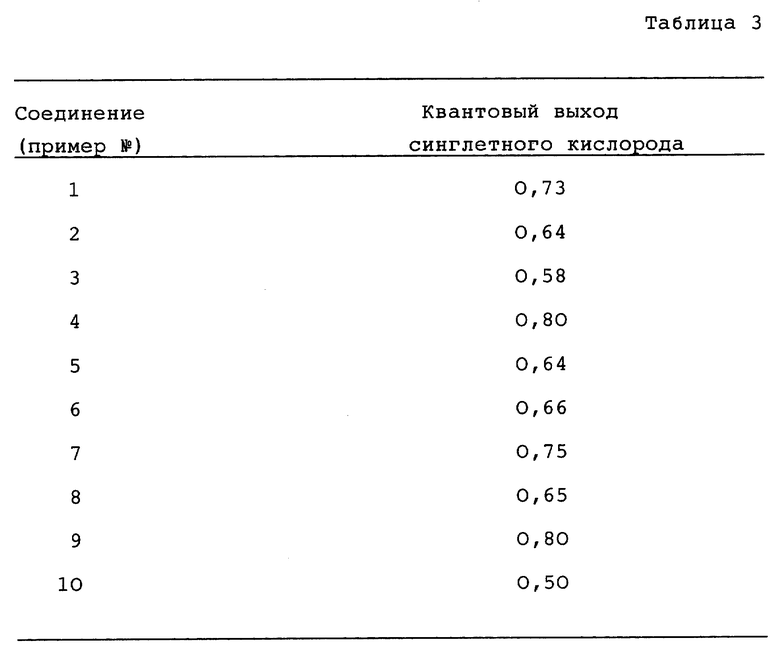
Изучали также генерацию синглетного кислорода фталоцианинами. Способ детектирования синглетного кислорода включает измерение интенсивности люминесценции при 1270 нм, соответствующей запрещенному переходу из возбужденного синглетного состояния обратно в основное состояние, при помощи охлаждаемого жидким азотом германиевого детектора. Аэрированные образцы облучали при помощи такого же устройства, как описано для исследований триплетного состояния. В качестве стандартов использовали ZnTPP, ZnPc и антрацен.
Данные в табл. 3 являются средними по не менее чем четырем независимым испытаниям, исключая соединения 8 и 9, которые были испытаны однократно.
Были исследованы свойства продуктов разложения, являющихся результатом облучения фталоцианинов. Полагают, что главными продуктами разложения являются замещенные фталимиды. Результаты, полученные при облучении раствора ZnODPc (соединение в примере 1) в 1% пиридине в толуоле показывают, что квантовый выход синглетного кислорода в смеси продуктов разложения не превышает 0,05.
Эти результаты ясно показывают, что настоящее изобретение дает перспективные агенты для PDT благодаря их чрезвычайно селективной локализации в ткани опухоли. Например, при рассмотрении соединения ZnODPc выявлены сравнительно низкие концентрации ZnODPc в печени, даже если выведение фотосенсибилизатора из организма должно происходить через желчно-кишечный тракт, поскольку в почках аккумулируются незначительные его количества. Кроме того, фталоцианин не присутствует в существенных количествах в кожных покровах, минимизируя таким образом побочные эффекты, вследствие фотосенсибилизации кожи. Через исследованные промежутки времени после инъекции не было извлечено детектируемых количеств фталоцианина из перитуморальной ткани, в то время как количество ZnODPc, аккумулированное в фибросаркоме, достаточно для того, чтобы вызвать действенные повреждения опухоли при фотовозбуждении красным светом. Особым преимуществом настоящего изобретения является то, что соединения поглощают световое излучение в красной области спектра. При описанных здесь условиях облучения злокачественные клетки оказываются основной мишенью для фотосенсибилизации, например при помощи ZnODPc, хотя наблюдается также заметное повреждение кровеносных капилляров. В целом PDT-агенты, которые вводятся в сочетании с системами доставки липидного типа, вызывают некроз опухоли путем быстрого повреждения неопластических клеток, в то время как повреждение сосудов наблюдается только через более длительное время после облучения, возможно как вторичное следствие повреждения клеток, например в результате фильтрации внутриклеточной жидкости в кровоток. Настоящее изобретение показывает, что как клеточная, так и сосудистая составляющая часть неопластической ткани несомненно подвергаются воздействию на начальных стадиях процесса разрушения под действием света.
Механизм фотосенсибилизации опухоли фотосенсибилизаторами характеризуется в некоторых случаях, например для ZnODPc, появлением обширных повреждений ядер клеток, которые становятся пикнотическими и оптически пустыми. Это отличается от того, что наблюдается для других гидрофобных фталоцианинов, где вызванные сенсибилизацией повреждения обычно ограничены мембранами клеток даже после радикального облучения, см. например Milanei et al., Br. J. Canser 1, 846-850, 1990.
Одновременные повреждения как злокачественных клеток, так и капилляров могут усилить реакцию ткани опухоли на обработку методом PDT.
В другом варианте осуществления изобретения M в формуле I может быть неметаллом помимо кремния или соединений кремния.

Изобретение относится к медицине и касается фталоцианиновых соединений формул I и композиций на их основе, проявляющих фотосенсибилизирующую активность. Предложенные фотосенсибилизаторы более эффективны и могут использоваться как для лечения опухолей, так и в качестве противовирусных и инсектицидных средств. 6 с. и 18 з.п.ф-лы, 4 табл., 2 ил.
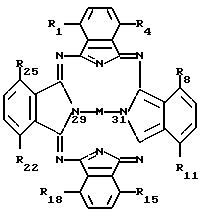

где M представляет собой ион диамагнитного металла, или соединение диамагнитного металла, или кремний, или соединение кремния, или же обозначает 2H, причем по одному атому H связано с каждым из двух атомов азота, которые изображены связанными с M (показаны в позициях 29 и 31);
радикалы R1 - R25 являются одинаковыми или различными и независимо выбираются из числа следующих: C1-C20алкил,
C2-C20алкенил, X-O-Y, 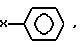
X2COOX1, X2CONR1R11 и H;
где X и X2 независимо выбирают из химической связи, (CH2)n-, где n равно целому числу от 1 до 20, и -(CH2)aCH=CH(CH2)b, где a и b независимо выбирают из целых чисел 0 - 20, а сумма a + b составляет от 0 до 20;
X1 независимо выбирают из C1-20алкил, C2-20алкенил и H;
R1 и R11 независимо выбираются из H, C1-20алкил, C2-20алкенила,
Y независимо выбирают из C1-20алкила, C2-20алкенил и H; при условии, что не все R1 - R25 одновременно представляют H; при условии, что не все R1 - R25 одновременно представляют н-алкоксигруппу.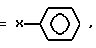 или R1,4,8, 11,15, 18,22,25 = X2CONR1R11, или R1,4,8, 11,15,18, 22,25 = алкенил, где X2, R1, R11, X и M имеют значения определенные в п.1.
или R1,4,8, 11,15, 18,22,25 = X2CONR1R11, или R1,4,8, 11,15,18, 22,25 = алкенил, где X2, R1, R11, X и M имеют значения определенные в п.1.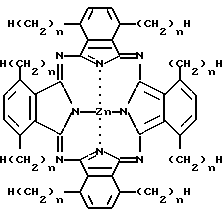
где n имеет значения 1 - 20, в смеси или в ассоциации с фармацевтическим приемлемым носителем или разбавителем.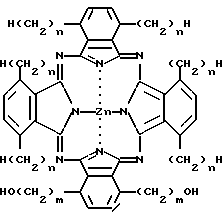
где n и m независимо имеют значения 1 - 20, в смеси или в ассоциации с фармацевтически приемлемым носителем или разбавителем.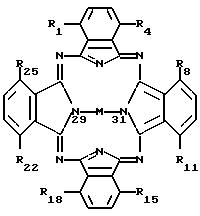
где M представляет собой ион диамагнитного металла, или соединение диамагнитного металла, или кремний, или соединение кремния, или же обозначает 2H, причем по одному атому H связано с каждым из двух атомов азота, которые изображены связанными с M (показаны в позициях 29 и 31);
радикалы R1 - R25 являются одинаковыми или различными и независимо выбираются из C1-C20алкила,
C2-C20алкенила, X-O-Y, 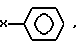 X2COOX1, X2CONR1R11 и H;
X2COOX1, X2CONR1R11 и H;
где X и X2 независимо выбирают из химической связи, -(CH2)n-, где n равно целому числу от 1 до 20, и -(CH2)aCH=CH(CH2)b, где a и b независимо выбирают из целых чисел 0 - 20, а сумма a + b составляет от 0 до 20;
X1 независимо выбирают из C1-20алкила, C2-20алкенила и H;
R1 и R11 независимо выбирают из H, C1-20алкила, C2-20алкенила,
Y независимо выбирают из C1-20алкила, C2-20алкенила и H; при условии, что не все R1 - R25 одновременно представляют H; при условии, что не все R1 - R25 одновременно представляют н-алкоксигруппу.
| УПЛОТНИТЕЛЬНЫЙ ЭЛЕМЕНТ, УЗЕЛ ДЛЯ УПЛОТНЕНИЯ И СПОСОБ УПЛОТНЕНИЯ | 1999 |
|
RU2229190C2 |
| Подшипниковый узел | 1974 |
|
SU484027A1 |
| US 5166197 A, 24.11.1992 | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| КАРУ Т.Й | |||
| и др | |||
| Фотосенсибилизирующая инактивация опухолевых клеток Hela фталоцианинами | |||
| Радиобиология, 1989, N 3, с.353 - 358. | |||
Авторы
Даты
2000-11-27—Публикация
1994-08-24—Подача