Изобретение относится к области медицины, в частности к офтальмологии, и может быть использовано при разработке методов профилактики и лечения пролиферативной витреоретинопатии (ПВР).
ПВР - нозологическая форма, представляющая прогрессивную внутрисетчаточную пролиферацию с выходом в преретинальное пространство, образованием эпиретинальной мембраны, обладающей контрактильными свойствами и приводящей к отслойке сетчатки.
Наиболее закономерно ПВР как осложнение наблюдается при диабетической ретинопатии, при травматических поражениях глаза, при отслойке сетчатки с дырчатыми разрывами.
Профилактика и лечение этой патологии не разработаны.
Весьма перспективным является разработка лечения на экспериментальных моделях.
Известен способ моделирования ПВР путем введения в полость стекловидного тела культуры фибробластов кожи (Hitchins C.A. and Grierson J. Intravitreal injection of fibroblasts. The pathological effects on the ocular tissue of the rabbit following an intravitreal injection of analogus skin fibroblasts Br. I. Ophth. 1988, vol. 72, p. 488). Недостатком этого способа моделирования является то, что он не отражает особенности патогенеза заболевания.
Введение в стекловидное тело фибробластов вызывает бурную пролиферацию только фибробластических элементов, что значительно отличает эту модель от клинических проявлений, в то время как исследования последних лет показали, что образование эпиретинальных мембран является результатом пролиферации различных типов клеток, включая клетки ретинального пигментного эпителия (РПЭ), макрофагов, глиальных клеток и фибробластов. Кроме того, гетерогенные (кожные) фибробласты в тканях глаза способствуют развитию дополнительных иммунологических реакций.
Техническим результатом изобретения является получение ПВР в глазу экспериментальных животных, отражающей патогенез процесса, близкий к изменениям у человека. Технический результат достигается за счет использования биологических субстратов, активирующих клеточную пролиферацию и с учетом воздействия комплекса основных, известных в данной патологии патогенетических факторов.
Для этого вводят в полость стекловидного тела глаза кроликов три компонента: взвесь клеток аутологичного ретинального пигментного эпителия в количестве 9,1-9,6•102 в 0,2 мл среды, естественный комплекс гомологичных цитокинов объемом 0,1 мл в концентрации 40 мкг и гомологичный плазменный фибронектин объемом 0,1 мл в концентрации 0,5 мкг.
Все три компонента, введенные одномоментно, отражают основные звенья в механизме ПВР, обеспечивая активный пролиферативный процесс на поверхности сетчатки. Основное внимание обращает тесное взаимодействие всех используемых компонентов при моделировании ПВР. Главную роль в этом процессе играют функционально активные клетки РПЭ. Активация их происходит, по-видимому, при взаимодействии с макрофагами (мононуклеарными фагоцитами), которые аттрактируются из кровяного русла в полость стекловидного тела при введении естественного комплекса гомологичных цитокинов, продуцируемых лимфоцитами периферической крови и представляющих комплекс эндогенных иммунопептидов с активностью интерлейкина-1, интерлейкина-6, фактора некроза опухоли, миграционноингибирующего фактора, трансформируемого фактора роста β1. Кроме того, выделяемые макрофагами факторы роста способствуют пролиферации РПЭ и формированию эпиретинальной мембраны, являющейся характерным признаком ПВР (фиг. 1).
Фибронектин, введенный экзогенно, способствует адгезии клеточных элементов, их распластыванию и агрегации, приводящим к формированию мембранных субстратов.
Трехкомпонентная экспериментальная модель ПВР имеет преимущество при разработке универсальных патогенетически обоснованных подходов при профилактике и лечении этого заболевания.
Способ осуществляется следующим образом.
1. Введение взвеси аутологичных клеток РПЭ. Под общим обезболиванием проводится энуклеация одного глаза. Энуклеированный глаз разрезают сагитальным разрезом по экватору и из задней чаши глаза выделяют ретинальный пигментный эпителий по специальной методике (N. Wang, C.A. Koutz and A.E. Andersen. A method for the isolation of the retinal pigment epithelial cells from rats Jnvest. Ophth. 1993, 34, 1, 101 - 107). Выделенные клетки подсчитываются и в концентрации 9,1 - 9,6•102 клеток в объеме 0,2 мл среды вводят в полость стекловидного тела второго глаза.
2. Через ту же иглу вводят 0,1 мл естественного комплекса цитокинов (ЕКЦ), гомологичных, полученных по методике Ганковской Л.В. и др. в концентрации 40 мкг (Ганковская Л.В., Ковальчук Л.В., Гвоздева Н.А. Способ приготовления цитокинов, ингибирутощих миграцию нейтрофилов и макрофагов). Сертификат на авторск. свидет. N 1494274 1989, Москва; КОВАЛЬЧУК Л.В. и др., NATURAL COMPLEX OF CYTOCIN. OCULAR PHARMOCOL INTER, 1996, v. 12, N 3, p. 271-279.
3. Через эту же иглу вводят 0,1 мл плазменного фибронектина в концентрации 0,5 мкг. Фибронектин представляет адгезивный белок, усиливающий клеточную агрегацию, играющий информационную роль в процессах фибриллогенеза.
Предложенный способ применен в эксперименте на 11 кроликах. У всех экспериментальных животных получен идентичный результат - формирование ПВР, подтвержденное гистологическим исследованием.
После эксперимента клиническое наблюдение проводилось в течение 1 - 3 месяцев. Через 1 - 3 месяца животные забивались. Глаза энуклеировались, фиксировались в 10% нейтральном формалине и подвергались гистологическому исследованию. После фиксации глаза разрезались на 3 части, центральную, захватывающую область воронки зрительного нерва и двух боковых. Центральная часть обезвоживалась в спиртах восходящей концентрации и заливалась в парафин. Парафиновые срезы окрашивались гематоксилин-эозином и по Ван - Гизону. Клинически после введения трех компонентов в глаз экспериментальных животных в первые три дня отмечалась небольшая перикорнеальная инъекция, легкий мидриаз, в стекловидном теле выявлялись интенсивная плавающая взвесь, уплотнение периферической зоны стекловидного тела. Через месяц при исследовании глазного дна на внутренней поверхности сетчатки, чаще вблизи диска зрительного нерва, формировались тяжи, под которыми верифицировалась отслойка сетчатки.
Морфологически основные изменения локализовались в заднем отрезке глаза, где на внутренней поверхности сетчатки формировалась эпиретинальная мембрана, под которой выявлялась складчатость сетчатки, очаговая ее отслойка.
В формировании мембраны принимали участие пролиферирующие клетки РПЭ, глиальные клетки. Помимо пролиферирующих клеток в полости стекловидного тела отмечалось скопление экссудата из макрофагов, оседающих на внутренней поверхности сетчатки. То есть у 11 животных развивалась картина ПВР в ответ на введение трех компонентов, индуцирующих воспалительно-пролиферативный процесс.
Пример 1.
Кролик 41. Под общим обезболиванием проведена энуклеация левого глаза, из РПЭ которого приготовлена взвесь, содержащая 9,1 - 9,6•102 клеток в 0,2 мл среды (8 - 9 клеток в поле зрения). Через эту же иглу введено 0,1 мл ЕКЦ - комплекса гомологичных цитокинов (40 мкг) и 0,1 мл плазменного фибронектина в концентрации 5 мкг. Для профилактики гипертензионного синдрома произведено предварительное отсасывание стекловидного тела (0,1 мл) и парацентез. В послеоперационном периоде, в первые дни, сохранялась смешанная инъекция глазного яблока, мидриаз, гиперемия радужки. В стекловидном теле интенсивные плавающие помутнения. В дальнейшем глаз успокоился. Через месяц в стекловидном теле формировались тяжи, складчатость сетчатки, ограниченная ее отслойка.
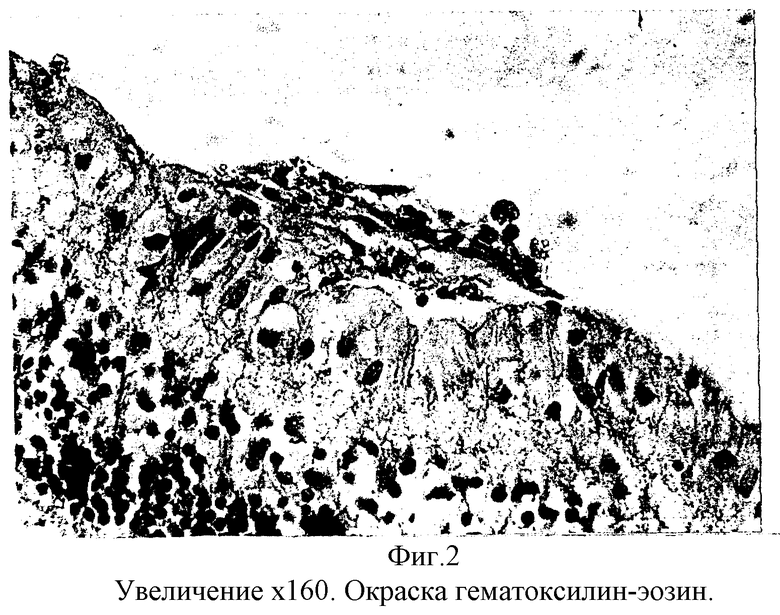
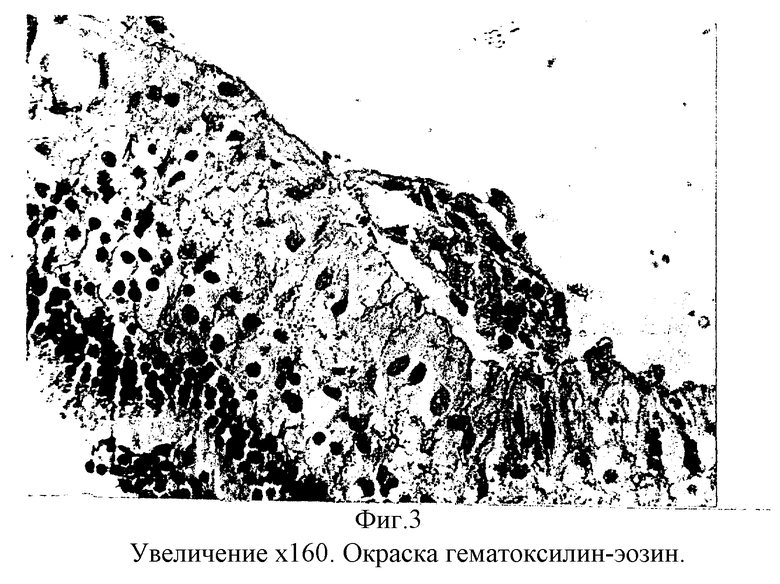
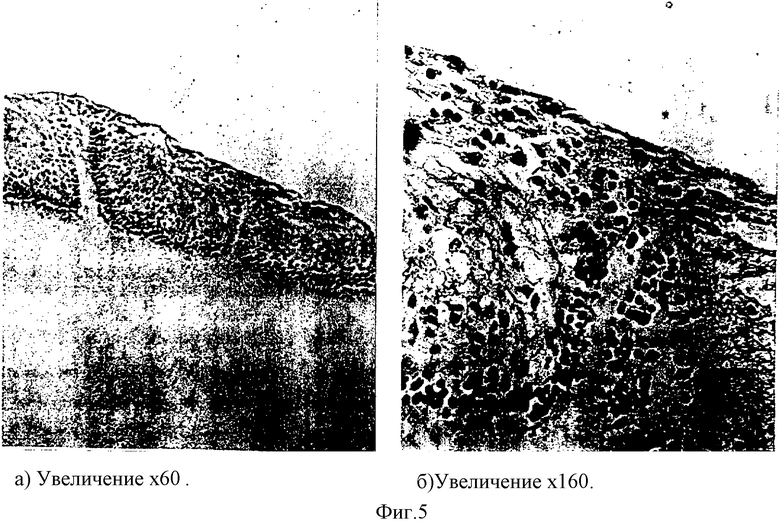
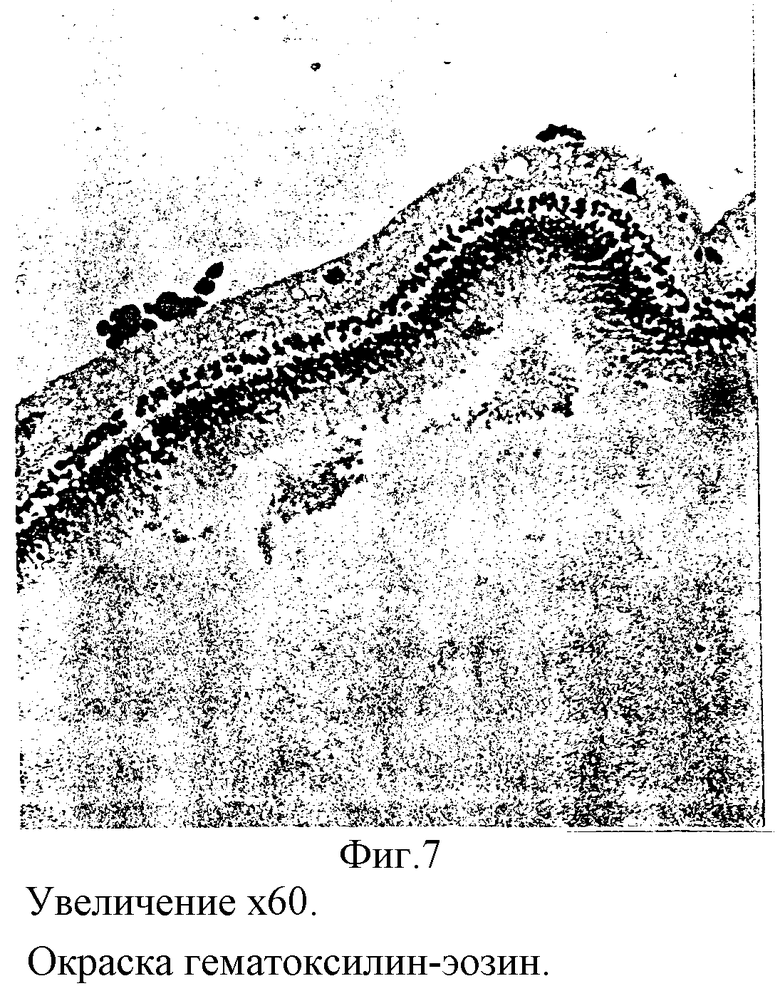
Гистологически (N протокола 801). Роговица не изменена. В радужке - новообразованные сосуды. В стекловидном теле вблизи внутренней поверхности сетчатки - скопление клеток воспалительной инфильтрации лимфоцитов и макрофагов, уплотнение мембранных структур кортикальных слоев стекловидного тела. На периферии сетчатки отмечалась адсорбция клеток РПЭ, а также макрофагов и лимфоцитов на внутренней пограничной мембране сетчатки. В заднем отделе глаза множественные очаги ПВР, под которыми выявлялась зона разрушения внутренней пограничной мембраны, пролиферация клеток РПЭ, приобретающих веретеновидную форму с пигментными гранулами в цитоплазме (фиг. 2, 3). Встречались очаги продвинутой ПВР, где в пролиферате наряду с клеточными элементами определялись волокнистые структуры (фиг. 4).
Контрактильные свойства в новообразованной эпиретинальной мембране проявлялись в формировании складок и очагов отслоенной сетчатки (фиг. 5 а, б).
Патогистологический диагноз: Пролиферативная витреоретинопатия. Ограниченная отслойка сетчатки.
В качестве контроля мы использовали экспериментальные модели, где испытали роль отдельных компонентов, применяемых в трехкомпонентной модели. Основным критерием для оценки появления пролиферативной витреоретинопатии была в этих экспериментах также клинико-морфологическая характеристика.
Было выполнено три серии экспериментов (23 кролика).
I серия (15 кроликов - 15 глаз) с введением в полость стекловидного тела взвеси аутологичных клеток РПЭ.
II серия (6 кроликов - 12 глаз) с введением в полость стоповидного тела ЕКЦ в дозах 0,1, 0,2, 0,3 мл.
III серия (2 кролика - 4 глаза) с введением в полость стекловидного тела 0,1 мл плазменного фибронектина на фосфатном буфере в концентрации 5 мкг в 0,1 мл.
I серия. Введение взвеси аутологичных клеток РПЭ.
Получение взвеси аутологичных клеток РПЭ проведено по той же методике, что и в трехкомпонентной модели. Инъекции клеток в оставшийся правый глаз проводилась через плоскую часть цилиарного тела объемом 0,2 мл. Проводилось клиническое исследование в динамике. Глаз за весь период наблюдения оставался спокойным. Основные изменения локализовались в стекловидном теле, а также на глазном дне, выявляемые при офтальмоскопии. В первые дни наблюдалась взвесь суспензии пигментных клеток, которая закрывала диск зрительного нерва и оседала на поверхности сетчатки в виде конгломератов. В стекловидном теле отмечались помутнения в виде тяжей и вуалеподобных взвесей. Через 1,5 - 2 месяца наблюдалась стабилизация процесса. Складок сетчатки и преретинальных шварт не наблюдалось. При гистологическом исследовании в ранние сроки (8 - 9 дней) после введения взвеси аутологичных клеток отмечались небольшие реактивные воспалительные явления в глазу, которые характеризовались появлением в стекловидном теле, преимущественно в преретинальной зоне, клеток воспалительной инфильтрации, состоящей из лимфоцитов и макрофагов. Отмечались скопления клеток РПЭ на внутренней пограничной мембране сетчатки. Такие же скопления РПЭ наблюдались через 1,5 - 2 месяца. В стекловидном теле в этот период наблюдалось уплотнение за счет формирования конгломератов из фибриллей.
Таким образом, для модели с интравитреальным введением аутоклеток РПЭ было характерно оседание и прикрепление на внутренней пограничной мембране сетчатки жизнеспособных клеток РПЭ. Одновременно наблюдались изменения в стекловидном теле, которые выражались в формировании плотных волокнистых структур, имеющих преретинальное расположение, что видимо связано с накоплением фибронектина, продуцируемого клетками РПЭ. Активных пролиферативных процессов в сетчатке с разрастанием эпиретинальных мембран в модели, где вводились только клетки РПЭ, не наблюдалось.
Пример 2.
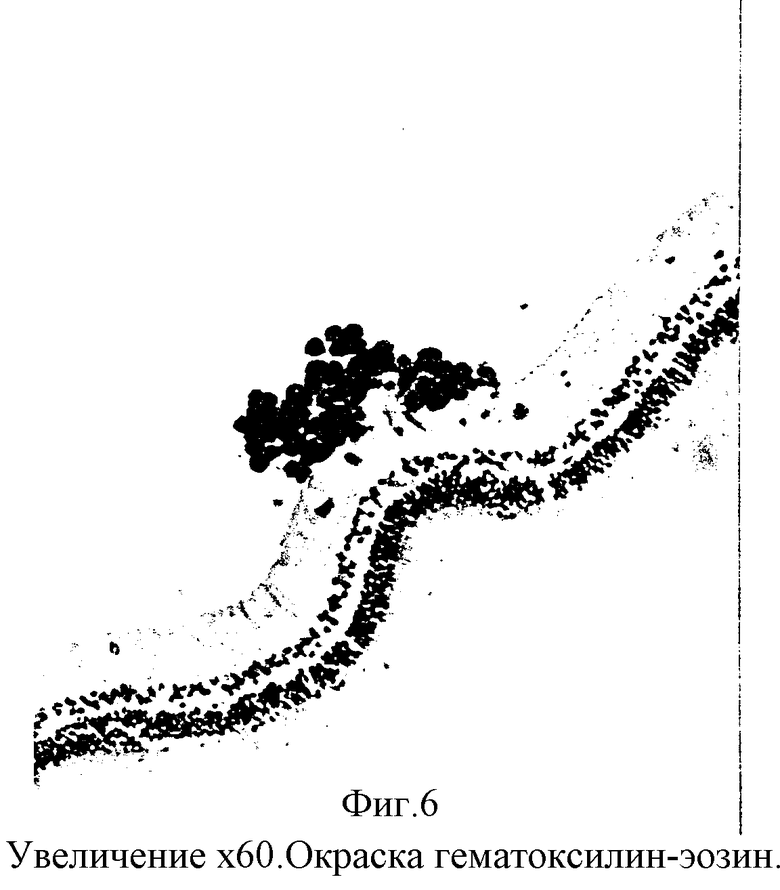
Кролик 12. В правый глаз введена взвесь аутоклеток РПЭ в концентрации 9,5•102 в 0,2 мл среды. Через 7 дней в стекловидном теле выявлялась взвесь пигментных клеток, закрывающих область диска зрительного нерва. Через месяц в стекловидном теле сформировались фиксированные тяжи и взвеси из пигментных скоплений. Складчатости, отслойки сетчатки не выявлялось. Рефлекс с глазного дна был розовый. Энуклеация через 1 месяц. При морфологическом исследовании на внутренней поверхности сетчатки обнаружены клетки РПЭ в виде скоплений и рассеянные клетки, прикрепленные к внутренней пограничной мембране сетчатки (фиг. 6, 7).
В стекловидном теле выявлены грубые фибриллярные структуры, вызывающие уплотнение стекловидного тела.
Эпиретинальных мембран не наблюдалось.
II серия. Введение в полость стекловидного тела ЕКЦ в дозе 0,1 мл, 0,2 мл, 0,3 мл.
Клинически на следующий день после введения ЕКЦ наблюдали небольшую ригидность зрачка и расширение перикорнеальных сосудов. В стекловидном теле появлялись плавающие помутнения, которые постепенно рассасывались в течение последующих дней. К 30 дню рефлекс с глазного дна был розовым. В области воронки определялись фиксированные помутнения.
В морфогенезе цитокиновой модели большое значение имело накопление в стекловидном теле макрофагов и лимфоцитов, аттрактируемых из кровяного русла. Отмечалось формирование конгломератов из макрофагов и лимфоцитов, адсорбируемых на внутренней пограничной мембране сетчатки. Однако степень их накопления и конгломерация зависели от дозы цитокинов и от их гомологичности. То есть реакция глаза на введение ЕКЦ в полость стекловидного тела имела дозозависимый характер. Мы вводили ЕКЦ в дозе 0,1 мл (40 мкг) кроличьего происхождения, близкую к естественной, которая вызывала небольшое накопление макрофагов и лимфоцитов в стекловидном теле, без активной конгломерации. В данной дозе в эксперименте мы получили лишь небольшой воспалительный ответ, без развития ПВР.
Большие дозы 0,2 - 0,3 мл оказывали более выраженную воспалительную реакцию.
Пример 3.
Кролик 23. В полость стекловидного тела вводилось 0,1 мл кроличьего ЕКЦ через плоскую часть цилиарного тела. В первые три дня после эксперимента отмечались расширение перикорнеальных сосудов, ригидность зрачка. В стекловидном теле выявляли плавающие и фиксированные помутнения. В дальнейшем в течение месяца помутнения частично рассосались и к концу месяца вблизи диска зрительного нерва выявляли фиксированные помутнения в стекловидном теле. Складчатости сетчатки не наблюдалось.
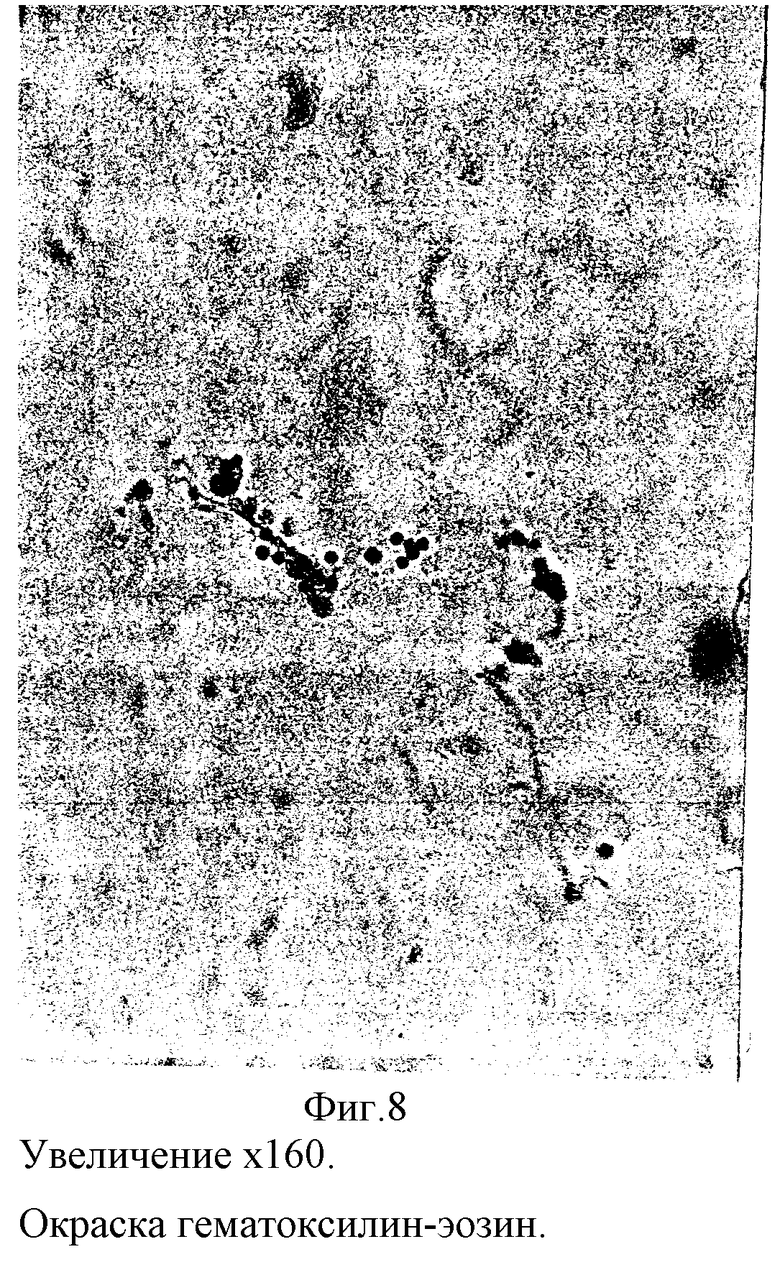
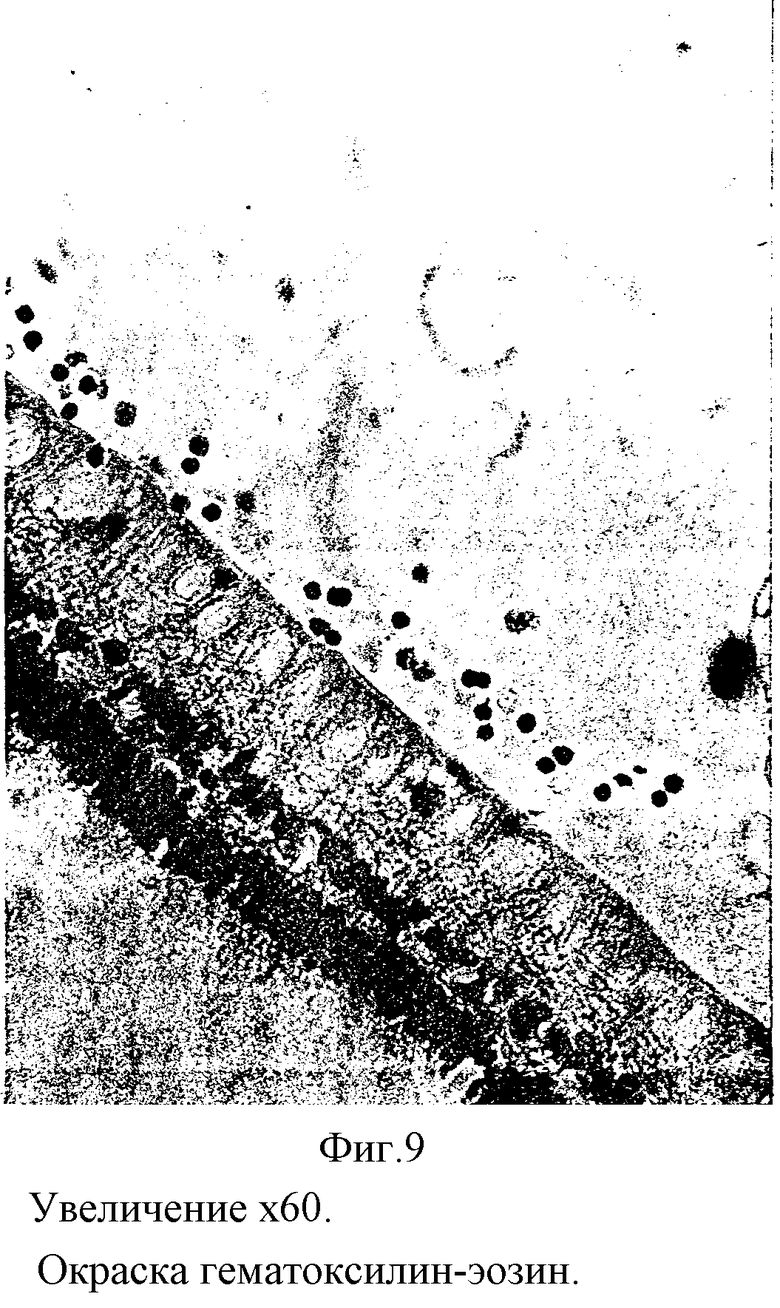
Гистологически (N протокола 752) сетчатка была сохранной, прилежала. В стекловидном теле выявлялись грубые фибриллярные структуры, на которых адсорбировались макрофаги и лимфоциты (фиг. 8). На внутренней поверхности сетчатки отмечались небольшие скопления из макрофагов и лимфоцитов. Некоторые клеточные элементы оседали на внутренней пограничной мембране (фиг. 9). Эпиретинальных мембран не наблюдалось.
III серия. Введение ФИБРОНЕКТИНА в полость стекловидного тела (2 кролика - 4 глаза).
В стекловидное тело через плоскую часть цилиарного тела вводился плазменный фибронектин в дозе 0,1 мл в концентрации 5 мкг. Клинически особых изменений в стекловидном теле не выявлено. Лишь к 30 дню определялось небольшое огрубение стекловидного тела. Забой животных осуществлялся через месяц, глаза энуклеировались и гистологически исследованы. Морфологически сетчатка была сохранной, прилежала. В стекловидном теле формировались грубые фибриллярные структуры, состоящие из конгломератов фибриллей в кортикальных слоях стекловидного тела и в области воронки зрительного нерва. Эпиретинальных мембран не наблюдалось.
Таким образом, отдельные компоненты нашей модели не вызвали формирования эпиретинальных мембран, что показано в приведенных экспериментально-морфологических исследованиях. Только одномоментное введение всех трех компонентов вызывало развитие ПВР у всех экспериментальных животных. Действующие компоненты модели активировали патогенетические механизмы не только путем индуцирования патологических изменений, но и путем взаимодействия этих компонентов между собой, в частности клеток РПЭ, макрофагов и фибронектина. Весь этот комплекс и определял закономерное возникновение пролиферативных процессов в сетчатке в виде ПВР при моделировании.
Следует подчеркнуть, что в данной модели все компоненты носили аутологичный и гомологичный характер, что приближало данную модель к естественному процессу в клинике.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ПРОЛИФЕРАТИВНОЙ ВИТРЕОРЕТИНОПАТИИ | 1999 |
|
RU2175223C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПРОЛИФЕРАТИВНОЙ ВИТРЕОРЕТИНОПАТИИ | 2014 |
|
RU2568368C1 |
| Способ лечения пролиферативных процессов заднего отрезка глаза | 2018 |
|
RU2684927C1 |
| Способ лечения пролиферативной витреоретинопатии с помощью мелфалана, ассоциированного с липосомами, в эксперименте | 2021 |
|
RU2772520C1 |
| СПОСОБ ЛЕЧЕНИЯ РЕЦИДИВА ОТСЛОЙКИ СЕТЧАТКИ | 2001 |
|
RU2192822C1 |
| СПОСОБ ДИАСКЛЕРАЛЬНОГО УДАЛЕНИЯ ВНУТРИГЛАЗНЫХ ИНОРОДНЫХ ТЕЛ | 2002 |
|
RU2223076C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПРОЛИФЕРАТИВНОЙ ВИТРЕОРЕТИНОПАТИИ У КРЫС | 2014 |
|
RU2558991C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭНДОФТАЛЬМИТОВ | 1998 |
|
RU2164115C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПРОЛИФЕРАТИВНОЙ ВИТРЕОРЕТИНОПАТИИ У КРЫС | 2014 |
|
RU2563368C1 |
| СПОСОБ ОЦЕНКИ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ ЦИТОКИНОВ | 1999 |
|
RU2150113C1 |

Изобретение относится к экспериментальной офтальмологии и предназначено для получения экспериментальной модели пролиферативной витреоретинопатии, необходимой для разработки методов профилактики и лечения этой патологии. Вводят в полость стекловидного тела биологические субстраты, активирующие клеточную пролиферацию. В качестве биологических субстратов используют смесь, состоящую из трех компонентов. Первый компонент - аутологичные клетки ретинального пигментного эпителия глаза кролика (в количестве 9,1 - 9,6 • 102 клеток в 0,2 мл среды). Второй компонент - естественный комплекс гомологичных цитокинов, продуцируемых лимфоцитами (объемом 0,1 мл в концентрации 40 мкг). Третий компонент - плазменный фибронектин (объемом 0,1 мл в концентрации 0,5 мкг). Способ позволяет получить адекватную модель пролиферативной витреоретинопатии. 9 ил.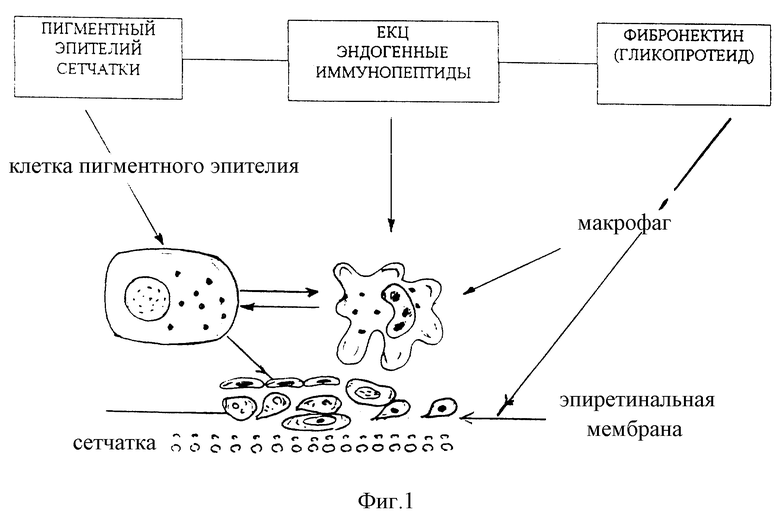
Способ моделирования пролиферативной витреоретинопатии, включающий введение в стекловидное тело биологического субстрата, активирующего клеточную пролиферацию, отличающийся тем, что в качестве биологического субстрата используют смесь аутологичных клеток ретинального пигментного эпителия в количестве 9,1 - 9,6 х 102 клеток в 0,2 мл среды, естественного комплекса гомологичных цитокинов, продуцируемых лимфоцитами периферической крови объемом 0,1 мл в концентрации 40 мкг и гомологичного плазменного фибронектина объемом 0,1 мл в концентрации 0,5 мкг.
| B.M.Martini, Proliferative VITREO-RETINAL DISORDERS: EXPERIMENTAL MODELS IN VITRO AND IN VIVO | |||
| ACTA OPHTHALMOLOGICA, STOCKHOLM, SCRIPTOR, 1992, v.70, Suppl.201 | |||
| P.WIEDEMANN, M.WELLER, THE PATHOPHYSIOLOGY OF PROLIFERATIVE VITREORETINOPATHY | |||
| ACTA OPHTHALMOLOGICA, Suppl.189, 1989 | |||
| КРАЙНОВА Т.А | |||
| Регуляция раневого процесса в роговице естественным комплексом цитокинов: Автореф.к.м.н | |||
| - М., 1994, с.8-12. |
Авторы
Даты
2000-12-27—Публикация
1998-10-20—Подача