Настоящая патентная заявка является частичным продолжением одновременно рассматриваемой заявки рег. N 08/404833, поданной 15 марта 1995, которая, в свою очередь, является частичным продолжением одновременно рассматриваемой заявки рег. N 08/267092, поданной 28 июня 1994.
Предпосылки создания изобретения
По предварительным данным, в 1994 г. в США, число диагностированных случаев заболеваний раком предстательной железы у мужчин составляет 200000, при этом, смертность от этого заболевания может составить 38000 человек (Garnick, М.В. (1994) The Dilemmas of Prostate Cancer. Scientific American, April: 72-81). Таким образом, рак предстательной железы является одним из наиболее часто диагностируемых раковых заболеваний (помимо рака кожи) у мужчин в США, и занимает второе место по смертности от рака (после рака легких).
Простатический антиген (PSA) представляет собой одноцепочечный гликопротеин в 33 кДа, который почти исключительно продуцируется эпителием предстательной железы человека, и присутствует в сперме человека в количестве от 0,5 до 2,0 мг/мл (Nadji, М., Taber, S.Z., Castro, A., et al. (1981) Cancer 48: 1229; Papsidero, L., Kuriyama, M., Wang, M. et al. (1981). JNCI 66:37; Qui, S.D., Young, C.Y.F., Bihartz, D.L., (1990), J. Urol. 144:1550; Wang, M. C. , Valenzuela, L.A., Murphy, G.P., et al. (1979), Invest. Urol. 17:159). В этом гликопротеине имеется одна углеводная единица, которая присоединена к остатку аспарагина 45, и которая составляет 2 - 3 кДа от общей молекулярной массы. PSA представляет собой протеазу с химотрипсинподобной специфичностью (Christensson, A. , Laurell, C.B., Lilja, Н. (1990). Eur. J. Biochem. 194: 755-763). Было показано, что PSA является ответственным, главным образом, за растворение гелевой структуры, образующейся при эякуляции, путем протеолиза основных (мажорных) белков, содержащихся в геле спермы, например, таких, как семеногелин I и семеногелин II, и фибронектин (Lilja, Н. (1985). J. Clin. Invest. 76: 1899; Lilja, H., Oldbring, J., Rannevik, G., et al. (1987). J. Clin. Invest. 80:281; McGee. R.S., Herr, J.C. (1988). Biol. Reprod. 39:499). PSA-опосредованный протеолиз гелеобразующих белков способствует образованию нескольких растворимых фрагментов семеногелина I и семеногелина II и растворимых фрагментов фибронектина с разжижением эякулята и высвобождением все более подвижных сперматозоидов (Lilja, Н., Laurell, C.B. (1984), Scand. J. Glin. Lab. Invest. 44: 447; McGee, R.S. Herr, J.C. (1987); Biol. Reprod. 37: 431). Кроме того, простатический антиген (PSA) обладает способностью к протеолитическому расщеплению IGFBP-3 (белка, связывающегося с инсулиноподобным фактором роста), что позволяет IGF (инсулиноподобному фактору роста) специфически стимулировать рост PSA-секретирующих клеток (Cohen et al., (1992) J. Clin. Endo. & Meta., 75: 1046-1053).
Преобладающей молекулярной формой сывороточного PSA является комплекс, образованный PSA с альфа 1-антихимотрипсином, и составляющий до 95% от всего обнаруживаемого сывороточного PSA (Christensson, A., Bjork, Т., Nilsson, 0., et. al. (1993). J. Uro. 150: 100-105; Lilja, H., Christensson, A., Danlen, U. (1991). Clin. Chem. 37: 1618-1625; Stenman, U.H., Leinoven, J., Alfthan, H. , et. al. (1991). Cancer Res. 51: 222-226). Ткань предстательной железы (нормальная ткань, доброкачественная гиперпластическая ткань и злокачественная ткань) высвобождает преимущественно зрелую ферментативно активную форму PSA, поскольку такая форма необходима для образования комплекса с альфа 1-антихимотрипсином (Mast, A. E., Enghild, T. J., Pizzo, S.V., et. al. (1991), Biochemistry 30: 1723-1730; Perlmutter, D.H., Glover, G.I., Rivetna, M. , et. al. (1990). Proc. Natl. Acad. Sci. USA 87: 3753-3757). Поэтому в микроокружении PSA-секретирующих клеток предстательной железы PSA, очевидно, процессируется и секретируется в своей зрелой ферментативно активной форме, не конъюгированной с какой-либо ингибирующей молекулой. PSA также образует стабильные комплексы с альфа 2-макроглобулином, но, поскольку это приводит к инкапсуляции PSA и полной потери PSA-эпитопов, то смысл in vivo-образования такого комплекса пока не ясен. Свободная неконъюгированная форма PSA составляет минорную фракцию сывороточного PSA (Christensson, A., Bjork, Т., Nilsson, 0., et. al. (1993). J. Urol. 150: 100-150; Lilja, H., Christensson, A. , Dahlen, U. (1991) Clin. Chem. 37: 1618-1625). Размер этой формы сывороточной PSA аналогичен размеру формы PSA, присутствующей в семенной жидкости (Lilja, H. , Christensson, A. , Dahlen, U. (1991) Clin. Chem. 37: 1618-1625), однако пока неизвестно, может ли свободная форма сывороточного PSA быть зимогеном; внутренне гидролизованной неактивной формой зрелого PSA; или PSA, обладающим ферментативной активностью. Однако представляется маловероятным, что свободная форма сывороточного PSA обладает ферментативной активностью, поскольку присутствующий в сыворотке молярный избыток обоих непрореагировавших альфа 1-антихимотрипсина и альфа 2-макроглобулина значительно превышает (в 100-1000) раз детектируемые сывороточные уровни свободной 33 кДа-формы PSA (Christensson, A., Bjork, T., Nilsson, O., et. al. (1993). J. Urol. 150: 100-105; Lilja, H., Christensson, A., Danlen, U. (1991). Clin. Chem. 37: 1618-1625).
Измерение уровней PSA в сыворотке может оказаться полезным при наблюдении за развитием аденокарциномы предстательной железы (Duffy, M.S. (1989). Ann. Clin. Biochem. 26: 379-387; Brawer, M.K. & Lange, P.H. (1989), Urol. Suppl. 5: 11-16; Hara, М. & Kimura, Н. (1989), J. Lab. Clin. Med. 113: 541-548), хотя по имеющимся данным, повышение концентрации PSA в сыворотке наблюдается также при доброкачественной гиперплазии предстательной железы и после хирургической операции на предстательной железе (Lilja, Н., Christensson, A., Dahlen, U. (1991). Clin. Chem. 37: 1617-1625). Кроме того, известно, что метастазы предстательной железы секретируют иммунореактивный PSA, так как у пациентов с удаленной предстательной железой и с распространенными метастазами рака предстательной железы обнаруживаются высокие уровни сывороточного PSA (Ford, T.F., Butcher, D.N., Masters, R.W., et. al. (1985). Brit. J. Urology 57: 50-55). Поэтому цитотоксическое соединение, которое активируется посредством протеолитической активности PSA, должно быть специфическим к клеткам предстательной железы, а также к PSA-секретирующим метастазам предстательной железы.
В соответствии с этим, целью настоящего изобретения является получение новых олигопептидов, которые селективно и ферментативно расщепляются активным свободным простатическим антигеном (PSA).
Другой целью настоящего изобретения является разработка количественного анализа на ферментативную активность PSA с использованием новых олигопептидов.
Следующей целью настоящего изобретения является получение новой противораковой композиции, которая может быть использована для лечения рака предстательной железы, и которая включает в себя новые олигопептиды, конъюгированные с цитотоксическим агентом. Еще одной целью настоящего изобретения является обеспечение способа лечения рака предстательной железы, предусматривающего введение новой противораковой композиции.
Краткое описание изобретения
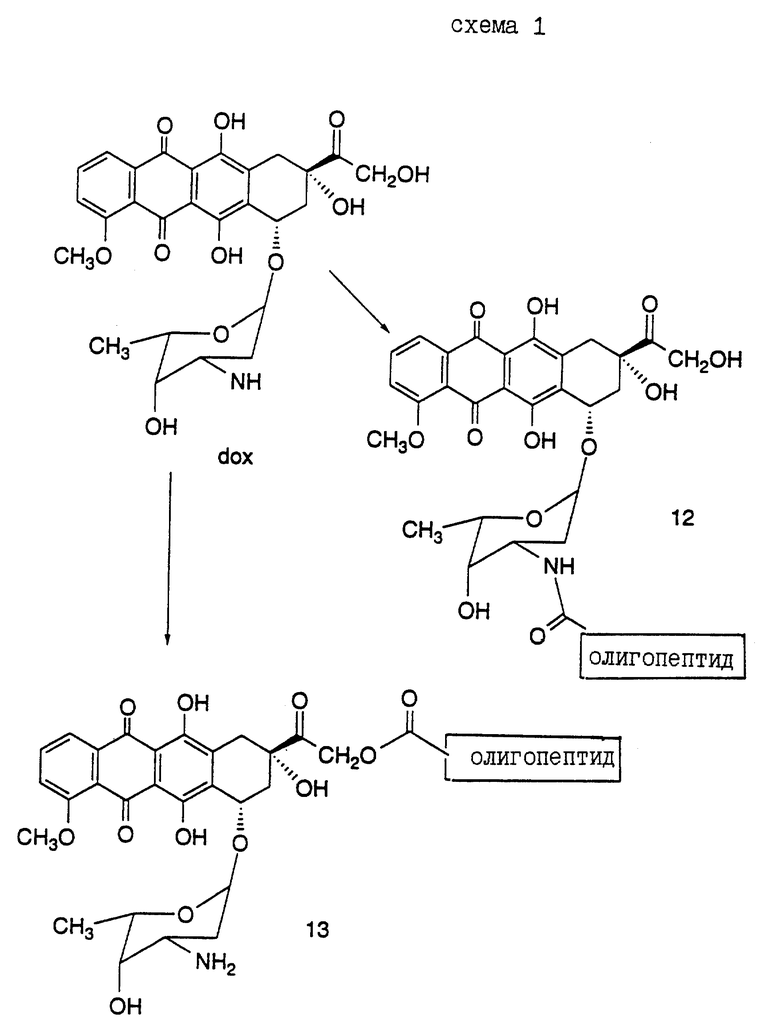
Было идентифицировано несколько сайтов расщепления, в которых семеногелин I селективно протеолитически гидролизуется свободным PSA. Описываются олигопептиды, имеющие аминокислотные последовательности, которые распознаются и протеолитически расщепляются свободным простатическим антигеном (PSA). Такие олигопептиды могут быть использованы в анализах in vivo и in vitro для определения протеазной активности свободного простатического антигена (PSA). Кроме того, указанные олигопептиды могут быть включены в терапевтические средства, которые содержат конъюгаты этих олигопептидов и известные цитотоксические агенты, и которые могут быть использованы для лечения рака предстательной железы.
Краткое описание рисунков
Фиг. 1a и 1b. Первичная аминокислотная последовательность семеногелина I.
Показана первичная аминокислотная последовательность семеногелина I (SEQ ID N 1). Показаны также сайты протеолитического расщепления ("CS") простатическим антигеном (пронумерованные в соответствии с относительной аффинностью сайта по отношению к PSA-гидролизу), при этом фрагменты белка пронумерованы начиная от аминоконца.
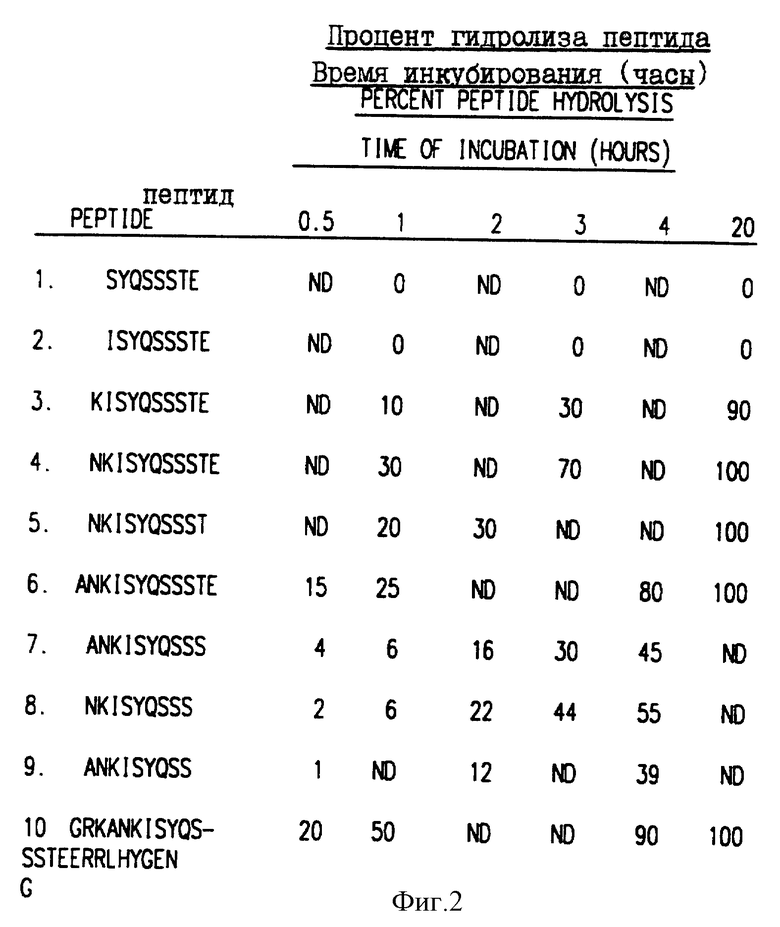
Фиг. 2. Аффинность в отношении гидролиза синтетических олигопептидов.
Было получено гнездовое множество синтетических олигопептидов, и эти олигопептиды были подвергнуты гидролизу ферментативно активным свободным PSA в течение различных промежутков времени. Полученные результаты представлены в виде таблицы (ND = не определяли). Для обозначения аминокислот был использован однобуквенный код, где A=Ala, E=Glu, G=Gly, H=His, I=Ile, K=Lys, L= Leu, N=Asn, Q=Gln, P=pro, S=Ser, T=Thr, Y=Tyr.
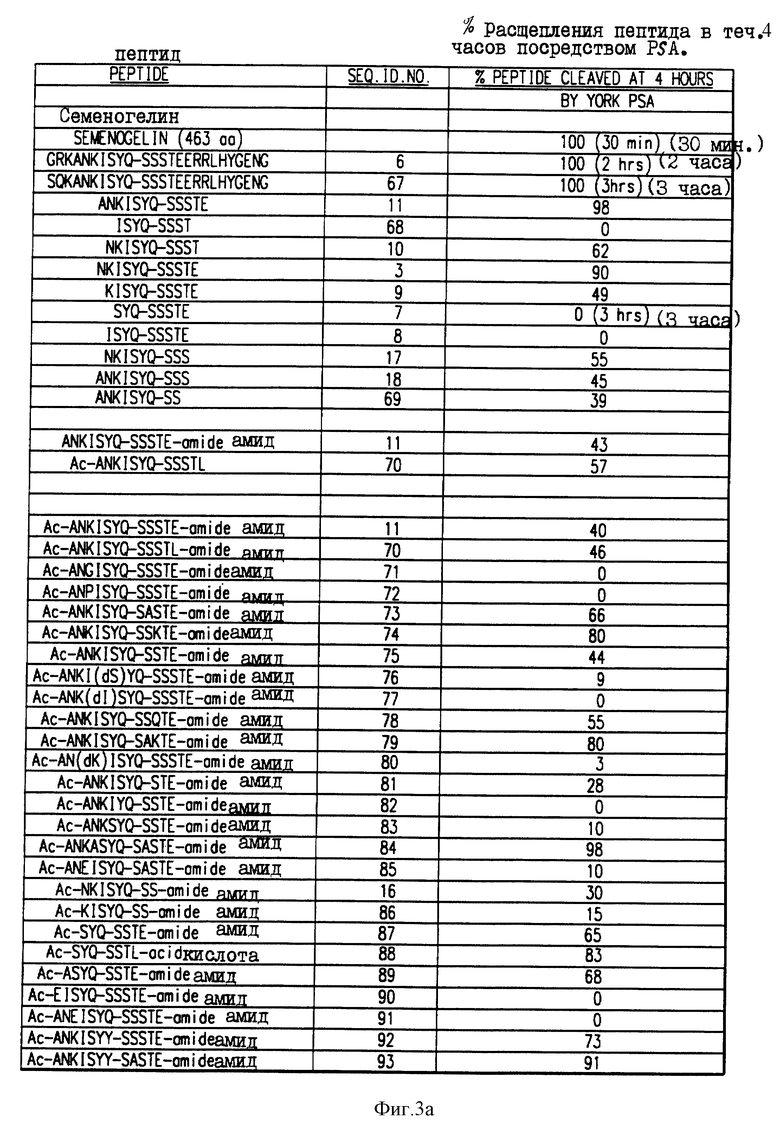
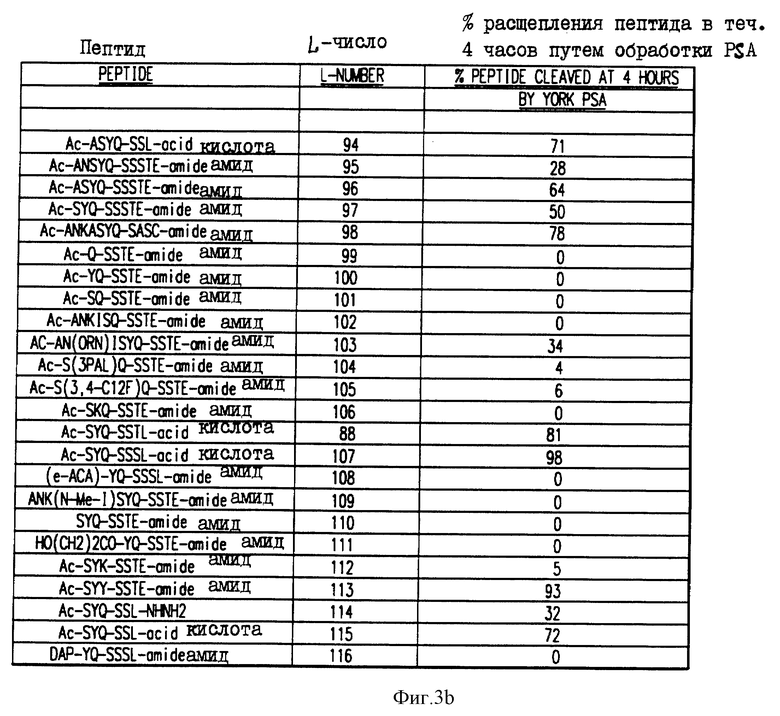
Фиг. 3a и 3b. Аффинность в отношении гидролиза синтетических олигопептидов.
Получали синтетические олигопептиды, которые были подвергнуты гидролизу ферментативно активным PSA в течение четырех (4) часов. На фиг. 3 приводится процент олигопептида, гидролизованного за этот период времени.
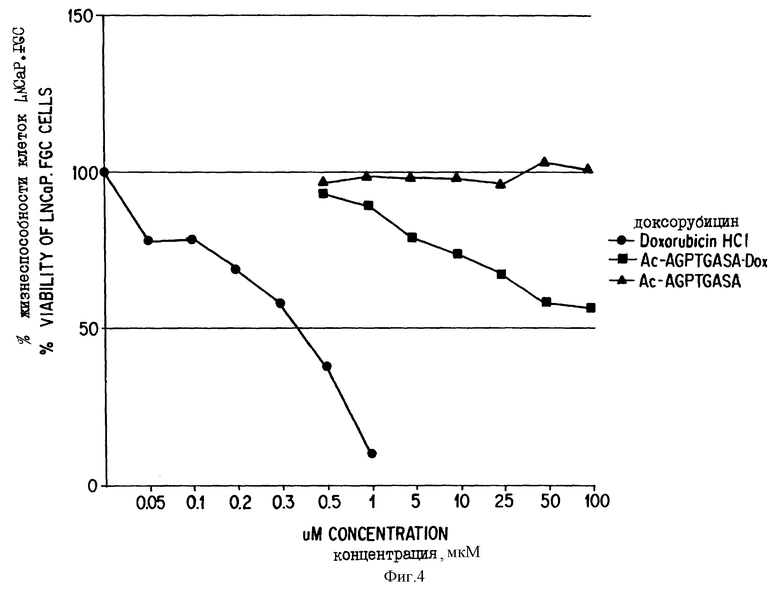
Фиг. 4. Данные о цитотоксичности нерасщепляемых конъюгатов "олигопептид - доксорубицин".
Данные, представленные на фиг. 4, иллюстрируют сравнительную цитотоксичность доксорубицина и конъюгата доксорубицина, ковалентно связанного с олигопептидом (Соединение 12b), который не содержит сайта протеолитического расщепления простатическим агентом. IC50 для доксорубицина составляет 0,3 мкМ, тогда как доксорубицин, модифицированный ацетилированным олигопептидом, имеет более чем в 300 раз меньший IC50. Этот конъюгат не имеет ВЭЖХ-обнаруживаемых примесей немодифицированного доксорубицина. Олигопептид, взятый отдельно, не обладает заметной цитотоксической активностью.
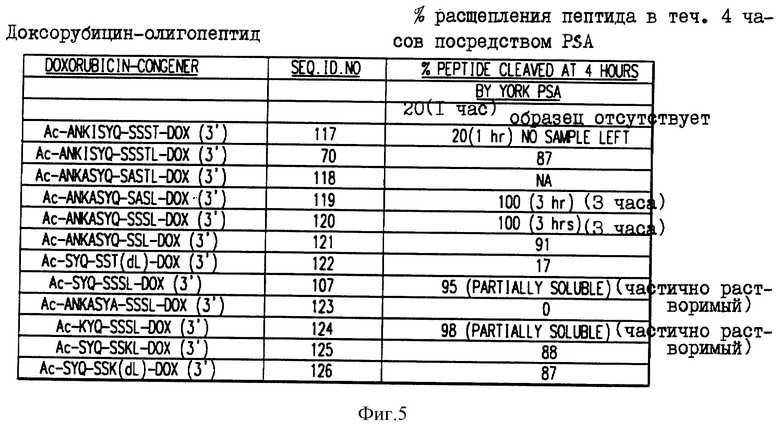
Фиг. 5. Аффинность in vitro-расщепления свободным PSA олигопептидов, конъюгированных с доксорубицином.
Получали конъюгаты олигопептидов с доксорубицином и эти конъюгаты подвергали гидролизу ферментативно активным свободным PSA в течение четырех (4) часов. На рисунке приводится процент конъюгата, ферментативно расщепляемого в олигопептиде за этот период времени.
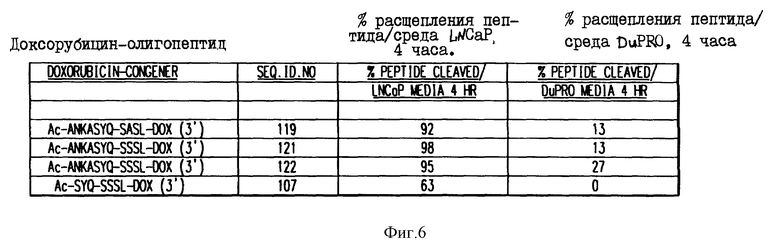
Фиг. 6. Аффинность расщепления олигопептидов, конъюгированных с доксорубицином, в кондиционированной клетками среде.
Конъюгаты олигопептидов с доксорубицином подвергали реакции в течение четырех (4) часов с культуральной средой, кондиционированной клетками LNCaP (которые, как известно, секретируют свободный PSA) или клетками DuPRO (которые не секретируют свободный PSA). На фиг. 6 приводится процент конъюгата, гидролизованного в олигопептиде за этот период времени.
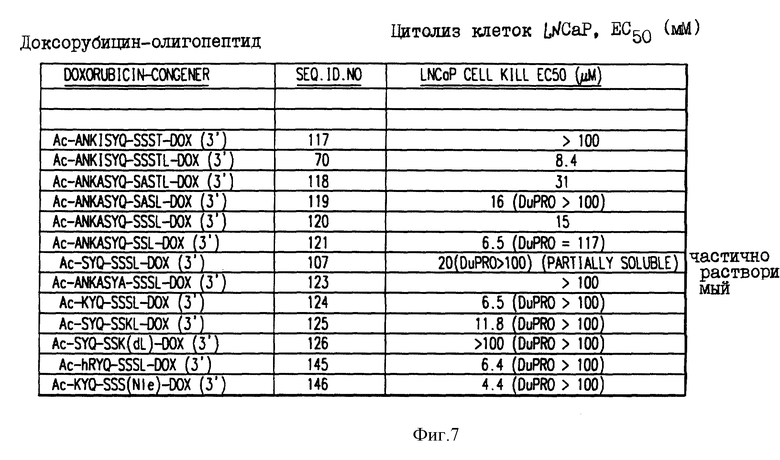
Фиг. 7. Данные о цитотоксичности гидролизованных конъюгатов олигопептида и доксорубицина.
Данные, представленные на фиг. 7, иллюстрируют цитотоксичность (IC50) доксорубицина, ковалентно связанного с олигопептидом, содержащим сайт протеолитического расщепления свободным PSA, направленную против раковой клеточной линии, которая, как известно, секретирует свободный PSA. Для некоторых конъюгатов показано также, что они обладают цитотоксичностью против клеточной линии (DuPRO), которая не секретирует свободный PSA.
Подробное описание изобретения
Настоящее изобретение относится к новым олигопептидам, которые специфически распознаются свободным простатическим антигеном (PSA), и которые могут быть протеолитически гидролизованы благодаря ферментативной активности свободного про статического антигена. Такими олигопептидами являются олигомеры, имеющие аминокислотную последовательность, выбранную из следующих последовательностей:
a) AsnLysIleSerTyrGln 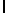 Ser (SEQ ID N 13),
Ser (SEQ ID N 13),
b) LysIleSerTyrGln 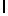 Ser (SEQ ID N 14),
Ser (SEQ ID N 14),
c) GlyGluAsnGlyValGlnLysAspValSerGlnXaaSerIleTyr 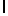 SerGln ThrGlu (SEQ ID N 15),
SerGln ThrGlu (SEQ ID N 15),
d) GlyLysGlyIleSerSerGlnTyr 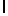 SerAsnThrGluGluArgLeu (SEQ ID No 2),
SerAsnThrGluGluArgLeu (SEQ ID No 2),
e) AsnLysIleSerTyrTyr 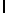 Ser (SEQ ID N 127),
Ser (SEQ ID N 127),
f) AsnLysAlaSerTyrGln 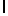 Ser (SEQ ID N 128),
Ser (SEQ ID N 128),
g) SerTyrGln 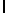 SerSer (SEQ ID N 129),
SerSer (SEQ ID N 129),
h) LysTyrGln 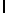 SerSer (SEQ ID N 140),
SerSer (SEQ ID N 140),
i) hArgTyrGln 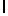 SerSer (SEQ ID N 141);
SerSer (SEQ ID N 141);
где hArg представляет собой гомоаргинин, a Xaa представляет собой любую натуральную аминокислоту.
В одном из вариантов осуществления настоящего изобретения олигопептидами являются олигомеры, имеющие аминокислотную последовательность, выбранную из следующих последовательностей:
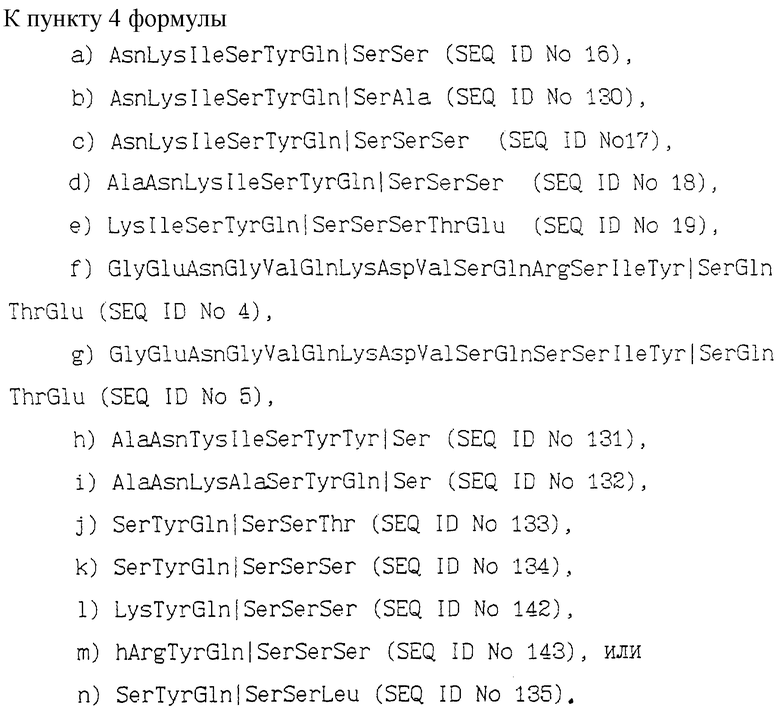
a) AsnLysIleSerTyrGln 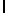 SerSer (SEQ ID N 16),
SerSer (SEQ ID N 16),
b) AsnLysIleSerTyrGln 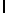 SerAla (SEQ ID N 130),
SerAla (SEQ ID N 130),
c) AsnLyslleSerTyrGln 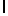 SerSerSer (SEQ ID N 17),
SerSerSer (SEQ ID N 17),
d) AlaAsnLysIleSerTyrGln 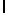 SerSerSer (SEQ ID N 18),
SerSerSer (SEQ ID N 18),
e) LysIleSerTyrGln 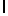 SerSerSerThrGlu (SEQ ID N 19),
SerSerSerThrGlu (SEQ ID N 19),
f) GlyGluAsnGlyValGlnLysAspValSerGlnArgSerIleTyr 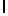 SerGln ThrGlu (SEQ ID N 4),
SerGln ThrGlu (SEQ ID N 4),
g) GlyGluAsnGlyValGlnLysAspValSerGlnSerSerIleTyr 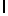 SerGln ThrGlu (SEQ ID N 5),
SerGln ThrGlu (SEQ ID N 5),
h) AlaAsnTysIleSerTyrTyr 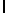 Ser (SEQ ID N 131),
Ser (SEQ ID N 131),
i) AlaAsnLysAlaSerTyrGln 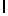 Ser (SEQ ID No 132),
Ser (SEQ ID No 132),
j) SerTyrGln 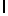 SerSerThr (SEQ ID N 133),
SerSerThr (SEQ ID N 133),
k) SerTyrGln 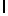 SerSerSer (SEQ ID N 134),
SerSerSer (SEQ ID N 134),
l) LysTyrGln 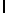 SerSerSer (SEQ ID N 142),
SerSerSer (SEQ ID N 142),
m) hArg TyrGln 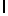 SerSerSer (SEQ ID N 143),
SerSerSer (SEQ ID N 143),
n) SerTyrGln 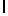 SerSerLeu (SEQ ID N 135),
SerSerLeu (SEQ ID N 135),
В более предпочтительном варианте осуществления настоящего изобретения олигопептидами являются олигомеры, имеющие аминокислотную последовательность, выбранную из следующих последовательностей:
a) AsnLysIleSerTyrGln 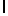 SerSerSerThr (SEQ ID N 10),
SerSerSerThr (SEQ ID N 10),
b) AlaAsnLysIleSerTyrGln 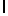 SerAla (SEQ ID N 136),
SerAla (SEQ ID N 136),
с) AsnLysLleSerTyrGln 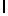 SerSerSerThrGlu (SEQ ID N 3),
SerSerSerThrGlu (SEQ ID N 3),
d) AlaAsnLysIleSerTyrGln 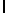 SerSerSerThrGlu (SEQ ID N 11),
SerSerSerThrGlu (SEQ ID N 11),
e) GlyGluAsnGlyValGlnLysAspValSerGlnArgSerIleTyr 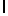 SerGln ThrGlu (SEQ ID N 4),
SerGln ThrGlu (SEQ ID N 4),
f) AlaAsnLysIleSerTyrTyr 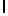 SerSer (SEQ ID N 137),
SerSer (SEQ ID N 137),
g) AlaAsnLysIleSerTyrTyr 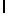 SerAla (SEQ ID N 138),
SerAla (SEQ ID N 138),
h) AlaAsnLysAlaSerTyrGln 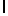 SerAla (SEQ ID N 139),
SerAla (SEQ ID N 139),
i) AlaSerTyrGln 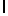 SerSerLeu (SEQ ID N 94).
SerSerLeu (SEQ ID N 94).
В еще более предпочтительном варианте осуществления настоящего изобретения олигопептидами являются олигомеры, имеющие следующую выбранную аминокислотную последовательность:
a) GlyArgLysAlaAsnLysIleSerTyrGln 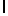 SerSerSerThrGluGluArg ArgLeuHisTyrGlyGluAsnGly (SEQ ID N 6).
SerSerSerThrGluGluArg ArgLeuHisTyrGlyGluAsnGly (SEQ ID N 6).
Используемая в настоящем подробном описании фраза "олигомеры, имеющие аминокислотную последовательность" относится к олигомерам, состоящим примерно из 6 - 100 аминокислотных остатков, и содержащим в своей аминокислотной последовательности описанную специфическую аминокислотную последовательность, которая протеолитически расщепляется свободным PSA. Так, например, олигомер GlnLeuAspAsnLysLleSerTyrGln 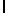 SerSerSerThrHisGlnSerSer (SEQ ID N 20) содержит аминокислотную последовательность AsnLysIleTyrGln
SerSerSerThrHisGlnSerSer (SEQ ID N 20) содержит аминокислотную последовательность AsnLysIleTyrGln 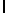 SerSerSerThr (SEQ ID N 10), а поэтому входит в объем настоящего изобретения. При этом следует отметить, что такие олигомеры не являются семеногелином I и семеногелином II. Кроме того, следует отметить, что настоящее изобретение относится также к олигомерам, где N-концевая аминокислота или C-концевая аминокислота, или обе концевые аминокислоты являются модифицированными. Такими модификациями являются, но не ограничиваются ими, ацилирование аминогруппы у N-конца и образование амидной группы для замены карбоксильной группы у C-конца. Добавление указанных групп может быть осуществлено в процессе твердофазного синтеза олигомера. Так, например, присоединение C-концевой аминокислоты к твердофазной смоле может быть осуществлено с помощью амина, который приводит к образованию амидной группы после кислотного отщепления олигомера от смолы. Таким образом, используемый выше термин "олигомеры, имеющие аминокислотную последовательность" означает следующие соединения, но не ограничивается ими:
SerSerSerThr (SEQ ID N 10), а поэтому входит в объем настоящего изобретения. При этом следует отметить, что такие олигомеры не являются семеногелином I и семеногелином II. Кроме того, следует отметить, что настоящее изобретение относится также к олигомерам, где N-концевая аминокислота или C-концевая аминокислота, или обе концевые аминокислоты являются модифицированными. Такими модификациями являются, но не ограничиваются ими, ацилирование аминогруппы у N-конца и образование амидной группы для замены карбоксильной группы у C-конца. Добавление указанных групп может быть осуществлено в процессе твердофазного синтеза олигомера. Так, например, присоединение C-концевой аминокислоты к твердофазной смоле может быть осуществлено с помощью амина, который приводит к образованию амидной группы после кислотного отщепления олигомера от смолы. Таким образом, используемый выше термин "олигомеры, имеющие аминокислотную последовательность" означает следующие соединения, но не ограничивается ими:
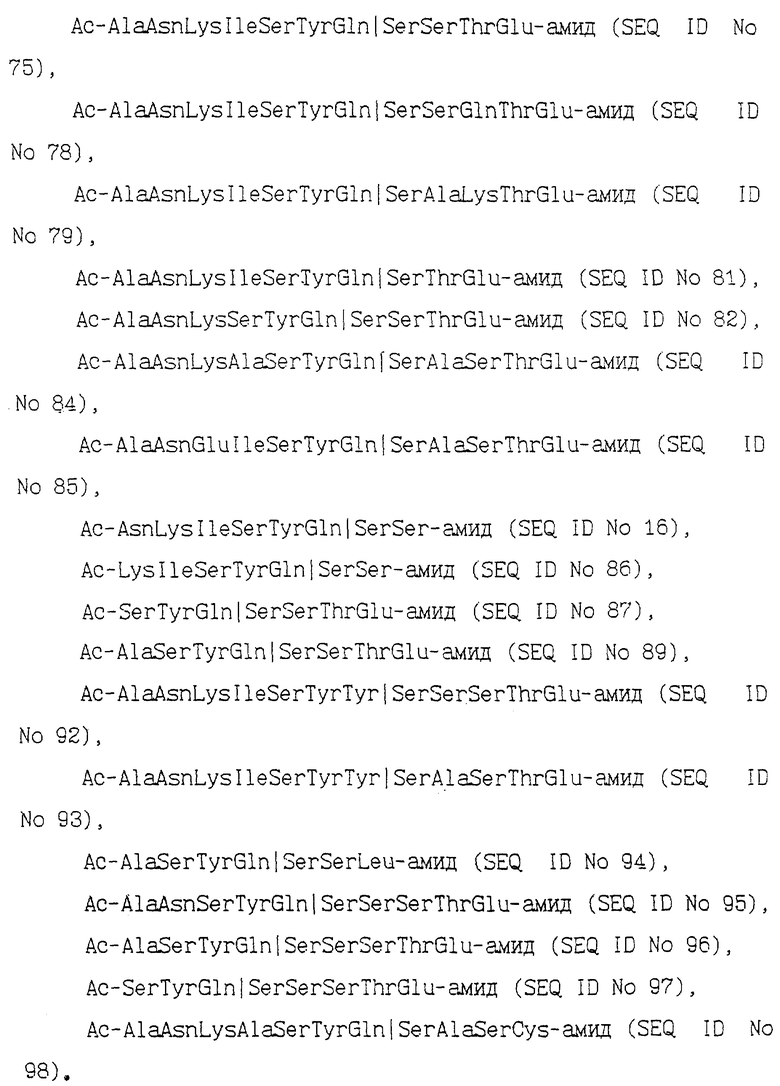
AlaAsnLysIleSerTyrGln 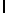 SerSerSerThrGlu-амид (SEQ ID N 11),
SerSerSerThrGlu-амид (SEQ ID N 11),
Ac-AlaAsnLysLleSerTyrGln 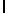 SerSerSerThrLeu (SEQ ID N 70),
SerSerSerThrLeu (SEQ ID N 70),
Ac-AlaAsnLysIleSerTyrGln 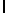 SerSerSerThrGlu-aмид (SEQ ID N 11),
SerSerSerThrGlu-aмид (SEQ ID N 11),
Aс-AlaAsnLysIleSerTyrGln 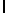 SerSerSerThrLeu-амид (SEQ ID N 70),
SerSerSerThrLeu-амид (SEQ ID N 70),
Ac-AlaAsnLуsIleSerTуrGln 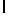 SerAlaSerThrGlu-aмид (SEQ ID N 73),
SerAlaSerThrGlu-aмид (SEQ ID N 73),
Ac-AlaAsnLysIleSerTyrGln 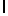 SerSerLysThrGlu-амид (SEQ ID N 74),
SerSerLysThrGlu-амид (SEQ ID N 74),
Ac-AlaAsnLуsIleSerTуrGln 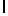 SerSerThrGlu-aмид (SEQ ID N 75),
SerSerThrGlu-aмид (SEQ ID N 75),
Ac-AlaAsnLysIleSerTyrGln 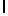 SerSerGlnThrGlu-амид (SEQ ID N 78),
SerSerGlnThrGlu-амид (SEQ ID N 78),
Ac-AlaAsnLysIleSerTyrGIn 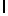 SerAlaLysThrGlu-aмид (SEQ ID N 79),
SerAlaLysThrGlu-aмид (SEQ ID N 79),
Ac-AlaAsnLysIleSerTyrGln 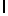 SerThrGlu-амид (SEQ ID N 81),
SerThrGlu-амид (SEQ ID N 81),
Ac-AlaAsnLysSerTyrGln 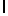 SerSerThrGlu-aмид (SEQ ID N 82),
SerSerThrGlu-aмид (SEQ ID N 82),
Ac-AlaAsnLysAlaSerTyrGln 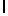 SerAlaSerThrGlu-амид (SEQ ID N 84),
SerAlaSerThrGlu-амид (SEQ ID N 84),
Ac-AlaAsnGluIleSerTyrGln 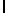 SerAlaSerThrGlu-амид (SEQ ID N 85),
SerAlaSerThrGlu-амид (SEQ ID N 85),
Ac-AsnLysIleSerTyrGln 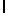 SerSer-aмидa (SEQ ID N 16),
SerSer-aмидa (SEQ ID N 16),
Ac-LysIleSerTyrGln 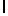 SerSer-амид (SEQ ID N 86),
SerSer-амид (SEQ ID N 86),
Ac-SerTyrGln 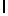 SerSerThrGlu-амид (SEQ ID N 87),
SerSerThrGlu-амид (SEQ ID N 87),
Ac-AlaSerTyrGln 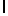 SerSerThrGlu-aмид (SEQ ID N 89),
SerSerThrGlu-aмид (SEQ ID N 89),
Ac-AlaAsnLysIleSerTyrTyr 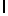 SerSerSerThrGlu-амид (SEQ ID N 92),
SerSerSerThrGlu-амид (SEQ ID N 92),
Ac-AlaAsnLysIleSerTyrTyr 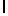 SerAlaSerThrGlu-aмид (SEQ ID N 93),
SerAlaSerThrGlu-aмид (SEQ ID N 93),
Ac-AlaSerTyrGln 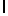 SerSerLeu-aмид (SEQ ID N 94),
SerSerLeu-aмид (SEQ ID N 94),
Ac-AlaAsnSerTyrGln 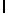 SerSerSerThrGlu-амид (SEQ ID N 95),
SerSerSerThrGlu-амид (SEQ ID N 95),
Ac-AlaSerTуrGln 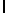 SerSerSerThгGlu-aмид (SEQ ID N 96).
SerSerSerThгGlu-aмид (SEQ ID N 96).
Ac-SerTyrGln 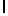 SerSerSerThrGlu-амид (SEQ ID N 97),
SerSerSerThrGlu-амид (SEQ ID N 97),
Ac-AlaAsnLysAlaSerTyrGln 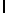 SerAlaSerCys-aмид (SEQ ID N 98).
SerAlaSerCys-aмид (SEQ ID N 98).
Для каждого специалиста по пептидной химии совершенно очевидно, что некоторые аминокислоты в биологически активном олигопептиде могут быть заменены гомологичными, изостерными и/или изоэлектронными аминокислотами, но при этом биологическая активность такого модифицированного олигопептида аналогична биологической активности исходного олигопептида. Нижеследующий список аминокислотных замещений носит чисто иллюстративный, а не ограничивающий характер:
Исходная аминокислота - Замещающая аминокислота
Ala - Gly
Arg - Lys Орнитин
Asn - Gln
Asp - Glu
Glu - Asp
Gln - Asn
Gly - Ala
Ile - Val, Leu, Met, Nle
Leu - Ile, Val, Met, Nle
Lys - Aro, Орнитин
Met - Leu, Ile, Nle, Val
Орнитин - Lys, Arg
Phe - Tyr, Trp
Ser - Thr
Thr - Ser
Trp - Phe, Tyr
Tyr - Phe, Trp
Val - Leu, Ile, Met, Nle
Так, например, нижеследующие олигопептиды могут быть синтезированы способами, хорошо известными любому специалисту, и должны, как предполагается, протеолитически расщепляться
свободным PSA:
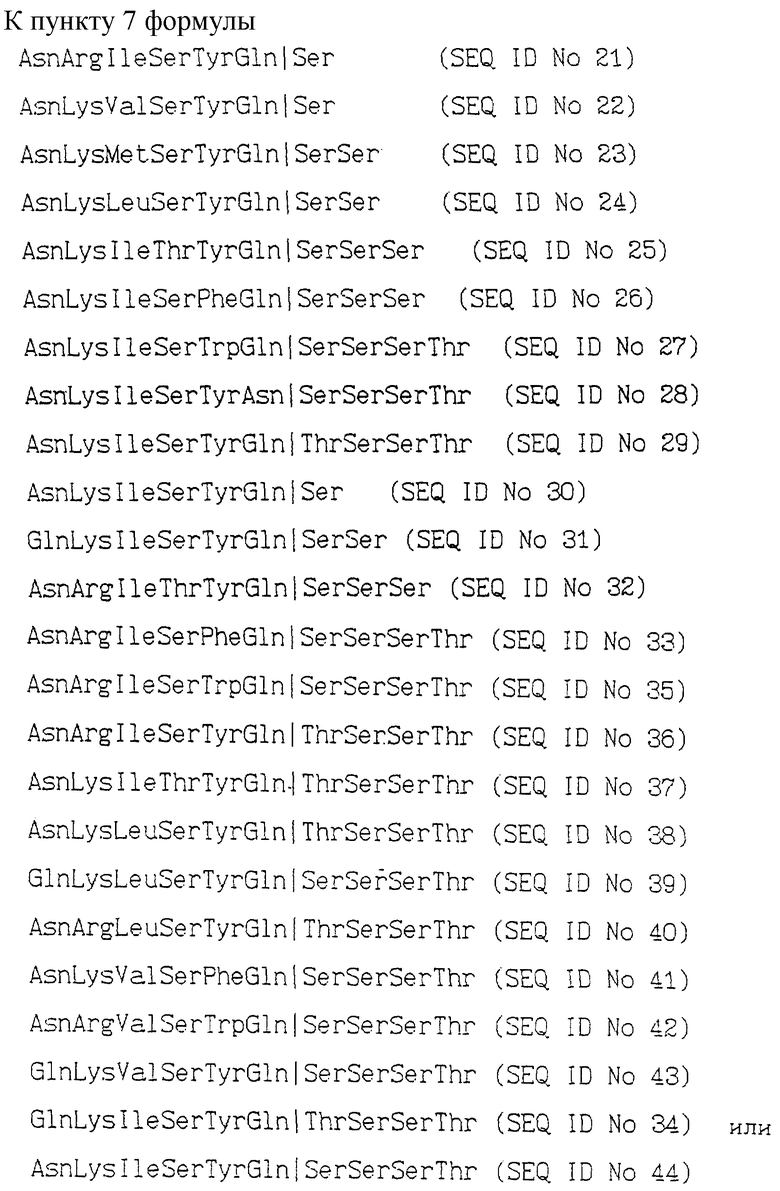
AsnArgIleSerTyrGln 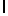 Ser (SEQ ID N 21)
Ser (SEQ ID N 21)
AsnLysValSerTyrGln 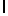 Ser (SEQ ID N 22)
Ser (SEQ ID N 22)
AsnLysMetSerTyrGln 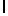 SerSer (SEQ ID N 23)
SerSer (SEQ ID N 23)
AsnLysLeuSerTyrGln 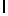 SerSer (SEQ ID N 24)
SerSer (SEQ ID N 24)
AsnLysIleThrTyrGln 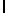 SerSerSer (SEQ ID N 25)
SerSerSer (SEQ ID N 25)
AsnLysIleSerPheGln 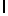 SerSerSer (SEQ ID N 26)
SerSerSer (SEQ ID N 26)
AsnLysIleSerTrpGln 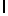 SerSerSerThr (SEQ ID N 27)
SerSerSerThr (SEQ ID N 27)
AsnLysIleSerTyrAsn 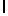 SerSerSerThr (SEQ ID N 28)
SerSerSerThr (SEQ ID N 28)
AsnLysIleSerTyrGln 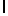 ThrSerSerThr (SEQ ID N 29)
ThrSerSerThr (SEQ ID N 29)
AsnLysIleSerTyrGln 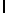 Ser (SEQ ID N 30)
Ser (SEQ ID N 30)
GlnLysIleSerTyrGln 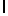 SerSer (SEQ ID N 31)
SerSer (SEQ ID N 31)
AsnArgIleThrTyrGln 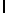 SerSerSer (SEQ ID N 32)
SerSerSer (SEQ ID N 32)
AsnArgIleSerPheGln 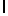 SerSerSerThr (SEQ ID N 33)
SerSerSerThr (SEQ ID N 33)
AsnArgIleSerTrpGln 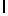 SerSerSerThr (SEQ ID N 35)
SerSerSerThr (SEQ ID N 35)
AsnArgIleSerTyrGln 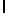 ThrSerSerThr (SEQ ID N 36)
ThrSerSerThr (SEQ ID N 36)
AsnLysIleThrTyrGln 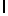 ThrSerSerThr (SEQ ID N 37)
ThrSerSerThr (SEQ ID N 37)
AsnLysLeuSerTyrGln 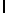 ThrSerSerThr (SEQ ID N 38)
ThrSerSerThr (SEQ ID N 38)
GlnLysLeuSerTyrGln 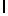 SerSerSerThr (SEQ ID N 39)
SerSerSerThr (SEQ ID N 39)
AsnArgLeuSerTyrGln 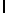 ThrSerSerThr (SEQ ID N 40)
ThrSerSerThr (SEQ ID N 40)
AsnLysValSerPheGln 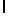 SerSerSerThr (SEQ ID N 41)
SerSerSerThr (SEQ ID N 41)
AsnArgValSerTrpGln 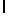 SerSerSerThr (SEQ ID N 42)
SerSerSerThr (SEQ ID N 42)
GlnLysValSerTyrGln 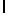 SerSerSerThr (SEQ ID N 43)
SerSerSerThr (SEQ ID N 43)
GlnLysIleSerTyrGIn 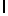 ThrSerSerThr (SEQ ID N 34)
ThrSerSerThr (SEQ ID N 34)
AsnLysIleSerTyrGln 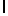 SerSerSerThr (SEQ ID N 44)
SerSerSerThr (SEQ ID N 44)
Аналогично, нижеследующие олигопептиды могут быть синтезированы способами, хорошо известными любому специалисту, и должны, как предполагается, протеолитически расщепляться свободным PSA:
GlyGluGlnGlyValGlnLysAspValSerGlnSerSerIleTyr 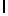 SerGlnThr Glu (SEQ ID N 45),
SerGlnThr Glu (SEQ ID N 45),
GlyGluAsuGlyLeuGlnLysAspValSerGlnSerSerIleTyr 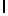 SerGlnThr Glu (SEQ ID N 47),
SerGlnThr Glu (SEQ ID N 47),
GlyGluAsnGlyValAsnLysAspValSerGlnSerSerIleTyr 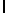 SerGlnThr Glu (SEQ ID N 48),
SerGlnThr Glu (SEQ ID N 48),
GlyGluAsnGlyValGlnArgAspValSerGlnArgSerIleTyr 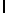 SerGlnThr Glu (SEQ ID N 49),
SerGlnThr Glu (SEQ ID N 49),
GlyGluAsnGlyValGlnLysAspValSerGlnLysSerIleTyr 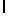 SerGlnThr Glu (SEQ ID N 50),
SerGlnThr Glu (SEQ ID N 50),
GlyGluAsnGlyValGlnLysAspLeuSerGlnThrSerIleTyr 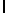 SerGlnThr Glu (SEQ ID N 51),
SerGlnThr Glu (SEQ ID N 51),
GlyGluAsnGlyValGlnLysAspValSerGlnSerSerIlePhe 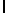 SerGlnThr Glu (SEQ ID N 52),
SerGlnThr Glu (SEQ ID N 52),
GlyGluAsnGlyValGlnLysAspMetSerGlnSerSerIleTyr 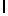 ThrGlnThr Glu (SEQ ID N 53),
ThrGlnThr Glu (SEQ ID N 53),
GlyGluAsnGlyValGlnLysAspValSerGlnArgSerIleTyr 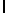 ThrGlnThr Glu (SEQ ID N 54),
ThrGlnThr Glu (SEQ ID N 54),
GlyGluAsnGlyValGlnLysAspValSerGlnSerSerIleTyr 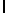 SerGlnSer Glu (SEQ ID N 55),
SerGlnSer Glu (SEQ ID N 55),
GlyGluAsnGlyValGlnLysAspValSerGlnArgSerIleTyr 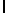 SerAsnThr Glu (SEQ ID N 56),
SerAsnThr Glu (SEQ ID N 56),
GlyLysAlaIleSerSerGlnTyr 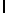 SerAsnThrGluGluArgeLeu (SEQ ID N 57),
SerAsnThrGluGluArgeLeu (SEQ ID N 57),
GlyArgGlyIleSerSerGlnTyr 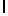 SerAsnThrGluGluArgLeu(SEQ ID N 59),
SerAsnThrGluGluArgLeu(SEQ ID N 59),
GlyLysGlyIleThrSerGlnTyr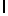 SerAsnThrGluGluArgLeu (SEQ ID N 60),
SerAsnThrGluGluArgLeu (SEQ ID N 60),
GlyLysGlyIleSerThrGlnTyr 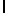 SerAsnThrGluGluArgLeu (SEQ ID N 61),
SerAsnThrGluGluArgLeu (SEQ ID N 61),
GlyLysGlyIleSerSerAsnTyr 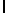 SerAsnThrGluGluArgLeu (SEQ ID N 62),
SerAsnThrGluGluArgLeu (SEQ ID N 62),
AlaLysGlyIleSerSerGlnTyr 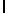 SerAsnThrGluGluArgLeu (SEQ ID N 63),
SerAsnThrGluGluArgLeu (SEQ ID N 63),
GlyLysGlyIleSerSerGlnPhe 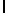 SerAsnThrGluGluArgLeu (SEQ ID N 64),
SerAsnThrGluGluArgLeu (SEQ ID N 64),
GlyLysGlyIleSerSerGlnTyr 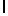 ThrAsnThrGluGluArgLeu (SEQ ID N 65),
ThrAsnThrGluGluArgLeu (SEQ ID N 65),
GlyLysGlyIleSerSerGlnTyr 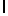 SerAsnSerGluGluArgLeu (SEQ ID N 58 и
SerAsnSerGluGluArgLeu (SEQ ID N 58 и
GlyLysGlyIleSerSerGlnTyr 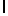 SerAsnThrAspGluArgLeu (SEQ ID N 46) и т.п.
SerAsnThrAspGluArgLeu (SEQ ID N 46) и т.п.
Символ 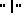 , включенный в аминокислотную последовательность, указывает на точку протеолитического расщепления олигопептида свободным PSA.
, включенный в аминокислотную последовательность, указывает на точку протеолитического расщепления олигопептида свободным PSA.
Настоящее изобретение также относится к способу анализа на протеолитическую активность свободного PSA в композиции. Этот способ является одним из важных аспектов настоящего изобретения и заключается в использовании аналитической системы, которая позволяет количественно определить содержание свободного PSA, присутствующего в некоторых физиологических жидкостях и тканях. Кроме того, этот анализ не только позволяет контролировать выделение и очистку свободного PSA, но также может быть положен в основу метода скрининга для идентификации ингибиторов протеолитической активности свободного PSA. В общих чертах, этот метод заключается просто в определении способности композиции, которая, как предполагается, содержит ферментативно активный свободный PSA, протеолитически расщеплять олигопептид.
В основном процедуру анализа осуществляют с использованием одного из олигонуклеотидов, описанных выше. Однако может оказаться предпочтительным разработать такой анализ, в котором олигопептид, содержащий сайт расщепления, был бы помечен меткой, например, радиоактивной меткой, присутствие которой как в нерасщепленном олигопептиде, так и в части олигопептида, оставшегося после расщепления и содержащего эту метку, можно было бы измерить.
Кроме того, настоящее изобретение относится к способу идентификации соединений (называемых далее соединениями-кандидатами), которые ингибируют протеолитическую активность свободного PSA. При этом предусматривается, что такой способ скрининга может быть с успехом использован для идентификации любого соединения-кандидата, которое является ингибитором, независимо от того, имеет или не имеет данное соединение-кандидат белковую или пептидиловую структуру.
Таким образом, настоящее изобретение также относится к способу определения способности испытуемого соединения ингибировать протеолитическую активность свободного PSA; причем указанный способ предусматривает:
(а) осуществление реакции субстрата, имеющего аминокислотную последовательность, распознаваемую и селективно протеолитически расщепляемую свободным простатическим антигеном, со свободным простатическим антигеном в присутствии испытуемого соединения; и
(b) установление факта расщепления субстрата, где на способность испытуемого соединения ингибировать протеолитическую активность указывает снижение уровня расщепления субстрата по сравнению с расщеплением субстрата в отсутствии испытуемого соединения.
По своей разработке и осуществлению анализ в целях скрининга соединений-кандидатов является довольно простым, и во многом похож на вышеописанный анализ для определения протеолитической активности. Так, например, после получения относительно очищенного препарата свободного PSA, желательно просто смешать испытуемое соединение с протеолитическим препаратом, предпочтительно в таких условиях, при которых PSA может осуществлять свою функцию расщепления, но в отсутствие ингибирующего соединения. Так, например, желательно включить в смесь определенное количество олигопептида, имеющего специфический сайт расщепления PSA, такого, как олигопептиды, описанные выше. Таким образом, можно измерить способность испытуемого соединения снижать относительный уровень расщепления олигопептида в присутствии испытуемого соединения.
В соответствии с этим, для оценки относительной ингибирующей способности испытуемого соединения желательно измерить или как-нибудь иначе определить активность свободного PSA в отсутствие добавляемого испытуемого соединения по сравнению с активностью в присутствии испытуемого соединения.
Настоящее изобретение также относится к противораковым композициям, которые могут быть использованы для лечения рака предстательной железы. Такие композиции содержат олигопептиды настоящего изобретения, ковалентно связанные с цитотоксическим агентом либо непосредственно, либо с помощью химического линкера. Эта комбинация олигопептида и цитотоксического агента может быть определена как конъюгат. В идеальном случае, цитотоксическая активность цитотоксического агента является очень низкой или вообще отсутствует, если олигопептид, содержащий сайт протеолитического PSA-расщепления, связан непосредственно или с помощью химического линкера с цитотоксическим агентом и является интактным. Кроме того, в идеальном случае цитотоксическая активность цитотоксического агента значительно возрастает или возвращается до уровня активности немодифицированного цитотоксического агента после протеолитического гидролиза связанного олигопептида в сайте расщепления. Наиболее предпочтительным, хотя и необязательным, вариантом осуществления настоящего изобретения является получение конъюгата, где олигопептид и химический линкер, если он присутствует, отделяются от цитотоксического агента под действием протеолитически активного свободного PSA и любых других нативных протеолитических ферментов, присутствующих в окружающей ткани, высвобождая, тем самым, немодифицированный цитотоксический агент во внутреннюю среду организма в месте протеолитического расщепления.
При этом следует отметить, что олигопептид настоящего изобретения, конъюгированный с цитотоксическим агентом, независимо от того, является ли он ковалентно связанным с этим агентом непосредственно или с помощью химического линкера, необязательно должен быть олигопептидом, наиболее распознаваемым и наиболее легко расщепляемым свободным PSA. Так, например, выбор олигопептида для включения в противораковую композицию может быть осуществлен исходя из его селективности, протеолитической расщепляемости простатическим агентом и цитотоксической активности конъюгата цитотоксического агента и протеолитического остатка (или, в идеальном случае, немодифицированного цитотоксического агента), являющейся следствием такого расщепления.
Поскольку конъюгаты настоящего изобретения могут быть использованы для модификации данного биологического ответа, то цитотоксический агент не должен быть ограничен лишь классическими типами химических терапевтических агентов. Так, например, цитотоксический агент может быть белком или полипептидом, обладающим нужной биологической активностью. Такими белками могут быть, например, токсин, такой как абрин, рицин A, экзотоксин pseudomonas, или дифтерийный токсин; белок, такой как фактор некроза опухоли, альфа-интерферон, бета-интерферон, фактор роста нервной ткани, тромбоцитарный фактор роста, тканевый активатор плазминогена; или модификаторы биологического ответа, такие как лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), фактор, стимулирующий образование колоний гранулоцитов и макрофагов (GM-CSF), фактор колониеобразования гранулоцитов (G-CSF) или другие факторы роста.
Предпочтительными цитотоксическими агентами являются, в основном, алкилирующие агенты, антипролиферативные агенты, тубулин-связывающие агенты и т. п. Предпочтительными классами цитотоксических агентов являются, например, семейство антрациклиновых лекарственных средств, лекарственные средства, относящиеся к винка-соединениям; митомицины; блеомицины; цитотоксические нуклеозиды; семейство птеридиновых лекарственных средств; диинены и подофиллотоксины. Особенно предпочтительными соединениями вышеуказанных классов являются, например, доксорубицин, карминомицин, даунорубицин, аминоптерин, метотрексат, метоптерин, дихлорометотрексат, митомицин C, порфиромицин, 5-фтороурацил, 6-меркаптопурин, цитозинарабинозид, подофиллотоксин или его производные, такие как этопозид или этопозидфосфат; мелфалан, винбластин, винкристин, лейрозидин, виндезин, лейрозин и т.п. Другими подходящими цитотоксическими агентами являются эстрамустин, цисплатин и циклофосфамид. При этом каждый специалист может осуществить соответствующие химические модификации с образованием нужного соединения, которое является более пригодным для проведения реакций в целях получения конъюгатов настоящего изобретения.
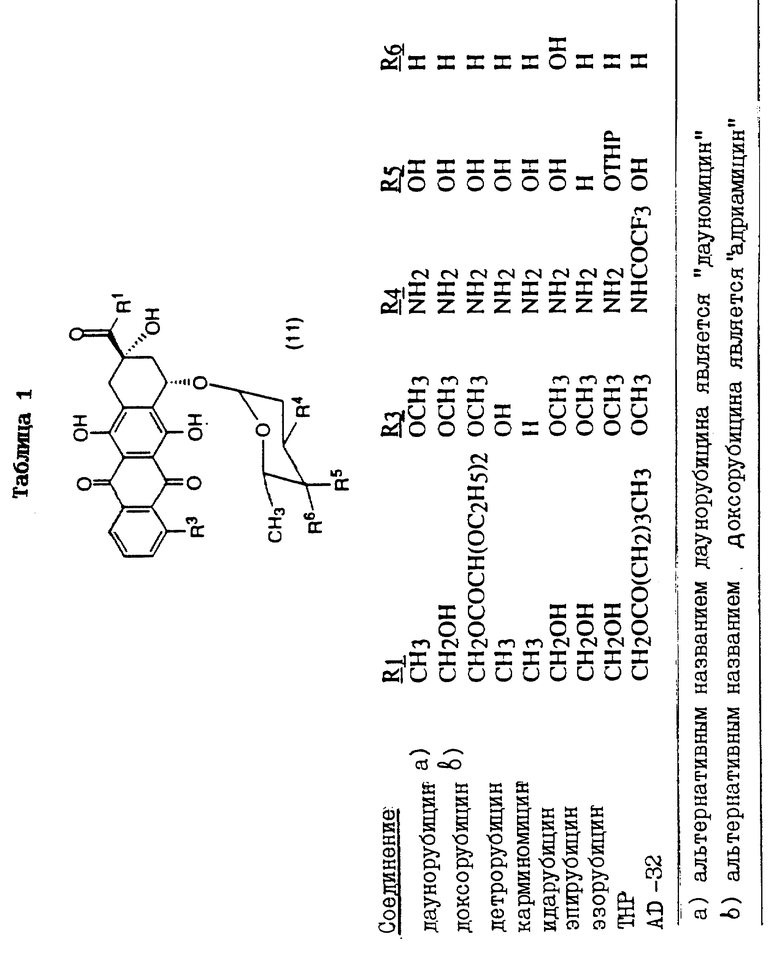
Особенно предпочтительной группой цитотоксических агентов настоящего изобретения являются лекарственные средства, имеющие следующие формулы:
Группа метотрексатов формулы (1)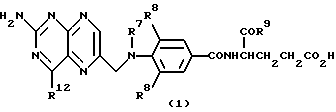
где R12 представляет собой амино- или гидроксигруппу;
R7 представляет собой водород или метил;
R8 представляет собой водород, фтор, хлор, бром или йод;
R9 представляет собой гидроксигруппу, или группу, образующую соль карбоновой кислоты.
Группа митомицинов формулы (2)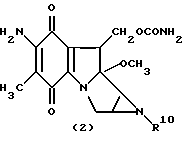
где R10 представляет собой водород или метил.
Группа блеомицинов формулы (3)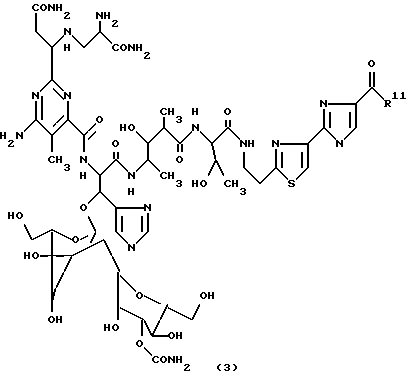
где R11 представляет собой гидроксигруппу, аминогруппу;
C1-C3-алкиламиногруппу, ди(C1-C3алкил)аминогруппу, C4-C6-полиметиленаминогруппу;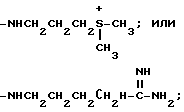
Мелфалан формулы (4)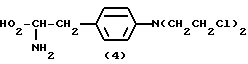
6-Меркаптопурин формулы (5)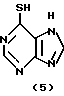
Цитозинарабинозил формулы (6)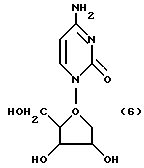
Подофиллотоксины формулы (7)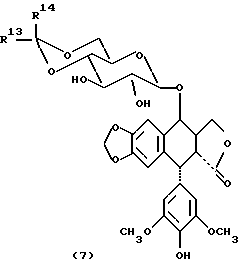
где R13 представляет собой водород или метил;
R14 представляет собой метил или тиенил; или их фосфатные соли.
Лекарственные средства группы винкаалкалоидов формулы (8)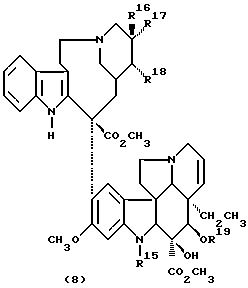
где R15 представляет собой H, CH3 или OHO, в случае, когда
R17 и R18 взяты отдельно;
R18 представляет собой H, причем, один из R16Я и R17 является этилом, а другой является H или OH; а в том случае, когда R17 и R18 взяты вместе с атомами углерода, с которыми они связаны, они образуют оксирановое кольцо, где R16 является этилом;
R19 представляет собой водород, (C1-C3алкил)-CO, или хлорзамещенную группу (C1-C3алкил)-CO;
Дифторонуклеозиды формулы (9)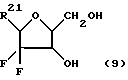
где R21 представляет собой основание, имеющее одну из формул: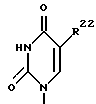
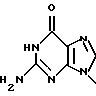
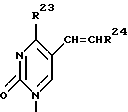
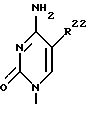
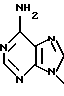
где, R22 представляет собой водород, метил, бром, фтор, хлор или иод
R23 представляет собой -OH или -NH2;
R24 представляет собой водород, бром, хлор или йод; или
Антрациклиновые антибиотики формулы (10)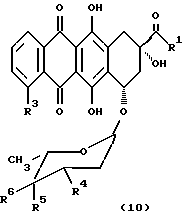
где R1 представляет собой -CH3, CH2OH, -CH2OCO(CH2)3CH3 или -CH2OCOCH(OC2H5)2;
R3 представляет собой -OCH3, -OH или H;
R4 представляет собой -NH2, -NHCOCF3, 4-морфолинил, 3-циано-4-морфолинил, 1-пиперидинил, 4-метокси-1-пиперидинил, бензиламин, дибензиламин, цианометиламин или 1-циано-2-метоксиэтиламин;
R5 представляет собой -OH, -OTHP или -H и
R6 представляет собой -OH или -H, при условии, что:
R6 не является -OH, если R5 = -OH или -OTHP.
Эстрамустин (11)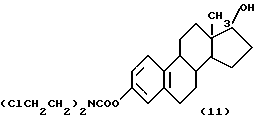
Циклофосфамид (12)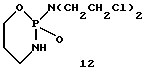
Самыми предпочтительными лекарственными средствами являются антрациклиновые антибиотики формулы (10), описанные ранее. При этом следует отметить, что указанные структурные формулы описывают соединения, которые являются лекарственными средствами или производными лекарственных средств, имеющими различные родовые или тривиальные названия. В таблице 1 представлены некоторые антрациклиновые лекарственные средства (и их родовые или тривиальные названия), которые являются особенно предпочтительными для использования в настоящем изобретении.
Из соединений, представленных в таблице 1, наиболее предпочтительным лекарственным средством является доксорубицин. Доксорубицин (обозначаемый также "DOX") представляет собой антрациклин формулы (10), где R1 является -CH2OH, R3 является -OCH3, R4 является -NH2, R5 является -OH, a R6 является -H.
Олигопептиды, пептидные субъединицы и производные пептидов (также называемые пептидами) настоящего изобретения могут быть синтезированы из составляющих их аминокислот методом стандартного пептидного синтеза, предпочтительно методом твердофазного синтеза. Затем пептиды очищают с помощью обращенно-фазовой высокоразрешающей жидкостной хроматографии (ВЭЖХ).
Стандартные методы пептидного синтеза описаны, например, в следующих работах: Schroeder et al., "The Peptides", Vol. 1, Academic Press 1965; Bodansky et al., "Peptide Synthesis", Interscience Publishers, 1966; McOmie (ed. ) "Protective Groups in Organic Chemystry", Plemim Press, 1973; Barany et al. , "The Peptides: Analysis, Synthesis, Biology" 2, Chapter 1, Academic Press, и Stewart et al., "Solid Phase Peptide Syntetic", Second Edition, Pierce Chemical Company, 1984. Содержание этих работ вводится в настоящее описание посредством ссылки.
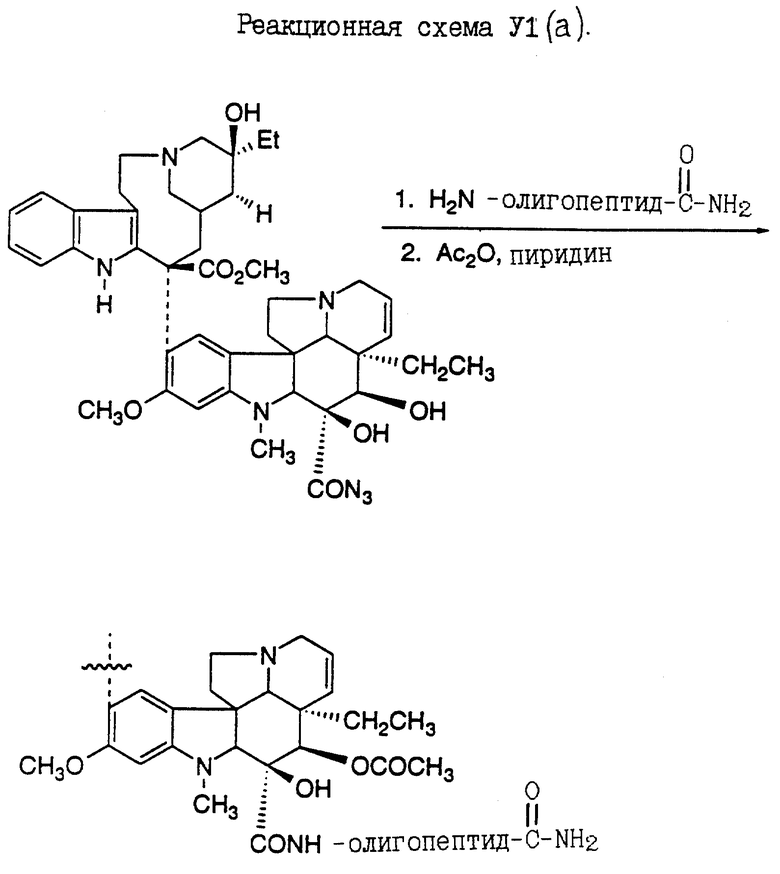
Конъюгаты настоящего изобретения, содержащие олигопептид, имеющий сайт PSA-расщепления и цитотоксический агент, могут быть аналогичным образом синтезированы методами, хорошо известными специалистам по клинической биохимии. Так, например, свободная аминовая часть на цитотоксическом агенте может быть ковалентно присоединена к олигопептиду у карбоксильного конца, в результате чего образуется амид. Аналогичным образом, амидная связь может быть образована путем ковалентного связывания аминогруппы олигопептида с карбоксильной группой цитотоксического агента. Для этих целей может быть использован такой реагент, как комбинация гексафторофосфата 2-(1Н-бензотриазол-1-ил)-1,3,3- тетраметилурония (известного как HBTU) и гидрата 1-гидроксибензотриазола (известного как HOBT), дициклогексилкарбодиимида (DCC), N-этил-N-(3-диметиламинопропил)- карбодиимида (EDC), дифенилфосфорилазида (DPPA), гексафторофосфата бензотриазол-1-ил-окси-трис- (диметиламино)фосфония (BOP), и т.п.
Кроме того, конъюгат настоящего изобретения может быть образован посредством непептидильной связи между сайтом расщепления PSA и цитотоксическим агентом. Так, например, цитотоксический агент может быть ковалентно присоединен к карбоксильному концу олигопептида посредством гидроксильной группы на цитотоксическом агенте, в результате чего образуется сложноэфирная связь. Для этих целей может быть использован такой реагент, как комбинация HBTU и HOBT, комбинация ВОР и имидазола, комбинация DCC и DMAP и т.п. Карбоновая кислота может быть также активирована путем образования нитрофенилового эфира или т.п., и подвергнута реакции в присутствии DBU (1,8-диазабицикло 5,4,0 ундек-7-ен).
Конъюгат настоящего изобретения может быть также образован путем присоединения олигопептида к цитотоксическому агенту посредством линкерной единицы. Такие линкерные единицы могут содержать, например, бикарбонилалкильный бирадикал, с помощью которого аминовую часть цитотоксического агента соединяют с линкерной единицей, в результате чего образуется амидная связь, а аминоконец олигопептида соединяют с другим концом линкерной единицы, в результате чего тоже образуется амидная связь. Могут быть также использованы другие линкерные единицы, которые являются стабильными в условиях физиологической среды при отсутствии свободного PSA, но которые могут расщепляться после гидролиза в соответствующем сайте протеолитического расщепления под действием PSA. Кроме того, могут быть использованы такие линкерные единицы, которые после PSA-гидролиза в сайте протеолитического расщепления остаются связанными с цитотоксическим агентом, но при этом активность такого производного цитотоксического агента, образовавшегося после расщепления, заметно не уменьшается по сравнению с немодифицированным цитотоксическим агентом.
При этом очевидно, что в процессе синтеза соединений настоящего изобретения может оказаться необходимым защитить или блокировать различные реактивные функциональные группы, присутствующие в исходных соединениях или в промежуточных соединениях, и в этом случае нужную реакцию осуществляют на других частях молекулы. После завершения нужных реакций или по истечении необходимого периода времени такие группы обычно удаляют, например, путем гидролиза или гидрогенолиза. Указанные стадии блокирования и деблокирования являются традиционными процедурами в органической химии. Для выбора подходящих защитных групп, которые могут быть использованы при получении соединений настоящего изобретения, специалисты могут обратиться к работам Protective Groups in Organic Chemistry, McOmie, ed. Plenum Press, NY, (1973); и Protective Groups In Organic Synthesis, Green, ed., John Wiley & Sons, NY, NY (1981).
Примерами подходящих аминозащитных групп могут служить C1-C10 алканоильные группы, такие как формил, ацетил, дихлорацетил, пропионил, гексаноил, 3,3-диэтилгексаноил, γ -хлор-бутрил и т.п.; C1-C10 алкоксикарбонильные и C5-C15арилоксикарбонильные группы, такие как трет-бутоксикарбонил, бензилоксикарбонил, аллилоксикарбонил, 4-нитробензилоксикарбонил, флуоренилметилоксикарбонил и циннамоилоксикарбонил; галоген-(C1-C10)-алкоксикарбонильная группа, такая как 2,2,2-трихлорэтоксикарбонил; и C1-C15 арилалкильные и алкенильные группы, такие как бензил, фенетил, аллил, тритил и т.п. Другими обычно используемыми аминозащитными группами являются группы в форме енаминов, полученных с помощью β-кетоэфиров, таких как метил- или этилацетоацетат.
Подходящими карбоксизащитными группами могут быть, например, C1-C10 алкильные группы, такие как метил, трет-бутил, децил; галоген-C1-C10 алкильные группы, такие как 2,2,2-трихлорэтил и 2-йодэтил; C5-C15 арилалкильные группы, такие как бензил, 4-метоксибензил, 4-нитробензил, трифенилметил, дифенилметил; C1-C10 алканоилоксиметильные группы, такие как ацетоксиметил, пропионоксиметил и т. п. ; и такие группы, как фенацил, 4-галогенфенацил, аллил, диметилаллил, три-(C1-C3алкил), силил, например, триметилсилил, β-п-толуолсульфонилэтил, β-п-нитрофенил-тиоэтил, 2,4,6-триметилбензил, β -метилтиоэтил, фталимидометил, 2,4-динитро-фенилсульфенил, 2-нитробензгидрил и родственные группы.
Аналогично, подходящими гидроксизащитными группами могут быть, например, формильная группа, хлорацетильная группа, бензильная группа, бензгидрильная группа, тритильная группа, 4-нитробензильная группа, триметилсилильная группа, фенацильная группа, трет-бутильная группа, метоксиметильная группа, тетрагидропиранильная группа и т.п.
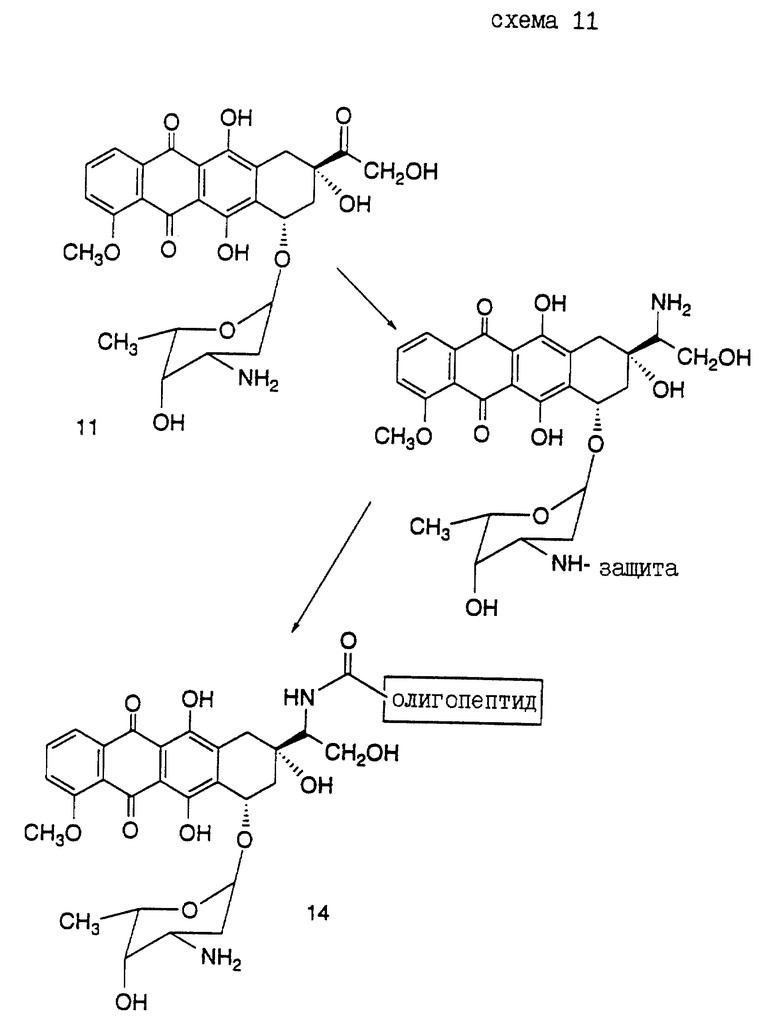
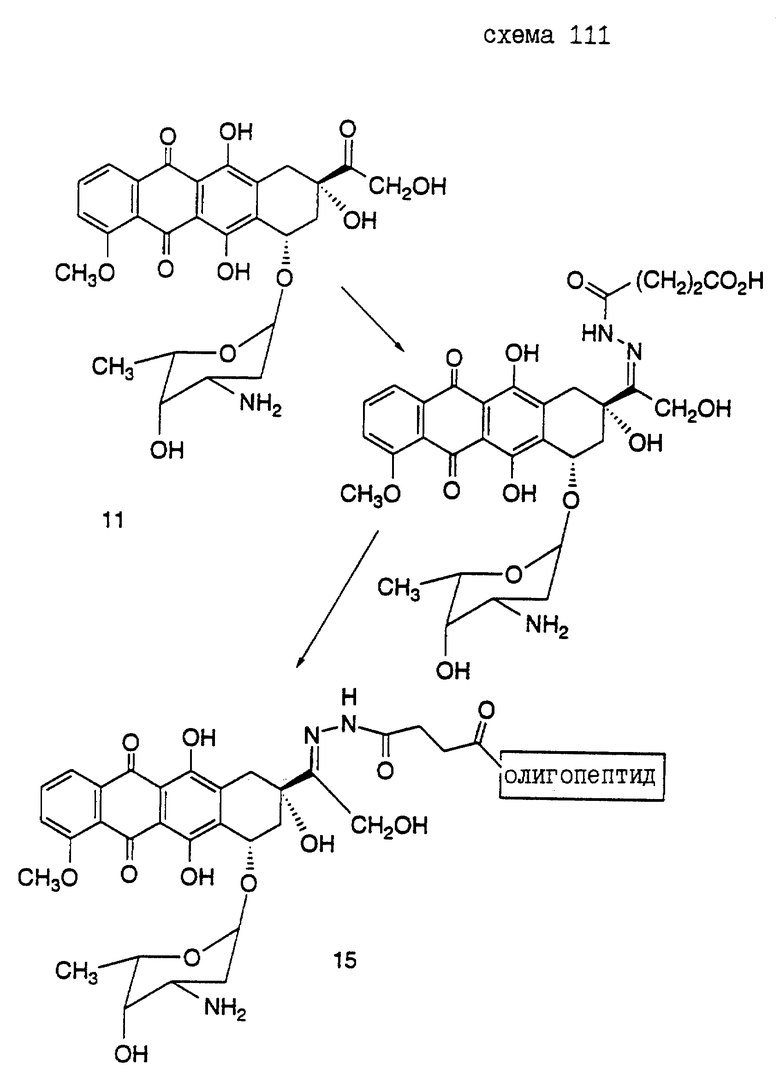
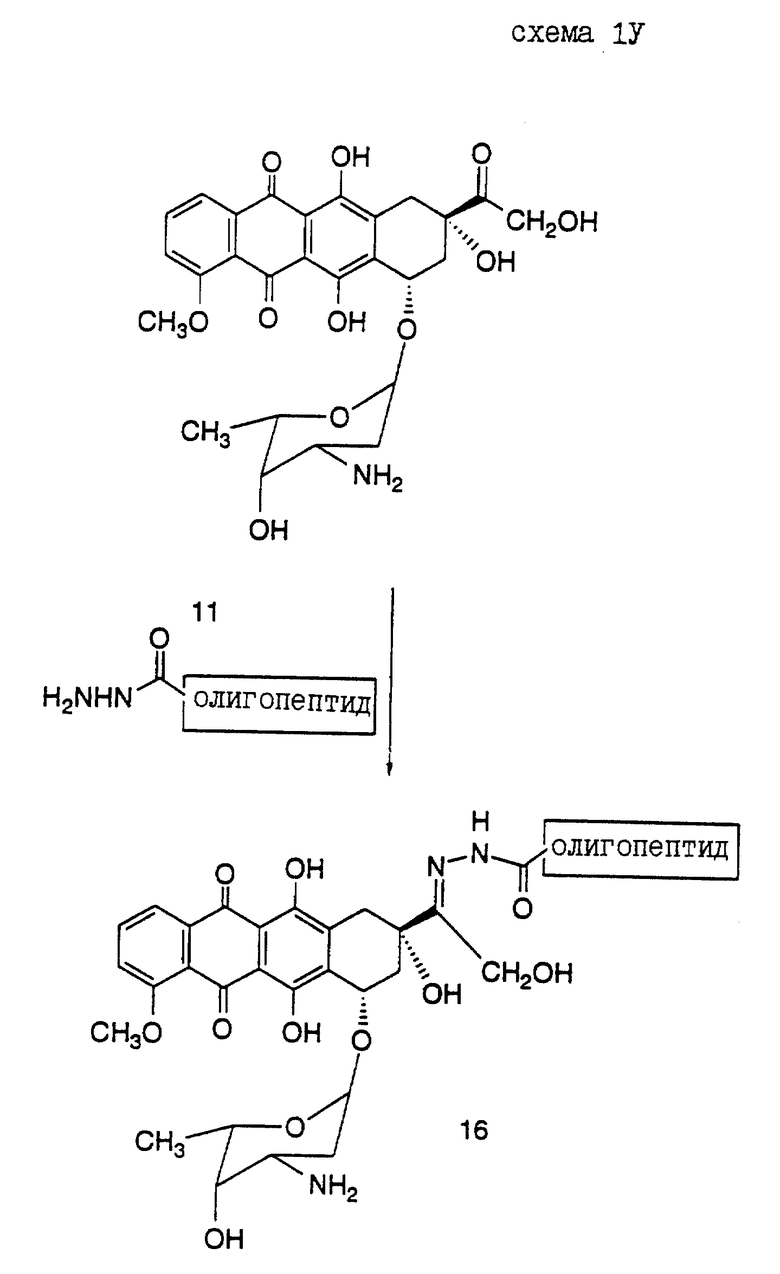
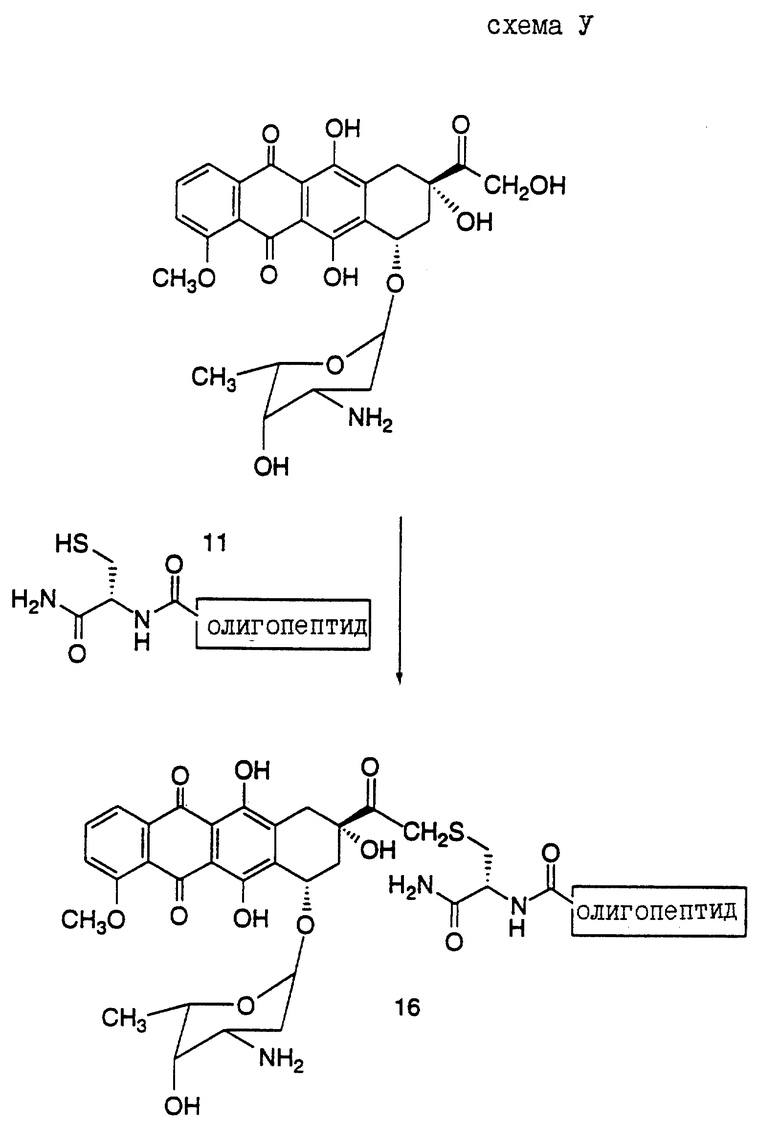
Предпочтительный вариант получения олигопептида, конъюгированного с антрациклиновым антибиотиком дозоксорубицином, представлен в нижеследующих Реакционных схемах, где проиллюстрирован синтез конъюгатов настоящего изобретения.
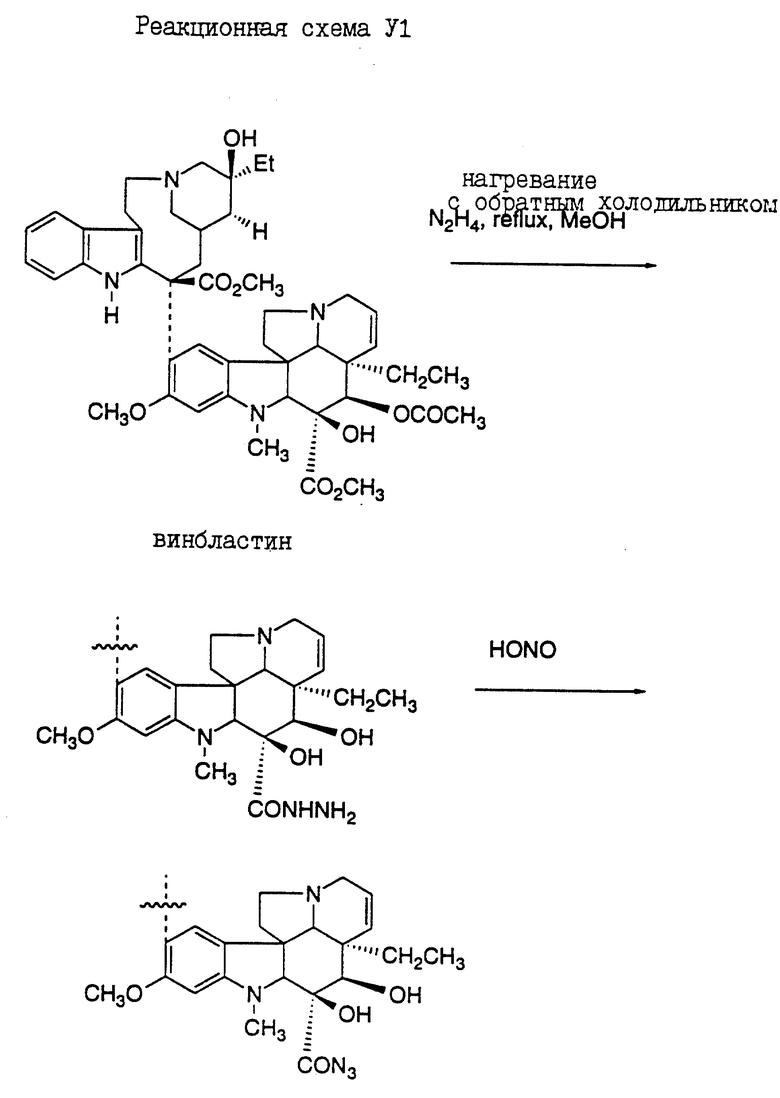
Реакционная схема VI иллюстрирует получение конъюгатов олигопептидов настоящего изобретения с винкаалкалоидным цитотоксическим агентом винбластином. Показано присоединение N-конца олигопептида с винбластином (S.P. Kandukuri et al., J. Med. Chem. 28: 1079-1088 (1985)). Однако можно ожидать, что конъюгирование олигопептида в других положениях и функциональных группах винбластина и в C-конце олигопептида также приведет к получению соединений, которые могут быть использованы для лечения рака предстательной железы.
Кроме того, следует отметить, что могут быть также получены конъюгаты, где N-конец олигопептида настоящего изобретения ковалентно связан с одним цитотоксическим агентом, таким как винбластин, а C-конец этого олигопептида одновременно связан с другим цитотоксическим агентом, который может быть тоже винбластином, или другим цитотоксическим агентом, таким как доксорубицин. Такой полицитотоксический конъюгат может обладать большими преимуществами, чем конъюгат, содержащий лишь один цитотоксический агент.
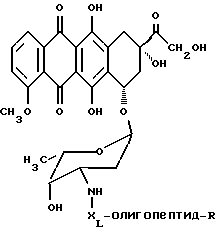
Конъюгат "олигопептид - цитотоксический агент" настоящего изобретения, в котором цитотоксическим агентом является предпочтительный цитотоксический агент дозоксорубицин, может быть представлен общей формулой: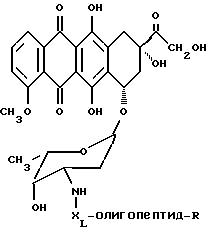
где "олигопептид" представляет собой олигопептид, который специфически распознается свободным простатическим антигеном (PSA), и который может быть протеолитически расщеплен под действием ферментативной активности свободного простатического антигена;
XL отсутствует или представляет собой аминокислоту, выбранную из:
а) фенилаланина,
b) лейцина,
с) валина,
d) изолейцина,
е) (2-нафтил)аланина,
f) дифенилаланина,
g) норвалина и
h) норлейцина;
R представляет собой водород или -(C=O)R1; и
R1 представляет собой C1-C6-алкил или арил.
В предпочтительном варианте конъюгата "олигопептид-цитотоксический агент":
"олигопептид" представляет собой олигомер, который имеет аминокислотную последовательность, выбранную из:
a) AsnLysIleSerTyrGln 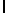 Ser (SEQ ID N 13),
Ser (SEQ ID N 13),
b) LysLleSerTyrGln 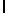 Ser (SEQ ID N 14),
Ser (SEQ ID N 14),
c) GlyGluAsnGlyValGlnLysAspValSerGlnXaaSerIleTyr 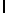 SerGln ThrGlu (SEQ ID N 15),
SerGln ThrGlu (SEQ ID N 15),
d) GlyLysGlyIleSerSerGlnTyr 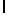 SerAsnThrGluGluArgLeu (SEQ ID N 2),
SerAsnThrGluGluArgLeu (SEQ ID N 2),
e) AsnLysIleSerTyrTyr 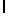 Ser (SEQ ID N 127),
Ser (SEQ ID N 127),
f) AsnLysAlaSerTyrGln 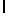 Ser (SEQ ID N 128),
Ser (SEQ ID N 128),
g) SerTyrGln 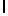 SerSer (SEQ ID N 129),
SerSer (SEQ ID N 129),
h) hArgTyrGln 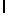 SerSer (SEQ ID N 141);
SerSer (SEQ ID N 141);
где Xaa является любой натуральной аминокислотой;
X1 отсутствует или является аминокислотой, выбранной из:
а) лейцина,
b) изолейцина,
с) норлейцина и
d) валина; и
R представляет собой ацетил, пивалоил или бензоил.
Конкретными примерами конъюгата "олигопептид - цитотоксический агент" настоящего изобретения являются нижеследующие соединения.
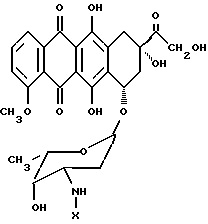
где X представляет собой:


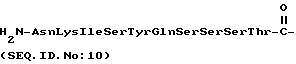
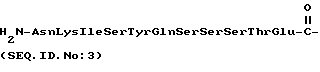
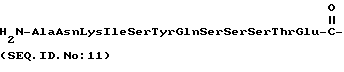



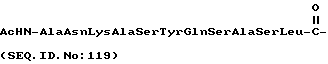
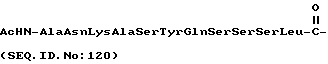





Как хорошо известно специалистам, и как очевидно из настоящего изобретения, пептидиловые терапевтические агенты, такие как конъюгаты "олигопептид-цитотоксический агент" настоящего изобретения предпочтительно имеют концевые аминогруппы любого олигопептидного заместителя, которые защищены соответствующей защитной группой, такой как ацетил, бензоил, пивалоил и т. п. Такая защита концевых аминогрупп снижает или устраняет возможность ферментативной деградации указанных пептидиловых терапевтических агентов под действием экзогенных аминопептидаз, присутствующих в плазме крови теплокровных животных.
В соответствии с настоящим изобретением, конъюгаты олигопептида и цитотоксического агента вводят пациенту в виде фармацевтической композиции, содержащей конъюгат формулы (1) и фармацевтически приемлемый носитель, наполнитель или разбавитель. Используемый в настоящем описании термин "фармацевтически приемлемый" относится к тем агентам, которые могут быть использованы при лечении или диагностики теплокровных животных, например человека, лошади, свиньи, коровы, мыши, собаки, кошки или других млекопитающих, а также птиц или других теплокровных животных. При этом предпочтительным является парентеральный способ введения, а в частности внутривенное, внутримышечное, подкожное, внутрибрюшинное или внутрилимфатическое введение. Указанные препараты могут быть получены с использованием носителей, разбавителей или наполнителей, которые обычно используются в этих целях. В этой связи, см. , например. Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Company, edited by Osol et al. Эти композиции могут включать в себя белки, например сывороточные белки, такие как альбумин сыворотки человека; буферы или забуферивающие соединения, такие как фосфаты, другие соли или электролиты и т.п. Подходящими разбавителями являются, например, стерильная вода, изотонический раствор, водный раствор декстрозы, многоатомный спирт или смеси таких спиртов, например глицерин, пропиленгликоль, полиэтиленгликоль и т.п. Указанные композиции могут содержать консерванты, такие как фенетиловый спирт, метил- и пропилпарабены, тимеросал и т.п. Если необходимо, то в композицию может быть включено от около 0,05 до около 0,20 мас.% антиоксиданта, такого как метасульфит натрия или бисульфит натрия.
Композицию для внутривенного введения изготавливают предпочтительно так, чтобы количество вводимого пациенту конъюгата составляло от около 0,01 до около 1 г. Предпочтительное количество вводимого конъюгата составляет в пределах от около 0,2 до около 1 г. Конъюгаты настоящего изобретения могут быть эффективными в широком диапазоне доз в зависимости от таких факторов, как тяжесть заболевания, на которое направлено лечение, модифицируемый биологический эффект, который желательно достигнуть, способ введения конъюгата, возраст, вес и состояние пациента, а также другие факторы, которые должны быть учтены лечащим врачом. Таким образом, количество конъюгата, необходимое для введения данному пациенту, должно быть определено индивидуально для каждого пациента.
При этом следует отметить, что хотя в примерах, приведенных ниже, описаны конкретные реагенты и реакционные условия, однако очевидно, что существо и объем настоящего изобретения также охватывают и различные их модификации. Поэтому нижеследующие процедуры и примеры носят лишь иллюстративный характер и не должны рассматриваться как некое ограничение изобретения.
ПРИМЕРЫ
Пример 1
Идентификация сайта PSA-опосредованного расщепления семеногелина
Разжижение семенного геля соответствует протеолитической фрагментации семеногелина (Lilja, Н., Laurell, C.B., (1984) Scand. J. Clin. Clab. Invest. 44, 447-452). Полагают, что протеолитическая фрагментация обусловлена, главным образом, активностью простатического антигена (Lilja, Н., (1985) J. Clin. Invest. 76, 1899-1903). Используя опубликованную последовательность семеногелина I (Lilja, Н., Abrahamsson, P.A., Lundwall, A., (1989)). Biol. Chem. 264, 1894-1900) (рис. 1), мы сконструировали PCR-праймеры (PCR - полимеразная цепная реакция) для клонирования кДНК семеногелина из коммерчески доступной кДНК-библиотеки, кодирующей белки предстательной железы (Clonetech, Palo Alto, CA.). Очищенную кДНК семеногелина встраивали в бактериальный экспрессирующий вектор pTAC (Linemeyer, D.L., Kelli, I.J., Minke, J. G. , Gimenez-Gallego, G., DeSalvo, J. & Thomas, K.A., (1987) Bio/ Technology 5, 960-965). кДНК семеногелина конструировали таким образом, что эпитоп тубулина находился у карбоксильного конца белка семеногелина. Семеногелин, экспрессированный с помощью бактериального вектора, очищали на колонке с антителом против тубулина. Очищенный белок семеногелин I смешивали с простатическим антигеном (PSA) (изготовленным промышленным путем (York Biologicals International, Stony Brook, NY)), в молярном отношении 100/1 (семеногелин 1/PSA) в 12 мМ Трис, pH 8,0, 25 мМ NaCl, 0,5 мМ CaCl2, а затем инкубировали в течение различных промежутков времени. Гидролизат фракционировали с помощью электрофореза в полиакриламидном геле и переносили путем электрофореза на фильтровальную бумагу ProBlott (Applied Biosystems, Inc., Foster City, CA.) в буфере CAPs (Matsudaira, P. , (1987) J. Biol. Chem. 252, 10035-10038). Фильтровальную бумагу ProBlott окрашивали кумасси синим для идентификации новых PSA-продуцированных фрагментов семеногелина I. Новые фрагменты вырезали из фильтра скальпелем и определяли их последовательности. После идентификации протеолитических фрагментов посредством гидролиза в различные периоды времени проводили реакцию гидролиза в течение 10 минут. Затем определяли относительную аффинность PSA для 5 потенциальных сайтов расщепления в последовательности семеногелина I, а именно: сайт 349/350 > сайт 375/376 > сайт 289/290 > сайт 315/316 > сайт 159/160. Относительные аффинности были получены исходя из интенсивности окраски кумасси синим каждого PSA-продуцированного пептидного фрагмента. Эти интенсивности имели приблизительные отношения 3:1:0,6:0,3.
Пример 2
Получение олигопептидов, содержащих сайт PSA-опосредованного расщепления
Олигопептиды получали путем твердофазного синтеза, где введение аминокислот осуществляли по схеме двойного присоединения на автоматическом пептидном синтезаторе Applied Biosystems модели 430A. Деблокирование и отделение олигопептида от полимерного носителя осуществляли путем обработки жидкой фтористоводородной кислотой. Олигопептиды очищали с помощью препаративной жидкостной хроматографии высокого давления на обращение-фазовой колонке с двуокисью кремния C18 с использованием градиента водной 0,1% трифторуксусной кислоты/ацетонитрила. Идентичность и гомогенность олигопептидов были подтверждены с помощью анализа аминокислотного состава жидкостной хроматографией высокого давления и масс-спектрометрического анализа путем бомбардировки быстрыми атомами. Олигопептиды, полученные этим методом, представлены на фиг. 2.
Пример 3
Оценка распознавания олигопептидов свободным PSA
Олигопептиды, полученные, как описано в примере 2, отдельно растворяли в буфере для PSA-гидролиза (12 мМ трис (гидроксиметил)аминометан, pH 8,0. 25 мМ NaCl, 0,5 мМ CaCl2) и полученный раствор добавляли к PSA в молярном отношении 100:1. Реакцию прекращали через различные промежутки времени путем добавления трифторуксусной кислоты (TFA) до конечного объема 1% (объем/объем). Погашенную реакцию анализировали с помощью ЖХВД на обращенно-фазовой колонке C18 с использованием градиента 0,1%, TFA/ацетонитрила. Результаты оценки представлены на фиг. 2. Другие олигопептиды, полученные, как описано в примере 2, были проанализированы тем же способом, за исключением того, что реакцию гасили через 4 часа. Результаты оценки показаны на фиг. 3. Удаление аспарагинового остатка из амино-конца олигопептида приводит к значительному ослаблению PSA-опосредованного гидролиза пептида, а присутствие остатка глутаминовой кислоты в карбоксильном конце пептида, очевидно, не играет решающей роли в распознавании простатическим антигеном.
Пример 4
Получение нерасщепляемых конъюгатов олигопептида и доксорубицина
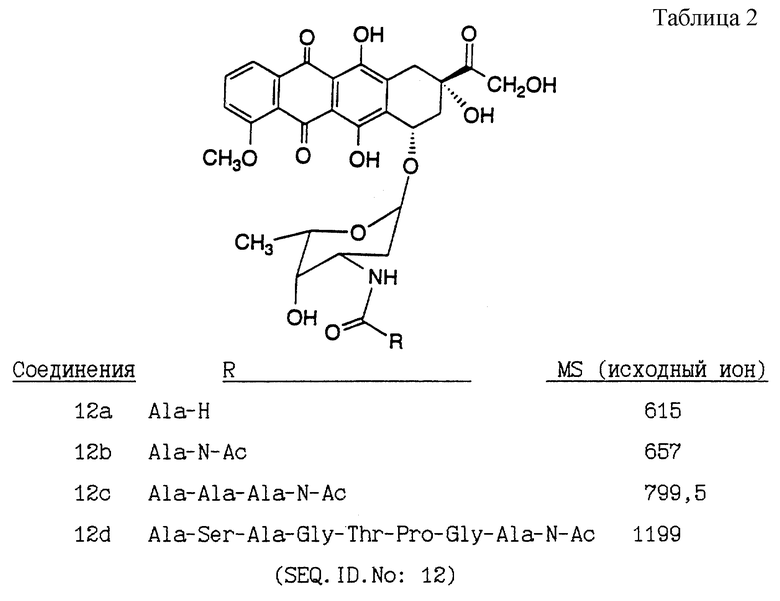
Производные доксорубицина, показанные в таблице 2, были получены в соответствии со следующей общей реакцией:
К смеси доксорубицина (Sigma) и соответствующего пептида (полученного путем твердофазного синтеза или закупленного в готовом виде (Sigma)) в ДМСО добавляли HBTS и HOBT вместе с диизопропилэтиламином и реакционную смесь размешивали в течение ночи. Затем неочищенную реакционную смесь очищали с помощью препаративной ВЭЖХ на обращенно-фазовой колонке с C-18, используя градиент 0,1% трифторуксусной кислоты (TFA) в ацетонитриле/ 0,1% TFA в воде.
Пример 5
In vitro-анализ цитотоксичности пептидиловых производных доксорубицина
Цитотоксичности нерасщепляемых конъюгатов олигопептида и доксорубицина (полученных, как описано в примере 4) против линии клеток, которые, как известно, подвергаются цитолизу под действием немодифицированного доксорубицина, оценивали посредством анализа с использованием аламарового синего. Для этого клеточные культуры клеток опухоли предстательной железы LNCaP, которые представляют собой метастатические клетки аденокарциомы предстательной железы, выделенные из пункционной биопсии лимфатического узла (LNCaP. FGC: Американская коллекция типовых культур, АТСС CRL 1740), или клеток DuPRO в 96-луночных планшетах разводили средой, содержащей различные концентрации данного конъюгата (конечный объем лунки планшета составляет 200 мкл). Затем клетки инкубировали в течение 3 дней при 37oC, после чего в лунку добавляли 20 мкл аламарового синего. После этого клетки снова инкубировали и аналитические планшеты прочитывали на ELISA-ридере ЕI-310 при двух длинах волн 570 и 600 нм через 4 и 7 часов после добавления аламарового синего. Затем вычисляли относительный процент жизнеспособности клеток при различных концентрациях испытуемых конъюгатов по сравнению с контрольными культурами (в отсутствие конъюгата). Оценивали также цитотоксичности немодифицированного дозоксорубицина и немодифицированного олигопептида. На фиг. 3 представлены данные цитотоксичности для характерного соединения (Соединения 12d).
Пример 6
Оценка ферментативной активности простатического антигена, происходящего из клеток LNCaP
Ферментативная активность была продемонстрирована путем инкубирования кондиционированной клетками LNCaP бессывороточной среды (примерно 200-кратно концентрированной) с рекомбинантным белком семеногелином I. Затем приблизительно 0,5 мкг иммунореактивного PSA в концентрированной кондиционированной среде (определенной с помощью ELISA HYBPIDTECH (Tandem Е)) смешивали приблизительно с 3 мкг рекомбинантного семеногелина I и инкубировали в течение 4 часов при 37oC. По окончании инкубирования гидролизованную смесь анализировали с помощью Вестерн-блот-анализа. Результаты показали, что очищенный PSA из спермы и PSA из LNCaP-кондиционированной среды давали идентичные протеолитические карты рекомбинантного белка семеногелина I. Таким образом клетки LNCaP продуцируют ферментативно активный PSA. Клетки LNCaP являются онкогенными у "голых" (бестимусных) мышей и продуцируют детектируемые уровни циркулирующего PSA.
Пример 7
Получение расщепляемых конъюгатов олигопептида-доксорубицина
Производные доксорубицина, в которых олигопептид, протеолитически расщепляемый свободным PSA, ковалентно связан с амином углеводной части доксорубицина, были получены в соответствии со следующей общей реакцией: к смеси дозоксорубицина (Sigma) и соответствующего пептида (полученного путем твердофазного синтеза, как описано в примере 2) в ДМСО добавляли HBTS и HOBT вместе с диизопропилэтиламином и реакционную смесь перемешивали в течение ночи. Неочищенную реакционную смесь очищали с помощью препаративной ВЭЖХ на обращенно-фазовой колонке с C-18, используя градиент 0,1% трифторуксусной кислоты (TFA) в ацетонитриле /0,1% TFA в воде. В случае, если на пептиде присутствовали реакционноспособные аминогруппы, то эти функциональные группы обычно блокировали флуоренилметилоксикарбонильной защитной группой, которую затем удаляли путем обработки вторичным амином, таким как пиперидин и т.п., а затем конъюгировали с доксорубицином. Конъюгаты настоящего изобретения имеют структуру общей формулы: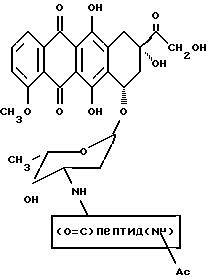
и могут быть обозначены как "Ас-пептид-DOX (3')". Конъюгаты, полученные этим способом, представлены на фиг. 5 (в таблице)/
Пример 8
Оценка распознавания конъюгатов "олигопептид-доксорубицин" свободным PSA
Конъюгаты, полученные, как описано в примере 7, отдельно растворяли в буфере для PSA-гидролиза (12 мМ трис(гидроксиметил)аминометан, pH 8,0; 0,25 мМ NaCl, 0,5 мМ CaCl2), и полученный раствор добавляли к PSA в молярном отношении 100: 1. Реакцию гасили через различные промежутки времени путем добавления трифторуксусной кислоты (TFA) до конечной концентрации 1% (объем/объем). После гашения реакции реакционную смесь анализировали с помощью ВЭЖХ на обращенно-фазовой колонке с C-18 с использованием градиента водной 0,1% TFA/ацетонитрила. Результаты оценки показаны на фиг. 5 (в таблице).
Пример 9
Оценка расщепления конъюгатов "олигопептид-доксорубицин" в кондиционированной клетками среде
Кондиционированные клетками бессывороточные среды MEMα (не содержащие фенолового красного) собирали через 3 дня после их добавления либо к клеточной линии LNCaP, либо к клеточной линии Dupro (полученных, как описано в J. Urology, 146: 915-919 (1991)). Эти среды 20-кратно концентрировали с использованием концентратора Amicon® с молекулярно-массовой отсечкой 10000. LNCaP-кондиционированная среда содержала свободный PSA-белок в средней концентрации приблизительно 100 нг/мл, как было определено с помощью набора для иммунодетекции Tandem®-E PSA (Hybritech®) . При этом в кондиционированной клетками Dupro среде свободного простатического антигена обнаружено не было.
с молекулярно-массовой отсечкой 10000. LNCaP-кондиционированная среда содержала свободный PSA-белок в средней концентрации приблизительно 100 нг/мл, как было определено с помощью набора для иммунодетекции Tandem®-E PSA (Hybritech®) . При этом в кондиционированной клетками Dupro среде свободного простатического антигена обнаружено не было.
100 мкл - порции концентрированной кондиционированной среды смешивали с 35 мкг конъюгата олигопептида-доксорубицина, полученного, как описано в примере 7, и смесь инкубировали при 37oC в течение периодов времени 0, 4 и 24 часа. Затем реакции прекращали путем добавления ZnCl2 (до конечной концентрации 0,01 М) и анализировали с помощью ВЭЖХ на обращенно-фазовой колонке с CD18 и с использованием градиента водной 1% TFA/ацетонитрила в целях определения процента гидролизованного конъюгата пептида-цитотоксического агента. Результаты оценки представлены на фиг. 6 (в таблице).
Пример 10
In vitro-анализ цитотоксичности пептидиловых производных доксорубицина
Цитотоксичность расщепляемых конъюгатов олигопептида-доксорубицина (полученных, как описано в примере 7) против линии клеток, которые, как известно, подвержены цитолизу под действием немодифицированного доксорубицина, оценивали с помощью анализа с использованием аламарового синего, как описано в примере 5. Для этого клеточные культуры опухолевых клеток предстательной железы LNCaP или клеток Dupro в 96-луночных планшетах разводили средой, содержащей различные концентрации данного конъюгата (конечный объем лунки планшета составлял 200 мкл). Затем клетки инкубировали в течение 3 дней при 37oC, и в аналитическую лунку добавляли 20 мкл аламарового синего. После этого клетки снова инкубировали и аналитические планшеты прочитывали на ELISA-ридере EL-310 при двух длинах волн: 570 и 600 нм через 4 и 7 часов после добавления аламарового синего. Затем вычисляли относительный процент жизнеспособности клеток при различных концентрациях испытуемых конъюгатов по сравнению с контрольными культурами (в отсутствие конъюгата). В этом же самом анализе оценивали также цитотоксичность конъюгатов по сравнению с цитотоксичностью немодифицированного доксорубицина и немодифицированного олигопептида. Результаты анализа представлены на фиг. 7 (в таблице). Т












































































Описываются олигопептиды, которые имеют аминокислотную последовательность от 6 до 100 аминокислот, распознаваемую и протеолитически расщепляемую свободным специфическим антигеном простаты (PSA) в ферментативно активной форме. Описаны также анализы, в которых указанные олигопептиды могут быть использованы для in vitro и in vivo-определения протеазной активности свободного PSA. Кроме того, раскрываются терапевтические агенты, содержащие конъюгаты указанных олигопептидов, представленные общей формулой I, и известных цитохимических агентов. 4 с. и 19 з.п.ф-лы, 7 ил., 2 табл.
где hArg представляет собой гомоаргинин;
Хаа представляет собой любую натуральную аминокислоту.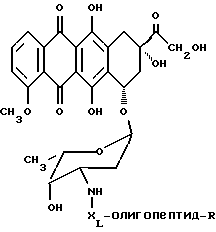
в которой "олигопептид" представляет собой олигопептид, содержащий от 6 до 100 аминокислот, который распознается и протеолитически селективно расщепляется свободным специфическим антигеном простаты в ферментативно активной форме, не образующей комплекс с какой-либо ингибирующей молекулой, и который содержит связь Gln-Ser, либо связь Tyr-Ser, либо связь между гомологичными им, изостерными и/или изоэлектронными аминокислотами, расщепляемую специфическим антигеном простаты;
XL отсутствует или представляет собой аминокислоту, выбранную из следующих аминокислот: а) фенилаланина, b) лейцина, с) валина, d) изолейцина, е) (2-нафтил)аланина, f) циклогексилаланина, g) дифенилаланина, h) норвалина и j) норлейцина;
R представляет собой водород или -(C=O)R1;
R1 представляет собой C1 - C6-алкил или арил.
где hArg представляет собой гомоаргинин;
Хаа представляет собой любую натуральную аминокислоту;
XL отсутствует или представляет собой аминокислоту, выбранную из: а) лейцина, b) изолейцина и с) валина;
R представляет собой ацетил, пивалоил или бензоил.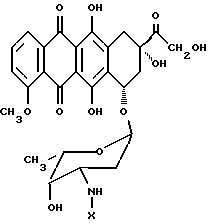
где Х представляет собой (см. графическую часть).
в которой "олигопептид" представляет собой олигопептид, содержащий от 6 до 100 аминокислот, который распознается и протеолитически селективно расщепляется свободным специфическим антигеном простаты и который содержит связь Gln-Ser, либо связь Tyr-Ser, либо связь между гомологичными им, изостерными и/или изоэлектронными аминокислотами, расщепляемую специфическим антигеном простаты.
Приоритеты по пунктам:
28.06.1994 по пп.6, 7, 11, 14 и 17;
15.03.1995 по пп.1, 2, 5, 8, 9, 10, 12, 13, 15, 16, 18 и 19;
07.06.1995 по пп.3, 4, 20, 21 и 22.
| US 4816561 A, 28.03.1989 | |||
| 8-ФТОРАНТРАЦИКЛИНГЛИКОЗИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2095365C1 |
| EP 0671412 A1, 13.09.1995 | |||
| 1970 |
|
SU417725A1 | |
| WO 9509149 A1, 06.04.1995. | |||
Авторы
Даты
2001-02-10—Публикация
1995-06-07—Подача