ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Для настоящей заявки испрашивается приоритет по Предварительной Патентной заявке США № 61/253990, поданной 22 октября 2009 г., содержание которой приведено в настоящем документе в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к области молекулярной биологии и регуляции факторов роста. Более конкретно, изобретение относится к модуляторам ферментной активации стимулирующего макрофаги белка и к использованию указанных модуляторов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Стимулирующий макрофаги белок (MSP) опосредует свою биологическую активность через связывание и активацию рецепторной тирозинкиназы Ron, члена семейства Met-протоонкогенов (Leonard & Danilkovitch, 2000). Взаимодействие MSP с его рецептором приводит к фосфорилированию рецептора и активации киназы. Путь MSP/Ron вовлечен в онкогенез различных злокачественных опухолей (см., например, Wagh et al., 2008). MSP представляет собой белок плазмы, который в первую очередь конститутивно синтезируется в паренхимальных клетках печени, но на низких уровнях экспрессируется также в легких, надпочечниках и плаценте. MSP циркулирует в крови в форме неактивного одноцепочечного предшественника (про-MSP), требующего протеолитического расщепления по связи Ser-Lys-Leu-Arg483↓Val484 (SEQ ID NO:1) для приобретения функциональной активности (Skeel et al., 1991) (Yoshimura et al., 1993). Активный MSP представляет собой гетеродимер α- и β-субъединиц, удерживаемых вместе дисульфидной связью. Известно, что MSP активируется в участке, расположенном вне сосуда, несколькими трипсиноподобными сериновыми протеазами (Bhatt et al., 2007; Kawaguchi et al., 2009; Wang et al., 1994b; Wang et al., 1996; Wang et al., 1994c).
Гепсин является членом семейства трансмембранных сериновых протеаз типа II (Netzel-Arnett et al., 2003; Wu & Parry, 2007) и идентифицирован как один из генов с наиболее сильной повышающей регуляцией при раке предстательной железы (Dhanasekaran et al., 2001; Luo et al., 2001; Magee et al., 2001; Stamey et al., 2001; Stephan et al., 2004; Welsh et al., 2001). Иммуногистохимическим окрашиванием выявили сильную экспрессию в опухолях на поздней стадии и очагах метастазирования в костях (Morrissey et al., 2008; Xuan et al., 2006), что позволяет предполагать роль гепсина в прогрессировании опухолей. Более того, на основании анализа экспрессии гена, гепсин вовлечен также в рак яичника (Tanimoto et al., 1997), почечноклеточный рак (Betsunoh et al., 2007; Zacharski et al., 1998) и рак эндометрия (Matsuo et al., 2008). Beliveau et al установили, что гепсин не расщепляет про-MSP (Beliveau et al., (2009) FEBS J. 276:2213-26).
Существует явная необходимость во всеобъемлющем понимании физиологических субстратов гепсина. Изобретение удовлетворяет этим требованиям и предоставляет другие преимущества.
Полное содержание всех процитированных в настоящем документе ссылок, включая патентные заявки и публикации, приведено в качестве ссылки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем документе описано, что гепсин эффективно превращает стимулирующий макрофаги пробелок (про-MSP) в стимулирующий макрофаги белок (MSP) посредством расщепления пептидной связи Arg483-Val484. Как описано в настоящем документе, физиологическим субстратом для гепсина является стимулирующий макрофаги пробелок, который является лигандом рецепторной тирозинкиназы Ron, члена семейства Met-протоонкогенов. В настоящем документе показано, что гепсин расщепляет про-MSP с высокой активностью, приводя к активированному MSP, обладающему нормальной биологической активностью. Изобретение относится к способам и композициям, основанным, по меньшей мере частично, на этих открытиях, подробно описанных в настоящем документе. Гепсин и его взаимодействие с про-MSP является уникальной и преимущественной мишенью для более тонкой регулировки при разработке профилактических и/или терапевтических способов против патологических состояний, ассоциированных с аномальной или нежелательной биологической активностью, опосредованной гепсином и/или MSP/Ron. Таким образом, изобретение относится к способам, композициям, наборам и изделиям для идентификации и для использования веществ, способных модулировать опосредованный гепсином и/или MSP/Ron биологический путь посредством модуляции молекулярных взаимодействий, вовлеченных в регуляцию активации MSP.
Соответственно, в одном аспекте изобретение относится к способу скрининга (или идентификации) вещества-кандидата - ингибитора (т.е. антагониста), ингибирующего активацию гепсином про-MSP, где указанный способ включает: (a) контакт вещества-кандидата с первым образцом, содержащим гепсин и субстрат про-MSP, и (b) сравнение уровня активации про-MSP в образце с уровнем активации про-MSP в контрольном образце, содержащем сходные количества гепсина и субстрата про-MSP, как и в первом образце, но не подвергавшемся контакту с указанным веществом-кандидатом, при этом уменьшение уровня активации про-MSP в первом образце по сравнению с контрольным образцом указывает на то, что вещество-кандидат способно ингибировать активацию про-MSP гепсином. В одном варианте осуществления гепсин в образце присутствует в эффективном количестве для активации указанного субстрата про-MSP. Субстрат про-MSP, пригодный для использования в этих способах, может присутствовать во множестве форм, при условии, что он мимикрирует характеристику участка расщепления гепсином в про-MSP.
Субстраты про-MSP включают, в качестве неограничивающих примеров, полноразмерную цепь MSP, содержащую форму пептидной связи Arg483-Val484 дикого типа, и любой фрагмент MSP, содержащий эту пептидную связь. Такой фрагмент может иметь любую длину, например, по меньшей мере (приблизительно) 5, 7, 10, 15, 20, 25 аминокислот в длину, или между (приблизительно) 4 и 25, 5 и 20, 7 и 15 аминокислотами в длину. Обычно и предпочтительно, субстрат про-MSP содержит пептидную связь Arg483-Val484, которую может расщеплять гепсин дикого типа. В некоторых вариантах осуществления субстрат про-MSP представляет собой синтетический субстрат про-MSP.
В другом аспекте изобретение относится к способу скрининга вещества, блокирующего активацию про-MSP гепсином, где указанный способ включает скрининг вещества, которое связывает (предпочтительно, но не обязательно, специфично) гепсин или про-MSP и блокирует специфическое взаимодействие (например, связывание) между гепсином и про-MSP. В некоторых вариантах осуществления вещество конкурирует с гепсином за связывание с MSP. В некоторых вариантах осуществления вещество конкурирует с про-MSP за связывание с гепсином. В одном варианте осуществления вещество содержит аминокислотную последовательность, состоит или в основном состоит из аминокислотной последовательности, обладающей по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 99% сходством или идентичностью последовательности по сравнению с про-MSP (например, человека), например, фрагмент MSP человека, содержащий аминокислотный остаток Arg483 с пептидной связью с Val484. В некоторых вариантах осуществления, где вещество содержит такую аминокислотную последовательность, состоит или в основном состоит из такой аминокислотной последовательности, фрагмент содержит мутацию по меньшей мере в части последовательности MSP или лишен по меньшей мере части последовательности MSP, ассоциированной с активностью, например, активацией Ron.
Как очевидно специалисту в данной области, анализы скрининга, совместимые с анализами, описанными выше, могут содержать также первую стадию скрининга для образования комплекса гепсин-MSP для получения первого набора модулирующих веществ-кандидатов с последующей второй стадией скрининга, основанной на способности первого набора модулирующих веществ-кандидатов модулировать активацию про-MSP и/или превращение про-MSP в форму, являющуюся биологически активной. Пригодные представления данных могут являться любыми, очевидными для специалиста в данной области, основанными на знании о формировании комплекса фермент-субстрат и/или видах биологической активности, ассоциированных с путем передачи сигнала гепсин/MSP/Ron. Образование фермент-субстратного комплекса можно измерять с использованием, например, общепринятых биохимических анализов (например, электрофореза в геле, хроматографии, ЯМР и т.д.).
В одном аспекте изобретение относится к антагонистам, нарушающим взаимодействие гепсин/MSP. Например, изобретение относится к молекуле, ингибирующей расщепление про-MSP гепсином (например, расщепление в положении Arg483-Val484). Молекула может проявлять свою ингибирующую функцию любым числом способов, включая, но без ограничения, связывание либо с гепсином, либо с про-MSP, так что ингибируется расщепление про-MSP гепсином, связывание с комплексом гепсин-про-MSP, так что ингибируется расщепление про-MSP, и/или связывание с про-MSP или гепсином (по отдельности или в комплексе), так что ингибируется расщепление MSP гепсином (например, ингибирование высвобождения MSP, следующего за расщеплением гепсином). В одном варианте осуществления молекула антагониста по изобретению ингибирует виды биологической активности, ассоциированные с активацией про-MSP/Ron.
В одном аспекте антагонист по изобретению получен на основании открытия, описанного в настоящем документе, что фрагмент ингибиторов активатора фактора роста гепатоцитов (HAI-1, HAI-1B, HAI-2) является сильным ингибитором активации про-MSP гепсином. В одном варианте осуществления изобретение относится к антагонисту активации про-MSP гепсином, где указанный антагонист содержит по меньшей мере часть (включая все) HAI-1, HAI-IB или HAI-2 человека. В одном варианте осуществления указанная часть содержит последовательность домена Кунитца (KD), способную ингибировать активацию про-MSP гепсином. В одном варианте осуществления указанная последовательность домена Кунитца представляет собой домен Кунитца 1 (KD1) HAI-1 или HAI-IB. В одном варианте осуществления антагонист по изобретению содержит вариант KD1, обладающий по меньшей мере приблизительно 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% идентичностью последовательности с KD1 дикого типа HAI-1 человека, где указанный вариант последовательности обладает способностью ингибировать расщепление про-MSP человека гепсином, по меньшей мере сравнимой со способностью KD1 дикого типа. В одном варианте осуществления антагонист по изобретению содержит вариант последовательности KD1, обладающий между приблизительно 70% и 99%, приблизительно 75% и 98%, приблизительно 80% и 97%, 85% и 95% идентичностью последовательности с KD1 дикого типа HAI-1 человека, где указанная последовательность обладает способностью ингибировать расщепление про-MSP человека гепсином, по меньшей мере сравнимой со способностью KD1 дикого типа. В одном варианте осуществления указанная последовательность домена Кунитца представляет собой один или оба из доменов Кунитца HAI-2. В одном варианте осуществления антагонист по изобретению содержит вариант последовательности домена Кунитца HAI-2, обладающий по меньшей мере приблизительно 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% идентичностью последовательности с соответствующим доменом(доменами) Кунитца HAI-2 человека дикого типа, где указанный вариант последовательности обладает способностью ингибировать расщепление про-MSP человека гепсином, по меньшей мере сравнимой со способностью HAI-2 дикого типа. В одном варианте осуществления антагонист по изобретению содержит вариант последовательности домена Кунитца HAI-2, обладающий между приблизительно 70% и 99%, приблизительно 75% и 98%, приблизительно 80% и 97%, 85% и 95% идентичностью последовательности с соответствующим доменом(доменами) Кунитца HAI-2 человека дикого типа, где указанная последовательность обладает способностью ингибировать расщепление про-MSP человека гепсином, по меньшей мере сравнимой со способностью HAI-2 дикого типа.
В некоторых вариантах осуществления антагонист по изобретению представляет собой или содержит малую молекулу, пептид, антитело, фрагмент антитела, аптамер или их комбинацию. Антагонисты, как описано в настоящем описании, можно получать общепринятым образом с использованием способов, известных в данной области (включая способы, более подробно описанные ниже), на основании открытия взаимодействия гепсина и про-MSP, как описано в настоящем описании. Например, в некоторых вариантах осуществления антагонист по изобретению конкурирует с гепсином за связывание с про-MSP, но не обладает способностью расщеплять про-MSP в участке расщепления гепсином (например, в Arg483-Val484). В некоторых вариантах осуществления антагонист по изобретению конкурирует с про-MSP за связывание с гепсином. Например, в одном варианте осуществления указанный антагонист содержит аминокислотную последовательность, состоит или в основном состоит из аминокислотной последовательности, обладающей по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 98%, 99% сходством или идентичностью последовательности по отношению к про-MSP (например, про-MSP человека) и по существу обладает способностью связывать гепсин, но лишен участка расщепления гепсином (например, пептидной связи про-MSP Arg483-Val484) и/или лишен биологической активности (например, когда β-цепь MSP подвергают мутации, так что ее функция по существу снижена или утрачена и т.д.). В одном варианте осуществления антагонист по изобретению содержит фрагмент про-MSP, состоит или в основном состоит из фрагмента про-MSP, способного связывать гепсин, где указанный фрагмент лишен по меньшей мере части последовательности MSP, ассоциированной с биологической активностью.
Таким образом, изобретение относится к мутанту MSP (или про-MSP), по существу способному связывать гепсин, но обладающему пониженной биологической активностью MSP по сравнению с MSP дикого типа, например, антагонисту активности MSP или варианту MSP со снижением, но не отсутствием, биологической активности MSP. В одном варианте осуществления антагонист по изобретению способен ингибировать биологическую активность (in vitro или in vivo) MSP дикого типа (такая биологическая активность включает, но без ограничения, биологическую активность по отношению к плазминогену в качестве субстрата). В одном варианте осуществления антагонист по изобретению обладает сниженной биологической активностью MSP.
В некоторых вариантах осуществления антитело-антагонист по изобретению содержит антитело против гепсина, блокирующее активацию про-MSP гепсином. В некоторых вариантах осуществления антитело против гепсина содержит (a) легкую цепь, содержащую (i) HVR-L1, содержащую последовательность RASQSVSSAVA (SEQ ID NO:2); (ii) HVR-L2, содержащую последовательность SASSLYS (SEQ ID NO:3); и (iii) HVR-L3, содержащую последовательность QQYYSSYYLLT (SEQ ID NO:4); и/или (b) тяжелую цепь, содержащую (i) HVR-H1, содержащую последовательность GFNFSYSYMH (SEQ ID NO:5); (ii) HVR-H2, содержащую последовательность ASIYSYYGSTYYADSVKG (SEQ ID NO:6); и (iii) HVR-H3, содержащую последовательность ARSDSWSYKSGYTQKIYSKGLDY (SEQ ID NO:7). В некоторых вариантах осуществления антитело против гепсина содержит вариабельную область легкой цепи, содержащую последовательность DIQMTQSPSSLSASVGDRVTITCRASQSVSSAVAWYQQKPGKAPKLLIYSASSLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQYYSSYYLLTFGQGTKVEIK (SEQ ID NO:8) и/или вариабельную область тяжелой цепи, содержащую последовательность EVQLVESGGGLVQPGGSLRLSCAASGFNFSYSYMHWVRQAPGKGLEWVASIYSYYGSTYYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARSDSWSYKSGYTQKIYSKGLDYWGQGTLVTVSS (SEQ ID NO:9). В некоторых вариантах осуществления антитело представляет собой моноклональные антитело. В других вариантах осуществления антитело представляет собой поликлональное антитело. В некоторых вариантах осуществления антитело выбрано из группы, состоящей из химерного антитела, антитела после аффинного созревания, гуманизированного антитела и человеческого антитела. В конкретных вариантах осуществления антитело представляет собой фрагмент антитела. В некоторых вариантах осуществления антитело представляет собой Fab, Fab', Fab'-SH, F(ab')2 или scFv.
В некоторых вариантах осуществления связывание вещества или молекулы по изобретению с гепсином ингибирует активацию гепсином субстрата гепсина. В некоторых вариантах осуществления связывание вещества или молекулы по изобретению с гепсином конкурентно ингибирует активацию гепсином субстрата гепсина. В одном варианте осуществления вещество связывает гепсин в отсутствии соединения, блокирующего активный (например, каталитический) участок гепсина, но не связывает гепсин в присутствии соединения, блокирующего активный участок гепсина.
В некоторых вариантах осуществления связывание указанных вещества или молекулы с гепсином ингибирует рост клеток (например, пролиферацию, выживаемость, ангиогенез, морфогенез, миграцию клеток), индуцированный MSP. В некоторых вариантах осуществления связывание указанных вещества или молекулы с гепсином ингибирует активацию рецептора Ron. В некоторых вариантах осуществления связывание вещества или молекулы по изобретению с гепсином ингибирует связывание субстрата гепсина с гепсином. В некоторых вариантах осуществления связывание вещества или молекулы по изобретению с гепсином не ингибирует связывание субстрата гепсина с гепсином. В некоторых вариантах осуществления связывание вещества или молекулы по изобретению с гепсином ингибирует активность гепсина, такую как ферментативная активность гепсина. В некоторых вариантах осуществления ферментативная активность гепсина включает расщепление полипептидного субстрата гепсина. В одном варианте осуществления полипептидный субстрат гепсина представляет собой про-MSP.
В некоторых вариантах осуществления антагонист по изобретению получают способом скрининга или идентификации по изобретению, как описано в настоящем документе.
В одном аспекте молекула антагониста по изобретению связана с токсином, таким как цитотоксическое средство. Эти молекулы можно составлять или вводить в сочетании с дополнительным/усиливающим средством, таким как радиоактивное и/или химиотерапевтическое средство.
Изобретение относится также к способам и композициям, пригодным для модуляции состояний заболевания, ассоциированных с нарушением регуляции пути гепсин/MSP/Ron. Таким образом, в одном аспекте изобретение относится к способу модуляции активации про-MSP у субъекта, где указанный способ включает введение субъекту молекулы модулятора гепсина/MSP по изобретению (например, молекулы антагониста, как описано в настоящем документе, ингибирующей расщепление про-MSP гепсином), посредством чего модулируют активацию про-MSP. В одном варианте осуществления указанная молекула представляет собой антагонист, ингибирующий активность MSP. В одном аспекте изобретение относится к способу лечения патологического состояния, ассоциированного с нарушением регуляции MSP у субъекта, где указанный способ включает введение субъекту антагониста по изобретению (например, любого из антагонистов расщепления про-MSP гепсином, как описано в настоящем документе), посредством чего ингибируют активацию про-MSP. В одном аспекте изобретение относится к способу модуляции активации Ron у субъекта, где указанный способ включает введение субъекту молекулы модулятора MSP/Ron по изобретению (например, молекулы антагониста, как описано в настоящем документе, ингибирующей расщепление про-MSP гепсином), посредством чего модулируют активацию Ron. В одном варианте осуществления указанная молекула представляет собой антагонист MSP/Ron, ингибирующий активность MSP/Ron. В одном аспекте изобретение относится к способу лечения патологического состояния, ассоциированного с нарушением регуляции Ron у субъекта, где указанный способ включает введение субъекту антагониста Ron по изобретению (например, любого из антагонистов расщепления про-MSP гепсином, как описано в настоящем документе), посредством чего ингибируют активацию Ron.
Путь передачи сигнала MSP/Ron вовлечен во множество биологических и физиологических функций, включая, например, стимуляцию роста клеток (например, пролиферацию клеток, выживаемость клеток, миграцию клеток, морфогенез клеток) и иммунный ответ (например, увеличенный воспалительный ответ, увеличенная продукция NO макрофагами).
Таким образом, в одном аспекте изобретение относится к способу ингибирования роста (например, роста, пролиферации или выживаемости клеток) клетки, экспрессирующей Ron или MSP, или оба, где рост клетки, по меньшей мере частично, зависит от гепсина, Ron и/или MSP, где указанный способ включает контакт указанной клетки с антагонистом по изобретению, таким образом вызывая ингибирование роста указанной клетки.
В одном аспекте изобретение относится к способу ингибирования миграции клетки, где миграция указанной клетки по меньшей мере частично зависит от гепсина, Ron и/или MSP, где указанный способ включает контакт указанной клетки с эффективным количеством антагониста по изобретению, таким образом ингибируя рост указанной клетки.
Таким образом, в одном аспекте изобретение относится к способу стимуляции апоптоза клетки, экспрессирующей Ron или MSP, или оба, где выживаемость клетки по меньшей мере частично зависит от гепсина, Ron и/или MSP, где указанный способ включает контакт указанной клетки с антагонистом по изобретению, таким образом вызывая ингибирование роста указанной клетки.
В другом аспекте изобретение относится к способу ингибирования иммунного ответа (например, воспаления), где иммунный ответ по меньшей мере частично зависит от гепсина, Ron и/или MSP, где указанный способ включает введение в клетку, ткань и/или субъекту с состоянием, ассоциированным с аномальным иммунным ответом, антагониста по изобретению, посредством чего ингибируют иммунный ответ.
В одном аспекте изобретение относится к использованию антагониста по изобретению в получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток и/или иммунное (например, аутоиммунное) нарушение. Антагонист может присутствовать в любой форме, описанной в настоящем документе, включая антитело, фрагмент антитела, малую молекулу (например, органическую молекулу), полипептид (например, олигопептид), нуклеиновую кислоту (например, олигонуклеотид, такой как антисмысловой олигонуклеотид или интерферирующая РНК), аптамер или их сочетание.
В одном аспекте изобретение относится к использованию нуклеиновой кислоты по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток и/или иммунное (например, аутоиммунное) нарушение.
В одном аспекте изобретение относится к использованию экспрессирующего вектора по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток и/или иммунное (например, аутоиммунное) нарушение.
В одном аспекте изобретение относится к использованию клетки-хозяина по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток и/или иммунное (например, аутоиммунное) нарушение.
В одном аспекте изобретение относится к использованию изделия по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток, иммунное (например, аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение (при заживлении ран).
В одном аспекте изобретение относится к использованию набора по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, опухоль, нарушение пролиферации клеток и/или иммунное (например, аутоиммунное) нарушение.
Способы по изобретению можно использовать для воздействия на любое подходящее патологическое состояние, например, клеток и/или тканей, ассоциированное с нарушением регуляции пути передачи сигнала гепсином и/или Ron/MSP. Иллюстративные нарушения описаны в настоящем документе и включают злокачественную опухоль, выбранную из группы, состоящей из немелкоклеточного рака легкого, рака яичника, рака щитовидной железы, рака яичка, рака эндометрия, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи), злокачественной опухоли мозга (например, нейробластомы или менингиомы), рака кожи (например, меланомы, базально-клеточной карциномы или плоскоклеточной карциномы), рака мочевого пузыря (например, переходно-клеточной карциномы), карциномы молочной железы, рака желудка, колоректального рака (CRC), печеночно-клеточной карциномы, рака шейки матки, рака легкого, рака поджелудочной железы, рака предстательной железы, злокачественной опухоли почек и рака эндометрия.
В одном варианте осуществления клетка, на которую нацеливаются в способе по изобретению, представляет собой клетку злокачественной опухоли. Например, клетка злокачественной опухоли может представлять собой клетку, выбранную из группы, состоящей из клетки рака молочной железы, клетки колоректального рака, клетки рака легкого (например, клетки немелкоклеточного рака легкого), клетки рака щитовидной железы, клетки множественной миеломы, клетки рака яичка, клетки папиллярной карциномы, клетки рака толстого кишечника, клетки рака поджелудочной железы, клетки рака яичника, клетки рака шейки матки, клетки злокачественной опухоли центральной нервной системы, клетки остеогенной саркомы, клетки карциномы почек, клетки печеночно-клеточной карциномы, клетки рака мочевого пузыря (например, клетки переходно-клеточной карциномы), клетки карциномы желудка, клетки плоскоклеточной карциномы головы и шеи, клетки меланомы, клетки лейкоза, клетки рака эндометрия и клетки аденомы ободочной кишки. В одном варианте осуществления клетка, на которую нацеливаются в способе по изобретению, является гиперпролиферативной и/или гиперпластической клеткой. В другом варианте осуществления клетка, на которую нацеливаются в способе по изобретению, является диспластической клеткой. В другом варианте осуществления клетка, на которую нацеливаются в способе по изобретению, является метастазирующей клеткой.
Способы по изобретению могут, кроме того, включать дополнительные стадии обработки. Например, в одном варианте осуществления способ дополнительно включает стадию, где намеченную клетку и/или ткань (например, клетку злокачественной опухоли) подвергают обработке радиоактивным излучением или химиотерапевтическим средством.
Как описано в настоящем документе, активация Ron является важным биологическим процессом, нарушение регуляции которого приводит ко множеству патологических состояний. Соответственно, в одном варианте осуществления способов по изобретению клетка, на которую нацеливаются (например, клетка злокачественной опухоли), представляет собой клетку, в которой активация Ron усилена по сравнению с нормальной клеткой, происходящей из той же ткани. В одном варианте осуществления способ по изобретению вызывает гибель намеченной клетки. Например, контакт с антагонистом по изобретению может приводить к неспособности клетки передавать сигнал через путь передачи сигнала Ron.
Нарушение регуляции активации Ron (и таким образом, передачи сигнала) может приводить к ряду изменений клеток, включая, например, сверхэкспрессию MSP (родственного Ron лиганда) и/или самого Ron.
Соответственно, в некоторых вариантах осуществления способ по изобретению включает нацеливание на клетку, где Ron или MSP, или оба, более сильно экспрессируются в указанной клетке (например, клетке злокачественной опухоли) по сравнению с нормальной клеткой, происходящей из той же ткани.
Нарушение активации про-MSP (и таким образом, активации Ron) может приводить к ряду изменений клеток, включая, например, сверхэкспрессию гепсина, про-MSP и/или Ron. Соответственно, в некоторых вариантах осуществления способ по изобретению включает нацеливание на клетку или ткань, когда гепсин, про-MSP и/или Ron, более сильно экспрессируется в указанной клетке или ткани (например, клетке или ткани злокачественной опухоли) по сравнению с нормальной соответствующей клеткой или тканью.
В одном аспекте изобретение относится к композициям, содержащим один или несколько антагонистов по изобретению и носитель. В одном варианте осуществления носитель является фармацевтически приемлемым.
В одном аспекте изобретение относится к нуклеиновым кислотам, кодирующим антагонист по изобретению. В одном варианте осуществления нуклеиновая кислота по изобретению кодирует антагонист, который представляет собой или содержит полипептид (например, олигопептид). В одном варианте осуществления нуклеиновая кислота по изобретению кодирует антагонист, который представляет собой или содержит антитело или его фрагмент.
В одном аспекте изобретение относится к векторам, содержащим нуклеиновую кислоту по изобретению.
В одном аспекте изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор по изобретению. Вектор может представлять собой вектор любого типа, например, рекомбинантный вектор, такой как экспрессирующий вектор. Можно использовать любые из множества клеток-хозяев. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку, например, E. coli. В одном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, например, клетку млекопитающего, такую как клетка яичников китайского хомяка (CHO).
В одном аспекте изобретение относится к способам получения антагониста по изобретению. Например, изобретение относится к способу получения антагониста, который представляет собой или содержит антитело (или его фрагмент), где указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора по изобретению, содержащего последовательность, кодирующую указанное антитело (или его фрагмент), и выделение указанного антитела (или его фрагмента). В другом примере изобретение относится к способу получения антагониста, который представляет собой или содержит полипептид (такой как олигопептид), где указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора по изобретению, кодирующего указанный полипептид (такой как олигопептид), и выделение указанного полипептида (такого как олигопептид).
В одном аспекте изобретение относится к изделию, содержащему контейнер; и композицию, содержащуюся внутри контейнера, где композиция содержит один или несколько антагонистов по изобретению. В одном варианте осуществления композиция содержит нуклеиновую кислоту по изобретению. В одном варианте осуществления композиция, содержащая антагонист, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления изделие по изобретению дополнительно содержит инструкции для введения композиции (например, антагониста) субъекту.
В одном аспекте изобретение относится к набору, содержащему первый контейнер, содержащий композицию, содержащую один или несколько антагонистов по изобретению; и второй контейнер, содержащий буфер. В одном варианте осуществления буфер является фармацевтически приемлемым. В одном варианте осуществления композиция, содержащая антагонист, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления набор дополнительно содержит инструкции для введения композиции (например, антагониста) субъекту.
В одном аспекте изобретение относится к композиции, содержащей очищенные про-MSP и гепсин. В некоторых вариантах осуществления композиция дополнительно содержит клетки, экспрессирующие Ron.
В одном аспекте изобретение относится к способам детекции про-MSP в образце, включающим (1) контакт образца с гепсином в условиях, позволяющих протеолитический процессинг MSP гепсином, и (2) детекцию присутствия активированного гепсином MSP.
В одном аспекте изобретение относится к способам детекции гепсина в образце, включающим (1) контакт образца с про-MSP в условиях, позволяющих протеолитический процессинг MSP гепсином, и (2) детекцию присутствия активированного гепсином MSP.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГУРА 1: Активация про-MSP гепсином in vitro. Рекомбинантный гепсин активировал про-MSP зависимым от дозы образом при инкубации в течение 1 часа при 37°C. Продукты разделяли в SDS-PAGE в восстанавливающих условиях. N-концевое секвенирование полосы ~25 кДа (показано) указывало на то, что она представляла собой β-цепь, и таким образом, гепсин расщеплял про-MSP по связи Arg483-Val484. На фигуре 1 описан SEQ ID NO:17.
ФИГУРА 2: Активация про-MSP экспрессированным на поверхности клеток гепсином для клеток LnCap-34. Клетки LnCap-34 со стабильной сверхэкспрессией гепсина подвергали голоданию по сыворотке и обрабатывали 125I-про-MSP отдельно или в сочетании с различными ингибиторами в течение 3 часов. Рекомбинантный гепсин (10 нМ) использовали в качестве положительного контроля. Значительное увеличение процессинга про-MSP наблюдали через 3 часа по сравнению с началом эксперимента. Ингибиторы KQLR (SEQ ID NO 10), KD1 и антитело против гепсина Fab25 эффективно блокировали активацию про-MSP.
ФИГУРА 3: Связывание активированного гепсином MSP с Ron. (a) Для эксперимента поверхностного плазмонного резонанса, чип CM5 с присоединенным по аминогруппе специфическим антителом против Fc использовали для иммобилизации Ron-Fc на биосенсоре. Не наблюдали поддающегося детекции связывания про-MSP (1 мкМ) с Ron, в то время как для активированного гепсином MSP показали высокую аффинность связывания (ΚD 7 нМ) с Ron, где данные подходили под модель связывания 1:1. (b) В эксперименте ELISA для измерения связывания MSP с Ron, определенная эффективная концентрация для получения половины максимального связывания (EC50) составляла 0,519 нМ.
ФИГУРА 4: Фосфорилирование S6- и MAP-киназы. Ни гепсин, ни про-MSP по отдельности не были эффективны для активации пути передачи сигнала Ron, в то время как для обработки про-MSP гепсином показали сильное фосфорилирование как MAP-киназы, так и S6-киназы зависимым от дозы образом.
ФИГУРА 5: Анализ изменения морфологии перитонеальных макрофагов. При стимуляции активированным гепсином MSP перитонеальные макрофаги подвергаются определенным изменениям формы клеток, проявляемых ветвлением и удлинением. Эффект активированного гепсином MSP являлся сравнимым с эффектом коммерчески доступного MSP, так же как активированного HGFA MSP.
ФИГУРА 6: Анализ хемотаксиса. Обработка про-MSP гепсином приводила к значимому увеличению (p<0,001) миграции перитонеальных макрофагов, и эффект являлся сравнимым с эффектом зрелого MSP из коммерческого источника. Для предварительной обработки ингибитором анти-гепсином (антителом против гепсина Fab25) показано заметное уменьшение миграции макрофагов.
ФИГУРА 7: Ингибирование синтеза оксида азота. Для первичных макрофагов костного мозга мыши показали сильную продукцию оксида азота в ответ на LPS. Активированный гепсином MSP значительно ослаблял продукцию NO в происходящих из костного мозга макрофагах. Эффект активированного гепсином MSP являлся сравнимым с эффектом коммерчески доступного MSP. Обработка про-MSP или про-MSP, смешанным с гепсином и антителом против гепсина Fab25, не ингибировала сильную продукцию оксида азота в ответ на LPS.
ФИГУРА 8: Один из вариантов осуществления аминокислотной последовательности природного гепсина человека (SEQ ID NO: 18).
ФИГУРА 9: (A) & (B) Другой вариант осуществления аминокислотной последовательности природного гепсина человека (SEQ ID NO: 19).
ФИГУРА 10: Один из вариантов осуществления аминокислотной последовательности природного стимулирующего макрофаги пробелка человека (про-MSP) (SEQ ID NO: 20).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способам, композициям, наборам и изделиям, содержащим модуляторы пути передачи сигнала MSP/Ron, включая способы использования таких модуляторов.
Подробное описание этих способов, композиций, наборов и изделий представлено в настоящем документе.
Общие способы
В практике настоящего изобретения используют, если нет иных указаний, общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в компетенции специалистов в данной области. Такие способы полностью объяснены в литературе, такой как «Molecular Cloning: A Laboratory Manual», second edition (Sambrook et al., 1989); «Oligonucleotide Synthesis» (M. J. Gait, ed., 1984); «Animal Cell Culture» (R. I. Freshney, ed., 1987); «Methods in Enzymology» (Academic Press, Inc.); «Current Protocols in Molecular Biology» (F. M. Ausubel et al., eds., 1987, и periodic updates); «PCR: The Polymerase Chain Reaction » (Mullis et al., ed., 1994); «A Practical Guide to Molecular Cloning» (Perbal Bernard V., 1988); «Phage Display: A Laboratory Manual» (Barbas et al., 2001).
Определения
Термин «гепсин», как применяют в настоящем документе, включает полипептиды с природной последовательностью, полипептидные варианты и фрагменты полипептида с природной последовательностью и полипептидные варианты (дополнительно определенные в настоящем документе), способные расщеплять про-MSP сходным образом с гепсином дикого типа. Полипептид гепсина, описанный в настоящем документе, может представлять собой полипептид, выделенный из множества источников, таких как типы тканей человека, или из другого источника, или полученный рекомбинантными или синтетическими способами. Термины «гепсин», «полипептид гепсина», «фермент гепсин» и «белок гепсин» также включают варианты полипептида гепсина, как описано в настоящем документе.
«Полипептид гепсина с природной последовательностью» включает полипептид, имеющий такую же аминокислотную последовательность, как и соответствующий полипептид гепсина, полученный из природного источника. В одном варианте осуществления природная последовательность полипептида гепсина содержит аминокислотную последовательность из фигуры 8. В одном варианте осуществления природная последовательность полипептида гепсина содержит аминокислотную последовательность из фигуры 9. Такую природную последовательность полипептида гепсина можно выделять из природных источников или можно получать рекомбинантными или синтетическими способами. Термин «природная последовательность полипептида гепсина» конкретно включает встречающиеся в природе усеченные или секретируемые формы конкретного полипептида гепсина (например, последовательность внеклеточного домена), формы встречающихся в природе вариантов (например, формы после альтернативного сплайсинга) и встречающиеся в природе аллельные варианты полипептида.
«Вариант полипептида гепсина», или его вариации, обозначает полипептид гепсина, как правило, активный полипептид гепсина, как определено в настоящем документе, обладающий по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности с любой из природных последовательностей полипептидов гепсина, как описано в настоящем документе. Такие варианты полипептида гепсина включают, например, полипептиды гепсина, где один или несколько аминокислотных остатков добавлены или делетированы на N- или C-конце природной аминокислотной последовательности. Обычно, вариант полипептида гепсина обладает по меньшей мере приблизительно 80% идентичностью аминокислотной последовательности, альтернативно, по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью аминокислотной последовательности с природной последовательностью полипептида гепсина, как описано в настоящем документе. Обычно, варианты полипептидов гепсина имеют длину по меньшей мере приблизительно 10 аминокислот, альтернативно, длину по меньшей мере приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600 аминокислот или более. Необязательно, варианты полипептидов гепсина имеют не более одной консервативной аминокислотной замены по сравнению с природной последовательностью полипептида гепсина, альтернативно, не более 2, 3, 4, 5, 6, 7, 8, 9 или 10 консервативных аминокислотных замен по сравнению с природной последовательностью полипептида гепсина.
«Процент (%) идентичности аминокислотной последовательности» по отношению к последовательности пептида или полипептида определяют как процент аминокислотных остатков в последовательности-кандидате, идентичных с аминокислотными остатками конкретной последовательности пептида или полипептида, после выравнивания последовательностей и внесения пропусков, если необходимо, для достижения максимального процента идентичности последовательностей, и не рассматривая никаких консервативных замен в качестве части идентичности последовательности. Выравнивание для цели определения процента идентичности аминокислотной последовательности можно выполнять различными способами, известными специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей по настоящему изобретению величины % идентичности аминокислотных последовательностей получали с использованием компьютерной программы сравнения последовательностей ALIGN-2, как описано в патенте США № 6828146.
Термин «вектор», как применяют в настоящем документе, предназначен для обозначения молекулы нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, к которой она присоединена. Одним из типов векторов является «плазмида», которая относится к замкнутому кольцу двухцепочечной ДНК, в которую можно лигировать дополнительные фрагменты ДНК. Другим типом вектора является фаговый вектор. Другим типом вектора является вирусный вектор, где дополнительные фрагменты ДНК можно лигировать в вирусный геном. Конкретные векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальную точку начала репликации, и эписомальные векторы млекопитающих). Другие векторы (например, не эписомальные векторы млекопитающих) можно встраивать в геном клетки-хозяина при введении в клетку-хозяина и таким образом реплицировать вместе с геномом хозяина. Более того, конкретные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы обозначены в настоящем документе как «рекомбинантные экспрессирующие векторы» (или просто «рекомбинантные векторы»). Как правило, экспрессирующие векторы для использования в способах рекомбинантных ДНК часто присутствуют в форме плазмид. В настоящем описании «плазмида» и «вектор» могут быть использованы взаимозаменяемо, поскольку плазмида является наиболее общеупотребительной формой вектора.
«Полинуклеотид» или «нуклеиновая кислота», как используют в настоящем документе взаимозаменяемо, относится к полимерам нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который можно включать в полимер посредством ДНК- или РНК-полимеразы или посредством реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификация в структуре нуклеотида, если присутствует, может быть введена до или после сборки полимера. Последовательность нуклеотидов можно прерывать ненуклеотидными компонентами. Полинуклеотид после синтеза можно модифицировать далее, например, посредством конъюгации с меткой. Другие типы модификаций включают, например, «кэпы», замену одного или нескольких природных нуклеотидов аналогом, межнуклеотидные модификации, например, такие как модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые группы, например, такие как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), модификации с интеркалирующими веществами (например, акридин, псорален и т.д.), модификации с хелатирующими веществами (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации с алкилирующими веществами, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), так же как немодифицированные формы полинуклеотида(ов). Кроме того, любую из гидроксильных групп, обычно присутствующих в сахарах, можно заменять, например, фосфонатными группами, фосфатными группами, защищать общепринятыми защитными группами или активировать для получения дополнительных связей с дополнительными нуклеотидами, или можно конъюгировать с твердыми или полутвердыми подложками. 5'- и 3'-концевые OH можно фосфорилировать или заменять аминами, или органическими кэпирующими группами с 1-20 атомами углерода. Другие гидроксилы также можно дериватизировать до общепринятых защитных групп. Полинуклеотиды могут содержать также формы аналогов сахаров рибозы или дезоксирибозы, которые в основном известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фторо- или 2'-азидорибозу, аналоги карбоциклических сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и лишенные азотистого основания аналоги нуклеозидов, такие как метилрибозид. Одну или несколько фосфодиэфирных связей можно заменять альтернативными связывающими группами. Эти альтернативные связывающие группы включают, но без ограничения, варианты осуществления, где фосфат заменен на P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацеталь»), в которых каждый из R или R' независимо представляет собой H или замещенный или незамещенный алкил (1-20°C), необязательно, содержащий простую эфирную связь (-O-), арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание относится ко всем полинуклеотидам, на которые ссылаются в настоящем документе, включая РНК и ДНК.
«Олигонуклеотид», как применяют в настоящем документе, как правило, относится к коротким, как правило, одноцепочечным, как правило, синтетическим полинуклеотидам, которые, как правило, но не обязательно, обладают длиной менее приблизительно 200 нуклеотидов. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Описание, приведенное выше для полинуклеотидов, одинаково и полностью применимо к олигонуклеотидам.
Термин «стимулирующий макрофаги белок» и «MSP», или «стимулирующий макрофаги пробелок» и «про-MSP», как применяют в настоящем документе, относится, если конкретно или в контексте не указано иначе, к любому полипептиду MSP или варианту (природному или синтетическому) полипептида MSP, способному активировать плазминоген в условиях, позволяющих прохождение такого процесса, или к полипептиду MSP, который можно активировать гепсином до активированного MSP, способного активировать плазминоген в условиях, позволяющих прохождение такого процесса. Термин «MSP дикого типа», как правило, относится к полипептиду, содержащему аминокислотную последовательность природного белка MSP, например, как показано на фигуре 10 и перечислено в SwissProt под № доступа P26927 (ссылки, перечисленные под этим номером доступа, приведены в настоящем документе в качестве ссылок).
Термины «антитело» и «иммуноглобулин» используют взаимозаменяемо в самом широком смысле, и они включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, мультиспецифические антитела (например, биспецифические антитела), пока они обладают желательной биологической активностью, и могут также включать конкретные фрагменты антител (как более подробно описано в настоящем документе). Антитело может являться человеческим, гуманизированным и/или аффинно зрелым.
«Фрагменты антител» содержат только часть интактного антитела, где часть предпочтительно сохраняет по меньшей мере одну, предпочтительно, большинство или все, из функций, в норме ассоциированных с данной частью, когда она присутствует в интактном антителе. В одном варианте осуществления фрагмент антитела содержит антигенсвязывающий участок интактного антитела и таким образом сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например, фрагмент, содержащий Fc-область, сохраняет по меньшей мере одну из биологических функций, в норме ассоциированных с Fc-областью, когда она присутствует в интактном антителе, такую как связывание FcRn, модуляция времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления фрагмент антитела представляет собой моновалентное антитело, обладающее временем полужизни in vivo, по существу сходным со временем полужизни интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, присоединенное к последовательности Fc, способной обеспечивать стабильность фрагмента in vivo.
Термин «моноклональное антитело», как применяют в настоящем документе, относится к антителу, полученному из популяции в основном гомогенных антител, т.е. отдельные антитела, составляющие популяцию, содержат в основном идентичную аминокислотную последовательность, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высоко специфическими, являясь направленными против одного антигена. Более того, в отличие от препаратов поликлональных антител, которые, как правило, содержат различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена.
Моноклональные антитела в настоящем документе конкретно включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(цепей) является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, так же как фрагменты таких антител, пока они обладают желательной биологической активностью (патент США № 4816567; и Morrison et al, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы не относящихся к человеку (например, мышиных) антител представляют собой химерные антитела, содержащие минимальную последовательность, полученную из не относящегося к человеку иммуноглобулина. По большей части, гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в котором остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области не относящихся к человеку видов (антитела-донора), таких как мышь, крыса, кролик или не относящийся к человеку примат, обладающими желаемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека заменяют соответствующими не присутствующими у человека остатками. Более того, гуманизированные антитела могут содержать остатки, не обнаруженные в антителе-реципиенте или в антителе-доноре. Такие модификации выполняют для дальнейшего усовершенствования характеристик антитела. Как правило, гуманизированное антитело содержит в основном все из по меньшей мере одного, и как правило, двух вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют петлям не относящегося к человеку иммуноглобулина, и все или в основном все FR являются областями с последовательностью человеческого иммуноглобулина. Гуманизированное антитело, необязательно, может содержать также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Более подробно см. в Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol 2:593-596 (1992). См. также следующие обзорные статьи и ссылки, процитированные в настоящем документе: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
«Человеческое антитело» представляет собой антитело, обладающее аминокислотной последовательностью, соответствующей последовательности антитела, продуцируемого человеком и/или полученного с использованием любого из способов получения человеческих антител, как описано в настоящем документе. Это определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не относящиеся к человеку.
«Аффинно зрелое» антитело представляет собой антитело с одним или несколькими изменениями в одной или нескольких из его CDR, приводящими к улучшению аффинности антитела для антигена по сравнению с исходным антителом, не обладающим данным изменением(ями). Предпочтительные аффинно зрелые антитела обладают наномолярными или даже пикомолярными аффинностями для антигена-мишени. Аффинно зрелые антитела получают способами, известными в данной области. В Marks et al. Bio/Technology 10:779-783 (1992) описано созревание аффинности посредством перетасовки доменов VH и VL. Случайный мутагенез CDR и/или каркасных остатков описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
«Блокирующее» антитело или антитело-«антагонист» представляет собой антитело, ингибирующее или уменьшающее биологическую активность связываемого им антигена. Предпочтительные блокирующие антитела или антитела-антагонисты в основном или полностью ингибируют биологическую активность антигена.
«Антитело-агонист», как применяют в настоящем документе, представляет собой антитело, имитирующее по меньшей мере один из видов функциональной активности интересующего полипептида.
«Нарушение» представляет собой любое состояние, при котором является благоприятным лечение композицией или способом по изобретению. Это включает хронические и острые нарушения или заболевания, включая те патологические состояния, которые предрасполагают млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений, подлежащих лечению, в настоящем документе включают злокачественные и доброкачественные опухоли; нелейкозные и лимфоидные злокачественные новообразования; нейрональные, глиальные, астроцитарные, гипоталамические и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцелиальные нарушения; и другие связанные с ангиогенезом нарушения.
Термины «нарушение пролиферации клеток» и «пролиферативное нарушение» относятся к нарушениям, ассоциированными с некоторой степенью аномальной пролиферации клеток. В одном варианте осуществления нарушение пролиферации клеток представляет собой злокачественную опухоль.
«Опухоль», как применяют в настоящем документе, относится к любым росту и пролиферации неопластических клеток, злокачественным или доброкачественным, и ко всем предраковым и злокачественным клеткам и тканям. Термины «злокачественная опухоль», «злокачественный», «нарушение пролиферации клеток», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими, как на них ссылаются в настоящем документе.
Термины «злокачественная опухоль» и «злокачественный» обозначают или описывают физиологическое состояние у млекопитающих, как правило, характеризующееся нерегулируемым ростом/пролиферацией и/или инвазивностью клеток. Злокачественные опухоли включают, но без ограничения, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, злокачественную опухоль брюшины, гепатоцеллюлярный рак, злокачественную опухоль желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, карциному печени и различные типы рака головы и шеи.
Как применяют в настоящем документе, «лечение» относится к клиническому вмешательству с целью изменения природного курса подлежащих лечению индивидуума или клетки, и его можно проводить либо для профилактики, либо при течении клинической патологии. Желательные эффекты лечения включают предупреждение возникновения или рецидива заболевания, облегчение симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предупреждение метастазирования, уменьшение скорости прогрессирования заболевания, улучшение состояния или временное облегчение состояния заболевания и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления композиции и/или способы по изобретению используют для задержки развития заболевания или нарушения.
«Эффективное количество» относится к количеству, эффективному при дозах и периодах времени, необходимых для достижения желаемого терапевтического или профилактического результата.
«Терапевтически эффективное количество» молекулы (например, антагониста) по изобретению может меняться в соответствии с такими факторами, как состояние заболевания, возраст, пол и вес индивидуума и способность молекулы (например, антагониста) вызывать желаемый ответ у индивидуума. Терапевтически эффективным количеством является также такое, при котором терапевтически выгодные эффекты превосходят любые токсичные или неблагоприятные эффекты молекулы (например, антагониста). «Профилактически эффективное количество» относится к количеству, эффективному при дозах и периодах времени, необходимых для достижения желаемого профилактического результата. Как правило, однако не обязательно, профилактически эффективное количество меньше, чем терапевтически эффективное количество, так как профилактическую дозу применяют для субъектов до заболевания или на ранней стадии заболевания.
Термин «цитотоксическое средство», как применяют в настоящем документе, обозначает вещество, ингибирующее или предупреждающее функционирование клеток и/или вызывающее разрушение клеток. Термин предназначен, чтобы включать радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212 P32 и радиоактивные изотопы Lu), химиотерапевтические средства, например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие средства, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики, и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Другие цитотоксические средства описаны ниже. Уничтожающее клетки опухолей средство вызывает разрушение клеток опухолей.
«Химиотерапевтическое средство» представляет собой химическое соединение, пригодное для лечения злокачественных опухолей. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид ЦИТОКСАН®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогинины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, МАРИНОЛ®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН®), CPT-11 (иринотекан, КАМПТОСАР®), ацетилкамптотецин, скополетин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкриастатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гaммa1I и калихеамицин омегаI1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; так же как хромофор неокарциностатина и родственные хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, сактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая АДРИАМИЦИН®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомальный доксорубицин HC1 для инъекций (ДОКСИЛ®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (ГЕМЗАР®), тегафур (УФТОРАЛ®), капецитабин (КСЕЛОДА®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калюстерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; угнетающие функцию коры надпочечников средства, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ЭЛДИЗИН®, ФИЛДЕЗИН®); декарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ара-C»); тиотепа; таксоиды, например, паклитаксел (ТАКСОЛ®), сконструированный на основе альбумина состав наночастиц паклитаксела (АБРАКСАН™), и доксетаксел (ТАКСОТЕР®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛЬБАН®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; лейковорин; винорелбин (НАВЕЛЬБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленного; так же как комбинации двух или более из вышеперечисленных, такие как CHOP, аббревиатура для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, аббревиатура для режима терапии оксалиплатином (ЭЛОКСАТИН™) в сочетании с 5-FU и лейковорином.
В это определение включены также антигормональные средства, которые действуют для регуляции, уменьшения, блокирования или ингибирования эффектов гормонов, способных стимулировать развитие злокачественной опухоли, и часто присутствуют в форме системного лечения или лечения всего организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен НОЛВАДЕКС®), ралоксифен (ЭВИСТА®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (ФАРЕСТОН®); антипрогестероны; средства для понижающей регуляции рецептора эстрогена (ERD); антагонисты рецептора эстрогенов, такие как фулвестрант (ФУЛВЕСТРАНТ®); средства, действующие для подавления или прекращения функционирования яичников, например, агонисты фактора высвобождения лютеинизирующего гормона (LHRH), такие как ацетат леупролида (ЛЮПРОН® и ЭЛИГАРД®), ацетат гозерелина, ацетат бузерелина и трипторелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующий продукцию эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (МЕГАЗА®), экземестан (АРОМАЗИН®), форместан, фадрозол, ворозол (РИВИЗОР®), лектрозол (ФЕМАРА®) и анастрозол (АРИМИДЕКС®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, БОНЕФОС® или ОСТАК®), этидронат (ДИДРОКАЛ®), NE-58095, золедроновую кислоту/золедронат (ЗОМЕТА®), алендронат (ФОСАМАКС®), памидронат (АРЕДИЯ®), тилудронат (СКЕЛИД®) или ризедронат (АКТОНЕЛ®); так же как троксацитабин (аналог нуклеозида цитозина с 1,3-диоксоланом); антисмысловые олигонуклеотиды, в частности те, которые ингибируют экспрессию генов в путях передачи сигнала, вовлеченных в нарушенную пролиферацию клеток, например, таких как гены PKC-альфа, Raf, H-Ras и рецептора эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОПА® и генотерапевтические вакцины, например, вакцину АЛЛОВЕКТИН®, вакцину ЛЕЙВЕКТИН® и вакцину ВАКСИД®; ингибитор топоизомеразы 1 (например, ЛУРТОТЕКАН®); rmRH (например, АБАРЕЛИКС®); дитозилат лапатиниба (низкомолекулярный ингибитор двух тирозинкиназ ErbB-2 и EGFR, известный также как GW572016); ингибиторы COX-2, такие как целекоксиб (ЦЕЛЕБРЕКС®; 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид; и фармацевтически приемлемые соли, кислоты или производные любого из вышеописанного.
«Ингибирующее рост средство» при использовании в настоящем документе относится к соединению или композиции, которые ингибируют рост клетки, рост которой зависит от активации MSP, in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, значительно уменьшающее процент MSP-зависимых клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют продолжение клеточного цикла (в отличном от S-фазы периоде), такие как средства, которые вызывают арест в G1 и арест в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Действие таких средств, которые вызывают арест в G1, также распространяется на арест в S-фазе, например, действие алкилирующих ДНК средств, таких как тамоксифен, преднизон, декарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ара-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer. Mendelsohn and Israel, eds., Chapter 1, entitled «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, оба полученные из тиса. Доцетаксел (ТАКСОТЕР®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (ТАКСОЛ®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки посредством предотвращения деполимеризации, что приводит к ингибированию митоза в клетках.
«Доксорубицин» представляет собой антрациклиновый антибиотик. Полное химическое наименование доксорубицина представляет собой (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсогексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Композиции и способы по изобретению
A. Антитела
В одном варианте осуществления настоящее изобретение относится к антителам-антагонистам, которые можно использовать по настоящему изобретению в качестве терапевтических и/или диагностических средств. Иллюстративные антитела включают поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгированные антитела.
1. Поликлональные антитела
Поликлональные антитела предпочтительно индуцируют у животных множественными подкожными (sc) или внутрибрюшинными (ip) инъекциями соответствующего антигена и адъюванта. Может быть полезно конъюгировать соответствующий антиген (особенно при использовании синтетических пептидов) с белком, иммуногенным для вида, подлежащего иммунизации. Например, антиген можно конъюгировать с гемоцианином морского блюдечка (KLH), сывороточным альбумином, бычьим тиреоглобулином или соевым ингибитором трипсина, с использованием бифункционального или дериватизирующего средства, например, малеимидобензоил-сульфосукцинимидного сложного эфира (конъюгация через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2, или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют антигеном, иммуногенными конъюгатами или производными посредством объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъекции раствора внутрикожно в нескольких участках. Через один месяц животных подвергают бустер-инъекции 1/5-1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в нескольких участках. Через 7-14 суток у животных забирают кровь и анализируют титр антитела в сыворотке. Животных подвергают бустер-инъекциям, пока титр не достигнет плато. Конъюгаты можно получать также в культуре рекомбинантных клеток в виде слитых белков. Вызывающие агрегацию средства, такие как квасцы, также подходящим образом используют для усиления иммунного ответа.
2. Моноклональные антитела
Моноклональные антитела можно получать способом гибридомы, впервые описанным Kohler et al., Nature, 256:495 (1975), или можно получать способами рекомбинантной ДНК (патент США № 4816567).
По способу гибридомы, мышь или другого подходящего животного-хозяина, такого как хомяк, иммунизируют, как описано выше для стимуляции лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающие белок, используемый для иммунизации. Альтернативно, лимфоциты можно иммунизировать in vitro. После иммунизации лимфоциты выделяют и затем сливают с линией клеток миеломы с применением подходящего сливающего средства, такого как полиэтиленгликоль, для образования клеток гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы рассевают и выращивают в подходящей культуральной среде, где среда предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживаемость не слитых, родительских клеток миеломы (обозначаемых также как партнер по слиянию). Например, если в родительских клетках миеломы отсутствует фермент гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), селективная культуральная среда для гибридом, как правило, содержит гипоксантин, аминоптерин и тимидин («среда HAT»), вещества, предотвращающие рост клеток, дефицитных по HGPRT.
Предпочтительными линиями клеток миеломы - партнерами по слиянию являются эффективно сливающиеся, поддерживающие стабильно высокий уровень экспрессии антител в отобранных продуцирующих антитела клетках и чувствительные к селективной среде для селекции против не слитых, родительских клеток. Предпочтительными линиями клеток миеломы являются линии миеломы мыши, такие как полученные из опухолей мыши MOPC-21 и MPC-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 и их производные, например, клетки X63-Ag8-653, доступные из American Type Culture Collection, Manassas, Virginia, USA. Описана также продукция человеческих моноклональных антител линиями клеток миеломы человека и гетеромиеломы мышь-человек (Kozbor, J. Immunol., 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой культивируют клетки гибридомы, анализируют по продукции моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют иммунопреципитиацией или анализом связывания in vitro, таким как радиоиммунный анализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно определять, например, анализом Скэтчарда, описанным в Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации клеток гибридомы, продуцирующих антитела желаемой специфичности, аффинности и/или активности, клоны можно субклонировать способами предельных разведений и выращивать общепринятыми способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно выращивать in vivo как асцитные опухоли в млекопитающем, например, посредством i.p. инъекции клеток мышам.
Моноклональные антитела, секретируемые субклонами, можно подходящим образом выделять или очищать из культуральной среды, асцитной жидкости или сыворотки общепринятыми способами очистки антител, например, такими как аффинная хроматография (например, с использованием сефарозы с белком A или белком G), или ионообменная хроматография, хроматография на гидроксилапатите, электрофорез в геле, диализ и т.д.
ДНК, кодирующие моноклональные антитела, можно легко выделять и секвенировать с использованием общепринятых способов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Клетки гибридомы служат предпочтительным источником такой ДНК. После выделения ДНК можно помещать в экспрессирующие векторы, которыми затем трансфицируют клетки-хозяева, такие как клетки E. coli, обезьяньи клетки COS, клетки яичников китайского хомяка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок антитело, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs. 130: 151-188 (1992).
В следующем варианте осуществления, моноклональные антитела или фрагменты антител можно выделять из фаговых библиотек антител, полученных с использованием способов, описанных в McCafferty et al., Nature. 348:552-554 (1990). В Clackson et al., Nature. 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описана продукция человеческих антител с высокой аффинностью (в нМ диапазоне) посредством перетасовки цепей (Marks et al., Bio/Technology. 10:779-783 (1992)), так же как посредством комбинированной инфекции и рекомбинации in vivo в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти способы являются обоснованной альтернативой общепринятым способам гибридомы с моноклональными антителами для выделения моноклональных антител.
ДНК, кодирующую антитело, можно модифицировать для получения химерных или слитых полипептидов антитела, например, заменой последовательностями константных доменов тяжелых и легких цепей человека (CH и CL) гомологичных мышиных последовательностей (патент США № 4816567; и Morrison, et al., Proc. Natl Acad. Sci. USA. 81:6851 (1984)), или слиянием кодирующей иммуноглобулин последовательности со всей или частью последовательности, кодирующей не относящийся к иммуноглобулинам полипептид (гетерологичный полипептид). Последовательностями не относящегося к иммуноглобулинам полипептида можно заменять константные домены антитела, или ими можно заменять вариабельные домены одного из антигенсвязывающих участков антитела для получения химерного бивалентного антитела, содержащего один антигенсвязывающий участок, обладающий специфичностью для одного антигена, и другой антигенсвязывающий участок, обладающий специфичностью для другого антигена.
3. Человеческие и гуманизированные антитела
Антитела по изобретению могут, кроме того, включать гуманизированные антитела или человеческие антитела. Гуманизированные формы не относящихся к человеку (например, мышиных) антител представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), содержащие минимальную последовательность, происходящие из не относящегося к человеку иммуноглобулина. Гуманизированные антитела включают человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющей комплементарность области (CDR) реципиента заменяют остатками из CDR не относящихся к человеку видов (антитело-донор), таких как мышь, крыса или кролик, обладающими желаемой специфичностью, аффинностью и емкостью. В некоторых случаях каркасные остатки Fv человеческого иммуноглобулина заменяют соответствующими не относящимися к человеку остатками. Гуманизированные антитела могут также содержать остатки, не обнаруженные ни в антителе-реципиенте, ни в импортируемых последовательностях CDR или каркаса. Как правило, гуманизированное антитело содержит в основном все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или в основном все области CDR соответствуют областям не относящегося к человеку иммуноглобулина, и все или в основном все области FR представляют собой области из консенсусной последовательности человеческого иммуноглобулина. Оптимально, гуманизированное антитело содержит также по меньшей мере часть константной области иммуноглобулина (Fc), обычно из человеческого иммуноглобулина [Jones et al., Nature. 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992)].
Способы гуманизации не относящихся к человеку антител хорошо известны в данной области. Как правило, гуманизированное антитело обладает одним или несколькими аминокислотными остатками, введенными в него из не относящегося к человеку источника. Такие не относящиеся к человеку аминокислотные остатки часто обозначают как «импортируемые» остатки, как правило, взятые из «импортируемого» вариабельного домена. Гуманизацию по существу можно проводить по способу Winter и соавторов [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)], посредством замены на CDR или последовательности CDR грызунов соответствующих последовательностей человеческого антитела. Следовательно, такие «гуманизированные» антитела представляют собой химерные антитела (патент США № 4816567), где по существу менее чем один интактный человеческий вариабельный домен заменен соответствующей последовательностью из не относящихся к человеку видов. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR, заменены остатками из аналогичных участков антител грызунов.
Выбор человеческих вариабельных доменов, как легкой, так и тяжелой цепи, для использования в получении гуманизированных антител является очень важным для уменьшения антигенности и ответа HAMA (антител человека против антител мыши), когда антитело предназначено для терапевтического использования для человека. Согласно так называемому способу «наилучшего соответствия», проводят скрининг последовательности вариабельного домена антитела грызунов против полной библиотеки известных последовательностей вариабельных доменов человека. Идентифицируют последовательность V-домена человека, наиболее близкую последовательности V-домена грызуна, и человеческую каркасную область (FR) внутри нее принимают для гуманизированного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). По другому способу используют конкретную каркасную область, выведенную из консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993)).
Кроме того, важно, чтобы антитела гуманизировали с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели, согласно предпочтительному способу, гуманизированные антитела получают способом анализа исходных последовательностей и различных умозрительных гуманизированных продуктов с использованием трехмерных моделей исходной и гуманизированной последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известными специалистам в данной области. Доступны компьютерные программы для иллюстрации и вывода на экран возможных трехмерных конформационных структур выбранных последовательностей иммуноглобулинов-кандидатов. Исследование этих моделей позволяет анализ возможной роли остатков в функционировании последовательности иммуноглобулина-кандидата, т.е. анализ остатков, влияющих на способность иммуноглобулина-кандидата связывать его антиген. Таким образом, можно выбирать и сочетать остатки FR из реципиентных и импортированных последовательностей реципиентного гуманизированного антитела, так чтобы достигать желательных характеристик антитела, таких как увеличенная аффинность для антигена(ов)-мишени. Как правило, остатки гипервариабельной области напрямую и наиболее существенно вовлечены в связывание антигена.
Предусматривают различные формы гуманизированного антитела. Например, гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab, который, необязательно, конъюгируют с одним или несколькими цитотоксическим средством(ами) для получения иммуноконъюгата. Альтернативно, гуманизированное антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
В качестве альтернативы гуманизации, можно получать человеческие антитела. Например, в настоящее время является возможным получение трансгенных животных (например, мышей), которые способны, при иммунизации, продуцировать полный набор антител человека в отсутствии эндогенной продукции иммуноглобулинов. Например, описано, что гомозиготная делеция гена участка соединения тяжелых цепей антител (JH) у химерных мышей и мутантных мышей зародышевой линии приводит к полному ингибированию эндогенной продукции антител. Перенос набора генов иммуноглобулинов зародышевой линии человека у таких мутантных мышей зародышевой линии приводит к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature. 362:255-258 (1993); Bruggemann et al., Year in Immuno. 7:33 (1993); патенты США №№ 5545806, 5569825, 5591669 (все из GenPharm); 5545807; и WO 97/17852.
Альтернативно, технологию фагового дисплея (McCafferty et al., Nature 348:552-553 [1990]) можно использовать для получения человеческих антител и фрагментов антител in vitro из репертуаров генов вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. В соответствии с этим способом, гены V-домена антител клонируют в рамку считывания либо мажорного, либо минорного гена оболочки нитевидного бактериофага, такого как M13 или fd, и они воспроизводятся в качестве функциональных фрагментов антител на поверхности частицы фага. Поскольку нитевидная частица содержит одноцепочечную копию ДНК генома фага, отбор на основе функциональных свойств антитела приводит также к отбору гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые из свойств B-клетки. Фаговый дисплей можно проводить во множестве форматов, обзор которых приведен, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников фрагментов V-генов. Clackson et al., Nature, 352:624-628 (1991) выделили массив разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать репертуар V-генов из неиммунизированных доноров-людей, и антитела против массива разнообразных антигенов (включая собственные антигены) можно выделять, в основном, следуя способам, описанным в Marks et al., J. Mol. Biol. 222:581-597 (1991), или Griffith et al., EMBO J. 12:725-734 (1993). См., также патенты США № 5565332 и 5573905.
Как обсуждают выше, человеческие антитела также можно получать с помощью активированных in vitro B-клеток (см. патенты США 5567610 и 5229275).
4. Фрагменты антител
В определенных условиях существуют преимущества использования фрагментов антител, а не полноразмерных антител. Меньший размер фрагментов позволяет быстрое выведение и может проводить к улучшенному доступу к солидным опухолям.
Для получения фрагментов антител разработаны различные способы.
Традиционно, эти фрагменты получали посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно с помощью рекомбинантных клеток-хозяев. Fab, Fv и ScFv фрагменты антител можно экспрессировать в E. coli и секретировать из E. coli, таким образом, позволяя простое получение больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab'-SH можно выделять непосредственно из E. coli и химически соединять с получением фрагментов F(ab')2 (Carter et al., Bio/Technology 10: 163-167 (1992)). В соответствии с другим способом фрагменты F(ab')2 можно выделять непосредственно из культуры рекомбинантных клеток-хозяев. Фрагменты Fab и F(ab')2 с увеличенным временем полужизни in vivo, содержащие остатки эпитопа связывания рецептора спасения, описаны в патенте США № 5869046. Другие способы получения фрагментов антител очевидны специалисту-практику в данной области. В других вариантах осуществления, предпочтительное для выбора антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185; патент США № 5571894; и патент США № 5587458. Fv и sFv являются единственными видами с интактными участками связывания, лишенными константных областей; таким образом, они пригодны для уменьшения неспецифического связывания во время использования in vivo. Можно конструировать слитые с sFv белки для получения эффекторного белка, слитого с амино- или карбокси-концом sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела может также представлять собой «линейное антитело», например, как описано в патенте США 5641870. Такие линейные фрагменты антител могут являться моноспецифическими или биспецифическими.
5. Биспецифические антитела
Биспецифические антитела представляют собой антитела, обладающие специфичностью связывания по меньшей мере для двух различных эпитопов. Иллюстративные биспецифические антитела могут связываться с двумя различными эпитопами гепсина, MSP и/или комплекса гепсин:MSP, как описано в настоящем документе. В других таких антителах можно комбинировать участок связывания этих структур с участком связывания для другого полипептида. Альтернативно, плечо антитела можно комбинировать с плечом, связывающимся с запускающей молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD3), или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD 16), так чтобы сфокусировать и локализовать механизмы клеточной защиты против клеток, экспрессирующих и/или связывающих гепсин и/или MSP. Биспецифические антитела можно также использовать для локализации цитотоксических средств на клетках, экспрессирующих и/или связывающих гепсин, MSP и/или комплекс гепсин:MSP. Эти антитела обладают плечом, связывающим полипептид, и плечом, связывающим цитотоксическое средство (например, сапорин, анти-интерферон-α, алкалоид барвинка, A-цепь рицина, метотрексат или гаптен с радиоактивным изотопом). Биспецифические антитела можно получать в форме полноразмерных антител или фрагментов антител (например, биспецифические антитела F(ab')2).
В WO 96/16673 описано биспецифическое антитело анти-ErbB2/анти-FcγRIII, и в патенте США № 5837234 описано биспецифическое антитело анти-ErbB2/анти-FcγRI. Биспецифическое антитело анти-ErbB2/Fcα описано в WO98/02463. В патенте США № 5821337 описано биспецифическое антитело анти-ErbB2/анти-CD3.
Способы получения биспецифических антител известны в данной области. Общепринятый способ получения полноразмерных биспецифических антител основан на совместной экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, где две цепи обладают различной специфичностью (Millstein et al., Nature 305:537-539 (1983)). Вследствие случайной сборки тяжелых и легких цепей иммуноглобулинов, эти гибридомы (квадромы) продуцируют смесь потенциально из 10 различных молекул антител, из которых только одно обладает правильной биспецифической структурой. Очистка правильной молекулы, которую обычно проводят посредством стадий аффинной хроматографии, является довольно трудоемкой, и выходы продукта являются низкими. Сходные способы описаны в WO 93/08829, и в Traunecker et al., EMBO J. 10:3655-3659 (1991).
В соответствии с другим способом, проводят слияние вариабельных доменов антитела с желаемой специфичностью связывания (участками связывания антитело-антиген) с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно проводят с константным доменом тяжелой цепи Ig, содержащим по меньшей мере часть шарнирной области, областей CH2 и CH3. Предпочтительно, чтобы первая константная область тяжелой цепи (CH1), содержащая участок, необходимый для связывания легкой цепи, присутствовала по меньшей мере в одном из компонентов, предназначенных для слияния. ДНК, кодирующую предназначенные для слияния компоненты тяжелых цепей иммуноглобулинов и, если желательно, легких цепей иммуноглобулина, вставляют в отдельные экспрессирующие векторы, и совместно трансфицируют в пригодную клетку-хозяина. Это обеспечивает увеличенную гибкость при регулировании соотношений трех полипептидных фрагментов в вариантах осуществления, где неравные соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальный выход желательного биспецифического антитела. Однако возможным является встраивание кодирующих последовательностей для двух или всех трех полипептидных цепей в один экспрессирующий вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или если соотношения не оказывают значительного влияния на выход желательной комбинации цепей.
В предпочтительном варианте осуществления этого способа, биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с одной специфичностью связывания на одном плече, и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом плече. Обнаружено, что такая ассиметричная структура облегчает отделение желательного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулинов, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ разделения. Этот способ описан в WO 94/04690. Более подробное описание получения биспецифических антител см., например, в Suresh et al., Methods in Enzymology 121:210 (1986).
В соответствии с другим способом, описанным в патенте США № 5731168, область контакта между парой молекул антител можно модифицировать для максимизации процента гетеродимеров, выделяемых из культур рекомбинантных клеток. Предпочтительная область контакта содержит по меньшей мере часть CH3-домена. По этому способу, одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). Компенсирующие «полости» идентичного или сходного с крупной боковой цепью(ями) размера создают в области контакта второй молекулы антитела посредством замены крупных боковых цепей аминокислот на цепи меньших размеров (например, аланин или треонин). Это обеспечивает механизм для повышения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают поперечно связанные антитела или «гетероконъюгаты» антител. Например, одно из антител в гетероконъюгате можно соединять с авидином, а другое - с биотином. Такие антитела, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980), и для лечения инфекции HIV (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител можно получать с использованием любых пригодных способов поперечного сшивания. Пригодные сшивающие средства хорошо известны в данной области, и описаны в патенте США № 4676980, вместе с рядом способов поперечного сшивания.
Способы получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получать с использованием химических связей. В Brennan et al., Science 229:81 (1985) описан способ, где интактные антитела протеолитически расщепляют для получения F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии средства, образующего комплексы с дитиолами, арсенита натрия, для стабилизации соседних дитиолов и предотвращения образования межмолекулярного дисульфида. Затем полученные Fab'-фрагменты превращают в производные с тионитробензоатом (TNB). Затем одно из производных Fab'-TNB повторно превращают в Fab'-тиол восстановлением меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифического антитела. Полученные биспецифические антитела можно использовать в качестве средств для избирательной иммобилизации ферментов.
Последние достижения упростили прямое выделение из E. coli фрагментов Fab'-SH, которые можно химически соединять для получения биспецифических антител. В Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описано получение полностью гуманизированной молекулы F(ab')2 биспецифического антитела. Каждый Fab'-фрагмент отдельно секретировали из E. coli, и их подвергали прямому химическому соединению in vitro для получения биспецифического антитела. Полученное таким образом биспецифическое антитело обладало способностью связывать клетки со сверхэкспрессией рецептора ErbB2 и нормальные T-клетки человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней, относящихся к опухолям молочной железы человека. Описаны также различные способы получения и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получали с использованием лейциновых молний. Kostelny et al., J. Immunol. 148(5):1547-1553 (1992). Пептиды лейциновой молнии белков Fos и Jun соединяли с Fab'-участками двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области для получения мономеров, а затем повторно окисляли для получения гетеродимеров антител. Этот способ также можно использовать для получения гомодимеров антител. Способ «диател», описанный Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993), обеспечивает альтернативный механизм получения биспецифических фрагментов антител. Фрагменты содержат VH, соединенный с VL посредством линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждают спариваться с комплементарными доменами VL и VH другого фрагмента, таким образом, формируя два антигенсвязывающих участка. Описан также другой способ получения фрагментов биспецифических антител с использованием димеров одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol., 152:5368 (1994).
Предусматривают также антитела более чем c двумя валентностями. Например, можно получать триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
6. Гетероконъюгированные антитела
Гетероконъюгированные антитела также включены в объем настоящего изобретения.
Гетероконъюгированные антитела состоят из двух ковалентно соединенных антител. Такие антитела предложены, например, для нацеливания клеток иммунной системы на нежелательные клетки [патент США № 4676980] и для лечения инфекции HIV [WO 91/00360; WO 92/200373; EP 03089]. Предусматривают, что антитела можно получать in vitro с использованием известных способов химии синтеза белков, включая способы, предусматривающие средства для перекрестного сшивания. Например, можно конструировать иммунотоксины с применением реакции дисульфидного обмена или посредством формирования тиоэфирной связи. Примеры подходящих для этой цели реагентов включают иминотиолат, метил-4-меркаптобутиримидат и реагенты, описанные, например, в патенте США № 4676980.
7. Мультивалентные антитела
Мультивалентное антитело может становиться интернализованным (и/или катаболизированным) клеткой, экспрессирующей антиген, с которым связываются антитела, быстрее, чем бивалентное антитело. Антитела по настоящему изобретению могут представлять собой мультивалентные антитела (отличные от класса IgM) с тремя или более антигенсвязывающими участками (например, тетравалентные антитела), которые можно легко получать посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Мультивалентное антитело может содержать домен для димеризации и три или более антигенсвязывающих участка. Предпочтительный домен для димеризации содержит Fc-область или шарнирную область (или состоит из них). В этом случае, антитело содержит Fc-область и три или более антигенсвязывающих участка на N-конце от Fc-области. Предпочтительное мультивалентное антитело в настоящем документе содержит, например, от трех до приблизительно восьми, но предпочтительно, четыре антигенсвязывающих участка (или состоит из них). Мультивалентное антитело содержит по меньшей мере одну полипептидную цепь (и предпочтительно, две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(цепи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид, и n представляет собой 0 или 1. Например, полипептидная цепь(и) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область; или цепь VH-CH1-VH-CH1-Fc-область. Мультивалентное антитело в настоящем документе предпочтительно дополнительно содержит по меньшей мере два (и предпочтительно, четыре) полипептида вариабельных доменов легкой цепи. Мультивалентное антитело в настоящем документе может содержать, например, от приблизительно двух до приблизительно восьми полипептидов вариабельных доменов легкой цепи. Полипептиды вариабельных доменов легкой цепи, предусмотренные в настоящем документе, содержат вариабельный домен легкой цепи и, необязательно, кроме того, содержат домен CL.
8. Модификация эффекторной функции
Может являться желательным модифицировать антитело по изобретению по отношению к эффекторной функции, например, чтобы усилить зависимую от антигена опосредуемую клетками цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC) антитела. Этого можно достигать введением одной или нескольких аминокислотных замен в Fc-область антитела. Альтернативно или дополнительно, в Fc-область можно ввести остаток(остатки) цистеина, таким образом, позволяя формирование межцепьевой дисульфидной связи в этой области. Полученное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или увеличенным комплементзависимым цитолизом и антителозависимой клеточной цитотоксичностью (ADCC). См. Caron et al., J. Exp Med. 176: 1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с улучшенной противоопухолевой активностью можно также получать с использованием гетеробифункциональных перекрестно-сшивающих средств, как описано в Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно, можно сконструировать антитело, которое обладает двойными Fc-областями и, таким образом, обладает улучшенной способностью к лизису комплементом и ADCC. См. Stevenson et al., Anti-Cancer Drug Design, 3: 219-230 (1989). Для увеличения времени полужизни антитела в сыворотке, можно вводить в антитело (особенно, в фрагмент антитела) эпитоп для связывания рецептора спасения, как описано, например, в патенте США 5739277. Как применяют в настоящем документе, термин «эпитоп для связывания рецептора спасения» относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
9. Иммуноконъюгаты
Изобретение относится также к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин из бактерий, грибов, растений или животных, или его фрагменты), или c радиоактивным изотопом (т.е. радиоконъюгат).
Использование конъюгатов антитело-лекарственное средство для местной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для уничтожения или ингибирования клеток опухоли при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; патент США 4975278), позволяет направленную доставку группы лекарственного средства к опухолям и внутриклеточное накопление в них, когда системное введение этих неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности для нормальных клеток, так же как для клеток опухоли, подлежащих уничтожению (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review», in Monoclonal Antibodies'84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp. 475-506). При этом стремятся к максимальной эффективности при минимальной токсичности. Опубликовано, что как поликлональные антитела, так и моноклональные антитела являются пригодными для этих способов (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al (2000) Jour, of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al (1998) Cancer Res. 58:2928; Hinman et al (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать свои цитотоксические и цитостатические эффекты посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства проявляют тенденцию являться неактивными или менее активными при конъюгации с крупными антителами или белковыми лигандами рецепторов.
ЗЕВАЛИН® (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из мышиного моноклонального антитела IgG1 каппа, направленного против антигена CD20, обнаруженного на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанных посредством линкера из тиомочевины - хелатирующего средства (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ЗЕВАЛИН обладает активностью против B-клеточной неходжкинской лимфомы (NHL), введение приводит к тяжелым и длительным цитопениям у большинства пациентов. МИЛОТАРГ™ (озогамицин гемтузумаба, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящее из антитела hu CD33, связанного с калихеамицином, одобрено в 2000 г. для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; патенты США № 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Мертансин кантузумаба (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, присоединенного через дисульфидный линкер SPP к группе лекарственного средства майтанзиноида, DM1, тестировали для лечения злокачественных опухолей с экспрессией CanAg, таких как злокачественная опухоль ободочной кишки, поджелудочной железы, желудка и других. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против специфического для простаты мембранного антигена (PSMA), присоединенного к группе лекарственного средства майтанзиноида, DM1, находится в разработке для потенциального лечения опухолей предстательной железы. Пептиды ауристатина, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги долостатина, конъюгировали с химерными моноклональными антителами cBR96 (специфическими для антигена Льюиса Y на карциномах) и cAC10 (специфическими для CD30 при гематологических злокачественных новообразованиях) (Doronina et al (2003) Nature Biotechnology 21(7):778-784), и они находятся в разработке для терапии.
Химиотерапевтические средства, пригодные для получения таких иммуноконъюгатов, описаны выше. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модецина, альфа-сарцин, белки Aleurites fordii, белки-диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Множество радиоактивных изотопов доступны для получения радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получают с использованием множества бифункциональных средств для сшивания белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие, как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие, как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать, как описано в Vitetta et al., Science, 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является примером хелатирующего средства для конъюгации радиоактивного изотопа с антителом. См. W094/11026.
В настоящее изобретение включены также конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, трихотецен и CC 1065, а также производных этих токсинов, также обладающих активностью токсинов.
Майтанзин и майтанзиноиды
В одном варианте осуществления антитело (полноразмерное или фрагменты) по изобретению конъюгируют с одной или несколькими молекулами майтанзиноида.
Майтанзиноиды представляют собой ингибиторы митоза, действующие посредством ингибирования полимеризации тубулина. Майтанзин впервые был выделен из восточно-африканского кустарника Maytenus serrata (патент США № 3896111). Затем обнаружили, что конкретные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и C-3 сложные эфиры майтанзинола (патент США № 4151042). Синтетический майтанзинол, а также его производные и аналоги описаны, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663; и 4371533, содержание каждого из которых таким образом конкретно приведено в качестве ссылки.
Конъюгаты майтанзиноид-антитело
В попытке улучшения их терапевтического индекса, майтанзин и майтанзиноиды конъюгировали с антителами, специфически связывающимися с антигенами клеток опухоли. Иммуноконъюгаты, содержащие майтанзиноиды, и их терапевтическое использование описано, например, в патентах США №№ 5208020, 5416064 и Европейском патенте EP 0 425 235 B1, содержание которых таким образом конкретно приведено в качестве ссылки. В Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DM1, связанный с моноклональным антителом C242, нацеленным против колоректального рака человека. Обнаружено, что конъюгат является высоко цитотоксическим против культивируемых клеток рака толстого кишечника и обладает противоопухолевой активностью при анализе роста опухоли in vivo. В Chari et al., Cancer Research 52: 127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид конъюгирован через дисульфидный линкер с мышиным антителом A7, связывающимся с антигеном линий клеток рака толстого кишечника человека, или с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид тестировали in vitro на линии клеток рака молочной железы человека SK-BR-3, которые экспрессируют 3×105 поверхностных антигенов HER-2 на клетку. Для конъюгата лекарственного средства достигли степени цитотоксичности, сходной с цитотоксичностью свободного лекарственного средства майтанзиноида, которую можно увеличивать посредством увеличения числа молекул майтанзиноида на молекулу антитела. Для конъюгата A7-майтанзиноид показали низкую системную цитотоксичность для мышей.
Конъюгаты антитело-майтанзиноид (иммуноконъюгаты)
Конъюгаты антитело-майтанзиноид получают химическим связыванием антитела с молекулой майтанзиноида без значительного снижения биологической активности антитела или молекулы майтанзиноида. В среднем для 3-4 молекул майтанзиноида, конъюгированных на молекулу антитела, показали эффективность для усиления цитотоксичности для клеток-мишеней без отрицательного влияния на функционирование или растворимость антитела, хотя даже для одной молекулы токсина/антитело можно ожидать усиления цитотоксичности по сравнению с применением голого антитела. Майтанзиноиды хорошо известны в данной области, и их можно синтезировать известными способами или выделять из природных источников. Пригодные майтанзиноиды описаны, например, в патенте США № 5208020 и в других патентных и непатентных публикациях, на которые ссылаются в настоящем документе выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, модифицированные в ароматическом кольце или в других положениях молекулы майтанзинола, например, различные сложные эфиры майтанзинола.
Существует множество связывающих групп, известных в данной области для получения конъюгатов антитело-майтанзиноид, включая, например, группы, описанные в патенте США № 5208020 или в патенте EP 0 425 235 B1 и в Chari et al., Cancer Research 52: 127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотно-лабильные группы, фотолабильные группы, неустойчивые к пептидазе группы или неустойчивые к эстеразе группы, как описано в указанных выше патентах, где предпочтительными являются дисульфидные и тиоэфирные группы.
Конъюгаты антитела и майтанзиноида можно получать с использованием множества бифункциональных средств для сшивания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные сшивающие средства включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для обеспечения дисульфидной связи.
Линкер можно присоединять к молекуле майтанзиноида в различных положениях, в зависимости от типа связи. Например, сложноэфирную связь можно формировать посредством реакции с гидроксильной группой с использованием общепринятых способов присоединения. Реакция может происходить в положении C-3, обладающем гидроксильной группой, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой, и в положении C-20, обладающем гидроксильной группой. В предпочтительном варианте осуществления связь формируют в положении C-3 майтанзинола или аналога майтанзинола.
Калихеамицин
Другой представляющий интерес иммуноконъюгат содержит антитело по изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики из семейства калихеамицина способны осуществлять двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Получение конъюгатов членов семейства калихеамицина см. в патентах США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все из American Cyanamid Company). Структурные аналоги калихеамицина, которые можно использовать, включают, но без ограничения, γ1 I, α2 I, α3 I, N-ацетил-γ1 I PSAG и θ1 I (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США из American Cyanamid). Другим противоопухолевым лекарственным средством, с которым можно конъюгировать антитело, является QFA, который представляет собой антифолат. Как калихеамицин, так и QFA, обладают внутриклеточными участками действия и нелегко пересекают плазматическую мембрану. Таким образом, поглощение клетками этих средств посредством опосредованной антителами интернализации сильно увеличивает их цитотоксические эффекты.
Другие цитотоксические средства
Другие противоопухолевые средства, которые можно конъюгировать с антителами по изобретению, включают BCNU, стрептозоцин, винкристин и 5-фторурацил, семейство средств, вместе известных как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, так же как эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модецина, альфа-сарцин, белки Aleurites fordii, белки-диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор momordica charantia, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 г.
Кроме того, по настоящему изобретению предусмотрен иммуноконъюгат, сформированный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для избирательного разрушения опухоли антитело может содержать высоко радиоактивный атом. Множество радиоактивных изотопов доступно для получения радиоконъюгированных антител. Примеры включают 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы. Когда конъюгат используют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например 99mtc или 123I, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (известного также как магнитно-резонансная томография, ЯМР), такую как иод-123, иод-131, индий-111, фтор-19, угерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно вводить в конъюгат известными способами. Например, пептид можно получать биосинтезом или можно синтезировать посредством химического синтеза аминокислот с использованием подходящих предшественников аминокислот, содержащих, например, фтор-19 вместо водорода. Метки, такие как 99mtc или 123I, 186Re, 188Re и 111In, можно присоединять через остаток цистеина в пептиде. Иттрий-90 можно присоединять через остаток лизина. Способ IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57 можно использовать для включения иода-123. В «Monoclonal Antibodies in Immunoscintigraphy» (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического средства можно получать с использованием множества бифункциональных средств для сшивания белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является примером хелатирующего средства для конъюгации радиоактивного изотопа с антителом. См. W094/11026. Линкер может представлять собой «расщепляемый линкер», который облегчает высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотно-лабильный линкер, чувствительный к пептидазам линкер, фотолабильный линкер, диметиловый линкер или содержащий дисульфид линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США № 5208020).
Соединения по изобретению конкретно включают, но без ограничения, ADC, полученные с помощью пререкрестно-сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, из Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. pages 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство
В конъюгатах антитело-лекарственное средство (ADC) по изобретению антитело (Ab) конъюгируют с одной или несколькими группами лекарственного средства (D), например, c от приблизительно 1 до приблизительно 20 группами лекарственного средства на антитело, посредством линкера (L). ADC формулы I можно получать несколькими способами с использованием реакций органической химии, условий и реагентов, известных специалистам в данной области, включая: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом, с формированием Ab-L посредством ковалентной связи с последующей реакцией с группой лекарственного средства D; и (2) реакцию нуклеофильной группы из группы лекарственного средства с бивалентным линкерным реагентом с формированием D-L посредством ковалентной связи с последующей реакцией с нуклеофильной группой антитела.
Нуклеофильные группы антител включают, но без ограничения: (i) N-концевые аминогруппы, (ii) боковые аминогруппы, например, лизина, (iii) боковые тиоловые группы, например цистеина, и (iv) гидроксильные группы или аминогруппы сахара, когда антитело является гликозилированным. Аминогруппы, тиоловые и гидроксильные группы являются нуклеофильными и способными вступать в реакцию с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галоацетамиды; (iii) группы альдегидов, кетонов, карбоксила и малеинимида. Конкретные антитела обладают поддающимися восстановлению межцепьевыми дисульфидами, т.е. цистеиновыми мостиками. Антитела можно сделать реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстанавливающим средством, таким как DTT (дитиотреитол). Каждый цистеиновый мостик будут, таким образом, формировать, теоретически, два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно вводить в антитела посредством реакции остатков лизина с 2-иминотиоланом (реагент Трота), что приводит к превращению амина в тиол.
Конъюгаты антитело-лекарственное средство по изобретению можно получать также посредством модификации антитела для введения электрофильных групп, которые могут вступать в реакцию с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител можно окислять, например, с помощью периодатных окисляющих реагентов, для формирования групп альдегида или кетона, которые могут вступать в реакцию с аминогруппами линкерных реагентов или групп лекарственного средства. Полученные группы иминового шиффова основания могут формировать стабильную связь, или их можно восстанавливать, например, посредством боргидридных реагентов для формирования стабильных аминосвязей. В одном варианте осуществления реакцией углеводной части гликозилированного антитела либо с оксидазой галактозы, либо с метапериодатом натрия можно в результате получать группы карбонила (альдегида и кетона) в белке, которые могут реагировать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, что приводит к получению альдегида на месте первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; U.S. 5362852). Такие альдегиды могут вступать в реакцию с группой лекарственного средства или нуклеофилом линкера.
Подобным образом, нуклеофильные группы на группе лекарственного средства включают, но без ограничения: группы амина, тиола, гидроксила, гидразида, оксима, гидразина, тиосемикарбазона, гидразинкарбоксилата и арилгидразида, способные вступать в реакцию с формированием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галоацетамиды; (iii) группы альдегидов, кетонов, карбоксила и малеинимида.
Альтернативно, можно получать слитый белок, содержащий антитело и цитотоксическое средство, например, посредством рекомбинантных способов или синтеза пептидов. Длина ДНК может содержать соответствующие области, кодирующие две части конъюгата, либо вплотную друг к другу, либо разделенные областью, кодирующей линкерный пептид, не нарушающий желательных свойств конъюгата.
В другом варианте осуществления антитело можно конъюгировать с «рецептором» (таким как стрептавидин) для использования в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязавшегося конъюгата из кровотока с использованием очищающего средства и введением затем «лиганда» (например, авидина), конъюгированного с цитотоксическим средством (например, радионуклеотидом).
10. Иммунолипосомы
Описанные в настоящем документе антитела можно также составлять в форме иммунолипосом. «Липосома» представляет собой небольшой пузырек, состоящий из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, пригодных для доставки лекарственного средства млекопитающему. Компоненты липосомы обычно упорядочены в двухслойную структуру, сходную с расположением липидов биологических мембран. Липосомы, содержащие антитело, получают способами, известными в данной области, такими, как описаны в Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); патентах США № 4485045 и 4544545; и W097/38731, опубликованной 23 октября 1997 г. Липосомы с увеличенным временем циркуляции описаны в патенте США № 5013556.
Особенно полезные липосомы можно получать способом обращеннофазового испарения со смесью липидов, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE). Липосомы выдавливают через фильтры с определенным размером пор для получения липосом желаемого диаметра. Fab'-фрагменты антитела по настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al., J. Biol. Chem., 257: 286-288 (1982) посредством реакции дисульфидного обмена. Внутри липосомы, не обязательно, заключено химиотерапевтическое средство. См. Gabizon et al., J. National Cancer Inst. 81(19): 1484 (1989).
B. Связывающие олигопептиды
Связывающие олигопептиды по изобретению представляют собой олигопептиды, связывающиеся, предпочтительно специфически, с гепсином, MSP и/или комплексом гепсин:MSP, как описано в настоящем документе. Связывающие олигопептиды можно синтезировать химически с использованием известных способов синтеза олигопептидов или их можно получать и очищать с использованием рекомбинантного способа. Связывающие олигопептиды обычно составляют по меньшей мере приблизительно 5 аминокислот в длину, альтернативно, по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот в длину или более, где такие олигопептиды способны связываться, предпочтительно, специфически, с интересующей мишенью. Связывающие олигопептиды можно идентифицировать без излишних экспериментов с использованием хорошо известных способов. В связи с этим, следует отметить, что способы скрининга олигопептидных библиотек по олигопептидам, способным специфически связываться с мишенью, хорошо известны в данной области (см., например, патенты США №№ 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; Публикации PCT № WO 84/03506 и WO84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82: 178-182 (1985); Geysen et al., in Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., L Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611-616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378; Lowman, H.B. et al. (1991) Biochemistry, 30: 10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363, и Smith, G. P. (1991) Current Opin. Biotechnol., 2:668).
В связи с этим, бактериофаговый (фаговый) дисплей является одним из хорошо известных способов, позволяющих скрининг больших олигопептидных библиотек для идентификации члена(членов) этих библиотек, способных специфически связывать мишень. Фаговый дисплей представляет собой способ, посредством которого варианты полипептидов экспонируют в форме белков, слитых с белком оболочки, на поверхности частиц бактериофага (Scott, J.K. and Smith, G. P. (1990) Science, 249: 386). Полезность фагового дисплея заключается в том факте, что большие библиотеки избирательно радномизированных вариантов белка (или случайным образом клонированных кДНК) можно быстро и эффективно сортировать по тем последовательностям, которые связывают молекулу-мишень с высокой аффинностью. Экспонирование пептидных (Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378) или белковых (Lowman, H.B. et al. (1991) Biochemistry, 30: 10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol., 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363) библиотек на фагах использовали для скрининга миллионов полипептидов или олигопептидов по пептидам со специфическими свойствами связывания (Smith, G. P. (1991) Current Opin. Biotechnol., 2:668). Для сортировки фаговых библиотек случайных мутантов необходим способ конструирования и размножения большого количества вариантов, способ аффинной очистки с использованием рецептора-мишени и способы оценки результатов обогащений по связыванию. Патенты США № 5223409, 5403484, 5571689 и 5663143.
Хотя в большинстве способов фагового дисплея используют нитевидный бактериофаг, известны также системы лямбдоидного фагового дисплея (WO 95/34683; U.S. 5627024), системы T4 фагового дисплея (Ren et al., Gene, 215: 439 (1998); Zhu et al., Cancer Research. 58(15):3209-3214 (1998); Jiang et al., Infection & Immunity, 65(11): 4770-4777 (1997); Ren et al., Gene, 195(2):303-311 Π 997): Ren. Protein Sci., 5: 1833 (1996); Efimov et al., Virus Genes, 10:173 (1995)) и системы T7 фагового дисплея (Smith and Scott, Methods in Enzvmology. 217: 228-257 (1993); U.S. 5766905).
В настоящее время разработано много других улучшений и вариантов основного способа фагового дисплея. Эти улучшения увеличивают возможность систем дисплея для скрининга пептидных библиотек по связыванию выбранных молекул-мишеней и для экспонирования функциональных белков с возможностью скрининга этих белков по желательным свойствам. Разработаны устройства для комбинаторных реакций для проведения реакций фагового дисплея (WO 98/14277), и библиотеки фагового дисплея использовали для анализа и контроля взаимодействий биомолекул (WO 98/20169; WO 98/20159) и свойств пептидов с пространственно-затрудненными спиралями (WO 98/20036). В WO 97/35196 описан способ выделения аффинного лиганда, в котором библиотеку фагового дисплея приводят в контакт с одним раствором, в котором лиганд может связываться с молекулой-мишенью, и со вторым раствором, в котором аффинный лиганд не может связываться с молекулой-мишенью, для избирательного выделения связывающих лигандов. В WO 97/46251 описан способ биопэннинга случайной библиотеки фагового дисплея с помощью аффинно очищенного антитела и затем выделения связавшегося фага, с последующим способом микропэннинга с использованием лунок микропланшета для выделения фага, связывающегося с высокой аффинностью. Опубликовано также использование белка A Staphlylococcus aureus в качестве аффинной метки (Li et al. (1998) Mol Biotech., 9:187). В WO 97/47314 описано использование вычитательных по отношению к субстрату библиотек для разделения ферментных специфичностей с использованием комбинаторной библиотеки, которая может представлять собой библиотеку фагового дисплея. Способ отбора ферментов, пригодных для использования в детергентах, с использованием фагового дисплея, описан в WO 97/09446. Дополнительные способы отбора специфических связывающих белков описаны в патентах США № 5498538, 5432018 и WO 98/15833.
Способы получения пептидных библиотек и скрининга этих библиотек описаны также в патентах США № 5723286, 5432018, 5580717, 5427908, 5498530, 5770434, 5734018, 5698426, 5763192 и 5723323.
C. Связывающие малые молекулы
Связывающие малые молекулы предпочтительно представляют собой органические молекулы, отличные от олигопептидов или антител, как определено в настоящем документе, связывающиеся, предпочтительно, специфически, с гепсином, MSP и/или комплексом гепсин:MSP, как описано в настоящем документе. Связывающие малые органические молекулы можно идентифицировать и химически синтезировать с использованием известных способов (см., например, Публикации PCT № WO 00/00823 и WO 00/39585). Связывающие малые органические молекулы обычно имеют размер менее приблизительно 2000 дальтон, альтернативно, размер менее приблизительно 1500, 750, 500, 250 или 200 дальтон, где такие малые органические молекулы, способные связываться, предпочтительно, специфически, с мишенью, как описано в настоящем документе, можно идентифицировать без излишних экспериментов с использованием хорошо известных способов. В связи с этим, следует отметить, что способы скрининга библиотек малых органических молекул по молекулам, способным связываться с мишенью, хорошо известны в данной области (см., например, Публикации PCT № WO 00/00823 и WO 00/39585). Связывающие малые органические молекулы могут представлять собой, например, альдегиды, кетоны, оксимы, гидразоны, семикарбазоны, карбазиды, первичные амины, вторичные амины, третичные амины, N-замещенные гидразины, гидразиды, спирты, эфиры, тиолы, простые тиоэфиры, дисульфиды, карбоновые кислоты, сложные эфиры, амиды, мочевины, карбаматы, карбонаты, кетали, тиокетали, ацетали, тиоацетали, арилгалогениды, арилсульфонаты, алкилгалогениды, алкилсульфонаты, ароматические соединения, гетероциклические соединения, анилины, алкены, алкины, диолы, аминоспирты, оксазолидины, оксазолины, тиазолидины, тиазолины, енамины, сульфонамиды, эпоксиды, азиридины, изоцианаты, сульфонилхлориды, диазосоединения, хлорангидриды или т.п.
D. Скрининг антител, связывающих олигопептидов и связывающих малых молекул с желательными свойствами
Способы получения антител, олигопептидов и малых молекул по изобретению описаны выше. Можно далее отбирать антитела, олигопептиды или другие малые молекулы с конкретными биологическими характеристиками, как желательно.
Ингибирующие эффекты антитела, олигопептида или другой малой молекулы по изобретению можно оценивать способами, известными в данной области, например, с использованием клеток, экспрессирующих гепсин и/или про-MSP либо эндогенно, либо после трансфекции соответствующим геном(ами). Например, подходящие линии клеток опухоли и клетки, трансфицированные гепсином и/или полипептидом про-MSP, можно обрабатывать моноклональным антителом, олигопептидом или другой малой молекулой по изобретению в различных концентрациях в течение нескольких суток (например, 2-7) суток и анализировать по биологической активности (нескольким видам активности), известным как ассоциированные с активацией MSP, включая виды биологической активности, оцениваемые согласно примерам ниже. Антитело, связывающее олигопептид, или связывающая малая органическая молекула могут ингибировать активность экспрессирующей гепсин и/или MSP клетки опухоли in vitro или in vivo приблизительно на 25-100% по сравнению с необработанной клеткой опухоли, более предпочтительно, приблизительно на 30-100%, и даже более предпочтительно, приблизительно на 50-100% или 70-100%, в одном варианте осуществления концентрация антитела составляет приблизительно 0,5-30 мкг/мл. Ингибирование активности можно измерять при концентрации антитела приблизительно 0,5-30 мкг/мл или приблизительно 0,5 нМ-200 нМ в культуре клеток или в другой подходящей экспериментальной системе, где ингибирование активности определяют через 1-10 суток после воздействия антитела на клетки опухолей. Антитело является ингибирующим in vivo, если введение антитела при от приблизительно 1 мкг/кг до приблизительно 100 мг/кг массы тела приводит к уменьшению размера опухоли, уменьшению инвазивности клеток опухоли и т.д., в пределах приблизительно от 5 суток до 3 месяцев от первого введения антитела, предпочтительно, в пределах приблизительно от 5 до 30 суток.
Для скрининга антител, олигопептидов или других малых органических молекул, связывающих эпитоп на интересующей мишени, можно проводить общепринятый перекрестный конкурентный анализ, такой как описано в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Этот анализ можно использовать для определения того, связывает ли тестируемое антитело, олигопептид или другая малая органическая молекула тот же самый участок или эпитоп, как известное антитело. Альтернативно или дополнительно, можно проводить картирование эпитопов способами, известными в данной области. Например, последовательность антитела можно подвергать мутагенезу, такому как аланиновое сканирование, для идентификации контактирующих остатков. Мутантное антитело сначала тестируют по связыванию с поликлональным антителом, чтобы убедиться в правильном сворачивании. По другому способу, пептиды, соответствующие различным областям полипептида, можно использовать в конкурентных анализах с тестируемыми антителами или с тестируемым антителом и антителом с охарактеризованным или известным эпитопом.
E. Антитело-зависимая ферментно-опосредованная пролекарственная терапия (ADEPT)
Антитела по настоящему изобретению можно использовать также в ADEPT посредством конъюгации антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильное химиотерапевтическое средство, см. WO81/01145) в активное противораковое лекарственное средство. См., например, WO 88/07378 и патент США № 4975278.
Ферментный компонент иммуноконъюгата, пригодного для ADEPT, включает любой фермент, способный действовать на пролекарство таким образом, чтобы превращать его в более активную, цитотоксическую форму.
Ферменты, пригодные для способа по этому изобретению, включают, но без ограничения, щелочную фосфатазу, пригодную для превращения содержащих фосфат пролекарств в свободные лекарственные средства; арилсульфатазу, пригодную для превращения содержащих сульфат пролекарств в свободные лекарственные средства; цитозин-дезаминазу, пригодную для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство, 5-фторурацил; протеазы, такие как протеаза serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины B и L), пригодные для превращения содержащих пептиды пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, пригодные для превращения пролекарств, содержащих D-аминокислотные заместители; расщепляющие углеводы ферменты, такие как β-галактозидаза и нейраминидаза, пригодные для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамазу, пригодную для превращения лекарственных средств, дериватизированных β-лактамами, в свободные лекарственные средства; и амидазы пенициллина, такие как амидаза пенициллина V или амидаза пенициллина G, пригодные для превращения лекарственных средств, дериватизированных по атомам азота в аминах феноксиацетильными или фенилацетильными группами, соответственно, в свободные лекарственные средства. Альтернативно, антитела с ферментативной активностью, также известные в данной области как «абзимы», можно использовать для превращения пролекарств по изобретению в свободные активные лекарственные средства (см., например, Massey, Nature 328:457-458 (1987)). Конъюгаты антитело-абзим можно получать, как описано в настоящем документе, для доставки абзима к популяции клеток опухоли.
Ферменты по этому изобретению можно ковалентно связывать с антителами способами, хорошо известными в данной области, такими как использование гетеробифункциональных перекрестно сшивающих реагентов, обсуждаемых выше. Альтернативно, слитые белки, содержащие по меньшей мере антигенсвязывающую область антитела по изобретению, связанную по меньшей мере с функционально активной частью фермента по изобретению, можно конструировать с использованием способов рекомбинантной ДНК, хорошо известных в данной области (см., например, Neuberger et al., Nature 312:604-608 (1984).
F. Варианты антител
В дополнение к антителам, описанным в настоящем документе, предусматривают, что можно получать варианты антител. Варианты антител можно получать введением подходящих нуклеотидных замен в кодирующую ДНК, и/или посредством синтеза желательного антитела. Специалистам в данной области понятно, что аминокислотные замены могут изменять пост-трансляционные процессы антитела, например, изменяя количество или положение участков гликозилирования или изменяя характеристики заякоривания в мембране.
Варианты антител, описанные в настоящем документе, можно получать, например, с использованием любого из способов и руководств для консервативных и неконсервативных мутаций, указанных, например, в патенте США № 5364934. Варианты могут представлять собой замену, делецию или вставку одного или нескольких кодонов, кодирующих антитело, что приводит к изменению аминокислотной последовательности по сравнению с природной последовательностью антитела или полипептида. Необязательно вариант представляет собой замену по меньшей мере одной аминокислоты на любую другую аминокислоту в одном или нескольких доменах антитела. Руководство для определения, какой из аминокислотных остатков можно вставлять, заменять или делетировать без неблагоприятного влияния на желательную активность, можно получить сравнением последовательности антитела с последовательностями известных гомологичных белковых молекул и минимизацией количества изменений аминокислотной последовательности, выполненных в областях высокой гомологии. Аминокислотные замены могут являться результатом замены одной аминокислоты на другую аминокислоту, обладающую сходными структурными и/или химическими свойствами, например, замены лейцина на серин, т.е. консервативных замен аминокислот. Вставки или делеции могут, необязательно, лежать в диапазоне приблизительно 1-5 аминокислот. Допустимые варианты можно определять систематическим внесением вставок, делеций или замен аминокислот в последовательность и тестированием полученных вариантов по активности, проявляемой исходной последовательностью.
Фрагменты антител и полипептидов представлены в настоящем документе. Такие фрагменты могут являться укороченными по N-концу или C-концу, или могут быть лишены внутренних остатков, например, при сравнении с полноразмерным нативным антителом или белком. В конкретных фрагментах отсутствуют аминокислотные остатки, не являющиеся необходимыми для желательной биологической активности антитела или полипептида.
Фрагменты антител и полипептидов можно получать любым из множества общепринятых способов. Желательные пептидные фрагменты можно химически синтезировать. Альтернативный способ включает в себя получение фрагментов антитела или полипептида посредством ферментативного расщепления, например, посредством обработки белка ферментом, как известно, расщепляющим белки в участках, определенных конкретными аминокислотными остатками, или посредством расщепления ДНК подходящими рестрикционными ферментами и выделения желательного фрагмента. Другой пригодный способ включает выделение и амплификацию фрагмента ДНК, кодирующего желательное антитело или полипептидный фрагмент, посредством полимеразной цепной реакции (ПЦР). Олигонуклеотиды, определяющие желательные концы фрагмента ДНК, используют в качестве 5'- и 3'-праймеров в ПЦР. Предпочтительно, фрагменты антител и полипептидов разделяют по меньшей мере один вид биологической и/или иммунологической активности с природным антителом или полипептидом, описанным в настоящем документе.
В конкретных вариантах осуществления представляющие интерес консервативные замены показаны в таблице ниже под заголовком предпочтительные замены. Если такие замены приводят к изменению биологической активности, тогда вводят более существенные изменения, представляющие иллюстративные замены в этой таблице, или как дополнительно описано ниже по отношению к классам аминокислот, и проводят скрининг продуктов.
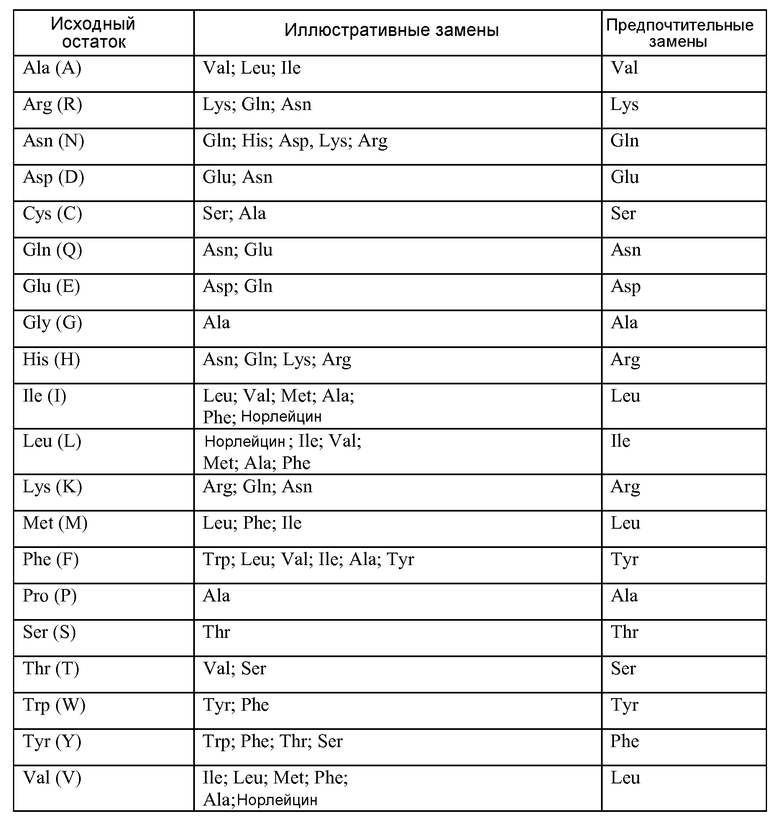
Значительные модификации функции или иммунологического родства антитела проводят, выбирая замены, значительно отличающиеся по эффекту на поддержание (a) структуры полипептидного остова в области замены, например, конформации листа или спирали, (b) заряда или гидрофобности молекулы в участке-мишени или (c) объема боковой цепи. Аминокислоты можно объединять в группы в соответствии со сходством свойств их боковых цепей (в A. L. Lehninger, в Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислые: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H)
Альтернативно, природные остатки можно разделять на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приводят к замене члена одного из этих классов на член из другого класса. Такие измененные остатки также можно вводить в участки консервативных замен или, более предпочтительно, в оставшиеся (неконсервативные) участки.
Изменения можно производить с использованием способов, известных в данной области, таких как направляемый олигонуклеотидами (сайт-специфический) мутагенез, аланиновое сканирование и ПЦР мутагенез. Сайт-специфический мутагенез [Carter et al., Nucl. Acids Res., 13:4331 (1986); Zoller et al., Nucl. Acids Res., 10:6487 (1987)], кассетный мутагенез [Wells et al., Gene. 34:315 (1985)], определяемый рестрикцией мутагенез [Wells et al., Philos. Trans. R. Soc. London SerA, 317:415 (1986)] или другие известные способы можно осуществлять с клонированной ДНК для получения ДНК варианта полипептида.
Сканирующий аминокислотный анализ можно также применять для идентификации одной или нескольких аминокислот в непрерывной последовательности. Среди предпочтительных сканирующих аминокислот присутствуют относительно небольшие, нейтральные аминокислоты. Такие аминокислоты включают аланин, глицин, серин и цистеин. Аланин, как правило, является предпочтительной сканирующей аминокислотой среди данной группы, потому что он исключает боковую цепь после бета-углерода и менее вероятно изменяет конформацию главной цепи варианта [Cunningham and Wells, Science, 244: 1081-1085 (1989)]. Аланин также, как правило, является предпочтительным, поскольку является наиболее распространенной аминокислотой. Кроме того, его часто обнаруживают как в углубленном, так и в экспонированном положении [Creighton, The Proteins, (W.H. Freeman & Co., N.Y.); Chothia, J. MoI. Biol., 150:1 (1976)]. Если при замещении аланином не получают достаточного количества вариантов, можно использовать изостерическую аминокислоту.
Любой остаток цистеина, не вовлеченный в поддержание правильной конформации антитела или полипептида, также можно заменять, главным образом, на серин, для улучшения устойчивости молекулы к окислению и предотвращения ошибочного поперечного сшивания. Напротив, в антитело или полипептид можно добавлять цистеиновую связь(и) для улучшения его стабильности (особенно, в случае, если антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменой включает одну или несколько замен остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или человеческого антитела). Как правило, полученный вариант(ы), отобранный для дальнейшей разработки, обладает улучшенными биологическими свойствами относительно исходного антитела, из которого он получен. Удобный способ получения таких вариантов с заменами включает аффинное созревание с использованием фагового дисплея. Кратко, в несколько участков гипервариабельной области (например, в 6-7 участков) вносят мутации для получения всех возможных аминокислотных замен в каждом участке. Варианты антитела, полученные таким образом, экспонируют в моновалентной форме на частицах нитевидных фагов в качестве антител, слитых с продуктом гена III M13, упакованного в каждой частице. Затем проводят скрининг вариантов в фаговом дисплее по их биологической активности (например, аффинности связывания), как описано в настоящем документе. В целях выявления участков гипервариабельной области, являющихся кандидатами для модификации, можно проводить сканирующий аланиновый мутагенез для выявления остатков гипервариабельной области, вносящих значительный вклад в связывание антигена. Альтернативно, или дополнительно, может являться преимущественным анализ кристаллической структуры комплекса антиген-антитело для определения участков контакта между антителом и полипептидным антигеном. Такие образующие контакт остатки и соседние остатки являются кандидатами для замены способами, разработанными по настоящему изобретению. После получения таких вариантов, панель вариантов подвергают скринингу, как описано в настоящем документе, и для дальнейшей разработки можно отбирать антитела с наилучшими свойствами в одном или нескольких подходящих анализах.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела, получают множеством способов, известных в данной области. Эти способы включают, но без ограничения, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение посредством направляемого олигонуклеотидами (или сайт-специфического) мутагенеза, ПЦР мутагенеза и кассетного мутагенеза ранее полученного измененного или не измененного варианта антитела.
G. Модификации антител и полипептидов
Ковалентные модификации антител и полипептидов также включены в объем этого изобретения. Один из типов ковалентной модификации включает реакцию намеченных аминокислотных остатков антитела или полипептида с органическим дериватизующим средством, способным вступать в реакцию с выбранными боковыми цепями или N- или C-концевыми остатками антитела или полипептида. Дериватизацию бифункциональными средствами применяют, например, для перекрестного сшивания антитела или полипептида с нерастворимой в воде матрицей или подложкой для применения в способе очистки антител, и наоборот. Общепринятые сшивающие средства включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, сложные эфиры N-гидроксисукцинимида, например, сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные сложные имидные эфиры, включая сложные эфиры дисукцинилимидила, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеинимиды, такие как бис-N-малеимидо-1,8-октан, и такие средства, как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают дезамидирование остатков глутаминила и аспарагинила до соответствующих остатков глутамила и аспартила, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серила или треонила, метилирование боковых цепей α-аминогрупп лизина, аргинина и гистидина [T.E. Creighton, Proteins: Structure и Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)], ацетилирование N-концевого амина, и амидирование любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации антитела или полипептида, включенный в объем этого изобретения, включает изменение характера природного гликозилирования антитела или полипептида. «Изменение характера природного гликозилирования» для целей в настоящем документе предназначено для обозначения удаления одной или нескольких углеводородных групп, обнаруженных в природной последовательности антитела или полипептида, (либо посредством удаления лежавшего в основе участка гликозилирования, либо посредством удаления гликозилирования химическими и/или ферментативными способами), и/или добавления одного или нескольких участков гликозилирования, которые не присутствуют в природной последовательности антитела или полипептида. Кроме того, фраза включает качественное изменение гликозилирования природных белков, включающее изменение природы и соотношений различных присутствующих углеводородных групп.
Гликозилирование антител и других полипептидов, как правило, является либо N-связанным, либо O-связанным. N-связанное относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, кроме пролина, являются последовательностями узнавания для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, наиболее часто, к серину или треонину, хотя можно использовать также 5-гидроксипролин или 5-гидроксилизин.
Добавление участков гликозилирования к антителу или полипептиду удобно осуществлять изменением аминокислотной последовательности, так чтобы она содержала один или несколько вышеописанных трипептидных последовательностей (для N-связанных участков гликозилирования). Изменение можно выполнять, например, добавлением или заменой с помощью одного или нескольких остатков серина или треонина в природной последовательности антитела или полипептида (для участков O-связанного гликозилирования). Аминокислотную последовательность антитела или полипептида можно, необязательно, изменять посредством замен на уровне ДНК, в частности, введением мутаций в ДНК, кодирующую антитело или полипептид, по предварительно выбранным основаниям, так что получают кодоны, которые транслируются в желаемые аминокислоты.
Другими способами увеличения количества углеводородных групп в антителе или полипептиде является химическое или ферментативное присоединение гликозидов к полипептиду. Такие способы описаны в данной области, например, в WO 87/05330, опубликованной 11 сентября 1987 г., и в Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Удаление углеводородных групп, присутствующих в антителе или полипептиде, можно осуществлять химически или ферментативно, или мутационной заменой кодонов, кодирующих аминокислотные остатки, служащие мишенями для гликозилирования. Способы химического дегликозилирования известны в данной области и описаны, например, в Hakimuddin, et al., Arch. Biochem. Biophvs., 259:52 (1987) и Edge et al., Anal. Biochem., 118:131 (1981). Ферментативное расщепление углеводородных групп на полипептидах можно осуществлять с использованием множества эндо- и экзо- гликозидаз, как описано в Thotakura et al., Meth. Enzymol., 138:350 (1987).
Другой тип ковалентной модификации антитела или полипептида включает связывание антитела или полипептида с одним из множества небелковых полимеров, например, полиэтиленгликолем (PEG), полипропиленгликолем или полиоксиалкиленами, способом, описанным в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337. Антитело или полипептид можно также заключать в микрокапсулы, полученные, например, способами коацервации или межповерхностной полимеризации (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметацилатные) микрокапсулы, соответственно), в коллоидных системах доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Антитело или полипептид по настоящему изобретению можно также модифицировать таким способом, чтобы получать химерные молекулы, содержащие антитело или полипептид, слитые с другими, гетерологичными полипептидом или аминокислотной последовательностью.
В другом варианте осуществления такая химерная молекула содержит антитело или полипептид, слитые с полипептидом-меткой, предоставляющей эпитоп, с которым может избирательно связываться антитело против метки. Эпитоп-метку, как правило, можно помещать на амино- или карбокси-конце полипептида. Присутствие таких меченных эпитопом форм антитела или полипептида можно детектировать с использованием антитела против полипептида-метки. Предоставление эпитопа-метки позволяет также легкую очистку антитела или полипептида посредством аффинной очистки с использованием антитела против метки или другого типа аффинной матрицы, связывающейся с эпитопом-меткой. Различные полипептиды-метки и соответствующие антитела хорошо известны в данной области. Примеры включают метки из полигистидина (поли-his) или поли-гистидина-глицина (поли-his-gly); полипептид-метку HA вируса гриппа и антитело против него 12CA5 [Field et al., Mol. Cell. Biol, 8:2159-2165 (1988)]; метку c-myc и антитела против нее 8F9, 3C7, 6E10, G4, B7 и 9E10 [Evan et al., Molecular and Cellular Biology, 5:3610-3616 (1985)]; и метку из гликопротеина D (gD) вируса простого герпеса и антитело против нее [Paborsky et al., Protein Engineering, 3(6):547-553 (1990)]. Другие полипептиды-метки включают Flag-пептид [Hopp et al., BioTechnology, 6: 1204-1210 (1988)]; пептид эпитопа KT3 [Martin et al., Science, 255: 192-194 (1992)]; пептид эпитопа α-тубулина [Skinner et al., J. Biol. Chem., 266:15163-15166 (1991)]; и пептидную метку из белка гена 10 T7 [Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)].
В альтернативном варианте осуществления химерная молекула может содержать антитело или полипептид, слитые с иммуноглобулином или конкретной областью иммуноглобулина. Для бивалентной формы химерной молекулы (обозначаемой также «иммуноадгезин») можно получать такой белок, слитый с Fc-областью молекулы IgG. Слитые с Ig белки предпочтительно включают замену растворимой формой (с делецией или инактивацией трансмембранного домен) антитела или полипептида по меньшей мере одной вариабельной области в молекуле Ig. В особенно предпочтительном варианте осуществления слитый с иммуноглобулином белок включает шарнирную, CH2 и CH3, или шарнирную, CH1, CH2 и CH3 области молекулы IgG1. Получение слитых с иммуноглобулинами белков см. также в патенте США № 5428130, выданном 27 июня 1995 г.
H. Получение антител и полипептидов
Описание ниже в первую очередь относится к продукции антитела или полипептида культивируемыми клетками, трансформированными или трансфицированными вектором, содержащим нуклеиновую кислоту, кодирующую антитело или полипептид. При этом, конечно, предусматривают, что альтернативные способы, хорошо известные в данной области, можно использовать для получения антител или полипептидов. Например, подходящую аминокислотную последовательность или ее части можно получать прямым пептидным синтезом с использованием твердофазных способов [см., например, Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc., 85:2149-2154 (1963)]. Синтез белка in vitro можно проводить с использованием ручных способов или автоматически. Автоматический синтез можно выполнять, например, с использованием пептидного синтезатора Applied Biosystems (Foster City, CA) с использованием инструкций производителя. Различные части антитела или полипептида можно химически синтезировать отдельно и объединять с использованием химических или ферментативных способов для получения желаемого антитела или полипептида.
1. Выделение ДНК, кодирующей антитела или полипептиды
ДНК, кодирующую антитело или полипептид, можно получать из библиотеки кДНК, полученной из ткани, считающейся обладающей мРНК антитела или полипептида и экспрессирующей ее на поддающемся детекции уровне. Соответственно, ДНК антитела или полипептида человека можно удобно получать из библиотеки кДНК, полученной из ткани человека. Кодирующий антитело или полипептид ген можно получать также из геномной библиотеки или посредством известных синтетических способов (например, автоматическим синтезом нуклеиновых кислот).
Можно проводить скрининг библиотек с помощью зондов (таких олигонуклеотиды из по меньшей мере приблизительно 20-80 оснований) сконструированными, чтобы идентифицировать интересующий ген или кодируемый им белок. Скрининг библиотеки кДНК или геномной библиотеки с помощью выбранного зонда можно проводить с использованием общепринятых способов, таких как описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативным способом выделения гена, кодирующего антитело или полипептид, является применение способа ПЦР [Sambrook et al., выше; Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)].
Способы скрининга библиотек кДНК хорошо известны в данной области. Олигонуклеотидные последовательности, выбранные в качестве зондов, должны обладать достаточной длиной и достаточной однозначностью, чтобы минимизировать ложноположительные сигналы. Олигонуклеотид предпочтительно является меченым, так что его можно детектировать при гибридизации с ДНК в скринируемой библиотеке. Способы мечения хорошо известны в данной области и включают использование радиоактивных меток, подобных 32P-меченному ATP, биотинилирование или ферментативное мечение. Условия гибридизации, включая умеренно строгие и высоко строгие, представлены в Sambrook et al., выше.
Последовательности, идентифицированные такими способами скрининга библиотек, можно сравнивать и выравнивать с другими известными последовательностями, депонированными и доступными в публичных базах данных, таких как GenBank или другие частные базы данных последовательностей. Идентичность последовательности (на аминокислотном или на нуклеотидном уровне) с определенными областями молекулы или по всей длине полноразмерной последовательности можно определять с использованием способов, известных в данной области, и как описано в настоящем документе.
Нуклеиновую кислоту, обладающую кодирующей белок последовательностью, можно получать посредством скрининга выбранных библиотек кДНК или геномных библиотек первоначально с использованием выведенной аминокислотной последовательности, описанной в настоящем документе, и, если необходимо, с использованием общепринятых способов удлинения праймеров, как описано в Sambrook et al., выше, для детекции предшественников и промежуточных продуктов процессинга мРНК, которые могли не оказаться обратно транскрибированными в кДНК.
2. Выбор и трансформация клеток-хозяев
Клетки-хозяева трансфицировали или трансформировали экспрессирующими или клонирующими векторами, описанными в настоящем документе, для продукции антитела или полипептида и культивировали в общепринятых питательных средах, модифицированных соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности. Опытный специалист в данной области может без излишних экспериментов выбрать условия культивирования, такие как среда, температура, pH и т.п. Как правило, принципы, протоколы, и практические способы для максимизации продуктивности культур клеток можно найти в Mammalian Cell Biotechnology: a Practical Approach, M. Butler, ed. (IRL Press, 1991) и Sambrook et al., выше.
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток известны специалистам в данной области, например, c помощью CaCl2, CaPO4, c помощью липосом и электропорации. В зависимости от используемой клетки-хозяина, трансформацию проводят общепринятыми способами, подходящими для таких клеток. Для прокариот, как правило, используют обработку кальцием, применяя хлорид кальция, как описано в Sambrook et al., выше, или электропорацию. Для трансформации конкретных клеток растений используют инфекцию Agrobacterium tumefaciens, как описано в Shaw et al., Gene, 23:315 (1983) и WO 89/05859, опубликованной 29 июня 1989 г. Для клеток млекопитающих без таких клеточных стенок можно использовать способ кальций-фосфатной преципитации Graham and van der Eb, Virology, 52:456-457 (1978). Общие аспекты трансфекций в системе клеток-хозяев млекопитающих описаны в патенте США № 4399216. Трансформации дрожжей, как правило, проводят способами Van Solingen et al., J. Bact, 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако для введения ДНК в клетки можно использовать также другие способы, такие как микроинъекция в ядро, электропорация, слияние бактериальных протопластов с интактными клетками или поликатионы, например, полибрен, полиорнитин. Различные способы трансформации клеток млекопитающих см. в Keown et al., Methods in Enzymology, 185:527-537 (1990) и Mansour et al., Nature, 336:348-352 (1988).
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах в настоящем документе включают клетки прокариот, дрожжей или высших эукариот. Подходящие прокариоты включают, но без ограничения, эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как E. coli. Публично доступны различные штаммы E. coli, такие как штамм E. coli K12 MM294 (ATCC 31446); E. coli X1776 (ATCC 31537); штамм E. coli W3110 (ATCC 27325) и K5 772 (ATCC 53635). Другие подходящие прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterohacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, так же как Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанный в DD 266710, опубликованной 12 апреля 1989 г.), Pseudomonas, такой как P. aeruginosa и Streptomyces. Данные примеры являются иллюстративными, а не ограничивающими. Штамм W3110 является одним из особенно предпочтительных хозяев или исходных хозяев, поскольку он является общеупотребительным штаммом-хозяином для ферментаций продукта рекомбинантной ДНК. Предпочтительно, клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 можно модифицировать для эффекта генетической мутации в генах, кодирующих белки, эндогенные для хозяина, где примеры таких хозяев включают штамм E. coli W3110 1A2, который обладает полным генотипом tonA; штамм E. coli W3110 9E4, который обладает полным генотипом tonA ptr3; штамм E. coli W3110 27C7 (ATCC 55244), который обладает полным генотипом tonA ptr3 phoA E15 (argF-lac)169 degP ompT kan r; штамм E. coli W3110 37D6, который обладает полным генотипом tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kan r; штамм E. coli W3110 40B4, который представляет собой штамм 37D6 с делеционной мутацией degP и неустойчивостью к канамицину; и штамм E. coli, обладающий мутантной периплазматической протеазой, описанный в патенте США № 4946783, опубликованном 7 августа 1990 г. Альтернативно, пригодны способы клонирования in vitro, например, ПЦР или другие реакции с полимеразой нуклеиновых кислот.
Полноразмерное антитело, фрагменты антител и слитые с антителом белки можно получать в бактериях, в частности, когда гликозилирование и эффекторные функции Fc не являются необходимыми, например, когда терапевтическое антитело конъюгируют с цитотоксическим средством (например, токсином) и иммуноконъюгат сам по себе обладает эффективностью разрушения клеток опухоли. Полноразмерные антитела обладают большим временем полужизни в кровотоке. Продукция в E. coli быстрее и более экономически выгодна. Об экспрессии фрагментов антител и полипептидов в бактериях, см., например, в U.S. 5648237 (Carter et al.), U.S. 5789199 (Joly et al.), и U.S. 5840523 (Simmons et al.), где описаны область инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, содержание этих патентов приведено в настоящем документе в качестве ссылки. После экспрессии антитело выделяют из клеточной биомассы E. coli в растворимой фракции, и его можно очищать, например, на колонке с белком A или G, в зависимости от изотипа. Окончательную очистку можно проводить способом, сходным со способом очистки антитела, экспрессированного, например, в клетках CHO.
Кроме прокариот, подходящими клонирующими или экспрессирующими хозяевами для кодирующих антитело или полипептид векторов являются эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи. Saccharomyces cerevisiae является общепринятым микроорганизмом-хозяином из низших эукариот. Другие хозяева включают Schizosaccharomyces pombe (Beach and Nurse, Nature, 290: 140 [1981]; EP 139383, опубликованная 2 мая 1985 г.); хозяева Kluyveromyces (патент США № 4943529; Fleer et al., Bio/Technology, 9:968-975 (1991)) например, такие как K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al., J. Bacteriol, 154(2):737-742 [1983]), K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al., Bio/Technology, 8:135 (1990)), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070; Sreekrishna et al., J. Basic Microbiol., 28:265-278 [1988]); Candida; Trichoderma reesia (EP 244234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76:5259-5263 [1979]); Schwanniomyces, такие как Schwanniomyces occidentalis (EP 394538, опубликованная 31 октября 1990 г.); и мицелиальные грибы, например, такие как Neurospora, Penicillium, Tolypocladium (WO 91/00357, опубликованная 10 января 1991 г.), и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112:284-289 [1983]; Tilburn et al., Gene, 26:205-221 [1983]; Yelton et al., Proc. Natl. Acad. Sci. USA, 81: 1470-1474 [1984]) и A. niger (Kelly and Hynes, EMBO J., 4:475-479 [1985]). Метилотрофные дрожжи подходят для этой цели и включают, но без ограничения, дрожжи, способные расти на метаноле, выбранные из родов, состоящих из Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Список конкретных видов, являющихся примерами этого класса дрожжей, можно найти в C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Подходящие клетки-хозяева для экспрессии гликозилированного антитела или полипептида происходят из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки насекомых, таких как Drosophila S2 и Spodoptera Sf9, так же как клетки растений, например, культуры клеток кукурузы, картофеля, сои, петунии, томата и табака. Идентифицировано множество штаммов и вариантов бакуловирусов и соотвествующих пермиссивных клеток-хозяев насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Множество штаммов вирусов для трансфекции являются широко доступными, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать в качестве вирусов по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культуре тканей) стало общепринятым способом. Примерами пригодных линий клеток хозяев-млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы буффало (BRL 3A, ATCC CR11442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими и клонирующими векторами для продукции полипептида по изобретению и культивирования в общепринятой питательной среде, модифицированной соответствующим образом веществами для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
3. Выбор и применение реплицирующегося вектора
Нуклеиновую кислоту (например, кДНК или геномную ДНК), кодирующую антитело или полипептид, можно вставлять в реплицирующийся вектор для клонирования (амплификации ДНК) или для экспрессии. Различные векторы являются публично доступными. Вектор может присутствовать, например, в форме плазмиды, космиды, вирусной частицы или фага. Подходящую последовательность нуклеиновой кислоты можно вставить в вектор посредством множества способов. Как правило, ДНК вставляют в подходящий участок(участки) рестрикционной эндонуклеазы с использованием способов, известных в данной области. Компоненты вектора, как правило, включают, но без ограничения, одну или несколько сигнальных последовательностей, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор, и последовательность терминации транскрипции. Для конструирования подходящих векторов, содержащих один или несколько из этих компонентов, применяют общепринятые способы лигирования, известные специалисту в данной области.
Полипептид можно получать не только напрямую рекомбинантным способом, но также как полипептид, слитый с гетерологичным полипептидом, который может представлять собой сигнальную последовательность или другой полипептид, обладающий специфическим участком расщепления на N-конце зрелого белка или полипептида. Как правило, сигнальная последовательность может являться компонентом вектора, или она может являться частью ДНК, кодирующей антитело или полипептид, которая вставлена в вектор. Сигнальная последовательность может представлять собой прокариотическую сигнальную последовательность, выбранную, например, из группы из лидеров щелочной фосфатазы, пенициллиназы, lpp, или термостабильного энтеротоксина II. Для секреции в дрожжах сигнальная последовательность может представлять собой, например, лидер инвертазы дрожжей, лидер альфа-фактора (включая лидеры α-факторов Saccharomyces и Kluyveromyces, последний описан в патенте США № 5010182), или лидер кислой фосфатазы, лидер глюкоамилазы C. albicans (EP 362179, опубликованная 4 апреля 1990 г.), или сигнал, описанный в WO 90/13646, опубликованной 15 ноября 1990 г. При экспрессии в клетках млекопитающих, чтобы направлять секрецию белка, можно использовать сигнальные последовательности млекопитающих, такие как сигнальные последовательности из секретируемых полипептидов того же самого или родственных видов, так же как вирусные секреторные лидеры.
Как экспрессирующие, так и клонирующие векторы содержат последовательность нуклеиновой кислоты, позволяющую вектору реплицироваться в одной или нескольких выбранных клетках-хозяевах. Такие последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 пригодна для большинства грамотрицательных бактерий, точка начала репликации плазмиды 2μ пригодна для дрожжей, и различные вирусные точки начала репликации (SV40, полиомы, аденовируса, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих.
Экспрессирующие и клонирующие векторы, как правило, содержат ген для селекции, называемый также селективным маркером. Типичные гены для селекции кодируют белки, которые (a) обеспечивают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату, или тетрациклину, (b) комплементируют ауксотрофную недостаточность, или (c) снабжают критическими питательными веществами, недоступными из комплексной среды, например, ген, кодирующий D-аланин-рацемазу для Bacilli.
Примером пригодных селективных маркеров для клеток млекопитающих являются маркеры, обеспечивающие идентификацию клеток, компетентных для поглощения нуклеиновой кислоты, кодирующей антитело или полипептид, такие как DHFR или тимидинкиназа. При использовании DHFR дикого типа подходящей клеткой-хозяином является линия клеток CHO, дефецитных по активности DHFR, полученная и размноженная, как описано в Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980). Пригодным геном для селекции для использования в дрожжах является ген trp1, присутствующий в плазмиде дрожжей YRp7 [Stinchcomb et al., Nature, 282:39 (1979); Kingsman et al., Gene. 7:141 (1979); Tschemper et al., Gene, 10:157 (1980)]. Ген trp1 обеспечивает селективный маркер для мутантного штамма дрожжей, лишенных способности расти на триптофане, например, ATCC № 44076 или PEP4-1 [Jones, Genetics, 85:12 (1977)].
Экспрессирующие и клонирующие векторы обычно содержат промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей антитело или полипептид, для непосредственного синтеза мРНК. Промоторы, узнаваемые множеством потенциальных клеток-хозяев, хорошо известны. Промоторы, пригодные для использования в прокариотических хозяевах, включают промоторные системы β-лактамазы и лактозы [Chang et al., Nature, 275:615 (1978); Goeddel et al., Nature, 281:544 (1979)], щелочной фосфатазы, промоторную систему триптофана (trp) [Goeddel, Nucleic acids Res., 8:4057 (1980); EP 36776], и гибридные промоторы, такие как промотор tac [deBoer et al., Proc Natl. Acad. Sci. USA, 80:21-25 (1983)]. Промоторы для использования в бактериальных системах могут содержать также последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей антитело или полипептид.
Примеры пригодных промоторных последовательностей для использования в дрожжевых хозяевах включают промоторы для 3-фосфоглицераткиназы [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] или других гликолитических ферментов [Hess et al., J. Adv. Enzyme Reg., 7:149 (1968); Holland, Biochemistry, 17:4900 (1978)], таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, изомераза фосфоглюкозы и глюкокиназа.
Другими промоторами дрожжей, представляющими собой индуцируемые промоторы, обладающие дополнительным преимуществом транскрипции, контролируемой условиями роста, являются промоторные области алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, ферментов деградации, связанных с метаболизмом азота, металлотеонеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Пригодные векторы и промоторы для использования для экспрессии в дрожжах дополнительно описаны в EP 73657.
Транскрипцию антитела или полипептида с векторов в клетках-хозяевах из млекопитающих контролируют, например, с помощью промоторов, полученных из геномов вирусов, таких как вирус полиомы, вирус оспы-дифтерита птиц (UK 2211504, опубликованная 5 июля 1989 г.), аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьян 40 (SV40), гетерологичных промоторов млекопитающих, например, промоторов актина или иммуноглобулина, и промоторов теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Транскрипцию ДНК, кодирующей антитело или полипептид, у высших эукариот можно увеличить вставкой в вектор энхансерной последовательности. Энхансеры представляют собой цис-действующие элементы ДНК, обычно приблизительно от 10 до 300 п.н., которые действуют на промотор для увеличения его транскрипции. В настоящее время известно множество энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Как правило, однако, используют энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне от точки начала репликации (п.н. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне от точки начала репликации, и энхансеры аденовируса. Энхансер можно вставить в вектор в положении 5' или 3' от последовательности, кодирующей антитело или полипептид, но предпочтительно его локализуют в участке 5' от промотора.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (клетках дрожжей, грибов, насекомых, растений, животных, человека, или содержащих ядро клетках из других многоклеточных организмов), могут содержать также последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности из 5'- и, иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК, являются общедоступными. Эти области содержат нуклеотидные фрагменты, транскрибируемые как полиаденилированные фрагменты в нетранслируемой части мРНК, кодирующей антитело или полипептид.
Другие способы, векторы и клетки-хозяева, подходящие для адаптации для синтеза антитела или полипептида в культуре рекомбинантных клеток позвоночных, описаны в Gething et al., Nature. 293:620-625 (1981); Mantei et al., Nature, 281:40-46 (1979); EP 117060; и EP 117058.
4. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продукции антитела или полипептида по этому изобретению, можно культивировать в разнообразных средах. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma)), RPMI-1640 (Sigma) и среда Игла, модифицированная Дульбекко, ((DMEM), Sigma). Кроме того, в качестве культуральной среды для клеток-хозяев можно использовать любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal Biochem. 102:255 (1980), патентах США № 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или в патенте США Re. 30985. Любые их этих сред можно дополнять при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид и фосфат натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство ГЕНТАМИЦИН™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях микромолярного диапазона) и глюкозой или эквивалентным источником энергии. Также можно добавлять любые другие добавки в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, которые ранее использовали для выбранных для экспрессии клеток-хозяев, и они очевидны специалисту в данной области.
5. Детекция амплификации/экспрессии гена
Амплификацию и/или экспрессию гена можно измерять в образце непосредственно, например, посредством общепринятого Саузерн-блоттинга, Нозерн-блоттинга для количественной оценки транскрипции мРНК [Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)], дот-блоттинга (анализ ДНК), или гибридизации in situ с использованием соответствующим образом меченого зонда на основе представленных в настоящем документе последовательностей. Альтернативно, можно применять антитела, которые могут узнавать специфические дуплексы, включая дуплексы ДНК, дуплексы РНК и гибридные дуплексы ДНК-РНК или дуплексы ДНК-белок. Антитела, в свою очередь, можно метить, и можно проводить анализ, где дуплекс связан с подложкой, так что при формировании дуплекса на подложке можно детектировать антитело, связанное с дуплексом.
Альтернативно, экспрессию гена можно измерять иммунологическими способами, такими как иммуногистохимическое окрашивание клеток или срезов ткани и анализ культуры клеток или жидкостей организма для непосредственной количественной оценки экспрессии продукта гена. Антитела, пригодные для иммуногистохимического окрашивания и/или анализа жидкостей организма, могут являться либо моноклональными, либо поликлональными, и их можно получать в любом млекопитающем. Можно легко получать антитела против природной последовательности полипептида или против синтетического пептида на основе последовательности ДНК, представленной в настоящем документе, или против экзогенной последовательности, слитой с ДНК антитела или полипептида и кодирующей специфический эпитоп антитела.
6. Очистка антитела и полипептида
Формы антитела или полипептида можно выделять из культуральной среды или из лизатов клетки-хозяина. Если они связаны с мембраной, их можно высвобождать из мембраны с использованием раствора подходящего детергента (например, Тритона-X 100) или ферментативного расщепления. Клетки, используемые для экспрессии антитела или полипептида, можно разрушать различными физическими или химическими способами, такими как циклы замораживания и оттаивания, обработка ультразвуком, механическое разрушение или лизирующие клетки средства.
Может являться желательным очистить антитело или полипептид от белков или полипептидов рекомбинантных клеток. Следующие способы являются примерами подходящих способов очистки: фракционирование на ионообменной колонке; осаждение этанолом; обращеннофазовая ВЭЖХ; хроматография на оксиде кремния или на катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с использованием, например, Sephadex G-75; колонки с сефарозой с белком A для удаления примесей, таких как IgG; и металл-хелатные колонки для связывания меченных эпитопом форм антитела и полипептида. Можно применять различные способы очистки белка, и такие способы известны в данной области и описаны, например, в Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранная стадия(и) очистки будет зависеть, например, от природы используемого способа получения и конкретного полученного антитела или полипептида.
С использованием рекомбинантных способов можно продуцировать антитело внутриклеточно, в периплазматическом пространстве, или непосредственно секретировать в среду. При внутриклеточной продукции антитела, в качестве первой стадии удаляют дебрис в виде частиц как клеток-хозяев, так и лизированных фрагментов, например, посредством центрифугирования или ультрацентрифугирования. В Carter et al., Bio/Technology 10:163-167 (1992) описан способ выделения антител, которые секретируются в периплазматическое пространство E. coli. Кратко, клеточную массу размораживают в присутствии ацетата натрия (pH 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 мин. Клеточный дебрис можно удалять центрифугированием. В случае, когда антитело секретируется в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например, установки для ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза на любой из указанных выше стадий можно добавлять ингибитор протеаз, такой как PMSF, и можно добавлять антибиотики для предотвращения роста нежелательных организмов.
Композицию антитела, полученную из клеток, можно очищать с использованием, например, хроматографии с гидроксилапатитом, гель-электрофореза, диализа и аффинной хроматографии, где аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, присутствующего в антителе. Белок A можно использовать для очистки антител, в основе которых лежат тяжелые цепи γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендован для всех изотипов мыши и для γ3 человека (Guss et al., EMBO J. 5:15671575 (1986)). Матрица, к которой присоединен аффинный лиганд, наиболее часто представляет собой агарозу, однако доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокие скорости потока и более короткое время обработки, чем те, которых можно достигать с помощью агарозы. Если антитело содержит домен CH3, для очистки является пригодной смола ABX™ (J. T. Baker, Phillipsburg, NJ). Также в зависимости от антитела, подлежащего выделению, пригодными являются другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на SEPHAROSE™ с гепарином, хроматография на анионной или катионной обменной смоле (например, колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После любой предварительной стадии(ий) очистки смесь, содержащую представляющее интерес антитело и примеси, можно подвергать хроматографии гидрофобного взаимодействия с низким значением pH с использованием буфера для элюирования со значением pH между приблизительно 2,5-4,5, которую предпочтительно проводят при низких концентрациях соли (например, приблизительно 0-0,25 М соль).
I. Фармацевтические составы
Терапевтические составы антител, связывающих олигопептидов, связывающих малых органических или неорганических молекул и/или полипептидов, используемых по настоящему изобретению, подготавливают для хранения смешиванием антитела, полипептида, олигопептида или малой органической или неорганической молекулы, обладающей желаемой степенью чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как ацетат, Трис, фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексония; хлорид бензалкония, хлорид бензетония; фенольный, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводороды, включая глюкозу, маннозу, или декстрины; хелатобразующие средства, такие как ЭДТА; придающие тоничность средства, такие как трегалоза и хлорид натрия; сахара, такие как сахароза, маннит, трегалоза или сорбит; поверхностно-активное вещество, такое как полисорбат; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как ТВИН™, ПЛЮРОНИК™ или полиэтиленгликоль (PEG). Состав может содержать антитело в концентрации между 5-200 мг/мл, предпочтительно между 10-100 мг/мл.
Составы в настоящем документе могут содержать также более одного активного компонента, как необходимо для конкретного симптома, подлежащего лечению, предпочтительно, компоненты со взаимодополняющим действием, не оказывающие отрицательного влияния друг на друга. Например, в дополнение к антителу, связывающему олигопептиду или связывающей малой органической или неорганической молекуле, может быть желательным включение в один состав дополнительного антитела, например, второго антитела, которое связывает различные эпитопы одного пептида, или антитела, нацеленного на какую-либо другую мишень, в частности, фактор роста, который влияет на рост конкретной злокачественной опухоли. Альтернативно или дополнительно, композиция может содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, антигормональное средство и/или кардиопротектор. Такие молекулы, соответственно, присутствуют в сочетании в количествах, эффективных для предназначенной цели.
Активные ингредиенты можно заключать в микрокапсулы, полученные, например, способами коацервации или межфазной полимеризацией, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, где матрицы присутствуют в форме профилированных изделий, например, пленок или микрокапсул. Примеры матриц с пролонгированным действием включают полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат), или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие как LUPRON DEPOT™ (пригодные для инъекции микросферы, состоящие из сополимера молочной кислоты - гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Составы, применяемые для введения in vivo, должны быть стерильными. Этого легко достичь фильтрацией через стерилизующие фильтрационные мембраны.
J. Лечение антителами, связывающими олигопептидами и связывающими малыми органическими/неорганическими молекулами
Для определения экспрессии полипептида (гепсина и/или MSP) при злокачественных опухолях доступно множество детектирующих анализов. В одном варианте осуществления сверхэкспрессию полипептида можно анализировать посредством иммуногистохимии (IHC). Погруженные в парафин срезы тканей из биоптата опухоли можно подвергать анализу IHC и следовать критериям интенсивности окрашивания полипептида следующим образом:
Балл 0: не наблюдают окрашивания, или окрашивание мембраны наблюдают менее чем в 10% клеток опухоли.
Балл 1+: слабое/незначительно выявляемое окрашивание мембраны более чем в 10% клеток опухоли. У клеток окрашивается лишь часть мембраны.
Балл 2+: от слабого до умеренно полного окрашивания мембраны наблюдают более чем в 10% клеток опухоли.
Бал 3+: от умеренного до сильного полного окрашивания мембраны наблюдают более чем в 10% клеток опухоли.
Опухоли с баллами экспрессии полипептида от 0 до 1+ можно охарактеризовать как не обладающие сверхэкспрессией полипептида, в то время как опухоли с баллами от 2+ или 3+ можно охарактеризовать как обладающие сверхэкспрессией полипептида.
Альтернативно или дополнительно, анализы FISH, такие как INFORM™ (поставляемый Ventana, Arizona) или PATHVISION™ (Vysis, Illinois) можно проводить на фиксированном в формалине, погруженном в парафин образце опухолевой ткани для выявления уровня (при его наличии) сверхэкспрессии полипептида в опухоли.
Сверхэкспрессию или амплификацию полипептида можно оценивать с использованием анализа детекции in vivo, например, посредством введения молекулы (такой как антитело, олигопептид или малая органическая молекула), связывающейся с молекулой, подлежащей детекции, и меченной поддающейся детекции меткой (например, радиоактивным изотопом или флуоресцентной меткой) и наружное сканирование пациента для локализации метки.
Как описано выше, антитела, олигопептиды и малые органические/неорганические молекулы по изобретению имеют различные нетерапевтические применения. Антитела, олигопептиды и малые органические/неорганические молекулы по настоящему изобретению могут являться пригодными для определения стадий экспрессирующих полипептид злокачественных опухолей (например, при радиовизуализации). Антитела, олигопептиды и малые органические/неорганические молекулы являются также пригодными для очистки или иммунопреципитации полипептида из клеток, для детекции и количественной оценки полипептида in vitro, например, в ELISA или Вестерн-блоттинге, для уничтожения и удаления экспрессирующих полипептид клеток из популяции смешанных клеток в качестве стадии очистки других клеток.
В настоящее время, в зависимости от стадии злокачественной опухоли, лечение злокачественной опухоли включает один из следующих видов терапии или комбинацию следующих видов терапии: хирургическая операция для удаления злокачественной ткани, радиотерапия и химиотерапия. Терапия антителом, олигопептидом или малой органической/неорганической молекулой может являться особенно желательной для пожилых пациентов, которые плохо переносят токсичность и побочные эффекты химиотерапии, и при метастазирующем заболевании, когда радиотерапия обладает ограниченной применимостью. Нацеленные на опухоли антитела, олигопептиды и малые органические/неорганические молекулы по изобретению являются пригодными для облегчения при экспрессирующих полипептид злокачественных опухолях после первичной диагностики заболевания или во время рецидива. Для терапевтических применений антитело, олигопептид или малую органическую/неорганическую молекулу можно использовать отдельно или при комбинированной терапии, например, вместе с гормонами, антиангиогенными или меченными радиоактивной меткой соединениями, или вместе с хирургией, криотерапией и/или радиотерапией. Лечение антителом, олигопептидом или малой органической/неорганической молекулой можно проводить одновременно с другими формами общепринятой терапии, или в последовательном порядке до или после общепринятой терапии. Химиотерапевтические средства, такие как ТАКСОТЕР® (доцетаксел), ТАКСОЛ® (паклитаксел), эстрамустин и митоксантрон, используют для лечения злокачественной опухоли, в частности, у пациентов с высоким риском. В настоящем способе по изобретению для лечения или облегчения злокачественной опухоли, пациенту со злокачественной опухолью можно вводить антитело, олигопептид или малую органическую/неорганическую молекулу в сочетании с лечением одним или несколькими из предшествующих химиотерапевтических средств. В частности, предусмотрена комбинированная терапия паклитакселом и модифицированными производными (см., например, EP0600517). Антитело, олигопептид или малую органическую/неорганическую молекулу можно вводить вместе с терапевтически эффективной дозой химиотерапевтического средства. В другом варианте осуществления антитело, олигопептид или малую органическую/неорганическую молекулу вводят в сочетании с химиотерапией для увеличения активности и эффективности химиотерапевтического средства, например, паклитаксела. В Physicians' Desk Reference (PDR) описаны дозы этих средств, которые использовали для лечения различных злокачественных опухолей. Режим дозирования и дозы этих вышеупомянутых химиотерапевтических средств, являющиеся терапевтически эффективными, зависят от конкретной злокачественной опухоли, подлежащей лечению, тяжести заболевания и других факторов, известных терапевту-специалисту в данной области, и их может определить терапевт.
В одном конкретном варианте осуществления конъюгат, содержащий антитело, олигопептид или малую органическую/неорганическую молекулу, конъюгированные с цитотоксическим средством, вводят пациенту. Предпочтительно, иммуноконъюгат, связанный с белком, интернализуется клеткой, что приводит к увеличенной терапевтической эффективности иммуноконъюгата для уничтожения клетки злокачественной опухоли, с которой он связывается. В предпочтительном варианте осуществления цитотоксическое средство нацелено на нуклеиновую кислоту или интерферирует с нуклеиновой кислотой в клетке злокачественной опухоли. Примеры таких цитотоксических средств описаны выше и включают майтанзиноиды, калихеамицины, рибонуклеазы и ДНК-эндонуклеазы.
Антитела, олигопептиды, малые органические/неорганические молекулы или их конъюгаты с токсинами вводят пациенту-человеку, в соответствии с известными способами, такими как внутривенное введение, например, в виде болюса или посредством непрерывной инфузии в течение периода времени, посредством внутримышечных, внутрибрюшинных, интрацереброспинальных, подкожных, интраартикулярных, внутрисуставных, интрасиновиальных, интратекальных, пероральных, местных способов или способов ингаляции. Внутривенное или подкожное введение антитела, олигопептида или малой органической/неорганической молекулы является предпочтительным.
Другие терапевтические режимы можно комбинировать с введением антитела, олигопептида или малой органической/неорганической молекулы. Комбинированное введение включает совместное введение, с использованием отдельных составов или одного фармацевтического состава, и последовательное введение в любом порядке, где, предпочтительно, существует период времени, когда оба (или все) активных средства одновременно проявляют свою биологическую активность. Предпочтительно, такая комбинированная терапия приводит к синергическому терапевтическому эффекту.
Может также являться желательным комбинировать введение антитела или антител, олигопептидов или малых органических/неорганических молекул, с введением антитела, нацеленного против другого опухолевого антигена, ассоциированного с конкретной опухолью.
В другом варианте осуществления способы терапевтического лечения по настоящему изобретению включает комбинированное введение антитела (или антител), олигопептидов или малых органических/неорганических молекул и одного или нескольких химиотерапевтических средств или ингибирующих рост средств, включая совместное введение коктейлей различных химиотерапевтические средства. Химиотерапевтические средства включают фосфат эстрамустина, преднемустин, цисплатин, 5-фторурацил, мелфалан, циклофосфамид, гидроксимочевину и гидроксимочевинатаксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики. Получение и режимы дозирования для таких химиотерапевтических средств можно использовать согласно инструкциям производителя или по эмпирическому определению практикующего специалиста в данной области. Получение и режимы дозирования для такой химиотерапии описаны также в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антитело, олигопептид или малую органическую/неорганическую молекулу можно комбинировать с антигормональным соединением; например, антиэстрогеновым соединением, таким как тамоксифен; антипрогестероном, таким как онапристон (см., EP 616 812); или антиандрогеном, таким как флутамид, в дозах, известных для таких молекул. Когда злокачественная опухоль, подлежащая лечению, является андроген-независимой злокачественной опухолью, пациента могли ранее подвергать анти-андрогенной терапии и, после того как злокачественная опухоль стала андроген-независимой, пациенту можно вводить антитело, олигопептид или малую органическую/неорганическую молекулу (и необязательно, другие средства, как описано в настоящем документе).
Иногда может являться преимущественным совместное введение также кардиопротектора (для предотвращения или уменьшения дисфункции миокарда, связанной с терапией) или одного или нескольких цитокинов пациенту. В дополнение к вышеуказанным терапевтическим режимам, пациента могут подвергать хирургическому удалению клеток злокачественных опухолей и/или радиотерапии, до, во время или после терапии антителом, олигопептидом или малой органической/неорганической молекулой. Подходящие дозы для любого из вышеуказанных вводимых совместно средств являются такими, какие используют в настоящее время, и их можно понижать благодаря комбинированному действию (синергизму) средства и антитела, олигопептида или малой органической/неорганической молекулы.
Для предотвращения или лечения заболевания дозу и способ введения выбирает терапевт согласно известным критериям. Подходящая доза антитела, олигопептида или малой органической/неорганической молекулы зависит от типа заболевания, подлежащего лечению, как определено выше, от тяжести и течения заболевания, от того, вводят ли антитело, олигопептид или малую органическую/неорганическую молекулу для профилактических или терапевтических целей, от предшествующей терапии, истории болезни пациента и ответа на антитело, олигопептид или малую органическую/неорганическую молекулу, и от решения лечащего врача. Антитело, олигопептид или малую органическую/неорганическую молекулу подходящим образом вводят пациенту однократно или на протяжении серии введений. Предпочтительно, антитело, олигопептид или малую органическую/неорганическую молекулу вводят посредством внутривенной инфузии или посредством подкожных инъекций. В зависимости от типа и тяжести заболевания, от приблизительно 1 мкг/кг до приблизительно 50 мг/кг массы тела (например, приблизительно 0,1-15 мг/кг/дозу) антитела может представлять собой начальный вариант дозы для введения пациенту, например, посредством одного или нескольких введений, или посредством непрерывной инфузии. Режим дозирования может включать введение первоначальной нагрузочной дозы приблизительно 4 мг/кг, с последующим введением еженедельной поддерживающей дозы приблизительно 2 мг/кг антитела. Однако можно использовать другие схемы дозирования. Типичная ежесуточная доза может лежать в диапазоне от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких суток или дольше, в зависимости от состояния, лечение продолжают, пока не возникнет желательное подавление симптомов заболевания. Прогресс этой терапии легко мониторировать общепринятыми способами и анализами и на основании критериев, известных терапевту или другим специалистам в данной области.
Помимо введения белка антитела пациенту по настоящей заявке предусмотрено введение антитела посредством генотерапии. Такое введение нуклеиновых кислот, кодирующих антитело, включено в выражение «введение эффективного количества антагониста». См., например, WO 96/07321, опубликованную 14 марта 1996 г., относительно использования генотерапии для получения внутриклеточных антител.
Существует два основных способа получения нуклеиновой кислоты (необязательно, содержащейся в векторе) в клетках пациента; in vivo и ex vivo. Для доставки in vivo нуклеиновую кислоту инъецируют непосредственно пациенту, обычно в участке, где необходимо антитело. Для обработки ex vivo клетки пациента удаляют, нуклеиновую кислоту вводят в эти выделенные клетки, и модифицированные клетки вводят пациенту либо непосредственно, либо, например, инкапсулированными внутри пористых мембран, которые имплантируют пациенту (см., например, патенты США № 4892538 и 5283187). Существует множество способов, доступных для введения нуклеиновых кислот в жизнеспособные клетки. Способы меняются в зависимости от того, переносят ли нуклеиновую кислоту в культивируемые клетки in vitro или в клетки намеченного хозяина in vivo. Способы, пригодные для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают использование липосом, электропорации, микроинъекции, слияния клеток, DEAE-декстрана, способа преципитации фосфатом кальция и т.д. Общепринятым вектором для доставки гена ex vivo является ретровирусный вектор.
Предпочтительные в настоящее время способы переноса нуклеиновой кислоты in vivo включают трансфекцию вирусными векторами (такими как аденовирус, вирус простого герпеса I или аденоассоциированный вирус) и системы на основе липидов (пригодными липидами для опосредованного липидами переноса гена являются, например, DOTMA, DOPE и DC-Chol). Обзор известных в настоящее время способов маркировки генов и генотерапии см., например, в Anderson et al., Science 256:808-813 (1992). См. также WO 93/25673 и процитированные в этом документе ссылки.
Антитела по изобретению могут присутствовать в различных формах, включенных в определение «антитело» в настоящем документе. Таким образом, антитела включают полноразмерное или интактное антитело, фрагменты антител, антитело с природной последовательностью или с вариантами аминокислот, гуманизированные, химерные или слитые антитела, их иммуноконъюгаты и функциональные фрагменты. В слитых антителах последовательность антитела слита с последовательностью гетерологичного полипептида. Антитела можно модифицировать в Fc-области для обеспечения желательных эффекторных функций. Как более подробно обсуждают в разделах настоящего документа, с помощью соответствующих Fc-областей, голое антитело, связанное с поверхностью клеток, может индуцировать цитотоксичность, например, через антителозависимую клеточную цитотоксичность (ADCC) или посредством рекрутирования комплемента при комплементзависимой цитотоксичности, или по какому-либо другому механизму. Альтернативно, если желательно исключить или уменьшить эффекторные функции, чтобы минимизировать побочные эффекты или терапевтические осложнения, можно использовать другие конкретные Fc-области.
В одном варианте осуществления антитело конкурирует за связывание или связывается по существу с тем же самым эпитопом, что и антитела по изобретению. Предусмотрены также антитела, обладающие биологическими характеристиками антител по настоящему изобретению, конкретно включая нацеливание на опухоли in vivo и любое ингибирование пролиферации клеток или цитотоксические характеристики.
Способы получения вышеуказанных антител подробно описаны в настоящем документе.
Настоящие антитела, олигопептиды и малые органические/неорганические молекулы пригодны для лечения экспрессирующей гепсин и/или MSP злокачественной опухоли, или для облегчения одного или нескольких симптомов злокачественной опухоли у млекопитающего. Способы по изобретению включают использование антагонистов для лечения и/или облегчения симптомов метастазирующих опухолей, связанных с этими злокачественными опухолями. Антитело, олигопептид или малая органическая/неорганическая молекула-антагонист способны связываться по меньшей мере с частью клеток злокачественных опухолей, экспрессирующих полипептид(ы) (гепсин и/или MSP) у млекопитающего. В одном варианте осуществления антитело, олигопептид или малая органическая/неорганическая молекула является эффективным, чтобы вызывать разрушение или уничтожение экспрессирующих полипептид и/или чувствительных клеток опухолей, или ингибировать рост и/или инвазивность таких клеток опухолей, in vitro или in vivo, при связывании с полипептидом. Такое антитело включает голое антитело (не конъюгированное с каким-либо средством). Голые антитела, обладающие цитотоксическими или другими ингибирующими свойствами, можно дополнительно соединять с цитотоксическим средством для придания им еще большей активности для разрушения клеток опухолей. Цитотоксические свойства можно придавать антителу, например, посредством конъюгации антитела с цитотоксическим средством с образованием иммуноконъюгата, как описано в настоящем документе. В некоторых вариантах осуществления цитотоксическое средство или ингибирующее рост средство является низкомолекулярным. В некоторых вариантах осуществления используют токсины, такие как калихеамицин или майтанзиноид и их аналоги или производные.
Изобретение относится к композиции, содержащей антитело, олигопептид или малую органическую/неорганическую молекулу по изобретению и носитель. Для целей лечения злокачественных опухолей композиции можно вводить пациенту, нуждающемуся в таком лечении, где композиция может содержать одно или несколько антител, присутствующих в форме иммуноконъюгата или в форме голого антитела. В следующем варианте осуществления композиции могут содержать эти антитела, олигопептиды или малые органические/неорганические молекулы в сочетании с другими лекарственными средствами, такими как цитотоксические или ингибирующие рост средства, включая химиотерапевтические средства. Изобретение относится также к составам, содержащим антитело, олигопептид или малую органическую/неорганическую молекулу по изобретению и носитель. В одном варианте осуществления состав представляет собой терапевтический состав, содержащий фармацевтически приемлемый носитель.
В другом аспекте изобретение относится к выделенным нуклеиновым кислотам, кодирующим антитела. Включены нуклеиновые кислоты, кодирующие остатки как H, так и L цепей, и особенно гипервариабельной области, цепи, кодирующие антитело с природной последовательностью, так же как варианты, модификации и гуманизированные варианты антител.
Изобретение относится также к способам, пригодным для лечения злокачественной опухоли или облегчения одного или нескольких симптомов злокачественной опухоли у млекопитающего, включающим введение терапевтически эффективного количества антитела, олигопептида или малой органической/неорганической молекулы млекопитающему. Терапевтические композиции антитела, олигопептида или малой органической/неорганической молекулы можно вводить кратковременно (остро) или хронически, или дробно, по указанию терапевта. Представлены также способы ингибирования роста и уничтожения экспрессирующей полипептид (гепсин и/или MSP) и/или чувствительной клетки.
Изобретение относится также к наборам и изделиям, содержащим по меньшей мере одно антитело, олигопептид или малую органическую/неорганическую молекулу. Наборы, содержащие антитела, олигопептиды или малые органические/неорганические молекулы, находят применение, например, для анализов уничтожения клеток, для ингибирования инвазии клеток опухоли и для очистки или иммунопреципитации полипептида из клеток. Например, для выделения и очистки полипептида, набор может содержать антитело, олигопептид или малую органическую/неорганическую молекулу, связанную с бусинами (например, бусинами сефарозы). Можно предоставлять наборы, содержащие антитела, олигопептиды или малые органические/неорганические молекулы для детекции и количественного определения полипептида in vitro, например, в ELISA или Вестерн-блоттинге. Такое антитело, олигопептид или малую органическую/неорганическую молекулу, пригодную для детекции, можно предоставлять с меткой, такой как флуоресцентная или радиоактивная метка.
K. Изделия и наборы
Другой вариант осуществления изобретения относится к изделию, содержащему материалы, применимые для лечения экспрессирующей полипептид (гепсин и/или MSP) злокачественной опухоли, такой как злокачественная опухоль предстательной железы и яичника. Изделие содержит контейнер и этикетку или листовку-вкладыш на контейнере или приложенные к контейнеру. Подходящие контейнеры включают, например, флаконы, ампулы, шприцы и т.д. Контейнеры можно изготавливать из множества материалов, таких как стекло или пластик. Как правило, контейнер содержит композицию, являющуюся эффективной для лечения состояния злокачественной опухоли, и может обладать стерильным отверстием для доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, прокалываемой стерильной иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции представляет собой антитело, олигопептид или малую органическую/неорганическую молекулу по изобретению. На этикетке или в листовке-вкладыше указано, что композицию применяют для лечения злокачественной опухоли. Этикетка или листовка-вкладыш может дополнительно содержать инструкции для введения композиции антитела, олигопептида или малой органической/неорганической молекулы пациенту со злокачественной опухолью. Кроме того, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически пригодный буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Оно может дополнительно содержать другие материалы, желательные с коммерческой или пользовательской точки зрения, включая другие буферы, растворители, фильтры, иглы и шприцы.
Представлены также наборы, пригодные для различных целей, например, для анализов экспрессии полипептида или уничтожения клеток, для очистки или иммунопреципитации полипептида из клеток. Для выделения и очистки полипептида набор может содержать антитело, олигопептид или малую органическую/неорганическую молекулу, связанную с бусинами (например, бусинами сефарозы). Можно предоставлять наборы, содержащие антитела, олигопептиды или малые органические/неорганические молекулы для детекции и количественного определения полипептида in vitro, например, в ELISA или Вестерн-блоттинге. Как и в случае изделия, набор содержит контейнер и этикетку или листовку-вкладыш на контейнере или приложенные к контейнеру. Контейнер содержит композицию, содержащую по меньшей мере одно антитело, олигопептид или малую органическую/неорганическую молекулу по изобретению. Также можно включать дополнительные контейнеры, содержащие, например, разбавители и буферы, контрольные антитела. На этикетке или в листовке-вкладыше можно предоставлять описание композиции, так же как инструкции для предполагаемого применения in vitro или диагностического применения.
L. Полипептиды и кодирующие полипептиды нуклеиновые кислоты - конкретные формы и применения
Нуклеотидные последовательности (или комплементарные им), кодирующие полипептиды по изобретению, имеют различные применения в области молекулярной биологии, так же как применения для терапии и т.д. Кодирующая полипептид нуклеиновая кислота пригодна также для получения полипептидов рекомбинантными способами, описанными в настоящем документе, где эти полипептиды могут находить применение, например, для получения антител, как описано в настоящем описании.
Ген полноразмерной природной последовательности полипептида или его части можно использовать в качестве зондов для гибридизации с библиотекой кДНК для выделения других кДНК (например, кодирующих природные варианты полипептида или полипептид из других видов), обладающих желаемой идентичностью последовательности с природной последовательностью полипептида, описанной в настоящем документе. Необязательно, длина зондов составляет от приблизительно 20 до приблизительно 50 оснований. Зонды для гибридизации могут происходить из по меньшей мере частично новых областей полноразмерной природной нуклеотидной последовательности, где эти области можно определять без излишних экспериментиров, или из геномных последовательностей, включая промоторы, энхансерные элементы и интроны из природной последовательности полипептида. Например, способ скрининга может включать выделение кодирующей области гена полипептида с использованием известной последовательности ДНК для синтеза выбранного зонда из приблизительно 40 оснований. Зонды для гибридизации можно метить множеством меток, включая радиоактивные нуклеотиды, такие как содержащие 32P или 35S, или ферментные метки, такие как щелочная фосфатаза, связанная с зондом посредством систем связывания авидин/биотин. Меченые зонды, обладающие последовательностью, комплементарной последовательности гена полипептид по настоящему изобретению, можно использовать для скрининга библиотек кДНК, геномной ДНК или мРНК человека, чтобы определить, с какими членами таких библиотек гибридизуется зонд. Способы гибридизации более подробно описаны в примерах ниже. Любые последовательности EST, описанные в настоящей заявке, можно сходным образом использовать в качестве зондов, с использованием способов, описанных в настоящем документе.
Другие пригодные фрагменты кодирующих полипептид нуклеиновых кислот включают антисмысловые или смысловые олигонуклеотиды, содержащие одноцепочечную последовательность нуклеиновой кислоты (РНК или ДНК), способную связывать намеченную последовательность мРНК полипептида (смысловую) или ДНК полипептида (антисмысловую). Антисмысловые или смысловые олигонуклеотиды, в соответствии с настоящим изобретением, содержат фрагмент кодирующей области ДНК, кодирующей гепсин, про-MSP или связывающие фрагменты, как описано в настоящем документе. Такой фрагмент, как правило, содержит по меньшей мере приблизительно 14 нуклеотидов, предпочтительно, приблизительно от 14 до 30 нуклеотидов. Возможность выводить антисмысловой или смысловой олигонуклеотид на основе последовательности кДНК, кодирующей данный белок, описана, например, в Stein and Cohen (Cancer Res. 48:2659, 1988) и van der Krol et al. (BioTechniques 6:958. 1988).
Связывание антисмысловых или смысловых олигонуклеотидов с последовательностями нуклеиновой кислоты-мишени приводит к образованию дуплексов, блокирующих транскрипцию или трансляцию последовательности-мишени одним из нескольких способов, включая усиленную деградацию дуплексов, преждевременную терминацию транскрипции или трансляции, или другими способами. Такие способы включены в настоящее изобретение. Таким образом, антисмысловые олигонуклеотиды можно использовать для блокирования экспрессии белка, когда белок может играть роль в индукции злокачественной опухоли у млекопитающих. Кроме того, антисмысловые или смысловые олигонуклеотиды содержат олигонуклеотиды, имеющие модифицированные сахар-фосфодиэфирные остовы (или другие связи сахаров, такие как связи, описанные в WO 91/06629), и такие связи сахаров устойчивы к эндогенным нуклеазам. Такие олигонуклеотиды с устойчивыми связями сахаров являются стабильными in vivo (т.е., могут являться устойчивыми к ферментативной деградации), но сохраняют специфичность последовательности, чтобы являться способными связывать нуклеотидные последовательности-мишени.
Предпочтительные внутригенные участки для антисмыслового связывания включают область, содержащую кодон инициации трансляции/инициирующий кодон (5'-AUG/5'-ATG) или кодон терминации трансляции /стоп-кодон (5'-UAA, 5'-UAG и 5-UGA/5'- TAA, 5'-TAG и 5'-TGA) открытой рамки считывания (ORF) гена. Эти области относятся к части мРНК или гена, содержащей от приблизительно 25 до приблизительно 50 последовательных нуклеотидов в любом направлении (т.е., 5' или 3') от кодона инициации или терминации. Другие предпочтительные области для антисмыслового связывания включают: интроны; экзоны; места стыковки интрон-экзон; открытую рамку считывания (ORF) или «кодирующую область», которая представляет собой область между кодоном инициации трансляции и кодоном терминации трансляции; 5'-кэп мРНК, который содержит N7-метилированный остаток гуанозина, присоединенный к крайнему 5'-остатку мРНК через 5'-5'-трифосфатную связь, и включает саму структуру 5'-кэпа, так же как первые 50 нуклеотидов, соседние с кэпом; 5- нетранслируемую область (5'UTR), часть мРНК в 5'-направлении от кодона инициации трансляции, и таким образом, включая нуклеотиды между участком 5'-кэпа и кодоном инициации трансляции мРНК или соответствующими нуклеотидами в гене; и 3'-нетранслируемую область (3'UTR), часть мРНК в 3' направлении от кодона терминации трансляции, и таким образом, включая нуклеотиды между кодоном терминации трансляции и 3'-концом мРНК или соответствующими нуклеотидами в гене.
Конкретные примеры предпочтительных антисмысловых соединений, пригодных для ингибирования экспрессии полипептида, включают олигонуклеотиды, содержащие модифицированные остовы или неприродные межнуклеозидные связи. Олигонуклеотиды, обладающие модифицированными остовами, включают олигонуклеотиды, сохраняющие атом фосфора в остове, и олигонуклеотиды, не имеющие атома фосфора в остове. Для целей по этому описанию, и как иногда обозначают в данной области, модифицированные олигонуклеотиды, не имеющие атома фосфора в межнуклеозидном остове, можно также рассматривать как являющиеся олигонуклеозидами. Предпочтительные модифицированные олигонуклеотидные остовы включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3'-алкиленфосфонаты, 5'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, селенофосфаты и боранфосфаты, имеющие нормальные 3'-5' связи, их аналоги с 2'-5' связями и остовы с инвертированной полярностью, где одна или несколько межнуклеотидных связей представляют собой 3'-3', 5'-5' или 2'-2'-связь. Предпочтительные олигонуклеотиды, имеющие обращенную полярность, содержат одну 3'-3' связь в положении ближней к 3'-концу межнуклеотидной связи, т.е. один обращенный нуклеозидный остаток, который может являться абазическим (нуклеозидное основание отсутствует или вместо него находится гидроксильная группа). Включены также различные соли, смешанные соли и формы свободной кислоты. Репрезентативные патенты США, описывающие получение вышеописанных фосфорсодержащих связей, включают, но без ограничения, патенты США №: 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Предпочтительные модифицированные олигонуклеотидные остовы, не содержащие атома фосфора, содержат остов, образованный посредством короткоцепочечных алкильных или циклоалкильных межнуклеозидных связей, или смешанных гетероатомных и алкильных или циклоалкильных межнуклеозидных связей, или одной или более короткоцепочечных гетероатомных или гетероциклических межнуклеозидных связей. Они включают остовы, содержащие морфолино-связи (образованные частично за счет сахарной части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; рибоацетильные скелеты; алкен-содержащие остовы; сульфаматные остовы; метиленимино- и метиленгидразино-остовы; сульфонатные и сульфонамидные остовы; амидные остовы и другие остовы, содержащие части из смешанных N, О, S и СН2 компонентов. Репрезентативные патенты США, описывающие получение таких олигонуклеозидов, включают, но без ограничения, патенты США №№: 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
В других предпочтительных антисмысловых олигонуклеотидах как сахар, так и межнуклеозидная связь, т.е., остов, нуклеотидных единиц заменены новыми группами. Единицы оснований сохраняют для гибридизации с подходящим соединением нуклеиновой кислоты-мишени. Одно из таких олигомерных соединений, олигонуклеотидный миметик, обладающий, как показано, превосходными свойствами гибридизации, обозначено пептидной нуклеиновой кислотой (ПНК). В соединениях ПНК сахарный остов олигонуклеотида заменен на амидсодержащий остов, в частности, аминоэтилглициновый остов. Нуклеиновые основания сохранены и связаны, напрямую или опосредованно, атомами азота азагрупп амидной части остова. Репрезентативные патенты США, описывающие получение соединений ПНК, включают, но без ограничения, патенты США №: 5539082; 5714331; и 5719262, содержание каждого из которых приведено в настоящем документе в качестве ссылки. Дополнительное описание соединений ПНК можно найти в Nielsen et al., Science, 1991, 254, 1497-1500.
Предпочтительные антисмысловые олигонуклеотиды содержат фосфоротиоатные остовы и/или гетероатомные остовы, и, в частности, -CH2-NH-O-CH2-, -CH2-N(CH3)-O-CH2- [известные как метилен- (метилимино) или MMI остов], -CH2-O-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- и -O-N(CH3)-CH2-CH2- [где нативный сложный фосфодиэфирный остов представлен как -O-P-O-CH2-], описанные в вышеуказанном патенте США № 5489677, и амидные остовы из вышеуказанного патента США № 5602240. Предпочтительными являются также антисмысловые олигонуклеотиды, имеющие структуры морфолинового остова из вышеуказанного патента США № 5034506.
Модифицированные олигонуклеотиды могут содержать также одну или нескольких замещенных групп сахара. Предпочтительные олигонуклеотиды содержат в 2'-положении одно из следующего: OH; F; O-алкил, S-алкил, или N-алкил; O-алкенил, S-алкенил, или N-алкенил; O-алкинил, S-алкинил или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут представляет собой замещенный или незамещенный C1-C10 алкил или C2-C10 алкенил и алкинил. Особенно предпочтительными являются O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. Другие предпочтительные антисмысловые олигонуклеотиды содержат в 2'-положении одно из следующего: C1-C10 низший алкил, замещенный низший алкил, алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, CI, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющая РНК группа, репортерная группа, интеркалирующее средство, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида, и другие заместители, обладающие подобными свойствами. Предпочтительная модификация включает 2'-метоксиэтокси (2'-O-CH2CH2OCH3, известную также как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504) т.е., алкоксиалкокси группу. Другая предпочтительная модификация включает 2'-диметиламинооксиэтоксигруппу, т.е. группу О(CH2)2ON(CH3)2, известную также как 2'-DMAOE, как описано в примерах ниже, и 2'-диметиламиноэтоксиэтокси (также известную в данной области как 2'-О-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2).
Другая предпочтительная модификация включает запертые нуклеиновые кислоты (LNA), в которых 2'-гидроксильная группа связана с 3'- или 4'-атомом углерода сахарного кольца, образуя при этом бициклическую сахарную группу. Связь предпочтительно представляет собой метиленовую (-CH2-)n группу, соединяющую мостиковой связью 2'-атом кислорода и 4'-атом углерода, где n составляет 1 или 2. LNA и способы их получения описаны в WO 98/39352 и WO 99/14226.
Другие предпочтительные модификации включают 2'-метокси (2'-O-CH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2), 2'-аллил (2'-CH2-CH=CH2), 2'-O-аллил (2'-O-CH2-CH=CH2) и 2'-фтор (2'-F). 2'-модификация может присутствовать в арабино (верхнем) положении или в рибо (нижнем) положении. Предпочтительной 2'-арабино-модификацией является 2'-F. Аналогичные модификации можно вводить также в другие положения олигонуклеотида, в частности, в 3'-положение сахара в 3'-концевом нуклеотиде или в олигонуклеотидах с 2'-5' связью, и в 5'-положении 5'-концевого нуклеотида. Олигонуклеотиды могут также содержать миметики сахаров, такие как группы циклобутила, вместо пентофуранозильного сахара. Репрезентативные патенты США, описывающие получение таких модифицированных сахарных структур, включают, но без ограничения, патенты США №№: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747; и 5700920, полное содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Олигонуклеотиды могут включать также модификации или замены нуклеинового основания (часто обозначаемого в данной области просто как «основание»). Как применяют в настоящем документе, «немодифицированные» или «природные» нуклеиновые основания включают пуриновые основания аденин (A) и гуанин (G), и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеиновые основания включают другие синтетические и природные нуклеиновые основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинил (-С≡С-СН3 или -CH2-C≡CH) урацил и цитозин, и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, в частности 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Другие модифицированные нуклеиновые основания включают трициклические пиримидины, такие как феноксазинцитидин(1H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин (1H-пиримидо[5,4-b][1,4]бензотиазин-2(3H)-он), G-зажимы, такие как замещенный феноксазинцитидин (например, 9-(2-аминоэтокси)-H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазолцитидин (2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные нуклеиновые основания могут включать также те, в которых пуриновое или пиримидиновое основание заменено на другие гетероциклы, например, 7-деазааденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Дополнительные нуклеиновые основания включают основания, описанные в патенте США № 3687808, основания, описанные в The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990, и основания, описанные в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613. Некоторые из этих оснований нуклеиновых кислот являются особенно пригодными для увеличения аффинности связывания олигомерных соединений по изобретению. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Показано, что 5-метилцитозиновые замены увеличивают стабильность дуплексов нуклеиновой кислоты на 0,6-1,2°С (Sanghvi et al, Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и являются предпочтительными заменами оснований, даже более конкретно, в комбинации с 2'-O-метоксиэтильными модификациями сахаров. Репрезентативные патенты США, описывающие получение модифицированных нуклеиновых оснований включают, но без ограничения: патент США № 3687808, так же как патенты США №№: 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5645985; 5830653; 5763588; 6005096; 5681941 и 5750692, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Другая модификация антисмысловых олигонуклеотидов представляет собой химическое связывание с олигонуклеотидом одной или более групп или конъюгатов, которые повышают активность, распределение в клетке или поглощение клеткой олигонуклеотида. Соединения по изобретению могут содержать конъюгированные группы, ковалентно связанные с функциональными группами, такими как первичные или вторичные гидроксильные группы. Конъюгированные группы по изобретению включают интеркалирующие средства, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, полиэфиры, группы, улучшающие фармакодинамические свойства олигомеров, и группы, улучшающие фармакокинетические свойства олигомеров. Типичные конъюгированные группы включают холестерины, липиды, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. Группы, улучшающие фармакодинамические свойства, в контексте этого изобретения включают группы, улучшающие поглощение олигомера, улучшающие устойчивость олигомера к деградации и/или усиливающие специфическую для последовательности гибридизацию с РНК. Группы, улучшающие фармакокинетические свойства, в контексте этого изобретения включают группы, улучшающие поглощение, распределение, метаболизм или выделение олигомера. Конъюгированные группы включают, но без ограничения, липидные группы, такие как группа холестерина (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например, додекандиоловые или ундецильные остатки (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например, дигексадецил-рац-глицерин или 1,2-ди-О-гексадецил-рац-глицеро-3-Н-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминную или полиэтиленгликолевую цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654); пальмитиловую группу (Mishra et al., Biochim. Biophys., Acta, 1995, 1264, 229-237) или октадециламиновую или гексиламинокарбонил-оксихолестериновую группу. Олигонуклеотиды по изобретению можно конъюгировать также с активными лекарственными веществами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трииодбензойной кислотой, флуфенамовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометицином, барбитуратом, цефалоспорином, сульфанильными лекарственными средствами, антидиабетическими, антибактериальными или антибиотическими средствами. Конъюгаты олигонуклеотид-лекарственное средство и их получение описаны в Патентной заявке США серийный № 09/334130 (поданной 15 июня 1999 г.) и в патентах США №№: 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Нет необходимости в том, чтобы все положения в данном соединении были одинаково модифицированы, и фактически более одной из вышеупомянутых модификаций можно вводить в одно соединение или даже в один нуклеозид в олигонуклеотиде. Настоящее изобретение относится также к антисмысловым соединениям, представляющим собой химерные соединения. «Химерные» антисмысловые соединения или «химеры», в контексте этого изобретения, представляют собой антисмысловые соединения, в частности, олигонуклеотиды, которые содержат две или более химически различных области, каждая из которых состоит по меньшей мере из одного мономерного звена, т.е. нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды, как правило, содержат по меньшей мере одну область, в которой олигонуклеотид модифицирован таким образом, чтобы придать олигонуклеотиду повышенную устойчивость к деградации нуклеазами, увеличенное поглощение клетками и/или увеличенную аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительная область олигонуклеотида может служить субстратом для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКаза Н представляет собой клеточную эндонкулеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. Активация РНКазы Н, таким образом, приводит к расщеплению РНК-мишени, тем самым значительно повышая эффективность ингибирования экспрессии генов олигонуклеотидами. Следовательно, сравнимые результаты часто можно получать с более короткими олигонуклеотидами при использовании химерных олигонуклеотидов, по сравнению с фосфоротиоатными дезоксиолигонуклеотидами, гибридизующимися с той же самой областью-мишенью. Химерные антисмысловые соединения по изобретению можно получать в виде составных структур из двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или олигонуклеотидных миметиков, как описано выше. Предпочтительные химерные антисмысловые олигонуклеотиды содержат по меньшей мере один 2'-модифицированный сахар (предпочтительно 2'-O-(CH2)2-O-CH3) на 3'-конце для придания устойчивости к нуклеазам и область по меньшей мере с 4 последовательными 2'-H сахарами для обеспечения активности РНКазы H. Такие соединения в данной области обозначают также гибридами или гэпмерами. Предпочтительные гэпмеры обладают областью из 2'-модифицированных сахаров (предпочтительно, 2'-O-(CH2)2-O-CH3) на 3'-конце и на 5'-конце, разделенными по меньшей мере одной областью, содержащей по меньшей мере 4 последовательных 2'-H сахара и предпочтительно, содержащей фосфоротиоатные связи остова. Репрезентативные патенты США, описывающие получение таких гибридных структур, включают, но без ограничения, патенты США №№ 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356; и 5700922, полное содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Антисмысловые соединения, используемые в соответствии с этим изобретением, можно удобно и общепринятым образом получать посредством хорошо известного способа твердофазного синтеза. Оборудование для такого синтеза продают несколько поставщиков, включая, например, Applied Biosystems (Foster City, Calif). Дополнительно или альтернативно, можно использовать любые другие способы такого синтеза, известные в данной области. Хорошо известно использование подобных способов для получения олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные. Соединения по изобретению могут также являться смешанными, инкапсулированными, конъюгированными или иным образом ассоциированными с другими молекулами, молекулярными структурами или смесями соединений, например, такими как липосомы, нацеленные на рецептор молекулы, составы для перорального, ректального, местного или другого введения, чтобы способствовать поглощению, распределению и/или абсорбции. Репрезентативные патенты США, описывающие получение таких способствующих поглощению, распределению и/или абсорбции составов, включают, но без ограничения, патенты США №№ 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575; и 5595756, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Другие примеры смысловых или антисмысловых олигонуклеотидов включают олигонуклеотиды, ковалентно связанные с органическими группами, такими как описаны в WO 90/10048, и другими группами, увеличивающими аффинность олигонуклеотида для последовательности нуклеиновой кислоты-мишени, такими как поли-(L-лизин). Более того, интеркалирующие средства, такие как эллиптицин, и алкилирующие средства или комплексы металлов, можно присоединять к смысловым или антисмысловым олигонуклеотидам для модификации специфичности связывания антисмыслового или смыслового олигонуклеотида по отношению к нуклеотидной последовательности-мишени.
Антисмысловые или смысловые олигонуклеотиды можно вводить в клетку, содержащую последовательность нуклеиновой кислоты-мишени, любым способом переноса генов, включая, например, опосредованную CaPO4 трансфекцию ДНК, электропорацию, или использование векторов для переноса генов, таких как вирус Эпштейна-Барр. В предпочтительном способе антисмысловой или смысловой олигонуклеотид вставляют в подходящий ретровирусный вектор. Клетку, содержащую последовательность нуклеиновой кислоты-мишень, приводят в контакт с рекомбинантным ретровирусным вектором, in vivo или ex vivo. Подходящие ретровирусные векторы включают, но без ограничения, векторы, полученные из мышиного ретровируса M-MuLV, N2 (ретровирус, полученный из M-MuLV), или векторы с двойной копийностью, обозначенные DCT5A, DCT5B и DCT5C (см. WO 90/13641).
Смысловые или антисмысловые олигонуклеотиды можно также вводить в клетку, содержащую последовательность нуклеиновой кислоты-мишени, посредством образования конъюгата со связывающей лиганд молекулой, как описано в WO 91/04753. Пригодные связывающие лиганд молекулы включают, но без ограничения, рецепторы поверхности клеток, факторы роста, другие цитокины или другие лиганды, которые связываются с рецепторами поверхности клеток. Предпочтительно, конъюгация связывающей лиганд молекулы по существу не мешает способности связывающей лиганд молекулы связываться с соответствующей ей молекулой или рецептором, или не блокирует проникновение смыслового или антисмыслового олигонуклеотида или его конъюгированного варианта в клетку.
Альтернативно, смысловой или антисмысловой олигонуклеотид можно вводить в клетку, содержащую последовательность нуклеиновой кислоты-мишени, посредством образования комплекса олигонуклеотид-липид, как описано в WO 90/10448. Комплекс смысловой или антисмысловой олигонуклеотид-липид предпочтительно диссоциирует внутри клетки под действием эндогенной липазы.
Молекулы антисмысловой или смысловой РНК или ДНК, как правило, имеют длину по меньшей мере приблизительно 5 нуклеотидов, альтернативно, длину по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, или 1000 нуклеотидов, где в этом контексте термин «приблизительно» обозначает упомянутую длину нуклеотидной последовательности плюс или минус 10% от этой упомянутой длины.
Зонды можно использовать также в способах ПЦР для получения пула последовательностей для идентификации близкородственных кодирующих полипептиды последовательностей.
Нуклеотидные последовательности, кодирующие полипептиды, можно также использовать для конструирования зондов для гибридизации для картирования гена, кодирующего этот полипептид, и для генетического анализа индивидуумов с генетическими нарушениями. Нуклеотидные последовательности, представленные в настоящем документе, можно картировать на хромосоме и в конкретных областях хромосомы с использованием известных способов, таких как гибридизация in situ, анализ связывания с известными хромосомными маркерами и скрининг библиотек с помощью гибридизации.
Полипептид можно использовать в анализах для идентификации других белков или молекул, вовлеченных во взаимодействие связывания с полипептидом. Такими способами можно идентифицировать ингибиторы взаимодействия связывания рецептор/лиганд. Белки, вовлеченные в такие взаимодействия связывания, также можно использовать для скрининга пептидов или низкомолекулярных ингибиторов взаимодействия связывания. Можно разрабатывать анализы скрининга для поиска лидирующих соединений, мимкрирующих биологическую активность природного полипептида или рецептора полипептида. Такие анализы скрининга могут включать анализы, совместимые с высокопроизводительным скринингом библиотек химических веществ, что делает их особенно пригодными для идентификации низкомолекулярных лекарственных средств - кандидатов. Предусматриваемые молекулы включают синтетические органические или неорганические соединения. Анализы можно проводить во множестве форматов, включая анализы белок-белкового связывания, анализы биохимического скрининга, иммуноанализы и анализы на основе клеток, хорошо охарактеризованные в данной области.
Нуклеиновые кислоты, кодирующие полипептид или его модифицированные формы, можно использовать также для получения либо трансгеннных животных, либо «нокаутных» животных, которые, в свою очередь, являются пригодными для разработки и скрининга терапевтически пригодных реагентов. Трансгенное животное (например, мышь или крыса) представляет собой животное, имеющее клетки, содержащие трансген, где трансген вводят животному или предку животного в пренатальном, например, эмбриональном состоянии. Трансген представляет собой ДНК, интегрированную в геном клетки, из которой развивается трансгенное животное. В одном варианте осуществления, кДНК, кодирующую полипептид, можно использовать для клонирования геномной ДНК, кодирующей полипептид, согласно разработанным способам, и геномные последовательности использовать для получения трансгенных животных, содержащих клетки, экспрессирующие ДНК, кодирующую полипептид. Способы получения трансгенных животных, в частности, таких животных, как мыши или крысы, стали общепринятыми в данной области и описаны, например, в патентах США № 4736866 и 4870009. Как правило, на конкретные клетки можно нацеливаться для включения трансгена для полипептида вместе с тканеспецифическими энхансерами. Трансгенных животных, несущих копию трансгена, кодирующего полипептид, введенную в зародышевую линию животного в эмбриональном состоянии, можно использовать для исследования эффекта увеличенной экспрессии ДНК, кодирующей полипептид. Таких животных можно использовать в качестве животных для тестирования реагентов, предположительно обеспечивающих защиту, например, от патологических состояний, ассоциированных с ее сверхэкспрессией. Согласно этому аспекту изобретения, животного обрабатывают реагентом, и уменьшенная частота возникновения патологического состояния, по сравнению с необработанными животными, несущими трансген, может указывать на потенциальное терапевтическое вмешательство для патологического состояния.
Альтернативно, не относящиеся к человеку гомологи полипептида можно использовать для конструирования животного с «нокаутом» гена, обладающего дефектным или измененным геном, кодирующим полипептид, в результате гомологичной рекомбинации между эндогенным геном, кодирующим полипептид, и измененной геномной ДНК, кодирующей тот же полипептид, введенной в эмбриональную стволовую клетку животного. Например, кДНК, кодирующую полипептид, можно использовать для клонирования геномной ДНК, кодирующей этот полипептид, в соответствии с общепринятыми способами. Часть геномной ДНК, кодирующей этот полипептид, можно делетировать или заменять другим геном, таким как ген, кодирующий селективный маркер, который можно использовать для контроля интеграции. Как правило, в вектор включают несколько тысяч пар оснований неизмененной фланкирующей ДНК (как на 5'-, так и на 3'-концах) [см., например, описание векторов для гомологичной рекомбинации в Thomas and Capecchi, Cell. 51:503 (1987)]. Вектор вводят в линию эмбриональных стволовых клеток (например, электропорацией) и отбирают клетки, в которых произошла гомологичная рекомбинация введенной ДНК с эндогенной ДНК [см., например, Li et al., Cell. 69:915 (1992)]. Затем отобранные клетки инъецируют в бластоцисту животного (например, мыши или крысы) для получения агрегированных химер [см., например, Bradley, in Teratocarcinomas and Embryonic Stem Cells: A Practical Approach, E. J. Robertson, ed. (IRL, Oxford, 1987), pp. 113-152]. Затем химерный эмбрион можно имплантировать в подходящую ложнобеременную патронатную самку животного, которая вынашивает эмбриона до срока для получения животного «с нокаутом». Потомство, несущее гомологично рекомбинировавшую ДНК в половых клетках, можно идентифицировать общепринятыми способами и использовать для выведения животных, у которых все клетки содержат гомологично рекомбинировавшую ДНК. Животных с нокаутом можно характеризовать, например, по их способности к защите против конкретных патологических состояний и по развитию у них патологических состояний из-за отсутствия полипептида.
Нуклеиновую кислоту, кодирующую полипептиды, можно также использовать для генотерапии. В применениях для генотерапии гены вводят в клетки, чтобы достигать синтеза in vivo терапевтически эффективного генетического продукта, например, для замены дефектного гена. «Генотерапия» включает как общепринятую генотерапию, где продолжительного эффекта достигают посредством однократной обработки, так и введение генотерапевтических средств, которое включает однократное или повторяющееся введение терапевтически эффективной ДНК или мРНК. Антисмысловые РНК и ДНК можно использовать в качестве лекарственных средств для блокирования экспрессии конкретных генов in vivo. Уже показано, что короткие антисмысловые олигонуклеотиды можно импортировать в клетки, где они действуют как ингибиторы, несмотря на их низкие внутриклеточные концентрации, вызванные их ограниченным поглощением мембраной клеток. (Zamecnik et al, Proc. Natl. Acad. Sci. USA 83:4143-4146 [1986]). Олигонуклеотиды можно модифицировать для увеличения их поглощения, например, посредством замены их отрицательно заряженных фосфодиэфирных групп на незаряженные группы.
Существует множество способов, доступных для введения нуклеиновых кислот в жизнеспособные клетки. Способы меняются в зависимости от того, переносят ли нуклеиновую кислоту в культивируемые клетки in vitro, или в клетки намеченного хозяина in vivo. Способы, пригодные для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают использование липосомы, электропорации, микроинъекции, слияния клеток, DEAE-декстрана, способа кальций-фосфатной преципитации и т.д. Предпочтительные в настоящее время способы переноса генов in vivo включают трансфекцию вирусными (как правило, ретровирусными) векторами и трансфекцию, опосредованную липосомами с белком вирусной оболочки (Dzau et al., Trends in Biotechnology 11, 205-210 (1993)). В некоторых ситуациях является желательным предоставлять источник нуклеиновой кислоты со средством, специфическим для клеток-мишеней, таким как антитело, специфическое для белка мембраны поверхности клеток на клетке-мишени, лиганд для рецептора на клетке-мишени и т.д. Когда используют липосомы, белки, связывающие белок мембраны поверхности клеток, ассоциированный с эндоцитозом, можно использовать для нацеливания и/или для облегчения поглощения, например, белки капсида или их фрагменты с тропизмом для конкретного типа клеток, антитела против белков, которые подвергаются интернализации при прохождении клеточного цикла, и белки, нацеленные на внутриклеточную локализацию и увеличивающие время полужизни внутри клеток. Способ опосредованного рецептором эндоцитоза описан, например, в Wu et al., J. Biol. Chem. 262:4429-4432 (1987); и Wagner et al., PNAS USA 87:3410-3414 (1990). Обзор способов маркировки генов и генотерапии см., например, в Anderson et al., Science 256:808-813 (1992).
Молекулы нуклеиновой кислоты, кодирующей полипептиды или их фрагменты, описанные в настоящем документе, являются пригодными для идентификации хромосом. В связи с этим существует постоянная необходимость идентификации новых хромосомных маркеров, поскольку относительно немного реагентов для маркировки хромосом, основанных на действительных данных о последовательности, доступно в настоящее время. Каждую молекулу нуклеиновой кислоты по настоящему изобретению можно использовать в качестве хромосомного маркера.
Полипептиды и молекулы нуклеиновой кислоты по изобретению можно использовать в диагностике для типирования тканей, когда полипептиды могут дифференциально экспрессироваться в одной ткани по сравнению с другой, предпочтительно, в пораженной заболеванием ткани по сравнению с нормальной тканью того же самого типа. Молекулы нуклеиновой кислоты могут находить применение для получения зондов для ПЦР, Нозерн-анализа, Саузерн-анализа и Вестерн-анализа.
Это изобретение относится к способам скрининга соединений для идентификации соединений, предотвращающих эффект полипептида (антагонистов). Анализ скрининга кандидатов на лекарственные средства-антагонисты разрабатывают для идентификации соединений, которые связываются или образуют комплексы с полипептидами, кодируемыми генами, идентифицированными в настоящем документе, или иным образом мешают взаимодействию кодируемых полипептидов с другими белками клетки, включая, например, ингибирование экспрессии полипептида в клетках. Такие анализы скрининга могут включать анализы, совместимые с высокопроизводительным скринингом библиотек химических веществ, что делает их особенно пригодными для идентификации низкомолекулярных лекарственных средств-кандидатов.
Анализы можно проводить во множестве форматов, включая анализы белок-белкового связывания, анализы биохимического скрининга, иммуноанализы и анализы на основе клеток, хорошо охарактеризованные в данной области.
Все анализы антагонистов являются общими в том, что они требуют контакта лекарственного средства-кандидата с полипептидом или комплексом полипептида в соответствующих условиях и в течение достаточного времени, чтобы позволить взаимодействие этих компонентов.
В анализах связывания взаимодействие представляет собой связывание, и сформированный комплекс можно выделять или детектировать в реакционной смеси. В конкретном варианте осуществления полипептид или лекарственное средство-кандидат иммобилизуют на твердой фазе, например, на микропланшете для титрования, посредством ковалентного или нековалентого присоединения. Нековалентное присоединение, как правило, выполняют покрытием твердой поверхности раствором полипептида и высушиванием. Альтернативно, иммобилизующее антитело, например, моноклональное антитело, специфичное к полипептиду, подлежащему иммобилизации, можно применять для его заякоривания на твердой поверхности. Анализ проводят добавлением немобилизованного компонента, который может быть меченным детектируемой меткой, к иммобилизованному компоненту, например, покрытой поверхности, содержащей заякоренный компонент. После завершения реакции непрореагировавшие компоненты удаляют, например, отмывкой, и детектируют комплексы, заякоренные на твердой поверхности. Когда первоначально неиммобилизованный компонент несет детектируемую метку, детекция метки, иммобилизованной на поверхности, показывает наличие комплексообразования. Когда первоначально неиммобилизованный компонент не несет метки, комплексообразование можно детектировать, например, применением меченых антител, специфически связывающих иммобилизованный комплекс.
Если соединение-кандидат взаимодействует, но не связывается с полипептидом, его взаимодействие с полипептидом можно анализировать способами, хорошо известными для детекции белок-белковых взаимодействий. Такие анализы предусматривают традиционные способы, например, такие как перекрестное сшивание, коиммунопреципитация и совместная очистка на градиентах или хроматографических колонках. Кроме того, белок-белковые взаимодействия можно контролировать с применением генетической системы на основе дрожжей, описанной Fields и соавторами (Fields and Song, Nature (London), 340:245-246 (1989); Chien et al., Proc. Natl. Acad. Sci. USA, 88:9578-9582 (1991)), как описано в Chevray and Nathans, Proc. Natl. Acad. Sci. USA, 89: 5789-5793 (1991). Многие активаторы транскрипции, такие как дрожжевой GAL4, состоят из двух физически отдельных модульных доменов, один из которых действует как ДНК-связывающий домен, а другой функционирует как активирующий транскрипцию домен. В дрожжевой экспрессирующей системе, описанной в вышеупомянутых публикациях (обычно обозначаемой «двухгибридной системой»), используют преимущества данного свойства и используют два гибридных белка, в одном из которых белок-мишень присоединен к ДНК-связывающему домену GAL4, а в другом активирующие белки-кандидаты присоединены к активирующему домену. Экспрессия репортерного гена GAL1-lacZ под контролем GAL4-активируемого промотора зависит от восстановления активности GAL4 посредством белок-белкового взаимодействия. Колонии, содержащие взаимодействующие полипептиды, детектируют с применением хромогенного субстрата для β-галактозидазы. Полный набор (MATCHMAKER™) для идентификации белок-белковых взаимодействий между двумя специфическими белками с применением двухгибридного способа коммерчески доступен в Clontech. Данную систему можно также расширять для картирования доменов белка, вовлеченных в специфические белковые взаимодействия, так же как для уточнения аминокислотных остатков, ключевых для этих взаимодействий.
Соединения, мешающие взаимодействию гена, кодирующего полипептид, идентифицированный в настоящем документе, и других внутри- или внеклеточных компонентов, можно тестировать следующим образом: обычно готовят реакционную смесь, содержащую продукт гена и внутри- или внеклеточный компонент в условиях и в течение времени, позволяющих взаимодействие и связывание двух продуктов. Для тестирования способности соединения-кандидата ингибировать связывание, реакцию проводят в присутствии или в отсутствие тестируемого соединения. Кроме того, в третью реакционную смесь, чтобы она служила положительным контролем, можно добавлять плацебо. Связывание (комплексообразование) между тестируемым соединением и внутри- или внеклеточным компонентом, присутствующим в смеси, мониторируют, как описано в настоящем документе выше. Комплексообразование в контрольной реакционной смеси(ях), но не в реакционной смеси, содержащей тестируемое соединение, показывает, что тестируемое соединение мешает взаимодействию тестируемого соединения с его партнером по связыванию.
Для анализа антагонистов полипептид можно добавлять к клеткам вместе с соединением, подлежащим скринингу по конкретной активности, и способность соединения ингибировать интересующую активность в присутствии полипептида указывает на то, что соединение является антагонистом полипептида. Альтернативно, антагонисты можно детектировать объединением полипептида и потенциального антагониста с мембраносвязанными рецепторами полипептида или кодируемыми рецепторами в условиях, подходящих для анализа конкурентного ингибирования. Полипептид можно метить, например, радиоактивной меткой, так что количество молекул полипептида, связанных с рецептором, можно использовать для определения эффективности потенциального антагониста. Ген, кодирующий рецептор, можно идентифицировать множеством способов, известных специалистам в данной области, например, пэннинг с помощью лиганда и сортировка FACS. Coligan et al., Current Protocols in Immun., 1(2): Chapter 5 (1991). Предпочтительно, используют экспрессионное клонирование, где полиаденилированную РНК получают из клеток, чувствительных к полипептиду, и библиотеку кДНК, полученную из этой РНК, разделяют на пулы и используют для трансфекции клеток COS или других клеток, не чувствительных к полипептиду. Трансфицированные клетки, выращенные на предметных стеклах, подвергают воздействию меченого полипептида. Полипептид можно метить множеством способов, включая иодирование или введение участка узнавания для сайт-специфической протеинкиназы. После фиксации и инкубации, стекла подвергают радиоавтографическому анализу. Идентифицируют положительные пулы и получают подпулы, и проводят повторную трансфекцию с использованием способа согласованного разделения на подпулы и повторного скрининга, в конечном итоге приводящего к отдельному клону, кодирующему предположительный рецептор.
Более конкретные примеры потенциальных антагонистов включают антитела, включая, но без ограничения, поли- и моноклональные антитела и фрагменты антител, одноцепочечные антитела, анти-идиотипические антитела, и химерные или гуманизированные варианты таких антител или фрагментов, так же как человеческие антитела и фрагменты антител. Альтернативно, потенциальный антагонист может представлять собой близкородственный белок, например, мутантную форму полипептида, который узнает рецептор, но не оказывает эффекта, таким образом, конкурентно ингибируя действие полипептида.
Другой потенциальный антагонист представляет собой конструкцию антисмысловой РНК или ДНК, полученную с использованием антисмыслового способа, где, например, молекула антисмысловой РНК или ДНК действует для непосредственного блокирования трансляции мРНК посредством гибридизации с мРНК-мишенью и предотвращения трансляции белка. Антисмысловой способ можно использовать для контроля экспрессии гена посредством образования тройной спирали или антисмысловой ДНК или РНК, где оба этих способа основаны на связывании полинуклеотида с ДНК или РНК. Например, 5'-кодирующую область полинуклеотидной последовательности, кодирующей зрелые полипептиды в настоящем документе, можно использовать для конструирования антисмыслового олигонуклеотида РНК длиной приблизительно от 10 до 40 пар оснований. Олигонуклеотид ДНК конструируют так, чтобы он был комплементарен области гена, вовлеченной в транскрипцию (тройная спираль - см. Lee et al., Nucl. Acids Res., 6:3073 (1979); Cooney et al., Science. 241: 456 (1988); Dervan et al., Science. 251: 1360 (1991)), таким образом, предотвращая транскрипцию и продукцию полипептида. Антисмысловой олигонуклеотид РНК гибридизуется с мРНК in vivo и блокирует трансляцию молекулы мРНК в полипептид (антисмысловой - Okano, Neurochem., 56:560 (1991); Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression (CRC Press: Boca Raton, FL, 1988). Олигонуклеотиды, описанные выше, можно также доставлять в клетки, так что антисмысловую РНК или ДНК можно экспрессировать in vivo для ингибирования продукции полипептида. При использовании антисмысловой ДНК, предпочтительными являются олигодезоксирибонуклеотиды, выведенные из участка инициации трансляции, например, между положениями приблизительно -10 и +10 нуклеотидной последовательности гена-мишени.
Потенциальные антагонисты включают малые молекулы, связывающиеся с активным участком, участком связывания рецептора или фактора роста или другим подходящим участком связывания в полипептиде, таким образом блокируя нормальную биологическую активность полипептида. Малые молекулы включают в качестве неограничивающих примеров малые пептиды или пептидоподобные молекулы, предпочтительно, растворимые пептиды, и синтетические не-пептидильные органические или неорганические соединения.
Рибозимы представляют собой ферментные молекулы РНК, способные катализировать специфическое расщепление РНК. Рибозимы действуют посредством специфической для последовательности гибридизации с комплементарной РНК-мишенью, с последующим эндонуклеотическим расщеплением. Специфические участки расщепления рибозимом внутри потенциальной РНК-мишени можно идентифицировать известными способами. Более подробно см., например, Rossi, Current Biology. 4:469-471 (1994) и Публикацию PCT № WO 97/33551 (опубликованную 18 сентября 1997 г.).
Молекулы нуклеиновой кислоты при формировании тройной спирали, используемые для ингибирования транскрипции, должны является одноцепочечными и состоять из дезоксинуклеотидов. Состав оснований этих олигонуклеотидов разрабатывают так, чтобы он способствовал формированию тройной спирали согласно правилам спаривания хугстиновских оснований, которые, как правило, требуют протяженных отрезков пуринов или пиримидинов на одной цепи дуплекса. Более подробно см., например, в Публикации PCT № WO 97/33551, выше.
Эти малые молекулы можно идентифицировать одним или несколькими из анализов скрининга, обсуждаемых в настоящем документе выше, и/или посредством любого другого из способов скрининга, хорошо известных специалистам в данной области.
Выделенную кодирующую полипептид нуклеиновую кислоту можно использовать для рекомбинантной продукции полипептида с использованием способов, хорошо известных в данной области, и как описано в настоящем описании. В свою очередь, продуцированные полипептиды можно использовать для получения антител с использованием способов, хорошо известных в данной области, и как описано в настоящем документе.
Антитела, специфически связывающие полипептид, идентифицированный в настоящем документе, так же как другие молекулы, идентифицированные в анализах скрининга, описанных в настоящем документе выше, можно вводить для лечения различных нарушений, включая злокачественные опухоли, в форме фармацевтических композиций.
Если полипептид является внутриклеточным, и полноразмерные антитела используют в качестве ингибиторов, интернализующиеся антитела являются предпочтительными. Однако способы липофекции или липосомы также можно использовать для доставки антитела или фрагмента антитела, в клетки. При использовании фрагментов антител наименьший ингибирующий фрагмент, специфически связывающийся со связывающим доменом белка-мишени, является предпочтительным. Например, на основании последовательностей вариабельной области антитела, можно разрабатывать пептидные молекулы, сохраняющие способность связывать белковую последовательность-мишень. Такие пептиды можно синтезировать химически и/или получать способом рекомбинантной ДНК. См., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993).
Состав в настоящем документе может также содержать более одного активного соединения, как необходимо для конкретного симптома, подлежащего лечению, предпочтительно, соединения со взаимодополняющим действием, не оказывающие неблагоприятного влияния друг на друга. Альтернативно или дополнительно, композиция может содержать средство, усиливающее ее функцию, например, такое как цитотоксическое средство, цитокин, химиотерапевтическое средство или ингибирующее рост средство. Такие молекулы подходящим образом присутствуют в комбинации в количествах, эффективных для предназначенной цели.
Следующие примеры предложены только с целью иллюстрации и не предназначены для ограничения объема настоящего изобретения никаким образом.
ПРИМЕРЫ
Материалы и методы
Клонирование, экспрессия и очистка рекомбинантных белков: Внеклеточный домен рекомбинантного гепсина человека экспрессировали и очищали, как описано (Moran et al., 2006). Антитело против гепсина Fab25 экспрессировали и очищали, как описано в находящейся одновременно на рассмотрении Предварительной патентной заявке США того же заявителя № 61/253953, поданной 22 октября 2009 г. Рекомбинантный MSP человека, содержащий мутацию C672A для улучшения экспрессии и выхода, экспрессировали в клетках яичника китайского хомяка, как описано (Wahl et al., 1997). KD1 экспрессировали и очищали, как описано (Shia et al., 2005).
Анализ активации про-MSP гепсином in vitro с использованием SDS-PAGE: Про-MSP (25 мкг/мл) инкубировали с различными концентрациями гепсина (1,25 нМ, 2,5 нМ, 5 нМ и 10 нМ) в буфере, содержащем 50 мМ Трис-HCl pH 8,0, 150 мМ NaCl, 0,05% Тритон-X100 и 2 мМ CaCl2 при 37°C. Аликвоты реакционной смеси в различных временных точках смешивали с 6X-SDS буфером для образцов, и образцы кипятили в течение 5 минут при 95°C и разделяли в SDS-PAGE с использованием 4-20% градиентного геля. Белок визуализировали после окрашивания SimplyBlue Safe Stain (Invitrogen, Carlsbad, CA). Сходные эксперименты проводили с про-MSP, в который вносили мутации, чтобы сделать его нерасщепляемым по Arg483-Val484 (про-MSP-R483E), для оценки того, возникают ли участки протеолитического расщепления в другом участке, помимо ожидаемой связи Arg483-Val484 в про-MSP.
Активация про-MSP гепсином, экспрессированным на поверхности клеток, в клетках LnCap: Клетки LnCaP-34 получали, как описано (Moran et al., 2006), для стабильной сверхэкспрессии гепсина, получив увеличенную в 5 раз экспрессию гепсина на поверхности клеток и увеличенную в 3 раза ферментативную активность гепсина по сравнению с клетками LnCaP-17, экспрессирующими только эндогенный гепсин на относительно низких уровнях, сравнимых с исходными клетками LnCaP. Конфлюэнтные клетки LnCap-34, культивированные в 24-луночных планшетах, промывали бессывороточной средой RPMI-1640 и инкубировали либо отдельно, либо с различными ингибиторами против гепсина (1 мкМ антитело против гепсина Fab25/1 мкМ KD1/1 мкМ Ac-KQLR-cmk ('KLQR'', описанный как SEQ ID NO: 10)) в бессывороточной среде RPMI-1640 в течение 15 минут при 37°C перед добавлением 125I-меченного про-MSP (25 мкг/мл). После инкубации в течение 3 часов при 37°C отбирали аликвоты и анализировали в SDS-PAGE (4-20% градиентный гель) (Invitrogen, Carlsbad, CA) с последующим экспонированием рентгеновских пленок.
Связывание активированного гепсином про-MSP с Ron по поверхностному плазмонному резонансу и ELISA: Для определения аффинности связывания активированного гепсином MSP с Ron человека, проводили измерения поверхностного плазмонного резонанса на аппарате BIAcore™-3000 (GE Health Care, NJ). Антитела кролика против IgG человека химически иммобилизовали (присоединением по аминогруппам) на биосенсорных чипах CM5, и связывали слитый белок Ron (Sema IPT1)-IgG для получения приблизительно 250 единиц ответа (RU). Для измерений кинетики различные концентрации либо активированного гепсином MSP, либо коммерчески доступного MSP (R&D systems) инъецировали в буфере HBS-P при 25°C со скоростью потока 30 мкл/мин. Скорости связывания (kon) и скорости диссоциации (koff) получали с использованием модели связывания Ленгмюра один-к-одному (BIA-Evaluation), и рассчитывали равновесные константы диссоциации (ΚD) (koff/kon). Для экспериментов ELISA микропланшеты для титрования maxiSorp (Nunc, Roskilde, Denmark) покрывали в течение ночи при 4°C с помощью 2 мкг/мл антитела кролика, специфического против Fc IgG человека (Jackson ImmunoResearch Laboratory, West Grove, PA) в 50 мМ буфере карбонате натрия, pH 9,6. После блокирования буфером для анализа (PBS pH 7,4, 0,5% BSA и 0,05% Твин-20, 15 PPM Proclin), добавляли 1 мкг/мл слитого белка Ron (Sema IPT1)-IgG, и планшеты инкубировали в течение 1 часа с осторожным покачиванием при комнатной температуре. После промывки буфером для промывки (PBS, 0,05%> полисорбат 20), на 1 час добавляли белки MSP с меткой His. Связанный MSP детектировали с использованием анти-His-HRP (Qiagen, Valencia, CA) с последующим добавлением субстрата TMB/H2O2 (KPL, Gaithersburg, MD). Реакцию останавливали 1M H3PO4 и A450 измеряли на считывателе для микропланшетов SpectraMax Plus384 Molecular Devices (Sunnyvale, CA). Эффективную концентрацию для получения половины максимального связывания (EC50) определяли аппроксимацией по четырем параметрам с использованием Kaleidagraph (Synergy Software, Reading, PA).
Анализ хемотаксиса и изменения морфологии перитонеальных макрофагов: перитонеальные резидентные макрофаги мыши получали от мышей C57BL/6 промыванием брюшной полости с помощью 15 мл на мышь бессывороточной среды RPMI-1640. Клетки промывали и ресуспендировали в среде RPMI-1640, содержащей 25 мМ Hepes в концентрации 1 × 106 клеток∙мл-1. Анализ хемотаксиса макрофагов проводили с использованием набора для анализа хемотаксиса QCM с размером пор 5 мкм (Millipore). Сто микролитров суспензии перитонеальных макрофагов (т.е. 105 клеток) добавляли в верхние лунки камер для хемотаксиса. Нижние лунки заполняли средой RPMI-1640, содержащей очищенный про-MSP, либо отдельно, либо обработанный гепсином при 37°C в течение 2 часов. Рекомбинантную активную форму MSP человека (R&D Systems) использовали в качестве положительного контроля. После инкубации при 37°C в течение 4 часов, клетки на верхней поверхности мембраны стирали ватной палочкой, а мигрировавшие клетки отделяли с использованием буфера для отделения по рекомендациям производителя. Аликвоты из различных лунок инкубировали со смесью буфера для лизиса и красителя CYPRO в течение 15 минут. Миграцию оценивали количественно измерением флуоресценции с использованием считывателя для микропланшетов (Spectramax-M5, Molecular devices, Sunnyvale, CA) при длине волны возбуждения 480 нм и длины волны излучения 520 нм.
Для оценки эффекта MSP на морфологию, перитонеальные макрофаги (1 × 106 клеток∙мл-1) культивировали в бессывороточной среде RPMI-1640 в течение ночи. После инкубации неадгерентные клетки удаляли и про-MSP (1,0 нМ), либо отдельно, либо предварительно обработанный гепсином, добавляли в культуральную среду. После дополнительной инкубации при 37°C в течение 1 часа, морфологические изменения макрофагов наблюдали с помощью фазово-контрастной микроскопии.
Ингибирование синтеза NO зрелым MSP: Клетки костного мозга, полученные из собранных бедренных костей мышей, пипетировали до суспензии отдельных клеток, и затем осаждали центрифугированием. Эритроциты лизировали инкубацией с буфером для лизиса эритроцитов в течение 5 минут при комнатной температуре. Затем клетки суспендировали в среде для дифференцировки макрофагов (DMEM с глутамином, содержащей 10% FBS, 1X Pen/Strep и 50 нг/мл рекомбинантного mCSF-1). Затем клетки рассевали в стерильные 24-луночные планшеты, не предназначенные для культивирования клеток. Среду меняли на следующие сутки, и затем каждые 2 сутки. Через 6 суток в культуре, макрофаги были зрелыми, и эти зрелые клетки промывали в бессывороточной DMEM и дополнительно инкубировали в течение 2 часов. Различные реакционные смеси (общий объем 300 мкл), как показано на фигуре, состоящие из рекомбинантного MSP (10 нг/мл), про-MSP (10 нг/мл), гепсина (1 нМ) и Fab25 (500 нМ) добавляли в соответствующие лунки и культивировали в течение 24 часов при 37°C в инкубаторе для культивирования клеток. Продукцию NO оценивали количественно с использованием реакции Грисса (Molecular Probes), согласно рекомендациям производителя.
Иммуноблот для детекции фосфорилированной киназы: Линию клеток карциномы яичников человека (A2780) со сверхэкспрессией Ron человека использовали для исследования фосфорилирования Ron и других нижестоящих киназ. Клетки при плотности 2×105 клеток/лунку культивировали в 12-луночном планшете и подвергали голоданию по сыворотке в течение 24 часов. Затем клетки стимулировали про-MSP (10 и 50 нг/мл) отдельно или в присутствии 10 нМ гепсина в течение 1 часа. Зрелый MSP из коммерческого источника и гепсин использовали в качестве контроля. Образцы получали промывкой клеток дважды холодным PBS с последующим добавлением 200 мкл буфера для лизиса. Затем образцы анализировали в SDS/PAGE в 4-12% Трис-глициновых гелях (Invitrogen, Carlsbad, CA). Белки переносили на нитроцеллюлозные мембраны и затем обрабатывали анти-Ron антителом или анти-фосфо-AKT антителом, или анти-фосфо-MAPK антителом, или анти-фосфо-S6 антителом, в течение ночи при 4°C. После промывки мембраны инкубировали с IRDye800-конъюгированным антителом козы против IgG мыши (Rockland, Gilbertsville, PA) и антителом козы против IgG кролика с AlexaFluor 680 (Invitrogen) в течение 1 час. Белки детектировали в системе визуализации Odyssey Infrared (LI-COR Biosciences, Lincoln, NE).
Результаты
Активация про-MSP рекомбинантным гепсином in vitro
Консенсусная последовательность, основанная на получении субстратного профиля для гепсина посредством PS-SCL (позиционного сканирования-синтетической комбинаторной библиотеки), выявила предпочтение P4-P1 как (P/K)-(K/Q)-(T/L/N)-R (Herter et al., 2005). Из списка идентифицированных ранее субстратов гепсина (Kazama et al., 1995; Kirchhofer et al., 2005; Moran et al., 2006; Tripathi et al., 2008) (Таблица 1) очевидно, что последовательности участка расщепления по большей части соответствуют получению субстратного профиля PS-SCL. В частности, узнаваемые последовательности субстратов в случае proHGF (KQLR↓V) (SEQ ID NO: 11) и Ln-332 (SQLR↓L) (SEQ ID NO: 12) обладают близким сходством с последовательностью расщепления про-MSP (SKLR↓V) (SEQ ID NO: 1). Однако такие аргументы не могут объяснить, почему другой зимоген, про-tPA, является плохим субстратом для гепсина, поскольку его последовательность узнавания представляет собой гибрид последовательностей из про-HGF и про-uPA (Таблица 1).
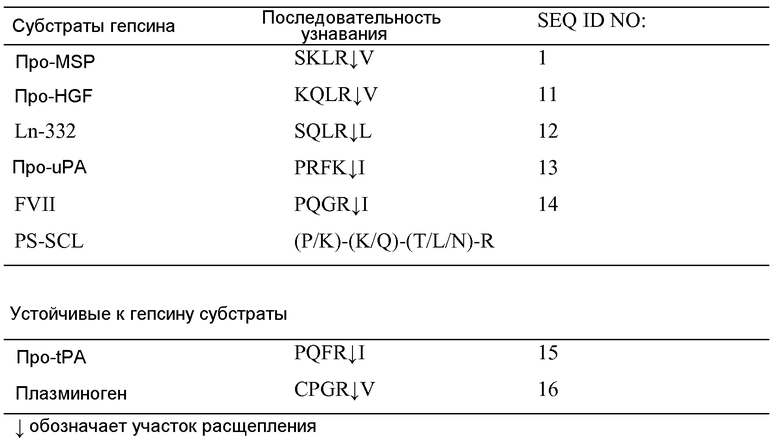
Гепсин активировал про-MSP зависимым от дозы и зависимым от времени образом при инкубации с различными концентрациями гепсина при 37°C. Активацию мониторировали по сдвигу подвижности в геле в 4-20% градиентном Трис-глициновом SDS-PAGE в восстанавливающих условиях (Фиг.1). Продукты расщепления анализировали N-концевым секвенированием для идентификации участка процессинга. Протеолитическое расщепление про-MSP гепсином происходило по связи Arg483-Val484, приводя к образованию активного гетеродимерного (α/β) MSP. Про-MSP с мутацией в участке расщепления (про-MSP-R483E) экспрессировали и очищали, и подвергали протеолитическому процессингу гепсином. Гепсин не расщеплял этот мутантный про-MSP, несмотря на увеличенную инкубацию (24 часа), что снова подтверждает специфичность активации.
Активация про-MSP экспрессированным на поверхности клеток гепсином
Протеолитический процессинг про-MSP естественно экспрессированным на поверхности клеток гепсином мониторировали на линии клеток LnCap-34 (Moran et al., 2006). Клетки LnCap-34, экспрессирующие гепсин, являлись способными процессировать 125I-про-MSP (Фиг. 2). Протеолитическая активность процессинга про-MSP в основном была обусловлена гепсином, поскольку все три ингибитора гепсина (Ac-KQLR-хлорметилкетон ('KQLR; описанный как SEQ ID NO: 10), KD1 и Fab25) эффективно блокировали протеолитическое расщепление.
Биологическая активность активированного гепсином MSP
Связывание MSP с Ron
Авторы настоящего изобретения использовали поверхностный плазмонный резонанс (BIAcore) для определения аффинности связывания MSP с Ron человека. Протеолитическое расщепление одноцепочечного про-MSP является критическим для связывания с рецептором Ron. Ни про-MSP, ни мутант по участку связывания (про-MSP-R483E), не обладал каким-либо поддающимся детекции связыванием с Ron вплоть до концентрации 1 мкМ. В отличие от этого, для активированного гепсином MSP показали высокую аффинность связывания с Ron (KD=7 нМ) (Фиг. 3a). Аффинность активированного гепсином MSP являлась очень сходной с коммерчески доступным MSP (KD=4,4 нМ). Кроме того, авторы настоящего изобретения измеряли связывание MSP с Ron в экспериментах ELISA. Определенная эффективная концентрация для получения половины максимального связывания (EC50) составляла 0,519 нМ (Фиг. 3b).
Фосфорилирование нижестоящей киназы в пути MSP/RON
Биологические эффекты обработанного гепсином про-MSP на путь передачи сигнала Ron мониторировали по последующему фосфорилированию нижестоящих киназ, которые включают киназу митогенактивируемого белка (MAP) и киназу рибосомального белка S6. Ни гепсин, ни про-MSP по отдельности не были эффективны для активации пути передачи сигнала Ron, в то время как для обработанного гепсином про-MSP показали сильное фосфорилирование как MAP-киназы, так и S6-киназы зависимым от дозы образом. Степень фосфорилирования обработанного гепсином про-MSP являлась сравнимой со степенью фосфорилирования образца зрелого MSP из коммерческого источника.
Анализ изменения морфологии и хемотаксиса перитонеальных макрофагов
Биологическую активность активированного гепсином MSP далее оценивали в первичных культурах макрофагов. Известно, что зрелый MSP вызывает характерные изменения морфологии макрофагов. При стимуляции активированным гепсином MSP перитонеальные макрофаги подвергаются определенным изменениям формы клеток, проявляемых ветвлением и удлинением (Фиг. 5). Эффект активированного гепсином MSP являлся сравнимым с эффектом коммерчески доступного MSP, так же как активированного HGFA MSP.
В анализе хемотаксиса обработка про-MSP гепсином приводила к значимому увеличению (p<0,001) миграции перитонеальных макрофагов (Фиг. 6), и эффект являлся сравнимым с эффектом зрелого MSP из коммерческого источника. Для предварительной обработки ингибитором анти-гепсином показано заметное уменьшение миграции макрофагов.
Ингибирование синтеза оксида азота (NO)
Wang et al. ранее показали, что зрелый MSP способен блокировать увеличение количества мРНК синтазы оксида азота макрофагов и связанное с этим увеличение продукции NO в ответ на различные стимулы (Wang et al., 1994a). Для первичных макрофагов костного мозга показали сильную продукцию оксида азота в ответ на LPS. Активированный гепсином MSP значительно ослаблял продукцию NO в происходящих из костного мозга макрофагах (Фиг. 7), и этот эффект был полностью ингибирован в присутствии антитела против гепсина, в то время как про-MSP отдельно не ингибировал этот ответ.
Частичный список литературы







Хотя вышеизложенное изобретение описано достаточно подробно посредством иллюстраций и примеров с целью облегчения понимания, описания и примеры не следует рассматривать как ограничивающие объем изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ АКТИВАЦИИ ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2005 |
|
RU2405041C2 |
| АНТИТЕЛА ПРОТИВ ГЕПСИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2559533C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2011 |
|
RU2595389C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2011 |
|
RU2636461C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2010 |
|
RU2563359C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛИ У СУБЪЕКТА | 2006 |
|
RU2404193C2 |
| СПОСОБЫ ВЫЯВЛЕНИЯ ВОСПАЛИТЕЛЬНОГО ЗАБОЛЕВАНИЯ КИШЕЧНИКА | 2008 |
|
RU2502806C2 |
| ГЕТЕРОДИМЕРНЫЕ ПОЛИПЕПТИДЫ IL-17 A/F И ВОЗМОЖНОСТИ ИХ ЛЕЧЕБНОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2440134C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ РЕГУЛЯЦИИ РАЗВИТИЯ СОСУДОВ | 2005 |
|
RU2365382C2 |
| ВАРИАНТЫ БЕТА-ЦЕПИ HGF | 2006 |
|
RU2403261C2 |













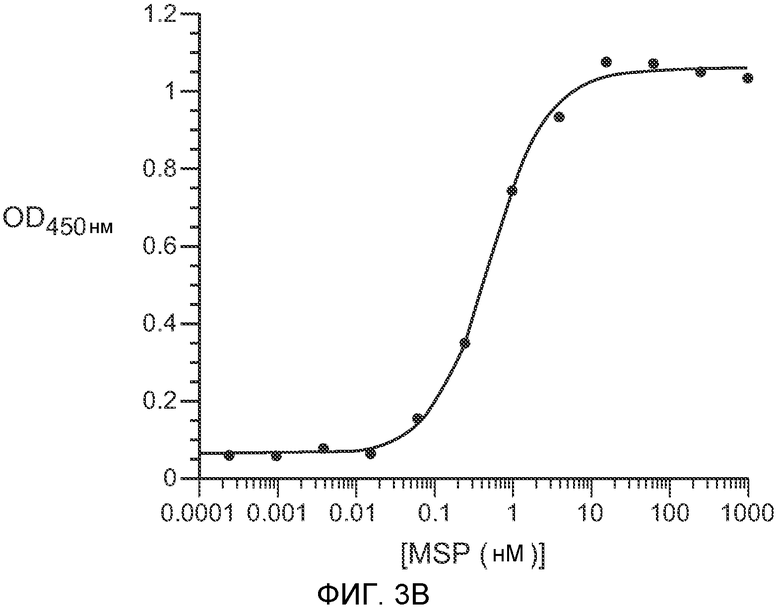

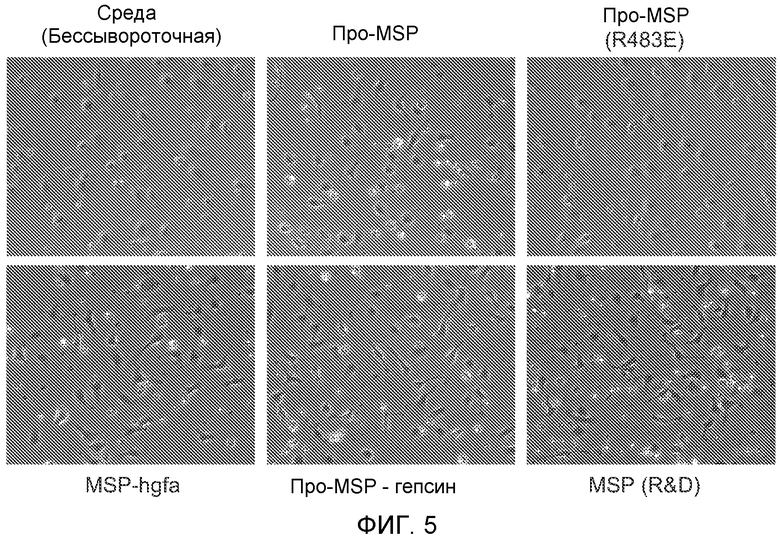
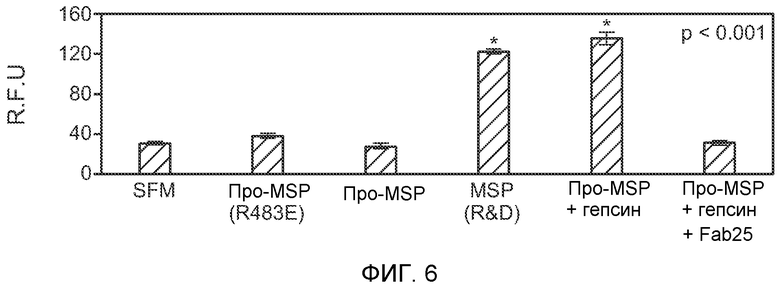
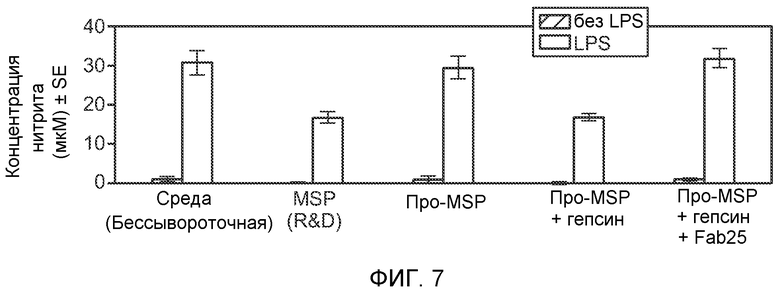




Изобретение относится к биохимии. Представлен способ идентификации вещества-кандидата, ингибирующего активацию гепсином стимулирующего макрофаги пробелка (про-MSP). 9 з.п. ф-лы, 10 ил., 1 табл., 1 пр.
1. Способ идентификации вещества-кандидата, ингибирующего активацию гепсином стимулирующего макрофаги пробелка (про-MSP), где указанный способ включает:
(a) контакт вещества-кандидата с первым образцом, содержащим гепсин и субстрат про-MSP, где гепсин представляет собой (i)полипептид, содержащий SEQ ID NO: 18 или ее функциональный фрагмент, или (ii) полипептид, содержащий SEQ ID NO: 19 или ее функциональный фрагмент, и где функциональный фрагмент SEQ ID NO: 18 способен расщеплять про-MSP тем же образом, что и SEQ ID NO: 18; и где функциональный фрагмент SEQ ID NO: 19 способен расщеплять про-MSP тем же образом, что и SEQ ID NO: 19; и субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20 или ее функциональный фрагмент; и где функциональный фрагмент SEQ ID NO: 20 содержит пептидную связь Arg483-Val484 и может быть активирован гепсином в активированный MSP, который способен активировать плазминоген, и
(b) сравнение уровня активации субстрата про-MSP в образце с уровнем активации про-MSP в контрольном образце, содержащем сходные количества гепсина и субстрата про-MSP, как и в первом образце, но не подвергавшемся контакту с указанным веществом-кандидатом, при этом уменьшение уровня активации субстрата про-MSP в первом образце по сравнению с контрольным образцом указывает на то, что вещество-кандидат способно ингибировать активацию про-MSP гепсином.
2. Способ по п.1, где гепсин представляет собой полипептид, содержащий SEQ ID NO: 18 или ее функциональный фрагмент.
3. Способ по п.2, где гепсин представляет собой полипептид, содержащий SEQ ID NO: 18.
4. Способ по п.3, где субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20.
5. Способ по п.2, где субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20.
6. Способ по п.1, где субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20.
7. Способ по п.1, где гепсин представляет собой полипептид, содержащий SEQ ID NO:19 или ее функциональный фрагмент.
8. Способ по п.7, где гепсин представляет собой полипептид, содержащий SEQ ID NO: 19.
9. Способ по п.8, где субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20.
10. Способ по п.7, где субстрат про-MSP представляет собой полипептид, содержащий SEQ ID NO: 20.
| RU 2007106862 А, 10.09.2008 | |||
| LEONARD EJ, Biological aspects of macrophage-stimulating protein (MSP) and its receptor, Ciba Found Symp | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
Авторы
Даты
2015-01-27—Публикация
2010-10-21—Подача