Камптотецин является природным соединением, которое было выделено впервые из листьев и коры китайского растения, называемого Camptotheca acuminata (См. Wall et al., J. Amer. Chem. Soc. 88: 3888 (1966)). Камптотецин представляет собой пентациклическое соединение, состоящее из фрагмента индолизино[1,2-b] хинолина, конденсированного с 6-цепочечным α- гидроксилактоном. Углерод в положении 20, который несет α- гидрокси, является асимметричным и сообщает вращающую способность молекуле. Природная форма камптотецина обладает абсолютной конфигурацией "S" относительно углерода 20 и соответствует следующей формуле: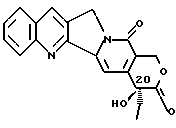
Камптотецин обладает антипролиферативной активностью в некоторых линиях раковых клеток, в том числе, клеточных линиях опухолей ободочной кишки, легкого и молочной железы человека (Suffness, М et al: the Alkaloids Chemistry and Pharmacology, Bross, A. , ed. Vol. 25, p. 73 (Academic Press, 1985)). Предполагается, что антипролиферативная активность камптотецина связана с его ингибирующей активностью в отношении топоизомеразы I ДНК.
Было показано, что α- гидроксилактон был абсолютно необходим для активности камптотецина как in vivo, так in vitro (Camptothecins: New Anticancer Agents, Putmesil, М. et al, ed., p.27 (CRC Press. 1995); Wall, M. et al. Cancer Res. 55: 753 (1995); Hertzberg et al., J. Med. Chem., 32:715 (1982) и Crow et al. , J. Med. Chem., 35:160 (1992)). Данное изобретение относится к новому классу производных камптотецина, в которых β- гидроксилактон заменяет природный α- гидроксилактон камптотецина. Соединения согласно данному изобретению проявляют сильную биологическую активность, которая является неожиданной относительно прежнего уровня знаний.
Таким образом, объектом данного изобретения являются новые соединения камптотецина, которые отличаются от всех известных соединений камптотецина тем, что они содержат β- гидроксилактон (или его открытую гидроксикарбоксильную форму) вместо α- гидроксилактона (или его открытой гидроксикарбоксильной формы); или их фармацевтически приемлемые соли. Под соединением камптотецина понимают соединение, имеющее тот же самый структурный скелет, что и камптотецин (т.е. фрагмент индолизино[1,2-b]хинолина, который конденсирован с 6-цепочечным α- гидроксилактоном) с другими химическими заменами или без других химических замен на этой скелетной структуре (например, производные камптотецина). Различные производные камптотецина хорошо известны специалистам, как описано ниже. Под β- гидроксилактоном понимают лактон, который состоит из дополнительного атома углерода между углеродом карбоксила и α- углеродом, несущим гидроксигруппу α- гидроксилактона. β- гидроксилактон из семи "закрытых" или "открытых" цепей, в котором сложноэфирная связь между карбонильной группой и соседним атомом кислорода гидролизована, что проявляется образованием группы карбоновой кислоты и гидроксильной группы, которые могут быть или могут не быть замещенными.
Соединение камптотецина согласно данному изобретению может затем содержать замещения на фрагменте индолизино[1,2-b]хинолина (например, для улучшения растворимости соединения) или на открытом или закрытом β- гидроксилактоне (например, для улучшения стабильности соединения). Примеры замещений на закрытом β- гидроксилактоне включают алкильное замещение (например, этил) на β- углероде. Примеры замещения на открытом β- гидроксилактоне включают алкильные замещения на β- углероде, замещения (например, амидирование) образованной карбоновой кислоты и замещения (например, этерификация) или защитные группы образованной гидроксильной группы.
Более конкретно, объектом данного изобретения являются соединения формулы I и формулы II.
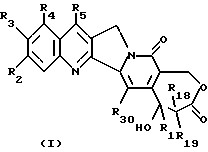
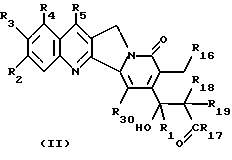
в рацемической форме, в форме энантиомера или любой комбинации этих форм, где
R1 обозначает низший алкил, низший алкенил, низший алкинил, низший галогеналкил и низший алкокси-низший алкил или низший алкилтио-низший алкил;
R2, R3, R4 обозначают независимо H, галоген, низший галогеналкил, низший алкил, низший алкенил, циано, низший цианоалкил, нитро, низший нитроалкил, амидо, низший амидоалкил, гидразино, низший гидразиноалкил, азидо, низший азидоалкил, (CH2)mNR6R7, (CH2mOR6, (CHmSR6, (CH2)mCO2R6, (CH2)mNR6C(O)R8, (CH2)mC(O)R8, (CH2)mOC(O)R8, O(CH2)mNR6R7, OC(O)NR6R7, OC(O)(CH2)mCO2R6 или (CH2)n[N=X], OC(O)[N=X], (CH2)mOC(O)[N=X] (где [N=X] в этом изобретении обозначает гетероциклическую группу из 4-7 цепей с атомом азота N, который является членом гетероциклической группы, а X обозначает полученные члены, необходимые для комплектования гетероциклической группы, выбранные из группы, состоящей из О, S, CH2, CH, N, NR9 и COR10), арил или низший арилалкил, замещенный (т. е. замещенный 1-4 раза на гетероциклической или арильной группе) или незамещенный, где заместитель представляет собой низший алкил, галоген, нитро, амино, низший алкиламино, низший галогеналкил, низший гидроксиалкил, низший алкокси или низший алкокси-низший алкил) или R2 и R3 вместе образуют цепь из 3 или 4 звеньев, причем элементы этой цепи выбраны из группы, состоящей из CH, CH2, О, S, N или NR9;
R5 обозначает H, галоген, низший галогеналкил, низший алкил, низший алкокси, низший алкокси-низший алкил, низший алкилтио-низший алкил, циклоалкил, низший циклоалкилалкил, циано, цианоалкил, низший алкил-низший сульфонилалкил, низший гидроксиалкил, нитро, (CH2)mC(O)R8, (CH2)mNR6C(O)R8, (CH2)mNR6R7, (CH2)mN(CH3)(CH2)nNR6R7, (CH2)mOC(O)R8, (CH2)mOC(O)NR6R7,
(CH2)mS(O)qR11, (CH2)mP(O)R12R13, (CH2)2P(S)R12R13 или (CH2)n[N-X] , OC(O)[N=X], (CH2)mOC(O) [N=X], арил или замещенный низший арилалкил (т.е. 1-4 раза на арильной группе или гетероариле) или незамещенный, где заместитель представляет собой низший алкил, галоген, нитро, амино, низший алкиламино, низший галогеналкил, низший гидроксиалкил, низший алкокси или низший алкокси-низший алкил;
R6 и R7 обозначают независимо H и низший алкил, низший гидроксиалкил, низший алкил-низший аминоалкил, низший аминоалкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси-низший алкил, низший галогеналкил или арил или замещенный низший арилалкил (т.е. 1-4 раза на арильной группе) или незамещенный, где заместитель представляет собой низший алкил, галоген, нитро, амино, низший алкиламино, низший галогеналкил, низший гидроксиалкил, низший алкокси или низший алкокси-низший алкил;
R8 обозначает H, низший алкил, низший гидроксиалкил, амино, низший алкиламино, низший алкил-низший аминоалкил, низший аминоалкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси, низший алкокси-низший алкил, низший галогеналкил или арил или замещенный низший арилалкил (т.е. 1-4 раза на арильной группе) или незамещенный, где заместитель представляет собой низший алкил, галоген, нитро, амино, низший алкиламино, низший галогеналкил, низший гидроксиалкил, низший алкокси или низший алкокси-низший алкил;
R9 обозначает H, низший алкил, низший галогеналкил, арил или арил, замещенный одной или несколькими группами, выбранными из радикалов низший алкил, галоген, нитро, амино, низший алкиламино, низший галогеналкил, низший гидроксиалкил, низший алкокси или низший алкокси-низший алкил;
R10 обозначает H, низший алкил, низший галогеналкил, низший алкокси, арил или арил, замещенный (т.е. 1-4 заместителя на арильной группе) одной или несколькими группами, выбранными из радикалов низший алкил, низший галогеналкил, низший гидроксиалкил или низший алкокси-низший алкил;
R11 обозначает низший алкил, арил, (CH2)mOR14, (CH2)mSR14, (CH2)2NR14R15 или (CH2)m[N-X];
R12 и R13 обозначают независимо низший алкил, арил, низший алкокси, арилокси или амино;
R14 и R15 обозначают независимо H и низший алкил или арил;
R16 обозначает H или OR21;
R17 обозначает OR6 или NR6R7;
R18 и R19 обозначают независимо H, галоген, низший алкил, низший алкокси или гидрокси;
R20 обозначает H или галоген;
R21 обозначает H, низший алкил, CHO или C(O) (CH2)mCH3;
m целое число между 0 и 6;
n 1 или 2; и
q обозначает целое число от 0 до 2; и [N=X] обозначает гетероциклическую группу с 4-7 звеньями, X обозначает необходимую цепь для комплектования гетероциклической группы и выбран из группы, состоящей из О, S, CH2, CH, N, NR9 и COR9; или фармацевтически приемлемую соль последнего.
В частности данное изобретение относится к соединениям формулы I и формулы II, описанных выше, в которых R1 обозначает низший алкил, низший алкенил, низший галогеналкил, низший алкокси-низший алкил или низший алкилтио-низший алкил; R5 обозначает H, галоген, низший галогеналкил, низший алкил, низший алкокси, низший алкокси-низший алкил, низший алкилтио-низший алкил, циклоалкил, низший циклоалкилалкил, циано, цианоалкил, низший гидроксиалкил, нитро, (CH2)mC(O)R8, (CH2)mNR6C(O)R8, (CH2)mNR6R7, (CH2)mN(CH3)(CH2)nNR6R7, (CH2)mOC(O)R8, (CH2)mOC(O)NR7R7 или (CH2)n[N= X], OC(O)[N=X], (CH2)mOC[N=X], арил или низший арилалкил, замещенный или незамещенный; R12 и R13 обозначают независимо низший алкил; R16 обозначает OR21 и R18, R19 и R20 обозначают H.
Более конкретно, данное изобретение касается соединений формулы I и формулы II, описанных выше, в которых R1 обозначает низший алкил, низший алкенил, низший галогеналкил или низший алкокси-низший алкил; R2, R3 и R4 обозначают независимо H, галоген, низший галогеналкил, низший алкил, нитро, амидо, низший амидоалкил, гидразино, низший гидразиноалкил, азидо, низший азидоалкил, (CH2)mNR6R7, (CH2)mOR6, (CH2)mSR6, (CH2)mC(O)R8,
OC(O)NR6R7, (CH2)n[N=X] или (CH2)mOC(O)[N=X], замещенный или незамещенный, или OC(O)[N=X]; или R2 и R3 вместе образуют цепь из 3 или 4 звеньев, причем эти элементы цепи выбраны из группы, состоящей из CH, CH2, О, S, N или NR9; R5 обозначает H, галоген, низший галогеналкил, низший алкил, низший алкокси, низший алкокси-низший алкил, низший алкилтио-низший алкил, низший гидроксиалкил, нитро, (CH2)mC(O)R8, (CH2)mNR6C(O)R8, (CH2)mNR6R7, (CH2)mN(CH3) (CH2)nNR6R7, (CH2)mOC(O)R8, (CH2)mOC(O)NR6R7 или (CH2)n[N= X] , OC(O)[N= X] , замещенные или незамещенные, или (CH2)mOC[N=X]; R6 и R7 обозначают независимо H, низший алкил, низший гидроксиалкил, низший алкил-низший аминоалкил, низший аминоалкил, циклоалкил, низший циклоалкилалкил, низший алкокси-низший алкил, арил, низший арилалкил или низший галогеналкил; R8 обозначает H, низший алкил, низший гидроксиалкил, низший алкиламино, низший алкил-низший аминоалкил, низший аминоалкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси, низший алкокси-низший алкил, низший галогеналкил, арил или низший арилалкил; R9 обозначает H, низший алкил или низший галогеналкил; R10 обозначает H, низший алкил, низший галогеналкил или низший алкокси; R11 обозначает низший алкил; и R14 и R15 обозначают независимо H или низший алкил.
Более конкретно, предпочтительными соединениями данного изобретения являются соединения формулы I, описанные выше, в которых R1 обозначает этильную группу; R2 и R3 обозначают независимо H, низший алкил, галоген, низший галогеналкил или (CH2)mOR6 или R2 и R3 вместе образуют метилендиокси или этилендиокси и R4 и R5 обозначают независимо H, низший алкил, (CH2)mNR6R7 или (CH2)n[N= X] , незамещенные или замещенные низшим алкилом. Предпочтительно, R4 обозначает H или (CH2)mNR6R7, где R6 и R7 обозначают независимо H или низший алкил, a R5 обозначает H и низший алкил или (CH2)n[N=X], незамещенный или замещенный низшим алкилом; в качестве примера [N=X], замещенного или незамещенного, можно привести радикалы пиперидил, морфолинил, пиперазинил, имидазолил и 4-метилпиперазинил.
Более предпочтительно, R2 обозначает H или галоген и, предпочтительно, H, хлор или фтор; и R3 обозначает H, низший алкил, галоген или OR6, где R6 обозначает H, низший алкил или низший арилалкил, и, предпочтительно, H, фтор, хлор, метил или метокси. Предпочтительно, R2 и R3 образуют вместе метилендиокси или этилендиокси.
Более конкретно, данное изобретение имеет своей основной целью продукты, описанные далее в примерах, в частности продукты, соответствующие следующим формулам:
--5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
--5,12-диэтил-4,5-дигидро-5-гидрокси-1Н-оксепино(3',4': 6,7]- индолизино[1,2-b]хинолин-3,15-(4H,13H)-дион
--8-этил-2,3,8,9-тетрагидро-8-гидрокси-10Н,12H-[1,4]-диоксино[2,3-g] оксепино[3',4': 6,7]-индолизино[1,2-b]-хинолин-10,13-(15H)-дион
--10-бензилокси-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13H)-дион
--5-этил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино-[3', 4': 6,7]- индолизино[1,2-b]хинолин-3,15(4Н,13H)-дион
--11-(диметиламино)метил-5-этил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино [3',4': 6,7] -индолизино[1,2-b]-хинолин-3,15(4Н,13H)-дион
--5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15-(4Н,13H)-дион
--9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метил-1Н-оксепино [3',4':6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-9,10-дифтор-4,5-дигидро-5-гидрокси-1Н-оксепино [3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--7-этил-7,8-дигидро-7-гидрокси-9Н,11Н-[1,3]диоксоло[4,5-g]оксепино [3', 4':6,7]-индолизино[1,2-b]хинолин-9,12(14Н)-дион
--9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино[3', 4': 6,7]- индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--9,11-дихлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]- индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-1Н-оксепино[3', 4':6,7]- индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-10-фтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b] хинолин-3,15(4Н,13Н)-дион
--10-хлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--10-хлор-5-этил-9-фтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5,12-диэтил-4,5-дигидро-5,10-дигидрокси-11-морфолинометил-1Н-оксепино [3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5,12-диэтил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1H-оксепино [3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-4,5-дигидро-5-гидрокси-12-метил-1Н-оксепино[3',4':6,7]- индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--9-хлор-5-этил-4,5-дигидpo-5-гидpoкcи-10-метокси-12-(4- метилпипеpaзинoметил)-1H-oкcепинo[3', 4':6,7]-индолизино- [1,2-b]хинолин-3,15(4Н,13Н)-дион
--9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12-морфолинометил- 1Н-оксепино[3',4':6,7]-индолизино[1,2-b]-хинолин-3,15(4H,13Н)-дион
--5-этил-4,5-дигидро-5-гидрокси-12-(4-метил-пиперазинометил) -1H-оксепино [3',4':6,73-индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
--5-этил-4,5-дигидро-5-гидрокси-12-пиперидинометил-1H-оксепино[3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н- оксепино[3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-(4-метилпиперазинометил)- 1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н-оксепино [3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
--5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12- (4-метилпиперазинометил)-1H-оксепино[3',4':6,7]-индолизино[1,2-b] хинолин-3,15(4H,13H)-дион
--5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12-морфолинометил-1H- оксепино[3',4':6,7]-индолизино[1,2-b]-хинолин-3,15(4H,13H)-дион
--5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12-пиперидинометил-1H-оксепино [3',4':6,7]-индолизино[1,2-b]-хинолин-3,15(4Н,13Н)-дион
--8-этил-2,3,8,9-тетрагидро-8-гидрокси-16-(4-метилпиперазинометил)- 10H, 12Н-(1,4)диоксино(2,3-g)-оксепино[3', 4': 6,7] индолизино[1,2-b] хинолин-10,13[15H]-дион
--9-хлор-5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н- оксепино[3',4':6,7]-индолизино[1,2-b]-хинолин-3,15(4Н,13H)-дион
или их фармацевтически приемлемые соли.
Данное изобретение, более конкретно, предлагает соединения формулы II, описанной выше, где R1 обозначает этильную группу; R2 и R3 обозначают независимо H, низший алкил, галоген, низший галогеналкил или (CH2)mOR2 или R2 и R3 вместе образуют метилендиокси или этилендиокси и R4 и R5 обозначают независимо H, низший алкил, (CH2)mNR6R7 или (CH2)n[N=X], незамещенные или замещенные низшим алкилом; R20 обозначает H и R17 обозначает OR6, где R6 обозначает H или низший алкил, или NR6R7, где R6 и R7 независимо обозначают H, низший алкил, арил или низший арилалкил. Предпочтительно, R4 обозначает H или (CH2)mNR6R7, где R6 и R7 обозначают независимо H или низший алкил; R5 обозначает H и низший алкил или (CH2)n[N=X], незамещенный или замещенный низшим алкилом; и R17 обозначает OR6, где R6 обозначает H или низший алкил, или их фармацевтически приемлемые соли. В качестве примера [N=X] можно привести радикалы пиперидил, морфолинил, пиперазинил, имидазолил и 4-метилпиперазинил.
Еще более предпочтительно, R2 обозначает H или галоген и, предпочтительно, H, хлор или фтор; и R3 обозначает H, низший алкил, галоген или OR6, где R6 обозначает H, низший алкил или низший арилалкил, и, предпочтительно, H, фтор, хлор, метил или метокси. Предпочтительно, R2 и R3 образуют вместе метилендиокси или этилендиокси.
Более конкретно, данное изобретение предлагает продукты, описанные далее в примерах, в частности, продукты, соответствующие следующим формулам:
--трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо- (11H)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
--этил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)- индолизино-[1,2-b]хинолин-7-ил)-пропионат
-β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил) -пропионовая кислота
--метил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил) -пропионат
--этил -β-этил-α,α-дифтор-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил) -пропионат
--этил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)- индолизино-[1,2-b]хинолин-7-ил)-пропионат
--трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)-индолизино-[1,2-b] хинолин-7-ил)-пропионат (12-этил-8-гидроксиметил-9-оксо(11Н)- индолизино-[1,2-b]хинолин-7-ил)-пропионовая кислота
(12-этил-8-гидроксиметил-9-оксо(11Н)- индолизино-[1,2-b]хинолин-7-ил)-пропионовая кислота
-γ- (12-бензилокси-8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b] хинолин-7-ил) -β-этил-β- гидрокси-пропионовая кислота (E)
или их фармацевтически приемлемую соль.
В применении здесь, термин низший в отношении алкила, алкилтио и алкоксигрупп обозначает насыщенные алифатические углеводородные группы, линейные или разветвленные, содержащие 1-6 атомов углерода, примерами которых являются метил, этил, пропил, изопропил, бутил, трет-бутил, метилтио, этилтио, метокси и этокси. Применительно к алкенилу или алкинилу, термин низший обозначает группы, содержащие 2-6 атомов углерода и одну или более двойных или тройных связей, примерами которых являются винил, аллил, изопренил, пентенил, гексенил, пропенил, этинил, пропинил и бутинил. Термин циклоалкил обозначает цикл, содержащий 3-7 атомов углерода, например, циклопропил, циклобутил, циклопентил или циклогексил. Термин арил обозначает углеводородное соединение, моно-, ди- или трициклическое, по меньшей мере с одним ароматическим циклом, причем каждый цикл содержит максимум 7 звеньев, как, например, фенил, нафтил, антрацил, бифенил или инденил. Термин галоген обозначает хлор, бром, иод и фтор. Радикалы, соответствующие низшему галогеналкилу, низшему цианоалкилу, низшему нитроалкилу, низшему амидоалкилу, низшему гидразиноалкилу, низшему азидоалкилу, низшему арилалкилу, низшему гидроксиалкилу, низший алкокси-низшему алкилу, низший алкилтио-низшему алкилу и низший алкилсульфонил-низшему алкилу, являются замещенными, соответственно одним - тремя заместителями, такими как галоген, циано, нитро, амидо, гидразино, азидо, арил, гидрокси, низший алкокси, низший алкилтио или низший сульфонил. Низший алкиламино-радикал может содержать одну или две алкильных групп и обозначать, например, NHCH3, NHCH2CH3, NH(CH3)2 или N(CH3)(CH2CH3). Примеры [N= X] включают пиперидинильную, морфолинильную, пиперазинильную и имидазолильную группы.
Как наблюдается для камптотецина, атом углерода, несущий гидроксильную группу, на β- гидроксилактоне, или β- гидроксикарбоксилатная группа соединений данного изобретения, является асимметричным. Поэтому соединения согласно данному изобретению имеют две возможные энантиомерные конфигурации, т.е. конфигурации "R" и "S". Данное изобретение включает в себя эти две энантиомерные конфигурации и все комбинации этих конфигураций, а также "RS"-рацемические смеси. В интересах простоты, когда в структурных формулах не указана никакая конкретная конфигурация, следует понимать, что представлены две энантиомерные конфигурации и их смеси.
Задачей данного изобретения являются также способы получения соединений общей формулы I и общей формулы II либо из камптотецина или из замещенного камптотецина, либо посредством полного химического синтеза.
Данное изобретение относится, таким образом, к способу получения соединений формул I и II, исходя из замещенного камптотецина, заключающемуся в том, что:
-α- гидроксилактон камптотецина восстанавливают до общей формулы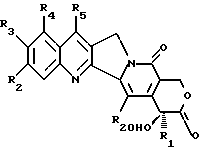
где R1, R2, R3, R4, R5 и R20 имеют указанное выше значение, с получением α- гидроксилактола общей формулы A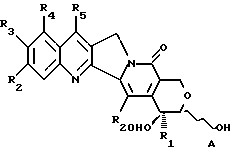
где R1, R2, R3, R4, R5 и R20 имеют указанное выше значение. В образованном таким образом соединении A связь углерод-углерод соседнего карбинола разрывают подходящим окислителем таким образом, чтобы получить соединение формулы B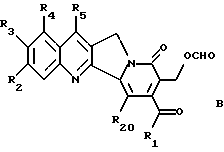
где R1, R2, R3, R4, R5 и R20 имеют указанное выше значение. Его затем обрабатывают функциональным алкилирующим агентом и формильную группу соединения формулы B разрезают с получением β- гидроксиэфира общей формулы C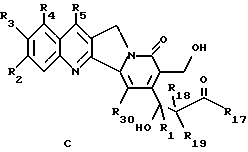
где R1, R2, R3, R4, R5, R18 и R20 имеют указанное выше значение и R17 обозначает OR6 и R6 обозначает низший алкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси-низший алкил или арил или низший арилалкил;
-- соединение общей формулы C циклизуют с получением 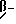 гидроксилактонного соединения общей формулы D
гидроксилактонного соединения общей формулы D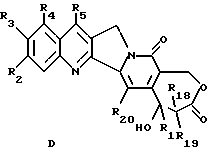
где R1, R2, R3, R4, R5, R18, R19 и R20 имеют указанное выше значение,
--лактон общей формулы D раскрывают с получением соединения формулы E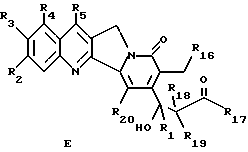
где R1, R2, R3, R4, R5, R18, R19 и R20 имеют указанное выше значение; R16 обозначает OR21, где R21 обозначает H или низший алкил; и R17 обозначает OR6 или NHR6 и R6 обозначает H, низший алкил, циклоалкил, низший циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси-низший алкил или арил или низший арилалкил.
Некоторые соединения формулы E могут быть также получены гидролизом сложноэфирной связи соответствующих соединений формулы C. Соединения общей формулы E, в которых R16 и/или R17 обозначают независимо гидроксигруппу, могут быть этерифицированы или амидированы при классических условиях, известных специалистам в данной области, с получением сложных эфиров или амидов, соответствующих формуле E.
В описанном выше способе группы R1, R2, R3 и R4 могут быть защищены, если требуется, согласно классическим способам защиты (Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981)). Во время этой процедуры происходит восстановление восстановителем в подходящем растворителе, например, боргидридом натрия в метаноле. Стадию, соответствующую образованию соединения B из соединения A, выполняют при окислительных условиях, например, с тетраацетатом свинца, периодной кислотой или метапериодатом натрия, в подходящем растворителе, таком как, например, уксусная кислота. Обработку функционализированным алкилирующим агентом можно выполнять с применением производного металла, например лития или цинка, или с применением эфира карбоновой кислоты в безводном апротонном растворителе, таком как тетрагидрофуран. Стадию лактонизации соединения D, получаемого из соединения C, обычно проводят в кислых условиях, например, обработкой трифторуксусной кислотой или газообразным хлористым водородом, растворенным в безводном растворителе, таком как дихлорметан или диоксан. Размыкание лактонового цикла соединения D для получения соединения E может быть выполнено, например, гидролизом в щелочных условиях с последующей нейтрализацией.
Примеры замещенных камптотецинов, используемых в качестве исходных продуктов, могут быть найдены в US Patents Nos. 4473692, 4604463, 4894956, 5162532, 5395939, 5315007, 5264579, 5258516, 5254690, 5212317 и 5341745, PCT Patent Application Nos. US 91/08028, US94/06451, US90/05172, US92/04611, US93/10987, US91/09598, EP94/03058 и European Patent Applications Nos. 325247, 495432, 321122 и 540099.
Данное изобретение относится также к способу получения соединений формул I и II, заключающемуся в том, что:
- соединение общей формулы M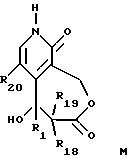
где R1, R18 и R19 имеют указанное выше значение, и R20 обозначает атом водорода или галогена, связывают с 2-галоген-3-хинолинметанолом общей формулы N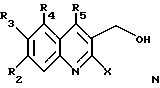
где R2, R3, R4 и R5 имеют указанное выше значение и X обозначает атом галогена, с получением соединения формулы O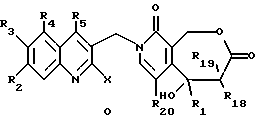
где R1, R2, R3, R4, R5, R18, R19 и R20 и X имеют указанное выше значение;
- затем соединение общей формулы O циклизуют с получением соединения формулы D, как описано выше.
В описанном выше способе группы R1, R2, R3 и R4 могут быть защищены, если требуется, в соответствии с классическими способами защиты (Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981)). Образование соединения O из соединений общих формул M и N проводят обработкой, известной специалистам в данной области, называемой реакцией Митсунобу (Mitsunobu, O. et al. Syntheses. P.1 (1981)). Она состоит в замене гидроксильной группы соединения N нуклеофилом, таким как соединение М, или депротонированным производным последнего, обработке фосфином, например, трифенилфосфином, и азодикарбоксилатным производным, например диэтил-дикарбоксилатом, в апротонном растворителе, таком как, например, тетрагидрофуран или N,N-диметилформамид. Циклизацию соединения O проводят предпочтительно в присутствии палладиевого катализатора (например, диацетата палладия) в щелочных условиях (обеспечиваемых, например, ацетатом щелочного металла, возможно, комбинированным с агентом фазового переноса, таким как, например, тетрабутиламмонийбромид) в апротонном растворителе, таком как ацетонитрил или N,N-диметилформамид, при температуре между 50oC и 120oC (R. Grigg et al. Tetrahedron 46, page 4003 (1990)). Соединения общей формулы M являются новыми. Они могут быть получены согласно способу, заключающемуся в том, что
-- карбонил пиридина общей формулы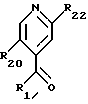
где R1 и R20 имеют указанное выше значение и R22 обозначает атом галогена или низший алкокси, защищают ацетальной группой, с получением соединения формулы F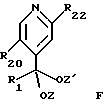
где R1, R20 и R22 имеют указанное выше значение и Z и Z' - группы обозначают независимо низший алкил или вместе образуют насыщенную углеводородную цепь с 2-4 атомами углерода:
-- гидроксиметильную группу вводят в соединение формулы F с получением соединения общей формулы G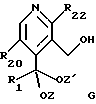
где R1, R20, R22, Z и Z' имеют указанное выше значение,
-- затем спиртовую группу соединения общей формулы G защищают с получением соединения общей формулы H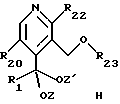
где R1, R20, R22, Z и Z' имеют указанное выше значение и R23 обозначает защитную группу спиртовой группы.
--ацеталь соединения общей формулы H освобождают от защитной группы с получением соединения общей формулы I'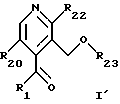
где R1, R20, R22 и R23 имеют указанное выше значение,
-- соединение формулы I' обрабатывают функционализованным алкилирующим агентом с получением β- гидроксиэфира общей формулы J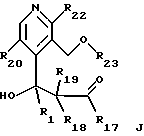
где R1, R20, R22 и R23 имеют указанное выше значение, R18 и R19 имеют значение, указанное в общей формуле II, и R17 обозначает OR6 и R6 обозначает низший алкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси-низший алкил или арил или низший арилалкил,
--защитную группу R23 отщепляют от соединения общей формулы J с получением соединения общей формулы K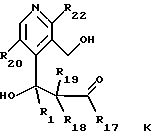
где R1, R18, R19, R20 и R22 имеют указанное выше значение и R17 обозначает OR6, где R6 обозначает низший алкил, циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкокси-низший алкил или арил или низший арилалкил,
--соединение общей формулы K циклизуют с получением соединения формулы L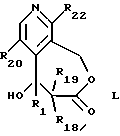
где R1, R18, R19, R20 и R22 имеют указанное выше значение, и, наконец,
--радикал R22 соединения L превращают в карбонил с получением соединения общей формулы M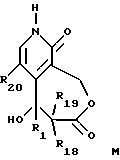
где R1, R18, R19 и R20 имеют указанное выше значение. Карбонильную группу 4-ацил-2-пиридина (полученного, например, согласно Lamattina, J. L. J. Heterocyclic Chem. 20, p.553 (1983)) предпочтительно защищают ацетальной группой, предпочтительно циклическим ацеталем, в соответствии с классическими условиями, известными специалистам в данной области (Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981)). Когда R22 является хлором или фтором, полученный таким образом промежуточный продукт обрабатывают алкоголятом натрия или алкоголятом калия в апротонном растворителе (например, ацетонитриле), или в спирте, из которого был получен алкоголят, при температуре между 0oC и 100oC с получением соединения формулы F. Последнее может быть обработано для присоединения лития в положении 3 ариллитием или алкиллитием (например, мезитиллитием) в растворителе - простом эфире, таком как тетрагидрофуран, при температуре между -100oC и 0oC. К полученному таким образом литиированному промежуточному соединению добавляют формилирующий электрофил, такой как N,N-диметилформамид, и полученный альдегид, после гидролиза, обрабатывают восстановителем, таким как боргидрид натрия, с получением соединения общей формулы G. Защиту спиртовой группы соединения G выполняют согласно классическим условиям, известным специалистам в данной области, с получением соединения общей формулы H. Примерами защитных групп спирта являются такие группы, которые образуют простые эфиры (например, метил, метоксиметил, тетрагидропиранил, 2-метоксиэтоксиметил, бензилоксиметил, трет-бутил и бензил (замещенный или незамещенный)) и сложные эфиры (например, формиат, ацетат и изобутират). Примеры других защитных групп первичных гидроксилов описаны Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981). Удаление защитных групп соединений общей формулы H, приводящее к соединению общей формулы I' выполняют в селективной окружающей среде, позволяющей сохранить целостность радикала R23, например, обработкой в кислых условиях (например, трифторуксусной кислотой). Избирательные условия защиты и удаления защиты функциональных групп известны специалистам в данной области (Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981)). Обработка соединения I' функционализованным алкилирующим агентом с получением β- гидроксиэфира общей формулы J может выполняться с использованием енолята лития или цинк-производного эфира карбоновой кислоты в апротонном безводном растворителе, например тетрагидрофуране. Защитную группу R23 соединения общей формулы J отщепляют с получением соединения общей формулы K при условиях удаления защитных групп, известных специалистам в данной области. Например, когда R23 является бензильной группой, спиртовой раствор соединения общей формулы J восстанавливают на палладиевом катализаторе в атмосфере водорода с давлением 0,5-10 бар. Циклизацию полученного таким образом соединения общей формулы K можно выполнять в кислых условиях (например, обработкой трифторуксусной кислотой или газообразным хлористым водородом, растворенным в безводном растворителе, таком как дихлорметан или диоксан) с получением β- гидроксилактонового цикла с семью звеньями, такими как в соединении общей формулы L. Соединения общей формулы L могут быть превращены в пиридоны общей формулы M, например, обработкой горячей соляной кислотой или триметилсилилиодидом.
2-Галоген-3-хинолинметанол общей формулы N может быть получен из ацетанилидов общей формулы P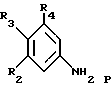
где R2, R3 и R4 имеют значение, указанное для соединений формул I и II. В последующих процедурах R2, R3 и R4 могут быть защищены согласно классическим способам защиты (Greene, T., Protective Groups in Organic Synthesis 10-86 (John Wiley and Sons 1981)).
Затем могут быть получены соединения формулы N согласно следующей процедуре: анилины формулы P N-ацетилируют обработкой ацетилирующим агентом, таким как, например, уксусный ангидрид. Полученные таким образом ацетанилиды обрабатывают при температуре между 50oC и 100oC, предпочтительно 75oC, реагентом, известным специалистам в данной области под названием реагент Вилсмейера (получаемым действием фосфорилоксихлорида на N,N-диметилформамид при температуре между 0oC и 10oC) с получением соответствующего 2-хлор-3-хинолинкарбальдегида (см., например, Meth-Cohn et al. J. Chem. Soc., Perkin Trans I p. 1520 (1981); Meth-Cohn et al. J. Chem. Soc., Perkin Trans I p.2509 (1981); и Nakasimhan et al. J. Am. Chem. Soc., 112. P. 4431 (1990)). Хлор в положении 2 2-хлор-3-хинолинкарбальдегидов может быть замещен иодом или бромом путем нагревания продукта в инертном растворителе, таком как ацетонитрил, в присутствии соли иода или брома (например, иодида натрия или тетрабутиламмонийбромида). Следы кислоты, такой как концентрированная соляная кислота, могут быть необходимы для катализа этого превращения. 2-Галоген-3-хинолинкарбальдегиды легко восстанавливаются до 2-галоген-3-хинолинметанолов, соответствующих общей формуле N, при классических условиях, известных специалистам в данной области, таких как обработка в спиртовом растворителе (например, метаноле) боргидридом натрия при температуре между 0oC и 40oC.
Соединения формулы N могут быть получены также согласно следующей процедуре: анилины общей формулы P, описанные выше, ацилируют реакцией с нитрилом (таким как хлорацетонитрил или пропионитрил) в присутствии трихлорида бора и другой кислоты Льюиса, такой как трихлорид алюминия, тетрахлорид титана или хлорид диэтилалюминия, в апротонном растворителе или смеси апротонного растворителя, с последующим гидролизом (см. Sugasawa, T., et al. J. Am. Chem. Soc. 100, p. 4842 (1978)). Затем полученное промежуточное соединение обрабатывают этилмалонилхлоридом в апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как триэтиламин, затем обрабатывают щелочным алкоголятом, например, метилатом натрия в метаноле, с получением этил-2-гидрокси-3-хинолинкарбоксилата, замещенного в положении 4. Последнее соединение превращают в этил-2-хлор-3-хинолинкарбоксилат обработкой фосфорилоксихлоридом. Когда в положении 4 хинолина находится хлорметильная группа, нуклеофильное замещение может выполняться обработкой вторичным амином, таким как диметиламин, N-метилпиперазин, морфолин или пиперидин. Затем этил-2-хлор-3- хинолинкарбоксилат восстанавливают диизобутилалюминийгидридом в апротонном растворителе, таком как дихлорметан, с получением 2-хлор-3-хинолинметанола общей формулы N. Аналоги промежуточных (N) соединений были описаны в литературе и, в частности, в PCT Application 95/05427.
Данное изобретение относится также к новым промышленным продуктам, являющимся промежуточными продуктами для получения продуктов формул I и II, которыми являются продукты формул I' и М, как описано выше.
Некоторые соединения данного изобретения могут быть получены в форме фармацевтически приемлемых солей согласно обычным способам. Приемлемые соли включают в себя в качестве примера, но не ограничивающие объем изобретения аддитивные соли с неорганическими кислотами, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, салицилат, оксалат и стеарат. Соли, образованные с основаниями, такими как гидроксид натрия или калия, также входят в объем данного изобретения, когда они применимы. Относительно других примеров фармацевтически приемлемых солей смотрите "Pharmaceutical Salts", J. Pjarm. Sci., 66:1 (1977).
Соединения данного изобретения обладают интересными фармакологическими свойствами, а именно соединения данного изобретения влияют на активность топоизомеразы I и/или II и противоопухолевую активность. Данный способ предполагает, что соединения данного изобретения обладают антипаразитарной и/или антивирусной активностью. Таким образом, соединения данного изобретения могут использоваться для различных терапевтических целей.
Соединения изобретения могут ингибировать топоизомеразу, например, типа I и/или II, у больного, например, млекопитающего, такого как человек, при введении этому больному эффективного терапевтического количества соединения формулы (I) или формулы (II).
Соединения данного изобретения обладают также противоопухолевой активностью. Их можно использовать для лечения опухолей, например, опухолей, экспрессирующих топоизомеразу, путем введения больному эффективного терапевтического количества соединения формулы (I) или формулы (II). Некоторые примеры опухолей или карцином включают в себя раковые опухоли пищевода, желудка, кишечника, прямой кишки, полости рта, глотки, гортани, легких, ободочной кишки, молочной железы, шейки матки, эндометрия, яичников, простаты, яичек, мочевого пузыря, почек, печени, поджелудочной железы, костей, соединительной ткани, кожи, глаз, мозга и центральной нервной системы, а также рак щитовидной железы, лейкоз, болезнь Ходжкина, лимфомы, иные, чем болезнь Ходжкина, множественные меланомы и др.
Их можно использовать также для лечения паразитарных инфекций путем ингибирования кровяных жгутиковых паразитов (например, при инфекциях трипаносомы или лейшмании) или путем ингибирования плазмодия (например, при малярии), но также для лечения вирусных инфекций или заболеваний.
Эти свойства делают соединения формулы I и формулы II пригодными для фармацевтического использования. Объектом данной заявки являются также соединения формулы I и II, описанные выше, а также аддитивные соли с фармацевтически приемлемыми органическими или минеральными кислотами этих соединений формул I и II, в качестве лекарственных средств, а также фармацевтические композиции, содержащие в качестве активного ингредиента одно из лекарственных средств, описанных выше.
Данное изобретение относится, таким образом, к фармацевтическим композициям, содержащим эффективное количество соединения согласно данному изобретению или его аддитивную соль с фармацевтически приемлемой кислотой, вместе с фармацевтически приемлемым носителем согласно выбранному способу введения (например, пероральному, внутривенному, внутрибрюшинному, внутримышечному, трансдермальному или подкожному). Фармацевтическая композиция (например, терапевтическая) может быть в форме твердого вещества, жидкости, липосомы или липидной мицеллы.
Фармацевтическая композиция может быть в форме твердых веществ, например, порошков, пилюль, гранул, таблеток, липосом, капсул или суппозиториев. Пилюля, таблетка или капсула могут быть покрыты веществом, способным защищать композицию от действия желудочной кислоты или ферментов в желудке субъекта во время достаточного периода времени для прохождения композиции в нерасщепленном виде в тонкую кишку. Таким образом, соединение может быть введено локально, например, помещением рядом с опухолью. Соединение может также быть введено по способу пролонгированного высвобождения (например, в виде композиции с пролонгированным высвобождением или при помощи инфузионного насоса). Подходящей твердой средой могут быть, например, фосфат кальция, стеарат магния, карбонат магния, тальк, сахара, лактоза, декстрин, амидон, желатин, целлюлоза, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, поливинилпирролидон и воск. Фармацевтическая композиция, содержащая соединение данного изобретения, может быть представлена также в форме жидкости, например в виде растворов, эмульсий, суспензий или форм с пролонгированным высвобождением. Подходящими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин, или гликоли, такие как полиэтиленгликоль, а также их смеси, в различных соотношениях, в воде.
Объектом данного изобретения является также применение соединений формул I и II, описанных выше, для получения лекарственного средства, предназначенного для ингибирования топоизомеразы и, более конкретно, топоизомеразы типа I и II, лекарственного препарата, предназначенного для лечения опухолей, лекарственного препарата, предназначенного для лечения паразитарных инфекций, а также лекарственных средств, предназначенных для лечения вирусных инфекций или заболеваний.
Дозу соединения согласно данному изобретению, предусматриваемую для лечения заболеваний или расстройств, упомянутых выше, варьируют в зависимости от способа введения, возраста и веса тела нуждающегося в лечении субъекта, а также от его состояния, и должна определяться лечащим врачом или ветеринаром. Эту дозу называют здесь "терапевтически эффективным количеством".
В нижеследующем экспериментальном разделе можно найти иллюстрацию фармакологических свойств этих соединений.
В том случае, если все технические и научные термины, используемые здесь, не определены иным образом, они имеют значение, понимаемое в настоящее время средним специалистом в области, к которой относится данное изобретение. Все публикации, патентные заявки, все патенты и все другие упоминаемые здесь источники информации включены здесь в качестве ссылки.
Следующие далее примеры представлены для иллюстрации описанных выше способов и ни в коем случае не должны рассматриваться как ограничивающие данное изобретение.
ЭКСПЕРИМЕНТАЛЬНЫЙ РАЗДЕЛ
Пример 1: трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)-индолизино [1,2-b] хинолин-7-ил)-пропионат 1. а. 4-этил-3,4-дигидрокси-1H-пирано [3',4':6,7] индолизино[1,2-b]хинолин-14(4Н,12Н)-он
Боргидрид натрия (14 г, 370 ммоль) добавляют порциями к суспензии (S)-(+)-камптотецина (14 г, 40 ммоль), который может быть получен с использованием различных коммерческих источников, таких как Aldrich Chemical Со. (Milwaukee, WI), в метаноле (750 мл) и полученную смесь нагревают медленно до 55oC до получения прозрачного раствора, который затем перемешивают в течение 16 часов при температуре окружающей среды. Затем растворитель выпаривают при пониженном давлении, остаток извлекают в воду (250 мл), нейтрализуют добавлением уксусной кислоты (21 мл) и оставляют стоять в течение 2 часов при 4oC. Полученную суспензию фильтруют и промывают последовательно холодной водой, ацетоном и диэтиловым эфиром, что, после высушивания при пониженном давлении, позволяет получить целевое соединение в форме белого твердого вещества, т. пл. 280oC.
1.b. 8-формилоксиметил-7-пропионилиндолизино[1,2-b]хинолин-9(11Н)-он
Раствор метапериодата натрия (14 г, 65 ммоль) в воде (140 мл) добавляют по каплям к суспензии 4-этил-3,4-дигидрокси-1Н- пирано[3',4':6,7]индолизино[1,2-b]хинолин-14(4Н,12Н)-она (13,4 г, 38 ммоль) в ледяной уксусной кислоте (720 мл) и полученный раствор перемешивают в течение 1 часа при температуре окружающей среды. Затем реакционную смесь выливают в смесь лед/вода (650 мл) и полученную суспензию перемешивают в течение 1/2 часа, затем фильтруют и промывают последовательно водой, изопропиловым спиртом и диэтиловым эфиром и спиртом, что, после высушивания при пониженном давлении, дает целевое соединение (11,5 г) в форме бледно-желтого твердого вещества, т. пл. > 200oC (разл.).
1. с. трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-) оксо(11H)-индолизино[1,2-b]хинолин-7-ил)-пропионат
Суспензию цинка (6,5 г, 100 ммоль), перемешиваемую магнитной мешалкой в безводном диэтиловом эфире (50 мл) в атмосфере аргона, активируют добавлением по каплям хлортриметилсилана (0,75 мл, 5,7 ммоль) и опять перемешивают в течение 15 минут при температуре окружающей среды для нагревания с обратным холодильником. Затем нагревающую баню удаляют и добавляют по каплям трет-бутилбромацетат (15 мл, 100 ммоль) при скорости, гарантирующей поддержание дефлегмации. Наружное нагревание восстанавливают и продолжают нагревать опять в течение 1 часа. Эфирный раствор, образующийся из реагента Реформатского, оставляют охлаждаться до температуры окружающей среды, затем переносят при помощи канюли в суспензию 8-формилоксиметил-7-пропионилиндолизино[1,2-b] хинолин-9(11Н)-она (1,6 г, 4,7 ммоль) в безводном тетрагидрофуране (40 мл) в атмосфере аргона. Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 1 часа, затем оставляют охладиться до температуры окружающей среды и реакцию останавливают добавлением насыщенного раствора хлорида аммония (100 мл) и экстрагируют хлороформом (3 х 100 мл). Объединенные хлороформные экстракты сушат на сульфате натрия, выпаривают и остаток очищают гель-хроматографией на силикагеле (1-2% MeOH/CH2Cl2), что позволяет получать 0,64 г целевого соединения (31%) в форме бледно-желтого твердого вещества, т. пл. 146-149oC.
1H-ЯМР (CDCl3): δ 0,93 (т, 3Н), 1,37 (с, 9Н), 1,99 (м, 2Н), 2,97 (дд, 2Н), 3,5 (се, 1Н), 5,10 (с, 2Н), 5,24 (с, 2Н), 7,40 (с, 1Н), 7,59 (т, 1Н), 7,83 (т, 1Н), 7,90 (д, 1Н), 8,20 (д, 1Н), 8,34 (с, 1Н).
13C-ЯМР (CDCl3): 8,18; 27,90; 34,59; 45,34; 49,91; 58,55; 77,39; 82,42; 100,52; 127,67; 127,97; 128,10; 128,64; 129,44; 129,79; 130,42; 130,99; 142,86; 148,69; 152,75; 155,16; 162,38; 172,24.
ИК (KBr): 764; 1016; 1157; 1580; 1651; 1726.
Пример 2: этил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11Н)- индолизино[1,2-b]хинолин-7-ил)-пропионат
Суспензию цинка (500 мг, 7,64 ммоль) и 8-формилоксиметил-7-пропионилиндолизино [1,2-b] хинолин-9(11H)-она (400 мг, 1,15 ммоль) в безводном тетрагидрофуране (20 мл), содержащем 10 мг гидрохинона, нагревают с обратным холодильником в атмосфере аргона. Нагревающую баню удаляют и инициируют экзотермическую реакцию добавлением капли этилбромацетата и небольшого кристалла иода. Нагревание с обратным холодильником поддерживают добавлением по каплям этилбромацетата (500 мкл, 4,48 ммоль), затем реакционную смесь вновь нагревают с обратным холодильником в течение 1 часа. После охлаждения до температуры окружающей среды реакцию останавливают добавлением насыщенного раствора хлорида аммония (10 мл) и метанола (30 мл). Полученную смесь растворяют в дихлорметане (30 мл), промывают водой и сушат на сульфате натрия. Затем удаляют растворитель и проводят очистку колоночной хроматографией (SiO2, CH2Cl2/MeOH 98/2) с получением 230 мг (49%) целевого соединения в форме желтого твердого вещества, т. пл. 157-161oC.
1H-ЯМР (CDCl3): δ 0,93 (т, 3Н), 1,20 (т, 3Н), 2,02 (м, 2Н), 3,07 (дд, 2Н), 4,11 (к, 2Н), 4,9 (се, 1Н), 5,08 (с, 2Н), 5,23 (с, 2Н), 7,45 (с, 1Н), 7,62 (т, 1Н), 7,80 (т, 1Н), 7,90 (д, 1Н), 8,22 (д, 1H), 8,36 (с, 1Н).
13C-ЯМР (CDCl3): 8,09; 14,01; 34,67; 44,85; 49,94; 58,31; 61,09; 77,21; 100,78; 127,78; 127,96; 128,11; 128,72; 129,16; 129,65; 130,60; 131,32; 142,76; 152,55; 155,09; 162,22; 172,59.
ИК (KBr): 766; 1009; 1184; 1582; 1647; 1750.
Пример 3: 5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7]-индолизино [1,2-b]хинолин-3,15(4H,13H)-дион
трет-Бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)-индолизино[1,2-b] хинолин-7-ил)-пропионат (1,45 г, 3,32 ммоль) растворяют в безводном дихлорметане (25 мл) и обрабатывают насыщенным раствором хлорида аммония в дифлорметане (100 мл). Полученную смесь поддерживают при -20oC в течение 16 часов. Осадок фильтруют, промывают метанолом и сушат при пониженном давлении, что дает 662 мг (55%) целевого соединения в форме желтого твердого вещества, т. пл. > 300oC.
1H-ЯМР (ДМСО): 0,90 (т, 3Н), 1,20 (к, 2Н), 3,27 (дд, 2Н), 5,29 (с, 2Н), 5,49 (дд, 2Н), 7,42 (с, 1Н), 7,73 (т, 1H), 7,90 (т, 1Н), 8,16 (т, 2Н), 8,71 (с, 1Н).
13C-ЯМР (ДМСО): 8,45; 36,48; 42,54; 50,68; 61,44; 73,34; 99,78; 122,71; 127,83; 128,15; 128,75; 129,08; 130,07; 130,61; 131,81; 144,66; 148,04; 152,80; 155,91; 159,26; 172,08.
ИК(KBr): 761; 1127; 1204; 1285; 1580; 1653; 1757.
Пример 4: -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)- индолизино[1,2-b]хинолин-7-ил)-пропионовая кислота
Водный раствор гидроксида калия (0,1 н., 30 мл) добавляют к 5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино-[3', 4': 6,7]-индолизино [1,2-b]хинолин-3,15(4Н, 13Н)-диону (500 мг, 1,38 ммоль) и полученную суспензию перемешивают в течение 16 часов, что приводит к образованию почти прозрачной жидкости, которую фильтруют. Фильтрат подкисляют до pH 3,5 1 н. соляной кислотой и желтый осадок извлекают фильтрованием, промывают водой и ацетоном, затем сушат при пониженном давлении. Получают 415 мг (79%) целевого соединения в форме моногидрата, т. пл. 165-167oC.
1H-ЯМР (ДМСО): 0,82 (т, 3Н), 2,10 (м, 2Н), 2,83 (д, 2Н), 3,12 (д, 2Н), 3,25 (се, 1Н), 4,81 (с, 2Н), 5,26 (с, 2Н), 5,76 (се, 1Н), 7,38 (с, 1Н), 7,71 (т, 1Н), 7,84 (т, 1Н), 8,10 (д, 1Н), 8,18 (д, 1Н), 8,34 (с, 1Н), 12,15 (се, 1Н).
13C-ЯМР (ДМСО): 8,16; 34,80; 46,71; 50,36; 55,73; 76,53; 100,17; 127,50; 128,00; 128,26; 128,69; 129,06; 130,01; 130,45; 131,63; 142,57; 148,09; 153,19; 156,07; 161,22; 172,27.
ИК(KBr): 1020; 1188; 1413; 1586; 1651; 1694.
Пример 5:
метил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)- индолизино[1,2-b]хинолин-7-ил)-пропионат
5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино [1,2-b] хинолин-3,15(4Н, 13Н)-дион (180 мг, 0,5 ммоль) в суспензии метанола (50 мл) обрабатывают 6 н. высушенным хлористым водородом в метаноле (0,5 мл) и нагревают с обратным холодильником до полного растворения (4 часа). Летучие компоненты выпаривают и остаток растворяют в дихлорметане (50 мл), промывают разбавленным гидроксидом натрия (0,05 н., 15 мл) и солевым раствором (15 мл). Органическую фракцию сушат на сульфате натрия и выпаривают. Оставшееся твердое вещество очищают колоночной хроматографией на силикагеле (3% MeOH/CH2Cl2) и продукт очищают и извлекают в диэтиловый эфир, фильтруют и сушат, что дает 120 мг (58%) целевого соединения в форме бледно-желтого твердого вещества, т.пл. 163-166oC.
1H-ЯМР (CDCl3): 0,93 (т, 3Н), 2,2 (м, 2Н), 3,05 (дд, 2Н), 3,49 (с, 3Н), 3,62 (с, 3Н), 4,93 (с, 2Н), 5,22 (д, 2Н), 5,52 (д, 2Н), 7,21 (с, 1Н), 7,62 (т, 1Н), 7,81 (т, 1Н), 7,91 (д, 1Н), 8,22 (д, 1Н), 8,36 (с, 1Н).
13C-ЯМР (CDCl3): 7,74; 35,54; 46,82; 50,15; 51,67; 58,10; 65,33; 78,03; 100,17; 125,57; 127,70; 128,04; 128,10; 128,35; 129,53; 130,39; 130,94; 143,87; 148,75; 152,94; 157,83; 161,74; 171,35.
ИК (KBr): 1207; 1595; 2655; 1709.
Пример 6: этил -β-этил-α,α-дифтор-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)-индолизино[1,2-b]хинолин-7-ил)-пропионат
Приблизительно 1/2 общего количества этилбромдифторацетата (1,8 мл, 14 ммоль), 8-формилоксиметил-7-пропионилиндозилино[1,2-b]хинолин-9(11Н)-он (2,0 г, 5,75 ммоль), полученный как в Примере 1.b., в суспензии с безводным ТГФ (10 мл) добавляют по каплям в атмосфере аргона к суспензии цинка (1,25 г, 17,2 ммоль) в безводном ТГФ при нагревании с обратным холодильником (40 мл), затем добавляют оставшуюся часть этилбромдифторацетата. Реакционную смесь поддерживают при нагревании с обратным холодильником еще в течение 1/2 часа. После охлаждения до температуры окружающей среды реакцию останавливают добавлением насыщенного водного раствора хлорида аммония (20 мл) и реакционную смесь экстрагируют дихлорметаном (3 х 20 мл). Объединенные органические экстракты сушат и концентрируют. Остаток извлекают в диэтиловый эфир (10 мл), фильтруют и очищают колоночной хроматографией (SiO2, CH2Cl2/MeOH 98/2) с получением 664 мг (26%) целевого соединения в форме желтого твердого вещества, т.пл. 208-209oC.
1H-ЯМР (CDCl3): 0,91 (т, 3Н), 1,38 (т, 3Н), 2,32 (м, 2Н), 4,8 (се, 1Н), 4,38 (к, 2Н), 5,09 (д, 2Н), 5,13 (дд, 2Н), 7,42 (с, 1Н), 7,55 (т, 1Н), 7,72 (т, 1Н), 7,79 (д, 1Н), 8,08 (д, 1Н), 8,22 (с, 1Н).
13C-ЯМР (CDCl3): 6,97; 13,93; 28,63; 50,18; 56,27; 63,15; 77,20; 81,96(t); 101,27; 116,40(t); 127,67; 127,77; 127,97; 128,31; 129,26; 130,33; 130,94; 131,23; 143,16; 148,34; 150,20; 151,91; 161,21; 163,21 (t)
ИК(KBr): 1124; 1308; 1591; 1647; 1748.
Пример 7: этил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)-индолизино [1,2-b]хинолин-7-ил)-пропионат
Суспензию цинка (1,25 г, 19,1 ммоль) и 8-метил-7-припионилиндолизино[1,2-b]хинолин-9-(11H)-она (500 мг, 1,43 ммоль), такого как полученный Kingsbury, W.D., Tetrahedron Lett. 29:6847 (1988), и ацетата серебра (250 мг, 1,50 ммоль) в безводном тетрагидрофуране (10 мл) перемешивают при температуре окружающей среды в атмосфере аргона. В конце 10 минут реакционную смесь активируют добавлением по каплям молярного раствора хлордиэтилалюминия (10 мл, 10 ммоль), затем добавляют этилбромацетат (1,25 мл, 11,3 ммоль) по каплям и полученную смесь оставляют реагировать еще в течение 5 часов. Реакцию останавливают добавлением избытка этилового спирта (10 мл) и насыщенного раствора тартрата калия и натрия (10 мл). Полученную смесь опять перемешивают в течение 1 часа, фильтруют и концентрируют при пониженном давлении. Остаток извлекают в дихлорметан (30 мл), промывают водой, сушат, концентрируют и очищают колоночной хроматографией (SiO2, CH2Cl2/MeOH 98/2) с получением 93 мг (15%) целевого продукта в форме бледно-желтого твердого вещества, т.пл. 185-188oC.
1H-ЯМР (CDCl3): 0,91 (т, 3Н), 1,17 (т, 3Н), 1,99 (м, 2Н), 2,49 (с, 3Н), 3,10 (дд, 2Н), 4,11 (к, 2Н), 4,6 (се, 1Н), 5,25 (с, 2H), 7,65 (т, 1H), 7,67 (с, 1Н), 7,80 (т, 1H), 7,90 (д, 1H), 8,22 (д, 1H), 8,34 (с, 1H).
13C-ЯМР (CDCl3): 8,02; 13,99; 14,72; 33,14; 43,97; 50,02; 61,0; 76,54; 101,90; 127,65; 127,84; 128,08; 128,81; 128,88; 130,74; 131,59; 131,65; 140,33; 147,64; 152,96; 153,61; 162,11; 172,91.
ИК(KBr): 762; 1192; 1576; 1653; 1740.
Пример 8: трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо-(11H)-индолизино[1,2-b] хинолин-7-ил)-пропионат
Уксусный ангидрид (70 мкл, 0,7 ммоль) добавляют по каплям к раствору трет-бутил -β-этил-β-гидрокси-γ- (8-гидроксиметил-9-оксо(11H)-индолизино [1,2-b] хинолин-7-ил)-пропионата (200 мг, 0,46 ммоль) и тpиэтилaминa (140 мкл, 1 ммоль) в дихлорметане (5 мл) и полученную смесь перемешивают при температуре окружающей среды в течение 21 часа. Летучие компоненты выпаривают и остаток очищают колоночной хроматографией на силикагеле (1-2% MeOH/CH2Cl2) с получением 152 мг целевого соединения в форме желтого твердого вещества, т. пл. 195-196oC.
1H-ЯМР (CDCl3): 0,88 (т, 3Н), 1,32 (с, 9Н), 1,93 (м, 2H), 2,07 (с, 3Н), 2,97 (дд, 2H), 4,8 (се, 1H), 5,28 (с, 2H), 5,59 (дд, 2H), 7,39 (с, 1Н), 7,63 (т, 1H), 7,80 (т, 1H), 7,90 (д, 1H), 8,23 (д, 1H), 8,34 (с, 1H).
13C-ЯМР (CDCl3): 8,02; 21,06; 27,91; 35,05; 45,58; 50,16; 77,52; 82,26; 100,59; 124,59; 124,21; 127,91; 128,10; 128,14; 128,97; 129,18; 130,68; 131,46; 142,85; 148,29; 152,43; 158,49; 161,83; 171,13; 171,90.
Пример 9: 5,12-диэтил-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7]-индолизино [1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают способом, аналогичным примеру 1, за исключением того, что в стадии 1.а. вместо камптотецина используют 7-этил-камптотецин (Sawada et al., Chem. Pharm. Bull. 39:2574 (1991)). Целевое соединение получают в форме ярко-желтого твердого вещества, т. пл. > 270oC.
1H-ЯМР (ДМСО): 0,92 (т, 3Н), 1,39 (т, 3Н), 1,93 (к, 2Н), 3,08 (д, 2Н), 3,25 (к, 2Н), 3,51 (д, 2Н), 5,32 (с, 2Н), 5,52 (дд, 2Н), 7,42 (с, 1Н), 7,76 (т, 1Н), 7,89 (т, 1Н), 8,18 (д, 1Н), 8,32 (д, 1Н).
13C-ЯМР (ДМСО): 8,46; 14,15; 22,42; 36,50; 42,54; 49,95; 61,45; 73,35; 99,68; 122,61; 124,27; 126,76; 127,70; 128,27; 129,27; 129,92; 130,18; 145,17; 145,82; 148,57; 152,15; 155,89; 159,26; 172,08.
Пример 10: -β-этил-γ- (12-этил-8-гидроксиметил-9-оксо(11H)-индолизино[1,2-b]хинолин-7-ил) -β- гидроксипропионовая кислота
Это соединение получают способом, аналогичным примеру 4, за исключением того, что 5,12-диэтил-4,5-дигидро-5-гидрокси-1Н- оксепино[3',4':6,7]-индолизино[1,2-b] хинолин-3,15(4Н, 13Н)-дион используют вместо 5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7]-индолизино [1,2-b]хинолин-3,15(4Н, 13Н)-диона.
Его получают в форме твердого вещества слегка нестандартного белого цвета, т. пл. 238-239oC.
1H-ЯМР (ДМСО): 0,82 (т, 3Н), 1,35 (т, 3Н), 2,01 (м, 2Н), 2,85 (д, 2Н), 3,18 (д, 2Н), 3,22 (к, 2Н), 4,81 (с, 2Н), 5,00 (се, 1Н), 5,24 (с, 2Н), 5,78 (се, 1Н), 7,38 (с, 1Н), 7,77 (т, 1Н), 7,86 (т, 1Н), 8,18 (д, 1Н), 8,28 (д, 1Н), 12,10 (се, 1Н).
13C-ЯМР (ДМСО): 8,12; 14,15; 22,41; 34,78; 46,74; 49,65; 55,71; 76,51; 100,04; 124,22; 126,63; 127,48; 128,12; 128,21; 129,94; 130,02; 143,10; 148,69; 152,62; 156,03; 161,22; 172,22.
Пример 11: 8-этил-2,3,8,9-тетрагидро-8-гидркси-10Н-[1,4] диоксино[2,3-g] оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-10,13(15Н)-дион
11.a. 2-этил-2-(2-метокси-4-пиридил)-1,3-диоксалан
Воду дистиллируют азеотропно в течение ночи с применением аппарата Dean-Stark из смеси 2-хлор-4-пропионилпиридина (10 г, 59 ммоль) (полученного, как в Lamattina. J. L. J. Heterocyclic Chem. 20, p.553 (1983)), этиленгликоля и п-толуолсульфокислоты (250 мг) в толуоле (150 мл). Затем растворитель удаляют при пониженном давлении, кислоту нейтрализуют насыщенным водным бикарбонатом (100 мл) и продукт экстрагируют эфиром. Объединенные эфирные экстракты промывают солевым раствором, сушат на сульфате натрия и выпаривают, что дает 13,3 г (96%) неочищенного продукта, защищенного карбонильной группой, который нагревают с обратным холодильником с 3 эквивалентами метоксида натрия в ацетонитриле до завершения реакции (контролируемой тонкослойной хроматографией; SiO2, трет-бутил-метилоксид/гексан (ТВМО/НХ) 50/50). Затем раствор в ацетонитриле фильтруют и выпаривают. Остаток извлекают в эфире, промывают водой и солевым раствором, сушат на сульфате натрия и выпаривают с получением коричневого масла, которое перегоняют (70-75oC, 0,04 мбар); 10,7 г (общий выход 81%) продукта (F) извлекают в форме прозрачной жидкости.
11.б. 2-этил-2-(3-гидроксиметил-2-метокси-4-пиридил)-1,3-диоксолан (G)
Трет-бутиллитий (1,7 М в пентане, 100 мл, 170 ммоль) добавляют по каплям при помощи канюли к раствору броммезитилена (13 мл, 85 ммоль) в безводном тетрагидрофуране (300 мл) при -78oC в атмосфере аргона. Полученный белый осадок перемешивают при -78oC в течение 1 часа, затем добавляют 2-этил-2-(2-метокси-4-пиридил)-1,3-диоксолан (10 г, 44,8 ммоль) и реакционную смесь перемешивают в течение 15 минут при -78oC, в течение 1 часа при 0oC и в течение 1 часа при температуре окружающей среды. После еще одного охлаждения до -78oC добавляют безводный N,N-диметилформамид (100 ммоль) и реакционную смесь оставляют для нагревания до температуры окружающей среды, затем перемешивают в течение 16 часов, после чего проводят анализ тонкослойной хроматографией (SiO2 ТВМО/НХ 50/50), для подтверждения полного потребления исходного соединения. Реакцию останавливают насыщенным раствором хлорида аммония и реакционную смесь экстрагируют диэтиловым эфиром (200 мл, 50 мл, 50 мл). Объединенные экстракты сушат на сульфате натрия и выпаривают с получением желтого масла, которое очищают колоночной хроматографией (SiO2, ТВМО/НХ: 0/100 - 5/95 для элюции производных мезитилена, затем 20/80 - 50/50 для элюции продукта) с получением промежуточного альдегида (7 г). Альдегид растворяют в метаноле (100 мл) и обрабатывают боргидридом натрия (5 г, 132 ммоль) и полученную смесь перемешивают до полного потребления промежуточного альдегида (около 1 часа) согласно аналитическому определению при помощи тонкослойной хроматографии. Затем растворитель выпаривают, остаток извлекают в эфир, промывают водой и солевым раствором и растворитель выпаривают. Колоночная хроматография (SiO2, ТВМО/НХ 10/90 - 50/50) остатка дает 7 г (общий выход 62%) продукта (G) в форме желтого масла.
11.с. 2-(3-бензилоксиметил-2-метокси-4-пиридил)-2-этил-1,3- доксолан (H)
Раствор 2-этил-2-(3-гидроксиметил-2-метокси-4-пиридил)-1,3- диоксолана (7 г, 30 ммоль) и бензилхлорида (5 мл, 45 ммоль) в безводном тетрагидрофуране (150 мл) добавляют по каплям к суспензии гидрида натрия (80% в минеральном масле, 1,85 г, 61 ммоль) в безводном тетрагидрофуране (100 мл) и реакционную смесь нагревают с обратным холодильником в течение 16 часов. Затем реакционную смесь оставляют для охлаждения до температуры окружающей среды, реакцию останавливают водой (50 мл) и реакционную смесь концентрируют при пониженном давлении. Остаток растворяют в диэтиловом эфире (150 мл) и промывают водой и солевым раствором, сушат и выпаривают. Очистка колоночной хроматографией (SiO2, ТВМО/НХ; 5/95 -20/80) дает продукт, защищенный бензилом (H), 9 г (87%) в форме прозрачного масла.
11.d. 1-(3-бензилоксиметил-2-метокси-4-пиридил)-пропан-1-он (I')
2-(3-бензилоксиметил-2-метокси-4-пиридил)-2-этил-1,3-диоксолан (9 г, 27 ммоль) обрабатывают трифторуксусной кислотой (10 мл) и водой (5 мл) в бане с температурой 120oC в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении и оставшиеся следы кислоты нейтрализуют добавлением насыщенного водного бикарбоната натрия. Экстракция эфиром с последующей колоночной хроматографией (SiO2, ТВМО/НХ; 10/90) приводит к получению 5,5 г (70%) продукта (I).
11. e. трет-бутил -β-этил-β-гидрокси-γ- (3-бензилоксиметил-2-метокси-4-пиpидил) пропионат
Трет-бутилбромацетат (13 мл, 80 ммоль) добавляют по каплям к суспензии цинка (5,3 г, 80 ммоль, активированной обработкой 6 н. HCl в течение 10 секунд, с последующим промыванием водой до нейтрального pH, ацетоном и диэтиловым эфиром) в безводном тетрагидрофуране (60 мл) при нагревании с обратным холодильником. Реакционную среду поддерживают при нагревании с обратным холодильником еще в течение 10 минут, после чего добавление заканчивают. Добавляют раствор 1-(3-бензилоксиметил-2-метокси-4-пиридил)-пропан-1-она (5,8 г, 20 ммоль) в безводном тетрагидрофуране (20 мл) и реакционную смесь перемешивают при нагревании с обратным холодильником еще в течение 1 часа. Реакцию останавливают при 0oC насыщенным водным хлоридом аммония (100 мл) и реакционную смесь экстрагируют диэтиловым эфиром. Объединенные экстракты сушат на сульфате натрия и выпаривают с получением желтого масла, которое очищают колоночной хроматографией (SiO2, ТВМО/НХ; 5/95 - 10/90) с получением трет-бутилового эфира (J) (7 г, 95%) в форме прозрачного масла.
11. f. трет-бутил -β-этил-β-гидрокси-γ- (3-гидроксиметил-2-метокси-4-пиридил)-пропионат
Трет-бутил -β-этил-β-гидрокси-γ- (3-бензилоксиметил-2-метокси-4-пиридил)пропионат (1 г, 2,5 ммоль)гидрогенолизируют при атмосферном давлении и при температуре окружающей среды с применением 5% палладия на древесном угле в качестве катализатора (50 мг) и абсолютного спирта в качестве растворителя (10 мл). Как только реакция завершается (6 часов), катализатор отделяют фильтрованием и растворитель выпаривают с получением 0,7 г (90%) продукта (K) достаточной чистоты для последующего использования в синтезе.
11. g. 5-этил-1,5-дигидро-5-гидрокси-9-метоксиоксепино [3,4-c]пиридин-3-(4Н)-он (L)
Трет-бутил- -β-этил-β-гидрокси-γ- (3-гидроксиметил-2-метокси-4-пиридил)пропионат (8,8 г, 28 ммоль) обрабатывают трифторуксусной кислотой (30 мл) в течение 3 часов при температуре окружающей среды. Летучие компоненты выпаривают и остаток очищают колоночной хроматографией (SiO2, CH2Cl2/MeOH; 100/0 - 98/2) с получением прозрачного масла, которое после обработки толуолом дает 5,9 г продукта (L) (89%) в форме белых кристаллов, т. пл. 97oC.
11. h. 5-этил-1,5-дигидро-5-гидрокси-оксепино[3,4-c] пиридин-3,9(4Н, 8Н)-дион (М)
1 н. соляную кислоту (20 мл), 5-этил-1,5-дигидро-5-гидрокси-9-метоксиоксепино[3,4-с]пиридин-3(4Н)-он (0,5 г, 2,1 ммоль) нагревают с обратным холодильником в течение 9 часов. Реакционную смесь концентрируют под давлением и остаток опять сушат путем добавления и выпаривания толуола, два раза, затем оставляют на ночь при пониженном давлении в присутствии пентоксида фосфора. Полученное масло растворяют в безводном ацетонитриле (5 мл) и перемешивают в атмосфере аргона в течение 24 часов. Осадок отфильтровывают и сушат с получением 0,23 г (49%) белого твердого вещества (М), т.пл. 118-119oC.
11.i. 6,7-этилендиокси-2-иод-3-хинолинметанол (N)
Используют способы, описанные Meth-Cohn et al., J. Chem. Soc. Perkin Trans. I, p.1520 (1981); Meth-Cohn et al., J. Chem. Soc. Perkin Trans. I, p. 2509 (1981) и Nakasimhan et al., J. Am. Chem. Soc., 112, p.4431 (1990). Добавляют 3,4-этилендиоксиацетанилид (22 г, 113 мл) к реагенту Вилсмейера, полученному добавлением по каплям фосфорилоксихлорида (71 мл, 0,77 ммоль) к безводному диметилформамиду (23 мл, 0,28 ммоль), охлаждают на бане со смесью воды со льдом еще в течение 0,5 часа в атмосфере аргона. Полученную смесь нагревают до 75oC в течение 16 часов. После охлаждения до температуры окружающей среды реакционную смесь добавляют к смеси воды со льдом (300 мл) и экстрагируют дихлорметаном (5 х 200 мл). Объединенные органические экстракты сушат на сульфате натрия, фильтруют и концентрируют. Твердый остаток помещают в суспензию в дихлорметане (20 мл), фильтруют и сушат при пониженном давлении с получением 10 г (35%) 2-хлор-6,7-этилендиоксихинолин-3-карбальдегида в форме желтого твердого вещества, т. пл. 222-224oC. Это промежуточное соединение обрабатывают иодидом натрия (30 г, 0,2 моль) и концентрированной хлористоводородной кислотой (1,5 мл) в ацетонитриле при нагревании с обратным холодильником (150 мл) в течение 24 часов. После охлаждения до температуры окружающей среды растворитель удаляют при пониженном давлении и осадок извлекают в 50%-ный водный тетрагидрофуран (200 мл), фильтруют, промывают тетрагидрофураном и сушат при пониженном давлении с получением 12 г 6,7-диоксиэтилен-2-иодхинолин-3-карбальдегида в форме желтого твердого вещества, т. пл. 155-157oC. Это промежуточное соединение обрабатывают боргидридом натрия (2 г, 52 ммоль) в метаноле (200 мл) при температуре окружающей среды в течение 0,5 часов. Растворитель удаляют при пониженном давлении и остаток извлекают в воду и отфильтровывают. Полученное твердое вещество сушат при пониженном давлении в присутствии пентоксида фосфора с получением 11 г (6,7-этилендиокси-2-иодхинолин-3-ил)-метанола в форме желтого твердого вещества, т. пл. 178-180oC.
11. j. 5-этил-8-(6,7-диоксиэтилен-2-иод-3-хинолинметил)-1,5- дигидро-5-гидроксиоксепино[3,4-c]пиридин-3,9(4Н,8Н)-дион (О)
На протяжении 5 минут диэтилазокарбоксилат (570 мкл, 3,6 ммоль) добавляют по каплям к раствору 5-этил-1,5-дигидро-5- гидроксиоксепино[3,4-c]пиридин-3,9(4Н, 8Н)-диона (400 мг, 1,79 ммоль), соединения, полученного в предыдущей стадии 11. i. (770 мг, 2,23 ммоль), и трифенилфосфина (934 мг, 3,58 ммоль) в смеси безводного ТГФ/ДМСО (8/1 об./об., 45 мл) и реакционную смесь перемешивают в атмосфере аргона при температуре окружающей среды в течение 16 часов. Затем реакционную смесь концентрируют при пониженном давлении и остаток растворяют в хлороформе (100 мл). Полученный раствор промывают солевым раствором (4 х 50 мл), сушат на сульфате натрия и выпаривают. Остаток очищают колоночной хроматографией (SiO2, CH2Cl/MeOH; 99/1-98/2) с получением 650 мг (66%) продукта (О) в форме белого твердого вещества, т. пл. 165-167oC.
11. k. 8-этил-2,3,8,9-тетрагидро-8-гидрокси-10Н, 12Н-[1,4] диоксино [2,3-g]оксепино[3',4':6,7]индолизино[1,2-b]хинолин-10,13-(15Н)-дион
5-этил-8-(6,7-этилендиокси-2-иодхинолин-3-ил)метил-4,5-дигидро-5- гидрокси-(1H,3Н)оксепино[3,4-c]пиридин-3-дион (600 мг, 1,1 ммоль), тетрабутиламмонийбромид (352 мг, 1,1 ммоль), ацетат натрия (359 мг, 4,4 ммоль) и ацетат палладия II (98 мг, 0,43 ммоль) растворяют в безводном ацетонитриле (40 мл) и нагревают до 90oC в атмосфере аргона в течение 16 часов. После охлаждения до температуры окружающей среды белый осадок отделяют от красноватого раствора. Этот осадок отфильтровывают и сушат при пониженном давлении. Неочищенный продукт суспендируют в воде, фильтруют и сушат при пониженном давлении на пентоксиде фосфора с получением 250 мг целевого соединения в форме прозрачного желтого твердого вещества, т. пл. > 250oC.
1H-ЯМР(ДМСО): 0,91 (т, 3Н), 1,87 (м, 2Н), 3,08 (д, 1Н), 3,51 (д, 1Н), 4,45 (с, 2Н), 5,19 (с, 2Н), 5,47 (дд, 2Н), 6,02 (се, 1Н), 7,33 (с, 1Н), 7,54 (с, 1Н), 7,55 (с, 1Н), 8,43 (с, 1Н).
13C-ЯМР (ДМСО): 8,43; 36,47; 42,54; 50,52; 61,43; 64,43; 73,31; 99,07; 112,27; 113,14; 122,00; 124,24; 128,18; 129,74; 144,59; 145,01; 145,33; 147,63; 150,88; 155,88; 159,23; 172,07.
Пример 12: 10-бензилокси-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]- индолизино[1,2-b]хинолин-3,15-(4H,13H)-дион
12.a. (6-бензилокси-2-иод-3-хинолин)-метанол
Это соединение получают по способу, аналогичному описанному в стадии 11. i. примера 11, но с использованием 4-бензилоксиацетанилида вместо 3,4-этилендиоксиацетанилида. Очистка колоночной хроматографией на силикагеле и использование дихлорметана в качестве элюента необходимы для выделения (с выходом 8%) достаточно чистого промежуточного 6-бензилокси-2-хлорхинолин-3-карбальдегида, т. пл. 180-182oC. Затем замена последующего восстановления галогена на боргидрид натрия приводит к получению (6-бензилокси-2-иодхинолин-3-ил)-метанола, т. пл. 147-149oC.
12. b. 8-(6-бензилокси-2-иод-3-хинолинметил)-1,5- дигидрокси-5-этил-5-гидроксиоксепино[3,4-c]пиридин-3,9(4Н,8Н)-дион
Это соединение получают согласно способу описанному в стадии 11.j. примера 11, но с использованием (6-бензилокси-2-иодхинолин-3-ил)метанола вместо (6,7-этилендиокси-2-иодхинолин-3-ил) метанола. Соединение получают в форме белого твердого вещества, т. пл. 197-199oC.
12.с. 10-бензилокси-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7] - индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
Это соединение получают по способу, аналогичному указанному в стадии 11. k. примера 11, но с использованием 8-(6-бензилокси-2-иод-3-хинолинметил)-1,5-дигидрокси-5-этил-5-гидроксиоксепино [3,4-c] пиридин-3,9(4Н, 8Н)-диона вместо 5-этил-8-(6,7-этилендиокси-2-иодхинолин- 3-ил)метил-4,5-дигидро-5-гидрокси-(1Н,3Н)оксепино [3,4-c]пиридин-3-диона. Целевое соединение образуется в форме прозрачного желтого твердого вещества, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,90 (т, 3Н), 1,85 (м, 2Н), 3,08 (д, 1Н), 3,50 (д, 1Н), 5,25 (с, 2Н), 5,30 (с, 2Н), 5,50 (дд, 2Н), 6,05 (с, 1Н), 7,30-7,70 (м, 8Н), 8,10 (д, 1Н), 8,55 (с, 1Н).
13C-ЯМР (ДМСО): 8,43; 36,48; 38,28; 50,65; 61,42; 70,00; 73,32; 99,05; 107,71; 122,05; 123,42; 128,18; 128,26; 128,70; 129,40; 130,19; 130,48; 130,63; 136,65; 144,18; 144,90; 150,53; 155,91; 157,31; 159,24; 172,06.
Пример 13: γ- (12-бензилокси-8-гидроксиметил-9-оксо(11H)-индолизино- [1,2-b]хинолин-7-ил) -β-этил-β- гидроксипропионовая кислота (E)
Это соединение получают способом, аналогичным описанному в примере 4, но с использованием 10-бензилокси-5-этил-4,5-дигидро-5- гидрокси-1Н-оксепино[3', 4': 6,7] индолизино[1,2-b] хинолин-3,15(4Н,13Н)-диона вместо 5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] индолизино [1,2-b]хинолин-3,15(4Н, 13Н)-диона. Его получают в форме желтого твердого вещества, т. пл. 171-173oC.
1H-ЯМР (ДМСО): 0,80 (т, 3Н), 2,00 (м, 2Н), 2,85 (д, 1Н), 3,15 (д, 1Н), 4,80 (с, 2Н), 5,25 (с, 2Н), 5,30 (с, 2Н), 5,75 (се, 1Н), 7,30 (с, 1Н), 7,35-7,70 (м, 7Н),8,10 (д, 1Н), 8,55(с, 1Н).
13C-ЯМР (ДМСО): 8,11; 34,75; 46,68; 50,35; 55,70; 69,97; 76,51; 99,45; 107,78; 123,28; 127,64; 128,18 (2C); 128,26; 128,70 (2C); 129,33; 130,17; 130,47; 130,57; 136,69; 142,79; 144,17; 150,93; 156,03; 157,19; 161,20.
Пример 14: 5-этил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино[3',4':6,7]-индолизино [1,2-b]хинолин-3,15-(4H,13H)-дион
10-бензилокси-5-этил-4,5-дигидро-5-гидрокси-1Н- оксепино[3',4':6,7]-индолизино[1,2-b] хинолин-3,15-(4Н, 13Н)-дион (370 мг, 0,79 ммоль) обрабатывают водородом при атмосферном давлении и при температуре окружающей среды с применением 10% палладия на древесном угле в качестве катализатора (60 мг) и трифторуксусной кислоты в качестве растворителя (15 мл). По завершении реакции (16 часов) к реакционной смеси добавляют дихлорметан (50 мл) и метанол (50 мл), катализатор отфильтровывают и летучие компоненты выпаривают при пониженном давлении, что позволяет получить неочищенную форму целевого соединения, содержащую следы трифторуксусной кислоты. Эти следы удаляют ко-дистилляцией с 1,4-диоксаном. Продукт получают в форме оранжевого твердого вещества, т. пл. 150oC (разл.), с чистотой, достаточной для дальнейшего использования в синтезе.
1H-ЯМР (ДМСО): 0,89 (т,3Н), 1,85 (к, 2Н), 3,02 (д, 1Н), 3,45 (д, 1Н), 5,19 (с, 2Н), 5,37 (д, 1Н), 5,50 (д, 1Н), 5,98 (се, 1Н), 7,26 (с, 1Н), 7,31 (с, 1Н), 7,40 (д, 1Н), 8,00 (д, 1Н), 8,42 (с, 1Н), 10,32 (с, 1Н).
1C-ЯМР (ДМСО): 8,47; 36,50; 42,61; 50,57; 61,46; 73,35; 98,84; 109,02; 121,83; 123,18; 129,50; 129,85; 130,12; 130,80; 143,39; 145,10; 149,69; 155,97; 159,30; 172,11.
Пример 15: 11-(диметиламино)метил- 5-этил-4,5-дигидро-5,10-дигидрокси-1Н- оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
15. a. 11-(диметиламино)-5-этил-4,5-дигидро-5,10- дигидрокси-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Суспензию 10-бензилокси-5-этил- 4,5-дигидро-5-гидрокси-1Н-оксепино [3', 4': 6,7]-индолизино[1,2-b]хинолин-3,15-(4Н,13Н)-диона (260 мг, 0,69 ммоль) в уксусной кислоте (15 мл) обрабатывают 37%-ным водным формальдегидом (500 мкл) и 40%-ным водным диметиламином (500 мкл) и полученную смесь перемешивают при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрируют досуха и остаток очищают колоночной хроматографией (SiO2, CH2Cl2/MeOH; 100/0 - 90/10) с последующей кристаллизацией с ацетонитрилом с получением 102 мг целевого соединения.
15.b. Хлоргидрат 11-(диметиламино)метил-5-этил-4,5-дигидро-5,10- дигидрокси-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-диона
Разбавленную соляную кислоту (1 н. ) добавляют по каплям к суспензии 11-(диметиламино)метил-5-этил-4,5-дигидро-5,10-дигидрокси-1Н- оксепино[3', 4': 6,7] индолизино[1,2-b]хинолин-3,15(4H,13H)-диона (105 мг) в воде до полного растворения. Воду выпаривают при пониженном давлении и остаток суспендируют в ацетонитриле (5 мл) и отфильтровывают с получением 103 мг целевой соли, т. пл. 248oC (разл.).
1H-ЯМР (ДМСО): 0,88 (т, 3Н), 1,85 (м, 2Н), 2,84 (с, 6Н), 3,08 (д, 1Н), 3,5 (д, 1Н), 4,73 (с, 2Н), 5,47 (дд, 2Н), 7,33 (с, 1H), 7,38 (с, 1H), 7,72 (д, 1Н), 8,19 (д, 1H), 8,99 (с, 1H), 9,92 (се, 1H), 11,45 (с, 1H).
13C-ЯМР (ДМСО): 8,46; 34,36; 42,44 (3C); 50,61 (2C); 61,42; 73,35; 99,19; 108,63; 122,21; 122,36; 126,86; 129,13; 130,61; 133,09; 143,53; 144,70; 149,76; 155,98; 157,17; 159,27; 172,06.
Пример 16: 5-этил-фтор-4,5-дигидро-5-гидрокси-10-метокси-1H-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
Это соединение получают из 3-фтор-4-метоксианилина согласно способу, иллюстрируемому стадиями 11. i, 11. j, и 11.k примера 11. Получают желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,89 (т, 3Н), 1,85 (к, 2Н), 3,08 (д, 1H), 3,49 (д, 1H), 4,00 (с, 3Н), 5,25 (с, 2Н), 5,39 (д, 1Н), 5,51 (д, 1H), 6,00 (с, 1H), 7,32 (с, 1H), 7,72 (д, 1H), 7,91 (д, 1H), 8,58 (с, 1H).
13C-ЯМР (ДМСО): 8,43; 36,48; 42,51; 50,68; 56,60; 61,42; 73,29; 99,25; 108,68; 113,52; 122,23; 126,33; 129,99; 130,30; 143,79; 144,70; 148,42; 151,18; 153,19; 155,19; 159,20; 172,06.
ИК (KBr): 1259; 1503; 1602; 1737.
Пример 17: 9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метил-1H-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
Это соединение получают из 3-хлор-4-метоксианилина согласно способу, иллюстрируемому стадиями 11.i, 11.j, и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 2,55 (с, 3Н), 3,07 (д, 1Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 5.25 (с, 2Н), 5,39 (д, 1Н), 5,51 (д, 1Н), 6,05 (с, 1н), 7,39 (с, 1Н), 8,10 (с, 1Н), 8,20 (с, 1Н), 8,60 (с, 1Н).
13C-ЯМР (ДМСО): 8,43; 20,20; 36,47; 42,49; 50,67; 61,41; 73,28; 99,87; 122,82; 126,98; 127,99; 129,60; 130,53; 131,08; 135,64; 136,56; 144,39; 147,11; 153,10; 155,85; 159,18; 172,03.
ИК (KBr): 1208; 1479; 1606; 1656; 1724.
Пример 18: 5-этил-9,10-дифтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4': 6,7]индолизино [1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 3,4-дифторанилина согласно способу, иллюстрируемому стадиями 11.i, 11.j, и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,47 (д, 1Н), 5,25 (с, 2Н), 5,39 (д, 1Н), 5,51 (д, 1Н), 6,05 (с, 1Н), 7,39 (с, 1Н), 8,15 (к, 1Н), 8,25 (к, 1Н), 8,68 (к, 1Н).
13C-ЯМР (ДМСО): 8,41; 36,45; 42,48; 50,68; 61,40; 73,25; 99,92; 114,14; 115,58; 122,96; 130,56; 131,46; 144,21; 145,25; 142,36; 153,41; 155,85; 159,16; 172,00.
ИК (KBr): 1266; 1512; 1581; 1618; 1751.
Пример 19: 7-этил-7,8-дигидро-7-гидрокси-9Н, 11Н-[1,3] диоксоло[4,5-g] оксепино[3',4':6,7]индолизино[1,4-b]хинолин-9,12(14H)-дион
Это соединение получают из 3,4-метилендиксианилина согласно способу, иллюстрируемому стадиями 11.i, 11.j, и 11.k примера 11. Бежевое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 5,20 (с, 2Н), 5,39 (д, 1Н), 5,51 (д, 1Н), 6,00 (с, 1Н), 6,30 (с, 1Н), 7,30 (с, 1Н), 7,49 (д, 2Н), 8,45 (с, 1Н).
13C-ЯМР (ДМСО): 8,43; 36,49; 42,56; 50,58; 61,42; 73,31; 98,87; 102,75; 103,33; 104,92; 121,76; 125,74; 128,59; 130,33; 145,08; 146,69; 148,78; 150,19; 151,49; 155,90; 159,24; 172,08.
ИК (KBr): 1248; 1459; 1606; 1731.
Пример 20: 9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 3-хлор-4-метоксианилина согласно способу, иллюстрируемому стадиями 11.i, 11.j, и 11.k примера 11. Белое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 4,01 (с, 3Н), 5,22 (с, 2Н), 5,39 (д, 1Н), 5,51 (д, 1Н), 6,02 (с, 1Н), 7,31 (с, 1Н), 7,68 (с, 1Н), 8,20 (с, 1Н), 8,55 (с, 1Н).
13C-ЯМР (ДМСО): 8,82; 36,27; 42,30; 50,48; 56,69; 61,23; 73,08; 99,16; 107,44; 122,16; 127,12; 128,12; 128,25; 130,02; 130,53; 143,29; 144,37; 151,12; 153,29; 155,71; 158,98; 171,84.
ИК(KBr): 1056; 1256; 1483; 1592; 1657; 1747.
Пример 21: 5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3',4': 6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 4-метоксианилина согласно способу, иллюстрируемому стадиями 11.1, 11.j, и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 3,95 (с, 3Н), 5,28 (с, 2Н), 5,40 (д, 1Н), 5,51 (д, 1Н), 6,00 (с, 1Н), 7,38 (с, 1Н), 7,51 (д, 2Н), 8,07 (д, 1Н), 8,55 (с, 1Н).
13C-ЯМР (ДМСО): 8,45; 36,48; 42,51; 50,64; 55,92; 61,42; 73,33; 99,01; 106,49; 122,02; 123,19; 129,59; 130,20; 130,43; 144,17; 144,94; 150,40; 155,92; 158,31; 159,26; 172,07.
ИК(KBr): 1251; 1604; 1655; 1735.
Пример 22: 9,11-дихлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино [3',4': 6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 3,5-дихлоранилина согласно способу, иллюстрируемому стадиями 11.i, 11.j, и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1H), 5,30 (c, 2H), 5,41 (д, 1H), 5,55 (д, 1H), 6,08 (c, 1H), 7,41 (c, 1H), 8,05 (c, 1H), 8,21 (с, 1H), 8,91 (c, 1H).
13C-ЯМР (ДМСО): 8,39; 36,45; 42,51; 51,03; 61,39; 73,25; 100,62; 123,55; 124,63; 127,60; 128,08; 128,56; 132,06; 132,19; 134,53; 143,77; 148,80; 154,88; 155,82; 159,13; 171,98.
ИК(KBr): 1064; 1275; 1586; 1651; 1743.
Пример 23: 5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-1Н-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
Это соединение получают из 3-фтор-4-метиланилина согласно способу, иллюстрируемому стадиями 11. i, 11.j, и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,89 (т, 3Н), 1,85 (к, 2H), 2,49 (с, 3Н), 3,08 (д, 1H), 3,49 (д, 1Н), 5,21 (с, 2H), 5,39 (д, 1H), 5,51 (д, 1H), 6,05 (с, 1Н), 7,39 (с, 1Н), 7,87 (д, 1H), 8,05 (д, 1H), 8,61 (с, 1H).
13C-ЯМР (ДМСО): 8,40; 15,14; 36,45; 42,52; 50,60; 61,41; 73,28; 99,71; 112,00; 122,66; 125,38; 127,66; 129,59; 130,28; 144,49; 147,88; 152,88; 155,85; 159,18; 162,25; 172,02.
ИК(KBr): 1054; 1580; 1651; 1760.
Пример 24: 5-этил-10-фтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7] индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 4-фторанилина согласно способу, иллюстрируемому стадиями 11.i, 11.j и 11.k примера 11. Белое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 5,29 (с, 2Н), 5,39 (д, 1Н), 5,55 (д, 1Н), 6,30 (с, 1Н), 7,39 (с, 1Н), 7,80 (к, 1Н), 7,99 (к, 1Н), 8,23 (к, 1Н), 8,68 (с, 1Н).
13C-ЯМР (ДМСО): 8,40; 36,46; 42,48; 50,66; 61,41; 73,31; 99,68; 111,83; 122,75; 128,93; 130,93; 131,22; 131,93; 144,46; 145,27; 152,60; 155,89; 159,21; 172,04.
ИК (KBr): 1209; 1589; 1659; 1739.
Пример 25: 10-хлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7] индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Это соединение получают из 4-хлоранилина согласно способу, иллюстрируемому стадиями 11.i, 11.j и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,47 (д, 1Н), 5,25 (с, 2Н), 5,39 (д, 1Н), 6,05 (с, 1Н), 7,39 (с, 1Н), 7,89 (д, 1Н), 8,19 (д, 1Н), 8,29 (с, 1Н), 8,67 (с, 1Н).
13C-ЯМР (ДМСО): 8,40; 36,46; 42,48; 50,70; 61,42; 73,31; 100,00; 122,96; 127,31; 127,42; 128,87; 131,11; 132,12; 144,34; 146,53; 153,38; 155,88; 159,20; 172,04.
ИК(KBr): 1069; 1483; 1606; 1741.
Пример 26: 10-хлор-5-этил-9-фтор-4,5-дигидро-5-гидрокси- 1H-оксепино[3', 4':6,7]индолизино[1,2-b]хинолин-3,15 (4Н,13Н)-дион
Это соединение получают из 4-хлор-3-фторанилина согласно способу, иллюстрируемому стадиями 11.i, 11.j и 11.k примера 11. Желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,85 (к, 2Н), 3,07 (д, 1Н), 3,45 (д, 1Н), 5,25 (с, 2Н), 5,39 (д, 1Н), 5,61 (д, 1Н), 6,05 (с, 1Н), 7,40 (с, 1Н), 8,20 (д, 1Н), 8,40 (д, 1Н), 8,68 (с, 1Н).
13C-ЯМР (ДМСО): 8,38; 36,47; 42,58; 50,71; 61,40; 73,26; 99,99; 133,59; 123,09; 124,28; 127,74; 130,64; 131,31; 144,13; 145,08; 153,57; 154,13; 155,84; 159,14; 172,00.
ИК(KBr): 1488; 1583; 1655; 1743.
Пример 27: 5,12-диэтил-4,5-дигидро-5,10-дигидрокси-11- морфолинометил-1H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H) -дион
Это соединение получают из морфолина согласно способу, иллюстрируемому в примере 15а. Белое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,85 (т, 3Н), 1,87 (к, 2Н), 2,53 (с, 4H), 3,03 (д, 1Н), 3,45 (д, 1Н), 3,57 (с, 4H), 4,02 (c, 2Н), 5,01 (с, 2Н), 5,38 (д, 1Н), 5,52 (д, 1Н), 6,0 (се, 1Н), 7,30 (с, 1Н), 7,42 (д, 1Н), 7,95 (д, 1Н), 8,82 (с, 1Н).
13C-ЯМР (ДМСО): 8,45; 3,49; 42,58; 53,04; 61,44; 66,33; 73,33; 98,81; 113,78; 121,81; 122,74; 126,80; 129,05; 129,91; 143,72; 145,07; 149,24; 155,06; 156,92; 159,28; 172,08.
ИК(KBr): 1515; 1595; 1654; 1736.
Пример 28: 5,12-диэтил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1Н- оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
28.а. 5-фтор-4-метокси-2-пропиониланилин
(Этот продукт получают согласно Sugasawa T; Toyoda T; Adacji М; Saskura K, J. Am. Chem. Soc., 100 (1978), p.4842-4852). Раствор 3-фтор-4- метоксианилина (20 т, 142 ммоль) в безводном дихлорметане (200 мл) в атмосфере аргона и при 0oC добавляют по каплям к трихлориду бора (1М в гептане, 156 мл, 156 ммоль). Полученную таким образом розовую суспензию выдерживают при перемешивании в течение 5 минут. Затем добавляют по каплям маленькими порциями пропионитрил (33 мл, 420 ммоль) и затем трихлорид алюминия (20,9 г, 156 ммоль). Реакционную среду нагревают с обратным холодильником в течение 3 часов, охлаждают при 0oC, гидролизуют осторожным добавлением 2 н. соляной кислоты (100 мл), затем кипятят с обратным холодильником в течение 45 минут. После охлаждения до 0oC получают осадок, который затем фильтруют, промывают дихлорметаном, затем извлекают в воду (300 мл). Водную фазу подщелачивают до щелочного pH, экстрагируют дихлорметаном и затем этилацетатом. Органическую фазу сушат (MgSO4), затем выпаривают с получением неочищенного продукта, который очищают колоночной хроматографией (SiO2, AcOEt/Hpt: 1/99-20/90). Получают 15,3 г желтого твердого вещества.
1H-ЯМР (CDCl3): 1,20 (т, 3Н), 2,92 (к, 2Н), 3,83 (с, 3Н), 6,2 (с, 2Н), 6,40 (д, 2Н), 7,32 (д, 2Н).
ИК(KBr): 857; 1148; 1240; 1583; 1662.
28.b. этил-4-этил-7-фтор-2-гидрокси-6-метокси-3-хинолин-карбоксилат
Раствор 5-фтор-4-метокси-2-пропиониланилина (15,3 г, 77,5 ммоль) и триэтиламина (13,9 мл, 100 ммоль) в безводном ацетонитриле (110 мл) в атмосфере аргона и при 0oC добавляют по каплям к раствору этилмалонилхлорида (12,9 мл, 100 ммоль) в безводном ацетонитриле (30 мл). Реакционную среду оставляют стоять для возвращения к температуре окружающей среды, добавляют раствор этилата натрия (полученный с 1,8 г, 78 ммоль натрия в 80 мл этанола), затем оставляют перемешиваться в течение 12 часов при температуре окружающей среды. Реакционную смесь выливают в смесь воды со льдом (100 мл) и перемешивают в течение 2 часов, затем осадок фильтруют и промывают водой, этанолом и эфиром. Получают 19,4 г белого твердого вещества.
1H-ЯМР (CDCl3): 1,25 (м, 6Н), 2,78 (к, 2Н), 3,92 (с, 3Н), 4,30 (к, 2Н), 7,15 (д, 2Н), 7,40 (д, 2Н), 11,93 (с, 1Н).
ИК (KBr): 786; 1083; 1410; 1521; 1644; 1725.
28.c. этил-2-хлор-4-этил-7-фтор-6-метокси-3-хинолинкарбоксилат
Суспензию этил-4-этил-7-фтор-2-гидрокси-6-метокси-3-хинолинкарбоксилата (19,4 г, 0,066 моль) в фосфорилхлориде (243 мл) нагревают с обратным холодильником в течение 6 часов. Фосфорилхлорид отгоняют. Реакционную смесь выливают в смесь воды со льдом, извлекают дихлорметаном для солюбилизации. Органическую фазу промывают водой, затем насыщенным раствором хлорида натрия. Органическую фазу сушат на сульфате магния и растворитель выпаривают. Остаток суспендируют в эфире и непревращенный исходный продукт (4 г) отфильтровывают. Фильтрат выпаривают и остаток очищают колоночной хроматографией, (SiO2, AcOEt/Hpt: 5/95-20/80). Получают 10,9 г белого твердого вещества.
1H-ЯМР (CDCl3): 1,30 (т, 3Н), 1,39 (т, 3Н), 3,08 (к, 2Н), 4,09 (с, 3Н), 4,49 (к, 2Н), 7,64 (д, 2Н), 7,86 (д, 2Н).
ИК(KBr): 865; 1016; 1082; 1190; 1224; 1253; 1272; 1508; 1571; 1732.
28.d. 2-хлор-4-этил-7-фтор-6-метокси-3-хинолинметанол
Раствор этил-2-хлор-4-этил-7-фтор-6-метокси-3-хинолинкарбоксилата (10,8 г, 35 ммоль) в безводном дихлорметане (200 мл) обрабатывают по каплям при температуре окружающей среды в атмосфере аргона диизобутилалюминийгидридом (1М в дихлорметане, 65 мл, 65 ммоль), затем нагревают до 40oC в течение 4 часов. Охлаждают до 0oC, осторожно добавляют 20%-ный водный раствор сегнетовой соли и дихлорметан (200 мл) и перемешивание продолжают в течение 1 часа. Декантируют, промывают три раза водой и сушат органическую фазу на сульфате магния и растворитель выпаривают. Остаток очищают колоночной хроматографией (SiO2, AcOEt/Hpt: 5/95 - 50/50). Получают 6 г белого твердого вещества.
1H-ЯМР (CDCl3): 1,28 (т, 3Н), 3,25 (к, 2Н), 4,04 (с, 3Н), 4,77 (д, 2Н), 5,27 (т, 1Н), 7,55 (д, 2Н), 7,73 (д, 2Н).
ИК(KBr): 840; 864; 1023; 1232; 1267; 1317; 1444; 1511; 1569.
28. e. 5,12-диэтил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
2-хлор-4-этил-7-фтор-6-метокси-3-хинолинметанол соединяют с соединением (М), как описано в стадии 11.j. примера 11. Полученный связанный продукт циклизуют согласно процедуре стадии 11.k. Получают желтое твердое вещество, т. пл. > 275oC.
1H-ЯМР (CF3COOD): 1,07 (м, 3Н), 1,62 (м, 3Н), 2,27 (м, 2Н), 3,44 (д, 1Н), 3,54 (м, 2Н), 3,91 (д, 1Н), 4,25 (с, 3Н), 5,60 (д, 1Н), 5,74 (с, 2Н), 5,98 (д 1Н), 7,85 (м, 1Н), 8,16 (м, 1Н), 8,31 (с, 1Н).
1C-ЯМР (CF3COOD): 9,03; 14,20; 26,68; 38,77; 43,98; 53,79; 58,27; 64,73; 77,93; 106,85; 110,15; 128,99; 131,61; 137,32; 141,23; 144,13; 154,79; 158,32; 160,25; 160,81; 179,30.
ИК(KBr): 1013; 1068; 1265; 1466; 1514; 1601; 1655; 1748.
Пример 29: 5-этил-4,5-дигидро-5-гидрокси-12-метил-1Н-оксепино[3',4':6, 7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
2-ацетиланилин используют в процедурах, описанных в примерах 28.b., 28. с. и 28. d. с получением 2-хлор-4-метил-3-хинолинметанола. Его связывают с соединением (M), как описано в стадии 11.j. примера 11. Полученный связанный продукт циклизуют согласно процедуре стадии 11.k. Получают желтое твердое вещество, т. пл. > 260oC.
1H-ЯМР (ДМСО): 0,87 (т, 3Н), 1,87 (к, 2Н), 2,78 (с, 3Н), 2,80 (д, 1Н), 3,55 (д, 1Н), 5,27 (с, 2Н), 5,42 (д, 1Н), 5,52 (д, 1Н), 6,04 (с, 1Н), 7,39 (с, 1Н), 7,75 (т, 1Н), 7,88 (т, 1Н), 8,13 (д, 1Н), 8,25 (д, 1Н).
13C-ЯМР (ДМСО): 8,23; 36,26; 42,36; 62,00; 73,11; 78,65; 79,13; 79,25; 99,52; 122,36; 124,30; 127,67; 129,54; 129,55; 129,56; 140,11; 145,06; 148,07; 152,00; 155,79; 171,89.
ИК(KBr): 1649; 1751; 3404.
Пример 30: 9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12- (4-метилпиперазинометил)-1H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15 (4Н, 13Н)-дион
30.a. 5-хлор-2-хлорацетил-4-метоксианилин
Этот продукт получают согласно Sugasawa T; Toyoda T; Adacji М; Saskura K, J. Am. Chem. Soc., 100 (1978), p. 4842-4852. Молярный раствор трихлорида бора в гексане (164 мл, 164 ммоль), хлорацетонитрила (11,4 мл, 180 ммоль) и молярный раствор диэтилалюминийхлорида в гексане (164 мл, 164 ммоль) добавляют по каплям последовательно к раствору 3-хлор-4-метоксианилина (23,6 г, 150 ммоль) в атмосфере инертного газа при 0oC. Реакционную среду нагревают с обратным холодильником в течение 1 часа, затем охлаждают до 0oC, гидролизуют осторожным добавлением 2 н. соляной кислоты (90 мл), затем нагревают с обратным холодильником в течение 1 часа. Среду опять охлаждают и добавляют концентрированный раствор бикарбоната натрия до pH 14. Раствор экстрагируют этилацетатом, органическую фазу промывают водой, затем водным раствором соли. Сушат на сульфате магния, фильтруют и выпаривают при пониженном давлении. Остаток извлекают в изопентан, декантируют, затем извлекают нерастворимый материал в минимальное количество изопропилового эфира и добавляют изопентан для осаждения продукта. Фильтруют и сушат под вакуумом. Получают 17,26 г коричневого твердого вещества.
1H-ЯМР (CDCl3): 3,82 (с, 3Н), 4,60 (c, 2Н), 6,11 (с, 2Н), 6,78 (с, 1Н), 7,11 (с, 1Н).
30.b. этил-7-хлор-4-хлорметил-2-гидрокси-6-метокси-3-хинолинкарбоксилат
Этилмалонил хлорид (17 мл, 131 ммоль) добавляют по каплям к раствору 5-хлор-2-хлорацетил-4-метоксианилина (17 г, 73 ммоль) и триэтиламина (18,5 мл, 131 ммоль) в безводном ацетонитриле (310 мл) в атмосфере аргона и при 0oC. Перемешивают в течение 2 часов при температуре окружающей среды, затем добавляют по каплям при 0oC раствор этилата натрия в этаноле (полученного из 1,88 г, 80 ммоль, натрия в 90 мл этанола). Перемешивают в течение 12 часов при температуре окружающей среды. Добавляют 300 мл воды, перемешивают еще 20 минут. Отфильтровывают осадок, промывают водой, этанолом и этиловым эфиром. После высушивания в вакууме получают 16,7 г желтоватого твердого вещества.
1H-ЯМР (ДМСО): 1,31 (т, 3Н), 3,95 (с, 3Н), 4,36 (к, 2Н), 4,95 (с, 2Н), 7,46 (с, 1Н), 7,49 (с, 1Н).
30.с. этил-2,7-хлор-4-хлорметил-6-метокси-3-хинолин-карбоксилат
Суспензию этил-7-хлор-4-хлорметил-3-гидрокси-6-метоксихинолинкарбоксилата (116,7 г, 50 ммоль) в фосфорилхлориде (100 мл) кипятят с обратным холодильником в течение 6 часов. Фосфорилхлорид отгоняют. Остаток извлекают в воду и перемешивают в течение 30 минут. Осадок отфильтровывают и промывают водой до нейтрализации. Осадок извлекают в дихлорметане и (?) насыщенным раствором хлорида натрия. Фильтруют на слое целита и фильтрат декантируют. Органическую фазу промывают насыщенным раствором хлорида натрия. Сушат на сульфате магния и фильтруют и выпаривают при пониженном давлении. Получают 15,88 г коричневого масла.
1H-ЯМР (CDCl3): 1,47 (т, 3Н), 4,08 (т, 3Н), 4,55 (к, 2Н), 4,87 (с, 2Н), 7,35 (с, 1Н), 8,09 (с, 1Н).
30. d. этил-2,7-хлор-6-метокси-4-(4-метилпиперазинометил)-3 -хинолинкарбоксилат
Смесь этил-2,7-хлор-4-хлорметил-6-метокси-3-хинолин-карбоксилата (6,9 г, 20 ммоль) и N-метилпиперазина (9 мл, 80 ммоль) нагревают до 60oC в течение 30 минут. Реакционную массу разбавляют водой и экстрагируют этилацетатом. Декантируют и промывают органическую фазу водой. Сушат на сульфате магния, фильтруют и выпаривают при пониженном давлении. Остаток извлекают водой, перемешивают 15 минут, фильтруют, промывают водой и сушат в вакууме. Остаток очищают колоночной хроматографией (SiO2, MeOH/CH2Cl2; 5/95 - 8/92). Получают 6,7 г бежевого твердого продукта.
1H-ЯМР (CDCl3): 1,45 (т, 3Н), 2,28 (с, 3Н), 2,35-2,70 (м, 8Н), 3,86 (с, 2Н), 4,04 (с, 3Н), 4,48 (к, 2Н), 7,77 (с, 1Н), 8,05 (с, 1Н).
30.e. 2, 7-хлор-6-метокси-4-(4-метилпиперазинометил)-3-хинолинметанол
Этил-2,7-хлор-6-метокси-4-(4-метилпиперазинометил)-3-хинолинкарбоксилат (6 г, 14,5 ммоль) растворяют в метиленхлориде (120 мл). Медленно добавляют молярный раствор диизобутилалюминийгидрида в метиленхлориде (60 мл, 60 ммоль). Перемешивают в течение 1 часа при температуре окружающей среды. Выливают реакционную массу медленно в 300 мл 20%-ного раствора сегнетовой соли. Перемешивают в течение 1 часа, фильтруют на целите, декантируют, промывают органическую фазу насыщенным раствором хлорида натрия. Сушат на сульфате магния, фильтруют и выпаривают при пониженном давлении. Твердое вещество извлекают изопропиловым эфиром, фильтруют и сушат в вакууме. Получают 4,3 г целевого соединения в форме желтого твердого вещества.
1H-ЯМР (CDCl3): 2,27 (с, 3Н), 2,30-2,80 (м, 8Н), 4,03 (с, 3Н), 4,08 (с, 2Н), 4,96 (с, 2Н), 5,95 (с, 1Н), 7,37 (с, 1Н), 8,05 (с, 1Н).
30. f. 9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12- (4-метилпиперазинометил)-1H-оксепино[3', 4': 6,7] индолизино[1,2-b] хинолин-3,15(4Н, 13Н)-дион
2,7-хлор-6-метокси-4-(4-метилпиперазинометил) -3-хинолинметанол связывают с соединением (М), как описано в стадии 11.j. примера II. Полученный связанный продукт циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,87 (т, 3Н), 1,84 (к, 2Н), 2,53 (с, 4Н), 3,08 (д, 1Н), 3,47 (д, 1Н), 3,58 (с, 4Н), 3,58 (с, 4Н), 4,06 (с, 5Н), 5,30 (с, 2Н), 5,42 (к, 2Н), 6,03 (с, 1Н), 7,31 (с, 1Н), 7,91 (с, 1Н), 8,16 (с, 1Н).
13C-ЯМР (ДМСО): 8,42; 36,53; 50,65; 53,30; 56,67; 62,00; 73,32; 99,31; 104,86; 122,32; 126,94; 126,70; 129,83; 130,44; 138,89; 144,22; 144,85; 151,05, 153,17; 155,92; 159,19; 172,06.
ИК (KBr): 862; 1063; 1116; 1248; 1595; 1655; 1744; 3449.
Пример 31: 9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12- морфолинометил-1Н-оксепино[3',4':6,7] индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
3-хлор-4-метоксианилин можно использовать в процедуре, описанной в примерах 30. а. , 30.b. и 30.с. с получением этил-2,7-хлор-6-метокси-4-хлорметил-3-хинолин-карбоксилата, который обрабатывают согласно процедуре в примере 30.d., с использованием морфолина в место N-метилпиперазина, затем восстанавливают этот раствор согласно способу в примере 30.e. до хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11. k. Получают бежевое твердое вещество, т. пл. > 250oC.
63 1H-ЯМР (ДМСО): 0,87 (т, 3Н), 1,84 (к, 2Н), 2,15 (с, 3Н), 2,32 (с, 4H), 2,50 (с, 4H), 3,08 (д, 1Н), 3,47 (д, 1Н), 4,06 (с, 5Н), 5,29 (с, 2Н), 5,46 (к, 2Н), 6,06 (с, 1Н), 7,31 (с, 1Н), 7,92 (с, 1Н), 8,17 (с, 1Н).
13C-ЯМР (ДМСО): 8,42; 36,51; 42,57; 45,93; 50,66; 52,83; 55,05; 56,09; 56,72; 61,44; 73,29; 99,30; 104,89; 122,32; 126,89; 127,63; 129,85; 130,16; 138,78; 144,18; 144,81; 151,03; 153,01; 155,10; 159,17; 172,07.
ИК(KBr): 1055; 1252; 1596; 1655; 1747; 3449.
Пример 32: 5-этил-4,5-дигидро-5-гидрокси-12-(4-метил- пиперазинометил)-1H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H) -дион
Анилин можно использовать в процедурах, описанных в примерах 30.а., 30. b. и 30.с. с получением этил-2-хлор-4-хлорметил-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. N-метилпиперазином, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11. j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,86 (т, 3Н), 1,87 (к, 2Н), 2,14 (с, 3Н), 2,32-2,60 (м, 8Н), 3,05 (д, 1Н), 3,48 (д, 1Н), 4,09 (к, 2Н), 5,42 (д, 1Н), 5,52 (д, 1Н), 6,03 (се, 1Н), 7,40 (с, 1Н), 7,72 (т, 1Н), 7,85 (т, 1Н), 8,16 (д, 1Н), 8,45 (д, 1Н).
ИК (KBr): 1652; 1735; 3424.
Пример 33: 5-этил-4,5-дигидро-5-гидрокси-12-пиперидино-метил-1H-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
Анилин можно использовать в процедурах, описанных в примерах 30.а., 30. b. и 30.с. с получением этил-2-хлор-4-хлорметил-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. с использованием пиперидина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30. e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО): 0,86 (т, 3Н), 1,40 (се, 2Н), 1,48 (се, 4Н), 1,87 (к, 2Н), 2,50 (с, 4Н), 3,05 (д, 1Н), 3,48 (д, 1Н), 4,04 (к, 2Н), 5,33 (с, 2Н), 5,42 (д, 1Н), 5,51 (д, 1Н), 6,07 (се, 1Н), 7,75 (т, 1Н), 7,85 (т, 1Н), 8,15 (д, 1Н), 8,45 (д, 1Н).
13C-ЯМР (ДМСО): 8,47; 23,50; 25,82; 36,50; 42,50; 50,68; 54,47; 58,00; 61,42; 73,35; 99,55; 122,61; 125,31; 127,58; 129,54; 129,55; 129,56; 129,57; 140,49; 144,95; 148,63; 152,41; 155,90; 159,23, 172,07.
ИК (KBr): 1659; 1727; 3408.
Пример 34: 5-этил-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н-оксепино [3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
Анилин можно использовать в процедурах, описанных в примерах 30.а., 30. b. и 30.с. с получением этил-2-хлор-4-хлорметил-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. с использованием морфолина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30. e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т.пл. > 250oC.
1H-ЯМР (ДМСО-d6): δ (м. д.): 0,86 (т, 3Н), 1,87 (к, 2Н), 3,05 (д, 1Н), 3,30 (с, 4Н), 3,49 (д, 1Н), 3,55 (се, 4Н), 4,10 (к, 2Н), 5,35 (с, 2Н), 5,40 (д, 1Н), 5,54 (д, 1Н), 6,04 (с, 1Н), 7,72 (т, 1Н), 7,85 (т, 1Н), 8,16 (д, 1Н), 8,47 (д, 1Н).
13C-ЯМР (ДМСО): 8,42; 36,51; 42,57; 50,68; 53,51; 56,06; 61,42; 66,41; 73,34; 99,56; 122,64; 125,25; 127,56; 129,81; 139,55; 144,92; 148,62; 152,39; 155,89; 159,21; 172,05.
ИК (KBr): 1657; 1729; 3347.
Пример 35: 5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-(4- метилпиперазинометил)-1H-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н, 13H)-дион
4-фторанилин можно использовать в процедурах, описанных в примерах 30.а. , 30. b. и 30.c. с получением этил-2-хлор-4-хлорметил-6-фтор-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. N-метилпиперазином, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 275oC.
1H-ЯМР(ДМСО): 0,87(т, 3Н), 1,85 (к, 2Н), 2,15 (с, 3Н), 2,31 (м, 4Н), 2,50 (м, 4Н), 3,07 (д, 1Н), 3,48 (д, 1Н), 4,04 (м, 2Н), 5,31 (с, 2Н), 5,40 (д, 1Н), 5,53 (д, 1Н), 6,05 (с, 1Н),7,38 (с, 1Н), 7,77 (м, 1Н), 8,19 (м, 2Н).
13C-ЯМР (ДМСО): 8,43; 36,51; 42,54; 45,89; 50,67; 52,92; 54,93; 55,92; 73,32; 99,56; 122,69; 130,43; 132,40; 139,69; 144,70; 145,84; 152,19; 155,90; 159,17; 172,05.
ИК (KBr): 836; 1051; 1217; 1291; 1612; 1662; 1726.
Пример 36: 5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-морфолинометил- 1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион
4-фторанилин можно использовать в процедурах, описанных в примерах 30.а. , 30. b. и 30.с. с получением этил-2-хлор-4-хлорметил-6-фтор- 3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. с использованием морфолина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают бежевое твердое вещество, т. пл. > 250oC.
1H-ЯМР (ДМСО-d6): δ (м. д.): 0,87 (м, 3Н), 1,85 (м, 2Н), 2,51 (м, 4Н), 3,06 (д, 1Н), 3,48 (л, 1Н), 3,56 (м, 4Н), 4,05 (м, 2Н), 5,34 (с, 2Н), 5,40 (д, 1Н), 5,53 (д, 1Н), 6,04 (с, 1Н), 7,38 (с, 1Н), 7,77 (м, 1Н), 8,21 (м, 2Н).
13C-ЯМР(ДМСО): 8,40; 36,47; 42,52; 50,59; 53,40; 56,14; 61,44; 66,41; 73,29; 99,58; 109,05; 109,28; 120,11; 120,37; 122,68; 128,53; 130,53; 132,43; 139,13; 144,62; 145,79; 152,07; 155,94; 159,14; 161,59; 172,04.
ИК (KBr): 834; 860; 1061; 1118; 1215; 1286; 1516; 1609; 1658; 1734.
Пример 37: 5-этил-9-фтop-4,5-дигидро-5-гидрокси-10-метил-12-(4- метилпиперазинометил)-1H-оксепино[3', 4': 6,7] индолизино[1,2-b] хинолин-3,15(4H, 13H)-дион
3-фтор-4-метиланилин можно использовать в процедурах, описанных в примерах 30. а., 30.b. и 30.с. с получением этил-2-хлор-4-хлорметил-7-фтор-6-метил-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. N-метилпиперазином, затем восстанавливают согласно способу примера 30. e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 260oC.
1H-ЯМР (CDCl3): 1,00 (т, 3Н), 2,00 (к, 2Н), 2,35 (с, 3Н), 2,50 (с, 3Н), 2,61 (м, 8Н), 3,33 (д, 1Н), 3,39 (д, 1Н), 3,97 (д, 1Н), 4,07 (д, 1Н), 5,17 (д, 1Н), 5,38 (д, 1Н), 5,52 (д, 1Н), 5,63 (д, 1Н), 7,13 (д, 1Н), 7,28 (с, 1Н), 7,99 (д, 1Н).
ИК (KBr): 1652; 1747; 3430.
Пример 38: 5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12- морфолинометил-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H) -дион
3-фтор-4-aнилин можно использовать в процедурах, описанных в примерах 30. а., 30.b. и 30.с. с получением этил-2-хлор-4-хлорметил-7-фтор-6-метил -3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30. d. с использованием морфолина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 260oC.
1H-ЯМР (ДМСО + CDCl3): 1,00 (т, 3Н), 2,02 (к, 2Н), 2,57 (с, 3Н), 2,60 (с, 4H), 3,23 (д, 1Н), 3,45 (д, 1Н), 3,75 (с, 4H), 4,11 (с, 2Н), 5,44 (с, 2Н), 5,47 (д, 1Н), 5,65 (д, 1Н), 7,62 (с, 1Н), 7,73 (д, 1Н), 8,24 (д, 1Н).
13C-ЯМР (CF3CO2OD): 8,35; 13,93; 16,01; 22,24; 25,29; 38,18; 43,42; 54,19; 56,04; 56,74; 64,16; 65,09; 66,48; 108,29; 108,57; 128,07; 128,70; 129,90; 135,64; 138,03; 139,86; 141,10; 141,56; 147,78; 158,30; 161,87; 178,72.
ИК (KBr): 117; 1609; 1654; 1750; 3437.
Пример 39: 5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12- пиперидинометил-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H) -дион
3-фтор-4-анилин можно использовать в процедурах, описанных в примерах 30. а. , 30.b. и 30.с. с получением этил-2-хлор-4-хлорметил-7-фтор-6-метил-3-хинолин-карбоксилата, который обрабатывают согласно процедуре в примере 30. d. с использованием пиперидина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 260oC.
1H-ЯМР (CF3CO2D): 1,09 (с, 3Н), 1,70 (т, 1Н), 2,03 (м, 5Н), 2,25 (с, 2Н), 2,70 (с, 3Н), 3,88 (д, 1Н), 4,01 (се, 2Н), 5,30 (к, 2Н), 5,65 (д, 1Н), 5,96 (д, 1Н), 6,10 (с, 2Н), 8,16 (д, 1Н), 8,35 (с, 1Н), 8,61 (с, 1Н).
13C-ЯМР (CF3CO2D): 8,47; 16,07; 20,93; 22,18; 24,76; 38,28; 43,53; 54,30; 56,12; 58,33; 64,24; 77,56; 108,37; 111,30; 128,20; 129,02; 129,98; 135,60; 138,29; 139,90; 141,60; 142,26; 147,57; 158,28; 161,90; 167,63; 170,31; 178,82.
ИК (KBr): 1605; 1728; 3390.
Пример 40: 8-этил-2,3,8,9-тетрагидро-8-гидрокси-16-(4-метилпиперазинометил) -11, 12H- (1, 4) диоксино (2, 3-g) оксепино [3',4':6,7]индолизино[1,2-b]хинолин-10,13(15H)-дион
3,4-этилендиоксианилин можно использовать в процедурах, описанных в примерах 30. а. , 30.b. и 30.с. с получением этил-2-хлор-4-хлорметил-6,7-этилендиокси-3-хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30. d. N-метилпиперазином, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают желтое твердое вещество, т. пл. > 260oC.
1H-ЯМР (ДМСО): 0,92 (т, 3Н), 1,89 (к, 2Н), 2,16 (с, 3Н), 2,50 (м, 8Н), 3,12 (д, 1Н), 3,50 (д, 1Н), 3,95 (с, 2Н), 4,47 (с, 4Н), 5,19 (к, 2Н), 5,43 (д, 1Н), 5,56 (д, 1Н), 7,35 (с, 1Н), 7,54 (с, 1Н), 7,76 (с, 1Н).
13C-ЯМР (ДМСО): 8,45; 24,80; 36,51; 42,48; 45,90; 50,45; 52,98; 54,91; 56,10; 61,44; 64,43; 73,30; 99,03; 109,46; 113,51; 121,95; 123,51; 127,76; 137,99; 145,00, 145,14; 145,27; 147,24; 150,53; 155,90; 159,18; 172,27; 177,00.
ИК (KBr): 1656; 1743; 3422.
Пример 41: 9-хлор-5-этил-10тор-4,5-дигидро-5-гидрокси-12- морфолинометил-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)- дион
3-хлор-4-анилин можно использовать в процедурах, описанных в примерах 30.а., 30.b. и 30.с. с получением этил-2,7-дихлор-4-хлорметил-6-фтор-3- хинолинкарбоксилата, который обрабатывают согласно процедуре в примере 30.d. с использованием морфолина вместо N-метилпиперазина, затем восстанавливают согласно способу примера 30.e. до соответствующего хинолинметанола. Последний связывают с соединением (М), как описано в стадии 11.j. примера 11. Полученный продукт связывания циклизуют согласно процедуре, описанной в 11.k. Получают бежевое твердое вещество, т. пл. > 250oC.
1H-ЯМР (CF3COOD): 1,09 (т, 3Н), 2,30 (м, 2Н), 3,50 (д, 1Н), 3,90 (д, 1Н), 3,98 (д, 4Н), 4,36 (с, 4Н), 5,38 (к, 2Н), 5,64 (д, 1Н), 5,96 (д, 1Н), 6,23 (к, 2Н), 8,57 (д, 1Н), 8,69 (с, 1Н), 8,85 (д, 1Н).
13C-ЯМР (CF3COOD): 8,10; 37,80; 43,11; 54,31; 55,78; 63,75; 65,11; 77,06; 128,28; 129,55; 130,33; 136,26; 137,11; 138,40; 139,67; 139,85; 148,58; 157,54; 159,74; 161,31; 178,00.
ИК (KBr): 848; 1042; 1230; 1609; 1658; 1750; 3310; 3387.
Пример 42: Разрешение 5-этил-4,5-дигидро-5-гидрокси-1Н- оксепино[3',4': 6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-диона
Смесь β-этил-β-гидрокси-γ- (8-гидроксиметил-имидолизино[1,2-b]хинолин-9-(11Н) -он-7-ил)-пропионовой кислоты (19,5 г, 52 ммоль) и L-(-)- α -метилбензиламина (12,12 г, 100 ммоль) в абсолютном этаноле (11) кипятят, подвергают горячему фильтрованию и дают стоять в течение 68 часов. Осадок отфильтровывают и промывают этанолом и эфиром с получением 9,8 г белого твердого вещества. Анализ аффинной хроматографией высокого давления на хиральной фазе ("HPLC chiral" на колонке Chiral-AGP (Chromthech, Stockholm, Sweden) 100 x 4 мм, с 2%-ным ацетонитрилом в качестве элюента в 10 мМ фосфатном буфере при pH 6,9, пики элюента при 4,5 и 7,5 мин) выявил два пика, охватывающие, соответственно, 24% и 76% общей площади этих двух пиков. Твердое вещество извлекают в 93%-ный этанол (350 мл) при нагревании с обратным холодильником, затем дают стоять в течение 48 часов. Осадок отфильтровывают, затем промывают этанолом и эфиром с получением 4,8 г белого твердого вещества, дающего два пика, охватывающих, соответственно 9% и 91% общей площади этих двух пиков, при хиральной ВЭЖХ. Твердое вещество извлекают в 50%-ный этанол (48 мл) при нагревании с обратным холодильником, затем дают стоять в течение 48 часов. Осадок отфильтровывают, затем промывают этанолом и эфиром с получением 2,7 г белого твердого вещества, дающего два пика, соответственно, 1% и 99% общей площади двух пиков при хиральной ВЭЖХ. Полученную соль обрабатывают, обогащают диастереоизомерно, извлекают в дистиллированной воде (20 мл), с уксусной кислотой (0,35 мл, 6,4 ммоль) в течение 15 минут. Полученный осадок отфильтровывают, промывают водой, ацетоном и эфиром, затем сушат в вакууме при 80oC с получением 1,1 г белого твердого вещества. Это вещество извлекают в абсолютном спирте (55 мл) с добавленной концентрированной хлористоводородной кислотой (11,5 н., 11 мл) с получением желтого раствора, который перемешивают при температуре окружающей среды в течение 68 часов. Осадок, полученный таким образом, отфильтровывают и промывают водой, этанолом и эфиром, затем сушат в вакууме при 80oC с получением 770 мг энантиомерно обогащенного 5-этил-4,5-дигидро-5- гидрокси-1H-оксепино[3', 4': 6,7]индолизино[1,2-b]хинолин-3,15(4Н, 13Н)-диона. Анализ хиральной ВЭЖХ (колонка Chiral-AGP, элюция градиентом 2-5% ацетонитрила в 10 мМ фосфатном буфере при pH 6,9, пики элюента при 15 и 20 минутах) выявил энантиомерный избыток 98%. Описанную выше процедуру повторяют с заменой L-(-)-α- метилбензиламина D-(+)-α- метилбензиламином. Таким образом получают другой энантиомер 5-этил-4,5-дигидро-5-гидрокси- 1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-диона.
С использованием описанных выше способов могут быть получены также следующие продукты, которые также являются частью данного изобретения, включающей в себя предпочтительные продукты:
10-бензилокси-5,12-диэтил-4,5-дигидро-5-гидрокси-1Н- оксепино[3',4':6,7] индолизино[1,2-b]хинолин-3,15(4H,13H)-дион;
5,12-диэтил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино[3',4':6,7]индолизино [1,2-b]хинолин-3,15(4Н,13Н)-дион;
5,12- диэтил-4,5-дигидро-5,10-дигидрокси-11-диметил-аминометил-1Н- оксепино[3',4':6,7]индолизино[1,2- b]хинолин-3,15(4Н,13Н)-дион;
5-этил-4,5-дигидро-5- гидрокси-9,10-диметокси-1Н-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-3, 15(4Н,13Н)-дион;
10-бром-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион;
11-бром-5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино [3',4':6,7] индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион;
5-этил-12-диметиламинометил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7]индолизино[1,2-b]хинолин-3,15(4H,13H)-дион;
5-этил-4,5-дигидро-5-гидрокси-1Н, 3Н-циклопента[g] -оксепино[3', 4':6,7] индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион;
7-этил-7,8-дигидро-7-гидрокси-16-(4-метилпиперазинометил)-9Н, 11Н-[1, 3] диоксоло[4,5-g]оксепино[3',4':6,7]индолизино[1,2-b]хинолин-9,12(14H)-дион;
5-этил-4,5-дигидро-5-гидрокси-12-(1-имидазилметил)-1Н-оксепино [3', 4': 6,7]индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион;
8-этил-8,9-дигидро-8-гидрокси-10Н, 12Н-оксепино[3', 4': 6,7] индолизино [1,2-b]хинолин-3,15(4Н,13Н)-дион;
5-этил-4,5,9,10,11,12-гексагидро-5-гидрокси-1Н, 3Н-бензо[g] оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,17(15Н)-дион;
8-этил-8,9-дигидро-8-гидрокси-14Н, 10Н, 12H-[1,3]-диоксино [4,5-g]-оксепино[3',4':6,7]индолизино[1,2-b]хинолин-10,13(15Н)-дион;
7-этил-7,8-дигидро-7-гидрокси-1Н, 9Н, 11Н-оксепино[3', 4':6,7]индолизино [1,2-b]пирроло[2,3-g]хинолин-9,12(14Н)-дион;
7-этил-7,8-дигидро-7-гидрокси-1Н, 9Н,11Н-имидазо [4,5-g]оксепино [3',4': 6,7]индолизино[1,2-b]хинолин-9,12(14Н)-дион;
7-этил-7,8-дигидро-7-гидрокси-1Н,9Н,11H-оксепино[3',4':6,7]индолизино[1, 2-b]1,2,3-тиазоло[4,5-g]хинолин-9,12(14Н)-дион;
7-этил-7,8-дигидро-7-гидрокси- 9Н, 11H-оксепино[3', 4': 6,7] индолизино [1,2-b]тиазоло[4,5-g]хинолин-9,12(14H)-дион;
7-этил-7,8-дигидро-7-гидрокси-9Н,11H-оксазоло[4,5-g]оксепино[3',4': 6,7] индолизино[1,2-b]хинолин-9,12(14Н)-дион.
Фармакологическое исследование продуктов данного изобретения 1.
Тест для определения активности релаксации ДНК, индуцируемой топоизомеразой 1.
Все реакции проводят в реакционном буфере 20 мкл, содержащем 50 мМ Трис-HCl (pH 7,5), 50 мМ KCl, 0,5 мМ дитиотритол, 10 мМ MgCl2, 0,1 мМ этилендиамин-тетрауксусную кислоту (ЭДТА), 30 мкл/мл бычьего сывороточного альбумина и 300 нг спирализованной pUC19 (Pharmacia Biotech, Orsay, France), с тестируемыми соединениями или без них, для тестирования заданных концентраций. Все тестируемые соединения растворяют сначала в 50 мМ диметилсульфоксиде (ДМСО), остальные разведения делают дистиллированной водой. Конечная концентрация в ДМСО не превышает 1% (об/об). Реакцию инициируют добавлением одной единицы топоизомеразы 1 очищенной ДНК тимуса теленка (Gibco-BRL, Paisley, United Kingdom) и проводят в течение 15 минут при 37oC. Реакции останавливают добавлением 3 мкл смеси, содержащей 1% додецилсульфат натрия, 20 мМ ЭДТА и 500 мкг/мл протеиназы K (Boehringer Mannheim, Melan, France). После дополнительного периода инкубации в течение 30 минут при 37oC, 2 мкл загрузочного буфера, содержащего Na2HCO3, 0,3% бромфенолового синего 16% Фиколла, добавляют к пробам, которые подвергают гель-электрофорезу на 1,2%-ной агарозе при 1 В/см в течение 20 часов в буфере, содержащем 36 мМ Трис-HCl pH 7,8, 30 мМ Na2PO4, 1 мМ ЭДТА м 2 мкг/мл хлорохина. Гели окрашивают бромидом этидия (2 мкг/мл), фотографируют в 312 нм УФ-света фотографическим прибором и интенсивность флуоресценции измеряют камерой bioProfil (Vilber Lourmat, Lyon, France) для определения процента релаксированной ДНК. Каждый эксперимент выполняют по меньшей мере три раза в двух повторностях.
В каждом эксперименте спиральную ДНК-плазмиду инкубируют отдельно или с топоизомеразой 1. Реакция завершается в диапазоне 15 минут, для каждого соединения, тестируемого или используемого в качестве контроля, спиральную ДНК-плазмиду инкубируют в присутствии 500 мкМ тестируемого соединения с ферментом или без фермента плюс соединение, при концентрациях 10 мкМ, 100 мкМ, 200 мкМ и 500 мкМ. Как показано в Таблице 1, примеры 2, 3, 4, 9, 10 и 11 ингибируют релаксирующую активность топоизомеразы 1 в зависимости от дозы.
2. Тест пролиферации клеток
Восемь опухолевых клеточных линий используют в данном исследовании: L1210 (лимфолейкоз мышей), HCT15 и LOVO (линии клеток аденокарциномы ободочной кишки человека), A549 (рак легкого человека), A172, U373, U87 (глиобластомы человека). Все эти линии получены из American Type Collection Cultures (ATCC), Rockville, Md. Культуры клеток L1210 в суспензии культивируют в среде Игла, модифицированной Дульбекко (DMEM) (BioWhitaker, Verviers, Belgium), дополненной 10%-ной фетальной телячьей сывороткой, инактивированной нагреванием, 2 мМ глутамином, 50 E/мл пенициллина и 50 мкл/мл стрептомицина. Клетки HT29 культивируют в монослойных культурах в среде 5аMcCoy (Gibco, Paisley, United Kingdom), дополненной 10%-ной фетальной телячьей сывороткой, инактивированной нагреванием, с добавлением 2 мМ глутамина и 50 мкг гентамицина. Другие клетки культивируют в основной среде, модифицированной Эрлом (ЕМЕМ; Gibco, Paisley, United Kingdom), дополненной 5%-ной фетальной телячьей сывороткой, инактивированной нагреванием, 2 мМ глутамином, 50 E/мл пенициллина и 50 мкг/мл стрептомицина. Все клеточные линии культивируют при 37oC в увлажненной атмосфере, содержащей 95% воздуха и 5% CO2.
Ингибирование опухолевых клеточных линий определяют посредством МТТ-теста, 1500 клеток L1210 в среде культуры (в соответствии с потребностью в клеточной среде) высевают в лунку микротитрационного планшета (уровень культуры ткани: 96 лунок, плоское дно) за 24 часа перед обработкой тестируемыми соединениями. Для исследований доза-ответ, клетки инкубируют с каждым тестируемым соединением или с их соответствующим растворителем (контроль) в течение 48 часов в пуле конечных концентраций 1·10-10 - 1·10-4 М. Все соединения растворяют непосредственно перед использованием в диметилсульфоксиде (ДМСО) при концентрации 50 мМ. Другие разведения лекарственных средств выполняют в культуральной среде. Конечная концентрация ДМСО никогда не превышает 0,2% (об. /об.). В качестве контроля растворы лекарственных средств заменяют растворителем, который последовательно разводят таким же образом, что и тестируемые соединения.
После периода инкубации добавляют маркерный реагент МТТ (3-[4,5-диметилтиазол-2-ил] -2,5- дифенилтетразолий; Thiazol blue, Sigma М 565, Sigma, St. Louis МО) в конечной концентрации 0,3 мг/мл в каждую лунку. Клетки инкубируют в течение 4 часов при 37oC в увлажненной атмосфере. Эта стадия позволяет митохондриальной дегидрогеназе живых клеток превращать желтую соль тетразолия МТТ в пурпурные кристаллы формазана. Супернатант удаляют и образованные кристаллы формазана солюбилизируют при помощи ДМСО. Полученный окрашенный раствор используют для количественного определения по поглощению при 570 нм с использованием перемещающегося мультикюветного спектрофотометра. Данные, касающиеся пролиферации, выражают в процентах живых клеток в обработанных лунках, деленных на живые клетки в контроле. Каждая точка представляет собой среднее из трех независимых экспериментов, причем каждый эксперимент дает 6 определений.
Для других клеточных линий (HTC15, LOVO, A549, A172, U373, U87) 1000-2000 клеток высевают в лунку планшета за 24 часа перед обработкой лекарственными средствами. Их инкубируют с каждым из тестируемых соединений или их соответствующим растворителем (контроль) в течение 72 часов в пуле конечных концентраций 1·10-10 - 1·10-6 М.
Результаты выражают в процентах пролифераций, рассчитанных по оптической плотности клеток, обработанных лекарственным средством, разделенных на OD контрольных клеток (клеток, обработанных ДМСО). Как представлено в Таблице II, тестируемые соединения ингибировали пролиферацию клеток в зависимости от дозы.
1. Тестирование in vivo
Соединения данного изобретения тестируют in vivo с использованием клеточных линий лимфобластного лейкоза L1210 мышей. Опухолевые клетки поддерживают при помощи серии внутрибрюшинных инъекций в мышах DBA/2 Lafacedu, Lyon, France. В экспериментальном испытании 106 клеток на 0,2 мл инъецируют i.p.-переносом в самок мышей B6D2F1. Лечение начинают в 1 день после инокуляции лейкозными клетками и продолжают до 4 дня или до 8 дня. Тестируемые соединения инъецируют внутрибрюшинно или внутривенно в различных концентрациях и инъецируемый объем корректируют до 0,1 мл/10 г веса тела. Не получавшие тестируемое соединение мыши умирают между 9 и 14 днями, после инъекции клеток лимфобластного лейкоза L1210 и выживание получивших тестируемое соединение мышей наблюдают во время продолженного периода до 60 дней.
Этот эксперимент проведен с 5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7]-индолизин [1,2-b]хинолин-3,15(4Н,13Н)-дионом. Это соединение увеличивает на 50% продолжительность жизни мышей при концентрации между 0,32 и 2,5 мг/кг, вводимой внутрибрюшинно в течение 4 дней и при концентрациях между 0,32 и 5,0 мг/кг, вводимых внутривенно в течение 8 дней.
Примеры лекарственных соединений
Жидкая композиция: 10 мг соединения согласно изобретению; 3,3 г диметилацетамида; qsp 200 г физиологической сыворотки.
Твердая композиция (в спрессованном виде): 1 мг состава согласно изобретению; 75 мг порошка лактозы; 20 мг микрокристаллической целлюлозы; 3 мг коллоидного кремниевого ангидрида; 1 мг стеарата магния.
Предложенные композиции получают путем тщательного смешения активного начала и инертных наполнителей носителей и т.д.
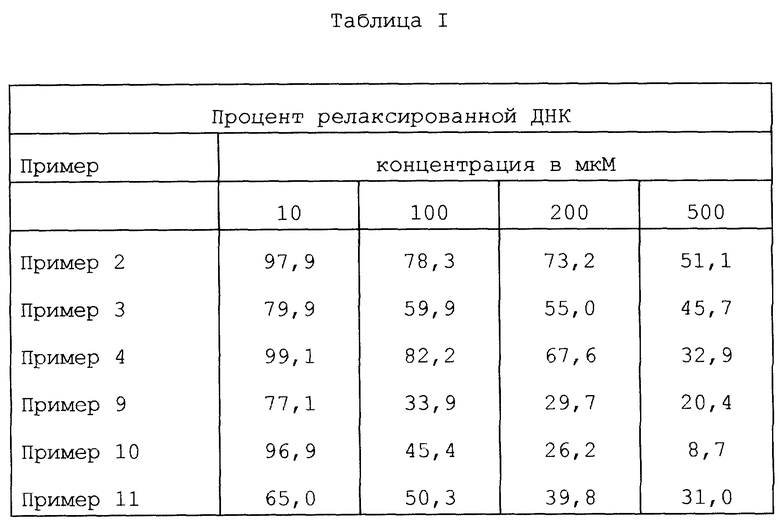
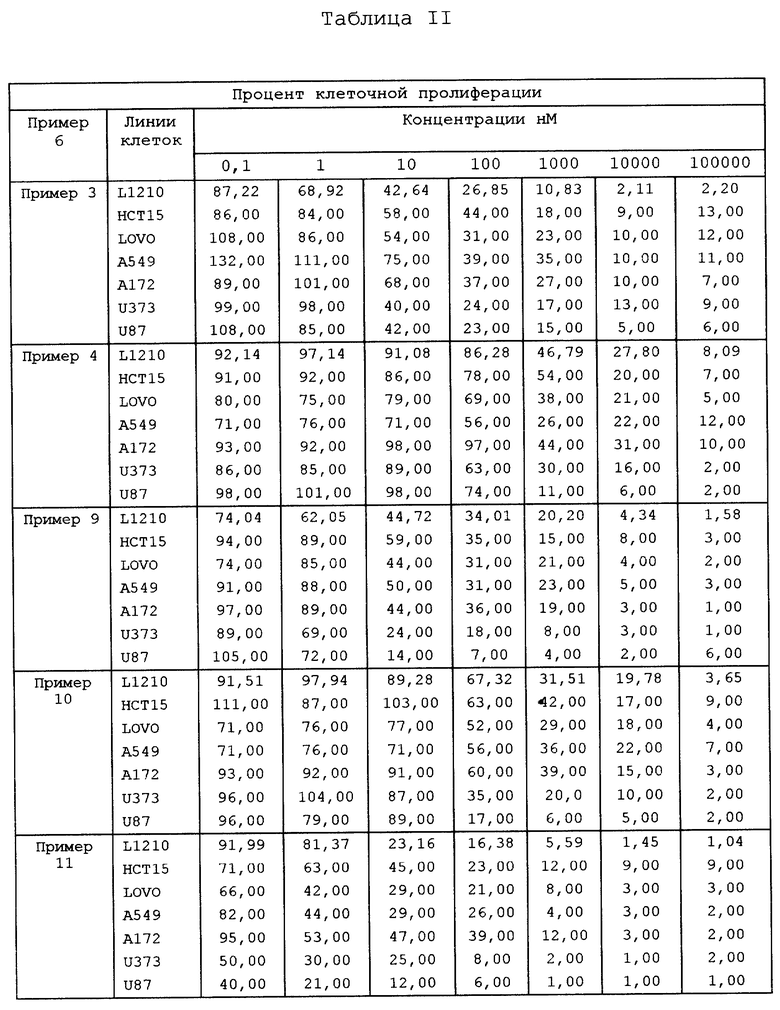
Описываются новые соединения камптотецина общей формулы I или II в рацемической форме, в форме энантиомера или любой комбинации этих форм, где R1 обозначает низший алкил, низший галогеналкил и низший алкоксинизший алкил R2, R3, R4 обозначают независимо H, галоген, низший галогеналкил, низший алкил, (CH2)mNR6R7, (CH2)mOR6 (CH2)n [N = X], замещенный или незамещенный, где заместитель представляет собой низший алкил, или R2 и R3 вместе образуют метиленокси или этиленоксигруппу, R5 обозначает H, галоген, низший алкил, низший алкокси, (CH2)mNR6R7, или (CH2)n [N = X], замещенный или незамещенный, где заместитель представляет собой низший алкил, R6 и R7 обозначают независимо H и низший алкил, арил низший алкил, галоген низший алкил, R9 обозначает низший алкил, арилалкил, R16 обозначает H или OR21; R17 обозначает OR6, R18 и R19 обозначают независимо H, галоген, низший алкил, низший алкокси или гидрокси; R20 обозначает H или галоген; R21 обозначает H, низший алкил, CHO, m целое число между 0 и 6; n1 или 2; и [N = X] обозначает замещенный или незамещенный гетероциклическую группу с 4 - 7 звеньями, X обозначает необходимую цепь для комплектования гетероциклической группы и выбран из группы, состоящей из O, S, CH2, CH, NH, NR9; или его фармацевтически приемлемую соль. Описывается способ получения новых соединений, промежуточные соединения и терапевтические фармацевтические композиции. Соединения находят применение в качестве ингибиторов топоизомеразы и противоопухолевых средств. 6 с. и 19 з.п. ф-лы, 2 табл.
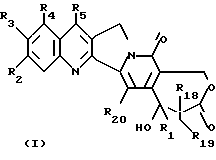
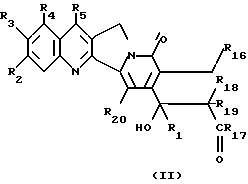
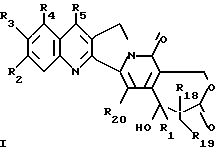
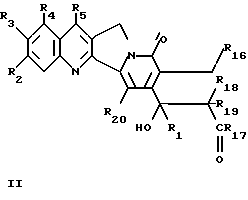
в рацемической форме, в форме энантиомера или любой комбинации этих форм,
где R1 обозначает низший алкил: низший галогеналкил и низший алкоксинизший алкил;
R2, R3, R4 обозначают независимо Н, галоген, низший галогеналкил, низший алкил, (CH2)mNR6R7, (CH2)mOR6 (CH2)n [N=X], замещенный или незамещенный, где заместитель представляет собой низший алкил, или R2 и R3 вместе образуют метиленокси- или этиленоксигруппу;
R5 обозначает Н, галоген, низший алкил, низший алкокси, (CH2)mNR6R7 или (CH2)n [N=X], замещенный или незамещенный, где заместитель представляет собой низший алкил;
R6 и R7 обозначают независимо Н и низший алкил, арил низший алкил, галоген низший алкил;
R9 обозначает низший алкил, арилалкил;
R16 обозначает Н или OR21;
R17 обозначает OR6;
R18 и R19 обозначают независимо Н, галоген, низший алкил, низший алкокси или гидрокси;
R20 обозначает Н или галоген;
R21 обозначает Н, низший алкил, СНО;
m целое число между 0 и 6;
n = 1 или 3;
[N= X] обозначает замещенную или незамещенную гетероциклическую группу с 4 - 7 звеньями, Х обозначает необходимую цепь для комплектования гетероциклической группы и выбран из группы, состоящей из O, S, CH2, CH, NH, NR9;
или его фармацевтически приемлемую соль.
-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b] хинолин-3,15(4Н,13Н)-дион
-5,12-диэтил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-8-этил-2,3,8,9-тетрагидро-8-гидрокси-10Н, 12Н-[1,4] диоксино[3',4':6,7] -индолизино[1,2-b]хинолин-10,13-(15Н)-дион
-10-бензилокси-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино[3', 4': 6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-11-(диметиламино)метил-5-этил-4,5-дигидро-5,10-дигидрокси-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино[3', 4':6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метил-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9,10-дифтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-7-этил-7,8-дигидро-7-гидрокси-9Н, 11Н-[1,3] диоксоло[4,5-q]оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-9,12(4Н)-дион
-9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино[3', 4':6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-9,11-дихлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-10-фтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индилизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-10-хлор-5-этил-4,5-дигидро-5-гидрокси-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-10-хлор-5-этил-9-фтор-4,5-дигидро-5-гидрокси-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5,12-диэтил-4,5-дигидро-5,10-дигидрокси-11-морфолино-метил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5,12-диэтил-9-фтор-4,5-дигидро-5-гидрокси-10-метокси-1Н-оксепино[3',4': 6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5-гидрокси-12-метил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12-(4-метилпиперазинометил)-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-9-хлор-5-этил-4,5-дигидро-5-гидрокси-10-метокси-12-морфолинометил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5-гидрокси-12-(4-метилпиперазинометил)-1Н-оксепино[3'.4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5-гидрокси-12-пиперидинометил-1Н-оксепино[3',4':6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н-оксепино[3', 4':6,7] -индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-(4-метилпиперазинометил)-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н-оксепино[3', 4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12-(4-метилпиперазинометил)-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12-морфолино-метил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-5-этил-9-фтор-4,5-дигидро-5-гидрокси-10-метил-12-пиперидинометил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион
-8-этил-2,3,8,9-тетрагидро-8-гидрокси-16-(4-метил-пиперазинометил)-10Н, 12Н-(1,4-диоксино(2,3-q)оксепино[3', 4': 6,7] -индолизино[1,2-b] хинолин-10,13(15Н)-дион
-9-хлор-5-этил-10-фтор-4,5-дигидро-5-гидрокси-12-морфолинометил-1Н-оксепино[3',4':6,7]-индолизино[1,2-b]хинолин-3,15(4Н,13Н)-дион, или его фармацевтически приемлемая соль.
-трет-бутил-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-этил-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b] хинолин-7-ил)-пропионовая кислота
-метил-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-этил-β-этил-α,α-дифтор-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-этил-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-трет-бутил-β-этил-β-гидрокси-γ-(8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b]хинолин-7-ил)-пропионат
-β-этил-γ-(12-этил-8-гидроксиметил-9-оксо(11Н)-индолизино[1,2-b] хинолин-7-ил)-β-гидрокси-пропионовая кислота
-γ-(12-бензилокси-8-гидроксиметил-9-оксо(11Н)-индолизино-[1,2-b] хинолин-7-ил)-β-этил-β-гидроксипропионовая кислота(Е) или его фармацевтически приемлемая соль.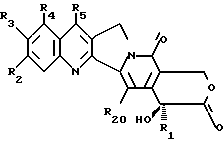
где R1, R2, R3, R4, R5 и R20 имеют указанные выше значения,
восстанавливают с получением  гидроксилактола общей формулы А
гидроксилактола общей формулы А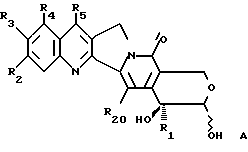
где R1, R2, R3, R4, R5 и R20 имеют указанные выше значения,
связь углерод-углерод соседнего карбинола образованного таким образом соединения А расщепляют подходящим окислителем таким образом, чтобы получить соединение формулы В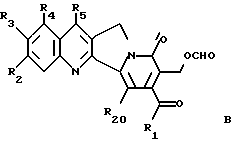
где R1, R2, R3, R4, R5 и R20 имеют указанные выше значения,
с последующей обработкой его функциональным алкилирующим агентом и формильную группу соединения формулы В расщепляют с получением β-гидроксиэфира общей формулы С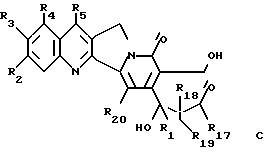
где R1, R2, R3, R4, R5, R18 и R20 имеют указанные выше значения;
R17 обозначает OR6;
R6 обозначает низший алкил, низший арилалкил;
далее соединение общей формулы С циклизуют с получением β-гидроксилактонного соединения общей формулы D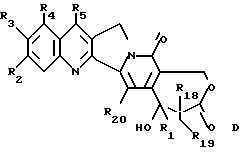
где R1, R2, R3, R4, R5, R18, R19 и R20 имеют указанные выше значения, которые раскрывают с получением соединения формулы Е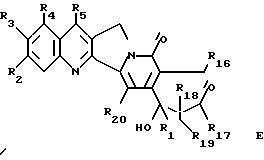
где R1, R2, R3, R4, R5, R18, R19 и R20 имеют указанные выше значения;
R16 обозначает OR21, где R21 обозначает Н или низший алкил;
R17 обозначает OR6;
R6 обозначает Н, низший алкил, низший арилалкил.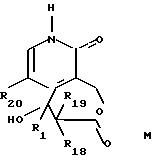
где R1, R18 и R19 имеют указанные выше значения;
R20 обозначает атом водорода или галогена,
с 2-галоген-3-хинолинметанолом общей формулы N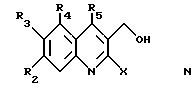
где R2, R3, R4 и R5 имеют указанные выше значения,
Х обозначает атом галогена,
с получением соединения формулы О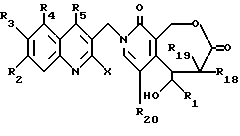
где R1, R2, R3, R4, R5, R18, R19 и R20 и Х имеют указанные выше значения;
с последующей циклизацией соединения общей формулы О с получением соединения формулы D, как описано выше, которое раскрывают с получением соединения формулы Е.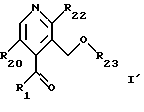
где R1 обозначает низший алкил, низший алкенил, низший алкинил, низший галогеналкил, низший алкоксинизший алкил или низший алкилтионизший алкил;
R20 обозначает Н или галоген, R22 обозначает F, Cl или низший алкокси;
R23 обозначает защитную группу первичной гидроксигруппы.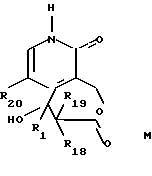
где R1 обозначает низший алкил, низший галогеналкил, низший алкоксинизший алкил;
R18 и R19 обозначают независимо Н, галоген, низший алкил, низший алкокси или гидрокси;
R20 обозначает Н или галоген.
Приоритет по пунктам:
04.03.1996 по пп.1,7,14,19,20,22-25;
21.06.1995 по пп.1 - 19 - (соединения I);
04.03.1996 по пп.1 - 19 - соединения II;
04.03.1996 по пп.2 - 5,13;
21.06.1995 по п.21.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Ф.П.ТРИНУС | |||
| Фармако-терапевтический справочник | |||
| - Киев: Здоровья, 1989, с.458. | |||
Авторы
Даты
2001-03-27—Публикация
1996-06-21—Подача