Изобретение относится к области медицины и касается нового применения флюпиртина.
ФЛЮПИРТИН (Катадолон®) - новый неопиатный (ненаркотический) анальгетик, обладающий центральным механизмом действия (Jakoviev V. Sofia R.D., Achterath - Tuckermann U., von Schlichtegroll A., Thiemer K., Arzneim.-Forsch. /Drug Res.35 (1), 30 (1985); Nickel В., Herz A., Jakoviev V., Tibes U., Arzneim.- Forsh. Drug Res.35 (11), 1402 (1985). Флюпиртин проявляет свой центральный обезболивающий эффект посредством механизмов действия, отличных от таковых у опиатных/ опиоидных анальгетиков (Nickel В., Postgrad.med.J. 63 (Suppi. 3), 19 (1987); Szelenyi 1., Nickel В., Borbe H.O., Brune К., Br.J. Pharmacol. 143, 89 (1989)). Электрофизиологические исследования показали, что флюпиртин способен вмешиваться в процесс образования болевых импульсов как на уровне спинного, так и головного мозга (Carlsson К.Н., Jurnal., Eur. J. pharmacol. 143, 89 (1987); Bleyer H., Carlsson К.Н., Erkel H.J., Jurnal., Eur.J.Pharmacol. 151, 259 (1988): Nickel В., Aldeter A., Postgrad Med, J. 63 (suppl. 3) 41 (1987)).
Флюпиртин до настоящего времени использовался для купирования острых болей, вызванных заболеваниями двигательного аппарата. Препарат также успешно применялся при невралгиях, болях при раковых заболеваниях, вазомоторных головных болях и мигрени, послеоперационном болевом синдроме, переломах, ожогах, эрозиях, болях при дисменоррее, купировании зубной боли. Показания и используемые дозировки даны в профессиональной информации (Катадолон® , моноанальгетик, научный бюллетень, второе переработанное издание 04/1992, издано ASTA Medica AG).
Комбинация препаратов флюпиртина с нестероидными противовоспалительными препаратами описана в ЕР 189788. В таких назначениях польза флюпиртина заключается не только в обезболивающих свойствах, но также и в действии в качестве мышечного релаксанта, как описано в опубликованной заявке ФРГ 41 22 166.4.
По химическому строению флюпиртин представляет собой малеат 2-амино-3-этил-этоксикарбониламино-6[5-фторбензил] - аминопиридин. Синтез флюпиртина и его фармацевтических производных солей описан в ЕР 160 865 и 199 951. Флюпиртина малеат имеет химическую структуру, отличную от других известных ранее анальгетиков. Флюпиртин - бесцветный кристаллический порошок, практически без запаха, с легким сладко-горьким вкусом. Обезболивающее действие флюпиртина было продемонстрировано во время экспериментального моделирования боли у животных на крысах, мышах и собаках путем механического (тест Хаффнера), термического (тест с горячей пластинкой), электрического (электроболевой тест, раздражение пульпы зуба), химического (тест на судорогу) и химико-механического раздражения (тест Рэнделла-Селито). Более полная информация о действии и побочных эффектах моноанальгетика флюпиртина дана в научном бюллетене (Катадолон®, моноанальгетик, научный бюллетень, второе дополненное издание 04/1992. издано ASTA, Medica AG).
Фармакологические исследования показали, что флюпиртин действует как на уровне спинного, так и головного мозга. Эксперименты с антагонистами показали, что обезболивающее действие флюпиртина не может быть объяснено блокадой серотонинергических и опиоидных рецепторов. Наиболее вероятно действие флюпиртина объясняется его влиянием на нисходящие норадренергические пути, ответственные за болевые ощущения (1. Szelenyi, В. Nickel, Н.О. Borbe, К. Brune Br. , J. Pharmacol. (1989), 97, 835-842), несмотря на то, что флюпиртин не имеет сродства к a1 или a2- адренергическим рецепторам (В. Nickel et al., Br. J. Pharmacol (1989) 97,835).
Кроме того, отсутствие сродства флюпиртина к опиатным рецепторам головного мозга крыс так же говорит против опиатоподобного механизма действия препарата. Таким образом, подобный механизм действия флюпиртина можно исключить. Толерантность и зависимость к флюпиртину также не наблюдались.
Во время изучения на крысах миорелаксантного действия флюпиртина неожиданно было обнаружено, что это действие блокируется возбудительной (эксайторной) аминокислотой N -метил-D-аспартатом (NMDA). Предположительно это означает, что действие флюпиртина, по крайней мере частично, достигается вследствие подавления NMDA- опосредованных стимуляций. Это открывает возможности для использования флюпиртина как антагониста возбудительных аминокислот при лечении заболеваний, вызываемых возбудительными аминокислотами, таких как эпилепсия, церебральная ишемия, нейродегенеративные заболевания и т.п.
Сущность изобретения
Целью изобретения является получение лекарственных средств, содержащих флюпиртин в качестве действующего вещества для лечения нейродегенеративных и подобных им расстройств.
К заболеваниям, которые на основании фармакологических данных можно лечить флюпиртином, относятся: церебральная ишемия, идиопатическая болезнь Паркинсона, токсически- или лекарственно вызванный синдром Паркинсона, болезнь Альцгеймера и синдром церебральной деменции различного происхождения, хорея Гентингтона, амиотрофический латеральный склероз, множественный склероз, нейродегенеративные процессы инфекционного происхождения такие, как ВИЧ-энцефалопатия, болезнь Крицфельда- Жакоба, энцефалопатии, вызванные вирусом герпеса и кори, боррелией; метаболическо- токсические нейродегенеративные расстройства, такие, как алкогольная, печеночная, гипоксическая, гипо- и гипергликемическая энцефалопатия, энцефалопатия, развившаяся в результате приема лекарств или др. химических соединений, дегенерация сетчатки различного происхождения, травмы головного мозга, поражение костного мозга, появление симптомов церебральной гипервозбудимости различного происхождения - при назначении и/или синдроме отмены препаратов, употреблении больным ядов, токсинов, наркотиков; состояние повышенной возбудимости церебрального и травматического генеза, нейродегенеративные поражения периферической нервной системы, такие как метаболические, медикаментозные, токсические, инфекционные полиневропатии и полиневриты. Также может быть использовано бронхоспазмолитическое действие медицинского препарата.
Перечень фигур чертежей.
Фиг. 1. Флексорный рефлекс (верхний график), полученный в результате электрической стимуляции М. tibialis (5 стимулов с частотой 500 Гц, с силой, в 3 раза превышающей пороговую) на тыльной стороне лапки и H-рефлекс (рефлекс Хоффманна) и М-волна (нижний график), записанная при сокращении мышц стопы после электрической стимуляции N. tibialis (однократный стимул, с силой, в 2 раза превышающей пороговую) до введения (слева) и через 20 мин после введения (справа) флюпиртина 10 мг/кг. Артефакты стимулов помечены стрелками.
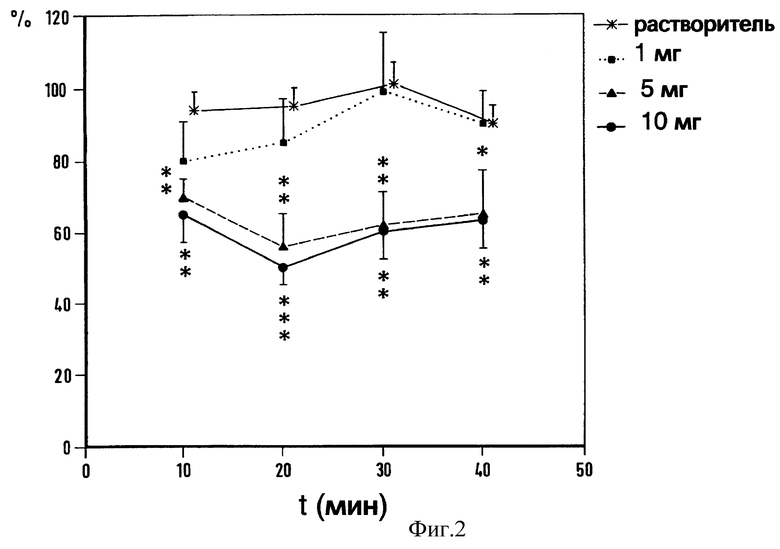
Фиг. 2. Длительность действия на силу флексорного рефлекса после внутрибрюшинного введения растворителя или флюпиртина в различных дозах. Абсцисса: время (в мин) после инъекции. Ордината: сила рефлекса после введения препарата в процентном отношении к силе рефлекса до введения (средняя величина ± SEM каждого опыта (6-8 животных)). Достоверность: ** p < 0,01, *** p < 0,001 vs растворителя (U-тест Mann-Whitney).
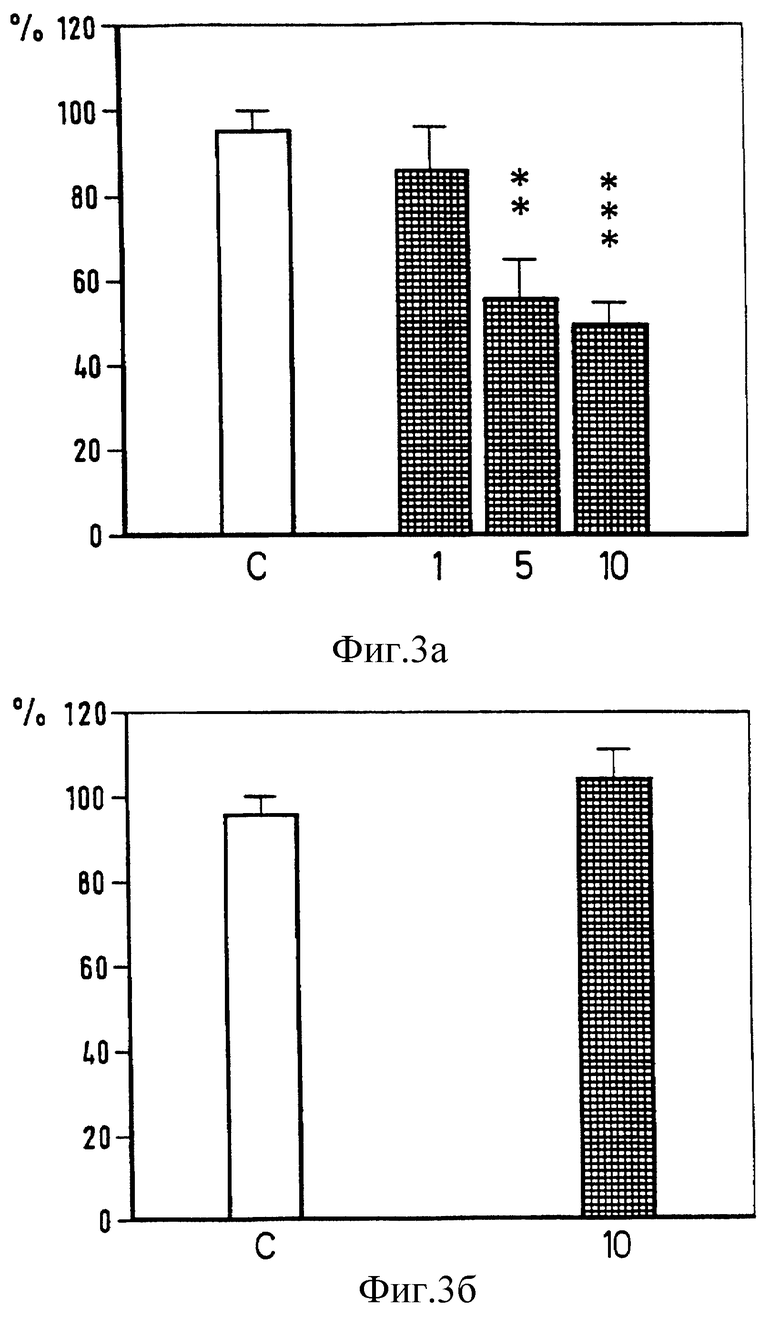
Фиг.3. Влияние внутрибрюшинного введения флюпиртина (1-10 мг/кг) на силу рефлекса: флексорного (верхний график) и H-рефлекса (нижний график). Сила рефлекса выражена в процентах относительно силы рефлекса до введения препарата, (среднее значение ± SEM каждого опыта (6-8 животных)). С: растворы, достоверность ** p < 0,01, *** P < 0,001 vs растворителя (U-тест Манна-Уитни).
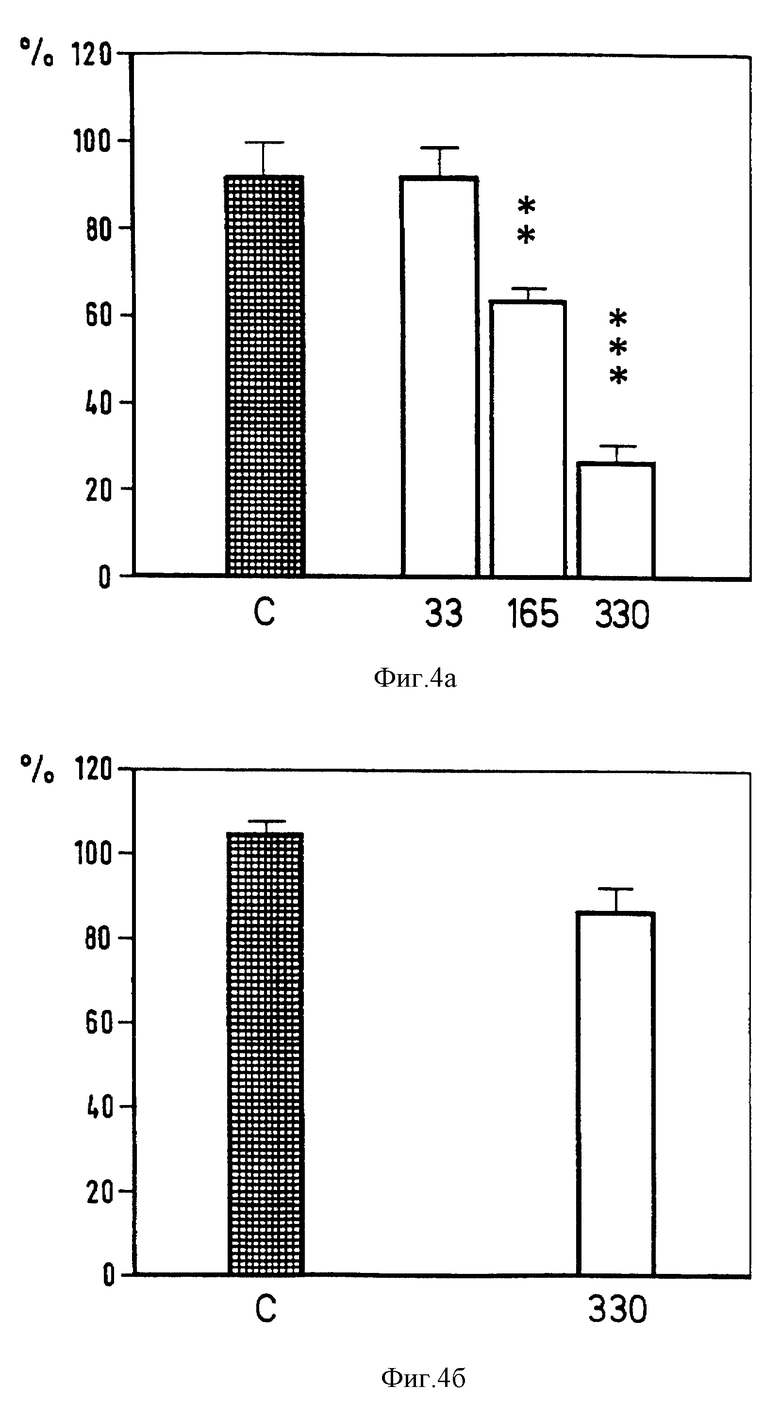
Фиг. 4. Влияние интратекального введения флюпиртина (33-330 нмоль) на силу флексорного (верхний график) и H-рефлекса (нижний график). Сила рефлекса выражена в процентах к начальному уровню до введения препарата (среднее значение ± SEM в каждом случае 7-10 животных). С: растворы, дозированные в нмолях. Достоверность ** p < 0,01, *** p < 0,001 vs растворителя (U-тест Манна-Уитни).
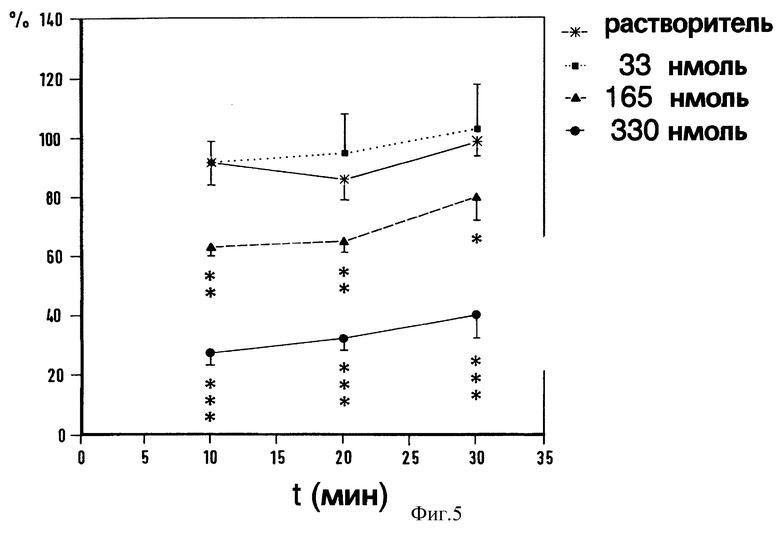
Фиг.5. Зависимость силы флексорного рефлекса от длительности воздействия интратекально введенных растворов и флюпиртина в различных дозах (33-330 нмоль). Абсцисса: время в минутах после инъекции. Ордината: сила рефлекса в процентах от соответствующего уровня до введения препарата (средняя величина ± SEM в каждом случае 7-10 животных). Достоверность ** p < 0,01, *** p < 0,001 vs растворителя (U- тест Манна-Уитни).
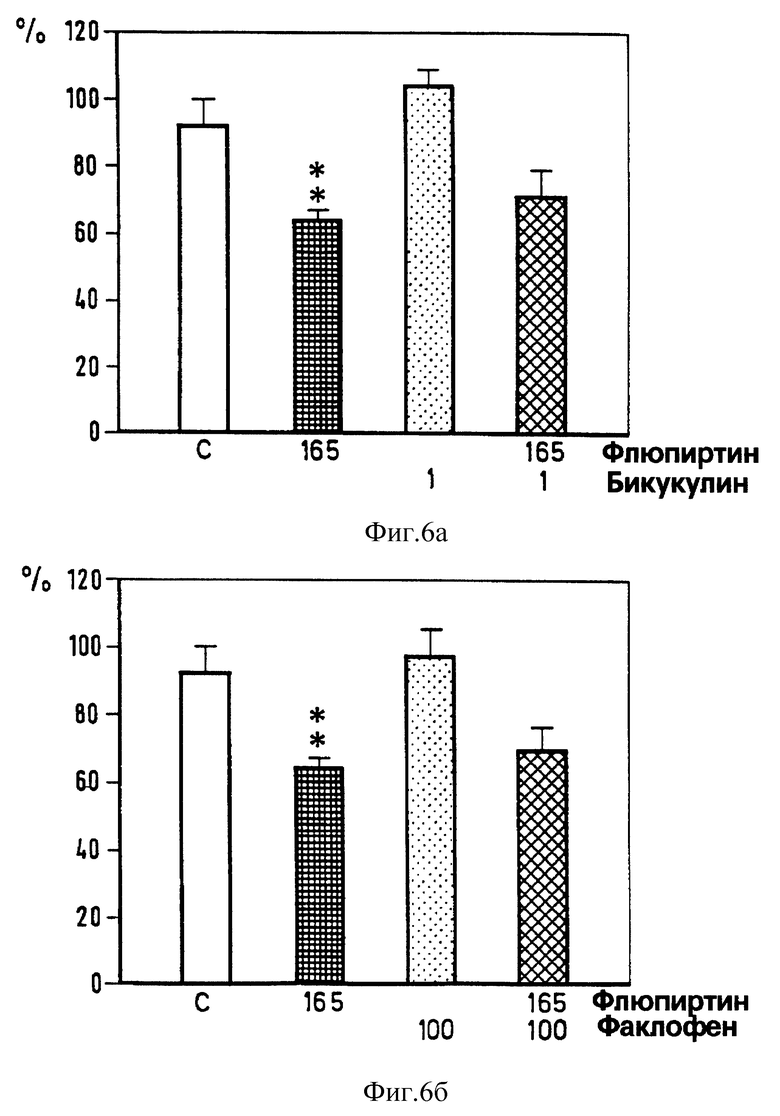
Фиг. 6. Действие интратекально введенных бикукулина (верхний график), факлофена (нижний график) и флюпиртина на силу флексорного рефлекса, концентрация в нмолях. Достоверность ** p < 0,01, *** p < 0,001 vs растворителя * (U-тест Манна-Уитни).
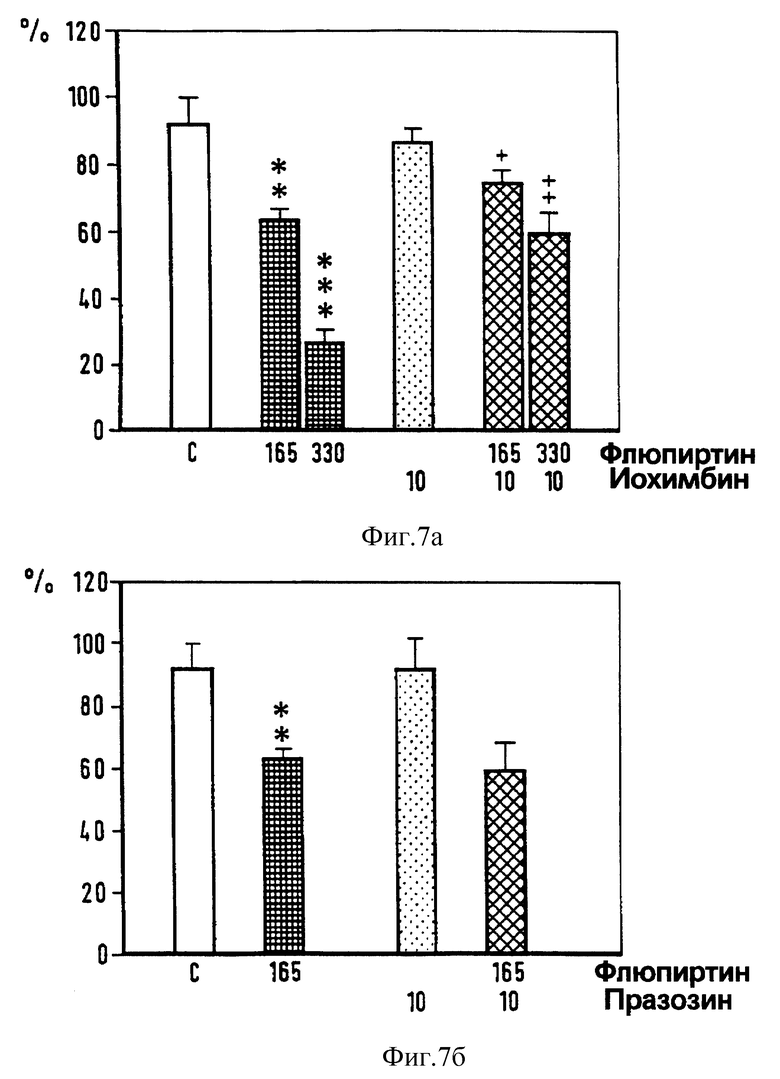
Фиг. 7. Воздействие интратекально введенных иохимбина (верхний график), празозина (нижний график) и флюпиртина на силу флексорного рефлекса, концентрация в нмолях. Достоверность ** p < 0,01, *** p < 0,001 vs растворителя; + p < 0,05, +++ p < 0,01 vs флюпиртина (U-тест Манна-Уитни).
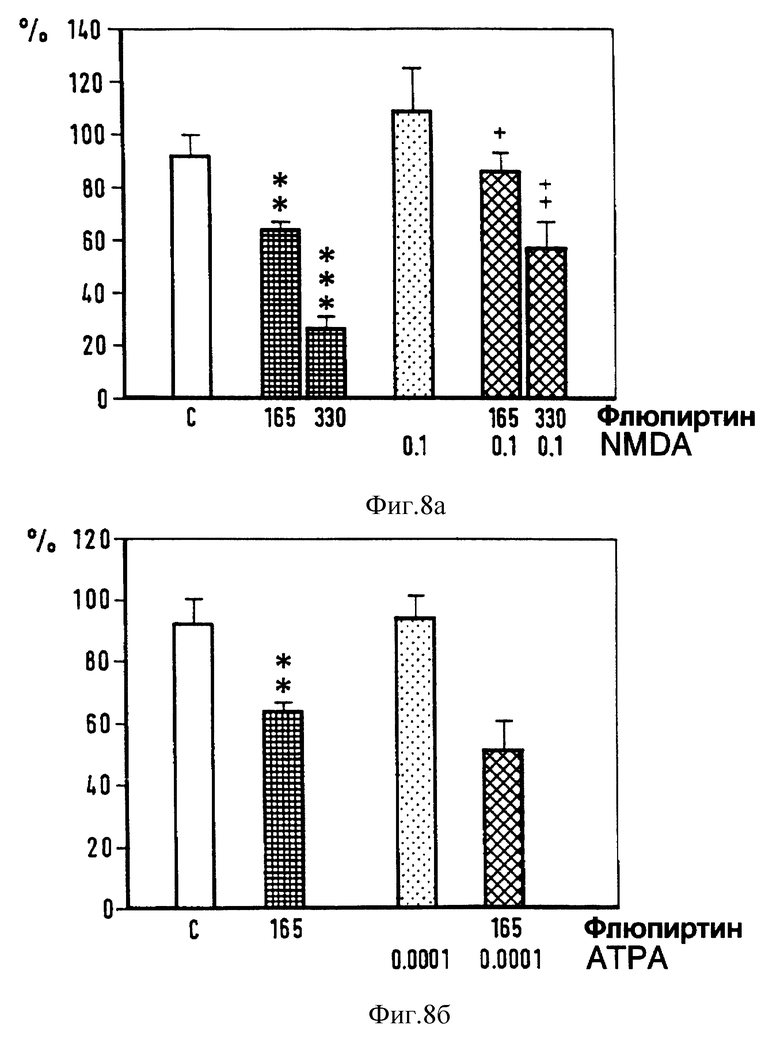
Фиг. 8. Действие интратекально введенных NMDA (верхний график), АТРА (нижний график) и флюпиртина на силу флексорного рефлекса, концентрация в нмолях. Достоверность ** p < 0,01, *** p < 0,001 vs растворителя; +p < 0,05, +++ p < 0,01 vs флюпиртина (U-тест Манна-Уитни).
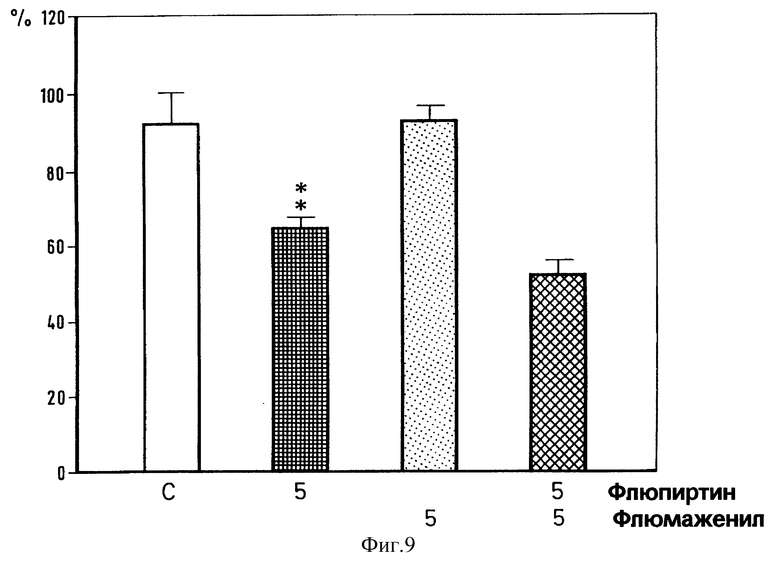
Фиг. 9. Действие внутрибрюшинно введенного флюмаженила и интратекально введеного флюпиртина на силу флексорного рефлекса. Дозировка мг/кг (Флюмаженил) и нмоль (Флюпиртин). Достоверность ** p < 0,01, *** p < 0,001 (U-тест Манна-Уитни).
Сведения, подтверждающие возможность осуществления изобретения
Экспериментальная часть.
Эксперименты in vivo проводились на крысах. Самцы крысы Вистара (вес 250-280 г) получали анестезию уретаном (400 мг/кг) и α- хоралозой (80 мг/кг). Nervus tibialis стимулировался чрескожными игольчатыми электродами для упреждения H-рефлекса (индивидуальные квадратные импульсы длительностью 0,2 мс со стимулирующей силой, вдвое превышающей пороговую, вызывающую рефлекс). Электромиографические упреждения записывались с мышц подошвы ног с использованием пары кожных электродов Клиппеля.
Электрическая стимуляция Nervus tibialis малой стимулирующей силы вызывается рефлекторной реакцией, сходной с рефлексом Хофмана (Н)-рефлекс) у человека, который приписывают моносинаптическому возбуждению спинальных α- мононейронов, преимущественно мышечными) веретенообразными афферентными нейронами. С увеличением силы электростимуляции H-рефлексу предшествует вторая EMG волна, называемая также М-волна с более коротким латентным периодом, которую можно объяснить прямой стимуляцией аксонов альфа-мотонейронов. Десять последовательных мышечных сокращений (рефлексов) усреднили с помощью компьютера как до (контроль), так и после внутрибрюшинного или интратекального введения растворителя или других веществ. Размер М-волны (и соответственно H-рефлекс) определяли измерением амплитуды между двумя пиками.
Для получения сгибательного рефлекса мышцы лапки животного раздражались двумя тонкими подкожными игольчатыми электродами (5 последовательных квадратных импульсов со стимулирующей частотой 500 Гц по 0,2 мс длительностью каждый, со стимулирующей силой, в три раза превышающей пороговую, вызывающую рефлекс). Электромиографические (EMG) упреждения записывались при помощи пары тонких игольчатых электродов, отведенных от N. tibialis. Семь последовательных EMG реакций были выделены и усреднены с помощью компьютера как до, так и после внутрибрюшинного или интратекального введения растворителя или веществ. Величину сгибательного рефлекса определяли по площади, заключенной между рефлекторными кривыми и линией основания.
Во всех рефлекторных опытах измеряемые величины, полученные после введения растворителя или других веществ, давались в процентах относительно соответствующих контрольных величин, измеренных до введения. Статистический анализ выполнен с использованием U-теста Манн-Уитни.
Для интратекальных инъекций катетеризация крыс производилась при помощи полиэтиленовых катетеров (РЕ 10). Атланто-окципитальная мембрана была обнажена и осторожно надрезана в области срединной линии. Катетер был помещен в спинномозговой канал и тонким концом введен в область поясничного отдела. Инъекция растворителя или веществ производилась в объеме 5 ul со скоростью 1 ul в мин. Для уверенности в том, что все количество вещества попало в спинномозговой канал, через катетер затем вводили еще 10 ul растворителя.
После окончания эксперимента точное местонахождение кончика катетера определялось путем введения 2% синьки Эванса.
Флюпиртин (ASTA Medica AG, Germany), иохимбина гидрохлорид (Sigma Chemicals, USA) и празозин (RBI, USA) растворяли в физиологическом растворе. NMDA (Sigma), бикукуллина метиодид (Sigma), 6,7-динитрохиноксалин-2,3-дион (DNQX) (RBI, USA) и АТРА (любезно предоставленный др. Турски, Шеринг, Германия) растворяли в небольшом количестве 1 М NaOH, объем дополнен солевым раствором. Факлофен (Tocris, Great Britain) растворяли в 0,2 N HCl, окончательный объем также достигался добавлением солевого раствора.
Флюмаженил (любезно предоставленный проф. Haefely, Hoffmann-La Roche, Швейцария) растворялся в Твине 80 и дистиллированной воде. pH всех растворов доводили до 7,2-7,4. Во время внутрибрюшинного введения растворитель не влиял ни на моносинаптический H-рефлекс, ни на полисинаптический сгибательный рефлекс. Однако системное применение флюпиртина в дозах от 1 до 10 мг 1 на кг массы тела снижало флексорный (сгибательный) рефлекс в зависимости от введенной дозы (фиг. 1 -3). Эффект от введения флюпиртина наблюдался уже в первые 10 мин и достигал максимума через 10-30 мин после введения. Длительность действия составляла 20-60 мин в зависимости от дозы.
Напротив, на моносинаптический H-рефлекс флюпиртин не оказал воздействия. Даже в самой высокой дозе (10 мг на 1 кг), которая снижает флексорный рефлекс на 50% от начального уровня, на H-рефлекс флюпиртин не повлиял (фиг. 3).
Различное влияние флюпиртина на флексорный и H-рефлекс было подтверждено при интратекальном введении фармакологического препарата. В дозах 33-330 нмоль, флюпиртин снижает флексорный рефлекс после интратекального введения без каких-либо изменений H-рефлекса (фиг. 4). Этот эффект также появлялся в течение 10 мин и длился 40-60 мин в зависимости от выбранной дозы (фиг. 5). Интратекальное введение растворителя не влияет ни на флексорный рефлекс, ни на H-рефлекс. При введении как растворителя, так и флюпиртина М-волна не изменялась. Это свидетельствует об устойчивости выбранного препарата. Данные, полученные во время фармакологических исследований на животных, подтверждены также при изучении воздействия флюпиртина на человека. У людей флюпиртин также снижает флексорные рефлексы не влияя на H-рефлекс.
Для того, чтобы узнать, участвуют ли в миорелаксирующем действии флюпиртина изменения в передаче GABA (γ- аминомасляной кислоты), норадреналина или аминокислот, выделяющихся при возбуждении нервных окончаний, мы исследовали влияние на миорелаксирующий эффект флюпиртина различных веществ, действующих на рецепторы как агонисты или антагонисты. Депрессорный эффект от интратекального введения 165 нмоль флюпиртина оставался неизменным при совместном введении GАВАA-антагониста бикукулина (1 нмоль) и GABAB-антагониста факлофена (100 нмоль) (фиг. 6), α1- - антагониста празозина (10 нмоль) (фиг. 7), или аминокислоты АТРА (α-амино-3-гидрокси-5-тертил-4-изоксазол-проприоновая кислота) (0,1 пм) (фиг. 8), которая представляет собой сильный агонист на кискулатном рецепторе. Эффект от флюпиртина оставался неизменным при внутрибрюшинном введении бензодиазепинового антагониста флюмаженила (5 мг/кг). Флюмаженил назначался системно, поскольку препарат нерастворим в воде и не может вводиться интратекально. В противоположность этому смешанный α1-α2- антагонист иохимбин (10 нмоль) (фиг. 7) и аминокислота NMDA (0,1 нмоль) (фиг. 8) предотвращали при совместном введении с флюпиртином его воздействие на флексорный рефлекс. Бикукулин, празозин, факлофен, АТРА, флюмаженил, иохимбин и NMDA вводились в дозах, которые сами по себе не влияют на силу рефлекса (фиг. 6-9), однако достаточных, чтобы блокировать депрессорное действие GАВАA- агониста мусцимола, α2- агониста тизанидина и NMDA-антагониста 2-амино-фосфоногептаноата (AР7) и мемантина (Schwarz et аl. , 1992) на спинномозговые рефлексы.
Эксперименты последовательно показывают, что полисинаптические флексорные рефлексы снижаются в зависимости от дозы флюпиртина как после интратекального (33-330 нмоль), так и после внутрибрюшинного (1-10 мг/кг) введения фармакологического препарата, при этом моносинаптический H-рефлекс остается неизменным. При совместном введении возбудительной аминокислоты N-метил-D-аспартата (NMDA) и флюпиртина действие последнего уменьшается. В соответствии с полученными данными можно сделать вывод, что действие флюпиртина основано на торможении переноса возбудительных аминокислот. В данном случае перенос через NMDA рецепторы чрезвычайно ухудшается.
Флюпиртин можно применять вместе с препаратами, назначаемыми при лечении паркинсонизма, такими, как L-допа и другими допаминовыми агонистами в комбинации или последовательно. При применении флюпиртина в комбинации с другими препаратами используют следующие дозировки:
- L-допа 2 - 200 мг (как фиксированное сочетание с бенсеразидом или карбидопой) и 5-100 мг флюпиртина;
- при использовании допаминовых агонистов, таких, как бромокриптин, в качестве одного из компонентов назначают 0,5 - 10 мг бромокриптина и 5 -100 мг флюпиртина;
- в комбинации с лизуридом: 0,05 - 0,2 мг лизурида и 5-100 мг флюпиртина;
- перголид используют в дозе 0,01-1 мг и 5-100 мг флюпиртина,
- ингибитор МАО-Вселегилин применяют в комбинации с флюпиртином в дозе 0,1-5 мг и 5-100 мг флюпиртина.
Аналогично, флюпиртин может назначаться отдельно или в комбинации сантиоксидантами, противоэпилептическими препаратами, нейролептиками, препаратами, улучшающими кровообращение.
Свойства флюпиртина позволяют применять его в нейролептаналгезии самостоятельно или в сочетании с другими нейролептиками. Медицинский препарат может выпускаться в следующих формах: таблетки, таблетки в облатке, жесткие и мягкие желатиновые капсулы, гранулы, таблетки с оболочкой, суппозитории (свечки), микрокапсулы, пилюли, водная и масляная суспензия, масляный раствор, раствор для внутримышечных, интратекальных инъекций, раствор для внутривенных инъекций и инфузий. Для приготовления препаратов флюпиртина можно использовать такие физиологически приемлемые соли как хлориды, малеаты, глюконаты, сульфаты. Указанные дозы препаратов относятся только к флюпиртину, как основе. Если используются соли флюпиртина расчет производится в соответствии с молекулярной массой.
Возможен выпуск флюпиртина в различных формах, с использованием методов, описанных в опубликованной заявке ФРГ 39 12 292.
Количество флюпиртина в препаратах по изобретению составляет: от 10 мг до 3000 мг, предпочтительно 20 мг - 2000 мг, особо предпочтительно 50 мг - 1500 мг флюпиртина в препарате. Медицинский препарат может назначаться орально, ректально, внутривенно, внутримышечно, интратекально.
Кратность приема от 1 до 5 раз, возможно от 1 до 3 раз, особо предпочтительно 1-2 раза в сутки.
Предложено новое средство для лечения церебральной ишемии, нейродегенеративных расстройств, травм головного мозга, эпилептических приступов, синдромов повышенной церебральной возбудимости, нейродегенеративных синдромов периферической нервной системы, болезни Альцгеймера, хореи Гентингтона, множественного склероза, амиотрофического латерального склероза, нейродегенеративных расстройств инфекционного генеза и метаболическо-токсических нейродегенеративных расстройств. В качестве такого средства предложен Флюпиртин, для которого выявлено NMDA - антагонистическое действие. Изобретение расширяет арсенал средств указанного назначения. 9 ил.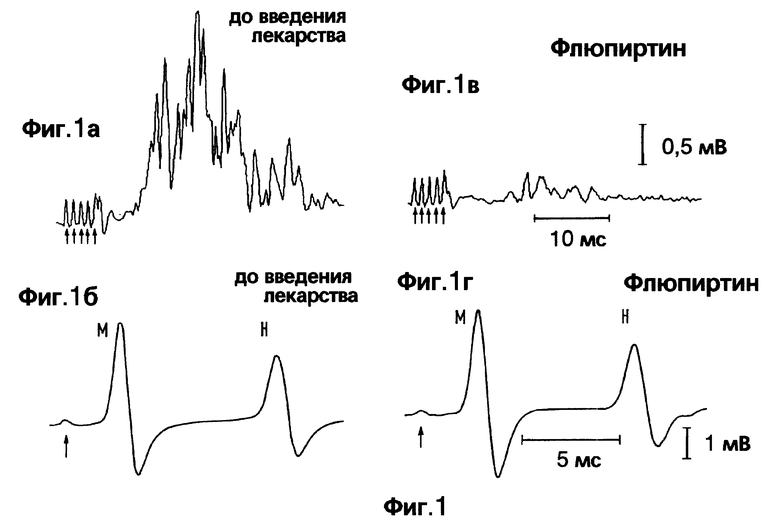
Применение флюпиртина в качестве действующего вещества медицинских и фармакологических средств с активностью антагониста эксайторных аминокислот при лечении церебральной ишемии, дегенеративных и ишемических процессов в сетчатке, травм головного мозга, синдромов повышенной церебральной возбудимости, нейродегенеративных синдромов периферической нервной системы, болезни Альцгеймера, хореи Гентингтона, множественного склероза, амиотрофического латерального склероза, нейродегенеративных расстройств инфекционного генеза и метаболическо-токсических нейродегенеративных расстройств.
| DE 3337593, 03.05.1984 | |||
| 1972 |
|
SU410114A1 | |
| WO 9112797 A1, 05.01.1991 | |||
| WO 9511016 A1, 27.04.1995 | |||
| В.В.МИХЕЕВ | |||
| Нервные болезни | |||
| - М.: Медицина, 1974, с.262-264. | |||
Авторы
Даты
2001-05-10—Публикация
1994-08-10—Подача