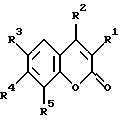
Изобретение относится к новым кумаринхинолонкарбоновым кислотам, в которых система пиридона конденсирована в 3,4-; 6,7- и 7,8-положениях кумариновой системы общей формулы I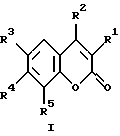
где R1R2 = -NHCH=C(CO2R6)CO-, R3 = NO2 или NH2, R4 = R5 = H, R6 = H или C2H5;
R1R2 = -NHCH=C(CO2R6)CO-, R3 = R4 = H, R5 = F, R6 = H или C2H5;
R1R2 = -CO(CO2R6)C=CHNH-, R3 = R4 = R5 = H, R6 = H или C2H5;
R1R2 = R3R4 = -NHCH = C(CO2R6)CO-, R5 = H, R6 = H или C2H5;
R1 = H или ОН, R2 = R5 = H, R3R4 = -NHCH-C(CO2R6)CO-, R6 = H или C2H5;
R1 = ОН, R2 = R3 = H, R4R5 = -CO(CO2R6)C=CHNH-, R6 = H или C2H5;
R1 = R5 = H, R2 = CH3 или CF3, R3R4 = -CO(CO2R6)C = CHNH-, R6 = H или C2H5,
а также к их фармацевтически приемлемым солям.
Объектом изобретения также являются способы получения новых кумаринхинолонкарбоновых кислот, а также их биологическое действие.
В соответствии с настоящим изобретением новые кумаринхинолонкарбоновые кислоты общей формулы I получают из сложных кумаринмалонатных эфиров формулы II, описанных в патентной заявке Хорватии P-960308A (европейская патентная заявка N...) от 2 июля 1996 г.
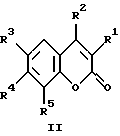
где R1 = -NHCH = C(CO2C2H5)2, R2 = R4 = H или NO2, R5 = H или F;
R1 = R3 = -NHCH-C(CO2C2H5)2, R2 = R4 = R5 = H;
R1 = H или ОН, R3 = -NHCH = C(CO2C2H5)2, R2 = R4 = R5 = H;
R1 = ОН, R2 = R3 = R4 = H, R5 = -NHCH-C(CO2C2H5)2;
R1 = R3 = R5 = H, R2 = CH3 или CF3, R4 = -NHCH=C(CO2C2H5)2, которые нагревают в Dowtherm A при 250-260oC в течение 10 минут - 13 часов для получения циклизованных сложных эфиров общей формулы III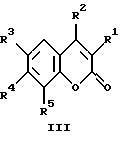
где R1R2 = -NHCH=C(CO2C2H5)CO-, R3 = R4 = H, R5 = F;
R1R2 = -NHCH-C(CO2C2H5)CO-, R3 = NO2, R4 = R5 = H;
R1R2 = -CO(CO2C2H5)C = CHNH-, R3 = R4 = H, R5 = H или F;
R1R2 = R3R4 = -NHCH-C(CO2C2H5)CO-, R5 = H;
R1 = H или ОН, R2 = R5 = H, R3R4 = -NHCH=C(CO2C2H5)CO-,
R1 = OH, R2 = R3 = H, R4R5 = -CO(CO2C2H5)C=CHNH-,
R1 = R5 = H, R2 = CH3 или CF3, R3R4 = -CO(CO2C2H5)C=CHNH-.
Для соединения формулы III, где R1R2 = -CO(CO2C2H5)C=CHNH-, R3 = R4 = H, R5 = H, в работе D.T.Connor, P.A. Young, M. von Strandtman, J. Heterocyclic Chem. , 18, (1981) 697-702 подчеркивается, что попытка циклизовать соответствующий сложный кумаринмалонатный эфир в эфир формулы III, имеющий вышеупомянутые заместители, была неуспешной, и таким образом также не была получена соответствующая кислота; указанная кислота, помимо сложного эфира формулы III, также является предметом настоящего изобретения и она имеет общую формулу I со значениями R1R2 = -CO(CO2H)C = CHNH, R3 = R4 = H, R5 = H.
Соединение формулы III, где R1R2 = -NHCH=C(CO2C2H5)CO-, R3 = R4 = H, R5 = H (описано ранее в патенте США N 4210758 D.T. Connor (Warner-Lambert Company)), вначале нитруют, затем восстанавливают и, наконец, конденсируют с диэтил-этилоксиметиленмалонатом с образованием соединения формулы IV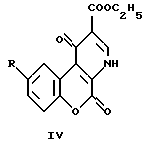
где R = NO2 или NH2.
Для получения соединений общей формулы I, где R2R2 = -NHCH-C(CO2C2H5)CO-, R3 = NH2, R4 = R5 = H, соединения общей формулы III, где R1R2 = -NHCH-C(CO2C2H5)CO-, R3 = NO2, R4 = R5 = H, восстанавливают в ледяной уксусной кислоте в присутствии палладия на активированном угле в качестве катализатора и в потоке азота при 3 бар в течение 6 часов.
Путем гидролиза соединений формулы III получают кумаринхинолонкарбоновые кислоты формулы I, где R1, R2, R3, R4 и R5 имеют ранее описанные значения и R6 = Н.
Кумаринхинолонкарбоновые кислоты, которые являются предметом настоящего изобретения, а также их фармацевтически приемлемые соли, являются ингибиторами испытанных штаммов бактерий. В этих испытаниях использовался тест микроразбавления для исследования чувствительности бактерий согласно методу NCCLS (M7-A2, том 10, N 8, 1990; M100-S4, том 12, N 20, 1992). Контрольными испытуемыми микроорганизмами, используемыми в этих экспериментах, являлись S. aureus АТСС 29213, Е. faecalis АТСС 29212 и P. aeruginosa АТСС 29213 с норфлоксацином и энорфлоксацином как рабочими стандартами антибиотиков для сравнения. Испытывались следующие штаммы: Skaphiloc. aureus ATCC 6538P, Bacillus subtilis NCTC 8236, Micrococcus flavus ATCC 10240, Pseudomonas aerug. NCTC 10490, Salmonella Panama 6117, E. coli Lac.+ 6131, E. coli Lac - 6130, b-Haemol. streptococc. - B J22, b-Haemol. streptococc. -A J-21, Streptococcus pyogenes 20F, Streptococcus faecalis ATCC 8043, E. coli ATCC 10536, Staphyloc. epidermis ATCC 12228, В. Cereus, AYTC 11778, В. pumalis ATCC 8241 и В. subtilis ATCC 6633.
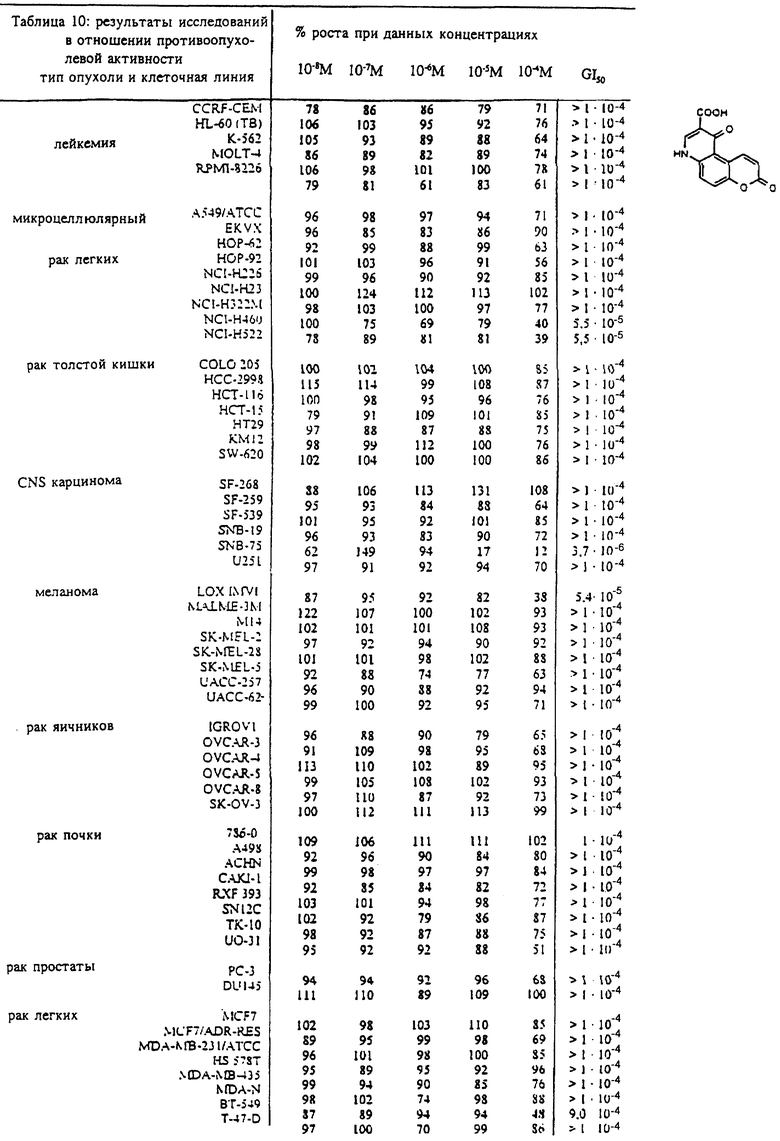
4,5-дигидро-4,5-диоксо-1H-[1] бензопирано[4,3-b] пиридин-3- карбоновая кислота ингибировала E. coli Lac+ 6131 и b-Haemol. streptococc.- A J-21.
1,5-Дигидро-1,5-диоксо-7-фтор-4H-[1] бензопирано[3,4-b] пиридин-3-карбоновая кислота ингибировала исследованные штаммы.
4,7-Дигидро-4,7-диоксо-1H-[1] бензопирано[6,7-b] пиридин- 3-карбоновая кислота ингибировала Bacillus subtilis NCTC 8236, Streptococcus pyogenes 20F и Streptococcus faecalis ATCC 8043.
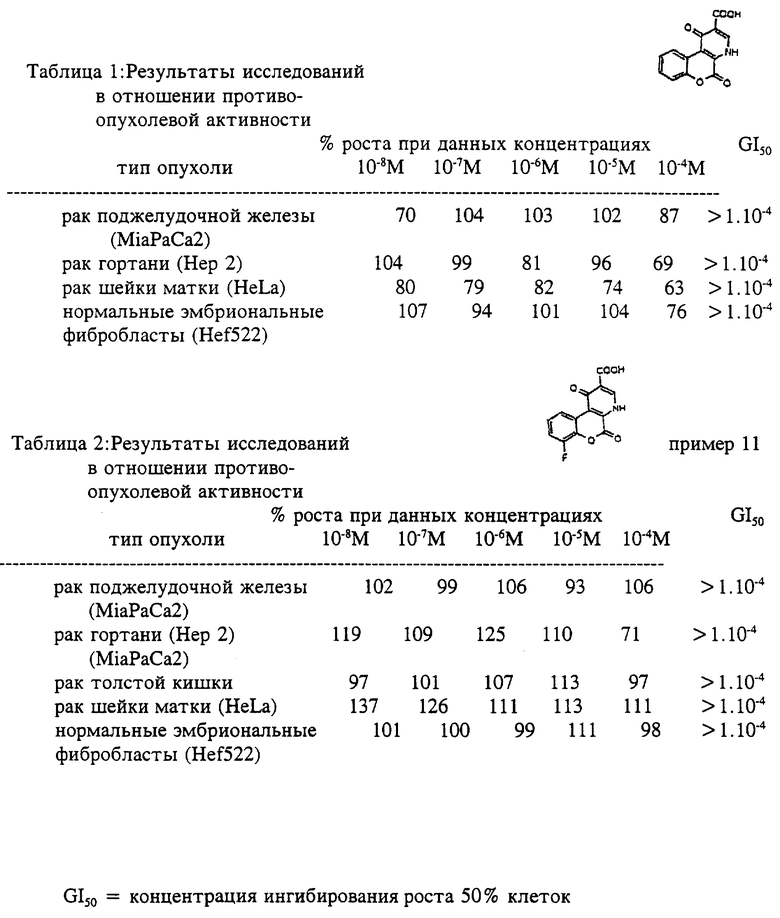
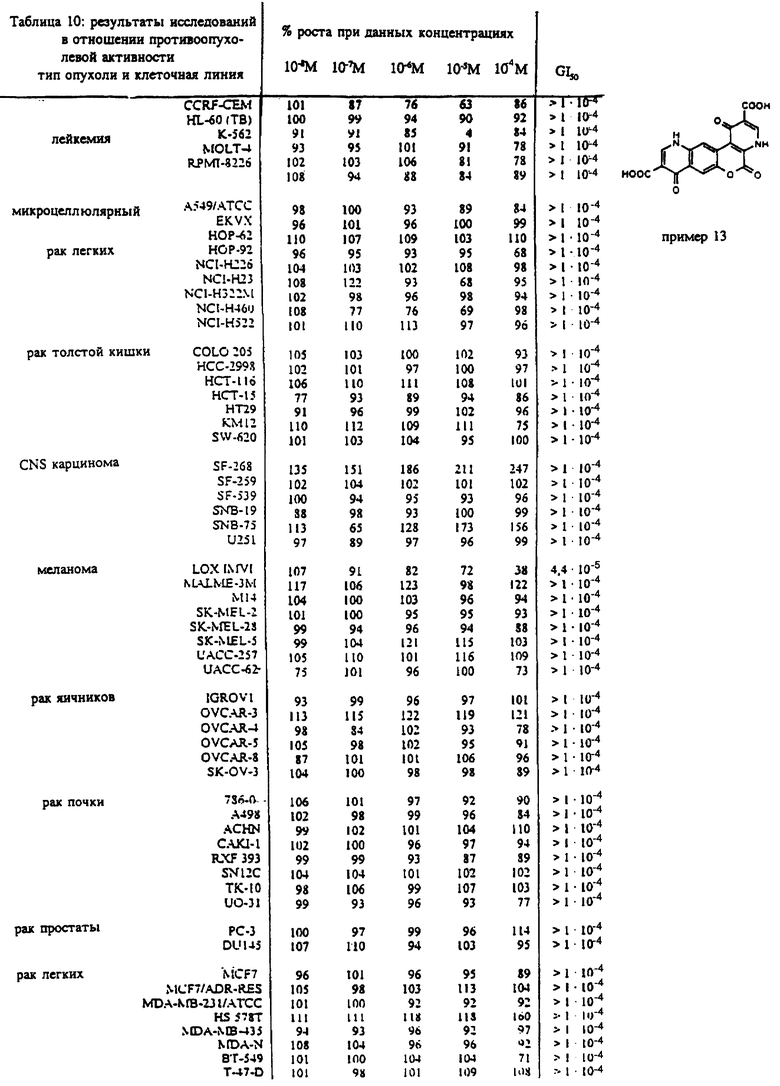
Кумаринхинолоновые кислоты по настоящему изобретению и их фармацевтически приемлемые соли также исследовали на противоопухолевое действие in vitro. Противоопухолевое действие исследовали на рост клеточных линий рака молочной железы (MCF7), рака шейки матки (HeLa), рака поджелудочной железы (MiaPaCa2), рака гортани (Hep2) и на нормальных фибробластах человека (Hef522).
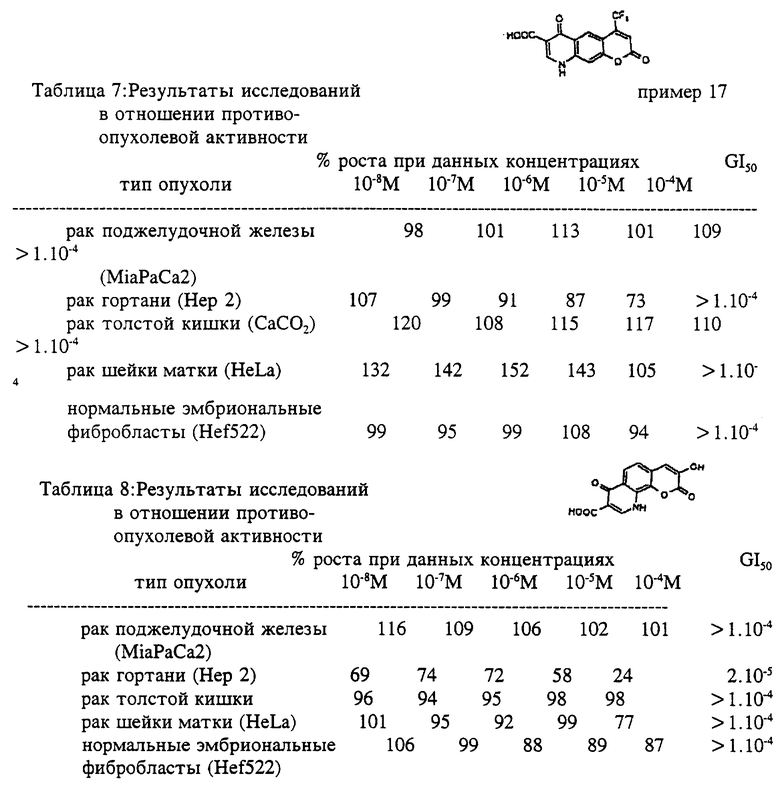
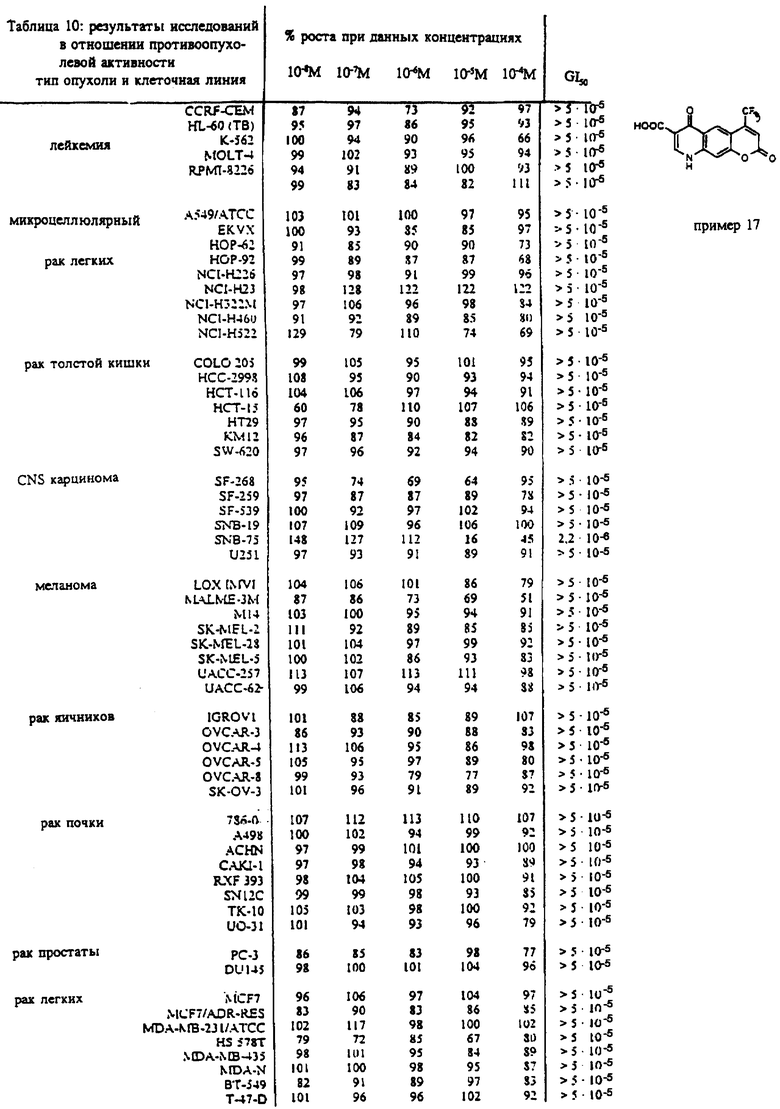
1,7-дигидро-1,7-диоксо-9-(трифторметил)-4H-[1] бензопирано[6,7-b]пиридин-3-карбоновая кислота ингибировала рост клеток рака молочной железы (MCF7), рака поджелудочной железы (MiaPaCa2) и рака гортани (Hep2) и слегка стимулировала рост клеток рака шейки матки (HeLa) при высоких концентрациях. Она не имела значительного воздействия на рост фибробластов (Hef522).
Рост MCF7 ингибировался в зависимости от концентрации, и наилучшее ингибирование было достигнуто при 10-5 и 10-8 М.
Она не влияла на рост клеток HeLa в диапазоне концентраций от 10-8 до 10-6 М, в то время как стимулировала их рост при более высоких концентрациях (10-5 и 10-4 М).
Рост клеток UiaPaCa2 ингибировался в зависимости от концентрации. При концентрации 10-4 М было достигнуто ингибирование 35%.
Испытываемое соединение ингибировало рост клеток Hep2, причем при повышении концентрации ингибиторное действие снижалось, и наилучшие результаты были достигнуты в диапазонах концентраций 10-7 и 10-5 М.
Испытываемое соединение не влияло на рост нормальных фибробластов (Неf522).
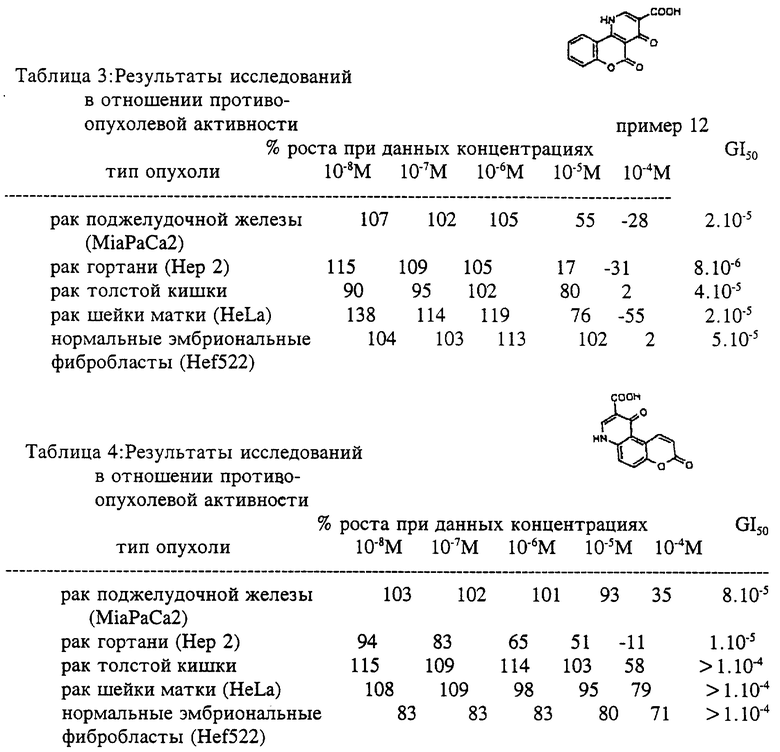
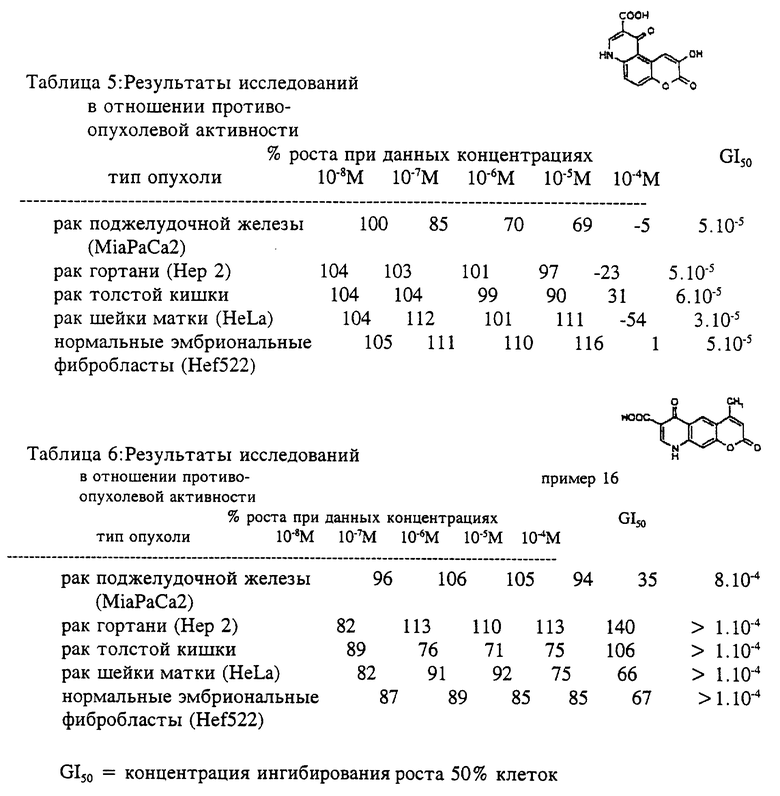
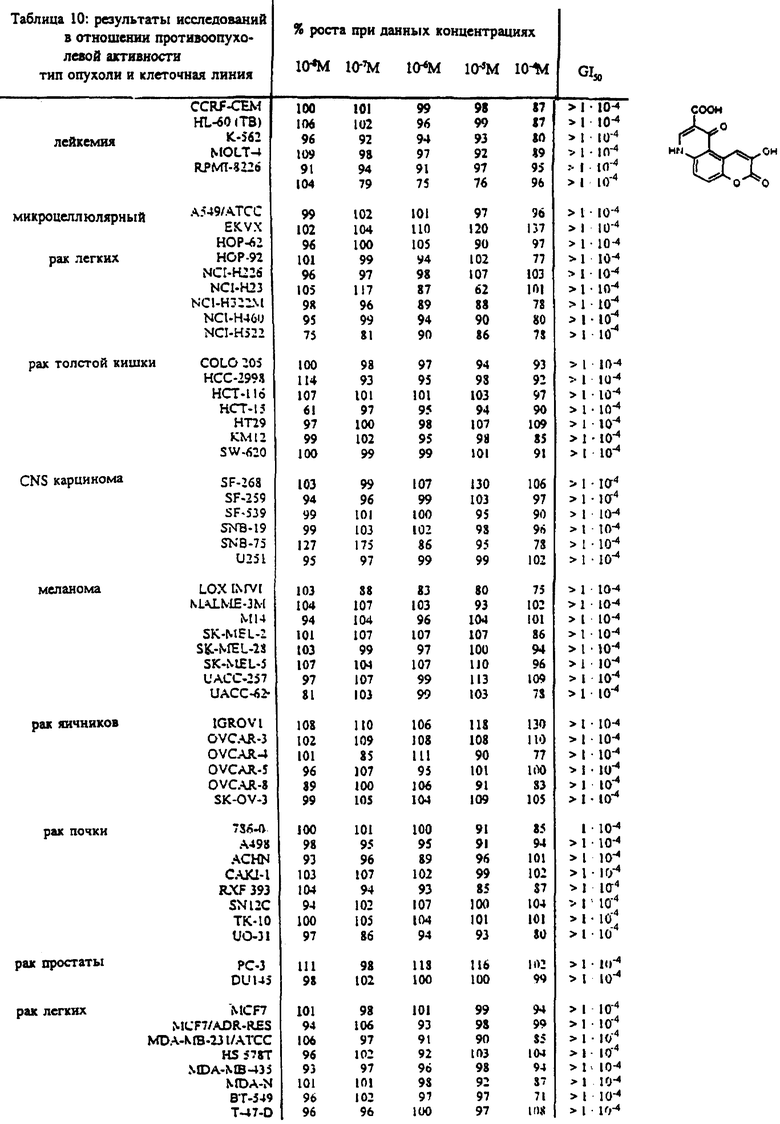
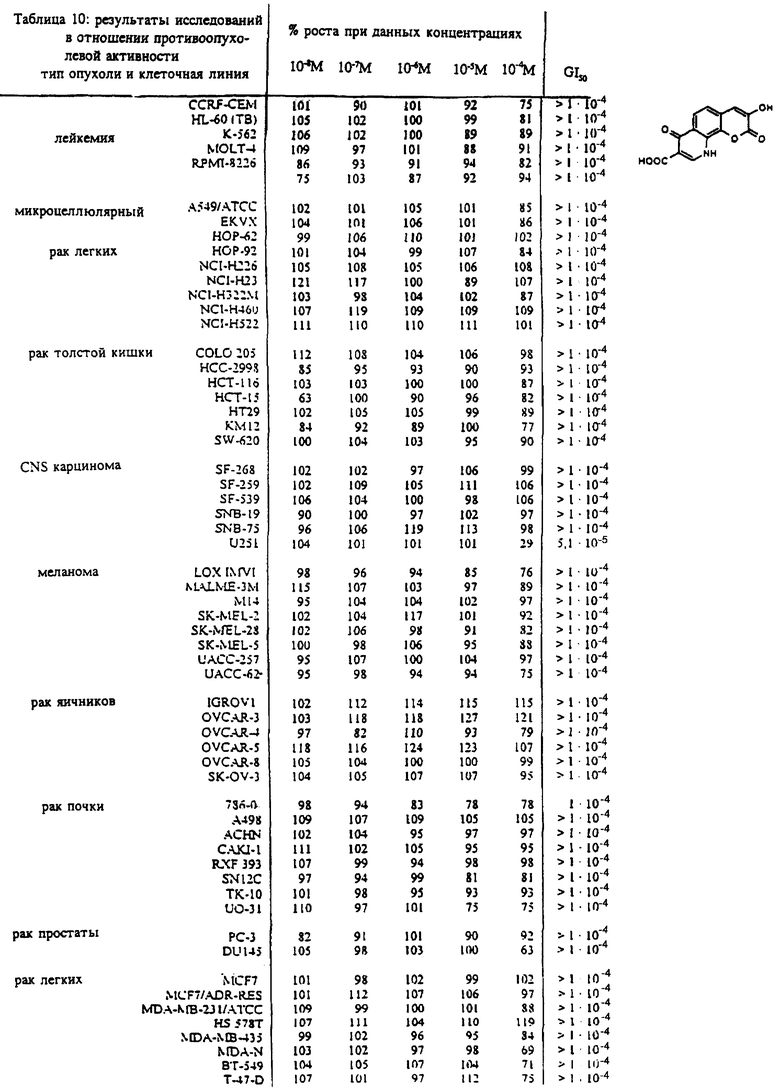
Изобретение иллюстрируется следующими примерами, которые ни в коем случае не надо рассматривать как ограничивающие. Результаты исследований в отношении противоопухолевой активности представлены в табл. 1-10.
Пример 1
Этил-1,5-дигидро-1,5-диоксо-7-фтор-4H-[1] бензопирано[3,4-b] пиридин-2-карбоксилат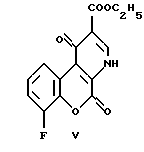
Раствор диэтил-{[(8-фтор-2-оксо-2H-[1]-бензопирано-3- ил)амино]метилен} малоната (2.40 г, 0.871 ммоль) в Dowtherm A (55 мл) нагревали 40 минут при температуре кипения. В охлажденный раствор добавили петролейный эфир с низкой температурой кипения, чтобы способствовать полному осаждению полученного сложного эфира. Полученный осадок этил-1,5-дигидро-1,5-диоксо-7-фтор-4H-[1] бензопирано[3,4-b]-пиридин-2-карбоксилата серо-коричневого цвета промывали вначале петролейным эфиром, а затем диэтиловым эфиром (1.85 г, 89%). Т.пл.: 288-290oC.
Анализ: рассчитано для C15H10FNO5: C 59.41; H 3.32; N 4.62;
найдено: C 59.74; H 2.97; N 4.72.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (т, CH3); 4.3 (кв., CH2); 6.8-7.6 (м, Ar H), 8.3 (с, Py H), 9.3 (д, NH).
Пример 2
Этил-4,5-дигидро-4,5-диоксо-1Н-[1] бензопирано[3,4-b] пиридин-3-карбоксилат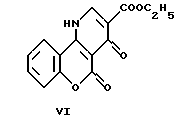
Он был получен по способу, описанному в примере 1, исходя из диэтил{ [(2-оксо-4H-[1] -бензопирано-3-ил)амино] метилен} -малоната (3.96 г, 0.012 моль). Продолжительность реакции: 13 часов. Получен этил-4,5-дигидро-4,5-диоксо-1Н-[1]бензопирано[3,4-b]пиридин-3-карбоксилат (1,90 г, 56%).
Анализ: рассчитано для C11H15NO5: C 63.16; H 3.89; N 4.91;
найдено: C 62.98; H 3.92; N 5.07.
1Н-ЯМР (TFA) δ м.д. 1.2 (т, CH2); 4.3 (кв., CH3); 7.3-8.0 (м, Ar H), 8.4 (с, Py H), 11.3 (д, NH).
Пример 3
Диэтил-1,5,8-тригидро-1,5,8 -триоксо-4,11H-[1] бензопирано[3,4-b] [7,6-с]дипиридин-2,9-дикарбоксилат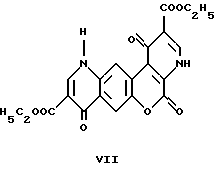
Он был получен по способу, описанному в примере 1, исходя из тетраэтил-[[(2-оксо-2H-[1] -бензопирано-3,6-диил) диамино]диметилен]малоната (2,00 г, 3,872 моль). Продолжительность реакции: 50 минут. Полученный диэтил-1,5,8-тригидро-1,5,8-триоксо- 4,11H-[1] -бензопирано[3,4-b] [7,6-c]дипиридин-2,9-дикарбоксилат коричневого цвета перекристаллизовывали из абсолютированного этанола (1,43 г, 87%). Т.пл.: 175 -177oC.
Анализ: рассчитано для C21H16N2O5: C 59.43; H 3.80; N 6.60;
найдено: C 59.72; H 3.89; N 6.89.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (2т, 2 CH3); 4.2 (2 кв., 2 CH2); 7-10 (м, C H, Ar H, Py H); 10.6 и 12,3 (2 д, 2 NH).
Пример 4
Этил-4,7-дигидро-4,7-диоксо- 1H-[1] -бензопирано [6,7-b]пиридин-3-карбоксилат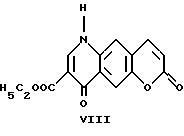
Он был получен по способу, описанному в примере 1, исходя из диэтил-[[(2-оксо-2H-[1]-бензопирано-3-ил)амино]метилен]малоната (3,10 г, 9,357 ммоль). Продолжительность реакции: 45 минут. Полученный желто-коричневый осадок этил-4,7- дигидро-4,7-диоксо-1H-[1] -бензопирано[6,7-b]пиридин- 3-карбоксилата перекристаллизовывали из N,N-диметилформамида (2,23 г, 84%). Т.пл. > 300oC.
Анализ: рассчитано для C15H11NO5: C 63.16; H 3.89; N 4.91;
найдено: C 63.05; H 3.92; N 4.88.
1H-ЯМР (ДМСО-d6) δ м. д. 1.3 (т, CH3); 4.2 (2 кв, CH2); 6,5 (д, H8), 7,4-8,0 (м, Ar H, Py H); 8,4 (д, H9); 10,7 (д, NH).
m/z: 284 (М-), 258, 256, 239, 212, 183, 127, 79.
Пример 5
Этил-4,7-дигидро-4,7-диоксо-3-гидрокси-1H-[1]- бензопирано[6,7-b]пиридин-3-карбоксилат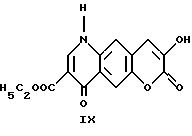
Он был получен по способу, описанному в примере 1, исходя из диэтил-[[(3-гидрокси-2-оксо-2H-[1] -бензопирано-6-ил) амино]метилен]малоната (3,63 г, 0,011 моль). Продолжительность реакции: 15 минут. Получен светло-желто-коричневый осадок этил-4,7-дигидро-4,7-диоксо-3-гидрокси-1H-[1]- бензопирано [6,7-b]пиридин-3-карбоксилата (3,63 г, 95%). Т.пл.: > 300oC.
Анализ: рассчитано для C15H11NO6: C 59.80; H 3.68; N 4.65;
найдено: C 59.66; H 3.61; N 4.27.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (т, CH3); 4.2 (кв., CH2); 7,2-9,3 (м, Ar H, Py H); 10,7 (с, OH); 12,4 (с, NH).
m/z: 300 (М-), 273, 272, 255, 227, 178, 136, 91, 68, 54.
Пример 6
Этил-1,7-дигидро-1,7-диоксо-9-метил-4H- [1] -бензопирано [6,7-b] пиридин-2-карбоксилат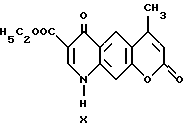
Он был получен по способу, описанному в примере 1, исходя из диэтил-[[(4-метил-2-оксо-2H-[1] -бензопирано-7-ил)амино] метилен]малоната (5,70 г, 0,017 моль). Продолжительность реакции: 10 минут. Получен серо-коричневый осадок этил-1,7-дигидро-1,7-диоксо-9-метил-4H-[1] -бензопирано[6,7-b] пиридин-2-карбоксилата (3,43 г, 69%). Т.пл. > 300oC.
Анализ: рассчитано для C16H13NO5: C 64.21; H 4.38; N 4.68;
найдено: C 64.36; H 4.14; N 4.50.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (с, CH3); 2.1 (т, CH2); 4,1 (кв., CH2); 6,2 (д, H8); 7,4 (д, H5); 7,7 (т, H10); 10,3 (с, Py H); 12,4 (шс, NH).
Пример 7
Этил-4,7-дигидро-4,7-диоксо-9-(трифторметил)-1H- [1]-бензопирано[6,7-b] пиридин-2-карбоксилат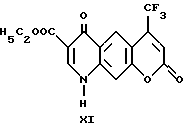
Он был получен по способу, описанному в примере 1, исходя из диэтил-[[(4-трифторметил)-2-оксо-2H-[1] -бензопирано-7-ил) амино] метилен]малоната (2,00 г, 0,005 моль). Продолжительность реакции: 15 минут. Получен светло-желтый осадок сложного эфира (1,67 г, 94%). Т.пл. > 300oC.
Анализ: рассчитано для C16H10F3NO5: C 54.40; H 2.85; N 3.97;
найдено: C 54.41; H 2.97; N 3.86.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (т, CH3); 4,2 (кв., CH2); 7,0 (д, H8); 7,4 (с, H5); 7,9 (д, H10); 8,5 (д, Py H); 12,4 (шс, NH).
Пример 8
Этил-1,6-дигидро-1,6-диоксо-7-гидрокси-4H-[1] - бензопирано[7,8-b]пиридин-2-карбоксилат
Он был получен по способу, описанному в примере 1, исходя из диэтил-[[(3-гидрокси-2-оксо-2H-[1] -бензопирано-8-ил) амино]метилен]малоната (3,15 г, 9,070 моль). Продолжительность реакции: 40 минут. Получен этил-1,6-дигидро-1,6-диоксо-7- гидрокси-4H-[1]-бензопирано[7,8-b]пиридин-2-карбоксилат оранжево-коричневого цвета (2,35 г, 86%). Т.пл. > 300oC.
Анализ: рассчитано для C15H11NO6: C 59.80; H 3.68; N 4.65;
найдено: C 59.45; H 3.29; N 4.28.
1H-ЯМР (ДМСО-d6) δ м.д. 1.3 (т, CH3); 4,2 (кв., CH2); 7,1-8,3 (м, Ar H Py H); 10,4 (с, OH); 11,8 (с, NH).
m/z: 302 (М+), 171, 155, 141.
Пример 9
Этил-1,5-дигидро-1,5-диоксо-9-нитро-4H-[1] -бензопирано-[3,4-b] пиридин-2-карбоксилат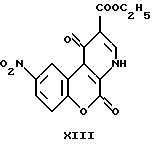
К раствору этил-1,5-дигидро-1,5-диоксо-4H-[1]-бензопирано[3,4-b] пиридин-2-карбоксилата (0,81 г, 2,840 ммоль) в концентрированной серной кислоте (3,73 г, 0,038 моль), которая была охлаждена до 0-5oC, при перемешивании по каплям добавляли смесь азотной кислоты (d = 1.4, 1.01 г, 0.016 моль) и концентрированной серной кислоты (1.96 г, 0.020 моль). Реакционную смесь перемешивали еще 10 минут после достижения комнатной температуры и затем ее выливали в смесь воды и льда. Полученный этил-1,5-дигидро-1,5-диоксо-9-нитро-4H-[1] -бензопирано[3,4-b]пиридин- 2-карбоксилат перекристаллизовывали из этанола (0.89 г, 95%). Т.пл.: 246-247oC.
Анализ: рассчитано для C15H10N2O7: C 54.55; H 3.05; N 8.48;
найдено: C 54.50; H 2.87; N 8.65.
1H-ЯМР (TFA) δ м.д. 1.2 (т, CH3); 4.3 (кв., CH2); 7,4 (д, H7); 8.3 (д, H8); 9,1 (с, H10); 9,6 (с, Py H); 11.3 (с, NH).
m/z: 329 (М-), 313, 301, 284, 269, 257, 256, 241, 228, 151.
Пример 10
Этил-1,5-дигидро-1,5-диоксо-9 -амино-4H-[1] -бензопирано[3,4-b] пиридин-2-карбоксилат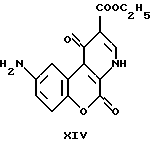
К раствору этил-1,5-дигидро-1,5-диоксо-9-нитро-4H-[1] - бензопирано[3,4-b] пиридин-2-карбоксилата (0,50 г, 1,514 ммоль) в ледяной уксусной кислоте (150 мл) добавили катализатор (4,92% Pd/C, 0.15 г), и восстановление проходило 6 часов в потоке азота при 3 бар. После завершения реакции уксусную кислоту выпаривали из отфильтрованной реакционной смеси. Полученный амин (0.59 г, 100%) перекристаллизовывали из ледяной уксусной кислоты. Т.пл.: 270-272oC.
Анализ: рассчитано для C15H22N2O5 • C2H4O2: C 58.18; H 4.28; N 8.48;
найдено: C 57.94; H 4.14; N 8.24.
1H-ЯМР (TFA) δ м.д. 1.3 (т, CH3); 4.4 (кв., CH2); 7,4-7,8 (м, Ar H); 9,2 (м, Py H); 11.3 (с, NH).
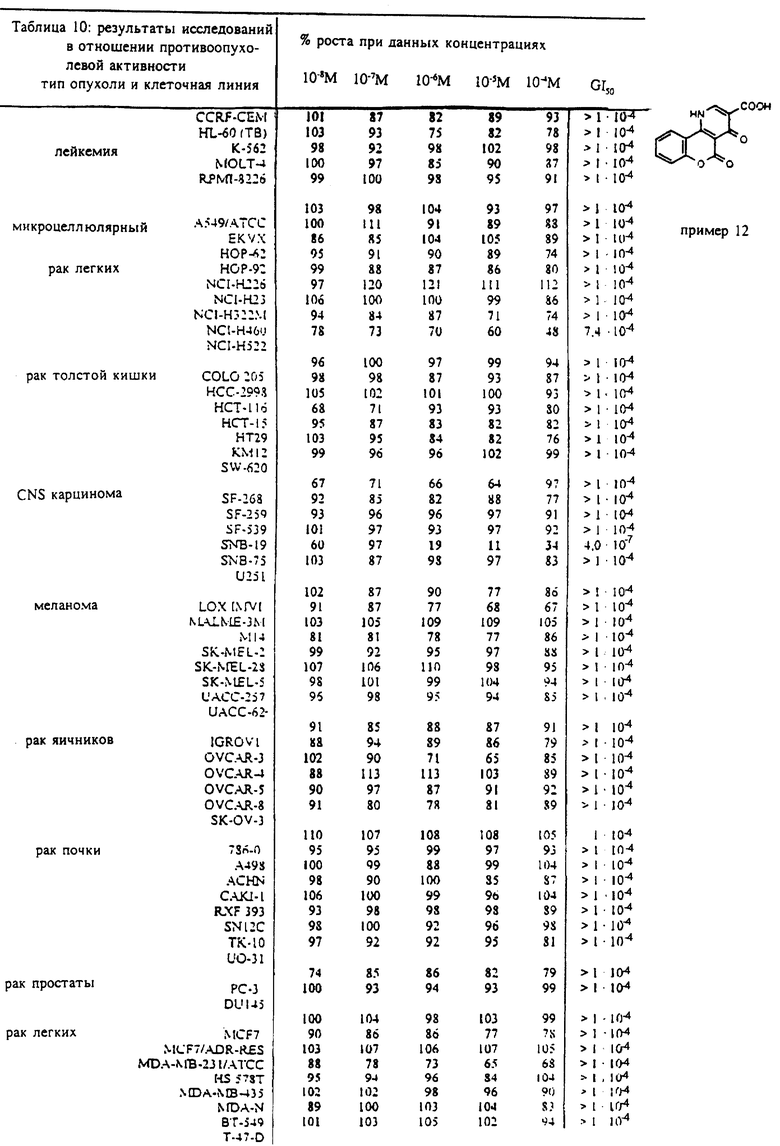
Пример 11
1,5-дигидро-1,5-диоксо-7-фтор-4H- [1]-бензопирано[3,4-b]пиридин- 2-карбоновая кислота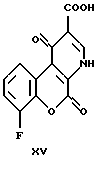
Раствор этил-1,5-дигидро-1,5-диоксо- 7-фтор-4H-[1]-бензопирано [3,4-b] пиридин-2-карбоксилата (1.70 г, 5.606 ммоль) в 10% водном растворе гидроксида натрия (22 мл) нагревали в течение 90 минут при температуре кипения, затем кипятили примерно 5 минут с активированным углем. В фильтрате кислоту осаждали 10% водным раствором соляной кислоты (до pH 2-3) и охлажденный раствор оставляли стоять в течение нескольких часов при +4oC. Полученный светло-желтый осадок кислоты (1.50 г; 97%) перекристаллизовывали из смеси этилацетат/этанол (1:1) или из N,N-диметилформамида. Т.пл. > 300oC.
Анализ: рассчитано для C13H6FNO5: C 56.74; H 2.20; N 5.09;
найдено: C 56.52; H 1.84; N 5.11.
1H-ЯМР (TFA) δ м. д. 7,3-7,4 (м, 3 Ar Н); 8,7 (м, Py H); 9,2 (с, NH); 11,3 (с, COOH).
Пример 12
4,5-дигидро-4,5-диоксо-4H-[1] -бензопирано[4,3-b] пиридин-3-карбоновая кислота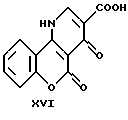
Раствор этил-4,5-дигидро-4,5 -диоксо-4H-[1] -бензопирано [4,3-b]пиридин-3-карбоксилата (1.90 г, 6.661 ммоль) в 1 М гидроксиде натрия (50 мл) нагревали в течение 90 минут при температуре кипения, а затем короткое время кипятили с активированным углем, фильтровали и фильтрат подкисляли 10% водным раствором соляной кислоты (до pH 2-3); кислота выпадала в осадок (1.54 г, 95%). Т.пл. > 300oC.
Анализ: рассчитано для C13H7NO5: C 60.70; H 2.74; N 5.45;
найдено: C 60.37; H 2.43; N 5.51.
1H-ЯМР (ДМСО-d6) δ м.д. 7,5 (д, H7): 7,8 (т, H9); 8,4 (д, H10); 8,7 (м, H8, Py H); 9,2 (с, NH); 11,3 (с, COOH).
m/z: 256 (М-), 240, 239, 223, 212, 211, 183, 120, 82.
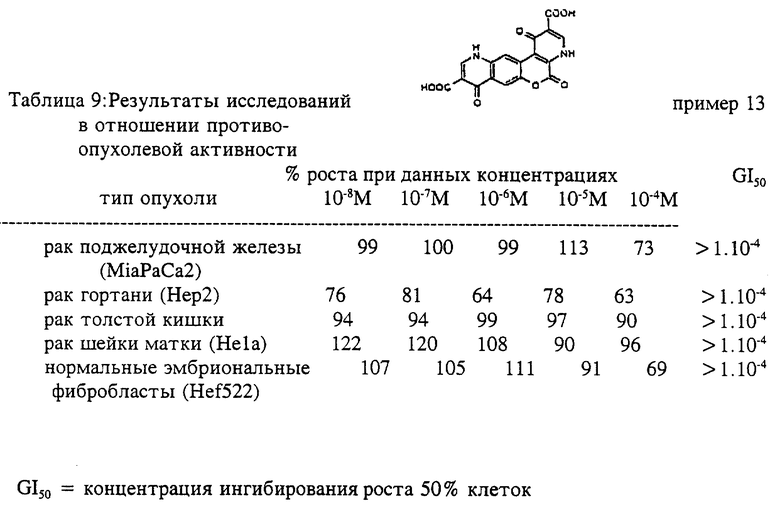
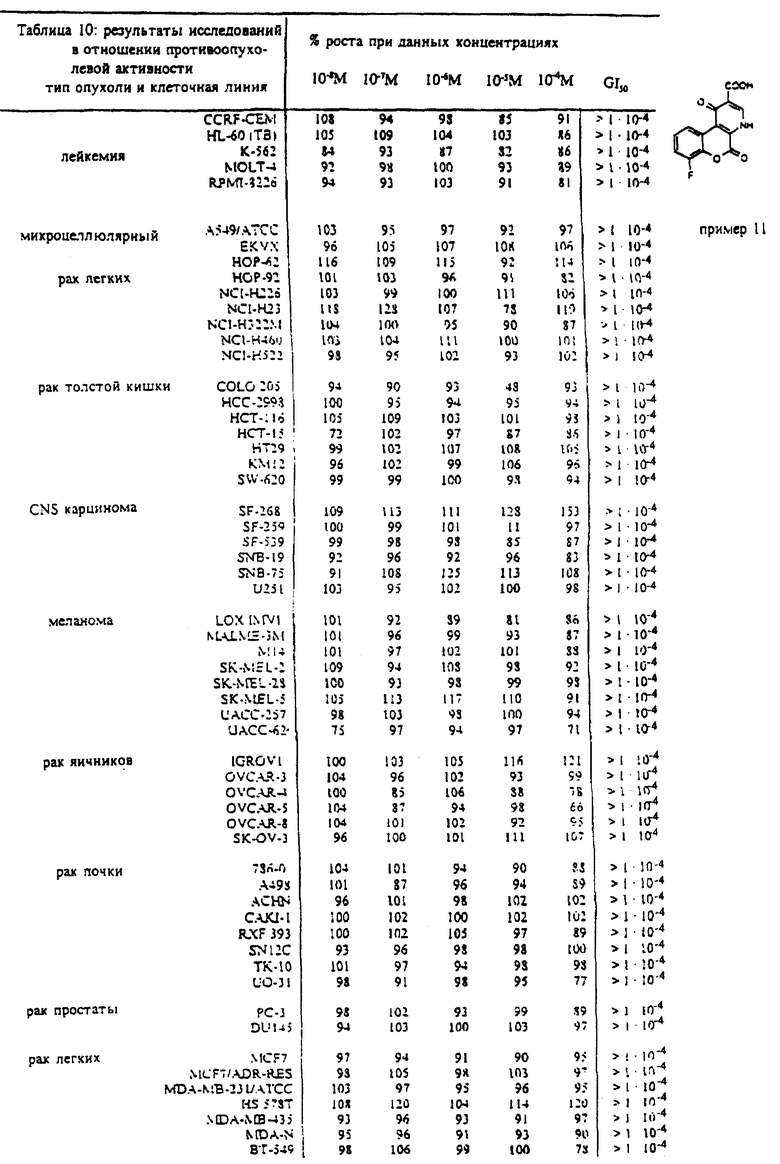
Пример 13
1,5,8-тригидро-1,5,8-триоксо- 4,11H-[1]-бензопирано [3,4-b][7,6-с]дипиридин- 2,9-дикарбоновая кислота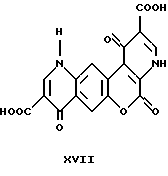
Она была получена по способу, описанному в примере 12, исходя из диэтил-1,5,8-тригидро-1,5,8 -триоксо-4,11H-[1] -бензопирано [3,4-b][7,6-с]дипиридин-2,9-дикарбоксилата (0.90 г, 121 ммоль). Продолжительность реакции: 45 минут. Полученная кислота имела желто-коричневый цвет (0.45 г, 58%). Т. пл. > 300oC.
Анализ: рассчитано для C17H8N2O8: C 55.44; H 2.19; N 7.61;
найдено: C 55.22; H 2.58; N 7.50.
1H-ЯМР (ДМСО-d6) δ м.д. 7,1-9,5 (м, Ar H, Py H); 12,3 (д, 2 NH); 14,8 (с, COOH); 15,4 (с, COOH).
m/z: 368 (М+), 314, 264, 256, 213, 198, 188, 156, 137, 129, 91, 81, 69.
Пример 14
4,7-дигидро-4,7-диоксо-1H-[1] -бензопирано[6,7-b] пиридин-3-карбоновая кислота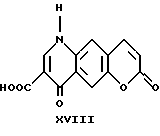
Она была получена по способу, описанному в примере 11, исходя из этил-4,7-дигидро-4,7-диоксо -1H-[1] -бензопирано[6,7-b] пиридин-3- карбоксилата (1.10 г, 3.856 ммоль). Продолжительность реакции: 3 часа. Получен светло-желтый осадок кислоты (0.84 г, 85%). Т.пл. > 300oC.
Анализ: рассчитано для C13H7NO5: C 60.70; H 2.74; N 5.45;
найдено: C 60.37; H 2.80; N 5.76.
m/z: 258 (M+), 254, 249, 213, 151, 138, 125, 109, 98, 74, 62.
Пример 15
4,7-дигидро-4,7-диоксо-8-гидрокси -1H-[1] -бензопирано[6,7-b] пиридин-3-карбоновая кислота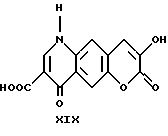
Она была получена по способу, описанному в примере 12, исходя из этил-4,7-дигидро-4,7-диоксо-8-гидрокси-1H-[1] -бензопирано [6,7-b]пиридин-3-карбоксилата (2.83 г, 9.394 ммоль). Продолжительность реакции: 3 часа. Получен желтый осадок кислоты (2.13 г, 83%). Т.пл. > 300oC.
1H-ЯМР (ДМСО-d6) δ м.д. 7,6-8,7 (м, Ar H); 9,4 (с, Py H); 13,4 (с, NH); 15,2 (с, COOH).
m/z: 273 (M+), 256, 239, 229, 181, 125, 114, 95, 73.
Пример 16
1,7-дигидро-1,7-диоксо-9-метил -4H-[1] -бензопирано[6,7-b] пиридин-2-карбоновая кислота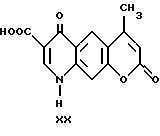
Она была получена по способу, описанному в примере 11, исходя из этил-1,7-дигидро-1,7-диоксо -9-метил-4H-[1] -бензопирано [6,7-b] пиридин-2-карбоксилата (3.40 г, 0.011 моль). Продолжительность реакции: 20 минут. Полученный осадок серо-белого цвета перекристаллизовывали из N,N-диметилформамида (2.32 г, 75%).
Анализ: рассчитано для C14H9NO5 • C3H7NO: C 59.30; H 4.68; N 8.14;
найдено: C 59.50; H 4.61; N 7.81.
1H-ЯМР (ДМСО-d6) δ м.д. 1.9 (с, CH3); 6,3 (с, H8); 7,6 (д, H5); 8,0 (с, H10); 9,0 (с, Py H); 13,2 (шс, NH); 14,9 (с, COOH).
Пример 17
1,7-дигидро-1,7-диоксо-9- (трифторметил)-4H-[1]- бензопирано [6,7-b]пиридин-2-карбоновая кислота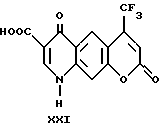
Она была получена по способу, описанному в примере 12, исходя из этил-1,7-дигидро-1,7- диоксо-9-(трифторметил-4H-[1]- бензопирано[6,7-b]пиридин-2-карбоксилата (1.40 г, 3.963 ммоль). Продолжительность реакции: 2 часа. Полученную кислоту перекристаллизовывали из смеси N,N-диметилформамид/этанол (1.28 г, 99%). Т.пл. > 300oC.
Анализ: рассчитано для C14H6F3NO5: C 51.70; H 1.86; N 4.31;
найдено: C 51.48; H 1.82; N 4.27.
1H-ЯМР (ДМСО-d6) δ м.д. 7,2 (с, H8); 7,8 (с, H5); 8,6 (с, H10); 9,0 (с, Py H); 13,4 (шс, NH); 14,5 (шс, COOH).
Пример 18
1,5-дигидро-1,5-диоксо-7-гидрокси -4H-[1] -бензопирано[7,8-b] пиридин- 2-карбоновая кислота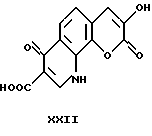
Она была получена по способу, описанному в примере 13, исходя из этил-1,5-дигидро-1,5-диоксо -7-гидрокси-4Н-[1] -бензопирано [7,8-b] пиридин-2-карбоксилата (2.12 г, 7.037 ммоль). Продолжительность реакции: 3 часа. Получена кислота зелено-коричневого цвета (1.27 г, 66%). Т.пл. > 300oC.
1H-ЯМР (ДМСО-d6) δ м.д. 7,1-7,8 (м, Ar H, Py H); 8,6 (с, OH); 10,6 (с, NH); 15,2 (с, COOH).
m/z: 273 (М+), 212, 179, 81, 79, 61, 59, 45, 43.
Изобретение относится к новым кумаринхинолонкарбоновым кислотам, в которых система пиридона конденсирована в 3,4-, 6,7- и 7,8-положениях кумариновой системы, общей формулы I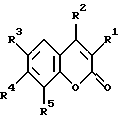
где R1R2 = NHCH=C(CO2R6)CO, R3 = NO2 или NH2, R4 = R5 = H, R6 = H или C2H5; R1R2 = NHCH=C(CO2R6)CO, R3 = R4 = H, R5 = F, R6 = H или С2Н5; R1R2 = СО(СО2R6)С = СНNH, R3 = R4 = R5 = H, R6 = H или С2Н5; R1R2 = R3R4 = NHCH= C(CO2R6)CO, R5 = H, R6 = H или С2Н5; R1 = Н или ОН, R2 = R5 = Н, R3R4 = -NHCH=C(CO2R6)CO,R6 = H или С2Н5; R1 = ОН, R2 = R3 = Н, R4 R5 = -СО(СО2R6)С = СНNH, R6 = H или С2Н5; R1 = R5 = Н, R2 - СН3 или CF3, R3R4 = CO(CO2R6)C = CHNH, R6 = H или С2Н5, а также к их фармацевтически приемлемым солям. Новые соединения являются ингибиторами испытанных штаммов бактерий, ингибируют рост клеток рака молочной железы, рака поджелудочной железы и рака гортани. Описываются также способы получения новых соединений. 3 с. и 18 з.п.ф-лы, 10 табл.
где R1R2 = -NHCH=C(CO2R6)CO-, R3 = NO2 или NH2, R4 = R5 = H, R6 = H или C2H5;
R1R2 = -NHCH=C(CO2R6)CO-, R3 = R4 = H, R5 = F, R6 = H или C2H5;
R1R2 = -CO(CO2R6)C=CHNH-, R3 = R4 = R5 = H, R6 = H или C2H5;
R1R2 = R3R4 = -NHCH=C(CO2R6)CO-, R5 = H, R6 = H или C2H5;
R1 = H или OH, R2 = R5 = H, R3R4 = -NHCH=C(CO2R6)CO-, R6 = H, или C2H5;
R1 = OH, R2 = R3 = H, R4R5 = -CO(CO2R6)C=CHNH-, R6 = H или C2H5;
R1 = R5 = H, R2 = CH3 или CF3, R3R4 = CO(CO2R6)C=CHNH-, R6 = H или C2H5,
а также их фармацевтически приемлемые соли.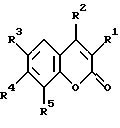
где R1 = -NHCH=C(CO2C2H5)2, R2 = R4 = H, R3 = NO2, R5 = H или F;
R1 = R3 = -NHCH=C(CO2C2H5)2, R2 = R4 = R5 = H;
R1 = H или OH, R3 = -NHCH=C(CO2C2H5)2, R2 = R4 = R5 = H;
R1 = OH, R2 = R3 = R4 = H, R5 = -NHCH=C(CO2C2H5)2;
R1 = R3 = R5 = H, R2 = CH3 или CF3, R4 = -NHCH=C(CO2C2H5)2,
нагревают в Dowtherm A при 250 - 260oC в течение 10 мин - 13 ч для получения циклизованных сложных кумаринхинолоновых эфиров общей формулы III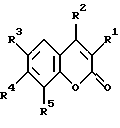
где R1R2 = -NHCH=C(CO2C2H5)CO-, R3 = R4 = H, R5 = F;
R1R2 = -NHCH=C(CO2C2H5)CO-, R3 = NO2, R4 = R5 = H;
R1R2 = -CO(CO2C2H5)C=CHNH-, R3 = R4 = R5 = H;
R1R2 = R3R4 = -NHCH=C(CO2C2H5)CO-, R5 = H;
R1 = H или OH, R2 = R5 = H, R3R4 = -NHCH=C(CO2C2H5)CO-,
R1 = OH, R2 = R3 = H, R4R5 = - CO(CO2C2H5)C=CHNH-,
R1 = R5 = H, R2 = CH3 или CF3, R3R4 = -CO(CO2C2H5)C=CHNH-,
которые являются соединениями формулы I, где R6 = C2H5, и для получения соединений общей формулы I, где R1R2 = -NHCH=C(CO2C2H5)CO-, R3 = NH2, R4 = R5 = H, восстанавливают соединения общей формулы III, где R1R2 = -NHCH= C(CO2C2H5)CO-, R3 = NO2, R4 = R5 = H, и для получения соединений общей формулы I, где R1, R2, R3, R4 и R5 имеют значения, определенные в п.1, и R6 = H, гидролизуют соединения общей формулы III, где R6 = C2H5.
| Способ получения производных 4-оксо4н-пирано-(3,2-с) хинолин-2-карбоновых кислот или их солей | 1975 |
|
SU545262A3 |
| US 4210758 А, 01.07.1980 | |||
| US 4060619 А, 29.11.1977. | |||
Авторы
Даты
2001-05-10—Публикация
1997-07-25—Подача