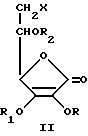
Данное изобретение относится к новым производным аскорбиновой кислоты, а именно к производным амино-аскорбиновой кислоты общей формулы I
в которой R'= H, C1-C18алкил, C6 циклоалкил, C6-C12 арил, гетероил, который представляет собой гетероциклическое соединение, содержащее в кольце кислород, серу или азот в качестве гетероатома, R''= C1-C18 алкил. C6циклоалкил, C6-C12арил, гетероил, который представляет собой гетероциклическое соединение, содержащее в кольце кислород, серу или азот в качестве гетероатома, R' и R''- CH2R3, где R3=C1-C18 C6циклоалкил, C6-C12-арил, гетероил, представляющий собой гетероциклическое соединение, содержащее в кольце кислород, серу или азот в качестве гетероатома, т.е. R'=H, R''= ацил, т.е. R'' = COR, где R'''=H, C1- C18алкил, C6-циклоалкил, C6-C12арил, гетероил, представляющий собой гетероциклическое соединение, содержащее в кольце кислород, серу или азот в качестве гетероатома, R, R1 и R2=H или защищающая группа, которая легко удаляется в нейтральной среде, такая как бензил. Новые соединения, которые содержат (не)замещенную амино-группу, образуют соли с кислотами, причем, когда R=R1=R2=H, они образуют соли с основаниями. Незащищенные соединения формулы I в нейтральной среде существуют в виде цвиттер-иона. Новые производные аскорбиновой кислоты I, которые являются целью данного изобретения, можно получить несколькими путями из соединений общей формулы II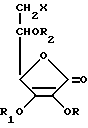
в которой X = галоид (Cl, Br, J) или амино (NH2). Когда X= галоид, R=R1= бензил, R2= H, т.е. R=R1=R2=бензил, а когда X=амино, R=R1=R2=H. Новые соединения получают несколькими типами реакций, иллюстрируемыми следующими схемами:
I. Восстановительное алкилирование
Восстановительное алкилирование представляет собой обработку альдегида или кетона аммиаком или первичными, т.е. вторичными аминами в присутствии водорода и катализатора для гидрирования. Вместо водорода и катализатора, могут быть использованы другие восстановители, такие как боргидриды и муравьиная кислота. В данном изобретении восстановительное алкилирование амино-аскорбиновой кислоты (II, X= NH2, R=R1=R1=R 2=H) проводят различными альдегидами R3CHO, что иллюстрируется схемой 1:
Схема 1. Восстановительное алкилирование амино-аскорбиновой кислоты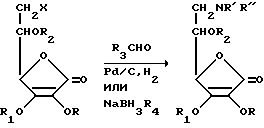
X=NH2 R=R1= R2= H R'= R"(CH2R3)2 R = R1= R2= H
Восстановительное алкилирование проводят в воде, как растворителе, при температуре 20-25oC. Используемым восстановителем является водород с катализатором 5% или 10% Pd/C, или боргидрид натрия, где R4=H или CN. В случае каталитического восстановления время реакции составляет 1-2 часа, в то время как в случае восстановления боргидридами реакция протекает в течение 5-10 часов. Механизм восстановительного алкилирования иллюстрируемый схемой 1a.,
Схема 1a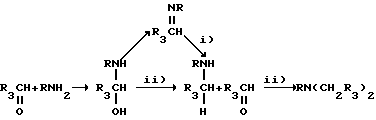
позволяет получить моно- и дизамещенные производные амино-аскорбиновой кислоты. В нашем случае, однако, обнаружены и выделены только дизамещенные производные. Это подтверждает, что реакция алкилирования на второй фазе протекает очень быстро.
2. Реакция алкилирования
Моно- и дизамещенные производные амино-аскорбиновой кислоты получают алкилированием соответствующих первичных и вторичных аминов, согласно схеме реакции 2.
Схема 2. Реакция алкилирования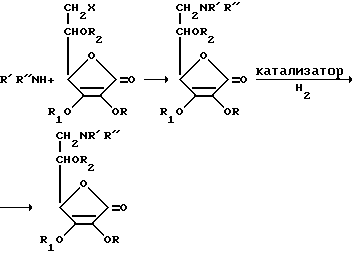
X = галоид RH, R1=R2=бензил R=R1=R2=H
R=H, R1=R2=бензил или R=R1=R2=бензил
В реакциях алкилирования используют первичные и вторичные амины общей формулы NHR' R" в которой R' и R'' уже описаны для соединений общей формулы I. В этой реакции алкилирующим реагентом является галоид-аскорбиновая кислота общей формулы II. Так как галоид-аскорбиновая кислота имеет более трех гидроксильных групп, из которых гидроксильные группы ендиольной системы в положениях C2, и C3 являются очень реакционноспособными в щелочной среде, то молекулу необходимо соответственно защитить до реакции. Другими словами, необходимо подобрать защищающие группы, которые удаляются в нейтральных средах, такая как бензильная группа. Реакцию защиты проводят в соответствии со схемой 2a.
Схема 2a. Защита гидроксильных групп галоид-аскорбиновой кислоты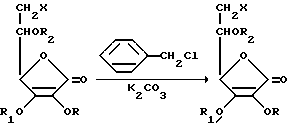
X=Гал X=Гал
R=R1=R2=H R=R1=R2=бензил
Продукт реакции зависит от молярного соотношения реагентов. Если для одного моля галоид-аскорбиновой кислоты используют два моля защищающих реагентов, то получают соединение общей формулы II, где R2=H, а если используют три моля или больший молярный избыток этого реагента, то получают полностью защищенное соединение. Удаление защищающих групп проводят в нейтральной среде с помощью каталитического восстановления, как это иллюстрируется схемой 2. Реакцию также можно проводить без изоляции интермедиата путем добавления катализатора к реакционной смеси после окончания алкилирования, и после этого путем снятия защиты (реакция в одном сосуде) в атмосфере водорода, где, как отмечается, в случае полностью защищенного соединения защищающую группу R2 нелегко удалить, и поэтому в таких типах реакций чаще всего используют соединения общей формулы II, где R2=H.
3. Реакция ацилирования
реакцию ацилирования амино-группы проводят с помощью реагентов, обычно известных в химической литературе, таких как хлориды или ангидриды кислот или активные сложные эфиры кислот, те, с помощью реагентов общей формулы:
R5COR6
где R5=H, алкил, циклоалкил, арил или гетероил, имеющий значение, указанное для формулы I, и R6=Cl, или OCOR7, где R7=алкил, или OR8 где R8 представляет собой группу, известную в химии как активная сложно-эфирная группа, такая как сукцинил или бензотиазолил.
Реакция алкилирования иллюстрируется схемой 3.
Схема 3. Ацилирование амино-группы
X=NH2 R=R1=R2=H
R=R=R=H
Если реакцию ацилирования проводят с муравьиной кислотой (R5=R6=OH) или со смешанным ангидридом муравьиной и уксусной кислот (R5=H, R6=OCOR7, R7= CH3), то получают N-формильное производное. Известно, что в восстановительных условиях N-формильные производные могут превращаться в соответствующие монометильные амино-производные. Однако, показано, что амино-аскорбиновая кислота образует амильные производные, которые очень стабильны в восстановительных условиях. Например, формил амино-аскорбиновая кислота не восстанавливается при давлении 80 бар и при 80oC и ацильные производные амино-аскорбиновой кислоты значительно более стабильны при высоких температурах, чем аскорбиновая кислота. В упомянутых условиях, поддерживаемых на протяжении 8 часов, хроматографически не регистрируется какое-либо разрушение молекулы. Поскольку производные ациламино-аскорбиновой кислоты сохраняют свои восстанавливающие свойства, они могут быть использованы как антиоксиданты при температурах, превышающих температуру для аскорбиновой кислоты.
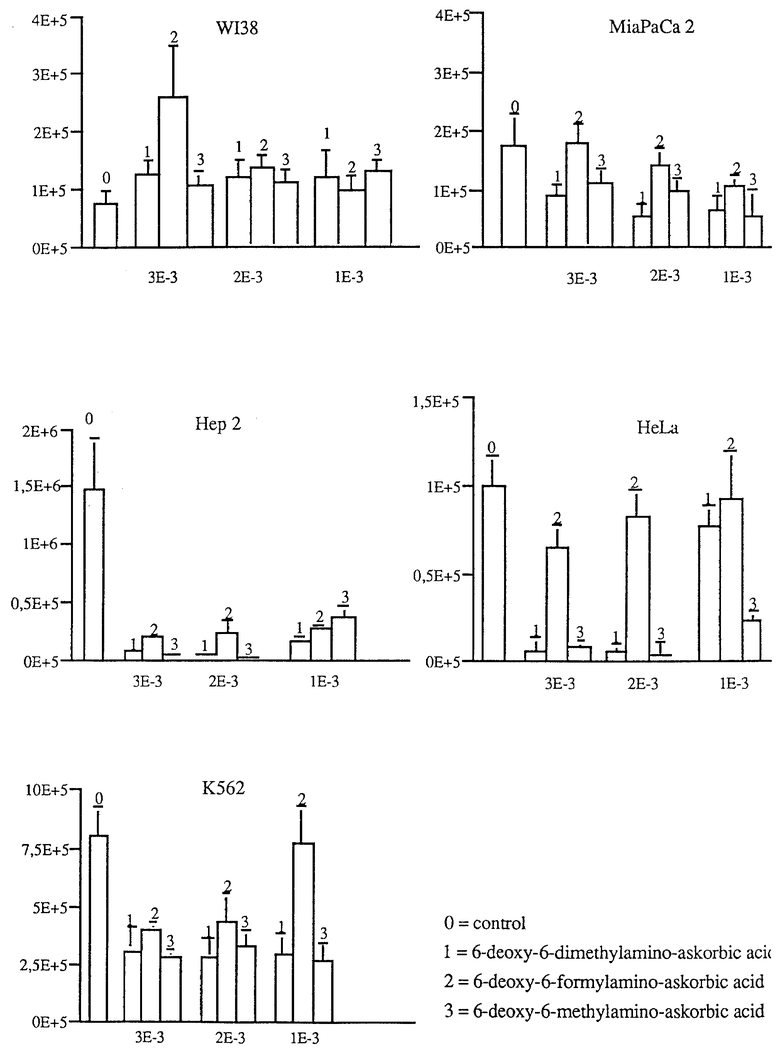
Новые производные амино-аскорбиновой кислоты демонстрируют антиканцерогенные свойства, которые были испытаны на следующих линиях опухолевых клеток: Hela (карцинома portio vaginalis cervicis); Hep 2 (карцинома гортани); MiaPaCa 2 (карцинома поджелудочной железы) и K562 (эритролейкоз), все линии клеток человека и W138 (нормальные фибробласты человека), которые используют в качестве контроля.
Линии клеток опухолей человека и фибробласты человека выращивают на жидких DMEM средах (среда Eagle, модифицированная Dulbecco) с добавлением 10% фетальной телячьей сыворотки (ФТС), 2 мМ ин глутамина, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина во влажной атмосфере с 5% CO2 при 37oC. Клетки инокулируют в концентрации 104 клеток/мл.
Образцы растворяют в DMEM без добавления сыворотки, и 0,1N NaOH добавляют до pH 7,4. Используемые концентрации составляли 10-3 М, 2•10-3 М и 3•10-3 М. Результаты, иллюстрируемые чертежом, представляют средние значения четырех параллельных образцов ± стандартное отклонение (CO). Результаты иллюстрируются чертежом.
Как видно из чертежа испытываемые производные не оказывают воздействия на рост нормальных фибробластовых W138 клеток, но они, однако, ингибируют рост опухолевых клеток, особенно Hep 2.
Получение новых производных амино-аскорбиновой кислоты иллюстрируется следующими примерами, которые, однако, никоим образом не являются ограничивающими.
Примеры восстановительного алкилирования
Пример 1 N,N-диметиламино-аскорбиновая кислота
(I, R'=R''=CH3, R=R1=R2=H)
Способ a): восстановление добавлением Pd/C катализатора.
К раствору аминоаскорбиновой кислоты (II, X=NH2, R=R1=R2=H) (1,2 г) в воде (100 мл) добавляют 35% водный раствор формальдегида (2,4 мл) и катализатор 10% Pd/C (0,48 г), после чего перемешивают под давлением водорода 0,8 бар в сосуде согласно Parr в течение 1 часа. Катализатор удаляют фильтрацией, и водный раствор выпаривают до объема приблизительно 2-3 мл. Концентрат очищают хроматографией на колонке с силикагелем (кизельгур 60 0.063-0,2 мм арт. 7734), путем элюирования растворителем метанол-вода = 7:3. Фракции, которые содержат продукт (tlc, силикагель 60 F254 Merck определение распылением с фосфорномолебденовой кислотой) объединяют, и затем выпаривают до сухого остатка, получая 0,3 г продукта, т.пл. 207-210oC; = [α]
ИК (KBr) (см-1): 3400, 2900, 2800, 2350, 1750, 1650, 1620, 1480, 1430, 1100, 1050.
1H ЯМР ппм (d)(DO), 2,83(6H, с), 3,22-3,37(2H, м), 4,2-4,25 (1H, м), 4,28-4,29 (1H, д, J =2,17 гц).
1H ЯМР ппм (d) (CF3COOD): 3,2-3,23(6H, д, J=8,79 гц), 3,58-3,83 (2H, м), 4,79-4,83(1H, м), 5,02(1H, с).
13C ЯМР ппм (d) (CF3COOD + D2O): 40,97, 44,19, 58,47, 62,98, 75,43, 152,43, 161,23.
EI-MS м/з: 203 (M+), 58, 82, 88, 112, 130.
Пример 2
Способ b): восстановление боргидридом
К раствору амино-аскорбиновой кислоты (0,5 г) в воде (50 мл) добавляют 35% водный раствор формальдегида (1 мл), цианоборгидрид натрия (NaBH3CN, 0,537 г) и холодную уксусную кислоту (0,3 г), после чего перемешивают в атмосфере азота в течение 5 часов при 20-25oC. Затем реакционную смесь концентрируют до объема приблизительно 1-2 мл, очищают колоночной хроматографией на силикагеле, и после этого элюируют растворителем метанол-вода = 7: 3. Фракции, содержащие продукт (tlc) собирают, и затем выпаривают досуха, получая 0,28 г продукта, идентичного продукту Примера 1.
Пример 3
N,N-ди-н-пропиламино-аскорбиновая кислота
(I, R' R''= C3H7, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0,32 г) в воде (15 мл) добавляют н-пропанол (C3H6O, 0,11 г), цианоборгидрид натрия (NaBH3CN, 0,32 г), и после этого добавляют холодную уксусную кислоту (0,2 мл), после чего реакционную смесь перемешивают в атмосфере азота в течение 3 часов при 20-25oC. Реакционную смесь концентрируют до объема приблизительно 1 мл, и очищают колоночной хроматографией на силикагеле путем элюирования растворителем этанол-вода= 1: 1. Фракции, которые содержат продукт (tlc, силикагель 60 F245 EtOH:H2O = 9:1), выпаривают досуха, получая 0,2 г продукта.
1H ЯМР ппм (d) (D2O):0,9-0,94(6H, т), 1,69-1,7(4H, м), 3,11-3,2(4H, т), 3,37-3,38(2H, м), 3,4-3,45(1H, м), 4,37-4,38(1H, д).
Пример 4
N,N-дибензиламино-аскорбиновая кислота (I, R'=R''=CH2C6H5, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0,36 г) в воде (20 мл) добавляют бензальдегид (0,228 г), цианоборгидрид натрия (0,382 г) и холодную уксусную кислоту (0,2 мл), после этого перемешивают в атмосфере азота в течение 3 часов при 20-25oC. Реакционную смесь концентрируют до объема приблизительно 1 мл и очищают колоночной хроматографией на силикагеле (Кизельгур 60 0,062-0,2 мм арт. 7734), элюируя растворителем этанол-вода = 8:2. Фракции, которые содержат продукт (tlc), собирают и затем выпаривают досуха, получая 0,25 г продукта.
1H ЯМР ппм (d)(D2O):3,92(2H, с), 4,31-4,35(1H, м), 4,59-4,61(1H, д, J= 2,15 гц), 4,83(4H, с), 7,59-7,69 (10H, м).
Пример 5
N,N'-дифурфуриламино-аскорбиновая кислота
(I, R'=R''=CH2C4H3O, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0,52 г) в воде (26 мл) добавляют фурфураль (1,45 г), цианоборгидрид натрия (0,565 г) и холодную уксусную кислоту (0,5 мл), после этого реакционную смесь перемешивают в атмосфере азота в течение 5 часов при 20-25oC. Смесь концентрируют при пониженном давлении до объема 2 мл и очищают колоночной хроматографией на силикагеле, элюируя растворителем этанол-вода =8:2. Фракции, которые содержат продукт (tlc), собирают и затем выпаривают досуха, получая 0,7 г продукта
т. пл.=220oC (разложение): [α]
Примеры реакций алкилирования
Пример 6
N- метиламино-аскорбиновая кислота
(I, R'=H, R''=CH, R=R1=R2=H).
К раствору 2,3-дибензил-6-бром-6-дезокси-аскорбиновой кислоты (II, X=Br, R= R1= Bn, R2=H (0,5) метаноле (10 мл) добавляют 20% метанольный раствор метиламина (10 мл) и перемешивают в течение 1 часа, после этого смесь выдерживают в течение ночи при 20oC. Реакционную смесь концентрируют при пониженном давлении досуха. К остатку добавляют метанол (15 мл) и катализатор 10% Pd/C (0,015 г) и перемешивают под давлением водорода 2 бара в сосуде согласно Parr в течение 3 часов. Катализатор отделяют фильтрацией, после чего раствор концентрируют при пониженном давлении до объема 2 мл и затем очищают колоночной хроматографией на силикагеле, элюируя растворителем метанол-вода 8: 2. Фракции которые содержат продукт (tlc), собирают и затем упаривают досуха, получая 0,05 г продукта.
Т. пл. = 155-160oC; ИК (KBr)(см-1): 3400, 2900, 2810, 2380, 1740, 1600, 1480, 1380, 1150, 1110, 1050.
1H ЯМР ппм (d) (D2O): 2,72(3H, с), 3,21-3.29(2H, м), 3.73-4,29(1H, м), 4,37-4,40(1H, д, J=2,2 Гц).
Пример 7
N,N-диметиламино-аскорбиновая кислота
(I, R'=R''=CH3, R=R1=R2=H).
К раствору 2,3-дибензил-6-бром-6-дезокси-аскорбиновой кислоты (II, 1= Br, R= R1=Bn, R2=H) (0,27 г) в метаноле (5 мл) добавляют 20% метанольный раствор диметиламина (5 мл), перемешивают в течение 1 часа, и после этого смесь выдерживают в в течение 24 часов при 20-25oC. Реакционную смесь концентрируют при пониженном давлении досуха. Остаток растворяют в метаноле (10 мл), куда добавляют катализатор 10% Pd/C (0,01 г) и перемешивают под давлением водорода 2 бара в сосуде согласно Parr в течение 3 часов. Катализатор отделяют фильтрацией, и метанол концентрируют при пониженном давлении до объема 2 мл. Затем продукт очищают колоночной хроматографией на силикагеле, элюируя растворителем метанол-вода 8:2. Фракции, которые содержат продукт (tlc), собирают и затем упаривают досуха, получая 0,03 г продукта, который идентичен продукту примера 1.
Защита гидроксильных групп галоид-аскорбиновой кислоты
Пример 8
2,3,5-трибензил-6-бром-6-дезокси-аскорбиновая кислота (II, X=Br, R=R1= R2=Bn).
К раствору 6-бром-6-дезокси-аскорбиновой кислоты (II, X=Br, R=R1=R2=H) (1 г) в диметилформамиде (15 мл) добавляют карбонат калия (0,91 г) и бензилхлорид (1,64 г) и после этого перемешивают в атмосфере азота в течение 2 часов при 60oC. Реакционную смесь концентрируют при пониженном давлении досуха, после чего к остатку добавляют хлороформ (15 мл) и воду (5 мл). Органический слой отделяют и дважды промывают водой (5 мл) и затем сушат над сульфатом натрия sic. Раствор хлороформа концентрируют при пониженном давлении до объема 2 м, затем очищают колоночной хроматографией на силикагеле, элюируя растворителем хлороформ-этанол 32:1. Фракции, которые содержат продукт, собирают и затем выпаривают досуха, получая 0,2 г продукта.
ИК CHCl3 (см-1): 3400, 3090, 3060, 3040, 2950, 1760, 1670, 1500, 1460, 1320, 1210, 1150, 1050.
1H ЯМР ппм (d) (CDCl3): 3,51-3,54(2H, м), 4,03-4,07(1H, м), 4,91-4,92(1H, д, J=2,14 гц), 5,08(2H, с), 5,09(2H, с), 5,16-5,19(2H, д), 7,20-7,37(15H, м).
Пример 9
Способ получения 2,3-дибензил-6-бром-6-дезокси-аскорбиновой кислоты (II, X=Br, R=R1=Bn, R2=H)
К раствору 6-бром-6-дезокси-аскорбиновой кислоты (II, X=Br, R=R'=R2=H) (2 г) в диметилформамиде (30 мл) добавляют карбонат калия (1,2 г) и бензилхлорид (2,2 г), после этого перемешивают в атмосфере азота в течение 2 часов при 60oC. Реакционную смесь концентрируют при пониженном давлении до маслянистого остатка. К остатку добавляют хлороформ (30 мл) и воду (10 мл). Органический слой отделяют и промывают водой (2 х 10 мл) и затем сушат над сульфатом натрия sic. Раствор хлороформа концентрируют до объема 2 мл, затем очищают колоночной хроматографией на силикагеле, элюируя растворителем метиленхлорид-этанол (80:1). Фракции, которые содержат продукт (tlc), собирают и затем выпаривают до маслянистого остатка, который имеет все физико-химические свойства, описанные в литературе.
Реакция ацилирования
Пример 10
Формиламино-аскорбиновая кислота
(I, R'=H, R''=CHO, R=R1=R2=H)
Ангидрид уксусной и муравьиной кислоты (3,7 мл) получают путем перемешивания ангидрида уксусной кислоты (2,5 мл) и муравьиной кислоты (1,2 мл) в течение 2 часов при 50-60oC, после чего его охлаждали до 0oC. Аминоаскорбиновую кислоту (I, R'=R''=H, R=R1=R2=H, 0,5 г растворяют и перемешивают в течение 4,5 часов при 20-24oC. Реакционную смесь концентрируют при пониженном давлении, выпаривают после добавления воды (5 мл), и затем растворяют в 2 мл воды. После этого ее очищают колоночной хроматографией на силикагеле. Далее элюируют растворителем метанол-ацетонитрил 8:2. Фракции, которые содержат продукт (tlc), собирают и упаривают досуха при пониженном давлении, получая 0,26 г продукта.
Т. пл. = 200oC (разложение) ИК (KBr) (см-1): 3450, 2900, 2350, 1740, 1670, 1600, 1390, 1250, 1150, 1110, 1050.
1H ЯМР ппм (d)(D2O): 3,31-3,54(2H, м), 3,97-4,02(1H, м), 4,42(1H, д, J= 2,3 гц), 8,03(1H, с).
13С ЯМР ппм (d) (CF3COOD + D2O): 43,2. 66,0, 73,2, 119,3, 153,8, 166,9, 174,0
EI-MS м/з: 55, 566 57, 59, 62, 69, 79, 73, 84, 85, 86, 87, 103, 113.
Пример 11.
N- октиламиноаскорбиновая кислота
(1, R'= H, R''= (CH2)7CH3, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0.49 г) в воде (500 мл) добавляют октаналь (октальдегид, 1.8 г), цианоборгидрид натрия (0.35г) и ледяную уксусную кислоту (0.2 мл). Реакционную смесь перемешивают в течение 4 час в атмосфере азота при температуре 20-25oC, выпаривают до объема около 2 мл и хроматографируют, используя колонку, набитую силикагелем. Ее элюируют смесью ацетонитрил - вода (5:1). Фракции, содержащие продукт (tic) объединяют и выпаривают досуха. Выход 0.25 г.
1H NMR ppm CD3OD: 0.98 (3H, t), 1.40 (10H, s); 1.63 (2H, s); 1.81 (2H, s); 3.24- 3.40 (2H, m); 4.20-4.22 (1H, m); 4.45 (1H, d).
IR (KBr) (cm-1): 3397; 2958; 2926; 2855; 1738; 1675; 1627.
Пример 12.
N-циклогексилметиламиноаскорбиновая кислота
(1, R'=H, R''=CH2; C6H11, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0.49 г) в воде (500 г) добавляют циклогексанкарбоксальдегид (1,6 г), цианоборгидрид натрия (0.35 г) и ледяную уксусную кислоту (0.2 мл). Реакционную смесь перемешивают в течение 7 час в атмосфере азота при температуре 20-25oC и промывают толуолом ( 2 х 20 мл). Водный слой выпаривают при пониженном давлении до объема около 2 мл и хроматографируют на колонке с силикагелем. Элюируют смесью ацетонитрил-вода (3: 1). Фракции, содержащие продукт (tlc), объединяют и выпаривают досуха. Выход 0.33 г.
1H NMR ppm (D2O): 4.43 (1H, d); 4.11-4.14 (1H, m); 3.02-3.30) (4H, m); 1.87-1.98 (1H, m); 1.70-1.73 (2H, m); 1.52-1.57 (2H, m); 1.14-1.29 (4H, m); 1.03-1.07 (2H, m).
IR (KBr) (cm-1): 3424; 2935; 2858; 1722; 1601.
Пример 13. N-4'-(2'-фенилимидазоил)-метиламиноаскорбиновая кислота
(1, R'=H, R' = CH2C9H7N2; R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0.5 г) в воде (1500 мл) добавляют 2-фенилимидазол-4-карбоальдегид (0.59 г) цианборгидрид натрия (0.36 г) и ледяную кислоту. Реакционную смесь перемешивают в течение 8 час в атмосфере азота при температуре 50-55oC, затем выпаривают до объема около 2 мл и хроматографируют на колонке с силикагелем (Кизельгель 60, 0,063-0,2 мм), используя в качестве элюанта смесь ацетонитрила-вода (3:1). Фракции, содержащие продукт (tlc, силикагель 60 F254), объединяют и выпаривают досуха. Выход: 0.16 г продукта.
1H NMR ppm (D2O): 3.18 (2H, m); 4.10 (1H, m); 4.15(2H, s); 4.26 (1H, d); 7.24 (1H, s); 7.35 (3H, m); 7.62 (2H, m).
IR (KBr)(cm-1):3432; 1728; 1591; 1410; 1121.
Пример 14.
N,N-ди-(2-тиофенилметил)аминоаскорбиновая кислота
(1, R'=R''=CH2C4H3S, R=R1=R2=H)
К раствору аминоаскорбиновой кислоты (0.52 г) в воде (50 мл) добавляют тиофен-2-карбоксальдегид (1.66 г), цианоборгидрид натрия (0.36 г) и ледяную уксусную кислоту (0.3 мл). Реакционную смесь перемешивают в течение 24 час в атмосфере азота при температуре 20-25oC, выпаривают при пониженном давлении до объема около 2 мл и очищают на колонке с силикагелем смесью н-пропанол-1N NH4OH-ацетон (3:2:0.2). Фракции, содержащие продукт (tlc), объединяют и выпаривают досуха. Выход 0,38 г.
1H NMR ppm (D2O): 4.05-4.20 (3H, m); 4.55 (1H, d); 4.65-4.75 (4H, m); 6.95-6.99 (4H, m); 7.30-7.32 (2H, m).
IR (KBr) (cm-1): 3400; 1730; 1670; 1570.
Предложены производные аминоаскорбиновой кислоты формулы I, где R1 - H, C1 - C8-алкил, CH2R3, R" - C2-C8-алкил, CH2R3, или когда R' - H, R" означает -C(O)H, R3 - 5- или 6-членный гетероцикл, содержащий в качестве гетероатома кислород, азота или сера, C1-C8-алкил, C6-C12-арил или циклогексил, R, R1 и R2 - H, бензил. Эти соединения обладают антиканцерогенными свойствами. Соединения I получают различными способами, в том числе алкилированием соединения формулы I соединением формулы II. 3 с. и 8 з.п.ф-лы, 1 ил.

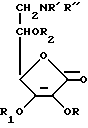
где R' означает Н, C1 - C8-алкил или CH2R3;
R'' означает C2 - C8-алкил, CH2R3 или, когда R'-H,
R'' означает -C(O)H;
R3 означает 5- или 6-членный гетероцикл, содержащий в качестве гетероатома кислород, азот или серу, C1 - C8-алкил, C6 - C12-арил или циклогексил;
R, R1 и R2 означают водород или бензил.
подвергают восстановительному алкилированию соединением общей формулы
R3CHO,
где R3 - как указано в п.1,
в атмосфере водорода в присутствии металлического катализатора или боргидрида общей формулы
NaBH3R4,
где R4 означает водород или CN,
в качестве восстановителя.
R'R''NH,
где R' и R'' - как указано в п.1,
алкилируют соединением общей формулы
где Х - галоид;
R и R' - бензил;
R2-H или R, R1 и R2-бензил.
где R, R1 и R2 - Н или бензил или R и R1 - бензил, R2-Н,
ацилируют соединением общей формулы
HCOR6,
где R6 означает OCOR7, R7 - низший алкил.
в которой Х - хлор, бром или иод;
R, R1 и R2 - бензил.
| Способ обезвоживания и обессоливания нефти | 1972 |
|
SU446539A1 |
| Торсионная подвеска | 1949 |
|
SU86556A1 |
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| 1971 |
|
SU411184A1 | |
| ЦИСТОТОМ ДЛЯ ПЕРЕДНЕЙ КАПСУЛОТОМИИ | 1994 |
|
RU2114571C1 |
| Аппарат для сортирования монет | 1932 |
|
SU31159A1 |
| Квадратичный механизм для счетно-решающих приборов | 1947 |
|
SU74411A2 |
| Устройство для автоматического регулирования скорости подачи врубовых машин и угольных комбайнов | 1952 |
|
SU96930A1 |
| Способ получения алкиловых эфиров сахароаскорбиновой кислоты | 1989 |
|
SU1729292A3 |
| Способ получения производных аскорбиновой кислоты | 1985 |
|
SU1428198A3 |
| РЕГУЛЯТОР РАСХОДА СЫПУЧЕГО МАТЕРИАЛА | 2016 |
|
RU2616351C1 |
Авторы
Даты
1999-02-20—Публикация
1994-02-04—Подача