Изобретение относится к медицине, в частности к области фармацевтических средств, применяемых для лечения тяжелых острых и хронических поражений человеческого организма, влекущих потерю крови или утрату ее функциональных свойств с сопутствующим состоянием иммунодефицита.
Цель изобретения - увеличение процента выживаемости и сокращение сроков лечения больных, для которых быстрое восстановление количества или функциональных свойств крови является необходимым по жизненным показаниям.
Известны тяжелые острые поражения человеческого организма, такие как обширные ожоги с глубоким проникновением в ткани, заражение крови продуктами распада тканей в результате тяжелых травм, обморожений, проникающих ранений и так далее.
Известны тяжелые хронические поражения, такие как различного вида анемии, лейко- и тромбоцитопении, возникшие в результате облучения или отравления при радиологических или экологических катастрофах, специфической химиотерапии онкологических больных.
Как правило, все вышеперечисленные заболевания сопровождаются состоянием иммунодефицита.
Известны также тяжелые острые и хронические инфекционные заболевания, такие как СПИД, гепатит В, генитальный герпес II и др., влекущие за собой стойкое состояние иммунодефицита.
Ключевой составляющей лечения таких заболеваний, помимо сопутствующей терапии очагов поражения, является трансфузионная терапия плазмозамещающими растворами (ПЗР).
Современные плазмозамещающие растворы условно поделены на четыре основные группы по назначению и функциональным свойствам (1, 2), а именно: гемодинамические (противошоковые), основные представители которой полиглюкин и реополиглюкин; дезинтоксикационные, основные представители - гемодез, полидез; растворы для белкового парентерального питания и регуляторы водно-солевого и кислотно-щелочного состояния.
Из гемодинамических плазмозамещаюших растворов наиболее популярным является полиглюкин, представляющий из себя освобожденную от токсичности и пирогенности среднемолекулярную фракцию частично гидролизованного декстрана, растворенного в изотоническом растворе хлорида натрия (прототип).
В качестве растворов для белкового парентерального питания наиболее известны гидролизат казеина, гидролизин, аминокровин; каждый из которых представляет из себя смесь аминокислот и простейших пептидов в изотоническом растворе натрия хлорида или глюкозы (прототип).
Среди регуляторов водно-солевого и кислотно-щелочного состояния известны растворы дисоль, трисоль, а также водно-солевой инфузионный раствор лактасол, содержащий сбалансированный солевой состав и молочную кислоту.
Известны плазмозамещающие растворы, моделирующие дыхательные функции крови (переносчики газов крови), созданные на основе очищенного от стромальных примесей и прокоагулянтов концентрированного раствора гемоглобина (2, 7). Разработана модель переноса кислорода на основе модифицированного гемоглобина (8, 9), среди которых особую группу составляют эмульсии перфторана и перфукола (3). В настоящее время разработан новый плазмозамещающий раствор гемодинамического действия на основе крахмала (5, 4).
Необходимость одновременного применения различных лечебных манипуляций, связанных с заполнением кровяного русла, восстановлением и поддержанием постоянного артериального давления (АД), освобождением организма от токсинов, нормализацией кровяного стаза, обеспечением доставки питательных веществ и кислорода, сопровождающих, как правило, массивную кровопотерю и тяжелый шок, предопределила создание целого ряда комплексных полифункциональных плазмозамещающих растворов, например, таких, как раствор гемодинамического и гемопоэтического действия - полифер, или диуретического и реологического - реоглюман. Кроме того, в указанных случаях нашло широкое применение плазмозамещающих растворов, в состав которых одновременно введен полиглюкин, повышающий АД, и удерживающий его на стабильном уровне, реополиглюкин, нормализующий микроциркуляцию, ликвидирующий кровяной стаз, приводящий к редепонированию эритроцитов из каппиляров; соединения, способствующие выведению из организма с мочой метаболитов обмена и лактасол, ликвидирующий тканевой ацидоз и повышающий общий лечебный эффект.
Однако ни один из известных плазмозамещающих растворов, в том числе и полифункционального действия, не позволяет непосредственно воздействовать на иммунную систему с целью нормализации ее функционирования.
Сущность изобретения состоит в том, что для преодоления вышеуказанных недостатков и достижения цели изобретения предлагается к составу существующих ПЗР добавлять композицию в количестве 0,5•10-5 - 0,5% по весу, состоящую из основной компоненты в виде натриевой соли деривата ДНК, полученного из животного сырья, со средней молекулярной массой 1,5 - 550,0)•103 Дальтон и гиперхромным эффектом 28 - 46% и дополнительных компонент: белка - не более 1,5% по весу; полисахаридов - не более 2% по весу; РНК - не более 6% по весу
Существенными признаками предложения следует считать количественный состав композиции, физические характеристики основной компоненты, а также ее количественное содержание в ПЗР, дающие возможность получить оптимальный терапевтический эффект при отсутствии осложнений (табл. 1, 2).
Приготовление заявленного средства осуществляют в заводских условиях традиционным объемно-весовым методом. При этом к определенному весовому количеству композиции в виде порошка добавляют растворитель до получения необходимого объема раствора с концентрацией более 0,5% по весу. В качестве растворителя используют дистиллированную воду или физиологический раствор. Далее раствор фильтруют, стерилизуют и добавляют в необходимом количестве в кровезаменитель до получения в нем необходимой концентрации композиции. Полученный раствор представляет собой прозрачную бесцветную жидкость, не содержит механических или иных примесей, стабилен. Может подвергаться длительному хранению не менее 2-х лет. При химическом и бактериологическом контроле загрязнения отсутствуют. Соответствует требованиям ГФХ.
В экспериментально-клинических исследованиях были выявлены гемокоррегирующие свойства заявленного средства в условиях цитопении, вызванной цитостатиком (модель иммунодефицита на почве хронического отравления, вызванного экологическими причинами) или гамма-облучением (модель иммунодефицита, вызванного радиологическим загрязнением). Исследования были проведены на мышах-самцах линии F1 (СВА х C57B1), крысах-самцах F1 (AMCY х Wistar) и собаках породы "Английский бигль".
В качестве цитотоксических препаратов использовали: циклофосфан отечественного производства, фармарубицин производства фирмы "Фарм-Италия", цис-платин (ДДР) производства США. Облучение производили при помощи установки "Стебель-3а". Цитостатики применяли при внутрибрюшинном пути введения. При проведении экспериментов на установке "Стебель-3а" - источнике гамма облучения - мышей помещали в стеклянные камеры по 3-4 животных и вводили в зону облучения установки с расположением источников по типу "беличьего колеса". Дозиметрический контроль фиксировал перепад доз внутри контейнера не более 10%. Доза облучения составляла 6 Гр. Заявленное средство вводилось внутривенно из расчета 2 мг иммуномоделирующей композиции на 1 кг веса животного.
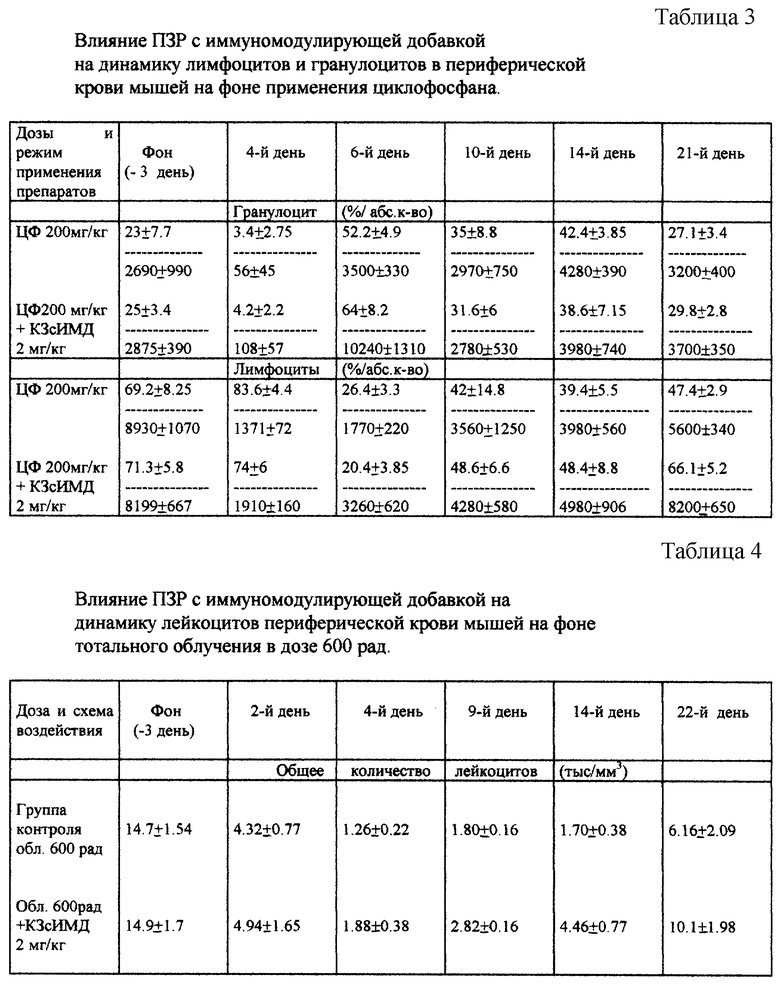
При анализе морфологического состава периферической крови после применения цитостатиков выявлено, что заявленное средство стимулировало выброс в периферическую кровь как лимфоцитов, так и гранулоцитов. На 6-й день количество гранулоцитов у мышей, получивших заявленное средство, превышало в 3 раза этот показатель в контрольной группе (табл. 3).
Влияние заявленного средства на динамику восстановления показателей крови после тотального гамма-облучения показано в табл. 4. Наблюдается статистически достоверное превышение числа лейкоцитов в периферической крови в несколько раз по сравнению с контрольной группой.
Фармакокинетические исследования были проведены на мышах, для чего были разработаны условия получения и очистки иммуномодулирующей добавки, меченой тритием. Было использовано несколько путей введения фармакологического средства, включая внутривенный. Изучены концентрационная и временная зависимости распределения меченого препарата и продуктов его метаболизма в крови, плазме, форменных элементах крови, почках, печени, лимфатических узлах, селезенке, тимусе, желудке, тонкой кишке, головном мозге, кости и костном мозге. Для всех фармакокинетических кривых, описывающих изменение концентрации ИД и метаболитов в изученных органах и тканях, был характерной быстрая фаза снижения концентраций в интервале времени 3 - 6 суток. Наибольшую тропность к ИД имели лимфатические узлы, селезенка, желудок и почки. Среднее время удерживания для органов и тканей составляло 60+2,9 часа. Выведение ИД происходило в основном с мочой. Основное количество ИД выводилось в первые сутки после введения препарата: 37% и 3,3% от дозы соответственно с мочой и калом. Далее скорость процесса выведения замедлялась и к 6-м суткам после введения препарата в организме животных оставалось не более 10-15% от введенной дозы. Полностью элиминирует ИД из органов и тканей не менее чем за 10 суток.
Токсикологические свойства препарата были изучены в области острой токсичности на мышах, крысах собаках, субхронической токсичности на крысах и собаках, аллергизирующего и иммунологического действия на морских свинках, эмбриотоксического и тератогенного действия на крысах, пирогенных свойств на кроликах, безвредности препарата с исследованием потенциальной мутагенности и прогнозом на канцерогенез. Исходя из полученных результатов можно заключить, что препарат является малотоксичным веществом, патоморфологические исследования показали, что изменения в органах и тканях коррелируют с величиной примененной дозы препарата и носят обратимый характер. Препарат не обладает тератогенным, канцерогенным и эмбриотоксическим действием, не влияет на морфологический и биохимический состав периферической крови, не обладает гастроинтестинальной, кардио-, гепато- и нефротоксичностью, не обладает местнораздражающим действием, апирогенен. Выявлены основные виды токсичности препарата, которые проявляются только при его применении внутривенно в высоких дозах и концентрациях (см. табл. 1, 2). Препарат не анафилактогенен и не вызывает сенсибилизации при повторном применении.
В целом анализ экспериментальных данных позволяет сделать следующие основные выводы:
1. В отличие от прототипа заявленное средство позволяет резко ускорить восстановление имунного статуса организма.
2. При использовании средства не выявлено побочных последствий и осложнений.
В клинике были проведены исследования заявленного изобретения у больных хронической анемией и у онкологических больных с угнетением гемопоэза вследствие применения химиолучевой терапии (разрешение Фармакологического комитета прилагается).
В исследования больных хронической анемией были включены пациенты в возрасте старше 18-ти лет с анемиями (мужчины - число эритроцитов менее 4,0•1012/л; женщины - число эритроцитов менее 3,5•1012/л) на момент включения в исследование, которые или сохраняются в течение не менее 6-ти месяцев, либо периодически рецидивируют после проводимого лечения в течение 1-го года. Перед началом исследований больные проходили полное обследование с получением клинико-гематологических и биохимических данных, подтверждающих диагноз: анамнез, количество лейкоцитов, эритроцитов, ретикулоцитов, гемоглобин, гематокрит, лейкоцитарная формула крови, СОЭ, железо и железосвязывающая способность сыворотки, трансферрин, ферритин, медь, цинк, церулоплазмин. Также определялись клинико-иммунологические данные, характеризующие состояние имунной системы: CD3, CD4, CD8, CD16, CD72 - лимфоциты, сывороточные иммуноглобулины, фагоцитарное число и индекс, гемолитическая активность комплемента, титр ревматоидного фактора.
Курс лечения проводили внутривенным ежедневным введением 100 - 200 мл полиглюкина с содержанием ИМД (0,5-1,5)•10-3% в течение 3-х дней.
По окончании лечения оценка результатов проводилась по следующим критериям: состояние и самочувствие больного, динамика гематологических показателей, динамика иммунологических показателей, динамика биохимических показателей, наличие или отсутствие рецидивов заболевания в течение срока наблюдения.
В результате обобщения данных по 18-ти больным определена статистически достоверно положительная динамика с последующей нормализацией гематологических, биохимических и иммунологических показателей у 83% больных, у остальных пациентов отмечена положительная динамика показателей с невыраженным рецидивом заболевания через 40-60 дней после окончания курса лечения. У 22% больных наблюдалась гипертермическая реакция с повышением температуры до 38-38,5o, которая исчезала самопроизвольно на 2 - 3-й день без применения симптоматических средств. Другие побочные последствия не наблюдались.
При исследованиях у онкологических больных была отобрана группа из 14-ти человек, получающих комбинированную химиотерапию в интенсивном режиме САМ по поводу мелкоклеточного рака легкого. До начала исследования больным проводилось полное клиническое обследование: рентгенография легких, КТ печени, надпочечников, мозга, сканирование скелета, биохимическое исследование крови, миелограмма.
Больные с морфологически доказанным локализованным МРЛ в первый день лечения получали: циклофосфан 1,5 г/м2 в/в, адриамицин 60 мг/м2 в/в, метотрексат 30 мг/м2 в/в.
Курс лечения проводили ежедневным внутривенным введением 100 - 200 мл полиглюкина с содержанием ИМД (0,5 - 1,5)•10-3%, начиная со второго дня лечения в течение 5 - 10-ти дней. Анализы крови проводились ежедневно со 2-го по 20-й дни, на 6-й и 10-й дни проводилась контрольная миелограмма. В период исследования больные не получали других гемостимуляторов, витамины, кортикостероиды, гемотрансфузии.
В результате обобщения данных применение заявленного средства у больных МРЛ на фоне проводимой химиотерапии позволило уменьшить глубину лейко- и нейтропении, сократить их длительность, провести химиотерапию без септических осложнений и у 64% больных начинать повторные курсы химиотерапии с сокращением интервала между ними на 20 - 30%. Все больные отмечали удовлетворительную переносимость препарата, у 21% больных отмечено повышение температуры до 38o, которое исчезало самопроизвольно, не требовало применения симптоматических средств и не препятствовало дальнейшему введению препарата.
Сущность изобретения иллюстрируется следующим примером:
Пример 1.
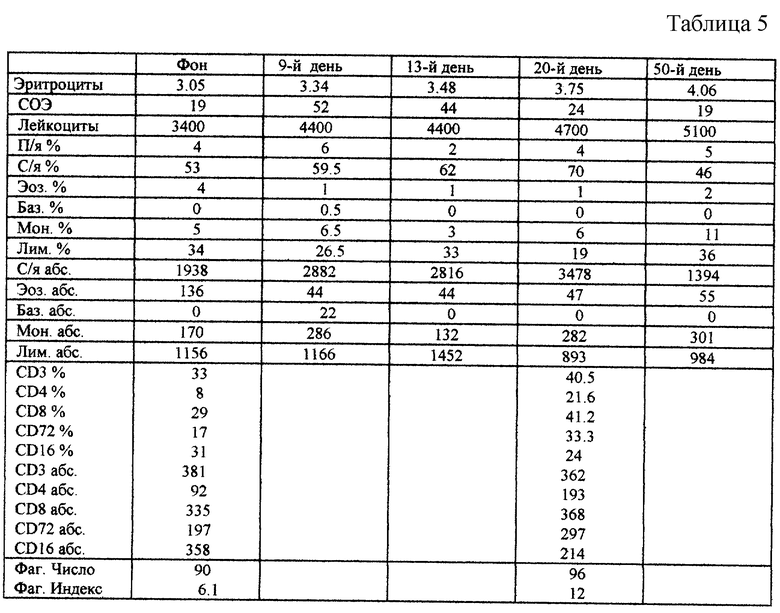
Больная К. А. У., 1935 г.р., хроническая анемия, наблюдалась 6 месяцев, терапевтический эффект от применения известных средств непродолжителен или отсутствует. Получила курс лечения ПЗР с ИМД в виде ежедневного внутривенного введения 200 мл полиглюкина с содержанием ИМД 0,5•10-3% в течение 3-х дней. Результаты представлены в табл. 5.
В приведенном примере характерным является стойкий рост числа эритроцитов и лейкоцитов в течение 50-ти дней наблюдения, а также изменение других показателей в сторону приближения их к норме. Отмечено стойкое улучшение самочувствия больной, исчезновение симптомов головокружения, слабости.
Осложнений общего характера, а также побочного действия не наблюдалось.
Таким образом, пример иллюстрирует эффективность предложенного средства в области поставленной перед изобретением цели.
Все это позволяет рекомендовать его для широкого использования в качестве ПЗР с иммуномодулирующими свойствами.
Список литературы.
1. Машковский М.Д., Лекарственные средства, 1983, 4.2, с. 122- 135.
2. Справочник по переливанию крови и кровезаменителей, Москва, Медицина, 1982, с. 155-178.
3. Вестник АН СССР, 1989, N 6, с. 55-64.
4. Е.Р. 059633, 27.04.94, A 61 K 31/72.
5. U.S. 5470841, 25.11.95, НКИ 514/60.
6. E.P. 0083469, 13.07.83, A 61 K 37/02, 37/12, 45/06.
7. J.P. заявка 3-59883, 12.09.91, A 61 K 37/14.
8. U.S. 5610137, 11.03.97, НКИ 514/12.
9. U.S. 5449759, 12.09.95, НКИ 530/375.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ НАТРИЯ НУКЛЕОСПЕРМАТА ДЛЯ ЛЕЧЕНИЯ ВИЧ-ИНФЕКЦИИ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2206326C2 |
| ПЛАЗМОЗАМЕЩАЮЩЕЕ СРЕДСТВО, КОРРЕКТИРУЮЩЕЕ ГЕМОДИНАМИЧЕСКИЕ НАРУШЕНИЯ, - НЕОРОНДЕКС | 1992 |
|
RU2043108C1 |
| СПОСОБ ПРОФИЛАКТИКИ И (ИЛИ) ЛЕЧЕНИЯ АНЕМИИ У ДЕТЕЙ (ВАРИАНТЫ) | 2003 |
|
RU2268745C2 |
| СПОСОБ ИНФУЗИОННОЙ ТЕРАПИИ ПРИ ТРОФИЧЕСКИХ РАНАХ | 2012 |
|
RU2475242C1 |
| СПОСОБ НАСЫЩЕНИЯ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ АНТИБИОТИКАМИ | 2006 |
|
RU2329054C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2001 |
|
RU2210390C2 |
| СПОСОБ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 1992 |
|
RU2009664C1 |
| СПОСОБ ЛЕЧЕНИЯ АНЕМИЙ РАЗЛИЧНОГО ГЕНЕЗА | 2008 |
|
RU2387404C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КРОВОПОТЕРИ ("СПАСКРОВЬ") | 2009 |
|
RU2416413C1 |
| СПОСОБ ДИАГНОСТИКИ ОСТРОГО АППЕНДИЦИТА У БЕРЕМЕННЫХ | 2005 |
|
RU2293561C1 |


Изобретение относится к медицине, в частности к области фармацевтических средств, применяемых для лечения тяжелых острых и хронических поражений человеческого организма, влекущих потерю крови или утрату ее функциональных свойств с сопутствующим состоянием иммунодефицита. Плазмозамещающий раствор включает изотонический раствор и дополнительно содержит натриевую соль производной ДНК, полученной из животного сырья, имеющей среднюю молекулярную массу (1,5-550,0)•103 Дальтон и гиперхромный эффект 28-46%, в количестве 5•10-5-5 г на 1 л изотонического раствора. Средство дополнительно к основному лечебному действию стимулирует гемо- и миелопоэз, не вызывает побочных последствий. Технический результат - увеличение процента выживаемости и сокращение сроков лечения больных, для которых быстрое восстановление количества или функциональных свойств крови является необходимым по жизненным показаниям. 5 табл.
Плазмозамещающий раствор, включающий изотонический раствор, отличающийся тем, что он дополнительно содержит натриевую соль производной ДНК, полученной из животного сырья, имеющей среднюю молекулярную массу (1,5 - 550,0) • 103 Дальтон и гиперхромный эффект 28 - 46%, в количестве 5 • 10-5 - 5 г на 1 л изотонического раствора.
| SU 1635330 А3, 15.12.93 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
Даты
2001-05-20—Публикация
1998-01-09—Подача