Настоящее изобретение относится к соединениям формулы (I),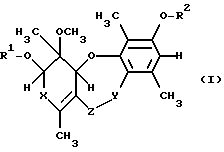
где R1 и R2 независимо друг от друга обозначают водород, незамещенный (низш. )алкил либо (низш. )алкил, замещенный (низш. )алкокси- или (низш. )алкилтиогруппой, или ацил, который может быть незамещенным или может быть замещен одним или несколькими радикалами, выбранными из группы, включающей (низш. )алкил, (низш.)алкокси, (низш.)алкил, замещенный водородом или галогеном,
X обозначает CO или CHOH,
Y обозначает CO или CH2 и
Z обозначает O или NH,
и к их эпимерам или энантиомерам или к их физиологически приемлемым солям.
В контексте настоящего описания понятие "(низш.)алкил" относится к углеводородным группам, содержащим, если не указано иное, до 6 включительно, предпочтительно 1-2 атома углерода, которые могут быть незамещенными или могут быть замещены (низш.)алкокси- или (низш.)алкилтиогруппой. Так, например, "(низш. )алкил" обозначает, например, метил, этил, трет-бутил, н-пентил, замещенный метил, такой как метоксиметил, метилтиометил.
"Ацил" может представлять собой алифатический, аралифатический или ароматический ацил. Предпочтительно алифатический ацил имеет 1-6 атомов углерода и представляет собой, например, формил, ацетил, пропионил, н-бутирил, изобутирил и пивалоил. Алифатический ацил обозначает, например, фенилацетил, который может быть замещен одним или несколькими заместителями, такими как (низш. )алкокси и (низш.)алкил, замещенный галогеном, например, α-метокси-α-(трифторметил)фенилацетил. Предпочтительно ароматический ацил представляет собой бензоил, который может быть незамещенным или может быть замещен (низш. )алкилом, таким как, например, метил, этил, трет-бутил и н-пентил, или галогеном, таким как фтор, хлор, бром или йод. Предпочтительно X обозначает CO, Y обозначает CO и Z обозначает O.
Настоящее изобретение также относится к композициям, содержащим одно или несколько соединений, как определено в формуле (I), или их физиологически приемлемых солей, и к применению этих соединений или их физиологически приемлемых солей в качестве противоопухолевых агентов, к способу получения этих соединений или их физиологически приемлемых солей и к микроорганизмам, способным продуцировать некоторые из этих соединений.
В частности, настоящее изобретение относится к соединениям, обозначенным как соединения A, A-1, A-2, A-3, A-4, A-5, A-6, A-7, A-8, A-9 и A-10, и к соответствующим им эпимерам, соединениям B, B-1, B-2, B-3, B-4, B-5 и B-6 формулы (I), как определено ниже.
Соединение A: I, R1 обозначает H, R2 обозначает H, X обозначает CO, Y обозначает CO, Z обозначает O (3,7-дигидрокси-6- метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b,e] [1,4]диоксепин-8,11-дион).
1) Внешний вид: кристаллы белого цвета
2) Температура плавления: 187-188oC
3) Удельное вращение: [α]
4) Молекулярная масса: (метод БУА-МС (масс-спектроскопия с бомбардировкой ускоренными атомами))
Тип отрицательного иона: m/z 347 (M-H)-
5) Молекулярная формула: C18H20O7
6) Масс-спектроскопия высокого разрешения (для M-H): обнаружено: 347,1146
рассчитано для C18H19O7: 347,1131
7) УФ λmax нм (∈):
в MeOH: 213 (20,100), 282 (14,500)
в MeOH + N/10 HCl: 215 (18,400), 278 (14,200)
в MeOH + N/10 NaOH: 248 (16,100), 297 (13,900), 328 (17,000)
8) ИК-спектр: на таблетке KBr, волновые числа (см-1) основного поглощения: 3410, 2932, 1729, 1678, 1639, 1604, 1232, 1126
9) 1H-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС (тетраметилсилан) в качестве внутреннего стандарта, δ: 1,01 (3Н, s), 1,77 (3Н, d, J=2 Гц), 2,09 (3Н, s), 2,38 (3Н, s), 3,28 (3Н, s), 4,32 (1H, d, J=5 Гц), 5,35 (1H, q, J=2 Гц), 5,52 (1H, d, J=5 Гц, D2O заменяемый), 6,62 (1H, s), 10,60 (1H, s, D2O заменяемый)
10) 13C-ЯМР-спектр: 100 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 8,3, 8,4, 13,3, 21,8, 50,1, 74,6, 80,2, 82,8, 110,8, 113,7, 114,6, 117,1, 142,1, 159,2, 160,2, 160,8, 161,1, 197,5
11) Растворимость:
растворимо в: диметилсульфоксиде, этилацетате, метаноле
нерастворимо в: н-гексане, воде
Соединение A-1: I, R1 обозначает ацетил, R2 обозначает ацетил, X обозначает CO, Y обозначает CO, Z обозначает O (3,7-ди(метилкарбонилокси)-6-метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b, e] [1,4]диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 433 (М+Н)+
3) Молекулярная формула: C22H24O9
4) 1H-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,09 (3Н, s), 1,80 (3Н, d, J=2 Гц), 2,10 (3Н, s), 2,17 (3Н, s), 2,34 (3Н, s), 2,45 (3Н, s), 3,23 (3Н, s), 5,69 (1H, s), 5,78 (1H, q, J=2 Гц), 7,04 (1H, s)
Соединение A-2: I, R1 обозначает водород, R2 обозначает пара-бромбензоил, X обозначает CO, Y обозначает CO, Z обозначает O (3-(4-бромбензоил)-7-гидрокси-6-метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b, e] [1,4]диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 531 (М+Н)+
3) Молекулярная формула: C25H23BrO8
4) 1H-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,00 (3Н, s), 1,80 (3Н, d, J=2 Гц), 2,14 (3Н, s), 2,45 (3Н, s), 3,31 (3Н, s), 4,29 (1H, s), 5,56 (1H, d, J=2 Гц), 5,71 (1H, широкий s), 7,17 (1H, s), 7,85 (2H, d, J=8,5 Гц), 8,08 (2Н, d, J=8,5 Гц)
Соединение A-3: I, R1 обозначает пара-бромбензоил, R2 обозначает пара-бромбензоил, X обозначает CO, Y обозначает CO, Z обозначает O (3,7-ди(4-бромбензоил)-6-метокси-1,4,6,9-тетраметил-6,7- дигидро-5аН-дибензо[b, e] [1,4] диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 713 (М+Н)+
3) Молекулярная формула: C32H26Br2O9
4) 1H-ЯМР-спектр: 400 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,44 (3Н, s), 1,97 (3Н, d, J=2 Гц), 2,19 (3Н, s), 2,57 (3H, s), 3,38 (3Н, s), 5,21 (1H, d, J=2 Гц), 5,73 (1H, s), 6,97 (1H, s), 7,62 (2H, d, J=8,5 Гц), 7,69 (2H, d, J=8,5 Гц), 7,95 (2H, d, J=9 Гц), 8,05 (2H, d, J=9 Гц)
Соединение A-4: I, R1 обозначает H, R2 обозначает CH3, X обозначает CO, Y обозначает CO, Z обозначает O ((5аS,6S,7S)-7- гидрокси-3,6-диметокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b,e][1,4]диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод ЭУ-МС (масс-спектрометрия с электронным ударом))
Тип положительного иона: m/z 362 (M)+0
3) Молекулярная формула: C19H22O7
4) 1H-ЯМР-спектр: 270 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,20 (3Н, s), 1,97 (3Н, d, J=2 Гц), 2,20 (3Н, s), 2,56 (3Н, s), 3,50 (3Н, s), 3,81 (1H, d, J=2,5 Гц), 3,89 (3Н, s), 4,22 (1H, d, J=2,5 Гц), 4,91 (1H, q, J=2 Гц), 6,60 (1H, s).
Соединение A-5: I, R1 обозначает (-)-α-метокси-α-(трифторметил)фенилацетил, R2 обозначает CH3, X обозначает CO, Y обозначает CO, Z обозначает О ((5аS,6R,7R)-2,6-диметокси-1,4,6,9-тетраметил-8,11-диоксо-5а, 6,7,8- тетрагидро-11Н-дибензо[b, e] [1,4]диоксепин-7-иловый эфир (S)-3,3,3 -трифтор- 2-метокси-2-фенилпропионовой кислоты).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 579 (М + H)+
3) Молекулярная формула: C29H29F3O9
4) 1H-ЯМР-спектр: 400 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,29 (3Н, s), 1,97 (3Н, d, J=2 Гц), 2,13 (3Н, s), 2,57 (3H, s), 3,09 (3H, s), 3,72 (3H, d, J=1 Гц), 3,89 (3H, s), 4,98 (1H, d, J=2 Гц), 5,60 (1H, s), 6,61 (1H, s), 7,42 (3H, m), 7,74 (2H, m)
Соединение A-6: I, R1 обозначает (+)-α-метокси-α-(трифторметил)фенилацетил, R2 обозначает CH3, X обозначает CO, Y обозначает CO, Z обозначает O ((5aS,6R,7S)-2,6-диметокси-1,4,6,9-тетраметил- 8,11-диоксо-5а, 6,7,8-тетрагидро-11Н-дибензо[b, e] [1,4] диоксепин- 7-иловый эфир (R)-3,3,3-трифтор-2-метокси-2-фенилпропионовой кислоты).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 579 (M+Н)+
3) Молекулярная формула: C29H29F3O9
4) 1Н-ЯМР-спектр: 400 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,38 (3H, s), 1,96 (3Н, d, J=2 Гц), 2,20 (3H, s), 2,58 (3Н, s), 3,33 (3Н, s), 3,63 (3Н, d, J=1 Гц), 3,91 (3Н, s), 5,07 (1H, d, J=2 Гц), 5,66 (1H, s), 6,62 (1H, s), 7,44 (3Н, m), 7,70 (2H, m)
Соединение A-7: I, R1 обозначает CH2SCH3, R2 обозначает CH3, X обозначает CO, Y обозначает CO, Z обозначает О ((5аS,6R,7S)-3,6-диметокси-1,4,6,9-тетраметил-7-метилсульфанилметокси-6,7-дигидро-5аН-дибензо[b, e] [1,4] диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 423 (M+Н)+
3) Молекулярная формула: C21H26O7S
4) 1Н-ЯМР-спектр: 500 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,40 (3Н, s), 1,88 (3Н, d, J=1,5 Гц), 2,16 (3Н, s), 2,18 (3Н, s), 2,53 (3Н, s), 3,43 (3Н, s), 3,88 (3Н, s), 4,29 (1H, s), 4,86 (2H, d, J=12,5 Гц), 4,93 (1H, q, J=1,5 Гц), 6,55 (1H, s)
Соединение A-8: I, R1 обозначает H, R2 обозначает H, X обозначает CHOH, Y обозначает CO, Z обозначает О (3,7,8-тригидрокси-6-метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН- дибензо[b,e] [1,4]диоксепин-11-он).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод ЭИ-МС)
Тип положительного иона: m/z 350 (М)+0
3) Молекулярная формула: C18H22O7
4) 1Н-ЯМР-спектр: 500 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,43 (3Н, s), 1,63 (3Н, s), 2,01 (3Н, s), 2,21 (3Н, s), 3,28 (3Н, s), 3,56 (1H, dd, J=5, 5,4 Гц), 4,07 (1H, ddd, J=8, 4,5, 1 Гц), 4,59 (1H, d, J=5 Гц, D2O заменяемый), 4,67 (1H, d, J=1 Гц), 4,77 (1H, d, J= 8 Гц, D2O заменяемый), 6,40 (1H, s), 9,82 (1H, широкий s, D2O заменяемый)
Соединение A-9: I, R1 обозначает H, R2 обозначает H, X обозначает CO, Y обозначает CH2, Z обозначает О ((5аS,6S,7S)-3,7- дигидрокси-6-метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН,11Н-дибензо[b,e][1,4]диоксепин-8-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 335 (М+H)+
3) Молекулярная формула: C18H22O6
4) 1Н-ЯМР-спектр: 500 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,15 (3Н, s), 1,66 (3Н, s), 2,01 (3Н, s), 2,12 (3Н, s), 3,27 (3Н, s), 4,26 (1H, d, J=5 Гц), 5,18 (1H, d, J=14 Гц), 5,22 (1H, d, J=5 Гц, D2O заменяемый), 5,23 (1H, s), 5,29 (1H, d, J=14 Гц), 6,39 (1H, s), 9,33 (1H, s, D2O заменяемый)
Соединение A-10: I, R1 обозначает H, R обозначает H, X обозначает CO, Y обозначает CO, Z обозначает NH.
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 348 (М+Н)+
3) Молекулярная формула: C18H21NO6
4) 1Н-ЯМР-спектр: 400 МГц в MeOH-d4 при использовании ТМС в качестве внутреннего стандарта, δ: 1,25 (3Н, s), 1,90 (3Н, d, J=l,2 Гц), 2,20 (3Н, s), 2,44 (3Н, s), 3,36 (3Н, s), 4,35 (1H, s), 4,95 (1H, s с расширением), 6,56 (1H, s)
Соединение B: энантиомер соединения A (3,7-дигидрокси-6- метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b,e] [1,4]диоксепин-8,11-дион).
1) Внешний вид: кристаллы белого цвета
2) Температура плавления: 198-199oC
3) Удельное вращение: [α]
4) Молекулярная масса: (метод БУА-МС)
Тип отрицательного иона: m/z 347 (М-Н)-
5) Молекулярная формула: C18H20O7
6) Масс-спектроскопия высокого разрешения (для М-Н):
обнаружено: 347,1140
рассчитано для C18H19O7: 347,1131
7) УФ λmax нм (∈):
в MeOH: 220 (21300), 290 (8400)
в MeOH + N/10 HCl: 220 (20100), 289 (8000)
в MeOH + N/10 NaOH: 249 (17100), 335 (12800)
8) ИК-спектр: на таблетке KBr, волновые числа (см-1) основного поглощения: 3424, 2932, 1744, 1657, 1600, 1247, 1128
9) 1H-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,53 (3Н, s), 1,66 (3Н, s), 2,00 (3Н, s), 2,32 (3Н, s), 3,24 (3H, s), 4,27 (1H, d, J=6 Гц), 5,13 (1H, s), 5,42 (1H, d, J=6 Гц, D2O заменяемый), 6,54 (1H, s), 10,38 (1H, широкий s, D2O заменяемый)
10) 13C-ЯМР-спектр: 125 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 7,7, 8,6, 15,7, 22,3, 51,3, 75,4, 77,0, 79,9, 107,9, 111,0, 113,0, 117,3, 139,7, 155,2, 155,8, 159,8, 162,2, 196,5
11) Растворимость:
растворимо в: диметилсульфоксиде, этилацетате, метаноле
нерастворимо в: н-гексане, воде
Соединение B-1: эпимер соединения A-1 (3,7-ди(метилкарбонилокси)-6- метокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b, e] [1,4] диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 433 (М+Н)+
3) Молекулярная формула: C22H24O9
4) 1H-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,51 (3Н, s), 1,69 (3Н, s), 1,98 (3Н, s), 2,21 (3Н, s), 2,33 (3Н, s), 2,39 (3Н, s), 3,28 (3Н, s), 5,55 (1H, s), 5,56 (1H, s), 6,92 (1H, s)
Соединение B-2: эпимер соединения A-2 (3-(4-бромбензоил)-7-гидрокси-6- метокси 1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b, е] [1,4] диоксепин -8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 531 (М+Н)+
3) Молекулярная формула: C25H23BrO8
4) 1Н-ЯМР-спектр: 400 МГц в ДМСО-d6 при использовании ТМС в качестве внутреннего стандарта, δ: 1,55 (3Н, s), 1,71 (3Н, s), 2,04 (3Н, s), 2,41 (3Н, s), 3,26 (3Н, s), 4,23 (1H, d, J=6 Гц), 5,37 (1H, s), 5,46 (1H, d, J=6 Гц), 7,07 (1H, s), 7,86 (2H, d, J=8 Гц), 8,06 (2H, d, J=8 Гц)
Соединение B-3: эпимер соединения A-3
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 713 (М+Н)+
3) Молекулярная формула: C32H26Br2O9
4) 1Н-ЯМР-спектр: 500 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,63 (3Н, s), 1,87 (3Н, s), 2,13 (3Н, s), 2,50 (3Н, s), 3,47 (3Н, s), 4,92 (1H, s), 5,95 (1H, s), 6,86 (1H, s), 7,63 (2H, d, J=9 Гц), 7,69 (2H, d, J=9 Гц), 7,98 (2H, d, J=8 Гц), 8,06 (2H, d, J=8 Гц)
Соединение B-4: эпимер соединения A-4 ((5аS,6S,7R)-7-гидрокси- 3,6-диметокси-1,4,6,9-тетраметил-6,7-дигидро-5аН-дибензо[b, e] [1,4] диоксепин-8,11-дион).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод ЭИ-МС)
Тип положительного иона: m/z 362 (М)+0
3) Молекулярная формула: C19H22O7
4) 1H-ЯМР-спектр: 400 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,71 (3Н, s), 1,84 (3Н, s), 2,08 (3Н, s), 2,51 (3H, s), 3,35 (3Н, s), 3,53 (1H, d, J=3,5 Гц, D2O заменяемый), 3,87 (3Н, s), 4,43 (1H, d, J=3,5 Гц), 4,76 (1H, s), 6,54 (1H, s)
Соединение B-5: эпимер соединения A-5 ((5аS, 6R,7S)-2,6-диметокси-1,4,6,9- тетраметил-8,11-диоксо-5а, 6,7,8-тетрагидро-11Н-дибензо[b,e] [1,4] диоксепин-7-иловый эфир (S)-3,3,3-трифтор-2-метокси-2- фенилпропионовой кислоты).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 579 (М + Н)+
3) Молекулярная формула: C29H29F3O9
4) 1H-ЯМР-спектр: 500 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,61 (3Н, s), 1,82 (3Н, s), 2,11 (3Н, s), 2,51 (3Н, s), 3,30 (3Н, s), 3,59 (3Н, s), 3,88 (3Н, s), 4,78 (1H, s), 5,81 (1H, s), 6,55 (1H, s), 7,45 (3Н, m), 7,69 (2H, m)
Соединение B-6: эпимер соединения A-6 ((5аS,6R,7R)-2,6- диметокси-1,4,6,9-тетраметил-8,11-диоксо-5а, 6,7,8-тетрагидро-11Н- дибензо[b,e] [1,4] диоксепин-7-иловый эфир (R)-3,3,3-трифтор-2- метокси-2-фенилпропионовой кислоты).
1) Внешний вид: порошок белого цвета
2) Молекулярная масса: (метод БУА-МС)
Тип положительного иона: m/z 579 (М + Н)+
3) Молекулярная формула: C29H29F3O9
4) 1H-ЯМР-спектр: 500 МГц в CDCl3 при использовании ТМС в качестве внутреннего стандарта, δ: 1,37 (3Н, s), 1,83 (3Н, s), 2,10 (3Н, s), 2,50 (3Н, s), 3,18 (3Н, s), 3,72 (3Н, s), 3,88 (3Н, s), 4,72 (1H, s), 5,80 (1H, s), 6,55 (1H, s), 7,45 (3Н, m), 7,80 (2H, m)
Согласно способу по настоящему изобретению соединение A (R1 обозначает H, R2 обозначает H, X обозначает CO, Z обозначает О) и его эпимер, соединение В (R1 обозначает H, R2 обозначает H, X обозначает CO, Z обозначает О), могут быть получены путем культивирования микроорганизма, принадлежащего к роду Aspergillus, обладающего способностью продуцировать соединения A и/или B в аэробных условиях в культуральной среде, и выделения соединений A и B из культуры.
Микроорганизм, который используется согласно вышеуказанному способу, может относиться к любому штамму (включая мутанты и варианты), принадлежащему к роду Aspergillus, обладающему способностью продуцировать эти соединения. Особенно предпочтительными штаммами являются Aspergillus japonicus NR 7328, Aspergillus fumigatus NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334, а также их мутанты и варианты.
Штаммы Aspergillus japonicus NR 7328, Aspergillus fumigatus NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334 выделяли из кукурузы или из образцов почвы и идентифицировали в качестве штаммов, принадлежащих к видам Aspergillus japonicus и Aspergillus fumigatus соответственно. Штаммы, обозначенные как Aspergillus japonicus NR 7328 и Aspergillus fumigatus NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334, были депонированы в DMS (Deutsche Sammliung von Mikroorganismen und Zellkulturen GmbH (Немецкая коллекция микроорганизмов и клеточных культур), Германия, в соответствии с Будапештским договором от 9 мая 1996 г. под следующими номерами: Aspergillus japonicus NR 7328 (DSM 10677), Aspergillus fumigatus NR 7329 (DSM 10678), Aspergillus fumigatus NR 7330 (DSM 10679), Aspergillus fumigatus NR 7331 (DSM 10680), Aspergillus fumigatus NR 7332 (DSM 10681) и Aspergillus fumigatus NR 7334 (DSM 10682).
Aspergillus japonicus NR 7328 (DSM 10677), Aspergillus fumigatus NR 7329 (DSM 10678), NR 7330 (DSM 10679), NR 7331 (DSM 10680), NR 7332 (DSM 10681) и NR 7334 (DSM 10682) имеют следующие характеристики культивирования и морфологические характеристики.
Особенности культивирования штамма NR 7328
На агаре с дрожжевым экстрактом Чапека (CYA-агар) колонии росли быстро и заполняли чашки Петри через 7 дней при 25oC, проявляя обильный конидиогенез в центре плотной хлопьевидноопушенной мицелярной пленки. Колонии имели цвет от глубокого коричневого до темно-коричневого (Munsell, 7,5YR2/2-7,5YR2/2). Мицелий был белого цвета. Цвет с обратной стороны был светло-желтым (Munsell, 2,5Y8/6). Эксудат и растворимые пигменты не продуцировались.
На агаре с солодовым экстрактом (MEA-агар) при 25oC колонии росли относительно медленнее, чем на CYA-агаре, достигая диаметра 48-50 мм через 7 дней при 25oC и образуя плоские, плотные колонии с сильной споруляцией. Цвет колоний был темно-желтовато-коричневый (Munsell, 10YR3/2). Мицелий был белого цвета, но не выраженный. Цвет с обратной стороны был бледно-желтым (Munsell, 5Y8/4). Эксудат и растворимые пигменты не продуцировались.
На агаре с дрожжевым экстрактом Чапека с добавлением 20%-ной сахарозы (CY20S-arap) при 25oC колонии росли быстрее, чем на CYA-агаре. Цвет колоний был также темно-коричневым. Мицелий был белый и хлопьевидноопушенный. Цвет с обратной стороны был желтовато-белым.
На CYA-агаре при 37oC колонии росли со средней скоростью, достигая диаметра 17-18 мм через 7 дней и образуя бороздчатые, выпуклые колонии. Конидиогенез был слабым. Цвет колоний был темно-желтовато-серым (Munsell, 5Y5/2). Цвет с обратной стороны был глубоким желтовато-коричневым (Munsell, 5Y3/2).
На CYA-агаре при 5oC развития не наблюдалось.
Морфологические характеристики штамма NR 7328
Верхушки конидиев вначале лучееобразно расходились и разделялись на несколько продольных колонн. Стригмата односерийная, плотно покрыта короткими фиалидами и покрывает почти всю поверхность пузырьков. Пузырек шаровидный диаметром примерно 35-55(-75) мкм с плотной стенкой, имеющей в некоторой степени коричневатый оттенок. Ножка толстая, с гладкой поверхностью размером 7,5-20 х 250-700(-1000) мкм. Конидии шаровидные или близки к шаровидной форме, иногда эллиптические, с темной пигментацией, диаметром 3,5-5,0 мкм. Поверхность конидиев мелкоигольчатая с широко расставленными иглами.
Штамм NR 7328 давал темноокрашенные с некоторым оттенком черного плотные колонии с обильным конидиогенезом. Пузырек шаровидный или близкий к шаровидной форме. Стригмата из отдельных серий. Конидии шаровидные или эллиптические, мелкоигольчатые, темноокрашенные. На основании этих отличительных характеристик настоящий штамм NR 7328 был индентифицирован как штамм Aspergillus japonicus и обозначен как Aspergillus japonicus NR 7328 (DSM 10677).
Особенности культивирования штаммов NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334
На CYA-агаре колонии этих штаммов росли быстро, достигая диаметра 53-61 мм, за исключением штамма NR 7334, который позднее, чем другие штаммы, достигал диаметра 44-45 мм через 7 дней при 25oC. Все колонии имели плоскую, бархатистую текстуру с обильным, хлопьевидноопушенным конидиогенезом. Колонии были невыраженного синевато-зеленого цвета (Munsell, 5BG4/2-7/4) или от темного до светлого сине-зеленого цвета. Мицелий был белого цвета только по краям и иногда невыраженным. Цвет штамма NR 7329 с обратной стороны был колониальным желтым (Munsell, 5Y7/6), а цвет остальных штаммов был от неаполитанского желтого (Munsell, 2,5Y8/6) до слабого желто-зеленого (Munsell, 2.5GY7/2). Эксудат и растворимые пигменты не продуцировались.
На MEA-агаре колонии росли быстро, достигая диаметра 52-63 мм через 7 дней при 25oC; плоские, плотные иногда войлочные колонии имели более рыхлую текстуру по сравнению с колониями, выращенными на CYA-агаре при 25oC. Колонии были тусклого зеленого или зеленовато-серого цвета (Munsell, 5G5/4-7/2). Мицелий был невыраженным. Обратная сторона была бесцветной или тусклого желто-зеленого цвета (Munsell, 7,5GY6/4). Эксудат и растворимые пигменты не наблюдались.
На CY20S-агаре при 25oC колонии росли быстро, достигая диаметра 50-56 мм через 7 дней и давая плотные бархатистые или войлочные колонии. Цвет и текстура колоний были такими же, как и при культивировании на CYA-агаре при 25oC. Мицелий имел белый или светло-зеленовато-желтоватый цвет (Munsell, 10Y9/4) только по краям. Обратная сторона колоний была от кремовой до средненасыщенного зеленовато-желтого цвета (Munsell, 10Y7)/6). Только штамм FE 6425 слабо продуцировал красновато-коричневый растворимый пигмент.
На CYA-агаре при 37oC колонии росли быстро и заполняли чашку Петри, давая плоские порошкообразные колонии. Цвет колоний был от серовато-желто-зеленого до серовато-зеленого (цвет листа шалфея) (Munsell, 7,5GY6/2-5GY6/2). Конидиогенез был очень обильным, а мицелий был невыраженным или был расположен только по краям. Обратная сторона колоний была бороздчатой и имела цвет от цвета буйволиной кожи (темно-желтый) до светлого красновато-желтого цвета (Munsell, 2,5Y6/6-7/6). Некоторые из этих колоний продуцировали прозрачный эксудат.
На CYA-агаре при 5oC развитие всех штаммов не наблюдалось.
Морфологические характеристики штаммов NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334
Верхушки конидиев колончатые. Стригмата односерийная, плотно покрыта фиалидами, которые расположены параллельно друг другу и оси ножки. Фиалиды покрывают от более половины до двух третей пузырьков. Пузырек лопатообразный или имеет форму воронки с толстой стенкой толщиной 13-30 мкм. Ножка неокрашенная, с гладкой поверхностью, постепенно переходящая в пузырек длиной до 400 мкм, иногда 500 мкм. Конидии шаровидные или близки к шаровидной форме, иногда эллиптические, диаметром 2,5-4,0 мкм. Поверхность конидиев разная от гладкой до шероховатой и иногда мелкоигольчатая.
Колонии растут быстро при 25oC, а также при 37oC, имеют тусклый зеленый оттенок, плотные, с обильным конидиогенезом. Верхушка конидия образует колонну. Пузырек лопатовидной формы, плодородный слой достигает половины или двух третей пузырька, плотно покрыт фиалидами, они параллельны друг другу и оси. Стригмата состоит из отдельных серий. Конидии маленькие, от шаровидных до эллиптических. На основании этих отличительных характеристик настоящие штаммы NR 7329, NR 7330, NR 7331, NR 7332 и NR 7334 были индентифицированы соответственно как штаммы Aspergillus fumigatus, обозначенные как Aspergillus fumigatus NR 7329 (DSM 10678), Aspergillus fumigatus NR 7330 (DSM 10679), Aspergillus fumigatus NR 7331 (DSM 10680), Aspergillus fumigatus NR 7332 (DSM 10681) и Aspergillus fumigatus NR 7334 (DSM 10682).
Соединения A и B по настоящему изобретению могут быть получены путем культивирования микроорганизма, принадлежащего к роду Aspergillus, который обладает способностью продуцировать соединения A и/или B в аэробных условиях в культуральной среде, и выделения соединений A и B из культуры.
Культивирование согласно настоящему изобретению может быть проведено в культуральной среде, которая додержит обычные питательные вещества, необходимые для культивируемого микроорганизма. В качестве источников углерода можно использовать, например, глюкозу, сахарозу, крахмал, глицерин, мелассу, декстрин и их смеси. Источниками азота являются, например, соевая мука, мука из семян хлопчатника, мясной экстракт, пептон, сухие дрожжи, дрожжевой экстракт, экстракт замоченных семян, сульфат аммония, нитрат аммония и их смеси. Однако в культуральную среду могут быть добавлены другие органические или неорганические вещества с целью усиления роста микроорганизма и увеличения производства фунгаррестинов. Примерами таких веществ являются неорганические соли, такие как карбонат кальция, хлорид натрия, фосфаты и т.п.
Культивирование проводят в аэробных условиях в водной среде, предпочтительно путем глубинного брожения. Культивирование можно проводить при температуре от 20oC до 37oC, а оптимальной является температура 27oC. Культивирование предпочтительно проводят при значении pH 3-9. Время культивирования зависит от условий, при которых его проводят. Как правило, для проведения культивирования достаточно 20-200 ч.
Для выделения соединений A и B из культур могут применяться методы разделения, которые обычно применяются для выделения метаболитов, продуцируемых микроорганизмами, из их культур. Например, мицелий может быть отделен от ферментационного бульона центрифугированием или фильтрацией, а соединения по изобретению могут быть экстрагированы из фильтрата смешивающимся с водой органическим растворителем, таким как спирт, например н-бутанол, и сложный эфир, например этилацетат, бутилацетат и т.д. С другой стороны, соединения по изобретению, содержащиеся в отделенном мицелии, могут быть получены, например, экстракцией мицелия растворителем, таким как водный ацетон или водный метанол, с удалением растворителя и дополнительной экстракцией остатка смешивающимся с водой органическим растворителем. Полученный при этом слой растворителя сушат над обезвоживающим агентом, таким как сульфат натрия и т. д., а затем концентрируют при пониженном давлении. Образовавшиеся неочищенные соединения A и B могут быть очищены с помощью методов распределения, методов хроматографии на колонках (с использованием в качестве адсорбентов силикагеля, оксида алюминия, октадецил-силикагеля, Сефадекса LH-20 и т.д.) и жидкостной хроматографии высокого разрешения (с использованием в качестве адсорбентов силикагеля, октадецил-силикагеля и фенил-силикагеля и т. д.).
Соединения A и B могут быть выделены в свободой форме, но при необходимости могут быть превращены в физиологически приемлемые соли (например, соли натрия, соли аммония и т.д.) общепринятыми методами.
Соединения A и B могут быть превращены в соединения A-1...A-10 и B-1... B-6 соответственно согласно описанным ниже способам A-E.
Способ A
Соединения формулы (I), в которых R1 обозначает (низш.)алкил, R2 обозначает водород, X и Y обозначают CO и Z обозначает О или R1 обозначает водород, R2 обозначает (низш.)алкил, X и Y обозначают CO и Z обозначает О, или R1 и R2 обозначают (низш.)алкил, Х и Y обозначают CO и Z обозначает О, могут быть получены алкилированием соединения A или B алкилгалогенидом или алкилсульфатом в присутствии основания, такого как карбонат калия или оксид серебра, в инертном растворителе, таком как ацетон или N,N-диметилформамид. Температура реакции может варьироваться в широких пределах: приблизительно от -50oC до 150oC, предпочтительно приблизительно от 0oC до 100oC. Метилирование также может быть проведено путем обработки соединения A или B диазометаном в таком растворителе, как хлороформ или метанол. Температура реакции может варьироваться в широких пределах: приблизительно от 0oC до 80oC, предпочтительно приблизительно от 10oC до 30oC.
Способ Б
Соединения формулы (I), в которых R1 обозначает ацил, R2 обозначает водород, X и Y обозначают CO и Z обозначает О или R1 обозначает водород, R2 обозначает ацил, X и Y обозначают CO и Z обозначает О, или R1 и R2 обозначают ацил, X и Y обозначают CO и Z обозначает О, могут быть получены путем ацилирования соединения A или B карбоновой кислотой в присутствии связывающего вещества, такого как карбодиимид, в инертном растворителе, таком как ацетонитрил или диоксан. Температура реакции может варьироваться в широких пределах: приблизительно от -50oC до 100oC, предпочтительно приблизительно от -20oC до 50oC. Ацилирование также может быть проведено с использованием реакционноспособного производного указанной карбоновой кислоты, такого как, например, хлорангидрид кислоты или смешанный ангидрид другой органической кислоты, например бензолсульфоновой кислоты. Ацилирование необязательно проводят в присутствии основания, такого как бикарбонат натрия, пиридин, триэтиламин или N, N-диметиламинопиридин, в инертном органическом растворителе, таком как метиленхлорид, хлороформ, ацетонитрил или N,N-диметилформамид.
Способ B
Соединения формулы (I), в которых R1 обозначает (низш.)алкил, R2 обозначает ацил, X и Y обозначают CO и Z обозначает О или R1 обозначает ацил, R2 обозначает (низш. )алкил, X и Y обозначают CO и Z обозначает О, могут быть получены ацилированием соединений формулы (I), в которых R1 обозначает (низш. )алкил, R2 обозначает водород, X и Y обозначают CO и Z обозначает О или R1 обозначает водород, R2 обозначает (низш.)алкил, X и Y обозначают CO и Z обозначает О (которые получены согласно способу A), карбоновой кислотой в присутствии связывающего вещества, такого как карбодиимид, в инертном растворителе, таком как ацетонитрил или диоксан. Температура реакции может варьироваться в широком диапазоне: приблизительно от -50oC до 100oC, предпочтительно приблизительно от -20oC до 50oC. Ацилирование также может быть проведено с использованием реакционноспособного производного указанной карбоновой кислоты, такого как, например, хлорангидрид кислоты или смешанный ангидрид другой органической кислоты, например бензолсульфоновой кислоты. Ацилирование необязательно проводят в присутствии основания, такого как бикарбонат натрия, пиридин, триэтиламин или N,N-диметиламинопиридин, в инертном органическом растворителе, таком как метиленхлорид, хлороформ, ацетонитрил или N,N-диметилформамид, или соединения могут быть получены алкилированием соединений формулы (I), в которых R1 обозначает ацил, R2 обозначает водород, X и Y обозначают CO и Z обозначает О или R1 обозначает водород, R2 обозначает ацил, X и Y обозначают CO и Z обозначает О (которые получены согласно вышеприведенному способу Б), алкилгалогенидом или алкилсульфатом в присутствии основания, такого как карбонат калия или оксид серебра, в инертном растворителе, таком как ацетон или N,N-диметилформамид. Температура реакции может варьироваться в широком диапазоне: приблизительно от -50oC до 100oC, предпочтительно приблизительно от -20oC до 50oC. Метилирование может быть проведено также путем обработки соединения A или B диазометаном в таком растворителе, как хлороформ или метанол. Температура реакции может варьироваться в широком диапазоне: приблизительно от 0oC до 80oC, предпочтительно приблизительно от 10oC до 30oC.
Способ Г
Соединения формулы (I), в которых X обозначает CHOH, R1 и R2 каждый обозначает водород, (низш. )алкил или ацил, Y обозначают CO и Z обозначает О, могут быть получены восстановлением соединения A или B или соединения, полученного согласно методу, описанному выше в способе A, Б или В, гидрированием в присутствии катализатора, такого как палладий на древесном угле или платина, в пригодном апротонном органическом растворителе, таком как этиловый спирт или уксусная кислота, необязательно при повышенном давлении, или путем обработки борогидридом натрия в пригодном органическом растворителе, таком как этиловый спирт. Температура реакции может варьироваться в широком диапазоне: приблизительно от -80oC до 50oC, предпочтительно приблизительно от 0oC до 30oC.
Способ Д
Соединения формулы (I), в которых Y обозначает CH2, R1 и R2 каждый обозначает водород, (низш.)алкил или ацил, X обозначают CO или CHOH и Z обозначает О, могут быть получены восстановлением соединения A или B или соединения, полученного согласно методу, описанному выше в способе A, Б, B или Г, путем обработки борогидридом натрия в пригодном органическом растворителе, таком как этиловый спирт. Температура реакции может варьироваться в широком диапазоне: приблизительно от -80oC до 50oC, предпочтительно приблизительно от 0oC до 30oC.
Способ E
Соединения формулы (I), в которых Z обозначает NH, R1 и R2 каждый обозначает водород, (низш. )алкил или ацил, X обозначают CO или CHOH и Y обозначает CO или CH2, могут быть получены путем обработки соединения A или B или соединения, полученного согласно методу, описанному выше в способе A, Б, В, Г или Д, аммиаком в пригодном органическом растворителе, таком как N, N-диметилформамид, при температуре приблизительно от -40oC до 80oC, предпочтительно приблизительно от 0oC до 30oC, с последующим нагреванием в пригодном растворителе, таком как толуол и бензол, в присутствии слабой кислоты, такой как пара-толуолсульфонат пиридиния, при температуре приблизительно от 40oC до 200oC, предпочтительно приблизительно от 80oC до 150oC.
Антипролиферативная активность соединений формулы (I) в отношении нескольких трансформированных линий клеток
Линию клеток карциномы толстой кишки (НТ-29 и SW480), линию клеток карциномы легкого (Н460а), линию клеток остеосаркомы (Saos-2) и линию клеток поджелудочной железы (ASPC-1) получали из АТСС (American type Cell Culture Collection) (Американская коллекция типовых клеточных культур) и выращивали в культуральной среде согласно рекомендациям АТСС. Также оценивали антипролиферативные активности соединений на клетках линии карциномы молочной железы (T-47D и MCF-7), на клетках линии карциномы толстой кишки (COLO-320 DM и НСТ116) и на клетках линии карциномы легкого (Н1299). Для анализа воздействия различных соединений на рост этих клеток клетки высевали в концентрации, которая давала возможность получить как минимум 4 дублирования в конце анализа. Тестируемые соединения растворяли в 100%-ном ДМСО, получая маточный раствор с концентрацией 10 мМ. Каждое соединение разбавляли водой до концентрации 1 мМ и добавляли в трех повторностях в лунки первого ряда, содержащего среду 96-луночного планшета-"хозяина", получая конечную концентрацию 40 мкМ. Соединения затем подвергали серийному разбавлению в среде планшета-"хозяина". Разбавленное (ые) соединение (я) затем переносили в планшеты для анализа, содержащие клетки. Конечная концентрация ДМСО в каждой лунке составляла 0,1% ДМСО. Анализы с использованием МТТ проводили через различные промежутки времени после добавления соединений. МТТ (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия, тиазолил голубой) добавляли в каждую лунку, получая конечную концентрацию 1 мг/мл. 3атем планшеты инкубировали при 37oC в течение 2,5-3 ч. 3атем среду, содержащую МТТ, удаляли и для растворения формазана в каждую лунку добавляли по 50 мкл 100%-ного этанола. Далее подсчитывали абсорбцию с помощью автоматического планшент-ридера (планшент-ридер типа Bio-tek). В случае клеток линии Saos-2 клетки высевали в 6-луночные планшеты, различные концентрации соединений добавляли через 24 ч после посева и затем клетки оценивали через различное количество дней после добавления лекарства. Результаты приведены в таблице 1.
Как видно из приведенной таблицы 1, соединения A и В обладают ингибирующей активностью в отношении пролиферации трансформированных линий клеток, Таким образом, соединения формулы (I) по настоящему изобретению являются приемлемыми противоопухолевыми агентами в отношении рака молочной железы, рака толстой кишки, рака легкого, злокачественной остеосаркомы и т.п. при соответствующем введении млекопитающему: как человеку, так и представителям других видов.
Острая токсичность соединений формулы (I) по настоящему изобретению не выявлена.
Продукты по изобретению могут применяться в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального (орального) введения. Продукты по изобретению могут вводиться, например, перорально, например, в форме таблеток, таблеток с покрытием, драже, желатиновых капсул с твердым или мягким покрытием, растворов, эмульсий или суспензий, или ректально, например, в форме суппозиториев.
Для терапевтического применения соединения формулы (I) и их физиологически приемлемые соли могут быть изготовлены в виде фармацевтических композиций различных форм. Фармацевтические композиции, содержащие эти соединения, могут быть изготовлены с использованием общепринятых методов, известных специалистам в данной области, таких как объединение ингредиентов в дозируемой форме вместе с пригодными, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и при необходимости с обычно применяемыми фармацевтическими адьювантами.
Предполагается, что соединения в конечном итоге включают в композиции соответствующих оральных или парентеральных дозируемых форм. Композиции по изобретению могут содержать в качестве необязательных ингредиентов любые из различных адъювантов, которые обычно применяются для изготовления фармацевтических препаратов. Так, например, при изготовлении композиций по настоящему изобретению с получением требуемых оральных дозируемых форм в качестве необязательных ингредиентов могут применяться наполнители, такие как совместно осажденные гидроксид алюминия-карбонат кальция, вторичный кислый фосфат кальция или лактоза, агенты, способствующие дезинтеграции, такие как кукурузный крахмал, замасливатели, такие как тальк, стеарат кальция и т.п. Очевидно, однако, что такие необязательные ингредиенты указаны в настоящем описании исключительно в качестве примеров и что изобретение не ограничено только их применением. При осуществлении изобретения могут применяться и другие такие адъюванты, которые хорошо известны в данной области.
В качестве таких носителей можно использовать не только неорганические, но и органические носители. Так, для таблеток, таблеток с покрытием, драже и желатиновых капсул с твердым покрытием могут применяться, например, лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Приемлемыми носителями для желатиновых капсул с мягким покрытием являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы действующего вещества, причем иногда для изготовления желатиновых капсул с мягким покрытием носители не требуются). Приемлемыми носителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар и глюкоза. Приемлемыми носителями для суппозиториев являются, например, природные или гидрогенизированные масла, воски, жиры и полутвердые или жидкие полиолы.
В качестве фармацевтических адъювантов также могут применяться общепринятые консерванты, солюбилизаторы, стабилизаторы, смачивающие вещества, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, покровные вещества и антиоксиданты.
Соединения формулы (I) или их соли предпочтительно могут использоваться для парентерального введения, и для этой цели их предпочтительно изготавливать в виде лиофилизатов или сухих порошков, предназначенных для разбавления общепринятыми агентами, такими как вода или изотонический раствор общих солей.
Например, соединение A можно вводить внутривенно, подкожно или внутримышечно, как правило, в физиологическом растворе, обычно в дозе 1-50 мг/кг/день, предпочтительно 1-20 мг/кг/день, или в виде капсул или покрытых сахаром таблеток и обычно применять в суточной дозе, составляющей 1-100 мг/кг/день, предпочтительно 5-50 мг/кг/день.
Ниже изобретение проиллюстрировано на примерах, которые, однако, не ограничивают его объем. Если не указано иное, % обозначает процентное содержание в отношении массы к объему (мас./об.).
Пример 1
Культура в колбе
Часть маточной культуры (0,1 мл) Aspergillus fumigatus NR 7329 (DSM 10678) инокулировали в колбу Эрленмейера объемом 500 мл, содержащую 100 мл среды, включающей 0,05% Mg3(PO4)2•8H2O, 0,8% KCl, 5,0% сахарозы, 1,0% экстракта замоченных зерен, 2% сои Toast (фирма Nisshin Seiyu Co. Ltd., Япония) и 0,03% пеногасителя Nissan CA-123 (фирма Nippon Yushi, Co. Ltd., Япония). 3начение pH среды доводили до 6,5. Посеянную культуру инкубировали при 27oC на роторном шейкере при 220 об/мин в течение 3 дней. 3атем аликвоты объемом по 2 мл переносили в сто колб объемом по 500 мл, каждая из которых содержала по 100 мл такой же среды, которая описана выше. Ферментацию проводили на роторном шейкере в таких же условиях, как и при посеве культуры. Через примерно 96 ч выход соединений достигал максимума. 3атем весь бульон подвергали процессу выделения, описанному ниже.
Ферментация в сосуде
Часть маточной культуры (0,1 мл) Aspergillus fumigatus NR 7329 (DSM 10678) инокулировали в колбу Эрленмейера объемом 500 мл, содержащую 100 мл описанной выше среды. Первый посев культуры инкубировали при 27oС на роторном шейкере при 220 об/мин. 3атем аликвоты объемом по 2 мл переносили в 24 колбы объемом по 500 мл, каждая из которых содержала по 100 мл такой же среды, которая описана выше. Ферментацию проводили в течение 3 дней в таких же условиях. По 600 мл каждой из полученных культур инокулировали в сосуды для ферментации объемом 50 л, каждый из которых содержал по 30 л такой же среды, дополнительно содержащей 500 мл пеногасителя Nissan CA-123. Ферментацию в сосуде проводили при 27oC с перемешиванием при 400 об/миц и со скоростью воздушного потока 30 л/мин. Максимальный выход соединений достигался после ферментации примерно в течение 91 ч, и весь бульон подвергали процессу выделения, описанному ниже.
Процесс выделения I
Культуральный бульон (10 л), полученный в результате описанной выше ферментации в сосуде, разделяли центрифугированием на супернатант и мицелярный осадок. Супернатант (6,4 л) экстрагировали этилацетатом (6,4 л) и органический слой концентрировали досуха при пониженном давлении. Концентрат (6,9 г) растворяли в метаноле (1 л) и распределяли в н-гексане (2 л) с последующим удалением слоя н-гексана. Метанольный слой затем концентрировали досуха при пониженном давлении (неочищенный экстракт I; 5,2 г). С другой стороны, мицелярный осадок экстрагировали метанолом (4,5 л) и смесь фильтровали, получая метанольный экстракт. Полученный таким путем метанольный экстракт концентрировали при пониженном давлении и концентрат (1,5 л) промывали н-гексаном (1,5 л). Нижний слой концентрировали досуха при пониженном давлении. Остаток растворяли в воде (1,5 л) и полученную таким путем суспензию экстрагировали этилацетатом (1,5 л). Этилацетатный слой затем концентрировали досуха при пониженном давлении (неочищенный экстракт II; 4,0 г). Неочищенные экстракты I и II объединяли и подвергали хроматографии на колонке типа YMC-GEL ODS-A 60-60/30 (50 г, YMC Co. Ltd, Япония). Колонку элюировали смесью воды и метанола. Элюаты, содержащие активные соединения, объединяли и концентрировали досуха при пониженном давлении. 3атем остаток (7,1 г) подвергали хроматографии на колонке на Sephadex LH-20 (4 л, фирма Pharmacia, Швеция), используя в качестве элюента метанол. Элюаты, содержащие активные соединения, объединяли, получая 2 фракции (фракция 1: 1,98 г, фракция 2: 63 мг). Фракцию 1 подвергали препаративной ЖХВР (CAPCELL PAK C18 UG-120A; фирма Shiseido, Япония), используя в качестве элюента 30%-ный водный ацетонитрил. Фракции, содержащие соединение A и В соответственно, концентрировали досуха при пониженном давлении. Остаток, содержащий соединение A (275 мг), повторно подвергали препаративной ЖХВР (YMC-Pack Ph А-414; фирма YMC Co., Ltd., Япония), используя в качестве элюента 30%-ный водный ацетонитрил. Фракции, содержащие соединение A, концентрировали досуха при пониженном давлении, затем кристаллизовали из метанола, получая соединение A в виде кристаллов белого цвета (132 мг). Остаток, содержащий соединение В (115 мг), обрабатывали таким же путем, получая соединение В виде кристаллов белого цвета (74 мг).
Процесс выделения II
Культуральный бульон (120 л), полученный в результате описанной выше ферментации в сосуде, разделяли центрифугированием на супернатант и мицелярный осадок. Супернатант (100 л) экстрагировали этилацетатом (72 л) и органический слой концентрировали досуха при пониженном давлении. Концентрат (160 г) растворяли в метаноле (3 л) и распределяли в н-гексане (5 л) с последующим удалением слоя н-гексана. Метанольный слой затем концентрировали досуха при пониженном давлении (неочищенный экстракт I; 70 г). С другой стороны, мицелярный осадок экстрагировали метанолом (36 л) и смесь фильтровали, получая метанольный экстракт. Полученный таким образом метанольный экстракт концентрировали при пониженном давлении и концентрат (3 л) промывали н-гексаном (3 л). Нижний слой концентрировали досуха при пониженном давлении. Остаток растворяли в воде (2 л) и полученную таким образом суспензию экстрагировали этилацетатом (2 л). Этилацетатный слой затем концентрировали досуха при пониженном давлении (неочищенный экстракт II; 230 г). Неочищенные экстракты 1 и II объединяли и подвергали хроматографии на колонках на силикагеле (300 г, Wakogel C-200; фирма Wako Pure Chemical Industries, Ltd., Япония). Колонку элюировали смесью дихлорметана и метанола. Элюат, содержащий действующие вещества, концентрировали досуха при пониженном давлении. Остаток (77 г) затем подвергали хроматографии на колонках на Сефадексе LH-20 (44 л), используя в качестве элюента метанол. Элюат, содержащий действующие вещества, объединяли, получая 3 фракции (фракции 1, 2 и 3). Фракцию 1 (10,61 г), содержащую соединения А и В, подвергали хроматографии на колонке типа Lobar (типа LiChroprep Si60, размер C; фирма Merck, Германия), используя в качестве элюента дихлорметан и метанол. Фракции, содержащие соединение А, концентрировали досуха при пониженном давлении и далее после кристаллизации из метанола получали соединение А в виде кристаллов белого цвета (2,39 г). Фракции, содержащие соединение В, обрабатывали таким же путем, получая соединение В (0,72 г) в виде кристаллов белого цвета.
Пример 2
Aspergillus fumigatus NR 7334 (DSM 10682) и Aspergillus japonicus NR 7328 (DSM 10677) культивировали по методике, описанной в примере 1.
Выход после выделения соединений А и В приведен в таблице 2.
Пример 3
Ферментация в сосуде
Часть маточной культуры (0,1 мл) Aspergillus fumigatus NR 7330 (DSM 10679) инокулировали в колбу Эрленмейера объемом 500 мл, содержащую 100 мл среды, включающей 2% сахарозы, 1% картофельного крахмала, 1,5% глицерина, 1% сои Toast, 0,25% полипептона, 0,35% дрожжевого экстракта, 0,3% NaCl, 0,5% CaCO3, 0,005% ZnSO4•7H2O, 0,0005% CuSO4•5H2O, 0,0005% MnSO4•4H2O и 0,03% пеногасителя Nissan CA-123. 3начение pH среды не регулировали. Методика и условия посева и обработки культуры были теми же, что и для культуры в колбе, описанные в примере 1. После ферментации в течение примерно 96 ч весь бульон подвергали процессу выделения. Aspergillus fumigatus NR 7331 (DSM 10680) и Aspergillus fumigatus NR 7332 (DSM 10681) культивировали аналогично указанному выше способу.
Выход после выделения соединений A и В приведен в таблице 3.
Пример 4
Получение соединений A-1 и B-1
Раствор, содержащий 21 мг соединения A в 1,4 мл пиридина/уксусного ангидрида (1: 1, об./об.), перемешивали при комнатной температуре в течение 1 ч. Смесь сушили при пониженном давлении, получая 26 мг соединения A-1 в виде порошка белого цвета.
Раствор, содержащий 21 мг соединения В в 1,4 мл пиридина/уксусного ангидрида (1: 1, об./об.), перемешивали при комнатной температуре в течение 1 ч. Смесь сушили при пониженном давлении, получая 26 мг соединения В-1 в виде порошка белого цвета.
Пример 5
Получение соединений A-4 и B-4
К раствору, содержащему 4 мг соединения A в 3 мл метанола, добавляли избыточное количество диазометана в этиловом эфире при комнатной температуре. Выдерживали в течение 8 ч и раствор упаривали в вакууме. Остаток очищали препаративной ТСХ (Kieselgel 60 F254, Арт. 5715; фирма Merck, Германия), получая 4 мг соединения A-4 в виде порошка белого цвета.
Раствор, содержащий 6 мг соединения B в 3 мл метанола, обрабатывали аналогичным образом, получая 5 мг соединения В-4 в виде порошка белого цвета.
Пример 6
Получение соединения A-7
К раствору, содержащему 5 мг соединения A-4 в 0,2 мл диметилсульфоксида, добавляли 0,2 мл уксусного ангидрида при комнатной температуре. Смесь перемешивали в течение 17 ч, упаривали при пониженном давлении и остаток очищали с помощью препаративной ЖХВР, получая 0,5 мг соединения A-7 в виде порошка белого цвета.
Пример 7
Получение соединения A-8
К раствору, содержащему 50 мг соединения A в 10 мл этилового спирта, добавляли 15 мг палладия на древесном угле. Смесь перемешивали в атмосфере водорода при комнатной температуре в течение 15 ч. После удаления катализатора раствор упаривали при пониженном давлении. Остаток очищали с помощью ЖХВР (CAPCELL Pak C18 SG120A), используя в качестве элюента смесь фосфатного буфера и ацетонитрила, с получением 5 мг соединения A-8 в виде порошка белого цвета.
Пример 8
Получение соединения A-9
К раствору, содержащему 20 мг соединения A в 4 мл метанола, добавляли 2,6 мг борогидрида натрия при 0oC в атмосфере аргона. После перемешивания в течение 4 ч раствор упаривали при пониженном давлении и к остатку добавляли 4 мл этилацетата и 4 мл дистиллированной воды. Раствор встряхивали, органический слой упаривали при пониженном давлении и остаток очищали с помощью ЖХВР (CAPCELL Pak C18 SG120A), используя в качестве элюента смесь фосфатного буфера и ацетонитрила, с получением в результате 15 мг соединения A-8 и 2 мг соединения A-9 в виде порошка белого цвета.
Пример 9
Получение соединений A-5, A-6, B-5 и B-6
К раствору, содержащему 3 мг соединения A-4 в 0,2 мл пиридина, добавляли 4,5 мг хлорида (-)-α-метокси-α- трифторметилфенилацетила. Смесь перемешивали в течение 5 ч. После удаления пиридина при пониженном давлении остаток очищали с помощью препаративной ТСХ (Kieselgel 60 F254, Арт. 5715), получая 3 мг соединения A-5 в виде порошка белого цвета.
К раствору, содержащему 3 мг соединения A-4 в 0,2 мл пиридина, добавляли 4,5 мг хлорида (+)-α-метоксий-α- трифторметилфенилацетила. Смесь перемешивали в течение 5 ч. После удаления пиридина при пониженном давлении остаток очищали с помощью препаративной ТСХ (Kieselgel 60 F254, Арт. 5715), получая 3 мг соединения A-5 в виде порошка белого цвета.
К раствору, содержащему 2 мг соединения B-4 в 0,2 мл пиридина, добавляли 4,5 мг хлорида (-)- α -метокси- α - трифторметилфенилацетила. Смесь перемешивали в течение 5 ч. После удаления пиридина при пониженном давлении остаток очищали с помощью препаративной ТСХ (Kieselgel 60 F254, Арт. 5715), получая 2 мг соединения В-5 в виде порошка белого цвета.
К раствору, содержащему 2 мг соединения B-4 в 0,2 мл пиридина, добавляли 4,5 мг хлорида (+)- α -метокси- α -трифторметилфенилацетила. Смесь перемешивали в течение 5 ч. После удаления пиридина при пониженном давлении остаток очищали с помощью препаративной ТСХ (Kieselgel 60 F254, Арт. 5715), получая 2 мг соединения В-6 в виде порошка белого цвета.
Пример 10
Получение соединений A-3 и B-3
К раствору, содержащему 5 мг соединения A в 0,8 мл пиридина, добавляли 4 мг пара-бромбензоилхлорида. Смесь перемешивали в течение 1 ч. После удаления пиридина при пониженном давлении остаток очищали с помощью препаративной ТСХ (Kieselgel 60 F254, Арт. 5715), получая 2 мг соединения A-2 и 0,5 мг соединения A-3 в виде порошков белого цвета.
Раствор, содержащий 5 мг соединения B в 0,8 мл пиридина, обрабатывали аналогичным образом, получая 1 мг соединения B-2 и 2 мг соединения B-3 в виде порошков белого цвета.
Пример 11
Получение соединений A-2 и B-2
К раствору, содержащему 200 мг соединения A в 20 мл ацетонитрила, добавляли 164 мг пара-бромбензоилхлорида и 120 мг карбоната калия. Смесь перемешивали в течение 30 мин при комнатной температуре. Реакционную смесь разбавляли этилацетатом и примывали дистиллированной водой. Органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на силикагеле (Wakogel C-200), используя в качестве элюента смесь этилацетата и гексана, с получением 100 мг соединения A-2 в виде порошка белого цвета.
Раствор, содержащий 200 мг соединения B в 20 мл ацетонитрила, обрабатывали аналогичным образом, получая 200 мг соединения B-2 в виде порошка белого цвета.
Пример 12
Получение соединения A-10
К раствору, содержащему 72,9 мг соединения A в 0,25 мл безводного ДМФ, добавляли в атмосфере аргона 0,5 мл свежеприготовленного NH3 в растворе ДМФ. Через 30 мин летучие компоненты удаляли при пониженном давлении. К твердому остатку добавляли 22 мл толуола и 10 мг пара-толуолсульфоната пиридиния. Смесь кипятили с обратным холодильником в общей сложности в течение 125 мин, затем охлаждали и летучие компоненты удаляли при пониженном давлении. Продукт очищали с помощью хроматографии на силикагеле, элюируя гексаном-этилацетатом (1:1), и в результате получали 45,9 мг соединения А-10 в виде порошка белого цвета.
В следующем примере представлен состав противоопухолевого агента, содержащий соединение A по настоящему изобретению.
Пример
Таблетки, содержащие следующие ингредиенты, изготавливали общепринятым способом:
соединение A - 100 мг
крахмал - 26 мг
кальцийкарбоксилметилцеллюлоза - 15 мг
кристаллическая целлюлоза - 20 мг
стеарат магния - 4 мг
Всего - 165 мгр
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИАЗОЛО[4,3-А][1,4]-БЕНЗОДИАЗЕПИНЫ И ТИЕНО[3,2-F]-[1,2,4]-ТРИАЗОЛО[4,3-А] [1,4]ДИАЗЕПИНЫ, В СЛУЧАЕ НАЛИЧИЯ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО АСИММЕТРИЧЕСКОГО ЦЕНТРА ИХ ЭНАНТИОМЕРЫ, РАЦЕМАТЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ. | 1992 |
|
RU2094436C1 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2131425C1 |
| 3-ОКСО-3,9-ДИГИДРО-1Н-ХРОМЕНО[2,3-c]ПИРРОЛЫ В КАЧЕСТВЕ АКТИВАТОРОВ ГЛЮКОКИНАЗЫ | 2011 |
|
RU2603191C2 |
| РЕТИНОИДЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ | 1997 |
|
RU2173683C2 |
| ПИРАЗОЛПИРИМИДИНЫ | 2005 |
|
RU2412186C2 |
| ПРОИЗВОДНЫЕ D-ПРОЛИНА | 1998 |
|
RU2201937C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА | 2005 |
|
RU2382782C2 |
| АРИЛ-S(О)ЗАМЕЩЕННЫЕ КАРБОНОВЫЕ/ГИДРОКСАМОВЫЕ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2175316C2 |
| ПРОИЗВОДНЫЕ 4-ГИДРОКСИПИПЕРИДИНА | 1997 |
|
RU2178412C2 |
| АНАЛОГИ ВИТАМИНА D, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2173682C2 |


Изобретение относится к новым производным дибензооксазепина или дибензодиоксепина формулы I, где R1 и R2 независимо друг от друга обозначают водород, незамещенный (низш. )алкил или (низш. )алкил, замещенный (низш. )алкокси- или (низш.)алкилтиогруппой, или ацил, который может быть незамещенным или может быть замещен одним или несколькими заместителями, выбранными из группы, включающей (низш.)алкил, (низш.)алкил, замещенный галогеном или (низш. )алкокси, X обозначает СО или СНОН, Y обозначает СО или СН2 и Z обозначает О или NH, и их эпимерам и энантиомерам или физиологически приемлемым солям. Также изобретение относится к противоопухолевой фармацевтической композиции, включающей эффективное количество соединения формулы I. Продукты по изобретению могут применяться в качестве лекарственных средств против рака. 2 с. и 33 з.п. ф-лы, 3 табл.
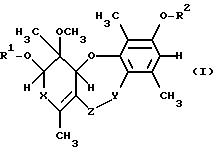

где R1 и R2 независимо друг от друга обозначают водород, незамещенный (низш. )алкил или (низш. )алкил, замещенный (низш. )алкокси- или (низш. )алкилтиогруппой, или ацил, который может быть незамещенным или может быть замещен одним или несколькими заместителями, выбранными из группы, включающей (низш.)алкил, (низш.)алкил, замещенный галогеном или (низш.)алкокси;
Х обозначает СО или СНОН;
Y обозначает СО или CH2;
Z обозначает О или NH,
и их эпимеры и энантиомеры или физиологически приемлемые соли.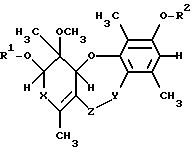
где R1 и R2 независимо друг от друга обозначают водород, незамещенный (низш. )алкил или (низш. )алкил, замещенный (низш. )алкокси- или (низш. )алкилтиогруппой, или ацил, который может быть незамещенным или может быть замещен одним или несколькими заместителями, выбранными из группы, включающей (низш.)алкил, (низш.)алкил, замещенный галогеном или (низш.)алкокси;
Х обозначает СО или СНОН;
Y обозначает СО или CH2;
Z обозначает О или NH,
и его эпимеры и энантиомеры или его физиологически приемлемые соли и фармацевтически приемлемый носитель.
| ПРОИЗВОДНЫЕ ДИБЕНЗ(B, F) (1,4)ОКСАЗЕПИН-11-ОНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ УМЕНЬШЕНИЯ МУЛЬТИЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ РАКОВЫХ КЛЕТОК К ЦИТОТОКСИЧЕСКОМУ ЛЕКАРСТВУ | 1992 |
|
RU2086545C1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| US 5350763 A, 27.09.1994. | |||
Авторы
Даты
2001-05-27—Публикация
1997-05-30—Подача