Настоящее изобретение относится к 14, 17-C2 - мостиковым стероидам общей формулы (I):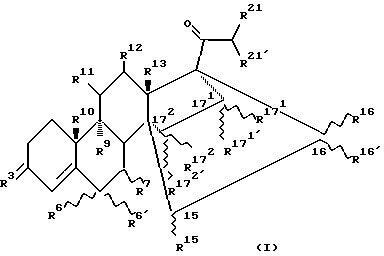
где
R3 означает атом кислорода, гидроксииминогруппу или два атома водорода;
R6 означает атом водорода, фтора, хлора или брома или находящийся в α - или β - положении (С1-С4)-алкильный остаток, причем тогда R6′ и R7 представляют собой атомы водорода или, однако,
R6 означает атом водорода, фтора, хлора или брома или (С1-С4)-алкильный остаток, причем тогда R6′ и R7 вместе образуют дополнительную связь;
R7 означает находящийся в α - или β -постоянном положении (С1-С4)-алкильный остаток, причем тогда R6 и R6′ представляют собой атомы водорода или, однако,
R6 и R7 вместе означают находящуюся в α - или β - постоянном положении метиленовую группу и R6 означает атом водорода или
R6 и R6′ вместе означают этиленовую или метиленовую группу и
R7 означает атом водорода;
R9 и R10, каждый, означают атом водорода или вместе образуют связь;
R11 и R12, каждый, означают атом водорода или вместе образуют связь;
R13 означает метильную или этильную группу;
R15 означает атом водорода или (С1-С3)-алкильный остаток;
R16 и R16′ независимо друг от друга означают атом водорода, (С1-С3)-алкильный остаток или (С2-С4)-алкенильный остаток или вместе означают (С1-С3)-алкилиденовую группу;
R15 и R16 - вместе образуют связь, а также
R16′ означает атом водорода или (С1-С3)-алкильный остаток
или
R15 и R16 вместе образуют цикл частичной формулы: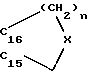
где n = 1 и 2, а X означает метиленовую группу или атом кислорода, а также
R16′ означает атом водорода; означает атом водорода или (С1-С3)-алкильный остаток;
означает атом водорода или (С1-С3)-алкильный остаток; означает атом водорода, (С1-С3)-алкильный остаток или (C2-C4)-алкенильный остаток;
означает атом водорода, (С1-С3)-алкильный остаток или (C2-C4)-алкенильный остаток;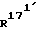 и
и 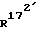 , каждый, означают атом водорода или вместе образуют связь;
, каждый, означают атом водорода или вместе образуют связь;
R16′ означает атом водорода или (С1-С3)-алкильный остаток;
R21′ означает атом водорода, (С1-С3)-алкильный остаток или гидроксильную группу;
за исключением соединения 14,17-этано-19-норпрегн-4-ен-3,20-дион.
Извилистые линии 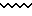 в общих формулах настоящего изобретения означают, что соответствующий заместитель может находиться в α - или β - положении к соответствующему атому углерода.
в общих формулах настоящего изобретения означают, что соответствующий заместитель может находиться в α - или β - положении к соответствующему атому углерода.
В случае указанных выше в качестве возможных заместителей (С1-С3)-алкильных групп речь может идти о метильной, этильной, н-пропильной или изопропильной группах, а в случае (С1-С4)-алкильных групп - дополнительно о н-бутильной, изобутильной или трет-бутильной группе. Во всех случаях предпочтительна метильная или этильная группа.
В случае (С2-С4)-алкенильного остатка в значениях R16, R16′ и/или 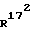 речь идет о винильном, аллильном или бут-3-енильном остатке, предпочтительным является винильный остаток.
речь идет о винильном, аллильном или бут-3-енильном остатке, предпочтительным является винильный остаток.
Согласно настоящему изобретению предпочтительны такие соединения общей формулы (I), в которых
R3 означает атом кислорода или два атома водорода, и/или
R6 означает атом водорода или находящийся в α - или β - положении (С1-С4)-алкильный остаток, когда R6′ и R7 представляют собой атомы водорода или, однако,
R6′ означает атом водорода, хлора или брома или (C1-C4)-алкильный остаток, когда R6′ и R7 вместе представляют собой дополнительную связь, и/или
R16 и R16′ , каждый, означают атом водорода, метильную группу или один из этих обоих заместителей означает (С1-С4)-алкильную или винильную группу, а другой из этих обоих заместителей представляет собой атом водорода; или оба вместе образуют (С1-С3)-алкилиденовую группу; и/или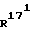 и
и 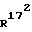 , независимо друг от друга, означают атом водорода или метильную группу, и/или
, независимо друг от друга, означают атом водорода или метильную группу, и/или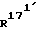 и
и 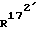 , каждый, означают атом водорода или вместе образуют связь; и/или
, каждый, означают атом водорода или вместе образуют связь; и/или
R21 означает атом водорода или (С1-С3)-алкильный остаток,
а также
R21′ означает атом водорода или гидроксильную группу;
причем другие заместители могут иметь все указанные в формуле (I) значения.
Согласно изобретению в особенности предпочтительными являются нижеуказанные соединения:
14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
14,17-этано-19-норпрегна-4,6,15-триен-3,20-дион;
14,17-этано-19-норпрегна -4,9,15-триен-3,20-дион;
21-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион;
14,17-этено-19-норпрегн-4-ен-3,20-дион;
14,17-этено-19-норпрегна-4,6-диен-3,20-дион;
14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
21-метил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
21-метил-14,17-этено-19-норпрегна-4,6-диен-3,20-дион;
21-метил-14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
21-метил-14,17-этено- 19-норпрегна-4,9,11-триен-3,20-дион;
21-гидрокси-14,17-этено-19-норпрегн-4-ен-3,20-дион;
21-гидрокси-14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
171-метил-14,17-этено-19- норпрегн-4-ен-3,20-дион;
171-метил-14,17-этено-19-норпрегна-4,6-диен-3,20-дион;
172-метил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
172-метил-14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
15β,16α -диметил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
6-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
6-хлор-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
α -метил-14,17-этано-19-норпрегн-4-ен-3, 20-дион;
6,21-диметил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
15β,16α -диметил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
6-хлор-21-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
16 α -метил-14,17-этано-19-норпрегн-4-ен-3, 20-дион;
16 α -метил-14,17-этано-19-норпрегна-4, 6-диен-3,20-дион;
16 α -метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
16 α,21 -диметил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-16α-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16 α -этил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16 α -этенил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16-метил-14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
(171R)-171-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
(171 S)-171-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
(171R)-171-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(171S)-171-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(172R)-172 -метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
(172R)-172-метил-14,17-этано-19-норпрегна-4,6-диен- 3,20-дион;
(172R)-172 -метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(172)-172,21-диметил-14,17-этано-19-норпрегна-4,6-диен- 3,20-дион;
(172R)-172,21-диметил-14,17-этано-19 -норпрегна-4,9-диен-3,20-дион;
(172R)-172,21-диметил-14,17-этано-19-норпрегна-4,9,11- триен-3,20-дион;
16-метилен-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16-метилен-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
16-метилен-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегн-4-ен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион;
(21R)-21-гидрокси-21- метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
(21R)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9-диен- 3,20-дион;
(21R)-21-гидрокси-21-метил-14,17-этано-19-норпрегна- 4,6-диен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-19- норпрегна-4,6-диен-3,20-дион;
(21R) -21-гидрокси-21-метил-14,17-этано-19-норпрегна- 4,9,15-триен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17- этано-19-норпрегна-4,9,15-триен-3,20-дион;
14,17-этано-18а-гомо- 19-норпрегн-4-ен-3,20-дион;
14,17-этано-18а-гомо-19-норпрегна-4,6- диен-3,20-дион;
14,17-этано-18а-гомо-19-норпрегна-4,9-диен-3, 20-дион;
14,17-этано-18а-гомо-19-норпрегна-4,15-диен-3, 20-дион;
21-метил-14,17-этано-18а-гомо-19-норпрегн-4-ен-3,20-дион;
21-метил-14,17-этано-18а-гомо-19-норпрегна-4,6-диен-3,20-дион;
21-метил-14,17-этано-18а-гомо-19-норпрегна-4,9-диен-3,20-дион;
(21R)-21-гидрокси-21-метил-14,17-этано-18а-гомо-19-норпрегн-4-ен- 3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-18а-гомо-19- норпрегн-4-ен-3,20-дион;
(21R)-21-гидрокси-21-метил-14,17-этано- 18а-гомо-19-норпрегна-4,9-ен-3,20-дион;
(21S)-21-гидрокси-21- метил-14,17-этано-18а-гомо-19-норпрегна-4,9-ен-3,20-дион;
(21R)-21-гидрокси-21-метил-14,17-этано-18а-гомо-19-норпрегна-4,6-ен- 3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-18а-гомо-19- норпрегна-4,6-ен-3,20-дион;
В тесте на связывания рецептора гестагена на гестагенное действие, при использовании цитозола из гомогената из матки кролика и 3H-прогестерона в качестве эталонного вещества, новые соединения проявляют очень сильное сродство к рецептору гестагена. В тесте на сохранение беременности у крысы предлагаемые согласно изобретению соединения общей формулы (I) проявляют очень высокую гестагенную активность.
Соединения общей формулы (I) также оказывают воздействия на другие стероидные рецепторы.
14,17-Этано-19-норпрегн-4-ен-3,20- дион, который представляет собой соединение, исключенное из объема охраны соединений общей формулы (I), уже описан A.J.Solo и J.N.Kapoor в J.Med.Chem., 16, 270 (1973). Это соединение в тесте на трансформацию эндометрия (тест Клауберга) проявляет хорошее гестагенное действие после подкожного введения, однако, только незначительное действие после введения перорально. Согласно указанному литературному источнику фактор между подкожным пероральным действием лежит выше 20.
Дополнительно к очень высокой гестагенной активности в тесте на сохранение беременности, которая большей частью даже превышает таковую исключенного из объема формулы (I) соединения, предлагаемые в изобретении соединения общей формулы (I), в противоположность уже известному соединению 14,17-этано-19-норпрегн-4-ен-3,20-диону, однако, большей частью также после введения перорально проявляют хорошее гестагенное действие. В случае предлагаемых согласно изобретению соединений подкожное действие отличается от перорального примерно в 3-5 раз. Предлагаемые согласно изобретению соединения, следовательно, отличаются от известного соединения 14, 17-этано-19-норпрегн-4-ен- 3,20-диона отчетливо улучшенным спектром действия.
На основании их высокой гестагенной активности новые соединения общей формулы (I) можно применять, например, индивидуально или в комбинации с эстрогенами в препаратах для контрацепции. Однако новые соединения также можно применять во всех других, известных на сегодняшний день для гестагенов случаях использования.
Пригодные дозировки можно определять обычным путем, например путем определения биоэквивалентности по отношению к известному гестагену для определенного вида применения, например количество, которое биоэквивалентно 30-150 мкг левоноргестрела для контрацепции.
Дозировки предлагаемых согласно изобретению соединений в контрацептивных препаратах должна составлять предпочтительно от 0,01 до 2 мг в день.
Гестагенные и эстрогенные компоненты биологически активных веществ в контрацептивных препаратах предпочтительно вводят вместе перорально. Суточная доза вводится предпочтительно однократно.
В качестве эстрогенов предпочтительно используют синтетические эстрогены, как этинилэстрадиол, 14α,17α -этано-1,3,5(10)-эстратриен-3,17 β -диол (международная заявка 88/01275) или 14α,17α -этано-1,3,5(10)-эстратриен-3, 16α,17β -триол (международная заявка 91/08219). Эстроген вводят в количестве, которое соответствует 0,01-0,05 мг этинилэстрадиола.
Новые соединения общей формулы (I) можно также использовать в препаратах для лечения гинекологических нарушений и для заместительной терапии. Из-за своего благоприятного профиля действия предлагаемые согласно изобретению соединения особенно хорошо пригодны для лечения предменструальных недомоганий, таких как головные боли, депрессивное настроение, задержка воды и мастодиния. Суточная доза при лечении предменструальных недомоганий составляет примерно 1-20 мг.
Наконец, новые соединения можно также использовать в качестве гестагенных компонентов в недавно разработанных композициях для контролирования женской фертильности, которые отличаются дополнительным использованием конкурентных антагонистов прогестерона (H.B.Croxatto и A.M.Salvatierra в Female Contraception and Male Fertility Regulation, изд. Runnebaum, Rabe и Kiesel, том 2, Advances in Gynecological and Obstetric Research Series, Parthenon Publishing Group -1991, с. 245).
Дозировка лежит в уже указанной области; лекарственную форму можно получать как и в случае обычных ОС-препаратов. При этом последовательно также можно вводить дополнительные, конкурентные антагонисты прогестерона.
Лекарственные формы на основе новых соединений получают само по себе известным образом тем, что активное вещество, при необходимости в сочетании с эстрогеном, перерабатывают и переводят в желательную готовую лекарственную форму с помощью обычных в галеновой промышленности носителей, разбавителей, возможно улучшающих вкус веществ и т.д.
Для предпочтительного перорального введения используют в особенности таблетки, драже, капсулы, пилюли, суспензии или растворы.
Для парентерального применения в особенности пригодны масляные растворы, как, например, растворы в кунжутном масле, касторовом масле и хлопковом масле. Для повышения растворимости можно добавлять агенты растворения, как, например, бензилбензоат или бензиловый спирт.
Соединения общей формулы (I) также можно вводить непрерывно благодаря внутриматочной системе высвобождения (IUD); скорость высвобождения активного соединения (активных соединений) при этом выбирают так, чтобы ежедневно высвобождаемая доза составляла величину в уже указанной области дозировок.
Предлагаемые согласно изобретению вещества также можно вводить в трансдермальную систему и таким образом вводить их чрескожно.
Прежде всего для получения соединений общей формулы (I) необходимые исходные соединения синтезируют согласно указанному в схеме 1 пути синтеза (см. в конце описания).
Согласно схеме 1, например, само по себе известное соединение общей формулы (I) (см., например, патент ФРГ 43 26 240 - А 1) путем присоединения аниона концевого алкина можно переводить в само по себе известное соединение общей формулы (2). Это соединение путем введения во взаимодействие с кислотой, как, например, серная кислота, соляная кислота, п-толуолсульфокислота, муравьиная кислота или уксусная кислота, в присутствии или в отсутствие инертных растворителей, как, например, толуол, тетрагидрофуран или дихлорметан, переводят в соединение общей формулы (3) (см., например, D.K.Phillips, P.P. Wickham, G. О. Potts и A.A.Arnold, J.Med.Chem., II, 924 (1968)). Если желательно, то соединение общей формулы (3) с помощью пригодных нуклеофилов, как, например, диалкилмедных соединений, с последующим окислением, например, модифицированным Saegusa-окислением (см. I.Minami и др., Tetrahedron, 42, 2971 (1986) или европейская заявка на патент 0299913), превращают в соединение общей формулы (4), причем В тогда означает алкильный остаток. В противном случае В означает водород.
Соединение общей формулы (4) затем с помощью этена под давлением и при повышенной температуре согласно само по себе известным способам циклоприсоединения можно переводить в соединение общей формулы (5). Это соединение затем стандартными способами путем гидрирования 171, 172 - двойной связи (атомом углерода 171, соответственно 172 обозначают атом углерода, у которого находится заместитель 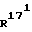 , соответственно
, соответственно 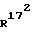 ) в присутствии катализатора на основе благородного металла, как, например, платина или палладий, переводят в соединение общей формулы (6). Соединения общих формул (5) и (6), в которых R21 означает атом водорода, можно алкилировать также согласно стандартным способам и таким образом переводить в соответствующие соединения общих формул (5) и (6), в которых R21 означает (С1-С3)-алкильную группу (см. , например, R.BIoch, Tetrahedron, 39, 639 (1983)). Соединения общей формулы (5) можно кетализировать стандартными методами до соединений общей формулы (7), которые в свою очередь путем гидри- рования можно превращать в соединения общей формулы (8). Эти соединения также можно получать путем кетализации соединения общей формулы (6). При этом вместо 1,2-этандиилбис(окси)-защитной группы у атома углерода 20 вообще согласно изобретению пригодны также другие известные кетозащитные группы, как, например, 2,2- диметил-1,3-пропандиилбис(окси)-группа. Другие защитные группы, которые можно использовать в рамках настоящего изобретения, описываются в книге "Защитные группы в органическом синтезе" Theodora W. Greene, Peter G.N.Wuts, изд. John Wiley and Sons, Inc., Нью-Йорк, 1991, с. 178-210.
) в присутствии катализатора на основе благородного металла, как, например, платина или палладий, переводят в соединение общей формулы (6). Соединения общих формул (5) и (6), в которых R21 означает атом водорода, можно алкилировать также согласно стандартным способам и таким образом переводить в соответствующие соединения общих формул (5) и (6), в которых R21 означает (С1-С3)-алкильную группу (см. , например, R.BIoch, Tetrahedron, 39, 639 (1983)). Соединения общей формулы (5) можно кетализировать стандартными методами до соединений общей формулы (7), которые в свою очередь путем гидри- рования можно превращать в соединения общей формулы (8). Эти соединения также можно получать путем кетализации соединения общей формулы (6). При этом вместо 1,2-этандиилбис(окси)-защитной группы у атома углерода 20 вообще согласно изобретению пригодны также другие известные кетозащитные группы, как, например, 2,2- диметил-1,3-пропандиилбис(окси)-группа. Другие защитные группы, которые можно использовать в рамках настоящего изобретения, описываются в книге "Защитные группы в органическом синтезе" Theodora W. Greene, Peter G.N.Wuts, изд. John Wiley and Sons, Inc., Нью-Йорк, 1991, с. 178-210.
Те соединения общих формул (5) и (6), в которых R13 означает этильную группу и R21 означает атом водорода или (С1-C3)-алкильную группу или R13 означает метильную группу и R21 означает (С1-С3)-алкильную группу, составляют предмет изобретения настоящей заявки в качестве промежуточных соединений общей формулы (II):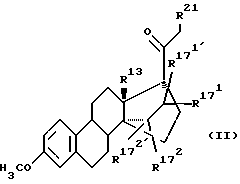
где
R13 означает - С2H5; R21 означает водород или (С1-С3)- алкил,
или
R13 означает - CH3; R21 означает (С1-С3)-алкил, и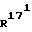 и
и 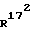 , независимо друг от друга, означают водород или (С1-С3)-алкил;
, независимо друг от друга, означают водород или (С1-С3)-алкил;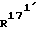 и
и 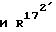 , каждый, означают водород или вместе образуют связь.
, каждый, означают водород или вместе образуют связь.
Все получаемые путем кетализации соединений общих формул (5), соответственно (6) соединения общих формул (7) и (8) являются новыми и также составляют предмет настоящего изобретения в качестве промежуточных соединений общей формулы (III):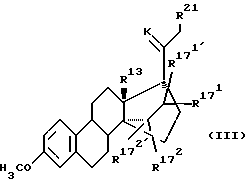
где
R13 означают -CH3; -C2H5;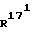 и
и 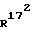 независимо друг от друга, означают водород или (С1-С3)-алкил;
независимо друг от друга, означают водород или (С1-С3)-алкил;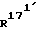 и
и 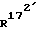 каждый, означают водород или вместе образуют связь;
каждый, означают водород или вместе образуют связь;
K означает кетальную защитную группу;
R21 означает водород, (С1-С3)-алкил.
Согласно схеме 2 (см. в конце описания) взаимодействие соединения общей формулы (4) с фенилвинилсульфоном в инертных растворителях, также по само по себе известным способам, приводит к соединению общей формулы (9) (J.R.Bull и R.I.Thomson, S.Afr.J. Chem., 41, 87 (1991)). Восстановление этого соединения в присутствии металла, как никель Ренея или магний, в низших спиртах, как метанол или этанол, в свою очередь приводит к соединениям общих формул (6) и (10), которые по способу окисления, соответственно, восстановления, например, с помощью пиридинийдихромата или в условиях окисления по Оппенауэру, соответственно с помощью боргидрида натрия или литийалюминийгидрида, можно переводить одно в другое.
Предлагаемые согласно изобретению соединения, которые замещены в положениях 15 и/или 16, получают путем взаимодействия соединения общей формулы (4) с пригодными олефинами, как, например, пропен, 2-метилпропен, 2-бутен, циклопентен, циклогексен или 2,5-дигидрофуран, и при необходимости гидрирования образовавшейся 171, 172-двойной связи. Дальнейшие превращения таким образом полученных соединений осуществляют аналогично дальнейшим реакциям соединений общей формулы (6).
Для получения предлагаемых согласно изобретению соединений, которые в положении 16 содержат алкильный или алкенильный остаток, соединение общей формулы (4) также можно вводить во взаимодействие с эфиром акриловой кислоты формулы H2С=CH-COOалкил (где алкил означает (С1-С4)-алкил) согласно схеме 3 (см. в конце описания).
Таким образом полученные соединения общей формулы (II) после кетализации кетогруппы в положении 20 и гидрирования образующейся 171, 172-двойной связи превращают в соединения общей формулы (12), которые путем взаимодействия с литий- алюминийгидридом можно превращать в 16-гидроксиметильные соединения общей формулы (13).
Соединения общей формулы (13) согласно стандартным способам (см., например, J. Hooz и S.S.Gilani, Can.J.Chem., 46, 86 (1968)) можно переводить в соответствующие 16-бромметильные соединения, которые в условиях восстановления по Бирху восстанавливают до соединений с метильной группой в положении 16. При этом также восстанавливается ароматическое A-кольцо с образованием 2,5 (10)-диеновой структуры.
Соединения общей формулы (13) путем окисления по само по себе известным способам, например, с помощью пиридинийдихромата, можно превращать в соответствующие 16-альдегиды, которые после взаимодействия с соответствующими фосфорилидами приводят к предлагаемым согласно изобретению соединениям с алкенильной группой в положении 16, которые в свою очередь можно путем гидрирования переводить в соединения с алкильной группой в положении 16.
16-Альдегиды путем нагревания с арилгидразинами по само по себе известным способам (см., например, M.Pieper и др., Liebigs Ann.Chem., 1334 (1986)) можно переводить в арилгидразоны, которые при обработке основаниями в смысле реакции Шапиро, соответственно реакции Бемфорда-Стивенса, расщепляют до 16-экзометиленовых соединений. Альтернативно 16- альдегиды путем взаимодействия с производными сульфокислот, как, например, галоидангидриды сульфокислот или ангидриды сульфокислот, в присутствии оснований, как, например, диизопропиламид лития или также гексаметилдисилазид калия, в инертных растворителях, как, например, тетрагидрофуран, можно переводить в эфиры анолсульфокислот, которые в свою очередь за счет восстановительного расщепления, например, путем обработки с помощью формиата аммония, в присутствии каталитических количеств катализатора на основе палладия-(II), как, например, ацетат палладия-(II), в пригодных растворителях, например, как ацетонитрил, превращают в 16-экзометиленовое соединение.
Соединение общих формул (11), (12) и (13) вместе с описанными в тексте производными все являются новыми и составляют предмет настоящего изобретения в качестве промежуточных соединений общей формулы (IV):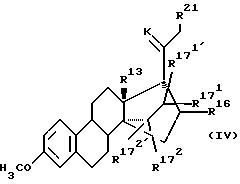
где
R13 означает -CH3, -С2H5;
R 16 означает -COOалкил, причем алкил представляет собой (С1-С4)-алкильный остаток, или -CH2ОН, или CHO, или метилен;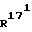 и
и 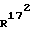 - независимо друг от друга, означают водород или (С1-С3)-алкил;
- независимо друг от друга, означают водород или (С1-С3)-алкил;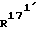 и
и 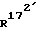 , каждый, означают водород или вместе образуют связь;
, каждый, означают водород или вместе образуют связь;
К означает атом кислорода или кетальную защитную группу;
R21 означает водород, (С1-С3)-алкил.
Соединения общей формулы (12) путем щелочного гидролиза можно переводить в соответствующие карбоновые кислоты, которые за счет декарбоксилирования и окисления, например, путем нагревания с тетраацетатом свинца и ацетатом меди-(II) в толуоле (см., например, J.D.Bacha и J.K.Kochi, Tetrahedron, 24, 2215 (1968)) приводят к производным с 15,16-двойной связью.
14,17-С2 - мостиковые производные с 15,16-двойной связью получают также другими путями.
1. Взаимодействие соединения общей формулы (4) с малеиновым ангидридом при образовании продукта Дильса-Альдера с последующим каталитическим гидрированием 171, 172-двойной связи, после нагревания с бистрифенилфосфиндикарбонилом никеля в пригодных растворителях, как диглим, дает соответствующее производное с 15,16-двойной связью (см., например, К. Wiesner и др., Can. J.Chem., 52, 640 (1974)). Альтернативно, исходя из 171, 172-насыщенного ангидрида с помощью оснований, как, например, водный раствор гидроксида натрия, можно получать 15,16-дикарбоновую кислоту, которую через двойное декарбоксилирование переводят в соответствующее производное с 15,16-двойной связью (см. , например, С.М. Gimarusti и J.Wolinsky,J.Am.Chem.Soc., 90, 113 (1968)). Например, дикарбоновую кислоту нагревают с тетрацетатом свинца в пригодных растворителях, например, как пиридин, при температурах от 30 до 100oC.
Аддукт Дильса-Альдера можно также использовать для синтеза других производных: восстановление продукта Дильса-Альдера до лактона с помощью пригодных восстановителей, как, например, боргидрид натрия (см., например, D.M. Bailey и R.F.Johnson,J.Org.Chem., 35, 3574 (1970)), окисление образовавшегося спирта в положении 20, например, с помощью пиридинийхлорхромата и защита кетона в качестве кеталя после восстановления лактона с помощью пригодных восстановителей, как, например, литийалюминийгидрид, приводит к 15,16-бисгидроксиметильному соединению. Гидроксильную функцию, например, в пригодных условиях можно конденсировать до простого циклического эфира. Эту конденсацию осуществляют предпочтительно в основных условиях, как, например, путем обработки с помощью производных сульфокислот, как галоидангидриды сульфокислот или ангидриды сульфокислот, в присутствии оснований, как, например, пиридин.
2. Взаимодействие соединений общей формулы (4) с виниленкарбонатом по поводу реакций Дильса-Альдера с виниленкарбонатом смотри, например, Y.Shizuri и др., J.Chem., Soc.,Chem. Commun., 292(1985); или G.H.Posnet и др.,Tetrahedron Lett. 32, 5295 (1991)) по реакции Дильса-Альдера согласно схеме 4 (см. в конце описания) приводит к продукту циклоприсоединения формулы (14). После гидрирования 171, 172-двойной связи с расщепления циклического карбоната по стандартным способам, как, например, взаимодействие карбоната в пригодном растворителе, как, например, метанол, с основанием, как, например, карбонат калия, получают диол формулы (17). Последовательность гидрирования и расщепления карбоната любая.
Для превращения вицинальных диолов в олефины специалисту известен целый ряд обычно используемых методов (см. например, M.Ando и др. Chemistry Letters, 879 (1986)). Например, диол общей формулы (17) можно вводить во взаимодействие со сложным ортоэфиром, как, например, триметилортоформиат, при кислотном катализе, например, с помощью пиридинийпаратолуолсульфоната, в пригодном растворителе, причем в качестве примера здесь следует назвать дихлорметан, или без растворителя, с получением соответствующего сложного ортоэфира, который при нагревании в пригодных растворителях, как, например, ацетангидрид, расщепляется до олефина общей формулы (18).
Соединения общих формул 14, 15, 16, 17 и 18 вместе с описанными в тексте производными все являются новыми и составляют предмет настоящего изобретения в качестве промежуточных соединений общей формулы (V):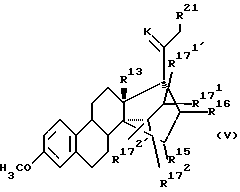
где
R13 означает -CH3 -C2H5;
R15 и R16 вместе образуют цикл частичных формул: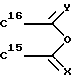
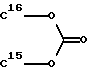
или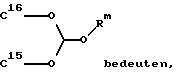
где
где X и V, независимо друг от друга, каждый, означают атом кислорода или два атома водорода; и
Rm означает (С1-С3)-алкил; или
R15 и R16 каждый, означают гидроксильную группу, или
R15 и R16 вместе означают связь, и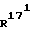 и
и 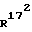 независимо друг от друга, означают водород или (С1-С3)-алкил;
независимо друг от друга, означают водород или (С1-С3)-алкил;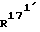 и
и 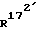 каждый, означают водород или вместе образуют связь;
каждый, означают водород или вместе образуют связь;
К означает атом кислорода или кетальную защитную группу;
R21 означает водород или (С1-С3)-алкил.
Других путей замещения в D- кольце 14, 17-С2-мостиковых стероидов можно достичь, например, исходя из продуктов Дильса- Альдера формулы (19), получаемых за счет взаимодействия диена общей формулы (4) с алкиловым эфиром ацетиленкарбоновой кислоты (алкил означает (С1-С4)-алкил) (схему 5 см. в конце описания).
Кетализация продукта циклоприсоединения формулы (19) приводит к соединению общей формулы (21). Селективное восстановление 15,16-двойной связи осуществляют с помощью магния в пригодном растворителе, предпочтительно в спирте, таком как, например, метанол, и получают соединение формулы (23), где R15 тогда означает атом водорода. Реакции 1,4-присоединения к соединениям формулы (21) осуществляют само по себе известными способами. Так, например, взаимодействие диметилмеди в пригодных растворителях, как, например, тетрагидрофуран, дает соединение общей формулы (23), где R15 тогда означает метильную группу. Путем каталитического гидрирования в присутствии катализаторов на основе благородных металлов, при необходимости на любой промежуточной стадии, удается удалять 171,127 - двойную связь. Сложноэфирную функцию у углерода в положении 16 можно модифицировать разными способами. Дополнительно к уже описанным для осуществления циклоприсоединения с помощью алкиловых эфиров акриловой кислоты возможностям здесь следует упомянуть следующие:
α,β - насыщенные сложные эфиры, как, например, соединения общих формул (23) и (24), после восстановления с помощью литийалюминийгидрида, переведения образовавшейся спиртовой группы в удаляемую группу, как, например, сложный эфир суль- фокислоты, который, например, получают путем взаимодействия с галоидангидридом сульфокислоты при использовании пригодных оснований, как, например, пиридин, с помощью или без инертного растворителя, как, например, дихлорметан, и последующего восстановления с помощью пригодных восстановителей, например, как триэтилборгидрид лития, дают производные с метильной группой в положении 16.
α,β - ненасыщенные сложные эфиры, как, например, соединения общих формул (21) и (22), при обработке с помощью пригодных восстановителей, как, например, диизобутилалюминийгидрид, при необходимости при помощи кислот Льюиса, например, как хлорид цинка, дают 15,16-ненасыщенные 16- гидроксиметильные производные. Переведение в соответствующие эфиры карбоновых кислот, соответственно эфиры сульфокислот, осуществляют само по себе известными методами. Например, аллиловый спирт с помощью ацетилхлорида в пиридине превращают в соответствующий эфир уксусной кислоты. В условиях реакции Бирха (Birch) затем получают соответствующее 15,16-ненасыщенное производное с метильной группой в положении 16 (по поводу восстановления по Бирху аллилацетатов см., например, R. T. Jacbos и др. J.Org.Chem., 55, 4051 (1990)). При этом также восстанавливается А-кольцо с образованием 2,5 (10)-диеновой структуры.
Соединения общих формул (19), (20), (21), (22), (23) и (24) вместе с описанными в тексте производными все являются новыми и составляют предмет настоящего изобретения в качестве промежуточных соединений общей формулы (VI):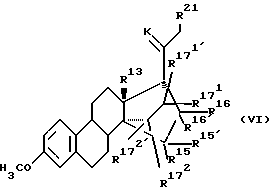
где
R13 означает -CH3, -С2H5;
R15 и R16, каждый, означают водород или вместе образуют связь;
R15 означает водород или (С1-С3)-алкил;
R16 означает -COOалкил, причем алкил представляет собой (С1-С4)-алкильный остаток, или CH2ОН, или CHO, или (С1-С3)-алкильный остаток;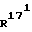 и
и 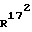 , независимо друг от друга, означают водород или (C1-С3)-алкил;
, независимо друг от друга, означают водород или (C1-С3)-алкил;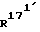 и
и 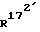 , каждый, означают водород или вместе образуют связь;
, каждый, означают водород или вместе образуют связь;
К означает атом кислорода или кетальную защитную группу;
R21 означает водород или (C1-C3)-алкил.
В вышеуказанных соединениях формул (III), (IV), (V) и (VI) стоит К, когда речь идет о кетальной защитной группе, и означает 1,2-этандиилбис(окси)- или 2,2-диметил-1,3-пропандиил-бис(окси) группу.
Восстановление таким образом полученных соединений общих формул (6), (7), (8) и (9), как также соответствующих производных, которые замещены в положениях 15, 16, 171 или 172, в само по себе известных условиях восстановления по Бирху (см., например, J.Fried, J.A.Edwards "Органические реакции в химии стероидов", Nostrand Reinhold Company, 1972, с. 1-60) приводит к соответствующим 3- мeтoкcи- Δ2,Δ5 (10)-производным. Путем введения во взаимодействие с разбавленными неорганическими кислотами и при необходимости последующего окисления 20-гидроксильной группы стандартными способами, как, например, с помощью пиридинийдихромата, вышеуказанные соединения можно превращать в Δ 4-3-кетоны общей формулы (I). 3-Метокси- Δ2,Δ5 (10)-производные, однако, также согласно стандартным способам (см., например, D.Burn и V. Petrow, J.Chem.Soc., 364(1962)) можно превращать в Δ5 (10)-3-кетоны, которые путем бромирования-дегидробромирования и возможно последующего окисления 20-гидроксильной группы можно переводить в предлагаемые согласно изобретению Δ4,Δ9-3-кетоны общей формулы (I) (см. , например, J.Fried, J.A.Edwards "Органические реакции в химии стероидов", Nostrand Reinhold Company, 1972, с. 265-374). Кетализация Δ4,Δ9 -3-кетонов стандартными способами приводит к Δ 5(10), Δ 9 (11)-3-кеталям, которые в мягких кислых условиях, например, с помощью водного раствора уксусной кислоты можно расщеплять до Δ 5(10), Δ 9(11)-3-кетонов. Деконъюгацию Δ4,Δ9 -3-кетонов можно при необходимости также осуществлять путем обработки с помощью кислот, например, как водная соляная кислота, при добавке агента растворения, как, например, ацетон. Взаимодействие полученных деконъюгированных диенонов с окислителями (см., например, патент ФРГ 2748250-С 2), как, например, 2,3- дихлор- 5,6-дициано-п-бензохинон, в пригодных растворителях, например в дихлорметане, после удаления возможно еще имеющихся защитных групп приводит к Δ4,Δ9,Δ11 -3-кетонам общей формулы (I).
Следующие стадии действуют по всем правилами введения остатков R6, R6′ и R7. 6,7-Двойную связь вводят через бромирование простого диенольного эфира и последующее отщепление бромоводорода (см. например, J.Fried, J.A.Edwards "Органические реакции в химии стероидов" Nostrand Reinhold Company, 1972, с. 265-374) или также путем взаимодействия с хлоранилом или 2,3- дихлор-5,6-дициано-п-бензохиноном.
Бромирование простого диенольного эфира можно осуществлять, например, согласно методике, описанной в Steroids, I, 233 (1965). Отщепление бромоводорода проводят путем нагревания 6-бромсоединения с основными средствами, как, например, бромид лития или карбонат лития, в апротонных растворителях, как дйметилформамид, при температурах 50-150oC или, однако, тем, что 6-бромсоединения нагревают в коллидине или лутидине.
Для соединений с 6,7-метиленовой функцией ее введение осуществляют также исходя из диенона за счет взаимодействия с диметилсульфоксонийметилидом, причем здесь, однако, образуется смесь α - и β -изомеров (соотношение зависит от используемых субстратов и составляет примерно 1:1), которые можно разделять, например, путем колоночной хроматографии.
Соединения, в которых R7 означает алкил, получают из 4,6-диен-3-онов путем 1,6-присоединения согласно известным способам (J.Fried, J.A.Edwards "Органические реакции в химии стероидов", Nostrand Reinhold Company, 1972, с. 75-82; А. Hosomi и H.Sakurai, J.Am.Chem. Soc., 99, 1673 (1977)). При этом, как правило, 7-алкильные функции вводят с помощью диалкил-медь-литиевых соединений.
Соединений, в которых R6 означает атом хлора, a R6′ и R7 образуют общую дополнительную связь, получают также исходя из 4,6-диен-3-онов. Для этой цели сначала эпоксидируют 6,7-двойную связь при применении органических надкислот, как, например, м-хлорнадбензойная кислота, в дихлорметане, при необходимости в присутствии раствора гидрокарбоната натрия (см. W.Adam, J.-C.Liu и O. Rodriguez, J. Org.Chem., 38, 2269 (1973)). Раскрытие этого эпоксида и удаление образующейся первичной 7α - гидроксильной группы осуществляют, например, путем введения во взаимодействие с газообразным хлороводородом в ледяной уксусной кислоте (см., между прочим, заявку на патент ФРГ 11 58 966 и заявку на патент ФРГ 40 06 165).
6-Метиленовую группу можно вводить, например, исходя из 3-амино-3,5-диенового производного путем введения его во взаимодействие с формалином в спиртовых растворах при образовании 6 α -гидроксиметильной группы и последующего отщепления воды в кислых условиях, например, с помощью раствора хлороводорода в смеси диоксана с водой. Отщепление воды, однако, также можно осуществлять таким образом, что сначала вводят удаляемую группу и затем элиминируют. В качестве удаляемых групп пригодны, например, мезилат, тозилат или бензоат (см. заявку на патент ФРГ 34 02 329, европейскую заявку на патент 150157, патент США 4 584 288 (86); K.Nickisch, S.Beier, D. Bittler, W.EIger, H.Laurent, W.Losent, Y.Nishino, E.Schillinger, R.Wiechert, J.Med.Chem., 34, 2464 (1991)).
Другая возможность получения соединений с метиленовой группой в положении 6 состоит в прямом взаимодействии 4(5)- ненасыщенных 3-кетонов с ацеталями формальдегида в присутствии ацетата натрия, например, с помощью оксихлорида фосфора или пентахлорида фосфора в пригодных растворителях, как, например, хлороформ (см. , например, K.Annen, H.Hofmeister, Н. Laurent и R. Wiechert, Synthesis, 34, (1982)). Дополнительная возможность для введения 6-метиленовой группы состоит в превращении Δ 4-3-кетона в простой диенольный эфир, введении его во взаимодействие с диметилформамидом и оксихлоридом фосфора с получением альдегида и восстановлении полученного альдегида с помощью комплексных боргидридов с последующим отщеплением воды с помощью неорганических кислот само по себе известными способами (см. международная заявка 90/12027).
Соединения с метиленовой группой в положении 6 можно использовать для получения соединений общей формулы (I), в которых R6 означает метил, a R6′ и R7 вместе образуют дополнительную связь.
Для этой цели используют, например, описанный D.Burn, D.N.Kirk и V.Petrov в Tetrahedron, 21, 1619 (1965) способ, согласно которому изомеризации двойной связи достигают путем нагревания соединений с метиленовой группой в положении 6 в этаноле в присутствии 5%-ного палладия-на-угле в качестве катализатора, который предварительно обработан либо с помощью водорода, либо путем нагревания в небольшом количестве циклогексена. Изомеризацию можно осуществлять также с помощью предварительно необработанного катализатора, если в реакционную смесь добавляют небольшое количество циклогексена. Образование незначительных количеств гидрированных продуктов можно предотвращать за счет добавления избытка ацетата натрия.
Получение 6-метил-4,6-диен-3-онов, однако, также можно осуществлять прямым способом (см., K.Annen, H.Hofmeister, H.Laurent и R.Wiechert, Liebigs Ann.Chem., 712 (1983)).
Соединения, в которых R6 означает α -метильную функцию, можно получать из 6-метиленовых соединений путем гидрирования в пригодных условиях. Наилучших результатов (селективное гидрирование экзо-метиленовой функции) достигают путем трансферт-гидрирования (Е.А. Brande, R.P.Linstead и P.W.D.Mitchell, J.Chem.Soc., 3578 (1954)). Если 6-метиленовое производное в пригодном растворителе, как, например, этанол, нагревают в присутствии донора водорода, как, например, циклогексен, и катализатора на основе благородного металла, например, как платина или палладий, то получают с очень хорошими выходами 6 α -метильные производные. Незначительные количества 6 β -метильных соединений можно изомеризовать с помощью кислоты (см., например, D.Burn, D. N.Kirk V.Petrow, Tetrahedron, 21, 1619 (1965)).
Алкилирование 17-ацетильных производных до гомологичных кетонов можно осуществлять не только, как уже описано, при использовании соединений с ароматическим A-кольцом, но и также при дальнейшем протекании синтеза при использовании пригодным образом защищенных производных.
21-ОН-Заместители вводят в пригодным образом защищенные 20-кетосоединения само по себе известными способами, такими как прямое окисление анолята (см. , например, E.Vedejs, D.A.Engler и J.T.Telschow, J.Org.Chem., 43, 188 (1978); и J. C. Anderson и S.C.Svith, Synlett, 107 (1990)) или превращение енолята в соответствующий иодид, замещение иодида ацетатом и гидролиз ацетата. Образующиеся при этом в случае необходимости смеси диастереомеров можно разделять путем хроматографии.
После введения всех остатков отщепляют еще имеющиеся защитные группы стандартными способами.
Полученные соединения общей формулы (I), где R3 означает кислород, в желательном случае, путем введения во взаимодействие с гидроксиламингидрохлоридом в присутствии третичных аминов при температурах от -20oC до +40oC, можно переводить в оксимы (общая формула (I), где R3 означает N-OH, причем гидроксильная группа может находиться в син- или антиположении).
Удаление 3-оксогруппы с получением целевого продукта общей формулы (I), где R3 означает два атома водорода, можно осуществлять, например, согласно методике, указанной в заявке на патент ФРГ 2805490, путем восстановительного расщепления тиокеталя.
Нижеследующие примеры служат для более близкого пояснения изобретения:
Пример 1: 14,17-Этено-19-норпрегн-4-ен-3,20-дион
а) 3-Метокси-19-норпрегна-1,3,5(10),14,16-пентаен-20-он
84,2 г 3-Метокси-19-нор-17 α -прегна-1,3,5(10), 15-тетраен-20-ин-17 β-ола (J. Med. Chem. , 11, 924 (1968)) в 875 мл 86%-ной муравьиной кислоты нагревают при перемешивании при температуре 110oC. Спустя 2 часа охлаждают путем добавления 1000 мл воды. Выпавшее в осадок твердое вещество отфильтровывают, высушивают и хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 47,8 г целевого соединения 1 а).
Температура плавления 152-155oC.
1H-ЯМР (дейтерированный хлороформ δ (м.д.) = 1,22 (с, 3H, H-18); 2,35 (с, 3H, H-21);3,78 (с, 3H, 3-ОСН3);6,08 (м,1H,Н-15); 6,68 (д, J =3 Гц, 1H, Н-4); 6,74 (дд, J=9,3 Гц, 1H, Н-2); 7,23 (д, J=9 Гц, 1H, H-1);7,27 (д, J-3 Гц, 1H, Н-16).
б) 3-Метокси-14,17-этено-19-норпрегна-1,3,5(10)-триен-20-он
Раствор 200 г описанного в примере 1а) вещества в 2,5 л бензола под давлением этилена 300 бар нагревают в течение 240 часов при температуре 160oC. После охлаждения реакционную смесь концентрируют и остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 175 г целевого соединения 1б).
1H-ЯМР (дейтерированный хлороформ) δ (м.д.)=0,91 (с, 3H, Н-18); 2,22 (с, 3H, H-21); 3,78 (с, 3H, 3-ОСН3); 6,07 и 6,14 (2д, J = 6 Гц, по 1H,Н-171 и Н-172);6,65 (д, J = 3 Гц, 1H, H-4); 6,73 (дд, J =9,3 Гц, 1H, H-2);7,22 (д, J = 9 Гц, 1H, H-1).
в) 20; 20[1,2-Этандиилбис (окси)]-3-метокси-14, 17-этено-19- норпрегна-1,3,5 (10)-триен
К раствору 25 г описанного в примере 16) соединения в 175 мл дихлорметана, при комнатной температуре и при перемешивании, добавляют 75 мл этиленгликоля, 63 мл триметилортоформиата и 1,25 г п-толуолсульфокислоты. Спустя 90 минут добавляют 15 мл триэтиламина и 100 мл дихлорметана и реакционную смесь трижды промывают концентрированным раствором гидрокарбоната натрия. Органическую фазу сушат над карбонатом калия, отфильтровывают и концентрируют. Получают 31 г целевого соединения 1в).
1H-ЯМР (дейтерированный хлороформ), δ (м.д.) = 0,98 (с, 3H, Н-18); 1,37 (с, 3H, Н-21); 3,78 (с, 3H, 3-ОСН3); 3,95-4,05 (м,4H, 20-ОСН2CH2О-); 5,97 и 6,01 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,65 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J = 9,3 Гц, 1H, Н-2); 7,22 (д, J-9 Гц,1H, Н-1).
г) 20,20-/1,2-Этандиилбис (окси)/-3-метокси-14,17-этено-19- норпрегна-2,5(10)-диен
К 2,2 л жидкого аммиака при температуре -70 oC добавляют раствор 31 г описанного в примере 1в) соединения в смеси из 400 мл тетрагидрофурана и 70 мл трет-бутанола. К этой смеси при перемешивании добавляют порциями 16 г лития. Оставляют нагреваться до -40oC, спустя 5,5 часов прикапывают 350 мл этанола, затем смесь оставляют нагреваться до комнатной температуры, разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Получают 23,1 г кристаллического соединения 1г), которое без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ) δ (м.д.) = 0,96 (с, 3H, Н-18); 1,33 (с, 3H, Н-21); 3,55 (с, 3H, 3-OCH3); 3,88-4,03 (м, 4H, 20-ОСН2CH2O-); 4,63-4,67 (м, 1H, Н-2); 5,93 и 6,07 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172).
д) 14,17-Этено-19-норпрегн-4-ен-3,20-дион
Раствор 2,7 г описанного в примере 1 г) соединения в 30 мл тетрагидрофурана и 150 мл ацетона при перемешивании смешивают с 7,8 мл 4 н соляной кислоты. Спустя два часа, растворитель удаляют и остаток перекристаллизуют из диизопропилового эфира. Получают 1,72 г соединения 1д). Температура плавления 139-143oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)=0,92 (с, 3H, Н-18); 2,18 (с, 3H, Н-21); 5,88 (уш.с, 1H, Н-4); 6,04 (с, 2H, H-171 и Н-172).
Пример 2: 14,17-Этено-19-норпрегна-4,6-диен-3,20-дион
а) 3-Этокси-14,17-этено-19-норпрегна-3,5-диен-20-он
К раствору 2,02 г описанного в примере 1д) соединения в 80 мл тетрагидрофурана при перемешивании добавляют 6,1 мл этанола, 6,1 мл триэтилфтоформиата и 145 мг п-толуолсульфокислоты. После выдерживания в течение двух часов при комнатной температуре добавляют 2,5 мл триэтиламина, разбавляют раствором гидрокарбоната натрия и смесь экстрагируют этилацетатом. Органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Получают 3,3 г соединения 2а) в виде бесцветного масла, которое без дальнейшей очистки вводят во взаимодействие в следующей стадии.
б) 14,17-Этено-19-норпрегна-4,6-диен-3,20-дион
Раствор 3,3 г описанного в примере 2а) соединения в 41 мл диоксана и 10 мл воды смешивают с 16 мл 10%-ного раствора ацетата натрия и затем при 0oC и при перемешивании с 890 мг 1,3-дибром-5,5-диметилгидантоина. Спустя 15 минут реакционную смесь выливают в воду со льдом и экстрагируют этилацетатом. Органическую фазу промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия и фильтрируют в суспензию из 2,4 г карбоната лития и 3,4 г бромида лития в 120 мл диметилформамида. Смесь нагревают при 150oC при отгонке этилацетата. Спустя один час охлаждают, разбавляют реакционную смесь водой и экстрагируют этилацетатом. Органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси из н-гексана и этилацетата. Получают 880 мг соединения 2б).
Т.пл. 150-152oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)=0,95 (с, 3H, H-18); 2,19 (с, 3H, Н-21); 5,82 (уш.с, 1H, Н-4); 5,92 и 6,04 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,20-6,32 (м, 2H, Н-6 и Н-7).
Пример 3: 7 β -Метил-14,17-этано-19-норпрегн-4-ен-3, 20-дион
Суспензию из 1,9 г иодида меди -(I) в 25 мл диэтилового эфира при 0oC по каплям смешивают с 8,5 мл 1,6 М раствора метиллия в диэтиловом эфире. После перемешивания в течение 30 минут при 0oC добавляют 40 мл тетрагидрофурана и затем при -40oC прикапывают 1,23 мл эфирата трифторида бора и после этого прикапывают раствор из 340 мг описанного в примере 2б) соединения в 15 мл тетрагидрофурана. Оставляют нагреваться в течение 4-х часов до комнатной температуры, перемешивают еще 72 часа и реакционную смесь выливают в 100 мл концентрированного раствора хлорида аммония. Смесь экстрагируют четырехкратно этилацетатом, объединенные органические фазы промывают водой, сушат над сульфатом натрия, отфильтровывают и концентрируют. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 46 мг соединения 3).
Т.пл. 133-135oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,94 (с, 3H, Н-18); 1,07 (д, J = 7,5 Гц, 3H, 7-СН3); 2,20 (с, 3H, Н- 21); 5,83 (уш.с, 1H, Н-4); 6,05 (с, 2H, Н-171 и Н-172).
Пример 4: 14, 17-Этено-19-норпрегна-4,9-диен-3,20-дион
а) 14, 17-Этено-19-норпрегн-5 (10)-ен-3,20-дион
К суспензии 3,0 г описанного в примере 1г) соединения в 60 мл ацетона при перемешивании и при комнатной температуре прикапывают раствор 2,1 г дигидрата щавелевой кислоты в 30 мл воды. Спустя 2 часа смешивают со 150 мл концентрированного раствора гидрокарбоната натрия и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 1,51 г целевого соединения 4а).
Т.пл.96-110oC; [α]
1 H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,03 (с, 3H, Н-18); 2,20 (с, 3H, Н-21); 2,72 и 2,82 (уш. 2д, J = 20 Гц, каждый 1H, Н-4); 6,04 и 6,10 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172).
б) 14,17-Этено-19-норпрегна-4,9-диен-3,20-дион
Раствор 500 мг описанного в примере 4а) соединения в 6,5 мл пиридина при перемешивании смешивают с 530 мг пиридинийбромид-пербромида, перемешивают в течение часа при комнатной температуре и затем еще 2 часа при 50oC. После охлаждения реакционную смесь перемешивают в 20 мл 6н соляной кислоты и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 0,31 г соединения 4б).
Т.пл. 152-158oC; [α]
1H-ЯМР (дейтерированный хлороформ); δ (м.д.) = 1,04 (с, 3H, Н-18); 2,20 (с, 3H, Н-21); 5,72 (уш.с, 3H, Н-4); 6,03 (с, 2H, Н-171 и Н-172).
Пример 5: 21-Гидрокси-14,17-этено-19-норпрегн-4-ен-3,20- дион
а) 3,3; 20,20-Бис[2,2-диметил-1,3-пропандиилбис (окси)]- 14,17-этено-19-норпрегн-5(10)-ен
К раствору 3,2 г описанного в примере 1д) соединения в 30 мл толуола при перемешивании добавляют 2,08 г 2,2-диметилпропан-1,3-диола, 2,7 мл триметилортоформиата и 190 мг п-толуолсульфокислоты. Спустя 2 часа смешивают с 5 мл триэтиламина, разбавляют этилацетатом, промывают пятикратно водой и однократно концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 3,85 г соединения 5а) в виде пены.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,72;0,88; 0,94;1,07 и 1,19(5с, 15H, кеталь-CH3 и Н-18);1,43(с, 3H, H-21); 3,17-3,78 (м, 8H, кеталь-OCH2);5,88 и 5,95 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172).
б) 3,3-[2,2-Диметил-1,3-пропандиилбис(окси)]-14,17-этено-19- норпрегн-5(10)-ен-20-он
Раствор из 3,85 г описанного в примере 5а) соединения в 50 мл дихлорметана смешивают с 11 г силикагеля (0,063-0,2 мм) и 1,1 мл водного концентрированного раствора щавелевой кислоты и интенсивно перемешивают в течение 30 минут. Добавляют 100 мл 1н раствора гидроксида натрия и 100 мл дихлорметана, перемешивают в течение пяти минут, оставляют отстаиваться, отфильтровывают, остаток промывают дихлорметаном, промывают объединенные органические фазы концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 1,93 г соединения 5б) в виде пены
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,85 и 0,88 (-с, 6H, кеталь-CH3); 1,08 (с, 3H, H-18);2,18 (с, 3H, H-21);3,42- 3,70 (м, 4H, кеталь-OCH2); 5,98 и 6,07(2д, J = 6 Гц, каждый, 1H, Н-171 и Н-172).
в) 3,3-/2,2-Диметил-1,3-пропандиилбис (окси)/-21-иод-14,17- этено-19-норпрегн-5(10)-ен-20-он
К раствору 1,9 мл N-циклогексилизопропиламина в 10 мл тетрагидрофурана при температуре -40oC прикапывают 3,9 мл 1,6 М раствора н-бутиллития в гексане. После перемешивания в течение 15 минут прикапывают раствор 1,93 г описанного в примере 5б) вещества в 15 мл тетрагидрофурана. После перемешивания в течение 30 минут при -30oC раствор охлаждают до -50oC и затем через тефлоновую трубку нагнетают охлажденный до -50oC раствор из 1,37 г иода в 10 мл тетрагидрофурана. Реакционную смесь в течение двух часов нагревают до комнатной температуры, после чего выливают в концентрированный раствор хлорида аммония и экстрагируют этилацетатом. Органическую фазу промывают концентрированным раствором тиосульфата натрия и концентрированным раствором гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют. Получают 2,6 г соединения 5в) в виде светло-желтой смолы, которую без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,88 (с,6H,кеталь - CH3); 1,08 (с, 3H, H-18); 3,42-3,70(м, 4H, кеталь-OCH2); 3,90 и 3,99 (2д, J = 12 Гц, каждый, 1H, H-21); 6,07-6,18 (м, 2H, H-171 и H-172).
г) 21-(Ацетилокси)-3,3-[2,2-диметил-1,3-пропандиилбис (окси)]-14,17-этено-19-норпрегн-5(10)-ен-20-он
Раствор 2,6 г описанного в примере 5в) вещества в 10 мл диметилформамида смешивают с 4,9 г ацетата калия, перемешивают в течение 80 минут при температуре 80oC, после охлаждения выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Получают 1,99 г соединения 5г) в виде бесцветной смолы, которую без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,88 (с,6H, кеталь-CH3); 1,08 (с, 3H, H-18); 2,17 (с, 3H, ацетилокси-CH3); 3,42- 3,72 (м, 4H, кеталь-OCH2); 4,67 и 4,85 (2д, J = 15 Гц, каждый, 1H, H-21);5,99 и 6,12 (2д, J = 6 Гц,каждый 1H, H-171 и H-172).
д) 21-(Ацетилокси)-14,17-этено-19-норпрегн-5(10)-ен-3,20-дион
Раствор 1,99 г описанного в примере 5г) вещества в 10 мл тетрагидрофурана смешивают со 100 мл 70%-ной уксусной кислоты и перемешивают в течение 60 минут при комнатной температуре и затем в течение 60 минут при температуре 40oC. Реакционную смесь выливают в воду, нейтрализуют раствором гидроксида натрия и трижды экстрагируют этилацетатом. Объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 1,15 г соединения 5д).
Т.пл. 126-128oC [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,90 (с, 3H, Н-18); 2,18 (с, 3H, ацетилокси-CH3); 4,67 и 4,84 (2д, J = 16 Гц, каждый 1H, H-21); 6,02 и 6,14(2д, J = 6 Гц, каждый, 1H, H-171 и Н-172).
е) 21-(Ацетилокси) -14,17-этено-19-норпрегн-4-ен-3,20-дион
Раствор 500 мг описанного в примере 5д) вещества в 25 мл ацетона смешивают с 1 мл 4н соляной кислоты, перемешивают в течение 30 минут при комнатной температуре и затем концентрируют досуха. Получают 500 мг соединения 5е) в виде пены, которую без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ): δ (м. д. ) = 0,93 (с, 3H, Н-18); 2,18(с, 3H, ацетолокси-CH3); 4,68 и 4,83 (2д, J = 16 Гц, каждый 1H, Н-21); 5,86 (уш.с, 1H, Н-4); 6,02 и 6,10 (2д, J = 6 Гц, каждый, 1H, Н-171 и Н-172).
ж) 21-Гидрокси-14,17-этено-19-норпрегн-4-ен-3,20-дион
Раствор 500 мг описанного в примере 5е) вещества в 15 мл метанола смешивают с 1,8 мл 10%-ного водного раствора карбоната калия, перемешивают в течение 30 минут при комнатной температуре и затем выливают в воду. Подкисляют с помощью 1н соляной кислоты до pH 5, экстрагируют трижды этилацетатом, объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 282 мг соединения 5ж).
Т.пл.160-163oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,95 (с, 3H, H-18); 3,32( T, J = 5 Гц, 1H, ОН); 4,23 и 4,42 (2дд, J = 16 Гц и 5 Гц, каждый, 1H, Н-21); 5,87(уш.с, 1H, Н-4); 5,87 и 6,10 (2д, J = 6 Гц, каждый, 1H, Н-171 и Н-172).
Пример 6: 21-Гидрокси-14,17-этено-19-норпрегна-4,9-диен- 3,20-дион
а) 21-(Ацетилокси)-14,17-этено-19-норпрегна-4,9-диен-3,20-дион
540 мг Описанного в примере 5д) вещества вводят во взаимодействие согласно описанной в примере 4б) методике. Получают 292 мг соединения 6а).
Т.пл. 182-184oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,04 (с, 3H, Н-18); 2,19 (с, 3H, ацетилокси-CH3); 4,69 и 4,83 (2д, J = 16 Гц, каждый, 1H, Н-21); 5,72(уш.с, 1H, Н-4); 6,02 и 6,10 (2д, J = 6 Гц,каждый, 1H, Н-171 и Н-172).
б) 21-Гидрокси-14,17-этено-19- норпрегна-4,9-диен-3,20-дион
270 мг Описанного в примере ба) вещества вводят во взаимодействие согласно описанной в примере 5ж) методике. Получают 159 мг соединения 6б).
Т.пл. 143-146oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,04 (с, 3H, Н-18);3,33 (уш.с, 1H, ОН); 4,24 и 4,43 (уш. 2д, J = 16 Гц, каждый, 1H, Н-21); 5,72 (уш. с, 1H, Н-4); 5,95 и 6,10 (2д, J = 6 Гц, каждый, 1H, Н-171 и Н-172).
Пример 7: 21-Метил-14,17-этено-19-норпрегн-4-ен-3,20- дион
а) 3-Метокси-21-метил-14, 17-этено-19-норпрегна-1,3,5 (10) - триен-20-он
К раствору из 1,5 мл диизопропиламина в 15 мл тетрагидрофурана при температуре -20oC прикапывают 6,6 мл 1,6 М раствора н-бутиллития в гексане, затем перемешивают еще 30 минут при 0oC, после чего прикапывают при температуре -30oC раствор из 2,4 г описанного в примере 1б) вещества и 0,78 мл 1,3- диметилимидазолин-2-она в 46 мл тетрагидрофурана и перемешивают еще 30 минут при -30oC. Затем прикапывают 0,66 мл метилиодида и нагревают до 0oC. Реакционную смесь вносят при перемешивании в концентрированный раствор хлорида аммония, разбавляют водой, экстрагируют трижды этилацетатом, объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток кристаллизуют из диизопропилового эфира. Получают 2,12 г соединения 7а).
Т.пл.94oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д. ) = 0,89 (с, 3H, H-18); 1,08(T, J = 7,5 Гц, 3H, Н-22); 3,79 (с, 3H, 3-ОСН3); 6,05 и 6,12 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,64 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J = 9,3 Гц, 1H, H-2); 7,22 (д, J = 9 Гц, 1H, Н-1).
б) 21-Метил-14,17-этено-19-норпрегн-4-ен-20-ол-3-он
1,9 г Описанного в примере 7а) вещества вводят во взаимодействие согласно описанной в примере 1г) методике. Сырой продукт хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 750 мг промежуточного продукта, который превращают согласно описанной в примере 1д) методике. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 317 мг соединения 7б).
1H-ЯМР(дейтерированный хлороформ): δ (м.д.)=0,89 (0,92) (с, 3H, H-18); 1,05(1,03), (т, J = 7,5 Гц, 3H, Н-22); 3,70(дд, J = 8 и 3 Гц ,1H, Н-20); 5,83(5,85)(уш. с, 1H, H-4);5,89 и 5,94 (5,96 и 6,02)(2a,J = 6 Гц, каждый 1H, H-171 и Н-172) (сигналы второго диастереомера указаны в скобках).
в) 21-Метил-14, 17-этено-19- норпрегн-4-ен-3, 20-дион
К суспензии 1,67 r пиридинийдихромата в 15 мл диметилформамида при перемешивании добавляют раствор 300 мг описанного в примере 76) соединения в 40 мл дихлорметана. Смесь перемешивают в течение часа при комнатной температуре, затем смешивают с 50 мл этилацетата, перемешивают следующий час и после этого отфильтровывают. Фильтрат промывают пятикратно водой и после этого концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток очищают с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Получают 100 мг соединения 7в).
Т.пл.140-149oC;[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)=0,90 (с, 3H, Н-18); 1,06 (T, J = 7,5 Гц, 3H, H-22); 5,86(уш.с, 1Н, Н-4);6,02(с,2H,Н-171 и Н-172).
Пример 8: 21-Метил-14,17-этено-19-норпрегна-4,9-диен-3,20- дион
а) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-31-метил-14,17- етено-19-норпрегна-1,3,5(10)-триен
К раствору 21,3 г описанного в примере 7а) соединения в 250 мл толуола при комнатной температуре и при перемешивании добавляют 62 мл этиленгликоля, 52 мл триметилортоформиата и 1,0 г п-толуолсульфокислоты. Нагревают в течение 8 часов
при температуре 60oC. После охлаждения добавляют 15 мл триэтиламина и 250 мл этилацетата и смесь промывают трижды концентрированным раствором гидрокарбоната натрия. Органическую фазу сушат над карбонатом калия, отфильтровывают и концентрируют. Получают 27 г соединения 8а), которое без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,94 (т, J = 7,5 Гц, 3H, Н-22); 0,96(с, 3H, Н-18); 3,78(с, 3H, 3-ОСН3);3,95- 4,18(м,4H,20-ОСН2CH2О-); 5,98(с, 2H, Н-171 и Н-172); 6,64(д, J = 3 Гц, 1H, Н-4); 6,72(дд, J = 9,3 Гц, 1H, Н-2); 7,21(д, J = 9 Гц, 1H, Н-1).
б) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-21-метил-14, 17-этено-19-норпрегна-2,5(10)-диен
27 г Описанного в примере 8а) вещества вводят во взаимодействие согласно описанной в примере 1г) методике. Получают 18,9 г соединения 8б).
1H-ЯМР (дейтерированный хлороформ): δ (м.д. = 0,93 (т, J = 7,5 Гц, 3H, Н-22); 0,95 (с, 3H, Н-18); 3,56 (с, 3H, 3-OCH3); 3,93-4,10 (м, 4Н, 20-ОСН2CH2-О-); 4,62-4,67 (м, 1H, Н-2); 5,92 (с, 2H, Н-171 и Н-172).
в) 20,20-[1,2-Этандиилбис(окси)] -21-метил-14,17- этено-19-норпрегн-5(10)-ен-3-он
Раствор из 18,2 г описанного в примере 8б) вещества в 700 мл тетрагидрофурана при перемешивании смешивают с 250 мл концентрированного раствора хлорида аммония и 18 мл концентрированного раствора щавелевой кислоты и перемешивают в течение 6 часов. Затем разбавляют водой и экстрагируют трижды этилацетатом. Объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 11,0 г соединения 8в) в виде пены.
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,92 (т, J = 7,5 Гц, 3H, H-22); 0,97(с, 3H, H-18); 2,71 и 2,82(2д,уш. J = 20 Гц, каждый, 1H,Н-4) 3,95-4,12 (м,4H,20-ОСН2CH2О-); 5,87-5,98 (м,2H, Н-171 и Н-172).
г) 21-Метил-14,17-этено-19-норпрегна-4,9-диен-3,20-дион
11 г Описанного в примере 8в) вещества превращают согласно описанной в примере 4б) методике. Получают 3,75 г соединения 8г)
Т.пл. 145-146oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,03(с,3H,Н-18); 1,08 (т, J= 7,5 Гц,3H,Н-22);5,72(уш.с,3H,Н-4);6,03(с, Н-171 и Н-172).
Пример 9: 21-Метил-14,17-этено-19-норпрегна-4,9,11-триен- 3,20-дион
а) 3,3-/2,2-Диметил-1,3-пропандиилбис(окси)/-21- метил-14,17-этено-19-норпрегна-5(10),9(11)-диен-20-он
К раствору 3,5 г описанного в примере 8г) соединения в 30 мл дихлорметана при перемешивании добавляют 2,87 г 2,2- диметилпропан-1,3-диола, 1,4 мл триметилортоформиата и 100 мг п-толуолсульфокислоты. Спустя 3 часа разбавляют дихлорметаном, промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 3,84 г соединения 9а) в виде пены.
1H-ЯМР (дейтерированный хлороформ); δ (м.д.) = 0,82 (2с, 6H, кеталь-CH3); 1,09 (с, 3H, Н-18);1,09 (т, J = 7,5 Гц, 3H, Н-22); 3,42-3,52 (м, 2H, кеталь-OCH2); 3,57-3,68 (м, 2H, кеталь-OCH2); 5,45-5,53 (м, 1H, Н-11); 6,03 и 6,12 (2д, J = 6 Гц, каждый, 1H, Н-171 и Н-172).
б) 21-Метил-14,17-этено-19-норпрегна-5(10), 9(11)-диен-3,20-дион
500 мг Описанного в примере 9а) соединения с помощью ультразвука растворяют в 25 мл 70%-ной уксусной кислоты и 5 мл тетрагидрофурана и затем перемешивают 4 часа при комнатной температуре. После этого при перемешивании нейтрализуют концентрированным раствором гидрокарбоната натрия, экстрагирует трижды этилацетатом, объединенные органические фазы промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 480 мг соединения 9б), которое без дальнейшей очистки вводят во взаимодействие в следующей стадии.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,87 (с, 3H, Н-18); 1,08 (т,J = 7,5 Гц, 3H, Н-22); 2,91(уш.с, 2H, Н-4); 5,53-5,60 (м, 1H, Н-11); 6,07 и 6,13 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172).
в) 21-Метил-14,17-этено-19-норпрегна-4,9,11-триен-3,20-дион
480 мг Описанного в примере 9б) соединения растворяют в 40 мл дихлорметана и смешивают с 600 мг 2,3-дихлор-5,6-дициан-п-бензохинона. Перемешивают 4 часа при комнатной температуре, отфильтровывают, фильтрат промывают концентрированным раствором гидрокарбоната натрия, концентрированным раствором тиосульфата натрия и снова концентрированным раствором гидрокарбоната натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с циклогексаном. Получают 206 мг соединения 9в).
Т.пл. 117-119oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,97 (с, 3H, Н-18); 1,11 (т, J = 7,5 Гц, 3H, Н-22); 5,80 (уш.с, 3H, Н-4); 5,99 и 6,08 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,04 (д, J = 12 Гц, 1H, Н-11) 6,44 (д, J = 12 Гц, 1H, Н-12).
Пример 10: 171-Метил-14,17-этено-19-норпрегн-4-ен-3,20- дион
а) 3-Метокси-16-метил-19-норпрегна-1,3,5(10),14,16-пентаен-20-он
Суспензию из 15,2 г иодида меди-(1) в 50 мл диэтилового эфира при 0oC по каплям смешивают с 90 мл 1,6 М раствора метил- лития в диэтиловом эфире. После перемешивания в течение 30 минут при -70oC прикапывают 12 мл триэтиламина и затем 11 мл триметилхлорсилана. Затем прикапывают раствор из 15 г описанного в примере 1а) соединения в 220 мл тетрагидрофурана. Перемешивают еще 2 часа при -70oC, затем добавляют 100 мл концентрированного раствора хлорида аммония, оставляют нагреваться до комнатной температуры, встряхивают с 400 мл этилацетата, отфильтровывают твердые составные части и водную фазу экстрагируют снова этилацетатом. Объединенные органические фазы промывают четырехкратно полуконцентрированным раствором хлорида аммония, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток растворяют в 500 мл ацетонитрила при обработке ультразвуком. К раствору добавляют 10,9 г ацетата палладия-(II) и нагревают в течение 20 часов при 80oC. После охлаждения добавляют 400 мл этилацетата, отфильтровывают под вакуумом через целит и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с н-гексаном. Получают 5,03 г соединения 10а).
Т.пл. 166-167oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,22 (с, 3H, Н-18); 2,37 и 2,40 (2с, 6H, 16-СН3 и Н-21); 3,80 (с, 3H, 3-ОСН3); 5,92 (д, J = 2 Гц, 1H, Н-15); 6,68 (д, J = 3 Гц, 1H, Н-4); 6,75 (дд, J= 9,3 Гц, 1H, Н-2); 7,25(д, J=9 Гц, 1H, H-1).
б) 3-Метокси-171-метил-14,17-этено-19-норпрегна- 1,3,5(10)-триен-20-он
5,0 г Описанного в примере 10а) соединения превращают согласно описанной в примере 1б) методике. Получают 3,38 г соединения 10б) в виде пены.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,85 (с, 3H, Н-18); 1,74 (уш. с, 171-CH3); 2,20 (с, 3H, Н-21); 3,79 (с, 3H, 3-OCH3); 5,67 (уш.с., Н-172); 6,66 (д, J = 3 Гц, 1H, Н-4); 6,73 (дд, J = 9,3 Гц, 1H, Н-2); 7,22 (д, J-9 Гц, 1H, Н-1).
в) 171-Метил-14,17-этено-19-норпрегн-4-ен-3,20-дион
500 мг Описанного в примере 10б) соединения превращают согласно описанным в примерах 1в), 1г) и 1д) методикам. Получают 344 мг соединения 10в).
Т.пл. 137oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,86 (с, 3H, Н-18); 1,70 (уш.с, 171-CH3); 2,16 (с, 3H, Н-21); 5,58 (уш.с, 1H, Н-172); 5,84 (уш.с, 1H, Н-4).
Пример 11: 171-Метил-14,17-этено-19-норпрегна-4,6-диен- 3,20-дион
250 мг Описанного в примере 10в) соединения превращают согласно описанным в примерах 2а) и 2б) методикам. Получают 102 мг соединения 11). Т.пл. 132-136oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,89 (с, 3H, Н-18); 1,69 (уш.с, 171-CH3); 2,17 (с, 3H, Н-21); 5,47 (уш.с, 1H, Н-172); 5,80 (уш.с, 1H, Н-4); 6,17-6,30 (м, 2H, H-6 и H- 7)
Пример 12: (171R)-171-Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
а) 3-Меокси-171-метил-14,17-этано-19-норпрегна-1,3,5(10)-триен-20-он
2,75 Описанного в примере 10б соединения при встряхивании растворяют в 125 мл тетрагидрофурана. Добавляют 765 мг 10%-ного палладия-на-угле, в аппаратуру вводят водород и встряхивают вплоть до прекращения поглощения водорода. После фильтрации раствора через целит фильтрат концентрируют в вакууме. Получают 2,9 г соединения 12 а) в виде пены.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,88 (0,92),(C, 3H, H-18) 0,99 (1,10) (д, J=7,5 Гц, 3H, 171 -CH3); 2,08 (2,11) (c, 3H, H-21), 3,78 (c, 3H, 3-OCH3), 6,62 (д, J=3 Гц, 1H, H-4); 6,73 9дд, J=9,3 Гц, 1H, H-2); 7,22 (д, J=9 Гц, 1H, H-1) (сигналы второго диастереомера указаны в скобках).
б) (71R)-171-Метил-14,17-этано-19-норпрегн-5-(10)-ен-3,20-дион
2,9 г описанного в примере 12а) соединения превращают согласно описанным в примерах 1в), 1г) и 8в) методикам. Получают 209 мг соединения 12б), 310 мг обоих С-171-эпимеров 20,20-/1,2-этандиилбис(окси)/-171-метил-14,17-этано-19-норпрегн- 4-ен-3-она в смеси с (171S)-171-метил-14,17-этано-19-норпрегн-5(10)-ен-3,20- дионом, а также 1,36 г обоих C-171-эпимеров 20,20-/1,2-этандиилбис(окси)/-171-метил-14,17-этано-19-норпрегн-5(10) -ен-3-она
1H-ЯМР(дейтированный хлороформ): δ (м.д.) = 0,90 (c, 3H, H-18); 1,07 (д, J = 7,5 Гц, 3H, 171-CH3); 2,06 (c, 3H, H-21).
в) (171R)-171 -метил-14,17-этано-19-норпрегн-4-ен-3,20-дион 190 мг соединения 12б) превращают согласно описанной в примере 1д) методике. Получают 105 мг соединения 12в).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,95 (с,3H,Н-18); 1,05 (д, J = 7,5 Гц, 3H, 171-CH3); 2,07 (с, 3H, Н-21); 5,81 (уш.с, 1H, Н-4).
Пример 13: (171S)-171 -Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
300 мг Описанной в примере 12б) смеси обоих С-171-эпимеров 20,20-/1, 2-этандиилбис(окси)/-171-метил-14,17- этано-19-норп-регн-4-ен-3-она с (171S)-171 -метил-14,17-этано-19- норпрегн-5(10)-ен-3,20-дионом вводят во взаимодействие согласно описанной в примере 1д) методике. Получают 77 мг соединения 12в) и 122 мг соединения 13).
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,68 (дд, J= 6 Гц и 13 Гц, 1H, Н-172); 0,92 (с, 3H, Н-18); 0,96 (д, J = 7,5 Гц, 3H, 171-CH3); 2,08 (с, 3H, Н-21); 5,82 (уш.с, 1H, H-4).
Примеры 14 и 15:
14:(171R)-Метил-14,17-этано-19-норпрегна-4,9-диен- 3,20-дион
15:(171S)-171 -Метил-14,17-этано-19-норпрегна-4,9-диен- 3,20- дион
1,30 г Описанной в примере 12б) смеси обоих С-171- эпимеров 20,20-/1,2-этандиилбис(окси)/-171-метил-14,17- этано-19-нор-прегн-5(10)-ен-3-она вводят во взаимодействие согласно описанным в примерах 4б) и 1д) методикам. Получают 200 мг соединения 14) и 120 мг соединения 15).
14):
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 1,04 (с,3H, Н-18); 1,06 (д, J = 7,5 Гц, 3H, 171-CH3); 2,07 (с, 3H, Н-21); 5,65 (уш.с, 1H, Н-4).
15):
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,76 (дд, J = 5 Гц и 12 Гц, 1H, Н-172); 0,95 (д, J = 7,5 Гц, 3H, 171-CH3); 1,01 (с, 3H, Н-18); 2,09 (с, 3H, Н-21); 5,66 (уш.с, 1H, H-4).
Пример 16: 14, 17-Этано-19-норпрегна-4, 9-диен-3, 20-дион
а) 3-Метокси-16 α -фенилсульфонил-14,17-этено-19-норпрегна- 1,3,5(10)-триен-20-он
Смесь из 14,7 г описанного в примере 1а) вещества и 24,0 г фенилвинилсульфона в 100 мл бензола нагревают в течение 10 дней при температуре 155oC. После охлаждения реакционную смесь концентрируют и остаток хроматографируют на силикагеле сначала с помощью дихлорметана и затем с помощью смеси этилацетата с гексаном. Получают 14,9 г соединения 16а). Т.пл. 178-179oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,84 (с, 3H, Н-18); 2,30 (с, 3H, Н-21); 3,77 (с, 3H, 3-ОСН3); 4,58 (дд, J=8,4 Гц, 1H, Н-16); 6,48 и 6,50 (2д, J= 5 Гц, каждый 1H, Н-171 и Н-172); 6,64 (д, J= 3 Гц, 1H, Н-4); 6,72 (дд, J= 9,3 Гц, 1H, Н-2); 7,18 (д, J= 9 Гц, 1H, Н-1); 7,52-7,87 (м, 5H, SO2C6H5).
б) 3-Метокси-14,17-этано-19-норпрегн-1,3,5(10)-триен- 20-ол
120 г Безводного никеля Ренея многократно промывают этанолом и, наконец, суспендируют в 900 мл этанола. К этой суспензии добавляют 6,95 г описанного в примере 16а) вещества и в течение 16 часов кипятят с обратным холодильником. После охлаждения никель Ренея удаляют путем декантации реакционной смеси, дополнительно промывают многократно этанолом и объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с циклогексаном. Получают 1,40 г 3-Метокси- 14,17-этано-19-норпрегна-1,3,5 (10)-триен-20-она с т.пл. 140-142oC и 2,70 г соединения 16б). Т.пл. 90-100oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,88 и 0,92 (2с, 3H, H-18); 1,12 и 1,18 (2д, J = 6 Гц, 3H, H-21); 3,78 (с, 3H, 3-OCH3); 3,95 (к, J= 6 Гц, 1H, H- 20); 6,63 (д, J = 3 Гц, 1H, H-4); 6,72 (дд, J= 9,3 Гц, 1H, H-2); 7,21 (д, J= 9 Гц, 1H, H-1).
в) 3-Метокси-14,17-этано-19-норпрегна-2,5(10)-диен-20-ол
5,50 г Описанного в примере 16б) соединения превращают согласно описанной в примере 1г) методике. Получают 5,50 г соединения 16в).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,87 и 0,90 (2с, 3H, H-18); 1,10 и 1,16 (2д, J= 6 Гц, 3H, H-21); 3,55 (с, 3H, 3-OCH3); 3,87-3,98 (м, 1H, H-20); 4,65 (м, 1H, H-2).
г) 14,17-Этано-19-норпрегн-5(10)-ен-20-ол-3-он
1,70 г Описанного в примере 16в) соединения превращают согласно описанной в примере 4а) методике. Получают 0,80 г соединения 16 г). Т.пл. 103-117oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,87 и 0,90 (2с, 3H, H-18); 1,11 и 1,16 (2д, J = 6 Гц, 3H, H-21); 2,69 и 2,78 (2д, J = 20 Гц, каждый 1H, H-4); 3,85-3,98 (м,1H, H-20).
д) 14, 17-Этано-19-норпрегна-4,9-диен-20-ол-3-он
К раствору 0,16 мл брома в 10 мл пиридина при охлаждении льдом и при перемешивании прикапывают раствор 0,80 г описанного в примере 16 г) соединения в 10 мл пиридина. Спустя 3 часа реакционную смесь выливают в 2н соляную кислоту и устанавливают pH-значение, равное 4-5. Экстрагируют этилацетатом, органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 0,22 г соединения 16 д).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 1,01 и 1,07 (2с, 3H, H-18); 1,12 и 1,15 (2д, J= 6 Гц, 3H, H-21); 3,88-4,00 (м, 1H, H-20); 5,67 (уш. с, 1H, H-4).
е) 14,17-Этано-19-норпрегна-4,9-диен-3,20-дион
К раствору 220 мг описанного в примере 16 д) соединения в 20 мл дихлорметана при охлаждении льдом добавляют 360 мг пиридинийхлорхромата. Смесь перемешивают 2 часа при комнатной температуре и затем отфильтровывают. Фильтрат концентрируют и остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 130 мг соединения 16е) в виде пены.
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,04 (с, 3H, H-18); 2,12 (с, 3H, H-21); 5,67 (уш.с, 3H, H-4).
Пример 17: 14,17-Этано-19-норпрегна-4,6-диен-3,20-дион
а) 14,17-Этано-19-норпрегн-4-ен-3,20-дион
5,50 г Описанного в примере 16в) соединения превращают согласно описанным в примерах 1д) и 16е) методикам. Получают 2,80 г соединения 17а). Т.пл. 140- 145oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,94 (с, 3H, Н-18); 2,10 (с, Н-21); 5,83 (уш.с, 1H, H-4).
б) 14,17-Этано-19- норпрегна-4,6-диен-3, 20-дион
326 мг Описанного в примере 17а) соединения превращают согласно описанным в примерах 2а) и 26) методикам. Получают 160 мг соединения 17б). Т. пл. 126-132oC;. [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,96 (с, 3H, Н-18); 2,11 (с, 3H, Н-21); 5,78 (уш.с, 1H, Н-4); 6,14-6,23 (м, 2H, Н-6 и Н-7).
Пример 18: 21-Метил-14,17-Этано-19-норпрегн-4-ен-3, 20-дион
а) 3-Метокси-21-метил-14,17-этано-19-норпрегна-1,3,5(10)-триен- 20-он
133 г Описанного в примере 1б) соединения растворяют при встряхивании в 2 л этилацетата. Добавляют 13 г 10%-ного палладия-на-угле, помещают в аппаратуру с атмосферой водорода и встряхивают вплоть до прекращения поглощения водорода. После фильтрации раствора через целит фильтрат концентрируют. После кристаллизации из этилацетата получают 129 г соединения 18а). Т.пл. 146-147oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,90 (с, 3Н, H-18); 2,23 (с, 3H, Н-21); 3,78 (с, 3H, 3-OCH3); 6,63 (д, J= 3 Гц, 1H, Н-4); 6,73 (дд, J = 9,3 Гц, 1H, Н-2); 7,22 (д, J = 9 Гц, 1H, Н-1).
б) 3-Метокси-21-метил-14,17-этано-19-норпрегна- 1,3,5(10)-триен-20-он
5,00 г Описанного в примере 18а) соединения превращают согласно описанной в примере 7а) методике. Получают 4,4 г соединения 18б) в виде пены.
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,89 (с, 3H, Н-18); 1,03 (т, J= 7 Гц, 3H, Н-22); 2,40-2,50 (м, 2H, Н-21); 3,78 (с, 3H, 3-OCH3); 6,63 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J= 9,3 Гц, 1H, Н-2); 7,22 (д, J= 9 Гц, 1H, Н-1).
в) 3-Метокси-21-метил-14, 17-этано-19-норпрегна-2,5(10)- -диен-20-ол
2,70 г Описанного в примере 18б) соединения превращают согласно описанной в примере 1г) методике. Получают 1,75 г соединения 18в).
Т.пл. 137-143oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,86 (с, 3H, Н-18); 0,98 (т, J= 7 Гц, 3H, Н-22); 3,55 (с, 3H, 3-OCH3); 4,66 (уш.с, 1H, Н-2).
г) 21-Метил-14,17-этано-19-норпрегн-4- ен-20-ол-3-он
356 мг Описанного в примере 18в) соединения превращают согласно методике, описанной в примере 1д). Получают 300 мг соединения 18г).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,91 (с, 3H, Н-18); 0,98 (т, J= 7 Гц, 3H, Н-22); 3,55-3,63 (м, 1H, Н-20); 5,81 (уш.с, 1H, Н-4).
д) 21-Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
300 мг Описанного в примере 18г) соединения превращают согласно описанной в примере 14е) методике. Получают 200 мг соединения 18д).
Т.пл. 123-128oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,93 (с, 3H, Н-18); 1,00 (т, J = 7 Гц, 3H, Н-22); 5,82 (уш.с, 1H, Н-4).
Пример 19: 21-Метил-14, 17-этано-19-норпрегна-4, 9-диен-3, 20 -дион
770 мг Описанного в примере 18в) соединения превращают согласно описанным в примерах 4а), 4б) и 16е) методикам. Получают 170 мг соединения 19). Т.пл. 130oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,02 (т, J = 7 Гц, 3H, Н-22); 1,05 (с, 3H, Н-18); 5,68 (уш.с, 1H, Н-4).
Пример 20: 21-Метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион
370 мг Описанного в примере 18г) соединения превращают согласно указанным в примерах 2а), 2б) и 16е) методикам. Получают 120 мг соединения 20). Т.пл. 155-158oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,96 (с, 3H, Н-18); 1,02 (т, J = Гц, 3H, Н-22); 5,78 (уш.с, 1H, Н-4); 6,15- 6,23 (м, 2H, H-6 и Н-7).
Пример 21: 21, 21-Диметил-14, 17-этано-19-норпрегна-4, 9- диен-3,20-дион
а) 3,3/2,2-Диметил-1,3-пропандиилбис (окси)/- 21-метил-14,17-этано-19-норпрегна-5 (10),9(11)-диен-20-он
18,3 г Описанного в примере 18в) соединения вводят во взаимодействие согласно указанным в примерах 4а), 46), 9а) и 7в) методикам. Получают 1,0 г соединения 21а).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,85 и 0,90 (2с, 6H, кеталь-CH3);1,03 (т, J = 7 Гц, 3H, Н-22); 1,09 (с, 3H, Н-18); 3,42-3,52 (м, 2H, кеталь-OCH2); 3,57-3,68 (м, 2H, кеталь-OCH2);5,50-5,55 (м,1H, Н-11).
б) 21,21-Диметил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион
210 мг Описанного в примере 21а) соединения вводят во взаимодействие (превращают) согласно указанным в примерах 7а) и 1д) методикам. Получают 108 мг соединения 21б).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,01 (д, J = 6 Гц, 6H, Н-22', Н-22);1,05 (с, 3H, H-18);5,68 (уш.с, 1H, H-4).
Пример 22: 6-Метил-14,17-этано-19-норпрегна-4,6-диен-3,20- дион
а) 6-Метилен-14,17-этано-19-норпрегн-4-ен-3,20-дион
6,10 г Описанного в примере 17а соединения согласно описанной в примере 2а) методике превращают в соответствующий простой диенольный эфир, который в виде сырого продукта растворяют в 60 мл диметилформамида и при 0o смешивают с раствором 5,2 мл оксихлорида фосфора в 30 мл диметилформамида. Спустя час реакционную смесь прикапывают к концентрированному раствору гидрокарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 5,27 г 6-формильного соединения в виде сырого продукта, которые растворяют в 14 мл этанола и 28 мл диметилформамида и порциями смешивают с 0,66 г боргидрида натрия. Спустя час прикапывают 7,5 мл 2 н серной кислоты. Спустя 15 минут реакционную смесь разбавляют с помощью 120 мл воды, нейтрализуют концентрированным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 4,31 г соединения 22а) в виде сырого продукта.
1H-ЯМР (дейтерированный хлороформ): δ (м. д. ) = 0,93 (с, 3H, Н-18); 2,12(с, 3H, Н-21);4,94 и 5,18 (уш. 2с, каждый, 1H, 6 - = CH2); 6,11 (уш.с, 1H, Н-4).
б) 6-Метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион
1,05 г 5%-ного Палладия-на-угле в 50 мл метанола в течение 30 минут кипятят с обратным холодильником и затем смешивают с раствором 2,15 г описанного в примере 22а) соединения в 90 метанола и в течение 90 минут кипятят с обратным холодильником. Катализатор отфильтровывают и после концентрирования остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 88 мг соединения 22б).
1H-ЯМР (дейтерировнный хлороформ): δ (м.д.) = 0,95 (с,3H,H-18); 1,83 (уш.с,1H,6-СН3);2,12 (с,3H,H-21);5,93 и 5,99 (уш.2с,2H, H-4 и Н-7).
Пример 23: 6 α-Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
Раствор 2,15 г описанного в примере 22а) соединения в 30 мл этанола смешивают с 3 мл циклогексана и 0,25 г 10%-ного палладия-на-угле и в течение 75 минут кипятят с обратным холодильником. Катализатор отфильтровывают и остаток после концентрирования хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 140 мг соединения 23).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,95 (с,3H,Н-18); 1,12 (д, J=7 Гц, 3H, 6-СН3); 2,12 (с,3H,Н-21);5,86 (уш.с,1H, Н-4).
Пример 24: 21-Гидрокси-14,17-этано-19-норпрегн-4-ен-3, 20-дион
4,9 г Описанного в примере 17а) соединения превращают согласно указанным в примерах 9а), 5в), 5г), 1д) и 5ж) методикам. Получают 253 мг соединения 24).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,95 (с,3H, Н-18); 3,35 (т, J = 5 Гц, 1Н,21-ОН);4,24 и 4,27 (2д, J = 5 Гц, каждый,1H,Н-21);5,27 (уш. с,1H,Н-4).
Пример 25: 21-Гидрокси-14, 17-этано-19-норпрегна-4,9-диен-3,20-дион
805 мг Описанного в примере 16е) соединения превращают согласно указанным в примерах 9а), 5в), 5г), 1д) и 5ж) методикам. Получают 110 мг соединения 25).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,04 (с,3H, Н-18); 3,32 (т, J = 5 Гц, 1H, 21-ОН); 4,23 и 4,27 (2д, J = 5 Гц, каждый, 1H, H-21);5,68 (уш.с,1H, H-4).
Примеры 26 и 27:
26: (21R)-21-Гидрокси-21-метил-14,17- этано-19-норпрегна-4,9-диен-3,20-дион
27: (21S)-21-Гидрокси-21-метил-14,17-этано-19-норпрегна-4,9- диен-3,20-дион
2,00 г Описанного в примере 21а) соединения превращают согласно указанным в примерах 5в), 5г), 1д) и 5ж) методикам. Получают 640 мг смеси 21-эпимеров, которую разделяют путем хроматографии на силикагеле с помощью смеси этилацетата с гексаном, получая 210 мг соединения 26) и 230 мг соединения 27).
26: [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,03 (с, 3H, Н-18); 1,32 (д, J= 6 Гц, 3H, H-22); 3,60 (д, J= 6 Гц, 1H, 21-ОН); 4,37-4,46 (м, 1H, Н-21); 5,68 (уш.с, 1H, Н-4).
27: [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,07 (с, 3H, Н-18); 1,29 (д, J= 6 Гц, 3H, Н-22); 3,40 (д, J= 7 Гц, 1H, 21-ОН); 4,33-4,44 (м, 1H, Н-21); 5,68 (уш.с, 1H, Н-4).
Пример 28: 16 α -Метил-14,17- этано-19-норпрегн-4-ен-3, 20-дион
а) Метиловый эфир 3-метокси-20-оксо-14,17-этено-19-норпрегна- 1,3,5 (10)-триен-16 α-карбоновой кислоты
9,4 г Описанного в примере 1а) соединения, 37 мл свежеперегненного метилакрилата и 200 мг гидрохинона в запаянной трубке выдерживают в течение 7 дней при 120oC. После охлаждения и отгонки всех летучих компонентов при пониженном давлении остаток хроматографируют на силикагеле с помощью смеси этилацетатата с гексаном. Получают 21,0 г соединения 28а).
Т.пл. 145-146oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) =0,96 (с, 3H,Н-18); 2,29 (с, 3H, Н-21);3,60 (с,3H,СО2CH3);3,78 (с,3H,3-ОСН3); 3,84 (дд, J = 9,5 и 4,5 Гц, Н-16); 6,15 и 6,27 (2д, J = 6 Гц, каждый, 1H,Н-171 и Н-172);6,64 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J = 9 Гц и 3 Гц, 1H, Н-2);7,19 (д, J = 9 Гц, 1H, Н-1).
б) Метиловый эфир 20,20-/1,2-этандиилбис(окси)/-3-метокси- -14,17-этено-19-норпрегна-1,3,5 (10)-триен-16 α -карбоновой кислоты
20,8 г Описанного в примере 28а) соединения превращают согласно указанной в примере 1в) методике. Получают 17,0 г соединения 28б). Т.пл. 128-130oC; [α]
1 H-ЯМР (дейтированный хлороформ): δ (м.д.) = 1,03 (с, 3H, Н-18); 1,32 (с, 3H, Н-21); 3,38 (дд, J = 9,5 и 4,5 Гц, 1H, Н-16); 3,60 (с, 3H, СО2CH3); 3,78 (с, 3H, 3-ОСН3); 3,82-4,18 (м, 4H, 20-OCH2CH2О-); 6,00 и 6,23 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,63 (д, J=3 Гц, 1H, Н-4); 6,71 (дд, J = 9 и 3 Гц, 1H, Н-2); 7,20 (д, J= 9 Гц, 1H, Н-1).
в) 20,20-[1,2-Этандиилбис(окси)] -3-метокси-14,17- этено-19-норпрегна-1,3,5 (10)-триен-16 α -метанол
Раствор 8,2 г описанного в примере 28б) соединения в 150 мл тетрагидрофурана прикапывают к охлажденной до 0oC суспензии 2,84 г литийалюминийгидрида в 100 мл тетрагидрофурана. После перемешивания в течение двух часов при комнатной температуре медленно смешивают с 5 мл воды. Спустя следующие 20 минут отфильтровывают через целит, дополнительно промывают дихлорметаном, сушат над сульфатом натрия и концентрируют. Получают 7,1 г соединения 28в). Для аналитических целей продукт кристаллизуют из пентана.
Т.пл. 162-164oC [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,05 (с, 3H, (Н-18); 1,48 (с, 3H, Н-21); 3,18-3,44 (м, 2H, 16-С2ОН); 3,77 (с, 3H, 3-OCH3): 4,01-4,12 (м, 4H, 20-ОСН2CH2О-); 5,95 и 6,04 (2д, J = 6 Гц, каждый 1H, Н-171 и Н-172); 6,62 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J =9 и 3 Гц, 1H, Н-2); 7,21 (д, J = 9 Гц, 1H, Н-1).
г) 20,20-[1,2-Этандиилбис(окси)]-3-метокси-14,17-этано-19- -норпрегна-1,3,5 (10)-триен-16 α -метанол
7,8 г Описанного в примере 28в) соединения превращают согласно указанной в примере 16а) методике. Получают 7,4 г соединения 28г).
Т.пл. 190-193oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,05 (с,3H, Н-18);1,43 (с,3H,Н-21);3,54 (м,1H,16-СН2ОН);3,37 (с,3H, 3-ОСН3); 3,69-4,10 (м,5H,20-ОСН2CH2О- и 16-СН2ОН);6,62 (д, J = 3 Гц, 1H, Н-4); 6,70 (дд, J =9 и 3 Гц, 1H, Н-2);7,21 (д, J = 9 Гц, 1H, Н-1).
д) 16 α -(Бромметил)-20,20-[1,2-этандиилбис (окси)]- 3-метокси-14,17-этано-19-норпрегна-1,3,5 (10)-триен
6,8 г Описанного в примере 28г) соединения, 7,2 г тетрабромметана и 5,7 трифенилфосфина в 250 мл дихлорметана перемешивают в течение 16 часов при комнатной температуре. После концентрирования остаток хроматографируют на силикагеле с по мощью смеси этилацетата с гексаном. Получают 2,2 г соединения 28д).
Т.пл. 176-177oC; [α]
1 H-ЯМР (дейтерироварный хлороформ): δ (м.д.) = 1,02 (с,3H, Н-18);1,30 (с, 3H, Н-21); 3,34 (дд, J - 10 Гц и 12 Гц, 16-СН2Br); 3,73 (с,3H,3-ОСН3); 3,82-4,06 (м, 5H,20-ОСН2CH2О- и 16-СН2Br); 6,63 (д, J = 3 Гц, 1H, Н-4) 6,71 (дд, J = 9 Гц и 3 Гц,1H,Н-2); 7,20 (д, J = 9 Гц, 1H, Н-1).
е) 20,20-[1,2-Этандиилбис (окси)]-3-метокси-16 α - метил-14,17-этано-19-норпрегна-2,5(10)-диен
1,78 г Описанного в примере 28д) соединения превращают согласно указанной в примере 1г) методике. Получают 1,1 г соединения 28е).
Т.пл. 174-178oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,99 (с,3H, Н-18); 1,06 (д, J = 7 Гц, 16-СН3);1,25 (с, 3H, Н-21); 3,56 (с, 3H, 3-ОСН3); 3,78-4,01 (м, 4H, 20-ОСН3CH2О-);4,64 (м, 1H, Н-2).
ж)16 α -Метил-14, 17-этано-19-норпрегн-4-ен-3,20-дион
1,05 г Описанного в примере 28e) соединения превращают согласно указанной в примере 1д) методике. Получают 0,7 г соединения 28ж).
Т.пл. 172-173oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,96 (с,3H, H-18);0,96 (д, J = 7 Гц,16-СHз);2,09 (с,3H,H-21);5,81 (т, J = 1 Гц,H-4).
Пример 29: 16 α -Этил-14, 17-этано-19-норпрегн-4-ен-3, 20-дион
а) 20,20-[1,2-Этандиилбис(окси)]-3-метокси-14, 17- этано-19-норпрегна-1,3,5 (10)-триен-16 α -карбальдегид
2,7 г Описанного в примере 28г) соединения превращают согласно указанной в примере 7в) методике. Получают 2,4 г соединения 29а).
1 H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 1,02 (с,3H,H-18); 1,34(с, 3H, H-21); 3,78 (с,3H,3-ОСH3)3,82-4,16 (м,4H, 20-ОСH2CH2О-);6,61 (д, J-3 Гц,1H,H-4);6,72 (дд, J = 9 Гц и 3 Гц,1H,H-2);7,20 (д, J = 9 Гц,1H,H-1); 9,88 (д, J = 2 Гц,CHO).
б) 20,20-/1,2-Этандиилбис (окси)/-16 α -этенил-3-метокси- - 14,17-этано-19-норпрегна-1,3,5(10)-триен
10,7 г Метилтрифенилфосфонийбромида суспендируют в 70 мл тетрагидрофурана и при 0oC по каплям смешивают в целом с 18 мл 1,6 М раствора н-бутиллития в гексане. После перемешивания в течение 20 минут при температуре 0oC и в течение 1 часа при комнатной температуре прикапывают раствор 2,6 г описанного в примере 29а) соединения в 40 мл тетрагидрофурана. Спустя 2 часа отфильтровывают твердые компоненты и концентрируют. Остаток распределяют между водой и этилацетатом, органическую фазу промывают водным концетрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концетрируют. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 1,6 г соединения 29б).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,03 (с, 3H, Н-18);1,38 (с, 3H, Н-21);3,78(с, 3H, 3-ОСН3);3,84-4,03 (м,4H, 20-ОСН2CH2О-);4,96-5,08 (м, 2H винил-CH2);6,02-6,17 (м, 1H винил-CH); 6,62 (д, J = 3 Гц, 1H, Н-4); 6,71 (дд, J = 9 и 3 Гц, 1H, Н-2); 7,21 (д, J= 9 Гц, 1H, Н-1).
в) 20,20-[1,2-Этандиилбис(окси)]-16 α -этил-3-метокси-14, 17-этано-19-норпрегна-1,3,5(10) -триен
1,0 г Описанного в примере 29б) соединения превращают согласно указанной в примере 16а) методике. Получают 1,0 г соединения 29в).
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,91 (т, J = 7 Гц, 3H, 16-этил-СН3); 1,00 (с, 3H, Н-18); 1,30 (с, 3H, Н-21); 3,77 (с, 3H, 3-OCH3); 3,70-4,02 (м, 4H, 20-ОСН2CH2О-); 6,61 (д, J = 3 Гц, 1H, Н-4); 6,71 (дд, J =9 и 3 Гц, 1H, Н-2); 7,21 (д, J= 9 Гц, 1H, Н-1).
г) 20,20-[1,2-Этандиилбис (окси)] -16 α этил-3-метокси-14,17- -этано-19-норпрегна-2,5 (10) -диен
1,0 г Описанного в примере 29в) соединения превращают согласно указанной в примере 1г) методике. Получают 1,07 г соединения 29г), которое вводят во взаимодействие далее в виде сырого продукта.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 3,54 (с, 3H, 3-OCH3); 3,75-4,01 (м, 4H, 20-OCH2CH2O-); 4,63 (м, 1H, Н-2).
д) 16 α Этил-14,17-этано-19-норпрегн-4-ен-3,20-дион
0,97 г Описанного в примере 29г) соединения превращают согласно указанной в примере 1д) методике. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 0,56 г соединения 29д), которое кристаллизуют из диизопропилового эфира.
Т.пл. 145-147oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,96 (т, J = 7 Гц, 3H, 16-этил-СН3); 0,96 (с, 3H, Н-18); 2,10 (с, 3H, H-21); 5,81 (т, J= 1 Гц, 1H, Н-4).
Пример 30: 16 α -Этенил-14, 17-этано-19-норпрегн-4-ен-3,20-дион
а) 20,20-[1,2-Этандиилбис(окси)]-16а-этенил-3-метокси-14, 17-этано-19-норпрегна-2,5(10)-диен
0,5 г Описанного в примере 29б) соединения превращают согласно описанной в примере 1г) методике. Получают 0,5 г соединения 30а), которое без очистки вводят во взаимодействие далее.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,02 (с, 3H, Н-18); 1,23 (с, 3H, Н-21); 3,56 (с, 3H, 3-OCH3); 3,82-4,02 (м, 4H, 20-OCH2CH2O-); 4,64 (м, 1H, Н-2); 4,93-5,07 (м, 2H, винил-CH2); 6,08 (м, 1H, винил-CH)
б) 16 α Этенил-14,17-этано-19-норпрегн-4-ен-3,20-дион
0,49 г Соединения 30а) превращают согласно описанной в примере 1д) методике. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 0,27 г соединения 30б).
Т.пл. 171oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,00 (с, 3H, Н-18); 2,08 (с, 3H, Н-21); 5,03-5,13 (м, 2H, винил-CH); 5,72-5,87 (м, 2H, винил-CH и Н-4).
Пример 31: 16-Метилен-14, 17-этано-19-норпрегн-4-ен-3, 20- - дион
а) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-16-метилен-14, 17-этано-19-норпрегна-1,3,5(10)-триен
27,86 г Описанного в примере 29а) соединения растворяют в 268 мл тетрагидрофурана и при температуре ОoС смешивают с 26,6 г гексаметилдисилазида калия. Спустя 1 час прикапывают 17,8 мл нонафлилфторида (1,1,2,2,3,3,4,4,4-нонафторбутан-сульфонилфторида). После перемешивания в течение трех часов при комнатной температуре реакционную смесь распределяют между водой и этилацетатом и органическую фазу промывают концентрированным раствором гидрокарбоната натрия и раствором хлорида натрия. После высушивания органической фазы над сульфатом натрия отфильтровывают, концентрируют и остаток обрабатывают 546 мл диметилформамида. После добавления 111,5 мл триэтиламина, 2,0 г бис-(трифенилфосфин)-палладий-(II)-хлорида и 19,5 мл муравьиной кислоты нагревают в течение 7 часов при 80oC и затем выдерживают в течение ночи при комнатной температуре. После распределения между этилацетатом и водой органическую фазу промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 5,33 г соединения 31а).
[α]
1 H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,99 (с, 3H, Н-18); 1,44 (с, 3H, Н-21); 3,78 (с, 3H,3-ОСН3,); 3,87-4,07 (м, 4H, 20-OCH2CH2O-); 4,90 (уш. с, 1H, 16-метилен); 5,15 (уш.с, 1H, 16-метилен); 6,63 (д, J = 3 Гц, 1H, Н-4); 6,72 (дд, J= 9 и 3 Гц, 1H, Н-2); 7,23 (д, J = 9 Гц, 1H, Н-1).
б) 16-Метилен-14,17-этано-19-норпрегн-4-ен-3,20-дион
510 мг Описанного в примере 31 а) соединения превращают согласно описанным в примерах 1г) и 1д) методикам. Получают 440 мг соединения 31б), которое настаивают с диизопропиловым эфиром.
1 H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,09 (с, 3H, Н-18); 2,22 (с, 3H, Н-21); 4,83 (уш.с, 1H, 16-метилен); 4,90 (уш.с, 1H, 16-метилен); 5,82 (уш.с, 1H, Н-4).
Пример 32: 16-Метилен-14, 17-этано-19-норпрегна-4,9-диен-3,20-дион
а) 20,20-/1,2-Этандиилбис(окси)/-16-метилен-14,17- этано-19-норпрегн-5(10)-ен-3-он
6,8 г Описанного в примере 31а) соединения превращают согласно описанным в примерах 1г) и 8в) методикам. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 4,9 г соединения 32а). Кроме того, получают 600 мг 20,20-/1,2-этандиилбис(окси)/-16-метилен-14, 17-этано-19-норпрегн-4-ен-3-она.
1H-ЯМР (дейтерированный хлороформ) для соединения 32а): δ (м.д.)= 0,98 (с, 3H, Н-18); 1,41 (с, 3H, Н-21); 2,68 и 2,78 (уш, 2д, J = 20 Гц, каждый 1H, Н-4); 3,84-4,05 (м, 4H, 20-OCH2CH2O-); 4,89 (уш.с, 1H, 16-метилен); 5,12 (уш.с, 1H, 16-метилен);
1H-ЯМР (дейтерированный хлороформ) для 20,20-/1,2-этандиил-бис(окси)/-16-метилен-14, 17-этано-19-норпрегн-4-ен-3-она: δ (м.д.) = 1,00 (с, 3H, Н-18); 1,42 (с, 3H, Н-21); 3,84-4,04 (м, 4H, 20-ОСН2CH2О); 4,88 (уш.с, 1H, 16-метилен); 5,13 (уш. с, 1H, 16-метилен); 5,82 (уш.с, 1H, Н-4).
б) 16-Метилен-14, 17-этано-19- норпрегна-4, 9-диен-3,20-дион
4,9 г Описанного в примере 32а) соединения превращают согласно описанным в примерах 4б) и 1д) методикам. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном и настаивания продукта с диизопропиловым эфиром получают 1,52 г соединения 32б).
Т.пл. 141oC (при разложении); [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,19 (с, 3H, Н-18); 2,22 (с, 3H, Н-21); 4,84 (уш.с, 1H, 16-метилен); 4,90 (уш.с, 1H, 16-метилен); 5,68 (уш.с, 1H, Н-4).
Пример 33: 16-метилен-14,17-этано-19-норпрегна-4,6-диен-3,20-дион
600 мг 20,20-/1,2-Этандиилбис(окси)/-16-метилен-14,17- этано-19-норпрегн-4-ен-3-она из примера 32а) превращают согласно описанным в примерах 2а), 26) и 1д) методикам. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном и кристаллизации продукта из диизопропилового эфира получают 70 мг соединения 33).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,10 (с, 3H, Н-18) 12,21 (с,3H,Н-21);4,86 (уш.с,1H,16-метилен);4,92 (уш.с,1H, 16-метилен);5,78 (уш.с, 1H,Н-4);6,10-6,26 (м,2H,Н-6 и Н-7).
Пример 34: 16 α -Метил-14,17-этано-19-норпрегна-4,6-диен- 3, 20-дион
а) 20,20-[2-Этандиилбис(окси)] -3-метокси-16 α /[(метилсульфонил)окси] метил/-14,17-этано-19-норпрегна-1, 3,5(10)-триен
11,7 г Описанного в примере 28б) соединения, растворенного в смеси из 15 мл пиридина и 110 мл дихлорметана, при температуре 0oC медленно смешивают с 4,7 мл хлорангидрида метансульфокислоты. После выдерживания в течение 24-х часов при комнатной температуре смешивают с концентрированным, охлажденным льдом раствором гидрокарбоната натрия. Органическую фазу промывают трижды с помощью концентрированного, охлажденного льдом раствора гидрокарбоната натрия, сушат над сульфатом натрия и отфильтровывают. При пониженном давлении удаляют все летучие компоненты. Получают 14,3 г соединения 34а), которое вводят во взаимодействие далее без очистки.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,11 (с, 3H, Н-18); 1,31 (с, 3H, Н-21); 3,02 (с, 3H, SO2,CH3);3,68 (с,3H,3-ОСН3); 3,82- 4,06 (м, 4H, 20-OCH2CH2O-); 4,12 (дд, J =9 и 10 Гц, 1H, 16-СН2); 4,80 (дд, J = 4 и 10 Гц, 1H, 16-СН2); 6,62 (д, J = 3 Гц, 1H, Н-4); 6,70 (дд, J = 9 и 3 Гц, 1H, Н-2); 7,20 (д, J = 9 Гц, 1H, Н-1).
б) 20,20-[1,2-Этандиилбис(окси)] -3-метокси-16 α -метил-14, 17-этано-19-норпрегна-1,3,5(10)-триен
14,3 г Описанного в примере 34а) соединения суспендируют в 20 мл тетрагидрофурана и смешивают со 150 мл 1М раствора триэтилборгидрида лития в тетрагидрофуране. После нагревания в течение 5,5 часов в атмосфере аргона оставляют стоять в течение 15 часов при комнатной температуре и распределяют между этилацетатом и концентрированным раствором хлорида аммония. Органическую фазу промывают концентрированным раствором гидрокарбоната натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 6,0 г соединения 34б). Т.пл. 132- 134oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1.01 (с,3H,Н-18); 1,19 (д, J = 7,5 Гц,16-СН3);1,30 (с,3H,Н-21);3,78 (с,3H,3- OCH3); 3,83-4,04 (м, 4H, 20-OCH2CH2O-); 6,62 (д, J = 3 Гц, 1H, Н- 4);6,71 (дд, J = 9 и 3 Гц, 1H, Н-2); 7,22 (д, J=9 Гц, 1H, Н-1).
в) 3-Метокси-16 α/метил-14,17-этано-19-норпрегна-1,3,5 (10) - триен-20-он
5,96 г Описанного в примере 34б) соединения превращают согласно описанной в примере 1д) методике. Получают 5,58 г соединения 34в) в виде сырого продукта.
Т.пл. 115-116oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,93 (с,3H,Н-18); 0,99 (д, J = 7,5 Гц,16-СН3);2,11 (с,3H,Н-21);3,78 (с,3H,3-ОСН3);6,62 (д, J = 3 Гц,1H,Н- 4);6,71 (дд, J =9 и 3 Гц, 1H, Н-2); 7,21 (д, J = 9 Гц, 1H, Н-1).
г) 3-Метокси-16 α -метил-14,17-этано-19-норпрегна- 1,3,5(10)-триен-20 ξ ол
5,53 г Описанного в примере 34в) соединения растворяют в смеси из 90 мл метанола и 130 мл дихлорметана и порциями смешивают с 2,37 г боргидрида натрия. После выдерживания в течение двух часов при комнатной температуре смешивают с водой, подкисляют с помощью 2н соляной кислоты и водную фазу экстрагируют дважды дихлорметаном. После промывки органической фазы водой, концентрированным раствором гидрокарбоната натрия и концентрированным раствором хлорида натрия ее сушат над сульфатом натрия, отфильтровывают и концентрируют. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 4,28 г соединения 34 г).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,98 (с,3H, H-18);1,04 (1,13) (д, J = 7,5 Гц, 16-СH3), 1,24 (1,22) (д, J = 6,5 Гц, 3H, H-21); 3,78 (с, 3H, 3-ОСH3); 3,88- 3,98 (м, 1H, H-20);6,62 (д, J = 3 Гц, 1H, H-4); 6,71 (дд, J = 9 и 3 Гц, 1H, H-2); 7,21(д, J = 9 Гц, 1H, H-1) (сигналы второго диастереомера указаны в скобках).
д) 3-Метокси-16 α -метил-14, 17-этано-19-норпрегна-2,5(10)- диен-20 ξ ол
4,26 г Описанного в примере 34 г) соединения превращают согласно описанной в примере 1г) методике. Получают 4,45 г соединения 34в) в виде сырого продукта.
1H-ЯМР (дейтерированный хлороформ):δ (м.д.) = 0,94 (с, 3H, H-18); 1,02 (д, J = 7,5 Гц, 16-СH3); 1,20 (д, J = 6,5 Гц, 3H, H-21); 3,53 (с, 3H, 3-ОСH3); 3,84-3,96 (м, 1H, H-20); 4,64 (уш.с, 1H, H-2), (данные ЯМР представлены только для основного диастереомера).
е) 16 α -Метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион
2 г Описанного в примере 34д) соединения превращают согласно описанным в примерах 1д), 2а), 2б) и 7в) методикам. Получают 446 мг соединения 34е).
Т.пл. 165o; [α]
1H-ЯМР (дейтерированный хлороформ); δ (м.д.) = 0,98 (c,3H, H-18);1,00 (д, J = 7,5 Гц, 3H, 16-СH3); 2,11 (с, 3H, H-21); 5,78 (уш.с, 1H, H-4); 6,08-6,22 (м, 2H, H-6 и H-7).
Пример 35: 16 α -Метил-14,17-этано-19-норпрегна-4,9-диен- 3,20-дион
2,5г Описанного в примере 34д) соединения превращают согласно описанным в примерах 4а),4б) и 7в) методикам. Получают 410 мг соединения 35).
Т.пл. 125-126oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,98 (д, J = 7,5 Гц, 3H, 16-СH3);1,07 (с, 3H, H-18); 2,11 (с, 3H, H-21); 5,68 (уш. с, 1H, H-4).
Пример 36: 16 α 21-Диметил-14-17-этано-19- норпрегна-4,9-диен- 3,20-дион
3,2 г Описанного в примере 34д) соединения превращают согласно описанным в примерах 4а),4б),9а),7а),7в) и 1д) методикам. Получают 308 мг соединения 36).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,99 (д, J = 7,5 Гц, 3H, 16-СH3); 1,04 (т, J = 7 Гц, 3H, H-22); 1,08 (с,3H,H- 18); 5,69 (уш.с,1H,H-4).
Пример 37: 21-Гидрокси-16 α -метил-14, 17-этано-19-норпегн-4-ен-3,20-дион
1,25 г Описанного в примере 34д) соединения превращают согласно описанным в примерах 1д),9а),7в),5в),5г),1д) и 5ж) методикам.
Получают 73 мг соединения 37).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,97 (д, J = 7,5 Гц, 3H, 16-СH3);0,98 (с, 3H, H-18);4,22 (уш.с, 2H, H-21); 5,82 (уш.с, 1H, H-4).
Пример 38: 172 -Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
а) 17 α -Этинил-3-метокси-15 -метилэстра-1,3,5(10), 15-тетраен-17 β -ол.
При температуре 0oC и в течение 30 минут в 500 мл тетрагидрофурана пропускают ацетилен. Затем прикапывают 230 мл 1,6 М раствора н-бутиллития в гексане. Спустя следующие 30 минут прикапывают раствор 12,1 г 3-метокси-15-метил-эстра-1,3,5(10), 15- тетраен-17-она (см. заявку на патент ФРГ 4326240-А 1) в 250 мл тетрагидрофурана. Спустя 30 минут реакционную смесь распределяют между полунасыщенным раствором хлорида натрия и этилацетатом, органическую фазу промывают полунасыщенным и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. При этом вещество кристаллизуется. В целом получают 12,12 г соединения 38а).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,95 (с,3H,H-18);1,90 (уш. с, 3H, 15-СH3); 2,66 (с,1H,17-этинил);3,79 (с,3H,3-ОСH3);5,40 (уш.с,1H, H-16);6,64 (д, J=3 Гц,1H,H-4);6,73 (дд, J = 9 и 3 Гц, 1H, H-2); 7,22 (д, J = 9 Гц, 1H, H-1).
б) 3-Метокси-172-метил-14,17-этено-19-норпрегна- 1,3,5(10)-триен-20-он
12,10 г Описанного в примере 38а) соединения превращают согласно описанным в примерах 1а) и 1б) методикам. Получают 8,95 г соединения 38б).
Т.пл. 123,5-125oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,86 (с,3H,H-18);1,88 (уш.c,3H,172-CH3);2,21 (c,3H,H-21);3,79 (с,3H,3-ОСH3); 5,66 (уш.с,1H,H-171); 6,63 (д, J = 3 Гц,1H,H-4);6,73 (дд, J = 9 Гц и 3 Гц,1H,H-2);7,22 (д, J = 9 Гц,1H,H-1).
в) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-172- метил-14,17-этено-19-норпрегна-2,5(10)-диен
1,50 г Описанного в примере 38б) соединения превращают согласно описанным в примерах 1в) и 1г) методикам. Получают 1,65 г неочищенного соединения 38в).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,92 (с,3H,H-18);1,32 (с, 3H, H-21);1,80 (уш.с,3H,172-CH3);3,56 (с,3H,3-ОСH3); 3,83 -4,02 (м,4H,20-ОСH2CH2О-);4,65 (уш.с,1H,H-2);5,53 (уш.с,1H,H-171).
г) 172-Метил-14,17-этено-19-норпрегн-4-ен-3, 20-дион
270 мг Описанного в примере 38в) соединения превращают согласно описанной в примере 1д) методике. Получают (согласно ВЭЖХ) 126 мг соединения 38 г).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,90 (с,3H,H-18);1,82 (уш.с,3H,172-CH3);2,18 (с,3H,H-21);5,63 (уш.с,1H, H-171);5,85 (уш.с,1H,H-4).
Пример 39: 172-Метил-14,17-этено-19-норпрегна-4,9-диен- -3,20-дион
1,41 г Описанного в примере 38в) соединения превращают согласно описанным в примерах 4а) и 4б) методикам. Согласно ВЭЖХ получают 178 мг соединения 39).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,98 (с,3H,H-18);1,73 (уш. с, 3H, 172-CH3);2,18 (с,3H,H-21);5,67 и 5,73 (уш.2с,каждый,1H,H-4 и H-171).
Пример 40: (172R)-172 -Метил-14,17-этано-19-норпрегн-4-ен-3,20-дион
a) (172R)-3-Метокси-17 -метил-14,17-этано-19-норпрегна- 1,3,5(10)-триен-20-он
7,95 г Описанного в примере 38б) соединения превращают согласно описанной в примере 12а) методике. Получают 6,97 г соединения 40а). Т.пл. 107,5 - 109,5oC.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,94 (с,3H,H-18);1,07 (д, J = 7,5 Гц,3H,172-CH3);2,11 (с,3H,H-21);3,78 (с,3H,3-ОСH3);6,61 (д, J-3 Гц, 1H,H-4);6,72 (дд, J = 9 и 3 Гц,1H,H-2);7,23 (д, J= 9 Гц,1H,H-1).
б) (172R)-20,20-/1,2-Этандиилбис(окси)/-3-метокси-172 - метил-14,17-этано-19-норпрегна-2, 5 (10) -диен
3,5 г Описанного в примере 40а) соединения превращают согласно описанным в примерах 1в) и 1г) методикам. Получают 4,0 г неочищенного соединения 40б), которое без очистки вводят во взаимодействие далее.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,99 (с,3H,H-18);0,99 (д, J = 7,5 Гц,3H,172-CH3);2,11 (с,3H,H-21);3,55 (с, 3H,3-ОСH3);3, 83-4,00 (м 4H, 20-ОСH2CH2О-); 4,64 (уш.с,1H, H-2).
в) (172R)-172 -Метил-14,17-этано-19-норпрегн-4-ен-3,20- дион
0,27 г Описанного в примере 40б) соединения превращают согласно описанной в примере 1д) методике. Получают 0,14 г
соединения 40в).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,95 (с,3H,H-18);1,05 (д, J = 7,5 Гц,3H,172-CH3);2,05 (с,3H,H-21);5,79 (уш.с,1H,H-4).
Пример 41: (172R)-172 -Метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион
1,1 г Описанного в примере 40б) соединения превращают согласно описанным в примерах 1д), 2а) и 2б) методикам. Получают 0,21 г соединения 41).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,98 (д, J = 7,5 Гц,3H, 172-CH3);0,99 (с,3H,H-18);2,08 (с,3H,H- 21);5,68 (уш.с,1H,H-4);6,11-6,27 (м, 2H,H-6 и H-7).
Пример 42: (172R)-172 -Метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион
1,4 г Описанного в примере 40б) соединения превращают согласно описанным в примерах 4а) и 4б) методикам. Получают 0,56 г соединения 42).
Т.пл. 118-120oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,06 (с,3H,H-18); 1,09 (д, J= 7,5 Гц,3H,172-CH3);2,09 (с,3H,H-21);5,66 (уш.с, 1H,H-4).
Пример 43: (172R)-172, 21-Диметил-14,17-этано-19- норпрегна-4,9-диен-3,20-дион
а) (172R)-172, 21-Диметил-20,20- [1,2-этандиилбис(окси)]-14,17-этано-19-норпрегн-5(10)-ен-3-он
3,65 г Описанного в примере 40а) соединения превращают согласно описанным в примерах 7а), 1в), 1г) и 8в) методикам. Получают 2,33 г соединения 43а) и наряду с ним 0,63 г (172R)-172, 21-диметил-20,20-/1,2-этандиилбис(окси)/ -14,17-этано-19-норпрегн-4-ен-3-она.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,86 (т, J = 7,7 Гц,3H, H-22); 0,99 (с,3H,H-18);1,00 (д, J = 7,5 Гц,3H,177 - CH3); 2,67 и 2,78 (д, J = 20 Гц, каждый, 1H, H-4);3,90-4,08 (м,4H,20-ОСH2CH2О-).
б) (172R)-172,21-Диметил-14,17-этано-19-норпрегна-4,9- диен-3,20-дион
2,33 г Описанного в примере 43а) соединения превращают согласно описанным в примерах 4б) и 1д) методикам. Получают 0,8 г соединения 43б) и наряду с ним 0,48 г (172R)- 172,21- диметил-14,17-этано-19-норпрегна-5(10),9(11)-диен-3,20-диона.
[α]
1H-ЯМР (дейтерированный хлороформ) для соединения 43б): δ (м.д.) = 1,00 (T, J= 7,5 Гц,3H,H-22);1,05 (с,3H,H-18);1,08 (д, J = 7,5 Гц,3H,172-CH3);5,67 (уш.с,1H,H-4).
1H-ЯМР (дейтерированный хлороформ) для (172R)-172,21-диметил- 14,17-этано-19-норпрегна-5(10), 9(11)-диен-3,20-диона: δ (м.д.) = 0,86 (с,3H,H-18); 1,00 (т, J = 7,5 Гц,3H,H-22);1,04 (д, J = 7,5 Гц,3H,172-CH3);2,88 (уш.с,2H, H-4);5,59-5,68 (м,1H,H-11).
Пример 44: (172R)-172,21-Диметил-14,17-этано-19- норпрегна-4,9,11-триен-3,20-дион
0,45 г Описанного в примере 43б) соединения (172R)- 172,21-диметил-14,17-этано-19-норпрегна-5(10), 9(11) -диен-3,20- диона превращают согласно описанной в примере 9в) методике.
Получают 0,16 г соединения 44).
[α]
1H-ЯМР (дейтерированный хлороформ): δ(м.д.) = 1,00 (с,3H,H-18); 1,02 (д, J = 7,5 Гц,3H,172-CH3);1,03 (т, J = 7,5 Гц,3H,H-22); 5,76 (уш.с,3H,H-4);6,44 (д, J = 12 Гц,1H,H-11);6,48 (д, J = 12 Гц,1H,H-12).
Пример 45: (172R)-172, 21-Диметил-14,17-этано-19- норпрегна-4,6-диен-3,20-дион
0,62 г Описанного в примере 43а) соединения (172R)- 172,21-диметил-20,20-/1,2-этандиилбис (окси)/-14, 17-этaнo-19-нopпpeгн 4-ен-3-она превращают согласно описанным в примерах 2а), 2б) и 1д) методикам. Получают 0,13 г соединения 45).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,93-1,02 (м,9H, 172-CH3, H-18 и H-22);5,76 (уш.с,1H,H-4);6,12-6,24 (м,2H,H-6 и H-7).
Пример 46: 14, 17-Этано-19-норпрегна-4, 15-диен-3, 20- дион
a) 15β,16β-Дигидро-3-метокси/1,3/диоксоло/4',5';15,16/-14,17-этено-19-норпрегна-1,3,5(10)-триен-2',20 -дион
56 г Описанного в примере 1а) соединения смешивают с 90,5 мл виниленкарбоната и 50 мг гидрохинона и выдерживают в атмосфере аргона при температуре бани 170oC в течение 18 часов. После удаления всех летучих компонентов в высоком вакууме остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. После кристаллизации из смеси диизопропилового эфира с ацетоном получают 56,04 г соединения 46а).
Т.пл. 217-217,5oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,94 (с,3H,H-18);2,30 (с, 3H, H-21); 3,79 (с,3H,3-ОСH3);4,99 и 5,76 (2H, J = 8 Гц,H-15 и H-16);6,31 и 6,40 (2д, J = 6 Гц,каждый,1H,H-171 и H-172);6,66(д, J = 3 Гц,1H,H-4);6,72 (дд,J = 9,3 Гц,1H, H-2);7,18 (д, J = 9 Гц,1H,H-1).
б) 15β,16β -Дигидpo-3-мeтoкcи/1,3/диoкcoлo/4',5':15,16/-14, 17-этано-19-норпрегна-1,3,5(10)-триен-2' 20-дион
56 г Описанного в примере 46а) соединения превращают согласно описанной в примере 12а) методике. Получают 56 г соединения 46б).
Т.пл. 223-224oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,94 (с,3H,H-18);2,20 (с, 3H,H-21);3,78 (с,3H,3-ОСH3);4,68 и 5,48 (2дд, J = 1,5 и 9 Гц,каждый 1H,H-171 и H-172); 6,64(д,J = 3 Гц,1H,H-4); 6,73(дд, J = 9,3 Гц,1H,H-2),19 (д, J = 9 Гц,1H,H-1).
в) 15α,16α -Дигидрокси-3-метокси-14,17-этано-19- норпрегна-1,3,5(10)-триен-20-он
50 г Описанного в примере 46б) соединения вместе с 26 г карбоната калия в смеси из 250 мл метанола, 500 мл тетрагидрофурана и 150 мл воды в течение 6 часов кипятят. После последующего удаления растворителей выливают в 2 л воды со льдом, отфильтровывают под вакуумом и осадок на фильтре промывают с помощью 1 л воды. Получают 45,80 г соединения 46в).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,91 (с,3H,H-18);2,18 (с, 3H, H-21); 3,78 (с, 3H,3-ОСH3);3,84-3,93 и 4,62-4,71 (2м,каждый 1H,H-171 и H-172); 6,63 (д, J = 3 Гц,1H,H-4); 6,72 (дд, J = 9,3 Гц,1H,H-2);7,21 (д, J = 9 Гц,1H,H-1).
г) 3-Метокси-14,17-этано-19-норпрегна-1,3,5(10),15-тетраен-20-он
45,7 г Описанного в примере 46в) соединения растворяют в 1,5 л дихлорметана и при 0oC смешивают со 150 мл триметилортоформиата, а также 6 г пиридинийпаратолуолсульфоната. После выдерживания в течение 6 часов при комнатной температуре смесь фильтруют через колонку с силикагелем и фильтрат концентрируют. Остаток после выпаривания обрабатывают с помощью 1 л ацетангидрида и кипятят в течение 5 часов. После концентрирования остаток распределяют между концентрированным раствором гидрокарбоната натрия и дихлорметаном. После промывки органической фазы концентрированным раствором хлорида натрия ее сушат над сульфатом натрия, отфильтровывают и концентрируют; остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 6,75 г соединения 46г). Все полярные фракции после хроматографии объединяют и концентрируют. Остаток вместе с 20 г карбоната калия в 800 мл метанола кипятят в течение трех часов и выливают в 2 л воды со льдом, отфильтровывают под вакуумом и осадок на фильтре промывают с помощью 0,5 л воды. Получают 27,5 г описанного в примере 46в) соединения, из которого по методике примера 46г) получают дальнейшие 4,50 г соединения 46г).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,91 (с,3H,H-18);2,23 (с, 3H, H-21);3,79 (с,3H,3-ОСH3);6,62 и 6,13 (2д, J = 6 Гц, каждый 1H,H-15 и H-16); 6,66 (д, J = 3 Гц,1H,H-4);6,73 (дд, J = 9,3 Гц,1H,H-2);7,21 (д, J=9 Гц, 1H,H-1).
д) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-14,17- этано-19-норпрегна-2,5(10),15-триен
4,5 г Описанного в примере 46г) соединения превращают согласно описанным в примерах 1в) и 1г) методикам. Получают 5,33 г сырого соединения 46д).
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,98 (с,3H,H-18);1,32 (с, 3H,H-21);3,56 (с,3H,3-ОСH3);3,93-4,07 (м,4H,20-ОСH2CH2О-);4,65 (уш.с,1H, H-2);5,94-6,03 (2д, J = 6 Гц,каждый 1H,H-15 и H-16).
е) 14,17-Этано-19-норпрегна-4, 15-диен-3,20-дион
2,0 г Описанного в примере 46д) соединения превращают согласно описанной в примере 1д) методике. Получают 1,32 г сырого соединения 46е).
Т.пл. 131-133o; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,93 (с,3H,H- 18);2,20 (с, 3H, H-21); 5,85 (уш.с,1H,H-4);6,05 и 6,19 (2д, J = 6 Гц,каждый 1H,H-15 и H-16).
Пример 47: 14, 17-Этано-19-норпрегна-4,6,15-триен-3,20- дион
1,2 г Описанного в примере 46е) соединения превращают согласно описанным в примерах 2а) и 26) методикам. Получают 0,54 г соединения 47).
Т.пл. 138-140oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,94 (с,3H,H-18);2,21 (с, 3H,H-21);5,79 (уш.с,1H,H-4);6,14-6,34 (м,4H,H-6, H-7,H-15 и H-16).
Пример 48: 14,17-Этано-19-норпрегна-4,9-15-триен-3,20- дион
3,33 г Описанного в примере 46д) соединения превращают согласно описанным в примерах 8в) и 4б) методикам. Получают 1,08 г соединения 48).
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,01 (с,3H,H-18);2,21 (с, 3H,H-21);5,70 (уш.с,1H,H-4);6,06 и 6,23 (2Д, J =6 Гц, 2H,H-15 и H-16).
Пример 49: 21-Гидрокси-14,17-этано-19-нопрегна-4,9,15-триен-3,20-дион
а) 3,3-/1,2-Этандиилбис(окси)/-14,17-этано-19- норпрегна-5(10),9 (11), 15-триен-20-он
1,0 г Описанного в примере 48) соединения превращают согласно описанной в примере 1в) методике. Получают 0,29 г соединения 49а), а также 0,7 г соответствующего 3,20-бискеталя.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,82 (с,3H,H-18);2,22 (с, 3H,H-21);4,00 (с,4H,3-ОСH2CH2О-);5,51 (уш.с,1H, H-11);6,04 и 6,22 (2д, J = 6 Гц,2H,H-15 и H-16).
б) 21-Гидрокси- 14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион
0,28 г Описанного в примере 49а) соединения превращают согласно описанным в примерах 5в), 5г), 1д) и 5ж) методикам. Получают 11 мг соединения 49б).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,00 (с,3H,H-18);4,33 и 4,42 (2д, J = 20 Гц,2H,H-21);5,70 (уш.с,1H,H- 4); 6,12 и 6,15 (2д, J = 6 Гц, 2H,H-15 и H-16).
Пример 50: 21-Метил-14,17-этано-19-норпрегна-4, 15-диен- 3,20-дион
а) 20,20-/1,2-Этандиилбис(окси)/-21-метил-14,17- этано-19-норпрегна-4,15-диен-3-он
6,6 г Описанного в примере 46г) соединения превращают согласно описанным в примерах 7а), 8а), 1г) и 8в) методикам. Получают 0,605 г соединения 50а), а также 3,70 г 20,20-/1,2- этандиилбис(окси)/-21-метил-14,17-этано-19-норпрегна-5(10), 15-диен-3-она.
12H-ЯМР (дейтерированный хлороформ) для соединения 50а): δ (м.д.) = 0,93 (т, J = 7 Гц,3H,H-22);0,99 (с, 3H,H-18);3,98-4,15 (м,4H,20-ОСH2СH2О-);5,83 (уш.с,1H,H-4);5,96 (с,2H,H-15 и H-16).
1H-ЯМР (дейтерированный хлороформ) для 20,20-/1,2-этандиилбис(окси)/-21-метил-14, 17-этано-19-норпрегна-5(10),15-диен-3-она: δ (м.д.) = 0,94 (т, J = 7 Гц, 3H, H-22); 0,96 (с, 3H, H-18); 2.70 и 2,80 (2д, J = 20 Гц, 2H, H-4); 3,96-4,14 (м, 4H, 20-OCH2CH2O-); 5,94 и 6,01 (2д, J = 6 Гц, 2H, H-15 и H-16).
б) 21-Метил-14,17-этано-19-норпрегна-4,15-диен-3,20-дион
142 мг Описанного в примере 50а) соединения превращают согласно описанной в примере 1д) методике. Получают 127 мг соединения 50б). Т.пл. 140-141oC;
[α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,90 (с,3H,H- 18);1,07 (т, J = 7 Гц,3H,H-22);5,85 (уш.с,1H,H-4)6,05 и 6,20 (2д, J = 6 Гц,2H,H-15 и H-16).
Пример 51: 21-Метил-14, 17-этано-19-норпрегна-4,6,15- триен-3,20-дион
460 мг Описанного в примере 50а) соединения превращают согласно описанным в примерах 2а), 2б) и 1д) методикам. Получают 210 мг соединения 51).
Т.пл. 153,5-154,5oC
[α]
1H ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,93 (с, 3H, H-18); 1,08 (т, J= 7 Гц, 3H, H-22); 5,80 (уш.с, 1H, H-4); 6,16-6,36 (м, 4H, H-6 и H-7 и H-15 и H-16).
Пример 52: 21-Метил-14, 17-этано-19-норпрегна-4,9-15-триен- 3,20-дион
3,7 г 20,20-/1,2-Этандиилбис(окси)/-21-метил-14,17- этано-19-норпрегна-5(10), 15-диен-3-она из примера 50а) превращают согласно описанным в примерах 4б) и 1д) методикам. Получают 2,1 г соединения 52).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 1,00 (с, 3H, H-18); 1,08 (т, J- 7 Гц, 3H, H- 22); 5,70 (уш.с, 1H, H-4); 6,06 и 6,24 (2д, J= 6 Гц, 2H, H-15 и H- 16).
Примеры 53 и 54:
53: (21R)-21-Гидрокси-21-метил-14, 17- этано-19-норпрегна-4,9,15-триен-3,20-дион
54: (21S) -21-Гидрокси-21-метил-14, 17-этано-19-норпрегна-4, 9, 15-триен-3,20-дион
1,72 г Описанного в примере 52) соединения превращают согласно описанным в примерах 9а), 5в), 5г), 1д) и 5ж) методикам. Получают 198 мг соединения 53) и 250 мг соединения 54).
53: [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,95 (с, 3H, H-18); 1,38 (д, J= 7 Гц, 3H, H-22); 4,43-4,56 (м, 1H, H-21); 5,68 (уш.с, 1H, H-4); 6,15 и 6,22 (2д, J= 6 Гц, 2H, H-15 и H-16).
54: [α]
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,98 (с, 3H, H-18); 1,38 (д, J = 7 Гц, 3H, H-22); 4,41-4,52 (м, 1H, H-21); 5,71 (уш.с, 1H, H-4); 6,10 и 6,18 (2д, J = 6 Гц, 2H, H-15 и H-16)
Пример 55: 16-Метил-14, 17-этано-19-норпрегна-4, 15-диен- - 3,20-дион
а) Метиловый эфир 3-метокси-20-оксо-14,17-этено-19-норпрегна- 1,3,5 (10) 15-тетраен-16-карбоновой кислоты
20 г Описанного в примере 1а) соединения, 20 мл метилового эфира пропиоловой кислоты и 50 мг гидрохинона выдерживают в запаянной трубке в атмосфере аргона в течение 34 часов при температуре бани 110oC. После охлаждения, удаления летучих компонентов и хроматографии остатка на силикагеле с помощью смеси этилацетата с гексаном получают 12,66 г соединения 55а).
Т.пл. 149-149,5oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д. = 1,30 (с, 3H, H-18; 2,28 (с, 3H, H-21); 3,73 и 3,78 (2с, каждый 3H, 3-ОСH3 и СО2CH3); 6,65 (д, J=3 Гц, 1H, H-4); 6,73 (дд, J = 9 и 3 Гц, 1H, H-2); 6,76 и 7,02 (2д, J = 6 Гц, каждый 1H, H-171 и H-172); 7,20 (д, J = 9 Гц, 1H, H-1); 7,58 (с, 1H, H-15)
Метиловый эфир
б) 20,20-[1,2-этандиилбис (окси)]-3- метокси-14,17-этено-19-норпрегна-1,3,5 (10),15-тетраен-16- карбоновой кислоты
10,83 г Описанного в примере 55а) соединения превращают согласно описанной в примере 1в) методике. Получают 11,46 г соединения 55б).
Т.пл. 147-147,5oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,28 (с, 3H, H-18); 1,55 (с, 3H, H-21); 3,73 и 3,78 (2с, каждый 3H, 3-ОСH3 и СО2CH3); 3,95-4,11 (м, 4H, 20-OCH2CH2O-); 6,64 (д, J = 3 Гц, 1H, H-4); 6,72 (дд, J =9 и 3 Гц, 1H, H-2); 6,67 и 6,80 (2д, J - 6 Гц, каждый 1H, H-171 и H-172); 7,21 (д, J = 9 Гц, 1H, H-1); 7,50 (с, 1H, H-15).
в) Метиловый эфир 20,20-[1,2-этандиилбис (окси)]-3-метокси-14,17-этано-19-норпрегна-1,3,5(10),15- тетраен-16-карбоновой кислоты
2,50 г Описанного в примере 55б) соединения в смеси из 250 мл метанола и 250 мл этилацетата в присутствии 100 мг 10%-ного палладия-на-угле гидрируют при нормальном давлении вплоть до поглощения 1 эквивалента водорода. После отфильтровывания катализатора, концентрирования и хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 1,99 г соединения 55в).
1H-ЯМР (дейтерированный хлороформ): δ (м. д.) = 0,97 (с, 3H, H-18); 1,54 (с, 3H, H-21); 3,73 и 3,78 (2с, каждый 3H, 3-ОСH3 и СО2CH3); 3,90-4,06 (м, 4H, 20- ОСH2CH2О-); 6,64 (д, J = 3 Гц, 1H, H-4); 6,72 (дд, J= 9 и 3 Гц, 1H, H-2); 6,92 (с, 1H, H-15); 7,21 (д, J= 9 Гц, 1H, H-1).
г) 20,20/1,2-Этандиилбис(окси)/-3-метокси-14,17- этано-19-норпрегна-1,3,5(10),15-тетраен-16-метанол
2,52 г Описанного в примере 55в) соединения, растворенного в 40 мл тетрагидрофурана, смешивают со 157 мг хлорида цинка. При температуре -78oC прикапывают 24 мл 1,2 М раствора диизобутилалюминийгидрида в толуоле. Затем выдерживают в течение 3,5 часов при этой температуре, смешивают с водой, повышают температуру до комнатной и экстрагируют этилацетатом, органическую фазу промывают концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. После хроматографии на силикагеле с помощью смеси этилацетата с гексаном получают 1,46 г соединения 55 г).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,98 (с, 3H, H-18);1,39 (с, 3H, H-21); 3,24-3,32 (м, 1H, 16-СH2); 3,78 (с, 3H, 3-ОСH3); 3,94-4,13 (м, 4H, 20-ОСH2CH2О-); 4,18-4,26 (м, 1H, 16-СH2); 6,00 (уш.с, 1H, H-15); 6,64 (д, J = 3 Гц, 1H, H-4);6,71 (дд, J=9 и 3 Гц, 1H, H-2); 7,20 (д, J= 9 Гц, 1H, H-1).
д) 16-/(Ацетилокси)-метил/-20,20-/1,2-этандиилбис(окси)/- -3-метокси-14,17-этано-19-норпрегна-1,3,5(10),15-тетраен
1,475 г Описанного в примере 55г) соединения в 60 мл пиридина при температуре 0oC по каплям смешивают с 1,3 мл ацетилхлорида. После выдерживания 1,5 часа при комнатной температуре выливают в охлажденный льдом концентрированный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают последовательно концентрированным раствором гидрокарбоната натрия и раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают и концентрируют. Получают 1,85 г сырого соединения 55 д).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,97 (с, 3H, H-18); 1,33 (с, 3H, H-21); 2,09 (с, 3H, ацетат); 3,77 (с, 3H, 3-ОСH3); 3,92-4,12 (м, 4H, 2= -OCH2CH2O-); 4,74 и 4,82 (2д, J = 1,5 и 20 Гц, каждый 1H, 16-СH2); 5,95 (уш. с, 1H, H-15); 6,64 (д, J = 3 Гц, 1H, H-4); 6,72 (дд, J =9 и 3 Гц, 1H, H-2); 7,20 (д, J= 9 Гц, 1H, H-1).
е) 16-Метил-14,17-этано-19-норпрегна-4,15-диен-3, 20-дион
1,73 г Сырого соединения 55 д превращают согласно описанным в примерах 1г) и 1д) методикам. Получают 34 мг соединения 55е) и 92 мг описанного в примере 31 б) соединения.
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,96 (с, 3H, H-18); 1,77 (уш. с, 3H, 16-СH3); 2,17 (с, 3H, H-21); 5,62 (уш.с, 1H, H-15); 5,84 (уш.с, 1H, H-4).
Пример 56: 15β,16α -Диметил-14,17-этено-19-норпрегн-4- ен- 3,20-дион
а) Метиловый эфир 20,20-/1,2-этандиилбис(окси)/- 3-метокси-15 β -метил-14,17-этено-19-норпрегна-1,3,5(10)-триен- 16 α -карбоновой кислоты
К 30,47 г иодида меди-(1) в 420 мл диэтилового эфира при температуре 0oC прикапывают 200 мл 1,6 М раствора метиллития в диэтиловом эфире. После выдерживания в течение 30 минут при этой температуре разбавляют с помощью 500 мл тетрагидрофурана. После охлаждения до -50oC прикапывают раствор 7,0 г описанного в примере 55б) соединения в 200 мл тетрагидрофурана. После нагревания до 0oC выдерживают в течение 4-х часов при этой температуре. После добавления концентрированного раствора хлоради аммония при температуре -20oC реакционную смесь распределяют между водой и этилацетатом, органическую фазу промывают последовательно раствором аммиака, водой и концентрированным раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают, концентрируют и остаток хроматографируют на силикагеле с помощью смеси этилацетата с гексаном, получают 5,47 г соединения 56а).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,18 (д, J = 7 Гц, 3H, 15-СH3); 1,20 (с, 3H, H-18); 1,30 (с, 3H, H- 21); 3,14 (д, J= 5 Гц, 1H, H-16); 3,62 (с, 3H, СО2CH3); 3,78 (с, 3H, 3-ОСH3); 3,79-4,13 (м, 4H, 20-ОСH2CH2О-); 5,98 и 6,30 (2д, J= 6 Гц, каждый 1H, H-171 и H-172); 6,64 (д, J = 3 Гц, 1H, H-4); 6,72 (дд, J = 9 и 3 Гц, 1H, H-2); 7,20 (д, J = 9 Гц, 1H, H-1).
б) 15β,16α -Диметил-14,17-этено-19-норпрегн-4-ен-3,20- дион
2,0 г Описанного в примере 56а) соединения превращают согласно описанным в примерах 28в), 34а), 34б), 1г) и 1д) методикам. Получают 303 мг соединения 56б). [α]
1 H-ЯМР (дейтерированный хлороформ): δ (м.д.)= 0,88 и 1,05 (2д, J = 7 Гц, каждый 3H, 15-СH3, и 16-СH3); 1,04 (с, 3H, H-18); 2,14 (с, 3H, H-21) 5,85 (уш.с, 1H, H-4); 6,01 и 6,20 (2д, J = 6 Гц, каждый 1H, H-171 и H-172).
Пример 57: 15β,16α -Диметил-14,17-этано-19-норпрегн-4-ен-3,20-дион
1,48 г Описанного в примере 56а) соединения превращают согласно описанным в примерах 28в), 34а), 34б) 55в), 1г) и 1д) методикам.
Получают 223 мг соединения 57).
Т.пл. 212-214oC; [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) 0,97 и 1,01 (2д, J = 7 Гц, каждый 3H, 15-СH3 и 16-СH3); 1,08 (с, 3H, H-18); 2,09 (с, 3H, H-21); 5,82 (уш.с, 1H, H-4).
Пример 58: 2', 5' 15β,16β -тетрагидрофуро /3',4'; 15,16/-14,17-этено-19-норпрегн-4-ен-3, 20-дион,
a) 15β,16β -Дигидро-3-метокси/2H,5H/фуро/3', 4', 15,16/- 14,17-этено-19-норпрегна-1,3,5(10)-триен-2',5',20-трион
10,0 г Описанного в примере la) соединения и 10,0 малеинового ангидрида перемешивают в течение 18 часов в атмосфере аргона при температуре 95oC. После удаления избыточного малеинового ангидрида в высоком вакууме остаток кристаллизуют из диизопропилового эфира. Получают 9,8 г соединения 58а).
Т.пл. 186- 187oC (при разложении); [α]
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,00 (с, 3H, H-18); 2,35 (с, 3H, H-21); 3,57 и 4,47 (2д, J = 8 Гц, каждый 1H, H-15 и H-16); 3,79 (с, 3H, 3-ОСH3); 6,41 и 6,49 (2д, J = 6 Гц, каждый 1H, H-171 и H-172); 6,66 (д, J= 3 Гц, 1H, H-4); 6,73 (дд, J= 9 и 3 Гц, 1H, H-2); 7,18 (д, J = 9 Гц, 1H, H-1),
б) 20,20-/1,2-Этандиилбис(окси)/-14, 17-этено-19-норпрегна-1,3,5(10)-триен- 15α,16α -диметанол
5,45 г Описанного в примере 58а) соединения превращают согласно указанным в примерах 34г), 7в), 1в) и 28в) методикам. Получают 4,13 г сырого соединения 58б).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 1,01 (с, 3H, H-18); 1,42 (с, 3H, H-21): 3,48-3,58 и 3,60-3,69 (2м, каждый по 1H, CH2OH); 3,78 (с, 3H, 3-ОСH3); 3,93-4,10 (м, 6H, CH2OH и 20-ОСH2CH2О-); 5,96 и 6,04 (2д, J = 6 Гц, каждый 1H, H-171 и H- 172); 6,63 (д, J= 3 Гц, 1H, H-4); 6,72 (дд, J = 9 и 3 Гц, 1H, H-2); 7,19 (д, J = 9 Гц, 1H, H-1).
в) 20,20-/1,2-Этандиилбис(окси)/-3-метокси-2',5', 15β,16β -тетрагидрофуро/3',4': 15,16/-14,17-этено-19-норпрегна-1,3,5(10)-триен
4,1 г Описанного в примере 58б) соединения в смеси из 70 мл дихлорметана и 14 мл пиридина охлаждают до 0oC и по каплям смешивают в целом с 3,34 мл хлорангидрида метансульфокислоты. После перемешивания в течение трех часов при комнатной температуре реакционную смесь смешивают с концентрированным раствором гидрокарбоната натрия. Спустя 20 минут распределяют между водой и этилацетатом, органическую фазу промывают концентрированным раствором гидрокарбоната натрия и раствором хлорида натрия, сушат над сульфатом натрия, отфильтровывают, концентрируют и хроматографируют на силикагеле с помощью смеси этилацетата с гексаном. Получают 0,81 г соединения 58в).
Т.пл. 148-150oC; [α]
1H-ЯМР (дейтерированный хлороформ); δ (м.д.)= 1,19 (с, 3H, H-18); 1,30 (с, 3H, H-21); 3,34-3,83 (м, 4H, 15-СH2 и 16-СH2); 3,79 (с, 3H, 3-ОСH3); 3,85-4,08 (м, 4H, 20-ОСH2CH2О-); 6,12 и 6,18 (2д, J= 6 Гц, каждый, 1H, H-171 и H-172); 6,63 (д, J= 3 Гц, 1H, H-4); 6,72 (дд, J= 9 и 3 Гц, 1H, H-2); 7,21 (д, J = 9 Гц, 1H, H-1).
г) 2', 5', 15β,16β -Teтpaгидpoфуpo/3',4'; 15,16/- 14,17-этено-19-норпрегн-4-ен-3,20-дион
0,41 г Описанного в примере 58в) соединения превращают согласно описанным в примерах 1г) и 1д) методикам. Получают 0,23 г соединения 58г). Т.пл. 163- 165oC; [α]
1H-ЯМР (дейтерированный хлороформ) δ (м.д.) = 1,08 (с, 3H, H-18); 2,17 (с, 3H, H-21); 3,33-3,46 и 3,60-3,76 (2м, каждый 2H, 15-СH2 и 16-СH2); 5,88 (уш.с, 1H, H-4); 6,21 и 6,27 (2д, J = 6 Гц, каждый 1H, H-171 и H-172).
Пример 59: 2',5', 15β,16β-Тетрагидрофуро/3',4':15,16/-14, 17-этано-19-норпрегн-4-ен-3,20-дион
0,4 г Описанного в примере 58в) соединения превращают согласно указанным в примерах 55в), 1г) и 1д) методикам. Получают 0,234 г соединения 59).
Т.пл. 187-189oC; [α]
Пример 60: 14,17-Этано-18а-гомо-19-норпрегна-4,15-диен-3,20-дион
а) 3-Метокси-14,17-этано-18а-гомо-19-норпрегна-1,3,5(10)- тетраен-20-он
34,0 г 3-Метокси-15-метил-18а-гомоэстра-1,3,5(10), 15- тетраен-17-она (см. заявку на патент ФРГ А1 - 3710728) превращают согласно описанным в примерах 38а), 1а), 58а) и 18а) методикам и затем обрабатывают с помощью 2н раствора гидроксида натрия в тетрагидрофуране. 2,0 г Полученную дикарбоновую кислоту в виде сырого продукта растворяют в 20 мл пиридина, смешивают с 2,2 г тетраацетата свинца и нагревают в течение 10 часов при 70oC. После этого реакционную смесь вносят в 4 н соляную кислоту. Осадок отфильтровывают и хроматографируют на силикагеле с помощью смеси H-гексана с этилацетатом.
Получают 90 мг соединения 60а)
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,62 (т,J =7 Гц, 3H, H-18а); 2,25 (с, 3H, H-21); 3,78 (с, 3H, 3-ОСH3); 6,10 и 6,26 (2д, J = 6 Гц, каждый, 1H, H-15 и H-16); 6,65 (д, J= 3 Гц, 1H, H-4); 6,72 (дд, J = 9,3 Гц, 1H, H-2); 7,19 (д, J = 9 Гц, 1H, H-1).
б) 14,17-Этано-18а-гомо-19-норпрегна-4,15-диен-3,20-дион
115 мг Описанного в примере 60а) соединения превращают согласно описанным в примерах 1в), 1г) и 1д) методикам. Получают 18 мг соединения 60б).
1H-ЯМР (дейтерированный хлороформ): δ (м.д.) = 0,63 (т, J = 8 Гц, 3H, H-18а); 2,23 (с, 3H, H-21); 5,86 (уш.с, 1H, H-4); 6,03 и 6,24 (2д, J= 5 Гц, каждый 1H, H-15 и H-16).
| название | год | авторы | номер документа |
|---|---|---|---|
| 19,11-ПЕРЕКРЫТЫЕ МОСТИКАМИ 4-ЭСТРЕНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1993 |
|
RU2157814C2 |
| ГОРМОНАЛЬНЫЕ ИЛИ НЕГОРМОНАЛЬНЫЕ СТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ | 1999 |
|
RU2230071C2 |
| ИНГИБИТОРЫ ТРОМБИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2172741C2 |
| НОВЫЕ АКТИВАТОРЫ РАСТВОРИМОЙ ГУАНИЛАТЦИКЛАЗЫ И ИНГИБИТОРЫ ФОСФОДИЭСТЕРАЗЫ С ДВОЙНЫМ МЕХАНИЗМОМ ДЕЙСТВИЯ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2758373C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-(N-МЕТИЛ-N-ФЕНИЛ)АМИНОМЕТИЛ-ГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663483C1 |
| АЗОЛЗАМЕЩЕННОЕ СОЕДИНЕНИЕ ПИРИДИНА | 2017 |
|
RU2730498C2 |
| Способ получения замещенных 8-гидрокси-1,2,3,4,4a,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов | 2022 |
|
RU2785713C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2451681C2 |
| 2-ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2331638C2 |
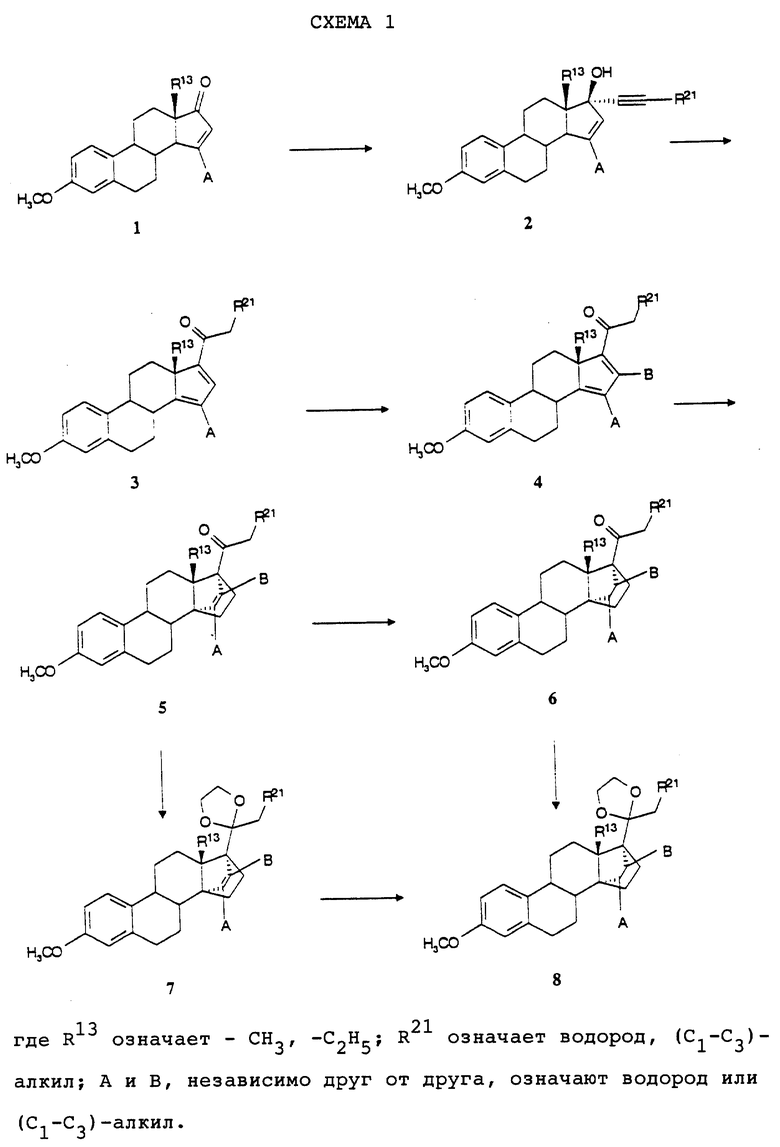
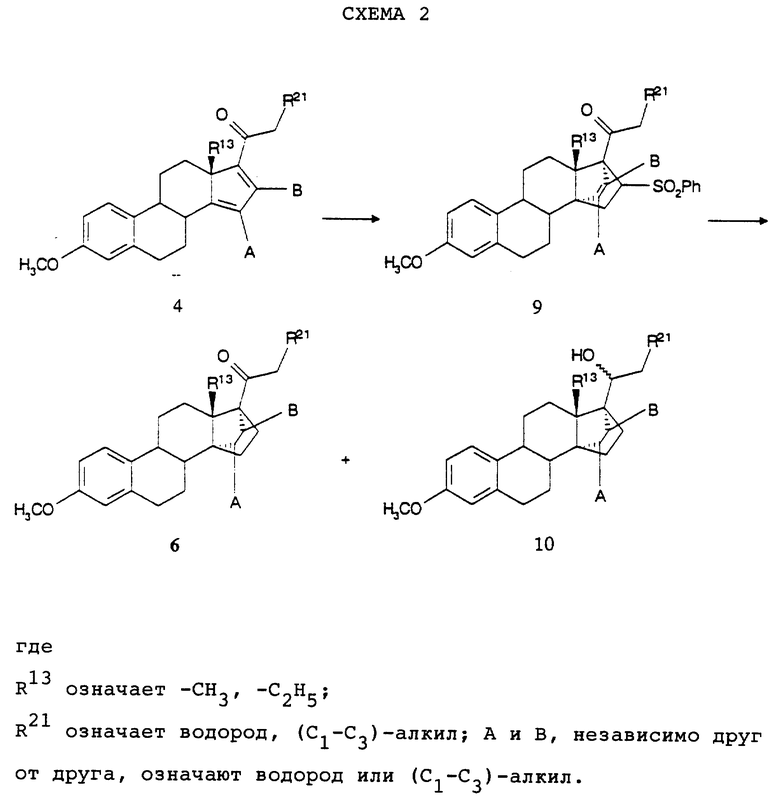
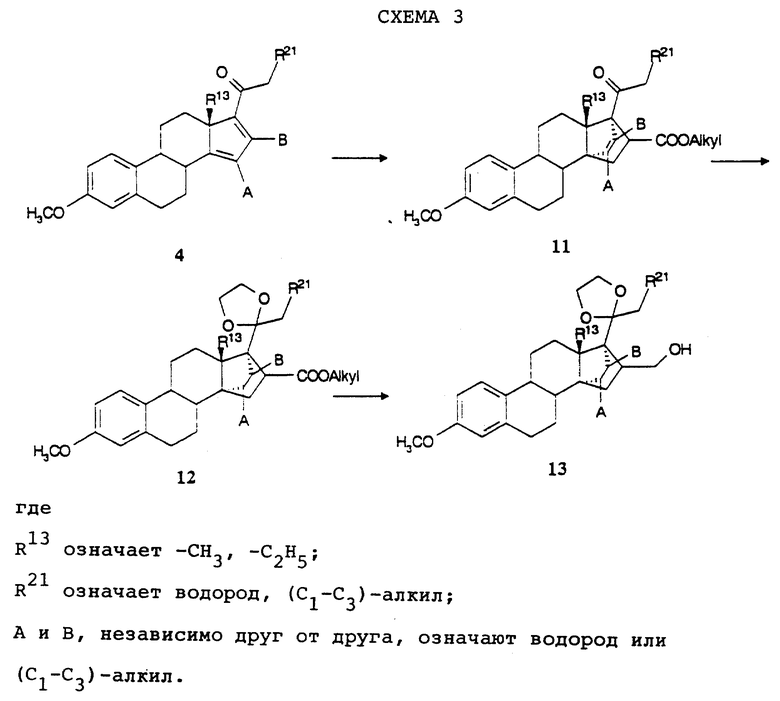
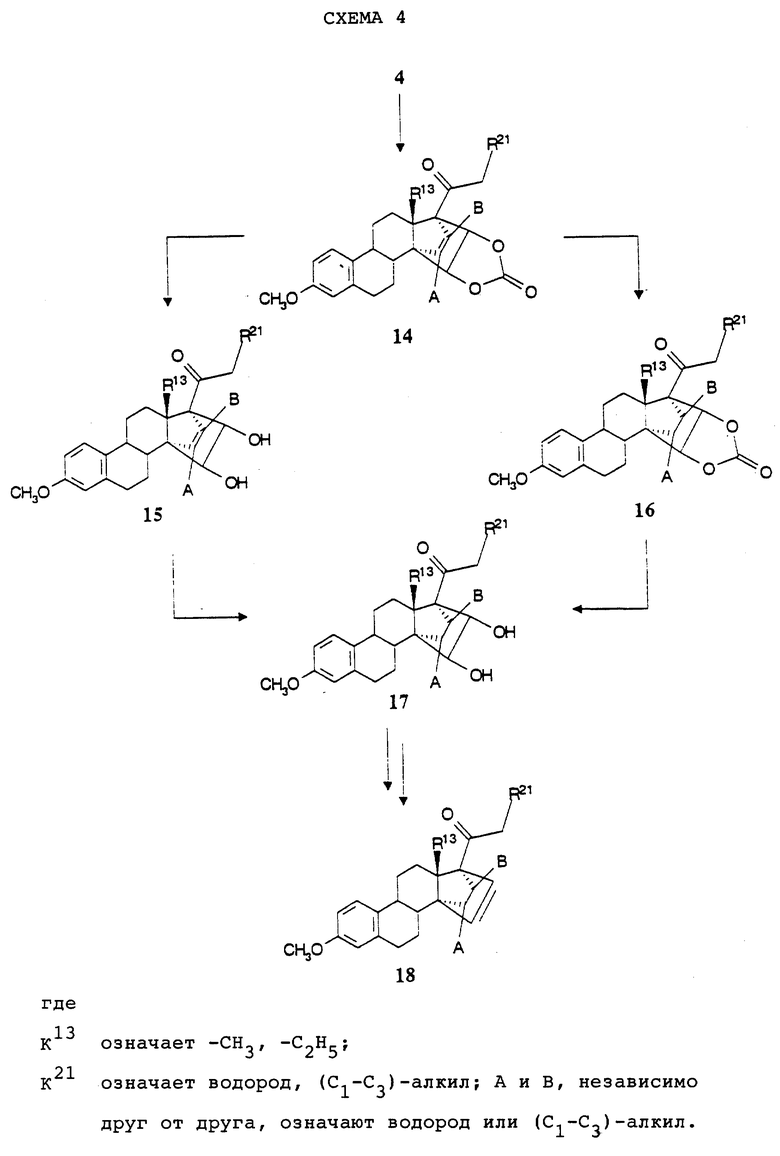
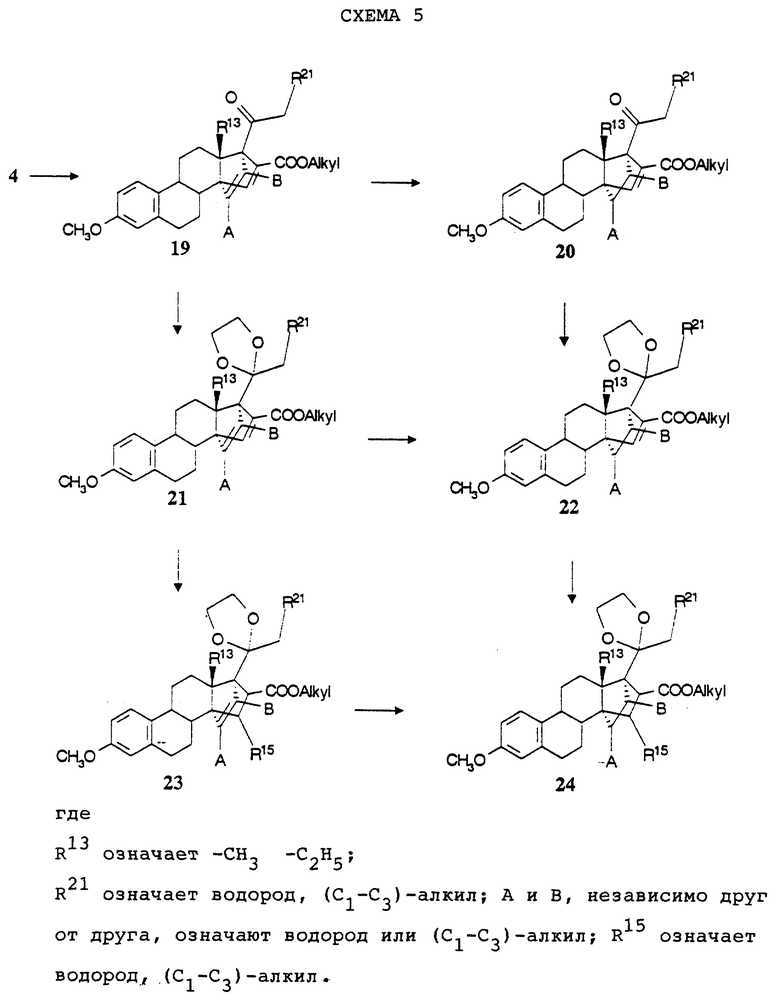
Изобретение относится к 14,17-C2-мостиковым стероидам формулы I, где R3 - O, R6 - H, α или β-(С1-С4)-алкил, причем тогда R6′ и R7 вместе образуют дополнительную связь; R7 - α- или β-(С1-С4)-алкил, причем тогда R6 и R6′- оба Н, или R9 и R10 каждый Н или вместе образуют связь, R11 и R12 каждый Н или вместе образуют связь, R13 - СН3 или С2H5; R15 - H или С1-С3-алкил; R16 и R16′ независимо Н, (С1-С3)-алкил или С1-С4-алкенил или вместе образуют (С1-С3)-алкилиден; R15 и R16 вместе образуют цикл 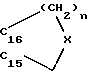 где n = 1, а Х - О и R16 - Н,
где n = 1, а Х - О и R16 - Н, 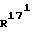 - H, (С1-С3)-алкил,
- H, (С1-С3)-алкил, 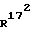 - H, (С1-С3)-алкил,
- H, (С1-С3)-алкил, 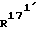 и
и 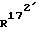 каждый Н или вместе образуют связь, R21 - H или (С1-С3)-алкил, R21′ - H, (С1-С3)-алкил или ОН; за исключением 14,17-этано-19-норпрегн-4-ен-3,20-диона. Соединения проявляют очень высокую гестагенную активность, а также оказывают воздействие на другие стероидные рецепторы, что используется в фармацевтических препаратах. 2 с. и 9 з.п.ф-лы.
каждый Н или вместе образуют связь, R21 - H или (С1-С3)-алкил, R21′ - H, (С1-С3)-алкил или ОН; за исключением 14,17-этано-19-норпрегн-4-ен-3,20-диона. Соединения проявляют очень высокую гестагенную активность, а также оказывают воздействие на другие стероидные рецепторы, что используется в фармацевтических препаратах. 2 с. и 9 з.п.ф-лы.
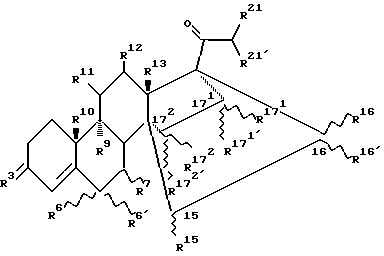 (I)
(I)
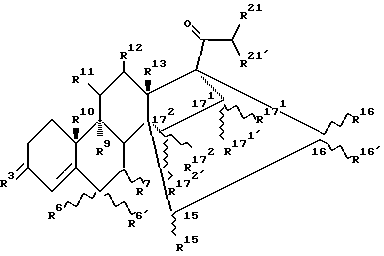
где R3 означает атом кислорода;
R6 означает атом водорода или находящийся в α- или β-положении (C1-C4)-алкильный остаток, причем тогда R6′ и R7 представляет собой атомы водорода, или R6 означает атом водорода или (C1-C4)-алкильный остаток, причем тогда R6′ и R7 вместе образуют дополнительную связь;
R7 означает находящийся в α- или β-положении постоянном (C1-C4)-алкильный остаток, причем тогда R6 и R6′ представляют собой атомы водорода, или
R9 и R10 каждый означают атом водорода или вместе образуют связь;
R11 и R12 каждый означают атом водорода или вместе образуют связь;
R13 означает метильную или этильную группу;
R15 означает атом водорода или (C1-C3)-алкильный остаток;
R16 и R16′ независимо друг от друга означают атом водорода, (C1-C3)-алкильный остаток или (C2-C4)-алкенильный остаток или вместе означают (C1-C3)-алкилиденовую группу;
R15 и R16 вместе образуют связь, а также R16 означает атом водорода или (C1-C3)-алкильный остаток, или R15 и R16 вместе образуют цикл частичной формулы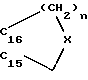
где n = 1, а Х означает атом кислорода, а также R16 означает атом водорода;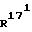 означает атом водорода или (C1-C3)-алкильный остаток;
означает атом водорода или (C1-C3)-алкильный остаток;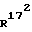 означает атом водорода, (C1-C3)-алкильный остаток;
означает атом водорода, (C1-C3)-алкильный остаток;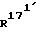 и
и 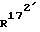 каждый означает атом водорода или вместе образуют связь;
каждый означает атом водорода или вместе образуют связь;
R21 означает атом водорода или (C1-C3)-алкильный остаток;
R21′ означает атом водорода, (C1-C3)-алкильный остаток или гидроксильную группу;
за исключением соединения 14,17-этано-19-норпрегн-4-ен-3,20-дион.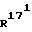 означает атом водорода или (C1-C3)-алкильный остаток, а
означает атом водорода или (C1-C3)-алкильный остаток, а 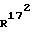 означает атом водорода, (C1-C3)-алкильный остаток или (C2-C4)-алкенильный остаток, и
означает атом водорода, (C1-C3)-алкильный остаток или (C2-C4)-алкенильный остаток, и 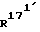 и
и 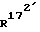 каждый означают атом водорода или вместе образуют дополнительную связь.
каждый означают атом водорода или вместе образуют дополнительную связь.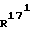 ,
, 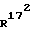 , R21 и/или R21′ означает метильный или этильный остаток.
, R21 и/или R21′ означает метильный или этильный остаток.
14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
14,17-этано-19-норпрегна-4,6,15-триен-3,20-дион;
14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4-ен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
21-метил-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион;
4,17-этено-19-норпрегн-4-ен-3,20-дион, пример 1д;
14,17-этено-19-норпрегна-4,6-диен-3,20-дион, пример 2б;
21-метил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
21-метил-14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
21-метил-14,17-этено-19-норпрегна-4,9,11-триен-3,20-дион;
21-гидрокси-14,17-этено-19-норпрегн-4-ен-3,20-дион, пример 5ж, стр. 46-47;
21-гидрокси-14,17-этено-19-норпрегна-4,9-диен-3,20-дион, пример 6б, стр. 47;
171-метил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
171-метил-14,17-этено-19-норпрегна-4,6-диен-3,20-дион;
172-метил-14,17-этено-19-норпрегн-4-ен-3,20-дион, пример 38г, стр. 82;
172-метил-14,17-этено-19-норпрегна-4,9-диен-3,20-дион;
15β, 16α-диметил-14,17-этено-19-норпрегн-4-ен-3,20-дион;
6-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
6α-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
15β, 16α-диметил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16α-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16α-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
16α-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
16α,21-диметил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-16-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16α-этил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16α-этенил-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16-метил-14,17-этано-19-норпрегна-4,15-диен-3,20-дион;
(171R)-171-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион, пример 12в, стр. 57;
(171S)-171-метил-14,17-этано-19-норпрегн-4-ен-3,20-дион, пример 13, стр. 57;
(171R)-171-метил-14,17-этано-19-норпрегн-4,9-диен-3,20-дион, пример 14, данные стр. 58;
(171S)-171-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион, пример 15, данные стр. 58;
(172R)-172-метил-14,17-этано-19-норпрегна-4-ен-3,20-дион;
(172R)-172-метил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
(172R)-172-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(172R)-172,21-диметил-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
(172R)-172,21-диметил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(172R)-172,21-диметил-14,17-этано-19-норпрегна-4,9,11-триен-3,20-дион;
16-метилен-14,17-этано-19-норпрегн-4-ен-3,20-дион;
16-метилен-14,17-этано-19-норпрегна-4,6-диен-3,20-дион;
16-метилен-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегн-4-ен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
21-гидрокси-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион, пример 49б, стр. 90;
(21R)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9-диен-3,20-дион, пример 27, данные стр. 67 (середина);
(21R)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион;
(21S)-21-гидрокси-21-метил-14,17-этано-19-норпрегна-4,9,15-триен-3,20-дион, пример 54, данные стр. 93;
14,17-этано-18а-гомо-19-норпрегн-4-ен-3,20-дион;
14,17-этано-18а-гомо-19-норпрегна-4,15-диен-3,20-дион.
| Шланговое соединение | 0 |
|
SU88A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| A.J.Solo, J.N.Kapoor J.Med | |||
| Chem | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2001-06-20—Публикация
1995-12-23—Подача