Настоящее изобретение относится к 19,11-перекрытым мостиками эстренам общей формулы I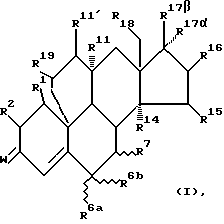
где W обозначает атом кислорода, оксииминогруппу 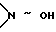 или два атома водорода,
или два атома водорода,
R1 и R2 каждый обозначает атом водорода или вместе дополнительную связь или в α-положении метиленовый мостик,
R6a и R6b обозначают каждый атом водорода или вместе метиленовую группу или образованное вместе с атомом углерода 6 трехчленное кольцо, причем R7 в этих случаях обозначает атом водорода или
R6a обозначает атом водорода или атом фтора, хлора, брома или йода или обозначает насыщенный в α- или β-положении стоящий алкильный остаток с прямой или разветвленной цепью с количеством атомов углерода до 4, причем в этом случае R6b и R7 представляют каждый атом водорода или вместе дополнительную связь, или
R6b и R7 обозначают вместе в α- или β-положении метиленовый мостик, причем R6a представляет в этом случае атом водорода,
R7 обозначает насыщенный стоящий в α- или β-положении алкильный остаток с прямой или разветвленной цепью с количеством атомов углерода до 4 или обозначает тиогруппу -SR20, где R20 представляет атом водорода или группу алканоила с 1-4 атомами углерода,
R14, R15 и R16 обозначают каждый атом водорода или
R14 обозначает в α-положении находящийся атом водорода и R15 и R16 обозначают вместе дополнительную связь или в α- или β-положении стоящий метиленовый мостик, или R14 и R15 обозначают каждый атом водорода и R16 обозначает в α- или β-положении стоящую C1-C4-алкильную группу или R16 вместе с R17α обозначают в α-положении метиленовый мостик и R17β обозначает группу 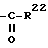 ,
,
R16 обозначает атом водорода и R14 и R15 обозначают вместе дополнительную связь,
R11, R11′ и R19 обозначают каждый атом водорода или R11 обозначает в α-положении атом водорода и R11′ и R19 обозначают вместе дополнительную связь или R19 обозначает атом водорода и R11 и R11′ обозначают вместе дополнительную связь,
R17β/R17α обозначают
-OR21/-(CH2)n-A
-OR21/-(CH2)m-C≡C-B
-OR21/-(CH2)p -CH=CH-(CH2)k-D
-OR21/-HC=C=CEG
-OR21/-CF3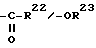
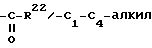
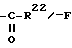
или R17β/R17α обозначают вместе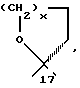
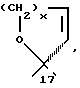
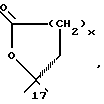

c x = 1 или 2, с U=0 или 
c R21 и R23 в значении атома водорода, группы С1-С4-алкила или группы C1-C4-алканоила,
R22 - в значении группы C1-C3-алкила,
А - в значении атома водорода, группы циано, -COOR24 или -OR25, причем R24 обозначает C1-C4-алкил и R25 обозначает водород, C1-C4-алкил или C1-C4-алканоил,
B - в значении атома водорода, группы C1-C4-алкила, группы C2- или C3-алкинила, атома фтора, хлора, брома или йода, группы оксиалкила, алкоксиалкила или алканоилоксиалкила соответственно с 1-4 атомами углерода в части алкил-, алкокси- или алканоилокси,
D - в значении атома водорода, окси-, C1-C4-алкокси- или C1-C4-алканоилоксигруппы,
E и G - в значении водорода или C1-C3-алкила,
n - в значении 0, 1, 2, 3 или 4,
m - в значении 0, 1 или 2,
p - в значении 0 или 1,
k - в значении 0, 1, 2 или 3 и
R18 обозначает атом водорода или группу метила.
Согласно настоящему изобретению предпочтительными являются такие соединения общей формулы I, в которых
W обозначает атом кислорода или два атома водорода,
R6a и R6b каждый обозначает атом водорода или обозначают вместе образованное с атомом углерода 6 трехчленное кольцо,
или
R6a обозначает атом хлора или атом брома или насыщенный в α- или β-положении C1-C4-алкильный остаток с прямой цепью, или
R6b и R7 обозначают вместо в β-положении метиленовый мостик или обозначают вместе дополнительную двойную связь, или
R7 обозначает насыщенный в α- или β-положении алкильный остаток с прямой или разветвленной цепью с количеством атомов углерода до 4,
R14, R15 и R16 обозначают каждый атом водорода или
R14 обозначает в α-положении атом водорода и
R15 и R16 обозначают вместе дополнительную связь в α- или в β-положении метиленовый мостик,
R17β/R17α обозначает -OH/-CH3,
-OC(O)CH3/-CH3;
-OH/-C≡CH,
-OC(O)CH3/-C=CH;
-OH/-C≡C-CH3,
-OC(O)CH3/-C≡C-CH3,
-C(O)CH3/-OC(O)CH3;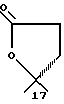
и другие заместители могут иметь все указанные в формуле I значения.
Особенно предпочтительными являются названные ниже соединения:
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11]- 19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11] - 19-норпрегн-4,6-диен-3,20-дион;
17-(ацетилокси)-9,11 α -дигидро-6-метил-6'H-бензо [10,9,11] -19-норпрегн-4,6-диен-3,20-дион;
17-(ацетилокси)-9,11 α -дигидро-6 α -метил-6'H-бензо[10,9,11]- 19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-6-хлор-9,11 α -дигидро-6'H-бензо [10,9,11] -19-норпрегн-4,6-диен-3,20-дион;
17-(ацетилокси)-6-хлор-1 β ,2 β ,9,11 α -тетрагидро- 3'H-циклопропа[1,2] [6''H]бензо-[10,9,11]-19-норпрегн-4,6-диен- 3,20-дион;
17-(ацетилокси)-4', 5', 9,11 α -тетрагидро-6'H-бензо [10,9,11]-19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-6-метил-4', 5',9,11 α -тетрагидро-6'H-бензо- [10,9,11]-19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-6-хлор-1 β , 2 β ,4'',5'',9,11 α - гексагидро-3'H-циклопропа[1,2][6''H]бензо-[10,9,11]- 19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-5', 6'-дигидро-9H-бензо[10,9,11)-19-норпрегн-4- ен-3,20-дион;
17-(ацетилокси)-5', 6'-дигидро-6-метил-9H-бензо[10,9,11] - 19-норпрегн-4,6-диен-3,20-дион;
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11] - 18a-гомо-19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-9,11 α -дигидро-6-метил-6'H-бензо [10,9,11]]-18a-гомо-19-норпрегна-4,6-диен-3,20-дион;
9,11 α -дигидро-17-метил-6'H-бензо[10,9,11]-19- норпрегн-4-ен-3,20-дион;
3', 9,11 α 16 β -тетрагидроциклопропа[16,17][6H]бензо [10,9,11]-19-норпрегн-4-ен-3,20-дион;
9,11 α -дигидро-17-метил-6'H-бензо[10,9,11] -18a-гомо- 19-норпрегн-4-ен-3,20-дион;
3', 9,11 α ,16 β -тетрагидроциклопропа[16,17][6H]бензо [10,9,11]-18a-гомо-19-норпрегн-4-ен-3,20-дион;
9,11 α -дигидро-17 β окси-17 α -метил-6'H-бензо [10,9,11]эстр-4-ен-3-он;
9,11 α -дигидро-17 α -этинил- 17 β -окси-6'H-бензо [10,9,11]-эстр-4-ен-3-он;
9,11 α дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо- [10,9,11]эстр-4-ен-3-он;
9,11 α -дигидро-17 β -гидрокси-17 α -(1,3- пентадиинил)-6'H-бензо[10,9,11]эстр-4-ен-3-он;
(Z)-9,11 α -дигидро-17 β окси-17 α -(3-окси-1- пропенил)-6'H-бензо[10,9,11]эстр-4-ен-3-он;
9,11 α дигидро-17 β окси-17 α -(3-оксипропил)-6'H-бензо- [10,9,11] эстр-4-ен-3-он;
17 β -окси-17 α -метил-4',5',9,11 α -тетрагидро-6'H-бензо- [10,9,11] эстр-4-ен-3-он;
17 α -этинил-17 β -окси-4',5',9,11 α -тетрагидро-6'H-бeнзо- [10,9,11] эстр-4-ен-3-он;
17 β -окси-17 α -(1-пропинил)-4', 5', 9,11 α -тетрагидро-6'H-бензо[10,9,11]эстр-4-ен-3-он;
5',6'-дигидро-17 α -этинил-17 β -окси-9H-бензо [10,9,11]эстр-4-ен-3-он;
5', 6'-дигидро-17 β -окси-17α -(1-пропинил)-9H-бензо [10,9,11]эстр-4-ен-3-он;
9,11 α -дигидро-17 α -этинил-17 β -окси-6'H-бензо [10,9,11]-18a-гомоэстр-4-ен-3-он;
9,11 α-дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо [10,9,11]18a-гомоэстр-4-ен-3-он;
17 α -(1-бутинил)-9,11 α -дигидро-17 β окси-6'H-бензо [10,9,11]-18a-гомоэстр-4-ен-3-он;
9,11 α -дигидро-17 α -(1,2-пропадиенил)-17 β -окси-6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он;
17 α -этинил-17 β -окси-4',5',9,11 α тетрагидро-6' H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он;
17 β -окси-17 α -(1-пропинил)-4', 5', 9,11 α -тетрагидро-6'H-бензо [10,9,11]-l8a-гомоэстр-4-ен-3-он;
5', 6'-дигидро-17 α -этинил-17 β -окси-9H-бензо[10,9,11]-18a- гомоэстр-4-ен-3-он;
5, '6'-дигидро-17 β окси-17 α -(1-пропинил)-9H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он;
9,11 α-дигидро-17 α этинил-17 β -окси-6'H-бензо[10,9,11] эстр-4,15-диен-3-он;
9,11α-дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо [10,9,11]эстра-4,15-диен-3-он;
17 α -этинил-17 β -окси-4',5',9,11 α -теграгидро- 6'H-бензо-[10,9,11] эстра-4,15-диен-3-он;
5', 6'-дигидро-17 α -этинил-17 β -окси-9H-бензо[10,9,11] эстра-4,15-диен-3-он;
5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H-бензо[10,9,11]эстра-4,15-диен-3-он;
9,11 α -дигидро-17 α -этинил-17 β -окси-6'H-бензо [10,9,11]-18a-гомоэстра-4,15-диен-3-он;
9,11 α-дигидpo-17 β -oкси-17 α -(1-пpoпинил)-6'H-бензo [10,9,11]-18a-гомоэстра-4,15-диен-3-он;
17 α -этинил-17 β -окси-4',5',9,11 α -тетрагидро-6'H-бензо- [10,9,11]-18a-гомоэстра-4,15-диен-3-он;
5', 6'-дигидро-17 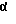 этинил-17 β -окси-9H-бензо[10,9,11-18a- гомоэстра-4,15-диен-3-он;
этинил-17 β -окси-9H-бензо[10,9,11-18a- гомоэстра-4,15-диен-3-он;
5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо[10,9,11]-18a-гомоэстра-4,15-диен-3-он;
4'', 5'', 9,11 α -тетрагидроспиро[6'H-бензо [10,9,11]эстр-4-ен-17 β , 2''(3''H)-фуран)-3-он;
3'', 4'', 9,11 α -тетрагидроспиро[6'H-бензо[10,9,11] эстр-4- ен-17 β, 2''(5''H)-фуран]3,5''-дион;
3'''', 4'''', 6 α ,7 α ,9,11 α ,15 α ,16 α - октагидроспиро[3'H,3''H-дициклопропа[6,7: 15,16] - [6H]бензо[10,9,11]эстр-4-ен-17 β, 2''''(5''''H)-фуран]-3,5''''- дион;
3'''',4'''',9',11' α ,15'α,16' α - гексагидроспиро[циклопропан-1,6'-[3H] -циклопропан-[15,16] [6H]бензо[10,9,11]эстр-4-ен-17' β, 2''''(5'''')-фуран] -3',5''''-дион;
3'''', 4'''', 9', 11 α ,15' α ,16' α -гексагидроспиро [циклопропан-1,6'-[3H] циклопропа[15,16] -[6H] бензо[10, 9,11] эстра-1,4-диен-17' β, 2''''(5''''H)-фуран-3',5''''-дион;
3'''',4''',4'''',5''',6 α ,7 α ,9,11 α ,15 α ,16 α -декагидроспиро-[3'H, 3''H-дициклопропа-[6,7:15,16][6H]бензо[10,9,11] эстр-4-ен-17 β , 2''''(5''''H)-фуран-3,5''''-дион;
3'', 4'', 9,11 α -тетрагидроспиро[6'H]-бензо[10,9,11]-18a- гомоэстр-4-ен-17 β ,2''(5'')-фуран]-3,5''-дион;
3'''', 4'''',6 α ,7 α ,9,11 α ,15 α ,16 α октагидроспиро [3',H,3''H]-дициклопропа[6,7: 15,16] [6H] -бензо[10,9,11] - 18a-гомоэстра-4-ен-17 β , 2''''(5''''H)-фуран]-3,5''''-дион;
9,11 α -дигидро-17 α -этинил-H'6-бензо [10,9,11]эстр-4-eн-17 α -ол;
17 α -этинил-4',5',9,11 α -тетрагидро-6'H-бензо [10,9,11]эстр-
4-ен-17 β -ол;
5',6'-дигидро-17 α -этинил-9H-бензо[10,9,11]эстр-4-ен- 17 β -ол;
9,11 α -дигидро-17 α -этинил-6'H-бензо[10,9,11]эстр- 4,15-диен-17β-ол;
9,11 α -дигидро-17 α -этинил-6'H-бензо[10,9,11] -18a-гомоэстр-4-ен-17 β -ол;
9,11 α -дигидро-17 α -этинил-6'H-бензо [10,9,11]-18a-гомоэстр-4,15-диен-17β-ол.
9,11 β -перекрытые мостиками стероиды как наиболее близкие по структуре предложенным соединениям описаны впервые в заявке на патент ФРГ 3708942 (EP-A 10283428). Однако известные соединения в отличие от обсуждаемых здесь соединений не имеют никакого этено- или этаномостика между C11 и C19; там оба атома углерода перекрыты мостиком через два соседних атома углерода замещенного обычно фениленового кольца. Как известные, так и описанные здесь соединения отличаются исключительно высоким сродством к гестагенному рецептору.
В тесте связывания гестагенного рецептора с применением цитозола из гомогената матки кролика и 3H-прогеcтерона в качестве исходного вещества новые соединения показывают очень сильное сродство к гестагенному рецептору и высокую эффективность в тесте сохранения беременности у крысы после подкожного введения.
В табл. 1 указаны факторы конкуренции (KF) в тесте связи гестагенного рецептора. Фактор конкуренции KF в качестве критерия для силы связи определен как отношение концентрации испытываемого вещества к концентрации вещества-этанола (прогестерон), при которой оба соединения показывают одинаковое по величине вытеснение 3H-прогестерона из комплекса прогестерона-рецептора, так как низкая величина KF показывает большую силу связи (высокое сродство) (табл. 1).
Но в то время как такое сильное связывание у известных соединений приводит в первую очередь к ярко выраженной конкурентной прогестерон-антагонистической активности, и, следовательно, эти соединения можно применять в первую очередь для абортов, против гормональных нарушений, при менструациях и при начале родов, соединения по изобретению неожиданно отличаются сильной агонистической, т.е. гестагенной, активностью.
Гестагенное действие в известном тесте сохранения беременности у крысы определяли после подкожного введения соединений. Результаты обобщены в табл. 2.
Следовательно, соединения общей формулы I по изобретению имеют очень сильную гестагенную эффективность только при слабой андрогенной или даже слабо антиандрогенной активности (диссоциация).
На основании своей гестагенной эффективности новые соединения общей формулы I можно применять одни или в комбинации с эстрогеном в препаратах для контрацепции.
Дозировка соединений по изобретению в контрацепционных препаратах должна составлять преимущественно от 0,01 до 2 мг на 1 день.
Гестагенные и эстрогенные компоненты активного вещества в контрацепционных препаратах назначают вместе орально. Ежедневная доза преимущественно одноразовая.
В качестве эстрогенов применяют преимущественно синтетические эстрогены как этинилэстрадиол, 14 α ,17 α -этано-1,3,5(10)-эстратриен- 3,17 β -диол (WO 88/01275) или 14 α ,17 α -этано- 1,3,5(10)-эстратриен-3,16 α ,17 β -триол (WO 91/08219).
Эстроген назначают в количестве, которое соответствует количеству от 0,01 до 0,05 мг этинилэстрадиола.
Новые соединения общей формулы I можно применять также в препаратах для лечения гинекологических нарушений и для заместительной терапии. Благодаря их благоприятному спектру действия соединения по изобретению особенно хорошо пригодны для лечения предменструальных болей, как головные боли, депрессивные дурные настроения, задержка воды и мастодиния. Суточная доза при лечении предменструальных болей составляет около 1-20 мг.
Получение фармацевтических препаратов на основе новых соединений осуществляют известным образом, причем активное вещество в случае необходимости в комбинации с эстрогеном с обычными галеновыми веществами-носителями, с растворителями, в случае необходимости с веществами, корригирующими неприятный вкус лекарства, и т.д. обрабатывают и переводят в желательную форму применения.
Для предпочтительного орального введения применяют, в частности, таблетки, драже, капсулы, пилюли, суспензии или растворы.
Для парентерального введения применяют, в частности, масляные растворы, как, например, растворы в кунжутном масле, касторовом масло и в хлопковом масле. Для повышения растворимости можно добавлять агенты растворения, как, например, бензилбензоат или бензиловый спирт.
Можно также включать вещества по изобретению в подкожную систему и тем самым вводить их под кожу.
Наконец, можно использовать новые соединения также в качестве гестагенных компонентов в ставших недавно известными составах для контроля способности женщин производить потомство, которые отличаются дополнительным применением конкурентного прогестеронантагониста (H.B. Croxatto и A.M. Salvatierra в Female Contraception and Male Fertility Regulation, ed. by Runnebaum, Rabe & Kiesel, том 2, Advances in Gynecological and Obstetric Research Series, Parthenon Publishing Group, 1991, стр. 245).
Дозировка лежит в уже указанной области, приготовление состава можно осуществлять как при обычных OC-препаратах. При этом применение дополнительного конкурентного прогестерон-антагониста можно осуществлять также последовательно.
Новые соединения общей формулы I получают по способу изобретения в результате того, что соединение общей формулы II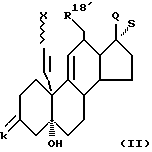
где k обозначает защитную кето- или оксигруппу и атом водорода,
X обозначает находящийся в син- или анти-положении атом хлора или брома,
R18 обозначает атом водорода или группу метила,
Q обозначает оксигруппу в β-положении и S обозначает атом водорода в α-положении, или Q и S обозначают вместе кетонный атом кислорода, или, кроме того, обозначают одну из названных в формуле I R17β/R17α - комбинаций заместителей, включая спиросоединения, причем имеющиеся в них оксигруппы и/или кетогруппы в случае необходимости защищены,
a) радикальной циклизацией переводят в соединение общей формулы III
где k, R18 и Q и S имеют указанное в формуле II значение,
b) затем, если Q обозначает оксигруппу, последнюю по желанию окисляют,
c) если R11, R11′ и R19 в конце должны представлять атом водорода, 19,11 β - этеномостик гидрируют, или
d) если R19 в конце должен обозначать атом водорода и R11 и R11′ вместе должны обозначать дополнительную двойную связь, двойную связь в 19,11 β -этеномостике подвергают изомеризации в 11-положение (экзо-положение),
e) по желанию вводят в D-кольцо 15,16-двойную связь и эту связь
f) по желанию изомеризируют в 14,15-положение или
g) метиленируют в соответствующее 15 β ,16 β - метиленовое соединение и
h) если Q и S вместе обозначают атом кислорода кетогруппы, превращают нуклеофильным присоединением заместителя R17α или его реакционноспособного предшественника и при необходимости этерификацией с образованием простого или сложного эфира по 17 β -оксигруппе с соответствующим реагентом, вводящим остаток R21, или синтезируют образец замещения 17 α -окси-17 β -алканоила, и 17  - оксигруппу в случае необходимости подвергают этерификации c образованием простого или сложного эфира при помощи соответствующего дающего остаток R23 реактива,
- оксигруппу в случае необходимости подвергают этерификации c образованием простого или сложного эфира при помощи соответствующего дающего остаток R23 реактива,
i) в случае необходимости частичным или полным гидрированием ненасыщенной C17-боковой цепи и
j) по желанию окислением соответствующего 17-(3-оксипропил)- или 17-(4-оксибутил)- соединения для образования 17-спиролактона или
k) по желанию реакцией циклизации соответствующего (Z)-17α-(3- оксипроп-1-енил)- или (Z)-17 α -(4-окси-бут-1-енил)-17 β -оксисоединения или соответствующих насыщенных в боковой цепи соединений для образования простого спироэфира и
l) обработкой кислотой в смешиваемом с водой растворителе переводят в кетосистему, причем другие имеющиеся защитные группы также отщепляют, и этим переводят в соединение общей формулы I, и это соединение общей формулы I в случае необходимости превращают
m) введением 1,2- и/или 6,7-двойной связи в случае необходимости метиленированием одной или обоих двойных связей,
n) введением находящегося в α- или β-положении алкильного остатка с прямой или разветвленной цепью или тиогруппы SR20 - в 7-положении,
o) эпоксидированием 6,7-двойной связи с раскрытием эпоксида с галоидным водородом (Hal = F, Cl, Br, I) и удалением образованной 7 α -оксигруппы,
p) 6 α -оксиметилированием и последующим отщеплением воды для 6-метиленового соединения,
q) изомеризацией стоящей в экзо-положении двойной связи группы 6-метилена или прямым введением группы 6-алкила (6- алкил-4,6-диен-3-он),
r) гидрированием группы 6-метилена превращают соединение общей формулы I,
где R1, R2, R14, R15, R16, R17α,, R17β, R18, R11 и R19 имеют желаемое значение,
и R6a представляет группу α -метила и R6b и R7 представляют каждый атом водорода или вместе представляют дополнительную связь,
или
s) если R6a должен представлять насыщенный находящийся в α- или β-положении алкильный остаток с прямой или разветвленной цепью с количеством атомов углерода до 4, превращают катализацией при одновременной изомеризации 4 (5)-двойной связи в 5(6), эпоксидированием 5 (6)-двойной связи и нуклеофильным раскрытием 5,6 α -эпоксида с защищенной 3-кетогруппой подвергают превращенное с насыщенным алкилмагнийгалогенидом или алкиллитийсоединением с прямой или разветвленной цепью с количеством атомов углерода до 4 в алкильном остатке и расщеплением защитной 3-кетогруппы в образованном соединении 5 α - окси-6 β -алкила при мягких кислых условиях в соответствующее 3-кето-5 α -окси-6 β -алкилсоединение и удалением при помощи основания 5 α -оксигруппы переводят в соответствующее 3- кето-4-ен-соединение общей формулы I с находящейся в β -положении 6-алкильной группой или отщеплением защитной 3-кетогруппы при жестких условиях переводят в соответствующее 3-кето-4-ен-соединение общей формулы I с находящейся в α -положении группой 6-алкила и
t) в случае необходимости одно из полученных выше 3- кетосоединений превращают с гидроксиламингидрохлоридом в присутствии третичных аминов при температуре между -20 и +40oC в 3-оксииминосоединение (W=>N~OH; обозначает син- или антиположение OH) или
u) в случае необходимости превращают в 3-тиокеталь, преимущественно 3-(1', 3'-этилендитио)-кеталь, и последний расщепляют восстановлением до соединения общей формулы I, где W обозначает два атома водорода.
Механизм синтеза соединений, содержащих новый вид мостика, показан на схеме 1 (см. в конце описания).
Согласно схеме 1 описанный, например, в eвропейских заявках на патенты 0110434 и 0127864 эпоксид I, в котором R18 обозначает атом водорода или группу метила и K обозначает защитную группу кеталя, раскрытием с пропаргилмагнийгалогенидами (получение см. "Синтезы ацетиленов, алленов и кумуленов", Z. Brandsma и H.D.Verkruijsse, стр. 16, Elsevier Scientific Publishing Company, Амстердам, Оксфорд, Нью-Йорк (1981) переводят в соединение формулы 2. K обозначает уходящую защитную группу кеталя, например этилендиокси- или 2,2-диметилпропилен-1,3-диоксигруппу. Используют также другие распространенные защитные группы кеталя. K может обозначать также защищенную оксигруппу и атом водорода, причем оксигруппа в этом случае защищена, например, в виде простого метоксиметилового, метоксиэтилового, тетраоксипиранилового или силилового эфира. Отщеплением защитной группы и окислением свободной оксигруппы получают кетогруппу.
Затем соединение 2 по известному способу бромируют на конце тройной связи (H.Hofmeister, K.Annen, H.Laurent и R.Wiechert, Angew. Chem. 96, стр. 720 (1984)). Потом полученное соединение 3 гидрированием или переносом гидрида переводят в винилгалогенид 4. Преимущественно реакцию осуществляют восстановлением диимида.
Радикальную циклизацию соединения 4 осуществляют аналогично уже неоднократно описанной циклизации соответствующих арилгалогенированний (см. B.E. Ottow, G.Neef и R.Wiechеrt; Angew. Chem. 101, стр. 776 (1989)). Из возможных способов для образования промежуточных радикалов здесь применяют, в частности, два:
реакцию с триалкилстаннанами, преимущественно с трибутилоловогидридом, в подходящих растворителях, как, например, толуол, или превращение с литием в жидком аммиаке, смешанном с органическим растворителем, как, например, тетрагидрофуран при температурах между -78 и -33oC.
Соединение 5 в этом случае можно известным образом окислением 17-оксифункции переводить в соединение 6. Соединения 5 и 6 представляют исходные продукты при получении соединений общей формулы I.
Если R11, R11′ и R19 каждый представляет атом водорода, то имеющуюся в 5 или 6 двойную связь можно гидрировать известными способами.
Если R19 должен представлять атом водорода и R11 и R11′ обозначают вместе дополнительную двойную связь, то изомеризации первоначальной двойной связи (R11 = H, R11′ и R19 образуют вместо дополнительную связь) достигают нагреванием соединения 5 или 6 в этаноле c катализатором 5%-ный палладий на угле, который предварительно был обработан водородом, или нагреванием с небольшим количеством циклогексена. Но изомеризации можно достигать также превращением с катализатором палладий/уголь, например в этаноле или смесях тетрагидрофурана/этанола, в атмосфере водорода при комнатной температуре, или кипячением этой реакционной смеси с циклогексеном вместо водорода.
Следующие стадии включают в этом случае, возможно, желательные превращения в D-кольце: введении 15,16-двойной связи (R15 и R16 образуют общую дополнительную связь) осуществляют, например, модифицированным окислением по методу Saegusa (J.Minami, K.Takahashi, J.Shimizu, T.Kimura, J.Tsuji; Tetrahydron 42 (1986), стр. 2971; европейский патент A 0299913) соответствующих енольных соединений 17-кетона.
В случае необходимости можно изомеризировать двойную связь по 14-положению. Для этого 15,16-ен-соединения обрабатывают силикагелем/триэтиламином (S.Scholz и др., Lieb. Ann. Chem., 1989, стр. 151).
Для примеров, в которых R15 и R16 представляют вместе находящуюся в β-положении метиленовую группу, введение этой группы осуществляют, например, превращением соответствующего 15,16-ен-17-он соединения с метилидом диметилсульфоксония (см., например, описание изобретения к выложенной акцептованной заявке на патент ФРГ 1183500, выложенное описание изобретения к неакцептованной заявке ФРГ 2922500, европейский патент A 0-019690, патент США 4291029 A, E.J.Cozey, M.Chaykovsky, J.Am. Chem. Soc. 84, стр. 867 (1962)).
После проведенной модификации D-кольца действуют другие стадии, прежде всего введение остатков R17α и R17β на C-17-атоме. Это введение по аналогии с известными из литературы способами (например, J. Fried, J.A.Edwards, "Органические реакции в химии стероидов", van Nostrand Reinhold Company, 1972, том 1 и 2; "Терпеноиды и стероиды", Specialist Periodical Report, The Chemical Society, Лондон, том 1-2) осуществляют в большинстве случаев нуклеофильным присоединением заместителя R17α или реакционноспособного предшественника к C-17-атому.
В случае легко енолизируемого 17-кетона, как, например, 14,15-ен-соединений, нуклефилы вводят при добавке солей церия (T.Jmamoto, N.Fakjana, K. Nakamura, Y.Sugiura, Tet.Lett., 25. 4233 (1984)).
Введение заместителя C≡C-B в качестве R17α с названными значениями для B осуществляют при помощи соединении металлов, которые могут образовываться также "ин ситу" и могут вступать в реакцию с 17-кетоном. Соединения металлов образуются, например, реакцией ацетиленов с щелочными металлами, в частности с калием, натрием или литием, в присутствии спирта или в присутствии аммиака. Но щелочной металл может также применяться в форме, например метил- или бутиллития. Соединения, в которых B=бром или йод, получают из 17-этинил-соединений известным образом (см., например, H.Hofmeister, K.Annen, H.Laurent и R.Wiechert, Angew. Chem. 96, 720 (1984)).
Введение 3-окси-1-пропила в 17-положение производят взаимодействием 17-кетона с дианионом пропаргилового спирта (3- оксипропин), например с образованной "ин ситу" дикалийной солью пропаргилового спирта или с соответствующими защищенными на оксифункции производными, как, например, с литиевым соединением 3- [(тетрагидро-2H-пиран-2-ил/окси]-1-пропина.
Соединения оксипропила и оксипропенила можно получать из производных оксипропинила. Цепь оксипропила получают, например, гидрированием при комнатной температуре и при нормальном давлении в растворителях, как метанол, этанол, тетрагидрофуран или этилацетат, при добавке катализаторов на основе благородного металла, как платина или палладий.
Получение соединений с двойной связью с Z-конфигурацией в боковой цепи осуществляют гидрированием ацетиленовой тройной связи с дезактивированным катализатором на основе благородного металла, например 10%-ного палладия на сульфате бария, в присутствии амина или 5%-ного палладия на карбонате кальция, при добавке свинец (11)-ацетата. Гидрирование прекращают после поглощения одного эквивалента водорода.
Соединения с двойной связью с E-конфигурацией в боковой цепи образуются восстановлением тройной связи, например с натрием в жидком аммиаке (K.N. Cambell, L. T. Eby, J.Am.Chem.Soc., 63 (1941, стр. 216), с амидом натрия в жидком аммиаке или с литием в низкомолекулярных аминах (R.A.Benkeser и др., J.Am.Chem.Soc., 77(1955), стр. 3378).
Введение оксиалкенов и оксиалканов можно осуществлять также непосредственно превращением 17-кетона с металлическими производными (E.J.Corey, R. H.Wollenberg, J.Org.Chem. 40, 2265 (1975); H.P.On.W.Lewis, G.Zweifel, Синтез 1981, стр. 999; G.Gohiez, A.Alexakis, J.F.Normant, Tet.Lett. 1978, стр. 3013, P.E. Eaton и др., J.Org.Chem. 37, 1947). Введение гомологичных оксиалкин-, оксиалкен- и оксиалкангрупп возможно соответствующим образом.
Продукты, в которых R17α/R17β обозначают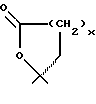
с x = 1 или 2, можно получать из 17-(3-оксипропил)- или 17- (4-оксибутил)-соединений окислением известным образом, например с реактивом Джонса, двуокисью марганца, дихроматом пиридиния, хлорхроматом пиридиния, хромовой кислотой- пиридином или с реактивом Фетизона.
Продукты, в которых R17α/R17β обозначают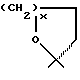
или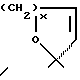
с x = 1 или 2, можно получать реакцией циклизации соответствующих (Z)-17 α -(3-оксипроп-1-енил) или (Z)-17 α - (4-окси-1-бутенил)-17 β -оксисоединений или насыщенных соответственно в боковой цепи соединении. Соединения с насыщенным простым спироэфиром можно получать гидрированием ненасыщенных простых спироэфиров на катализаторах из платины- палладия.
17 α -1,2-алкидиенил-замещенные стероиды можно получать, например, превращением в случае необходимости защищенных в
виде простого тетрагидропиранилового эфира, простого α -алкоксиэтилового эфира, алкил- или арилсульфонатов 17 α -(3- окси-1-алкин)-замещенных соединений с комплексными гидридами в алифатических иди алициклических простых эфирах (см. , например, A.Burger, J.-P.Roussel, C.Hetru, J.A.Hoffmann и B. Luu, Tetrahedron 45, 155 (1989); A.Claesson, Z. -J.Olsson и C.Bogentoft, Acta Chem.Scand. 27, 2941 (1973); L. -J.Olsson и A.Claesson, Acta Chem. Scand. B31, 614 (1977)) и также по другим известным из литературы способам (см. , например, описание изобретения к выложенной акцептованной заявке на патент ФРГ 19585333; выложенное описание к неакцептованной заявке на патент ФРГ 1668679).
Введение трифторметилгруппы осуществляют превращением 17-кетона с трифторметилтриметилсиланом в присутствии тетрабутиламмонийфторида (см. R. Krshnamurti, D.P.Bellew и G.K.Prahash, J.Org.Chem. 56, 984 (1991).
Боковую цепь 17-цианметила получают из 17-кетона или непосредственно присоединением ацетонитрила или расщеплением спироэпоксида при помощи HCN по K.Ponsold и др., Z.Chem. 18(1978)), 259-260.
Синтез 16,17 α-метилен-17 β -алканоил- замещенных соединении осуществляют известными из литературы способами. Так, например, исходя из 17-кетонов, можно получать Δ16 -17-перфторсульфонилоксисоединения, которые в присутствии катализаторов на основе переходных металлов можно сочетать с соединениями алкоксивинилолова или цинка (см., например, M.Kosugi, T.Sumiya, Y.Obara, M.Suzuki, H.Sano и T.Migita, Bull.Chem.Soc., Япония 60, 767 (1987); P.G. Ciattini, E.Morera и G.Ortar, Tetrahedron Lett. 31, 1889 (1990)). Кислотный гидролиз продуктов сочетаний дает Δ16 17-ацетилсоединения. Эти еноны можно подвергать превращению по способам, указанным выше для циклопропанирования Δ15 17-кетонов с иодидом триметилсульфоксония до 16,17 α -метилен- 17 β -ацетилсоединений, или же присоединением к сопряженным связям алкилмедных соединений переводить в производные 16 α -алкилпрогестерона.
Соединения, в которых R17α представляет остаток алкила и R17β представляет остаток алканоила, можно получать, например, из Δ16 -17-алканоилсоединений или 17 α -окси-17 β -алканоилсоединений, причем восстановлением с литием в жидком аммиаке, смешанном с тетрагидрофураном, получают 17-енолатанионы, которые можно алкилировать с алкилгалогенидами до желательных соединений (см., например, M.J.Weiss, R.E.Schaub, G.R.Allen, Jr., J.F.Poletto, C. Pidacks, R.B.Conrow и C.J.Coscia, Tetrahedron 20.357 (1964).
Получение производных, в которых R17α и R17β вместе обозначают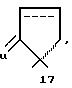
осуществляют исходя из 17-кетона известными из литературы методами (например, европейский патент A-04443951, 1991); и европейский патент A-0154429, 1989). Для этого получают, например, восстановительным аллилированием вышеупомянутого Δ16 -17-ацетильного соединения соответствующие 17 α -(2- пропенил)- соединения (аллилирование с аллилбромидом). Концевую двойную связь в этом случае переводят или гидроборированием, например с 9.BBN (9-борабициклононаном), окислительной обработкой и дальнейшим окислением до соответствующего C3-альдегида или же расщеплением озонолизом в C2-альдегид. Спирокетоны с 6- или 5- кольцами можно получать в этом случае через альдольную реакцию. При этом образуются сначала α,β -ненасыщенные кетоны, которые в случае необходимости можно восстанавливать известными методами до насыщенных кетонов.
Введение образца замещения оксипрогестерона (17 β = ацетил, 17 α = окси) или синтез соответствующих гомологических α -окси-17 β -алканоилсоединений осуществляют известными из литературы способами. При этом следует особенно выделить способ через 17 β -циано-17 α -оксисоединение (метод с циангидрином; см. , в частности, патент ФРГ 3931064 A1 (1989); патент ГДР 147669 (1981); патент ФРГ 2110140 (1971); патент Японии 57062296-300 (1982); J.C. Gase и L. Nedelec, Tet. Lett. 1971, стр. 2005; J.N.M.Batist, N.C.M.E.Barendze, A.F.Marx, Стероиды, 1990, стр. 109).
При этом 17-кетон превращают реакцией, например, с ацетонциангидрином (2-окси-2-метилпропаннитрил) в подходящих системах растворителей, например этанол или метанол и дихлорметан, при соответствующей (преимущественно слабоосновной) величине pH (регулируют добавкой KCN или NaCN или KOH или NaOH). При этих условиях реакции можно достигнуть выкристаллизовывания 17 β -цианосоединения. В этом случае защищают 17 α оксифункцию и затем проводят реакцию цианогруппы с C1-C4- алкиллитием, например с метиллитием или C1-C4-алкилмагнийгалогенидами, например метилмагнийгалогенидами, чтобы получать затем после кислотного расщепления 17 α -окси- 17 β алканоилсоединение. Исходя из 17 α -окси- 17 β - алканоилсоединений можно получать потом известным способом 17 α -алканоилокси-производные.
Затем следует особенно выделить перевод 17 α -этинил-17 β - нитрооксисоединений (см. H.Hofmeister, K.Annen,H.Laurent и R.Wiechert, Chem.Ber. III, 3086 (1978)) или образованных из 17 α -этинил-17 β -оксисоединений реакцией с фенилсульфенилхлоридом алленсульфоксидов (см. V.Van Rheenen и K.P.Shephard, J.Org.Chem. 44, 1582(1979)) в 17 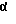 -окси-17 β - ацетилсоединения.
-окси-17 β - ацетилсоединения.
17 β -ацетил-17 α -фторсоединения можно получать, например, из соответствующих 17 β -ацетил-17 α -оксисоединений превращением с DAST (трифторид диэтиламиносеры) в подходящих растворителях, как, например, трихлорметан.
Последующее освобождение 3-кетофункции при отщеплении воды и образовании 4(5)-двойной связи осуществляют обработкой кислотой или кислым ионообменником. Обработка кислотой происходит известным образом, причем соответствующий 5 α - окси-3-кеталь растворяют в смешиваемом с водой растворителе, как водном метаноле, этаноле или ацетоне, и воздействуют на раствор каталитическими количествами минеральной кислоты или сульфокислоты, например соляной, серной, фосфорной, хлорной или p-толуолсульфокислоты, или органической кислоты, как уксусная кислота, до тех пор, пока не удаляют имеющиеся защитные группы. Превращение, которое протекает при температурах от 0 до 100oC, можно осуществлять также с кислым ионообменником. Ход превращения можно контролировать аналитическими методами, например отобранными тонкослойной хроматографией пробами.
Следующие стадии относятся, к синтезу остатков R6a и R6b, R7 и R1, R2.
Для конечных соединений, в которых имеется 1,2- и 6,7-двойная связь, или для соответствующих промежуточных продуктов, в которых желательны рядом обе двойные связи, можно исходя из 3-кетона (W= кислород) в принципе через 2,6-дибромирование и последующее удаление одновременно осуществлять введение обеих двойных связей (см., например, описание изобретения к выложенной акцептованной заявке на патент ФРГ 1119266). Однако часто возникает необходимость на основании других функций в молекуле вводить друг за другом обе двойные связи. При этом сначала происходит, как правило, введение 6,7-двойной связи. Это введение осуществляют через бромирование простого диенолового эфира и последующее отцепление бромистого водорода (см., например, J.Fried, J.A. Edwards, Органические реакции в химии стероидов, von Nostrand Reinhold Company 1972, стр. 265-374).
Бромирование простого диенолового эфира можно проводить, например, аналогично предписанию в "Стероиды" 1, 233. Отщепление бромистого водорода проводят нагреванием 6-бромсоединения с основаниями, как, например, LiBr или LiCO3 в апротонных растворителях, как диметилформамид, при температурах 50-120oC или же нагреванием 6-бромсоединений в коллидине или лутидине.
Введение 1,2-двойной связи можно в зависимости от желательного конечного соединения проводить непосредственно после введения 6,7-двойной связи или также на более поздней промежуточной стадии. Это дегидрирование проводят преимущественно химическим или также микробиологическим методом известными из литературы способами (например, патент ФРГ 3402329 A1 и европейский патент A-0150157).
Химическое дегидрирование осуществляют, например, нагреванием с двуокисью селена, 2,3- дихлор-5,6-дицианобензохиноном, хлоранилом, триацетатом таллия или тетраацетатом свинца в подходящих растворителях, как, например, диоксан, трет.бутанол, тетрагидрофуран, толуол, бензол или смеси этих растворителей.
Введение 1,2-двойной связи можно, однако, проводить также модифицированным окислением по Saegusa (J.Minami, K.Takahashi, J.Shimizu, T.Kimura, J. Tsuji, Tetrahedron 42 (1986), стр. 2971; европейский патент A-0299913) соответствующих енольных соединений 3-кетона.
Соединения, которые несут функцию 1,2 α -метилена, получают из 1,2-ненасыщенных соединений превращением с метилидом диметилсульфоксония по аналогии с получением 15,16 β -метиленового соединения (см. выше). При этом возможно избирательное введение 1,2-функции метилена также в присутствии 4,6-диен-3-он-единицы (см., например, выложенное описание к акцептованной заявке ФРГ 1183500).
Для соединений с функцией 6,7- метилена введение проводят также из диенона превращением с метилидом диметилсульфоксония, причем здесь появляется, конечно, смесь α-\ и β- изомеров (соотношение зависит от примененных субстратов и составляет около 1:1), которые можно разделять хроматографией на колонке.
Соединения с R7, равным алкилу или SR20, причем R20 имеет названные значения, получают из 4,6-диен-3-он-соединений 1,6-присоединением известными методами (J. Fried, J.A.Edwards: "Органические реакции в химии стероидов", Nostrand Reinhold Company 1972, стр. 75-82; и A.Hosomi, H.Sakurai, J.Am. Chem.Soc., 99 (1977), стр. 1673).
При этом введение функции 7-алкила осуществляют, как правило, через диалкилмедьлитийсоединения. Введение SR20 - группы производят 1,6-присоединением тиоуксусной кислоты. При этом обычно образуются смеси стереоизомеров, причем влияние на эту реакцию в случае присоединения тиоуксусной кислоты в результате добавки кислот по Льюису, как, например, бортрифторэфирата в тетрагидрофуране в качестве растворителя, приводит к резкому повышению 7 α -изомеров.
Соединения, в которых R6a представляет атом хлора и R6b и R7 образуют вместе дополнительную связь, получают также исходя из 4,6-диен-3-он-соединений. Для этого сначала эпоксидируют 6,7-двойную связь при применении органических надкислот, как мета-надхлорбензойная кислота в хлористом метилене, в случае необходимости в присутствии раствора бикарбоната натрия (см. W.Adam и др. J.Org.Chem. 38 (1973), стр. 2269). Раскрытие этого эпоксида и удаление первично образованной 7 α -оксигруппы производят, например, превращением газообразного хлористого водорода в ледяной уксусной кислоте (см., в частности, патент ФРГ A-1158966 и патент ФРГ A-4006165).
Но обе реакции можно также проводить друг за другом, причем сначала нуклеофильно раскрывают эпоксид при помощи, например, галогенидов щелочных металлов (например, LiCl) в растворителях, как уксусная кислота, и затем удаляют образованную 7 α -оксигруппу после перевода в уходящую группу (например, мезилат или тозилат).
Введение группы 6-метилена можно осуществлять, например, исходя из производного 3-амино-3,5-диена превращением с формалином в спиртовом растворе при образовании оксиметил-группы и с последующим отщеплением воды кислотой, например соляной кислотой, в диоксане/воде. Но можно проводить также отщепление воды в результате того, что сначала вводят отводимую группу и затем удаляют. В качестве отводимых групп пригодны, например, мезилат, тозилат или бензоат (см. патент ФРГ A-3402329 A1; европейский патент A-0150157; патент США 4584288(86); K.Nickisch и др. J.Med.Chem., 34, 2464 (1991).
Другая возможность для введения 6-метиленсоeдинений заключается в прямом превращении 4(5)-ненасыщенных 3-кетонов с ацеталями формальдегида в присутствии ацетата натрия, например с хлорокисью фосфора или пентахлоридом фосфора в подходящих растворителях, как хлороформ (см., например, K.Annen, H.Hofmeister, H.Laurent и R.Wiechert. Синтез 1982, стр. 34).
Соединения 6-метилена можно использовать для получения соединений общей формулы I, в которых R6a обозначает метил и R6b и R7 образуют вместе дополнительную связь.
Для этого можно использовать, например, описанный D.Burn и др. в Tetrahydron 21 (1965), стр. 1619 способ, при котором достигают изомеризации двойной связи нагреванием соединений 6-метилена в этаноле с катализатором на основе 5%-ного палладия на угле, который был предварительно обработан водородом, или нагреванием с небольшим количеством циклогексена. Изомеризацию можно проводить также с необработанным предварительно катализатором, если в реакционную смесь добавляют небольшое количество циклогексена. Появлению небольших количеств гидрированных продуктов можно препятствовать добавкой избытка ацетата натрия.
Но можно также непосредственно получать производные 6-метил-4,6-диен-3-она (см. K.Annen, H.Hofmeister, H.Laurent и R.Wiechert, Lieb. Ann. 1983, стр. 712).
Соединения, в которых R6a представляет α -метил-функцию, можно получать из 6-метиленсоединений гидрированием при подходящих условиях. Самых лучших результатов (избирательное гидрирование экзометиленовой функции) достигают гидрированием с переносом (E. A.Brande, R.P.Linstead и P.W.D.Mitchell, J. Chem. Soc. , 3578 (1954). Если производные 6-метилена нагревают в подходящем растворителе, как, например, этанол, в присутствии донора водорода, как, например, циклогексен, то получают очень хорошие выходы производных 6 α - метила. Небольшие количества соединений 6 β -метила можно изомеризовать в кислой среде (см. , например, D. Burn, D.N.Kirk и J.Petrow, Tetrahedron, (1965), стр. 1619).
Можно также целенаправленно получать соединения 6 β -алкила. Для этого 4-(5)-ненасыщенные 3-кетоны можно превращать, например, с этиленгликолем, триметилортоформиатом в дихлорметане в присутствии каталитических количеств кислоты (например, p-толуолсульфокислоты) в соответствующие 3-кетали. Во время этого катализирования изомеризируют двойную связь в положении 5(6). Избирательное эпоксидирование этой 5(6)-двойной связи осуществляют, например, применением органических надкислот в подходящих растворителях, как, например, дихлорметан. В качестве альтернативы для этого можно проводить эпоксидирование также с перекисью водорода в присутствии, например, гексахлорацетона или 3-нитротрифторацетофенона. Образованные 5,6 α - эпоксиды при применении, например, алкилмагнийгалогенидов или алкиллитийсоединений можно затем раскрывать по оси.Таким путем получают 5 α -окси-6 β -алкилсоединения. Расщепление защитной 3-кетогруппы можно осуществлять при получении 5 α - оксифункции в результате обработки при мягких условиях кислотой (уксусная кислота или 4 н. соляная кислота при 0oC). Удаление основаниями 5 α -оксифункции при помощи, например, разбавленного водного раствора натрового щелока дает 3-кето-4-ен-соединения с 6-алкил-группой в β -положении. В качестве альтернативы для этого расщепление кеталя при жестких условиях (водная соляная кислота или другая крепкая кислота) дает соответствующие 6 α -алкилсоединения.
Полученные соединения общей формулы I с W в значении атома кислорода можно при желании превращением с гидроксиламингидрохлоридом в присутствии третичных аминов при температурах между -20 и +40oC переводить в оксимы (общая формула I с X в значении 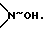 причем оксигруппа может быть в син- или антиположении).
причем оксигруппа может быть в син- или антиположении).
Удаление 3-оксигруппы для получения конечного продукта общей формулы I с W в значении двух атомов водорода можно проводить, например, по указанной в патенте ФРГ A 2805490 инструкции восстановительным расщеплением тиокеталя.
К предмету настоящего изобретения относятся также промежуточные соединения общей формулы III'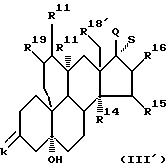
где k обозначает защищенную кето- или оксигруппу и атом водорода,
R11′ и R19 обозначают вместе дополнительную связь и R11 обозначает атом водорода в α -положении или R19 обозначает атом водорода и R11 и R11′ обозначают вместе дополнительную связь или R11, R11′ и R19 обозначают каждый атом водорода,
R14, R15 и R16 имеют указанные в формуле I значения,
R18' обозначает атом водорода или группу метила и
Q представляет оксигруппу в β -положении и S представляет атом водорода в α -положении, или Q и S обозначают вместе кетонный атом кислорода или, кроме того, Q и S обозначают одну из названных в формуле I R17α/R17β -комбинаций заместителей, включая спиросоединения, причем имеющиеся в них окси- и/или кетогруппы в случае необходимости защищены.
Эти соединения уже прошли реакцию циклизации и могут иметь в 17-положении еще первоначальную оксигруппу, уже кетогруппу или окончательный образец R17α/R17β заместителей.
Следующие примеры служат для более подробного пояснения настоящего изобретения.
Примеры.
Общие замечания.
I) Все опыты проводят в атмосфере защитного газа.
II) Если нет других указаний, проведение опытов осуществляют следующим образом.
Реакционный раствор выливают или в насыщенный водный раствор хлорида натрия (A), насыщенный водный раствор бикарбоната натрия (B) или насыщенный водный раствор хлорида аммония (C). Затем экстрагируют несколько раз этилацетатом. Соединенные органические фазы промывают или насыщенным водным раствором хлорида аммония (D), или насыщенным водным раствором бикарбоната натрия (E), или насыщенным водным раствором хлорида натрия (F) и сушат над сульфатом натрия. После этого фильтруют и концентрируют в вакууме.
III) Если нет других указаний, полученные сырые продукты очищают хроматографией на колонке на силикагеле смесью из гексана/этилацетата.
IV) Общие инструкции.
1) Расщепление C-3-кеталей в случае необходимости с удалением 5 α -оксигруппы и расщепление возможно имеющейся защитной группы тетрагидропиранила в 17 α -боковой цепи:
5 ммоль исходного вещества и 5 мл 4 н. соляной кислоты растворяют в 60 мл ацетона. Дополнительно перемешивают 1 ч при комнатной температуре и 30 мин при 40oC. Последующая водная обработка (A, E, F) и очистка дают соответствующий 3-кетон.
2) Присоединение этинил-, пропинил- или 1-бутинилбоковой цепи к C-17:
100 мл абсолютного тетрагидрофурана насыщают от 0oC в течение 30 мин газообразным этилом или пропилом; для присоединения 1-бутинилбоковой цепи вводят 5 г 1-бутина в 100 мл тетрагидрофурана. Затем присоединяют 31 мл 1,6-молярного раствора
н-бутиллития в гексане и дополнительно перемешивают 30 мин при 0oC. После этого присоединяют раствор соответствующего исходного вещества (5 ммоль) в абсолютном тетрагидрофуране. Дополнительно перемешивают 1 ч при 0oC и обрабатывают затем водой (C, F).
3) Окисление трехокисью хрома/пиридином:
к 10 мл пиридина в 80 мл дихлорметана присоединяют при 0oC 30 ммоль трехокиси хрома. Перемешивают дополнительно 30 мин при 0oC и затем присоединяют при 0oC 5 ммоль исходного вещества в 15 мл дихлорметана. Потом дополнительно перемешивают 1 ч при 0oC. После этого декантируют реакционный раствор и трижды промывают остаток дихлорметаном. Соединенные органические фазы дважды промывают 5%-ным водным раствором гидроокиси натрия и один раз насыщенным водным раствором хлорида натрия и сушат над сульфатом натрия. После этого фильтруют и концентрируют в вакууме.
4) Введение 15(16)-двойной связи из насыщенного 17-кетона через образование простого силиленолового эфира и последующее окисление по Saegusa.
а) Получение простого силиленолового эфира:
из 15 ммоль диизопропиламина в 100 мл абсолютного тетрагидрофурана и 9 мл 1,5-молярного раствора н-бутиллития в гексане получают при -30oC диизопропиламид лития. После этого присоединяют раствор 5 ммоль соответствующего 17-кетона в 50 мл абсолютного тетрагидрофурана и дополнительно перемешивают 1 ч при -30oC. Затем присоединяют 17 ммоль триметилхлорсилана. Потом доводят реакционную смесь до комнатной температуры и дополнительно перемешивают 1 ч. В результате обработки водой (B, D, F) получают соответствующий простой силиленоловый эфир.
б) Введение 15(16)-двойной связи:
5 ммоль описанного в пункте a) простого силиленолового эфира растворяют в 60 мл ацетонитрила. Прибавляют 5,5 ммоль ацетата палладия(II) и дополнительно перемешивают 8 ч при комнатной температуре. Затем фильтруют реакционный раствор через целит и концентрируют в вакууме.
Пример 1
9,11 α -дигидро-17 β -окси-17 α -метил-6'H-бензо[10,9,11]эстр-4-ен-3-он
a) 3,3-[2,2-диметил-1,3-пропандиилбис(окси] -19-этинил- 5 α -андрост-9(11)-ен-5,17 β -диол
В суспензию 48,6 г магниевых стружек в 700 мл абсолютного простого диэтилового эфира добавляют 3 г хлористой ртути(II). Перемешивают 30 мин и затем охлаждают до 0oC. Потом присоединяют сначала 7,5 мл 3-бромпропана. После скачка реакции (повышение температуры) охлаждают до -5oC. Затем прикапывают остальные 67,5 мл 3-бромпропана с такой скоростью, чтобы внутренняя температура не превышала 0oC. После полной добавки перемешивают 30 мин при 0oC и затем медленно прикапывают раствор 50 г 3,3-[2,2-диметил-1,3-пропандиилбис(окси)] -5,10 α -эпокси-5α-эстр-9(11)-ен-17 β -ола в 300 мл абсолютного тетрагидрофурана. Перемешивают 1 ч при 0oC и затем удаляют избыток магния. Затем осторожно присоединяют 500 мл насыщенного водного раствора хлористого аммония и перемешивают 1 ч при комнатной температуре (сильное выделение газа). После этого обрабатывают водой (F). После перекристаллизации сырого продукта из диизопропилового простого эфира получают 45,2 г 1a).
1H-NMR (CDCl3): δ = 5,42 ппм m (1H, H-11); 4,40s (1H, OH); 3,75dd (J = 14, 7,5 Гц, 1H, H-17); 3,40-3,60m (4H, кеталь); 1,93 (J = 1,5 Гц, 1H, этин); 0,99s (3H, Me-кеталь); 0,92s (3H, Me-кеталь): 0,76s (3H, C-18).
b) 19-(бромэтинил)-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -5 α -андрост-9(11)-ен-5,17 β -диол
45 г описанного в пункте 1a) вещества растворяют в 750 мл ацетона. Присоединяют 1,85 г нитрата серебра и 23,3 г N-бромсукцинимида. Затем перемешивают 20 мин при комнатной температуре. Обработка водой (B, F) дает 52,5 г 1b), который без очистки применяют в следующей стадии.
c) 19-(2-бромэтенил)-3,3-[2,2-диметил-1,3-пропандиилбис(окси)] -5 α -андрост-9(11)-он-5,17 β -диол
52,5 г описанного в пункте 1b) вещества растворяют в 1000 мл смеси из тетрагидрофурана и воды (1:1). Присоединяют 79 г гидразида p-толуолсульфокислоты и 52 г ацетата натрия. Затем кипятят 4 ч обратным холодильником. Обработка водой (В, F) и очистка дает 36,9 г 1c) в виде белой пены.
1H-NMR (CDCl3): δ = 6,18 ппм m (1H, винил); 5,85 m (1H, винил); 5,43 m (1H, H-11); 4,40s (1H, OH); 3,73dd (J = 14, 7,5 Гц, 1H, H-17); 3,48-3,58m (4H, кеталь); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь); 0,70s (3H, C-18).
d) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 6'H-бензо[10,9,11]-5 α -эстран-5,17 β -диол
Получение при применении гидрида трибутилолова
20 г описанного в пункте 1c) вещества растворяют в 500 мл абсолютного толуола. Прибавляют 12 мл гидрида трибутилолова и 25 мг азобисизобутиронитрила и кипятят 1 ч с обратным холодильником при одновременном облучении ультрафиолетовой лампой. После полного превращения реакционный раствор концентрируют в вакууме и остаток очищают перекристаллизацией из простого диизопропилового эфира. Получают 9,1 г 1d) в виде белых кристаллов. Хроматографией на колонке с силикагелем маточного раствора со смесью из гексана/этилацетата получают другие 3,84 г 1d) в виде белой пены.
1H-NMR (CDCl3): δ = 5,50 ппм dbr (J = 10 Гц, 1H, мостик); 5,47m (1H, бугель); 4,37s (1H, OH); 3,50-3,62m (5H, кеталь и H-17); 2,47m (1H, H-11); 0,99s (3H, Me-кеталь); 0,98s (3H, Me-кеталь); 0,80s (3H, C-18).
Получение по методу Бирха
К 400 мл конденсированного аммиака медленно прибавляют при -78oC 3,5 г лития. После полного растворения прикапывают раствор 5 г описанного в пункте 1c) вещества в 600 мл тетрагидрофурана. После полной добавки перемешивают 15 мин при -40oC. Затем резко охлаждают реакционный раствор добавкой воды. За ночь отгоняют аммиак и обрабатывают водой (F). После очистки наряду с 1,9 г 1d) получают 1,6 г 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 19-этенил-5 α -андрост-9(11)-ен-5,17 β -диола.
1e) 9,11α-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -5-окси-6'H-бензо-[10,9,11]-5 α -эстран-17-он
1. Получение из 1d)
По общей прописи 3) из 12,9 г описанного в пункте 1d) вещества, 18,5 г трехокиси хрома и 62 мл пиридина в 450 мл дихлорметана получают 11,34 г 1e) в виде белой пены.
2. Альтернативное получение 1e)
1e1) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-19-этинил-5- окси-5 α -андрост-9(11)-ен-17-он
По общей прописи 3 превращают 5 г описанного в пункте 1a) вещества. Получают 4,82 г 1e1) белую пену.
1H-NMR (CDCl3): δ = 5,43 ппм dbr (J = 5,5 Гц, 1H, H-11); 4,40s (1H, OH); 3,40-3,60m (4H, кеталь); 1,92t (J = 1,5 Гц, 1H, этин); 1,02s (3H, C-18); 0,95s (3H, Me-кеталь), 0,91s (3H, Me-кеталь).
1e2) 19-(2-бромэтинил)-3,3-[2,2-диметил-1,3-пропандиилбис- (окси)]-5-гидро-5 α -андрост-9(11)-ен-17-он
Аналогично 1b) 4,82 г описанного в пункте 1e1) вещества превращают с 5,5 г N-бромсукцинимида и 200 мг нитрата серебра в 100 мл ацетона. Получают 5,7 г 1e2), который применяют как исходное в следующей стадии.
1e3) 19-(2-бромэтенил)-3,3-[2,2-диметил-1,3-пропандиилбис- (окси)]-5-окси-5 α -андрост-9(11)-ен-17-он
По аналогии с примером 1c) 5,7 г описанного в пункте 1e2) вещества превращают с 9 г гидразида p-толуолсульфокислоты и 6 г ацетата натрия в 100 мл смеси из тетрагидрофурана и воды (1:1). Получают после очистки 3 г 1e3) в виде белой пены.
1H-NMR (CDCl3): δ = 6,19m (1H, винил); 5,83m (1H, винил); 5,33dbr (J = 5,5 Гц, 1H, H-11); 4,40s (1H, OH); 3,45-3,60m (4H, кеталь); 1,00s (3H, C-18); 0,95s (3H, Me-кеталь); 0,82s (3H, Me-кеталь).
1e) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5-окси-6'H-бензо[10,9,11]-5 α -эстран-17- он
По аналогии с 1d) 3 г описанного в пункте 1e3) вещества превращают с 3 мл гидрида трибутилолова и 25 мг азобисизобутиронитрила в 100 мл абсолютного толуола. Получают после очистки 2,39 г 1e) в виде белой пены.
1H-NMR (CDCl3): δ = 5,57 ппм dbr (J = 10 Гц, 1H мостик); 5,49m (1H, мостик); 4,40s (1H, OH); 3,50-3,60m (4H, кеталь); 2,53m (1H, H-11); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь); 0,92s (3H, С-18).
1f) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -метил-6'H-бензо-[10,9,11]-5 α -эстран-5,17 β -диол
К 13 мл 1,6-молярного раствора метиллития в простом диэтиловом эфире при 0oC в атмосфере аргона присоединяют раствор 882 мг полученного в пункте 1e) соединения в 20 мл абсолютного тетрагидрофурана. Перемешивают 2 ч при 0oC и обрабатывают водой (C, F). Получают 845 мг 1f) в виде белой пены, который без очистки применяют в следующей стадии.
1g) 9,11 α -дигидро-17 β -окси-17 α -метил-6'H-бензо[10,9,11]-эстр-4-ен-3-он
По общей инструкции 1) превращают 839 мг 1f) с 4 н. соляной кислотой в ацетоне. Получают после очистки 594 мг 1g) в виде белой пены.
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,61 dbr (J = 10 Гц, 1H, бугель); 5,50m (1H, мостик); 2,69m (1H, H-11); 1,23s (3H, метил); 0,95s (3H, C-19).
Пример 2
9,11 α -дигидро-17α-этинил-17 β -окси-6'H-бензо[10,9,11]эстр-4-он-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 17 α -этинил-6'H-бензо-[10,9,11]-5 α -эстран-5,17 β -диол
По общей прописи 2) превращают 1,24 г описанного в 1e) вещества и 18,9 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного этина в абсолютном тетрагидрофуране. Получают после очистки 1,20 г 2a) в виде белой пены.
1H-NMR (CDCl3): δ = 5,55 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,40s (1H, OH); 3,50-3,62m (4H, кеталь); 2,59s (1H, этин); 2,52m (1H, H-11); 0,98s (3Н, Me-кеталь); 0,97s (3H, Me-кеталь); 0,90s (3H, C-18).
b) 9,11 α -дигидро-17 α -этинил-17 β -окси-6'H- бензо[10,9,11]-эстр-4-ен-3-он
По общей прописи 1) превращают 1,2 г 2a) с 3 мл 4 н. нормальной соляной кислоты в ацетоне. После кристаллизации сырого продукта из этилацетата получают 776 мг 2b) в виде белых кристаллов.
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,62dbr (J = 10 Гц, 1H, мостик); 5,56m (1H, мостик); 2,67m (1H, H-11); 2,59s (1H, этин); 0,91s (3H, C-18).
Пример 3
9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H- бензо[10,9,11]-эстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(1-пропинил)-6'H- бензо[10,9,11]-5 α -эстран-5,17 β -диол
По общей прописи 2) превращают 1 г описанного в пункте 1e) соединения и 15,1 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране. Получают 1,05 г 3a) в виде белой пены, который применяют без очистки в следующей стадии.
3b) 9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H- бензо-[10,9,11] эстр-4-ен-3-он
По общей инструкции 1) превращают 1 г описанного в пункте 3a) вещества с 2,5 мл 4 н. водного раствора соляной кислоты в ацетоне. После кристаллизации сырого продукта из диизопропилового простого эфира получают 600 мг 3b) в виде белых кристаллов.
Точка плавления = 161,6oC; [α]
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,60dbr (J = 10 Гц, 1H, мостик); 5,50m (1H, мостик); 2,68m (1H, H-11); 1,87s (3H, пропин); 0,90s (3H, C-18).
Пример 4
(Z)-9,11 α -дигидро-17 β -окси-17 α -(3-окси-1-пропенил)- -6'H-бензо[10,9,11]эстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-17 α -[3-[(тетрагидро-2H-пиран-2-ил)окси]-1-пропинил]-6'H-бензо[10,9,11]- 5 α -эстран-5,17 β -диол
Из 17 мл 3-[(тетрагидро-2H-пиран-2-ил)окси]-1-пропина в 600 мл абсолютного тетрагидрофурана и 75,4 мл 1,6-молярного раствора н-бутиллития в гексане получают при 0oC в атмосфере аргона литийорганическое соединение. Затем присоединяют раствор 5 г описанного в пункте 1e) вещества в 120 мл абсолютного тетрагидрофурана. Перемешивают один раз при 0oC и обрабатывают после этого водой (C, F). После очистки получают 5,75 г (4a) в виде белой пены.
1H-NMR (CDCl3); δ = 5,56 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,84 (1H, ТHР); 4,40s (1H, OH); 4,32m (2H, CH2OTHP); 3,87m (1H, ТHР); 3,50-3,70m (5H, кеталь и ТHР); 2,50m (1H, H-11); 0,95m (6H, Me-кеталь); 0,89s (3H, C-18).
b) (Z)-9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиил- бис(окси)]-17 α -[3-тетрагидро-2H-пиран-2-ил)окси]-1- пропенил]-6'H-бензо[10,9,11]-5 α -эстран-5,17 β -диол
К раствору 5,4 г описанного в пункте 4a) вещества в 45 мл тетрагидрофурана присоединяют 549 мг палладия на сульфате бария (10%-ный). Помещают аппарат в атмосферу водорода перемешивают 20 минут. Затем фильтруют реакционный раствор через целит и концентрируют в вакууме. После очистки получают 4,56 г 4b) в виде белой пены.
1H-NMR (CDCl3): δ = 5,73 ппм dbr (J = 10 Гц, 1H, мостик); 5,55m (2H); 5,47m (1H, мостик); 4,71m (1H, ТHП); 4,38m (2H, CH2OTHP); 3,85m (1H, ТHР); 3,50-3,65m (5H, кеталь и ТHР); 2,45m (1H, H-11); 0,99s (3H, Me-кеталь); 0,38s (3H, Me-кеталь); 0,94s (3H, C-18).
c) (Z)-9,11 α -дигидро-17 β -окси- 17 α -(3-окси-1-пропенил)-6'H-бензо[10,9,11]-эстр-4-ен-3-он
По общей прописи 1 превращают 1 г описанного в пункте 4b) вещества с 4 н. соляной кислотой в ацетоне. После кристаллизации сырого продукта из простого диизопропилового эфира получают 440 мг 4c) в виде, белых кристаллов.
Т.пл. = 219-221oC. [α]
1H-NMR (CDCl3: δ = 5,81 ппм sbr (1H, H-4); 5,70m (1H); 5,62dbr (J = 10 Гц, 1H, бугель); 5,59m (2H); 4,26m (2H, CH2OH); 2,63m (1H, H-11); 1,00s (3H, С-18).
Пример 5
9,11 α -дигидро-17 β-окси-17 α -(3-оксипропил)-6'H-бензо -[10,9,11]эстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 17 α -[3-[(тетрагидро-2H-пиран-2-ил)окси] пропил]6'H-бензо [10,9,11]-5 α -эстран-5,17 β -диол
К раствору 3,56 г описанного в пункте 4b) вещества в 175 мл этилацетата прибавляют 360 мг палладия на активированном угле (10%). Устанавливают аппарат в атмосфере водорода и перемешивают 1 ч при комнатной температуре. Затем фильтруют реакционную смесь через целит и концентрируют в вакууме. Полученный сырой продукт (3,49 г) применяют без очистки в следующей стадии.
b) 9,11 α -дигидро-17 β-окси-17 α -(3-оксипропил)- 6'H-бензо-[10,9,11] эстр-4-ен-3-он
По общей прописи 1) превращают 3,23 г 5a) с 4 н. соляной кислотой в ацетоне. После очистки получают 1,5 г 5b) в виде белой пены.
[α]
1H-NMR (CDCl3); δ = 5,81 ппм sbr (1H, H-4); 5,63dbr (J = 10 гц, 1H, мостик); 5,50m (1H, мостик); 3,60-3,75m (2H, CH2OH); 2,68m (1H, H-11); 0,96s (3H, C-18).
Пример 6
5'', 4'', 9,11 α -тетрагидроспиро[6'H-бензо[10,9,11]эстр- 4-ен-17 β , 2''(5'')-фуран]-3,5''-дион
По общей прописи 3) превращают 700 мг описанного в пункте 5b) вещества, 1,1 г трехокиси хрома и 3,62 мл пиридина в дихлорметане. После очистки получают 485 мг 6) в виде белой пены.
[α]
1H-NMR (CDCl3); δ = 5,82 ппм sbr (1H, H-4); 5,58m (2H, мостик); 2,71m (1H, H-11); 1,02s (3H, C-19).
Пример 7
5'', 4'', 9,11 α -тетрагидроспиро[6'H-бензо[10,9,11] эстр-4-ен- 17 β , 2''(5'')-фуран]-3-он.
600 мг описанного в пункте 5b) соединения растворяют в 40 мл дихлорметана. Перемешивают с 3,3 мл триэтиламина. Охлаждают до 0oC и прибавляют 770 мг хлорангидрида p-толуолсульфокислоты. После этого перемешивают 1 ч при 0oC и 6 ч при комнатной температуре и обрабатывают затем водой (B, F). После очистки получают 380 мг 7) в виде белой пены.
1H-NMR (CDCl3): δ = 5,82 ппм sbr (1H, H-4); 5,62dbr (J = 10 Гц, 1H, мостик); 5,55m (1H, мостик); 3,70-3,81m (2H, простой спироэфир); 2,63m (1H, H-11); 0,93s (3H, C-18)
Т.пл. = 127,3oC. [α]
Пример 8
9,11 α -дигидро-17 β -окси-17 α -(1,3-пентадиинил)-6'H-бензо [10,9,11] эстр-4-ен-3-он
700 мг описанного в пункте 2b) вещества растворяют в 60 мл триэтиламина. Насыщают раствор при комнатной температуре газообразным пропином, присоединяют 250 мг тетракис (трифенилфосфин)палладия и 120 мг йодида меди(I), нагревают до 60oC и при сохранении потока пропина перемешивают 1 ч при этой температуре. Затем фильтруют реакционный раствор через целит и концентрируют в вакууме. После очистки получают 311 мг 8) в виде белой пены.
1H-NMR (CDCl3): δ = 5,80 ппм sbr (1H, H-4); 5,58m (2H, мостик); 2,70m (1H, H-11); 1,95s (3H, бутинил); 0,82s (3H, метил).
Пример 9
9,11 α -дигидро-17 α -этинил-17 β -окси-6'H-бензо[10,9,11]- эстра-4,15-диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -17-[(триметилсилил)окси-6'H-бензо[10,9,11]-5 α -эстр-16-ен-5-ол
По общей прописи 4a) превращают 2,7 г описанного в пункте 1e) вещества с 3,2 мл диизопропиламина, 14,4 мл 1,6-молярного раствора н-бутиллития в гексане и 4 мл триметилхлорсилана в абсолютном тетрагидрофуране. После перекристаллизации сырого продукта из ацетонитрила получают 2,5 г 9a).
b) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис- окси)]-5-окси-6'H-бензо-[10,9,11]-5 α -эстр-15-ен-17-он
По общей прописи 4b) превращают 2,5 г описанного в пункте 9a) соединения с 1,3 г ацетата палладия (II) в ацетонитриле. После очистки получают 1,8 г 9b).
1H-NMR (CDCl3): δ = 7,52 ппм dbr (J = 6 Гц, 1H, H-15); 5,98dd (J = 6,3 Гц, 1H, H-16); 5,60dbr (J = 10 Гц, 1H, мостик); 5,50m (1H, мостик); 4,47s (3H, OH); 3,50-3,60m (4H, кеталь); 2,60m (1H, H-11); 1,18s (3H, C-18); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь).
с) 9,11 α -дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 17 α -этинил-6'H-бензо[10,9.11]-5 α -эстр-15-ен-5,17 β -диол.
По общей прописи 2) превращают 1,8 г 9b), 15 мл 1,6- молярного раствора н-бутиллития в гексане и газообразного этина в абсолютном тетрагидрофуране. Получают 1,59 г 9c), который без очистки применяют в следующей стадии.
d) 9,11 α -дигидро-17 α -этинил-17 β -окси-6'H- бензо[10,9,11]-эстра-4,15-диен-3-он
По общей прописи 1) превращают 1,59 г 9c) с 4 н. соляной кислотой в ацетоне. После очистки получают 970 мг 9d).
1H-NMR (CDCl3): δ = 6,00 dbr (J = 6 Гц, 1H, H-15); 5,72sbr (1H, H-4); 5,21dd (J = 6,3 Гц, 1H, H-16); 5,60 (2H, мостик); 2,77m (1H, H-11); 2,60s (1H, этин); 1,00s (3H, C-18).
Т.пл. = 98oC. [α]
Пример 10
9,11 α -дигидро-17 β -окси-17 α -(1- пропинил)-6'H-бензо-[10,9,11]эстра-4,15-диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил- 1,3-пропандиилбис(окси)]-17 α -(1-пропинил-6'H- бензо[10,9,11]-5 α -эстр-15-ен-5,17 β -диол
По общей прописи 2) превращают 1 г 9b), 15 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране. Получают 1 г 10a), который без очистки применяют в следующей стадии.
b) 9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо- [10,9,11] эстра-4,15-диен-3-он
По общей прописи 1) превращают 1 г 10a) с 4 н соляной кислотой в ацетоне. После очистки получают 610 мг 10b).
[α]
1H-NMR (CDCl3: δ = 5,94 dbr (J = 6 Гц, 1H, H-15); 5,72 sbr (1H, H-4); 5,20dd (J = 6,3 Гц, 1H, H-16); 5,60 (2H, бугель); 2,73m (1H, H-11); 1,90s (3H, пропил); 0,99 (3H, C-18).
Пример 11
9,11 α -дигидро-17 β -окси-17 α -метил-6'H- бензо[10,9,11]-эстра-4,14-диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5-окси-6'H-бензо[10,9,11]-5 α -эстр-14-ен-17-он
2,3 г описанного в пункте 9b) вещества растворяют в 300 мл смеси из этилацетата и гексана (9:1). Прибавляют 180 г силикагеля и 35 мл триэтиламина и перемешивают 2 дня при комнатной температуре. Затем фильтруют через целит и концентрируют. Получают 1,02 г a) наряду с 1,15 г исходного вещества.
1H-NMR (CDCl3: δ = 5,65 ппм dbr (J = 10 Гц, 1H, мостик); 5,55m (1H, мостик); 5,52m (1H, H-15); 4,40s (1H, OH); 3,50-3,62m (4H, кеталь); 3,00ddd (J = 20, 3,1 Гц, 1H, H-16); 2,80dt (J = 20, 1,5 Гц, 1H, H-16); 2,51m (1H, H-11); 1,12s (3H, C-18); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь).
б) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -метил-6'H- бензо[10,9,11]-5 α -эстр-14-ен-5,17 β -диол.
2,5 г безводного трихлорида церия прибавляют к 20 мл абсолютного тетрагидрофурана. Перемешивают суспензию 1 ч, затем охлаждают до 0oC и прибавляют 3,34 мл 3-молярного раствора магнийхлорметила в абсолютном тетрагидрофуране. Перемешивают еще 1,5 ч при 0oC и затем прибавляют раствор 413 мг описанного в пункте 11a) вещества в 5 мл абсолютного тетрагидрофурана. Потом перемешивают 30 мин при 0oC и после этого обрабатывают водой (C, F). После очистки получают 170 мг 11b).
1H-NMR (CDCl3): δ = 5,60 ппм dbr (J = 10 Гц, 1H, мостик); 5,52m (1H, мостик); 5,18m (1H, H-15); 4,40s (1H, OH); 3,50-3,62m (4H, кеталь); 2,52m (1H, H-11); 2,42dtr (J = 10,1 Гц, 1H, H-16); 2,30dtr (J = 20,1 Гц, 19, H-16); 1,22s (3H, 17-метил); 1,10s (3H, C-18); 0,98s (6H, Me-кеталь).
c) 9,11 α -дигидро-17 β -окси-17 α -метил-6'H- бензо-[10,9,11]эстра-4,14-диен-3-он
По общей прописи 1) превращают 170 мг описанного в пункте 11b) соединения с 4 н. соляной кислотой в ацетоне. После очистки получают 100 мг 11c).
[α]
1H-NMR (CDCl3): δ = 5,83sbr (1H, H-4); 5,68dbr (J = 10,0 Гц, 1H, мостик); 5,62m (1H-мостик); 5,18m (1H, H-15); 1,23s (3H, 17-метил); 1,13s (3H, C-18).
Пример 12
9,11 α -дигидро-17 β -окси-17 α -(1- пропинил)-6'H-бензо-[10,9,11]эстра-4,14-диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(1-пропинил)-6'H-бензо[10,9,11]-5 α -эстр-14-ен-
5,17 β -диол
По общей прописи 2) превращают насыщенный раствор газообразного пропина в 30 мл абсолютного тетрагидрофурана с 6,25 мл 1,6-молярного раствора н-бутиллития в гексане. Прибавляют этот раствор к суспензии 2,5 г безводного трихлорида церия в 20 мл абсолютного тетрагидрофурана, которая предварительно была обработана по аналогии с примером 11b. Затем аналогично примеру 11b) превращают с раствором 413 мг описанного в пункте 11a) вещества в абсолютном тетрагидрофуране. Получают 420 мг сырого продукта, который без очистки применяют в следующей стадии.
b) 9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H- бензо-[10,9,11] эстра-4,14-диен-3-он
По общей инструкции 1) превращают 420 мг 12a) с 4 н. соляной кислотой в ацетоне. После очистки получают 200 мг 12b) в виде белой пены.
1H-NMR (CDCl3): δ = 5,82 ппм sbr (1H, H-4); 5,69dbr (J = 10 Гц, 1H, мостик); 5,62m (1H, мостик); 5,15m (1H, H-15); 1,88s (3H, пропин); 1,15s (3H, C-18).
Пример 13
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11] -19-норпрегн-4-ен-3,20-дион
а) 9,11 α -дигидро-5,17 α -диокси-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-6'H-бензо[10,9,11]-5 α -эстран-17 β -карбонитрил
10 г описанного в пункте 1e) вещества растворяют в 50 мл 2-окси-2-метилпропаннитрила вместе с 0,74 мл 20%-ного водного раствора гидроокиси натрия при 80oC. Осажденный после охлаждения продукт отфильтровывают и перекристаллизовывают из простого диизопропилового эфира. Получают 8,6 г 13a) в виде белых кристаллов.
1H-NMR (CDCl3): δ = 5,58 ппм dbr (J = 10,0 Гц, 1H, мостик); 5,50m (1H, мостик); 4,60 (1H, ОН); 3,50-3,62m (4H, кеталь); 2,59m (1H, H-11); 1,00s (3H, Me-кеталь); 0,97s (3H, Me-кеталь); 0,96s (3H, C-18).
b) 9,11 α -дигидро-17-окси-6'H-бензо[10,9,11]-19-норпрегн- 4-ен-3,20-дион
К раствору 4 г описанного в пункте 13a) соединения в 100 мл простого диэтилового эфира прибавляют 350 мг p-толуолсульфокислоты и 8,8 мл этоксиэтена. Перемешивают 30 мин при комнатной температуре и затем обрабатывают водой (B, F). Полученный сырой продукт снова растворяют в 100 мл простого диэтилового эфира, охлаждают до 0oC и присоединяют 16 мл 1,6-молярного раствора метиллития в простом диэтиловом эфире. Перемешивают 3 ч при 0oC и затем обрабатывают водой (C, F). Полученный сырой продукт превращают по общей прописи 1). После кристаллизации из диизопропилового простого эфира/метанола получают 2,9 г 13b) как белые кристаллы.
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,55m (2H, мостик); 2,27s (3H, ацетил); 0,71s (3H, C-18).
13c) 17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11]- 19-норпрегн-4-ен-3,20-дион
К суспензии 2,9 г описанного в пункте 13b) вещества в 40 мл ледяной уксусной кислоты добавляют при 0oC 15 мл ангидрида трифторуксусной кислоты. Перемешивают 4 ч при комнатной температуре и обрабатывают затем водой (B, F). После очистки получают 2,3 г 13c).
Т.пл. = 223oC. [α]
1H-NMR (CDCl3: δ = 5,82 ппм sbr (1H, H-4); 5,56m (2H, мостик); 2,72m (1H, H-11); 2,15s (3H, ацетил); 2,10s (3H, ацетокси); 0,70s (3H, C-18).
Пример 14
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11]-19-норпрегн- 4,6-диен-3,20-дион
a) 17-(ацетилокси)-9,11 α -дигидро-3-этокси-6'H-бензо [10,9,11]-19-норпрегна-3,5-диен-20-он.
Смесь 800 мг описанного в пункте 13c) вещества, 2 мл триэтилортоформиата, 2 мл этанола и 40 мг p-толуолсульфокислоты в 20 мл тетрагидрофурана перемешивают 1 ч при 40oC. Затем обрабатывают водой (B, F). Полученный сырой продукт (850 мг) без очистки вводят в следующую стадию.
b) 17-(ацетилокси)-6 β -бром-9,11 α -дигидро-6'H-бензо [10,9,11]-19-норпрегн-4-ен-3,20-дион.
К раствору 850 мг описанного в пункте 14a) вещества в 10 мл диоксана прибавляют 4 мл 10%-ного водного раствора ацетата натрия и затем 285 мг 1,3-дибром-5,5-диметилгидантоина. Перемешивают 5 мин при 0oC и обрабатывают водой (B, F). После очистки получают 600 мг 14b).
1H-NMR (CDCl3): δ = 6,02 ппм sbr (1H, H-4); 5,60m (1H, мостик); 5,52 dbr (J = 10 Гц, 1H, мостик); 5,05 dbr (J = 4 Гц, 1H, H-6α); 2,28m (1H, H-11); 2,15s (3H, ацетил); 2,10s (3H, ацетокси); 0,79s (3H, C-18).
c) 17-(ацетилокси)-9,11 α -дигидро-6'H- бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион
Смесь 600 мг описанного в пункте 14b) вещества, 550 мг бромида лития и 375 мг карбоната лития в 10 мл N,N-диметиформамида перемешивают 1 ч при 100oC. Затем обрабатывают водой (A, F). После очистки получают 435 мг 14c).
[α]
1H-NMR (CDCl3): δ = 6,13 ппм m (2H, H-6, H-7); 5,73sbr (1H, H-4); 5,60m (2H, мостик); 2,79m (1H, H-11); 2,15s (3H, ацетил); 2,10s (3H, ацетокси); 0,73s (3H, C-18).
Пример 15
17-(ацетилокси)-6-хлор-9-11 α -дигидро-6'H- бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион
a) 17-(ацетилокси)-9,11 α -дигидро-6 α,7α -эпокси- 6'H-бензо[10,9,11]-19-норпрегн-4-ен-3,20-дион
К раствору 2 г описанного в пункте 14c) соединения в 50 мл дихлорметана прибавляют 1,8 г m-надхлорбензойной кислоты (70%). Перемешивают 8 ч при комнатной температуре. Затем выливают реакционную смесь в насыщенный водный раствор бикарбоната натрия, экстрагируют дихлорметаном и промывают органическую фазу насыщенным раствором тиосульфата натрия и насыщенным раствором хлорида натрия. Очистка дает 832 мг 15a)
1H-NMR (CDCl3): δ = 6,20s (1H, H-4); 5,55m (2H, мостик); 3,52d (J = 4 Гц, 1H, H-6); 3,45dbr (J = 4 Гц, 1H, H-7); 2,70m (1H, H-11); 2,15s (3H, ацетил); 2,10s (3H, ацетокси); 0,73s (3H, C-18).
b) 17-(ацетилокси)-6 β -хлор-9,11 α -дигидро-7 α- окси-6'H-бензо[10,9,11]-19-норпрегн-4-ен-3,20-дион
К раствору 832 мг описанного в пункте 15a) соединения в 20 мл ледяной уксусной кислоты добавляют 4,8 г хлорида лития. Перемешивают 1,5 ч и затем обрабатывают водой (B, F). Полученный сырой продукт (900 мг) без очистки вводят в следующую стадию.
c) 17-(ацетилокси)-6 β -хлор-9,11 α -дигидро-7 α -[(метилсульфонил)окси] -6'H-бензо-[10,9,11]-19-норпрегн-4-ен- 3,20-дион
К раствору 900 мг описанного в пункте 15b) вещества в 10 мл пиридина добавляют при 0oC 1,2 мл хлорангидрида метансульфокислоты. Перемешивают 2 ч при комнатной температуре, затем выливают реакционную смесь в насыщенный водный раствор хлорида натрия и экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором хлорида натрия. Полученный сырой продукт без очистки вводят в следующую стадию.
d) 17-(ацетилокси)-6-хдор-9,11 α -дигидро-6'H- бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион
К раствору 930 мг описанного в пункте 15c) вещества в 25 мл N,N-диметилформамида добавляют 3,5 г безводного ацетата натрия. Нагревают до 100oC и перемешивают 1,5 ч при этой температуре. Затем реакционную смесь выливают на ледяную воду. Перемешивают еще 1 ч и после этого отфильтровывают осадок. После очистки сырого продукта получают 450 мг 15d).
Т.пл. = 225oC. [α]
1H-NMR (CDCl3): δ = 6,40 ппм sbr (1H, H-4); 6,35d (J = 2 Гц, 1H, H-7); 5,60m (2H, мостик); 2,80m (1H, H-11); 2,13s (3H, ацетил); 2,09s (3H, ацетокси); 0,72s (3H, C-18).
Пример 16
17-(ацетилокси)-9,11 α -дигидро-6-метилен-6'H- бензо[10,9,11]-19-норпрегн-4-ен-3,20-дион
3 г описанного в примере 13c) вещества растворяют в 75 мл тетрагидрофурана. Присоединяют 7,5 мл этанола, 7,5 мл триэтилортоформиата и 170 мг p-толуолсульфокислоты. Затем перемешивают 1 ч при 40oC. После этого прибавляют 2,3 мл N-метиланилина и 2,6 мл 37%-ного водного раствора формальдегида. Перемешивают еще 30 мин при 40oC. Потом охлаждают до комнатной температуры и добавляют 7,5 мл концентрированной соляной кислоты. Перемешивают еще 3 ч при комнатной температуре и обрабатывают водой (A, E, F). После очистки получают 2 г 16).
1H-NMR (CDCl3): δ = 6,02 ппм sbr (1H, H-4); 5,55m (2H, мостик); 5,15m (1H, экзометилен); 5,02m (1H, экзометилен); 2,76m (1H, H-11); 2,13s (3H, ацетил); 2,10s (3H, ацетокси); 0,72s (3H, C-18).
Пример 17
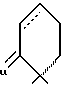
17-(ацетилокси)-9,11 α -дигидро-6 α -метил-6'H-бензо- [10,9,11]-19-норпрегн-4-ен-3,20-дион
2 г описанного в пункте 16) вещества растворяют в 30 мл этанола. Прибавляют 3 мл циклогексана и 250 мл палладия на активированном угле (10%). После этого кипятят 1 ч при флегме. Затем фильтруют реакционный раствор через целит. Концентрируют в вакууме, поглощают остаток в 30 мл ацетона, присоединяют 1,4 мл 4 н. соляной кислоты и перемешивают 2,5 ч при 40oC. Обработка водой (B, F) и очистка дает 1,1 г 17).
Т.пл. = 248oC, [α]
1H-NMR (CDCl3): δ = 5,90 ппм sbr (1H, H-4); 5,57m (2H, мостик); 2,73m (1H, H-11); 2,13s (3H, ацетил); 2,09s (3H, ацетокси); 1,12d (J = 6 Гц, 3H, 6 α -метил); 0,72s (3H, C-18).
Пример 18
17-(ацетилокси)-9,11 α -дигидро-6-метил-6'H-бензо[10,9,11] - -19-норпрегна-4,6-диен-3,20-дион
К 0,25 мл циклогексена в 15 мл этанола добавляют 125 мг палладия на активированном угле (10%). Кипятят 1 ч с обратным холодильником и затем присоединяют раствор 500 мг описанного в пункте 16) вещества в 5 мл этанола. После этого кипятят еще 2 ч. Потом фильтруют через целит, концентрируют в вакууме. После очистки получают 400 мг 18).
Т.пл. = 203,0oC. [α]
1H-NMR (CDCl3): δ = 6,0 ппм sbr (1H, H-7); 5,92sbr (1H, H-4); 5,60m (2H, мостик); 2,77m (1H, H-11); 2,14s (3H, ацетил); 2,10s (3H, ацетокси); 1,88sbr (3H, 6-метил); 0,73s (3H, C-18).
Пример 19
17 β -окси-17  -метил-4',5',9,11 α -тетрагидро- 6'H-бензо-[10,9,11]-эстр-4-ен-3-он
-метил-4',5',9,11 α -тетрагидро- 6'H-бензо-[10,9,11]-эстр-4-ен-3-он
a) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5-окси-4',5', 9,11 α -тетрагидро-6'H-бензо[10,9,11]-5 α -эстран-17-он
Гидрирование при применении палладия на активированном угле.
К раствору 1,6 г описанного в пункте 1e) вещества в 65 мл этанола прибавляют 165 мг палладия на активированном угле (10%). Устанавливают аппарат под давлением водорода 15 бар и проводят реакцию в течение 2 ч. Затем фильтруют через целит и концентрируют в вакууме. Получают 1,5 г 19a), который без очистки применяют дальше.
Гидрирование при применении окиси платины.
К раствору 1 г описанного в пункте 1e) вещества в смеси из 24 мл этилацетата и 6 мл тетрагидрофурана добавляют 100 мг окиси платины(IV). Устанавливают аппарат в атмосфере водорода и перемешивают 1 ч при комнатной температуре. Затем фильтруют реакционный раствор через целит и концентрируют. После очистки получают 600 мг 19a) и 150 мг 3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-4',5',9,11 α -тетрагидро-6'H- бензо[10,9,11]-5 α -эстран-5,17 β -диола.
1H-NMR (CDCl3): δ = 4,30 ппм s (1H, OH); 3,50-3,60m (4H, кеталь); 2,40dd (J = 17,9 Гц, 1H, H-16); 1,00s (3H, C-18); 0,96s (3H, Me-кеталь); 0,94s (3H, Me-кеталь).
b) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)] -17 α -метил-4',5',9,11 α -тетрагидро-6'H-бензо[10,9,11]-5 α -эстран- 5,17β-диол
Аналогично примеру 1) превращают 1,65 г полученного в пункте 19a) вещества в 30 мл абсолютного тетрагидрофурана с 18,8 мл 1,6- молярного раствора метиллития в простом диэтиловом эфире. Получают 1,5 г 19b), который без очистки применяют в следующей стадии.
c) 17 β -окси-17 α -метил-4',5',9,11 α -тетрагидро-6'H-бензо-[10,9,11] эстр-4-ен-3-он
По общей инструкции 1) превращают 1,5 г описанного в пункте 19b) вещества с 4 н. соляной кислотой в ацетоне. После очистки получают 0,97 г 19c) в виде белой пены.
[α]
1H-NMR (CDCl3): δ = 5,75 ппм sbr (1H, H-4); 1,22s (3H, метил); 1,03s (3H, C-19).
Пример 20
17 β -окси-17 α -(1-пропинил)-4', 5', 9,11 α -тетрагидро-6'H- бензо[10,9,11]эстр-4-ен-3-он
a) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-17 α -(1- пропионил)-4',5', 9,11 α -тетрагидро-6'H-бензо[10,9,11]-5α- эстран-5,17 β -диол
По общей инструкции 2) превращают 1 г описанного в пункте 19a) соединения и 15 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране. Полученный сырой продукт (1,19 г) вводят без очистки в следующую стадию.
b) 17 β -окси-17 α -(1-пропинил)-4', 5',9,11 α -тетрагидро-6'H-бензо[10,9,11]эстр-4-ен-3-он
По общей инструкции 1) превращают 1,19 г 20a) с 4 н. соляной кислотой в ацетоне. После очистки получают 720 мг 20b)
Т.пл. = 186,7oC. [α]
1H-NMR (CDCl3): δ = 573 ппм s (1H, H-4); 1,84s (3H, пропин); 1,01s (3H, C-18).
Пример 21
17 β -окси-17 α -(1-пропинил)-4', 5', 9,11 α -тетрагидро- 6'H-бензо[10,9,11]-эстра-4,15-диен-3-он
a) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)] - 4',5',9,11 α - тетрагидро-17-[(триметилсилил)окси]-6'H- бензо[10,9,11]-эстр-16-ен-5-ол
При общей инструкции 4a) превращают 1 г описанного в пункте 19a) соединения с 1,2 мл диизопропиламина, 5,6 мл 1,6-молярного раствора н-бутиллития в гексане и 1,5 мл триметилхлорсилана в абсолютном тетрагидрофуране. Перекристаллизацией сырого продукта из ацетонитрила получают 940 мг 21a).
b) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5-окси-4',5',9, 11 α -тетрагидро-6'H-бензо[10,9,11]-5 α -эcтр-15-ен-17-он
По общей инструкции 4b) превращают 940 мг 21a) с 475 мг ацетата палладия (II) в ацетонитриле. После очистки получают 650 мг 21b).
1H-NMR (CDCl3): δ = 7,52 ппм dbr (J = 6 Гц, 1H, H-15); 5,96dd (J = 6,3 Гц, 1H, H-16); 4,45s (1H, OH); 3,50-3,60m (4H, кеталь); 1,21s (3H, C-18); 1,00s (3H, Me-кеталь); 0,97s (3H, Me-кеталь).
c) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-17 α -(1- пропинил)-4',5', 9,11 α -тетрагидро-6'H-бензо[10,9,11]-5α- эстр-15-ен-5,17 β -диол
По общей инструкции 2) из 650 мг 21b), 10 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропила в абсолютном тетрагидрофуране получают 712 мг 21c). Сырой продукт без очистки вводят в следующую стадию.
d) 17 β -окси-17 α -(1-пропинил)-4', 5',9,11 α -тетрагидро-6'H-бензо[10,9,11]-эстра-4,15-диен-3-он
По общей инструкции 1) превращают 712 мг 21c) с 4 н. соляной кислотой в ацетоне. После очистки получают 440 мг 2ld).
[α]
1H-NMR (CDCl3): δ = 5,98 ппм dbr (J = 6,0 Гц, 1H, H-15); 5,76sbr (1H, H-4); 5,70dd (J= 6,3 Гц, 1H, H-16); 1,90s (3H, пропин); 1,09s (3H, C-18).
Пример 22
5',6'-дигидро-17 β -окси-17 α -(1- пропинил)-9H-бензо[10,9,11]-эстр-4-ен-3-он
a) 5',6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5-окси-9H-бензо[10,9,11]-5 α -эстран-17-он
4 г описанного в пункте 1e) вещества растворяют в 120 мл смеси из тетрагидрофурана и этанола (1:1). Прибавляют 25 мл циклогексена и 1 г палладия на активированном угле (10%) и кипятят 24 ч при флегме. Затем фильтруют через целит и концентрируют в вакууме. После очистки получают 1,9 г 22a).
1H-NMR (CDCl3): δ = 5,29 ппм m (1H, мостик/11-экзо); 4,40s (1H, OH); 3,50-3,60m (4H, кеталь); 2,43dd (J = 17,9 Гц, 1H, H-16); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь); 0,80s (3H, C-18).
b) 5', 6'-дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 17 α -(1-пропинил)-9H-бензо[10,9,11]-5 α -эстран- 5,17- β диол
По общей инструкции 2) из 1 г описанного в пункте 22a) вещества и 15 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране получают 1,1 г 22b) как сырой продукт, который без очистки применяют в следующей стадии.
c) 5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо[10,9,11] экстр-4-ен-3-он
По общей инструкции 1 превращают 1,1 г описанного в пункте 22b) вещества с 4 н. соляной кислотой в ацетоне. После очистки получают 640 мг 22c).
Т.пл. = 197,3oC, [α]
1H-NMR (CDCl3): δ = 5,27 ппм sbr (1H, H-4); 5,48m (1H, мостик/11-экзо); 1,86s (3H, пропин); 0,80s (3H, C-18).
Пример 23
5', 9'-дигидро-17 β -окси-17 α -(1-пропинил)- 9H-бензо[10,9,11]эстра-4,15-диен-3-он
a) 5', 6'-дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)] - 17-триметилсилил)окси]-9H-бензо[10,9,11]-5 α -эстр-16-ен-5-ол
По общей инструкции 4a) превращают 1 г описанного в пункте 22a) вещества с 1,2 мл диизопропиламина, 5,6 мл 1,6-молярного раствора н-бутиллития в гексане и 15 мл триметилхлорсилана в абсолютном тетрагидрофуране. После перекристаллизации сырого продукта из ацетонитрила получают 920 мг 23a).
b) 5',6'-дигидро-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]- 5-окси-9H-бензо[10,9,11]-5 α -эстр-15-ен-17-он.
По общей инструкции 4b) превращают 920 мг описанного в пункте 23a) соединения с 470 мг ацетата палладия(II) в ацетонитриле. После очистки получают 630 мг 23b).
1H-NMR (CDCl3): δ = 7,55 ппм dbr (J = 6 Гц, 1H, H-15); 6,02dd (J = 6,3 Гц, 1H, H-16); 5,48 (1H, мостик/11-экзо); 4,42s (1H, OH); 3,50-3,60m (4H, кеталь); 1,04s (3H, C-18); 1,00s (3H, Me-кеталь); 0,97s (3H, Me-кеталь).
c) 5', 6'-дигидро-3,3-[2,2-димeтил-1,3-пропандиилбис(окси)]- 17 α -(1-пропинил)-9H-бензо-[10,9,11]-5 α -эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 630 мг 23b) с 10 мл 1,6-молярного раствора н-бутиллития и газообразного пропина в абсолютном тетрагидрофуране. Сырой продукт (685 мг) без очистки применяют в следующей стадии.
d) 5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо-[10,9,11]эстра-4,15-диен-3-он
По общей инструкции 1) превращают 685 мг 23b) с 4 н. соляной кислотой в ацетоне. После очистки получают 430 мг 23d).
[α]
1H-NMR (CDCl3): δ = 5,97 ппм dbr (J = 6 Гц, 1H, H-15); 5,78sbr (1H, H-4); 5,73dd (J = 6,3 Гц, 1H, H-16); 5,40m (1H, мостик/11-экзо); 1,90s (3H, пропил); 0,90s (3H, C-18).
Пример 24
17-(ацитилокси)-5', 6'-дигидро-9H-бензо[10,9,11]-19-норпрегн-4-ен-3,20-дион
a) 5', 6'-дигидро-5,17 α -диокси-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-9H-бензо[10,9,11]-5 α -эстран- 17 β -карбонитрил
По аналогии с примером 13a) из 1,6 г описанного в пункте 22a) соединения, 8 мл 2-окси-2-метилпропаннитрила и 0,15 мл 20%-ного водного раствора гидроокиси натрия получают 1,3 г 24a).
1H-NMR (CDCl3): δ = 5,38 ппм m (1H, мостик/11-экзо); 4,50s (1H, OH); 3,50-3,60m (4H, кеталь); 1,00s (3H, Me-кеталь); 0,98s (3H, Me-кеталь); 0,90s (3H, С-18).
b) 5',6'-дигидро-17-окси-9H-бензо[10,9,11]-19-норпрегн-4- ен- 3,20-дион
По аналогии с примером 13b) превращают 1,3 г описанного в пункте 24a) вещества с 2,8 мл этоксиэтена и 120 мг p-толуолсульфокислоты в простом диэтиловом эфире. Полученный сырой продукт снова растворяют в простом диэтиловом эфире и превращают с 5 мл 1,6-молярного раствора метиллития в простом диэтиловом эфире. Полученный сырой продукт (по общей инструкции 1) расщепляют при помощи 4 н. соляной кислоты в ацетоне. После перекристаллизации из диизопропилового простого эфира/метанола получают 700 мг 24b).
1H-NMR (CDCl3): δ = 5,77 ппм sbr (1H, H-4); 5,32m (1H, мостик/11-экзо); 2,28s (3H, ацетил); 0,78s (3H, С-18).
c) 17-ацетилокси)-5', 6'-дигидро-9H-бензо[10,9,11] -19- норпрегн-4-ен-3,20-дион
700 мг описанного в пункте 24b) соединения превращают по аналогии с 13c) с 9 мл ледяной уксусной кислоты и 3,5 мл ангидрида трифторуксусной кислоты. После очистки получают 520 мг 24c).
1H-NMR (CDCl3): δ = 5,79 ппм sbr (1H, H-4); 5,48m (1H, мостик/11-экзо); 2,15s (3H, ацетил); 2,10s (3H, ацетокси); 0,62s (3H, С-18).
Пример 25
9,11 α -дигидро-17 α -этинил-17 β-окси-6'H бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 17 β -окси-18a-гомоэстр-5(10)-ен-3-он
В суспензии 355 г 17 β -окси-3-метокси-18a-гомоэстра- 2,5(10)-диена в 4 л ацетона прикалывают в течение 15 мин раствор 252 г дигидрата щавелевой кислоты в 2 л воды, затем перемешивают 3 ч, потом замешивают в 3,6 л воды и дважды экстрагируют, каждый раз 2 л дихлорметана. Соединенные органические фазы дважды промывают, каждый раз 1,5 л насыщенного раствора бикарбоната натрия, сушат над сульфатом натрия и концентрируют в вакууме. После перекристаллизации из уксусного эфира получают 293 г 25a).
Т.пл. 103-105oC [α]
1H-NMR (CDCl3): δ = 3,78 ппм dd (J = 14, 7,5 Гц, 1H, H-17); 1,00t (J = 7,5 Гц, 3H, 18a-СH3).
b) 17 β -окси-18a-гомоэстра-4,9-диен-3-он
К раствору 290 г описанного в пункте 25a) соединения в 4 л пиридина медленно прибавляют при охлаждении 443 г пербромида пиридинийгидробромида таким образом, чтобы температура не превышала 25oC. Затем перемешивают 2 ч при 50oC после этого охлаждают в ледяной бане, замешивают в 4 л охлажденной льдом полуконцентрированной соляной кислоты и потом экстрагируют один раз 4 л и дважды по 2 л дихлорметана. Соединенные органические фазы промывают 4 л охлажденной льдом полуконцентрированной соляной кислоты, сушат над сульфатом натрия и концентрируют в вакууме. После диспергирования с теплым уксусным эфиром получают 147,5 г 25b). Хроматография маточного раствора дает дополнительно 415 г 25b).
Т.пл. 136-138oC, [α]
1H-NMR (CDCl3): δ = 5,68 ппм sbr (1H, H-4); 3,77dd (J = 14, 7,5 Гц, 1H, H-17); 1,08t (J = 7,5 Гц, 3H, 18a-CH3).
c) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)] -18a-гомоэстра- 5(10), 9(11)-диен-17 β -ол
К раствору 189 г описанного в пункте 25b) соединения в 1,8 л дихлорметана добавляют 180 г 2,2-диметилпропан-1,3-диола, 84 г триметилортоформиата и 1 г моногидрата p-толуолсульфокислоты. После 3 ч перемешивания разбавляют 1 л дихлорметана, промывают 2 л насыщенного раствора бикарбоната натрия, водную фазу дважды экстрагируют по 400 мл дихлорметана, и соединенные органические фазы после сушки над сульфатом натрия концентрируют в вакууме. Остаток растворяют в 200 мл дихлорметана, смешивают с 900 мл метанола и 180 г карбоната калия, и смесь нагревают 1 ч с обратным холодильником. Затем смесь сильно концентрируют в вакууме, смешивают с 2 л воды и после этого экстрагируют 2 л и еще трижды по 400 мл дихлорметана. После сушки соединенных органических фаз над сульфатом натрия и отвода растворителя в вакууме получают 252 г 25c), который без очистки вводят в следующую стадию.
1H-NMR (CDCl3): δ = 5,55 ппм m (1H, 11-H); 3,86dd (J = 14, 7,5 Гц, 1H, H-17); 3,40-3,68m (4H, кеталь); 1,07s (3H, Me-кеталь); 0,94t (J = 7,5 Гц, 3H, 18a-CH3); 0,90s (3H, Me-кеталь).
d) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5,10 α - эпокси-18a-гомо-5 α -эстр-9(11)-ен-17 β -ол
252 г описанного в пункте 25c) соединения растворяют в 1,2 л дихлорметана и смешивают с 59 г 2-(3-нитрофенил)-1,1,1- трифторэтанона и 190 мл насыщенного раствора бикарбоната натрия. При охлаждении в ледяной бане присоединяют 240 мл 30%-ного раствора перекиси водорода и перемешивают смесь 18 ч при Т < 10oC. После этого осторожно прикапывают 500 мл насыщенного раствора тиосульфата натрия, затем разбавляют 500 мл воды, разделяют фазы и водную фазу дважды экстрагируют, по 500 мл дихлорметана. Соединенные органические фазы промывают 500 мл насыщенного раствора хлорида натрия, дважды по 500 мл 5%-ного натрового щелока и снова 500 мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Получают 250 г сырого 25d), который без очистки применяют в следующей стадии.
1H-NMR (CDCl3): 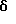 = 6,03 ппм m (1H, 11-H); 3,82m (1H, H-17); 3,36-3,63m (4H, кеталь); 1,07s (3H, Me-кеталь); 0,98t (J = 7,5 Гц, 3H, 18a-CH3); 0,87s (3H, Мe-кеталь).
= 6,03 ппм m (1H, 11-H); 3,82m (1H, H-17); 3,36-3,63m (4H, кеталь); 1,07s (3H, Me-кеталь); 0,98t (J = 7,5 Гц, 3H, 18a-CH3); 0,87s (3H, Мe-кеталь).
e) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-19-этинил-18a- гомо-5 α -андрост-9(11)-ен-5,17 β-диол
50 г описанного в пункте 25d) соединения по аналогии с 1a) превращают с образованным из 3-бром-пропина реактивом Гриньяра. После водной обработки (F) и очистки сырого продукта получают 33,6 г 25e).
Т.пл. 112-114oC, [α]
1H-NMR (CDCl3): δ = 5,42 ппм m (1H, H-11); 4,33s (1H, OH); 3,82m (1H, H-17); 3,42-3,60m (4H, кеталь); 1,88t (J = 1,5 Гц, 1H, этин); 0,99s (3H, Me-кеталь); 0,92s (3H, Me-кеталь); 0,92t (J = 7,5 Гц, 3H, 18a-CH3).
f) 19-(бромэтинил)-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-18a-гомо-5 α -андрост-9(11)-ен-5,17 β -диол
75,5 г описанного в пункте 25e) вещества превращают аналогично 1b) в 2 л ацетона с 2,99 г нитрата серебра и 32,9 г N-бромсукцинимида. Водная обработка (B, F) дает 96 г 25f), который без очистки применяют в следующей стадии.
g) 19-(2- бромэтенил)-3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-18a- гомо-5 α -андрост-9(11)-ен-5,17 β -диол.
96 г описанного в пункте 25 f) вещества превращают по аналогии с 1c) в 1,8 л смеси из тетрагидрофурана и воды (1:1) с 131 г гидразида p-толуолсульфокислоты и 67 г ацетата натрия. Водная обработка (B, F) и очистка дает 66,7 г 25 g) в виде светло-желтой пены.
[α]
1H-NMR (CDCl3): δ = 6,15 ппм m (1H, винил); 5,78m (1H, винил); 5,34m (1H, H-11)' 4,40s (1H, CH); 3,83dd (J = 14, 7,5 Гц, 1H, H-17); 3,46-3,58m (4H, кеталь); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,94t (J = 7,5 Гц, 3H, 18a-CH3).
h) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]- 6'H-бензо[10,9,11]-18a-гомо-5 α -эстран-5,17 β -диол
66,3 г описанного в пункте 25g) вещества превращают по аналогии с 1d) в 1,3 л толуола с 40 мл гидрида трибутилолова и 75 мг азобисизобутиронитрила. После очистки сырого продукта получают 31 г 25h).
Т.пл. = 213-215oC. [α]
1H-NMR (CDCl3): δ = 5,70 ппм ddr (J = 10 Гц, 1H, бугель); 5,48m (1H, бугель); 4,37s (1H, OH); 3,70m (1H, 17-H); 3,48-3,63m (4H, кеталь); 1,07t (J = 7,5 Гц, 3H, 18a- CH3); 0,99s (3H, Me-кеталь); 0,97s (3H, Me-кеталь).
i) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилобис(окси)] -5-окси-6'H-бензо-[10,9,11]-18a-гомо-5 α -эстран-17-он
По общей инструкции 3) получают из 12,0 г описанного в пункте 25h) вещества, 16,7 г трехокиси хрома и 57 мл пиридина в 500 мл дихлорметана 11,0 г 25i) как белые кристаллы.
Т.пл.=200-203oC. [α]
1H-NMR (CDCl3): δ = 5,61 ппм dbr (J = 10 Гц, 1H, мостик); 5,52m (1H, мостик); 4,40s (1H, OH); 3,48-3,63 (4H, кеталь); 2,51m (1H, H-11); 0,99s (3H, Me-кеталь); 0,97s (3H, Me-кеталь); 0,79t (J = 7,5 Гц, 3H, 18a-CH3).
j) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -этинил-6'H-бензо-[10,9,11]- 18a-гомо-5 α -эстран- 5,17 β -диол.
По общей инструкции 2) превращают 750 мг описанного в пункте 25i) вещества и 11 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного этина в абсолютном тетрагидрофуране. После очистки получают 620 мг 25j) как белые кристаллы.
Т.пл. = 124oC. [α]
1H-NMR (CDCl3): δ = 5,72 ппм dbr (J = 10 Гц, 1H, мостик); 5,49m (1H, мостик); 4,40s (1H, OH); 3,50-3,65m (4H, кеталь); 2,60s (1H, этин); 2,50m (1H, H-11); 1,06t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (6H, Me-кеталь).
k) 9,11 α -дигидро-17 α -этинил-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 600 мг 25j) с 1,5 мл 4 н. соляной кислоты в ацетоне. После очистки сырого продукта получают 348 мг 25k) как белые кристаллы.
Т.пл. = 242-245oC, [α]
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,77dbr (J = 10 Гц, 1H, мостик); 5,58m (1H, мостик); 2,67m (1H, H-11); 2,62s (1H, этин); 1,08t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 26
9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H- бензо-[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(1-пропинил)-6'H-бензо-[10,9,11]-18a-гомо-5 α -эстран-5,17 β -диол
По общей инструкции 2) превращают 750 мг описанного в пункте 25i) соединения и 11 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране. Получают 705 мг 26a) в виде аморфного твердого вещества.
[α]
1H-NMR (CDCl3): δ = 5,71 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,46s (1H, OH); 3,50-3,63m (4H, кеталь); 2,50m (1H, H-11); 1,88s (3H, пропин); 1,06t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь).
b) 9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо [10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 890 мг описанного в пункте 26a) вещества с 2 мл 4 н. водного раствора соляной кислоты в ацетоне. После очистки сырого продукта получают 380 мг 26b) как белые кристаллы.
Т.пл. = 201-203oC. [α]
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,76dbr (J = 10 Гц, 1H, мостик); 5,56m (1H, мостик); 2,68m (1H, H-11); 1,87s (3H, пропин); 1,07t (J = 7,5 Гц, 3H, 18a-CH3)
Пример 27
9,11 α -дигидро-17 α -(1-бутинил)-17 β -окси- 6'H-бензо[10,9,17]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -бутинил-6'H-бензо[10,9,11]- 18a-гомо-5 α -эстран-5, 17β-диол
По общей инструкции 2) превращают 800 мг описанного в пункте 25i) соединения и 15 мл 1,6-молярного раствора н-бутиллития в гексане и 5 г 1-бутина в абсолютном тетрагидрофуране. Получают 545 мг 27a) в виде белых кристаллов.
Т.пл. = 186-191oC. [α]
1H-NMR (CDCl3): δ = 5,7 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,42s (1H, OH); 3,46-3,62m (4H, кеталь); 2,48m (1H, H-11); 2,23q (J = 7,5 Гц, 2H, бутин-CH2); 1,12t (J = 7,5 Гц, 3H, бутин-CH3); 1,06t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь).
b) 9,11 α -дигидро-17 α -(1-бутинил)-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 485 мг описанного в пункте 27a) вещества с 1 мл 4 н. водного раствора соляной кислоты в ацетоне. После очистки сырого продукта получают 323 мг 27b) в виде белых кристаллов.
Т.пл. = 143-146oC; [α]
1H-NMR (CDCl3): δ = 5,81 ппм sbr (1H, H-4); 5,77dbr (J = 10 Гц, 1H, мостик); 5,56m (1H, мостик); 2,68m (1H, H-11); 2,23q (J = 7,5 Гц, 2H, бутин-CH2); 1,12t (J = 7,5 Гц, 3H, бутин-CH3); 1,07t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 28
9,11 α -дигидро-17 α -этенил-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -этенил-6'H-бензо[10,9,11]-18a-гомо-5 α - эстран-5,17 β -диол
При 0oC в раствор 1,32 г тетравинилолова в 50 мл простого диэтилового эфира закапывают 14,5 мл 1,6-молярного раствора н-бутиллития в гексане и перемешивают 1 ч при комнатной температуре. После этого прибавляют раствор 1 г описанного в пункте 25i) соединения в 25 мл тетрагидрофурана. Перемешивают 1 ч при 0oC и затем обрабатывают водой (C, F). После очистки сырого продукта получают 660 мг 28a) в виде белых кристаллов
Т.пл. = 117-121oC. [α]
1H-NMR (CDCl3): δ = 6,08 ппм dd (J = 17, 5,10 Гц, 1H, винил); 5,7dbr (J = 10 Гц, 1H, мостик); 5,46m (1H, мостик); 5,12dd (J = 17,5, 2 Гц, 1H, винил); 5,07dd (J = 10, 2 Гц, 1H, винил); 4,38s (1H, OH); 3,48-3,60m (4H, кеталь); 2,42m (1H, H-11); 1,09t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (6H, Me-кеталь).
b) 9,11 α -дигидро-17 α -этенил-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 600 мг описанного в пункте 28a) вещества с 1,3 мл водного раствора 4 н. соляной кислоты в ацетоне. После очистки сырого продукта получают 406 мг 28b) в виде белых кристаллов.
Т.пл. = 170-173oC; [α]
1H-NMR (CDCl3): δ = 6,06 ппм dd (J = 17,5, 10 Гц, 1H, винил); 5,80 sbr (1H, H-4); 5,75dbr (J = 10 Гц, 1H, бугель); 5,56m (1H, бугель); 5,12dd (J = 17,5, 2 Гц, 1H, винил); 5,08dd (J = 10, 2 Гц, 1H, винил); 1,12t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 29
9,11  -дигидро-17 β -окси-17 α -(трифторметил)-6'H- бензо-[10,9,11]-18a-гомоэстр-4-ен-3-он
-дигидро-17 β -окси-17 α -(трифторметил)-6'H- бензо-[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(трифторметил)-5-(триметилсилилокси)-6'H- бензо[10,9,11]-18a-гомо-5 α -эстран-17 β -ол
В раствор 1 г описанного в пункте 25i) соединения в 15 мл тетрагидрофурана прикапывают при -10oC 1,7 мл трифторметилтриметилсилана и затем 2,8 мл одномолярного раствора тетра-н-бутиламмонийфторида в тетрагидрофуране. Перемешивают 30 мин, выливают на смесь из этилацетата и воды, экстрагируют водную фазу еще дважды этилацетатом, сушат соединенные органические фазы над сульфатом натрия и концентрируют в вакууме. Получают 1,39 г 29a) в виде белой пены, которую без очистки применяют в следующей стадии.
1H-NMR (CDCl3) δ: J = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,50m (1H, мостик); 3,63m (2H, кеталь); 3,30m (2H, кеталь); 2,50m (1H, H-11); 1,16s (3H, Me-кеталь); 1,04t (J = 7,5 Гц, 3H, 18a-CH3); 0,77s (3H, Me-кеталь); 0,14s (9H, Me3Si).
b) 9,11 α -дигидро-17 β -окси-17 α -(трифторметил)-6'H- бензо[10,9,11] -18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 1,38 г описанного в пункте 29a) вещества с 2,8 мл 4 н. водной кислоты в ацетоне. После очистки сырого продукта получают 302 мг 29b) в виде белой пены.
[α]
1H-NMR (CDCl3): δ = 5,80 ппм sbr (1H, H-4); 5,77dbr (J = 10 Гц, 1H, мостик); 5,58m (1H, мостик); 2,67m (1H, H-11); 1,08t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 30
9,11 α -дигидpo-17 α -(цианометил)-17 β -oкcи- 6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(цианометил)-6'H- бензо[10,9,11]-18a-гомо-5 α -эстран-5,17 β -диол
В полученный по общий инструкции 4a) из 2,8 мл диизопропиламина и 12,5 мл 1,6-молярного раствора н-бутиллития раствор литийдиизопропиламина закапывают при -70oC 0,82 г ацетонитрила, перемешивают 30 мин при -70oC и прибавляют затем раствор 1,29 г описанного в пункте 25i) вещества в 10 мл тетрагидрофурана и нагревают в течение 4 ч до -40oC. После водной обработки (C, F) и очистки получают 1,06 г 30a).
1H-NMR (CDCl3): δ = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,49m (1H, мостик); 4,40s (1H, ОН); 3,47-3,65m (4H, кеталь); 2,65 и 2,52 AВ-сигнал (JAB = 15 Гц, 2H, CH2CN); 2,50m (1H, H-11); 1,06t (J = 7,5 Гц, 3H, 18a-CH3); 0,93s (6H, Me-кеталь).
b) 9,11 α -дигидро-17 α -(цианометил)-17 β -окси-6'H-бензо-[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 1,04 г описанного в пункте 30a) вещества с 1,1 мл 4 н. водной соляной кислоты в ацетоне. После очистки сырого продукта получают 640 мг 28b) как белые кристаллы.
Т.пл. = 207-212oC
1H-NMR (CDCl3): δ = 5,80 ппм dbr (1H, H-4); 5,76dbr (J = 10 Гц, 1H, мостик); 5,59m (1H, мостик); 2,67 и 2,52 AВ-сигнал (JAB = 15 Гц, 2H, CH2CN); 1,10t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 31
9,11 α -дигидро-17 β -окси-17 α -(1,2- пропадиенил)-6'H-бензо-[10,9,11] -18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -[3-[(тетрагидро-2H-пиран-2- ил)окси] -1-пропинил]-6'H-бензо-[10,9,11]-18a-гомо-5 α -эстран- 5,17 β -диол
Из 10,7 мл 3-тетрагидро-2H-пиран-2-ил)окси]-1-пропина в 380 мл тетрагидрофурана и 48 мл 1,6-молярного раствора н-бутиллития в гексане получают при 0oC в атмосфере аргона литийорганическое соединение. 3атем прибавляют раствор 3,3 г описанного в пункте 25i) вещества в 80 мл абсолютного тетрагидрофурана. Перемешивают 1 ч при 0oC и после этого обрабатывают водой (C, F). После очистки получают 3,7 г 31a) как белую пену.
[α]
1H-NMR (CDCl3): δ = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,82m (1H, THP); 4,39s (1H, OH); 4,32m (2H, CH2OTHP); 3,87m (1H, THP); 3,47-3,63m (5H, кеталь и THP); 2,48m (1H, H-11); 1,02t (J = 7,5 Гц, 3H, 18a-CH3); 0,95m (6H, Me-кеталь).
b) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]- 17 α -(1,2-пропадиенил)-6'H-бензо[10,9,11]-18a-гомо- 5 α -эстран-5,17 β -диол
В 30 мл одномолярного раствора алюмогидрида лития в тетрагидрофуране прикапывают раствор 1,1 г описанного в пункте 31a) соединения в 25 мл простого диэтилового эфира и нагревают 6 ч с обратным холодильником. Затем прикапывают при охлаждении льдом 10 мл ацетона и после этого 50 мл насыщенного раствора сульфата натрия, отсасывают от твердых веществ, промывают дихлорметаном, сушат соединенные органические фазы над сульфатом натрия, концентрируют в вакууме и очищают остающуюся смолу хроматографией на колонке на силикагеле смесью из гексана/этилацетата. Получают 230 мг 31b) в виде белой пены.
1H-NMR (CDCl3): δ = 5,71 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 5,42dd (J = 7, 7 Гц, 1H, аллен); 4,88m (2H, аллен); 4,40s (1H, OH); 3,48-3,63m (4H, кеталь); 2,46m (1H, H-11); 1,08t (J = 7,5 Гц, 3H, 18a-CH3); 0,38s (6H, Me-кеталь).
с) 9,11 α -дигидро-17 β -окси-17 α -(1,2-пропадиенил)-6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
180 мг описанного в пункте 31b) вещества превращают по общей инструкции 1) в ацетоне с 0,38 мл 4 н. водной соляной кислоты. После очистки сырого продукта получают 135 мг 31с) в виде белой пены.
1H-NMR (CDCl3): δ = 5,80 ппм sbr (1H, H-4); 5,77dbr (J = 10 Гц, 1H, бугель); 5,57m (1H, бугель); 5,41dd (J = 7, 7 Гц, 1H, аллен); 4,90d (J = 7 Гц, 2H, аллен); 2,54m (1H, H-11); 1,12t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 32
9,11 α -дигиро-17 β -окси-17 α -(3-метил- 1,2-бутадиенил)-6'H-бензо[10,9,17]-18a-гомоэстр-4-ен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -[3-метил-3-[(тетрагидро-2H-пиран- 2-ил)окси]-1-бутинил-6'H-бензо[10,9,11]-18a-гомо- 5 α -эстран-5,17 β -диол
Из 19,5 мл 3-метил-3-[(тетрагидро-2H-пиран-2-ил)окси]-1- бутина в 570 мл абсолютного тетрагидрофурана и 72,5 мл 1,6- молярного раствора н-бутиллития в гексане получают при 0oC в атмосфере аргона литийорганическое соединение. Затем присоединяют раствор 5 г описанного в пункте 25i) вещества в 120 мл абсолютного тетрагидрофурана. Перемешивают 30 мин при 0oC и потом обрабатывают водой (C, F). После очистки получают 4,22 г 32a) в виде белой пены
[α]
1H-NMR (CDCl3): δ = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 5,00m (1H, THP); 4,30s (1H, OH); 3,96m (1H, THP); 3,42-3,65m (5H, кеталь и THP); 2,48m (1H, H-11); 1,52s (3H, Me); 1,49s (3H, Me); 1,05t (J = 7,5 Гц, 3H, 18a-CH3); 0,97s (3H, Me-кеталь); 0,95s (3H, Me-кеталь).
b) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(3-метил-1,2-бутадиенил)-6'H-бензо[10,9,11] -18a- гомо-5 α -эстран-5,17 β -диол
Суспензию 3,8 г алюмогидрида лития в 70 мл простого диэтилового эфира нагревают 1 ч с обратным холодильником. Затем прикапывают при комнатной температуре в течение 30 мин раствор 4 г описанного в пункте 32a) соединения в 100 мл простого диэтилового эфира и после этого нагревают 2 ч с обратным холодильником. В реакционную смесь примешивают 40 г декагидрата сульфата натрия, перемешивают 1 ч, отфильтровывают через целит, промывают дихлорметаном и удаляют растворитель в вакууме. После очистки получают 1,2 г 23b) в виде белых кристаллов.
Т.пл. = 155oC. [α]
1H-NMR (CDCl3): δ = 5,72 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 5,42m (1H, аллен); 4,38s (1H, OH); 3,46-3,64m (4H, кеталь); 2,45m (1H, H-11); 1,75d (J = 2 Гц, 3H, Me-аллен); 1,74d (J = 2 Гц, 3H, Me-аллен); 1,08t (J = 7,5 Гц, 3H, 18a-CH3); 0,99s (3H, Me-кеталь); 0,95s (3H, Me-кеталь).
c) 9,11 α -дигидро-17 β окси-17 α -(3-метил-1,2-бутадиенил)-6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 620 мг 32b) с 4 н. соляной кислотой в ацетоне. После одночасового перемешивания при комнатной температуре обрабатывают водой (B, F) и после очистки сырого продукта получают 177 мг 36b) в виде белых кристаллов.
T пл. = 150-152oC. [α]
1H-NMR (CDCl3): δ = 5,78 ппм sbr (1H, H-4); 5,76dbr (J = 10,0 Гц, 1H, мостик); 5,55m (1H, мостик); 5,20m (1H, аллен); 2,52m (1H, H-11); 1,75d (J = 2,5 Гц, 3H, Me-аллен); 1,72d (J = 2,5 Гц, 3H, Me-аллен); 1,12t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 33
5'',4'',9,11 α -тетрагидроспиро[6'H- бензо[10,9,11]-18a-гомоэстр-4-ен-17 β ,2''(5'')-фуран]-3,5''-дион
a) 5'',4'',9,11 α -тетрагидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] [спиро[5-окси-6'H-бензо[10,9,11] 18a-гомо- 5 α -эстран-17 β ,2''(5'')-фуран] -5-ол-5''-он.
В смесь из 70 мл тетрагидрофурана и 60 мл 1,6-молярного раствора н-бутиллития в н-гексане прикапывают при -50oC в течение 20 мин раствор из 8,6 мл аллилтетраметилфосфордиамидата в 40 мл тетрагидрофурана и перемешивают 1 ч при -30oC. Затем прикапывают раствор из 2 г описанного в пункте 25i) соединения в 15 мл тетрагидрофурана, нагревают в течение 1 ч до комнатной температуры и перемешивают 4 ч. После водной обработки (C, F) и очистки получают 995 мг 33a) в виде белой пены.
1H-NMR (CDCl3): δ = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,50m (1H, мостик); 4,42s (1H, OH); 3,48-3,63m (4H, кеталь); 1,03t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (6H, Me-кеталь)
b) 5'', 4'',9,11 α -тетрагидроспиро[6'H-бензо[10,9,11]-18a- гомоэстр-4-ен-17β ,2''(5'')-фуран]-3,5''-дион
По общей инструкции 1) превращают 818 мг описанного в пункте 33a) вещества с 2,3 мл 4 н. водной соляной кислоты в ацетоне. После очистки сырого продукта получают 441 мг 33b) в виде белых кристаллов.
Т.пл. = 100-102oC. [α]
1H-NMR (CDCl3): δ = 5,82 ппм sbr (1H, H-4); 5,75dbr (J = 10 Гц, 1H, бугель); 5,58m (1H, мостик); 2,68m (1H, H-11); 1,05t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 34
9,11 α -дигидро-17 α -этинил-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстра-4,15 -диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17-триметилсилил)окси]-6'H-бензо[10,9,11]-18a- гомо-5 α- эстр-16-ен-5-ол
По общей инструкции 4a) превращают 2,15 г описанного в пункте 25i) вещества с 2,5 мл диизопропиламина, 11 мл 1,6- молярного раствора н-бутиллития в гексане и 3,1 мл триметилхлорсилана в абсолютном тетрагидрофуране. В виде сырого продукта получают 2,52 г 34a), который без дальнейшей очистки вводят в следующую стадию.
Т.пл.=172-174oC
1H-NMR (CDCl3): δ = 5,58 ппм dbr (J = 10 Гц, 1H, мостик); 5,44m (1H, мостик); 4,46m (1H, H-16); 4,37s (1H, OH); 3,48- 3,64m (4H, кеталь); 2,48m (1H, H-11); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,87t (J = 7,5 Гц, 3H, 18a-CH3); 0,18s (9H, Me-Si).
b) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5-окси-6'H-бензо[10,9,11]-18a-гомо-5 α - эстр-15-ен-17-он
По общей инструкции 4b) превращают 2,42 г описанного в пункте 34a) соединения с 1,19 г ацетата палладия (II) в ацетонитриле. После очистки получают 1,34 г 34b) в виде белых кристаллов.
Т.пл. = 210-212oC. [α]
1H-NMR (CDCl3): δ = 7,54 ппм dbr (J = 6 Гц, 1H, H-15); 5,96dd (J = 6, 3 Гц, 1H, H-16); 5,63ddr (J = 10,0 Гц, 1H, мостик); 5,52m (1H, мостик); 4,47s (3H, OH); 3,46-3,63m (4H, кеталь); 2,56m (1H, H-11); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,78t (J = 7,5 Гц, 3H, 18a-CH3).
c) 9,11 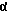 -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -этинил-6'H-бензо-[10,9,11]- 18a-гомо-5 α -эстр-15-ен-5,17 β -диол
-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -этинил-6'H-бензо-[10,9,11]- 18a-гомо-5 α -эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 1,0 г 34b), 15 мл 1,6- молярного раствора н-бутиллития в гексане и газообразного этина в абсолютном тетрагидрофуране. После очистки получают 1,23 г 34c), который без очистки вводят в следующую стадию.
1H-NMR (CDCl3): δ = 5,97 ппм dbr (J = 6 Гц, 1H, H-15); 5,63m (2H, H-16 и мостик); 5,48s (1H, мостик); 4,42s (1H, OH); 3,50-3,65m (4H, кеталь); 2,62s (1H, этин); 2,58m (1H, H-11); 0,98s (6H, Me-кеталь); 0,82t (J = 7,5 Гц, 3H, 18a-CH3).
d) 9,11 α -дигидро-17 α -этинил-17 β -окси-6'H-бензо[10,9,11]-18a-гомоэстра-4,15-диен-3-он
По общей инструкции 1) превращают 1,1 г 34c) с 4 н. соляной кислотой в ацетоне. После очистки получают 620 мг 34d).
Т.пл. = 201-203oC. [α]
1H-NMR (CDCl3): δ = 5,97dbr (J = 6 Гц, 1H, H-15); 5,82sbr (1H, H-4); 5,68dd (J = 6,3 Гц, 1H, H-16); 5,66m (1H, мостик); 5,58m (1H, мостик); 2,75m (1H, H-11); 2,66s (1H, этин); 0,86t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 35
9,11 α -дигидро-17 β -окси-17 α -(1- пропинил)-6'H-бензо-[10,9,11]-18a-гомоэстра-4,15-диен-3-он
a) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]- 17 α -(1-пропинил)-6'H-бензо[10,9,11]-18a-гомо-5 α - эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 600 мг 34b), 8,7 мл 1,6- молярного раствора н-бутиллития в гексане и газообразного пропина в абсолютном тетрагидрофуране. Получают 715 мг 35a), который без очистки вводят в следующую стадию.
1H-NMR (CDCl3): δ = 5,90 ппм dbr (J = 6 Гц, 1H, H-15); 5,62m (2H, H-16 и мостик); 5,48m (1H, бугель); 4,46s (1H, OH); 3,48-3,63m (4H, кеталь); 2,56m (1H, H-11); 1,90s (3H, пропин); 0,98s (3H, Me-кеталь); 0,97s (3H, Me-кеталь); 0,82t (J = 7,5 Гц, 3H, 18a-CH3).
b) 9,11 α -дигидро-5,17 β -диокси-17 α - (1-пропинил)-6'H-бензо-[10,9,11]-18a-гомо-5 α -эстр-15-ен-3-он
542 мг описанного в пункте 35a) соединения растворяют в 10 мл ацетона, смешивают с 1,2 мл 0,5 н. соляной кислоты и перемешивают 2,5 ч при комнатной температуре. Выливают в насыщенный раствор бикарбоната натрия, экстрагируют трижды дихлорметаном и сушат соединенные органические фазы над сульфатом натрия. После отгонки растворителя получают 438 мг 35b), которые без очистки применяют в следующей стадии.
1H-NMR (CDCl3): δ = 5,90dbr (J = 6 Гц, 1H, H-15); 5,72dbr (J = 10 Гц, 1H, мостик); 5,65dd (J = 6, 3 Гц, 1H, H-16); 5,56m (1H, мостик); 2,64m (1H, H-11); 1,92s (3H, пропин); 0,85t (J = 7,5 Гц, 3H, 18a-CH3).
c) 9,11 α -дигидро-17 β -окси-17 α -(1-пропинил)-6'H-бензо-[10,9,11]-18a-гомоэстра-4,15-диен-3-он
400 мг описанного в пункте 35b) соединения растворяют в ацетоне, смешивают с 0,5 мл 4 н. соляной кислоты и перемешивают 5 ч при комнатной температуре. После водной обработки (B, F) и очистки получают 139 мг 35c) в виде белых кристаллов.
Т.пл. 68-73oC. [α]
1H-NMR (CDCl3): δ = 5,90dbr (J = 6 Гц, 1H, H-15); 5,83sbr (1H, H-4); 5,68m (1H, мостик); 5,66m (1H, H-16); 5,58m (1H, мостик); 2,72m (1H, H-11); 1,90s (3H, пропин); 0,86t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 36
17 α -(1-бутинил)-9,11 α -дигидро-17 β -окси-6'H- бензо[10,9,11]-18a-гомоэстра-4,15-диен-3-он
a) 17 α -(1-бутинил)-9,11 α -дигидро-3,3-[2,2-диметил-1,3-
пропандиилбис(окси)]-6'H-бензо[10,9,11]-18a-гомо-5 α - эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 800 мг 34b), 15 мл, 1,6- молярного раствора н-бутиллития в гексане и 5 г 1-бутина в абсолютном тетрагидрофуране. После очистки получают 637 мг 36a) в виде белой пены.
1H-NMR (CDCl3): δ = 5,90 ппм dbr (J = 6 Гц, 1H, H-15); 5,63m (2H, H-16 и мостик); 5,48m (1H, мостик); 4,43s (1H, OH); 3,46-3,63m (4H, кеталь); 2,25q (J = 7,5 Гц, 2H, бутин-CH2); 1,16t (J = 7,5 Гц, 3H, бутин-CH3); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,81t (J = 7,5 Гц, 3H, 18a-CH3).
b) 17 α -(1-бутинил)-9,11 α -дигидро-17 β -окси-6'H- бензо-[10,9,11]-18a-гомоэстра-4,15-диен-3-он
По общей инструкции 1) превращают 364 мг 36a) с 4 н. соляной кислотой в ацетоне. После трехчасового перемешивания при комнатной температуре обрабатывают водой (B, F) и после очистки сырого продукта получают 145 мг 36b) в виде белой пены.
[α]
1H-NMR (CDCl3): δ = 5,87dbr (J = 6 Гц, 1H, H-15); 5,82sbr (1H, H-4); 5,68m (2H, H-16 и мостик); 5,56m (1H, бугель); 2,72m (1H, H-11); 2,26q (J = 7, 5 Гц, 2H, бутин-CH2); 1,14t (J = 7,5 Гц, 3H, бутин-CH3); 0,85t (J = 7,5 Гц, 3H, 18a-CH3)
Пример 37
9,11 α -дигидро-17 β -окси-17 α -(1,3- пентадиинил)-6'H-бензо-[10,9,11] -18a-гомоэстра-4,15-диен-3-он
300 мг описанного в пункте 34d) вещества растворяют в 40 мл триэтиламина. Насыщают раствор при комнатной температуре газообразным пропином, присоединяют 90 мг тетракис (трифенилфосфин)палладия и 45 мг иодида меди(I), нагревают до 600oC и перемешивают при сохранении потока пропина 1 ч при этой температуре. Затем реакционную смесь фильтруют через целит и концентрируют в вакууме. После очистки получают 66 мг 37) в виде аморфного твердого вещества.
1H-NMR (CDCl3): δ = 5,95dbr (J = 6 Гц, 1H, H-15); 5,82sbr (1H, H-4); 5,68m (1H, бугель); 5,63dd (J = 6,3 Гц, 1H, H-16); 5,56m (1H, бугель); 2,74m (1H, H-11); 1,96s (3H, пентадиин-Me); 0,82t (J = 7,5 Гц, 3H, 18a-CH3)
Пример 38
9,11 α , 15 α , 16 α -тетрагидро-17 α -этинил-17 β - окси-6'H-бензо[10,9,11][3''H]циклопропа[15,16]-18a-гомоэстра-4-ен-3-он
a) 9,11 α , 15 α ,16 α -тетрагидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -5-окси-6'H-бензо[10,9,11] [3''H] циклопропа- [15,16]-18a-гомо-5α-эстран-17-он
В суспензию 3,68 г иодида триметилсульфоксония в 50 мл диметилсульфоксида добавляют 430 мг гидрида натрия, перемешивают 90 мин, затем присоединяют 2 г описанного в пункте 34b) вещества и перемешивают 6 ч. Смесь вмешивают в ледяную воду; осажденное вещество отсасывают, поглощают в дихлорметане, сушат над сульфатом натрия и удаляют растворитель в вакууме. Получают 1,67 г 38a) как белые кристаллы.
Т.пл. = 226-230oC. [α]
1H-NMR (CDCl3): δ = 5,56 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 4,45s (1H, OH); 3,46-3,64m (4H, кеталь); 2,54s (1H, H-11); 1,00s (3H, Me-кеталь); 0,97s (3H, Me-кеталь); 0,76t (J = 7,5 Гц, 3H, 18a-CH3).
b) 9,11 α , 15 α ,16 α -тетрагидро-3,3-[2,2-диметил- 1,3-пропандиилбис(окси)] -17 α -этинил-6'H- бензо[10,9,11][3''H]циклопропа[15,16]-18a-гомо-5 α -эстран-5,17 β -диол.
По общей инструкции 2) превращают 1,0 описанного в пункте 38a) вещества и 14 мл 1,6-молярного раствора н-бутиллития в гексане и газообразного этина в абсолютном тетрагидрофуране. После очистки получают 949 мг 38b) в виде белых кристаллов.
Т.пл. = 197-202oC, [α]
1H-NMR (CDCl3): δ = 5,72 ппм dbr (J = 10 Гц, 1H, мостик); 5,47m (1H, мостик); 4,40s (1H, OH); 3,48-3,65m (4H, кеталь); 2,70s (1H, этин); 2,50m (1H, H-11); 0,99t (J = 7,5 Гц, 3H, 18a-CH3); 0,97s (6H, Me-кеталь); 0,81m (1H, циклопропил-H).
c) 9,11 α , 15, α 16 α -тетрагидро-17 α -этинил-17 β - окси-6'H-бензо[10,9,11][3''H]циклопропа[15,16]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 650 мг 38b) с 4 н. соляной кислотой в ацетоне. После очистки получают 348 мг 38c).
Т.пл. = 227-230oC. [α]
1H-NMR (CDCl3): δ = 5,83 sbr (1H, H-4); 5,78dbr (J = 10 Гц, 1H, мостик); 5,56m (1H, мостик); 2,72s (1H, этин); 1,02t (J = 7,5 Гц, 3H, 18a-CH3); 0,48 (1H, циклопропил-H)
Пример 39
17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11] -18a- гомо-19-норпрегн-4-ен-3,20-дион
a) [17(21)S]-21-фенилсульфинил)-9,11 α -дигидро-3,3- [2,2-диметил-1,3-пропандиилбис(окси)]-5-окси-6'H- бензо[10,9,11]-18a-гомо-19-нор-5 α -прегна-17(20),20-диен.
В раствор 500 мг описанного в пункте 25i) вещества в 7 мл дихлорметана и 1 мл триэтиламина прикапывают при -70oC раствор 285 мг фенилсульфенилхлорида в 0,7 мл дихлорметана, затем нагревают до -30oC и перемешивают 3 ч при -30oC. Смешивают реакционную смесь с водой, экстрагируют дважды этилацетатом, промывают соединенные органические фазы 1 н. водной соляной кислотой и водой, сушат над сульфатом натрия и концентрируют в вакууме. После очистки получают 445 мг 39a).
1H-NMR (CDCl3): δ = 7,68 ппм m (2H, ароматический углеводород): 7,50m (3H, ароматический углеводород); 6,06t (J = 3,5 Гц, 1H, аллен); 5,60dbr (J = 10 Гц, 1H, мостик); 5,50m (1H, мостик); 4,37s (1H, OH); 3,48-3,63m (4H, кеталь); 0,97s (3H, Me-кеталь); 0,95s (3H-Me-кеталь); 0,93t (J = 7,5 Гц, 3H, 18a-CH3).
b) 9,11α-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -5,17-дигидро-20-(метилокси)-6'H-бензо[10,9,11]-18a -гомо-19-нор-5 α -прегн-20-ен
В раствор 3,3 г описанного в пункте 39a) соединения в 30 мл тетрагидрофурана прикапывают 24 мл 1-молярного раствора метанолата натрия в метаноле, перемешивают 48 ч при комнатной температуре, выливают затем на воду, экстрагируют трижды дихлорметаном, сушат соединенные органические фазы над сульфатам натрия, фильтруют и отгоняют растворитель в вакууме. Остаток растворяют в 65 мл метанола, добавляют 10 мл триэтилфосфита, нагревают 45 мин с обратным холодильником и концентрируют в вакууме. После очистки получают 2,1 г 39b).
1H-NMR (CDCl3): δ = 5,67 ппм dbr (J = 10 Гц, 1H, мостик); 5,43m (1H, мостик); 4,30d (J = 4 Гц, 1H, H-21); 4,30s (1H, OH); 3,98d (J = 4 Гц, 1H, H-21); 3,52s (3H, MeO); 3,45-3,64m (4H, кеталь); 0,97s (3H, Me-кеталь); 0,95s (3H, Me-кеталь); 0,72t (J = 7,5 Гц, 3H, 18a-CH3).
c) 9,11 α -дигидро-5-окси-6'H-бензо-[10,9,11]-18a-гомо- 19-нор-5 α -прегнан-3,20-дион
В раствор 2,0 г описанного в пункте 39b) соединения в 25 мл ацетона добавляют 2 мл 4 н. водной соляной кислоты, перемешивают 1 ч при комнатной температуре и отсасывают осажденное вещество. Получают 1,31 г 39c), которое без очистки применяют в следующей стадии.
1H-NMR (D6-DMSO): δ = 5,76 ппм dbr (J = 10 Гц, 1H, мостик); 5,62m (1H, мостик); 5,17s (1H, OH); 4,40s (1H, OH); 2,25s (3H, ацетил); 0,70t (J = 7,5 Гц, 3H, 18a-CH3).
d) 17-(ацетилокси)-9,11 α -дигидро-6'H-бензо[10,9,11] - 18a-гомо-19-норпрегн-4-ен-3,20-дион
По аналогии с примером 13c) превращают 1,3 г описанного в пункте 39c) соединения в 25 мл ледяной уксусной кислоты с 6,6 мл ангидрида трифторуксусной кислоты. После обработки водой (B, F) и очистки получают 1,0 г 39d).
Т.пл. = 225-229oC.
1H-NMR (CDCl3): δ = 5,82 ппм sbr (1H, H-4); 5,70dbr (J = 10 Гц, 1H, мостик); 5,58m (1H, мостик); 2,72 (1H, H-11); 2,12s (3H, ацетил); 2,10s (3H, ацетокси); 0,72t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 40
17-(ацетилокси)-9,11 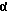 -дигидро-6-метилен-6'H- бензо[10,9,11]-18a-гомо-19-норпрегн-4-ен-3,20-дион
-дигидро-6-метилен-6'H- бензо[10,9,11]-18a-гомо-19-норпрегн-4-ен-3,20-дион
1,41 г описанного в пункте 39d) вещества превращают по аналогии с указанной в примере 16) инструкцией. Получают 1,03 г 40) в виде белых кристаллов.
Т.пл. = 215-219oC. [α]
1H-NMR (CDCl3): δ = 6,01 ппм sbr (1H, H-4); 5,70dbr (J = 10 Гц, 1H, мостик); 5,55m (1H, мостик); 5,15m (1H, экзометилен); 5,00m (1H, экзометилен); 2,74m (1H, H-11); 2,14s (3H, ацетил); 2,12s (3H, ацетокси); 0,72t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 41
17-(ацетилокси)-9,11α-дигидро-6-метил-6'H- бензо[10,9,11]-18a-гомо-19-норпрегна-4,6-диен-3,20-дион
423 мг описанного в примере 40) вещества превращают по аналогии с указанной в примере 18) инструкцией. Получают 303 г 41) в виде белых кристаллов.
Т.пл. = 260-264oC. [α]
1H-NMR (CDCl3): δ 6,00 ппм sbr (1H, H-7); 5,92sbr (1H, H-4); 5,72dbr (J = 10 Гц, 1H, мостик); 5,62m (1H, мостик); 2,75m (1H, H-11); 2,15s (3H, ацетил); 2,11s (3H, ацетокси); 1,86sbr (3H, 6-метил); 0,73t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 42
5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 5', 6'-дигидpo-3,3-[2,2-диметил-1,3- пропандиилбиc(oкcи)] -9H-бензо[10,9,11]-18a-гомо-5 α -эстран-5,17 β -диол
2 г описанного в пункте 25h) соединения растворяют в сосуде для встряхивания в смеси из 5 мл тетрагидрофурана и 50 мл этилацетата. Присоединяют 550 мг палладия на активированном угле (10%) устанавливают аппарат под водород и встряхивают 3 ч. Затем фильтруют через целит и концентрируют в вакууме. После очистки получают 1,69 г 42a).
1H-NMR (CDCl3): δ = 5,30 ппм m (1H, мостик); 4,38s (1H, OH); 3,85dd (J = 14, 7,5 Гц, 1H, 17-H); 3,50-3,65m (4H, кеталь); 1,04t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (6H, Me-кеталь).
б) 5',6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5-окси-9H-бензо[10,9,11]-18a-гомо-5 α -эстран-17-он
По общей инструкции 3) из 1,68 г описанного в пункте 42a) вещества, 2,35 г трехокиси хрома и 8 мл пиридина в 70 мл дихлорметана получают 1,50 г 42b).
1H-NMR (CDCl3): δ = 5,28 ппм m (1H, мостик); 4,40s (1H, OH); 3,48-3,60m (4H, кеталь); 1,00s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,76t (J = 7,5 Гц, 3H, 18a-CH3).
c) 5', 6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(1-пропинил)-9H-бензо[10,9,11]-18a-гомо-5 α - эстран-5,17 β -диол
По общей инструкции 2) из 1,35 г описанного в 42b) вещества и 19,5 мл 1,6-молярного раствора н-бутиллития в гексане и газообразном пропине получают 1,02 г 42c).
[α]
1H-NMR (CDCl3): δ = 5,31 ппм m (1H, мостик); 4,44s (1H, OH); 3,45-3,62m (4H, кеталь); 1,87s (3H, пропин); 1,02t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (3H, Me-кеталь); 0,95s (3H, Me-кеталь).
d) 5', 6'-дигидро-17 β окси-17 α -(1-пропинил)-9H- бензо[10,9,11]-18a-гомоэстр-4-он-3-он
По общей инструкции 1) превращают 0,99 г 42c) с 4 н. соляной кислотой в ацетоне. После очистки сырого продукта получают 421 г 42d).
Т.пл. = 188-190oC. [α]
1H-NMR (CDCl3): δ = 5,78 ппм sbr (1H, H-4); 5,48m (1H, мостик); 1,88s (3H, пропин); 1,05t (J = 7,5 Гц, 3H, 18a-CH3)
Пример 43
17 β -окси-17 α -(1-пропинил)-4', 5', 9,11 α - тетрагидро-6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
a) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)] -4',5',9,11 α тетрагидро-6'H-бензо[10,9,11]-18a-гомо-5 α -эстран-5,17 β -диол
2 г описанного в пункте 25h) соединения растворяют в сосуде для встряхивания в смеси из 5 мл тетрагидрофурана и 50 мл этилацетата. Прибавляют 400 мг окиси платины(IV), помещают аппарат в атмосферу водорода и встряхивают 8 ч. Затем фильтруют через целит и концентрируют в вакууме. После очистки получают 1,61 г 43a).
1H-NMR (CDCl3): δ = 4,28 ппм s (1H, OH); 3,68ddbr (J = 14, 7,5 Гц, 1H, 17-H); 3,46-3,62m (4H, кеталь); 1,02t (J = 7,5 Гц, 3H, 18a-CH3); 0,95s (3H, Me-кеталь); 0,95 (3H, Me-кеталь).
b) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-5-окси- 4',5',9,11 α - тетрагидро-6'H-бензо[10,9,11]-18a-гомо-5 α -эстран-17-он
По общей инструкции 3) из 1,4 г описанного в пункте 43a) вещества, 1,95 г трехокиси хрома и 6,7 мл пиридина в 60 мл дихлорметана получают 1,26 г 43b).
1H-NMR (CDCl3): δ = 4,30 ппм s (1H, OH); 3,45-3,63m (4H,
кеталь); 0,98s (3H, Me-кеталь); 0,96s (3H, Me-кеталь); 0,84t (J = 7,5 Гц, 3H, 18a-CH3)
c) 3,3-[2,2-диметил-1,3-пропандиилбис(окси)]-17 α -(1- пропинил)-4',5', 9,11 α -тетрагидро-6'H-бензо[10,9,11]-18a- гомо-5 α -экстран-5,17 β -диол
По общей инструкции 2) из 1,2 г описанного в пункте 43b) вещества и 29 мл 1,6-молярного раствора н-бутиллития в гексане и газообразном пропине получают 761 мг 43c).
[α]
1Н-NMR (CDCl3): δ = 4,34 ппм s (1H, OH); 3,45-3,62m (4H, кеталь); 1,87s (3H, пропин); 1,02t (J = 7,5 Гц, 3H, 18a-CH3); 0,98s (3H, Me-кеталь); 0,95s (3H, Me-кеталь);
d) 17 β -окси-17 α -(1-пропинил)-4',5',9,11 α - тетрагидро-6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 700 мг 43c) с 4 н. соляной кислотой в ацетоне. После очистки сырого продукта получают 463 мг 43d).
[α]
1H-NMR (CDCl3): δ = 5,73 ппм sbr (1H, H-4); 1,88s (3H, пропин); 1,06t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 44
5', 6'-дигидро-17 α -этинил-17 β окси-9H- бензо[10,9,11]-18a-гомоэстра-4,15-дион-3-он
a) 5', 6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -17-[(триметилсилил)окси]-9H-бензо[10,9,11]- 18a-гомо-5 α - эстр-16-ен-5-ол
По общей инструкции 4a) превращают 4,1 г описанного в пункте 42b) вещества с 47 мл диизопропиламина, 20 мл 1,6-молярного раствора н-бутиллития в гексане и 5,7 мл триметилхлорсилана в абсолютном тетрагидрофуране. В качестве сырого продукта получают 5,0 г 44a).
1H-NMR (CDCl3): δ = 5,21 ппм m (1H, бугель); 4,52m (1H, H-16); 4,35s (1H, OH); 3,45-3,64m (4H, кеталь); 0,95s (6H, Me-кеталь); 0,83t (J = 7,5 Гц, 3H, 18a-CH3); 0,18s (9H, Me-Si).
b) 5', 6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-5- окси-9H-бензо[10,9,11]-18a-гомо-5 α -эстр-15-ен-17-он
По общей инструкции 4b) превращают 4,99 г описанного в пункте 44a) соединения с 2,5 г ацетата палладия (II) в ацетонитриле. После очистки получают 3,15 г 44b).
1H-NMR (CDCl3): δ = 7,55 ппм dbr (J = 6 Гц, 1H, H-15); 5,99dd (J = 6,3 Гц, 1H, H-16); 5,35m (1H, мостик); 4,42s (1H, OH); 3,45-3,62m (4H, кеталь); 1,00s (3H, Me-кеталь); 1,00s (3H, Me-кеталь); 0,75t (J = 7,5 Гц, 3H, 18a-CH3).
c) 5', 6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)-17 α -этинил-9H-бензо[10,9,11]-18a- гомо-5 α -эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 1,2 г 44b) с 29 мл 1,6- молярного раствора н-бутиллития и газообразного этина в абсолютном тетрагидрофуране. Получают 1,2 г 44c).
1H-NMR (CDCl3): δ = 5,98 ппм dbr (J = 6 Гц, 1H, H-15); 5,65dd (J = 6,3 Гц, 1H, H-16); 5,32m (1H, мостик); 4,42s (1H, OH); 3,45-3,65m (4H, кеталь); 2,62s (1H, этин); 0,98s (3H, Me-кеталь); 0,95s (3H, Me-кеталь); 0,82t (J = 7,5 Гц, 3H, 18a-CH3).
d) 5', 6'-дигидро-17 α -этинил-17 β -окси-9H- бензо[10,9,11]-18 α -гомо-эстра-4,15-диен-3-он
По общей инструкции 1) превращают 1,1 г 44c) с 4 н. соляной кислотой в ацетоне. После очистки сырого продукта получают 432 мг 44d).
Т.пл. = 203-204oC. [α]
1H-NMR (CDCl3): δ = 5,98 ппм dbr (J = 6 Гц, 1H, H-15); 5,78sbr (1H, H-4); 5,73dd (J = 6,3 Гц, 1H, H-16); 5,57m (1H, бугель); 2,65s (1H, этин); 0,85t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 45
5', 6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо[10,9,11]-18a-гомоэстра-4,15-диен-3-он
a) 5', 6'-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-17 α -(1-пропинил)-9H-бензо[10,9,11]- 18a-гомо-5 α- эстр-15-ен-5,17 β -диол
По общей инструкции 2) превращают 1,2 г 44b) с 29 мл 1,6- молярного раствора н-бутиллития и газообразного пропила в абсолютном тетрагидрофуране. Получают 1,3 г 45a).
1H-NMR (CDCl3): δ = 5,92 ппм dbr (J = 6 Гц, 1H, H-15); 5,62dd (J = 6,3 Гц, 1H, H-16); 5,32m (1H, мостик); 4,46s (1H, OH); 3,48-3,64m (4H, кеталь); 1,88s (3H, пропин); 0,97s (3H, Me-кеталь); 0,95s (3H, Me-кеталь); 0,82t (J = 7,5 Гц, 3H, 18a-CH3)
b) 5',6'-дигидро-17 β -окси-17 α -(1-пропинил)-9H- бензо[10,9,11]-18a-гомоэстра-4,15-диен-3-он
По общей инструкции 1) превращают 1,1 г 45a) с 4 н. соляной кислотой в ацетоне. После очистки сырого продукта хроматографией на колонке на силикагеле и последующей HPLC получают 155 мг 45b).
Т.пл. = 210-217oC. [α]
1H-NMR (CDCl3): δ = 5,92 ппм dbr (J = 6 Гц, 1H, H-15); 5,78sbr (1H, H-4); 5,70dd (J = 6,3 Гц, 1H, H-16); 5,46m (1H, мостик); 1,91s (3H, пропин); 0,84t (J = 7,5 Гц, 3H, 18a-CH3).
Пример 46
3'', 16 β ,9,11 α -тетрагидро-6'H-бензо[10,9,11]циклопропа[16,17]-18a-гомо-19-норпрегн-4- ен-3,20-дион
a) 9,11 α -дигидро-17 β -окси-6'H-бензо[10,9,11]-18a-гомоэстр-4-ен-3-он
По общей инструкции 1) превращают 7 г 25h) с 4 н. соляной кислотой в ацетоне. После перекристаллизации из этилацетата получают 4 г 46a) в виде белых кристаллов.
Т.пл. = 172-175oC
1H-NMR (CDCl3: δ = 5,80 ппм sbr (1H, H-4); 5,75dbr (J = 10 Гц, 1H, мостик); 5,58m (1H, мостик); 3,75ddbr (J = 14, 7,5 Гц, 1H, 17-H); 1,08t (J = 7,5 Гц, 3H, 18a-CH3)
и) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-6'H-бензо[10,9,11]-18a- гомоэстр-5-ен-17 β -ол
3,98 г 46a) превращают по аналогии с указанной в примере 25c) инструкцией. После очистки получают 2,59 г 46b) в виде белой пены.
[α]
1H-NMR (CDCl3): δ = 5,70 ппм dbr (J = 10 Гц, 1H, мостик); 5,47m (1H, мостик); 5,32m (1H, H-6); 3,68m (1H, 17-H); 3,42-3,60m (4H, кеталь); 1,06t (J = 7,5 Гц, 3H, 18a-CH3); 1,02s (3H, Me-кеталь); 0,92s (3H, Me-кеталь)
c) 9,11 α - дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-6'H-бензо[10,9,11]-18a-гомоэстр-5-ен-17- он
По общей инструкции 3) из 2,57 г описанного в пункте 46b) вещества, 3,74 г трехокиси хрома и 13 мл пиридина в 110 мл дихлорметана получают 2,55 г 46c) в виде белых кристаллов.
Т.пл. = 190oC
1H-NMR (CDCl3): δ = 5,62 ппм dbr (J = 10 Гц, 1H, мостик); 5,48m (1H, мостик); 5,35m (1H, H-6); 3,42-3,62m (4H, кеталь); 1,04s (3H, Me-кеталь); 0,92s (3H, Me-кеталь); 0,78t (J = 7,5 Гц, 3H-18a-CH3).
d) 9,11 α -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)] -17-[[(1,1,2,2,3,3,4,4,4- нонафторбутил)сульфонил]окси-6'H-бензо[10,9,11]-18a-гомоэстра-5,16-диен
2,54 г описанного в пункте 46c) вещества растворяют в 30 мл абсолютного тетрагидрофурана. Прибавляют раствор 3,11 г амида калийбис(триметилсилила) в 15 мл абсолютного 1,2-диметоксиэтана и 1,45 мл фтористого перфторбутансульфонила.
Затем перемешивают 5 ч при комнатной температуре и после этого обрабатывают водой (B, F). После очистки получают 1,73 г 46d).
1H-NMR (CDCl3): δ = 5,60 ппм m (2H, H-16 и мостик); 5,50m (1H, мостик); 5,35m (1H, H-6); 3,42-3,60m (4H, кеталь); 1,02s (3H, Me-кеталь); 0,92s (3H, Me-кеталь); 0,89t (J = 7,5 Гц, 3H, 18a-CH3).
e) 9,11 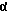 -дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-6'H-бензо[10,9,11]-18a-гомо-19-норпрегн- 5,16-диен-20-он
-дигидро-3,3-[2,2-диметил-1,3- пропандиилбис(окси)]-6'H-бензо[10,9,11]-18a-гомо-19-норпрегн- 5,16-диен-20-он
1,7 г описанного в пункте 46d) соединения растворяют в 32 мл абсолютного диметилформамида и смешивают с 1,25 мл (1-этоксивинил) трибутилолова, 320 мг безводного хлористого лития, 27 мг ацетата палладия(II) и 65 мг трифенилфосфина. Нагревают 5 ч до 60oC и затем 20 мин до 100oC. После водной обработки (B, F) и после очистки получают 682 мг 46e).
Т.пл. = 165-168oC
1H-NMR (CDCl3): δ = 6,81 ппм dd (J = 3,2 Гц, 1H, H-16); 5,68m (1H, мостик); 5,46m (1H, мостик); 5,36m (1H, H-6); 3,40-3,63m (4H, кеталь); 2,28s (3H, ацетил); 1,02s (3H, Me-кеталь); 0,90s (3H, Me-кеталь); 0,73t (J = 7,5 Гц, 3H, 18a-CH3)
f) 3'', 16 β , 9,11 α -тетрагидро-3,3-[2,2- диметил-1,3-пропандиилбис(окси)] -6'H-бензо[10,9,11]циклопропа[16,17]- 18a-гомо-19-норпрегн-5-ен-20-он
К суспензии 670 мг йодида триметилсульфоксония в 8,5 мл диметилсульфоксида прибавляют 78 мг 80%-ной суспензии гидрида натрия в минеральном масле. Перемешивают 90 мин при комнатной температуре и затем прибавляют суспензию 672 мг описанного в пункте 46e) соединения в 2,8 мл диметилсульфоксида. После этого перемешивают 10 ч при комнатной температуре и потом обрабатывают водой (A, F). После очистки получают 168 мг 46f).
1H-NMR (CDCl3): δ = 5,64 ппм dbr (J = 10 Гц, 1H, мостик); 5,45m (1H, мостик); 5,33m (1H, H-6); 3,40-3,61m (4H, кеталь); 2,03s (3H, ацетил); 1,00s (3H, Me-кеталь)' 0,92s (3H, Me-кеталь); 0,73t (J = 7,5 Гц, 3H, 18-CH3)
g) 3'',16 β ,9,11 α -тетрагидро-6'H-бензо[10,9,11]циклопропа- [16,17]-18a-гомо-19-норпрегн-4-ен-3,20-дион
154 мг 46f) растворяют в 8 мл ацетона, смешивают с 0,18 мл 2 н. соляной кислотой и перемешивают смесь 5,5 ч при комнатной температуре. После обработки водой (B, F) очищают сырой продукт хроматографией на колонке на силикагеле и последующей HPLC и получают 36 мг 46g).
1H-NMR (CDCl3): δ = 5,82 ппм sbr (1H, H-4); 5,68dbr (J = 10 Гц, 1H, мостик); 5,56m (1H, мостик); 2,54m (1H, H-11); 2,03s (3H, ацетил); 0,78t (J = 7,5 Гц, 3H, 18a-CH3).
Дополнительные примеры даны в конце описания.
Пример на приготовление капсул.
2 г активного ингредиента, 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г диоксида кремния и 1,2 г стеарата магния смешивают друг с другом. Полученной смесью далее заполняют 1000 подходящих твердых желатиновых капсул, каждая из которых содержит 2 мг активного ингредиента.
В зависимости от состояния больного и способа введения количество вводимых соединений может составлять 1-20 мг/сутки.
Пример на приготовление таблеток.
Смесь 1 г активного ингредиента, 570 г лактозы и 200 г крахмала тщательно смешивают и увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона приблизительно в 200 мл воды. Влажную смесь просеивают, сушат и вновь просеивают. Добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все тщательно смешивают и спрессовывают в таблетки, получая 1000 таблеток, каждая из которых содержит 1 мг активного ингредиента.
| название | год | авторы | номер документа |
|---|---|---|---|
| 14,17-C-МОСТИКОВЫЕ СТЕРОИДЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1995 |
|
RU2169153C2 |
| 15,15-ДИАЛКИЛСТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2147306C1 |
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| АНТАГОНИСТЫ ПРОГЕСТЕРОНА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВ ПРИ ЛЕЧЕНИИ ДИСФУНКЦИОНАЛЬНЫХ МАТОЧНЫХ КРОВОТЕЧЕНИЙ | 1995 |
|
RU2170580C2 |
| ПРОИЗВОДНЫЕ 11β-БЕНЗАЛЬДОКСИМ-ЭСТРА-4,9-ДИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2137777C1 |
| ПРОИЗВОДНЫЕ БЕНЗОПИПЕРИДИНА, БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2142945C1 |
| ГОРМОНАЛЬНЫЕ ИЛИ АНТИГОРМОНАЛЬНЫЕ СТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ТЕРАПЕВТИЧЕСКОГО ВОЗДЕЙСТВИЯ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1999 |
|
RU2238943C2 |
| ПРОИЗВОДНЫЕ 11,21-БИСФЕНИЛ-19-НОРПРЕГНАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1995 |
|
RU2152952C2 |
| МОДУЛЯТОРЫ РЕЦЕПТОРОВ ПРОГЕСТЕРОНА | 2005 |
|
RU2381232C2 |
| СПОСОБ ПОЛУЧЕНИЯ 17-(3-ГИДРОКСИПРОПИЛ)-17-ГИДРОКСИСТЕРОИДОВ | 2008 |
|
RU2466137C2 |




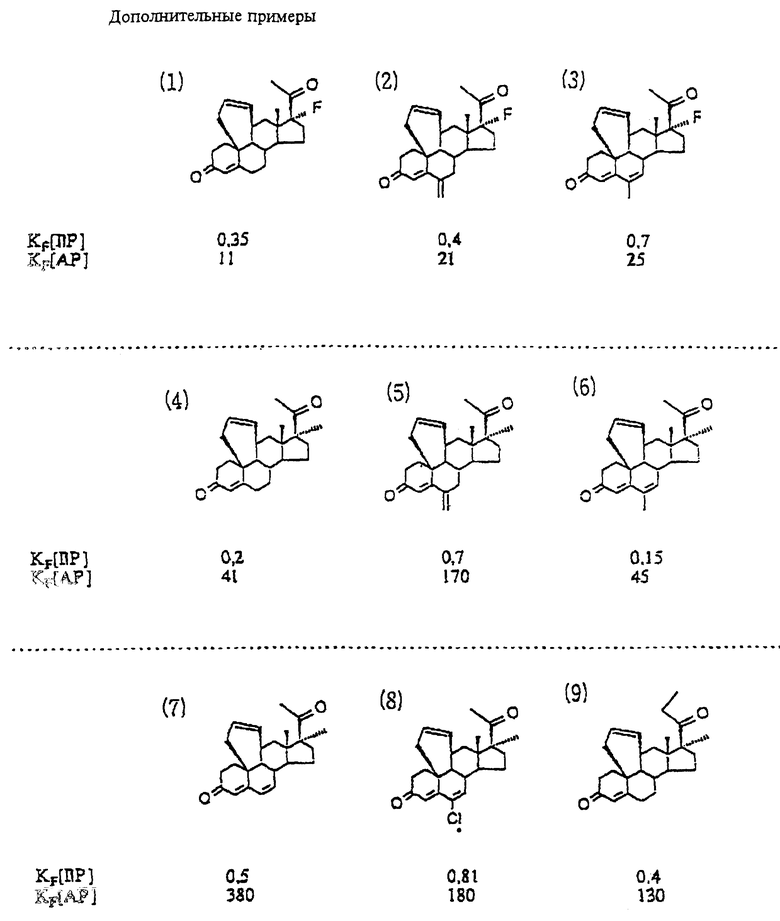
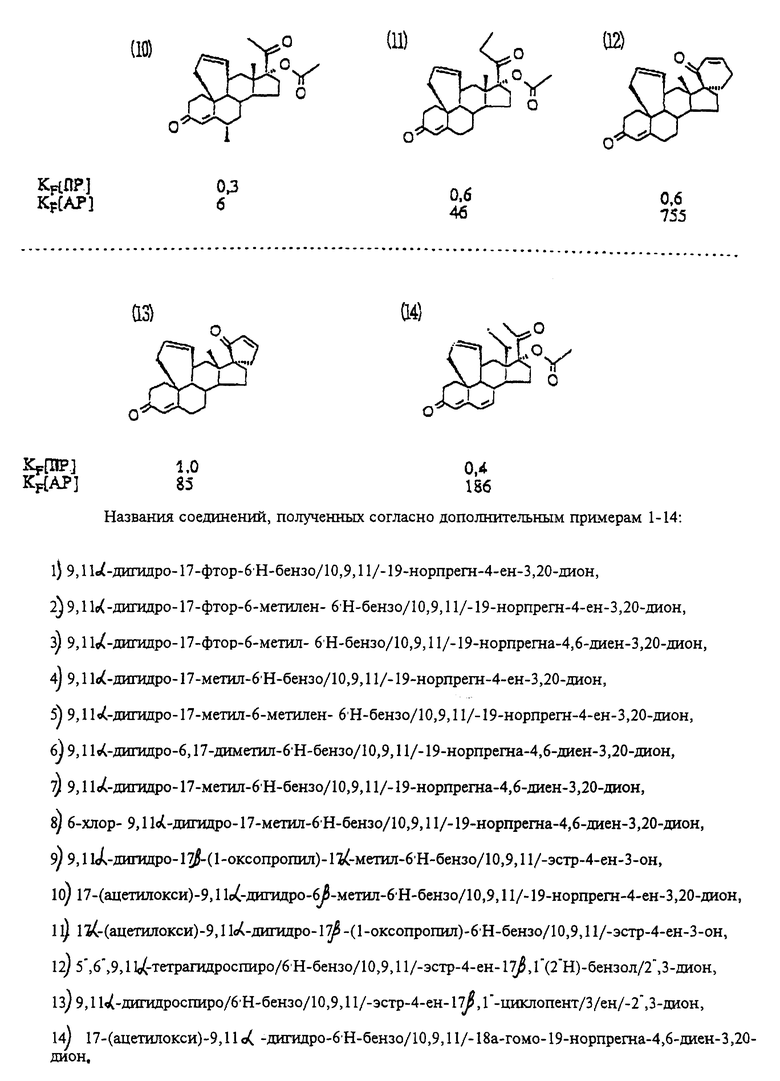
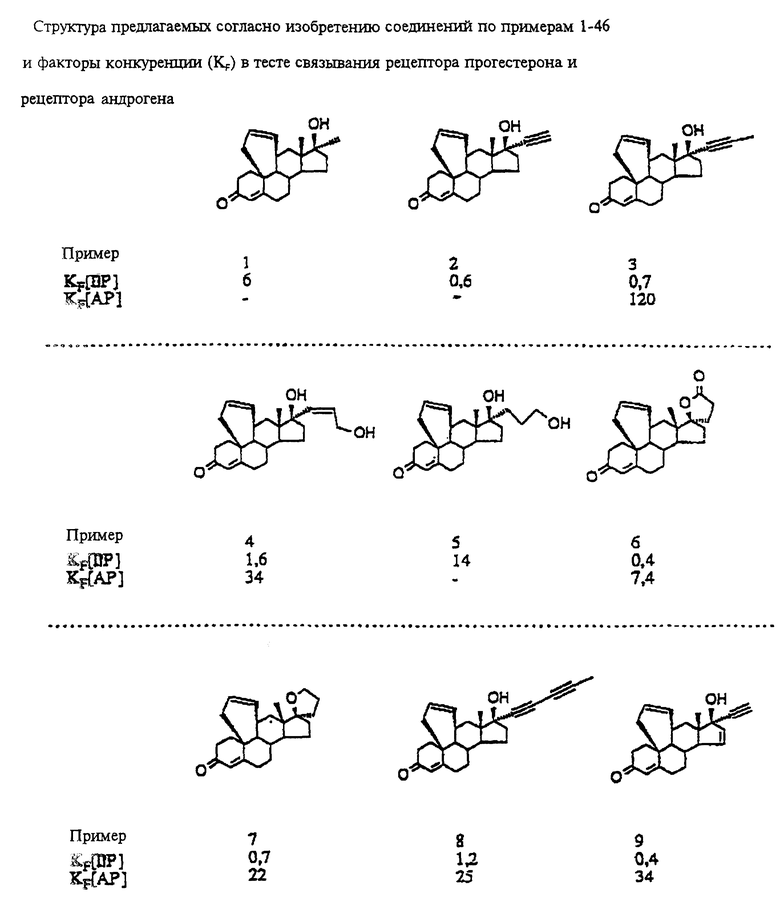
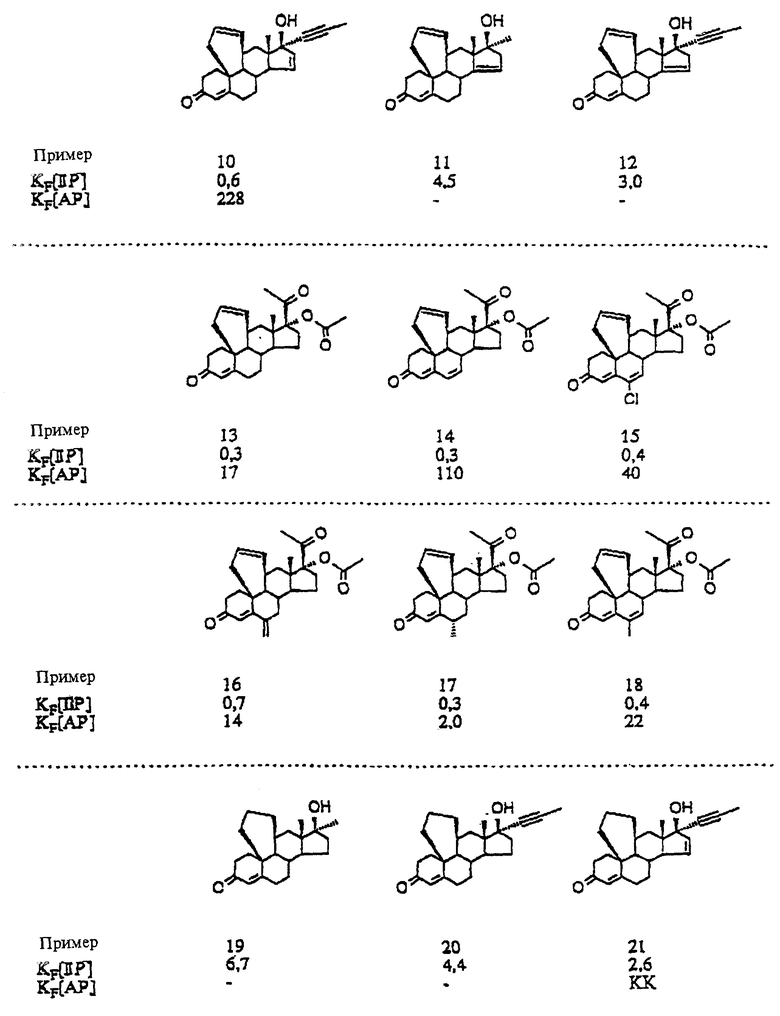
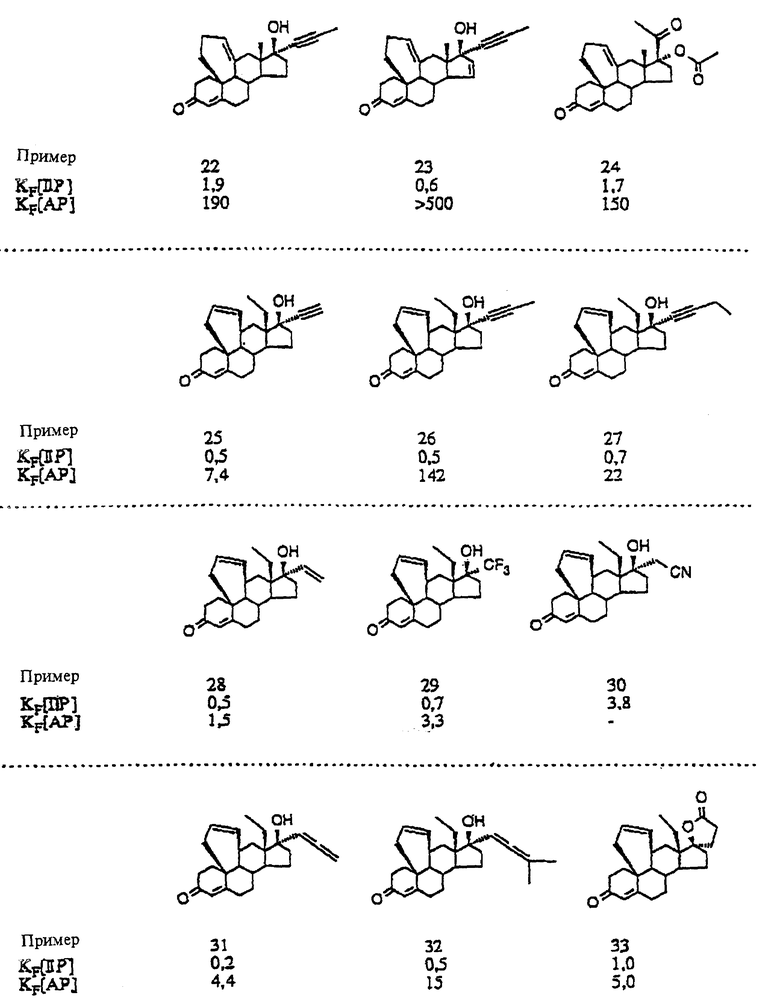
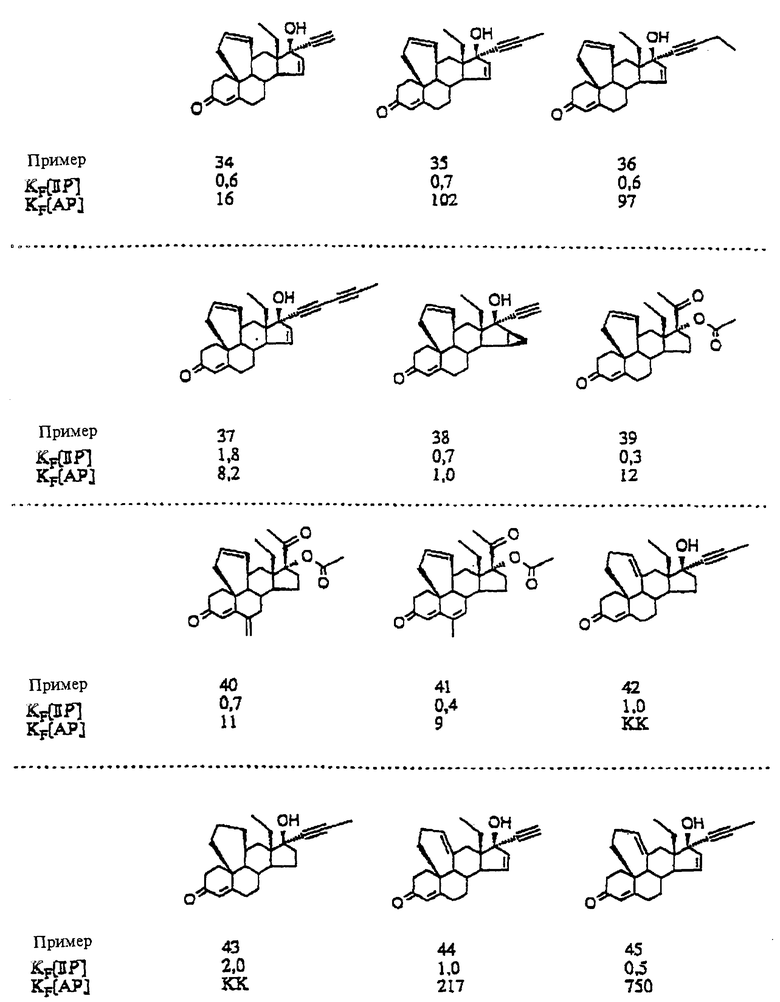
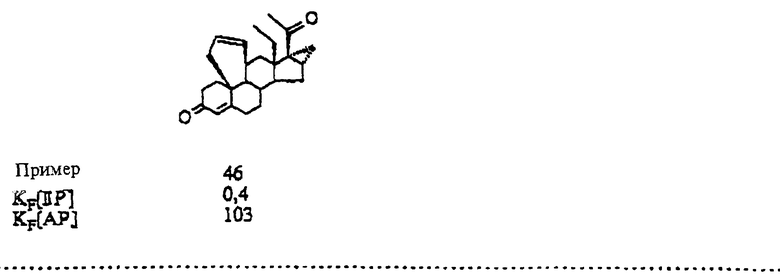
Описываются новые 19, 11-перекрытые мостиками 4-эстрены общей формулы I, где R6a и R6b каждый обозначает атом водорода или вместе метиленовую группу и R7 обозначает атом водорода, или R6a обозначает атом водорода или атом фтора, хлора, брома или йода, или обозначает насыщенный, находящийся в α- или β-положении алкильный остаток с прямой или разветвленной цепью с количеством С-атомов до 4, и R6b и R7 представляет каждый атом водорода или вместе дополнительную связь, или R14, R15, R16 каждый обозначает атом водорода, R14 обозначает атом водорода в α-положении и R15 и R16 обозначают вместе дополнительную связь или метиленовый мостик в β-положении, или R16 вместе с R17α обозначают метиленовый мостик в α-положении и R17β обозначает группу -C-R22, или R16 обозначает атом водорода и R14 и R15 обозначают вместе дополнительную связь, R11, R11′ и R19 обозначают каждый атом водорода, или R11 обозначает атом водорода в α-положении и R11 и R19 обозначают вместе дополнительную связь, или R19 обозначает атом водорода и R11 и R11′ обозначаютвместедополнительнуюсвязь,R17β/R17αобозначают-OR21/-(CH2)n-A, -OR21/-(CH2)m-C≡C-B, -OR21/-(CH2)p-CH= CH-(CH2)k-D, -OR21/-HC=C=CEG,-OR21/-CF3, -C-R22/-OR23, -C-R22/-C1-C4-алкил или -С-R22/-False или R17β/R17α обозначают вместе формулы II, где х = 1, U = 0; R21 обозначает атом водорода, R23 обозначает C1-C4-алкильную группу, R22 обозначает С1-С3-алкильную группу, А обозначает атом водорода, цианогруппу или -ОR25 и R25 обозначает водород, В обозначает атом водорода, C1-C4-алкильную группу, C2- или C3-алкильную группу, D обозначает атом водорода или гидроксигруппу, Е и G обозначают каждый атом водорода или C1-C3-алкил, N обозначает 0, 1, 2, 3 или 4, m обозначает 0,1 или 2, р обозначает 0 или 1, k обозначает 0, 1, 2 или 3 и R16 обозначает атом водорода или метильную группу. Новые соединения имеют сильную гестагенную активность и применяются для получения лекарственных средств. Описывается также способ их получения, фармацевтическая композиция и промежуточные соединения. 4 c. и 9 з.п. ф-лы, 2 табл.
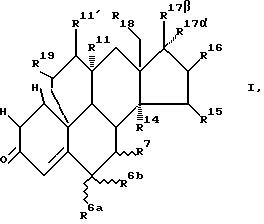
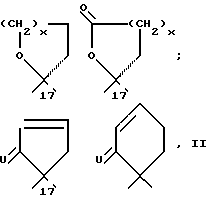
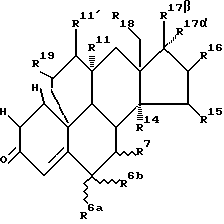
где R6a и R6b каждый обозначает атом водорода или вместе метиленовую группу и R7 обозначает атом водорода или R6a обозначает атом водорода или атом фтора, хлора, брома или йода или обозначает насыщенный, находящийся в α- или β-положении алкильный остаток с прямой или разветвленной цепью с количеством С-атомов до 4 и R6a и R7 представляет каждый атом водорода или вместе дополнительную связь,
R14, R15, R16 каждый обозначает атом водорода или R14 обозначает атом водорода в α-положении и R15 и R16 обозначают вместе дополнительную связь или метиленовый мостик в β-положении, или R16 вместе с R17α обозначают метиленовый мостик в α-положении и R17β обозначает группу  или R16 обозначает атом водорода и R14 и R15 обозначают вместе дополнительную связь;
или R16 обозначает атом водорода и R14 и R15 обозначают вместе дополнительную связь;
R11, R11′ и R19 обозначают каждый атом водорода, или R11 обозначает атом водорода в α-положении и R11′ и R19 обозначает вместе дополнительную связь, или R19 обозначает атом водорода и R11 и R11′ обозначают вместе дополнительную связь;
R17β/R17α обозначают -OR21/-(CH2)n-A, -OR21/-(CH2)m-C≡C-B, -OR21/-(CH2)p-CH= CH-(CH2)k-D, -OR21/-HC= C= CEG, -OR21/-CF3, 
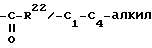 или
или 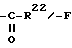 или R17β/R17α обозначают вместе
или R17β/R17α обозначают вместе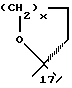
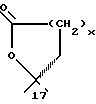
 ,
,
где х = 1;
U = 0;
R21 обозначает атом водорода;
R23 обозначает C1 - C4-алкильную группу;
R22 обозначает C1 - C3-алкильную группу;
А обозначает атом водорода, цианогруппу или -OR25, где R25 обозначает водород;
В обозначает атом водорода, C1 - C4-алкильную группу, C2- или C3-алкильную группу;
D обозначает атом водорода или гидроксигруппу;
E и G обозначает каждый атом водорода или C1 - C3 - алкил;
n обозначает 0, 1, 2, 3 или 4;
m обозначает 0, 1 или 2;
p обозначает 0 или 1;
k обозначает 0, 1, 2 или 3;
R18 обозначает атом водорода или метильную группу.
8. 9,11-Перекрытые мостиками 4-эстрены по п.1, представляющие собой
17-(ацетилокси)-9-11α-дигидро-6'H-бензо[10,9,11] -19-норпрегна-4-ен-3,20-дион;
17-(ацетилокси)-9-11α-дигидро-6-метил-6'Hбензо[10,9,11] -19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-9-11α-дигидро-6α-метил-6'Hбензо[10,9,11] -19-норпрегна-4-ен-3,20-дион;
17-(ацетилокси)-6-хлор-9,11α-дигидро-6'Hбензо[10,9,11] -19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-6-хлор-1β, 2β, 9,11α-тетрагидро-3Н-циклопропа[1,2][6''H] -бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-4', 5',9,11α-тетрагидро-6'Hбензо[10,9,11]-19-норпрегна-4-ен-3,20-дион;
17-(ацетилокси)-6-метил-4', 5', 9,11α-тетрагидро-6'H бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-6-хлор-1β, 2β, 4'', 5'', 9,11α-гексагидро-3'H-циклопропа[1,2]]6''H]бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-5', 6', -дигидро-9Н-бензо[10,9,11] -19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-5', 6',-дигидро-6-метил-9Н-бензо[10,9,11]-19-норпрегна-4,6-диен-3,20-дион;
17-(ацетилокси)-9,11α-дигидро-6'H-бензо[10,9,11] -18а-гомо-19-норпрегн-4-ен-3,20-дион;
17-(ацетилокси)-9,11α-дигидро-6-метил-6'H-бензо [10,9,11]-18а-гомо-19-норпрегна-4,6-диен-3,20-дион;
9,11α-дигидро-17-метил-6'H-бензо[10,9,11]-19-норпреги-4-ен-3,20-дион;
17-(ацетилокси)-9,11α-дигидро-6'H-бензо[10,9,11] -19-норпрегна-4,6-диен-3,20-дион;
3', 9,11α, 16β-тетрагидроциклопропа[16,17][6H]бензо [10,9,11]-норпрегн-4-ед-3,20-дион;
9,11α-дигидро-17-метил-6'H-бензо[10,9,11] -18а-гомо-19-норпрегн-4-ен-3,20-дион;
3', 9,11α, 16β-тетрагидроциклопропа[16,17][6H]бензо [10,9,11]-18а-гомо-19-норпрегн-4-ен-3,20-дион;
9,11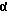 -дигидро-17β-гидрокси-17α-метил-6'H-бензо [10,9,11]-эстр-4-ен-3-он;
-дигидро-17β-гидрокси-17α-метил-6'H-бензо [10,9,11]-эстр-4-ен-3-он;
9,11α-дигидро-17α-этинил-17β-гидрокси-6'H-бензо [10,9,11]-эстр-4-ен-3-он;
9,11α-дигидро-17β-гидрокси-17α-(1-пропинил)-6'H-бензо [10,9,11] -эстр-4-ен-3-он;
9,11α-дигидро-17β-гидрокси-17α-(1,3-пентадиинил)-6'H-бензо[10,9,11] -эстр-4-ен-3-он;
(Z-9,11α-дигидро-17β-гидрокси-17α-(3-гидрокси-1-пропенил)-6'H-бензо [10,9,11]-эстр-4-ен-3-он;
9,11α-дигидро-17β-гидрокси-17α-(3-гидроксипропил)-6'H-бензо10,9,11] -эстр-4-ен-3-он;
17β-гидрокси-17α-метил-4', 5',9,11α-тетрагидро-6'H-бензо [10,9,11]эстр-4-ен-3-он;
17α-этинил-17β-гидрокси-4', 5', 9', 11α-тетрагидро-6'H-бензо[10,9,11] эстр-4-ен-3-он;
17β-гидрокси-17α-(1-пропинил)-4', 5',9,11α-тетрагидро-6'H-бензо[10,9,11] эстро-4-ен-3-он;
5',6'-дигидро-17α-этинил-17β-гидрокси-9Н-бензо [10,9,11]эстр-4-ен-3-он;
5', 6'-дигидро-17β-гидрокси-17α-(1-пропинил)-9Н-бензо [10,9,11]эстр-4-ен-3-он;
9,11α-дигидро-17α-этинил-17β-гидрокси-6'H-бензо [10,9,11]-18-а-гомо-эстр-4-ен-3-он;
9,11α-дигидро-17β-гидрокси-17α-(1-пропинил)-6'H-бензо [10,9,11]-18а-гомо-эстр-4-ен-3-он;
17α-(1-бутинил)-9,11α-дигидро-17β-гидрокси-6'H-бензо [10,9,11] -18а-гомо-эстр-4-ен-3-он;
9,11α-дигидро-17α-(1,2-пропадиенил)-17β-гидрокси-6'H бензо [10,9,11]-18а-гомо-эстр-4-ен-3-он;
17α-этинил-17β-гидрокси-4', 5',9,11α-тетрагидро-6'H бензо[10,9,11]-18а-гомо-эстр-4-ен-3-он;
17β-гидрокси-17α-(1-пропинил)-4', 5', 9,11α-тетрагидро-6'Hбензо[10,9,11] -18а-гомо-эстр-4-ен-3-он;
5', 6'-дигидро-17α-этинил-17β-гидрокси-9H-бензо [10,9,11] -18а-гомо-эстр-4-ен-3-он;
5', 6'-дигидро-17β-гидрокси-17α-(1-пропинил)-9H-бензо [10,9,11]-18а-гомо-эстр-4-ен-3-он;
9,11а-дигидро-17α-этилнил-17β-гидрокси-6'H-бензо [10,9,11]-эстра-4,15-диен-3-он;
9,11α-дигидро-17β-гидрокси-17α(1-пропинил)6'Hбензо [10,9,11] -эстра-4-диен-3-он;
17α-этинил-17β-гидрокси-4', 5', 9,11α-тетрагидро-6'Н бензо[10,9,11]-эстра-4,15-диен-3-он;
5', 6'-дигидро-17α-этинил-17β-гидрокси-9Н-бензо [10,9,11]-эстра-4,15-диен-3-он;
5', 6'-дигидро-17β-гидрокси-17α-(1-пропинил)-9Н-бензо [10,9,11]-эстра-4,15-диен-3-он;
9,11α-дигидро-17α-этинил-17β-гидрокси-6'Hбензо [10,9,11] -18а-гомо-эстра-4,15-диен-3-он;
9,11α-дигидро-17β-гидрокси-17α-(1-пропинил)6'Hбензо[10,9,11] -гомо-эстра-4,15-диен-3-он;
17α-этинил-17β-гидрокси-4', 5',9,11α-тетрагидро-6'H бензо[10,9,11]-18а-гомо-эстра-4,15-диен-3-он;
5', 6'-дигидро-17α-этинил-17β-гидрокси-9Н-бензо [10,9,11]-18а-гомо-эстра-4,15-диен-3-он;
5', 6'-дигидро-17β-гидрокси-17α-(1-пропинил)-9Н-бензо [10,9,11]-18а-гомо-эстра-4,15-диен-3-он;
4'',5'',9,11α-тетрагидроспиро[6'H-бензо[10,9,11]-эстр-4ен-17β, 2''(3''H)-фуран]-3-он;
3'',4'',9,11α-тетрагидроспиро[6'H-бензо[10,9,11]-эстр-4ен-17β, 2''(5''Н)-фуран]-3,5''-дион;
3'''', 4'''', 6a, 7α, 9,11а, 15а,16а-октагидроспиро[3'H,3''H-дициклопропа[6,7: 15,16] -[6H] бензо[10,9,11] эстр-4-ен-17β, 2''''(5''''H)-фуран] -3,5''''-дион;
3'''', 4'''', 9', 11'α, 15'α,16'α-гексагидроспиро [циклопропан-1,6'-[3H] циклопропан-[15,16] [6H] бензо[10,9,11]-эстр-4-ен-17'β,2''''''(5'''')-фуран] 3',5''''-дион;
3'''', 4'''', 9', 11'α, 15'α,16'α-гексагидроспиро [циклопропан-1,6'-[3H] циклопропан-[15,16] [6H] бензо[10,9,11]-эстра-1,4-диен-17β,2''''(5''''H)-фуран]3',5''''-дион;
3'''',4'''',5''',6α,7α,9,11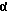 ,15α,16α-декагидроспиро[3'H,3''H-дициклопропа[6,7: 15,16][6H]бензо[10,9,11]экстр-4-ен-17β, 2''''(5''''H)-фуран]-3'''', 5''''-дион;
,15α,16α-декагидроспиро[3'H,3''H-дициклопропа[6,7: 15,16][6H]бензо[10,9,11]экстр-4-ен-17β, 2''''(5''''H)-фуран]-3'''', 5''''-дион;
3'''', 4'''', 9,11α-тетргидроспиро[6'Hбензо[10,9,11] -18а- гомо-эстр-4-ен-17β,2''''(5'')-фуран]3'.5''''-дион;
3'''', 4'''', 6α,7α,9,11α,15α,16α-октагидроспиро[3'H,3''H-дициклопропа-[6,7, : 15,16][6H]бензо[10,9,11]-18а-гомо-эстр-4-ен-17β,2''''(5''''H)-фуран] -3',5''''-дион;
9,11α-дигидро-17α-этинил-6'Hбензо[10,9,11]-эстр-4-ен-17β-ол;
17α-этинил-4',5',9,11α-тетрагидро-6'H-бензо[10,9,11]эстр-4-ен-17-17β-ол;
5',6'-дигидро-17α-этинил-9Н-бензо[10,9,11]эстр-4-ен-17β-ол;
9,11α-дигидро-17α-этинил-6'H-бензо[10,9,11]эстра-4,15-диен-17β-ол;
9,11α-дигидро-17α-этинил-6'H-бензо[10,9,11]-18а-гомо-эстр-4-ен-17β-ол;
9,11α-дигидро-17α-этинил-6'H-бензо[10,9,11] -18а-гомо-эстра-4,15-диен-17β-ол;
9. Способ получения соединений общей формулы I по п.1, отличающийся тем, что соединение общей формулы II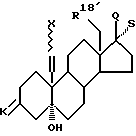
где К - защищенная кетогруппа;
Х - атом хлора или брома в син- или антиположении;
R18′ атом водорода или метил;
Q - оксигруппа в β-положении,
S - атом водорода в α-положении, или Q и S вместе означают одну из групп, указанных в п.1 для R17β/R17α, причем имеющиеся в них оксигруппы при необходимости защищены,
проводят а) радикальную циклизацию для получения соединения общей формулы III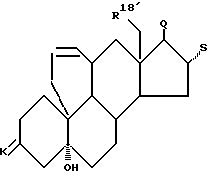
где К, R18′, Q и S имеют указанные значения;
в) затем, если Q - оксигруппа, ее при необходимости окисляют, с) если R11 и R19 должны представлять атомы водорода, гидрируют 19,11-этеновый мостик, d) если R19 представляет атом водорода и R11 и  вместе обозначают дополнительную связь, двойную связь в 19,11 β -этеновом мостике подвергают изомеризации в 11-положении, е) при желании вводят в кольцо D 15,16 - двойную связь и последнюю f) при желании подвергают изомеризации в 14, 15 - положении или g) проводят метиленирование с получением 15β, 16β - метиленового производного и h) в случае необходимости окисляют соответствующее 17-(3-оксипропил) или 16 -(4- оксибутил)-соединение для получения 17-спиролактона, или i) в случае необходимости подвергают реакции циклизации соответствующие (Z) -17α-(3- оксипроп-1-енил)- или (Z)-17α-(4-оксибут-1-енил)17β-оксисоединения или соответствующие насыщенные в боковой цепи соединения для получения простого спироэфира и j) обработкой кислотой в смешиваемом с водой растворителе переводят в Δ4 - 3- кетосистему, причем другие имеющиеся защитные группы также отщепляют с получением соединения общей формулы I и k) в случае необходимости вводят 1,2- и/или 6,7-двойную связь и в случае необходимости метиленируют одну двойную связь или обе двойные связи, l) проводят 6α-оксиметилирование с последующим отщеплением воды до 6-метиленового соединения, m) гидрирование 6-метиленовой группы с получением соединения I, где R6a - α-метил, а R6b и R7 каждый атом водорода или вместе образуют дополнительную связь.
вместе обозначают дополнительную связь, двойную связь в 19,11 β -этеновом мостике подвергают изомеризации в 11-положении, е) при желании вводят в кольцо D 15,16 - двойную связь и последнюю f) при желании подвергают изомеризации в 14, 15 - положении или g) проводят метиленирование с получением 15β, 16β - метиленового производного и h) в случае необходимости окисляют соответствующее 17-(3-оксипропил) или 16 -(4- оксибутил)-соединение для получения 17-спиролактона, или i) в случае необходимости подвергают реакции циклизации соответствующие (Z) -17α-(3- оксипроп-1-енил)- или (Z)-17α-(4-оксибут-1-енил)17β-оксисоединения или соответствующие насыщенные в боковой цепи соединения для получения простого спироэфира и j) обработкой кислотой в смешиваемом с водой растворителе переводят в Δ4 - 3- кетосистему, причем другие имеющиеся защитные группы также отщепляют с получением соединения общей формулы I и k) в случае необходимости вводят 1,2- и/или 6,7-двойную связь и в случае необходимости метиленируют одну двойную связь или обе двойные связи, l) проводят 6α-оксиметилирование с последующим отщеплением воды до 6-метиленового соединения, m) гидрирование 6-метиленовой группы с получением соединения I, где R6a - α-метил, а R6b и R7 каждый атом водорода или вместе образуют дополнительную связь.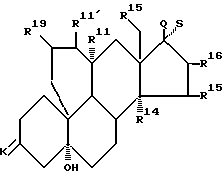
где К обозначает защищенную кето- или гидроксигруппу и атом водорода;
R11′ и R19 означают вместе дополнительную связь и R11 обозначает атом водорода в α- положении, или R19 обозначает атом водорода и R11′ и R11 обозначают вместе дополнительную связь, или R11, R11′ и R19 обозначают каждый атом водорода;
R14, R15 и R16 имеют обозначения, указанные в формуле I;
R18 обозначает атом водорода или метильную группу;
Q обозначает гидроксигруппу в β- положении; S обозначает атом водорода в α- положении, или Q и S обозначают вместе атом кетокислорода или, кроме того, Q и S обозначает одну из указанных в формуле I R17β/R17α - комбинаций заместителей, включающей спиросоединения, указанные в формуле I, причем имеющиеся в них гидрокси- и/или кетогруппы в случае необходимости защищены.
| EP 0283428, 1988 | |||
| Способ получения 3- кетоандростенов | 1982 |
|
SU1189353A3 |
| Крепь для поддержания междуэтажных целиков при щитовой системе разработки | 1960 |
|
SU139639A1 |
Авторы
Даты
2000-10-20—Публикация
1993-10-13—Подача