Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения амидного соединения.
Уровень техники
Некоторые амидные соединения описаны в WO 01/70671 и WO 03/015518.
Описание изобретения
Проблемы, которые предстоит решить при помощи изобретения
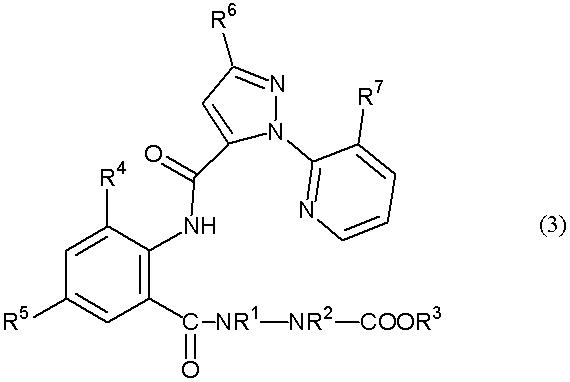
В настоящем изобретении предоставлен способ получения амидного соединения, представленного приведенной ниже формулой (3) и обладающего превосходной регулирующей активностью в отношении вредных членистоногих.
Способы решения проблем
В настоящем изобретении предоставлен способ получения амидного соединения, представленного формулой (3)
(в дальнейшем называемого соединением (3)):
[Химическая формула 3]
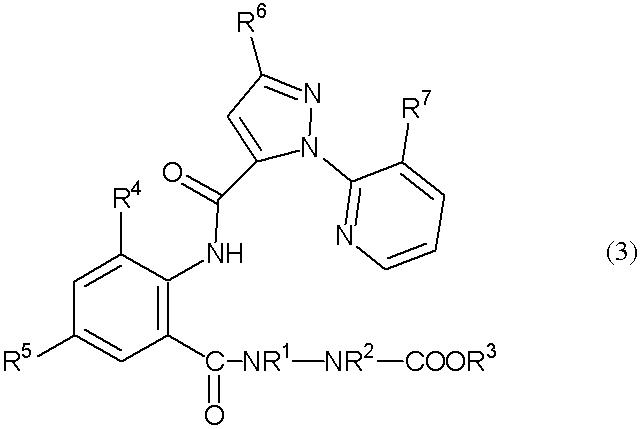
где R1, R2, R3, R4, R5, R6 и R7 определены ниже, включающий взаимодействие анилинового соединения, представленного формулой (1) (в дальнейшем называемого соединением (1)):
[Химическая формула 1]
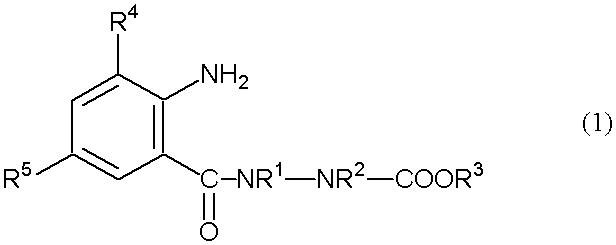
где R1 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, R2 представляет собой атом водорода или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, R3 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6 алкоксиалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6 алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена или С3-С6 алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, R4 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и R5 представляет собой атом водорода, атом галогена, цианогруппу или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, с соединением альдегида, представленного формулой (2) (в дальнейшем называемым соединением (2)):
[Химическая формула 2]
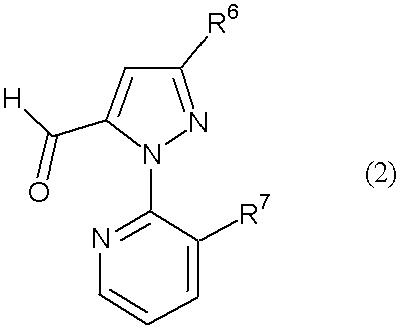
где R6 представляет собой атом водорода, атом галогена, цианогруппу, С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С1-С6 алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и R7 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, в растворителе в присутствии окислителя, выбранного из следующей группы А: (а) кислород, (b) пероксид и (с) хромовая кислота или ее соль.
Осуществление изобретения
В соответствии со способом настоящего изобретения можно получить соединение (3), обладающее превосходной регулирующей активностью в отношении вредных членистоногих.
Наилучший способ осуществления изобретения
В способе настоящего изобретения на 1 моль соединения (1) обычно используют от 0,5 до 2 моль соединения (2). Используемые количества соединения (1) и соединения (2) можно изменять в зависимости от реакционной ситуации.
Взаимодействие соединения (1) с соединением (2) проводят в присутствии окислителя, выбранного из группы А. Конкретными примерами окислителя, входящего в группу А, являются следующие окислители.
(а) Кислород
Кислород, используемый в способе настоящего изобретения, может представлять собой сам по себе газообразный кислород, смесь газов, полученную разбавлением газообразного кислорода другим газом, таким как газообразный азот или газообразная двуокись углерода или воздух. При использовании в качестве окислителя газообразного кислорода или воздуха реакцию проводят, перемешивая раствор соединения (1) и соединения (2) в растворителе в атмосфере газообразного кислорода или воздуха, барботируя газообразный кислород или воздух в данный раствор. Реакцию можно проводить при нормальном давлении или при повышенном давлении.
Количество кислорода, используемого в реакции, предпочтительно составляет от 1 до 2 моль на 1 моль соединения (2) и может изменяться в зависимости от реакционной ситуации.
(b) Пероксид (надкислота)
Пероксид представляет собой неорганическое или органическое соединение, содержащее в молекуле связь -О-О-. Примеры пероксида, используемого в способе настоящего изобретения, включают неорганический пероксид, такой как персульфат натрия, персульфат калия, персульфат аммония и пероксид водорода; пероксид спирта, такой как гидропероксид третбутила, пероксид ангидрида карбоновой кислоты, такой как пероксид бензоила; пероксид карбоновой кислоты, такой как надуксусная кислота, трифторнадуксусная кислота и метахлорнадбензойная кислота (mCPBA); и органический пероксид, такой как дитриметилсилилпероксид.
Количество пероксида, используемое в реакции, предпочтительно составляет от 1 до 2 моль на 1 моль соединения (2) и может изменяться в зависимости от реакционной ситуации.
(с) Хромовая кислота или ее соль
Примеры хромовой кислоты или ее соли, используемой в способе настоящего изобретения, включают соединения VI-валентного хрома, такие как хромовый ангидрид, хромовая кислота, хромат натрия, хромат калия, бихромат натрия, бихромат калия, хлорхромат пиридиния, бихромат пиридиния и хромилхлорид.
Количество хромовой кислоты или ее соли, используемое в реакции, предпочтительно составляет от 1 до 2 эквивалентов на 1 моль соединения (2) и может изменяться в зависимости от реакционной ситуации.
Описанную выше реакцию в способе настоящего изобретения проводят в растворителе. Примеры растворителей, которые можно использовать в данной реакции, включают эфирные растворители, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; галогенсодержащие углеводородные растворители, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводородные растворители, такие как гексан, гептан, толуол, бензол и ксилол; нитрильные растворители, такие как ацетонитрил, амидные растворители, такие как N,N-диметилформамид; растворители на основе азотсодержащих циклических соединений, такие как N-метилпирролидон и 1,3-диметил-2-имидазолидинон; апротонные растворители, например сульфоксидные растворители, такие как диметилсульфоксид; растворители на основе карбоновых кислот, такие как уксусная кислота; кетонные растворители, такие как ацетон и изобутилметилкетон; сложноэфирные растворители, такие как этилацетат; спиртовые растворители, такие как 2-пропанол и третбутиловый спирт; и воду. Можно использовать смесь двух или более растворителей, а реакцию можно проводить в однофазной системе или в двухфазной системе.
Температура реакции обычно находится в интервале от 0 до 150°С. Продолжительность реакции обычно находится в интервале от мгновения до 72 часов.
В случае необходимости в данной реакции может присутствовать кислота. Примеры кислоты, которую можно использовать, включают минеральные кислоты, такие как хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и хлорная кислота; карбоновые кислоты, такие как уксусная кислота и бензойная кислота; сульфокислоты, такие как метансульфокислота, бензолсульфокислота, и п-толуолсульфокислота; соединения бора, такие как трифторид бора; соединения алюминия, такие как хлорид алюминия(III) и изопропоксид алюминия(III); соединения титана, такие как тетрахлорид титана(IV) и изопропоксид титана(IV); соединения цинка, такие как хлорид цинка (II); соединения железа, такие как хлорид железа (III) и тому подобное.
В случае, когда в реакции используют кислоту, используемое количество данной кислоты обычно составляет от 0,001 до 1 моль на 1 моль соединения (2), и используемое количество может изменяться в зависимости от реакционной ситуации.
После завершения реакции соединение (3) можно выделить, выливая реакционную смесь в воду с последующей экстракцией органическим растворителем или выливая реакционную смесь в воду с последующим отделением образовавшегося осадка фильтрованием. Выделенное соединение (3) можно подвергнуть дополнительной очистке перекристаллизацией, хроматографией или тому подобным.
Далее будут разъяснены способы получения соединения (1) и соединения (2), используемые в способе настоящего изобретения.
Соединение (1) можно получить по следующей схеме (1).
Схема (1):
[Химическая формула 4]
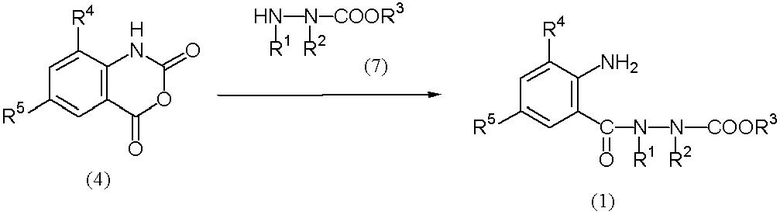
где R1, R2, R3, R4 и R5 определены выше.
Соединение (4) → соединение (1)
Соединение (7) обычно используется в количестве 1 моль на 1 моль соединения (4).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт; и их смеси.
Среди соединений (1) соединение, представленное формулой (1-i), можно получить по следующей схеме (2).
Схема (2):
[Химическая формула 5]
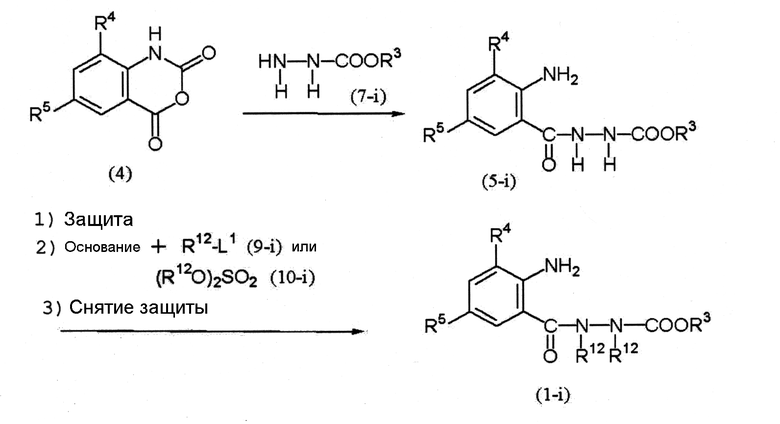
где R12 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, L1 представляет собой уходящую группу (например, атом галогена, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу), и R3, R4 и R5 определены выше.
Соединение (4) → соединение (5-i)
Соединение (7-i) обычно используется в количестве 1 моль на 1 моль соединения (4).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт; и их смеси.
Соединение (5-i) → соединение (1-i)
1. В случае необходимости аминогруппу (-NH2) в бензольном кольце соединения (5-i) можно защитить при помощи подходящей защитной группы (например, N-бензилиденовой группы, N-(1-метил)этилиденовой группы), описанной в книге Грина Protective Groups in Organic Synthesis (WILEY) и так далее.
2. Соединение (9-i) или соединение (10-i) обычно используется в количестве 2 моль на 1 моль соединения (5-i) или его производного, в котором аминогруппа защищена. Примеры основания, используемого в данной реакции, включают карбонаты металлов, такие как карбонат калия и карбонат натрия; гидроксиды металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; и гидриды металлов, такие как гидрид натрия.
3. С соединения (1-i), в котором аминогруппа защищена, можно снять защиту в известных условиях.
Среди соединений (1) соединение, представленное формулой (1-ii), можно получить по следующей схеме (3).
Схема (3):
[Химическая формула 6]
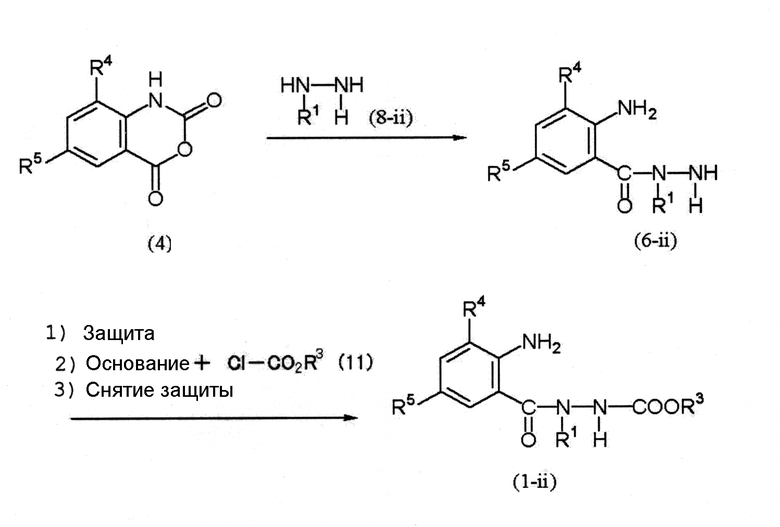
где R1, R3, R4 и R5 определены выше.
Соединение (4) → соединение (6-ii)
Соединение (8-ii) обычно используется в количестве 1 моль на 1 моль соединения (4).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт; и их смеси.
Соединение (6-ii) → соединение (1-ii)
1. В случае необходимости аминогруппу (-NH2) в бензольном кольце соединения (6-ii) можно защитить при помощи подходящей защитной группы (например, N-бензилиденовой группы, N-(1-метил)этилиденовой группы), описанной в книге Грина Protective Groups in Organic Synthesis (WILEY) и так далее.
2. Соединение (11) обычно используется в количестве 1 моль на 1 моль соединения (6-ii) или его производного, в котором аминогруппа защищена. Примеры основания, используемого в данной реакции, включают карбонаты металлов, такие как карбонат натрия, карбонат калия и карбонат цезия; гидроксиды металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; и гидриды металлов, такие как гидрид натрия.
3. С соединения (1-ii), в котором аминогруппа защищена, можно снять защиту в известных условиях.
Среди соединений (1) соединение, представленное формулой (1-iii), можно получить по следующей схеме (4).
Схема (4):
[Химическая формула 7]
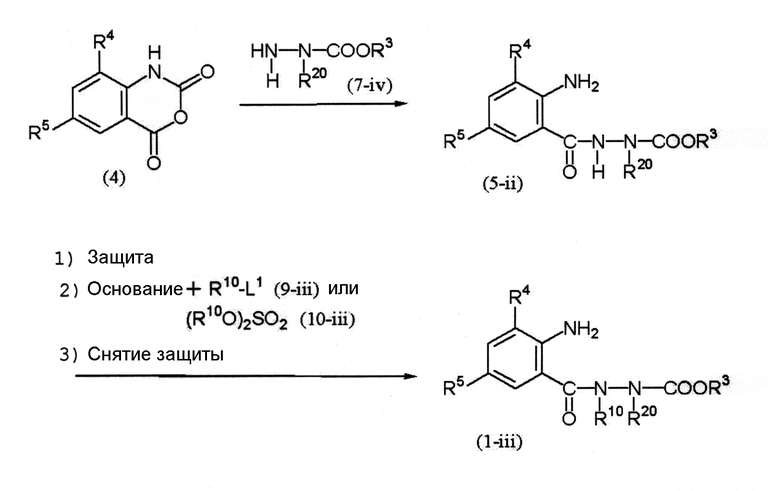
где R10 и R20 представляют собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и R3, R4 и R5 и L1 определены выше.
Соединение (4) → соединение (5-ii)
Соединение (7-iv) обычно используется в количестве 1 моль на 1 моль соединения (4).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт;, и их смеси.
Соединение (5-ii) → соединение (1-iii)
1. В случае необходимости аминогруппу (-NH2) в бензольном кольце соединения (5-ii) можно защитить при помощи подходящей защитной группы (например, N-бензилиденовой группы, N-(1-метил)этилиденовой группы), описанной в книге Грина Protective Groups in Organic Synthesis (WILEY) и так далее.
2. Соединение (9-iii) или соединение (10-iii) обычно используется в количестве 1 моль на 1 моль соединения (5-ii) или его производного, в котором аминогруппа защищена. Примеры основания, используемого в данной реакции, включают карбонаты металлов, такие как карбонат натрия, карбонат калия и карбонат цезия; гидроксиды металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; и гидриды металлов, такие как гидрид натрия.
3. С соединения (1-iii), в котором аминогруппа защищена, можно снять защиту в известных условиях.
Соединение (4) является известным соединением или может быть получено по следующей схеме (5).
Схема (5):
[Химическая формула 8]
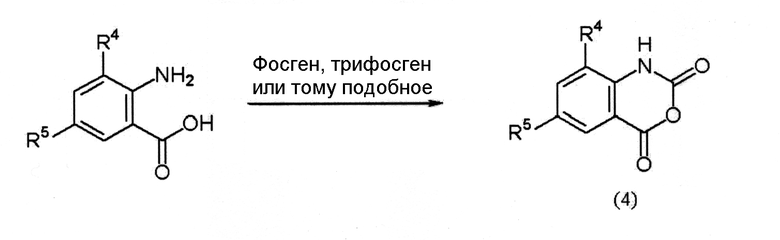
где R4 и R5 определены выше.
Соединения (7-i), (7-ii), (7-iii) и (7-iv) являются известными соединениями или могут быть получены по следующей схеме (6).
Схема (6):
[Химическая формула 9]
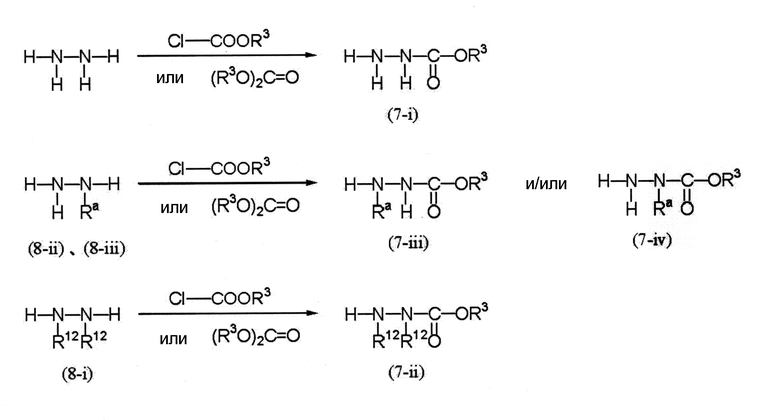
где Ra представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и R3 и R12 определены выше.
Среди соединений (7) соединение, представленное формулой (7-v), можно получить по следующей схеме (7).
Схема (7):
[Химическая формула 10]
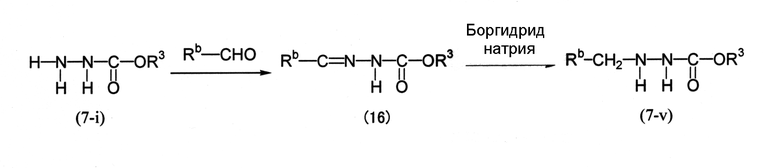
где Rb представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и R3 определен выше.
Соединение (7-i) → соединение (16)
Rb-СНО обычно используется в количестве от 1 до 2 моль на 1 моль соединения (7-i).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт; и их смеси.
Соединение (16) → соединение (7-v)
Боргидрид натрия обычно используется в количестве от 0,25 до 2 моль на 1 моль соединения (16).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; спирты, такие как метанол, этанол и изопропиловый спирт; и их смеси.
Соединения (8-i), (8-ii) и (8-iii) являются известными соединениями или могут быть получены из известных соединений известными способами (см., например, Organic Functional Group Preparations, 2nd edition, Vol. 1, chapter 14, p.434-465, Stanley R. Sandler, Wolf Karo).
Соединение (2) можно получить способом, который, например, представлен на следующей схеме (8).
Схема (8):
[Химическая формула 11]
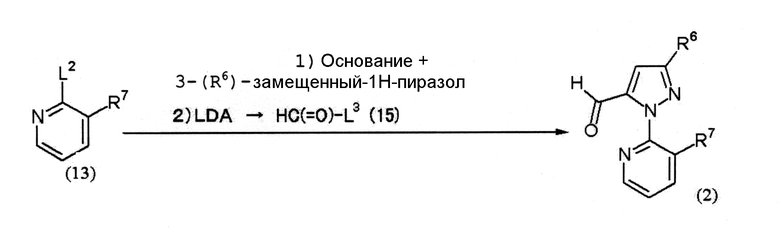
где L2 представляет собой уходящую группу (например, атом галогена, метилсульфонильную группу и тому подобное), L3 представляет собой уходящую группу (например, метоксигруппу, этоксигруппу, N,N-диметиламиногруппу, 1-имидазолильную группу и тому подобное), R6 и R7 определены выше.
Соединение (13) → соединение (2)
1. 3-(R6)-замещенный-1Н-пиразол обычно используется в количестве 1 моль на 1 моль соединения (13). Примеры основания, используемого в данной реакции, включают карбонаты металлов, такие как карбонат натрия, карбонат калия и карбонат цезия; гидроксиды металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; и гидриды металлов, такие как гидрид натрия.
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; и их смеси.
2. LDA (диизопропиламид лития) обычно используется в количестве 1 моль, а соединение (15) обычно используется в количестве 1 моль на 1 моль 2-[3-(R6)-замещенного-1Н-пиразол-1-ил]-3-(R7)-замещенного пиридина.
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, такие как толуол, бензол и ксилол; и их смеси.
Соединение (13) является известным соединением или может быть получено из известного соединения известным способом.
Соединение (2) также может быть получено способом, который представлен, например, на следующей схеме (9).
Схема (9):
[Химическая формула 12]
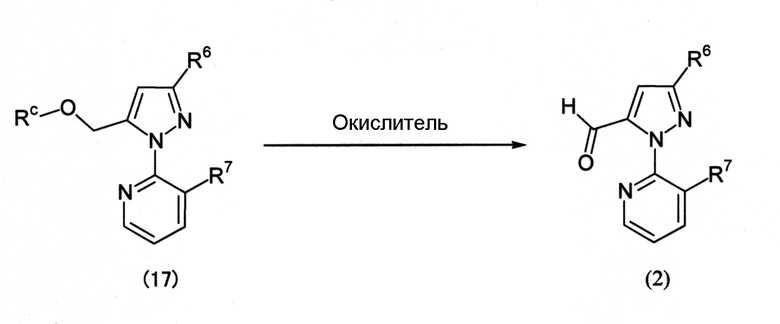
где Rc представляет собой C1-C4 алкильную группу, и R6 и R7 определены выше.
Примеры окислителя, используемого в реакции, включают персульфаты, такие как персульфат натрия, персульфат калия и персульфат аммония. Окислитель обычно используется в количестве от 1 до 2 моль на 1 моль соединения (17).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают нитрилы, такие как ацетонитрил, воду и их смеси.
Среди соединений (17) соединение, представленное формулой (17-i) можно получить, например, по следующей схеме (10).
Схема (10):
[Химическая формула 13]
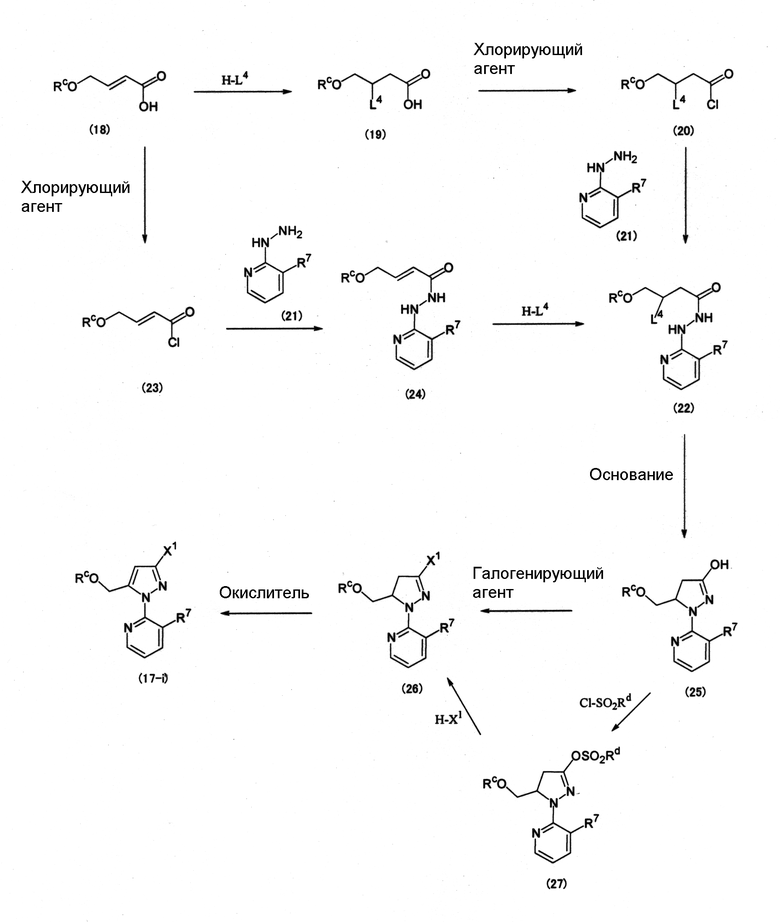
где Rd представляет собой метильную группу, фенильную группу или п-толильную группу, L4 представляет собой атом хлора или атом брома, Х1 представляет собой атом галогена, и Rc и R7 определены выше.
Соединение (18) → соединение (19)
Примеры Н-L4 включают хлористый водород и бромистый водород.
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и их смеси.
Соединение (19) → соединение (20)
Примеры хлорирующего агента, используемого в реакции, включают оксалилдихлорид и тионилхлорид. Хлорирующий агент обычно используется в количестве от 1 до 10 моль на 1 моль соединения (19).
Реакцию обычно проводят в отсутствие растворителя или в растворителе. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; и их смеси.
Соединение (20) → соединение (22)
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; и их смеси.
Количество соединения (21), используемого в реакции, обычно составляет 1 моль на 1 моль соединения (20).
В случае необходимости реакцию проводят в присутствии основания. Если реакцию проводят в присутствии основания, примеры основания включают азотсодержащие гетероциклические соединения, такие как пиридин, пиколин, 2,6-лутидин, 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ) и 1,5-диазабицикло[4.3.0]-5-нонен (ДБН), и третичные амины, такие как триэтиламин и N,N-диизопропилэтиламин. Если реакцию проводят в присутствии основания, основание обычно используется в количестве 1 моль или более на 1 моль соединения (20).
Соединение (18) → соединение (23)
Примеры хлорирующего агента, используемого в реакции, включают оксалилдихлорид и тионилхлорид. Хлорирующий агент обычно используется в количестве от 1 до 10 моль на 1 моль соединения (18).
Реакцию обычно проводят в отсутствие растворителя или в растворителе. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; и их смеси.
Соединение (23) → соединение (24)
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; и их смеси.
Количество соединения (21), используемое в реакции, обычно составляет 1 моль на 1 моль соединения (23).
В случае необходимости реакцию проводят в присутствии основания. Если реакцию проводят в присутствии основания, примеры основания включают азотсодержащие гетероциклические соединения, такие как пиридин, пиколин, 2,6-лутидин, 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ) и 1,5-диазабицикло[4.3.0]-5-нонен (ДБН); и третичные амины, такие как триэтиламин и N,N-диизопропилэтиламин. Если реакцию проводят в присутствии основания, основание обычно используется в количестве 1 моль или более на 1 моль соединения (23).
Соединение (24) → соединение (22)
Примеры Н-L4 включают хлористый водород и бромистый водород.
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и их смеси.
Соединение (22) → соединение (25)
Реакцию проводят в присутствии основания. Примеры основания, используемого в реакции, включают карбонаты металлов, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат кальция и карбонат цезия. Основание обычно используется в количестве 1 моль или более на 1 моль соединения (22).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; и их смеси.
Соединение (25) → соединение (26)
Примеры галогенирующего агента, используемого в реакции, включают оксалилдихлорид, тионилхлорид, хлорокись фосфора, пятихлористый фосфор, тионилбромид, бромокись фосфора и пятибромистый фосфор. Галогенирующий агент обычно используется в количестве от 1 до 10 моль на 1 моль соединения (25).
Реакцию обычно проводят в отсутствие растворителя или в растворителе. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; и их смеси.
Соединение (25) → соединение (27)
Примеры Cl-SO2Rd включают метансульфонилхлорид, бензолсульфонилхлорид и п-толуолсульфонилхлорид. Cl-SO2Rd обычно используется в количестве 1 моль на 1 моль соединения (25).
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; апротонные полярные растворители, такие как N,N-диметилформамид, N-метилпирролидон, 1,3-диметил-2-имидазолидинон и диметилсульфоксид; и их смеси.
В случае необходимости реакцию проводят в присутствии основания. Если реакцию проводят в присутствии основания, примеры основания включают азотсодержащие гетероциклические соединения, такие как пиридин, пиколин, 2,6-лутидин, 1,8-диазабицикло[5.4.0]-7-ундецен (ДБУ) и 1,5-диазабицикло[4.3.0]-5-нонен (ДБН); и третичные амины, такие как триэтиламин и N,N-диизопропилэтиламин. Если реакцию проводят в присутствии основания, количество используемого основания обычно составляет 1 моль или более на 1 моль соединения (25).
Соединение (27) → соединение (26)
Примеры Н-Х2 включают хлористый водород и бромистый водород.
Реакцию обычно проводят в присутствии растворителя. Примеры растворителя включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, бромистый метилен, хлороформ, бромоформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; карбоновые кислоты, такие как уксусная кислота; и их смеси.
Соединение (26) → соединение (17-i)
Примеры окислителя, используемого в реакции, включают персульфаты, такие как персульфат натрия, персульфат калия и персульфат аммония; хиноновые соединения, такие как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ), тетрахлор-1,4-бензохинон (п-хлоранил), тетрабром-1,4-бензохинон (п-броманил), тетрахлор-1,2-бензохинон (о-хлоранил) и тетрабром-1,2-бензохинон (о-броманил); галогены, такие как хлор и бром; и воздух.
Если окислителем является персульфат, количество данного окислителя обычно составляет от 1 до 2 моль на 1 моль соединения (26). Примеры растворителя, обычно используемого в реакции, включают нитрилы, такие как ацетонитрил; воду; и их смеси.
Если окислителем является хиноновое соединение, количество данного окислителя обычно составляет от 1 до 2 моль на 1 моль соединения (26). Примеры растворителя, обычно используемого в реакции, включают простые эфиры, такие как 1,4-диоксан, диэтиловый эфир, тетрагидрофуран и метилтретбутиловый эфир; углеводороды, содержащие галоген, такие как хлористый метилен, бромистый метилен, хлороформ, бромоформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как гексан, гептан, толуол, бензол и ксилол; нитрилы, такие как ацетонитрил; амиды, такие как N,N-диметилформамид; азотсодержащие циклические соединения, такие как N-метилпирролидон и 1,3-диметил-2-имидазолидинон; апротонные полярные растворители, например сульфоксидные растворители, такие как диметилсульфоксид; карбоновые кислоты, такие как уксусная кислота; кетоны, такие как ацетон и изобутилметилкетон; сложные эфиры, такие как этилацетат; спирты, такие как 2-пропанол и третбутиловый спирт; и воду. Можно использовать смесь из двух или более растворителей, и реакцию можно проводить в однофазной системе или в двухфазной системе.
Если окислителем является галоген, реакцию проводят в присутствии растворителя и основания, в случае необходимости. Количество окислителя обычно составляет от 1 моль до избытка на 1 моль соединения (26). Примеры растворителя, обычно используемого в реакции, включают углеводороды, содержащие галоген, такие как хлористый метилен, бромистый метилен, хлороформ, бромоформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и их смеси. Примеры используемого основания включают карбонаты металлов, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат кальция и карбонат цезия. Основание обычно используется в количестве 1 моль или более на 1 моль соединения (26).
В случае, когда окислителем является воздух, реакцию проводят в присутствии растворителя и катализатора, в случае необходимости. Примеры растворителя, обычно используемого в реакции, включают углеводороды, содержащие галоген, такие как хлористый метилен, бромистый метилен, хлороформ, бромоформ, четыреххлористый углерод, 1,2-дихлорэтан и хлорбензол; углеводороды, такие как толуол, бензол и ксилол; и их смеси. Примеры катализатора включают галогениды металлов, такие как хлорид железа(III) и бромид железа(III). Количество используемого катализатор обычно составляет от 0,001 моль до 1 моль на 1 моль соединения (26).
Описанные выше соединение (1), соединение (2) и их промежуточные соединения можно выделить и очистить стандартным способом, таким как отделение жидкости, фильтрация, перекристаллизация, колоночная хроматография, высокоэффективная колоночная хроматография (ВЭЖХ), препаративная ВЭЖХ среднего давления, колоночная хроматография на обессоливающей смоле, повторное осаждение или перегонка.
Далее будет разъяснен каждый заместитель, представленный R1, R2, R3, R4, R5, R6 и R7 в соединении (1), соединении (2) и соединении (3).
Примеры «атома галогена» включают атом фтора, атом хлора, атом брома и атом йода.
Примеры «С1-С6 алкильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают метильную группу, трифторметильную группу, трихлорметильную группу, хлорметильную группу, дихлорметильную группу, фторметильную группу, дифторметильную группу, этильную группу, пентафторэтильную группу, 2,2,2-трифторэтильную группу, 2,2,2-трихлорэтильную группу, пропильную группу, изопропильную группу, гептафторизопропильную группу, бутильную группу, изобутильную группу, вторбутильную группу, третбутильную группу, пентильную группу и гексильную группу.
Примеры «С3-С6 алкоксиалкильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают 2-метоксиэтильную группу, 2-этоксиэтильную группу и 2-изопропилоксиэтильную группу.
Примеры «С2-С6 алкенильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают 2-пропенильную группу, 3-хлор-2-пропенильную группу, 2-хлор-2-пропенильную группу, 3,3-дихлор-2-пропенильную группу, 2-бутенильную группу, 3-бутенильную группу, 2-метил-2-пропенильную группу, 3-метил-2-бутенильную группу, 2-пентенильную группу и 2-гексенильную группу.
Примеры «С3-С6 алкинильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают 2-пропинильную группу, 3-хлор-2-пропинильную группу, 3-бром-2-пропинильную группу, 2-бутинильную группу и 3-бутинильную группу.
Примеры «С1-С6 алкоксигруппы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают метоксигруппу, этоксигруппу, 2,2,2-трифторэтоксигруппу, пропоксигруппу, изопропилоксигруппу, бутоксигруппу, изобутоксигруппу, вторбутоксигруппу и третбутоксигруппу.
Примеры «С1-С6 алкилтиогруппы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают метилтиогруппу, трифторметилтиогруппу, этилтиогруппу, пропилтиогруппу, изопропилтиогруппу, бутилтиогруппу, изобутилтиогруппу, вторбутилтиогруппу, третбутилтиогруппу, пентилтиогруппу и гексилтиогруппу.
Примеры «С1-С6 алкилсульфинильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают метилсульфинильную группу, трифторметилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу, изопропилсульфинильную группу, бутилсульфинильную группу, изобутилсульфинильную группу, вторбутилсульфинильную группу, третбутилсульфинильную группу, пентилсульфинильную группу и гексилсульфинильную группу.
Примеры «С1-С6 алкилсульфонильной группы, необязательно замещенной, по меньшей мере, одним атомом галогена» включают метилсульфонильную группу, трифторметилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, изопропилсульфонильную группу, бутилсульфонильную группу, изобутилсульфонильную группу, вторбутилсульфонильную группу, третбутилсульфонильную группу, пентилсульфонильную группу и гексилсульфонильную группу.
Примеры соединения (1) включают следующие соединения:
соединение формулы (1), где R2 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (1), где R2 представляет собой атом водорода;
соединение формулы (1), где R1 представляет собой метильную группу или этильную группу, и R2 представляет собой атом водорода, метильную группу или этильную группу;
соединение формулы (1), где R1 и R2 представляют собой метильные группы;
соединение формулы (1), где R1 представляет собой метильную группу, и R2 представляет собой атом водорода;
соединение формулы (1), где R1 представляет собой этильную группу, и R2 представляет собой атом водорода;
соединение формулы (1), где R3 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (1), где R3 представляет собой метильную группу или этильную группу;
соединение формулы (1), где R4 представляет собой атом галогена или этильную группу;
соединение формулы (1), где R5 представляет собой атом галогена или цианогруппу;
соединение формулы (1), где R4 представляет собой атом галогена или метильную группу, и R5 представляет собой атом галогена или цианогруппу;
соединение формулы (1), где R1 представляет собой метильную группу или этильную группу, R2 представляет собой атом водорода, метильную группу или этильную группу, R3 представляет собой метильную группу или этильную группу, R4 представляет собой атом галогена или метильную группу, и R5 представляет собой атом галогена или цианогруппу;
соединение формулы (1), где R1, R2 и R3 представляют собой метильные группы, R4 представляет собой атом хлора, атом брома или метильную группу, и R5 представляет собой атом хлора, атом брома или цианогруппу;
соединение формулы (1), где R1 представляет собой метильную группу, R2 представляет собой атом водорода, R3 представляет собой метильную группу, R4 представляет собой атом хлора, атом брома или метильную группу, и R5 представляет собой атом хлора, атом брома или цианогруппу; и
соединение формулы (1), где R1 представляет собой этильную группу, R2 представляет собой атом водорода, R3 представляет собой метильную группу, R4 представляет собой атом хлора, атом брома или метильную группу, и R5 представляет собой атом хлора, атом брома или цианогруппу.
Примеры соединения (2) включают следующие соединения:
соединение формулы (2), где R6 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (2), где R6 представляет собой атом галогена или трифторметильную группу;
соединение формулы (2), где R7 представляет собой атом галогена;
соединение формулы (2), где R6 представляет собой атом галогена или трифторметильную группу, и R7 представляет собой атом галогена; и
соединение формулы (2), где R6 представляет собой атом хлора, атом брома или трифторметильную группу, и R7 представляет собой атом хлора.
Примеры соединения (3) включают следующие соединения:
соединение формулы (3), где R2 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (3), где R2 представляет собой атом водорода;
соединение формулы (3), где R1 представляет собой метильную группу или этильную группу, и R2 представляет собой атом водорода, метильную группу или этильную группу;
соединение формулы (3), где R1 и R2 представляют собой метильные группы;
соединение формулы (3), где R1 представляет собой метильную группу, и R2 представляет собой атом водорода;
соединение формулы (3), где R1 представляет собой этильную группу, и R2 представляет собой атом водорода;
соединение формулы (3), где R3 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (3), где R3 представляет собой метильную группу или этильную группу;
соединение формулы (3), где R4 представляет собой атом галогена или метильную группу;
соединение формулы (3), где R5 представляет собой атом галогена или цианогруппу;
соединение формулы (3), где R4 представляет собой атом галогена или метильную группу, и R5 представляет собой атом галогена или цианогруппу;
соединение формулы (3), где R6 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (3), где R6 представляет собой атом галогена или трифторметильную группу;
соединение формулы (3), где R7 представляет собой атом галогена;
соединение формулы (3), где R6 представляет собой атом галогена или трифторметильную группу, и R7 представляет собой атом галогена;
соединение формулы (3), где R1 представляет собой метильную группу или этильную группу, R2 представляет собой атом водорода, метильную группу или этильную группу, R3 представляет собой метильную группу или этильную группу, R4 представляет собой атом галогена или метильную группу, R5 представляет собой атом галогена или цианогруппу, R6 представляет собой атом галогена или трифторметильную группу, и R7 представляет собой атом галогена;
соединение формулы (3), где R1, R2 и R3 представляют собой метильные группы, R4 представляет собой атом хлора, атом брома или метильную группу, R5 представляет собой атом хлора, атом брома или цианогруппу, R6 представляет собой атом хлора, атом брома или трифторметильную группу, и R7 представляет собой атом хлора;
соединение формулы (3), где R1 представляет собой метильную группу, R2 представляет собой атом водорода, R3 представляет собой метильную группу, R4 представляет собой атом хлора, атом брома или метильную группу, R5 представляет собой атом хлора, атом брома или цианогруппу, R6 представляет собой атом хлора, атом брома или трифторметильную группу, и R7 представляет собой атом хлора; и
соединение формулы (3), где R1 представляет собой этильную группу, R2 представляет собой атом водорода, R3 представляет собой метильную группу, R4 представляет собой атом хлора, атом брома или метильную группу, R5 представляет собой атом хлора, атом брома или цианогруппу, R6 представляет собой атом хлора, атом брома или трифторметильную группу, и R7 представляет собой атом хлора.
Примеры соединения (17) включают следующие соединения:
соединение формулы (17), где R6 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена;
соединение формулы (17), где R6 представляет собой атом галогена или трифторметильную группу;
соединение формулы (17), где R7 представляет собой атом галогена;
соединение формулы (17), где R6 представляет собой атом галогена или трифторметильную группу, и R7 представляет собой атом галогена;
соединение формулы (17), где R6 представляет собой атом хлора, атом брома или трифторметильную группу, а R7 представляет собой атом хлора.
Соединение (3), полученное способом настоящего изобретения, обладает превосходной регулирующей активностью в отношении вредных членистоногих. Примеры вредных членистоногих, которых можно регулировать при помощи соединения (3), включают следующих членистоногих.
Полужесткокрылые:
Дельфациды, такие как темная цикадка (Laodelphax striatellus), бурая рисовая цикадка (Nilaparvata lugens) и белоспинная рисовая блоха (Sogatella furcifera),
Цикадки, такие как зеленая рисовая цикадка (Nephotettix cincticeps), зеленая рисовая цикадка (Nephotettix virescens) и чайная зеленая цикадка (Empoasca onukii),
Растительная тля, такая как хлопковая тля (Aphis gossypii), зеленая персиковая тля (Myzus persicae), капустная тля (Brevicoryne brassicae), спирейная тля (Aphis spiraecola), картофельная тля (Macrosiphum euphorbiae), наперстяночная тля (Aulacorthum solani), обыкновенная черемуховая тля (Rhopalosiphum padi), тропическая цитрусовая тля (Toxoptera citricidus) и сливовая опыленная тля (Hyalopterus pruni),
Щитники, такие как клоп хлопково-огородный (Nezara antennata), клоп бобовый (Riptortus clavetus), клоп рисовый (Leptocorisa chinensis), белопятнистый клоп (Eysarcoris parvus) и клоп-щитник (Halyomorpha mista),
Белокрылки, такие как белокрылка тепличная (Trialeurodes vaporariorum), белокрылка хлопковая (Bemisia tabaci), белокрылка магнолиевая (Bemisia argentifolii), белокрылка цитрусовая (Dialeurodes citri) и белокрылка цитрусовая колючая (Aleurocantus spiniferus),
Щитовки, такие как щитовка померанцевая красная (Aonidiella aurantii), щитовка калифорнийская (Comstockaspis perniciosa), щитовка восточная цитрусовая (Unaspis citri), ложнощитовка рубиновая (Ceroplastes rubens), австралийский желобчатый червец (Icerya purchasi), японский мучнистый червец (Planococcus kraunhiae), червец щетинистый мучнистый (Pseudococcus longispinis) и тутовая щитовка (Pseudalacaspis pentagona),
Кружевницы, листоблошки и так далее.
Бабочки:
Огневки, такие как стеблевая рисовая огневка (Chilo suppressalis), желтая рисовая огневка (Tryporyza incertulas), рисовая огневка (Cnaphalocrocis medinalis), хлопковая огневка (Notarcha derogata), южная амбарная огневка (Plodia interpunctella), кукурузный мотылек (Ostrinia furnacalis), огневка капустная (Hellula undalis) и огневка (Pediasia teterrellus),
Чешуекрылые, такие как азиатская хлопковая совка (Spodoptera litura), совка малая наземная (Spodoptera exigua), совка рисовая (Pseudaletia separata), совка капустная (Mamestra brassicae), совка ипсилон (Agrotis ipsilon), свекольная совка-металловидка (Plusia nigrisigna), вид Thoricoplusia, вид Heliotis и вид Helicoverpa,
Бабочки белянки, такие как репница (Pieris rapae),
Листовертки, такие как вид Adoxophyes, восточная плодожорка (Grapholita molesta), соевая плодожорка (Leguminivora glycinivorella), гусеница совки бобов азуки (Matsumuraeses azukivora), листовертка летних фруктовых деревьев (Adoxophyes orana fasciata), малая чайная листовертка (вид Adoxophyes), восточная чайная листовертка (Homona magnanima), яблонная листовертка (Archips fuscocupreanus) и яблонная плодожорка (Cydia pomonella),
Чешуекрылые, такие как чайная листовертка (Caloptilia theivora) и яблонная моль-минер (Phyllonorycter ringoneella),
Карпосиниды, такие как персиковая плодожорка (Carposina niponensis),
Крохотки-моли, такие как вид Lyonetia,
Волнянки, такие как вид Lymantria и вид Euproctis,
Горностаевые моли, такие как моль капустная (Plutella xylostella),
Выемчатокрылые моли, такие как розовый коробочный червь хлопчатника (Pectinophora gossypiella) и картофельный трубочник (Phthorimaea operculella),
Медведицы, такие как американская белая бабочка (Hyphantria cunea),
Моли настоящие, такие как прозрачная моль (Tinea translucens) и платяная моль (Tineola bisselliella), и так далее.
Пузыреногие:
Трипсы, такие как желтый цитрусовый трипс (Frankliniella occidentalis), пальмовый трипс (Thrips palmi), чилийский желтый чайный трипс (Scirtothrips dorsalis), трипс табачный (Thrips tabaci) и трипс пшеничный (Frankliniella intonsa);
Двукрылые:
Муха комнатная (Musca domestica), комар обыкновенный (Culex popiens pallens), слепень (Tabanus trigonus), личинка мухи луковой (Hylemya antigua), личинка мухи ростковой (Hylemya platura), Anopheles sinensis, рисовый минер (Agromyza oryzae), рисовый минер (Hydrellia griseola), личинка мухи рисовой (Chlorops oryzae), муха дынная (Dacus cucurbitae), средиземноморская плодовая муха (Ceratitis capitata), американский клеверный минер (Liriomyza trifolii), томатный листовой минер (Liriomyza sativae), листовой минер садового горошка (Chromatomya horticola) и так далее.
Жуки:
Двадцативосьмиточечная божья коровка (Epilachna vigintioctopunctata), листоед тыквенный (Aulacophora femoralis), полосатая жук-блошка (Phyllotreta striolata), рисовый листоед (Oulema oryzae), долгоносик рисовый (Echinocnemus squameus), долгоносик рисовый водяной (Lissorhoptrus oryzophilus), долгоносик хлопковый (Anthonomus grandis), долгоносик бобов азуки (Callosobruchus chinensis), долгоносик-охотник (Sphenophorus venatus), хрущик японский (Popillia japonica), хрущик медяный (Anomala cuprea), блошка длинноусая (вид Diabrotica), колорадский жук (Leptinotarsa decemlineata), жуки-щелкуны (вид Agriotes), жук табачный (Lasioderma serricorne), кожеед коровяковый (Anthrenus verbasci), хрущик каштановый (Tribolium caastaneum), капюшонник (Lyctus brunneus), азиатский усач (Anoplophora malasiaca), большой сосновый лубоед (Tomicus piniperda) и так далее;
Прямокрылые:
Азиатская перелетная саранча (Locusta migratoria), африканская медведка (Gryllotalpa africana), рисовая кобылка (Oxya yezoensis), рисовая кобылка (Oxya japonica) и так далее;
Перепончатокрылые:
Рапсовый пилильщик (Athalia rosae), муравей-листоед (вид Acromyrmex), огненный муравей (вид Solenopsis) и так далее;
Тараканы:
Рыжий таракан (Blatella germanica), дымчато-коричневый таракан (Periplaneta fuliginosa), американский таракан (Periplaneta americana), коричневый таракан (Periplaneta brunea), черный таракан (Blatta orientalis) и так далее;
Клещи:
Паутинные клещи, такие как двухпятнистый паутинный клещик (Tetranychus urticae), паутинный клещ канзава (Tetranychus kanzawai), цитрусовый красный клещ (Panonychus citri), европейский красный клещ (Panonychus ulmi) и вид Oligonychus;
Галловые четырехногие клещи, такие как розовый цитрусовый галловый клещ (Aculops pelekassi), розовый цитрусовый галловый клещ (Phyllocoptruta citri), томатный розовый клещ (Aculops lycopersici), пурпурный чайный клещ (Calacarus carinatus), розовый чайный галловый клещ (Acaphylla theavagrans) и грушевый галловый клещ (Eriophyes chibaensis),
Тарсонелидовые, такие как оранжерейный прозрачный клещ (Polyphagotarsonemus latus),
Плоские клещи, такие как Brevipalpus phoenicis,
Тукерелидовые,
Иксодовые, такие как Haemaphysalis longicornis, Haemaphysalis flava, Dermacentor taiwanicus, Ixodes ovatus, Ixodes persulcatus, Boophilus microplus и Rhipicephalus sanguines,
Амбарные клещи, такие как Tyrophagus putrescentiae и Tyrophagus similes,
Пироглифидовые, такие как Dermatophagoides farinae и Dermatophagoides ptrenyssnus,
Хейлетидовые, такие как Cheyletus eruditus, Cheyletus malaccensis и Cheyletus moorei,
Дерманиссидовые.
При использовании соединения (3) в качестве агента для борьбы с вредными членистоногими, хотя соединение (3) можно использовать само по себе, соединение (3) обычно смешивают с инертным носителем, таким как твердый носитель, жидкий носитель или газообразный носитель и, кроме того, при необходимости, с поверхностно-активным веществом и другими фармацевтическими добавками, для получения эмульгируемого концентрата, раствора в масле, порошка, гранулы, смачивающегося порошка, текучего препарата, микрокапсулы, аэрозоля, фумиганта, отравленной приманки, препарата на основе смолы или тому подобного, а затем используют. Полученный таким образом состав обычно содержит от 0,01 до 95 мас.% соединения (3).
Примеры твердого носителя, используемого для состава, включают тонкий порошок или гранулы глины (каолиновая глина, диатомовая земля, бентонит, глина Фубазами, кислая глина и так далее), синтетический гидратированный оксид кремния, тальк, керамику, другие неорганические минералы (серицит, кварц, сера, активированный уголь, карбонат кальция, гидратированный кремнезем и тому подобное), химические удобрения (сульфат аммония, фосфат аммония, нитрат аммония, мочевина, хлорид аммония и тому подобное) и так далее.
Примеры жидкого носителя включают воду, спирты (метанол, этанол, изопропиловый спирт, бутанол, гексанол, бензиловый спирт, этиленгликоль, пропиленгликоль, феноксиэтанол и так далее), кетоны (ацетон, метилэтилкетон, циклогексанон и так далее), ароматические углеводороды (толуол, ксилол, этилбензол, додецилбензол, фенилксилилэтан, метилнафталин и так далее), алифатические углеводороды (гексан, циклогексан, керосин, газойль и так далее), сложные эфиры (этилацетат, бутилацетат, изопропилмиристат, этилолеат, диизопропиладипат, диизобутиладипат, ацетат монометилового эфира пропиленгликоля и так далее), нитрилы (ацетонитрил, изобутиронитрил и так далее), простые эфиры (диизопропиловый эфир, 1,4-диоксан, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, монометиловый эфир диэтиленгликоля, монометиловый эфир пропиленгликоля, монометиловый эфир дипропиленгликоля, 3-метокси-3-метил-1-бутанол и так далее), амиды кислот (N,N-диметилформамид, N,N-диметилацетамид и так далее), углеводороды, содержащие галоген, (хлористый метилен, трихлорэтан, четыреххлористый углерод и так далее), сульфоксиды (диметилсульфоксид и так далее), пропиленкарбонат и растительные масла (соевое масло, хлопковое масло и так далее).
Примеры газообразного носителя включают фторуглерод, газообразный бутан, LPG (сжиженный попутный газ), диметиловый эфир и газообразную двуокись углерода.
Примеры поверхностно-активного вещества включают неионогенные поверхностно-активные вещества, такие как полиоксиэтиленалкиловый эфир, полиоксиэтиленалкилариловый эфир и сложный эфир полиэтиленгликоля и жирной кислоты, и анионогенные поверхностно-активные вещества, такие как алкилсульфонат, алкилбензолсульфонат и алкилсульфат.
Примеры других фармацевтических добавок включают связующее вещество, диспергатор, краситель и стабилизатор, а их конкретные примеры включают казеин, желатин, сахариды (крахмал, гуммиарабик, производные целлюлозы, альгиновую кислоту и так далее), производные лигнина, бентонит, синтетические водорастворимые полимеры (поливиниловый спирт, поливинилпирролидон, полиакриловая кислота и так далее), РАР (кислый изопропилфосфат), ВНТ (2,6-дитретбутил-4-метилфенол) и ВНА (смесь 2-третбутил-4-метоксифенола и 3-третбутил-4-метоксифенола).
Для борьбы с вредными членистоногими соединение (3) можно использовать само по себе. Обычно для борьбы с вредными членистоногими используют описанный выше агент для борьбы с вредными членистоногими, содержащий соединение (3). Способ борьбы с вредными членистоногими включает применение соединения (3) или агента для борьбы с вредными членистоногими, содержащего соединение (3), к вредным членистоногим или к месту обитания вредных членистоногих, по аналогии со способом, используемым для применения известного пестицида.
Примеры мест обитания вредных членистоногих включают рисовые поля, посевные земли, фруктовые сады, не посевные земли и дома.
Примеры способа применения включают обработку распылением, обработку грунта, обработку зерна и обработку водной культурной среды.
Обработка распылением представляет собой способ обработки, включающий обработку поверхности растений или самих вредных членистоногих активным ингредиентом и, за счет этого, может оказать регулирующее воздействие на вредных членистоногих. Конкретные примеры обработки распылением включают обработку листвы распылением, обработку стволов деревьев распылением и так далее.
Обработка почвы представляет собой способ обработки, который включает обработку почвы или ирригационной жидкости активным ингредиентом с целью допустить проникновение и перенос активного ингредиента внутрь стебля растения сельскохозяйственной культуры, которую требуется защитить от поражения, такого как поедание вредными членистоногими, через корневую или сходную часть растения, и, таким образом, может защитить урожай от поражения вредными членистоногими. Конкретные примеры обработки почвы включают обработку посадочных лунок (распыление в посадочные лунки, перемешивание почвы после обработки посадочных лунок), обработку корней растения (распыление на корни растения, перемешивание почвы после обработки корней растения, орошение корней растения на более поздней стадии выращивания высева), обработку борозд для высаживания (распыление на борозды для высаживания, перемешивание почвы после обработки борозд для высаживания), обработку рядов для высаживания (распыление на ряды для высаживания, перемешивание почвы после обработки рядов для высаживания, распыление на ряды для высаживания на стадии роста), обработку рядов для высаживания во время посева (распыление на ряды для высаживания во время посева, перемешивание почвы после обработки рядов для высаживания во время посева), разбросную обработку (общее распыление на поверхность почвы, перемешивание почвы после разбросной обработки), другую обработку почвы распылением (распыление гранулированного препарата на листву на стадии роста, распыление под кроной или вокруг ствола дерева, распыление на поверхность почвы, перемешивание с поверхностью почвы, распыление в лунки для семян, распыление на земляную поверхность борозд, распыление между растениями), другую ирригационную обработку (орошение почвы, орошение на стадии всхода ростков, обработку вливанием раствора препарата, орошение части растения непосредственно над землей, капельное орошение раствором препарата, химизация), обработку рассадного ящика (распыление в рассадный ящик, орошение рассадного ящика), обработку рассадного лотка (распыление в рассадный лоток, орошение рассадного лотка), обработку грядок (распыление на грядки, орошение грядок, распыление в низинном рисовом рассаднике, погружение рассады), обработку почвы грядок внедрением (смешивание с почвой грядок, смешивание с почвой грядок перед посевом) и другую обработку (смешивание с возделываемой почвой, под вспахивание, смешивание с поверхностной почвой, смешивание с почвой в месте падения дождевых капель с кроны, обработка в месте посадки, распыление гранулированного препарата на скопления цветов, смешивание с пастообразным удобрением).
Протравливание семян представляет собой способ обработки, который включает применение активного ингредиента непосредственно к семени, семенному клубню или луковице посева, которые требуется защитить от поражения, такого как поедание вредными членистоногими или вокруг них, и, таким образом, может оказать регулирующее воздействие на вредных членистоногих. Конкретные примеры протравливания семян включают обработку распылением, обработку покрытием, наносимым методом распыления, обработку погружением, обработку пропитыванием, обработку нанесением покрытия, обработку нанесением пленочного покрытия и обработку гранулированием.
Обработка водной культуральной среды представляет собой способ обработки, который включает обработку водной культуральной среды или тому подобное, активным ингредиентом с целью допустить проникновение и перенос активного ингредиента во внутреннюю часть посевного растения, которое требуется защитить от поражения, такого как поедание вредными членистоногими через корневую часть растения или тому подобное и, таким образом, может защитить посев от поражения вредными членистоногими. Конкретные примеры обработки водной культуральной среды включают смешивание с водной культуральной средой и введение в водную культуральную среду.
В том случае, когда содержащий соединение (3) агент для борьбы с вредными членистоногими используется для борьбы с вредными членистоногими в области сельского хозяйства, он обычно используется в количестве от 1 до 10000 г соединения (3) на 10000 м2. Если на основе агента для борьбы с вредными членистоногими получают состав в виде эмульгируемого концентрата, смачивающегося порошка или текучего состава, агент для борьбы с вредными членистоногими обычно применяют после его растворения в воде таким образом, чтобы концентрация активного ингредиента составляла от 0,01 до 10000 ч./млн. Если на основе агента для борьбы с вредными членистоногими получают состав в виде гранулы или порошка, агент для борьбы с вредными членистоногими обычно применяют в том виде, в каком он есть.
Агент для борьбы с вредными членистоногими или водный раствор агента для борьбы с вредными членистоногими можно непосредственно распылять на вредных членистоногих или растения, такие как посевы, которые требуется защитить от вредных членистоногих. Альтернативным образом, можно обработать почву обработанной земли агентом для борьбы с вредными членистоногими или водным раствором агента для борьбы с вредными членистоногими, чтобы уничтожить вредных членистоногих, населяющих почву.
Агент для борьбы с вредными членистоногими может иметь вид полимерного состава, который перерабатывают для получения листа или нити. Такой полимерный состав можно применять, обертывая растение листом или нитью полимерного состава, помещая нить полимерного состава вокруг растения, так что растение окружено этой нитью, или кладя лист полимерного состава на поверхность почвы рядом с корнем растения.
В том случае, когда содержащий соединение (3) агент для борьбы с вредными членистоногими используют для борьбы с вредными членистоногими, живущими в доме (например, муха, комар, таракан), он обычно используется в количестве от 0,01 до 1000 мг соединения (3) на 1 м2 в случае обработки плоской поверхности, и обычно от 0,01 до 500 мг соединения (3) на 1 м3 в случае обработки пространства. Если на основе содержащего соединение (3) агента для борьбы с вредными членистоногими получают состав в виде эмульгируемого концентрата, смачивающегося порошка или текучего порошка, агент для борьбы с вредными членистоногими обычно применяют после его растворения в воде так, чтобы концентрация активного ингредиента составляла от 0,1 до 1000 ч./млн. Если на основе содержащего соединение (3) агента для борьбы с вредными членистоногими получают состав в виде раствора в масле, аэрозоля, фумиганта или отравленной приманки, агент для борьбы с вредными членистоногими используют в том виде, в котором он есть.
Соединение (3) можно использовать в качестве инсектицида для посевных земель, таких как обработанные земли, рисовые поля, газоны и фруктовые сады или для не посевных земель. В некоторых случаях, при помощи соединения, полученного способом настоящего изобретения, можно бороться с вредителями на посевных землях и так далее, где выращивают перечисленные ниже сельскохозяйственные культуры и тому подобное, не нанося препаратом вреда данным сельскохозяйственным культурам.
Сельскохозяйственные культуры: кукуруза, рис, пшеница, ячмень, рожь, овес, сорго, хлопчатник, соя, арахис, гречиха полузонтичная, сахарная свекла, рапс, подсолнечник, сахарный тростник, табак и так далее;
Овощи: растения семейства пасленовых (баклажан, томат, зеленый перец, стручковый перец, картофель и так далее), бахчевые растения (огурец, тыква, цукини, арбуз, дыня и так далее), крестоцветные растения (японский редис, репа, хрен, кольраби, китайская капуста, капуста, китайская горчица, брокколи, цветная капуста и так далее), сложноцветные растения (лопух большой, съедобная хризантема, артишок, салат-латук и так далее), лилейные растения (лук-батун, лук, чеснок, спаржа и так далее), зонтичные растения (морковь, петрушка, сельдерей, пастернак и так далее), маревые растения (шпинат, швейцарский мангольд и так далее), губоцветные растения (японский базилик, мята, базилик и так далее), клубника, сладкий картофель, ямс, ароидные и так далее;
Цветы;
Декоративные растения;
Фруктовые деревья: яблокоподобные фрукты (яблоко, груша обыкновенная, китайская айва, айва и так далее), косточковые мясистые фрукты (персик, слива, нектарин, японская слива, вишня, абрикос, чернослив и так далее), цитрусовые растения (сатсумский мандарин, апельсин, лимон, лайм, грейпфрут и так далее), орехи (каштан, грецкий орех, фундук, миндаль, фисташка, орехи кешью, орехи макадамия и так далее), ягоды (голубика, клюква, ежевика, малина и так далее), виноградная лоза, хурма, олива, локва, банан, кофе, финик, кокос и так далее;
Деревья, отличающиеся от фруктовых деревьев: чайное, шелковица, цветковые деревья и кустарники, городские деревья (ясень, береза, кизил, эвкалипт, гингко, сирень, кленовое дерево, дуб, тополь, церцис, китайское амбровое дерево, платан, дзельква, японская туя, пихта, японская тсуга, можжевельник твердый, сосна, ель, тис) и так далее.
Далее настоящее изобретение будет разъяснено более подробно со ссылкой на примеры, но настоящее изобретение ими не ограничено.
Примеры
Пример 1
Смесь 0,79 г соединения (1-1):
[Химическая формула 14]
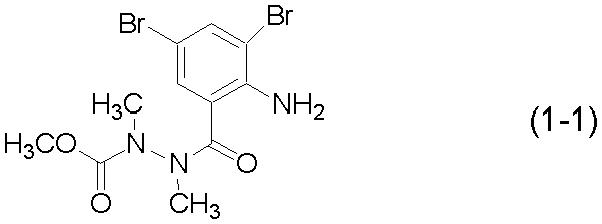 ,
,
0,57 г соединения (2-1):
[Химическая формула 15]
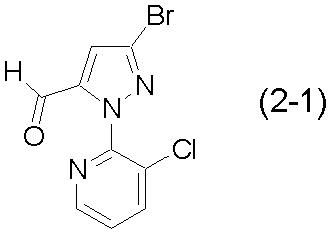 ,
,
0,04 г моногидрата п-толуолсульфокислоты и 10 мл толуола перемешивали и нагревали при кипячении с обратным холодильником в воздушной атмосфере в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры в реакционную смесь вливали воду, после чего проводили экстракцию этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,20 г соединения (3-1).
Соединение (3-1):
[Химическая формула 16]
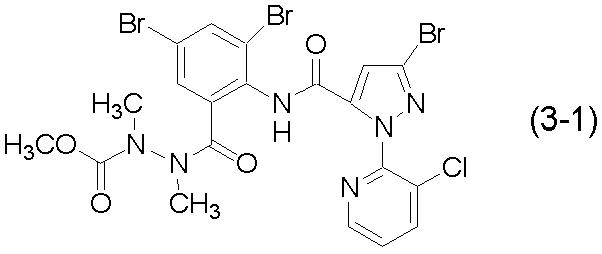
1H-ЯМР (ДМСО-d6, ТМС) δ (м.д.): 2,71 (1,4H, с), 2,83 (1,6H, с), 2,94 (1,5H, с), 3,06 (1,5H, с), 3,35-3,70 (3,0H, м), 7,41 (0,5H, с), 7,45 (0,6H, с), 7,47 (0,6H, с), 7,60-7,64 (1,3H, м), 8,07 (0,5H, д, J=2 Гц), 8,13 (0,5H, с), 8,18 (1,0H, д, J=8 Гц), 8,50 (1,0H, м), 10,52 (0,5H, с), 10,67 (0,5H, с).
Пример 2
Смесь 0,25 г соединения (1-1), 0,18 г соединения (2-1), 1 мг йодида меди(I), 0,12 г м-хлорпербензойной кислоты и 1 мл ацетонитрила перемешивали и нагревали при кипячении с обратным холодильником в атмосфере азота в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры в реакционную смесь вливали воду, после чего проводили экстракцию этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,10 г соединения (3-1).
Пример 3
Смесь 0,30 г соединения (1-1), 0,22 г соединения (2-1), 0,33 г хлорхромата пиридиния (РСС), моногидрата п-толуолсульфокислоты (каталитическое количество) и 4 мл хлорбензола перемешивали в атмосфере азота при 100°С в течение 1 часа. Из реакционной смеси отбирали образец и подвергали анализу методом ТСХ (тонкослойная хроматография). В результате подтверждали получение соединения (3-1).
Пример 4
Для получения соединения (3-2) вместо соединения (1-1) из примера 2 использовали соединение (1-2):
[Химическая формула 17]
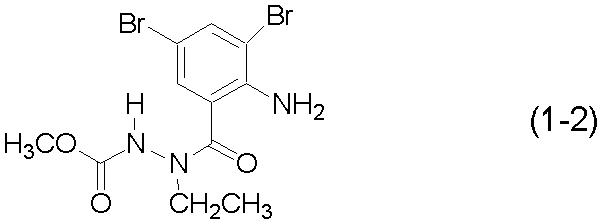
Соединение (3-2):
[Химическая формула 18]
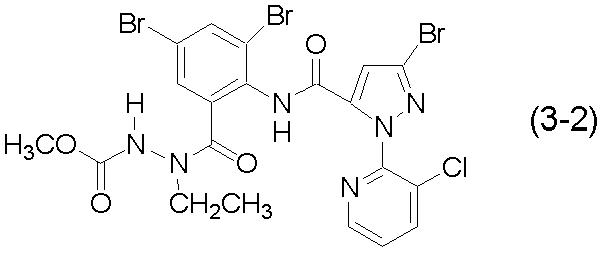
Пример 5
Для получения соединения (3-4) вместо соединения (1-1) из примера 2 использовали соединение (1-4):
[Химическая формула 19]
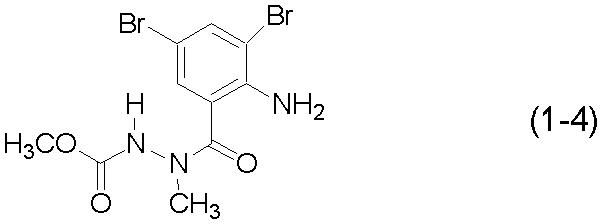
[Химическая формула 20]
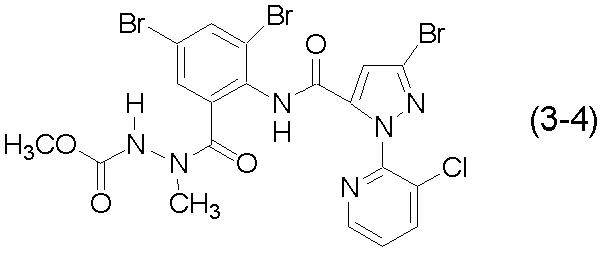
Конкретные примеры соединения (3), которые можно получить способом настоящего изобретения, перечислены ниже.
Приведены физические свойства некоторых соединений (3).
Соединение (3-1)
1H-ЯМР (ДМСО-d6, ТМС) δ (м.д.): 2,71 (1,4H, с), 2,83 (1,6H, с), 2,94 (1,5H, с), 3,06 (1,5H, с), 3,35-3,70 (3,0H, м), 7,41 (0,5H, с), 7,45 (0,6H, с), 7,47 (0,6H, с), 7,60-7,64(1,3H, м), 8,07 (0,5H, д, J=2 Гц), 8,13 (0,5H, с), 8,18 (1,0H, д, J=8 Гц), 8,50 (1,0H, м), 10,52 (0,5H, с), 10,67 (0,5H, с).
Соединение (3-2)
1H-ЯМР (ДМСО-d6, ТМС) δ (м.д.): 0,86 (1,0H, т, J=7 Гц), 0,99 (2,0H, т, J=7 Гц), 3,10 (1,7H, уш.с), 3,50 (2,4H, с), 3,64 (0,6H, с), 3,85 (0,3H, уш.с), 7,36-7,44 (2,0H, м), 7,59-7,65 (1,0H, м), 8,07-8,21 (2,0H, м), 8,49-8,51 (1,0H, м), 9,04 (0,7H, уш.с), 9,71 (0,3H, уш.с), 10,30 (0,7H, уш.с), 10,66 (0,3H, уш.с).
Соединение (3-3)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 2,04 (3H, с), 3,22 (3H, с), 3,57 (2,6H, с), 3,80 (0,4H, с), 7,01 (1H, с), 7,04 (1H, с), 7,28 (1H, с), 7,40 (1H, дд, J=8 Гц, 5 Гц), 7,61 (1H, уш.с), 7,87 (1H, дд, J=8 Гц, 2 Гц), 8,46 (1H, дд, J=5 Гц, 2 Гц), 9,80 (1H, уш.с).
Соединение (3-4)
1H-ЯМР (100°C, ДМСО-d6, ТМС) δ (м.д.): 2,96 (3H, с), 3,04 (3H, уш.с), 7,30 (1H, с), 7,38 (1H, с), 7,58 (1H, дд, J=8 Гц, 5 Гц), 7,96 (1H, с), 8,11 (1H, д, J=8 Гц), 8,47 (1H, д, J=5 Гц), 8,68 (1H, уш.с), 10,08 (1H, уш.с).
Соединение (3-5)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 0,87-0,95 (3,8H, м), 1,13-1,26 (4,4H, м), 3,55 (2,5H, с), 3,81 (0,5H, с), 4,55-4,67 (1,0H, м), 7,37-7,42 (3,0H, м), 7,49 (1,0H, д, J=2 Гц), 7,57 (1,1H, д, J=2 Гц), 7,86 (1,0H, дд, J=8 Гц, 2 Гц), 8,45 (1,0H, дд, J=5 Гц, 2 Гц), 9,68 (0,3H, уш.с), 9,93 (0,7H, уш.с).
Соединение (3-6)
1H-ЯМР (ДМСО-d6, ТМС) δ (м.д.): 2,11 (3H, с), 3,06 (3H, с), 3,33 (3H, с), 7,07 (1H, с), 7,45 (1H, с), 7,68 (1H, с), 7,69 (1H, дд, J=8 Гц, 4 Гц), 8,24 (1H, д, J=8 Гц), 8,55 (1H, д, J=4 Гц), 9,11 (0,6H, уш.с), 10,20 (1H, уш.с), 10,54 (0,4H, уш.с).
Соединение (3-7)
1H-ЯМР (ДМСО-d6, ТМС) δ (м.д.): 2,10-2,24 (3H, м), 2,61-2,87 (3H, м), 2,90-3,18 (3H, м), 3,45-3,74 (3H, м), 7,12-7,30 (1H, м), 7,33-7,44 (1H, м), 7,44-7,58 (1H, м), 7,58-7,66 (1H, м), 8,20 (1H, д, J=8Гц), 8,47-8,54 (1H, м), 10,10-10,50 (1H, м).
Соединение (3-8)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,21 (3H, с), 3,08 (3H, с), 3,45-3,70 (3H, м), 7,30-7,43 (1H, м), 7,44-7,61 (1H, м), 7,63 (1H, дд, J=8 Гц, 5 Гц), 7,82-7,94 (1H, м), 8,21 (1H, д, J=8 Гц, 1 Гц), 8,51 (1H, дд, J=5 Гц, 1 Гц), 9,21 (1H, уш.с), 10,24 (1H, уш.с).
Соединение (3-9)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,14-2,29 (3H, м), 2,64-2,87 (3H, м), 2,87-3,15 (3H, м), 3,42-3,73 (3H, м), 7,30-7,45 (1H, м), 7,54-7,81 (2H, м), 7,83-8,01 (1H, м), 8,15-8,24 (1H, м), 8,50 (1H, уш.с), 10,20-10,68 (1H, м).
Соединение (3-10)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 3,12-3,18 (3H, уш.м), 3,60-3,84 (3H, уш.м), 7,21-7,22 (2H, м), 7,34 (1H, уш.с), 7,41 (1H, дд, J=8 Гц, 5 Гц), 7,51 (1H, уш.с), 7,88 (1H, дд, J=8 Гц, 1 Гц), 8,48 (1H, дд, J=5 Гц, 1 Гц), 9,85 (1H, уш.с).
Соединение (3-11)
1H-ЯМР (CDCl3, TMC) δ(м.д.): 1,11-1,39 (3H, м), 3,12-3,18 (3H, уш.м), 4,06-4,25 (2H, уш.м), 7,08-7,22 (2H, м), 7,34 (1H, уш.с), 7,41 (1H, дд, J=8 Гц, 5 Гц), 7,43 (1H, уш.с), 7,88 (1H, дд, J=8 Гц, 1 Гц), 8,49 (1H, дд, J=5 Гц, 1 Гц), 9,87 (1H, уш.с).
Соединение (3-12)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,73 (1,4H, с), 2,83 (1,6H, с), 2,95 (1,6H, с), 3,07 (1,4H, с), 3,49-3,68 (3,0H, м), 7,32-7,44 (2,0H, м), 7,62 (1,0H, дд, J=8 Гц, 5 Гц), 7,85 (0,5H, д, J=2 Гц), 7,92 (0,5H, с), 8,19 (1,0H, дд, J=8 Гц, 1 Гц), 8,49-8,52 (1,0H, м), 10,53 (0,5H, с), 10,71 (0,5H, с).
Соединение (3-13)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,72 (1,4H, с), 2,83 (1,6H, с), 2,94 (1,6H, с), 3,07 (1,4H, с), 3,49-3,68 (3,0H, м), 7,34-7,45 (2,0H, м), 7,60-7,64 (1,0H, м), 7,98 (0,4H, д, J=2 Гц), 8,04 (0,5H, с), 8,19 (1,0H, д, J=8 Гц), 8,49-8,52 (1,0H, м), 10,54 (0,5H, с), 10,70 (0,5H, с).
Соединение (3-14)
1H-ЯМР (ДМСО-d6, TMC) δ(м.д.): 2,13 (1,4H, с), 2,18 (1,6H, с), 2,73 (1,4H, с), 2,82 (1,6H, с), 2,93-2,96 (1,2H, м), 3,07-3,07 (1,8H, м), 3,43-3,69 (3,0H, м), 7,18-7,32 (2,0H, м), 7,46-7,53 (1,0H, м), 7,60-7,64 (1,0H, м), 8,19 (1,0H, д, J=8Гц), 8,49-8,51 (1,0H, м), 10,20 (0,4H, уш.с), 10,45 (0,6H, уш.с).
Соединение (3-15)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,73 (1,3H, с), 2,84 (1,7H, с), 2,95 (1,3H, уш.с), 3,07-3,08 (1,7H, м), 3,46-3,68 (3,0H, м), 7,32-7,39 (2,0H, м), 7,62 (1,0H, дд, J=8 Гц, 5 Гц), 7,85-7,92 (1,0H, м), 8,19 (1,0H, д, J=8Гц), 8,49-8,51 (1,0H, м), 10,54 (0,4H, уш.с), 10,74 (0,6H, уш.с).
Соединение (3-16)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,71 (1,4H, с), 2,83 (1,6H, с), 2,94 (1,3H, уш.с), 3,06-3,08 (1,7H, м), 3,44-3,68 (3,0H, м), 7,36-7,47 (2,0H, м), 7,60-7,64 (1,0H, м), 8,08-8,20 (2,0H, м), 8,50-8,51 (1,0H, м), 10,56 (0,4H, уш.с), 10,71 (0,6H, уш.с).
Соединение (3-17)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,03-1,07 (3,0H, м), 3,31-3,82 (5,0H, м), 7,23 (2,0H, с), 7,31 (1,0H, с), 7,39 (1,0H, дд, J=8 Гц, 5 Гц), 7,54 (1,0H, с), 7,87 (1,0H, дд, J=8 Гц, 1 Гц), 8,46 (1,0H, дд, J=5, 1 Гц), 9,65 (0,2H, уш.с), 9,86 (0,8H, уш.с).
Соединение (3-18)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 2,71 (1,4H, с), 2,84 (1,6H, с), 2,95 (1,3H, уш.с), 3,07 (1,7H, с), 3,45-3,70 (3,0H, уш.м), 7,48 (1,0H, уш.с), 7,66-7,71 (1,0H, м), 7,77-7,80 (1,0H, м), 8,12 (1,0H, д, J=21Гц), 8,24 (1,0H, дд, J=8 Гц, 1 Гц), 8,53-8,55 (1,0H, м), 10,72 (0,4H, уш.с), 10,85 (0,6H, уш.с).
Соединение (3-19)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 0,88-0,95 (3H, м), 1,48 (2H, ткв., J=8 Гц, 8 Гц), 3,22-3,83 (5H, уш.м), 7,37-7,44 (3H, м), 7,56 (1H, д, J=2 Гц), 7,61 (1H, с), 7,86 (1H, дд, J=8 Гц, 2 Гц), 8,46 (1H, дд, J=5 Гц, 2 Гц), 9,77 (0,3H, с), 9,98 (0,7H, с).
Соединение (3-20)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 0,79-1,00 (3,0H, м), 2,88 (2,2H, д, J=12 Гц), 3,01-3,08 (1,0H, м), 3,12 (0,8H, с), 3,15-3,22 (1,0H, м), 3,45-3,69 (3,0H, м), 7,41-7,47 (2,0H, м), 7,60-7,64 (1,0H, м), 8,10-8,20 (2,0H, м), 8,49-8,52 (1,0H, м), 10,50 (0,3H, уш.с), 10,70 (0,7H, уш.с).
Соединение (3-21)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 0,86-0,91 (2,0H, м), 1,11-1,14 (1,0H, м), 2,75 (1,0H, с), 2,85-3,23 (4,0H, уш.м), 3,64-3,73 (3,0H, м), 7,41-7,46 (2,0H, м), 7,60-7,63 (1,0H, м), 8,07-8,19 (2,0H, м), 8,48-8,50 (1,0H, м), 10,48 (0,3H, уш.с), 10,67 (0,7H, уш.с).
Соединение (3-22)
1H-ЯМР (ДМСО-d6, TMC) δ (м.д.): 0,86-1,15 (6,0H, уш.м), 3,08-3,29 (3,0H, уш.м), 3,37-3,74 (4,0H, уш.м), 7,43-7,47 (2,0H, м), 7,61-7,65 (1,0H, м), 8,10-8,20 (2,0H, м), 8,49-8,51 (1,0H, м), 10,47 (0,3H, уш.с), 10,65-10,76 (0,7H, уш.м).
Соединение (3-23)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,06 (3H, т, J=7 Гц), 2,04 (3H, с), 3,56-3,78 (5H, м), 7,02 (1H, с), 7,06 (1H, с), 7,20-7,26 (1H, м), 7,38 (1H, дд, J=8, 5 Гц), 7,62 (1H, с), 7,86 (1H, дд, J=8 Гц, 2 Гц),8,44 (1H, дд, J=5 Гц, 2 Гц), 9,82 (1H, уш.с).
Соединение (3-25)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,04 (3H, т, J=7Гц), 3,45-3,90 (5H, м), 7,23 (1H, с), 7,40 (1H, дд, J=8 Гц, 5 Гц), 7,45 (1H, д, J=2 Гц), 7,54 (1H, с), 7,60 (1H, д, J=2 Гц), 7,87 (1H, дд, J=8 Гц, 2 Гц), 8,46 (1H, дд, J=5 Гц, 2 Гц), 9,67 (1H, уш.с).
Соединение (3-26)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,05 (3H, т, J=7 Гц), 3,43-3,69 (5H, м), 7,19-7,22 (3H, м), 7,40 (1H, дд, J=8 Гц, 5 Гц), 7,53 (1H, с), 7,87 (1H, д, J=8 Гц), 8,46 (1H, д, J=5 Гц), 9,82 (1H, уш.с).
Соединение (3-27)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,06 (3H, т, J=7Гц), 2,04 (3H, с), 3,45-3,95 (5H, м), 7,02 (1H, с), 7,06 (1H, с), 7,17 (1H, с), 7,38 (1H, дд, J=8 Гц, 5 Гц), 7,63 (1H, с), 7,86 (1H, дд, J=8 Гц, 2 Гц), 8,44 (1H, дд, J=5 Гц, 2 Гц), 9,83 (1H, уш.с).
Соединение (3-29)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,04 (3H, т, J=7 Гц), 3,41-3,83 (5H, м), 7,42-7,45 (2H, м), 7,55-7,58 (2H, м), 7,70 (1H, с), 7,89 (1H, дд, J=8 Гц, 2 Гц), 8,48 (1H, дд, J=5 Гц, 2 Гц), 10,20 (1H, уш.с).
Соединение (3-30)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,05 (3H, т, J=7 Гц), 3,45-3,95 (5H, м), 7,35 (1H, с),7,39 (1H, дд, J=8 Гц, 5 Гц),7,43 (1H, д, J=2 Гц), 7,55-7,59 (2H, м),7,86 (1H, дд, J=8 Гц, 2 Гц),8,46 (1H, дд, J=5 Гц, 2 Гц), 9,86 (1H, уш.с).
Соединение (3-31)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 1,05 (3H, т, J=7 Гц), 1,99 (3H, с), 3,45-3,95 (5H, м), 6,97 (1H, с), 7,04 (1H, с), 7,42 (1H, дд, J=8 Гц, 5 Гц), 7,65 (1H, с), 7,67 (1H, с), 7,88 (1H, д, J=8 Гц), 8,46(1H, д, J=5 Гц), 10,27 (1H, уш.с).
Соединение (3-33)
1H-ЯМР (CDCl3, TMC) δ (м.д.): 3,18 (3H, с), 3,60-3,85 (3H, м), 7,42-7,46 (2H, м), 7,55-7,58 (2H, м), 7,72 (1H, с), 7,90 (1H, дд, J=8 Гц, 2 Гц), 8,49 (1H, дд, J=5 Гц, 2 Гц), 10,14 (1H, уш.с).
Далее в виде стандартных примеров получения будут описаны примеры получения соединения (1) и соединения (2).
Пример 1 стандартного получения
(1) К смеси 1,85 г метилкарбазата и 60 мл тетрагидрофурана при охлаждении льдом прибавляли 6,0 г 6,8-дибром-2Н-3,1-бензоксазин-2,4-1Н-диона:
[Химическая формула 21]
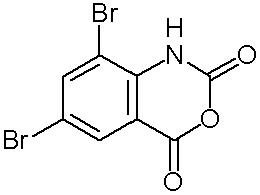
(соединение описано в Journal of Organic Chemistry (1947), 12, 743-51) с последующим перемешиванием в течение 3 часов при охлаждении льдом. Реакционную смесь нагревали до комнатной температуры и добавляли к ней еще 0,46 г метилкарбазата. Смесь перемешивали при комнатной температуре в течение 15 часов, а затем концентрировали при пониженном давлении. В полученный остаток вливали воду. Оставшийся осадок отфильтровывали. Данный осадок последовательно промывали водой и этилацетатом, получая 4,96 г N-(2-амино-3,5-дибромбензоил)-N'-метоксикарбонилгидразина.
N-(2-амино-3,5-дибромбензоил)-N'-метоксикарбонилгидразин
1H-ЯМР (ДМСО-d6) δ: 3,63 (3H, с), 6,55 (2H, с), 7,71 (1H, с), 7,79 (1H, с), 9,25 (1H, с), 10,32 (1H, с).
(2) К смеси 3,67 г N-(2-амино-3,5-дибромбензоил)-N'-метоксикарбонилгидразина, 3,04 г карбоната калия и 50 мл N-метилпирролидона прибавляли по каплям смесь 3,12 г йодистого метила и 2 мл 1-метил-2-пирролидинона при охлаждении льдом, после чего перемешивали при охлаждении льдом в течение 4 часов, а затем перемешивали при комнатной температуре в течение 3 часов. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 2,83 г соединения (1-1).
Соединение (1-1)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,11-3,18 (6H, м), 3,76 (3H, уш.с), 4,86 (1,4H, уш.с), 5,23 (0,6H, уш.с), 7,17-7,25 (1H, м), 7,57 (1H, д, J=2 Гц).
Пример 2 стандартного получения
(1) К смеси 0,61 г этилгидразиноксалата, 1,0 г 6,8-дибром-2Н-3,1-бензоксазин-2,4-1Н-диона и 10 мл тетрагидрофурана прибавляли при охлаждении льдом 1,12 г карбоната калия, после чего перемешивали при комнатной температуре в течение 1,5 часов. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,44 г N-(2-амино-3,5-дибромбензоил)-N-этилгидразина и 0,13 г N-(2-амино-3,5-дибромбензоил)-N'-этилгидразина.
N-(2-амино-3,5-дибромбензоил)-N-этилгидразин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 1,25 (3H, т, J=7 Гц), 3,52 (2H, кВ., J=7 Гц), 4,38 (2H, уш.с), 4,81 (2H, уш.с), 7,21 (1H, д, J=2 Гц), 7,59 (1H, д, J=2 Гц).
N-(2-амино-3,5-дибромбензоил)-N'-этилгидразин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 1,15 (3H, т, J=7 Гц), 2,95 (2H, кв., J=7 Гц), 4,78 (1H, уш.с), 6,02 (2H, уш.с), 7,38 (1H, д, J=2 Гц), 7,52 (1H, уш.с), 7,64 (1H, д, J=2 Гц).
(2) К смеси 0,42 г N-(2-амино-3,5-дибромбензоил)-N-этилгидразина и 3 мл пиридина прибавляли при охлаждении льдом 0,15 г метилхлорформиата, после чего перемешивали при охлаждении льдом в течение 1 часа. В реакционную смесь вливали воду, затем концентрировали при пониженном давлении. В полученный остаток вливали воду, после чего экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,42 г соединения (1-2).
Соединение (1-2)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 1,21 (3H, т, J=7 Гц), 3,62 (2H, кв., J=7 Гц), 3,78 (3H, с), 4,95 (2H, уш.с), 6,96 (1H, уш.с), 7,26 (1H, д, J=2 Гц), 7,59 (1H, д, J=2 Гц).
Пример 3 стандартного получения
(1) К смеси 10,0 г 6,8-дибром-2Н-3,1-бензоксазин-2,4-1Н-диона и 90 мл тетрагидрофурана прибавляли при охлаждении льдом 1,58 г метилгидразина, после чего перемешивали при комнатной температуре в течение 4 часов. В реакционную смесь вливали воду, после чего проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 4,64 г N-(2-амино-3,5-дибромбензоил)-N-метилгидразина и 0,75 г N-(2-амино-3,5-дибромбензоил)-N'-метилгидразина.
N-(2-амино-3,5-дибромбензоил)-N-метилгидразин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,25 (3H, с), 4,55 (2H, уш.с), 4,89 (2H, уш.с), 7,23 (1H, с), 7,59 (1H, с).
N-(2-амино-3,5-дибромбензоил)-N'-метилгидразин
1H-ЯМР (DMSO-d6, ТМС) δ (м.д.): 2,51 (3H, с), 5,11 (1H, уш.с), 6,54 (2H, с), 7,63 (1H, д, J=2 Гц), 7,73 (1H, д, J=2 Гц), 10,06 (1H, уш.с).
(2) К смеси 3,40 г N-(2-амино-3,5-дибромбензоил)-N-метилгидразина и 30 мл тетрагидрофурана последовательно прибавляли 2,2 г триэтиламина и 2,0 г метилхлорформиата, затем перемешивали при комнатной температуре. В реакционную смесь вливали воду, после чего проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 1,10 г соединения (1-4).
Соединение (1-4)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,28 (3H, с), 3,76 (3H, с), 4,96 (2H, уш.с), 7,00 (1H, уш.с), 7,27 (1H, д, J=2 Гц), 7,59 (1H, д, J=2 Гц).
Пример 4 стандартного получения
(1) Смесь 10,7 г 3-бром-1Н-пиразола, 11,8 2,3-дихлорпиридина, 57,3 г карбоната цезия и 80 мл N,N-диметилформамида перемешивали при 100°С в течение 8 часов. После охлаждения реакционной смеси до комнатной температуры в реакционную смесь вливали воду. Реакционную смесь дважды экстрагировали метилтретбутиловым эфиром. Органические слои объединяли, последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 12,9 г 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина.
2-(3-Бром-1Н-пиразол-1-ил)-3-хлорпиридин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 6,51 (1H, д, J=2 Гц), 7,31 (1H, дд, J=8 Гц, 4 Гц), 7,91 (1H, дд, J=8 Гц, 1 Гц), 8,04 (1H, д, J=2 Гц), 8,45 (1H, дд, J=4 Гц, 1 Гц).
(2) К смеси 5,0 г 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина и 30 мл тетрагидрофурана прибавляли по каплям при -78°С 11,7 мл 2,0 М раствора диизопропиламида лития в смеси гептан/тетрагидрофуран/этилбензол. К реакционной смеси прибавляли по каплям при -78°С смесь 3 г этилформиата и 10 мл тетрагидрофурана, после чего перемешивали при комнатной температуре в течение 2 часов. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 3,0 г соединения (2-1).
Соединение (2-1)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,11 (1H, с), 7,47 (1H, дд, J=8 Гц, 5 Гц), 7,96 (1H, дд, J=8 Гц, 1 Гц), 8,52 (1H, дд, J=5 Гц, 1 Гц), 9,79 (1H, с).
Пример 5 стандартного получения
(1) Для получения 3-хлор-2-(3-трифторметил-1Н-пиразол-1-ил)-пиридина вместо 3-бром-1Н-пиразола из примера стандартного получения 4(1) использовали 3-трифторметил-1Н-пиразол.
3-Хлор-2-(3-трифторметил-1Н-пиразол-1-ил)пиридин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 6,75 (1H, д, J=2 Гц), 7,37 (1H, дд, J=8 Гц, 4 Гц), 7,95 (1H, дд, J=8 Гц, 1 Гц), 8,14 (1H, д, J=1 Гц), 8,49 (1H, дд, J=4 Гц, 1 Гц).
(2) Для получения соединения (2-2) вместо 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина из примера стандартного получения 4(2) использовали 3-хлор-2-(3-трифторметил-1Н-пиразол-1-ил)пиридин.
[Химическая формула 22]
Соединение (2-2)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,36 (1H, с), 7,51 (1H, дд, J=8 Гц, 5 Гц), 7,99 (1H, дд, J=8 Гц, 2 Гц), 8,54 (1H, дд, J=5 Гц, 2 Гц), 9,86 (1H, с).
Пример 6 стандартного получения
(1) Для получения 2-(3-хлор-1Н-пиразол-1-ил)-3-хлорпиридина вместо 3-бром-1Н-пиразола из примера стандартного получения 4(1) использовали 3-хлор-1Н-пиразол.
2-(3-Хлор-1Н-пиразол-1-ил)-3-хлорпиридин
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 6,43 (1H, д, J=3 Гц), 7,30 (1H, дд, J=8 Гц, 5 Гц), 7,91 (1H, дд, J=8 Гц, 2 Гц), 8,09 (1H, д, J=2 Гц), 8,44 (1H, дд, J=5 Гц, 1 Гц).
(2) Для получения соединения (2-3) вместо 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина из примера стандартного получения 4(2) использовали 2-(3-хлор-1Н-пиразол-1-ил)-3-хлорпиридин.
Соединение (2-3)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,02 (1H, с), 7,47 (1H, дд, J=8 Гц, 5 Гц), 7,97 (1H, дд, J=8 Гц, 2 Гц), 8,51 (1H, дд, J=5 Гц, 2 Гц), 9,79 (1H, с).
Пример 7 стандартного получения
(1) К смеси 10 г метилкарбазата и 60 мл толуола прибавляли по каплям смесь 5,86 г ацетальдегида и 20 мл толуола при 50°С, после чего перемешивали в течение 1 часа. Реакционную смесь охлаждали льдом и отфильтровывали выпавший осадок. Осадок сушили, получая 12,1 г метил N'-этилиденгидразинкарбоксилата.
Метил N'-этилиденгидразинкарбоксилат
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 1,99 (3H, д, J=5 Гц), 3,82 (3H, с), 7,24 (1H, кв., J=5 Гц), 8,31 (1H, уш.с).
(2) К смеси 5,0 г метил N'-этилиденгидразинкарбоксилата и 50 мл тетрагидрофурана последовательно прибавляли при 50°С 1,95 г боргидрида натрия и 4,2 мл метанола, после чего перемешивали при 50°С в течение 3 часов. После прибавления 50 мл метанола при 50°С реакционную смесь перемешивали и нагревали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и добавляли 20 мл хлороформа, затем перемешивали при 50°С в течение 10 минут и потом фильтровали через целит. Полученный фильтрат концентрировали при пониженном давлении, и остаток подвергали колоночной хроматографии на силикагеле, получая 3,70 г метил N'-этилгидразинкарбоксилата.
Метил N'-этилгидразинкарбоксилат
1H-ЯМР (ДМСО-D6, ТМС) δ (м.д.): 0,93 (3H, т, J=7 Гц), 2,66-2,73 (2H, м), 3,54 (3H, с), 4,38-4,43 (1H, м), 8,45 (1H, с).
(3) К смеси 0,50 г метил N'-этилгидразинкарбоксилата и 4 мл тетрагидрофурана прибавляли 1,36 г 6,8-дибром-2Н-3,1-бензоксазин-2,4-1Н-диона при комнатной температуре и перемешивали и нагревали при кипячении с обратным холодильником данную смесь в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,89 г соединения (1-2).
Пример 8 стандартного получения
(1) Смесь 1,16 г 4-метоксикротоновой кислоты (соединение, описанное в Journal of Organic Chemistry, 1981, 46, 940-948) и 10 мл диэтилового эфира охлаждали льдом и пропускали в нее газообразный хлористый водород. После насыщения смеси газообразным хлористым водородом ее оставляли стоять при комнатной температуре в течение ночи. Образец, взятый из реакционной смеси, подвергали анализу методом ЯМР, и подтверждали получение 3-хлор-4-метоксимасляной кислоты. Весь объем полученной реакционной смеси использовали как она есть на следующей стадии.
3-Хлор-4-метоксимасляная кислота
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 2,76 (1H, дд, J=17 Гц, 9 Гц), 3,00 (1H, дд, J=17 Гц, 5 Гц), 3,42 (3H, с), 3,56 (1H, дд, J=10 Гц, 7 Гц), 3,65 (1H, дд, J=10 Гц, 5 Гц), 4,36-4,42 (1H, м).
(2) К реакционной смеси, полученной в упомянутом выше (1), прибавляли по каплям при охлаждения льдом 2,54 г оксалилдихлорида. К реакционной смеси добавляли каплю N,N-диметилформамида, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, получая 1,45 г 3-хлор-4-метоксибутирилхлорида.
3-Хлор-4-метоксибутирилхлорид
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,26 (1H, дд, J=18 Гц, 9 Гц), 3,41 (3H, с), 3,49-3,54 (2H, м), 3,66 (1H, дд, J=10 Гц, 5 Гц), 4,35-4,41 (1H, м).
(3) К 1,29 г 3-хлор-2-гидразинпиридина, 1,07 г пиридина и 10 мл N,N-диметилформамида прибавляли по каплям при охлаждении льдом смесь 1,45 г 3-хлор-4-метоксибутирилхлорида и 5 мл толуола, после чего перемешивали при комнатной температуре в течение 2 часов. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 1,86 г соединения (22-1).
Соединение (22-1):
[Химическая формула 23]
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 2,73 (1H, дд, J=15, 8 Гц), 2,93 (1H, дд, J=15 Гц, 5 Гц), 3,43 (3H, с), 3,63 (1H, дд, J=10 Гц, 6 Гц), 3,71 (1H, дд, J=10 Гц, 5 Гц), 4,47-4,54 (1H, м), 6,78 (1H, дд, J=8 Гц, 5 Гц), 7,35 (1H, уш.с), 7,56 (1H, дд, J=8 Гц, 1 Гц), 8,07 (1H, дд, J=5 Гц, 1 Гц), 8,66 (1H, уш.с).
(4) Смешанный раствор 4,5 г гидрокарбоната натрия и 300 мл N,N-диметилформамида нагревали до 130°С. К нему прибавляли по каплям в течение 1 часа смешанный раствор 7,48 г соединения (22-1) и 100 мл N,N-диметилформамида. Смесь перемешивали при 130°С в течение 1 часа. После охлаждения в реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Выпавшие кристаллы промывали небольшим количеством этилацетата, получая 2,02 г соединения (25-1).
Соединение (25-1):
[Химическая формула 24]
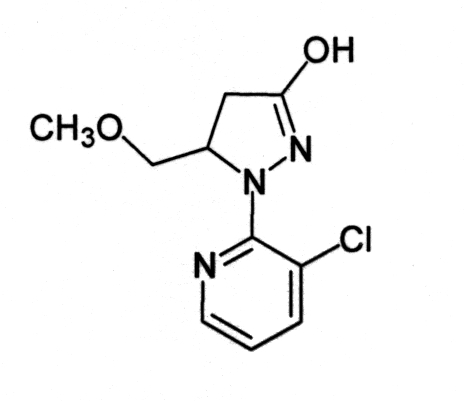
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 2,46 (1H, дд, J=17 Гц, 1 Гц), 2,77 (1H, дд, J=17 Гц, 8 Гц), 3,41 (3H, с), 3,63 (1H, дд, J=10 Гц, 8 Гц), 3,82 (1H, дд, J=10 Гц, 5 Гц), 4,59-4,67 (1H, м), 7,02 (1H, дд, J=8 Гц, 5 Гц), 7,60 (1H, с), 7,68 (1H, дд, J=8 Гц, 2 Гц), 8,20 (1H, дд, J=5 Гц, 2 Гц).
(5) К смешанному раствору 4,2 г соединения (25-1), 20 мл ацетонитрила и капли N,N-диметилформамида прибавляли при комнатной температуре 6 г бромокиси фосфора, после чего нагревали при кипячении с обратным холодильником в течение 1 часа. После охлаждения реакционную смесь выливали в ледяную воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 2,2 г соединения (26-1).
Соединение (26-1):
[Химическая формула 25]
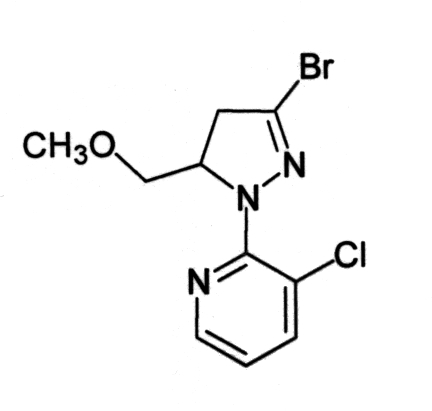
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,23 (2H, дд, J=10 Гц, 3 Гц), 3,34 (3H, с), 3,48 (1H, дд, J=10 Гц, 6 Гц), 3,66 (1H, дд, J=10 Гц, 4 Гц), 5,01-5,13 (1H, м), 6,91 (1H, дд, J=8 Гц, 5 Гц), 7,66 (1H, дд, J=8 Гц, 2 Гц), 8,17 (1H, дд, J=5 Гц, 2 Гц).
(6) Смешанный раствор 0,10 г соединения (26-1), 3 мл ацетонитрила, сульфата меди (каталитическое количество) и капли концентрированной серной кислоты нагревали до 80°С. Прибавляли к нему по каплям в течение 2 часов смешанный раствор 0,14 г персульфата калия и 4 мл воды, после чего перемешивали при 80°С в течение 10 минут. После охлаждения в реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,06 г соединения (17-1).
Соединение (17-1):
[Химическая формула 26]
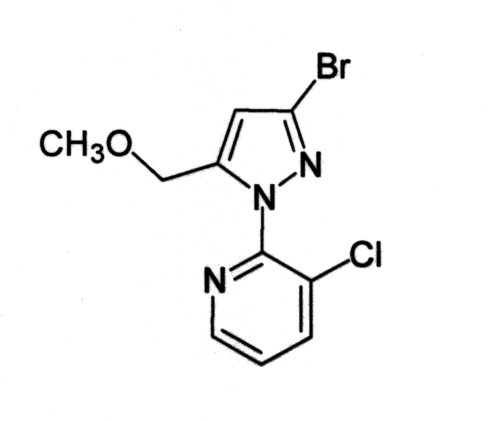
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,23 (3H, с), 4,50 (2H, с), 6,47 (1H, с), 7,39 (1H, дд, J=8 Гц, 5 Гц), 7,93 (1H, дд, J=8 Гц, 2 Гц), 8,47 (1H, дд, J=5 Гц, 2 Гц).
(7) Смесь 0,30 г соединения (17-1), 0,49 г персульфата калия, 1 мл ацетонитрила и 1 мл воды перемешивали при 90°С в течение 12 часов. После охлаждения в реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,16 г соединения (2-1).
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,11 (1H, с), 7,47 (1H, дд, J=8 Гц, 5 Гц), 7,96 (1H, дд, J=8 Гц, 1 Гц), 8,52 (1H, дд, J=5 Гц, 1 Гц), 9,79 (1H, с).
Пример 9 стандартного получения
(1) При охлаждении льдом смешивали 4 г 4-метоксикротоновой кислоты и каплю N,N-диметилформамида и прибавляли по каплям 16,5 г оксалилхлорида, после чего перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, получая сырой продукт. Все количество этого сырого продукта использовали на следующей стадии как он есть.
4-Метоксикротоноилхлорид:
[Химическая формула 27]
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,43 (3H, с), 4,18 (2H, дд, J=4 Гц, 2 Гц), 6,34 (1H, дт, J=15 Гц, 2 Гц), 7,19 (1H, дт, J=15 Гц, 4 Гц).
(2) Сырой продукт, полученный в описанном выше (1), 50 мл N,N-диметилформамида и 10 г пиридина перемешивали при комнатной температуре. Прибавляли туда 4,5 г 3-хлор-2-гидразинпиридина. Смесь перемешивали в течение 1 часа, и затем оставляли стоять в течение ночи при комнатной температуре. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида аммония, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Выпавшие сырые кристаллы промывали небольшим количеством этилацетата, получая 2,3 г соединения (24-1).
Соединение (24-1):
[Химическая формула 28]

1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,41 (3H, с), 4,10-4,15 (2H, м), 6,21 (1H, дт, J=15 Гц, 2 Гц), 6,76 (1H, дд, J=8 Гц, 5 Гц), 6,98 (1H, дт, J=15 Гц, 4 Гц), 7,48-7,60 (2H, м), 8,07 (1H, дд, J=5 Гц, 1 Гц), 8,45 (1H, уш.с).
(3) Смесь 8,0 г соединения (24-1) и 24,0 г ацетонитрила охлаждали на водяной бане и пропускали при перемешивании газообразный хлористый водород. После перемешивания при одновременном пропускании газообразного хлористого водорода примерно в течение 3 часов реакционную смесь концентрировали при пониженном давлении. В полученный остаток вливали насыщенный раствор бикарбоната натрия, после чего проводили экстракцию этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 8,97 г соединения (22-1).
Пример 10 стандартного получения
(1) К смеси 0,48 г соединения (25-1) и 10 мл ацетонитрила последовательно прибавляли при охлаждении льдом 0,25 г метансульфонилхлорида и 0,30 г триэтиламина, после чего перемешивали при 0°С в течение 1 часа. В реакционную смесь вливали воду, затем экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,32 г соединения (27-1).
Соединение (N-1):
[Химическая формула 29]
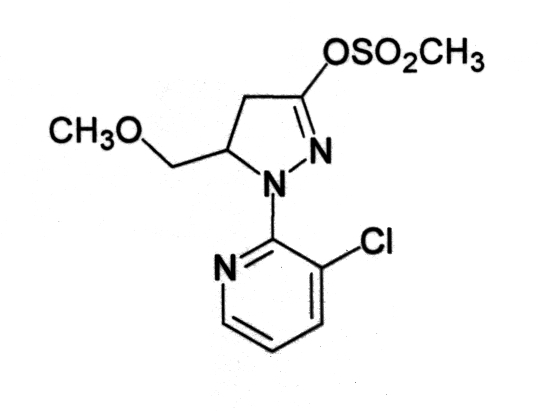
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,14 (2H, д, J=10 Гц), 3,36 (3H, с), 3,47 (3H, с), 3,55 (1H, дд, J=10 Гц, 6 Гц), 3,66-3,74 (1H, м), 5,10-5,21 (1H, м), 6,87 (1H, дд, J=8 Гц, 5 Гц), 7,64 (1H, дт, J=8 Гц, 1 Гц), 8,14 (1H, дт, J=5 Гц, 1 Гц).
(2) Смесь 0,53 г соединения (27-1) и 1,2 г 33 мас.% раствора бромистый водород-уксусная кислота перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в ледяную воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором гидрокарбоната натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле, получая 0,30 г соединения (26-1).
Далее перечислены конкретные примеры соединения (1).
[Химическая формула 30]
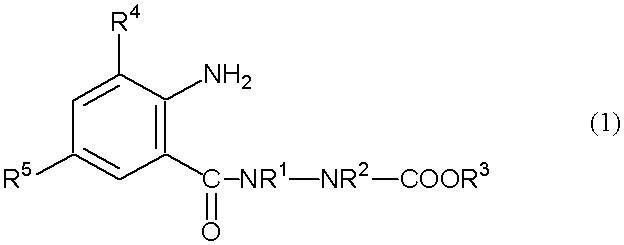
Приведены физические свойства некоторых из соединений (1).
Соединение (1-1)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,11-3,18 (6H, м), 3.76 (3H, уш.с), 4,86 (1,4H, уш.с), 5,23 (0,6H, уш.с), 7,17-7,25 (1H, м), 7,57 (1H, д, J=2 Гц).
Соединение (1-2)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 1,21 (3H, т, J=7 Гц), 3,62 (2H, кв., J=7 Гц), 3,78 (3H, с), 4,95 (2H, уш.с), 6,96 (1H, уш.с), 7,26 (1H, д, J=2 Гц), 7,59 (1H, д, J=2 Гц).
Соединение (1-4)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,28 (3H, с), 3,76 (3H, с), 4,96 (2H, уш.с), 7,00 (1H, уш.с), 7,27 (1H, д, J=2 Гц), 7,59 (1H, д, J=2 Гц).
Соединение (1-15)
1H-ЯМР (ДМСО-d6, 100°C, ТМС) δ (м.д.): 1,09 (3H, т, J=7 Гц), 3,12 (3H, с), 3,40-3,52 (2H, м), 3,70 (3H, с), 5,23 (2H, уш.с), 7,20 (1H, д, J=2 Гц), 7,62 (1H, д, J=2 Гц).
Соединение (1-16)
1H-ЯМР (ДМСО-d6, 100°C, ТМС) δ (м.д.): 1,15 (3H, т, J=7 Гц), 3,07 (3H, с), 3,45-3,60 (2H, м), 3,67 (3H, с), 5,19 (2H, уш.с), 7,20 (1H, д, J=2 Гц), 7,61 (1H, д, J=2 Гц).
Соединение (1-17)
1H-ЯМР (ДМСО-d6, 100°C, ТМС) δ (м.д.): 1,09-1,17 (6H, м), 3,40-3,55 (4H, м), 3,69 (3H, с), 5,19 (2H, уш.с), 7,22 (1H, д, J=2 Гц), 7,62 (1H, д, J=2 Гц).
Далее перечислены конкретные примеры соединения (2).
[Химическая формула 31]
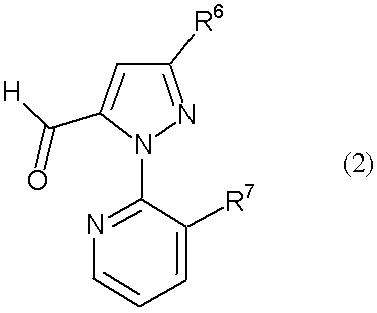
Приведены физические свойства некоторых соединений (2).
Соединение (2-1)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,11 (1H, с), 7,47 (1H, дд, J=8 Гц, 5 Гц), 7,96 (1H, дд, J=8 Гц, 1 Гц), 8,52 (1H, дд, J=5 Гц, 1 Гц), 9,79 (1H, с).
Соединение (2-2)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,36 (1H, с), 7,51 (1H, дд, J=8 Гц, 5 Гц), 7,99 (1H, дд, J=8 Гц, 2 Гц), 8,54 (1H, дд, J=5 Гц, 2 Гц), 9,86 (1H, с).
Соединение (2-3)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 7,02 (1H, с), 7,47 (1H, дд, J=8 Гц, 5 Гц), 7,97 (1H, дд, J=8 Гц, 2 Гц), 8,51 (1H, дд, J=5 Гц, 2 Гц), 9,79 (1H, с).
Далее перечислены конкретные примеры соединения (17).
[Химическая формула 32]
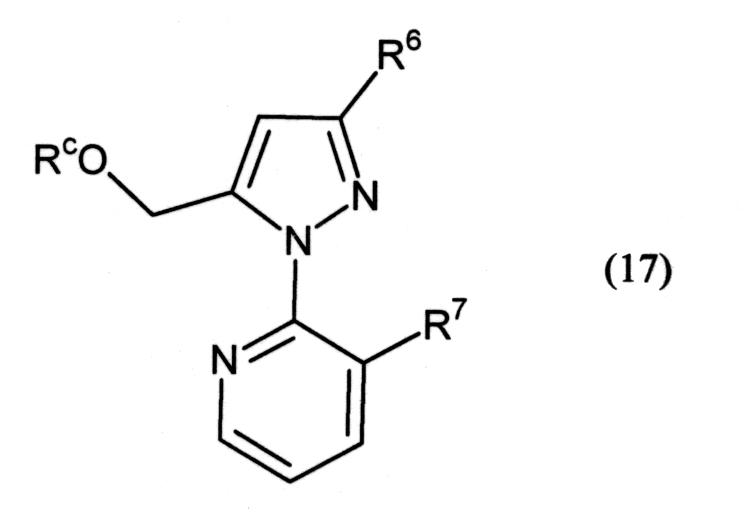
Приведены физические свойства некоторых соединений (17).
Соединение (17-1)
1H-ЯМР (CDCl3, ТМС) δ (м.д.): 3,23 (3H, с), 4,50 (2H, с), 6,47 (1H, с), 7,39 (1H, дд, J=8 Гц, 5 Гц), 7,93 (1H, дд, J=8 Гц, 2 Гц), 8,47 (1H, дд, J=5 Гц, 2 Гц).
Далее, в виде примера стандартного состава будут описаны примеры состава на основе соединения (3), используемого в качестве агента для борьбы с вредными членистоногими. Термин «часть(и)» означает массовую часть(и).
Пример стандартного состава 1
Смесь 10 частей любого из соединений от (3-1) до (3-43), 35 частей белого угля, содержащего 50 частей аммониевой соли сульфата полиоксиэтиленалкилового эфира, и 55 частей воды мелко измельчают методом мокрого измельчения, получая 10% текучий состав.
В следующих стандартных тестовых примерах показано, что соединение (3) применимо в качестве активного ингредиента агента для борьбы с вредными членистоногими.
Стандартный тестовый пример 1
Составы соединений от (3-1) до (3-23), от (3-25) до (3-27), от (3-29) до (3-31) и (3-33), полученные в примере стандартного состава, разбавляли водой, так что концентрация активного ингредиента составляла 50 ч./млн, для получения тестовых растворов для распыления.
Одновременно в полиэтиленовый стакан высаживали капусту и выращивали до появления третьего истинного листа или четвертого истинного листа. На капусту распыляли тестовый раствор для распыления в количестве 20 мл/стакан. После высыхания раствора препарата на капусте на капусту помещали 10 личинок капустной моли (Plutella xylostella) третьей возрастной стадии. Через 5 дней производили подсчет капустной моли и вычисляли контрольное значение по следующему уравнению:
Контрольное значение (%)={1-(Cb×Tai)/(Cai×Tb)}×100,
где Cb: число гусениц на необработанном участке до обработки
Cai: число гусениц на необработанном участке при наблюдении
Tb: число гусениц на обработанном участке до обработки
Tai: число гусениц на обработанном участке при наблюдении
В результате, каждый из тестовых растворов для распыления на основе соединений от (3-1) до (3-23), от (3-25) до (3-27), от (3-29) до (3-31) и (3-33) проявлял контрольное значение, составляющее 80% или более.
Стандартный тестовый пример 2
Составы соединений от (3-1) до (3-23), от (3-25) до (3-27), от (3-29) до (3-31) и (3-33), полученные в примере стандартного состава, разбавляли водой, так что концентрация активного ингредиента составляла 500 ч./млн, для получения тестовых растворов для распыления.
Одновременно в полиэтиленовый стакан высаживали огурцы и выращивали до появления первого истинного листа. На огурцы помещали около 30 личинок хлопковой тли (Aphis gossypii). Через день на огурцы распыляли тестовый раствор для распыления в количестве 20 мл/стакан. Через шесть дней после распыления производили подсчет хлопковой тли и вычисляли контрольное значение по следующему уравнению:
Контрольное значение (%)={1-(Cb×Tai)/(Cai×Tb)}×100,
где Cb: число насекомых на необработанном участке до обработки
Cai: число насекомых на необработанном участке при наблюдении
Tb: число насекомых на обработанном участке до обработки
Tai: число насекомых на обработанном участке при наблюдении
В результате каждый из тестовых растворов для распыления на основе соединений от (3-1) до (3-23), от (3-25) до (3-27), от (3-29) до (3-31) и (3-33) проявлял контрольное значение, составляющее 90% или более.
Промышленная применимость
В соответствии со способом настоящего изобретения можно получать новое соединение (3), обладающее превосходной регулирующей активностью в отношении вредных членистоногих.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АМИДНОГО СОЕДИНЕНИЯ | 2008 |
|
RU2459820C2 |
| СОЕДИНЕНИЕ ПИРИДАЗИНА И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2416609C2 |
| N,N-ЗАМЕЩЕННЫЕ 3-АМИНОПИРРОЛИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОВТОРНОГО ПОГЛОЩЕНИЯ МОНОАМИНОВ | 2006 |
|
RU2574406C2 |
| БИОЛОГИЧЕСКИ ДОСТУПНАЯ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ КОФЕЙНАЯ КИСЛОТА, ОТНОСЯЩАЯСЯ К ПРОТИВООПУХОЛЕВЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВАМ | 2007 |
|
RU2456265C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНИЛПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2012 |
|
RU2621732C2 |
| 2-ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2331638C2 |
| СЕРАОРГАНИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ РЕГУЛЯЦИИ ЧИСЛЕННОСТИ ВРЕДНЫХ ЧЛЕНИСТОНОГИХ | 2008 |
|
RU2469022C2 |
| 3-ГАЛОГЕН-6-(АРИЛ)-ИМИНОТЕТРАГИДРОПИКОЛИНАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2010 |
|
RU2527954C2 |
| ОРГАНИЧЕСКОЕ СОЕДИНЕНИЕ СЕРЫ И ЕГО ПРИМЕНЕНИЕ ДЛЯ БОРЬБЫ С ВРЕДНЫМИ ЧЛЕНИСТОНОГИМИ | 2008 |
|
RU2468006C2 |
| 14,17-C-МОСТИКОВЫЕ СТЕРОИДЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1995 |
|
RU2169153C2 |
Изобретение относится к способу получения амидного соединения, представленного приведенной ниже формулой (3). Предложенный способ заключается в том, что анилиновое соединение, представленное приведенной ниже формулой (1), и соединение альдегида, представленное приведенной ниже формулой (2), вводят во взаимодействие в растворителе в присутствии окислителя, такого как кислород, пероксид, хромовая кислота или ее соль. В приведенных ниже формулах R1, R2, R3, R4, R5, R6 и R7 имеют определения, приведенные в формуле изобретения. В частности, R1, R2 и R3 независимо представляют собой C1-С6 алкильную группу, которая может быть замещена атомом галогена или тому подобным; R4, R5, R6 и R7 независимо представляют собой атом галогена или тому подобное. Технический результат - предложенный способ позволяет получить соединения формулы (3), которые обладают превосходной регулирующей активностью в отношении вредных членистоногих. 2 з.п. ф-лы, 5 табл., 5 пр. получения соединений формулы (3), 10 стандартных примеров получения промежуточных соединений, 1 пр. состава и 2 пр. испытаний соединений.
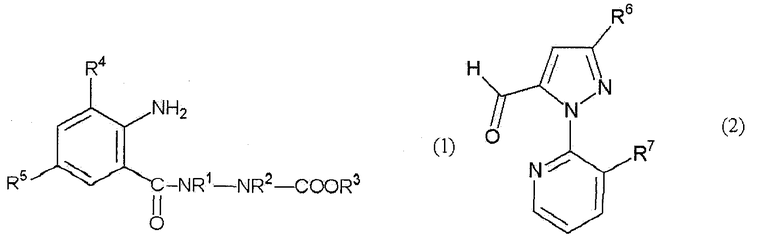
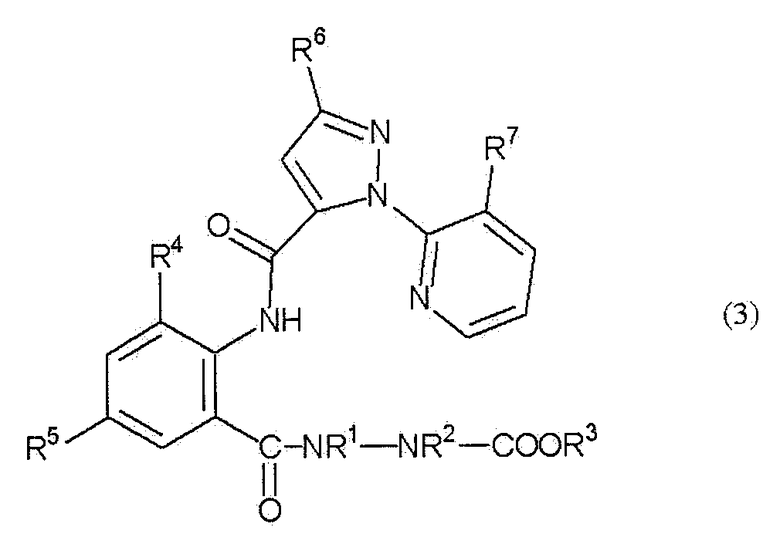
1. Способ получения амидного соединения, представленного формулой (3):
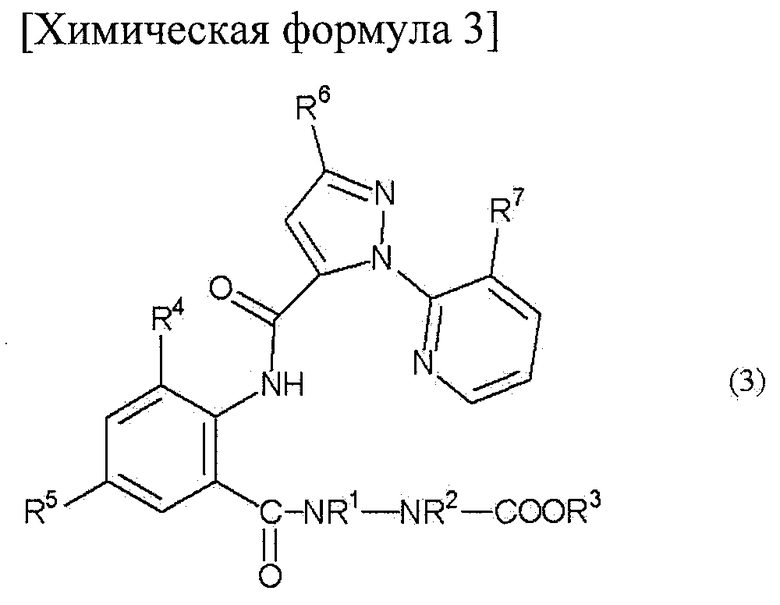
где R1, R2, R3, R4, R5, R6 и R7 определены ниже, включающий введение во взаимодействие анилинового соединения, представленного формулой (I):
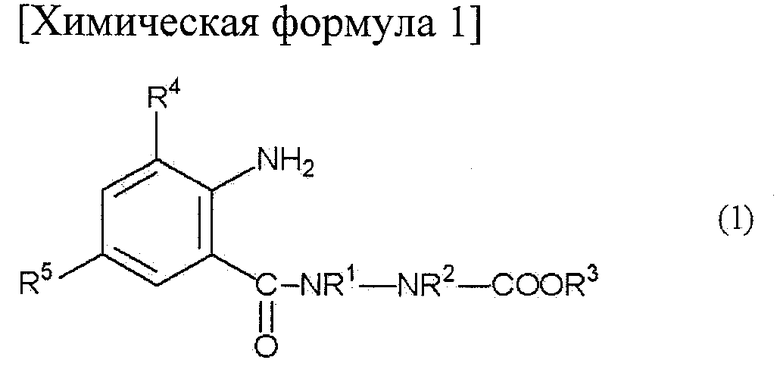
где R1 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена,
R2 представляет собой атом водорода или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена,
R3 представляет собой С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6 алкоксиалкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С3-С6 алкенильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С3-С6 алкинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена,
R4 представляет собой атом галогена или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и
R5 представляет собой атом водорода, атом галогена, цианогруппу или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, с соединением альдегида, представленным формулой (2):
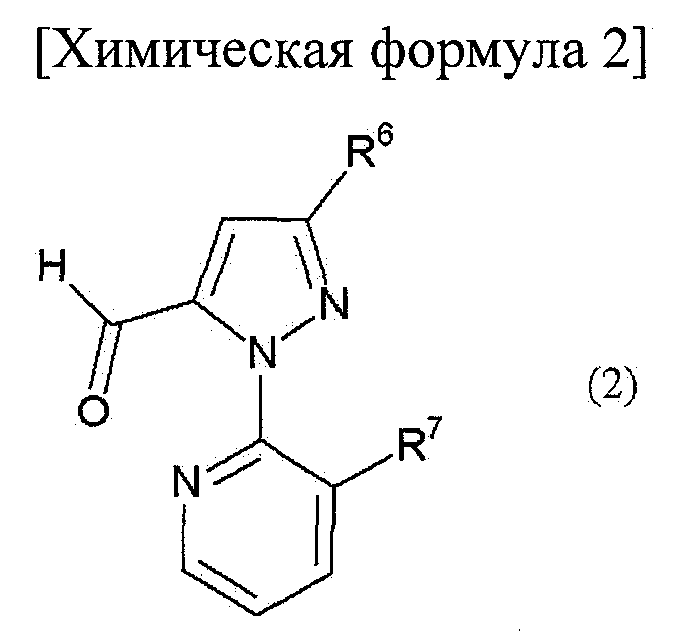
где R6 представляет собой атом водорода, атом галогена, цианогруппу, С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкоксигруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкилтиогруппу, необязательно замещенную, по меньшей мере, одним атомом галогена, С1-С6 алкилсульфинильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, или С1-С6 алкилсульфонильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, и
R7 представляет собой атом галогена, или С1-С6 алкильную группу, необязательно замещенную, по меньшей мере, одним атомом галогена, в
растворителе в присутствии окислителя, выбранного из следующей группы А: (а) кислород, (b) пероксид и (с) хромовая кислота или ее соль.
2. Способ по п.1, в котором окислитель представляет собой (а) кислород или (b) пероксид.
3. Способ по п.1, в котором (b) пероксид представляет собой пероксид карбоновой кислоты.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| АНТРАНИЛАМИДНОЕ СОЕДИНЕНИЕ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ, КОМПОЗИЦИЯ ДЛЯ БОРЬБЫ С БЕСПОЗВОНОЧНЫМИ ВРЕДИТЕЛЯМИ, СПОСОБЫ БОРЬБЫ С НАСЕКОМЫМИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2002 |
|
RU2283840C2 |
| ИНСЕКТИЦИДНЫЕ АНТРАНИЛАМИДЫ | 2001 |
|
RU2278852C2 |
| W-J.YOO, С.-J.LI "Highly Efficient Oxidative Amidation of Aldehydes with Amine Hydrochloride Salts", J | |||
| Am.Chem.Soc., 2006, 128 (40), p.13064, 13065. | |||
Авторы
Даты
2012-05-27—Публикация
2008-04-09—Подача