1. Область техники
Изобретение относится к способу получения моноклональных антител. В этом способе используются вакцинированные стерильные животные. В изобретении заявляется также использование указанных моноклональных антител и поликлональных антител, полученных от вакцинированных стерильных животных, для клинической диагностики в условиях in vitro и in vivo и в терапии. Целью изобретения является также фибрин-специфичное моноклональное антитело.
2. Предпосылки изобретения
Общепризнанно, что Kohler и Milstein разработали методику, которая с успехом привела к получению первой гибридомы, продуцирующей моноклональные антитела (G.Kohler and C. Mistein, 1975, Nature 256, 495-497; 1976, Eur. J. Immun. , 6, 511-519). Сливая клетки, продуцирующие антитела (B-лимфоциты селезенки), с миеломными клетками (злокачественными клетками первичных опухолей костного мозга), они получили линию гибридных клеток, возникающих из единственного слитого клеточного гибрида (называемого гибридомой или клоном). Гибридома унаследовала некоторые свойства как лимфоцитов, так и линий миеломных клеток. Как и лимфоциты, гибридома секретирует один тип иммуноглобулинов; более того, подобно миеломным клеткам, гибридома способна к неограниченному делению клеток. Сочетание этих двух свойств предоставляет несомненные преимущества перед обычными антисыворотками.
Антисыворотки, полученные от вакцинированных животных, представляют собой меняющиеся по составу смеси поликлональных антител, которые невозможно идентично воспроизвести. Моноклональные антитела являются высокоспецифичными иммуноглобулинами единственного типа. Один тип иммуноглобулинов, секретируемых гибридомой, является специфичным для одной и только одной антигенной детерминанты, или эпитопа, в антигене - сложной молекуле, включающей множество антигенных детерминант. Так, если антиген представляет собой белок, то антигенной детерминантой может быть одна из многих пептидных последовательностей (обычно длиной в 6-7 аминокислот; M.Z. Atassi. 1980. Molec. Cell. Biochem. 32, 21-43) в молекуле белка. Таким образом, моноклональные антитела, продуцированные против одного антигена, могут отличаться друг от друга в зависимости от детерминанты, которая инициирует их образование; однако для любой гибридомы все производимые ею антитела идентичны. Более того, клеточная линия гибридомы легко размножается в условиях in vitro и in vivo и позволяет получить антитела с чрезвычайно высокой концентрацией.
Моноклональные антитела могут использоваться в качестве зонда для обнаружения их антигена. Так моноклональные антитела использовали для диагностики в условиях in vitro, например в радиоиммунных анализах и ферментных иммуносорбентных анализах (ELISA), и для диагностики в условиях in vivo, например для визуализации в условиях in vivo с помощью содержащего метку моноклонального антитела. Моноклональное антитело может также использоваться в качестве носителя для доставки лекарства к подобному антигену антитела.
Однако прежде чем моноклональное антитело сможет быть использовано для указанных целей, необходимо чтобы моноклональное антитело могло бы связываться с представляющим интерес антигеном, т.е. антигеном-мишенью. Подобная процедура отбора может быть очень утомительной, поскольку может потребоваться отобрать множество, например предположительно несколько тысяч, моноклональных антител, прежде чем будет идентифицирована гибридома, продуцирующая антитело, способное связываться с антигеном-мишенью. Следовательно, необходимо разработать способ получения моноклональных антител, который превышает вероятность того, что гибридома продуцирует антитело для антигена-мишени.
3. Краткое описание изобретения
В настоящем изобретении заявляется способ получения моноклональных антител к антигену, включающий:
a) иммунизацию стерильного животного указанным антигеном с целью позволить продуцирующим антитело клеткам воспроизвести антитела к указанному антигену,
b) выделение по крайней мере части указанных продуцирующих антитело клеток из указанного стерильного животного,
c) получение гибридомы слиянием одной из указанных продуцирующих антитело клеток с иммортализующей клеткой, при этом указанная гибридома способна продуцировать моноклональное антитело к указанному антигену,
d) выращивание указанной гибридомы, и
e) выделение моноклональных антител, продуцированных указанной гибридомой.
В настоящем изобретении заявляются также способы использования моноклонального антитела и поликлонального антитела, полученного от стерильного животного. В настоящем изобретении заявляется также фибрин-специфичное моноклональное антитело и способы использования подобного моноклонального антитела.
Краткое описание чертежей
Фиг. 1(A) - определение иммунореактивности MH1 с фибриновым мономером DesAABB с помощью аффинной хроматографии.
Фиг. 1(B) - контрольный эксперимент для подтверждения связывающей способности матрицы фибринового мономера на сефарозе с использованием фибриноген-специфичного антитела 45J.
Фиг. 2 - иммунореактивность несшитых фибриновых полимеров DesAABB и сшитых фибриновых полимеров DesAABB в in vitro анализах для растворимых фибриновых полимеров DesAABB с использованием MH1.
Фиг. 3 - образование фибрина DesAA при обработке плазмы фибриногена батроксобином.
Фиг. 4 - иммунореактивность растворимых фибриновых полимеров DesAA в in vitro аналитической системе для растворимых фибриновых полимеров DesAABB с использованием MH1.
Фиг. 5 - иммунореактивность антитела MH1 с фибриногеном, обработанным активированным фактором XIII (фактором XIIIa).
Фиг. 6 - определение образования растворимого фибринового полимера DesAABB в условиях in virto с использованием анализа на растворимый фибрин MH1.
Фиг. 7 - демонстрация очистки растворимого фибрина из плазмы с использованием колонки сефароза-MH1.
Фиг. 8 - определение содержания растворимых фибриновых полимеров DesAABB в крови пациентов с болями в груди и установленным инфарктом миокарда.
4. Подробное описание изобретения
4.1. Стерильные животные
Настоящее изобретение относится к использованию стерильных животных для получения моноклональных антител. Стерильные животные были впервые получены в конце 19-го столетия и с тех пор интенсивно используются.
Стерильное животное является гнотобиотом, который свободен от связей со всеми возможными формами жизни, включая бактерии, вирусы, грибки, простейшие и другие формы сапрофитов и паразитов. Гнотобиот представляет собой животное или вид, полученный при асептическом кесаревом сечении или стерильном выведении яиц, которое выращивают и за которым постоянно наблюдают, используя стерильные методы в условиях изолятора, и у которого состав любой связанной с ним фауны и флоры, если она есть, полностью определяется действующей методологией. (Следует отметить, что все мыши содержат латентный лейкемогенный вирус, а потому мышь, которая безмикробна за исключением этого лейкемогенного вируса, следует рассматривать как стерильное животное для целей настоящего изобретения).
Суть безмикробной системы заключается в создании барьера по отношению к проникновению нежелательных микробных оккупантов. Помимо физического барьера из пластмассы, металла, резины и стекла, за который помещается животное, система требует операционных барьеров для фильтрации воздуха, стерилизации пищи и воды, манипуляции с помощью перчаток, которые составляют неотъемлемую часть барьерной системы. Кроме того, подача провианта в изолятор должна осуществляться в стерильных условиях.
Мы полагаем, что по настоящему изобретению может использоваться любое стерильное животное. Самыми распространенными стерильными животными являются мышь, свинья, крыса, кролик, морская свинка, коза, овца, приматы и домашняя птица, при этом мышь является предпочтительной, особенно мышь Balb/c.
4.2. Выведение, забота и уход за стерильными животными
Появилось много публикаций, посвященных вопросам выведения, заботы и ухода за стерильными животными. Например. B.S. Wostmann, Ed., "Gnotobiotes: Standards and Guidelines for the Breeding, Care and Management of Laboratory Animals", National Research Council, National Academy of Sciences, Washington, D.C. 1970; M.E. Coates et al., "The Germfree Animal in Research", Academic Press, London, 1968; J.R. Pleasants, "Gnotobiotics", in: Handbook of Laboratory Animal Science", Vol. 1 (E.C. Melby et al., Eds.). CRC Press, Boca Raton, Fla., 117 (1974), которые приводятся здесь для справок.
Далее приводятся выдержки из публикации B. S. Wostmann, Ed. (1970) "Gnotobiotes: Standards and Guidelines for the Breeding, Care and Management of Laboratory Animals", National Research Council, National Academy of Sciences, Washington. D.C., в которой описывается выведение, забота и уход за стерильными крысами и мышами. Следует отметить, что подобные методики выведения, заботы и ухода аналогичны и для других животных.
Внешняя лабораторная Среда
Помещения, оборудование и методики разведения должны готовиться и осуществляться таким образом, чтобы обеспечить максимальный контроль за окружающими условиями и оптимальные комфортные условия для животных. Клетки, кормушки и поилки должны быть сконструированы и изготовлены таким образом, чтобы животные чувствовали себя максимально комфортно, пища и вода были легко доступны, а уборка и стерилизация были легко осуществимы и эффективны.
Желательный план помещения для проведения интенсивных исследований в стерильных условиях должен предусматривать:
1) рабочую зону для сборки я стерилизации изоляторов,
2) зону для поддержания жизнедеятельности животных в изоляторах, и
3) лабораторную зону для осуществления контроля за состоянием гнотобиологической среды.
В план помещения может также включаться офис и зона приготовления пищи.
Лабораторные условия для обслуживания гнотобиологических изоляторов должны удовлетворять стандартам, установленным для строительства обычных лабораторных питомников. Конструкция должна защищать от проникновения насекомых, а стены и пол должны быть влагонепроницаемыми. Освещение должно быть равномерным с одинаковыми циклами светлое время - темное время в течение всего года. Вентиляция должна быстро удалять любые запахи, возникающие при химической стерилизации, а климатические условия должны контролироваться так, как указано далее.
Температура. Наиболее приемлемая температура в помещении, где размещаются животные, составляющая 21-27oC, может быть в случае необходимости изменена таким образом, чтобы температура в изоляторе составляла от 22 до 26oC.
Влажность. Относительная влажность должна поддерживаться на комфортном для человека уровне, составляющем 40-60%. Однако если для вентиляции изолятора используется комнатный воздух, то рекомендуемый уровень относительной влажности составляет 40-50%.
Вентиляция. Смена воздуха в помещении должна быть достаточной для быстрого удаления любых запахов, возникающих при химической стерилизации. Рекомендуемая кратность обмена воздуха в помещении составляет от десяти до пятнадцати объемов в час. Персонал должен иметь противогазы с подачей свежего воздуха для защиты от опасных уровней концентраций паров химических реагентов.
Стерильное оборудование (см. E.Sacquiet 1968, "Equipment design and management: General technique of maintaining germ-free animals", p. 1-22, in: M. E. Coates (Ed.) "The germ-free animals in research", Academic Press, London; P.C. Trexler 1968, "Equipment design and management: Transport of germ-free animals and current developments in equipment design, p. 23-35, in: M. E. Coates (Ed.) "The germ-free animals in research", Academic Press, London).
Полное исключение попадания микробов из внешней Среды требует создания абсолютного барьера. Успешное проведение операции зависит от постоянного поддержания целостности указанного барьера. Существуют два основных типа изоляторов - из металла и пластмассы. Некоторые конструкции из металла разрабатываются таким образом, чтобы они выдерживали внутри действие водяного пара с давлением 20 фунтов на квадратный дюйм (1406 г/кв.см). (См. J.A. Reyniers. 1959. "Design and operation of apparatus for rearing germ-free animals", Ann. N.Y. Acad. Sci. 78:37). Другие конструкции размещают внутри большого автоклава для проведения первичной стерилизации (см. B.E.Gustafsson, 1959. "Lightweight stainless steel systems for rearing germ-free animals", Ann N.Y. Acad. Sci. 78:17).
Наибольшее распространение в настоящее время получили гибкие пленочные изоляторы (см. P.C.Trexler and L.I.Reynolds 1957. "Flexible film appararus for rearing and use of germ-free animals", Appl Microbiol. 5:406). Их обычно изготавливают из гибких многослойных пленок виниловых полимеров и подвергают химической стерилизации; при этом они легко могут быть приспособлены для конкретного назначения. Стерилизаторы другого типа, которые изготавливают из больших нейлоновых труб, состыкованных друг с другом, можно стерилизовать в автоклаве. (См. M.Lev 1962. "An autoclavable plastic unit for rearing animals under germ-free conditions". J.Appl. Bacteriol. 25:30). Разработаны также изоляторы из органического стекла и одноразовые гибкие пленочные блоки. Многие из них являются достаточно легкими, так что их можно разместить друг над другом на одной стойке, что позволяет сэкономить пространство внутри помещения.
Для изоляторов, чувствительных к действию тепла, используют специальный цилиндр для стерилизации пищи и питания. Изоляторы должны быть разработаны таким образом, чтобы у них был большой узел фильтрации, из которого можно было бы отвести воздух в автоклав с глубоким вакуумом (см. P.C. Trexler 1963, "An isolator system for control of contamination", Lab. Anim. Care 13: 572). В качестве альтернативы цилиндр можно снабдить дренажной рубкой, связанной с атмосферой, позволяющей удалять воздух и конденсат в процессе стерилизации без использования вакуума. (См. N.E.Jaworski and C.E.Miller 1963. "Refinement of cylinder technique for supplying germ-free isolators", Lab. Anim. Care 13:591).
Стерилизация
Все оборудование, пища, подстилка, вода и воздух, используемые в изоляторе, должны быть абсолютно стерильны. Применяемые для этого методики и условия определяются в каждом случае индивидуально.
Использование водяного пара, подаваемого под давлением, является наилучшим из известных методов стерилизации. Он особенно удобен для пористых веществ, которые устойчивы к действию тепла. Каждая зона, которая предположительно может служить приютом микробам, должна подвергнуться прямому контакту с водяным паром. Время воздействия зависит от применяемой температуры. Рекомендуют, чтобы наименее доступная часть загружаемых компонентов (середина упаковки) обрабатывалась как минимум 15 минут при температуре 121oC. Более высокие температуры и более короткие времена обработки могут применяться после тщательного исследования на предмет полноты стерилизации. Стандартный размер упаковки и плотность пищи, подстилки и других материалов имеет первостепенное значение для того, чтобы время проникновения водяного пара было бы постоянным и предсказуемым.
Для стерилизации подаваемого в изолятор воздуха используют сухое тепло (см. M. Miyakawa 1959. "The Miyakawa remote-control germfree rearing unit", Ann. N.Y.Acad. Sci., 78:37; B.E.Gustafsson 1959. "Lightweight stainless steel systems for rearing germ-free animals", Ann. N.Y.Acad. Sci. 78:17).
Надуксусная кислота (CH3COOOH) широко используется в случае чувствительных к действию тепла непористых материалов, особенно гибких пленочных боксов. Эту кислоту применяют в виде 2%-ного раствора вместе со смачивателем (детергентом) (см. P.C.Trexler and L.I.Reynolds 1957. "Flexible film apparatus for the rearing and use of hermfree animals" Appl. Microbiol. 5:406). В специфических случаях могут применяться другие химические реагенты, в частности гипохлориты, йодофоры или четвертичные аммониевые соединения для заполнения жидких сепараторов, в которые помещают новорожденных после проведения экстирпации матки, или хлорид ртути для размещения яиц в стерильных условиях перед высиживанием.
Для стерилизации несмачивающихся чувствительных к действию тепла боксов можно использовать оксид этилена. Время стерилизации зависит от температуры, влажности, давления и концентрации оксида этилена. Оксид этилена может химически взаимодействовать с подстилкой и компонентами пищи с образованием токсичных или нежелательных соединений. Поскольку он является горючим и вредным соединением, то использование оксида этилена в обычных случаях должно быть ограничено выпускаемыми промышленностью газовыми смесями, содержащими не более 20% оксида этилена.
Для стерилизации поступающего воздуха используют фильтры из стекловолокна. Они должны функционировать как абсолютные фильтры.
Чтобы не подергать жидкости воздействию тепла, можно применять мембранные фильтры, при условии, что указанные мембраны являются абсолютными фильтрами, например фильтрами, не пропускающими частицы с диаметром более 0,22 микрона.
Для стерилизации пиши или других специальных компонентов могут использоваться источники гамма-излучения или электронов. Используемые дозы варьируют от 2,5 до 6•106 рад.
Внутренняя среда
Температура. Температура внутри изолятора зависит от комнатной температуры и должна поддерживаться в интервале 22-26oC.
Влажность. В случае перегрузки, недостаточной вентиляции или при действии обоих этих факторов в изоляторе может образовываться конденсат влаги. Воздух, поступающий в изолятор, должен иметь относительную влажность менее 50 процентов и предпочтительно не ниже 40 процентов.
Подача воздуха. Кратность обмена воздуха в изоляторе должна составлять от 12 до 20 объемов в час, а избыточное давление - 3-5 дюймов (8-13 см) водяного столба. Воздух может поступать централизованно или из индивидуального для каждого бокса натекателя. В качестве системы централизованной подачи воздуха рекомендуется применять воздушный компрессор турбинного типа, поскольку масляные насосы имеют тенденцию выделять аэрозоли масла в линии подачи воздуха.
Изолятор с диффузией воздуха (см. P.C.Trexler 1968. "Equipment design and management: Transport of germ-free animals and current developments in equipment design", p. 23-35. in: M.E.Coates (Ed.) "The germ-free animal in research", Academic Press, London) нечувствителен к потерям в вентиляции при отключении электропитания. Однако этот тип имеет тот недостаток, что позволяет осуществлять меньшую кратность обмена воздуха за час и не может создать защитное избыточное давление, которое могло бы предотвратить попадание загрязнений в случае небольших повреждений в барьере.
Защитные меры на случаи чрезвычайных обстоятельств.
На случай прекращения подачи воздуха на период не более нескольких минут (при отключении энергии или при механическом повреждении) следует предусмотреть соответствующие меры безопасности для подержания давления воздуха внутри изолятора. Выход из строя не обеспеченных должной аварийной поддержкой пленочных изоляторов может в конце концов привести к удушью животных, однако непосредственная опасность заключается в том, что животные могут добраться до пленки или перчаток и повредить их. Это можно предотвратить, временно закупорив воздухопроводы с помощью резиновой пробки. Функционирование источников воздуха для отдельных изоляторов требует лишь аварийного источника питания. Централизованная система подачи воздуха должна иметь второй турбинный компрессор для резервной подачи воздуха.
Рекомендуется ввести графическую запись температуры и давления. В централизованной системе подачи воздуха должна быть установлена система аудиовизуального оповещения, которая приводится в действие в случае падения давления в линии как вследствие потери мощности, так и в случае механических повреждений. Аналогичные системы оповещения должны указывать на нежелательные отклонения в температуре подаваемого воздуха. Для системы индивидуальной подачи воздуха рекомендуется проводить непрерывную графическую регистрацию условий внутри помещения.
Клетки и расположенное внутри оборудование
Оборудование. Перечень основного оборудования для лаборатории может включать клетки с защитными крышками, бутылки с водой, кормушки, защитные матерчатые перчатки для резиновых перчаток, дополнительное уплотнение дверей или колпачковые прокладки, длинные покрытые резиной пинцеты, кровоостанавливающие зажимы, ножницы, полотенца, марлевые тампоны, бидоны емкостью в две кварты для хранения инструментов, бидоны с покрытием емкостью в четыре кварты для хранения пищи, ложки, пробирки, бумажные пакетики и непромокаемые пакеты для грязной подстилки.
Клетки должны быть изготовлены из гладкого коррозиестойкого материала. Они должны быть непроницаемыми для жидкостей и легко подвергаться стерилизации. Приемлемыми материалами считаются пластические массы, нержавеющая сталь и стекло. Металлы с гальваническим покрытием корродируют и их не рекомендуется использовать, поскольку загрязнение следами металлов может оказать влияние на результаты эксперимента.
Размеры клеток обычно ограничены размером загрузочного отверстия. Минимальная площадь, необходимая для одной самки мыши и соломенной подстилки для нее, составляет 50 кв.дюймов (970 кв.см). В большинстве случаев для одного животного может потребоваться больше места.
В Таблице А представлены рекомендуемые площади для одного животного при размещении мышей и крыс в зависимости от весовой группы.
Другие рекомендации
С целью обеспечения целостности барьерной системы рекомендуется провести испытание па наличие течей с использованием фреона.
Для каждого бокса должен вестись свой протокол проведения операций с целью регистрации в хронологическом порядке всех мероприятий, проводимых в боксе с момента его сборки и стерилизации. Подобные записи обычно хранят в виде картотеки на металлических стеллажах с указанием номера изолятора. Они должны также содержать отметки о проведении обычных операций по обслуживанию, в частности по замене перчаток. На том же стеллаже могут храниться записи о выведении потомства.
Вследствие ограниченности доступного пространства внутри изолятора для пищи и подстилки, а также для транспортировки животных между изоляторами, соединенными стерильными проходами, рекомендуется использовать бумагу и складные пакеты. Внутри изолятора нельзя использовать эфир, поскольку он может взорваться при возникновении статического разряда. В качестве летучего негорючего анестезирующего средства рекомендуется использовать флуотан (бромхлортрифторэтан).
Пища, подстилка и вода
Общие рекомендации
Необходима полная формула для выпускаемой промышленностью пищи с указанием всех ингредиентов и их содержания, в том числе консервантов, антиоксидантов и других добавок. Должна быть отчетливо обозначена дата изготовления. Изготовитель должен гарантировать, что пища:
1) имеет нормальные приемлемые границы естественной гормональной активности;
2) не содержит добавок, содержащих стимуляторы, гормоны, антибиотики или другие вещества, которые создают ненормальные физиологические условия или вступают в конфликт с экспериментальными методиками;
3) не содержит сальмонеллу по данным анализа статистически выбранных образцов;
4) не содержит загрязнений от грызунов или паразитов;
5) свободна ото всех непревращаемых остатков мясных или рыбных продуктов, которые могут содержать патогены.
Обогащение пищи
К пище стерильных животных предъявляются повышенные требования по содержанию определенных питательных веществ, с целью компенсировать потери витаминов, вызванные тепловой обработкой при стерилизации (особенно некоторых витаминов группы B, а также витамином A и D), и потери питательной ценности белков (сокращение количества доступного лизина, метионина, аргинина и триптофана). Пища должна также содержать необходимые питательные вещества, которые обычные животные получают за счет синтеза микробами в желудочно-кишечном тракте (см. B. S. Reddy, B. S. Wostman and J.R.Pleasants 1968. "Nutritionally adequate diets for germ-free animals", p. 87-111, in: M.E.Coates (Ed. ) "The germ-free animal in research", Academic Press, London). Примером подобной пищи является L-485 - недорогая пища, которая прошла интенсивные испытания (см. T.F.Kellogg and B.S.Wostman 1969. "Rat and mouse stock diet L-485", Lab.Anim.Care) и выпускается промышленно (см. Таблицу Б). Для компенсации потерь в качественном составе белков следует не увеличивать общее содержание белков, а добавлять конкретные аминокислоты. Увеличение общего содержания белков в пище приведет к большему потреблению и выделению воды, что ведет к повышению влажности и тем самым ограничивает количество животных данного размера, которые могут быть размещены в изоляторе.
Стерилизация водяным паром (см. B.S.Reddy, B.S. Wostman and J.R.Pleasants 1968. "Nutritionally adequate diets for germ-free animals", p. 87-111, in: M. E. Coatcs (Ed.) "The germ-free animal in research", Academic Press, London).
Конкретная методика будет зависеть от имеющегося под рукой оборудования. Как правило, важную роль играют три фактора:
1. Предварительный вакуум но крайней мере 20 дюймов (508 мм) ртутного столба способствует проникновению водяного пара внутрь нищи в автоклаве или цилиндре, соединенном с атмосферой. Если цилиндр для подачи нищи не соединен с атмосферой, то рекомендуется вакуум 28 дюймов (711,2 мм) ртутного столба или более.
2. Использование минимальной фазы стерилизации, которая гарантирует общую стерильность, плюс безопасные границы, определяемые оборудованием и опытом экспериментатора. Температура, измеряемая во внутренних частях пищи, должна достигать по крайней мере 121oC. При этой температуре реальная фаза стерилизации должна составлять как минимум 15 минут. При более высоких температурах стерилизации время стерилизации будет несколько короче.
3. Вакуум после стерилизации ускоряет остывание пищи. Это приводит к предотвращению нежелательного разложения питательных веществ. Однако разработанное и изготовленное устройство должно быть таким, чтобы можно было избежать утечек во время этой стадии операции.
В процессе стерилизации пищи водяным паром цель заключается в том, чтобы избежать как неполной стерилизации, так и нежелательного разрушения питательных веществ, вызванного чрезмерно длительным нагреванием. Хотя потерь некоторых питательных веществ трудно избежать, вполне удовлетворительные результаты могут быть получены при контроле за следующими факторами:
(a) Техническими параметрами, такими как температура предварительной стерилизации и вакуум после стерилизации, а также размер таблетки.
(b) Содержанием воды в пище. Увеличение содержания воды приводит к лучшему сохранению витаминов группы В после стерилизации (см. D.R.Zimmerman and B.S. Wostmann 1963. "Vitamin stability in diets for germ-tree animals", J. Nutr. 79:318). Для твердой пищи рекомендуемое содержание воды составляет до 25 процентов или может быть таким, чтобы не ухудшать качество пищи при хранении. Изменение в содержании воды в пище должно сопровождаться новым испытанием быстроты, с которой пища достигает температуры стерилизации.
Стерилизация под действием радиации.
(См. B. S. Reddy, B. S. Wostman and J.R.Pleasants 1968. "Nutritionally adequate diets for germ-free animals", p. 87-111, in: M.E.Coates (Ed.) "The germ-free animal in research", Academic Press, London; F.J.Ley, J.Bleby, M. E. Coates and J.S. Paterson 1969. "Sterilization of laboratory animals using gamma radiation", Lab. Anim. 3:221).
Методики и доза зависят от оборудования и типа применяемого излучения. Хотя в общем случае считается, что стерилизация с применением радиации приводит к меньшему разрушению питательных веществ, в настоящее время рекомендуют, чтобы пища проходила стерилизацию водным паром.
Испытания на стерильность
Для контроля за степенью стерилизации, которая достигается с применением конкретной методики стерилизации, рекомендуется использовать индикаторную бумагу со спорами Bacillus stearothermophilus. Полоски индикаторной бумаги опускают внутрь пищи. Периодически микробиологическому мониторингу подвергают также изолятор и животных. Указанный контроль необходим для определения случайных загрязнений в результате разрушения барьеров изолятора или неправильной стерилизации изолятора или его содержимого. Указанную процедуру проводят как описано B.S.Wostmann, Ed., "Gnotobiotes: Standards and Guidelines for the Breeding, Care and Management of Laboratory Animals". National Research Council, National Academy of Sciences, Washington, D.C. 1970. pp. 28-39.
Оценка степени потери питательных веществ в процессе стерилизации
В качестве полезной проверки степени потери жизненно важных питательных веществ рекомендуется использовать определение количества экстрагируемого тиамина как индикатора количества выделения тиамина, добавленного к пище (см. B.S.Wostmann and P.L. Knight 1960. "The effect of methyl alcohol on the convercion of thiamine to thiochrome", Experientia 16:500). Выделение менее 25% указывает на значительное ухудшение общей питательной ценности пищи. При использовании соответствующего оборудования и должных мер предосторожности должно быть выделено 50% или более.
Хранение твердой пищи
Поскольку проведение экспериментов в стерильных условиях обычно стоит очень дорого, то следует принять дополнительные меры предосторожности и никогда не использовать пищу, которая в значительной степени потеряла свои питательные свойства. Рекомендуется, чтобы (а) нестерилизованная пища всегда хранилась в холодильнике и ни в коем случае не более одного месяца и (б) время хранения стерилизованной пищи внутри изолятора должно составлять одну неделю или менее и никогда не превышать десяти дней.
Подстилка
Подстилку следует менять по крайней мере один раз в неделю. Рекомендуется, чтобы материал подстилки можно было легко стерилизовать и чтобы он с трудом поглощался животными. Он не должен выделять в результате стерилизации токсичные вещества. Рекомендуется использовать обеспыленные белые сосновые щепки (опилки) и стружки. Приемлемы стружки американской липы или тополя или измельченные початки кукурузы. Не рекомендуется применять продукты переработки диатомовой земли, кедр, деревья смолистых пород и деревья твердых пород. Стерилизацию с помощью оксида этилена не следует использовать до тех пор, пока не будет прояснен вопрос о возможном образовании вредных веществ.
Вода
Питьевая вода должна быть стерилизована. Ее обрабатывают в автоклаве в квадратных упаковочных емкостях, сосудах Мейсона или баках, прикрепленных к боксу. Внутри каждого контейнера должно быть оставлено небольшое пространство.
Принципы получения гнотобиотов с применением кесарева сечения
Частично ключ к успеху любой операции кесарева сечения заключается в том, чтобы беременность полностью подошла к своему сроку. Это особенно важно для животных с короткими периодами беременности, когда утробный плод может прибавить 20% своего веса в последние 24 часа до родов. Планирование времени спаривания несомненно полезно, однако для животных, дающих большой приплод (крысы и мыши), полезно бывает подождать, чтобы до проведения операции самка дала первое потомство. Для морских свинок наиболее удовлетворительный метод заключается в отборе самок для проведения операции путем измерения степени растяжения лобковых костей (см. B. P. Philihs, P.A.Wolfe and H.A. Gordon 1959. "Studies on rearing the guinea pig germ-free", Ann.N.Y.Acad.Sci 78: 183).
Полученные кесаревым сечением детеныши должны быть перенесены в безмикробную среду прежде, чем они сделают свой первый глоток воздуха. Их можно непосредственно взять у матери путем рассечения матки и перенести в стерильный изолятор через вырез в мембране стерильного барьера или перенести в стерильный изолятор через бактерицидную ловушку путем экстирпации матки. Обычная хирургическая подготовка самки перед проведением операции кесаревого сечения включает удаление шерсти на брюхе, очистку и дезинфекцию оперируемого места. Анестезию проводят предпочтительно путем смещения шейных позвонков крысы или мыши, хотя можно провести анестезию по средней линии брюха или применить общий наркоз, не вызывая при этом значительного ослабления или смертности плода. В случае морских свинок операцию обычно проводят после предварительного воздействия седативным средством и под местным наркозом.
Перенос детенышей после кесаревого сечения через мембрану барьера требует специального оборудования для проведения изоляции. Хирургический бокс Рейнье из нержавеющей стали (см. J.A.Reyniers 1965. "Germ-free life methodology (gnotobiotics) and experimental nutrition", p. 458-466, in: Proc. 3rd Intertat. Congr. Biochem., Bruxelles) имеет встроенную горизонтальную металлическую перегородку, которая разделяет верхнее и нижнее отделение бокса. Перегородка имеет круглое отверстие, покрытое пленкой из майлара, сохраняющей целостность верхнего отделения. Самку, подготовленную к операции, помещают в нижнем отделении таким образом, что ее брюхо оказывается прижатым к майлару. Все хирургические инструменты размещаются в верхнем отделении, и операцию проводят в этой стерильной зоне. Рассечение проводят через пластик и кожу с помощью электрокаутера или скальпеля. Для рассечения кожи предпочтительнее использовать самостерилизующее лезвие электрокаутера. Края кожи и майлара прижимают друг к другу и отгибают. На брюхо кладут стерильную хирургическую салфетку, покрывая разрезанные края кожи, и открытые соединительные ткани перед вскрытием брюшной полости обрабатывают теплым дезинфицирующим раствором (хлорид бензалкония 1:1000). Следует проявить особую осторожность и не повредить кишечник. Полезным может оказаться размещение пары кровоостанавливающих зажимов между брюшной стенкой и внутренними органами. Затем раскрывают матку и вынимают детенышей, оболочки плода удаляют, пуповину пережимают и отрезают. Детенышей осторожно обтирают и массажируют, чтобы стимулировать дыхание. Их переносят в отделение для выращивания, где их вскармливает кормилица или же их кормят вручную. Другим листом майлара можно закрыть хирургическое отверстие и процедуру повторяют для 5 или 6 самок без особого риска внести загрязнения. Роды кесаревым сечением можно провести также, используя в качестве операционной пластиковый изолятор или бокс с перчатками. Внешнюю поверхность пола изолятора предварительно подвергают стерилизации, а затем к нему прижимают брюхо животного так, что он играет ту же роль, что и описанный ранее лист майлара. После проведения операции разрез в пластиковом барьере может быть закрыт стерильной лентой и хирургическую процедуру повторяют для других беременных самок.
Роды иссечением матки чаще проводят в пластиковых изоляторах (см. H.Foster 1959. "A procedure for obtaining nucleus srock for a pathogen-free animal colony", Lab. Anim. Care 9:135). Матку обнажают в асептических условиях и пережимают непосредственно перед шейкой. Иссеченную матку переносят в безмикробное отделение через ловушку с бактерицидной жидкостью. Как только матка окажется в изоляторе, как можно скорее проводят роды детенышей, так чтобы они не надышались отделяемыми при родах водами. Детенышей обычно обтирают и стимулируют им дыхание, а затем пережимают пуповину и отрезают ее. Далее детенышей передают кормилице или кормят вручную.
Иссечение матки может быть с успехом проведено для мышей, крыс и свиней. Однако для морских свинок предпочтительным является рассечение матки, поскольку большая смертность наблюдается в том случае, если с момента отделения от источника материнской крови и до момента размещения внутри изолятора проходит более двух минут.
Системы выращивания в гнотобиологических колониях
Инбредные породы
Обычные системы выращивания, в которых возможно спаривание брат x сестра, также могут использоваться для получения гнотобиологических колоний.
Неинбредные семьи
Истинный случайный отбор при выращивании потомства может включать некоторые случаи спаривания между родными братьями и сестрами и двоюродными братьями и сестрами. Хотя подобного спаривания в неинбредных колониях стараются избежать, получаемая система скрещивания не уменьшает уровень инбрединга до возможного предельного значения. Приемлема любая система с минимальным инбредингом. (См. D.С.Falconer 1967. "Genetic aspects of breeding methods", p. 72-96, in: "The UFAQ handbook on the care and management of laboratory animals", 3rd ed., E and S Lovingstone, Ltd., London; National Research Council, Institute for Laboratory Animal Resources. 1969. "A guide to genetic standards for laboratory animals", National Academy of Sciences, Washington, D.C.).
Сравнение обычных и гнотобиологических колоний
Для сравнения желательно содержать как обычную, так и гнотобиологическую колонию, при этом их схожие генетические конституции можно поддерживать, внося полученное кесаревым сечением потомство из эффективной выращиваемой популяции обычной колонии в гнотобиологическую колонию. Это вероятно вопрос выбора для тех производителей, которые наибольшее внимание уделяют выращиванию негнотобиологических крыс или мышей, однако указанный путь имеет тот недостаток, что препятствует установлению микробиологического происхождения, которое могло бы облегчить микробиологический контроль. В идеале контроль можно было бы осуществить используя потомство от конкретных скрещиваний, которое могло бы служить семейством для выращивания обычной колонии, а следующее потомство от каждого из этих спаривани1 можно было бы использовать в качестве семейства для выращивания гнотобиологической колонии. Если эту процедуру повторять через каждое второе или третье поколение, то генетическая конституция обоих колоний будет очень схожей, конечно, при условии, что в каждой колонии используется та же система скрещивания.
В качестве альтернативы потомство от эффективной выращиваемой популяция гнотобиологической колонии можно использовать для создания или поддержания обычной колонии. Генетические последовательности будут идентичны при условии, что используются одинаковые методики.
Сохранение регистрационных записей (см. G.L. Wolff 1967. "Practical mating systems and record-keeping in dreeding colony", p. 97-113, in "The UFAW handbook on the care and management of laboratory animals", 3rd ed., E and S Livingstone, Ltd., London).
Должны вестись соответствующие регистрационные записи о животных и по обслуживанию изолятора, регистрационные записи о животных должны определять эффективность проведения операции и биологическую активность животных. Регистрационные записи об изоляторе должны содержать в хронологическом порядке все события, связанные с изолятором, с тем чтобы помочь найти брешь в барьере при попадании загрязнений.
4.3. Не имеющие антигенов животные
В предпочтительном варианте осуществления настоящего изобретения предусматривается, что стерильные животные выращиваются с использованием химически определенной, низкомолекулярной, растворимой в воде пищи, которую подвергают ультрафильтрации. Считается, что такая пища позволяет осуществить полный контроль за потреблением животными питательных веществ и антигенов. Подобную пищу обычно полностью готовят из отдельных ингредиентов с известной химической природой, в частности аминокислот, простых сахаров, липидов, витаминов и минералов. В настоящем изобретении химически определенная пища включает аминокислоты, простые сахара, липиды, витамины и минералы и не содержит никаких других компонентов с молекулярным весом более приблизительно 10000 дальтон, таким образом, все компоненты химически определенной пищи имеют низкий молекулярный вес и являются природными питательными веществами, существующими в организме животных, а потому считается, что подобные компоненты не вызывают ответной иммунной реакции. Ранее приведенные литературные ссылки относятся к стерильным животным, которые выращены с использованием химически определенной пищи, как к "животным, не имеющим антигенов".
Желательно также использовать для подстилки фильтровальную бумагу, иначе стерильные животные могут поедать подстилку, что приведет к ответной иммунной реакции. Полагают, что поедание подстилки из фильтровальной бумаги не приводит к возникновению ответной иммунной реакции.
Конкретная химически определенная пища для данных видов животных должна включать такие компоненты и в таких пропорциях и количествах, чтобы удовлетворять известным требованиям по питательной ценности для данных видов животных. Ниже приводится состав и приготовление предпочтительной химически определенной пищи для стерильных мышей.
Состав и приготовление химически определенной пищи L489E14Se
Ингредиент - Количество, г на 100 г ингредиента
К 192 мл воды Milli-Q при температуре 70oC добавляют следующие компоненты:
Лейцин - 1,9
Фенилаланин - 0,74
Изолейцин - 1,08
Метионин - 1,06
Триптофан - 0,37
Валин - 1,23
Аспаргин - 0,91
Гидрохлорид аргинина - 0,81
Треонин - 0,74
Гидрохлорид лизина - 1,77
Гидрохлорид гистидина - 0,74
Раствор охлаждают до 45oC и добавляют к нему следующие компоненты:
Глицин - 0,59
Пролин - 1,48
Серин - 1,33
Аланин - 0,59
Глютамат натрия - 3,40
Гидрохлорид этилового эфира L-тирозина - 0,62
Глюконат железа (II) - 0,05
Соли 35D (1) - 0,105
Селенит натрия (2) - 0,074
Раствор охлаждают до 5oC и добавляют к нему следующие компоненты:
Глицерофосфат кальция - 5,22
Глицерофосфат магния - 1,43
Дигидрат хлорида кальция - 0,185
Смесь хлорид натрия - йодид калия (содержит 680 мг KI) - 0,086
Смесь 111E5 витаминов B (3) - 0,09
Витамин B12 (4) - 1,20 мг
Хлорид холина - 0,31
Ацетат калия - 1,85
К 108 мл волы Milli-Q при температуре 70oC добавляют:
D-декстроза безводная - 71,28
Растворы охлаждают до 5oC, смешивают друг с другом и подвергают ультрафильтрации.
(1) Состав солей солевой смеси 35D приведен в Таблице 3.
(2) Добавляют дополнительно к селенату натрия, содержащемуся в смеси солей 35D.
(3) Состав смеси 111E5 витаминов B представлен в Таблице 4.
(4) Добавляют дополнительно к витамину B-12, входящему в состав смеси 111E5 витаминов B (см. далее в Примерах).
Указанной композицией кормят мышей или крыс ad libitum.
Состав липидной добавки LADEK 69E6
Ингредиент - Количество в дневной дозе (*) взрослого животного (0385 мл)
Очищенные солевые триглицериды (1) - 0,33 Г
Ретинилпальмитат - 6,34 мг (11,7 и.е.)
Холекальциферол - 0,0288 мг (1,15 и.е.)
2-Амбо-альфа-токоферол - 3,3 мг
Ацетат 2-амбо-альфа-токоферола - 6,6 мг
Филлохинон - 72 мг
(*) Кормящие мыши получают удвоенную дозу для нормального животного.
(1) Включает: 12% пальмитата, 1,5% стеарата, 24% олеата, 55% линолеата, 8% линолената.
Для подробного описания химически определенных типов пищи см. J.R.Pleasants et al. J.Nutr. 116, 1449-1964 (1986); J.R.Pleasants et al., "Germ-free Research: Microflora Control and its Application to the Biomedical Sciences, B. S. Wostmann. Ed., p. 87, Liss, New York (1985); B.S.Wostmann et al., J. Nutr. , 112, 552 (1982); и J.R.Pleasants et al., J.Nutr., 100, 498 (1970), описание которых приводится здесь для справки.
4.4. Получение моноклонального антитела
Стерильное животное далее используют для получения моноклональных антител. Безмикробную систему можно применить для получения моноклонального антитела для любого антигена, которое может продуцировать животное в нестерильном состоянии. Примерный список антигенов приведен в патенте США 3935074. Мы полагаем, что стерильное животное позволяет получить значительно большую ответную иммунную реакцию на действие антигена. Так, можно повысить вероятность размещения B-лимфоцита, который продуцирует антитело, способное связываться со специфическим эпитопом антигена. Это главное преимущество настоящего изобретения. Далее, мы считаем, что безмикробная система особенно полезна для генерирования высокоспецифичного антитела для тех антигенов, которые имеют множество эпитопов.
Стерильное животное можно подвергнуть вакцинации стандартными способами. Однако предпочтительно подвергнуть стерильное животное вакцинации по крайней мере трижды с перерывом по крайней мере приблизительно в три недели между каждыми вакцинациями с последующей активной вакцинацией перед проведением слияния. Мы полагаем, что повышенный уровень вакцинации может оказаться необходимым, поскольку было замечено, что после двух вакцинаций, как это обычно практикуется, большую часть все еще составляют B-лимфоциты, секретирующие IgM, а не B-лимфоциты, секретирующие IgG.
4.5. Соматические клетки
Соматические клетки стерильного животного, потенциально способного продуцировать антитело и, в частности, B-лимфоциты, пригодны для слияния с B-клетками миеломной линии. Те продуцирующие антитело клетки, которые находятся на стадии деления лимфопласта, преимущественно сливаются легче. Соматические клетки могут быть получены из лимфатических узлов, селезенки и периферической кровяной системы примированных стерильных животных, и выбор лимфатических клеток в значительной степени зависит от их определяемой на практике полезности в конкретной системе слияния. Однако обычно предпочтение отдают соматическим клеткам, получаемым из селезенки, один раз повергнув стерильных животных примированию или гипервакцинации, их можно использовать в качестве источника лимфоцитов, продуцирующих антитела. Лимфоциты мышей дают большой процент устойчивых слияний с миеломными линиями мыши, которые описываются далее. Однако можно использовать продуцирующие антиген клетки и от других стерильных животных. Выбор конкретного стерильного животного зависит от выбора антигена, поскольку важно, чтобы стерильное животное среди своих B-лимфоцитов имело B-лимфоцит, способный продуцировать антитело по отношению к такому антигену.
4.6. Иммортализующие клетки
Из лимфоцитных опухолей выделены специализированные миеломные клеточные линии для использования при получении гибридом (G.Kohler and C.Milstein, 1976, Eur. J.Immunol. 6:511-519; M. Schulman et al., 1978, Nature 276:269-270). Клеточные линии разработаны по крайней мере по трем причинам. Первая причина заключается в том, что необходимо облегчить селекцию слитых миеломных клеток. Обычно это осуществляют, используя миеломы с дефицитом фермента, что делает их неспособными расти в определенных селективных средах, которые способствуют росту гибридом. Вторая причина вытекает из потенциальной способности лимфоцитных опухолевых клеток продуцировать свои собственные антитела. Цель использования моноклональных методик исключается в получении иммортализованных слитых гибридных клеточных линий, которые продуцируют одно нужное специфическое антитело при генетическом контроле со стороны соматической клетки, являющейся компонентом гибридомы. Чтобы предотвратить продуцирование гибридомами антител опухолевой клетки, используют миеломные клеточные линии, не способные продуцировать легкие или тяжелые цепи иммуноглобулинов, или миеломные клеточные линии с дефицитом механизма секреции антител. Третья причина выбора таких клеточных линий заключается в том, что они подходят и эффективны для слияния.
Для продуцирования слитых клеточных гибридов можно использовать несколько миеломных клеточных линий, в том числе NS-1, X63-A8, NIS-Ag4/1, MPC11-45.6TG1, X63-Ag8.653, Sp2/0-Agf14, FO и S194/5XX O.Bu.1., которые все получены от мышей, и 210-.RCY3.Ag1.2.3, которые получают от крыс (G.L.Hammerling, U. Hammerling and J.F.Kearnly, eds., 1981, "Monoclonal antibodies and hybridomas", in: J.L.Turk, eds. "Research Monographs in Immunology" Vol. 3, Elsevier/North Holland Biomedical Press, New York).
4.7. Слияние
Методы генерирования гибридов клеток селезенки или клеток лимфатических узлов, продуцирующих антигены, и иммортализующих клеток обычно заключаются в смешении соматических клеток с иммортализующими клетками в пропорции, которая может варьировать приблизительно от 20:1 до приблизительно 1:1, в присутствии агента или агентов (химических, вирусных или электрических), которые ускоряют слияние клеточных мембран. Часто бывает предпочтительнее, чтобы те же самые органы животного служили бы источником соматических и иммортализующих клеток, которые используют при слиянии. Методы слияния описывают Kohler and Milstein (1975, Nature 256:495-497; 1976. Eur. J. Immunol. , 6: 511-519), Gefter et al. (1977. Somatic Cell Genet. 3:231-236) и Kozbor et al. , 1983, Immunology Today, 4, 72. Агентами, промотирующими слияние, которые используются в этих исследованиях, являются, соответственно, вирус Sendai и полиэтиленгликоль.
Можно использовать также недавно разработанную методику EBV-трансформации (Cole et al., 1985. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96).
4.8. Выделение клонов и определение антител
Вероятность получения жизнеспособных гибридов по процедуре слияния обычно очень низка и составляет приблизительно от 1•10-6 до 1•10-8. Вследствие низкой вероятности получения жизнеспособных гибридов, очень важно иметь под рукой средство для отбора слитых клеточных гибридов от оставшихся неслитых клеток, в частности неслитых миеломных клеток. Необходим также способ определения нужных продуцирующих антитело гибридом среди прочих полученных слитых клеточных гибридов.
Обычно слитые клетки выращивают в селективной среде, например среде HAT, которая содержит гипоксантин, аминоптерин и тимидин. Среда HAT способствует разрастанию гибридных клеток и препятствует росту неслитых миеломных клеток, которые в обычных условиях продолжали бы делиться беспрерывно. Аминоптерин блокирует de novo синтез пурина и пиримидина путем подавления получения тетрагидрофолята. Добавление тимидина позволяет обойти блокирование синтеза пиримидина, а гипоксантин вводят в среду для того, чтобы ингибированные клетки могли синтезировать пурин по методу реутилизации нуклеотидов. Используемые миеломные клетки представляют собой мутанты, у которых отсутствует гипоксантин фосфорибозил-трансфераза (HPRT), а потому они не могут использовать путь реутилизации. В жизнеспособных гибридах генетическую информацию для продуцирования этого фермента предоставляет B-лимфоцит.
Поскольку сами B-лимфоциты имеют ограниченный жизненный цикл в культуре (приблизительно две недели), то единственными клетками, которые могут разрастаться в среде HAT, являются гибриды, полученные из миеломных клеток и клеток селезенки.
Для облегчения отбора антитела, секретируемого гибридами, и для предотвращения того, чтобы индивидуальные гибриды перерастали других, смесь слитых миелом и B-лимфоцитов разбавляют средой HAT и выращивают в ячейках планшета для микротитрования. Через две или три недели, когда клоны становятся видимыми в микроскоп, жидкость над осадком в индивидуальных ячейках, содержащих гибридные клоны, анализируют на предмет продуцирования специфического антитела.
Анализ должен быть чувствительным, простым и быстрым. Аналитические методы включают радиоиммуноанализы, ферментные иммуносорбентные анализы, анализы на цитотоксичность и тромбоцитный анализ.
4.9. Разрастание клеток и продуцирование антител
После того, как слитые гибридные клетки отобраны и подвергнуты клонированию в индивидуальных клеточных линиях, продуцирующих антитела, каждую клеточную линию проращивают одним из двух стандартных способов. Образец гибридомы вводят в гистосовместимое животное из того же класса, которое используют для получения соматических и миеломных клеток при проведении слияния. В подвергнутом инъекции животном развивается опухоль, секретирующая специфичное моноклональное антитело, продуцируемое слитым клеточным гибридом. Циркулирующие в организме животного жидкости, такие как сыворотка и асцитная жидкость, можно откачать путем пункции и получить моноклональные антитела в большой концентрации. В качестве альтернативы индивидуальные клеточные линии можно вырастить в лабораторных сосудах с культурой в условиях in vitro. Среду с культурой, содержащей высокие концентрации единственного специфичного моноклонального антитела, можно выделить декантацией, фильтрацией или центрифугированием.
4.10. Использование моноклонального антитела
Моноклональные антитела, полученные по способу настоящего изобретения, могут использоваться в любых известных методиках или методиках, которые появятся в будущем и в которых применяют моноклональное антитело.
Моноклональные антитела используют главным образом при проведении иммуноанализов, в которых определяют величину взаимодействия антиген - антитело. Подобные анализы являются обычно гетерогенными или гомогенными. В гомогенных иммуноанализах иммунологическая реакция обычно включает специфичное антитело, содержащее метку, определяемое при анализе вещество и анализируемый обрзец. Сигнал, поступающий от метки, прямо или косвенно модифицируется при связывании антитела с содержащим метку определяемым при анализе веществом. Как иммунологическую реакцию, так и определение ее продолжительности проводят в гомогенном растворе. Используемые иммунологические метки включают свободные радикалы, флюоресцентные красители, ферменты, бактериофаги, совместно действующие ферменты и т.п. Главным преимуществом гомогенного иммуноанализа является то, что специфичное антитело не нужно отделять от содержащего метку определяемого при анализе вещества.
В гетерогенном иммуноанализе в качестве реагентов используют анализируемый образец, специфичное антитело и средства для получения сигнала, который можно обнаружить. Образец обычно помещают на подложку, такую как планшет или предметное стекло, и он контактирует с антителом в жидкой фазе. Затем подложку отделяют от жидкой фазы и либо фазу на подложке либо жидкую фазу исследуют на наличие сигнала, который можно обнаружить, с использованием средств для получения этого сигнала. Сигнал указывает на присутствие в образце определяемого при анализе вещества. Средства для получения обнаруживаемого сигнала включают использование радиоактивных меток, флюоресцентных веществ, ферментов и т.п. Примерами гетерогенных иммуноанализов являются радиоиммунный анализ, иммунофлюоресцентные методы, иммуносорбентные анализы и т.п.
Для более подробного обсуждения вышеуказанных методик иммуноанализов см. "Enzyme-Immunoassays" Edward D. Maggio, CRC Press, Inc., Boca Raton, Fla., 1980. См. также Патенты США с номерами 3690834; 3791932; 3817837; 3850578; 3853987; 3867517; 3901654; 3935074; 3984533; 3996345 и 4098876, причем этот список далеко не полон.
Другим важным направлением использования моноклональных антител является in vivo визуализация и терапия. Моноклональные антитела могут содержать метку радиоактивного соединения, например радиоактивного йода, и назначаться пациенту внутривенно. Антитело может содержать также магнитную метку. Для точного указания местонахождения антигена можно применить метод ядерного магнитного резонанса. Локализовав антитела у антигена, сам антиген можно обнаружить методами эмиссионного томографического и радиоактивного сканирования, определяя тем самым местоположение антигена.
К примеру, очищенное моноклональное антитело суспендируют в подходящем носителе, в частности физиологическом солевом растворе, содержащем или не содержащем сывороточный альбумин человека, с подходящей дозировкой и назначают внутривенно, например путем непрерывного внутривенного вливания в течение нескольких часов, как указано в монографии Miller et al. "Hybridomas in Cancer Diagnosis and Therapy" (1982), которая приводится здесь для справок.
Моноклональные антитела но настоящему изобретению могут использоваться в терапевтических целях. Антитела, обладающие соответствующими биологическими свойствами, непосредственно могут оказаться полезными как терапевтические агенты в качестве альтернативы, антитела могут связываться с токсином с образованием иммунотоксина или с радиоактивным веществом или лекарством с образованием радиофармацевтического или фармацевтического препарата. Методы получения иммунотоксинов или радиофармацевтических препаратов антител хорошо известны (см. например, Cancer Treatment Reports (1984) 68:317-328).
Кроме того мы полагаем, что поликлональные антитела, полученные от стерильных животных, также могут использоваться в иммуноанализах и давать лучшие результаты по сравнению с поликлональными антителами, полученными от обычных животных.
Поликлональные антитела от стерильных животных могут быть получены при использовании стерильных животных, как это указано ранее, и вышеуказанных методов вакцинации с последующим выделением поликлональных антител из животных с помощью обычных методов, в частности путем выделения сыворотки животного.
Фибрин-специфичное моноклональное антитело
5.1. Предпосылки
Механизм остановки кровотечения является сложной физиологической ответной реакцией организма при ремонте разорванных кровеносных сосудов. Остановка кровотечения достигается за счет совместного кооперативного действия стенки поврежденного кровеносного сосуда, тромбоцитов и коагулирующей системы. Роль коагулирующей системы заключается в создании пространственной сети из фибрина, в которой стабилизируется и закрепляется пробка из тромбоцитов, которая формируется на субэндотелиальной структуре поврежденного сосуда. Образование нерастворимой фибриновой матрицы из циркулирующего в крови фибриногена является результатом сложной последовательности превращений, кульминацией которой является взрывное продуцирование тромбина в нужном месте. Коагуляция представляет собой процесс усложнения структуры, включающей цепь ферментативных реакций, в которых проферменты (факторы сворачивания крови) последовательно активируются и превращаются в реакционноспособные ферменты. Процесс полимеризации фибрина при образовании тромба контролируется рядом физиологических механизмов. Они включают ингибитор тромбина антитромбин III (ATIII), белок C, простациклин и различные компоненты фибринолитической системы, такие как тканевый плазминогенный активатор (t-PA) и его быстродействующий ингибитор (PAI).
В соответствии с гипотезой о механизме остановки кровотечения, высказанной в публикации T. Astrup, Blood 11, 781-806 (1956), существует равновесие между образованием фибрина (коагуляцией) и растворением фибрина (фибринолизом). В нормальном или здоровом состоянии эти функции строго сбалансированы. Однако как только процесс остановки кровотечения ослабляется, коагуляция и фибринолиз патологически выражаются в виде тромбоза и кровотечения соответственно. Патологические проявления патологического тромбоза или тромболитических заболеваний чрезвычайно разнообразны и включают коагулопатию потребления, тромбоз глубинных вен, артериальный и венозный тромбоз. Тромбоэмболизм и тромболитические осложнения других заболеваний сосудов (в частности, атеросклероз) могут привести к закупорки основных артерии, что приводит к ишемии органа и сопровождающими его опасными для жизни состояниями, такими как инсульт (удар), инфаркт миокарда и т.п.
Фибринолитический процесс заключается в превращении неактивного профермента, плазминогена, в протеолитический белок, плазмин, посредством действия агентов, известных как активаторы плазминогена. Молекулярный механизм физиологического фибринолиза не вполне понятен, однако известно, что в процессе образования фибрина плазминоген присоединяется туда, где он может быть приведен в активное состояние активаторами плазминогена, в частности t-PA. По этой схеме образование плазмина происходит внутри тромба, где он защищен от дезактивирующего воздействия основного ингибитора плазмина - альфа2-антиплазмина.
Под действием плазмина фибриноген и фибрин распадаются с образованием проектов деструкции. Фибриноген распадается на фрагменты X и Y, а при дальнейшем действии плазмина - на фрагменты D и E. Фибрин в виде несшитого D-димера разлагается на фрагменты X, Y, D и E, а сшитый фибрин разлагается на комплекс D-D/E, димер Y, димер Y-D и олигомер X.
Исследования маркеров тромботических заболеваний проведены совсем недавно с использованием поликлональных антител как в радиоиммуноанализах, так и анализах типа латексной агглютинации. Было показано (P.J. Gaffney, Ann. X. Y. Acad. Sci., 408, 407-423 (1983)), что эти анализы весьма ненадежны. Более специфичные и чувствительные иммуноанализы (такие как иммуноферментные анализы) с использованием моноклональных антител становятся обычной практикой в клинических лабораториях. Фактором, ограничивающим эти диагностические методы анализа, являются специфичность и аффинность конкретного используемого моноклонального антитела. Воспроизведение высокоспецифичных антител для любого потенциального индикатора ослабления гемостаза сдерживается как низким уровнем содержания индикаторов, так и антигенной связанностью конкретного маркера со своим предшественником, который обычно содержится в плазме в значительно большей концентрации. Примерами являются образование комплексов между ферментами и их ингибиторами, в частности тромбин - антитромбин III, плазмин - альфа2-антиплазмин, t-PA - PAI-1. Количество новых антигенных сайтов, возникающих вследствие образования указанных комплексов, чрезвычайно мало и затрудняет получение иммунологических зондов (таких как моноклональные антитела).
Аналогично, основной проблемой, связанной с восприимчивостью моноклонального антитела к фибрину, является структурное и конформационное сходство между фибрином и его физиологическим предшественником - фибриногеном. По оценке, сохранение ковалентной структуры при превращении фибриногена в фибрин превышает 98% (E.F. Plow et al., 1982, Semin. Thromb. Haemostas, 8, 36), а потому лишь небольшой процент эпитопов в молекуле фибрина на самом деле являются неоантигенами (и уникальны для фибрина). В большинстве этих подходов, опробованных для получения антител фибрина, основное внимание уделяется вакцинации животных растворимыми фрагментами фибрина и синтезу пептидов, которые имитируют обработанные неоантигенные сайты фибрина (см. K,Y. Hui et al. , Science 22, 1129-32 (1983); V. Scheefers-Borchel et al., Proc. Natl. Acad. Sci. USA, 82, 7091-95 (1985); M.J. Elms et al., Tromb. Haemostas., 50, 591-94 (1983); B. Kurdryk et al., Mol. Immunol., 21, 89-94 (1984)). Полагают, однако, что сайт связывания указанных антител сохраняется в процессе распада фибрина, а потому указанные антитела также могут связываться с продуктами распада фибрина.
Настоящее изобретение позволяет осуществить совершенно другой подход и используют исходный антиген фибрина в сочетании с усиленной иммунологической активностью не содержащего антиген животного с целью продуцирования фибрин-специфичного моноклонального антитела. В соответствии с настоящим изобретением фибрин-специфичное моноклональное антитело связывается с фибрином, а не с фибриногеном, продуктами распада фибриногена или продуктами распада фибрина.
5.2. Материалы и методы
5.2.1. Животные
Стерильные мыши BALB/cAnN получают из безмикробной колонии университета штата Висконсин. Животных транспортировали в безмикробных условиях. Не содержащую антиген колонию создают, перемещая беременных стерильных мышей, получающих пищу L-485 из природных ингредиентов (см. J.P. Pleasants el al., J. Netr, 116, 1949-1964 (1986)) в не содержащий антигенов изолятор, в котором мышам немедленно начинают давать химически определенную пищу. Их потомство, которое никогда не получало пищу, составленную из природных компонентов, отучают от материнского молока, переводят на химически определенную пищу и обозначают как первое поколение, не имеющее антигенов. Не содержащих антигенов мышей спаривают и содержат парами до тех пор, пока у женских особей появятся явные признаки беременности; после этого самку отделяют, с тем чтобы самка далее могла получать свой полный рацион липидов. Потомство отучают от материнского молока в возрасте 24 дня.
5.2,2. Жилище
Не содержащих антигены производителей помещают парами в одной половине стандартной клетки для мышей, изготовленной из поликарбоната, с размерами 28x17,8x12,7 см. Дно вырезают и заменяют на фальшивое дно, изготовленное из сетки из нержавеющей стали. Продольная разделительная перегородка из нержавеющей стали крепится болтами к концам пластиковой клетки, выступая достаточно далеко вверх и за пределы, чтобы удержать на месте проволочную крышку из нержавеющей стали. Эта крышка с углублением, которая обычно вставляется в клетку, перевертывается так, чтобы над фальшивым дном появилось дополнительное пространство. На верхнюю часть крышки приваривают петли из нержавеющей стали соответствующего размера, чтобы в них можно было закрепить бутылочки емкостью 60 мл. По сторонам продольной перегородки на половине расстояния от фальшивого дна до верха клетки приваривают чашки из нержавеющей стали. (Рисунок клетки приведен в статье J.R. Pleasants "The germ-free system for aging and immunity", in "CRC Handbook of Immunology in Aging" (M. M. Kay, T. Makinodan, eds. ), pp. 257-297, CRC Press, Boca Raton, F1, (1981)). Бутылочки с пищей изготовлены из стекла коричневого цвета. Как бутылочки с пищей, так и бутылочки с водой имеют пластмассовые крышки, в центре которых просверлены отверстия. Бутылочки заполняют и переворачивают в их петлях. Липидную добавку отмеряют ежедневно в чашки из нержавеющей стали. Под каждую клетку помещают поддон для сбора отходов.
Фильтровальная бумага, которая служит и как подстилка, и как съедобное волокно, представляет собой обеззоленную фильтровальную ватманскую бумагу номер 41, которую покупают в виде обрезков ("Sargent Welch"). Для подстилки бумагу режут на полоски. Неразрезанные куски бумаги квадратной формы используют для уборки изолятора. Бумагу обрабатывают в автоклаве в течение 25 минут при температуре 12oC или облучают дозой 4,5 Мрад в пластиковых пакетах. Всем мышам в одном из углов клетки стелят достаточное количество бумаги. Бумагу заменяют, когда она становится влажной, желтой или грязной.
Клетки помещают внутрь гибкого изолятора Трекслера размером 1,37x0,60 м (P. C. Trexler, Lab.Anim.Care, 13, 572-581)) и применяют стандартную гнотобиологическую лабораторию (см. B.S.Wostman Ed., "Gnotobiotics Standards and Guideliner for the Breeding, Care and Management of Laboratory Animals", National Research Council, National Academy of Sciences, Washington, D.C.). Изоляторы помещают в комнату с температурой 21oC и расписанием по 12 часов темного и светлого времени.
К верхней части изолятора приклеивают трубку из тигона диаметром 2,5 см и длиной 7,55 см, которая сверху и снизу закрыта виниловыми крышками. Она служит в качестве канала для стерильного фильтрования пищи, воды и масла.
5.2.3. Пища
В Таблице 1 указан состав пищи и последовательность растворения ингредиентов в подвергнутой ультрафильтрации воде Milli-Q ("Millipore", штат Массачусетс). Аминокислоты и декстрозу получают от компании "Sigma"; они соответствуют по чистоте препаратам, применяемым при выращивании культур. Витамины также получают от компании "Sigma", за исключением чистого ретинилпальмитата, который любезно предоставлен компанией "Hoffman-La Roche, Inc." (Натли, штат Нью-Джерси). Чистота других реагентов сертифицирована по Фишеру или имеет аналогичное качество. Полностью растворимую в воде пищу фильтруют в холодном виде через ультрафильтр Amicon Diaflo TC3 с использованием трех мембран Pm10 с диаметром 150 мм ("Amicon").
Величина отсечки мембраны ультрафильтра составляет 10000 дальтон. Аппарат ультрафильтра после сборки стерилизуют перед использованием, пропуская через него 0,15%-ный раствор гипохлорита натрия с последующей тщательной промывкой. Подвергнутую ультрафильтрации пищу до использования хранят при температуре 4oC в стерильных емкостях. Пищу вносят в не содержащий антигенов изолятор с помощью 0,2 мкм фильтра из найлона ("MSI"), размещенного в держателе друг-фильтра автоклава, который представляет собой трубку погружного типа с пробкой номер 6 из неопрена. С этой целью верхнюю виниловую пробку в трубке из тигона убирают и внутрь трубки подают стерилизующий раствор 2%-ной надуксусной кислоты, содержащий 0,1% алкиларилсульфоната. Пробку фильтродержателя размещают вместо верхней пробки. Через 20 минут удаляют нижнюю пробку (внутри изолятора) и пищу или воду фильтруют внутрь изолятора под избыточным давлением 20 фунтов на кв.дюйм (137,9 кПа) азота.
Состав липидной добавки представлен в Таблице 2. Соевые триглицериды представляют собой препарат, полученный из тех метиловых эфиров, которые после вакуумной перегонки в интервале температур дают эфиры от пальмитата до линолената. Полученные эфиры затем подвергают переэтерификации с глицерином и получают смесь триглицеридов ("NuChek Prep", Элизиан, штат Миннесота). Перед фильтрованием смеси в изолятор к глицеридам добавляют растворимые в масле витамины, при этом ее разогревают до температуры 50oC, а затем фильтруют в изолятор аналогично методике, приведенной для фильтрования растворимой в воде порции пищи.
Потребление липидов оценивают в 0,375 мл/день. Увеличение липидной добавки приводит к значительному снижению смертности новорожденных мышей. Средний размер потомства также возрастает по сравнению с животными, выращиваемыми в обычных условиях. Кормящие самки получают двойную порцию липидной добавки.
Примечание к Таблице 1:
(1) Состав солей солевой смеси 35D приведен в Таблице 3.
(2) Добавляют дополнительно к селенату натрия, содержащемуся в смеси солей 35D.
(3) Состав смеси 111E5 витаминов B представлен в Таблице 4.
(4) Добавляют дополнительно к витамину B-12, входящему в состав смеси 111E5 витаминов B (см. далее в Примерах).
Вода представляет собой подвергнутую ультрафильтрации воду Milli-Q, и ее фильтруют в изолятор так же, как и пищу.
5.2.4. Микробиологический мониторинг
Не содержащую антигенов систему испытывают на наличие микробиологических загрязнений по методике, приведенной в B.S.Wostman, Ed. (1970), "Gnotobiotes: Standards and Guidelines for the Breeding, Care and Management of Laboratory Animals", National Research Council, National Academy of Sciences, Washington, D.C. Если коротко, то тампонами, смоченными в пище и воде внутри изолятора, берут свежие фекальные мазки от мыши и отходов, накопившихся под каждой клеткой. Берут мазки также со стен изолятора, в частности вокруг загрузочных отверстий. Каждый раз берут по два мазка. Один набор подвергают непосредственному исследованию под микроскопом на наличие бактерий и грибков с использованием грам-красителя. Второй набор мазков используют для определения микроорганизмов. Прежде чем установить негативность культуры дают пройти трем неделям.
Микробиологические тесты проводят приблизительно каждые две недели или через несколько дней после размещения в изоляторе новых животных.
5.3. Получение моноклональных антител от не содержащих антигенов мышей
Вышеописанных не содержащих антигенов мышей используют в качестве доноров лимфоцитов при получении моноклональных антител. Растворы всех антигенов готовят в стерильных условиях в вытяжном шкафу с ламинарным потоком.
При вакцинации не имеющей антигенов мыши применяют следующую методику. Антиген (25-50 мкг) растворяют в стерильном физиологическом солевом растворе (100 мкл) и эмульгируют с помощью равного объема полного адъюванта Фрейнда. Перед получением эмульсии в раствор добавляют интерферон (1000 единиц). Для всех вакцинаций используют стерильные шприцы и иглы. Шприцы переносят в не содержащий антигенов изолятор через загрузочное отверстие и там их стерилизуют, спрыскивая 2%-ным раствором надуксусной кислоты. Проводят инъекции активатора, используя то же количество антигена, заменив полный адъювант Фрейнда на неполный адъювант Фрейнда. Проводят три активакционные вакцинации, каждую с интервалом в три недели. Конечное количество активатора (без адъюванта) назначают за 4-7 дней до проведения слияния. Все вакцинации проводят внутрибрушинно. Мышей извлекают из изолятора в день проведения слияния и мгновенно умерщвляют, удушая их углекислым газом. Удаляют селезенки и сливают селезеночные макрофаги с миеломными клетками мыши (NS1), используя стандартную гибридомную технологию.
5.4. Использование системы не содержащего антигенов животного для получения фибрин-специфичного моноклонального антитела
Не содержащая антигенов система используется для генерирования фибрин-специфичного моноклонального антитела. Антитело является высокоспецифичным и не распознает фибриноген, продукты распада фибрина или продукты распада фибриногена. Гибридомная клеточная линия продуцируется слиянием макрофагов селезенки от содержащих антигены мышей BALB/c, вакцинированных фибрином человека, и миеломных клеток NS1.
5.4.1. Расписание проведения вакцинаций
Трех не содержащих антигенов самок мышей в возрасте восьми недель вакцинируют 33 микрограммами препарата фибрина человека. Препарат представляет собой замороженный образец измельченного фибрина, который получают следующим образом.
Фибриноген человека превращают в фибрин с помощью тромбина и фактора XIIIa. Сгусток фибрина затем замораживают в жидком азоте и механически растирают в очень тонкий порошок. Замороженный измельченный фибрин диспергируют в физиологическом солевом растворе и получают прозрачный раствор сшитого фибрина XL-Fn с конечной концентрацией 1 мг/мл. Для вакцинации животного используют 33 мкл этого антигена фибрина. Объем раствора антигена доводят до 100 мкл с помощью стерильного физиологического солевого раствора и эмульгируют с помощью полного адъюванта Фрейнда, как это указано в предыдущем разделе. Активирующие вакцинации проводят с интервалами в три недели, используя одинаковые концентрации антигена в неполном адъюванте Фрейнда. Последнюю активацию проводят за 4 дня до слияния. Используют ту же концентрацию антигена, а адъювант заменяют на физиологический солевой раствор.
5.4.2. Обнаружение и определение содержания антитела
Качественное и количественное определение содержания антитела проводят с помощью ферментного иммуносорбентного анализа (ELISA). Иммуносорбентные анализы проводят, используя фибрин человека, иммобилизованный на поливинилхлоридном планшете с 96 ячейками ("Costar"). Покрытые фибрином ячейки для проведения анализа готовят путем выдерживания в инкубаторе 100 мкл раствора фибриногена ("Kabi", класс чистоты L) (50 мкг/мл борат/солевой буфер) в течение ночи при температуре 4oC. Несвязанный фибрин удаляют промывкой забуференным фосфатом солевым физиологическим раствором, содержащим 0,05% Tween 80. Фибриноген, покрывающий каждую пластиковую ячейку, превращает в фибрин, выдерживая его в инкубаторе с 100 микролитрами раствора тромбина (10 единиц Национального института здоровья США на 1 мл), содержащего 2 мМ раствора хлорида кальция, в течение 1 ч при температуре 37oC. Стандартные калибровочные кривые для антигена строят, используя препарат антитела, который является гомогенным по данным электрофореза в геле полиакриламид-додецилсульфонат натрия (SDS-PAGE).
Для предотвращения неспецифичного связывания покрытые фибрином планшеты термостатируют в 1%-ном растворе бычьего сывороточного альбумина в забуференном солевом физиологическом растворе с pH 4. Затем добавляют растворы, содержащие антитело (100 мкл), и выдерживают в инкубаторе при температуре 37oC в течение 90 минут. По окончании каждой стадии процедуры ячейки тщательно промывают с помощью забуференного фосфатом физиологического раствора, содержащего Tween 80. Связавшееся антитело определяют, добавляя разбавленное в 1000 раз антитело кролик - анти-мышь, связанное с алкалинфосфатазой ("Sigma"), разбавленной забуференным физиологическим раствором, содержащим 1% бычьего сывороточного альбумина, с pH 8,0.
5.4.3. Получение гибридом - слияние
Мышей умерщвляют удушением в углекислом газе и немедленно проводят удаление селезенки. Клетки селезенки вакцинированных мышей сливают, используя в качестве среды для проведения слияния полиэтиленгликоль 4000 (3000-3700). Клетки выдерживают в инкубаторе в селективной среде HAT в T-колбе в течение 1 недели. По истечении указанного срока клетки помещают на планшеты с 5x96 ячейками, из которых 93 показывают рост. Из них 19 ячеек показывают положительную реакцию на антиген фибрина. Один из этих клонов, F492D8 (позднее переименованной в MH1), продуцирует антитело, которое распознает антиген фибрина, однако не дает перекрестной реакции с фибриногеном. Этот клон, MH1, трижды подергают повторному клонированию путем ограниченного разбавления тройной фазой для клонирования, которое проводят для одной клетки на ячейку. После стабилизации клеточной линии ее переносят в бессывороточную среду, и клеточная линия продуцирует антитело с концентрацией приблизительно 7,5 мг/л.
5.4.4. Очистка моноклонального антитела
Перед очисткой (порции по 4 л) жидкости над осадками тканевой культуры центрифугируют для удаления клеточных остатков и отфильтровывают через 0,8 мм найлоновую мембрану для удаления каких-либо остатков исходных материалов. Жидкость над гибридомой концентрируют при температуре 4oC до объема 500 мл, используя мембрану типа YM ("Amicon") в качестве системы ультрафильтрации со спиральной намоткой, которая отсекает молекулы с молекулярным весом 30000. Замену буфера на 20 мМ раствор 2-(N-морфолин)этансульфоновой кислоты с pH 6 (буфер A) проводят методом диафильтрации в соответствии с рекомендациями производителя. После дальнейшего концентрирования до конечного объема 100 мл раствор антитела перед продолжением очистки фильтруют через найлоновую мембрану 0,451 микрон. Концентрированный раствор антитела очищают методом жидкостной хроматографии на жидкостном хроматографе высокого разрешения фирмы "Waters", используя колонку ABx размером 7,75 мм • 10 см ("J.T. Baker", Филиппсбург, штат Нью-Джерси). Колонку уравновешивают буфером A и помещают образец (100 мл) со скоростью подачи 1,0 мл/мин. После интенсивного промывания буфером A антитело элюируют из колонки в градиенте буфер A - 100% буфера B (1 М ацетат натрия с pH 7) со скоростью подачи 1 мл/мин. Собирают фракции (по 2 мл) и те из них, которые содержат моноклональное антитело (по данным ферментного иммуносорбентного анализа), объединяют и подвергают диализу по отношению к забуференному фосфатом физиологическому солевому раствору (20 мМ фосфата натрия, 150 мМ хлорида натрия, pH 7,4) и хранят при температуре минус 20oC с концентрацией > 1 мг/мл. Колонку ABx регенерируют промывкой в течение 5 минут 100%-ным буфером B с последующим уравновешиванием промывкой буфером A в количестве, равном 15 объемам колонки.
5.5. Определение специфичности по отношению к фибрину
Первичное определение специфичности но отношению к фибрину проводят путем отбора жидкостей над гибридомами отдельно из микропланшетов, покрытых фибрином, и планшетов, покрытых фибриногеном. Приемлемыми являются только те продуцирующие антитело клеточные линии, которые не дают перекрестной реакции с фибриногеном.
Дальнейшее подтверждение специфичности по отношению к фибрину проводят, используя конкурентный анализ с фибриногеном в растворе, подтверждая тем самым, что антитело не распознает фибриноген в растворе.
Конкурентный анализ, подтверждающий специфичность антитела по отношению к фибрину, проводят так же, как описано ранее для ферментного иммуносорбентного анализа, предварительно выдерживая в инкубаторе антитело вместе с фибриногеном в растворе. Если коротко, то жидкость над осадком гибридомы выдерживают в инкубаторе при температуре 37oC в течение 30 минут с раствором фибриногена в физиологической концентрации (4 мг/мл), содержащем бычий сывороточный альбумин (10 мг/мл), с целью помешать неспецифическому связыванию антигена к фибриногену. Раствор фибриноген/антитело затем переносят в ячейки микропланшета, покрытые фибрином. К ингибитору фибрина добавляют GlyProArgPro, чтобы предотвратить возможную полимеризацию фибриногена под действием остаточного тромбина на стенках ячейки. Затем проводят анализ как обычный ферментный иммуносорбентный анализ для антитела, связанного с иммобилизованным антигеном. Во всех экспериментах на определение специфичности антитела MH1 по отношению к фибрину в качестве контрольного соединения используют второе антитело 45J. 45J дает прекрасную реакцию с фибрином и фибриногеном.
5.5.1. Определение перекрестного взаимодействия с фибриногеном
5.5.1.1. Иммобилизованный фибрин и фибриноген
Клеточная линия MH1 продуцирует мышиное моноклональное антитело, которое дает перекрестную реакцию с фибрином, иммобилизованным на поверхности поливинилхлоридного планшета для микротитрования (Таблица 5). В том же анализе антитело не распознает иммобилизованный на планшетах фибриноген. Как показывают данные, представленные в Таблице 5, иммунореактивность резко возрастает, как только фибриноген превращается в фибрин под действием тромбина, что очевидно указывает на воздействие или образование неоэпитопа в молекуле фибрина. В то же время контрольное антитело, 35J, явно распознает эпитоп, который сохраняется при превращении фибриногена в фибрин.
5.5.1.2. Конкурентный анализ с фибрином и фибриногеном
Специфичность антитела, антитела MH1, по отношению к фибрину далее демонстрирует конкурентный анализ, в котором жидкость над гибридомой перед проведением иммуноферментного твердофазного анализа в ячейках, покрытых фибрином, предварительно выдерживают в инкубаторе с раствором фибриногена (с конечной концентрацией 4 мг/мл). Поскольку в этом конкурентном анализе используют высокую концентрацию фибриногена (x500 по отношению к концентрации антитела), то к смеси добавляют бычий сывороточный альбумин (с конечной концентрацией 10 мг/мл). С целью предотвращения полимеризации фибрина под действием остаточного количества тромбина на покрытых фибрином ячейках добавляют пептид GlyProArgPro. Результаты этого анализа показывают, что антитело MH1 не распознает фибриноген в растворе (Таблица 6).
Если допустить, что в каждой ячейке микропланшета связывается 400 нг фибрина, то используемое содержание фибриногена в данном конкурентном анализе в 1000 раз превышает количество связанного антигена фибрина. Кроме того, он соответствует 400-кратному избытку содержания антитела в жидкости над осадком тканей.
5.2.2. Определение способности к перекрестному взаимодействию с продуктами распада фибрина (фибриногена)
Продукты распада фибриногена получают выдерживая фибриноген вместе с плазмином в инкубаторе с температурой 37oC от 10 минут до 3 часов. В нужное время фибриногенолиз прерывают добавлением тразилола (100 единиц ингибитора калликреина в миллилитре) и 20 мМ эпсилон-аминокапроновой кислоты.
Сшитые продукты распада фибрина (XLFDP) получают добавлением тромбина (4 единицы Национального института здоровья США на 1 мл) к раствору фибриногена (5 мг/мл в физиологическом солевом растворе с буфером Tris (pH 7,4, 50 мМ Tris HCl, 150 мМ NaCl), содержащем 10 мМ хлорида кальция, плазминоген (0,25 мг/мл) и урокиназу (50 м.е./мл). Смесь выдерживают в инкубаторе при температуре 37oC и ферментацию фибрина прерывают через различные промежутки времени, как указано ранее для продуктов распада фибриногена.
Для определения способности антитела к перекрестной реакции с продуктами распада фибрина и продуктами распада фибриногена соответствующие продукты распада помещают в планшеты для микротетрирования и проводят ферментный иммуносорбентный анализ по обычной методике. Как указано в Таблице 7, антитело MH1 не вступает в перекрестное взаимодействие с любыми продуктами распада фибриногена, образующимися под действием фибрина. Как указано в Таблице 8, антитело не вступает в перекрестное взаимодействие с продуктами распада XL-фибрина. Аналогичная картина наблюдается, когда антитело исследуют на предмет перекрестной реакции по методу вестерн-блоттинга.
Можно сделать вывод, что антитело распознает эпитоп исходной молекулы фибрина, который отсутствует или не образуется в молекуле предшественника, фибриногена. Вероятно, как следует из Таблицы 8, эпитоп разрушается при ферментации сшитого фибрина под действием плазмина.
Таким образом, антитело MH1 представляет собой фибрин-специфичное моноклональное антитело, которое может быть охарактеризовано следующим образом: в соответствии с настоящим изобретением, фибрин-специфичным моноклональным антителом является моноклональное антитело, которое:
1. В конкурентном анализе на определение способности к перекрестной реакции с фибрином и фибриногеном, как указано ранее, моноклональное антитело обладает приблизительно менее 75%, преимущественного приблизительно менее 10% от способности к перекрестной реакции с фибриногеном, когда количество используемого фибриногена в 1000 раз превышает количество используемого фибрина.
2. В конкурентном анализе на определение способности к перекрестной реакции со сшитым фибрином и продуктами распада фибрина, как указано ранее, реакционноспособность моноклонального антитела по отношению к фибрину, подвергнутому ферментативному воздействию плазмина в течение приблизительно 3 ч, составляет приблизительно менее 50%, преимущественно приблизительно менее 40% от реакционноспособности моноклонального антитела по отношению к фибрину в момент времени ноль.
3. В конкурентном анализе на определение способности к перекрестной реакции с фибриногеном и продуктами распада фибриногена, как указано ранее, реакционноспособность моноклонального антитела по отношению к фибриногену, подвергнутому ферментативному воздействию плазмина в течение приблизительно 4 ч, не превышает реакционноспособность моноклонального антитела по отношению к фибриногену в момент времени ноль.
Антитело MH1 далее характеризуется своей аффинностью по отношению к фибрину. Аффинность определяют по анализу Скэтчарда (Frankel et al., Molecular Immunology, 16, 101-106 (1979)), используя антитело MH1, содержащее метку 125I. Значение константы диссоциации KD составляет 6,7•10-10 М. Эта аффинность приблизительно в 5000 раз превышает сродство t-PA к фибрину.
Анализом по методу вестерн-блоттинга было также показано, что антитело MH1 не вступает в перекрестную реакцию с Aα, Bβ или гамма-цепями фибриногена. С использованием того же метода было установлено, что антитело MH1 не вступает в перекрестную реакцию с обработанными тромбином Aα, Bβ или гамма-цепями фибриногена. (Обработка фибриногена тромбином приводит к высвобождению фибринопептида A и фибринопептида B из A-цепи и B-цепи соответственно, с образованием альфа-цепи и бета-цепи фибрина).
Далее, результаты, приведенные в Таблице 7, показывают, что контрольное антитело, антитело 45J, связывается с фибриногеном и не вступает в перекрестную реакцию с продуктами распада фибриногена. Таким образом, подобное моноклональное антитело является фибриноген-специфичным моноклональным антителом и является еще одной целью настоящего изобретения. Фибриноген-специфичное моноклональное антитело можно использовать в любом иммуноанализе, который может применяться для определения содержания фибриногена в плазме в условиях in vitro. Антитело 45J отличается тем, что, как было обнаружено, эпитоп 45J находится на альфа-цепи фибриногена в районе приблизительно от 206 аминокислоты до приблизительно 424 аминокислоты, а наиболее вероятно в районе приблизительно от 207 аминокислоты до приблизительно 231 аминокислоты. В соответствии с настоящим изобретением фибрин-специфичное моноклональное антитело представляет собой антитело, которое в анализе по определению способности вступать в перекрестную реакцию с фибриногеном и продуктами распада фибриногена, как указано ранее, демонстрирует реакционноспособность по отношению к фибриногену, подвергнутому ферментативному воздействию плазмина в течение приблизительно 40 минут, которая составляет приблизительно 50% от реакционноспособности моноклонального антитела по отношению к фибриногену в момент времени ноль.
Гибридому 45J получают обычными методами с использованием обычных мышей Balb/c, при этом мышей вакцинируют фибрином. Однако фибриноген также может быть использован в качестве антигена.
5.3.3. Определение способности к перекрестному взаимодействию с несшитым фибрином и сгустками несшитого фибрина
С использованием метода ферментного иммуносорбентного анализа было показано, что антитело MH1 вступает в перекрестную реакцию не только со сшитым фибрином (XLFn), но и несшитым фибрином (NONXLFn). Ферментный иммуносорбентный анализ проводят следующим образом:
1. Планшет для микротитрования с 96 ячейками покрывают 100 мкл раствора фибриногена (50 мкг/мл в забуференном боратом физиологическом растворе с pH 8,5) в течение ночи при температуре 4oC.
2. Сшитый фибрин получают в покрытых фибриногеном ячейках путем выдерживания в инкубаторе в течение 1 ч при температуре 37oC вместе с раствором тромбина (10 единиц Национального института здоровья США в 1 мл) в физиологическом солевом растворе с буфером Tris (pH 7,4, 50 mM Tris HCl, 150 mM NaCl), содержащем 2 мМ хлорида кальция и 10 мМ цистеина.
3. Несшитый фибрин получают в покрытых фибриногеном ячейках выдерживанием в инкубаторе в течение 1 ч при температуре 37oC вместе с раствором тромбина (10 единиц Национального института здоровья США в 1 мл) в фосфатном буфере (pH 6,1), содержащем ЭДТК с конечной концентрацией 0,0125 М.
4. Связанное антитело определяют выдерживанием в инкубаторе с антимышиным конъюгатом алкалинфосфатазы. Связанный конъюгат определяют добавлением субстрата щелочной фосфатазы и протекание колориметрической реакции контролируют с помощью автоматического устройства на длине волны 405 нм.
Результаты анализа приведены в Таблице 9 и из них можно заключить, что способность антитела к перекрестной реакции со сшитым фибрином сильнее, чем способность к перекрестной реакции с несшитым фибрином. Простейшее объяснение может заключаться в том, что ковалентное перекрестное связывание, существующее в сшитой структуре, служит, чтобы запереть или заморозить конформацию, которую распознает антитело. В несшитых образцах эта конформация, хотя она и образуется, не стабилизирована ковалентными связями полимера.
Было также показано, что антитело вступает в перекрестную реакцию как со сшитыми, так и несшитыми сгустками, полученными в условиях in vitro. Сшитый фибрин получают, выдерживая в инкубаторе раствор фибриногена (в физиологическом солевом растворе с буфером Tris (50 мМ, pH 7,4), содержащем 2 мМ хлорида кальция и 10 мМ цистеина) с тромбином (10 единиц Национального института здоровья США в 1 мл) в течение 3 ч при температуре 37oC. Несшитый фибрин получают выдерживая в инкубаторе раствор фибриногена (3 мг/мл) в фосфатном буфере (pH 6,1), содержащем ЭДТК с конечной концентрацией 0,0125 М, с тромбином (10 единиц Национального института здоровья США в 1 мл) в течение 3 ч при температуре 37oC. По завершении образования сгустков их промывают и выдерживают в инкубаторе при температуре 37oC с 400 мкл 1%-ного раствора бычьего сывороточного альбумина, содержащего
антитело MH1 с меткой 125I. В различные промежутки времени берут небольшие аликвоты и количество связанного антитела определяют в плазме с помощью счетчика гамма-излучения.
В Таблице 10 приведены данные по связыванию антитела как несшитыми, так и сшитыми сгустками.
5.6. Депонирование гибридомы
MH1 и 45J депонированы в Американской коллекции типовых культур (ATCC) 9 июня 1988 и получили регистрационные номера HB 9739 и HB 9740 соответственно. Адрес Американской коллекции типовых культур - 12301 Parklawn Drive, Rockville, MD, 20852. Антитело MH1 представляет собой антитело IgG1 с легкой каппа-цепью, и было показано, что MH1 вступает в перекрестную реакцию не только с фибрином человека, но и фибрином кролика.
Настоящее изобретение не ограничивается количеством депонированных гибридом, а они служат лишь примером гибридом, которые продуцируют фибрин-специфичное моноклональное антитело и фибриноген-специфичное моноклональное антитело, как это описано ранее. Любая функционально эквивалентная клеточная линия входит в объем притязаний по настоящему изобретению. Термин "функционально эквивалентная" обозначает, что антитело способно конкурировать с антителом MH1 или антителом 45J при связывании к эпитопу фибрина, к которому присоединяется антитело MH1, или к эпитопу фибриногена, к которому присоединяется антитело 45J, соответственно. Далее, этот термин охватывает фибрин-специфичные моноклональные антитела и фибриноген-специфичные моноклональные антитела, как указано ранее, которые присоединяются к эпитопу, отличному от эпитопа, к которому присоединяется антитело MH1, или к эпитопу, к которому присоединяется антитело 45J, соответственно.
5.7. Использование фибрин-специфичных моноклональных антител для диагностики в условиях in vivo и в терапии
5.7.1. Локализация заболевания сгусток/сосуд
Фибрин-специфичные моноклональные антитела по настоящему изобретению способны отмечать сгустки фибрина или агрегацию фибрина в условиях in vivo. Поэтому их можно использовать для локализации возможных повреждений тканей или сосудов у человека и для контроля за заболеваниями сосудов. Фибрин-специфичное моноклональное антитело особенно предпочтительно для использования в указанных целях, поскольку указанное моноклональное антитело не соединяется с фибриногеном, продуктами распада фибрина и продуктами распада фибриногена, тем самым уменьшая фоновое взаимодействие и позволяя точнее локализовать сгусток фибрина или агрегацию фибрина.
Для этих целей предпочтительнее использовать очищенные моноклональные антитела. Очистку преимущественно проводят методами жидкостной хроматографии высокого разрешения. Очистка моноклональных антител для назначения человеку может также включать очистку путем осаждения сульфатом аммония или сульфатом натрия с последующим диализом по отношению к физиологическому солевому раствору и стерилизацией фильтрованием. В качестве альтернативы для очистки моноклональных антител можно использовать методы иммуноаффинной хроматографии.
Очищенные моноклональные антитела можно пометить радиоактивными соединениями, например изотопами 123I, 125I, 131I, 99mTc, 111In, и назначать пациенту внутривенно. Антитело может также содержать метку магнитной пробы. Точное местоположение сгустка можно затем определить методом ядерного магнитного резонанса. После локализации антител в сгустке или агрегате фибрина их можно обнаружить методом эмиссионной томографии и сканирования радиоактивных ядер, тем самым устанавливая местоположение, например, тромба или опухоли, покрытой тромбином.
В качестве иллюстрации: очищенное моноклональное антитело суспендируют в подходящем носителе, в частности физиологическом солевом растворе, содержащем или не содержащем альбумин человека, с соответствующей дозировкой, и назначают пациенту. Моноклональное антитело предпочтительно назначают внутривенно, в частности, непрерывным вливанием в течение нескольких часов.
5.7.2. Лечение заболеваний сосудов конъюгатом моноклонального антитела
Моноклональные антитела по настоящему изобретению могут использоваться совместно с широким кругом фармацевтических средств, таких как цитотоксические реагенты и тромболитические реагенты, в частности t-PA, урокиназа, стрептокиназа и другие протеазы, способные к лизингу фибрина. Это применение является особенно предпочтительным, поскольку фибрин-специфичные моноклональные антитела по настоящему изобретению позволяют весьма эффективно использовать указанные реагенты, т.к. ни один из этих реагентов не будет потерян вследствие связывания с фибриногеном, продуктами распада фибрина или продуктами распада фибриногена. Различные обзоры по этому вопросу см. Bale et al. , 1980, Cancer Research, 40: 2965-297; Ghose and Blair, 1978, J.Natl. Cancer Inst. , 61(3): 657-676; Gregoriadis, 1977, Nature, 265:407-411; Gregoriadis, 1980 Pharmac. Ther., 10:103-108; Trouet et al., 1980, Recent Results Cancer Res., 75:229-235.
Методы, которые используются для связывания указанных агентов с моноклональным антителом, могут включать образование как нековалентных, так и ковалентных связей. Поскольку нековалентные связи могут разрушиться быстрее, чем комплекс антитела достигнет мишени, то ковалентные связи более предпочтительны. Например, между карбонильными группами фармацевтического агента и аминогруппами молекулы антитела могут быть образованы карбодиимидные связи. Бифункциональные агенты, такие как диальдегиды или имидоэфиры, могут использоваться для связывания аминогруппы лекарства с аминогруппой молекулы антитела. Для связывания лекарства с молекулой антитела могут использоваться реакции образования оснований Шиффа. Этот метод включает окисление лекарства или цитотоксического средства, содержащего гликолевые или гидроксильные группы под действием перйодата с образованием альдегида, который затем реагирует с молекулой антитела. Присоединение осуществляется за счет образования основания Шиффа с аминогруппой молекулы антитела. Кроме того, лекарства, содержащие реакционноспособные сульфгидрильные группы, связывают с молекулами антитела.
6. Обнаружение и определение концентрации растворимого фибрина в условиях in vitro
6.1. Предпосылки
Как указано ранее (см. Раздел 5.1.), механизм остановки кровотечения включает сложную последовательность реакций, в процессе которых фибриноген полностью превращается в фибрин под действием тромбина. Конечным результатом указанных реакций является образование тромба (сгустка крови). Последовательность реакций в упрощенном виде можно представить в виде трехстадийного процесса.
Стадия 1 - протеолиз: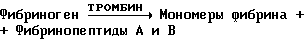
Стадия 2 - полимеризация: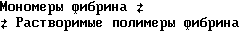
Стадия 3 - образование сгустка: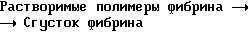
Фибриноген составлен тремя парами неидентичных полипептидных цепочек: Aα, Bβ и γ (см. L.Stryer, "Biochemistry", 3rd Edition, p. 249, W.H. Freeman and Company, New York (1988)). На первоначальной стадии, когда фибриноген превращается в фибрин, которая показана выше в виде Стадии 1, фибриноген расщепляется под действием тромбина, высвобождая фибринопептид A из имеющих аминогруппу окончаний двух Aα-цепей фибриногена. Полученный мономер представляет собой мономер DesAA фибрина. Как показано на Стадии 1, одновременно, однако более медленно, тромбин также расщепляет фибринопептид B из имеющих аминогруппу окончаний двух Bβ-цепей фибриногена. В результате высвобождения фибринопептидов на α-цепи и β-цепи фибрина появляются новые аминоконцевые участки. Как указано выше, молекулами, образовавшимися на Стадии 1, являются фибринопептид A, фибринопептид B и мономер фибрина DesAA, мономер фибрина DesAABB, показанные на схеме в качестве "мономеров фибрина" (см. W.Nieuwenhuizen, Blood Coagulation and Fibrinolysis, 4:93-96 (1993)). Как указано выше на Стадии 2, мономеры фибрина далее образуют как нековалентные (несшитые) и ковалентные (сшитые) полимеры с образованием растворимых полимеров фибрина. Как показано на Стадии 3, растворимые полимеры фибрина затем образуют сгусток фибрина.
Растворимым фибрином называют всякий молекулярный фрагмент, получаемый из фибриногена, или фибрин, который может привести к образованию полимера фибрина, или любой молекулярный фрагмент, получаемый из фибрина (фибриногена), молекулярный вес которого больше, чем молекулярный вес нативного фибриногена, который содержится в растворенном виде в крови.
Несшитые и сшитые полимеры фибрина DesAABB, образующиеся на Стадии 2, представляют собой два из нескольких производных растворимого фибрина, а также являются двумя фрагментами растворимого полимера фибрина. Кроме того, термин растворимый фибрин включает другие соединения, например полимеры фибрина DesAA, комплексы, образованные взаимодействием мономеров фибрина (как мономеров фибрина DesAA, так и DesAABB), и продукты распада фибриногена X, Y, D и У (см. выше раздел 5.1. для описания этих продуктов распада), а также, например, мономеры DesAA и DesAABB в виде комплекса с фибриногеном (см. Nieuwenhuizen pp. 93-94).
Растворимые фибриновые полимеры являются непосредственными предшественниками нерастворимого фибрина, т.е. сгустка, и, таким образом, содержание растворимых полимеров в плазме, как полагают, возрастает у пациентов, подверженных тромбозу или которым грозит тромбоз (образование тромба внутри сосуда). Обнаружение и определение содержания количества указанных полимеров в крови, в частности растворимых полимеров DesAABB, могло бы поэтому быть полезным в качестве индикации начала образования сгустка крови (см. Bang and Chang, pp. 119-121; Nieuwenhuizen, p. 94; Marder et al. , патент США 5206140).
Некоторые фрагменты растворимого фибрина ранее обнаруживали, а также определяли их содержание, используя различные методы, в том числе, например, определение содержания фибринопептида A, определение с применением антител к эпитопам Aα и γ, образующимся при превращении фибриногена в фибрин, Nieuwenhuizen, 94-96, и определение содержания D-димеров. Marder et al., патент США 5206140. Другие методы, применявшиеся для обнаружения или для определения содержания растворимого фибрина, включают определение величины агглютинации эритроцитов, покрытых фибрином, в присутствии растворимого фибрина, эксклюзионную гель-хроматографию, усиление плазминогенной активности посредством активатора плазминогена t-PA (см. Nieuwenhuizen, p. 94), гелеобразование под действием этанола или сульфата протамина. N-концевой анализ фракций фибриногена, выделенных из плазмы, включение этилового эфира глицина, содержащего метку 14C, и гель-хроматографию на агарозе (см. Bang and Chang, p. 111-118). Ни один из этих тестов не позволит обнаружить и специфично определить содержание как растворимых сшитых полимеров, так и растворимых несшитых фибриновых полимеров.
6.2. Анализ в условиях in vitro растворимых сшитых фибриновых полимеров и растворимых несшитых фибриновых полимеров.
Настоящее изобретение основывается на том открытии, что можно провести анализ в условиях in vitro с целью обнаружить и определить содержание количества растворимых несшитых фибриновых полимеров DesAABB, составленных из фибриновых мономеров DesAABB, в аналитической системе, в которой не обнаруживаются (a) фибриноген, (b) продукты распада фибриногена, (c) фибриновые мономеры DesAA, (d) фибриновые полимеры DesAA, (e) фибриновые мономеры DesAABB, (f) сшитый фибриноген (фибриноген, обработанный фактором XIIIa), (g) комплексы фибриновый мономер DesAA - фибриноген и (h) продукты распада фибрина ("фрагменты (a)-(h)"). Продукты распада фибриногена и продукты распада фибрина возникают при ферментативном воздействии плазмина на фибриноген или фибрин, как это описано ранее в разделе 5.5.2.
Мы полагаем, что вышеописанный анализ особенно полезен при клинической диагностике состояний, определяемых тромбозом.
Анализ проводят, используя любой подходящий образец жидкости, циркулирующей внутри организма, однако его предпочтительно проводят, используя кровь млекопитающих. Подходящими млекопитающими являются, например, кролики, обезьяны и люди, при этом люди являются предпочтительными.
При проведении указанного анализа в условиях in vitro можно применять любые методы, известные или которые будут разработаны, для обнаружения растворимых сшитых фибриновых полимеров DesAABB и растворимых несшитых фибриновых полимеров DesAABB, при этом эти методы не могут обнаружить фрагменты (a)-(h). После их обнаружения содержание растворимых сшитых фибриновых полимеров DesAABB и растворимых несшитых фибриновых полимеров DesAABB в образце можно определить сравнивая с контрольным образцом или используя стандарт с известным содержанием растворимых сшитых фибриновых полимеров DesAABB и растворимых несшитых фибриновых полимеров DesAABB, при этом эти указанные стандарты не содержат фрагменты (a)-(h).
Следует отметить, что средствами определения являются любые средства, с помощью которых можно определить присутствие в образце представляющего интерес соединения. Предпочтительным средством определения является антитело по отношению к растворимому сшитому фибриновому полимеру DesAABB и растворимому несшитому фибриновому полимеру DesAABB, при этом антитело не вступает в перекрестную реакцию с (a) фибриногеном, (b) продуктами распада фибриногена, (c) фибриновыми мономерами DesAA, (d) фибриновыми полимерами DesAA, (e) мономеров DesAABB, (f) сшитыми фибриногеном (g) комплексом фибриновый мономер DesAA - фибриноген и (h) продуктами распада фибрина. Указанное антитело можно использовать для обнаружения и определения содержания в образце растворимого сшитого фибринового полимера DesAABB и растворимого несшитого фибринового полимера DesAABB. Подобные антитела включают поликлональные или моноклональные антитела, преимущественно моноклональные антитела. Антитело может быть получено от любого вида. Однако антитела преимущественно имеют человеческое или мышиное происхождение или их получают от кроликов. Далее, подобные антитела включают, однако ими не ограничиваются, химерные антитела, антитела с одиночной цепью и фрагменты моноклональных антител.
Примером такого антитела является моноклональное антитело MH1, которое описано выше в разделах 5.5.1-5.5.3, а также в разделе 5.6. Мы полагаем, что MH1, помимо того, что оно обладает вышеуказанными особенностями, не присоединяется также к комплексу фибриноген - продукт распада фибрина. Это свойство MH1 может повысить его эффективность как средства обнаружения и определения растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB.
Следует также отметить, что в качестве средства обнаружения могут использоваться два или большее количество антител. Так, для обнаружения и определения содержания в образце растворимых сшитых фибриновых полимеров DesAABB и растворимых несшитых фибриновых полимеров DesAABB может использоваться сочетание антител с различной специфичностью, когда ни одно из антител само по себе не способно образовывать комплекс как с растворимыми сшитыми фибриновыми полимерами DesAABB, так и растворимыми несшитыми фибриновыми полимерами DesAABB, а два или большее количество антител могут образовывать указанные комплексы. Конечно, ни одно из антител не может вступать в перекрестную реакцию с фрагментами (a)-(h).
Следует также отметить, что когда используют антитела, то может оказаться необходимым применить антитело, специфичное по отношению к данной форме.
Для продуцирования антител различных животных-хозяев вакцинируют путем инъекции растворимыми сшитыми фибриновыми полимерами DesAABB и растворимыми несшитыми фибриновыми полимерами DesAABB в качестве антигена, и они включают в том числе, однако ими не ограничиваются, кроликов, мышей, крыс и т.п. Указанные полимеры можно селективно выделить с использованием, например, антитела MH1, связанного на колонке с сефарозой для аффинной хроматографии антигена MH1. Эти полимеры можно получить следующим образом: растворимый фибрин может быть получен в условиях in vitro добавлением небольших количеств тромбина к плазме, содержащей цитратный буфер. После подавления активности тромбина добавлением потенциального ингибитора тромбина, такого как гирудин, образцы плазмы можно поместить на колонку сефароза-NH1. Такая колонка с NH1 может быть получена связыванием антитела NH1 с сефарозой 4B ("Pharmacia"), активированной бромцианом, как это известно из области техники. См. вставку о продукции фирмы "Pharmacia" о получении колонки антитело-сефароза 4B с использованием предварительно активированной сефарозы 4B. В колонку сефароза-MH1 вначале помещают фибрин в присутствии забуференного фосфатом физиологического солевого раствора. После связывания в колонке сефароза-MH1 в присутствии забуференного фосфатом физиологического солевого раствора связанный на сефарозе-MH1 растворимый фибрин может быть элюирован с помощью раствора тиоцианата натрия. После диализа по отношению к забуференному фосфатом физиологическому солевому раствору выделенный растворимый фибриновый полимер можно хранить при температуре минус 70oC.
В сочетании с изолированными полимерами с целью усиления иммунологической ответной реакции в зависимости от видов хозяев могут использоваться различные адъюванты, которые включают, однако ими не ограничиваются, адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные соединения, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды масляные эмульсии, хемоцианин, динитрофенол и потенциально пригодные адъюванты человека, такие как БЦЖ (бацилла Кальметта-Герина) и corynebacterium parvum.
Моноклональные антитела, специфичные для растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB, при этом антитела не вступают в перекрестную реакцию с фрагментами (a)-(g), могут быть получены с использованием любых методов, которые позволяют продуцировать молекулы антитела непрерывными клеточными линиями в культуре. Они включают, однако ими не ограничиваются, гибридомные методы, которые впервые описали Kohler и Milstein (Nature, 1975, 256: 495-497), позднее разработанные методы получения гибридом B-клеток человека (Kosbor et al., 1983, Immunology Today, 4: 72) и методы EBV-гибридомы (Cole et al., 1985, Monoclonal antibodies and Cancer Therapy, Alan R. Liss, Inc., p. 77-96). В еще одном варианте осуществления настоящего изобретения моноклональные антитела можно продуцировать у стерильных животных, применяя вышеописанную технологию (см. разделы 5.2-5.4). Примером продуцирования подобного антитела является получение MH1, которое описано ранее в разделах 5.3-5.6.
В соответствии с настоящим изобретением, антитела человека могут применяться и могут быть получены при использовании гибридом человека (Cote et al. , 1983, Proc.Natl.Acad.Sci., 80: 2026-2030) или при трансформации B-клеток человека под действием вируса EBV в условиях in vitro (Cole et al., 1985, in: Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77-96). Фактически в соответствии с настоящим изобретением могут использоваться методы, разработанные для получения "химерных антител" (Morrison et al., 1984, Proc. Natl. Acad. Sci., 81: 6851-6855; Neuberger et al., 1984, Nature, 312: 604-608; Takeda et al., 1985, Nature, 314: 452-454) путем сплайсинга генов из молекулы антитела мыши, обладающих соответствующей антигенной специфичностью, вместе с генами из молекулы антигена человека, обладающими соответствующей биологической активностью; указанные антитела входят в объем притязаний по настоящему изобретению.
В соответствии с настоящим изобретением методики, описанные для получения одноцепочечных антител (патент США 4946778), могут применяться и для получения специфичных одноцепочечных антител.
В еще одном варианте осуществления настоящего изобретения применяют методику, разработанную для конструирования библиотек экспрессии моноклональных антител Huse et al., 1989, Science, 246:1275-1281), с целью быстрой и простой идентификации фрагментов моноклональных антител, обладающих требуемой специфичностью по отношению к растворимым сшитым и растворимым несшитым фибриновым полимерам DesAAABB.
Фрагменты антител, которые имеют специфические сайты связывания для растворимых сшитых и растворимых несшитых фибриновых полимеров DesAAABB, могут быть сформированы известными способами. Например, указанные фрагменты включают, однако ими не ограничиваются, фрагменты F(ab')2, которые могут продуцироваться при ферментации молекулы антитела под действием пепсина, и фрагменты моноклонального антитела, которые могут генерироваться при восстановлении дисульфидных мостиков во фрагментах F(ab')2.
Антитела по настоящему изобретению могут использоваться в известных из области техники системах иммуноанализа, которые включают, однако ими не ограничиваются, радиоиммуноанализы, ферментные иммуносорбентные анализы, "сэндвичевые" анализы, реакции преципитина, иммунодиффузионные анализы в геле, агглютинационные анализы, флуоресцентные иммуноанализы, иммуноанализы протеина A и иммуноэлектрофоретические анализы. Подходящие методы анализа приводятся также в патенте США 4629783.
Антитела могут использоваться в качестве основных реагентов в ряде различных иммуноанализов для обнаружения присутствия растворимых сшитых и растворимых несшитых фибриновых полимеров DesAAABB в образцах крови или другой жидкости, циркулирующей в организме. В общем, антитела могут применяться в любом типе иммуноанализов, как качественных, так и количественных. Они включают как двухсайтовый сэндвичевый анализ, так и односайтовый иммуноанализ неконкурентного типа, а также традиционные анализы по методу конкурентного связывания.
Особенно предпочтителен, благодаря простоте обнаружения и благодаря тому, что он является количественным, - сэндвичевый анализ, или анализ с двумя антителами, который имеет многочисленные разновидности, и все они охватываются настоящим изобретением.
Например, в типичном прямом сэндвичевом анализе не содержащее метку антитело иммобилизуют на твердом носителе, в частности ячейке планшета для микротитрования, и анализируемый образец вводят в контакт со связанной молекулой. По прошествии необходимого периода инкубации, т.е. интервала времени, необходимого для формирования бинарного комплекса антитело-антиген, добавляют второе антитело, содержащее метку молекулы-репортера, способной давать сигнал, который может быть зарегистрирован, и инкубацию продолжают в течение времени, достаточного для того, чтобы антиген смог присоединиться по другому сайту и образовался тройной комплекс антитело-антиген - содержащее метку антитело. Любые непрореагировавшие вещества вымывают, а присутствие антигена устанавливают, наблюдая сигнал, который можно оценить количественно путем сравнения с контрольными образцами (стандартами), содержащими известное количество антигена. Вариациями прямого сэндвичевого анализа являются непрерывный анализ, в котором как образец, так и антитело одновременно добавляют к связанному антителу, или обратный сэндвичевый анализ, в котором содержащее метку антитело и испытуемый образец вначале смешивают, выдерживают в инкубаторе и добавляют к не содержащему метку антителу на поверхности носителя. Указанные методики хорошо известны специалистам в данной области техники, а возможные небольшие отклонения от них вполне очевидны. В контексте настоящего изобретения "сэндвичевый анализ" охватывает все вариации базовой двухсайтовой методики.
В качестве более специфического примера в типичном прямом сэндвичевом анализе первичное антитело ковалентно или пассивно присоединяется к твердому носителю. Твердым носителем обычно является стекло или полимер, при этом наиболее часто используемыми полимерами является целлюлоза, полиакриламид, найлон, полистирол, поливинилхлорид или полипропилен. Твердый носитель может иметь форму трубочек, шариков, дисков или микропластин или иметь другую форму поверхности, подходящую для проведения иммуноанализа. Процессы связывания хорошо известны из области техники. После связывания комплекс твердая фаза-антитело вымывают и готовят для испытуемого образца. Затем аликвоту испытуемой жидкости добавляют к указанному твердофазному комплексу и выдерживают в инкубаторе в течение времени, достаточного для связывания любого присутствующего растворимого несшитого фибринового полимера DesAABB и растворимого сшитого фибринового полимера с любым антителом, специфичным для указанных белков. К твердофазному комплексу далее добавляют второе антитело и дополнительно выдерживают в инкубаторе в течение времени, достаточного для связывания с первичным с образованием первичного твердофазного комплекса антитело-антиген. Второе антитело присоединяется к молекуле-репортеру, видимый сигнал от которой используют для индикации связывания второго антитела с антигеном образца. Под "молекулой-репортером" в настоящем описании подразумевают молекулу, которая по своей химической природе позволяет получить устойчивый сигнал, обнаруживаемый аналитическими способами, т.е. обнаружить комплекс антиген-связанный антиген. Обнаружение должно быть, по крайней мере относительно, количественным, чтобы можно было определить количество антигена в образце, при этом его можно вычислить в абсолютных единицах или же провести сравнение со стандартом (или с серией стандартов), содержащим известный нормальный уровень содержания антигена.
Наиболее часто используемыми молекулами-репортерами в анализах подобного типа являются либо ферменты или флуорофоры. В случае ферментативного иммуноанализа фермент связывается со вторым антителом, часто с помощью глутарового альдегида или перйодата. Очевидно, что существует множество различных методик связывания, которые хорошо известны специалистам в данной области техники. Обычно используемые ферменты включают среди прочих пероксидазу хрена, оксидазу глюкозы, бета-галактозидазу и щелочную фосфатазу. Субстраты, которые будут использоваться с конкретными ферментами, обычно выбирают по заметному изменению цвета при гидролизе под действием соответствующего фермента, например п-нитрофенилфосфанат пригоден для использования с конъюгатами алкалин-фосфатазы; для конъюгатов пероксидазы обычно используют 1,2-фенилендиамин или толуидин. Можно также применять флуорогенные субстраты, которые дают флуоресцентные продукты, а не указанные выше хромогенные субстраты. В любом случае антитело, меченное ферментом, добавляют к первому комплексу антитела и дают образоваться комплексу, а избыток реагента затем вымывают. Затем к тройному комплексу антитело-антиген - содержащее метку антитело добавляют раствор, содержащий подходящий субстрат. Субстрат взаимодействует с ферментом, связанным со вторым антителом, подавая качественный визуальный сигнал, который можно затем оценить количественно, обычно спектрофотометрически, тем самым оценивая количество антигена, которое присутствует в образце сыворотки.
Иначе, флуоресцентные соединения, такие как флуоресцеин или родамин, могут быть химически связаны с антителами без изменения их связующей способности. При активации под действием света с конкретной длиной волны антитело, меченное флуорохромом, поглощает световую энергию, переводя молекулу в возбужденное состояние, с последующим испусканием характеристического света с большей длиной волны. Излучение имеет характерный цвет, который визуально наблюдается с помощью оптического микроскопа. Как и в ферментативном иммуноанализе, флуоресцентно меченому антителу дают возможность связаться с первым комплексом антигена. После вымывания непрореагировавшего реагента полученный тройной комплекс подвергают воздействию света с подходящей длиной волны, и наблюдаемая флуоресценция указывает на присутствие антигена. Оба метода иммунофлуоресцентного и ферментного иммуноанализа хорошо разработаны и являются наиболее предпочтительными для использования по настоящему изобретению. Однако можно применять и другие молекулы-репортеры, такие как радиоизотопы, хемилюминесцентные или биолюминесцентные молекулы. Для специалистов очевидно, как изменить методику, чтобы она удовлетворяла соответствующим требованиям.
В качестве альтернативы, испытуемый образец - либо кровь млекопитающего, либо другая циркулирующая в организме жидкость, содержащая растворимый несшитый фибриновый полимер DesAABB или растворимый сшитый фибриновый полимер DesAABB, - может использоваться в односайтовом иммуноанализе, где он ковалентно или нековалентно присоединяется к твердому носителю. Не содержащее метку антитело вступает в контакт с образцом, связанным на твердом носителе. Через нужный период инкубации в течение времени, достаточного для формирования бинарного комплекса антитело-антиген, добавляют второе антитело, помеченное молекулой-репортером, способной индуцировать сигнал, который можно обнаружить, и инкубацию продолжают в течение достаточного количества времени, необходимого для формирования тройного комплекса антиген-антитело - содержащее метку антитело. Вторым антителом для односайтового иммуноанализа может быть антитело общего типа (т.е. ксеногеновое антитело для иммуноглобулина, в частности анти-(IgM или IgG), связанный с молекулой-репортером), которое способно связывать антитело, специфичное для растворимого сшитого фибринового полимера и растворимого несшитого фибринового полимера.
Обнаружение и определение содержания растворимого несшитого фибринового полимера DesAABB или растворимого сшитого фибринового полимера DesAABB в условиях in vitro особенно полезно в том случае, когда это обнаружение и определение проводят, используя плазму пациента, в качестве индикации возникающего или существующего тромботического состояния, при этом указанное состояние вызвано возможным или возникшим тромбозом (см., в частности, W.Nieuwenhuizen, p. 94; Bang and Chang, p. 109-122; Marder et al., патент США 5206140).
Подобные состояния включают, например, тромбоз глубинных вен - состояние, которое возникает в результате образования сгустков крови в глубинных венах ноги; эмболию легочной артерии, которая возникает когда тромб (сгусток крови) смещается из глубинных вен и закупоривает сосуды легких; диссеминированное внутрисосудистое свертывание, которое возникает в результате систематической активации каскада свертывания крови (в частности, в результате бактериальной инфекции); инфаркт миокарда, который возникает в результате закупорки тромбом коронарных артерий, снабжающих кровью мышцы сердца; удары и внутрисердечные тромбы, образующиеся в результате фибрилляции предсердий. Тип тромботического состояния может быть установлен путем использования анализа для обнаружения и определения содержания растворимых несшитых фибриновых полимеров DesAABB или растворимых сшитых фибриновых полимеров DesAABB в сочетании с наблюдением за другими симптомами пациента. Этими симптомами являются такие симптомы, которые обычно используются в клинической диагностике возникающего тромботического состояния. Например, указанное обнаружение и определение содержания растворимых фибриновых полимеров DesAABB особенно полезно как средство для того, чтобы отличить пациентов с болями в груди вследствие возникающего инфаркта миокарда от пациентов с болями в груди, вызванными другими причинами.
6.3. Примеры материалов и методов
6.3.1. Белки
Бычий сывороточный альбумин и тромбин покупают у компании "ICN" (Коста Меса, штат Калифорния). Гирудин, пероксидазу хрена и субстрат дигидрохлорид о-фенилендиамина в виде таблеток покупают у компании "Sigma Chemicals Co" (Сент-Луис, штат Миссури). Человеческий фибриноген (марки L) покупают у компании "Helena Laboratories" (Бомонт, штат Техас). Фибриноген дополнительно очищают осаждением сульфатом аммония, как описано в публикации Holm et al. , Thromb. Res., 37:165-176 (1985). Антифибриновое моноклональное антитело, MH1, которое используют в аналитической системе, получают, как описано ранее в разделе 5. Антифибриногенное моноклональное антитело, 45J, получают, как описано ранее в разделе 5.
Фибриновый мономер DesAABB получают, растворяя несшитый фибриновый полимер в 50 мМ буферного раствора ацетата натрия (pH 5,3), содержащего бромид натрия.
Сшитые растворимые фибриновые полимеры DesAABB получают выдерживая в инкубаторе фибриноген или плазму, содержащую цитратный буфер, вместе с небольшим количеством тромбина (0,025 ед./мл) в течение 7-8 минут. Реакционная смесь содержит также фактор XIIIa. Реакцию прерывают, добавляя в реакционную смесь гирудин с конечной концентрацией 10 Atu/мл).
Несшитые растворимые фибриновые полимеры DesAABB получают выдерживая в инкубаторе плазму, содержащую цитратный буфер или фибриноген вместе с раствором тромбина, содержащего ЭДТК (конечная концентрация 12 мМ) в течение 7-8 минут при температуре 37oC. Реакцию прерывают, добавляя в реакционную смесь избыток гирудин (конечная концентрация 10 ATU/мл).
6.3.2. Конъюгаты MH1 и 45J с пероксидазой из хрена (видоизмененная методика, взятая из публикации Wilson and Nakane, Immunofluorescence and Related Staining Techniques", Knapp et al. (eds.), p. 215-224, Elsevier/North Holland Biomedical Press, Amsterdam (1978))
Пероксидазу из хрена (RZ > 3) (10 мг) растворяют в 1 мл дистиллированной воды. Добавляют свежеприготовленный раствор 0,1 М перйодата натрия (0,4 мл) и осторожно перемешивают в течение 20 минут. Затем полученный раствор переносят в буферный раствор ацетата натрия (1% мМ, pH 4,4) при температуре 4oC с помощью микроконцентратора Centricon 10.
Повышают pH раствора до 9,5, добавляя 40 мкл 0,2 М буферного раствора карбоната и бикарбоната натрия (pH 9,5).
Затем немедленно добавляют антитело MH1 (20 мкг) в 2,0 мл 0,01 М буферного раствора карбоната и бикарбоната натрия (pH 9,5). Полученный раствор осторожно перемешивают при комнатной температуре в течение 2 ч, а затем добавляют 0,2 мл свежеприготовленного раствора боргидрида натрия (4 мг/мл). Оставляют смесь на 2 ч при температуре 4oC.
Наконец конъюгат пероксидазы хрена с антителом подвергают диализу по отношению к 5x4 литрам забуференного фосфатом физиологического солевого раствора при температуре 2-8oC.
Конъюгат хранят в контейнере коричневого цвета при температуре 2-8oC.
6.3.3. Образцы крови
Образцы крови получают с разрешения как здоровых добровольцев, так и из отделения экстренной помощи от пациентов с клиническими симптомами инфаркта миокарда, в частности с сильными болями в груди. Образцы крови отбирают в раствор цитрата натрия с помощью вакутейнеров ("Becton Dickinson"). Плазму отделяют центрифугированием со скоростью 2400 об/мин в течение 15 минут. Плазму или используют немедленно, или хранят в замороженном виде при температуре минус 70oC.
6.3.4. Процедура проведения ферментного иммуносорбентного анализа для определения содержания растворимого фибрина
Растворимый фибрин обнаруживают в свежих или замороженных образцах плазмы с помощью системы ферментного иммуносорбентного анализа сэндвичевого типа. В качестве иммобилизованного антитела в соответствии с настоящим изобретением используют антифибриновое антитело MH1. В качестве идентифицирующего (или меченого) антитела используют конъюгат пероксидазы из хрена с тем же антителом. В качестве альтернативы в качестве меченого антитела можно использовать конъюгат пероксидазы из хрена с антифибриновым антителом 45J.
Планшеты для микротитрования из поливинилхлорида с 96 ячейками ("Costar" Кембридж, штат Массачусетс) покрывают моноклональным антителом путем инкубации 100 мкл раствора моноклонального антитела MH1 (с концентрацией 50 мкг/мл) в используемом для покрытия буфере (борат натрия, pH 8,5) в течение 12-16 ч при температуре 4oC. Несвязанное антитело удаляют, трижды промывая планшеты забуференным фосфатом физиологическим раствором, содержащим Tween 80. Покрытые антителом MH1 ячейки обрабатывают бычьим сывороточным альбумином путем выдерживания в инкубаторе с 200 мкл раствора бычьего сывороточного альбумина (БСА) (1%) в забуференном фосфатом физиологическом растворе в течение 1 ч при температуре 37oC. Несвязанный БСА удаляют, переворачивая ячейки на бумажное полотенце и осторожно постукивая. Образцы в цитратном буфере (50 мкл), содержащие растворимый фибрин, выдерживают в инкубаторе в ячейках, покрытых MH1-БСА в течение 30 мин при t 37oC. Несвязанный материал удаляют, переворачивая планшеты и осторожно постукивая. Затем ячейки промывают три раза с помощью забуференного фосфатом физиологического раствора, содержащего Tween 80. Связанный растворимый фибрин идентифицируют, помещая в ячейки вначале 100 мкл раствора конъюгата MH1 - пероксидаза из хрена (или конъюгата пероксидазы из хрена и антифибриногенового антитела 45J) в забуференном фосфатом физиологическом растворе, содержащем бычий сывороточный альбумин, и выдерживая в инкубаторе в течение 30 минут при температуре 37oC. Несвязанный конъюгат удаляют, переворачивая ячейки и промывая их три раза забуференным фосфатом физиологическим раствором, содержащим Tween 80. Связанный конъюгат определяют добавляя 100 мкл раствора дигидрохлорида о-фенилендиамина в течение 10 минут при комнатной температуре. Раствор субстрата готовят, растворяя таблетку дигидрохлорида о-фенилендиамина в растворе цитрата натрия, содержащего перекись водорода.
Колориметрическую реакцию прерывают через 10 минут, добавляя 25 мкл раствора серной кислоты (1 М). Поглощение раствора в каждой ячейке определяют на длине 490 нм с помощью считывающего устройства Thermomax ("Molecular Devices", Менло-Парк, штат Калифорния).
6.3.5. Приготовление колонок для проведения аффинной хроматографии
Колонки сефарозы MH1 получают следующим образом.
Отвешивают 1 г сефарозы 4B ("Pharmacia"), активированной высушенным замораживанием бромцианом и суспендируют в 1 мМ соляной кислоте. Набухший гель промывают в течение 15 минут 1 мМ раствором соляной кислоты на стеклянной воронке с фильтрующим дном.
Антитело NH1 (20 мг) растворяют в буфере для связывания (0,1 М раствор бикарбоната натрия с pH 8,3, содержащий 0,5 М хлорида натрия) и осторожно смешивают с набухшим гелем в снабженном пробкой сосуде в течение 2 ч при комнатной температуре или в течение ночи при температуре 4oC.
После смешения гель промывают буфером для связывания с целью удаления избытка антитела. Незаблокированные активные места блокируются обработкой 0,1 М раствором Tris•HCl с pH 8,0 (или 1 М раствора этаноламина с pH 9,0) в течение 2 ч при комнатной температуре. Гель со связанным антителом, промывают три раза 0,1 М раствором ацетатного буфера (pH 4,0, содержит 0,5 М хлорида натрия), а затем буфером Tris (0,1 М с pH 8,0, содержит 0,5 М хлорида натрия). Связанное антитело хранят при температуре 4oC в растворе азида натрия (0,05%).
Колонки сефароза - фибриновый мономер DesAABB получают следующим образом: фибриновый DesAABB связывают с активированной бромцианом сефарозой 4B в присутствии 1 М бромида натрия в 0,1 М боратном буфере (pH 8,2) по методике, описанной ранее для получения колонок сефароза - МH1.
6.3.6. Определение свойств форм растворимого фибрина, распознаваемых при проведении анализа в условиях in vitro для растворимых фибриновых полимеров, с использованием MH1 для обнаружения растворимого фибрина
Было показано (раздел 5.5.), что антитело MH1 не распознает фибриноген - содержащийся в плазме предшественник фибринового полимера. Ранее было также показано (раздел 5.5.), что антитело распознает как сшитый, так и несшитый фибриновый полимер. Далее, ранее в разделе 5.5. было показано, что деградация фибрина под действием плазмина (или другой процесс, который приводит к разрушению структуры фибринового полимера) вызывает у указанного антитела потерю способности иммунного распознавания фибрина, таким образом, антитело NH1 не распознает ни один из известных продуктов распада сшитого фибрина, образующихся под действием плазмина.
Доказательства того, что антитело MH1 распознает лишь полимерную структуру фибрина DesAABB и не распознает формы мономерного фибрина DesAABB, получают методом аффинной хроматографии. Если коротко, то 0,5 мг антитела MH1 пропускают через колонку сефароза - фибриновый мономер DesAABB. Колонку промывают уравновешивающим буфером (физиологическим раствором, содержащим 0,1 М Tris, pH 8,5). Заметного связывания антитела в колонке не наблюдается. Как показано на фиг. 1A, антитело сразу же элюируется из колонки. Когда колонку элюируют 6 М раствором гидрохлорида гуанидина, то выделяют небольшое количество связанного белка. Белок обнаруживают, проводя контроль всех фракций на длине волны 280 нм. Антитело обнаруживают, анализируя иммунореактивность белка методами твердофазного ферментного иммуносорбентного анализа с использованием ячейки для микротитрования, покрытой фибрином. Описание используемого ферментного иммуносорбентного анализа приведено выше в разделе 5.4.2. Связывание белка в колонке является следствием небольшого количества примесей растворимого фибринового полимера DesAABB, присоединившегося фибриновому мономеру DesAABB в колонке. Эта примесь присутствует в исходном материале, который используют для подготовки колонки с фибриновым мономером DesAABB. Для доказательства того, что колонка сефароза - фибриновый мономер DesAABB способна связывать антитело, через колонку в контрольном эксперименте пропускают фибриноген-специфичное моноклональное антитело. Как показано на фиг. 1B, колонка связывает контрольное моноклональное антитело, антифибриногеновое антитело 45J, а для элюирования антитела 45J необходимо использовать гидрохлорид гуанидина (6 М).
Доказательство того, что вышеописанное антитело MH1 распознает как сшитые, так и несшитые растворимые фибриновые полимеры DesAABB, получают из эксперимента, в котором растворимые фибриновые полимеры DesAABB генерируют путем добавления тромбина к образцам плазмы, содержащим цитратный буфер в присутствии или отсутствие ЭДТК (ЭДТК препятствует сшивке фибриновых полимеров DesAABB под действием фактора XIIIa). Как сшитые, так и несшитые растворимые фибриновые полимеры DesAABB получают, как описано в разделе 6.3.1, а их относительную иммунореактивность определяют методом ферментного иммуносорбентного анализа, как описано в разделе 6.3.4. Как следует из фиг. 2, в данной аналитической системе не наблюдается существенной разницы между иммунореактивностью сшитых (B) и несшитых (C) фибриновых полимеров.
Доказательства того, что антитело MH1 не распознает растворимый фибриновый полимер DesAA получают, действуя на фибриноген или плазму ферментом батроксобином из змеиного яда от Bothrops atrox, который селективно расщепляет фибринопептид A в молекуле фибрина. Батроксобин не расщепляет фибринопептид B в отличие от тромбина, который расщепляет как фибринопептид A, так и фибринопептид B. Удаление фибринопептида A приводит к полимеризации фибринового мономера DesAA и к образованию фибринового сгустка DesAA. На фиг. 3 изображено образование сгустка, определяемое по поглощению реакционной смеси на длине волны 340 нм, когда раствор батроксобина выдерживают в инкубаторе в течение 15 минут при комнатной температуре вместе с образцом фибриногена. Поглощение медленно возрастает с течением времени, по мере того как возрастает длина и концентрация растворимого фибринового полимера DesAA, пока, наконец, не образуется сгусток. В эксперименте, в котором проверяют способность MH1 распознавать фибрин DesAA, растворимый фибриновый полимер DesAA получают в условиях in vitro путем выдерживания в инкубаторе образца фибриногена с батроксобином (с конечной концентрацией 0,5 ед./мл) при температуре 37oC. От образца, обработанного батроксобином, через 7 минут берут аликвоту и анализируют методом ферментативного иммуноанализа в соответствии с разделом 6.3.4. Этот образец (образец C) не обладает активностью, как видно из фиг. 4. Из этого эксперимента также следует, что аналитическая система не распознает комплекс фибриноген-фибрин DesAA, который представляет собой источник растворимого фибрина. Очевидно, что реакционная смесь, полученная в этом эксперименте, будет содержать указанные формы "растворимого фибрина", поскольку батроксобин продуцирует фибриновые мономеры DesAA, которые вольны вступать во взаимодействие с другими фибриновыми мономерами DesAA или не подвергнутыми ферментации молекулами фибриногена. Поскольку после добавления батроксобина в данной аналитической системе реакция не наблюдается, то можно сделать вывод, что анализ не обнаруживает указанные формы фибриноген-фибрин DesAA. Образец B, который представляет собой положительный контрольный образец, состоит из фибриновых полимеров DesAABB, образованных при обработке образца плазмы тромбином и гирудином. В качестве негативного контрольного образца добавляют образец A.
Комплекс растворимого фибрина может также образовываться вследствие сшивки молекул нативного фибриногена под действием фактора XIIIa с образованием димеров фибрина (Kanaide et al., J. Lab. Clin. Med., 86: 574-579 (1975)). Фибриноген, обработанный фактором XIIIa, не обнаруживается аналитической системой. В этом эксперименте микропланшеты, покрытые фибриногеном, вначале обрабатывают фактором XIIIa, активированным тромбином, в течение 1,5 ч при температуре 37oC. После того, как остаточную активность тромбина подавляют, антитело MH1 выдерживают в инкубаторе в обработанных фактором XIIIa ячейках и связанный MH1 определяют с помощью анти-мышь конъюгата щелочной фосфатазы. Связанное антитело анти-мышь обнаруживают, добавляя субстрат щелочной фосфатазы. Количество MH1, связанного в ячейках, определяют по оптической плотности на длине 490 нм. На фиг. 5 образец, обозначенный Fg + FXIIIa, показывает, что MH1 связался в ячейках, указывая на то, что антитело не распознает структуру сшитого фибриногена. В качестве положительного контроля покрытые фибриногеном ячейки обрабатывают тромбином для получения фибриновых полимеров DesAABB и исследуют на иммунореактивность антителом MH1 (фиг. 5, образец, обозначенный Fg + тромбин).
6.3.7. Исследование образования растворимого фибринового полимера DesAABB в условиях in vitro
Растворимые фибриновые полимеры DesAABB получают в условиях in vitro добавлением небольшого количества тромбина (0,025 единиц Американского института здоровья в 1 мл) к образцу плазмы в цитратном буфере. Образец выдерживают в инкубаторе при температуре 37oC. С интервалом в 1 минуту от образца берут аликвоты и активность тромбина подавляют добавлением гирудина, потенциального ингибитора тромбина (с конечной концентрацией 2ATU/мл). Количество растворимого фибринового полимера DesAABB в каждой аликвоте определяют по методике ферментного иммуносорбентного анализа, приведенной в разделе 6.3.4.
Как показано на фиг. 6, количество растворимого фибринового полимера, что видно по поглощению при 490 нм, резко возрастает после первоначального индукционного периода, составляющего 4-5 минут после добавления тромбина к плазме. Пик растворимого фибринового полимера наблюдается приблизительно через 7,5 минут после добавления тромбина к плазме. Пологое уменьшение содержания растворимого фибрина, наблюдаемое через 9-10 минут, совпадает с гелеобразованием и формированием нерастворимых фибриновых полимеров (формирование сгустка).
6.3.8. Выделение растворимых фибриновых полимеров из плазмы методом аффинной хроматографии на колонке сефароза - MH1
Образец плазмы выдерживают в инкубаторе с тромбином (0,025 ед./мл) в течение 7 минут при температуре 37oC. Активность тромбина подавляют, добавляя избыток гирудина. Реакционную смесь пропускают через колонку сефароза - MH1. Исходный материал и прогон (несвязанный материал) через связанный белок (очищенный белок), при этом белок элюируют с помощью роданида натрия (3) и подвергают диализу по отношению к забуференному фосфатом физиологическому раствору, анализируют на иммунореактивность с помощью MH1, используя ферментный иммуносорбентный анализ, описанный в разделе 6.3.4. Иммунореактивность обработанной плазмином плазмы после подавления активности гирудином (исходный материал), связанного белка после выделения из колонки и диализа (элюция) и несвязанного материала (несвязанный материал) приведены на фиг. 7. Исходный материал и связанный белок после диализа обладает иммунореактивностью по отношению к MH1, в то время как несвязанный материал ею не обладает.
6.3.9. Обнаружение и определение содержания в условиях in vitro, растворимых сшитых и растворимых несшитых фибриновых полимеров для диагностики инфаркта миокарда
36 различных образцов плазмы исследуют на содержание растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB с помощью ферментного иммуносорбентного анализа, описанного ранее а разделе 6.3.4, используя MH1 в качестве иммобилизованного антитела. После отбора образцы плазмы переносят в антикоагулянт и замораживают. После оттаивания образцы исследуют на содержание растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB. Десять из указанных 36 образцов берут от здоровых людей. Контрольные образцы берут у добровольцев из персонала лаборатории, которые обладают отличным здоровьем и которые не испытывают болей в груди даже после физических нагрузок. Все остальные образцы взяты у пациентов из отделения экстренной помощи местного коммунального госпиталя. Все пациенты из отделения экстренной помощи имели клинические симптомы (боль в груди), предполагающие наличие инфаркта миокарда; у 15 из них диагноз инфаркта миокарда подтвердился; для остальных 11 пациентов было установлено, что они не страдают от инфаркта миокарда. Для последней группы были поставлены диагнозы наличия различных клинических состояний, в том числе грудной жабы, страха, отека легких. Образцы крови взяты у пациентов непосредственно после их поступления в отделение экстренной помощи. В большинстве случаев проводилась регистрация данных о положительности симптомов. В этом исследовании все пациенты ощущали боль в груди в течение 1-3 ч перед госпитализацией. Как показано на фиг. 8, во всех случаях у пациентов с подтвержденным диагнозом инфаркта миокарда содержание растворимых фибриновых полимеров DesAABB значительно превышает их содержание у здоровой контрольной группы (в 3-30 раз). У пациентов, испытывающих боль в груди, у которых инфаркт миокарда отсутствует, содержание растворимых фибриновых полимеров DesAABB незначительно отличается от величин, наблюдаемых для здоровой контрольной группы. (Содержание растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB показано как "Содержание растворимого фибрина в единицах ферментного иммуносорбентного анализа (x 1000)").
Чувствительность указанной аналитической системы поэтому составляет 100% (для n = 36), а специфичность также равна 100% (для n = 36), т.е. отсутствуют ошибочные позитивные и ошибочные негативные результаты. Отсюда можно сделать вывод, что данная аналитическая система имеет высокий уровень точности установления диагноза инфаркта миокарда.
6.4. Наборы для обнаружения в условиях in vitro растворимых сшитых и растворимых несшитых фибриновых полимеров
Следует понимать, что настоящее изобретение не ограничивается использованием моноклональных антител при проведении анализов. Однако в случае использования указанных антител в составе рассматриваемого далее набора подобные наборы содержат ряд стандартов, первое антитело (т.е. иммобилизованное антитело, например, MH1) и второе антитело, содержащее метку генератора сигнала, как это уже рассмотрено ранее. Указанные наборы содержат стандарты в виде известного количества растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB. Подобные стандарты могут быть получены путем выделения растворимых сшитых и растворимых несшитых фибриновых полимеров DesAABB с использованием аффинной колонки сефароза - MH1, как это указано ранее. Наборы могут также включать специфические буферные смеси, агенты для разделения и контрольные образцы. Наборы могут включать устройства для отбора пробы или химические вещества для обработки анализируемых образцов.
Все указанные выше публикации и патенты приводятся для справок.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИФИБРИНОВОЕ АНТИТЕЛО ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВОТРОМБОТИЧЕСКОГО СРЕДСТВА | 1995 |
|
RU2152801C2 |
| АНАЛИЗ СОДЕРЖАНИЯ ФИБРИНОГЕНА | 2012 |
|
RU2619256C2 |
| РЕАГЕНТ ДЛЯ ОЦЕНКИ ПРОДУКТА РАСЩЕПЛЕНИЯ ПЕРЕКРЕСТНОСШИТОГО ФИБРИНА И СПОСОБ ТАКОЙ ОЦЕНКИ | 2017 |
|
RU2742279C2 |
| УМЕНЬШЕНИЕ ОБЪЕМА ТКАНИ | 2000 |
|
RU2308967C2 |
| КОНЪЮГАТ, СВЯЗЫВАЮЩИЙ ФИБРИН/ФИБРИНОГЕН | 2001 |
|
RU2279890C2 |
| СПОСОБЫ ИСПОЛЬЗОВАНИЯ ФИБРИНОВОГО ГЕРМЕТИКА, СПОСОБ ПОЛУЧЕНИЯ СОСТАВА, СОСТАВЫ, НАБОРЫ | 1993 |
|
RU2143924C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РАСТВОРИМОГО ФИБРИНА | 2001 |
|
RU2310200C2 |
| ТВЕРДАЯ ПОВЯЗКА ДЛЯ ЛЕЧЕНИЯ ТРАВМИРОВАННОЙ ТКАНИ | 2007 |
|
RU2480191C2 |
| БИОГЕЛЬ | 2007 |
|
RU2503464C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО КЛЕЯ, ИЗГОТОВЛЕННОГО ИЗ КОНЦЕНТРИРОВАННЫХ КОАГУЛИРУЮЩИХ ФАКТОРОВ ПОСРЕДСТВОМ "ВЫСАЛИВАНИЯ" | 1994 |
|
RU2130946C1 |
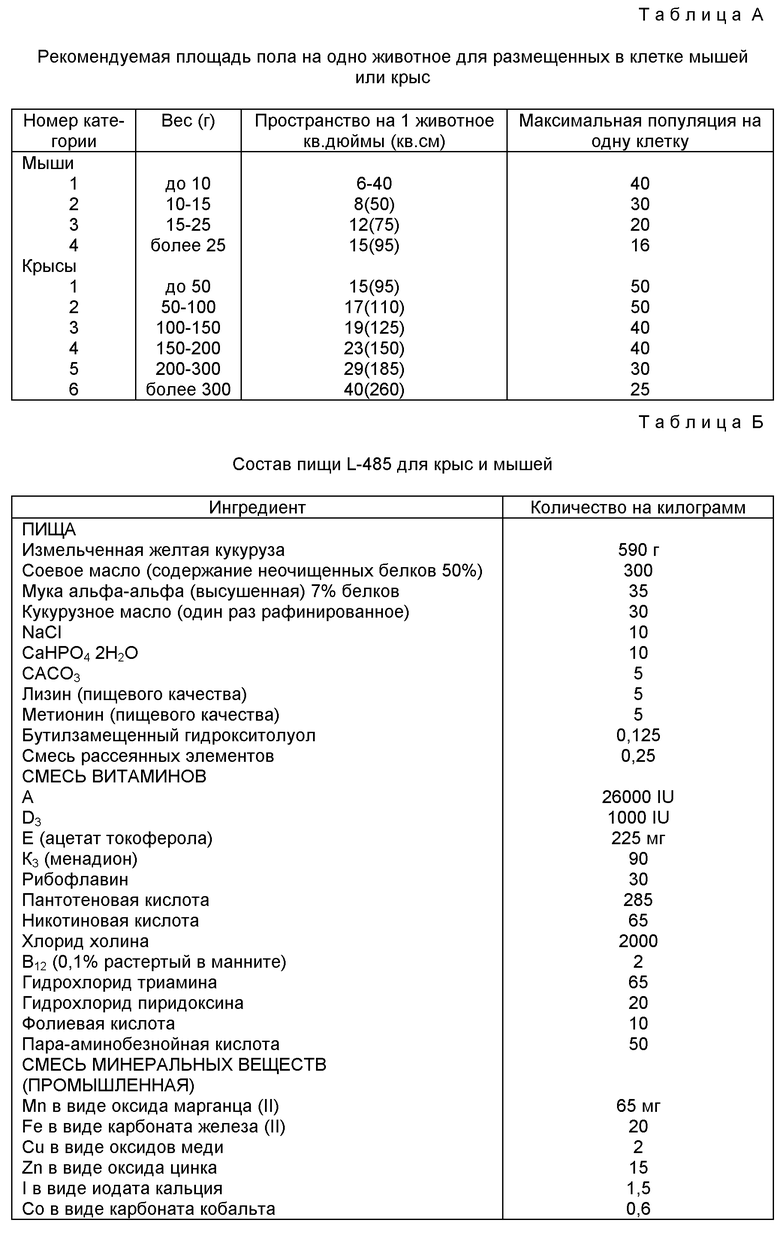
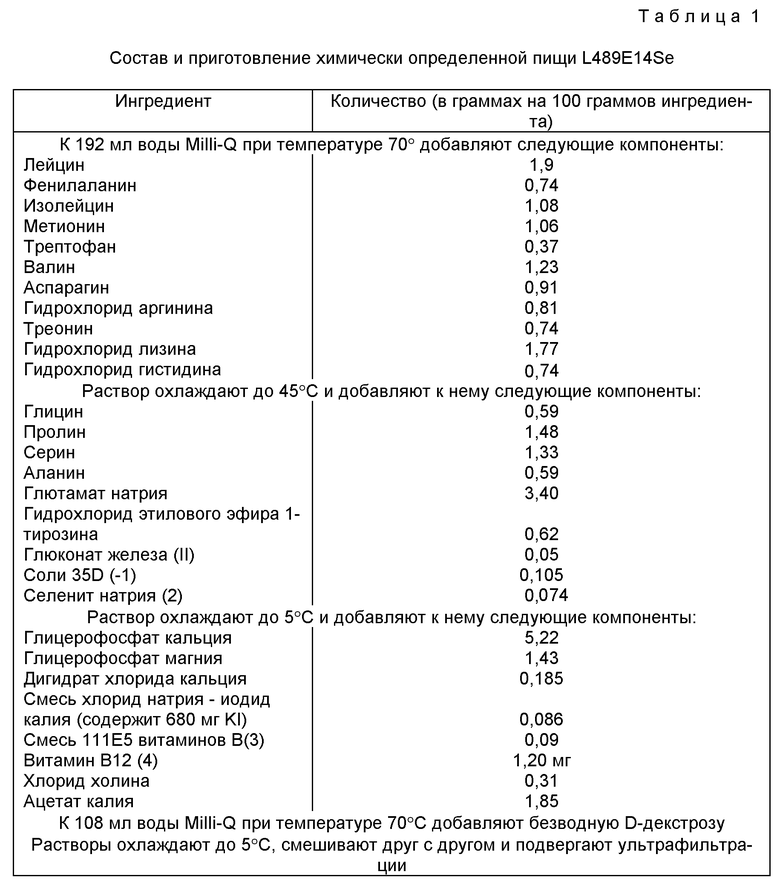
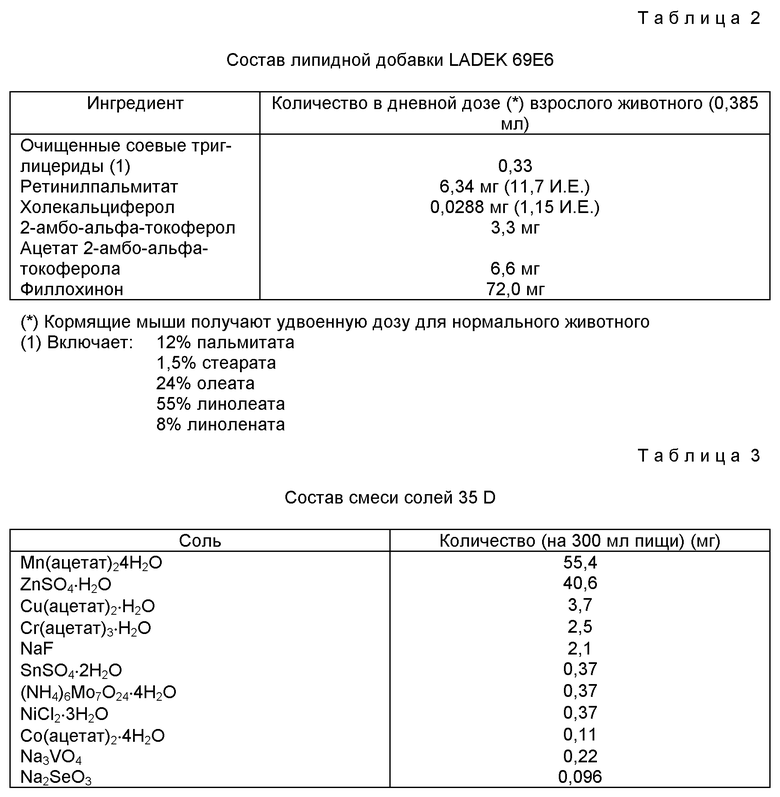
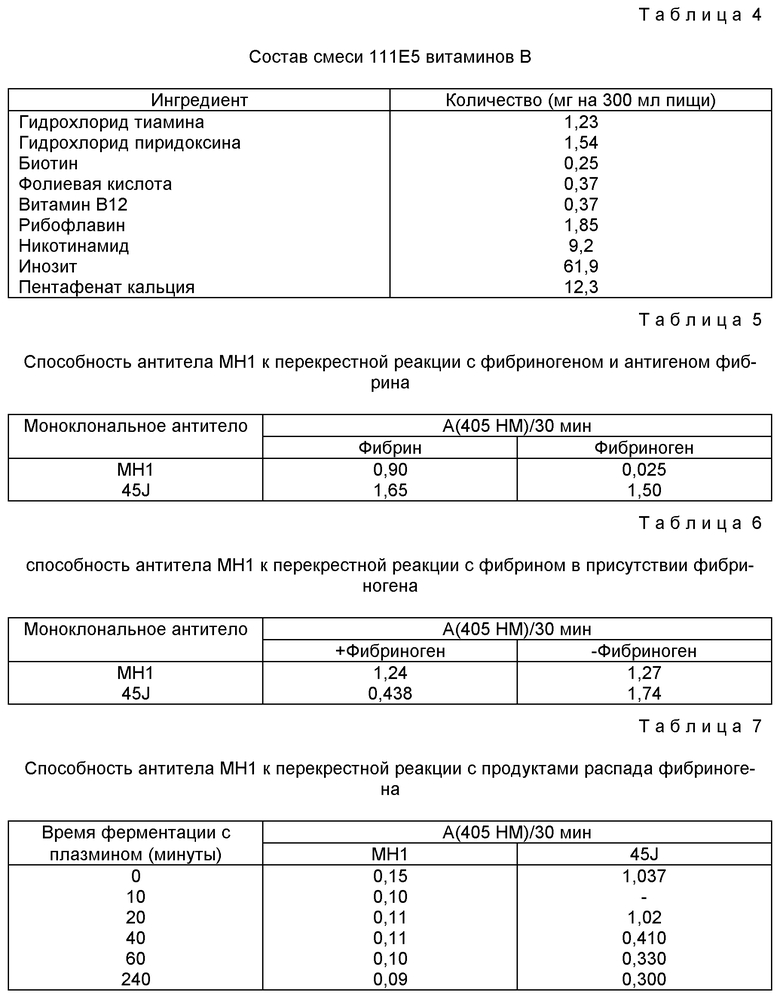
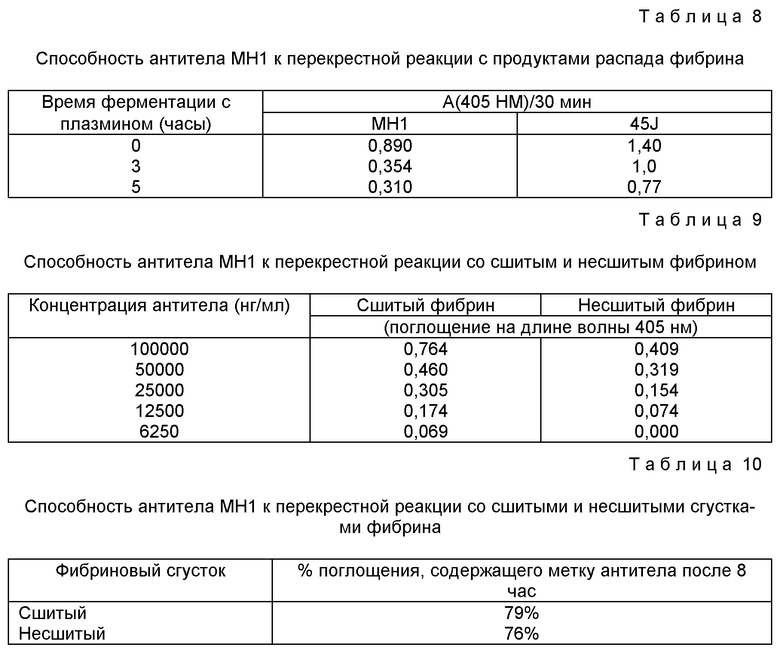
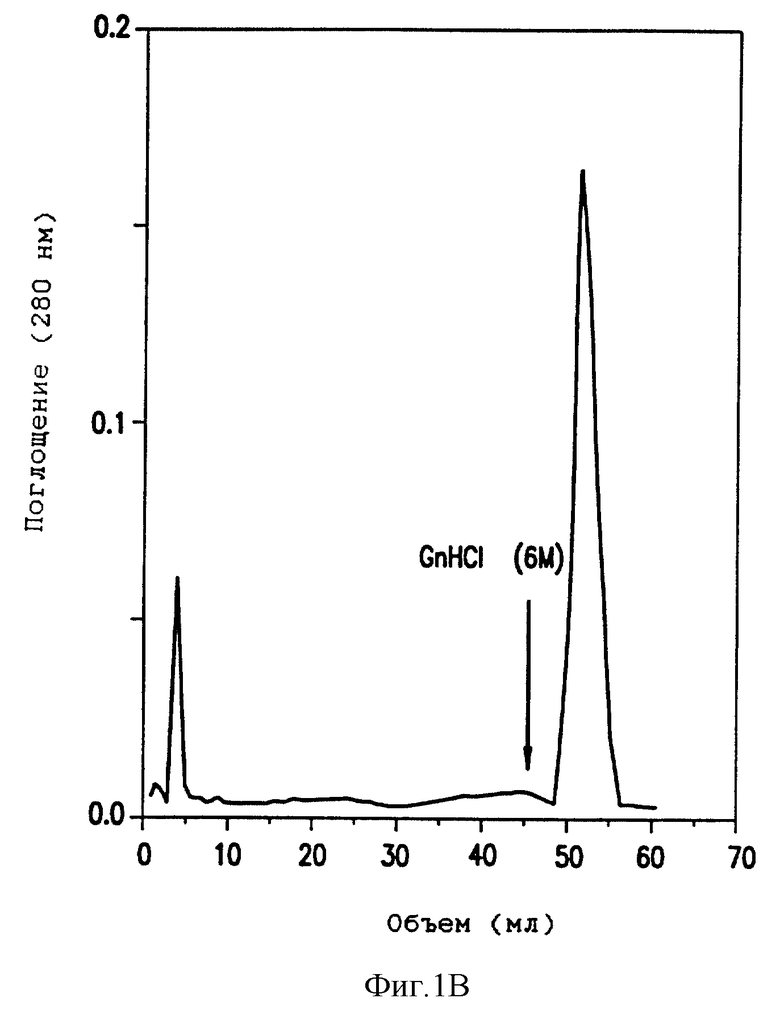
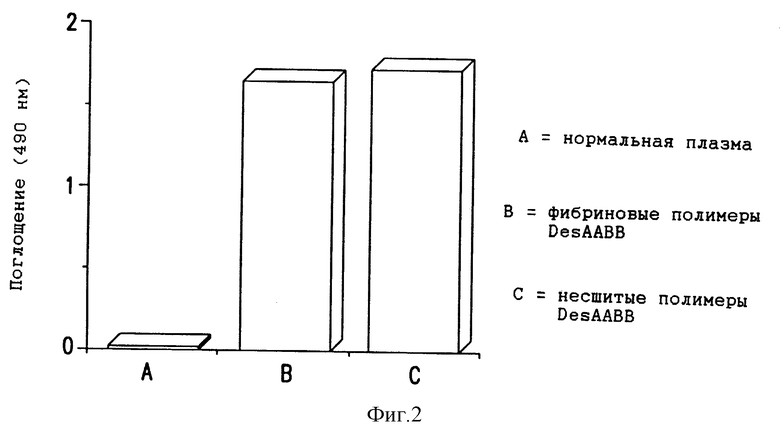
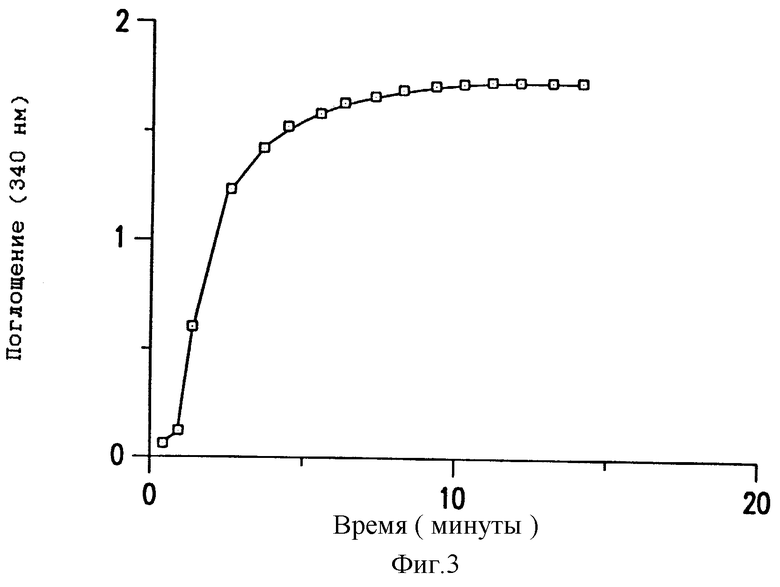
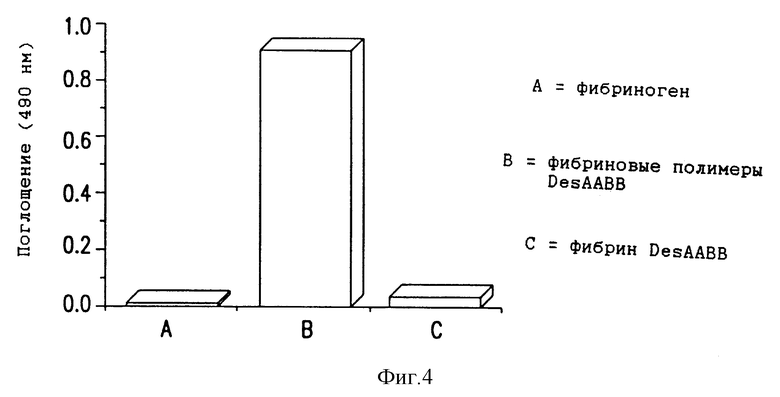
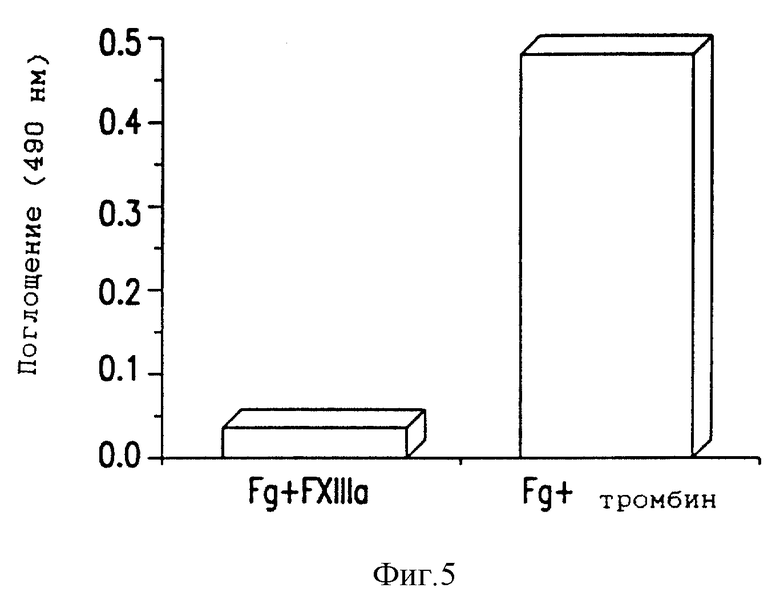
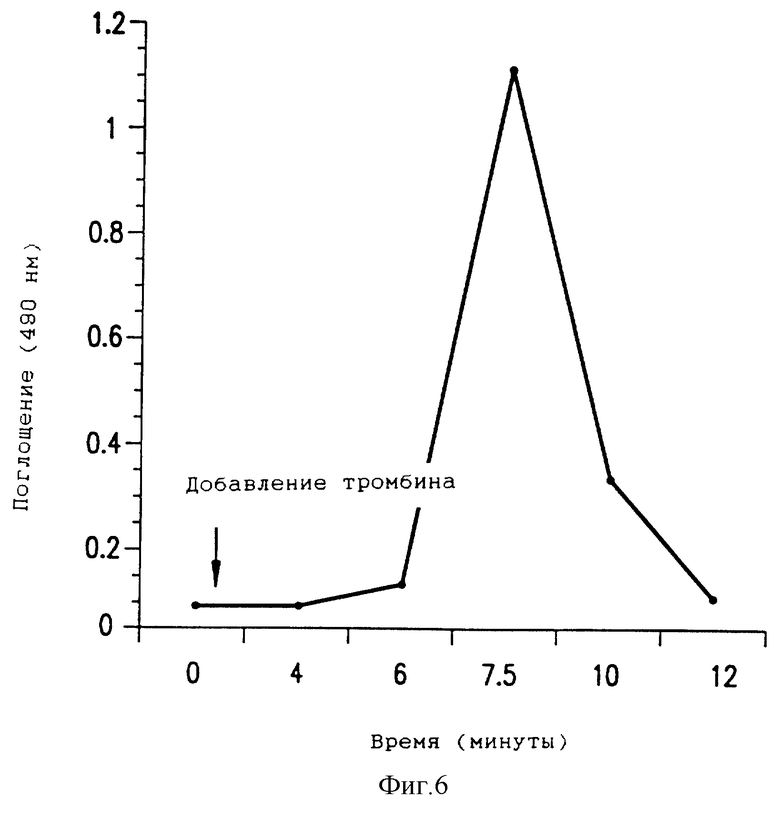
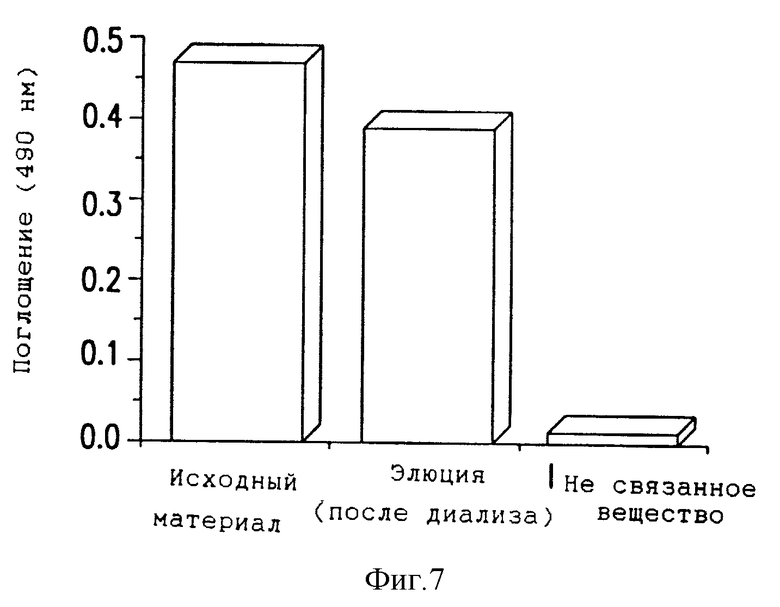
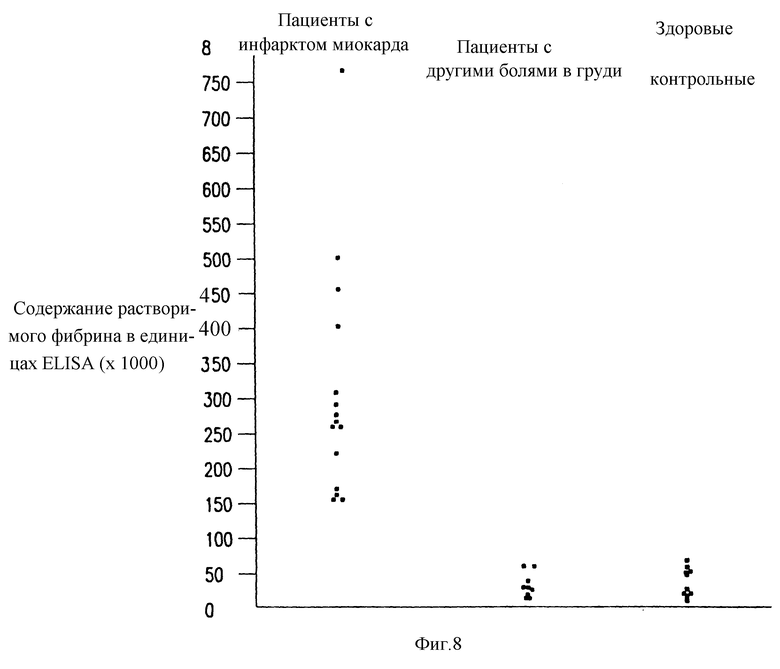
Изобретение относится к иммунологии. Способ определения в условиях in vitro присутствия или количества растворимых поперечно сшитых фибриновых полимеров DesААВВ и поперечно не сшитых фибриновых полимеров DesААВВ в образце, полученном от млекопитающего, включает в себя контактирование указанного образца с антителом или его иммунореактивным фрагментом. При этом последние не связываются специфически а) с фибриногеном, в) с продуктами распада фибриногена, с) с фибриновыми мономерами DesАА, d) с фибриновыми полимерами DesАА, е) с фибриновыми мономерами DesААВВ, f) с поперечно сшитым фибриногеном, g) с комплексом фибриновый мономер DesАА - фибриноген и h) с продуктами распада фибрина. Способы оценки предрасположенности к тромботическому состоянию, подтверждения диагноза наличия тромботического состояния и мониторинга тромботического состояния у млекопитающего включают в себя определение количества растворимых поперечно сшитых фибриновых полимеров DesААВВ и растворимых поперечно не сшитых фибриновых полимеров DesААВВ в образце, полученном у млекопитающего. Предложены наборы для определения in vitro присутствия или количества растворимых поперечно сшитых фибриновых полимеров DesAАВВ и растворимых поперечно не сшитых фибриновых полимеров DesААВВ в образце для определения предрасположенности к тромботическому состоянию у млекопитающего, для подтверждения диагноза наличия тромботического состояния и для определения стадии тромботического состояния у млекопитающего. Изобретение позволяет достоверно определить предрасположенность к тромботическому состоянию у млекопитающего. 8 с. и 26 з.п. ф-лы, 12 табл., 8 ил.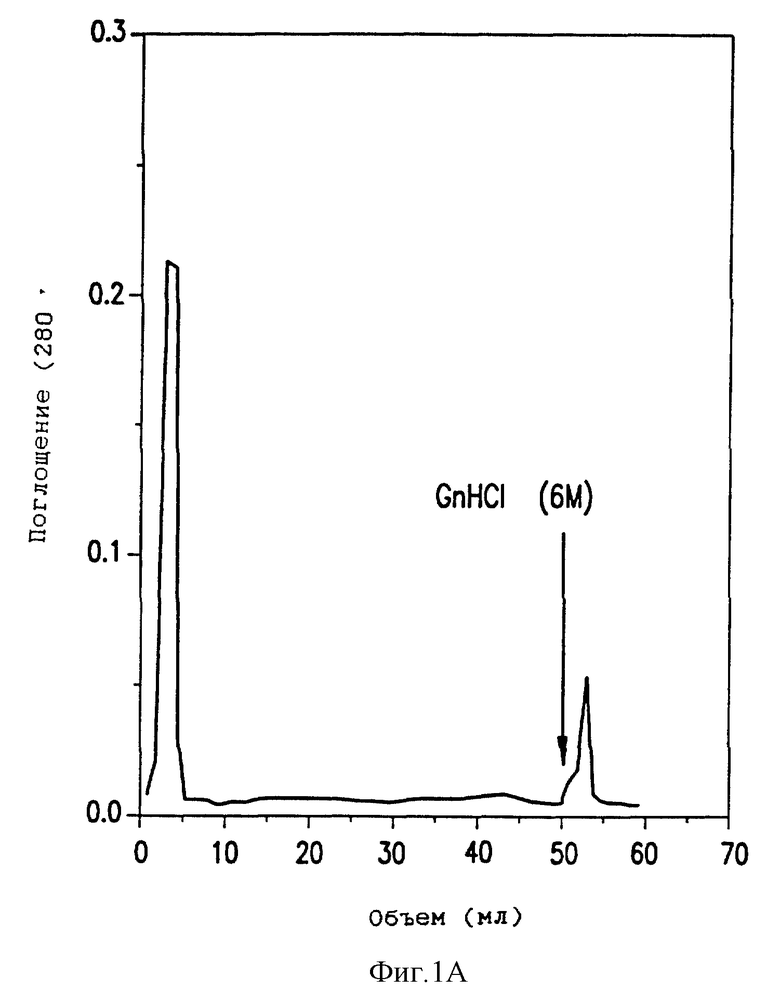
| US 5091512 A, 25.02.1992 | |||
| US 4758524 A, 19.07.1988 | |||
| УСТРОЙСТВО ДЛЯ НАСТРОЙКИ КОРРЕКТОРА | 0 |
|
SU347933A1 |
| Способ дифференциальной диагностики стабильной стенокардии и острого инфаркта миокарда | 1989 |
|
SU1725123A1 |
| SU 1769138 А1, 15.10.1992 | |||
| Способ прогнозирования течения инфаркта миокарда | 1989 |
|
SU1772756A1 |
Авторы
Даты
2001-09-10—Публикация
1994-06-22—Подача