Изобретение относится к соединениям формулы I
R1-Q1-X-Q2-R2, (I)
в которых Q1, Q2 в каждом случае, независимо от один от другого либо отсутствуют, либо представляют собой -NH-(CH2)n-CO-,
R1, R2 в каждом случае, независимо друг от друга либо отсутствуют, либо представляют собой цикло-(Arg-Gly-Asp-Z), где Z связан в боковой цепи с Q1 или Q2, или, если Q1 и/или Q2 отсутствуют (ет), с X и где по меньшей мере один из радикалов R1 или R2 должен всегда присутствовать,
X представляет собой -CO-R18-CO-, и если R1-Q1- или R2-Q2- отсутствует, то представляет собой R10, R13, R16, Het-CO- или остаток флуоресцентного красителя, который химически связан посредством CONH-, -COO-, -NH-C(=S)-NH- -NH-C(=O)-NH-, - SO2NH- или -NHCO-связей,
Z в каждом отдельном случае независимо представляет собой остаток аминокислоты или ди-, три- или тетрапептидный остаток, где аминокислоты независимо выбирают из группы, включающей Ala, Asn, Asp, Arg, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val или M,
где указанные аминокислоты могут быть производными и остатками аминокислот, соединенными один с другим подобно пептиду при помощи α-амино- и α-карбоксильных групп, и где М всегда присутствует,
М представляет собой NH(R8)-CH(R3)COOH,
R3 - -R5-R4, -R6-R4 или -R7-R4
R4 представляет собой ОН, NH2, SH или COOH,
R5 - алкилен, содержащий 1-6 атомов углерода,
R6 - алкиленфенилен, содержащий 7-14 атомов углерода,
R7 - алкиленфенилалкилен, содержащий 8-15 атомов углерода,
R8-H, A или алкиленфенил, содержащий 7-12 атомов углерода,
A - алкил, содержащий 1-6 атомов углерода,
R10 - алканоил, содержащий 1-18 атомов углерода, который является незамещенным или содержит один заместитель из числа COOH, COOA, SR11 или NR12R12,
R11 - H или тритил, пиридил-2-тио- или алкилтиогруппа, содержащая 1-6 атомов углерода,
R12, R12' - каждый, независимо друг от друга, представляет собой H, алкил, содержащий 1-8 атомов углерода или защитную группу аминогруппы,
R13 - ароил, который содержит 7-11 атомов углерода и является незамещенным или замещенным и содержит один или два заместителя, выбранных из группы, включающей алкил, содержащий 1-6 атомов углерода, алкоксигруппу, содержащую 1-4 атомов углерода, алканоил, содержащий 1-8 атомов углерода, Hal, SR14 или NR15R15',
R14 - H или A,
R15, R15' - в каждом случае независимо один от другого H или A,
R16 представляет собой аралканоил, который содержит 7-19 атомов углерода и который не замещен или замещен в арильном фрагменте на один, два или три заместителя, включающих Hal, алкоксигруппу, содержащую 1-6 атомов углерода, или ОН, и в котором арильный фрагмент может также представлять собой группу:
E - CH2 или О,
D - карбонил или [C(R17R17')]m,
R17R17' каждый независимо представляет собой H или A,
R18 - отсутствует или представляет собой R19, R20, R19-R20-R19 или фенилен, который не замещен или замещен и содержит один или два заместителя R5, длина цепи у которого является в каждом случае независимой друг от друга,
R19 представляет собой алкилен, содержащий 1-8 атомов углерода, где 1 или 2 метиленовых группы могут быть замещены S, -CH=CH- или  ,
,
R20 - циклоалкилен, содержащий 3-7 атомов углерода,
Hal -F, Cl, Br или I,
Het - моноциклический или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, который содержит от 1 до 4 атомов N, О и/или S, присоединяется через атом N или С и является незамещенным или замещенным и содержит один, два или три заместителя, выбранных из группы, включающей Hal, A, R3, NR4R4', CN, NO2 и/или карбонильный кислород,
n - 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 и
m равно 1 или 2,
где, при условии, что остатки представляют собой остатки оптически активных аминокислот и производных аминокислот, включаются обе D и L формы, и их соли.
Аналогичные соединения - циклические пептиды - описываются в заявке Германии DE 4310643.
Изобретение основывается на новых соединениях, обладающих ценными свойствами, в частности соединениях, которые могут быть использованы для получения лекарственных средств.
Установлено, что соединения формулы I и их соли обладают очень ценными фармакологическими свойствами и притом хорошо переносятся. В частности, они действуют как ингибиторы интегрина, при соединении с которым они, в частности, ингибируют взаимодействия  или
или  рецепторов интегрина с лигандами, такие как связывание фибриногена с
рецепторов интегрина с лигандами, такие как связывание фибриногена с  рецептором интегрина. Соединения проявляют специфическую активность в случае αvβ3, и αvβ5 и αIIbβ3 интегринов, а также αvβ1, αvβ6 и αvβ8 интегринов.
рецептором интегрина. Соединения проявляют специфическую активность в случае αvβ3, и αvβ5 и αIIbβ3 интегринов, а также αvβ1, αvβ6 и αvβ8 интегринов.
Это действие может быть продемонстрировано, например, при использовании способа, описанного в публикации J. M. Smith et al., J. Biol. Chem. 265, 12267-12271 (1990).
В публикации P.С.Brooks, R.A. Clark, D.A. Cheresh, Science 264, 569-71 (1994) сообщалось, что развитие кровеносных сосудов зависит от взаимодействия между интегринами сосудов и внеклеточными матричными белками.
Возможность применения циклического пептида для ингибирования этого взаимодействия и, таким образом, инициирования апротоза (программированной гибели клетки) ангиогенных клеток сосудов описана в публикации Р.С. Brooks, А. М. Montgomery, М. Rosenfeld, R.A Reisfeld, Т.-Hu, G. Klier, D.A. Cheresh, Cell 79, 1157-64 (1994).
Соединения формулы I, которые блокируют взаимодействие рецепторов интефина и лигандов, такое как взаимодействие фибриногена с рецептором фибриногена (Гликопротеид IIb/IIIa), предотвращают распространение опухолевых клеток в качестве результата метастаза. Это основывается на следующих наблюдениях:
Соединения способны ингибировать связывание металлопротеиназ с интегринами и, следовательно, исключают то, что клетки могут использовать ферментативную активность протеиназ (proteinases). Это, например, описывается посредством ингибирования связывания матричной металлопротеиназы-2 (ММР) с витронекционным рецептором αVβ3 при помощи циклического RGD цептида в публикации Brooks et al. Cell 85, 683-693 (1996).
Распространение опухолевых клеток из локальной опухоли в сосудистую систему протекает посредством образования микроагрегатов (микротромбов) как результата взаимодействия опухолевых клеток с тромбоцитами крови. В результате защиты, предоставляемой микроагрегатом, клетки опухоли экранируются и не распознаются клетками иммунной системы. Микроагрегаты могут оседать на клетках сосуда, способствуя тем самым дальнейшему проникновению опухолевых клеток в ткань. Поскольку образование микротромба осуществляется посредством связывания фибриногена с фибриногеновыми рецепторами на активированных тромбоцитах крови, GPIIa/IIIb антагонисты могут оцениваться как эффективные ингибиторы метастаза.
Соединения формулы I могут применяться как фармацевтически активные соединения в медицине и в ветеринарии, в частности для профилактики и/или терапии тромбоза, инфаркта миокарда, артериросклероза, воспалений, приступа грудной жабы, опухолевых заболеваний, остеолитических заболеваний, таких как остеопороз, заболеваний, связанных с патологическим развитием сосудов (pathology angiogenic diseases), такие как воспаления, офтальмологические заболевания, диабетической ретинопатии, дегенерации желтого пятна, близорукости, глазного гистоплазмолиза, ревматического артрита, остеоартрита, rubeotic глаукомы, язвенного колита, болезни Кронха, атеросклероза, псориаза, рестеноза после пластической операции на сосудах, вирусной инфекции, бактериальной инфекции, грибковой инфекции, острой печеночной недостаточности и для поддержания процессов выздоровления при заживлении ран.
Соединения формулы I могут использоваться в качестве веществ, обладающих антимикробным действием в операциях, в которых используются биоматериалы, имплантаты, катетеры или кардиостимуляторы. В данном контексте они обладают антисептическим действием. Эффективность антимикробной активности может быть продемонстрирована с использованием способа, описанного в публикации P. Valentin-Weigund et al., Infection and Immunity; 2851-2855 (1988).
В приведенном выше тексте и далее остатки аминокислот обозначаются аббревиатурами, которые соответствуют следующим аминокислотам:
Abu 4-Аминомасляная кислота
Aha 6-Аминогексановая кислота, 6-аминокапроновая кислота
Ala Аланин
Asn Аспарагин
Asp Аспарагиновая кислота
Arg Аргинин
Cys Цистеин
Dab 2,4-Диаминомасляная кислота
Dap 2,3-Диаминопропионовая кислота
Gln Глутамин
Glp Пироглутаминовая кислота
Glu Глутаминовая кислота
Gly Глицин
His Гистидин
homo-Phe гомо-Фенилаланин
Ile Изолейцин
Leu Лейцин
Lys Лизин
Met Метионин
Nle Норлейцин
Orn Орнитин
Phe Фенилаланин
Phg Фенилглицин
4-Hal-Phe 4-Галоген-фенилаланин
Pro Пролин
Ser Серин
Thr Треонин
Trp Триптофан
Tyr Тирозин
Val Валин
Кроме того, приведенные ниже аббревиатуры имеют следующие значения:
Ac Ацетил
BOC трет-Бутоксикарбонил
CBZ или Z Бензилоксикарбонил
DCCI Дициклогексилкарбодиимид
DFM Диметилформамид
EDCI N-этил-N,N'-(диметиламинопропил)-карбодиимид
Et Этил
FCA Флуоресцеинкарбоновая кислота
FITC Флуоресцеинизоцианат
Fmoc 9-Флуоренилметоксикарбонил
FTH Флуоресцеинтиомочевина
HOBt 1-Гидроксибензотиазол
Me Метил
MBHA Метилбензгидриламин
Mtr 4-Метокси-2,3,6-триметилфенилсульфонил
HONSu N-Гидроксисукцинимид
OBut Сложный трет-бутиловый эфир
Oct Октаноил
OMe Сложный метиловый эфир
OEt Сложный этиловый эфир
POA Феноксиацетил
Sal Салицилоил
TFA Трифторуксусная кислота
Trt Тритил(трифенилметил).
В том случае, когда указанные выше аминокислоты способны давать несколько энантиомерных форм, все эти формы, а также их смеси (например, DL формы), включаются, ниже и выше, например, как неотъемлемая часть соединений формулы I. Кроме того, аминокислоты могут, например, как неотъемлемая часть соединений формулы I обеспечиваться подходящими защитными группами, которые известны.
Соединения в соответствии с данным изобретением также включают так называемые производные пролекарства, представляющие собой соединения формулы I, которые модифицированы, например, алкильной или ацильной группами, сахарами или олигопептидами и которые быстро расщепляются в организме с образованием эффективных соединений согласно данному изобретению. К ним относятся также способные разлагаться биологическим способом полимерные производные соединений данного изобретения, как описывается, например, в публикации Int. J. Pharm. 115, 61-67 (1995).
Кроме того, изобретение относится к способу получения соединений формулы I по Пункту 1 и их солей, отличающемуся тем, что
а) соединение формулы II
H-Q1-R1, (II)
в котором Q1 и R1 принимают значения, указанные в Пункте 1, взаимодействует по реакции ацилирования с соединением формулы III
X-L, (III)
в котором X принимает значения, указанные в Пункте 1, и L-Cl, Br, I или представляет собой свободную или функционально модифицированную реакционноспособную ОН группу, или
b) соединение формулы IV
H-Q2-R2, (IV)
в котором
Q2 и R2 принимают значения, указанные в Пункте 1, взаимодействует в соответствии с реакцией ацилирования с соединением формулы V
R1-Q1-X-L, (V)
в котором
R1, Q1, X и L принимают указанные значения, или
с) соединение формулы II
H-Q1-R1, (II)
в котором
Q1 и R1 принимают значения, указанные в Пункте 1, взаимодействует в дополнительной реакции с соединением формулы VI
X-U, (VI)
в котором
X принимает значения, указанные в Пункте 1, и U представляет собой -N=C= O, -N=C=S или малеимидил, или
d) они выделяются из одной из их функциональных производных посредством обработки сольволизирующим или гидрогенолизирующим реагентом, и/или тем, что основное или кислотное соединение формулы I превращается в одну из его солей в результате обработки кислотой или основанием.
В приведенном выше тексте и в том, который следует далее, радикалы Q1, Q2, R, R, X и L, если не указаны другие значения, принимают значения, приведенные в формулах I, II и III.
В приведенных выше формулах, алкил предпочтительно представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил и дополнительно также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1- этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3- , 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил или 1,1,2- или 1,2,2-триметилпропил.
Алкилен предпочтительно представляет собой метилен, этилен, пропилен, бутилен, пентилен или гексилен, Алкиленфенил предпочтительно представляет собой бензил или фенэтил. Алкиленфенилалкилен предпочтительно представляет собой 4-метиленбензил или 4-этиленбензил.
Q1 и Q2 предпочтительно в каждом случае независимо один от другого представляют собой 6-аминогексановую кислоту (6-аминокапроновую кислоту) или отсутствуют, где предпочтительно, например, Q1 представляет собой 6-аминогексановую кислоту и Q2 отсутствует.
М предпочтительно представляет собой Dap, Ser, Cys, Asp, D-Asp, Dab, гомосерин, гомоцистеин, Glu, D-Glu, Thr, Orn, Lys, D-Lys, 4-аминометил-Phe или 4-аминометил-D-Phe.
Аминокислоты и остатки аминокислот, которые указаны для значений Z, также могут быть функциональными производными, причем предпочтительны N-метил, N-этил, N-пропил, N-бензил или Cα-метилпроизводные. Предпочтение также отдается производным Asp и Glu, в частности метиловому, этиловому, пропиловому, бутиловому, трет-бутиловому, неопентиловому или бензиловому сложным эфирам карбоксильных групп, находящихся в боковых цепях, а также производным Arg, которые могут быть замещены в группе -NH=C(=NH)-NH2 ацетильным, бензоильным, метоксикарбонильным или этоксикарбонильным радикалом.
Z предпочтительно представляет собой М, причем предпочтение отдается D-Phe-M, D-Trp-M, D-Tyr-M, D-Phe-Lys, D-Phe-D-Lys, D-Trp-Lys, D-Trp-D-Lys, D-Tyr-Lys, D-Tyr-D-Lys, D-Phe-Orn, D-Phe-Dab, D-Phe-Dap, D-Phe-D-Orn, D-Phe-D-Dab, D-Phe-D-Dap, D-Phe-4-аминометил-Phe, D-Phe-4-аминометил-D-Phe, D-Trp-4-аминометил-Phe, D-Trp-4-аминометил-D-Phe, D-Tyr-4-аминометил-Phe, D-Tyr-4 аминометил-D-Phe, D-Phe-Asp, D-Phe-D-Asp, D-Trp-Asp, D-Trp-D-Asp, D-Tyr-Asp, D-Tyr-D-Asp, D-Phe-Cys, D-Phe-D-Cys, D-Trp-Cys, D-Trp-D-Cys, D-Tyr-Cys, D-Tyr-D-Cys, Phe-D-Lys, Trp-D-Lys, Phe-Orn, Phe-Dab, Phe-Dap, Trp-Orn, Trp-Dab, Trp-Dap, Tyr-Orn, Tyr-Dab, Tyr-Dap, Phe-4-аминометил-О-Phe, Trp-4-аминометил-D-Phе, Tyr-4-аминометил-D-Phe, Phe-D-Asp, Trp-D-Asp, Tyr-D-Asp, Phe-D-Cys, Trp-D-Cys, Tyr-D-Cys, D-Phe-Lys-Gly, D-Phe-M-Gly, D-Trp-Lys-Gly, D-Trp-M-Gly, D-Tyr-Lys-Gly, D-Tyr-M-Gly, D-Phe-Val-Lys, D-Phe-Gly-Lys, D-Phe-Ala-Lys, D-Phe-Ile-Lys, D-Phe-Leu-Lys, D-Trp-Val-Lys, D-Trp-Gly-Lys, D-Trp-Ala-Lys, D-Trp-Ile-Lys, D-Trp-Leu-Lys, D-Tyr- Vai-Lys, D-Tyr-Gly-Lys, D-Tyr-Ala-Lys, D-Tyr-Ile-Lys, D-Tyr-Leu- Lys, а также M-Pro-Ala-Ser-Ser.
Радикал -R6-R4 предпочтительно представляет собой 2-3- или 4-гидроксибензил, 2-, 3- или 4- аминобензил, 2-, 3- или 4-меркаптобензил, 2-, 3- или 4- карбоксибензил, a также предпочтительно 2-, 3- или 4- гидроксифенэтил, 2-, 3- или 4-аминофенэтил, 2-, 3- или 4- меркаптофенэтил или 2-, 3- или 4-карбоксифенэтил.
Алканоил предпочтительно представляет собой формил, ацетил, пропионил, бутирил, пентаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил или октадеканоил.
Ароил предпочтительно представляет собой бензоил или нафтоил.
R13 представляет собой незамещенный, предпочтительно, как указывается, монозамещенный бензоил, причем отдельное предпочтение отдается следующим группам: бензоил, о-, м- или п-метилбензоил, о-, м- или п-этилбензоил, о-, м- или п-пропилбензоил, о-, м- или п-изопропилбензоил, о, м- или п-трет-бутилбензоил, о-, м- или п-аминобензоил, о-, м- или п-(N-метиламино) бензоил, о-, м- или п-метоксибензоил, о-, м- или п-этоксибензоил, о-, м- или п-(N, N-диметиламино) бензоил, о-, м- или п-(М,М-диэтиламино) бензоил, о-, м- или п-фторбензоил, о-, м- или п-бромбензоил, о-, м- или п-хлорбензоил, о-, м-или п-формилбензоил, о-, м- или п-ацетилбензоил, о-, м-или п-пропионилбензоил, о-, м- или п-бутирилбензоил, о-, м- или п-пентаноилбензоил, о-, м- или п-метилтиобензоил, причем предпочтение также отдается следующим группам 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дифторбензоил, 2,3- 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дихлорбензоил, 2,3-, 2,4- 2,5-, 2,6-, 3,4- или 3,5-дибромбензоил, 2-хлор-3-метил-, 2-хлор-4-метил-, 2-хлор-5-метил-, 2-хлор-6-метил-, 2-метил-3-хлор-, 2-метил-4-хлор-, 2-метил-5-хлор-, 2-метил-6-хлор-, 3-хлор-4-метил-, 3-хлор-5-метил- или 3-метил-4-хлорбензоил, 2-бром-3-метил-, 2-бром-4-метил-, 2- бром-5-метил-, 2-бром-6-метил-, 2-метил-3-бром-, 2-метил-4-бром-, 2-метил-5-бром-, 2-метил-6-бром-, 3-бром-4-метил-, 3-бром-5-метил- или 3-метил-4-бромбензоил или 2,5- или 3,4-диметоксибензоил.
R16 представляет собой незамещенный, предпочтительно, как указывается, монозамещенный фенилацетил, причем предпочтение отдается следующим группам: фенилацетил, о-, м- или п-метоксифенилацетил, о-, м- или п-гидроксифенилацетил, о-, м- или п-этоксифенилацетил, о-, м- или п-фторфенилацетил, о-, м- или п-бромфенилацетил, о-, м- или п-хлорфенилацетил, причем предпочтение отдается также следующим группам: 3-фенилпропионил, 4-фенилбутирил, 5-фенилпентаноил, 6-фенилгексаноил, 7-фенилгептаноил, 8-фенилоктаноил, 9-фенилнонаноил, 10-фенилдеканоил, 11-фенилундеканоил, 12-фенилдодеканоил или 13-фенилтридеканоил и, дополнительно, 2,3-метилендиоксифенил, 3,4-метилендиоксифенил, 2,3-дигидробензофуранил или 2,3-дигидро-2-оксобензофуранил.
Циклоалкилен предпочтительно представляет собой циклопропилен, 1,2- или 1,3-циклобутилен, 1,2- или 1,3-циклопентилен, 1,2-, 1,3- или 1,4-циклогексилен и, дополнительно, 1,2-, 1,3- или 1,4-циклогептилен.
D предпочтительно представляет собой CH2, причем предпочтителен также карбонил.
Het предпочтительно представляет собой 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5- оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2- 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, и предпочтительно также 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3- или 5-ил, 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или 5-ил, 1,2,4-оксадиазол-3- или 5-ил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 2-, 3-, 4-, 5- или 6-2H-тиопиранил, 2-, 3- или 4-4-Н-тиопиранил, 3- или 4-пиридазинил, пиразинил, 2-, 3-, 4-, 5-, 6- или 7-бензофурил, 2-, 3-, 4-, 5-, 6- или 7-бензотиенил, 1-, 2-3-, 4-, 5-, 6-или 7-индолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-,4-, 5-, 6- или 7-бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7- бензизотиазолил, 4-, 5-, 6- или 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8- изохинолил, 3-, 4-5-, 6-, 7- или 8-циннолинил или 2-, 4-, 5-, 6-, 7- или 8-хиназолинил. Гетероциклические радикалы могут быть также частично или полностью гидрированы. Следовательно, Het может также представлять собой, например, 2,3-дигидро-2-, -3-, -4- или -5-фурил, 2,5-дигидро-2-, -3-, -4- или -5-фурил, тетрагидро-2- или -3-фурил, 1,3-диоксолан-4-ил, тетрагидро-2- или -3-тиенил, 2,3-дигидро-1-, -2-, -3, -4- или -5-пирролил, 2,5-дигидро-1-2-, -3-, 4- или -5-пирролил, 1-, 2- или 3-пирролидинил, тетрагидро-1-, -2- или -4-имидазолил, 2,3- дигидро-1-, -2-, -3-, -4- или -5-пиразолил, тетрагидро-1-, -3- или -4-пиразолил, 1,4-дигидро-1-, -2-, -3- или -4-пиридил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5- или -6-пиридил, 1-, 2-, 3- или 4-пиперидинил, 2-, 3- или 4-морфолинил, тетрагидро-2-, -3- или 4-пиранил, 1,4- диоксанил, 1,3-диоксан-2-, -4- или -5-тл, гексагидро-1-, -3- или - 4-пиридазинил, гексагидро-1-, -2-, -4- или -5-пиримидинил, 1-, 2- или 3-пиперазинил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-хинолил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-изохинолил.
Аминозащитной группой предпочтительно является ацетил, пропионил, бутирил, фенилацетил, бензоил, толуил, РОА, метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, ВОС, 2-йодэтоксикарбонил, CBZ ("карбобензокси"), 4-метоксибензилоксикарбонил, FMOC, Mtr или бензил.
Остаток флуоресцентного красителя предпочтительно представляет собой 7-ацетоксикумарин-3-ил, флуоресцеин-5-(и/или 6-) ил, 2',7'- дихлорфлуоресцеин-5-(и 6-) ил, дигидротетраметилрозамин-4-ил, тетраметилродамин-5- (и/или 6-)ил, 4,4-дифтор-5,7-диметил-4-бор- 3a,4a-диаза-s-индацен-3-этил или 4,4-дифтор-5,7-дифенил-4-бор- 3a,4a-диаза-с-индацен-3-этил.
Подходящие остатки флуоресцентного красителя, содержащие в качестве заместителей функциональные группы, которые могут использоваться в качестве реагентов для получения соединений формулы I в соответствии с данным изобретением, описываются, например, в публикации R.P. Haugland, "Handbook of Fluorescent Probes and Research Chemicals, 5th Edition, 1992- 1994", Molecular Probes, Inc.
m предпочтительно равно 1, причем предпочтительно также 2.
Hal предпочтительно представляет собой F, Cl или Br, а также I.
Соединения формулы I могут иметь один или более хиральных центров и, следовательно, могут находиться в различных стереоизомерных формах. Формула I охватывает все эти формы.
Соответственно, изобретение относится, в частности, к тем соединениям формулы I, в которых по меньшей мере один из указанных радикалов принимает одно из указанных выше предпочтительных значений. Некоторые предпочтительные группы соединений могут быть представлены следующими частными формулами с Ia по Ih, которые соответствуют формуле I и в которых не указанные конкретно радикалы принимают значения, приведенные в формуле I, но в которых
в a) Q1, Q2 и R2 - отсутствуют,
R1 - цикло-(Arg-Cly-Asp-Z) и
X - алканоил;
в b) Q1, Q2 и R2 - отсутствуют,
R1 - цикло-(Arg-Cly-Asp-M) и
X - алканоил;
в c) Q1, Q2 и R2 - отсутствуют,
R1 - цикло (Arg-Gly-Asp-D-Phe-Lys) и
X - алканоил;
в d) Q1 и Q2 - отсутствуют,
R1 и R2 - представляют собой цикло (Arg-Cly-Asp-D-Phe-Lys), и
X -CO-(CH2)n-CO-;
в e) Q2 и R2 - отсутствуют,
Q1 -NH-(CH2)5-CO-
R1 - цикло-(Arg-Gly-Asp-Z) и
X - флуоресцентно-окрашенный остаток;
в f) Q2 и R2 - отсутствуют,
Q1 - NH-(CH2)5-CO-,
R1 - цикло (Arg-Gly-Asp-M), и
X - флуресцеиноил;
в g) Q1 и Q2 - отсутствуют,
R1 и R2 - представляют собой цикло-(Arg-Cly- Asp-M),
X - -CO-(GH2)8-CO-;
в h) Q1, Q2 и R2 - отсутствуют,
R1 - цикло-(Arg-Gly-Asp-Z) и
X - CH3- (CH2)16-CO-
Особое предпочтение отдается соединениям формулы VII
цикло-(Arg-Gly-Asp-D-Phe-Lys(Q1-X), (VII)
в которой Q1 принимает значения, указанные в Пункте 1, и где Q1 присоединяется к боковой цепи лизина или, если Q1 отсутствует, X присоединяется к боковой цепи лизина, и в которых X предпочтительно представляет собой
алканоил, содержащий 1-18 атомов углерода, который является незамещенным или замещенным и содержит один заместитель, выбранный из группы, включающей COOH, COOA, SR14 или NR15R15', FCA или FTH,
или ароил, содержащий 7-11 атомов углерода, который является незамещенным или замещенным и содержит один или два заместителя, выбранных из группы, включающей алкил, содержащий 1-6 атомов углерода, алкоксигруппу, содержащую 1-4 атома углерода, Hal, SR14 или NR15R15', где R14, R15 и R15' принимают значения, указанные в Пункте 1.
Другими словами, соединения формулы I, а также исходные соединения для их получения получают способами, которые хорошо известны, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie, [Methods of organic chemistry], Georg-Thieme-Verlag, Stuttgard), конкретно в условиях реакций, которые известны и подходят для указанных реакций. В этом контексте могут использоваться также варианты, которые известны, но которые не описаны подробно в данном описании.
Исходные соединения могут быть получены, если это необходимо, непосредственно на месте таким образом, что их не выделяют из реакционной массы, но вместо этого немедленно подвергают дальнейшему превращению с получением соединений формулы I.
Соединения формулы I могут быть предпочтительно получены взаимодействием соединений формулы II с соединениями формулы III.
Как правило, соединения формул II и III известны. Если они не описаны, они могут быть получены способами, которые известны.
В соединениях формулы III радикал L предпочтительно предварительно активируют карбоновой кислотой, предпочтительно карбонилгалогенидом (галогенагидридом карбоновой кислоты), симметричным или смешанным ангидридом или активным сложным эфиром. Радикалы этой природы для активирования карбонильной группы в обычных реакциях ацилирования описаны в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie, [Methods of organic chemistry] , Georg-Thieme-Verlag, Stuttgard).
Активированные сложные эфиры целесообразно получать на месте, например, добавлением HOBt или N-гидроксисукцинимида.
L предпочтительно представляет собой H, F, Cl, Br или -ON-сукцинимид.
Как правило, реакцию проводят в инертном растворителе в присутствии реагента, связывающего кислоту, предпочтительно органического основания, такого как триэтиламин, диметиланилин, пиридин или хинолин, или в избытке карбоксильного компонента формулы III.
Может быть преимущественным также добавление гидроксида щелочного или щелочноземельного металла, карбоната или бикарбоната или другой соли слабой кислоты и щелочных или щелочноземельных металлов, предпочтительно калия, натрия, кальция или цезия.
В каждом случае в зависимости от используемых условий время реакции заключается в интервале от нескольких минут до 14 дней, в то время как температура реакции находится в интервале приблизительно от -30 до 140oC, обычно от -10 до 90o, в частности, от приблизительно 0 до приблизительно 70o.
Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, тетрахлоруглерод, хлороформ или дихлорметан, спирты, такие как метанол, этанол, изопропанол, н-пропанол, н- бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (THF) или диоксан; простые гликолевые эфиры, такие как этиленгликольмонометиловый эфир или этиленгликольмоноэтиловый эфир (метилгликоль или этилгликоль), этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (DMF); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилфульфоксид (DMSO); дисульфид углерода; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол, сложные эфиры, такие как этилацетат; вода или смеси указанных растворителей.
Кроме того, соединения формулы I могут быть получены взаимодействием соединений формулы IV с соединениями формулы V. Как правило, исходные соединения формулы IV и V являются известными соединениями. Если же они не известны, они могут быть получены способами, которые известны.
В соединениях формулы V радикал L предпочтительно предварительно активизируют карбоновой кислотой, предпочтительно галогенангидридом карбоновой кислоты, симметричным или смешанным ангидридом или активным сложным эфиром. Радикалы этой природы для активирования карбоксильной группы в обычных реакциях ацилирования описаны в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie, (Methods of organic chemistry], Georg-Thieme-Verlag, Stuttgard).
L предпочтительно представляет собой F, Cl, Br или -ON-сукцинимид.
Взаимодействие соединений формулы IV с соединениями формулы V проводят в тех же условиях, т.е. при таких же времени реакции, температуре и растворителе, которые были описаны для взаимодействия соединений формулы II с соединениями формулы III.
Кроме того, соединения формулы I могут быть получены взаимодействием соединений формулы II с соединениями формулы VI. Как правило, исходные соединения формул II и VI являются известными соединениями. Если же они не известны, они могут быть получены способами, которые известны.
Взаимодействие соединений формулы II с соединениями формулы III составляет обычное присоединение к изоцианатам. Реакции присоединения такого характера описаны в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie, [Methods of organic chemistry), Georg-Thieme-Verlag, Stuttgard).
Циклические соединения формулы R1 и/или R2 могут быть получены циклизацией линейных соединений, как описано, например, в публикации DE 4310643 или в публикации Houben-Weyl, I.c., Volume 15/11, pages 1-806 (1974).
Соединения формулы I могут быть дополнительно получены выделением из их функциональных производных посредством сольволиза, в частности гидролиза, или посредством гидрогенолиза.
Исходные соединения, которые предпочтительны для сольволиза или гидрогенолиза, представляют собой соединения, которые вместо одной или более свободных амино- и/или гидроксильных групп содержат соответствующие защищенные амино- и/или гидроксильные группы, предпочтительно соединения, которые вместо атома H содержат группу, защищающую аминогруппу и присоединенную к атому N, например соединения, которые соответствуют формуле I, но которые содержат NHR' группу (в которой R' является защитной группой аминогруппы, например, BOC или CBZ) вместо NH2 группы.
Кроме того, предпочтительными являются исходные соединения, которые вместо атома H гидроксильной группы содержат группу, защитную для гидроксильной группы, например, соединения, которые соответствуют формуле I, но содержат R''O-фенильную группу (в которой R" является защитной группой для гидроксильной группы) вместо гидроксифенильной группы.
Некоторые - идентичные или разные - защищенные амино и/или гидроксильные группы могут также присутствовать в молекуле исходного соединения. Если защитные группы, которые присутствуют, различаются одна от другой, они могут во многих случаях удаляться избирательно.
Выражение "защитная группа аминогруппы" хорошо известно и относится к группам, которые подходят для защиты (блокирования) аминогруппы от химических реакций, но которые могут легко удаляться после проведения нужной химической реакции на другие сайты в молекуле. Незамещенные или замещенные ацильные, арильные, аралкоксиметильные или аралкильные группы являются типичными группами этой природы. Поскольку защитные группы аминогрупп удаляются после нужной реакции (или последовательности реакций), их природа и размер не являются определяющими; однако, предпочтительны группы, содержащие 1-10, особенно 1-8 атомов углерода. В отношении данного процесса выражение "ацильная группа" следует понимать в самом широком смысле этого слова. Оно включает ацильные группы, которые получены из алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфоновых кислот, а также, в частности, алкоксикарбонильные, арилоксикарбонильные и, особенно, аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропиноил и бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил или толил; арилоксиалканоил, такой как РОА; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2,5-тpиxлopэтoкcикapбoнил, BOC или 2-йодэтоксикарбонил; аралкоксикарбонил, такой как CBZ ("карбобензокси") 4-метоксибензилоксикарбонил или FMOC; арилсульфонил, такой как Mtr. Предпочтительными защитными группами аминогрупп являются BOC и Mtr, а также CBZ, Fmoc, бензил и ацетил.
Выражение "защитная группа гидроксильной группы" также хорошо известно и относится к группам, которые подходят для защиты гидроксильной группы от химических реакций, но которые могут быть легко удалены после проведения нужной химической реакции на других сайтах в молекуле. Упомянутые выше незамещенные или замещенные арильные, аралкильные или ацильные группы, а также алкильные группы являются типичными группами такого характера. Природа и размер защитных групп гидроксильной группы не являются определяющими, поскольку группы снова удаляют после проведения нужной химической реакции или последовательности реакция; причем группы, содержащие 1-20, в частности 1-10 атомов углерода являются предпочтительными. Примерами защитных групп гидроксильной группы являются помимо прочих бензил, п-нитробензоил, п-толуолсульфонил, трет-бутил и ацетил, причем бензил и трет-бутил особенно предпочтительны. COOH группы в аспарагиновой кислоте и глутаминовой кислоте являются предпочтительно защищенными в форме их трет-бутиловых эфиров (например, Asp(OBut)).
Соединения формулы I, в зависимости от применяемой защитной группы, выделяют из их функциональных производных, используя, например, сильные кислоты, целесообразно TFA или перхлорную кислоту, а также другие сильные неорганические кислоты, такие как соляная кислота или серная кислота, сильные органические карбоновые кислоты, такие как трихлоруксусная кислота, или сульфоновые кислоты, такие как бензолсульфоновая кислота или п-толуолсульфоновая кислота. Возможно, но не всегда необходимо присутствие дополнительного инертного растворителя. Подходящими инертными растворителями являются предпочтительно органические растворители, например, карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан, амиды, такие как DMF, галогенированные углеводороды, такие как дихлорметан, а также спирты, такие как метанол, этанол или изопропанол, а также вода. Смеси ранее упомянутых растворителей также являются приемлемыми. TFA предпочтительно используют в избытке без добавления любого другого растворителя, в то время как перхлорную кислоту используют в форме смеси уксусной кислоты и 70% перхлорной кислоты в соотношении 9:1. Приемлемые температуры реакций расщепления находятся в интервале значений от приблизительно = до приблизительно 50oC, причем предпочтительно проведение раскрытия при температуре от 15 до 30oC (комнатная температура).
BOC, OBut и Mtr группы могут предпочтительно удаляться, например, с использованием TFA в дихлорметане или с использованием приблизительно от 3 до 5 n HCl в диоксане при температуре 15-30oC, в то время как FMOC группа может быть предпочтительно удалена с использованием примерно 5-50% раствора диметиламина, диэтиламина или пиперидина в DMF при 15-30oC.
Тритильная группа используется для защиты аминокислот - гистидина, аспарагина, глутамина и цистеина. В зависимости от нужного конечного продукта, ее удаляют, используя TFA/10% тиофенол, причем тритильная группа удаляется из всех указанных аминокислот, когда используется TFA/анизол или TFA/тиоанизол, тритильная группа удаляется только из His, Asn и Gln, в то время как она остается на боковой цепи в Cys.
Группы, способные удаляться гидрогенолитически (например, CBZ или бензил), могут, например, удаляться обработкой водородом в присутствии катализатора (например, катализатора на основе благородного металла, такого как палладий, и приемлемо на носителе, таком как углерод). Подходящими растворителями в этом контексте являются упомянутые выше растворители, в частности, например, спирты, такие как метанол или этанол, или амиды, такие как DMF. Как правило, гидрогенолиз проводят при температурах в интервале от приблизительно 0 до 100oC
и давлении от 1 до 200 бар, предпочтительно при 20-30oC и 1-10 барах. Подходящим способом удаления CBZ группы является гидрогенолиз на 5-10% Pd/C в метаноле или с использованием формиата аммония (вместо водорода) на Pd/C в смеси метанол/DMF при 20-30oC.
Основание формулы I может быть превращено при взаимодействии с кислотой в ассоциированную кислотно-аддитивную соль, например, взаимодействием эквивалентных количеств основания и кислоты в инертном растворителе, таком как этанол, с последующим концентрированием путем упаривания. Подходящими кислотами для этого взаимодействия являются, в частности, кислоты, которые приводят к получению физиологически безвредных солей. Следовательно, могут использоваться неорганические кислоты, например, серная кислота, азотная кислота, галогенводородные кислоты, такие как соляная кислота или бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, и сульфамовая кислота и, дополнительно, органические кислоты, в частности, алифатические, алициклические, аралифатические, ароматические или гетероциклические моноосновные или полиосновные карбоновые, сульфоновые или серные кислоты, например, муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, сукциновая кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метансульфоновая кислота, этансульфоновая кислота, этандисульфоновая кислота, 2-гидрокси-этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, нафталинмоносульфоновая кислота, нафталиндисульфоновая кислота и лаурилсерная кислота. Соли с кислотами, которые не являются физиологически безвредными, например, пикраты, могут использоваться для выделения и/или очистки соединений формулы I.
С другой стороны, кислоты формулы I могут быть превращены в одну из физиологически безопасных солей металла или аммония путем взаимодействия с основанием. В этом контексте в качестве солей особенно подходят соли натрия, калия, магния, кальция и аммония, а также замещенные аммониевые соли, например, диметил-, диэтил-или диизопропиламмониевые соли, моноэтанол-, диэтанол-или диизопропиламмониевые соли, циклогексил- и дициклогексиламмониевые соли и дибензилэтилендиаммониевые соли, а также, например, соли с аргинином или лизином.
Изобретение дополнительно относится к применению соединений формулы I и/или их физиологически безвредных солей для получения фармацевтических препаратов, в частности, нехимическим способом. В этом контексте, они могут быть введены в подходящую дозированную форму вместе с по меньшей мере одним твердым, жидким и/или полутвердым носителем или вспомогательным веществом и, где это приемлемо, в сочетании с одним или большим количеством дополнительных активных соединений.
Изобретение дополнительно относится к фармацевтическим препаратам, которые содержат по меньшей одно соединение формулы I и/или одну из его физиологически безвредных солей.
Эти препараты могут применяться людьми в качестве фармацевтических средств в медицине и ветеринарии. Подходящими носителями являются органические или неорганические вещества, которые подходят для тонкокишечного (например, перорального), парентерального или местного введения или для введения в форме спрея для ингаляции и которые не взаимодействуют с новыми соединениями, например вода, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, глицеринтриацетат, желатин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк или вазелин. Для перорального применения используются, в частности, таблетки, драже, таблетки с покрытием, капсулы, порошки, гранулы, сиропы, соки или капли, для ректального применения - свечи, для парентерального - растворы, предпочтительно масляные или водные растворы, а также суспензии, эмульсии или имплантанты (внедрения) и для местного применения - мази, кремы или пудры. Новые соединения могут быть также лиофилизированы и образующийся лиофилизат использоваться, например, для получения препаратов для инъекции. Упомянутые препараты могут быть стерилизованы и/или содержать вспомогательные вещества, такие как смазки, консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, соли для регулирования осмотического давления, буферирующие вещества, красители, ароматизаторы и/или некоторые дополнительные активные соединения, например, один или более витаминов. Для введения в качестве ингаляционного спрея могут использоваться спреи, которые содержат активное соединение, растворенное или суспендированное, в пропеллантном газе или пропеллантной газовой смеси (например, CO2 или фторхлоруглеводороды). В этом контексте активное соединение целесообразно используют в микроизмельченной форме, причем возможно присутствие одного или большего количества дополнительных физиологически приемлемых растворителей, например этанола. Ингаляционные растворы могут вводиться с использованием обычных ингаляторов.
Соединения формулы I и их физиологически безвредные соли могут использоваться в качестве ингибиторов интегрина при лечении заболеваний, в частности заболеваний, связанных с патологическим развитием сосудов, тромбозов, сердечных инфарктов, коронарных заболеваний сердца, артериосклероза, воспалений и инфекций.
В этом контексте соединения в соответствии с данным изобретением могут, как правило, вводиться по аналогии с другими известными коммерчески приемлемыми пептидами, в частности, однако, по аналогии с соединениями, описанными в патенте США US-A-4472305, предпочтительно в дозах в интервале от 0,05 до 500 мг, в частности от 0,5 до 100 мг на единичную дозу. Ежедневная доза предпочтительно находится в интервале значений примерно от 0,01 до 2 мг/кг веса тела. Однако конкретная доза для каждого пациента зависит от очень большого количества факторов, например, активности конкретного применяемого соединения, от возраста, веса тела, общего состояния здоровья, сексуального состояния, питания, времени и способа введения, скорости выделения, сочетания фармацевтических средств, тяжести конкретного заболевания, для которого применяется терапия. Предпочтительно парентеральное введение.
Кроме того, новые соединения формулы I могут использоваться в аналитической биологии и молекулярной биологии.
Новые соединения формулы I, в которых X представляет собой флуоресцентно окрашенный остаток, который соединен посредством - CONH-, -COO-, -NH-C(= S)-NH-, -NH-C(=)-NH-, -SO2NH- или -NHCO-связи, могут использоваться как диагностические метки в FACS-анализе (анализ с помощью активируемого флюоресценцией анализатора клеток) и люминесцентной (флюоресцентной) микроскопии.
Применение меченых соединений в люминисцентной микроскопии описывается, например, в публикации Y.-L. Wang, D.L. Taylor, "Fluorescence Microscopy of Living Cells in Culture, Part A+B, Academic Press, Inc. 1989".
Новые соединения формулы I могут также использоваться в аффинной хроматографии для элюирующего связывания белков. В частности они могут использоваться в качестве лигандов интегрина для элюирующих интегринов.
В приведенном выше тексте и далее все температуры приводятся в градусах Цельсия. В следующих далее примерах выражение "обычная обработка" означает: добавляют воду, если это необходимо, pH доводят, если это необходимо и в зависимости от строения конечного продукта, до значения от 2 до 10, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия и упаривают и остаток очищают методом хроматографии на силикагеле и/или кристаллизацией. Rf величины - на силикагеле; подвижная фаза : этилацетат/метанол 9:1.
RT = время удерживания (в минутах) в ВЭЖХ на следующих системах:
[A]
Колонка: Нуклеосил 7C 18250 x 4 мм
Элюент А: 0,1% TFA в воде
Элюент В: 0,1% TFA в ацетонитриле
Скорость истечения: 1 мл/мин
Градиент: 20-50% В/30 мин.
[В]
50 минут, градиент 0-80% 2-пропанол в воде, содержащей 0,3% TFA при 1 мл/мин на колонке Lichrosord® RP Select В (7 мкм) 250 х 4 мм.
[С]
Колонка: Lichrospher (5 мкм) 100 RP 125 x 4 мм
Элюент A: 0,1 М фосфат натрия, pH 7,0
Элюент В: 0,005 М фосфат натрия, pH 7,0/60 объемн.% 2-пропанола
Скорость истечения: 0,7 мл/мин
Градиент 1-99% В/50 мин.
Масс-спектрометрия (MS): EI (ионизация электронным ударом) M+
FAB (бомбардировка быстрыми атомами) (М+Н)+
Пример 1
1,0 г N-сукцинимидилового эфира О-ацетилсалициловой кислоты (можно получать взаимодействием ацетилсалициловой кислоты с HONSu в этилацетате, DMF и с 1,2 эквивалентами диизопропилкарбодиимида, FAB 278] и 0,5 г триэтиламина добавляют в раствор 3,05 г цикло-(Arg-Gly-Asp-D-Phe- Lys) [можно получать циклизацией H-Arg(Mtr)-Gly-Asp(OBut)-D-Phe- Lys(BOC)ОН с получением цикло-(Arg(Mtr)-Gly-Asp(OBut)-D-Phe-Lys (BOC) и последующим удалением защитных групп] в 100 мл DMF. Смесь перемешивают при комнатной температуре в течение 5 часов, и после обычной обработки и сопутствующем удалении ацетильной группы получают цикло-(Arg-Gly-Asp-D-Phe-Lys(Nε-Sal)) x TFA; RT[B] 22,0; FAB 724.
Приведенные далее соединения получают аналогичным образом при взаимодействии цикло-(Arg-Gly-Asp-D-Phe-Lys) с N-сукцинимидиловым эфиром фенилпропионовой кислоты (PhEtCO-ONSu): цикло-(Arg-Gly-Asp-D-Phe-Lys( Nε-PhEtCO) x TFA: RT [C] 28,2; FAB 736; с N-сукцинимидиловым эфиром 3,3,3-трис-(4-хлорфенил)пропионовой кислоты (TCPP-ONSu)
цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε-TCPP)) x TFA;
RT [В] 33,19; FAB 992;
с N-сукцинимидиловым эфиром S-тритилмеркаптопропионовой кислоты (TrtSEtCO-ONSu): цикло-(Arg-Gly-Asp-D-Phe)Lys (Nε-TrtSEtCO)) x TFA;
RT [B] 33,4; FAB 934;
с бензилоксикарбонилхлоридом
цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε-CBZ)) с октаноилангидридом:
цикло-(Arg-Gly-Asp-D-Phe-Lys( Nε-Oct)) x TFA;
RT [B] 27,58; FAB 730;
с уксусным ангидридом:
цикло-(Arg-Gly-Asp-D-Phe-Lys( Nε -Ac)) x TFA;
RT [B] 17,02; FAB 646;
с FCA-N-сукцинимидиловым эфиром:
цикло-((Arg-Gly-Asp-D-Phe-Lys (Nε FCA))
RT [B] 24,18; FAB 962;
с FITC:
цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε-FTH)) x TFA;
RT [B] 27,3; FAB 994;
внутренняя соль с NH4HCO; RT [В] 22,26.
Приведенное далее соединение получают аналогичным образом при взаимодействии цикло-(Arg-Gly-Asp-D-Phe-N(Me)-Lys)
с FITC:
цикло-(Arg-Gly-Asp-D-Phe-N(Me)-Lys( Nε FTH));
RT 22,64; FAB 1007;
с бензилоксикарбонилхлоридом (CBZ-Cl)
цикло-(Arg-Gly-Asp-D-Phe-N(Me)Lys( Nε -CBZ));
RT 23,25; FAB 752.
Пример 2
6 г BOC-Aha-N-сукцинимидилового эфира добавляют в раствор 3,05 г цикло-(Arg-Gly-Asp-D-Phe-Lys) в 40 мл 5% водного раствора NaHCO3 и 40 мл THF. Смесь перемешивают в течение 4 часов и обрабатывают обычным способом, в результате получают цикло-(Arg-Gly-Asp-D-Phe-Lys(BOC-Aha)); RT [C] 27,7; FAB 817. Затем BOC группу удаляют в смеси HCl/диоксан и после обычной обработки получают цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε-Aha)) x 2 TFA; RT [С] 14,76; FAB 717.
Цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -FCA-Aha)) x TFA; RT [B] 23,8; FAB 1075 получают аналогично Примеру I последующей реакцией с FCA-N-сукцинимидиловым эфиром.
Приведенные далее соединения получают аналогичным образом с помощью реакции цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -Aha))
с FITC:
цикло-(Arg-Gly-Asp-D-Phe-Lys(Nε -Aha))
с уксусным ангидридом:
цикло-(Arg-Gly-Asp-D-Phe-Lys(Nε -Ac-Aha)) х TFA;
RT [В] 17,1; FAB 759.
Пример 3
По аналогии с Примером 2 цикло-(Arg-Gly-Asp-D-Phe- Lys(N-BOC-Aha)-Gly) получают из цикло-Arg-Gly-Asp-D-Phe-Lys-Gly) [может быть получен циклизацией H-Arg-(Mtr)-Gly-Asp-(OBut)-D-Phe- Lys (BOC)-Gly-OH с получением цикло-(Arg(Mtr)-Gly-Asp(OBut)-D-Phe- Lys (BOC)-Gly) и с последующим удалением защитных групп] и BOC- Aha-N-сукцинимидилового эфира;
После удаления BOC группы в смеси HCl/диоксан и после обычной обработки получают цикло (Arg-Gly-Asp-D-Phe-Lys( Nε -Aha)- Gly) x 2 TFA.
Указанное далее соединение получают аналогичным описанному в Примере 1 способом, последовательно реакцией цикло-(Arg-Gly-Asp-D-Phe-Lys(Nε-Aha)-Gly x 2 TFA N-сукцинимидиловым эфиром фенилпропионовой кислоты: цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε -PhEtCO-Aha)-Gly.
Указанные далее соединения получают аналогичным образом реакцией цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε -Aha)-Gly) с октаноиловым ангидридом; цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε -Oct-Aha) -Gly)
с FCA-N-сукцинимидиловым эфиром;
цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε -FCA-Aha)-Gly)
с FITC:
цикло-(Arg-Gly-Asp-D-Phe-Lys ( Nε -FTH-Aha)Gly).
Способом, аналогичным описанному в Примере 2, цикло-(Arg-Gly-Asp-D-Phe-Val-Lys-( Nε -BOC-Aha)) x TFA получают из цикло-(Arg-Gly-Asp-D-Phe-Val-Lys) [может быть получен циклизацией H-Arg(Mtr)-Gly-Asp-(OBut)-D-Phe-Val-Lys (BOC)-ОН с получением цикло-(Arg(Mtr)-Gly-Asp(OBut)-D-Phe-Val-Lys (BOC)) и последующим удалением защитных групп] и BOC-Aha-N-сукцинимидилового эфира.
После удаления BOC группы в смеси HCl/диоксан и после обычной обработки получают цикло-(Arg-Gly-Asp-D-Phe-Val-Lys( Nε-Aha)) x 2 TFA.
Аналогично Примеру 1 цикло-(Arg-Gly-Asp-D-Phe-Val- Lys( Nε- PhEtCo-Aha)) получают последовательно взаимодействием цикло-(Arg-Gly-Asp-D-Phe-Val-Lys (Nε-Aha)) x 2 TFA с N-сукцинимидиловым эфиром фенилпропионовой кислоты.
Пример 4 (см. в конце описания).
Пример 5
Цикло-(Arg-Gly-Asp-D-Phe-Lys(Nε-HSEtCO)) х TFA; RT [В] 18,54; FAB 692 получают после обычной обработки посредством удаления тритильной группы из цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -TrtSEtCO)) при использования смеси TFA/тиофенол.
Пример 6
2,0 г N-сукцинимидилового монометилового эфира сукциновой кислоты (succinic acid N-cuccinimidyl ester monomethyl ester) и 0,5 г триэтиламина добавляют в раствор 3,05 г цикло-(Arg-Gly-Asp-D-Phe-Lys) в 100 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 5 часов, и после обычной обработки получают цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -H3COCO (CH2)2 СО)). Цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -HOCO (CH2)2CO)) получают гидролизом сложного эфира водным гидроксидом калия. Цикло-(Arg-Gly-Asp-D-Phe-Lys (Nε -SuN-O-CO(CH2CO) получают последующим взаимодействием с HONSu в этилацетате. Следующее соединение - цикло-(Arg-Gly-Asp-D-Phe-Lys( Nε -CO(CH2)2CO-R2), где R2 - цикло-(Arg-Gly-Asp-D-Phe-Lys-Gly(Nε -Gly), получают по аналогии с Примером 1 взаимодействием с цикло-(Arg-Gly-Asp-D-Phe-Lys-Gly).
Пример 7
0,5 мл уксусной кислоты и 0,5 г палладия на активированном угле добавляют в раствор 1,17 г цикло-(Arg(Mtr)-Gly-Asp(OBut)-D-Phe-Lys(CBZ)) в 50 мл диметилацетамида и смесь перемешивают в течение 2 часов под атмосферой водорода. Цикло-(Arg(Mtr) Gly-Asp(OBut)-D-Phe-Lys) ("В"); RT [A 30-80% ацетонитрил] 18,6 получают после удаления катализатора и последующей обычной обработки.
0,075 г Ангидрида сукциновой кислоты добавляют в раствор 0,3 г "В" в 15 мл DMF и смесь перемешивают при комнатной температуре в течение 12 часов. 0,26 г цикло-(Arg-(Mtr)-Gly-Asp(OBut)-D-Phe-Lys( Nε -CO-(CH2)2- COOH)) ("С"); RT [A, 30-80% ацетонитрил] 19,2; FAB 972 -получают после обычной обработки.
0,1 г EDCI x HCl, 0,075 г HOBt и раствор 0,3 г "В" в 15 мл DMF добавляют к раствору 0,23 г "В" в 20 мл DMF и смесь перемешивают в (течение 12 часов. Цикло-(Arg(Mtr)-Gly-Asp(OBut)-D-Phe-Lys)2 (COCH2CH2CO) ("D"), RT [A, 30-80% ацетонитрил] 26,6; FAB 1826; получают после обычной обработки.
Раствор, включающий 85,5% TFA, 2% воды, 2,5% этандитиола, 5% фенола, 5% тиоанизола и 0,25 г "D", перемешивают при комнатной температуре в течение 24 часов. После обычной обработки получают цикло-(Arg-Gly-Asp-Phe-Lys)2 (COCH2CH2CO); RT [A, 10-50% ацетонитрил] 20,2; FAB 1289.
Аналогичным образом, взаимодействием цикло-(Arg(Mtr)-Gly-Asp-(OBut)-D-Phe-Lys)CBZ)) с ангидридом дитиодипропионовой кислоты (DTDB-OH) получают бис- Nε -цикло-(Arg-Gly-Asp-D-Phe-Lys)-DtDP; RT 20,73; FAB - 1382.
Следующие далее примеры относятся к фармацевтическим препаратам:
Пример A: Пузырьки для инъекций
pH раствора 100 г активного соединения формулы 1 и 5 г динатрийгидрофосфата в 3 л дважды дистиллированной воды доводят до 6,5 с помощью 2N соляной кислоты, стерилизуют фильтрованием и используют для наполнения пузырьков для инъекций; раствор лиофилизируют и пузырьки запаивают в стерильных условиях. Каждый пузырек для инъекции содержит 5 мг активного соединения.
Пример В: Свечи
Смесь 20 г активного соединения формулы I со 100 г соевого лецитина и 1400 г кокосового масла расплавляют, заливают в формы и дают охладиться. Каждая свеча содержит 20 мг активного соединения.
Пример C:
Раствор получают из 1 г активного соединения формулы I, 9,38 г NaH2PO4•H2O, 28,48 г Na2HPO4•12H2O и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. pH раствора доводят до 6,8, общий объем раствора доводят до 1 л и стерилизуют облучением. Раствор может использоваться в форме глазных капель.
Пример D: Мазь
500 мг активного соединения формулы 1 смешивают с 99,5 г вазелина в асептических (asceptic) условиях.
Пример E: Таблетки
Смесь 1 кг активного соединения формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния прессуют (сдавливают) в таблетки обычным способом так, что каждая таблетка содержит 10 мг активного соединения.
Пример F: Таблетки, покрытые оболочкой
Таблетки прессуют способом, аналогичным описанному в Примере E, причем после этого таблетки обычным способом покрывают оболочкой, которая включает сахарозу, картофельный крахмал, тальк, трагакант и краситель.
Пример G: Капсулы
2 кг активного соединения формулы I помещают обычным способом в твердые желатиновые капсулы таким образом, что каждая капсула содержит 20 мг активного соединения.
Пример H: Ампулы
Раствор 1 кг активного соединения формулы I в 60 л дважды дистиллированной воды стерилизуют фильтрованием и используют для наполнения ампул; раствор лиофилизируют и ампулы запаивают в стерильных условиях. Каждая ампула содержит 10 мг активного соединения.
Пример 1: Спрей для ингаляций
14 г активного соединения формулы I растворяют в 10 л изотонического раствора NaCl и раствор используют для наполнения коммерчески доступных баллончиков для распыления, которые имеют нагнетающий механизм. Раствор может распыляться в рот или в нос. Один "выстрел" разбрызгивания (приблизительно 0,1 мл) соответствует дозе приблизительно 0,14 мг.
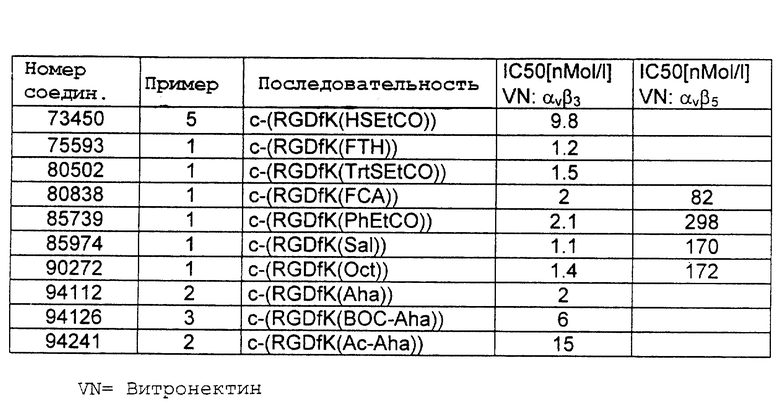
Данные фармакологической активности для представителей соединений формулы (I):
Значения JC50 связывания биотинилированных лигандом с человеческой планетарной αvβ3 и αvβ5 см. в таблице в конце описания.
Методика
1 мкг мл-1 биотин-лиганда культивитруют с 1 мкг мл-1 покрытого рецептора в присутствии серийно (последовательно) разбавленных EMD пептидов.
Спустя 3 часа при 30oC связывание лиганда измеряют с помощью анти-биотин-щелочнофосфатного детектирования (по Smith и др. J.Biol. Cham. (1990)).
Из результатов таблицы следует, что для некоторых представителей соединений настоящего изобретения значения JC50 связывания с αvβ3 и αvβ5 являются неожиданно низкими, что доказывает, что соединения являются активными αvβ3 и αvβ5 ингибиторами интегрина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2130030C1 |
| БИОТИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2171807C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2157379C2 |
| ЦИКЛИЧЕСКИЕ СУЛЬФОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2161616C2 |
| ЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ АДГЕЗИИ | 1997 |
|
RU2184121C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2151776C1 |
| ПРОИЗВОДНЫЕ 2,1,3-БЕНЗОТИАДИАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1997 |
|
RU2175320C2 |
| СПОСОБ ВВЕДЕНИЯ КАЖДОЙ ИЗ МНОЖЕСТВА ДОЗ СЫПУЧЕГО МАТЕРИАЛА В СООТВЕТСТВУЮЩЕЕ ОТДЕЛЕНИЕ КОНТЕЙНЕРА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2150415C1 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИДИНОБЕНЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1997 |
|
RU2158263C2 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2096415C1 |








Описываются новые соединения формулы I R1-Q1-Х-Q2-R2 I, где Q1, Q2 в каждом случае независимо один от другого либо отсутствует, либо представляют собой -NН-(СН2)n-СО, n = 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10; R1, R2 в каждом случае независимо друг от друга либо отсутствуют, либо представляют собой цикло-(Arg-Gly-Asp-Z), где Z связан в боковой цепи с Q1 или Q2, или, если Q1 и/или Q2 отсутствуют(ет), с Х и где по меньшей мере один из радикалов R1 или R2 должен всегда присутствовать, Х представляет собой -СО-R18-СО-, и, если R1-Q1- или R2 -Q2 - отсутствует, R10, R13, R16, остаток флуоресцентного красителя, который связывается посредством СОNН-, -СОО-, -NН-С-(=S)-NН- связей или салицилоил; Z в каждом случае независимо представляет собой остаток аминокислоты, или ди-, или три-пептида, аминокислоты независимо выбирают из группы, включающей Ala, Asn, Asp, Arg, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val или М, где указанные аминокислоты могут быть производными и остатками аминокислот, соединенными один с другим подобно пептиду при помощи α-амино- и α-карбоксильных групп, и где М всегда присутствует, М представляет собой NН(R8)СН(R3)СООН, R3 - -R5 - R4, -R6 - R4; R4 представляет собой ОН, SH; R5 - алкилен, содержащий 1 - 6 атомов углерода, R6 - алкиленфенилен, содержащий 7 - 14 атомов углерода, R8 - Н; R10 - алканоил, который содержит 1 - 18 атомов углерода и является незамещенным или замещенным и содержит один заместитель, выбранный из группы, включающей СООН, SR11 или NR12R12'; R11 - Н или тритил; R12, R12' - каждый независимо один от другого представляет собой Н, алкил, содержащий 1 - 8 атомов углерода или защитную группу аминогруппы, R13 - ароил, который содержит 7 - 11 атомов углерода и является незамещенным или содержит один или два заместителя, выбранных из группы, включающей алкил, содержащий 1 - 6 атомов углерода, R16 представляет собой аралканоил, который содержит 7 - 19 атомов углерода и который не замещен или замещен в арильном фрагменте одним Hal заместителем; R18 отсутствует или представляет собой алкенил, содержащий 1 - 8 атомов углерода; Hal - F, Cl, Br или I. Новые соединения могут найти применение в качестве ингибиторов интегрина, в частности, для профилактики и лечения заболеваний кровообращения, тромбоза, сердечного инфаркта коронарных заболеваний сердца, артериосклероза и заболеваний, связанных с развитием сосудов, а также в терапии опухолей. 3 с. и 3 з.п. ф-лы, 1 табл.
R1-Q1-X-Q2-R2
в котором Q1, Q2 в каждом случае независимо один от другого либо отсутствуют, либо представляют собой -NH-(CH2)n-CO-, n = 1,2,3,4,5,6,7,8,9 или 10;
R1, R2 в каждом случае независимо друг от друга либо отсутствуют, либо представляют собой цикло-(Arg-Gly-Asp-Z), где Z связан в боковой цепи с Q1 или Q2, или, если Q1 и/или Q2 отсутствуют(ет), с X и где по меньшей мере один из радикалов R1 или R2 должен всегда присутствовать;
X представляет собой -CO-R18-CO- и R1-Q1- или R2-Q2- отсутствует, R10, R13, R16, остаток флуоресцентного красителя, который связывается посредством CONH-, -COO-, -NH-C-(=S)-NH- связей или салицилоил;
Z в каждом случае независимо представляет собой остаток аминокислоты или ди- или трипептида, аминокислоты независимо выбирают из группы, включающей Ala, Asn, Asp, Arg, Cys, Cln, Glu, Cly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val или M, где указанные аминокислоты могут быть производными и остатками аминокислот, соединенными один с другим подобно пептиду при помощи α-амино- и α-карбоксильных групп, и где М всегда присутствует,
М представляет собой NH(R8)CH(R3)COOH,
R3--R5-R4, -R6-R4;
R4 представляет собой OH, SH;
R5 - алкилен, содержащий 1-6 атомов углерода;
R6 - алкиленфенилен, содержащий 7-14 атомов углерода;
R8 - H;
R10 - алканоил, который содержит 1-18 атомов углерода и является незамещенным или замещенным и содержит один заместитель, выбранный из группы, включающей COOH, SR11 или NR12R12';
R11 - H или тритил;
R12, R12' - каждый независимо один от другого представляет собой H, алкил, содержащий 1-8 атомов углерода или защитную группу аминогруппы;
R13 - ароил, который содержит 7-11 атомов углерода и является незамещенным или содержит один или два заместителя, выбранных из группы, включающей алкил, содержащий 1-6 атомов углерода;
R16 представляет собой аралканоил, который содержит 7-19 атомов углерода и который не замещен или замещен в арильном фрагменте одним Hal заместителем;
R18 - отсутствует или представляет собой алкилен, содержащий 1-8 атомов углерода;
Hal-F, Cl, Br или I,
при условии, что остатки представляют собой остатки оптически активных аминокислот и их производных, включаются в обе D и L формы, и их соли.
R1-Q1-X-Q2-R2 I
а) в которых Q1, Q2 и R2 отсутствуют, R1-цикло-(Arg-Gly-Asp-D-Phe-Lys) и X - ацетил;
b) в которых Q1, Q2 и R2 отсутствуют, R1-цикло-(Arg-Gly-Asp-D-Phe-Lys) и X-CO-(CH2)2-SH;
c) в которых Q1, Q2 и R2 отсутствуют, R1-цикло-(Arg-Gly-Asp-D-Phe-Lys) и X - салицилоил;
d) в которых Q1 и Q2 - отсутствуют, R1 и R2 - представляют собой цикло-Arg-Gly-Asp-D-Phe-Lys) и X-CO-(CH2)2-CO-;
e) в которых Q2 и R2 отсутствуют, Q1-NH-(CH2)5-CO-, R1 представляет собой цикло-(Arg-Gly-Asp-D-Phe-Lys) и X -ацетил;
f) в которых Q2 и R2 отсутствуют; Q1-NH-(CH2)5-CO-, R1-цикло-(Arg-Gly-Asp-D-Phe-Lys) и X - флуресценоил;
q) в которых Q2 и R2 отсутствуют, Q1 представляет собой -NH-(CH2)5-CO-, R1 представляет собой цикло-(Arg-Gly-Asp-D-Phe-Lys) и X - трет-бутоксикарбонил;
и физиологически безопасные соли указанных соединений.
H-Q1-R1 II
в котором Q1 и R1 принимают значения, указанные в п.1,
взаимодействуют по реакции ацилирования с соединением формулы III
X-L III
в котором X принимает значения, указанные в п.1,
L представляет собой свободную или функционально модифицированную реакционноспособную ОН группу.
| RU 93050068 A, 27.04.1996 | |||
| DE 4310643 A1, 06.10.1994 | |||
| RICHTER L.S | |||
| "Peptide - Cyclization on solid support, a fact and officient rout to small cyclopeptides" | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
Авторы
Даты
2001-10-10—Публикация
1996-10-14—Подача