Изобретение относится к новым циклопептидам формулы I:
Cyclo-(Arg-Gly-Asp-X-Y) (I),
где: X означает Cha, Nal, Phe, 2-Rl-Phe, 3-R1-Phe, 4-Rl-Phe, гомо-Phe, Phg, Thi, Trp, Туr или производные Туr, причем группа ОН может быть этерифицирована алкильным остатком с 1-18 атомами углерода, и указанные аминокислотные остатки могут быть дополнительно переведены в производные,
R1 означает NH2, NO2, I, Br, Cl, F, алкил с 1-18 атомами углерода, Аr, Аr-O или 3H,
Y означает Gly, причем α-N-атом может быть замещен R2 и/или α-С-атом замещен R3 и/или R4 при условии, что Gly по меньшей мере однократно замещен указанным образом,
Аr означает фенил, который при необходимости одно- или двукратно замещен NН2, NO2, I, Br, Cl, F, алкилом с 1-6 атомами углерода или 3H,
R2, R3, или R4 означают независимо друг от друга алкил с 1-18 атомами углерода
или
R2 и R3
или
R3 и R4 вместе образуют также разветвленную или неразветвленную алкиленовую цепь с 3-18 атомами углерода так, что при этом образуют кольцо либо α-N-атом и α-С-атом вместе с алкиленовой цепью, либо один α-С-атом вместе с алкиленовой цепью,
при этом, если речь идет об остатках оптически активных аминокислот и производных аминокислот, то изобретение включает D- и L-формы, а также производные, в особенности β-эфир аспарагиновой кислоты, или N-гуанидин-ацильные производные аргинина, пролекарства и их физиологически совместимые соли.
Аналогичные соединения известны, например, из ЕР 0406428 и FEBS Lett., 291, 1991 г., стр. 50-54.
Задачей изобретения является создание новых соединений с ценными свойствами, в особенности таких, которые могут применяться при получении лекарственных средств.
Неожиданно было показано, что соединения формулы I и их соли обладают очень ценными свойствами. Прежде всего они являются ингибиторами интегрина, причем в особенности они ингибируют взаимодействие между рецепторами β3- или β5-интегрина и лигандами. Особую активность проявляют соединения в случае интегринов avβ3, avβ5 и αIIβ3, а также по отношению к avβ1- , avβ6- и avβ8-рецепторам. Эта активность может быть подтверждена, например, методом, описанным J.W. Smith и др. в ж. Biol. Chem. 265, 1990 г., стр. 12267-12271. Дополнительно они оказывают противовоспалительное действие.
Зависимость происхождения ангиогенеза от взаимодействия между сосудистыми интегринами и внеклеточными протеинами матрикса описана Р.С. Brooks, R. A. Clark и D.A. Cheresh в Science, 264, 1994 г., стр. 569-571.
Возможность ингибирования такого взаимодействия и вызываемое им начало апотоза (запрограммированной гибели) ангиогенных сосудистых клеток под действием циклического пептида описаны Р.С. Brooks, A.M. Montgomery, M. Rosenfeld, R. A. Reisfeld, Т. - Нu, G. Klier и D.A. Cheresh в Cell, 79, 1994 г., стр. 1157-1164.
Соединения формулы I, блокирующие взаимодействие между рецепторами интегринов и лигандами, как, например, между фибриногеном и рецептором фибриногена (гликопротеин IIb/IIIa), в качестве GPIIb/IIIa-антагонистов препятствуют распространению опухолевых клеток путем метастаз. Это подтверждено следующими наблюдениями.
Распространение опухолевых клеток из одной локальной опухоли в сосудистую систему происходит в результате образования микроагрегатов (микротромбов) путем взаимодействия между опухолевыми клетками и тромбоцитами. Опухолевые клетки экранированы защитой в микроагрегате и не распознаются клетками иммунной системы.
Микроагрегаты способны осаждаться на стенках сосудов, чем дополнительно облегчается проникновение опухолевых клеток в ткань. Поскольку образование микротромбов вызывается связыванием фибриногена с рецепторами фибриногена на активированных тромбоцитах, то GPIIa/IIIb-антагонисты могут рассматриваться как эффективные ингибиторы метастаза.
Соединения формулы I могут также применяться в качестве противомикробных средств при операциях, когда используются биоматериалы, имплантаты, катетеры и стимуляторы сердца. В этом случае они оказывают антисептическое действие. Эффективность противомикробной активности может быть подтверждена способом, описанным Р. Valentin-Weigund и др. в Infection and Immunity (Инфекция и иммунитет), 1988 г., стр. 2851-2855.
Так как соединения формулы I представляют собой ингибиторы связывания фибриногена и, следовательно, лигандов рецепторов фибриногена на тромбоцитах, они могут использоваться in vivo в качестве диагностических средств для определения и локализации тромбов в сосудистых системах в том случае, когда они замещаются, например, радиоактивным или УФ-детектируемым остатком.
Соединения формулы I как ингибиторы связывания фибриногена могут применяться также в качестве эффективных вспомогательных средств при исследовании метаболизма тромбоцитов на различных стадиях активации или в виде межклеточных сигнальных механизмов рецептора фибриногена. Детектируемая единица встраиваемой "метки", например изотопная маркировка с помощью 3H, позволяет по связыванию с рецептором исследовать упомянутые механизмы.
Следовательно соединения обладают свойством ингибирования связывания естественных или искусственных лигандов интегринами, в особенности интегринами avβ3, αvβ5 и aIIβ3, а также avβ1, avβ6 и avβ8.
Кроме того, по сравнению с уровнем техники они обладают преимуществом, что благодаря α-N-алкилированию или α-С-алкилированию аминокислотного остатка Y обеспечивается метаболическая стабилизация и повышенная растворимость жиров. В результате уменьшения количества возможных водородных мостиков, так как N-алкил не может быть донором Н для группы С=О, повышается проникающая способность через мембраны, вследствие чего можно достигнуть повышенную оральную всасываемость, что может способствовать усилению связывания протеинов плазмы.
α-N-Алкилирование или α-С-алкилирование аминокислотного остатка Y повышает ингибирующую способность соединений и повышает селективность при ингибировании определенных интегринов. В особенности N-алкильными группами можно влиять на селективность.
Соединения можно использовать в качестве активных веществ лекарственных средств в медицине и ветеринарии, в особенности для профилактики и лечения заболеваний кровообращения, тромбоза, инфаркта миокарда, артериосклероза, воспалений, апоплексии, стенокардии, опухолевых заболеваний, остеолитических заболеваний, в частности остеопороза, ангиогенеэа и вызванных им болезней, как, например, диабетическая ретинопатия глаза, офтальмологические заболевания, дегенеративные изменения в области желтого пятна, близорукость, глазной гистоплазмоз, ревматический артрит, остеоартрит, краснушная глаукома, а также язвенный колит, болезнь Крона, множественный склероз, псориаз, а также рестеноз после ангиопластики. Кроме того, соединения могут применяться для улучшения и поддержания процессов заживления ран при микробных инфекциях и острой почечной недостаточности.
Такие эффекты могут быть подтверждены, например, с помощью известных из литературы методов, например описанных Р.С. Brooks и др. в Cell. 79, 1994 г. , стр. 1157-1164, или Science 264, 1994 г., стр. 569-571.
Приведенные ниже сокращения аминокислотных остатков означают остатки следующих аминокислот:
Abu - 4-аминомасляная кислота
Acha - α-аминоциклогексанкарбоновая кислота
Асра - α-аминоциклопентанкарбоновая кислота
Aha - 6-аминогексановая кислота
Ahds - 16-аминогексадекановая кислота
Aib - 3-аминоизомасляная кислота
А1а - аланин
Aos - 8-аминооктановая кислота
Asn - аспарагин
Asp - аспарагиновая кислота
Asp(OR) - аспарагиновая кислота (сложный β-эфир)
Аrg - аргинин
N-Ac-Аrg - N-гуанидиноациларгинин
Cha - 3-циклогексилаланин
Dab - 2,4-диаминомасляная кислота
Dap - 2,3-диаминопропионовая кислота
Deg - диэтилглицин
Gln - глутамин
Glu - глутаминовая кислота
Gly - глицин
hPro - пипеколиновая кислота
His - гистидин
Ilе - изолейцин
Leu - лейцин
Lys - лизин
Nal - 3-(2-нафтил)-аланин
Nhdg - N-гексадецилглицин
Nle - норлейцин
Phe - фенилаланин
homoPhe - гомо-фенилаланин
4-Hal-Phe - 4-галоген-фенилаланин
Phg - фенилглицин
Pro - пролин
Sar - саркозин (N-метилглицин)
Tia - 3-(2-тиенил)-аланин
Tic - тетрагидроизохинолин-3-карбоновая кислота
Thr - треонин
Tle - трет. лейцин(Cα-трет.-бутилглицин)
Тrр - триптофан
Туr - тирозин
Val - валин
Кроме того, приводимые ниже сокращения означают:
ВОС - трет-бутоксикарбонил
Bzl - бензил
DCCI - дициклогексилкарбодиимид
DMF - диметилформамид
EDCI - N-этил-N'-(3-диметиламинопропил)-карбодиимид•НСl
Et - этил
Fmoc - 9-фторфенилметоксикарбонил
HOBt - 1-гидроксибензотриазол
Me - метил
Mtr - 4-метокси-2,3,6-триметилфенил-сульфонил
NMe - N-метилированная α-аминогруппа
OBut - сложный трет-бутиловый эфир
ОMе - сложный метиловый эфир
OEt - сложный этиловый эфир
РОА - феноксиацетил
TBTU - 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний-тетрафторборат
TFA - трифторуксусная кислота
Если приведенные выше аминокислоты могут обладать несколькими энантиомерными формами, то они также включают указанные выше и ниже по тексту, например, в качестве составных частей соединений формулы I все эти формы, а также их смеси (например, формы DL). Кроме того, аминокислоты, например, в качестве составной части соединений формулы I, могут включать соответствующие известные защитные группы.
Кроме того, изобретение включает и такие пептиды, аминокислотные остатки которых частично или полностью превращены в производные. Под понятием "превращение в производные" следует понимать, что изобретение включает и так называемые пролекарства, например, N-гуанидино-ацильные производные Аrg, β-сложные эфиры Asp, Nδ-алканоильные-, аминоалканоильные-, меркаптоалканоильные производные лизина. Кроме того, аминокислотные остатки могут быть частично С-альфа-алкилированы или, например, помечены изотопами для диагностических целей. Далее изобретение включает такие соединения формулы I, которые в боковых цепях остатков Х и Y дополнительно превращены в производные в виде амино-, карбокси- или меркаптогрупп, так как такие производные являются важными исходными соединениями при получении высокомолекулярных конъюгатов, предназначенных, например, для иммунизации и получения антител. Возможно также применять функциональные группы в боковой цепи определенных аминокислотных остатков или аминокислотных остатков, переведенных в производные, при иммобилизации пептидов на полимерных материалах при изготовлении колонок для аффинной хроматографии или использовать функциональные группы для превращения в производные с помощью диагностических вспомогательных реактивов, таких как флюоресцирующие заместители.
Предметом изобретения является также способ получения соединения формулы I по п.1 формулы изобретения или одной из его солей, отличающийся тем, что соединение высвобождают из одного из его функциональных производных обработкой сольволизирующим или гидрогенолизирующим средством или пептид формулы II:
H-Z-OH (II),
где Z означает -Arg-Gly-Asp-X-Y-
-Gly-Asp-X-Y-Arg-
-Asp-X-Y-Arg-Gly-
-X-Y-Arg-Gly-Asp- или
-Y-Arg-Gly-Asp-X-,
или реакционноспособное производное такого пептида обрабатывают циклизирующим веществом,
или тем, что циклопептид, соответствующий формуле I, содержащий одну или несколько свободных аминогрупп, кислотных групп и/или активированных α-С-атомов, переводят в производное алкилированием, ацилированием или этерификацией,
и/или тем, что основное или кислотное соединение формулы I переводят в одну из его солей путем обработки кислотой или основанием.
Остатки Х и Y, приводимые выше и ниже по тексту, имеют указанные для формул I и II обозначения, если не оговорено иначе. Использованные буквенные обозначения соответствующих остатков не связаны с кодовыми заглавными буквами аминокислот.
В приведенных выше формулах алкил означает преимущественно метил, этил, изопропил, н-бутил, втор-бутил или трет-бутил. Кроме того, алкил означает также преимущественно н-пентил, изопентил, неопентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил или н-гексадецил.
Группа Х означает преимущественно Рhе, также преимущественно D-Phe, а также Phe(4-Hal), в частности Phe(4-F) или Phe(4-Cl), а также гомо-Phe или Phg, при этом в одинаковой степени предпочтительны и формы D.
Y означает предпочтительно гидрофобный аминокислотный остаток, в частности Gly, Ala, Val, Leu, Nle или Ile.
В соответствии с этим предметом изобретения являются в особенности такие соединения формулы I, в которых по меньшей мере один из указанных остатков имеет приведенные выше предпочтительные значения.
Предпочтительная группа соединений может быть выражена частичной формулой Iа, соответствующей обычно формуле I, но в которой:
X означает D-Phe, Phe, D-гомоPhe, гомоPhe, D-Phg, Phg, Phe(4-F), D-Phe (4-F), D-Phe(4-Cl) или Phe(4-Cl) и
Y означает Nle, hPro, Ahds, Aos, Nhdg, Acha, Aib, Acpa, Tle, Ala, Leu или Ile, причем в одинаковой степени предпочтительны и форма D, и форма L.
Далее предпочтительная группа соединений может быть выражена частичной формулой Ib, соответствующей обычно формуле I, но в которой:
Х означает D-Phe или Phe и
Y означает Ahds, hPro, Aos, Nhdg, Acha, Aib, Acpa или Tle, причем в одинаковой степени предпочтительны и форма D, и форма L,
и все аминокислотные остатки Arg, Gly или Asp находятся в естественной L-конфигурации.
Еще одна предпочтительная группа соединений может быть выражена частичной формулой Iс, соответствующей частичным формулам Iа и Ib, а также формуле I, но где находится в D-форме только один из аминокислотных остатков Х или Y, в то время как все остальные остатки имеют конфигурацию L.
Кроме того, все физиологически приемлемые соли соединений, соответствующие частичным формулам Iа, Ib и Iс, являются наиболее предпочтительными.
Соединения формулы I, а также исходные вещества для этих соединений получают известными методами, описанными в литературе (например, в сборниках стандартов, таких как Houben-Weyl, Methoden der organischen Chemie (Методы органической химии), изд. Georg-Thieme-Verlag, r. Штуттгарт), в частности в условиях реакции, которые известны и пригодны для названных взаимодействий. При этом могут также применяться известные, не рассматриваемые здесь подробно варианты.
При необходимости исходные вещества можно получать in situ, так что не требуется их выделение из реакционной смеси и их можно далее подвергать взаимодействию до соединений формулы I.
Соединения формулы I можно получать и тем, что их высвобождают из их функциональных производных посредством сольволиза, гидролиза или гидрогенолиза.
Предпочтительными исходными веществами для сольволиза или гидрогенолиза являются такие вещества, которые вместо одной или нескольких свободных амино- и/или гидроксильных групп содержат соответственно защищенные амино- и/или гидроксильные группы, предпочтительно такие группы, которые вместо атома водорода, связанного с N-атомом, содержат аминозащитную группу, например такие, которые соответствуют формуле I, но вместо группы NH2 содержат группу NHR' (где R' означает аминозащитную группу, например ВОС или CBZ).
Кроме того, предпочтительными являются исходные вещества, которые вместо атома водорода гидроксильной группы содержат гидроксизащитную группу, например такую, которая соответствует формуле I, но которая вместо гидроксифенильной группы содержит R''O-фенильную группу (где R'' означает гидроксизащитную группу).
Также могут присутствовать в молекуле исходного вещества и несколько одинаковых или разных защитных амино- и/или гидроксильных групп. В том случае когда присутствующие защитные группы различаются между собой, их можно в большинстве случаев селективно отщеплять.
Выражение "аминозащитная группа" общеизвестно и означает группы, способные защищать (блокировать) аминогруппу от химических взаимодействий, но которые легко удаляемы после протекания необходимой химической реакции на других участках молекулы. Типичными защитными группами являются, в частности, незамещенные или замещенные ацильные, арильные, аралкоксиметильные или аралкильные группы. Поскольку после реакции (или серии реакций) аминозащитные группы удаляются, то их природа и размер не являются критическими, однако предпочтительными являются такие, которые содержат 1-20, в особенности 1-8 атомов углерода. Выражение "ацильная группа" следует понимать в связи с настоящим изобретением в самом широком смысле. Оно включает в себя ацильные группы на основе алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфокислот, а также, в частности, алкоксикарбонильные, арилоксикарбонильные и прежде всего аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил, бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил или толуил; арилоксиалканоил, такой как РОА; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, ВОС, 2-иод-этоксикарбонил; аралкилоксикарбонил, такой как CBZ (карбобензокси), 4-метоксибензилоксикарбонил, FMOC; арил-сульфонил, такой как Mtr. Предпочтительными аминозащитными группами являются ВОС и Mtr, далее CBZ, Fmoc, бензил и ацетил.
Выражение "гидроксизащитная группа" также общеизвестно и означает группы, способные защищать гидроксильные группы от химического взаимодействия, но которые легко удаляемы по окончании реакции на других участках молекулы. Типичными группами являются приведенные выше незамещенные или замещенные арильные, аралкильные или ацильные группы, а также алкильные группы. Природа и размер гидроксизащитных групп не являются критическими, поскольку по окончании необходимой химической реакции или серии реакций их можно снова удалить; предпочтительными являются группы с 1-20 атомами углерода, в особенности с 1-10 атомами углерода. Примерами гидроксизащитных групп являются в числе прочего бензил, п-нитробензоил, трет-бутил и ацетил, при этом бензил и трет-бутил наиболее предпочтительны. Группы СООН в аспарагиновой и глутаминовой кислотах защищены преимущественно в виде их трет-бутиловых эфиров (например, Asp(OBut)).
Используемые в качестве исходных веществ функциональные производные соединений формулы I можно получать традиционными методами синтеза аминокислот и пептидов, как это описано, например, в уже упоминавшихся сборниках стандартов и патентных заявках, например, также твердофазным методом Merrifield (B. F. Gysin и R.B. Merrifield, ж. Am. Chem. Soc. (Американское химическое общество), 94, 1972 г., стр. 3102 и последующие)).
Высвобождение соединений формулы I из их функциональных производных обеспечивается- в зависимости от применяемой защитной группы, например, сильными кислотами, целесообразно посредством трифторуксусной кислоты или перхлорной кислоты, а также и другими сильными неорганическими кислотами, такими как соляная или серная кислота, сильными органическими карбоновыми кислотами, такими как трихлоруксусная или сульфокислоты, такие как бензол- или п-толуолсульфокислота. Возможно присутствие дополнительного инертного растворителя, но это не всегда необходимо. В качестве инертного растворителя пригодны преимущественно, например, органические карбоновые кислоты, такие как уксусная кислота, простые эфиры, как тетрагидрофуран или диоксан, амиды, такие как диметилформамид (DMF), галогенированные углеводороды, такие как дихлорметан, а также спирты, такие как метанол, этанол или изопропанол, и вода. Кроме того, пригодны смеси указанных растворителей. Трифторуксусная кислота применяется преимущественно в избытке без добавления дополнительного растворителя, перхлорная кислота - в виде смеси уксусной кислоты и 70%-ной перхлорной кислоты в соотношении 9:1. Оптимальная температура реакции при расщеплении составляет от около 0 до около 50oС, преимущественно от 15 до 30oС (комнатная температура).
Группы ВОС, OBut и Mtr отшепляют предпочтительно с помощью трифторуксусной кислоты в дихлорметане или с помощью приблизительно 3-5 н. НСl в диоксане при 15-30oС, группу FMOC - с помощью около 5-50%-ного раствора диметиламина, диэтиламина или пиперидина в диметилформамиде при 15-30oС.
Защитные группы (например, CBZ или бензил), удаляемые гидрогенизацией, могут отщепляться, например, в результате обработки водородом в присутствии катализатора (например, катализатора из благородного металла, такого как палладий, целесообразно, чтобы он применялся на носителе, таком как уголь). При этом в качестве растворителя пригодны указанные выше растворители, в частности, например, спирты, такие как метанол или этанол, или амиды, такие как диметилформамид. Гидрогенизация проводится, как правило, при температуре от около 0 до 100oС и давлении от около 1 до 200 бар, предпочтительно при 20-30oС и 1-10 барах. Гидрогенизация группы CBZ хорошо проводится, например, на 5-10%-ном Pd/C в метаноле или с формиатом аммония (вместо Н2) на Pd/C в смеси метанол/ДМФ при 20-30oС.
Соединения формулы I можно получать и путем циклизации соединений формулы II в условиях синтеза пептидов. В этом случае целесообразно применять традиционные методы синтеза пептидов, такие как, например, описанные в Houben-Weyl, 1. с., т. 15/II, 1974 г., стр. 1-806.
Реакция протекает преимущественно в присутствии дегидратирующего средства, например карбодиимида, такого как DCCI или EDCI, а также ангидрида пропанфосфоновой кислоты (см. Angew. Chemie (Прикладная химия), 92, 1980 г., стр. 129)), дифенилфосфорилазида или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолина, в среде инертного растворителя, например галогенированного углеводорода, такого как дихлорметан, простых эфиров, таких как тетрагидрофуран или диоксан, амида, такого как диметилформамид или диметилацетамид, нитрила, такого как ацетонитрил, или в смесях этих растворителей при температуре от около -10 до 40, предпочтительно от 0 до 30oС. Для того чтобы провести внутримолекулярную циклизацию перед межмолекулярным связыванием пептидов, целесообразно работать в разбавленных растворах (принцип разбавления).
Вместо соединений формулы II в реакции можно использовать также пригодные реакционноспособные производные этих веществ, например такие, в которых реакционные группы промежуточно блокированы защитными группами. Производные II аминокислот могут применяться, например, в виде активированных сложных эфиров, которые предпочтительно образовывать in situ, например путем добавления HOBt или N-гидроксисукцинимида.
Исходные вещества формулы II являются, как правило, новыми. Их можно получать известными способами, например приведенными выше методами синтеза пептидов, с отщеплением защитных групп.
Вначале синтезируют, как правило, защищенные сложные эфиры пентапептидов формулы R'-Z-OR'', например BOC-Z-OMe или BOC-Z-OEt, которые сначала омыляют с получением кислот формулы R'-Z-OH, например BOC-Z-OH; от этих кислот отщепляют защитную группу R', в результате чего получают свободные пептиды формулы H-Z-OH (II).
Превращение в производные циклопептида, соответствующего соединению формулы I, проводится также известными методами, которые известны для алкилирования аминов, этерификации карбоновых кислот или нуклеофильного замещения алифатических атомов углерода и описаны в каждом учебнике по органической химии, например в J. March, Adv. Org. Chem., John Wiley & Sons N.Y., 1985 г.
Основание формулы I можно перевести с помощью кислоты в соответствующую аддитивную кислую соль. Для такого взаимодействия используют в особенности кислоты, которые образуют физиологически приемлемые соли. Так, например, можно применять такие неорганические кислоты, как, например, серная кислота, азотная кислота, галогенводородные кислоты, такие как хлористоводородная кислота или бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, сульфаминовая кислота, а также органические кислоты, в частности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфо- или серные кислоты, например муравьиная кислота, уксусная, пропионовая, пивалиновая, диэтилуксусная, малоновая, янтарная, пимелиновая, фумаровая, малеиновая, молочная, винная, яблочная, бензойная, салициловая, 2- или 3-фенилпропионовая, лимонная, глюконовая, аскорбиновая, никотиновая, изоникотиновая кислоты, метан- или этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и нафталиндисульфокислоты, лаурилсерная кислота. Соли с физиологически неприемлемыми кислотами, например пикраты, могут применяться для выделения и/или очистки соединений формулы I.
С другой же стороны, кислоту формулы I взаимодействием с основанием можно перевести в одну из ее физиологически приемлемых солей металла или аммония. В качестве солей принимают во внимание, в частности, соли натрия, калия, магния, кальция и аммония, а также замещенные соли аммония, например соли диметил-, диэтил- или диизопропиламмония, соли моноэтанол-, диэтанол- или триэтаноламмония, соли циклогексил-, дициклогексиламмония, соли дибензилэтилендиаммония, а также, например, соли N-метил-D-глюкамина или аргинина или лизина.
Новые соединения формулы I и их физиологически приемлемые соли могут использоваться для получения фармацевтических препаратов, приводя их в пригодную дозированную форму вместе по меньшей мере с одним наполнителем или вспомогательным веществом и при необходимости вместе с одним или несколькими другими активными веществами. Получаемые таким образом композиции могут использоваться в качестве лекарственных средств в медицине или ветеринарии. В качестве наполнителей пригодны органические или неорганические вещества, которые пригодны для энтерального (орального или ректального), парентерального (например, внутривенная инъекция) или локального (например, топическое, накожное, офтальмическое или назальное) применения или для применения в виде аэрозольной ингаляции и которые не реагируют с новыми соединениями, например вода или водный изотонический раствор поваренной соли, низшие спирты, растительные масла, бензильные спирты, полиэтиленгликоли, глицеринтриацетат и другие глицериды жирных кислот, желатина, соевый лецитин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк, целлюлоза, вазелины. Для орального применения пригодны, в частности, таблетки, драже, капсулы, сиропы, соки и капли; особый интерес представляют таблетки и капсулы с устойчивыми к воздействию желудочного сока покрытиями или капсульные оболочки. Для ректального применения предназначены свечи, для парентерального - растворы, предпочтительно масляные или водные, а также суспензии, эмульсии и имплантаты. Для топического применения пригодны, например, растворы, которые могут применяться в виде глазных капель, а также, например, суспензии, эмульсии, кремы, мази или выжимки. Для аэрозольной ингаляции могут применяться аэрозоли, в которых активное начало содержится в растворенном или суспендированном виде в рабочем газе или в смеси рабочих газов (например, СО2 или фторхлорзамещенные углеводороды). Целесообразно применять активное вещество в микронизированной форме, причем могут присутствовать дополнительно один или несколько физиологически приемлемых растворителей, например этанол. Ингаляционные растворы могут применяться с помощью обычных ингаляторов. Новые соединения могут также применяться в лиофилизированном виде, а получаемые лиофилизаты могут применяться, например, для приготовления препаратов для инъекций. Инъекции можно осуществлять отдельной порцией или в виде непрерывной инфузии (например, внутривенно, внутримышечно, подкожно или интратекально). Указанные композиции могут быть стерилизованы и/или содержать в себе вспомогательные вещества, такие как консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для воздействия на осмотическое давление, буферные вещества, красители и/или ароматизаторы. При необходимости они могут содержать также один или несколько активных веществ, например один или несколько витаминов.
Соединения согласно изобретению можно использовать, как правило, аналогично известным реализуемым через торговую сеть пептидам, в частности аналогично описанным в патенте США 4472305 соединениям, преимущественно в дозах от около 0,05 до 500, в особенности от 0,5 до 100 мг на дозированную форму. Суточная доза составляет преимущественно от около 0,01 до 2 мг/кг веса тела. Специальная доза для определенного пациента зависит, однако, от самых разнообразных факторов, например активности применяемого специального соединения, возраста, веса тела, общего состояния здоровья, пола, питания, времени и способа приема, скорости выведения, комбинации лекарственного вещества и тяжести заболевания, по которому проводится терапия. Предпочтительно парентеральное применение.
Наряду с этим новые соединения формулы I могут применяться в качестве лигандов интегрина при изготовлении колонок для проведения аффинной хроматографии с целью очистки интегринов.
Лиганд, т. е. производное пептида формулы I, ковалентно связывается при этом благодаря анкерной функции с полимерным наполнителем.
В качестве полимерных наполнителей пригодны известные в химии пептидов полимерные твердые фазы преимущественно с гидрофильными свойствами, например поперечно сшитые полисахариды, такие как целлюлоза, сефароза или Sephadex®, акриламиды, полимеры на основе полиэтиленгликоля или Tentakelpolymere®.
В качестве анкерных функций, которые связываются с полимерными наполнителями, пригодны преимущественно линейные алкиленовые цепи с 2-12 атомами углерода, которые одним концом связаны непосредственно с полимером, а на другом конце содержат функциональную группу, как, например, гидрокси-, амино-, меркапто-, малеинимидо- или -СООН-группу, и которые обладают способностью связываться с С- или N-терминальным участком соответствующего пептида.
При этом возможно, что пептид свяжется с анкером полимера непосредственно или через вторую анкерную функцию. Также возможно, что пептиды, содержащие аминокислотные остатки с функциональными боковыми цепями, связываются через последние с анкерной функцией полимера.
Кроме того, определенные аминокислотные остатки, входящие в состав пептидов формулы I, в своих боковых цепях могут модифицироваться таким образом, что их можно использовать для соединения с анкером полимера, например, через SH-, ОН-, NH2- или СООН-группы.
При этом возможно использовать необычные аминокислоты, как, например, производные фенилаланина, которые в 4-положении фенильного кольца содержат меркапто-, гидрокси-, амино- или карбоксиалкильную цепь, причем функциональная группа располагается на конце цепи.
Примерами аминокислотных остатков, боковая цепь которых может служить непосредственно в качестве анкерной функции, являются, например, Lys, Arg, Asp, Asn, Glu, Gln, Ser, Thr, Cys или Туr.
Примерами N-терминальных анкеров служат остатки, как, например, -CO-CnH2n-NH2, -CO-CnH2n-OH, -CO-CnH2n-SH или -СО-СnН2n-СООН при n=2-12, причем длина алкиленовой цепи не критична, и она может быть при необходимости заменена, например, соответствующими арильными или алкиларильными остатками.
С-терминальными анкерами могут служить, например, -O-CnH2n-SH-, -O-CnH2n-OH, -O-CnH2n-NH2, -O-СnН2n-СООН, -NH-CnH2n-SH, -NH-CnH2n-OH, -NH-CnH2n-NH2 или -NH-CnH2n-COO, при этом n и алкиленовая цепь соответствуют вышеизложенному.
N- и С-терминальные анкеры могут служить также в качестве анкерного элемента для функционализированной боковой цепи аминокислотного остатка. Имеются в виду, например, аминокислотные остатки, такие как Lys (CO-C5H10-NH2), Asp(NH-C3H6-
СООН) или Cys(С3Н6-NH2), причем анкер остается постоянно связанным с функциональной группой боковой цепи.
Получение материалов для аффинной хроматографии для очистки интегрина осуществляют в условиях, которые обычны при конденсации аминокислот и которые известны и были уже описаны в разделе о получении соединений формулы I.
Наряду с применением циклопептидов для иммобилизации на полимерных материалах с целью изготовления колонок для аффинной хроматографии можно использовать соединения с их функционализированными боковыми цепями для последующего получения производных посредством диагностических вспомогательных реактивов, таких как, например, флюоресцирующие заместители.
Также возможно ввести в боковые цепи остатков Х и Y дополнительно функциональные группы, такие как амино-, меркапто- или карбоксигруппы, посредством которых затем можно будет получить конъюгаты с протеинами или другими высокомолекулярными веществами, например для иммобилизации и/или для получения антител.
Выше и ниже все температуры приводятся в oС. В последующих примерах выражение "обычная переработка" означает, что при необходимости добавляют воду, нейтрализуют, экстрагируют простым эфиром или дихлорметаном, отделяют, сушат органическую фазу сульфатом натрия, фильтруют, выпаривают, очищают хроматографией на силикагеле и/или кристаллизацией. RZ означает продолжительность ретенции (в минутах). Аналитическое исследование проводилось путем высокоэффективной жидкостной хроматографии на Lichrosorb® RP select В (7 мкм), колонка 250•4 мм, элюент А: 0,3% трифторуксусной кислоты в воде; элюент В: 0,3% трифторуксусной кислоты в смеси 2-пропанол/вода (8:2), градиент: 1-99% В за 50 мин при 1 мл/мин. Поток и детектирование при 215 нм. М+ = молекулярному пику в масс-спектре, получаемом по методу "Fast Atom Bombardment" (бомбардирование быстрыми атомами) (FAB).
Пример 1
Раствор 1,1 г H-Arg(Mtr)-Gly-Asp(OBut)-D-Phe-hPro-ONa [например, приготовленный из Fmoc-NMe-Аrg(Mtr)-Gly-Asp(OBut)-D-Phe-hPro-O-Wang, причем -O-Wang означает используемый в модифицированных способах Merrifield остаток 4-оксиметил-феноксиметил-полистирольной смолы, путем отщепления группы Fmoc с помощью смеси пиперидин/диметилформамид и отщепления смолы с помощью смеси трифторуксусная кислота/СН2Сl2 (1:1)], в 15 мл диметилформамида разбавляют 85 мл дихлорметана и смешивают с 50 мг NaHCO3. После охлаждения в смеси из сухого льда и ацетона добавляют 40 мкл дифенилфосфорилазида. После выдерживания в течение 16 часов при комнатной температуре раствор сгущают. Концентрат фильтруют (колонка Sephadex G10 в смеси изопропанол/вода, 8:2), после чего очищают, как обычно, высокоэффективной жидкостной хроматографией (HPLC). После обработки смесью трифторуксусная кислота/Н2О (98:2) получают цикло-(Arg-Gly-Asp-D-Phe-hPro); RZ=18,5; FAB-MS (M+H): 587.
Аналогично получили путем циклизации соответствующих линейных пептидов и отщеплением защитных групп:
цикло-(Arg-Gly-Asp-DPhe-Nle); RZ=25,3; FAB-MS(M+H):589;
цикло-(Arg-Gly-Asp-Phe-Ahds); RZ=35,1; FAB-MS(M+H):730;
цикло-(Arg-Gly-Asp-DPhe-Ahds); RZ=35,4; FAB-MS(M+H):730;
цикло-(Arg-Gly-Asp-Phe-DAhds); RZ=35,7; FAB-MS(M+H):730;
цикло-(Arg-Gly-Asp-DPhe-Aos);
цикло-(Arg-Gly-Asp-DPhe-DAos);
цикло-(Arg-Gly-Asp-Phe-Aos);
цикло-(Arg-Gly-Asp-DPhe-Nhdg); RZ=36,7; FAB-MS(M+H):758;
цикло-(Arg-Gly-Asp-Phe-Nhdg); RZ=36,5; FAB-MS(M+H):758;
цикло-(Arg-Gly-Asp-DPhe-DNhdg); FAB-MS(M+H):758;
цикло-(Arg-Gly-Asp-Phe-DNhdg); FAB-MS(M+H):758;
цикло-(Arg-Gly-Asp-DPhg-Nhdg);
цикло-(Arg-Gly-Asp-Phg-Nhdg);
цикло-(Arg-Gly-Asp-DPhg-DNhdg);
цикло-(Arg-Gly-Asp-Phg-DNhdg);
цикло-(Arg-Gly-Asp-DPhe-Acha); RZ=25,2; FAB-MS(M+H):601;
цикло-(Arg-Gly-Asp-Phe-Acha); FAB-MS(M+H):601;
цикло-(Arg-Gly-Asp-DPhe-DAcha); FAB-MS(M+H):601;
цикло-(Arg-Gly-Asp-Phe-DAcha); FAB-MS(M+H):601;
цикло-(Arg-Gly-Asp-DPhe-Aib); FAB-MS(M+H):575;
цикло-(Arg-Gly-Asp-Phe-Aib); RZ=36,5; FAB-MS(M+H):575;
цикло-(Arg-Gly-Asp-DPhe-DAib); FAB-MS(M+H):575;
цикло-(Arg-Gly-Asp-Phe-DAib); FAB-MS(M+H):575;
цикло-(Arg-Gly-Asp-DPhe-Acpa); RZ=17,1; FAB-MS(M+H):587;
цикло-(Arg-Gly-Asp-Phe-Acpa); FAB-MS(M+H):587;
цикло-(Arg-Gly-Asp-DPhe-DAcpa); FAB-MS(M+H):587;
цикло-(Arg-Gly-Asp-Phe-DAcpa); FAB-MS(M+H):587;
цикло-(Arg-Gly-Asp-DPhe-Tle); RZ=19,1; FAB-MS(M+H):589;
цикло-(Arg-Gly-Asp-Phe-Tle); FAB-MS(M+H):589;
цикло-(Arg-Gly-Asp-DPhe-DTle); FAB-MS(M+H):589;
цикло-(Arg-Gly-Asp-Phe-DTle); FAB-MS(M+H):589;
цикло-(Arg-Gly-Asp-DPhe(4-Cl)-Tle); RZ=23,2; FAB-MS(M+H):623;
цикло-(Arg-Gly-Asp-Phe(4-Cl)-Tle); FAB-MS(M+H):623;
цикло-(Arg-Gly-Asp-DPhe(4-Cl)-DTle); FAB-MS(M+H):623;
цикло-(Arg-Gly-Asp-Phe(4-Cl)-DTle); FAB-MS(M+H):623;
цикло-(Arg-Gly-Asp-DPhe(4-F)-Tle); RZ=20,2; FAB-MS(M+H):607;
цикло-(Arg-Gly-Asp-Phe(4-F)-Tle); FAB-MS(M+H):607;
цикло-(Arg-Gly-Asp-DPhe(4-F)-DTle); FAB-MS(M+H):607;
цикло-(Arg-Gly-Asp-Phe(4-F)-DTle); FAB-MS(M+H):607.
Пример 2
Раствор 0,28 г цикло-(Arg(Mtr)-Gly-Asp-DPhe-DhPro) [полученного циклизацией согласно примеру 1] в 8,4 мл трифторуксусной кислоты, 1,7 мл дихлорметана и 0,9 мл тиофенола выдерживают в течение 4 часов при комнатной температуре, затем сгущают и после разбавления водой сушат вымораживанием. Гель-фильтрованием на Sephadex G 10 (уксусная кислота/вода, 1:1) с последующей очисткой препаративной ВЭЖХ при указанных условиях получают цикло-(Arg-Gly-Asp-DPhe-DhPro); FAB-MS(M+H):587.
Аналогично получили:
из цикло-(Arg(Mtr)-Gly-Asp-Phe-DhPro):
цикло-(Arg-Gly-Asp-Phe-DhPro); FAB-MS(M+H):587;
из цикло-(Arg(Mtr)-Gly-Asp(OBut)-DPhg-Tle):
2[цикло-(D-Arg-NMeGly-Asp-DPhg-Tle)];
из цикло-(Arg(Mtr)-Gly-Asp(OEt)-DPhg-hPro):
цикло-(Arg-Gly-Asp-DPhg-hPro):
из цикло-(Arg(Mtr)-Gly-Asp-Phg-DAhgs):
цикло-(Arg-Gly-Asp-Phg-DAhgs):
из цикло-(Arg(Mtr)-Gly-Asp-DPhg-Acpa):
цикло-(Arg-Gly-Asp-DPhg-Acpa);
из цикло-(Arg(Mtr)-Gly-Asp-DPhg-Aos):
цикло-(Arg-Gly-Asp-DPhg-Aos).
Пример 3
80 мг цикло-(Arg-Gly-Asp-DPhe-hPro) [полученного согласно примеру 1] растворяют от пяти- до шестикратно в 0,01 М HCl и после каждого этапа растворения сушат вымораживанием. После последующей очистки посредством ВЭЖХ получают цикло-(Arg-Gly-Asp-DPhe-hPro)(HCl.
Аналогично получали:
из цикло-(Arg-Gly-Asp-DPhe-Nle):
цикло-(Arg-Gly-Asp-DPhe-Nle)•HCl;
из цикло-(Arg-Gly-Asp-DPhe-Ahds):
цикло-(Arg-Gly-Asp-DPhe-Ahds)•HCl;
из цикло-(Arg-Gly-Asp-Phe-Ahds):
цикло-(Arg-Gly-Asp-Phe-Ahds)•HCl.
Пример 4
Для получения аффинной фазы 0,9 г N-малеинимидо-(СН2)5-СО-NH-(СН2)3-полимера (полученного конденсацией N-малеинимидо-(CH2)5-COOH H2N-(СН2)3-полимером) суспендируют в 10 мл 0,1 М натрийфосфатного буфера при рН 7 и добавляют при 4oC эквивалент цикло-(Arg-Gly-Asp-DPhe(4-N-CO(CH2)2SH)-hPro) (полученного циклизацией H-DPhe(4-NH-BOC)-hPro-Arg(Mtr)-Gly-Asp-OH, отщеплением защитных групп и ацилированием, например посредством Cl-CO(CH2)2SH). Реакционную смесь перемешивают в течение 4 часов при одновременном нагреве при комнатной температуре, фильтруют твердый остаток и дважды промывают каждый раз в 10 мл буферного раствора (рН 7), затем промывают трижды, каждый раз в 10 мл воды. Получают цикло-(Arg-Gly-Asp-DPhe(4-N-СО(СН2)2S-3-(N-малеинимидо-(СН2)5-CONH-(СН2)3-полимер)-hPro)).
Пример 5
Аналогично описанному в примере 4 получают путем конденсации полимер-O-(CH2)3-NH2 (имеется в торговле) и цикло-(Arg-Gly-Asp-DPhe(4-N-CO(CH2)4-COOH)-hPro) (полученный путем конденсации адипиновой кислоты с цикло-(Arg(Mtr)-Gly-Asp-DPhe(4-NH-BOC)-hPro) в указанных в примере 4 условиях) следующую полимерную фазу: цикло-(Arg-Gly-Asp-DPhe(4-N-CO-(CH2)4-CO-NH-(СН2)3-O-полимер)-hPro).
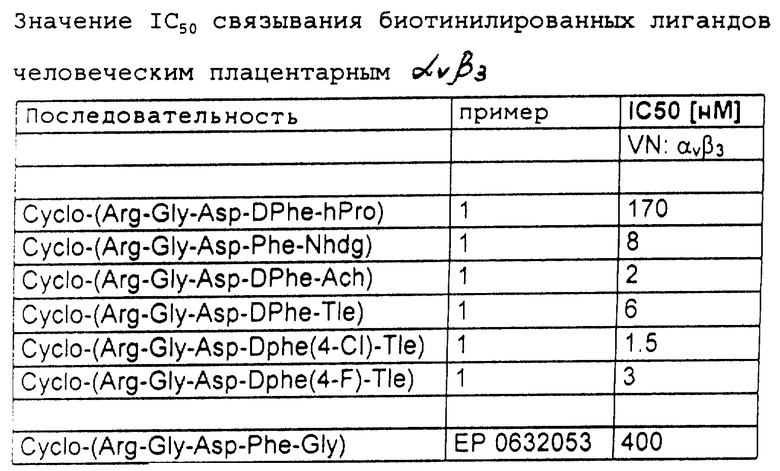
Определение ингибируюшей активности в отношении рецепторов
Очищенный человеческий интегрин αvβ3 плаценты был адсорбирован в микротитрационном планшете с введенным с биотинилированными комплементарными лигандами витронектином (VN) для αvβ3 в присутствии увеличивающегося количества тестируемых соединений.
Использовался метод определения, в соответствии с которым 1 мкг/мл биотин-лигандов инкубировали с 1 мкг/мл нанесенного рецептора в присутствии серийно разведенных пептидов. После выдерживания в течение 3 часов при 30oС количество связанных лигандов определяли путем измерения анти-биотин-алкалин-фосфатазы. Полученные данные приведены в таблице.
Приводимые далее примеры относятся к фармацевтическим композициям.
Пример А: ампулы для инъекций
100 г раствора циклопептида формулы I и 5 г динатрийгидрофосфата в 3 л дважды дистиллированной воды доводят 2 н. соляной кислотой до значения рН, равного 6,5, стерильно фильтруют, разливают по ампулам для инъекций, лиофилизируют в стерильных условиях и стерильно укупоривают. В каждой ампуле содержится 5 мг активного вещества.
Пример Б: свечи
Расплавляют смесь 20 г активного вещества формулы I, 100 г соевого лецитина и 1400 г масла какао, заливают в формы и охлаждают. Каждый суппозиторий содержит 20 мг активного вещества.
Пример В: раствор
Готовят раствор, содержащий 1 г активного вещества формулы I, 9,38 г NaH2PO4•2Н2O, 28,48 г Na2HPO4•12Н2О и 0,1 г бензалконийхлорида в 940 мл дважды дистиллированной воды. Доводят рН до значения 6,8, доводят до объема 1 л и стерилизуют облучением. Данный раствор пригоден для использования в качестве глазных капель.
Пример Г: мазь
В асептических условиях 500 мг активного вещества формулы I смешивают с 99,5 г вазелина.
Пример Д: таблетки
Из смеси, содержащей 100 г циклопептида формулы I, 1 кг лактозы, 600 г микрокристаллической целлюлозы, 600 г кукурузного крахмала, 100 г поливинилпирролидона, 80 г талька и 10 г стеарата магния прессуют обычным способом таблетки, каждая из которых содержит 10 г активного вещества.
Пример Е: драже
Прессуют таблетки, как указано в примере Д, и наносят на них обычным способом покрытие из сахарозы, кукурузного крахмала, талька, траганта и красителя.
Пример Ж: капсулы
Капсулы из твердого желатина наполняют обычным способом активным веществом формулы I с таким расчетом, чтобы в каждой из них содержалось 5 мг активного вещества.
Пример 3: аэрозоль для ингаляции
14 г активного вещества формулы I растворяют в 10 л изотонического раствора NaCl и разливают раствор по стандартным аэрозольным емкостям, снабженным насосным механизмом. Раствор можно распылять в полость рта или носа. При одном нажатии (около 0,1 мл) выделяется доза около 0,14 мг.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЦИКЛИЧЕСКИЕ ПЕПТИДЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2555357C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1996 |
|
RU2157379C2 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2130030C1 |
| БИОТИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2171807C2 |
| ПРОИЗВОДНЫЕ ЦИКЛОПЕПТИДОВ | 1997 |
|
RU2202557C2 |
| ЦИКЛИЧЕСКИЕ АЗАПЕПТИДЫ С АНГИОГЕННЫМ ДЕЙСТВИЕМ | 1998 |
|
RU2188205C2 |
| ЦИКЛОПЕПТИДНЫЕ ПРОИЗВОДНЫЕ | 1996 |
|
RU2174520C2 |
| ЦИКЛОПЕПТИДЫ ИЛИ ИХ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2129563C1 |
| ЦИКЛОПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2151776C1 |
| ЖИДКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ОЛИГОПЕПТИДЫ И ЭТЕРИФИЦИРОВАННЫЙ ЦИКЛОДЕКСТРИН | 2003 |
|
RU2322254C2 |
Изобретение относится к циклопептидам формулы I: Сус1о-(Arg-Gly-Asp-X-Y) (I), где Х означает Phe, гомо-Phe, Phg, Phe(4-F) или Phe (4-Cl), Y означает hPro, Ahds, Aos, Nhdg, Acha, Aib, Acpа или Тle, причем в случае остатков оптически активных аминокислот и производных аминокислот также D- и L-формы, а также производные, в особенности β-эфир аспарагиновой кислоты или N-гуанидинацильные производные аргинина, пролекарства и их физиологически приемлемые соли. Соединения обладают высокой активностью в качестве ингибиторов интегрина, а также противовоспалительным действием. Описаны также способ получения циклопептидов и фармацевтическая композиция, обладающая способностью ингибировать интегрин. 3 с. и 3 з.п.ф-лы, 1 табл.
Сусlо-(Arg-Gly-Asp-X-Y) I,
где Х означает Phe, гомо-Phe, Phg, Phe(4-F) или Phe(4-Cl);
Y означает hPro, Ahds, Aos, Nhdg, Acha, Aib, Acpa или Tle,
причем в случае остатков оптически активных аминокислот и производных аминокислот также D- и L-формы, а также производные, в особенности β-эфир аспарагиновой кислоты или N-гуанидинацильные производные аргинина, пролекарства и их физиологически приемлемые соли.
(а) Сусlо-(Arg-Gly-Asp-DPhe-hPro);
(б) Сусlо-(Arg-Gly-Asp-DPhe-Tle);
(в) Сусlо-(Arg-Gly-Asp-Рhe-DAhds);
(г) Сусlо-(Arg-Gly-Asp-Рhe-Nhdg);
(д) Сусlо-(Arg-Gly-Asp-Dphe-Асha);
(е) Сусlо-(Arg-Gly-Asp-Dphe(4-Сl)-Tle);
(ж) Сусlо-(Arg-Gly-Asp-Dphe(4-F)-Tle);
а также их физиологически приемлемые соли.
| Ультразвуковая линия задержки | 1977 |
|
SU632053A1 |
| Кантователь | 1976 |
|
SU596350A1 |
| Способ изготовления сотового заполнителя | 1978 |
|
SU770622A1 |
| RU 2002754 С1, 15.11.1993 | |||
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2002-06-27—Публикация
1997-04-02—Подача