Изобретение относится к области микробиологических исследований, связанных с оценкой уреазной активности микроорганизмов, вызывающих заболевания желудочно-кишечного тракта (ЖКТ), в частности для диагностики инвазии Heficobacter pylori (HP) [Marshall B.I. History of the discovery of C. pylori. - In "Campylobacter pylori in gastritis and peptic ulcer disease": Blaser M. J. ed. New York, Igaku-Shoir, 1989, p. 7-24. Marshall B.I., Warren I.R. Unidentifed curved bacill on gastric epitritium in active chronic gastritis. Lancet, 1984, p. 1311-1315. Foreman D., Webb P., Parsonnet I. H. pylori and gastric cancer. Lancet, 1994, p. 243 - 244, letter].
Для диагностических исследований уреазной активности микрофлоры желудка и двенадцатиперстной кишки и, главным образом, для диагностики HP инфицирования традиционно используют методики исследования уреазной активности in vitro [П.Я. Григорьев, В.А. Исаков, В.М. Розенталь и др. Способ выявления Campilobacter pylori при язвенной болезни желудка и хроническом гастрите. Авторское свидетельство СССР N 1564192, C 12 Q 1/04, опубл. 18.04.1988]. В основе этой методики лежит изменение pH реакционной среды в ходе удаления из нее продуктов гидролиза карбамида (субстрата). Гидролиз интенсивно протекает под действием фермента (уреазы), продуцируемого микроорганизмами (в частности HP).
Когда уреаза HP присутствует в желудке, субстрат (мочевина) быстро гидролизуется (1) с образованием аммиака и двуокиси углерода: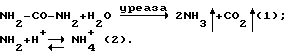
[Аруин Л. И, Григорьев П. Я. , Исаков В.А., Яковенко Э.П. Хронический гастрит, Амстердам, 1993, 262 с. Григорьев П.Я. и сотр. Метод определения Campilobacter pylori в слизистой оболочке желудка при хроническом гастрите. Лабораторное дело. 1989, N 6, с 52-54. Е.М. Стародуб и др. Геликобактериоз и язвенная болезнь, Л. , 1991, 32 с., с 19. Н.В. Сафонова и др. Гастрит язвенная болезнь и хеликобактериоз. СПб, 1993, 40 с., с. 13, 32]. Методики, выполняемые in vivo, используются для оценки активности микробного фермента по газообразным продуктам реакции гидролиза карбамида в выдыхаемом воздухе (воздухе ротовой полости) или моче и позволяют оценить характер инвазии.
Для таких исследований используют изотопные маркеры и реакция ферментативного гидролиза происходит не с 12C1H4 14N2 16O (карбамидом нормального изотопного состава), а с аналогами измененного изотопного состава: 13C1H4 14N2 16O, или 14C1H4 14N2 16O, или 12C1H4 15N2 16O.
Эти диагностические методики ("urea breath test") предполагают прием per os мочевины, меченной радиоактивным 14C или стабильным 13C, и контроль процесса ее гидролиза in vivo по содержанию изотопов углерода 14C и 13C в выдыхаемом CO2 [Peura D.A., Pambianko D.J., Dye K.R., et al. Microdose urea breath test offersdiagnosis of Helicobacter pylori in 10 minutes. Am. J. Gastro. 1996, v. 91, N. 2, p. 233-238. Marshall B.J., Plankey M.W., Hoffman S. R. , et al. A 20-minute breath test for helicobacter pylori. Am. J. Gastroenterol. 1991, v. 86, p 438-435. Grahm D.Y., Klein P.D., Evans D.J. Jr. Campylobacter pylory detectected noninvasively by the 13C-urea breath test. Lancet 1987, n. 1, 1174-1177]. По мнению их авторов не существует иной возможности для того, чтобы проконтролировать процесс ферментативного гидролиза in vivo по продуктам нормального изотопного состава из-за того, что мочевина присутствует во всех биологических жидкостях человека, а углекислый газ содержится в выдыхаемом воздухе. Однако в этом случае речь идет о моделировании естественного процесса, а не о реакции гидролиза карбамида нормального изотопного состава, который синтезируется печенью человека. Продукты гидролиза, радиоактивные 15N1H3 и 14C13O2 или стабильный 13C16O2, образующиеся из вносимых извне аналогов естественного карбамида, несвойственны для процессов, обычно протекающих в живом организме. Исключение составляет только 13C16O2. Его следовые количества всегда образуются в процессе дыхания. Именно поэтому контроль изотопных маркеров в выдыхаемом воздухе или моче является качественно иной задачей нежели контроль естественных метаболитов. Обычно он осуществляется методами радиоуглеродного анализа, масс-спектрометрией и им подобными приборными методами. Причем в случае радиоактивных изотопов их количество, вносимое в организм, лимитируется ущербом от их внедрения и оно минимизировано. Это требует применения высокоточных методик и использования высокочувствительных, а следовательно, дорогих аналитических устройств. В случае 13C ущерб здоровью от применения нерадиоактивного изотопного маркера не отмечался и его небольшое количество, вносимое в организм в ходе исследования, определяется только желанием сэкономить дорогостоящий реагент. Это в свою очередь неоправданно повышает требования к чувствительности и другим метрологическим характеристикам масс-спектрометра и используемых аналитических методик. В то же время, в этом случае требуется измерение фоновой концентрации 13C16O2 в выдыхаемом воздухе до введения карбамида, меченного изотопным маркером, и эффект селективности, присущий методикам с использованием изотопных маркеров, отсутствует или используется не в полной мере. Все вышеперечисленные способы (методические подходы) воспроизводят биохимический уреазный тест в максимально усложненном варианте, где контроль инвазии осуществляется по результатам анализа сложных кинетических зависимостей. Чувствительность таких кинетических методик тем не менее достигает 96-99%, а специфичность - 98% [Walsh J.H., Peterson W.L. The Treatment of Helicobacter Pylori Infection in the Management of Peptic Ulces Disease. Review Article, The New England Jounal of Medicine, v. 333, n. 15, p. 984-991]. Но использование радиоактивного 14C в детской практике ограничено, а определение 13C связано с эксплуатацией дорогостоящего масс-спектрометра.
Методики оценки уреазной активности in vivo по гидролизу карбамида нормального изотопного состава предполагают контроль содержания аммиака, так как считается, что наличие 12C16O2 в выдыхаемом воздухе (воздухе ротовой полости) не позволяет оценить ферментативный гидролиз карбамида по приросту содержания углекислого газа.
Ограниченное применение нашел метод, названный авторами как "Аэротест" [Safonova N.V., Meelaiko V.E., Zhebrun A.B. et al. "The Respiratory Test for detecting Helicobacteriosis.": - Workshop: - Helicobacter pylori and the new concepts in gastroduodenal diseases. - Prague, 1992. - P-3. Zhebrun A.B., Safonova N. V. , Mileiko V.E. et al. "AEROTEST" for Helicobacter pylori diagnosis. : - Acta Gastroenterol. Beig. - 1993. - Vol. 56. - P. 84]. Этот метод построен на определении содержания аммиака в воздухе ротовой полости (фоновой концентрации - C1) без внесения мочевины извне. По упрощенной методике C1 измеряют как среднюю величину текущих концентраций за время анализа (τ). В качестве диагностического критерия, свидетельствующего об инвазии HP, авторы предлагают C1 ≥ 0,8 мг/м3 [Милейко В.Е., Сафонова Н.В., Жебрун А. Б. и др. "Методы лабораторной диагностики хеликобактериоза": - Актуальные проблемы инфекционной патологии. - СПб, 1993. - С. 43].
В наиболее простом варианте содержание аммиака измеряется линейными одноразовыми газоанализаторами - индикаторными трубками (ИТ). Через ИТ, заполненную хемосорбентом (кислотно-основной индикатор Бромфеноловый синий на силикагеле марки КСК кислотной обработки с размером зерен 0,16-0,25 мм), прокачивается с помощью электромеханического или ручного аспиратора два литра воздуха из ротовой полости пациента. Аналитическая реакция происходит во время отбора пробы, а оценка содержания аммиака производится по длине слоя адсорбента, изменившего окраску. При использовании серийных стандартизованных ИТ каждый миллиметр слоя наполнителя, изменившего окраску, соответствует 0,3 мг/м3, а общая погрешность для C от 0,3 до 0,9 мг/м3 составляет 30%.
Для выполнения измерений по контролю содержания углекислого газа (другого газообразного продукта гидролиза) в воздухе также могут использоваться индикаторные трубки на основе твердых химических адсорбентов: Тимолфталеин на окиси алюминия или гидразингидрат совместно с фуксином основным на силикагеле [Е. А. Перегуд, М.С. Быховская, Е.В. Гернет. Быстрые методы определения вредных веществ. Изд. 2-ое, "Химия" М., 1970, 360 с., с. 153 и 154].
Кроме того, разработан биохимический тест измерения уреазной активности in vivo (ХЕЛИК-тест) по оценке прироста концентрации аммиака (ΔC) в воздухе ротовой полости после приема пациентом мочевины (карбамида) нормального изотопного состава 12C1H4 14N2 16O [патент РФ N 2100010, A 61 B 10/00, C 12 Q 1/58, "Способ неинвазивной хеликобактериозадиагностики ин виво", Корниенко Е. А., Милейко В.Е. опубл. 27.12.97, Бюл. N 36; Корниенко Е.А., Милейко В.Е. "Новый метод неинвазивной диагностики хеликобактериоза". Диагностика и лечение: - Архангельск, 1996, 11 (12), с. 31-33]. Мочевина быстро гидролизуется под действием уреазы HP и вызывает изменение содержания аммиака в воздухе. Причем контроль содержания аммиака в воздухе ротовой полости может осуществляется как простейшими средствами газового анализа (ИТ, тест-билеты или фотоколориметрические методики), так и сложными физико-химическими методами, например газоаналитической методикой с использованием спектрометра ионного дрейфа (СИД) [E. Kornienko, O. Vashkevich, V.Mileiko, V.Samokish, "Simple Express Urea Breath Test Offers Diagnosis of Helicobacter pylori Infection" in Abstracts ofinternnational Congress on Analytical Chemistry, Moscow, Russia, June 15-21, 1997, v. 2, p. 37]. Спектрометр обладает быстродействием и позволяет моментально оценить количество каких-либо веществ в воздухе, автоматически аспирируемом его системой пробоотбора. Метод ион-дрейфовой спектрометрии (ИДС) основан на том, что азот воздуха, ионизированный β -излучением от 63Ni взаимодействует с примесями в камере реактора, образуя ионные кластеры. В случае NH3 это ионные кластеры (H2O)nNH3 +. Слабоионизированная плазма импульсно эжектируется в дрейфовую камеру, где ионные кластеры дифференцируются по подвижности в электрическом поле. Измерение ионных токов в конце дрейфовой камеры позволяет получить представление о составе примесей в анализируемом воздухе.
Методики, предполагающие оценку прироста содержания аммиака в воздухе ротовой полости, который связан с пероральным приемом карбамида, или карбамида в смеси с наполнителем, или раствора 0,5 г карбамида в 5-20 мл воды [Милейко В. Е. , Корниенко Е.А., Григорян Т.М. "Комплекс методик для диагностики инвазии Helicobacter pylori": Сб. докладов и тезисов докладов Второй всеросийской научно-практической конференции с международным участием "Новое в экологии и безопасности жизнедеятельности" 20-22 мая 1997 г. в СПб, под ред. Проф. Н. И. Иванова, 3 т., МЦЕНТ СПб, 1997, т. 3, с. 432-438], или же ополаскиванием ротовой полости раствором карбамида [В.Л. Пайков, А.В. Иванов "Предварительные результаты исследований уреазной активности полости рта у детей с Helicobacter pylori ассоциированным гастродуоденитом". Пятая сессия Российской группы по изучению Helicobacter pylori, Омск, 20-21 мая 1997 г.: - Материалы сессии, с. 47-49] являются наиболее близкими к заявленному способу. Они предполагают контроль аммиака в выдыхаемом воздухе или воздухе ротовой полости. Выполнение этих аналитических процедур при дыхании через рот усложняет процедуру измерения, так как измеряется либо усредненный показатель между вдыхаемым и выдыхаемым воздухом, либо требуется устройство, отделяющее выдыхаемый воздух, или устройство, регулирующее отбор пробы воздуха на выдохе.
Нами экспериментально установлено, что контроль продуктов гидролиза, как углекислого газа, так и аммиака, в воздухе ротовой полости при дыхании через нос существенно упрощает аналитическую процедуру.
В воздухе ротовой полости при дыхании носом до приема дополнительных порций карбамида углекислый газ обычно содержится на уровне, не превышающем концентрации 0,1 об. %. Это содержание характерно для жилых помещений и не является значимым для диагностики. Таким образом, в этом случае присутствуют лишь следы аммиака и углекислого газа, которые обусловлены не только фоновым содержанием в воздухе жилых помещений, но и, вероятно, обусловлены уреазной активностью микроорганизмов как ротовой полости, так и ЖКТ. Кроме того, следы углекислого газа могут быть обусловлены некоторым вкладом процесса дыхания. Общеизвестно, что углекислый газ, обладающий наркотическим действием, даже в относительно малых концентрациях возбуждает дыхательный центр, а в очень больших - угнетает его [Е.А. Перегуд, М.С. Быховская, Е.В. Гернет. Быстрые методы определения вредных веществ в воздухе. Изд. 2-е, М.: Химия, 1970, 360 с., с. 151].
Целью данной работы было создание информативного, простого, удобного и недорогого неинвазивного метода диагностики, построенного на регистрации продуктов гидролиза карбамида под действием микробной уреазы в выдыхаемом воздухе и воздухе ротовой полости или влиянию этих продуктов на дыхание обследуемого.
Данные нашего исследования показали, что прием карбамида в виде раствора, гранул или же в кристаллическом виде приводит к существенному увеличению у пациентов, инфицированных HP, средневзвешенной концентрации углекислого газа и аммиака в выдыхаемом воздухе и воздухе ротовой полости при дыхании ртом или носом по сравнению с фоновым содержанием до приема карбамида. В то время как для лиц контрольной группы, не имеющих инвазии HP, отмечаются только несущественные колебания средневзвешенного содержания аммиака и углекислого газа в выдыхаемом воздухе (или воздухе ротовой полости при дыхании через рот), или воздухе ротовой полости при дыхании через нос по сравнению с фоновым содержанием до приема карбамида. Причем для пациентов, инфицированных HP, содержание углекислого газа и аммиака в воздухе ротовой полости как при дыхании носом, так и при дыхании ртом увеличивается с разной скоростью, что свидетельствует об отличии в процессах массопередачи и эвакуации для этих продуктов ферментативного гидролиза карбамида (см. чертеж). При ополаскивании ротовой полости раствором карбамида или внесении его в ротовую полость совместно с другими веществами, например жевательной резинкой Dirol® Carbamide+, увеличение содержания продуктов гидролиза в газовой среде ротовой полости отчетливо проявляется как при дыхании через нос, так и при дыхании ртом. Причем содержание аммиака и углекислого газа у пациентов, инфицированных HP, временно повышается уже со второй минуты и возвращается к фоновым значениям за меньшее время, чем в случае перорального приема внутрь, то есть попадания, главным образом, в пищевод и далее в желудок. При этом фоновая средневзвешенная концентрация углекислого газа и аммиака много меньше текущих максимальных величин, вызванных массопередачей в газовую среду продуктов ферментативного гидролиза внесенного извне карбамида. У обследуемых, не имеющих инвазии HP, содержание аммиака и углекислого газа остается практически неизменным. Аналогичная картина наблюдается и в случае других уреазопродуцентов.
Нами показано, что анализ воздуха, отобранного из ротовой полости при дыхании носом, следующий за внесением в ротовую полость или пищевод карбамида, характеризует инвазию верхних отделов ЖКТ уреазопродуцентными микроорганизмами, например HP, так как гидролиз карбамида нормального изотопного состава под действием эндогенной уреазы воспроизводит процесс, аналогичный естественному процессу, протекающему в организме у пациентов, инфицированных уреазоактивной микрофлорой. Такая диагностическая методика не нуждается в использовании каких-либо изотопных маркеров. Изменение содержания углекислого газа и аммиака легко контролируется доступными средствами газового анализа, в том числе и индикаторными трубками серийного производства. Проведение аналитической процедуры по определению содержания углекислого газа и аммиака предложенным методом несколько сокращает время исследования и позволяет снизить количество отбираемой для анализа газовой пробы.
Как упомянуто выше, содержание углекислого газа в окружающем или выдыхаемом воздухе является авторегулятором частоты дыхания. Кроме того, показано [Демиденко Е.Г., Иванов А.В., Милейко В.Е. Сб. докладов и тезисов докладов Второй всеросийской научно-практической конференции с международным участием "Новое в экологии и безопасности жизнедеятельности" 20-22 мая 1997 г. в СПб, под ред. Проф. Н.И. Иванова, 3 т., МЦЕНТ СПб, 1997, т. 3, с. 179], что у пациентов, инфицированных HP, выделение аммиака в выдыхаемый воздух за счет гидролиза карбамида по концентрации сравнимо с санитарными нормативами для воздуха рабочей зоны и, следовательно, достаточно для того, чтобы влиять на процесс дыхания. Нами установлено, что при нагрузочном тестировании пациентов, инфицированных уреазопродуцентной микрофлорой, содержание углекислого газа в их ротовой полости (в выдыхаемом воздухе) после приема карбамида в количестве от 0,1 г и выше временно увеличивается до величины, превышающей те минимальные значения, которые сказываются на характеристиках дыхания. На экспериментальном материале, обследуемом параллельно различными диагностическими методами, показано, что нагрузка карбамидом в количествах 0,1; 0,2; 0,5; 1,0; 2,0 г и более у пациентов, инфицированных HP, приводит к временному изменению состава воздуха в ротовой полости (выдыхаемого воздуха). Это в свою очередь приводит к увеличению частоты дыхания в 1,5-2,0 раза и увеличению минутного объема выдыхаемого воздуха (расхода воздуха). У пациентов, не инфицированных уреазопродуцентной микрофлорой, подобный отклик отсутствует. При этом общеизвестно, что главный вклад в процесс ферментативного гидролиза вносит HP, который продуцирует достаточно много высокоактивной уреазы. Следовательно, повышенная частота дыхания и увеличенный объемный расход выдыхаемого воздуха также служат диагностическими критериями для оценки степени инвазии HP. Причем измерения частоты дыхания и объемного расхода выдыхаемого воздуха после введения карбамида в организм извне (нагрузка карбамидом) может быть проведено, как с помощью стандартной приборной базы, так и простой счетной процедурой или вольюмометрическими измерениями с помощью газового колокола.
Для оценки скорости этого процесса мы изучили характер изменения концентрации аммиака и углекислого газа в воздухе ротовой полости после приема мочевины (карбамида) у здоровых обследуемых и лиц страдающих гастродуоденальными заболеваниями. Пациенты обследовались несколькими диагностическими методиками одновременно.
Пример 1. У пациента, страдающего ассоциированной с Helicobacter pylori гастродуоденальной патологией (антральный гастрит и язва двенадцатиперстной кишки), установленной ранее в стационаре в ходе эндоскопического обследования с проведением биопсии (биоптат слизистой оболочки антрального отдела желудка) и биохимического уреазного теста, в состоянии покоя в течение одной минуты отбираются пробы воздуха. Пробы воздуха отбираются из ротовой полости двухканальным аспиратором через индикаторные трубки для определения аммиака и углекислого газа. При этом пациент дышит носом. Одновременно измеряется частота дыхания, объем выдоха, минутный объем дыхания (CNH3 = 0,2 мг/м3, CCO2 = 0,04 об.%, n = 16 вдохов в минуту, объем одного выдоха 230 см3, обьем минутного выдоха 3680 см3). После чего обследуемый пациент жует жевательную резинку Dirol® Carbamide+ в течение 2 мин. Затем у обследуемого, когда он дышит через нос, вновь измеряют содержание аммиака и углекислого газа в воздухе ротовой полости, частоту дыхания и объем выдоха поминутно. Содержание аммиака в воздухе ротовой полости обследуемого пациента существенно возрастает уже через 2-3 мин (CNH3 = 1,8 ± 0,4 мг/м3) после внесения карбамида извне и возвращается к прежним показателям через 12-20 мин (CNH3 = 0,2 ± 0,1 мг/м3). Содержание углекислого газа возрастает через 5-7 мин (CCO2 = 1,6 ± 0,2 об.%), через 15-25 мин стабилизируется на уровне CCO2 = 1,0 ± 0,3 об.% и возвращается к прежним показателям (CCO2 = 0,1 ± 0,03 об.%) через 45-70 мин. При этом частота дыхания возрастает до 25-28 вдохов в минуту уже к 5-6-й минуте и плавно убывает, возвращаясь к прежним показателям через 25-30 мин. Объем одного выдоха постепенно увеличивается с 5-10-й минуты, достигая на 20-25-й минуте величины 300-320 см3, и колебалась в этих пределах в течение 10-15 мин, после чего плавно снижалась до исходного значения в течение 15 мин. Объем минутного выдоха возрастал с 5-6-й минуты, достиг максимальных значений на 15-20-й мин (5700-5800 см3), колебался в указанных пределах в течение 18-23 мин, после чего постепенно за 15-18 мин вернулся к исходным показателям. Параллельно наличие инвазии HP было подтверждено серологическими тестами по методу ELISE (тесты производства Bio-Rad) тестом с нагрузкой карбамидом нормального изотопного состава [патент РФ N 2100010, A 61 B 10/00, C 12 Q 1/58, "Способ неинвазивной хеликобактериозадиагностики ин виво", Корниенко Е. А. , Милейко В.Е. опубл. 27.12.97, Бюл. N 36] и тестом (PY-test производства Tri-med Specialties Co. USA) с радиоизотопным маркером [Peura D. A. , Pambianko D.J. Dye K.R., et al. Microdose urea breath test offersdiagnosis of Helicobacter pylori in 10 minutes. Am. J. Gastro. 1996, v. 91, N 2, p. 233-238].
Пример 2. Обследование проводили аналогично тому, как это описано в примере 1, с той лишь разницей, что обследуемым был доброволец, не имеющий гастродуоденальной патологии. Все показатели (концентрации углекислого газа и аммиака, частота дыхания, объем одиночного и объем минутного выдоха) в ходе обследования не имели существенных изменений (значимых отличий) на протяжении 40 мин, то есть до окончания обследования.
Отсутствие HP инвазии у пациента подтверждается серологическими тестами по методу ELISE (тесты производства Bio-Rad) и дыхательными тестами, упомянутыми в примере 1.
Пример 3. Обследование проводили аналогично тому, как это описано в примере 1, с той лишь разницей, что обследовался тот же самый пациент после курса антихеликобактерной терапии. После того как обследуемый в течение 2 мин жует жевательную резинку Dirol® Carbamide+, содержание аммиака в воздухе ротовой полости существенно возрастает уже через 2-3 мин (CNH3 = 0,8 ± 0,2 мг/м3) и возвращается к прежним показателям через 8-12 мин (CNH3 = 0,2 ± 0,1 мг/м3). Содержание углекислого газа поднимается через 5-7 мин (CCO2 = 1,4 ± 0,2 об. %) и возвращается к прежним показателям через 15-25 минут (CCO2 = 0,03 ± 0,01 об. %). При этом частота дыхания возрастает до 25-28 вдохов в минуту уже к 5-6-й минуте и плавно убывает, возвращаясь к прежним показателям через 25-30 мин.
Пример 4. Обследование проводили аналогично тому, как это описано в примере 3, с той лишь разницей, что обследовался тот же пациент, но после повторного курса антихеликобактерной терапии. Обследуемый пациент жевал резинку Dirol® Carbamide+ в течение 2 мин. После чего содержание аммиака в воздухе ротовой полости практически не возросло (через 2-3 мин CNH3 = 0,3 ± 0,1 мг/м3, через 5-8 мин CNH3 = 0,4 ± 0,2 мг/м3) и возвратилось к прежним показателям через 8-12 мин (CNH3 = 0,2 ± 0,1 мг/м3). Содержание углекислого газа в воздухе ротовой полости до внесения карбамида извне составляло (CCO2 = 0,04 ± 0,01 об.%), через 5-7 мин оно практически не увеличилось (CCO2 = 0,05 об.%). Не увеличилось оно и в последующие 35-40 мин (CCO2 = 0,04 ± 0,01 об. %). При этом частота дыхания во время всего обследования практически не менялась.
Пример 5. У того же обследуемого пациента, обследовавшегося ранее (пример 1) и страдающего гастродуоденальной патологией (антральный гастрит и язва двенадцатиперстной кишки), ассоциированной с Helicobacter pylori, до курса антихеликобактерной терапии из ротовой полости отбираются пробы воздуха. Пробы отбираются в состоянии покоя, когда он дышит ртом, в течение одной минуты аспиратором через индикаторную трубку для определения аммиака и через индикаторную трубку для определения углекислого газа. Одновременно измеряется частота дыхания (CNH3 = 0,2 ± 0,1 мг/м3, CCO2 = 0,7 ± 0,2 об.%, n = 18 вдохов в минуту). Затем обследуемый жует жевательную резинку Dirol® Carbamide+ в течение 2 мин. После чего у обследуемого при дыхании через рот вновь измеряют содержание аммиака и углекислого газа в воздухе ротовой полости и частоту дыхания поминутно. Содержание аммиака в воздухе ротовой полости существенно возрастает уже через 2-3 мин до CNH3 = 1,5 ± 0,3 мг/м3 и возвращается к прежним показателям через 8-12 мин (CNH3 = 0,5 ± 0,2 мг/м3). Содержание углекислого газа через 5-7 мин возрастает до CCO2 = 1,6 ± 0,2 об.% и возвращается к прежним показателям через 15-25 мин (CCO2 = 0,7 ± 0,1 об.%). При этом частота дыхания возрастает до 28-30 вдохов в минуту уже к 5-6-й минуте и плавно убывает, возвращаясь к прежним показателям через 25-30 мин.
Наличие HP инвазии у пациента подтверждается серологическими и дыхательными тестами, как и в примере 1.
Пример 6. Процедуру обследования проводили аналогично описанной в примере 5 с той лишь разницей, что обследуемым был доброволец, который не имел гастродуоденальной патологии и инфицирования Helicobacter pylori, что ранее подтверждено в условиях стационара диагностическими методами, аналогичными описанным в примере 1. Все показатели (концентрации углекислого газа и аммиака, частота и объем дыхания) в ходе обследования не имели существенных изменений (значимых отличий) на протяжении 40 мин, то есть до окончания обследования.
Отсутствие HP инвазии у пациента подтверждается параллельными исследованиями.
Пример 7. Процедуру обследования проводили аналогично описанной в примере 1 с той лишь разницей, что обследовался другой HP инфицированный пациент, частота дыхания которого после нагрузки карбамидом существенно не изменялась. Другие базовые и нагрузочные показатели отличались между собой существенно, как и в примере 1. До приема карбамида содержание аммиака 0,6 ± 0,2 мг/м3, углекислого газа 0,05 ± 0,01 об.%, частота дыхания 17 вдохов в минуту, объем одиночного выдоха 220 см3, объем минутного выдоха 3740 см3. После приема карбамида в качестве нагрузки: 1,2 ± 0,4 мг/м3 (с 5-й по 15-ю минуту), 1,3 ± 0,2 об.% (с 25-й по 35-ю минуту), 410-460 см3, 7400-7800 см3 (с 25-й по 40-ю минуту) соответственно.
Пример 8. Процедуру обследования проводили аналогично описанной в примере 5, но с другим пациентом, у которого частота в силу его физиологических особенностей дыхания после нагрузки карбамидом уменьшалась с 20 до 16 выдохов в минуту, в то время как объем одиночного выдоха и минутный объем выдоха увеличивались, как и другие контролируемые показатели, в 1,5-1,7 раз.
Пример 9. Обследование проводили аналогично примеру 5 с той лишь разницей, что у обследуемого в силу его физиологических особенностей после нагрузки объем одиночного выдоха уменьшился, а остальные контролируемые показатели возросли в 1,5-2 раза.
Пример 10. Обследование проводили аналогично примеру 5. У обследуемого в силу физиологических особенностей объем одиночного выдоха остался неизменным, а остальные контролируемые показатели возросли в 1,5-2 раза.
Пример 11. Обследование проводили аналогично примеру 1 с той разницей, что вместо жевательной резинки Dirol® Carbamide+ в ходе обследования для внесения карбамида в ротовую полость обследуемый ополаскивал рот 20%-ным раствором мочевины в воде и выплевывал раствор. При этом нагрузочные показатели концентраций увеличились по сравнению с аналогичными показателями по примеру 1 в 2-3 раза.
Пример 12. Обследование проводили аналогично примеру 2 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). Результаты по настоящему примеру не отличались от примера 2.
Пример 13. Обследование проводили аналогично примеру 3 и у того же пациента с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 1 в 2-3 раза.
Пример 14. Обследование проводили аналогично примеру 4 и у того же пациента с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 1 в 2-3 раза.
Пример 15. Обследование проводили аналогично примеру 5 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 5 в 2-3 раза.
Пример 16. Процедуру обследования проводили аналогично описанной в примере 6 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). Результаты по настоящему примеру не отличались от примера 6.
Пример 17. Обследование проводили аналогично примеру 7 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 7 в 2-3 раза, а характеристики дыхания соответствовали таковым по примеру 7.
Пример 18. Процедуру обследования проводили аналогично описанной в примере 8 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20% раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 7 в 2-3 раза, а характеристики дыхания соответствовали таковым по примеру 8.
Пример 19. Процедуру обследования проводили аналогично описанной в примере 9 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 7 в 2-3 раза, а характеристики дыхания соответствовали таковым по примеру 9.
Пример 20. Процедуру обследования проводили аналогично описанной в примере 10 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 20%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом нагрузочные концентрации увеличились по сравнению с аналогичными показателями по примеру 7 в 2-3 раза, а характеристики дыхания соответствовали таковым по примеру 10.
Пример 21. Процедуру обследования проводили аналогично описанной в примере 1 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде 5%-ного раствора в воде (ополаскивали рот и выплевывали раствор). При этом анализируемые показатели не отличались от показателей по примеру 1.
Пример 22. Процедуру обследования проводили аналогично описанной в примере 1 с той лишь разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ карбамид вносили в ротовую полость в виде гранул в количестве 0,1 г. Показатели аналогичны таковым по примеру 1.
Пример 23. Процедуру обследования проводили аналогично описанной в примере 1 с той разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде гранулированного кристаллического карбамида в количестве 1 г. Все анализируемые показатели превышают аналогичные показатели по примеру 1. После приема карбамида в качестве нагрузки: 2,0 ± 0,4 мг/м3 (с 5-й по 15-ю минуту), 1,9 ± 0,3 об.% (с 25-й по 35-ю минуту), частота достигает максимального значения к 15-й минуте (n = 25); объем одиночного выдоха - 500-530 см3, объемный расход (объем минутного выдоха) - 8400-8600 см3 (с 25-й по 40-ю минуту) соответственно.
Пример 24. Процедуру обследования проводили аналогично описанной в примере 1 с той разницей, что в ходе обследования вместо жевания резинки Dirol® Carbamide+ ополаскивали рот раствором карбамида (0,5 г в 10 мл воды) и проглатывали его. Полученные результаты были аналогичны результатам по примеру 1.
Пример 25. Процедуру обследования проводили аналогично описанной в примере 2 с той разницей, что в ходе обследования вместо жевания резинки Dirol® Carbamide+ ополаскивали рот раствором карбамида (0,5 г в 10 мл воды) и проглатывали его. Полученные результаты были аналогичны результатам по примеру 2.
Пример 26. Процедуру обследования проводили аналогично описанной в примере 11 с той разницей, что в ходе обследования вместо жевания резинки Dirol® Carbamide+ ополаскивали рот раствором карбамида (0,5 г в 5 мл воды) и проглатывали его. Полученные результаты были аналогичны результатам по примеру 11.
Пример 27. У пациента с Helicobacter pylori ассоциированной гастродуоденальной патологией (антральный гастрит и язва двенадцатиперстной кишки), которая была установлена ранее в ходе эндоскопического обследования в стационаре с проведением биопсии и биохимического уреазного теста с биоптатом слизистой оболочки антрального отдела желудка, отбирается проба воздуха. Проба отбирается в состоянии покоя, из ротовой полости в течение одной минуты через индикаторную трубку для определения аммиака и через индикаторную трубку для определения углекислого газа (CNH3 = 0,2 ± 0,1 мг/м3, CCO2 = 0,04 ± 0,01 об.%). Пациент при этом дышит носом. После чего он жует жевательную резинку Dirol® Carbamide Effect в течение 2 мин. Затем у обследуемого (дыхание через нос) вновь измеряют содержание аммиака и углекислого газа в воздухе ротовой полости. Содержание аммиака существенно повышается уже через 2-3 мин после нагрузки карбамидом (CNH3 = 1,6 ± 0,3 мг/м3) и возвращается к прежним показателям через 8-12 мин (CNH3 = 0,2 ± 0,1 мг/м3). Содержание углекислого газа возрастает через 5-7 мин (CCO2 = 1,8 ± 0,2 об.%) и возвращается к исходным показателям через 15-25 мин (CCO2 = (0,03±0,01)% об.). Параллельно наличие инвазии HP было подтверждено серологическими и дыхательными тестами по примеру. Через 4 недели после проведенной антихеликобактерной терапии у этого же пациента было проведено повторное исследование концентраций аммиака и углекислого газа до и после жевания Dirol® Carbamide Effect. Концентрация аммиака до и после нагрузки (через 5-10 мин) составила соответственно 0,2 ± 0,1 мг/м3 и 1,8 ± 0,3 мг/м3, в то время как концентрация углекислого газа существенно не изменялась, составляя 0,2-0,4 об.% в течение последующих 20 мин. Результаты газоаналитических измерений свидетельствовали о недостаточной эффективности терапии. При этом результат уреазного теста с биоптатом слизистой оболочки антрального отдела желудка был отрицательным. В предпринятом через 6 месяцев после терапии третьем исследовании концентраций газов после жевания Dirol® Carbamide Effect соответствовала 2,0 ± 0,4 мг/м3 для аммиака и 1,8 ± 0,2 об.% для углекислого газа, что свидетельствовует о наличии ивазии HP. Инвазия HP параллельно подтвердилась другими методами, включая биохимический уреазный тест с биоптатом из антрального отдела желудка, который ранее был отрицательным. Повторная антихеликобактерная терапия, проведенная согласно рекомендациям "Стандарты (протоколы) диагностики и лечения болезней органов пищеварения", утвержденных приказом Министерства здравоохранения Российской Федерации N 125 от 17.04.98, привела к нормализации показателей. Повышение содержания аммиака и углекислого газа в выдыхаемом воздухе, а также увеличение частоты дыхания или объемного расхода выдыхаемого воздуха после приема карбамида по результатам вышеописанных дыхательных тестов отсутствовало. Параллельно выполняемые тесты по оценке уреазной активности биоптата также свидетельствовали об эффективности выбранной схемы терапии. Однако серологический тест оставался положительным. Диагностические исследования еще через 4 месяца после повторной терапии не выявили инвазии HP. Причем серологический тест был, как и другие тесты, отрицательным.
Пример 28. Процедуру обследования проводили аналогично описанной в примере 1 с той лишь разницей, что в ходе обследования вместо жевательной резинки Dirol® Carbamide+ в ротовую полость карбамид вносили в виде гранулированного кристаллического карбамида в количестве 0,1 г. Результат теста был отрицательным. Затем у того же пациента провели аналитическую процедуру аналогично тому, как это описано в примере 1. Показатели аналогичны таковым по примеру 1, то есть указывали на наличие инвазии ПР. Через час аналитическую процедуру повторили аналогично тому, как это делалось в примере 1, но перед проведением процедуры ротовую полость тщательно прополоскали 1%-ным раствором перикиси водорода. Результат теста был отрицательным. Параллельно проведенные в стационаре дыхательные тесты и уреазный тест с биоптатом, как и гистологические исследования, не указывали на наличие инвазии HP. Серололгический тест указывал на наличие инвазии HP. Пациенту не проводили антихеликобактерной терапии. Через 6 месяцев повторное обследование всеми вышеописанными диагностическими методиками подтвердило наличие инвазии HP.
Пациенту был назначен стандартный курс антихеликобактерной терапии. Исследования, проведенные через 6 недель после окончания терапевтического курса, подтвердили эффективность терапии, как и в примере 27.
Пример 29. Проводили аналогично тому, как это описано в примере 28, у другого добровольца с той лишь разницей, что вместо санирования ротовой полости раствором перикиси водорода для того, чтобы исключить влияние уреазопродуцентов персистирующих в ротовой полости, кристаллический карбамид пациенту давали принять в легкорастворимой капсуле. Результаты аналогичны результатам по примеру 28.
Из вышеизложенного следует, что изменения показателей дыхания (увеличение частоты дыхания, объема одиночного выдоха, расхода воздуха - минутного объема выдоха), и особенно увеличение объемного расхода, связанные с внесением в организм карбамида извне, однозначно характеризует уреазную активность микрофлоры верхних отделов ЖКТ, в частности уреазную активность, обусловленную инвазией HP. Повышение содержания аммиака и углекислого газа в воздухе полости рта, связанное с внесением в организм карбамида, также характеризует уреазную активность in vivo. Предлагаемые диагностические подходы пригодны для контроля терапии, причем последний из них позволяет способствовать раннему выявлению случаев реинфекции, связанных с персистированием HP в полости рта.
С использованием вышеописанной методики было обследовано 32 человека. Из них 5 пациентов составили контрольную группу не страдающих гастродуоденальной патологией, 12 пациентов по данным других анализов не инфицированы Helicobacter pylori, 15 пациентов были инфицированы Helicobacter pylori. Селективность метода составила 96%, чувствительность 95%. Это соответствует другим аналитическим уреазным методикам с применением аналогичных тестов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ХЕЛИКОБАКТЕРИОЗА ИН ВИВО | 1996 |
|
RU2100010C1 |
| СПОСОБ ДИАГНОСТИКИ ХЕЛИКОБАКТЕРИОЗА ПО ОЦЕНКЕ УРЕАЗНОЙ АКТИВНОСТИ БИОЛОГИЧЕСКОГО МАТЕРИАЛА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2184781C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ИНФЕКЦИИ HELICOBACTER PYLORI ИН ВИВО И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2003 |
|
RU2263468C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ХЕЛИКОБАКТЕРНОЙ ИНФЕКЦИИ | 2001 |
|
RU2229714C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИАГНОСТИКИ ИНФЕКЦИИ HELICOBACTER PYLORI | 2007 |
|
RU2325845C1 |
| СПОСОБ ДИАГНОСТИКИ ХЕЛИКОБАКТЕРИОЗА | 1993 |
|
RU2091796C1 |
| СПОСОБ ДИАГНОСТИКИ Helicobacter pylori И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2015 |
|
RU2593008C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЭРАДИКАЦИОННОЙ ТЕРАПИИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА С СОЧЕТАНИЕМ ГАСТРОДУОДЕНАЛЬНОЙ ПАТОЛОГИИ | 2014 |
|
RU2604143C2 |
| СПОСОБ ДИАГНОСТИКИ ИНФЕКЦИИ HELICOBACTER PYLORI У БОЛЬНЫХ С ХИРУРГИЧЕСКОЙ ПАТОЛОГИЕЙ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ | 2009 |
|
RU2440583C2 |
| Способ неинвазивной диагностики инфекции Helicobacter pylori с помощью 13С-уреазного дыхательного теста | 2022 |
|
RU2790397C1 |
Способ может быть использован в медицине, а именно для диагностики инвазии Helicobacter pylori (НР) по уреазной активности микроорганизма. Способ определения уреазной активности Helicobacter pylori (НР) in vivo включает внесение в организм карбамида и контроль процесса его гидролиза газоаналитическими измерениями. До и после внесения в организм карбамида во время дыхания через нос определяют частоту дыхания, или объемный расход выдыхаемого воздуха, или содержание углекислого газа нормального изотопного состава, и/или содержание аммиака нормального изотопного состава. И по увеличению указанных параметров относительно исходных значений определяют наличие уреазной активности. Способ является простым, удобным и недорогим методом диагностики наличия в организме обследуемого НР. 5 с. и 1 з.п. ф-лы, 1 ил.
| МИЛЕЙКО В.Е | |||
| и др | |||
| Комплекс методик для диагностики Helicobacter pylori (НР) | |||
| Сборник докл | |||
| и тез | |||
| докл | |||
| Второй научно-практической конференции с международным участием "Новое в экологии безопасности жизнедеятельности" | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Н.И.Иванова | |||
| - МЦЕНТ СПб, 1997, с.432-438 | |||
| СПОСОБ ДИАГНОСТИКИ ХЕЛИКОБАКТЕРИОЗА | 1993 |
|
RU2091796C1 |
| Способ определения инфицированности желудка СамрYLовастеR pYLoRIDIS | 1988 |
|
SU1659850A1 |
| УСТРОЙСТВО ДЛЯ ИСПЫТАНИЯ высоковольтных | 0 |
|
SU253927A1 |
| ПАЙКОВ В.Л | |||
| и др | |||
| Предварительные результаты исследований уреазной активности полости рта у детей с Helicobacter pylori ассоциированным с гастродуоденитом | |||
| Пятая сессия группы по исследованию Helicobacter pylori, Омск, 20-21 Мая | |||
| Материалы сессии | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
Авторы
Даты
2001-12-10—Публикация
1998-05-15—Подача