Изобретение относится к технической области способов получения аминофенилсульфонилмочевин, обладающих свойствами гербицидов или регуляторов роста растений.
Известно, что гетероциклически замещенные фенилсульфонилмочевины, несущие в фенильном кольце амино-, соответственно функционализированную аминогруппу, обладают гербицидными и регулирующими рост растений свойствами (EP-A-1515; EP-A-7687 (=US -A 4,383,113); EP-A-30138 (=US -A 4,394,506); US -A-4,892,946; US -A-4,981,509; EP-A-116518 (= US -A-4,664,695, US -A-4,632,695)), WO -94/10154. Кроме того, в германской патентной заявке P 4415049.0 (WO 94/29899) были предложены в качестве гербицидов ациламиносульфонилмочевины. В указанной литературе также описаны способы получения сульфонилмочевин. Соединения со свободной аминогруппой в фенильном кольце сами по себе являются гербицидно-активными веществами или же пригодны в качестве исходных веществ для получения соединений с замещенной аминогруппой.
Методы получения аминофенилсульфонилмочевин часто возможны лишь с незначительными выходами или невысокой чистотой получаемого продукта из-за наличия многих реакционноспособных функциональных групп в молекуле.
Недостатком является также то, что во многих способах приходится применять защитные группы, например трет-бутильную группу для сульфонамидов, отщепление которых требует применения специальных и сложных в использовании реагентов, таких как трифторуксусная кислота. Кроме того, известные способы получения соединений сульфонилмочевины являются большей частью многоступенчатыми и поэтому, как правило, дают лишь умеренный общий выход.
Задачей изобретения является, таким образом, создание способа, пригодного для получения большой группы гербицидов из ряда аминофенилсульфонилмочевин и свободного от многих из вышеуказанных недостатков.
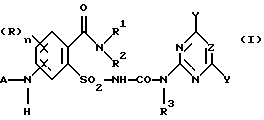
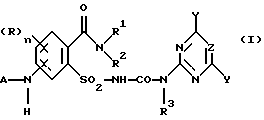
Предметом изобретения является способ получения соединений формулы (I) и их солей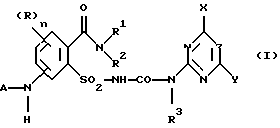
где (R)n означает n одинаковых или различных остатков из группы галоген, алкил и алкокси,
n означает 0, 1, 2 или 3, предпочтительно 0 или 1, в частности 0,
A означает водород или ацильный остаток,
R1 означает водород или незамещенный либо замещенный углеводородный или углеводородокси-остаток, содержащий 1 - 6 C-атомов, предпочтительно 1 - 4 C-атома,
R2 означает водород или незамещенный либо замещенный углеводородный остаток, содержащий всего 1 - 10 C-атомов, предпочтительно 1 - 4 C-атома,
или группа
NR1R2 означает гетероциклическое кольцо с 3-8 атомами в кольце, которое не замещено или замещено и содержит в кольце N-атом группы NR1R2 в качестве гетероатома и может содержать в кольце еще один или два гетероатома из группы N, O и S,
R3 означает водород или C1-C4-алкил,
X, Y означает независимо один от другого галоген, C1-C6-алкил, C1-C6-алкокси, C1-C6-алкилтио, причем каждый из трех последних остатков не замещен или замещен одним или несколькими остатками из группы галоген, C1-C4-алкокси, C1-C4-алкилтио, или C3-C6-циклоалкил, C2-C6-алкенил, C2-C6-алкинил, C3-C6-алкенилокси или C3-C6-алкинилокси и
Z означает CH или N,
отличающийся тем, что
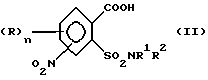
1. (стадия 1) соединение формулы (II)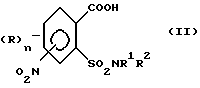
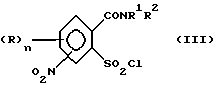
или его соли подвергают взаимодействию в присутствии галогенирующего средства с образованием галогенангидрида карбоновой кислоты и его перегруппировкой в соединение формулы (III)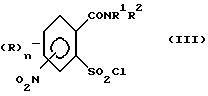
2. (стадия 2) затем
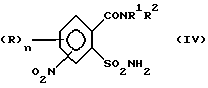
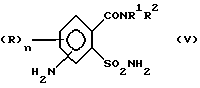
а) аммонолизируют соединение (III) по SO2Cl-группе с получением соединения формулы (IV),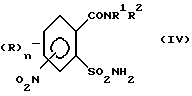
затем восстанавливают соединение (IV) по нитрогруппе с получением соединения (V)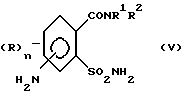
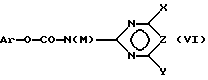
и затем подвергают соединение (V) взаимодействию с карбаматом, соответственно с солью карбамата формулы (VI),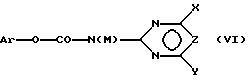
где Ar означает незамещенный или замещенный фенил и M означает H, C1-C4-алкил или катион металла с получением соединения формулы (I), в которой R3 в соответствии с M в формуле (VI) означает H или C1-C4-алкил, или в случае, если M = катион металла, R3 означает атом водорода и A означает H, или
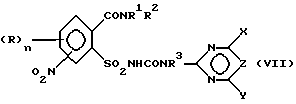
б) аммонолизируют соединение формулы (III) по SO2Cl-группе с получением указанного соединения формулы (IV), затем соединение (IV) подвергают взаимодействию с карбаматом, соответственно с солью карбамата указанной формулы (VI) с получением соединения формулы (VII),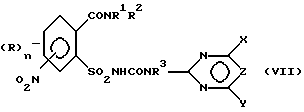
в которой R3 в соответствии с M в формуле (VI) означает H или C1-C4-алкил или в случае, если M = катион металла, R3 означает атом водорода, и восстанавливают соединение формулы (VII) по нитрогруппе с получением соединения формулы (I), в которой A означает H, или
в) подвергают взаимодействию соединение формулы (III) с цианатами или с гетероциклическим амином формулы (VIII),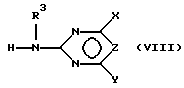
где R3 определен как в формуле (I) с получением сульфонилмочевины формулы (VII), которая после восстановления по нитрогруппе дает соединения формулы (I), в которой A означает H, и
3. (стадия 3) в случае, если A в конечном продукте формулы (I) означает не водород, а ацильный остаток, ацилируют полученное на стадии 2 соединение формулы (I), в которой A означает H, причем в формулах (II)-(VIII) остатки (R)n, R1, R2, X, Y, Z имеют такое же значение, как и в конечном продукте формулы (I).
В формулах (I) - (VIII) в применяемых ниже формулах остатки алкил, алкокси, галоалкил, галоалкокси, алкиламино и алкилтио, а также соответствующие ненасыщенные и/или насыщенные остатки в углеводородном скелете могут быть линейными или разветвленными. Если специально не указано иное, этими остатками являются низшие углеводородные скелеты, например, предпочтительно с 1-4 C-атомами, соответственно в случае ненасыщенных групп - с 2-4 C-атомами.
Алкильные остатки, в том числе и в сложных значениях, таких как алкокси, галоалкокси и т.д., означают, например, метил, этил, н- или изо-пропил, н-, изо-, трет- или 2-бутил, пентилы, гексилы, такие как н-гексил и 1,3-диметилбутил, гептилы, такие как н-гептил, 1-метилгексил и 1,4-диметилпентил.
Алкенильные или алкинильные остатки имеют значение соответствующих алкильным остаткам возможных ненасыщенных остатков; алкенил означает, например, аллил, 1-метил-проп-2-ен-1-ил, 2-метилпроп-2-ен-1-ил, бут-2-ен-1-ил, бут-3-ен-1-ил, 1-метилбут-3-ен-1-ил и 1-метилбут-2-ен-1-ил; алкинил обозначает, например, пропаргил, бут-2-ин-1-ил, бут-3-ин-1-ил, 1-метилбут-3-ин-1-ил.
Галоген означает, например, фтор, хлор, бром или иод.
Галоалкил, галоалкенил и галоалкинил означают частично или полностью замещенный галогеном, предпочтительно фтором, хлором и/или бромом, в частности фтором или хлором, алкил, алкенил, соответственно алкинил, например, CF3, CHF2, CH2F, CF3CF2, CH2FCHCl, CCl2, CHCl2, CH2CH2Cl; галоалкокси означает, например, OCF3, OCHF2, OCH2F, CF3CF2O, OCH2CF3 и OCH2CH2Cl; то же самое относится к галоалкенилу и другим замещенным галогеном остаткам.
Углеводородным остатком является линейный, разветвленный или циклический, насыщенный или ненасыщенный алифатический или ароматический углеводородный остаток, например алкил, алкенил, алкинил, циклоалкил, циклоалкенил или арил, предпочтительно алкил, алкенил или алкинил с числом C-атомов до 12 или цилоалкил с 5 или 6 атомами в кольце или фенил; то же относится к углеводородоксиостатку.
Гетероциклический остаток или кольцо может быть насыщенным, ненасыщенным или гетероароматическим; он содержит в кольце один или несколько гетероатомов, предпочтительно из группы N, O и S; предпочтительно он является 5- или 6-членным и содержит 1, 2 или 3 гетероатома в кольце. Остаток может быть, например, гетероароматическим остатком или кольцом с вышеуказанным значением или частично гидрированным остатком, таким как оксиранил, пирролидил, пиперидил, пиперазинил, диоксоланил, морфолинил, тетрагидрофурил. В качестве заместителей в замещенном гетероциклическом остатке могут рассматриваться приводимые ниже заместители и дополнительно также оксогруппы. Оксогруппа может встречаться также у гетероатомов в кольце, способных существовать в различной степени окисления, например, у N и S.
Замещенные остатки, такие как углеводородные остатки, например замещенные алкил, алкенил, алкинил, арил, фенил и бензил, или замещенный гетероарил, замещенный бициклический остаток или кольцо или замещенный бициклически остаток, в случае необходимости содержащий ароматические компоненты, означают, например, производный от незамещенной исходной основы замещенный остаток, причем заместители означают, например, один или несколько, предпочтительно 1, 2 или 3 остатка из группы галоген, алкокси, галоалкокси, алкилтио, гидрокси, амино, нитро, циано, азидо, алкоксикарбонил, алкилкарбонил, формил, карбамоил, моно- и диалкиламинокарбонил, замещенный амино, такой как ациламино, моно- и диалкиламино, и алкилсульфинил, галоалкилсульфинил, алкилсульфонил, галоалкилсульфонил и в случае циклических остатков также алкил и галоалкил, а также соответствующие названным насыщенным углеводородсодержащим остаткам ненасыщенные алифатические остатки, такие как алкенил, алкинил, алкенилокси, алкинилокси и т.д. Из остатков с C-атомами предпочтительными являются таковые с 1 - 4 C-атомами, в частности с 1 или 2 C-атомами. Предпочтительны, как правило, заместители из группы галоген, например, фтор и хлор, C1-C4-алкил, преимущественно метил или этил, C1-C4-галоалкил, преимущественно трифторметил, C1-C4-алкокси, преимущественно метокси или этокси, C1-C4-галоалкокси, нитро и циано. Особенно предпочтительны при этом заместители метил, метокси и хлор.
В случае необходимости замещенный фенил является предпочтительно фенилом, который не замещен или замещен однократно или многократно, предпочтительно до трехкратного, одинаковыми или различными остатками из группы галоген, C1-C4-алкил, C1-C4-алкокси, C1-C4-галогеналкил, C1-C4-галогеналкокси и нитро, например о-, м- и п-толил, диметилфенилы, 2-, 3- и 4-хлорфенил, 2-, 3-и 4-трифтор- и трихлорфенил, 2,4-, 3,5-, 2,5 и 2,3-дихлорфенил, о-, м- и п-метоксифенил.
Ацильный остаток означает остаток органической кислоты, например остаток карбоновой кислоты, и остатки производных от нее кислот, таких как тиокарбоновая кислота, в случае необходимости N-замещенные иминокарбоновые кислоты, или остаток моноэфиров карбоновых кислот, в случае необходимости замещенной карбаминовой кислоты, сульфоновых кислот, сульфиновых кислот, фосфоновых кислот, фосфиновых кислот. Ацил означает, например, формил, алкилкарбонил, такой как (C1-C4-алкил)-карбонил, фенилкарбонил, причем фенильное кольцо может быть замещено, например, так, как было показано выше для фенила, или алкилоксикарбонил, фенилоксикарбонил, бензилоксикарбонил, алкилсульфонил, алкилсульфинил, N-алкил-1-иминоалкил и другие остатки органических кислот.
Особый интерес представляют предлагаемые согласно изобретению способы получения соединений формулы (I) или их солей, в которой (R)n означает n одинаковых или различных остатков из группы галоген, C1-C4-алкил и C1-C4-алкокси,
n означает 0 или 1, в частности 0,
A означает H или ацил с 1 - 8 C-атомами, в частности с 1 - 4 C-атомами,
R1 означает H, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C1-C6-алкокси, C2-C6-алкенокси, C2-C6-алкинокси или C5-C6-циклоалкил, причем каждый из 7 названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, C1-C4-алкокси, C1-C5-галоалкокси, C1-C4-алкилтио, моно- и ди-(C1-C4-алкил)амино, циано, азидо, формил, (C1-C4-алкил)-карбонил, (C1-C4-алкокси)-карбонил, C1-C4-алкилсульфинил и C1-C4-алкилсульфонил, или фенил, незамещенный или замещенный остатками из группы галоген, C1-C4-алкил, C1-C4-алкокси, C1-C4-галогеналкил, C1-C4-галогеналкокси и нитро.
R2 обозначает H, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, причем каждый из трех названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, C1-C4-алкокси, C1-C4-галоалкокси, C1-C4-алкилтио-, моно- и ди-(C1-C4-алкил)-амино, циано, азидо, формил, (C1-C4-алкил)-карбонил, (C1-C4-алкокси)-карбонил, C1-C4-алкилсульфинил и C1-C4-алкилсульфонил,
или группа
NR1R2 означает гетероциклическое кольцо из 4, 5 или 6 атомов в кольце, которое может содержать в кольце еще до двух гетероатомов из группы N и O и которое не замещено или замещено одним или несколькими остатками из группы C1-C4-алкил,
R3 означает H или СH3,
один из остатков X и Y
означает галоген, C1-C2-алкил, C1-C2-алкокси, C1-C2-алкилтио, причем каждый из трех названных последних остатков не замещен или замещен одним или несколькими остатками из группы галоген, C1-C2-алкокси и C1-C2-алкилтио, или моно-, или ди(C1-C2-алкил)-амино, предпочтительно галоген, метил или метокси, и
другой из остатков X и Y
означает C1-C2-алкил, C1-C2-галоалкил, C1-C2-алкокси, C1-C2-галоалкокси или C1-C2-алкилтио, предпочтительно метил или метокси,
Z обозначает CH или N, предпочтительно CH.
Предпочтительны также предлагаемые согласно изобретению способы получения соединений или их солей формулы (I), в которой означают:
A - водород, формил, (C1-C4-алкил)-карбонил, который не замещен или замещен одним или несколькими остатками из группы галоген и (C1-C4)-алкокси,
или (C1-C4-алкокси)-карбонил, феноксикарбонил, фенилкарбонил, фенил-(C1-C4-алкил)-карбонил или фенил-(C1-C4-алкокси)-карбонил, причем фенил в каждом из 4 названных последними остатков не замещен или замещен, предпочтительно A означает формил, ацетил, пропионил, метоксикарбонил, этоксикарбонил, бензоил или бензилокси-карбонил, в частности формил, (C1-C4-алкил)карбонил или (C1-C4-алкокси)-карбонил. Предпочтительными являются предлагаемые изобретением способы получения соединений формулы (I) и их солей, в которой
R1 - H, C1-C2-алкил, C1-C2-алкокси, фенил, незамещенный или замещенный одним или несколькими остатками из группы галоген, C1-C2-алкил, C1-C2-алкокси, C1-C2-галогеналкил, C1-C2-галогеналкокси, в частности метил или этил,
R2 - H или C1-C2-алкил, в частности метил или этил, или группа
NR1R2 - гетероциклическое кольцо из 5 или 6 атомов в кольце, которое может содержать в кольце еще до одного другого гетероатома из группы N и O и которое не замещено или замещено одним или несколькими C1-C2-алкильными остатками, в частности пирролидинил или пиперидинил,
R3 - H или CH3, в частности H.
Из способов согласно изобретению предпочтительны такие, при которых в соединениях формулы (I) группа формулы NH2 в фенильном остатке находится в пара-положении к группе CO-NR1R2 и в мета-положении к группе SO2.
Предметом изобретения являются также изобретательские отдельные стадии всего способа в целом и их новые промежуточные продукты, в частности 1-я стадия и стадии 2а и 2б, поскольку это касается реакции взаимодействия с солями карбамата (VI), в которых M означает катион.
Превращение соединений (II) в соединения (III) может быть осуществлено с помощью обычных галогенирующих агентов, применяемых для получения хлорангидридов карбоновых кислот, например, с помощью тионилхлорида или тионилбромида. С этой целью проводят реакцию нитро-орто-сульфамоил-бензойной кислоты (II) с избытком галогенирующего агента в апротонном растворителе и нагревают затем до температуры, при которой начинается реакция перегруппировки. В качестве органических растворителей пригодны апротонные органические растворители, которые инертны по отношению к реагентам (так называемые "инертные растворители") и точка кипения которых лежит выше температуры, необходимой для реакции перегруппировки. Для получения целевых продуктов можно проводить взаимодействие этих реагентов, например, в гомогенном растворе или в гетерогенной смеси (например, в суспензии). Например, реакция может проводиться в случае необходимости в галогенированных ароматических углеводородах, таких как толуол, ксилол, хлорбензол или хлортолуол. Температуры реакции галогенирования лежат в пределах приблизительно от 50 до 100oC и температуры реакции перегруппировки в пределах от свыше 100oC до точки кипения апротонного растворителя, например, в пределах от 110 до 160oC; иногда перегруппировка происходит в достаточной мере уже при более низких температурах, например при 70oC. Тионилхлорид может применяться, например, в эквимолярном количестве или в избытке в пересчете на моль бензойной кислоты. Вместо производных бензойной кислоты можно использовать также соответствующие соли, такие как соли щелочных или щелочно-земельных металлов (например, соли Na, K, Li, Mg и Ca) для реакции с галогенирующим агентом, например тионилхлоридом, для получения соответствующих производных (III) 2-хлорсульфонилбензамида.
Уже известен способ проведения взаимодействия 2-(N,N-диалкиламиносульфонил)-бензойных кислот, незамещенных или несущих простые алкильные группы на фенильном кольце, с 4 - 8-кратным избытком тионилхлорида или тионилбромида в бензоле, дихлорметане или хлороформе с получение N,N-диалкиламидов 2-(хлорсульфонил)-, соответственно 2-(бромсульфонил)-бензойной кислоты при комнатной температуре (25oC); см. K. Hovius et al., Tetrahedron Lett. 1983, 3137-3140. Соответствующая реакция взаимодействия N,N-диалкил-о-сульфамоил-нитробензойных кислот (II) до сих пор не была известна и при этих условиях ее не удавалось до сих пор провести. Только путем модификации известных условий относительно температуры и растворителей эту реакцию удается провести также с испытанными нитробензойными кислотами (II).
Необходимые соединения формулы (II) могут быть получены альтернативными способами. Так, окисление метильной группы соединений формулы (IX)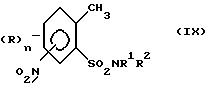
приводит к образованию соединения формулы (II). Окисление может проводиться, например, аналогично известным методам получения бензойных кислот из толуола. Производное толуола формулы (IX) может быть получено путем взаимодействия сульфохлорида формулы (X) с амином формулы NR1R2,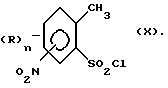
Еще один доступ к соединению (II) предоставляет аммонолиз сульфохлорида формулы (XI),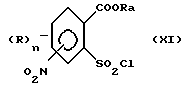
в которой Ra означает алкильный остаток, например метил или этил, с амином формулы HNR1R2 с получением сульфонамида и последующее омыление полученного соединения по сложноэфирной группе карбоновой кислоты. Отдельные реакции взаимодействия могут быть проведены аналогично известным способам подобного типа. Например, сложноэфирные функции могут быть омылены с помощью гидроксидов щелочных или щелочно-земельных металлов, таких как LiOH, NaOH, KOH, Mg(OH)2, Ca(OH)2 в различных полярных растворителях, таких как метанол, этанол, изопропанол, хлорбензол, хлортолуол, тетрагидрофуран, 1,2-диметоксиэтан ((DME), диглим, диметилформамид (DMF), N,N-диметилацетамид (DMA), N-метил-пирролидон (NMP) или вода, или в смесях растворителей, составленных из подходящих растворителей, при температурах, например, в пределах от -20oC до 150oC, преимущественно от -10oC до 100oC.
Сульфонамиды формулы (IV) могут быть получены с высокими выходами путем взаимодействия сульфохлоридов (III) с аммиаком (аммонолиз). Реакция проводится, в основном, при температурах от -20oC до 150oC, большей частью при температурах от -10oC до 100oC. Подходящими растворителями являются в условиях реакции, например, следующие инертные органические растворители:
- диполярно апротонные растворители, такие как диметилформамид, диметилацетамид, метилпирролидон, ацетонитрил,
- простые эфиры, такие как трет-бутилметиловый эфир, диметоксиэтан, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир,
- сложные эфиры, такие как этилацетат, бутилацетат,
- хлорированные или незамещенные углеводороды, такие как толуол, о-хлортолуол, хлорбензол,
- спирты, такие как метанол, этанол, изопропанол,
- вода или
- смеси из инертных растворителей.
Особенно предпочтительными растворителями являются нитрилы, такие как ацетонитрил, эфиры, такие как диэтиловый эфир, трет-бутилметиловый эфир, тетрагидрофуран (THF), диметоксиэтан (DME) или сложные эфиры, такие как этил- и бутилацетат, или хлорированные, или незамещенные углеводороды, такие как толуол, хлорбензол или хлортолуол.
Восстановление нитрогруппы в соединениях формулы (IV) может быть осуществлено, например, путем каталитического гидрирования (стадия 2, раздел а). Для гидрирования пригодно большое число имеющихся в продаже катализаторов, например платина, палладий или никель Ренея, которые применяются аналогично их применению в стандартных способах. Пригодными в условиях реакции инертными органическими или неорганическими растворителями являются, например, следующие:
- диполярно апротонные растворители, такие как диметилацетамид (DMA), диметилформамид (DMF), метилпирролидон (NMP) или CH3CN;
- сложные эфиры, такие как этилацетат или бутилацетат,
- эфиры, такие как диметоксиэтан (DME), диглим, тетраглим, тетрагидрофуран (THF) или диэтиловый эфир;
- спирты, такие как метанол или этанол,
- органические кислоты, такие как уксусная или пропионовая кислота;
- вода или
- смеси из подходящих инертных растворителей.
Температура реакции может варьировать, например, в пределах от -20oC до 150oC, преимущественно от -10oC до 100oC. Давление водорода также может варьировать в широких пределах и составлять, например, от 1 бар до 299 бар, предпочтительно от 1 бар до 100 бар, в частности от 1 бар до 50 бар.
Реакцию взаимодействия соединений формулы (V) с карбаматами формулы (VI) необходимо проводить предпочтительно максимально селективно по сульфонамидной группе, а не по альтернативным аминогруппам в фенильном остатке. Если реакция соединения (V) проводится с карбаматами формулы (IV) стандартным способом, например, в ацетонитриле в присутствии стерически затрудненного основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), то реакционные способности сульфонамидной и аминной функций аналогичны друг другу, т.е. хемоселективность реакции полностью неудовлетворительна. Так, например, реакция взаимодействия 5-амино-2-диметиламинокарбонилбензолсульфонамида с 4,6-диметокси-2-феноксикарбониламинопиримидином в присутствии DBU приводит к образованию двух продуктов в соотношении 2:1, а именно 5-амино-2-диметил-аминокарбонил-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-бензолсульфонамида и 5-([4,6-диметоксипиримидин-2-ил)-аминокарбониламино]-2-диметиламинокарбонил-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]- бензолсульфонамида (побочный продукт) (см. пример сравнения). Однако реакция взаимодействия может быть неожиданно селективной в случае взаимодействия с карбаматными солями. Согласно изобретению лучшая селективность в сравнении с селективностью, получаемой при реакции с карбаматами формулы (XI), в которой M обозначает водород, достигается, если применяют карбаматные соли (VI), где M = катион, например натриевые или калиевые соли карбаматов. С этой целью сначала, например, карбамат (VI) (M = H) подвергают взаимодействию с подходящими основаниями, например гидроксидами щелочных или щелочно-замельных металлов, такими как LiOH, NaOH, KOH, Mg(OH)2, Ca(OH)2, гидроксидами тетралкиламмония, такими как гидроксиды тетраметиламмония, гидридами щелочных или щелочноземельных металлов, такими как NaH, KH, CaH2, алкоголятами щелочных или щелочно-земельных металлов, такими как NaOCH3, NaOC2H5, изопропилат натрия, трет-бутилат натрия, KOCH3, KOC2H5, изопропилат калия, трет-бутилат калия, или смесями оснований в подходящих растворителях с получением соли формулы (VI) (M = катион).
В качестве растворителей пригодны инертные органические растворители, предпочтительно апротонные неполярные или апротонные полярные растворители, такие как эфиры (например, тетрагидрофуран, диметоксиэтан, диэтиловый эфир, диизопропиловый эфир, диоксан, трет-бутилметиловый эфир), амиды (например, диметилформамид, диметилацетамид, метилпирролидон), в случае необходимости галогенированные ароматические углеводороды, такие как толуол, хлортолуол или хлорбензол. Для солей щелочных или щелочно-земельных металлов подходящими растворителями являются также спирты, например метанол, этанол, изопропанол или смеси растворителей. Для гидроксидов щелочных, щелочно-земельных металлов и тетраалкиламмония подходящим растворителем или компонентом растворителя является также вода. Особенно предпочтительны эфиры, такие как тетрагидрофуран, диметоксиэтан или диоксан.
Получаемые таким образом соли формулы (VI) (M = катион) получают выгодно в растворе и используют в дальнейших реакциях без предварительного выделения. С этой целью, например, соли в растворе подвергают взаимодействию с сульфонамидами формулы (V) при температурах от -40oC до 150oC, предпочтительно от -40oC до 80oC, в частности от -20oC до 80oC. После подкисления реакционного раствора кислотами, например органическими кислотами, такими как муравьиная или уксусная кислота, или минеральными кислотами, такими как соляная или серная кислота, сульфонилмо.чевины формулы (I) (A=H) (= соединения (1')) выделяют стандартными методами. Оптимальный выход достигается, как правило, при молярном отношении сульфонамидов (V) к карбаматной соли (VI) в пределах от 1:0,7 до 1:1,5.
Предпочтительными вариантами являются реакции карбаматов формулы (VI) (M = H) с гидроксидами и алкоголятами щелочных металлов, такими как KOH, NaOH3, KOCH3, трет-бутилат натрия или калия, изопропилат натрия или калия, в частности со стерически требовательными алкоголятами щелочных металлов, в диполярных апротонных растворителях, таких как тетрагидрофуран (THF), диоксан, диметилформамид (DMF), диметилацетамид (DMA), в частности в тетрагидрофуране (THF), диметоксиэтане (DME) или диоксане.
Альтернативный подход к сульфонилмочевине (1') (= формула (I), в которой A = H) обеспечивается названным вариантом 2б. Согласно этому варианту из соединений (III) сначала, как на 1-м этапе стадии 2а, путем аммонолиза получают нитробензолсульфонамиды формулы (IV), которые затем подвергают взаимодействию с карбаматами формулы (VI) аналогично стандартным условиям в присутствии оснований, например органических азотных оснований, таких как DBU или триэтиламин, гидроксидов щелочных или щелочно-земельных металлов, таких как LiOH, NaOH, KOH, Mg(OH)2, Ca(OH)2, алкоголятов щелочных или щелочно-земельных металлов, таких как NaOH3, KOCH3, изопропилат натрия или калия, третбутилат натрия или калия, с получением нитросульфонилмочевины формулы (VII). Соотношения реагентов предпочтительно следующие: 0,7-1,5 эквивалента карбамата (VI) и 0,7-2,2 эквивалента основания соответственно в пересчете на 1 эквивалент сульфонамида (IV).
Реакции взаимодействия соединений (IV) с получением соединений (VII) проводят при температурах, например, от -20oC до 100oC, предпочтительно от -10oC до около 70oC, в инертных органических растворителях, например в апротонных растворителях, таких как эфиры (например, тетрагидрофуран, диметоксиэтан, диоксан, диэтиловый эфир), ацетонитрил, диметилформамид, диметилацетамид, метилпирролидон, спирты, сложные эфиры, такие как этилацетат или бутилацетат, хлорированные алифатические или ароматические углеводороды, такие как дихлорметан, трихлорэтан, хлорбензол или о-хлортолуол, или в протонных растворителях, таких как метанол, этанол, изопропанол или вода, или в соответствующих смесях растворителей.
Нитросульфонилмочевины формулы (VII) могут быть выделены аналогично вышеописанному взаимодействию карбаматных солей формулы (VI) (M = катион) с сульфонамидами формулы (V) до сульфонилмочевин (I') (=формула (I), в которой A = H), путем реакции сульфонамидов формулы (IV) (M = катион) с карбаматными солями (M = катион) (VI).
Затем нитросульфонилмочевины (VII) каталитически гидрируют с получением аминосульфонилмочевин (I') формулы (I), в которой A = H. Гидрирование может проводиться аналогично вышеописанному гидрированию соединений формулы (IV) стандартными способами. При применении водной среды в качестве растворителя особенно пригодны основные растворы или буферированные водные растворы с pH от 5 до 13, предпочтительно от 7 до 11. Альтернативно вместо нейтральных нитросульфонилмочевин (VII) для гидрирования могут быть использованы их соли. Подходящими катионами для анионов сульфонилмочевин формулы (VII) являются, например, катионы щелочных или щелочно-земельных металлов, такие как Li+, Na+, K+, Cs+, Mg2+ Ca2+, или катионы аммония, такие как NH4+, HN(CH3)3 +, N(CH3)4 +, N(C2H5)4 +, HN(C2H5)3 +, (DBU-H)+, или смеси этих катионов.
Метод взаимодействия сульфохлорида (III) с цианатами, например с цианатом натрия или цианатом калия, и гетероциклическими аминами (VIII) с получением соединений (VII) (вариант 2в), в принципе, описан в вышеприведенной литературе, см. , например, германскую патентную заявку P 4415049.0 (WO 95/29899). Последующее восстановление нитрогруппы может, как в случае соединения (IV), проводиться обычными методами, предпочтительно, например, каталитически, как уже описано выше для соединений (VII).
На 3-й стадии способа полученные на 2-й стадии соединения (I') формулы (I), в которой A = H, могут быть ацилированы с получение гербицидно активных веществ (I'') формулы (I), в которой A обозначает ацильный остаток. Ацилирование удается провести по аминогруппе, присоединенной к фенильному кольцу, неожиданным образом очень селективно с помощью обычных агентов ацилирования. Ацилирование проводят, например, в апротонном органическом растворителе. Ацилирование можно проводить с помощью обычных агентов ацилирования. Примеры ацилирующих агентов включают ангидриды, галогенангидриды карбоновых кислот, активированные сложные эфиры (=активные сложные эфиры), такие как эфиры угольной кислоты и хлоругольной кислоты, хлорангидриды сульфоновой кислоты и т. п. Например, для формирования аминной функции сульфонилмочевин (I') формулы (I), в которой A = H) в распоряжении имеется ряд очень хороших стандартных способов. Так, аминная функция может быть переведена смешанными ангидридами формулы (XII)
H-COO-CO-R, (XII) R = алкил
или муравьиной кислотой в формиламинную группу.
Смешанные ангидриды могут быть получены известными из литературы способами из муравьиной кислоты и ангидридов карбоновых кислот, например ацетангидрида, или солей муравьиной кислоты, например формиата натрия, и хлорангидридов карбоновых кислот, таких как ацетилхлорид или пивалоилхлорид.
Отдельные промежуточные продукты способа согласно изобретению являются новыми и они также составляют предмет изобретения.
Для достижения оптимальных выходов в единицу времени с единицы объема отдельные стадии реакции всего описанного способа в целом могут проводиться в гомогенном, также и в перенасыщенном, т.е. кинетически стабильном растворе или в гетерогенных суспензиях. При этом достигаются, в общем, очень хорошие выхода и чистота продукта. Комбинируя надлежащим образом отдельные стадии, можно получать такие общие выхода по сульфонилмочевинам формулы (I), предпочтительно по таким, в которых ациламинная функция находится в пара-положении относительно карбонамидной группе, которые превосходят описанные в литературе (DE 4415049, WO 95/29899) выхода.
Подбирая надлежащим образом условия реакции, можно объединить несколько стадий в реакции, проводимых в одном реакторе, соответственно проводимых в каскаде. Благодаря этому также может быть повышен, отчасти значительно, выход в единицу времени с единицы объема.
Предпочтительным является получение соединений формулы (I), в которой n = 0 и R3 обозначает H и аминогруппа у фенильного кольца находится в пара-положении к карбонамидной группе и в мета-положении к SO2-функции (=соединения (1a)).
Особенно предпочтительным являются способ согласно изобретению и его отдельные стадии, отличающиеся тем, что соединение формулы (IIa)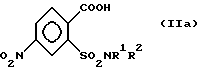
где R1 и R2 определены как в формуле (I), подвергают реакции взаимодействия в присутствии галогенирующего средства с образованием галогенангидрида кислоты и перегруппировкой в соединение формулы (IIIa),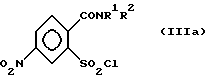
затем переводят соединение (IIIa) аммиаком в амид формулы (IVa),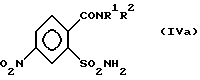
после чего восстанавливают соединение (IVa) по нитрогруппе с получением соединения (Va)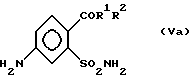
и подвергают соединение (Va) взаимодействию с карбаматной солью формулы (VIa)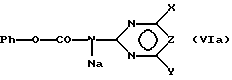
с получением соединения (Ia).
В нижеследующих примерах получения количества и проценты относятся к весу, поскольку не указано иное. Сокращение "Fp" означает точку плавления ("т.пл.").
Примеры получения
Пример 1
Хлорид 2-диметиламинокарбонил-5-нитробензолсульфокислоты
К суспензии из 195,2 г диметиламида 2-карбокси-5-нитробензолсульфоновой кислоты в 800 мл хлорбензола прибавляют 40 мл тионилхлорида. Затем смесь при энергичном перемешивании медленно нагревают до 70-75oC. После добавления еще 120 мл тионилхлорида реакционную смесь нагревают до кипения. По окончании реакции реакционную смесь концентрируют при пониженном давлении. Получают таким образом 209 г указанного в заголовке продукта, который имеет достаточную чистоту для применения в дальнейших реакциях, т.пл. 129-131oC.
Пример 2
2-Диметиламинокарбонил-5-нитробензолсульфонамид
В смесь из 77,8 г хлорангидрида 2-диметиламинокарбонил-5-нитробензолсульфокислоты и 780 мл тетрагидрофурана при 5oC при перемешивании по каплям добавляют 37 мл концентрированного раствора аммиака (33%). Смесь продолжают перемешивать до окончания реакции.
Реакционную смесь концентрируют при пониженном давлении и остаток размешивают в небольшом количестве воды. После сушки получают 66,9 г указанного в заголовке продукта, т. пл. 159-160oC.
Пример 3
5-Амино-2-диметиламинокарбонилбезолсульфонамид
Раствор 12,5 г 2-диметиламинокарбонил-5-нитробензолсульфонамида в 250 мл метанола смешивают с 1 г влажного никеля Ренея и энергично перемешивают при 60oC и давлении водорода 50 бар. По окончании поглощения водорода катализатор отделяют и фильтрат концентрируют. Получают таким образом 11,0 г указанного в заголовке продукта.
Пример 4
5-Амино-2-диметиламинокарбонил-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-бензолсульфонамид
Метод А:
128,4 г 4,6-диметокси-2-(феноксикарбониламино)пиримидина помещают при 0oC в 1250 мл тетрагидрофурана (THF). После добавления 44,8 г трет-бутилата натрия этот раствор при 0-2oC по каплям добавляют к смеси из 108,1 г 5-амино-2-диметиламинокарбонилбензолсульфонамида в 1250 мл тетрагидрофурана. По окончании реакции реакционную смесь концентрируют. Остаток распределяют между 1500 мл воды и 780 мл петролейного эфира и осторожно подкисляют концентрированной соляной кислотой (100 мл). Выпавшее в осадок твердое вещество промывают петролейным эфиром и этиловым эфиром уксусной кислоты. После сушки получают 186,9 г указанного в заголовке продукта. т. пл. 192-193oC.
Метод Б:
а) К суспензии из 3,78 г цианата натрия, 4,7 мл пиридина и 100 мл ацетонитрила последовательно прибавляют 5,3 г 2-амино-4,6-диметоксипиримидина и 10 г хлорангидрида 2-диметиламинокарбонил-5-нитробензол сульфокислоты. Смесь перемешивают при комнатной температуре до полного превращения и затем вносят в разбавленную охлажденную соляную кислоту. Выпавший в осадок сырой продукт очищают посредством хроматографии на колонке (CH2Cl2/CH3OH = 95/5). Получают таким образом 3,1 г указанного в заголовке продукта; т. пл.: 182-186oC с разложением.
б) 1,4 г 2-диметиламинокарбонил-5-нитро-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -бензолсульфонамида суспендируют в 25 мл воды и смешивают с 5,5 мл 1 н. раствора едкого натра. После добавления 0,1 г палладия на угле (10%-ный, 50% воды) смесь энергично перемешивают при комнатной температуре в атмосфере водорода (1 бар). По окончании реакции катализатор отделяют фильтрацией и промывают небольшим количеством воды. После подкисления водной фазы концентрированной соляной кислотой получают 1,1 г указанного в заголовке продукта; т. пл.: 192-193oC с разложением.
Пример 5
N,N-диметил-2-метоксикарбонил-5-нитробензолсульфонамид
К смеси из 202,8 г 2-метоксикарбонил-5-нитробензолсульфохлорида и 65,1 г диметиламиногидрохлорида в 1000 мл ацетонитрила прибавляют при 5oC при энергичном перемешивании 250,6 г карбоната калия. По окончании реакции твердое вещество отфильтровывают и промывают этилацетатом. Объединенные органические фазы затем концентрируют при пониженном давлении. Таким образом получают 206,7 г указанного в заголовке продукта; т. пл. 93-96oC.
Пример 6
N,N-диметил-2-карбокси-5-нитробензолсульфонамид
К раствору из 206,7 г диметиламида 2-метоксикарбонил-5-нитробензолсульфоновой кислоты в 1500 мл метанола добавляют 60,2 г гидроксида лития-моногидрата. Смесь затем перемешивают до полного превращения при 50oC. После концентрирования реакционной смеси при пониженном давлении остаток растворяют в воде и смешивают с концентрированной соляной кислотой (pH 1) при 0oC. После отсасывания и сушки получают указанную в заголовке кислоту. Выход: 162,9 г; т. пл. 160-163oC.
Пример 7
2-Диметиламинокарбонил-5-нитро-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-бензолсульфонамид
1-й метод:
31,7 г 4,6-диметокси-2-(феноксикарбониламино)-пиримидина помещают при 0oC в 400 мл тетрагидрофурана. После добавления 11,08 г трет-бутилата натрия этот раствор по каплям добавляют к смеси из 30,0 г 2-диметиламинокарбонил-5-нитробензолсульфонамида в 400 мл тетрагидрофурана при 0oC. После окончания реакции реакционную смесь концентрируют, распределяют между 500 мл воды и 250 мл петролейного эфира и подкисляют концентрированной соляной кислотой. Выпавшее в осадок твердое вещество промывают петролейным эфиром и этиловым эфиром уксусной кислоты. После сушки получают 43,4 г указанного в заголовке продукта; т. пл.: 182-186oC с разложением.
2-метод:
К суспензии из 5,0 г 2-диметиламинокарбонил-5-нитробензолсульфонамид в 20 мл воды при комнатной температуре и энергичном перемешивании добавляют по каплям 18,6 мл 1 н. раствора едкого натра. Затем добавляют 5,04 г 4,6-диметокси-2-феноксикарбониламина-пиримидина. Реакционную смесь нагревают приблизительно до температуры 50-60oC и перемешивают при этой температуре до полного превращения. Водную фазу промывают диизопропиловым эфиром. Водную фазу подкисляют концентрированной соляной кислотой (pH от 2 до 3). Выпавшее в осадок твердое вещество отделяют, промывают водой и сушат. Получают таким образом 7,6 г указанного в заголовке продукта, который имеет достаточную чистоту для применения в дальнейших реакциях.
Пример 8
N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -2-диметиламинокарбонил-5-ацетиламинобензолсульфонамид
К смеси из 0,64 г N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-5-амино-2- диметиламинокарбонилбензолсульфонамида и 10 мл диметилацетамида медленно прибавляют по каплям 0,13 мл ацетилхлорида. После окончания реакции реакционную смесь концентрируют при пониженном давлении и остаток промывают водой и этиловым эфиром уксусной кислоты. Получают таким образом 0,45 г указанного в заголовке продукта высокой чистоты (> 92%, ЖХВД).
Пример 9
N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -5-формиламино-2-диметиламинокарбонилбезолсульфонамид
К смешанному ангидриду, полученному стандартным методом из 0,5 мл муравьиной кислоты и 1,0 мл ангидрида уксусной кислоты, по каплям добавляют 1,9 г N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-5- амино-2-диметиламинокарбонилбезолсульфонамида и 10 мл дихлорметана. После окончания реакции реакционную смесь концентрируют и остаток промывают водой и этилацетатом. Получают таким образом 1,8 г указанного в заголовке продукта высокой чистоты (>92%, ЖХВД).
Пример 10
N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -2-диметиламинокарбонил-5-пропиониламинобензолсульфонамид
К раствору из 0,64 г 5-амино N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил] -2-диметиламинокарбонил-бензолсульфонамида в 10 мл диметилацетамида медленно по каплям добавляют 0,13 мл пропионилхлорида. После окончания реакции реакционную смесь концентрируют при пониженном давлении и остаток промывают водой и этиловым эфиром уксусной кислоты. Получают таким образом 0,45 г указанного в заголовке продукта высокой чистоты (>92%, ЖХВД).
Пример 11 (сравнительный пример)
5-Амино-2-диметиламинокарбонил-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-бензолсульфонамид
К суспензии из 1,0 г 5-амино-2-диметиламинокарбонил-бензолсульфонамида и 1,1 г 4,6 диметокси-2-(феноксикарбониламино) пиримидина в 10 мл ацетонитрила прибавляют при 0oC и при перемешивании 0,6 мл 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU). Смесь перемешивают до полного превращения. После отгонки летучих компонентов остаток растворяют в небольшом количестве воды и промывают диэтиловым эфиром. Водную фазу затем подкисляют концентрированной соляной кислотой (pH от 2 до 3). Выделенное твердое вещество промывают диизопропиловым эфиром и затем сушат. Получают таким образом 1,4 г твердого вещества, которое содержит оба соединения, а именно 5-амино-2-диметиламинокарбонил-N-[(4,6-диметоксипиримидин-2- ил)-аминокарбонил]-бензолсульфонамид и 5-[(4,6-диметоксипиримидин-2-ил)аминокарбониламино] -2-диметиламинокарбонил-N-[(4,6-диметоксипиримидин-2-ил)-аминокарбонил]-бензолсульфонамид в соотношении приблизительно 2:1.
Изобретение относится к новому способу получения (его вариантам) аминофенилсульфонилмочевин формулы I, обладающих свойствами регуляторов роста растений или гербицидов, а также к промежуточным продуктам для их получения. Способ получения аминофенилсульфонилмочевин формулы I, значения радикалов в которой указаны в формуле изобретения, заключается в том, что соединение формулы II или его соль подвергают обработке галогенирующим агентом с получением соответствующего галогенида карбоновой кислоты, который перегруппировывается, с получением соединения формулы III. Далее соединение формулы III подвергают аммонолизу по группе SO2Cl2 с получением соединения формулы IV, затем в этом соединении восстанавливают группу NO2 с получением соединения формулы V, которое подвергают взаимодействию с соответствующим карбаматом или его солью формулы VI, где Ar означает незамещенный или замещенный фенил и М означает водород, С1-С4-алкил или катион металла. Либо соединение формулы III подвергают аммонолизу по группе SO2Cl2, а затем полученное соединение формулы IV подвергают взаимодействию соответствующим карбаматом или его солью формулы VI, и полученное соединение формулы VII восстанавливают. Либо соединение формулы III подвергают взаимодействию с цианатом или с гетероциклическим амином формулы VIII с получением соединения формулы VII, которое восстанавливают. Промежуточные соединения, соответствующие формулам III, IV, V, VI, VII, являются новыми. Предлагается также способ получения соединения формулы III. Предлагаемый новый способ позволяет получить соединения формулы I с высокими выходами и хорошей чистотой. 12 с. и 2 з.п. ф-лы.
где (R)n означает n одинаковых или различных остатков из группы галоген, алкил и алкокси;
n означает 0, 1, 2 или 3;
А означает водород или ацильный остаток;
R1 означает водород или незамещенный либо замещенный углеводородный или углеводородоксиостаток, содержащий 1-6 С-атомов;
R2 означает водород или незамещенный либо замещенный углеводородный остаток, содержащий в сумме 1-10 С-атомов;
или группа NR1R2 означает гетероциклическое кольцо с 3-8 атомами в кольце, которое не замещено или замещено и содержит в кольце N-атом группы NR1R2 в качестве гетероатома и может содержать в кольце еще один или два гетероатома из группы N, О и S;
R3 означает водород или С1-С4алкил;
X, Y означает независимо друг от друга галоген, C1-С6-алкил, C1-С6-алкокси, C1-С6-алкилтио, причем каждый из трех названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси и С1-С4-алкилтио, или С3-С6-циклоалкил, C2-C6-алкенил, С2-С6-алкинил, С3-С6-алкенилокси или С3-С6-алкинилокси; Z означает СН или N,
отличающийся тем, что соединение формулы (II)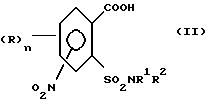
или его соли подвергают взаимодействию в присутствии галогенирующего средства с образованием галогенида карбоновой кислоты и его перегруппировкой в соединение формулы (III)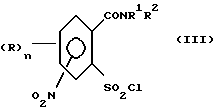
затем соединение формулы (III) аммонолизируют по SO2Cl-группе с получением соединения формулы (IV)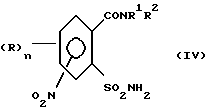
затем подвергают соединение (IV) взаимодействию с карбаматом, соответственно с карбаматной солью формулы (VI)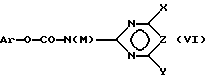
с получением соединения формулы (VII)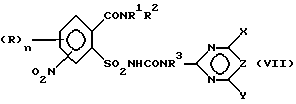
в которой R3 в соответствии с М в формуле (VI) обозначает Н или С1-С4-алкил или в случае, если М - катион металла, означает атом водорода, и восстанавливают соединение формулы (VII) по нитрогруппе с получением соединения формулы (I), в которой А означает Н, или для случая, если А в конечном желаемом продукте формулы (I) означает не водород, а ацильный остаток, ацилируют полученное на стадии 2 соединение формулы (I), в которой А означает Н, причем в формулах (II)-(VII) остатки (R)n, R1, R2, X, Y, Z имеют такое же значение, как и в конечном продукте формулы (I).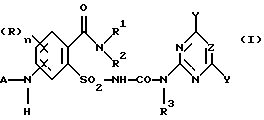
где (R)n означает n одинаковых или различных остатков из группы галоген, алкил и алкокси;
n означает 0, 1, 2 или 3;
А означает водород или ацильный остаток;
R1 означает водород или незамещенный либо замещенный углеводородный или углеводородоксиостаток, содержащий 1-6 С-атомов;
R2 означает водород или незамещенный либо замещенный углеводородный остаток, содержащий в сумме 1-10 С-атомов;
или группа NR1R2 означает гетероциклическое кольцо с 3-8 атомами в кольце, которое не замещено или замещено и содержит в кольце N-атом группы NR1R2 в качестве гетероатома и может содержать в кольце еще один или два гетероатома из группы N, О и S;
R3 означает водород или С1-С4-алкил;
X, Y означает независимо друг от друга галоген, C1-C6-алкил, C1-C6-алкокси, C1-С6-алкилтио, причем каждый из трех названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси и С1-С4-алкилтио или С3-С6-циклоалкил, С2-С6-алкенил,
С2-С6-алкинил, С3-С6-алкенилокси или С3-С6-алкинилокси;
Z означает СН или N,
отличающийся тем, что соединение формулы (II)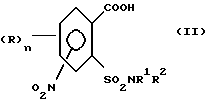
или его соли подвергают взаимодействию в присутствии галогенирующего средства с образованием галогенида карбоновой кислоты и его перегруппировкой в соединение формулы (III)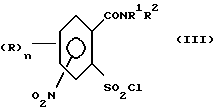
затем аммонолизируют соединение (III) пo SO2Cl-группе с получением соединения формулы (IV)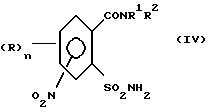
затем восстанавливают соединение (IV) по нитрогруппе с получением соединения (V)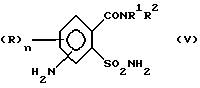
и затем подвергают соединение (V) взаимодействию с карбаматом, соответственно с карбаматной солью формулы (VI)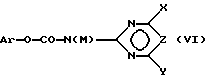
где Аr означает незамещенный или замещенный фенил и М означает Н, С1-С4-алкил или катион металла, с получением соединения формулы (I), в которой R3 в соответствии с М в формуле (VI) означает Н или С1-С4-алкил, или в случае, если М - катион металла, означает атом водорода и А означает Н, или для случая, если А в конечном желаемом продукте формулы (I) означает не водород, а ацильный остаток, ацилируют полученное на стадии 2 соединение формулы (I), в которой А означает Н, причем в формулах (II)-(VI) остатки (R)n, R1, R2, X, Y, Z имеют такое же значение, как и в конечном продукте формулы (I).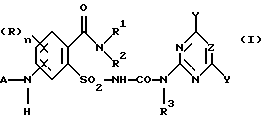
где (R)n означает n одинаковых или различных остатков из группы галоген, алкил и алкокси;
n означает 0, 1, 2 или 3;
А означает водород или ацильный остаток;
R1 означает водород или незамещенный либо замещенный углеводородный или углеводородоксиостаток, содержащий 1-6 С-атомов;
R2 означает водород или незамещенный либо замещенный углеводородный остаток, содержащий в сумме 1-10 С-атомов.;
или группа NR1R2 означает гетероциклическое кольцо с 3-8 атомами в кольце, которое не замещено или замещено и содержит в кольце N-атом группы NR1R2 в качестве гетероатома и может содержать в кольце еще один или два гетероатома из группы N, О и S;
R3 означает водород или С1-С4-алкил;
X, Y означает независимо друг от друга галоген, C1-C6-алкил, C1-С6-алкокси, С1-С6-алкилтио, причем каждый из трех названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси и С1-С4-алкилтио, или С3-С6-циклоалкил, C2-C6-алкенил, С2-С6-алкинил, С3-С6-алкенилокси или С3-С6-алкинилокси; Z означает СН или N,
отличающийся тем, что соединение формулы (II)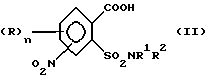
или его соли подвергают взаимодействию в присутствии галогенирующего средства с образованием галогенида карбоновой кислоты и его перегруппировкой в соединение формулы (III)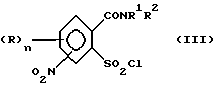
затем подвергают взаимодействию соединение формулы (III) с цианатом и с гетероциклическим амином формулы (VIII)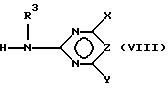
в которой R3 определен, как в формуле (I),
с получением сульфонилмочевины формулы (VII), которая после восстановления по нитрогруппе дает соединения формулы (I), в которой А означает Н, или для случая, если А в конечном желаемом продукте формулы (I) означает не водород, а ацильный остаток, ацилируют полученное на стадии 2 соединение формулы (I), в которой А означает Н, причем в формулах (II)-(VIII) остатки (R)n, R1, R2, X, Y, Z имеют такое же значение, как и в конечном продукте формулы (I).
С2-С6-алкинокси или С5-С6-циклоалкил, причем каждый из 7 последних остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси, C1-C4-галоалкокси, С1-С4-алкилтио, моно- и ди-(С1-С4-алкил)-амино, циано, азидо, формил, (С1-С4-алкил)-карбонил, (C1-С4-алкокси)-карбонил, С1-С4-алкилсульфинил и С1-С4-алкилсульфонил, или фенил, не замещенный или замещенный остатками из группы галоген, С1-С4-алкил, С1-С4-алкокси, С1-С4-галогеналкил, C1-С4-галогеналкокси и нитро; R2 означает Н, C1-С6-алкил, C2-С6-алкенил, C2-C6-алкинил, причем каждый из трех названных последними остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С4-алкокси, C1-C4-галоалкокси, C1-C4-алкилтио, моно- и ди-(C1-C4-алкил)-амино, циано, азидо, формил, (С1-С4-алкил)-карбонил, (C1-C4-алкокси)-карбонил, С1-С4-алкилсульфинил и С1-С4-алкилсульфонил; или группа NR1R2 означает гетероциклическое кольцо из 4, 5 или 6 атомов в кольце, которое может содержать в кольце еще до двух гетероатомов из группы N и О и которое не замещено или замещено одним или несколькими остатками из группы C1-C4-алкил; R3 означает Н или СН3; один из остатков Х и Y означает галоген, С1-С2-алкил, С1-С2-алкокси, C1-C2-алкилтио, причем каждый из трех последних остатков не замещен или замещен одним или несколькими остатками из группы галоген, С1-С2-алкокси и С1-С2-алкилтио, или моно- или ди-(С1-С2-алкил)-амино и другой из остатков Х и Y означает С1-С2-алкил, С1-С2-галоалкил, С1-С2-алкокси, C1-С2-галоалкокси или С1-С2-алкилтио; Z означает СН или N.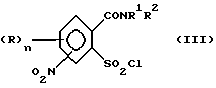
где R, n, R1 и R2 имеют значения, как в формуле (I ) согласно одному из пп.1-3,
отличающийся тем, что соединение формулы (II)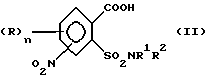
или его соли, в которой R, n, R1, и R2 имеют значения, как в формуле (III), подвергают взаимодействию в присутствии галогенирующего агента с образованием галогенангидрида карбоновой кислоты и его перегруппировкой в соединение формулы (III).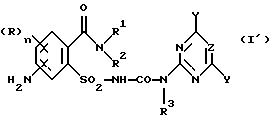
в которой R, R1, R2, X, Y, Z, n имеют значения, как в формуле (I) согласно одному из пп.1-3;
R3 обозначает Н,
отличающийся тем, что соединение формулы (V)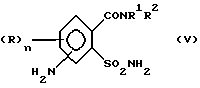
где R, R1, R2, n имеют значения, как в формуле (I),
подвергают взаимодействию с карбаматной солью формулы (VI)
где X, Y, Z, n имеют значения, как в формуле (I);
Аr обозначает незамещенный или замещенный фенил;
М обозначает катион металла,
с образованием соединения формулы (I').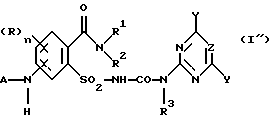
где R, n, R1, R2, R3, A3, X, Y, Z имеют значения, как в формуле (I) согласно одному из пп.1-3;
А означает ацильный остаток,
отличающийся тем, что ацилируют соединение формулы (I''), в которой А означает Н.
| US 4892946 А, 09.06.1990 | |||
| US 4394506 А, 19.07.1983 | |||
| DE 4236209 А, 05.05.1994 | |||
| Способ борьбы с нежелательной растительностью | 1986 |
|
SU1701103A3 |
Авторы
Даты
2001-12-20—Публикация
1996-10-21—Подача