Изобретение касается соли переходного металла с полипептидом, который проявляет сильное сродство к липополисахаридам, в частности к эндотоксинам, и кроме того, изобретение касается способа повышения антивирусной активности (например, активности против ВИЧ) полипептида, посредством которого указанная антивирусная активность проявляется стабильно и сильно, путем преобразования указанного полипептида в соль переходного металла, а также касается фармацевтической композиции или лекарственной композиции для ингибирования ВИЧ-активности, которая включает в себя в качестве активного ингредиента указанную соль переходного металла с полипептидом (которая здесь иногда называется солью полипептида и переходного металла).
Как показано в упоминаемых ниже публикациях, из мечехвостов выделили два семейства антимикробных полипептидов, которые проявляют сродство к эндотоксинам.
См. , например, Shigenaga et al., 1990, J.Biol. Chem., 265:21350-21354; Kawano et al., 1990, J.Biol. Chem., 265:15365-15367; Muta et al., 1990, J. Biochem., 108:261-266; выложенная заявка на патент Японии 167230/1990; выложенная заявка на патент Японии 1152987/1990; выложенная заявка на патент Японии 53799/1990; патент США номер 5068314 (опубликованная заявка с проведенным патентным поиском 500194/1990); Miyata et al., 1989, J.Biochem., 106: 663-668; Akaji et al., 1989; Chem. Pharm. Bull. 37:2661:2664; Tokunaga and Iwanaga, 1989, Taisha (Metabolism), 26:429-439); Shieh et al., 1989, FEBS Lett., 252:121-124; Nakamura et al., 1988, J. Biol. Chem., 263:16709-16713.
Одно семейство - семейство тахиплесинов - выделили из японского меченосца Tachypleus. Идентифицировали три тахиплесина I, II и III. Другое семейство - семейство полифемузинов - выделили из американского меченосца Limulus polyphemus. Идентифицировали два полифемузина I и II.
Было установлено, что оба указанные семейства тахиплесины и полифемузины ингибируют рост как грамположительных, так и грамотрицательных бактерий при низких концентрациях, а также грибков, таких как Candida albicans, и образуют комплексы с бактериальным липополисахаридом (Shigenaga et al., 1990, J. Biol. Chem., 265:21350-21354; Muta et al., 1990, J. Biochem., 108:261-266).
Было также установлено, что полипептид семейства тахиплесинов оказывает ингибирующее действие на вирусы, такие как вирус гриппа, вирус везикулярного стоматита (Murakami et al., 1991, Chemotherapy, 37, 327-334) или вирус иммунодефицита человека (ВИЧ) (Morimoto et al., 1991, Chemotherapy, 37, 206-211).
С другой стороны, с точки зрения выживания высокоразвитых человеческих существ чрезвычайно необходима разработка лекарств, которые могут оказать профилактическое или терапевтическое действие в отношении синдрома приобретенного иммунодефицита человека (СПИДа), вызываемого заражением вирусом иммунодефицита человека (ВИЧ).
Авторы настоящего изобретения в результате исследований по корреляции между структурным преобразованием полипептида, обладающего сродством к эндотоксину, и его активностью против ВИЧ открыли серию неизвестных ранее полипептидов, которые принципиально отличаются от обычной структуры полипептида меченосцев и проявляют высокую степень активности против вируса иммунодефицита человека (ВИЧ), и эти результаты были опубликованы в нижеуказанных публикациях (Nakashima et al. , 1992, Antimicrob. Agents Chemother., 36: 1249-1255; Masuda et al., 1992, Biochem. Biophys. Res. Commun., 189:845-850; Tamamura et al. , 1993, Chem. Pharm. Bull., 41:978-980; Tamamura et al., 1993. Biochem. Biophys. Acta, 1163:209-216; Masuda et al., 1992, J. Pharmacobio. Dyn. , 15: s-90; патент США 5571892 (международная публикация WO 92/04374); патент США 5449752 (выложенная заявка на патент Японии 163298/1993)).
В результате изучения требований к структуре, связанных с экспрессированием активности полипептида против ВИЧ, на основе базовой структуры полипептида, полученного из меченосцев, который состоит из 16-18 аминокислотных остатков, авторы настоящего изобретения разработали и представили в качестве изобретения неизвестную ранее концепцию, в которой фокусируется внимание на минимально необходимой структуре (Международная заявка WO 95/10534).
В соответствии с вышеупомянутым изобретением структурная концепция взятого в качестве примера соединения - полипептида, происходящего из полипептида меченосцев как стандартного материала и проявляющего антивирусную активность, может быть выражена с помощью нижеприведенной формулы [I]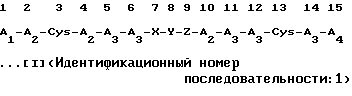
(в которой A1 независимо представляет собой остаток основной аминокислоты, выбранной из Lys (лизина), Аrg (аргинина) и Оrn (орнитина); остаток пептида, имеющий, по меньшей мере, два из указанных остатков основных аминокислот; или остаток N-α-замещенной аминокислоты или остаток N-α-замещенного пептида, в которых атом водорода в N-α-положении остатка аминокислоты, находящийся в амино-конце указанного остатка основной аминокислоты или указанного остатка пептида, может быть заменен на ацильную группу или на группу замещенного тиокарбамоила;
A2 независимо представляет собой остаток аминокислоты, выбранной из Phe (фенилаланина), Тrр (триптофана) и Туr (тирозина);
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток из двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из А1а (аланина), Val (валина), Leu (лейцина), Ilе (изолейцина), Sеr (серина), Met (метионина) и Суs (цистеина), одна из аминокислот из A2 присоединена через пептидную связь;
Y представляет собой пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Gly (глицина) и одного остатка аминокислоты, выбранной из А3, или пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Pro (пролина) и остатка одной аминокислоты, выбранной из D-Arg, D-Lys и С-Оrn;
Z представляет собой пептидный остаток из двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и A2, Cys присоединен через пептидную связь;
и остаток X-Y-Z, соединенный пептидными связями, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях через пептидные связи, или из-за конкурентной делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях через пептидные связи, где атом водорода находящейся в боковой цепи ω-аминогруппы D-Lys, L-Lys, D-Orn или L-Orn, являющийся составной частью аминокислоты из Y, может быть замещен ω-аминоацильной группой.
Уже установлено, что полипептиду, имеющему структуру вышеупомянутой формулы [I] , в дополнение к высокой активности против ВИЧ можно также придать свойство сохранять эту активность при модификации специфического сайта без снижения активности и при этом за счет такой модификации полипептид получает новые свойства, что позволяет иметь широкий выбор разнообразных физических и/или химических свойств и возможностей терапевтического использования, на основе свойств, которые имеет базовая структура, например, можно увеличивать или уменьшать гидрофильность или липофильность, селективно аккумулировать его в конкретной ткани, органе или клетке, увеличивать или уменьшать время удерживания его в организме или разрабатывать лекарственные формы со стандартными дозировками. В таблице 1 приведены примеры тех полипептидов формулы [I], которые проявляют высокую активность против ВИЧ.
Авторы настоящего изобретения сделали это изобретение на основе полученного ими факта, что образование соли между полипептидом формулы [I] и соединением переходного металла позволяет проявлять и стабильно сохранять высокую активность полипептида против ВИЧ, и на основе выяснения причины того, почему полипептид, показанный в формуле [I], специфически проявляет активность против ВИЧ.
Первой целью настоящего изобретения является создание не существовавшей ранее соли переходного металла с полипептидом, который проявляет высокую антивирусную активность и имеет специфическую структурную формулу, а вторая цель настоящего изобретения состоит в том, чтобы посредством преобразования указанного полипептида в соль переходного металла создать способ повышения физиологической активности, особенно антивирусной активности, такой как активность против ВИЧ, а также способ проявления фармацевтически стабильной активности в качестве терапевтического средства, а также создать лекарственную композицию.
Настоящее изобретение касается соединения соли переходного металла с полипептидом, показанным в формуле [I], который проявляет сильное сродство к липополисахаридам, в частности к эндотоксинам, и кроме того, настоящее изобретение касается способа повышения антивирусной активности (например, активности против ВИЧ) этого полипептида, в результате чего она проявляется стабильно и сильно, посредством преобразования указанного полипептида в соль переходного металла.
В частности, настоящее изобретение касается:
(1) соединения, являющегося солью переходного металла с полипептидом, показанного в следующей формуле: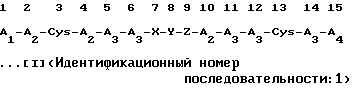
(в которой A1 независимо представляет собой остаток основной аминокислоты, выбранный из Lys, Arg и Orn; остаток пептида, имеющий, по меньшей мере, два из указанных остатков основных аминокислот; или остаток N-α-замещенной аминокислоты или остаток N-α-замещенного пептида, в которых атом водорода в N-α-положении аминокислотного остатка в амино-конце указанного остатка основной аминокислоты или указанного остатка пептида может быть заменен ацильной группой или группой замещенного тиокарбамоила;
A2 независимо представляет собой остаток аминокислоты, выбранной из Phe, Trp и Туr;
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Arg, Lys и Orn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и Cys, одна из аминокислот из А2 присоединена через пептидную связь;
Y представляет собой пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Gly и остатка одной аминокислоты, выбранной из А3, или пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Pro и остатка одной аминокислоты, выбранной из D-Arg, D-Lys и D-Orn;
Z представляет собой пептидный остаток двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и А2, Cys присоединен через пептидную связь;
и остаток X-Y-Z, соединенный пептидными связями, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, или в результате конкурентной делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, где атом водорода находящейся в боковой цепи ω-аминогруппы D-Lys, L-Lys, D-Orn или L-Orn, являющийся составной частью аминокислоты из Y, может быть замещен ω-аминоацильной группой, или кислот соли присоединения указанного соединения соли переходного металла с полипептидом и кислоты;
(2) соединения соли переходного металла с полипептидом или кислот соли присоединения указанной соли переходного металла с полипептидом по п.(1), в котором соль переходного металла представляет собой комплексную соль;
(3) соединения соли переходного металла с полипептидом или кислот соли присоединения указанной соли переходного металла с полипептидом по пп. (1) или (2), в котором переходный металл выбирают из группы, состоящей из группы железа в составе Fe, Co и Ni, группы меди в составе Сu, Аg и Аu, группы цинка в составе Zn, Cd и Нg, группы марганца в составе Мn, Тc и Re;
(4) способа повышения и экспрессирования высокой и стабильной активности против ВИЧ соединения полипептида, показанного в следующей формуле: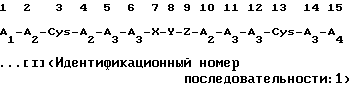
(в которой A1 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn; остаток пептида, имеющий, по меньшей мере, два из указанных остатков основных аминокислот; или остаток N-α-замещенной аминокислоты или остаток N-α-замещенного пептида, в которых атом водорода в N-α-положении аминокислотного остатка, находящийся в амино-конце указанного остатка основной аминокислоты или указанного остатка пептида, может быть заменен на ацильную группу или на группу замещенного тиокарбамоила;
А2 независимо представляет собой остаток аминокислоты, выбранной из Phe, Trp и Туr;
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Arg, Lys и Оrn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток двух аминокислотных остатков, где в следующей позиции одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и Суs, одна из аминокислот из А2 присоединена через пептидную связь;
Y представляет собой пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Gly и остатка одной аминокислоты, выбранной из А3, или пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Pro и остатка одной аминокислоты, выбранной из D-Arg, D-Lys и D-Orn;
Z представляет собой пептидный остаток двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и A2, Cys присоединен через пептидную связь;
и остаток X-Y-Z, присоединенный пептидными связями, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, или из-за одновременно действующей делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, где атом водорода находящейся в боковой цепи ω-аминогруппы D-Lys, L-Lys, D-Orn или L-Orn, являющийся составной частью аминокислоты из Y, может быть замещен ω-аминоацильной группой посредством преобразования указанного полипептида [I] в соль с переходным металлом;
(5) фармацевтической композиции или лекарственной композиции, включающей в себя эффективное количество соединения соли переходного металла с полипептидом или кислотной соли присоединения указанного соединения соли переходного металла с полипептидом согласно (1) и фармацевтический носитель;
(6) композиции по п. (5), ингибирующей вирусную активность; и
(7) композиции по п.(5), ингибирующей активность ВИЧ у пациента.
В качестве примеров ацильных групп, на которые может быть заменен атом водорода в вышеупомянутом положении N-α, приведены ацильные группы, имеющие от 2 до 18 атомов углерода, и в частности ацетильная группа, пропионильная группа, бутирильная группа, гексаноильная группа, октаноильная группа, деканоильная группа, лауроильная группа, миристоильная группа, пальмитоильная группа, стеароильная группа, никотиноильная группа и подобные им. В качестве примеров замещающих групп, которые могут быть использованы вместо групп замещенного тиокарбамоила, которые, в свою очередь, могут замещать атом водорода в вышеупомянутом положении N-α, приведены флуоресцеиновая группа, фенильная группа, группа замещенного фенила (например, диметиламинофенил-азофенильная группа) и подобные им.
В качестве примеров ω-аминоацильных групп, которые могут замещать атом водорода находящейся в боковой цепи ω-аминоацильной группы D-Lys, L-Lys, D-Orn или L-Orn, который является составной частью аминокислоты вышеупомянутого Y, приведены ω-аминоацильная группа, имеющая от 2 до 6 атомов углерода, и особенно ω-аминоацетильная группа, ω-аминобутирильная группа, ω-аминогексаноильная группа и подобные им.
В приведенной здесь последовательности полипептида каждый символ представляет собой остаток аминокислоты или остаток замещенной аминокислоты, обозначенный в соответствии с международно принятой трехбуквенной аббревиатурой, и кроме особо оговоренных случаев, этот остаток аминокислоты или остаток замещенной аминокислоты представляет собой L-форму. Например, каждый символ представляет собой нижеследующую аминокислоту или замещенную аминокислоту:
Ala, Arg, Cys, Ile, Gly, Leu, Ser, Met, Lys, Orn, Phe, Pro, Trp, Tyr, Val, DArg, DLys, Dorn, Ac-Arg (N-α-ацетиларгинин), FTC-Arg (N-α-флуоресцеин тиокарбамоил аргинин), Laur-Arg (N-α- лауроил аргинин), Myr-Arg (N-α-миристоил аргинин), Nicot-Arg (N-α-никотиноил аргинин), Oct-Arg (N-α-октаноил аргинин), Parm-Arg (N-α-пальмитоил аргинин), Parm-Orn (N-α-пальмитоил орнитин), PTC-Arg (N-α-фенилтиокарбамоил аргинин), ε-N-Ac-Dlys(ε-N-ω-аминоацетил-D-лизин)иε-N-But-Dlys аминобутирил-D-лизин).
аминобутирил-D-лизин).
Настоящее изобретение, которое было выполнено на основе вышеизложенных точек зрения, касается соли полипептида, включающей в себя соль переходного металла, выбранного из группы, состоящей из группы железа, группы меди, группы цинка и группы марганца, и полипептид, показанный в нижеследующей формуле: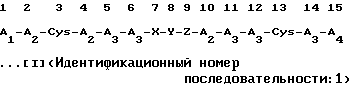
(в которой A1 независимо представляет собой остаток основной аминокислоты, выбранной из Lys (лизина), Аrg (аргинина) и Оrn (орнитина); остаток пептида, имеющий, по меньшей мере, два из указанных остатков основных аминокислот; или остаток N-α-замещенной аминокислоты или остаток N-α-замещенного пептида, в которых атом водорода в N-α-положении аминокислотного остатка, находящийся на амино-конце указанного остатка основной аминокислоты или указанного остатка пептида, может быть заменен на ацильную группу или на группу замещенного тиокарбамоила;
A2 независимо представляет собой остаток аминокислоты, выбранной из Phe, Trp и Туr;
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Аrg, Lys и Оrn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток из двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и Суs, одна из аминокислот из А2 присоединена через пептидную связь;
Y представляет собой пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Gly и остатка одной аминокислоты, выбранной из А3, или пептидный остаток двух аминокислотных остатков, который состоит из комбинации остатка Pro и остатка одной из аминокислот, выбранной из D-Arg, D-Lys и D-Orn;
Z представляет собой пептидный остаток двух аминокислотных остатков, где в следующем положении одного остатка аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и А2, Суs присоединен через пептидную связь;
и остаток X-Y-Z, присоединенный через пептидную связь, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях через пептидные связи, или в результате конкурентной делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях через пептидные связи, где атом водорода находящейся в боковой цепи ω-аминогруппы D-Lys, L-Lys, D-Orn или L-Orn, являющийся составной частью аминокислоты из Y, может быть замещен ω-аминоацильной группой), а также касается соли указанного полипептида, в которой соль переходного металла является комплексной солью, и целью настоящего изобретения является посредством преобразования указанного полипептида формулы [I], имеющего высокую активность против ВИЧ, в продукт в виде соли, создать способ повышения и стабилизации активности этого полипептида.
Ранее не существовавшее соединение соли переходного металла с полипептидом согласно изобретению ниже описывается более подробно.
ПОЛУЧЕНИЕ ПОЛИПЕПТИДОВ
Полипептид, показанный в формуле [I] настоящего изобретения, можно непосредственно получить известными способами, например с помощью метода твердофазного синтеза, описанного в "Solid Phase Peptide Synthesis", Stuart&Young, Pierce Chemical Co. , Rockford, Illinois (1984). В случае остатка N-α-ацилоаминокислоты или остатка N-α-ацилпептида, где атом водорода в N-α-положении на амино-конце остатка аминокислоты заменен ацильной группой в A1 формулы [I] , полипептид с прямой цепью формулы [I] связывают с нерастворимым полимером, для того, чтобы получить полипептидный полимер, и осуществляют реакцию указанного полипептидного полимера с ангидридом карбоновой кислоты или с карбоновой кислотой, соответствующими ацильной группе, с использованием конденсирующего агента, для того, чтобы ацилировать указанную N-концевую аминогруппу и получить N-ацилированный полипептидный полимер. Затем этот нерастворимый полимер и защитные группы из аминокислот удаляют и получают полипептид с прямой цепью формулы [I]. В случае остатка N-α-замещенной тиокарбамоильной аминокислоты или остатка N-α-замещенного тиокарбамоильного пептида, где атом водорода в N-α-положении в аминном конце остатка аминокислоты заменен тиокарбамоильной группой в A1 формулы [I], N-концевой N-α-замещенный тиокарбамоильный полипептид согласно изобретению может быть получен посредством реакции вышеупомянутого полипептида с соединением замещенного изотиоцианата, осуществленной в условиях слабощелочной среды.
У полученного таким образом полипептида карбоксильный конец аминокислотного остатка в 14-м положении может быть либо свободным (А4 соответствует -ОН), либо преобразованным в кислый амид (А4 соответствует -NH2).
За исключением особо оговоренных случаев, индивидуальные аминокислоты, используемые в вышеупомянутом методе твердофазного синтеза, находятся в L-форме, а основная аминокислота, спаренная с пролином в 8-м положении, обозначенная через Y, ограничена D-формой.
В качестве альтернативы полипептид согласно изобретению может быть также получен способом, предусматривающим использование рекомбинантной ДНК. В соответствии с этим способом последовательности, кодирующие нуклеотиды для полипептида согласно изобретению, можно клонировать и экспрессировать посредством методов, хорошо известных специалистам в данной области техники.
См. , например, Maniatis et al., Molecular Cloning, A Laboratory anual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1991.
Полипептид согласно изобретению можно выделить и очистить с помощью методов, известных в области техники, связанной с полипептидами, например, таких как экстрация, перекристаллизация, различные виды хроматографии (гельфильтрационная, ионообменная, распределительная, адсорбционная хроматография, хроматография с обращенной фазой), электрофорез, метод противоточного распределения и т.п., и среди них наиболее эффективным является метод жидкостной хроматографии высокого разрешения с обращенной фазой.
В качестве примеров работ, в которых описаны такие способы изготовления, можно сослаться на следующие публикации: патент США 5571892 (международная заявка WO 92/04374); Патент США 5449752 (выложенная заявка на патент Японии 163298/1993) и международная публикация WO 95/10534.
Полипептид, показанный в формуле [I], содержит в своей молекуле остатки цистеина, аргинина и лизина, и согласно стереоструктурной информации, по меньшей мере, одна пара остатков цистеина или остатков аргинина принимает такую конформацию, что боковая цепь -SH или гуанидиновая боковая цепь непосредственно располагается на той же самой стороне в стереоструктуре, так что указанная боковая цепь способна стабильно образовывать комплексную соль с соединением переходного металла. Однако указанный полипептид обычно принимает окисленную форму -S-S, поэтому предпочтительно, чтобы указанный полипептид предварительно изменили до восстановленной (-SH) формы, что облегчит образование комплексной соли с переходным металлом.
Например, комплексную соль с переходным металлом можно получить путем добавления к водному нейтральному раствору указанной восстановленной формы полипептида, по меньшей мере, двух эквивалентов соли переходного металла, предпочтительно водорастворимой соли переходного металла и органической или неорганической кислоты (например, ацетата цинка).
Соединение соли переходного металла с полипептидом, показанным в формуле [I] настоящего изобретения, проявляет чрезвычайно сильную основность.
Благодаря этой сильной основности соль присоединения образуют путем добавления кислоты. Образуют соль с фармацевтически пригодной кислотой, например с неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, серная кислота и подобные им, с органической карбоновой кислотой, такой как уксусная кислота, с галогенизированной уксусной кислотой, такой как трифторуксусная кислота, пропионовая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, лимонная кислота, винная кислота, салициловая кислота и подобные им, с кислыми сахарами, такими как глюкуроновая кислота, галактуроновая кислота, глюконовая кислота, аскорбиновая кислота и подобные им, с кислыми полисахаридами, иногда включающими в себя сульфаты полисахаридов, такими как гиалуроновая кислота, хондроитинсульфаты, альгиновая кислота и подобные им, с органическими сульфоновыми кислотами, такими как метансульфоновая кислота, р-толуолсульфоновая кислота и подобные им. Соль переходного металла с полипептидами, показанными в формуле [I] настоящего изобретения, можно использовать для приготовления лекарственной композиции, в качестве соли присоединения с указанной фармацевтически пригодной кислотой.
ПРИМЕНЕНИЕ СОЕДИНЕНИЯ СОЛИ ПЕРЕХОДНОГО МЕТАЛЛА С ПОЛИПЕПТИДОМ СОГЛАСНО ИЗОБРЕТЕНИЮ
Соединение соли переходного металла с полипептидом формулы [I] имеет свойство связывать эндотоксины, обладает антибактериальной активностью и способностью гемолизировать форменные элементы крови, чувствительные к эндотоксинам. Кроме того, соединение соли переходного металла с полипептидом согласно изобретению обладает чрезвычайно высокой антивирусной активностью. В конкретном варианте осуществления изобретения соединение соли переходного металла с полипептидом согласно изобретению обладает активностью против ВИЧ. Лекарство, в частности средство против ВИЧ, согласно изобретению можно приготовить в виде лекарственной композиции, включающей в себя соединение соли переходного металла с полипептидом, показанным в формуле [I], или соль присоединения указанного соединения соли переходного металла и полипептида с фармацевтически пригодной кислотой в качестве эффективного компонента, а также фармацевтически пригодный носитель, выбранный в соответствии со способом назначения и способом приема лекарственного средства. В качестве примеров фармацевтически пригодных носителей приведены физиологически совместимые буферы, такие как растворы Хэнкса или Рингера, физиологический раствор, физиологический раствор глюкозы или их смесь, а также гепаринизированный раствор из лимонной кислоты, цитрата натрия и декстрозы. Средство против ВИЧ согласно изобретению назначают для приема внутрь или для парентерального введения, в зависимости от объекта, против которого проводят лечение, или для дезинфекции от вирусной болезни внутри тела, либо для дезинфекции пораженных вирусом наружных участков тела, таких как поверхность тела, и его можно приготовить в такой препаративной форме как порошок, гранулы, раствор для инъекций или для приема внутрь, таблетки, суппозитории, пессарии, мазь, крем или аэрозоль, с использованием подходящего фармацевтически пригодного носителя, в соответствии со способом назначения и приема лекарственного средства.
В случае, когда средство против ВИЧ согласно изобретению назначают пациенту напрямую в виде инъекций, то полипептид или его соль согласно изобретению растворяют в физиологическом растворе и вводят постоянно или прерывисто в количестве от 10 до 5000 мг на кг веса тела человека в день или путем внутривенного вливания через капельницу.
ПРИМЕРЫ
Ниже показаны примеры осуществления настоящего изобретения, которые не исчерпывают объема данного изобретения.
В нижеприведенных примерах описаны примеры получения солей переходного металла с полипептидом (1) и полипептидом (2) и приведены результаты анализов на активность против ВИЧ для солей переходного металла с полипептидом согласно изобретению, а также для известных полипептидов, обладающих сродством к эндотоксинам.
ПРИМЕР 1: ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ СОЛИ ЦИНКА С ПОЛИПЕПТИДОМ (1)
Следующий полипептид (1) (см. в конце описания) синтезировали и получили с помощью способа, описанного в патенте США 5571892 (международная публикация WO 92/04374) и в патенте США 5449752 (выложенная заявка на патент Японии 163298/1993).
1.1. ПОЛУЧЕНИЕ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1)
Ацетат полипептида (1) (10,2 мг, 3,37 мкмоль), полученный в соответствии с вышеупомянутой международной публикацией РСТ, растворяли в очищенной воде (0,5 мл). К этому раствору добавляли дитиотрейтол (производства корпорации Сейкагаку) (26,0 мг, 169 мкмоль), в количестве 50-кратного эквивалента по отношению к полипептиду (1), промывали газообразным азотом и перемешивали в потоке азота при комнатной температуре в течение двух часов. Ход указанной реакции восстановления отслеживали с помощью ВЭЖХ, чтобы подтвердить окончание процесса восстановления.
После завершения реакции восстановления указанный реакционный раствор загружали в колонку (2,5 х 70 см) с сефадексом G-25 (тонкий), (производства компании фармация Биотех. Кo Лтд.), который предварительно уравновешивали водным раствором 25%-ной уксусной кислоты, извлекли из адсорбента с помощью того же самого водного раствора 25%-ной уксусной кислоты и затем подвергли фракционированию (1 фракция = 224 капли). Фракционные порции с номерами фракций 26 и 27, которые проявили положительную реакцию Элльмана (G.L.Ellman, Arch. Biochem. Biophys. , 82, 70 (1959); способ обнаружения тиоловых групп) и при реакции флуоресценции (A.M.Felix et al., J. Chromatogr., 89, 361 (1974), способ флуоресцентного обнаружения аминогрупп), собирали раствор указанных фракций, концентрировали в условиях вакуума и после разбавления водным раствором 10%-ной уксусной кислоты этот раствор подвергали лиофилизации и в результате получали желаемый ацетат восстановленной формы полипептида (1), что и требовалось.
Выход: 6,8 мг (67%).
1.2. АНАЛИЗ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1)
Ацетат восстановленной формы полипептида (1), полученный в разделе 1.1, подвергали кислотному гидролизу в 4М метансульфоновой кислоте, содержащей 0,2% триптамина, при 115oС в течение 24 часов, по методу Лю и др. (T.-Y. Liu et al. , J.Biol. Chem., 251, 1936 (1976)). Его аминокислотный состав хорошо согласовывался с аминокислотным составом восстановленной формы полипептида (1).
Удельное оптическое вращение [α]20D полученного ацетата восстановленной формы полипептида (1) составило -26,0o (с = 0,09, водный раствор 1М уксусной кислоты).
Более того, полученный ацетат восстановленной формы полипептида (1) показал единственный пик при анализе методом ВЭЖХ при нижеследующих условиях.
УСЛОВИЯ ПРОВЕДЕНИЯ АНАЛИЗА МЕТОДОМ ВЭЖХ И ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Колонка: TSK-гель ОДС - 120 Т (0,46 • 15 см) (Тосо К0., Лтд) + TSK жесткий гель ОДС - 120 Т (0,32 • 1,5 см) (Тосо К0., Лтд).
Градиентное элюирование:
Элюенты:
10% ацетонитрил / 0,1% трифторуксусная кислота (раствор A).
80% ацетонитрил / 0,1% трифторуксусная кислота (раствор B).
Условия градиента:
Время градиента: 1,0 мин; 29,4 мин; 35,0 мин.
Концентрация раствора В соответственно: 0%; 42%; 100%.
Концентрация раствора А соответственно: 10%; 39,4%; 80%.
Температура: 40oС.
Расход: 0,8 мл/мин.
Обнаружение: 220 нм и 280 нм.
Использованное количество: 5 мкл
(концентрация пептида: 1 мг/мл).
Время элюирования:
ацетат восстановленной формы полипептида (I): 19,27 мин,
ацетат полипептида (I): 18,24 мин.
1.3. ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1) И ИОНА ЦИНКА (II)
Ацетат восстановленной формы полипептида (1), полученный в разделе 1.1., растворяли в очищенной воде или в 1М буферном растворе ацетата аммония (рН 7.2).
К этому водному раствору или буферному раствору добавляли водный раствор 0,005 М ацетата цинка, соответствующий двум эквивалентам иона цинка (II) по отношению к восстановленной форме полипептида (1). Окончательную концентрацию полипептида довели до 5 мг/л и получили комплексный раствор восстановленной формы полипептида (1) и иона цинка (II).
1.4. ПОДТВЕРЖДЕНИЕ СТРУКТУРЫ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1) И ИОНА ЦИНКА (II) С ПОМОЩЬЮ ИОННО-РАСПЫЛИТЕЛЬНОЙ МАСС-СПЕКТРОМЕТРИИ
Порцию комплексного раствора восстановленной формы полипептида (1) и иона цинка (II), полученного в разделе 1.3, использовали в качестве тестируемого раствора для структурного анализа и провели структурный анализ методом ионно-распылительной масс-спектрометрии при нижеследующих условиях.
УСЛОВИЯ ИОННО-РАСПЫЛИТЕЛЬНОЙ МАСС-СПЕКТРОМЕТРИИ
Оборудование: трехстадийный квадрупольный масс-спектрометр типа АР IIIE (изготовитель - Перкин-Эльмер Сайекс К0., Лтд., обслуживание - Такара Шузо К0., Лтд).
Инфузия образца: для инфузии образца со скоростью расхода в 5 мкл/мин использовали шприцевый насос для инфузии 22 Харвард Аппаратус (Саут Нейтик, МАСС).
Напряжение на диафрагме: 130 вольт.
Область масс-спектров и тому подобное: масса против электрического заряда (m/z) 600 - 1800
(в положительном режиме ионов, с шагом в 0,5 атомных единиц массы, в среднем из 30 циклов сканирования).
Анализ полученных данных проводили с помощью Масsрес 3/22 (Sciex).
РЕЗУЛЬТАТЫ ИОННО-РАСПЫЛИТЕЛЬНОЙ МАСС-СПЕКТРОМЕТРИИ
Измеряли значения массы для состояния зарядов +2 и +3 (m/z: 1277,00 и 851,67 соответственно), и реконструированное значение массы (m/z: 2552,48) хорошо согласовывалось с расчетным значением массы для восстановленного полипептида (1) + Zn - 4Н (m/z: 2552,40).
Иначе говоря, было показано, что полипептид (1) и ион цинка (II) образуют комплекс, в котором соотношение пептид: Zn равно 1:1.
ОБСУЖДЕНИЕ
Уже сообщалось, что структуру комплекса, состоящего из пептида или белка и металла, можно идентифицировать с помощью ионно-распылительной масс-спектрометрии или электрораспылительной масс-спектрометрии. Например, см. анализ цинковой пальцевой структуры домена связывания ДНК глюкокортикоидного рецептора (H. E. Witkowska et al., J. Amer. Chem. Soc., 117, 3319 (1995)), анализ координации структуры меди по отношению к цинковой пальцевой области белка (T. W. Hutchens et al., FEBS Lett., 309, 170 (1992)), обзор Umeda по ионно-распылительной масс-спектрометрии (Tanpakyshitsu Kakusan Koso, 36, 1655 (1991)) и подобные им работы.
С помощью этого эксперимента также установили, что структуру комплекса восстановленной формы полипептида (1) и иона цинка (II) можно идентифицировать с помощью ионно-распылительной масс-спектрометрии.
1.5 ПОДТВЕРЖДЕНИЕ СТРУКТУРЫ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1) И ИОНА ЦИНКА (II) С ПОМОЩЬЮ УЛЬТРАФИОЛЕТОВОЙ АДСОРБЦИОННОЙ СПЕКТРОФОТОМЕТРИИ
Порции водного раствора восстановленной формы полипептида (1), полученной в р.1.1, и комплексного раствора восстановленной формы полипептида (1) и иона цинка (II), полученного в разделе 1.3, использовали в качестве тестируемого раствора для структурного анализа, и структурный анализ проводили посредством измерения спектров ультрафиолетового поглощения и их дифференциальных спектров в указанных ниже условиях.
ИЗМЕРЕНИЕ СПЕКТРОВ УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Оборудование: спектрофотометр ультрафиолетового-видимого излучения Ubest 30 (Нихон-Бунко К0., Лтд).
Измеряемая длина волны: 200 - 340 нм.
Образец: после помещения каждого свежеприготовленного тестируемого образца в измерительную трубку его промывали газообразным азотом и немедленно проводили измерение.
Нормальные спектры ультрафиолетового поглощения:
Контроль: дистиллированная вода.
Тестируемый образец: раствор восстановленной формы полипептида (1) и комплексный раствор восстановленной формы полипептида (1) и иона цинка (II).
Дифференциальные ультрафиолетовые спектры:
Контроль: раствор восстановленной формы полипептида (1).
Тестируемый образец: комплексный раствор восстановленной формы полипептида (1) и иона цинка (II).
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ СПЕКТРОВ УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Нормальные спектры ультрафиолетового поглощения:
Раствор восстановленной формы полипептида (1):
Продемонстрировали наличие большого пика поглощения при 250-300 нм, который характерен для поглощения, обусловленного триптофаном - аминокислотой, входящей в состав полипептида (1). Продемонстрировали максимум поглощения при 278 нм и плечо спектральной линии при 280 нм, которые характерны для поглощения, обусловленного триптофаном.
Комплексный раствор восстановленной формы полипептида (1) и иона цинка (II):
Получили кривую поглощения, которая была уширена по отношению к кривой поглощения вышеупомянутого раствора восстановленной формы полипептида (I), с диапазоном от 250 до 200 нм. Для того чтобы уточнить длины волн поглощения, провели измерения нижеследующего дифференциального спектра.
Дифференциальный ультрафиолетовый спектр:
Получили дифференциальный спектр с пиком от 215 до 235 нм и его разницу поглощения.
АНАЛИЗ ПОЛУЧЕННЫХ СПЕКТРОВ УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Как показано выше, при добавлении иона цинка (II) к восстановленной форме полипептида (1) ультрафиолетовое поглощение уширяется главным образом в диапазоне от 215 до 235 нм.
Это дает основание полагать, как обсуждается ниже, что в растворе восстановленной формы полипептида (1) и иона цинка (II) SH-группа цистеина восстановленной формы полипептида (1) образует комплекс с ионом цинка через меркаптидную связь.
ОБСУЖДЕНИЕ
Известно, что металлотионеин, белок, имеющий отношение к детоксикации тяжелого металла, имеет структуру, в которой SH-группа являющегося его составной частью остатка цистеина образует комплекс с ионом кадмия (II), цинка (II), меди (I, II), ртути (II) или им подобных через меркаптидную связь, и когда металл связывается с апо-металотионеином (SH-форма), то ультрафиолетовое поглощение увеличивается в пределах спектра с длинами волн, характерных для меркаптидной связи каждого металла. Например, известно, что в случае меркаптидного комплекса связи с ионом цинка (II) ультрафиолетовое поглощение увеличивается и уширяется главным образом в диапазоне 220-230 нм (см. J.H.R. Kagi and B.L.Vallee, J. Biol. Chem., 236, 2435 (1961); M.Vasak et al., Biochemistry, 20, 2852 (1981); A.R.Thrower et al., J. Biol. Chem., 263, 7037 (1988); J.H.R.Kagi et al., Environmental Health Perspectives, 54, 93 (1984) и подобные работы). Широкий диапазон, в котором увеличивается ультрафиолетовое поглощение (220-230 нм) благодаря меркаптидной связи этого иона цинка (II) согласуется с увеличенным диапазоном длин волн дифференциального спектра, наблюдавшегося для вышеупомянутого раствора восстановленной формы полипептида (1) и иона цинка (II).
Иначе говоря, выяснили, что в растворе восстановленной формы полипептида (1) и иона цинка (II) SН-группа цистеина восстановленной формы полипептида (1) образует меркаптидную связь с ионом цинка (II).
1.6 АКТИВНОСТЬ ПРОТИВ ВИЧ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (1) И ИОНА ЦИНКА (II)
Порцию комплексного раствора восстановленной формы полипептида (1) и иона цинка (II), полученного в п.1.3, использовали в качестве тестируемого раствора для измерения активности против ВИЧ и измеряли эту активность против ВИЧ. ПРИМЕР 2: ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ СОЛИ ЦИНКА С ПОЛИПЕПТИДОМ (2)
Полипептид (2) (см. в конце описания), показанный в нижеследующей формуле, получали согласно способу, описанному в международной публикации РСТ WO 95/10534.
2.1 ПОЛУЧЕНИЕ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2)
Ацетат полипептида (2) (10,0 мг, 3,94 мкмоль), полученный в соответствии с вышеупомянутой международной публикацией РСТ, растворяли в очищенной воде (0,5 мл). К этому раствору добавляли дитиотреитол (32,0 мг, 207,5 мкмоль) (производства корпорации Сейкагаку) в количестве 53-кратного эквивалента по отношению к полипептиду (2), промывали газообразным азотом и перемешивали в потоке азота при комнатной температуре в течение двух часов.
Протекание указанной реакции восстановления отслеживали с помощью ВЭЖХ и подтвердили полное восстановление.
После завершения реакции восстановления указанный реакционный раствор загружали в колонку (2,5 х 70 см) с сефадексом G-25 (тонкий), (производства компании фармация Биотех. К0., Лтд.), который предварительно уравновешивали водным раствором 25%-ной уксусной кислоты, извлекали из адсорбента с помощью того же самого водного раствора 25%-ной уксусной кислоты и затем подвергали фракционированию (1 фракция = 224 капли). Фракционные порции с номерами фракций 26 и 27, которые проявляли положительную реакцию при анализе с помощью реакции Элльмана и с помощью реакции флуоресценции, собирали, раствор указанных фракций концентрировали в вакууме, и после разбавления водным раствором 10%-ной уксусной кислоты этот раствор подвергали лиофилизации, в результате чего получали ацетат восстановленной формы полипептида (2), что и требовалось.
Выход: 9,8 мг (98%).
2.2 АНАЛИЗ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2)
Ацетат восстановленной формы полипептида (2), полученный в разделе 2.1, подвергали кислотному гидролизу в 4М метансульфоновой кислоте, содержащей 0,2% триптамина, при 115oС в течение 24 часов, по методу Liu et al., таким же образом, как это делали для полипептида (1) в разделе 1.2. Его аминокислотный состав хорошо согласовывался с аминокислотным составом восстановленной формы полипептида (2).
Удельное оптическое вращение [α]20D полученного ацетата восстановленной формы полипептида (2) составило -23,3o (с = 0,04, водный раствор 1М уксусной кислоты).
Более того, полученный ацетат восстановленной формы полипептида (2) показал единственный пик при анализе методом ВЭЖХ, проведенном при таких же условиях, что и анализ ВЭЖХ, выполнявшийся для полипептида (1) в разделе 1.2.
РЕЗУЛЬТАТЫ АНАЛИЗА ВЭЖХ
Время элюирования:
ацетат восстановленной формы полипептида (2) - 16,14 мин
ацетат полипептида (2) - 15,87 мин
2.3. ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2) И ИОНА ЦИНКА (II)
Ацетат восстановленной формы полипептида (2), полученный в разделе 2.1, растворяли в очищенной воде или в 1М буферном растворе ацетата аммония (рН 7.2).
К этому водному раствору или буферному раствору добавляли водный раствор 0,005 М ацетата цинка, соответствующий одному эквиваленту иона цинка (II) по отношению к восстановленной форме полипептида (2). Окончательную концентрацию полипептида доводили до 5 мг/л и получили комплексный раствор восстановленной формы полипептида (2) и иона цинка (II).
2.4. ПОДТВЕРЖДЕНИЕ СТРУКТУРЫ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2) И ИОНА ЦИНКА (II) С ПОМОЩЬЮ ИОННО-РАСПЫЛИТЕЛЬНОЙ МАСС-СПЕКТРОМЕТРИИ
Порцию комплексного раствора восстановленной формы полипептида (2) и иона цинка (II), полученного в разделе 2.3, использовали в качестве тестируемого раствора для структурного анализа, и проводили структурный анализ методом ионно-распылительной масс-спектрометрии, при тех же самых условиях, при которых проводили ионно-распылительную масс-спектрометрию комплексного раствора восстановленной формы полипептида (1) и иона цинка (II), как описано в разделе 1.4.
РЕЗУЛЬТАТЫ ИОННО-РАСПЫЛИТЕЛЬНОЙ МАСС-СПЕКТРОМЕТРИИ
Наблюдали значения массы для состояний зарядов +2 и +3 (m/z: 1030,50 и 687,34 соответственно), и реконструированное значение массы (m/z: 2059,98) хорошо согласовывалось с расчетным значением массы для восстановленного полипептида (2) +Zn-4H (m/z: 2059,83).
Иначе говоря, показали, что восстановленный полипептид (2) и ион цинка (II) образуют комплекс, в котором соотношение пептид : Zn равно 1:1.
2.5 ПОДТВЕРЖДЕНИЕ СТРУКТУРЫ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2) И ИОНА ЦИНКА (II) ПОСРЕДСТВОМ УЛЬТРАФИОЛЕТОВОЙ АДСОРБЦИОННОЙ СПЕКТРОФОТОМЕТРИИ
Порции водного раствора восстановленной формы полипептида (2), полученного в разделе 2.1, и комплексного раствора восстановленной формы полипептида (2) и иона цинка (II), полученного в разделе 2.3, использовали в качестве тестируемого раствора для структурного анализа, и структурный анализ проводили посредством измерения спектров ультрафиолетового поглощения и их дифференциальных спектров, в тех же самых условиях, которые использовали для полипептида (1) в р.1.5.
ИЗМЕРЕНИЕ СПЕКТРОВ УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Нормальные спектры ультрафиолетового поглощения:
Контроль: дистиллированная вода.
Тестируемый раствор: раствор восстановленной формы полипептида (2) и раствор комплексной соли восстановленной формы полипептида (2) и иона цинка (II).
Дифференциальные ультрафиолетовые спектры:
Контроль: раствор восстановленной формы полипептида (2).
Тестируемый раствор: комплексный раствор восстановленной формы полипептида (2) и иона цинка (II).
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ СПЕКТРОВ УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Нормальные спектры ультрафиолетового поглощения:
Раствор восстановленной формы полипептида (2): обнаружили наличие большого пика поглощения при 250 - 300 нм, который характерен для поглощения, обусловленного триптофаном - аминокислотой, входящей в состав полипептида (2). Продемонстрировали максимум поглощения при 278 нм и плечо спектральной линии при 280 нм, которые характерны для поглощения, обусловленного триптофаном.
Комплексный раствор восстановленной формы полипептида (2) и иона цинка (II): получили кривую поглощения, которая была уширена по отношению к кривой поглощения вышеупомянутого раствора восстановленной формы полипептида (2), с диапазоном примерно от 250 до 200 нм.
Дифференциальный ультрафиолетовый спектр:
Получили дифференциальный спектр с пиком в диапазоне от 215 до 235 нм и его разницу поглощения.
АНАЛИЗ ПОЛУЧЕННОГО СПЕКТРА УЛЬТРАФИОЛЕТОВОГО ПОГЛОЩЕНИЯ
Как было показано выше, при добавлении иона цинка (II) к восстановленной форме полипептида (2) наблюдали, что ультрафиолетовое поглощение уширяется главным образом в диапазоне от 215 до 235 нм.
Соответственно, показали, что в растворе восстановленной формы полипептида (2) и иона цинка (II) SH-группа цистеина восстановленной формы полипептида (2) образует комплекс с ионом цинка через меркаптидную связь.
2.6 АКТИВНОСТЬ ПРОТИВ ВИЧ КОМПЛЕКСНОЙ СОЛИ ВОССТАНОВЛЕННОЙ ФОРМЫ ПОЛИПЕПТИДА (2) И ИОНА ЦИНКА (II)
Порцию комплексного раствора восстановленной формы полипептида (2) и иона цинка (II), полученного, как описано выше, использовали в качестве тестируемого раствора для измерения активности против ВИЧ и измеряли эту активность против ВИЧ.
ПРИМЕР 3: АНТИВИРУСНАЯ АКТИВНОСТЬ ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА (ВИЧ)
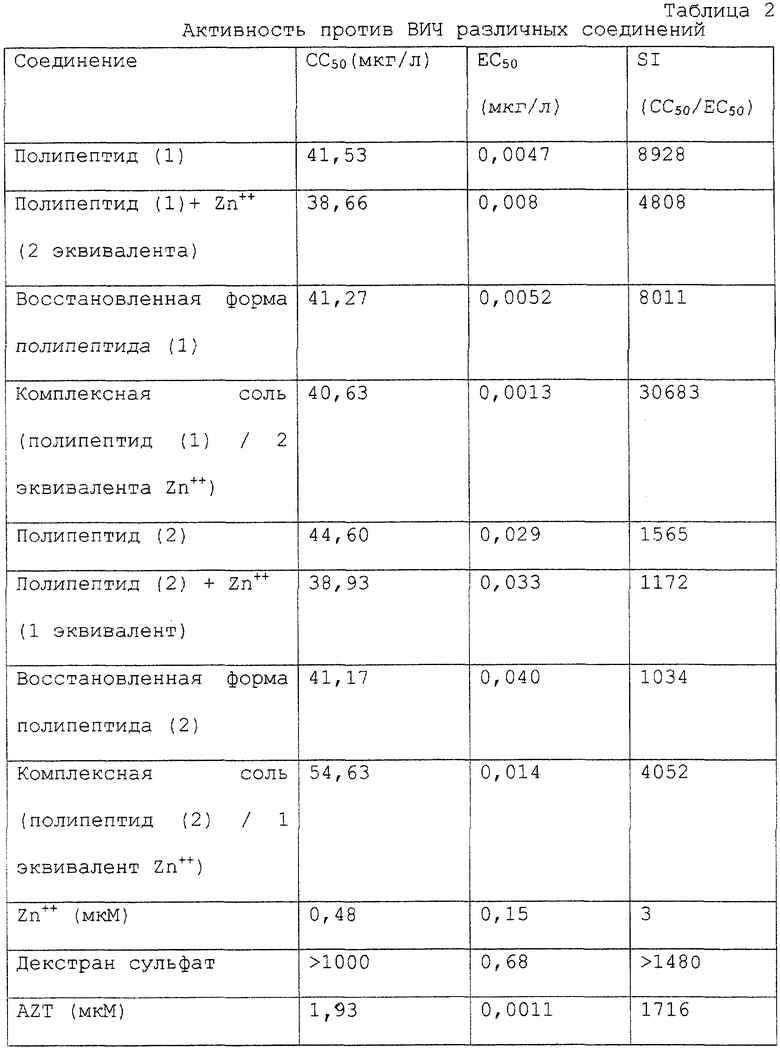
Антивирусную активность против ВИЧ комплекса цинка с полипептидом (1), полученного в соответствии с примером 1, и комплекса цинка с полипептидом (2), полученного в соответствии с примером 2, испытывали и определяли согласно нижеследующему способу.
В 96-луночный микротитрационный планшет непосредственно после заражения поместили ВИЧ-инфицированные клетки МТ-4 (2,5 х 104 клеток/лунку, множественность заражения: 0,001), наряду с испытуемыми материалами в разных концентрацииях. После инкубации в инкубаторе с CO2 при 37oС в течение 5 дней определяли количество выживших клеток, с помощью метода МТТ (Pauwels et al., J. Virol. Methods 20, 309-321 (1998)). Антивирусную активность выражали в виде концентрации, которая предотвращала на 50% гибель клеток, вызванную заражением ВИЧ (ЕС50: концентрация с 50%-ной эффективностью). С другой стороны, для того чтобы выяснить цитотоксичность испытуемых веществ для клеток МТ-4, культивировали не зараженные вирусом клетки вместе с испытуемыми материалами в различных концентрациях, как описано выше. Цитотоксичность выражали в виде концентрации, вызывающей 50%-ную цитотоксичность (CC50), обусловленную испытуемыми материалами, а примерное отношение СС50 к EC50 обозначали как эффективное отношение (SI).
Результаты измерений активности против ВИЧ показаны в таблице 2, наряду с результатами по другим соединениям.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Идентификационный номер последовательности: 1
Длина последовательности: 14
Тип последовательности: аминокислотный
Топология: линейная
Молекулярный тип: пептид
Характеристика:
Местоположение: 1
Прочая информация:
Хаа независимо представляет собой остаток основной аминокислоты, выбранной из лизина, аргинина и орнитина; остаток пептида, имеющий, по меньшей мере, два из указанных остатков основных аминокислот; или остаток N-α-замещенной аминокислоты или остаток N-α-замещенного пептида, в которых атом водорода в N-α-положении остатка аминокислоты на амино-конце указанного остатка основной аминокислоты или указанного остатка пептида может быть заменен ацильной группой или группой замещенного тиокарбамоила.
Местоположение: 2
Прочая информация:
Хаа независимо представляет собой остаток аминокислоты, выбранной из фенилаланина, триптофана и тирозина.
Местоположение: 4
Прочая информация:
Хаа независимо представляет собой остаток аминокислоты, выбранной из фенилаланина, триптофана и тирозина.
Местоположение: 5, 6
Прочая информация:
Хаа независимо представляет собой остаток основной аминокислоты, выбранной из аргинина, лизина и орнитина.
Местоположение: 7
Прочая информация:
Хаа независимо представляет собой пептидный остаток из двух аминокислотных остатков, в котором в следующем положении остатка одной аминокислоты, выбранной из аланина, валина, лейцина, изолейцина, серина, метионина и цистеина, одна из следующих аминокислот - фенилаланин, триптофан или тирозин -присоединена через пептидную связь.
Местоположение: 8
Прочая информация:
Хаа представляет собой пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка глицина и остатка одной аминокислоты, выбранной из аргинина, лизина и орнитина, или пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка пролина и остатка одной аминокислоты, выбранной из D-аргинина, D-лизина и D-орнитина.
Местоположение: 9
Прочая информация:
Хаа представляет собой пептидный остаток из двух аминокислотных остатков, в котором в следующем положении одного остатка аминокислоты, выбранной из аланина, валина, лейцина, изолейцина, серина, метионина, фенилаланина, триптофана и тирозина, цистеин присоединен через пептидную связь.
Местоположение: 7, 8, 9
Прочая информация:
Остаток Хаа-Хаа-Хаа, присоединенный через пептидную связь, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях через пептидные связи, или из-за одновременно действующей делеции Хаа в 7-м положении и Хаа в 9-м положении, остаток Хаа в 8-м положении может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях, через пептидные связи, где водород находящейся в боковой цепи ω-аминогруппы D-лизина, L-лизина, D-орнитина или L-орнитина, являющийся составной частью аминокислоты 8-го Хаа, может быть замещен ω-аминоацильной группой.
Местоположение: 10
Прочая информация:
Хаа независимо представляет собой остаток аминокислоты, выбранной из фенилаланина, триптофана и тирозина.
Местоположение: 11, 12
Прочая информация:
Хаа независимо представляет собой остаток основной аминокислоты, выбранной из аргинина, лизина и орнитина.
Местоположение: 14
Прочая информация:
Хаа независимо представляет собой остаток основной аминокислоты, выбранной из аргинина, лизина и орнитина.






Изобретение относится к соединениям соли полипептида, представленного в формуле (I), где А1, А2, А3, А4, Х, Y и Z имеют значения, представленные в описании, и переходного металла, которые обладают высокой антивирусной активностью против вируса иммунодефицита человека. Описаны также способ повышения активности против ВИЧ соединения полипептида формулы (I), заключающийся в том, что указанный полипептид переводят в соль с переходным металлом, а также фармацевтическая композиция, включающая в себя соединение соли полипетида (I) с переходным металлом, обладающая антивирусной активностью. 3 c. и 4 з.п. ф-лы, 2 табл.
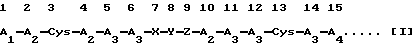
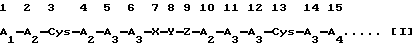
(Идентификационный последовательности: 1), в которой
A1 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn, или остаток пептида, имеющий по меньшей мере два из указанных остатков основных аминокислот;
А2 независимо представляет собой остаток аминокислоты, выбранной из Phe, Trp и Туr;
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток двух аминокислотных остатков, где первый аминокислотный остаток выбран из Ala, Val, Leu, Ile, Ser, Met и Cys, а второй аминокислотный остаток выбран из A2, присоединенных через пептидную связь;
Y представляет собой пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Gly и остатка аминокислоты, выбранной из А3, или пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Pro и остатка одной аминокислоты, выбранной из D-Arg, D-Lys и D-Orn;
Z представляет собой пептидный остаток из двух аминокислотных остатков, где к одному остатку аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и А2, присоединен Cys через пептидную связь; и остаток X-Y-Z, соединенный пептидными связями, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, или в результате конкурентной делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями.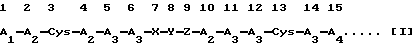
(Идентификационный последовательности: 1), в которой
A1 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn, или остаток пептида, имеющий по меньшей мере два из указанных остатков основных аминокислот;
А2 независимо представляет собой остаток аминокислоты, выбранной из Phe, Trp и Туr;
А3 независимо представляет собой остаток основной аминокислоты, выбранной из Lys, Arg и Orn;
А4 представляет собой -ОН (происходящий из карбоксильной группы) или -NH2 (происходящий из группы кислого амида);
Х представляет собой пептидный остаток двух аминокислотных остатков, где первый аминокислотный остаток выбран из Ala, Val, Leu, Ile, Ser, Met и Cys, а второй аминокислотный остаток выбран из A2, присоединенных через пептидную связь;
Y представляет собой пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Gly и остатка аминокислоты, выбранной из А3, или пептидный остаток из двух аминокислотных остатков, который состоит из комбинации остатка Pro и остатка одной аминокислоты, выбранной из D-Arg, D-Lys и D-Orn;
Z представляет собой пептидный остаток из двух аминокислотных остатков, где к одному остатку аминокислоты, выбранной из Ala, Val, Leu, Ile, Ser, Met и А2, присоединен Cys через пептидную связь; и остаток X-Y-Z, соединенный пептидными связями, присоединен к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, или в результате конкурентной делеции Х и Z, остаток Y может быть присоединен напрямую к каждому аминокислотному остатку в 6-м и 10-м положениях пептидными связями, заключающийся в том, что указанный полипептид (I) переводят в соль с переходным металлом.
| EP 0 502 198 А1, 09.09.1992 | |||
| EP 0 513 613 А1, 19.11.1992 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2002-02-27—Публикация
1997-10-15—Подача