Брадикинин является нонапептидом, имеющим аминокислотную последовательность
Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg,
на которую далее ссылаются как на SEQ ID NO:1, принадлежащим к семейству кининов, которое также включает каллидин или лизил-брадикинин, который имеет аминокислотную последовательность
Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg,
на которую далее ссыпаются как на SEQ ID NO:2, и метионил-лизил-брадикинин, который имеет аминокислотную последовательность
Met-Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg,
на которую далее ссылаются как на SEQ ID NO:3. Эти кинины выделяются из плазматических предшественников (кининогенов) под воздействием плазматических и тканевых калликреинов, чтобы регулировать важные физиологические функции [For a review of the therapeutic prospects of bradykinin receptor antagonists, see, J.N. Sharma, General Pharmacology 24:267-274 (1993)].
Брадикинин опосредует боль, проницаемость сосудов, воспаление, желудочно-кишечную функцию и тонус гладкой мускулатуры в сосудистой и других тканях. Брадикинин является одним из ключевых медиаторов реакции организма на травму и повреждение. Аномально повышенное выделение брадикинина в ответ на вредные вещества, повреждение ткани или недостаток циркулирующих киназ может индуцировать различные патологические состояния от ревматоидного артрита до астмы.
Рецепторы брадикинина существуют в нервной системе, эпителии, гладкой мускулатуре и фибробластах. В каждом типе ткани брадикинин является пусковым механизмом для специфических реакций, включая выделение нейротрансмиттера, сокращение мышц, секрецию жидкости эпителием и стимуляцию роста клеток. Начальное взаимодействие для биологического ответа происходит в сайте рецептора брадикинина на клетке.
Брадикинин может активировать нейроны и вызывать выделение нейротрансмиттера. Он может активировать фосфолипазы С и А2, приводя в результате к образованию ряда биологически активных промежуточных продуктов.
Рецепторы брадикинина являются G белок-сопряженными рецепторами, которые активируют фосфолипазу С или фосфолипазу А2 и увеличивают синтез трифосфата инозита, диацилглицерина и арахидоновой кислоты. Olsen, et al., Journal of Biological Chemistry, 263: 18030-18035 (1988). G белки являются семейством мембранных белков, которые становятся активированными только после связывания трифосфата гуанозина. Активированные G белки в свою очередь активируют амплифицирующий фермент на внутренней поверхности мембраны; затем фермент превращает молекулы предшественника во вторичные мессенджеры.
Рецепторы брадикинина классифицируются как В1 и В2 на основе относительных потенций агонистов (кининов) и антагонистов (аналогов кинина) на различных фармакологических препаратах. R.J. Vavrek and J.M. Stewart, Peptides, 6: 161-164 (1985). В1 рецепторы генерируются de novo в сосудистой гладкой мускулатуре при инкубировании изолированной ткани и при индуцированном антигеном артрите. J. Bouthiller, et al., British Journal of Pharmacology, 92: 257-264 (1987).
Существует все еще непрерывная потребность в непептидильных антагонистах рецептора брадикинина. Известны фармакологические средства, содержащие фрагменты молекул гуанидина. См., например, патенты США 5059624 и 5028613. Эти два выданных патента описывают ряд пирролохинопиновых алкалоидов, выделенных и очищенных из некоторых морских губок. Патент США 5288725, выданный 22 февраля 1994 г., описывает ряд соединений пирролохинолин-гуанидина, полезных в качестве антагонистов рецептора брадикинина. Патент США 5212182, выданный 18 мая 1993 г., описывает ряд хинолинил- и нафталинилбензамидов и бензиламинов, которые полезны как антагонисты рецептора брадикинина, обладающие обезболивающими свойствами. Патент США 5216165, выданный 1 июня 1993 г., описывает ряд N-замещенных аминохинолинов, полезных в качестве обезболивающих агентов, благодаря их свойствам как антагонистов рецептора брадикинина.
Продолжает существовать потребность в эффективных и безопасных соединениях, которые полезны как антагонисты рецептора брадикинина. Настоящее изобретение представляет новый ряд таких антагонистов, которые можно вводить различными путями, включая пероральное, а также парентеральное введение.
Данное изобретение представляет способ ингибирования физиологического расстройства, связанного с избытком брадикинина, который включает введение человеку, нуждающемуся в этом, терапевтически эффективного количества соединения формулы 1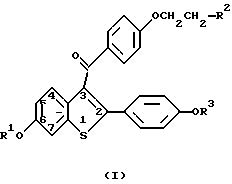
в которой R1 и R3 независимо представляют водород, -СН3, -С(=O)-(С1-С6 алкил) или -С(=O)-Аr, где Аr - необязательно замещенный фенил;
R2 выбран из группы, состоящей из пирролидино, гексаметиленимино и пиперидино; и его фармацевтически приемлемых солей и сольватов.
Настоящее изобретение связано с открытием того, что избранная группа 2-фенил-3-ароилбензотиофенов (бензотиофенов) формулы 1 полезна для ингибирования физиологического состояния, связанного с избытком брадикинина.
Терапевтические и профилактические методы лечения, представляемые настоящим изобретением, осуществляют на практике введение человеку, нуждающемуся в этом, дозы соединения формулы 1 или его фармацевтически приемлемой соли или сольвата, которая является эффективной для ингибирования физиологического состояния, связанного с избытком брадикинина, или его симптомов.
Термин "ингибировать" включает его общепринятые значения, которые включают препятствование, предотвращение, ограничение и замедление, прекращение или обратное развитие тяжести или конечного симптома. Таким образом, настоящий способ включает как медицинское терапевтическое, так и/или профилактическое введение соответственно.
Ралоксифен является предпочтительным соединением данного изобретения и представляет собой гидрохлоридную соль соединения формулы 1, где R1 и R3 - водород, а R2 - 1-пиперидинил.
Обычно, рецептуру лекарственного средства составляет, по крайней мере, одно соединение формулы 1 с обычными наполнителями, разбавителями или носителями, которые прессуют в таблетки или готовят как эликсиры или растворы, подходящие для удобного перорального введения или для введения внутримышечным или внутривенным путем. Соединения могут быть введены чрескожно и могут быть включены в состав лекарственных форм с замедленным выделением и т. п.
Соединения, используемые в способах настоящего изобретения, могут быть получены в соответствии с установленными процедурами, такими как подробно описаны в патентах США 4133814, 4418068 и 4380635, которые приведены здесь для сведения. В основном, процесс начинается с бензо[b]тиофена, имеющего 6-гидроксильную группу и группу 2-(4-гидроксифенил). Исходное соединение защищают, ацилируют и удаляют защиту, чтобы получить соединения формулы 1. Примеры получения таких соединений приведены в патентах США, обсуждаемых выше. Термин "необязательно замещенный фенил" включает фенил и фенил, моно- или ди-замещенный С1-С6 алкилом. С1-С4 алкокси, гидрокси, нитро, хлором, фтором или три(хлор- или фтор)метилом.
Соединения, используемые в способах настоящего изобретения, образуют фармацевтически приемлемые аддитивные соли с широким разнообразием органических и неорганических кислот и оснований и включают физиологически приемлемые соли, которые часто используются в фармацевтической химии. Такие соли также являются частью данного изобретения. К типичным неорганическим кислотам, используемым для получения таких солей, относятся хлористоводородная, бромистоводородная, иодистоводородная, азотная, серная, фосфорная, гипофосфорная и т.п. Могут быть также использованы соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты. Так, к таким фармацевтически приемлемым солям относятся ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, бета-гидроксибутират, бутин-1,4-диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, вторичный кислый фосфат, первичный кислый фосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацинат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензол-сульфонат, п-бромфенил-сульфонат, хлорбензол-сульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и т.п. Предпочтительной солью является гидрохлоридная соль.
Фармацевтически приемлемые аддитивные соли с кислотой обычно получают реакцией соединения формулы 1 с эквимолярным или избыточным количеством кислоты. Реагенты в основном объединяют в общем растворителе, таком как простой диэтиловый эфир или бензол. Соль обычно осаждается из раствора в течение примерно от одного часа до 10 дней, ее выделяют фильтрованием или отгонкой растворителя обычными способами.
Основания, обычно используемые для образования солей, включают гидроксид аммония и гидроксиды и карбонаты щелочных и щелочноземельных металлов, а также алифатические и первичные, вторичные и третичные амины, алифатические диамины. Основания, особенно полезные для получения аддитивных солей, включают гидроксид аммония, карбонат калия, метиламин, диэтиламин, этилендиамин и циклогексиламин.
Фармацевтически приемлемые соли, обычно, имеют улучшенные характеристики растворимости по сравнению с соединением, из которого они получены, поэтому они лучше подходят для приготовления жидких и эмульсионных препаратов.
Фармацевтические препараты (готовые формы) получают с помощью известных процедур. Например, соединения смешивают с обычными наполнителями, разбавителями и носителями и придают им форму таблеток, капсул, суспензий, порошков и т.п. Примеры наполнителей, разбавителей и носителей, которые являются подходящими для таких препаратов, включают следующее: наполнители и объемные наполнители (экстендеры), такие как крахмал, сахар, маннит и кремнийсодержащие производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажнители, такие как глицерин; дезинтегрирующие вещества, такие как карбонат кальция и бикарбонат натрия; средства для замедления растворения, такие как парафин; ускорители ресорбции, такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина; адсорбтивные носители, такие как каолин и бентонит, и смазки, такие как тальк, стеарат кальция и магния и твердые попиэтил-гликоли.
Соединения в виде готовых лекарственных могут также приготавливаться как эликсиры или растворы для обычного перорального введения или как растворы, предназначенные для парентерального введения, например, внутримышечным, подкожным или внутривенным путем. Кроме того, соединения очень удобны для приготовления лекарственного средства в виде лекарственных форм с замедленным выделением и т.п. Препараты могут быть составлены так, чтобы они выделяли активный ингредиент только или преимущественно в заданной части кишечного тракта, возможно через некоторый период времени. Покрытия, оболочки и защитные полимерные матрицы могут изготавливаться, например, из полимерных веществ или восков.
Часто желательно или необходимо ввести фармацевтическую композицию в мозг или непосредственно, или косвенно. Методика непосредственного введения обычно включает помещение выделяющего лекарство катетера в вентрикулярную систему хозяина, чтобы обойти гематоэнцефалический барьер. Одна из таких имплантируемых выделяющих систем, используемая для переноса биологических факторов к специфическим анатомическим областям тела, описана в патенте США 5011472, выданном 30 апреля 1991 г., который приводится здесь для сведения.
Индивидуальная дозировка соединения формулы 1, необходимая для ингибирования физиологического состояния, связанного с избытком брадикинина, или его симптомов в соответствии с настоящим изобретением, будет зависеть от тяжести состояния, пути введения и подобных факторов и должна определяться лечащим врачом. В основном, принятые и эффективные суточные составляют от около 0.1 до около 1000 мг/день, а более типично от около 50 до около 200 мг/день. Такие дозировки вводятся субъекту при необходимости этого от одного до трех раз каждый день или более часто, как требуется для эффективного лечения или предупреждения болезни (болезней) или симптома (симптомов).
Обычно предпочтительно вводить соединение формулы 1 в форме аддитивной соли с кислотой на основании опыта введения фармацевтических средств, несущих группу основного характера, такую как циклическая пиперидиногруппа. Для таких целей доступны следующие пероральные лекарственные формы.
Препараты
(готовые формы)
В следующих препаратах "Активный ингредиент" обозначает соединение формулы 1.
Препарат 1: Желатиновые капсулы
Твердые желатиновые капсулы получают, используя следующее:
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 0,1-1000
Крахмал, NF - 0-650
Сыпучий порошок крахмала - 0-650
Силиконовая жидкость 350 сСт - 0-15
Ингредиенты смешивают, пропускают через сито 45 меш США и заполняют ими твердые желатиновые капсулы.
Примеры специфических препаратов ралоксифена в капсулах, которые были приготовлены, включают приведенные ниже:
Препарат 2: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 1
Крахмал, NF - 112
Сыпучий порошок крахмала - 225,3
Силиконовая жидкость 350 сСт - 1,7
Препарат 3: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 5
Крахмал, NF - 108
Сыпучий порошок крахмала - 225,3
Силиконовая жидкость 350 сСт - 1,7
Препарат 4: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 10
Крахмал, Nf - 103
Сыпучий порошок крахмала - 225,3
Силиконовая жидкость 350 сСт - 1,7
Препарат 5: Капсула ралоксифена
Ингредиент - Количество (мг/капсула)
Активный ингредиент - 50
Крахмал, NF - 150
Сыпучий порошок крахмала - 397
Силиконовая жидкость 350 сСт - 3,0
Представленные выше специфические препараты могут быть изменены в соответствии с приемлемыми вариациями.
Препарат в форме таблеток получают, используя приведенные ниже ингредиенты:
Препарат 6: Таблетки
Ингредиент - Количество (мг/таблетка)
Активный ингредиент - 0,1-1000
Целлюлоза, микрокристаллическая - 0-650
Диоксид кремния, коллоидный - 0-650
Стеариновая кислота - 0-15
Компоненты смешивают и прессуют в таблетки.
Альтернативно, таблетки, каждая из которых содержит 0,1-1000 мг активного ингредиента, получают следующим образом:
Препарат 7: Таблетки
Ингредиент - Количество (мг/таблетка)
Активный ингредиент - 0,1-1000
Крахмал - 45
Целлюлоза, микрокристаллическая - 35
Поливинилпирролидон (как 10%-ный раствор в воде) - 4
Натриевая соль карбоксиметилцеллюлозы - 4,5
Стеарат магния - 0,5
Тальк - 1
Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками, которые затем пропускают через сито 14 меш США. Полученные таким образом гранулы сушат при 50-60oС и пропускают через сито 18 меш США. Натриевую соль карбоксиметилцеллюлозы, крахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 США, затем добавляют к гранулам и после перемешивания прессуют на таблетировочной машине, чтобы получить таблетки.
Суспензии, каждая из которых содержит 0,1-1000 мг активного ингредиента в 5 мл дозе, получают следующим образом:
Препарат 8: Суспензии
Ингредиент - Количество (мг/5 мл)
Активный ингредиент - 0,1-1000 мг
Натриевая соль карбоксиметилцеллюлозы - 50 мг
Сироп - 1,25 мг
Раствор бензойной кислоты - 0,10 мл
Ароматизатор - q. V.
Краситель - q. V.
Очищенная вода до - 5 мл
Активный ингредиент пропускают через сито 45 меш США и смешивают с натриевой солью карбоксиметилцеллюлозы и сиропом до образования гладкой пасты. Раствор бензойной кислоты, ароматизатор и краситель разбавляют некоторым количеством воды при перемешивании. Затем добавляют воду в количестве, достаточном для получения нужного объема.
Биологическую активность соединений настоящего изобретения оценивают, используя начальный скрининг-анализ, который быстро и точно измеряет связывание тестируемого соединения с известными сайтами рецептора брадикинина. Анализы, пригодные для оценки антагонистов рецептора брадикинина, хорошо известны. См. , например, патенты США 5162497, выданный 10 ноября 1992 г.; 5212182, выданный 18 мая 1993 г. ; 5216165, выданный 1 июня 1993 г., и 5288725, выданный 22 февраля 1994 г., которые приводятся здесь для сведения. См. также, Ransom, et al., Biochemical Pharmacology, 43:1823 (1992).
Анализ связывания брадикинина на морских свинках
Морских свинок гуманно умерщвляют и извлекают кишечники. Эти кишечники тщательно промывают 0,9%-ным солевым раствором, осушают промокательным материалом и взвешивают. Ткани гомогенизируют, по меньшей мере, в четырех объемах 50 мМ буфера Трис, рН 7,7 и центрифугируют при 15000 g в течение примерно тридцати минут.
Осадки затем промывают три раза последовательным суспендированием в 50 мМ Трис, рН 7,7 с последующим центрифугированием. Окончательные осадки повторно суспендируют в достаточном объеме 50 мМ Трис, 7,7, чтобы получить концентрацию 1 г мокрой массы ткани на 4 мл буфера. Данные образцы хранят замороженными при -80oС.
Для анализа связывания 190-195 мкл аналитического буфера (50 мМ Трис, рН 7,4, 1 мМ 1,10-фенантролина и 10 мкл ингибитора Пламмера) смешивают с 200 мкл гомогената ткани и 5-10 мкл тестируемого образца, добавления осуществляют в указанном порядке. Смесь для анализа затем тщательно перемешивают. Неспецифическое связывание определяют в присутствии 1 мкМ немеченого брадикинина.
К данному коктейлю для анализа добавляют 100 мкл (1 пМ) 3H-меченого брадикинина. Реакционную смесь для анализа связывания затем инкубируют около 90 минут при комнатной температуре и затем фильтруют через стекловолоконные фильтры GF/B, которые предварительно замачивают, по меньшей мере, в течение одного часа в 0,3%-ном полиэтиленимине. Фильтры промывают холодным 50 мМ Трис, рН 7,7 (3•3 мл), а затем производят подсчет на сцинтилляционном счетчике.
Многие из соединений, полученных выше, показывают значительную активность как антагонисты рецептора брадикинина. Так как соединения формулы 1 являются эффективными антагонистами рецептора брадикинина, эти соединения полезны при лечении большого разнообразия клинических состояний, которые характеризуются наличием избытка брадикинина. Таким образом, изобретение представляет способы лечения или профилактики физиологического нарушения, связанного с избытком брадикининов, этот способ содержит введение млекопитающему, при необходимости такого лечения, эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли, сольвата или пролекарства. Термин "физиологическое нарушение, связанное с избытком брадикининов", охватывает нарушения, ассоциированные с несоответствующей стимуляцией рецепторов брадикинина, несмотря на присутствие действенного количества брадикинина в месте локализации.
Эти физиологические нарушения могут включать такие нарушения, как ринит, астма, синдром раздраженной толстой кишки, язвенный колит, боль или восприятие повреждающих влияний, воспаление, периодонтит, ревматоидный артрит и остеомиелит. Известно также, что брадикинины играют важную роль в гомеостазе кровообращения, и поэтому антагонисты рецептора брадикинина могут быть полезны для регулирования кровяного давления и для лечения или профилактики гипертензии или гипотензии. Антагонисты рецептора брадикинина полезны также при лечении или профилактике эндотоксинового бактериально-токсического шока, который является следствием взаимодействия эндотоксина, продуцируемого стенками бактериальных клеток, с клетками ретикулоэндотелиальной системы.
Изобретение относится к медицине, в частности к терапии, и касается лечения патологических состояний, в развитии которых участвует, в том числе избыток брадикинина. Для этого предлагается использовать группу 2-фенил-3-ароилбензотиофенов в качестве антагонистов рецепторов брадикинина. Способ обеспечивает ингибицию патологического состояния с участием брадикинина. 2 з.п. ф-лы.
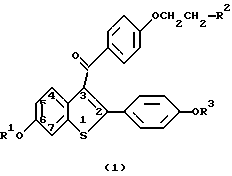
в которой R1 и R3 представляют независимо водород, -СН3, С(= O)-(C1-C6 алкил) или -С(= О)-Аr, где Ar представляет необязательно замещенный фенил;
R2 выбран из группы, состоящей из пирролидино, гексаметиленимино и пиперидино,
или его фармацевтически приемлемой соли или сольвата.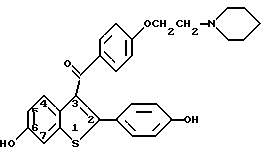
или его гидрохлоридную соль.
| Способ изготовления деревянных ложек | 1939 |
|
SU62503A1 |
| БЕРТРАМ Г.КАТЦУНГ Базисная и клиническая фармакология | |||
| - М.: Бином, 1998, ч.II, с.61-62 | |||
| TURNER C.H | |||
| et al - Endocrinology, 1994, Nov., 135(5), 2001-2005 | |||
| BLACK L.J | |||
| et al - J | |||
| Clin | |||
| Invest., 1994, Jan., 93(1) 63-9. | |||
Авторы
Даты
2002-04-10—Публикация
1995-10-19—Подача