Это изобретение относится к фармацевтическим композициям, способу приготовления таких композиций, использованию таких композиций для лечения и/или оценки степени развития болезни Паркинсона, продуктов и наборов реактивов для введения агониста дофамина (также называемого "допамин") и совместного введения агониста дофамина и антирвотного средства и/или опиоидного антагониста.
Болезнь Паркинсона представляет собой прогрессирующее нейродегенеративное нарушение, возникающее из-за потери клеточных тел дофаминэнергических нейронов из черного вещества (substantia nigra) и дегенерации нервных терминалей в полосатом теле (corpus striatum) на фоне низкого уровня дофамина в черном веществе и полосатом теле. Болезнь Паркинсона характеризуется хронической прогрессирующей дисфункцией активности, и ее главными симптомами являются тремор в покое, ригидность мускулатуры и снижение частоты произвольных движений (гипокинезия), сопровождающееся трудностями при ходьбе при окончании и начале движения, а также при выполнении повторов. Постоянный тремор накладывается на гипертонус групп мышц-антагонистов и начало движений становится все более трудным и медленным. В запущенных случаях движения больных становятся фактически "замороженными" и больные теряют способность передвигаться самостоятельно. Исследования показали, что симптомы болезни Паркинсона появляются тогда, когда содержание дофамина в полосатом теле снижается до 20-40% от нормального.
Так как болезнь Паркинсона связана с потерей дофамина полосатым телом, она обычно лечится препаратами, которые замещают дофамин, из них наиболее часто употребляется леводофа. Леводофа под действием дофадекарбоксилазы превращается в мозге в дофамин, и этот дофамин оказывает терапевтический эффект. Однако, несмотря на то, что леводофа хорошо всасывается тонким кишечником, значительная часть его инактивируется под действием моноаминооксидазы в стенках кишечника. Кроме того, период полужизни леводофа в плазме крови короток, и около 95% препарата превращается в дофамин в периферических тканях, где широко распространена дофадекарбоксилаза, в результате чего менее одного процента препарата поступает в мозг. Следовательно, леводофа должен вводиться часто и в больших дозах. Кроме того, образование дофамина в периферических ткнях вызывает появление нежелательных побочных эффектов. Таким образом, леводофа обычно назначается в комбинации с другими препаратами, увеличивающими действие леводофа на мозг и сводящими к минимуму его периферические эффекты. В частности, леводофа обычно применяется в комбинации с ингибитором активности дофадекарбоксилазы периферических тканей, неспособным пересечь гематоэнцефалический барьер, таким как карбидофа, который тормозит распад леводофа до дофамина вне мозга, снижая таким образом нежелательные периферические эффекты. Результатом действия ингибитора является также то, что относительно большое количество оральной дозы леводофа достигает мозга и таким образом становится возможным снижение дозы леводофа, что также снижает периферические побочные эффекты. Кроме того, периферический антагонист дофамина, который не проникает через гематоэнцефалический барьер, такой как домперидон, также может быть введен для снижения тошноты и рвоты как побочных эффектов леводофа.
В дополнение к отмеченным выше побочным эффектам, другие нежелательные явления связаны с продолжительным употреблением леводофа. В частности, у многих пациентов развиваются непроизвольные хорееподобные движения, которые являются результатом избыточной активации дофаминовых рецепторов. Эти движения обычно охватывают лицо и конечности и могут переноситься очень тяжело. Такие движения исчезают, если уменьшить дозу леводофа, но это вызывает возвращение ригидности. Более того, граница между желательными и нежелательными эффектами, по-видимому, постепенно становится все более узкой по мере того, как увеличивается время лечения леводофа. Традиционный метод борьбы с этим эффектом представляет собой увеличение частоты введения леводофа, сохраняя при этом постоянной суммарную дозу. Этот подход снижает ухудшение состояния при окончании введения дозы и уменьшает вероятность развития у пациентов дискинезии, которая появляется при высоких разовых дозах.
Еще одним осложнением при длительном лечении леводофа является развитие быстрых флуктуаций в клиническом состоянии пациента, когда происходят внезапные переходы от подвижности к неподвижности и, наоборот, в течение временных интервалов, колеблющихся от нескольких минут до нескольких часов. Этот феномен известен как "эффект включения и выключения", где состояние "включения" является предпочтительным состоянием, в течение которого может быть достигнута практически нормальная работа моторных функций, и где состояние "выключения" характеризуется дистоническими позами в течение периодов пониженной подвижности. Действительно, в результате этого влияния может возникать такая внезапная потеря подвижности, что больной может резко остановиться при ходьбе или быть не в состоянии подняться со стула, на который он нормально сел несколько минут назад. На этот эффект обычно не оказывают действия манипуляции с дозами леводофа, и может потребоваться лечение альтернативными препаратами.
В дополнение к отмеченным выше побочным эффектам при длительном применении леводофа найдено, что эффективность леводофа постепенно снижается с увеличением времени его использования до тех пор, пока он не становится полностью неэффективным. Наблюдалось также увеличение количества случаев злокачественной меланомы у пациентов, подвергавшихся лечению леводофа, и в связи с этим предполагается, что лечение леводофа может иметь отношение к развитию злокачественной меланомы. Таким образом, использование леводофа для лечения болезни Паркинсона далеко от идеала.
Альтернативным подходом к лечению болезни Паркинсона является использование лекарств, которые обладают дофаминоподобным эффектом. Такие лекарства в общем виде известны как агонисты дофамина, потому что они прямо стимулируют дофаминовые рецепторы в области нигростриатумного тракта при дефиците в нем дофамина. В отличие от леводофа агонисты дофамина не нуждаются в превращении в мозге в активные соединения. Агонисты дофамина эффективны также у пациентов с далеко зашедшими стадиями болезни Паркинсона, когда леводофа уже становится неэффективным, потому что они (агонисты) действуют прямо на дофаминовые рецепторы и на них не сказывается наличие недостатка дофаминпродецирующих нервных клеток у таких больных. Однако действие таких агонистов дофамина на дофаминовые рецепторы также вызывает нежелательные дофаминоэргические эффекты, такие как тошнота, рвота и экстрапирамидальные эффекты, которые могут ослаблять здоровье, и некоторые агонисты дофамина, такие как апоморфин, связаны, особенно при использовании в больших дозах, с дополнительными нежелательными побочными эффектами, такими как седативное действие, угнетение дыхания, гипотензия, брадикардия, потение и зевание.
На тяжесть и природу побочных эффектов может влиять способ введения лекарства. Например, при исследовании действия апоморфина изучались различные способы введения этого препарата. Однако при оральном введении таблеток апоморфина требуется вводить большие дозы для достижения необходимого терапевтического эффекта, так как апоморфин, введенный таким путем, подвергается интенсивному метаболизму в тонком кишечнике и/или печени до поступления в системную циркуляцию (эффект первичного прохождения). Кроме того, исследования длительного действия таких вводимых орально форм прекращались через 7-10 дней из-за необъяснимого повышения в крови азота мочевины. Сублингвальное введение таблеток апоморфина вызывало тяжелый стоматит при положительном употреблении с появлением изъязвления слизистой щек у половины пациентов при таком способе лечения. Интраназальное введение вызывало временную блокаду носового дыхания, чувство ожога и разбухание носа и губ, и у некоторых обследуемых пациентов должно было быть прекращено, принимая во внимание появление химически индуцированного воспаления слизистой носа. Таким образом, единственным удовлетворительным путем введения апоморфина, при котором можно избежать высокой степени метаболизма при первичном поступлении, как было показано, является подкожное введение, и, таким образом, единственным коммерчески доступным препаратом апоморфина является жидкий препарат для подкожного введения или подкожной инфузии. Даже в этом случае подкожное введение не дает возможности избежать побочных эффектов обычных агонистов дофамина, таких как тошнота и рвота, и подкожное введение, будь это инъекция или инфузия, нелегко для выполнения, особенно у пациентов, чьи моторные функции уже нарушены, и в этой связи требуется обучение пациентов и персонала уходу за больными. Кроме того, место введения должно меняться каждые 12 часов для сведения к минимуму риска изменения цвета кожи и образования узелков. С точки зрения этих проблем не удивительно, что использование агонистов дофамина, таких как апоморфин, в лечении болезни Паркинсона чаще всего приурочено к терапии в период "выключения", вызванного лечением леводофа, несмотря на очевидные клинические преимущества таких препаратов над леводофа.
Из сказанного выше кажется очевидным, что было бы крайне желательно с клинической точки зрения найти путь для введения агонистов дофамина, таких как апоморфин, который был бы прост для введения пациенту, снижая в связи с этим необходимость наблюдения за введением, и который обходил бы метаболизм при первичном попадании в печень. Таким образом, настоящее изобретение представляет фармацевтическую композицию для орального введения, включающую носитель и агонист дофамина как активный компонент, характеризующийся в этом составе тем, что находится в быстродиспергирующейся лекарственной форме, предназначенной для быстрого высвобождения активного компонента в ротовой полости.
Обнаружено, что такие быстродиспергирующиеся лекарственные формы индуцируют прегастральную абсорбцию активного компонента, то есть происходит абсорбция активного компонента из той части пищеварительного пути, которая находится до желудка. Термин "прегастральная абсорбция" включает таким образом абсорбцию в слизистых щек, сублингвальную, орофарингеальную абсорбцию и абсорбцию в пищеводе. Агонисты дофамина, абсорбируемые путем такой прегастральной абсорбции, поступают непосредственно в системную циркуляцию, избегая таким образом метаболизма при первичном поступлении в печень. Таким образом, физиологическая доступность агонистов дофамина, абсорбируемых этим путем, может быть также увеличена. Это значит, что доза таких агонистов дофамина может быть снижена при все еще сохраняющемся его желательном лечебном действии и что это снижение дозы будет сопровождаться соответствующим снижением нежелательных побочных эффектов.
Кроме того, клинические исследования показали, что у 23-52% пациентов с болезнью Паркинсона наблюдаются трудности с глотанием и что такие пациенты имеют тенденцию пускать слюни. Таким образом, такие быстродействующие лекарственные формы имеют дополнительное преимущество в том, что они будут быстро диспергироваться во рту, сводя к минимуму таким образом отмеченные выше проблемы, так как совместно с ними не будут вводиться большие объемы воды. Таким образом, ожидается, что такие быстродиспергирующиеся лекарственные формы будут легче переноситься пациентами и облегчат их введение медицинским персоналом.
Один пример быстродиспергирующейся лекарственной формы описан в Патенте США 4855326, в котором расплавляемый волоконный агент-носитель, такой как сахар, комбинируется с активным компонентом и окончательной смеси придается волоконная форма в виде препарата "леденцовой нити". Волоконный продукт "леденцовой нити" затем уплотняется в быстродиспергирующуюся высокопористую твердую лекарственную форму.
Патент США 5120549 раскрывает быстродиспергирующуюся связующую систему, которая получена путем первичного затвердения связующей системы, растворенной в первом растворителе, и последующего контакта затвердевшего матрикса со вторым растворителем, легко смешивающимся с первым растворителем при температуре ниже точки затвердения первого растворителя; элементы, формирующие матрикс, и активный компонент плохо растворимы во втором растворителе, за счет чего преобладающая часть первого растворителя удаляется и формируется быстродиспергирующийся матрикс.
Патент США 5079018 раскрывает быстродиспергирующуюся лекарственную форму, которая включает пористую волоконную структуру растворимого в воде гидра тируемого геля или пенообразующего материала, предварительно гидратированного обработкой водой и затвердевшего в гидратированном состоянии в присутствии агента-отвердителя, и диспергированного с помощью жидкого органического растворителя при температуре около 0oС или ниже для освобождения пространства, занимаемого гидратирующей жидкостью.
Опубликованная международная заявка WO 93/12769 (PCT/JP93/01631) описывает быстродиспергирующиеся лекарственные формы очень низкой плотности, образованные путем формирования желе агара, жидких систем, содержащих элементы связующего матрикса и активный компонент, с последующим удалением воды с помощью сжатого воздуха или вакуумной сушки.
Патент США 5298261 описывает быстродиспергирующиеся лекарственные формы, представляющие собой частично слипшуюся сеть матрикса, который был высушен под вакуумом при температуре, превышающей температуру слипания матрикса. Тем не менее, предпочтительнее, чтобы матрикс по крайней мере частично высушивался при температуре ниже равновесной точки его замерзания.
Опубликованная международная заявка WO 91/04757 (PCT/US90/05206) описывает быстродиспергирующиеся лекарственные формы, которые содержат диспергирующий агент, индуцирующий образование пузырьков, предназначенный для образования пузырьков при контакте со слюной, что обеспечивает быстрое растворение лекарственной формы и рассеивание активного компонента в ротовой полости.
Термин "быстродиспергирующаяся лекарственная форма", таким образом, охватывает все типы лекарственных форм, описанных в предыдущих параграфах. Однако особенно предпочтительно, чтобы лекарственная форма представляла собой такую форму, как описано в патенте UK 1548022, и являлась твердой быстродиспергирующейся лекарственной формой, включающей волоконную структуру лекарственной формы и водорастворимый или водорассеивающийся носитель, который является инертным по отношению к активному компоненту; волоконная структура получается путем сублимации растворителя из состава, находящегося в твердой форме, этот состав включает в себя активный компонент и раствор носителя в растворителе.
Предпочтительно, чтобы состав согласно изобретению дисинтегрировался в течение от 1 до 60 секунд, более предпочтительно в течение от 1 до 30 секунд, особенно от 1 до 10 секунд и еще более предпочтительно от 2 до 8 секунд, при помещении его в ротовую полость.
В случае предпочтительного типа быстродиспергирующейся лекарственной формы, описанной выше, композиция предпочтительно должна содержать в дополнение к активному компоненту агенты, образующие матрикс, и компоненты вторичного назначения. Агенты, образующие матрикс, пригодные для использования в представленном изобретении, включают соединения - производные животных или растительных белков, такие как желатины, декстрины и соя, белки семян пшеницы и psyllium; камеди, такие как аравийская камедь, guar, агар и ксантан; полисахариды; альгинаты; карбоксиметилцеллюлозы, карагены (препараты красной водоросли Chondrus crispus); декстрины; пектины; синтетические полимеры, такие как поливинилпирролидон, и комплексы полипептид-белок или полисахаридные комплексы, такие как желатин-аравийская камедь.
Другие агенты, формирующие матрикс, пригодные для использования в представленном изобретении, включают сахара, такие как маннитол, декстроза, лактоза, галактоза и трегалоза; циклические сахара, такие как циклодекстрин, неорганические соли, такие как фосфат натрия, хлорид натрия и силикат аллюминия и амнокислоты, имеющие от 2 до 12 углеродных атомов, такие как глицин, L-аланин, L-аспарагиновая кислота, L-глутаминовая кислота, L-оксипролин, L-изолейцин, L-лейцин и L-фенилаланин.
В раствор или суспензию перед затвердеванием может быть включен один или более агентов, формирующих матрикс. Агенты, образующие матрикс, могут присутствовать как добавка к сурфактанту или использоваться вместо него. В дополнение к способности образовывать матрикс агенты, формирующие матрикс, могут быть использованы с целью поддержания дисперсного состояния какого-либо активного компонента в растворе или суспензии. Это особенно удобно в случае таких активных компонентов, которые недостаточно хорошо растворимы в воде и должны, следовательно, быть скорее суспендированы, чем растворены.
Компоненты вторичного назначения, такие как консерванты, антиоксиданты, сурфактанты, усилители вязкости, окрашивающие средства, вкусовые отдушки, модификаторы рН, подсластители или средства, маскирующие вкус, также могут быть включены в композицию. Пригодные окрашивающие средства включают красную, черную и желтую окиси железа, а также FD и С красители, такие как FD и С голубой 2 и FD и С красный 40, поставляемые Ellis и Everard. Пригодные вкусовые отдушки включают мятную, малиновую, лакричную, апельсиновую, лимонную, грейпфрутовую, карамельную, ванильную, вишневую и виноградную вкусовые отдушки и их комбинации. Пригодные модификаторы рН включают лимонную кислоту, винную кислоту, фосфорную кислоту, соляную кислоту и малеиновую кислоту. Пригодные подсластители включают аспартам, ацесульфам К и тауматик. Пригодные средства, маскирующие вкус, включают бикарбонат натрия, ионообменные смолы, циклодекстринсодержащие компоненты, адсорбируемые соединения или микроинкапсулированные активные соединения.
Предпочтительно, чтобы агонист дофамина был выбран из следующих соединений: 5,6,6а, 7-тетрагидро-6-метил-4Н-дибензо[dе, g] хинолин-10,11-диола (апоморфин), 5,6,6а, 7-тетрагидро-6-пропил-4Н-дибензо-[dе,g]хинолин-10,11-диола (N-пропилнорапоморфин), (5'α)-2-бромо-12'-окси-2'-(1-метилэтил)-5'-(2-метилпропил)эрготаман-3', 6', 18-трион (бромокриптин), 1-[(6-аллилэрголин-8β-ил)карбонил] -1-[3-(диметиламино)пропил] -3-этилмочевины (каберголин), N'-[(8α)-9,10-дидегидро-6-метилэрголин-8-ил] -N, N-диэтилмочевины (лизурид), [[(8β)-1,6-диметилэрголин-8-ил] метил] фенилметиловый эфир карбаминовой кислоты (метерголин), (4aR)-транс-3,4,4а, 5,6,10b-гексагидро-4-пропил-2Н-нафт[1,2-b]-1,4-оксазин-9-ол (наксаголид), 8-[(метилтио)метил]-6-пропилэрголин (перголид), 2-[4-(1,3-бензодиоксол-5-илметил)-1-пиперазинил]пиримидин (пирибедил), 4-[2-(дипропиламино)этил] индолин-2-он (ропинирол), N,N-диэтил-N'-[(8α)-6-метилэрголин-8-ил] мочевина (тергурид) и (±)-N,N-диэтил-N'-[(3R, 4aR*, 10aS*)-1,2,3,4,4а,5,10,10а -октагидро-6-окси-1-пропилбензо[g]хинолин-3-ил] сульфамид (хинаголид), их солей и их смесей. Более предпочтительно, чтобы агонистом дофамина был апоморфин или его соль, предпочтительно его кислая соль, особенно гидрохлорид.
Также предпочтительно, чтобы агонист дофамина присутствовал в композиции в количестве от 0,05 до 100 мг, предпочтительнее от 0,05 до 20 мг.
Точное количество активного компонента будет зависеть от выбранного агониста дофамина. Предпочтительно, чтобы величины суточной дозы агонистов дофамина, перечисленных выше, колебались в пределах, приведенных в табл.1.
Если требуется введение большой суточной дозы, она может быть введена в несколько приемов в виде меньших доз.
Как отмечено выше, агонисты дофамина вызывают побочные эффекты, такие как тошнота и рвота. Следовательно, предпочтительно, чтобы композиция изобретения вводилась в сочетании с антирвотным средством. Антирвотное средство удобнее вводить в той же композиции, что и агонист дофамина. В одном из предпочтительных вариантов композиция изобретения, как было отмечено выше, дополнительно включала антирвотное средство. В противоположном случае антирвотное средство может вводиться отдельно от агониста дофамина с помощью любого орального или парэнтерального способов введения, например с помощью таблеток, капсул, суспензий, суппозиториев, инфузий, инъекций и так далее, в подходящее время, то есть до, после или одновременно с введением агониста дофамина. Особенно предпочтительно, чтобы антирвотное средство составлялось в виде быстродиспергирующейся лекарственной формы по типу, описанному выше, где рассматривалось, что такая быстродиспергирующаяся лекарственная форма антирвотного средства действительно имеет много преимуществ, связанных с составлением таких композиций, которые позволяют увеличить биологическую доступность, уменьшить дозу, облегчить введение и так далее, как описано выше, хотя конкретные преимущества будут зависеть от природы выбранного противорвотного средства.
Предпочтительно, чтобы противорвотное средство присутствовало в композиции в количестве от 1 до 120 мг, более предпочтительно 1-60 мг. Однако точное количество противорвотного средства, которое должно быть введено пациенту, будет зависеть от его выбранного варианта. Пригодные антирвотные средства включают периферические антагонисты дофамина, такие как 5-хлоро-1-[1-[3-(2,3-дигидро-2-оксо-1Н-бензимидазол-1-ил)пропил] -4-пиперидинил] -1,3-дигидро-2Н-бензимидазол-2-он (домперидон) и его соли, а также антагонисты рецептора серотонина (5-НТ3), такие как эндо-1-метил-N-(9-метил-9-азабицикло[3.3.1] нон-3-ил)-lH-индазол-3-карбоксамид (гранисетрон), 1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил] -4Н-карбазол-4-он (ондансетрон), а также 1αН,5αН-тропан-3α-илиндол-3-карбоксилат (трописетрон) и их соли. Из них особенно предпочтительным является домперидон.
Предпочтительная суточная доза антирвотных средств, отмеченных выше, колеблется в интервалах, приведенных в табл.2).
Если требуется введение большой суточной дозы, она может быть введена в несколько приемов в виде меньших доз.
Апоморфин представляет собой опиумный алкалоид. Таким образом, как отмечено выше, когда апоморфин или другой алкалоид опиума или его синтетическое производное выбирается как агонист дофамина, дополнительные побочные эффекты, такие как седативное действие, угнетение дыхания, гипотензия, брадикардия, потение и зевание, будут наблюдаться в дополнение к тошноте и рвоте. Однако было обнаружено, что все эти побочные эффекты могут быть компенсированы введением опиоидного антагониста в сочетании с опиоидным агонистом дофамина. Опиоидный антагонист удобнее вводить в той же композиции, что и агонист дофамина. Таким образом, в другом предпочтительном варианте композиция изобретения, как отмечалось выше, дополнительно включает опиоидный антагонист. Такая композиция может также включать антирвотное средство как дополнение к агонисту дофамина и антагонисту опиоидов, хотя это несущественно, так как опиоидный антагонист также противодействует некоторым эффектам агониста дофамина, вызывающим рвоту. С другой стороны, опиоидный антагонист может вводиться отдельно от агониста дофамина с помощью любого орального или парэнтерального способов введения в подходящее время, то есть до, после или одновременно с введением агониста дофамина. Особенно предпочтительно, чтобы композиция опиоидного антагониста составлялась в виде быстродиспергирующейся лекарственной формы по типу, описанному выше, где рассматривалось, что такая быстродиспергирующаяся лекарственная форма опиоидного антагониста действительно имеет много преимуществ, связанных с составлением таких композиций, которые позволяют увеличить биологическую доступность, уменьшить дозу, облегчить введение и так далее, как описано выше, хотя конкретные выявляемые преимущества будут зависеть от природы выбранного опиоидного антагониста.
Предпочтительно, чтобы опиоидный антагонист присутствовал в композиции в количестве от 0,5 до 100 мг, более предпочтительно от 0,5 до 50 мг. Однако точное количество опиоидного антагониста, вводимого пациенту, будет зависеть от выбранного типа опиоидного антагониста. Пригодные опиоидные антагонисты включают 4,5-эпокси-3,14-дигидрокси-17-(2-пропенил)морфинан-6-он (налоксон) и 17-(циклопропилметил)-4,5-эпокси-3,14-дигидроксиморфинан-6-он (налтрексон) и их соли, особенно кислые соли, особенно их гидрохлориды. Предпочтительные пределы суточной дозы для налоксона составляют 0,25-10 мг, более предпочтительно 0,5-2 мг, и для налтрексона 10-100 мг, более предпочтительно 25-50 мг. Если требуется введение большой суточной дозы, она может быть введена в несколько приемов в виде меньших доз. В соответствие с другим вариантом изобретения предлагается метод для приготовления любой из фармацевтических композиций изобретения, как описано выше, который включает создание связи носителя с активным компонентом и/или с антирвотным средством, и/или опиоидным антагонистом.
В другом варианте изобретения предлагается использовать быстродиспергирующуюся лекарственную форму, предназначенную для быстрого высвобождения активного компонента в ротовой полости для ускорения поступления агониста дофамина. Предлагается также метод введения агониста дофамина пациенту, который включает помещение композиции в ротовую полость пациента, описанным выше способом.
Как отмечалось выше, композиция изобретения может быть использована для борьбы с проявлениями болезни Паркинсона. Соответственно в изобретении также предлагается композиция, как указывалось выше, для лечения болезни Паркинсона. Предлагается также способ для лечения болезни Паркинсона, который включает введение в ротовую полость пациента терапевтически эффективного количества композиции, как указывалось выше.
Кроме того, агонисты дофамина, особенно апоморфин, могут быть использованы для предсказания возможного ответа на леводофа у пациентов с болезнью Паркинсона. В соответствии с этим, в изобретении дополнительно предлагается композиция, как указывалось выше, для оценки степени выраженности болезни Паркинсона. Предлагается также метод для оценки степени выраженности болезни Паркинсона, который включает введение в ротовую полость пациента определенного количества композиции, как указывалось ранее, и определение степени выраженности клинического эффекта у данного пациента.
В другом варианте в изобретении предлагается использование композиции, как указывалось ранее, для производства медикамента для лечения и/или оценки степени выраженности болезни Паркинсона.
Как отмечалось ранее, обнаружено, что агонист дофамина может вводиться в сочетании в антирвотным средством и/или антагонистом опиоидов по имеющимся показаниям, но при этом антирвотное средство и/или антагонист опиоидов может вводиться различными способами, и индивидуальные компоненты могут вводиться в различной последовательности. В соответствии с другим вариантом изобретения предлагается набор для совместного введения композиции, включающий агонист дофамина, как указывалось ранее, и антирвотное средство и/или опиоидный антагонист. Например, набор может включать по крайней мере одну дозу быстродиспергирующейся лекарственной формы агониста дофамина в соответствии с изобретением, по крайней мере одну дозу лекарственной формы антирвотного средства и, если агонистом дофамина является алкалоид опиума, по крайней мере одну дозу лекарственной формы опиоидного антагониста вместе с инструкциями по введению этой дозы лекарственной формы. В предпочтительной форме набора антирвотное средство вводится до введения агониста дофамина. Для облегчения введения еще предпочтительнее, чтобы антирвотное средство и антагонист опиоидов, если он присутствует, предоставлялись в виде быстродиспергирующихся лекарственных форм типа описанных выше. Соответственно набор может включать комбинацию быстродиспергирующихся лекарственных форм, как указывалось ранее, предпочтительно с инструкциями по последовательности их введения. В особенно предпочтительной форме набор может включать блистерную упаковку, содержащую дозировку лекарственных форм композиции, как указывалось ранее. Предпочтительно, чтобы последовательность введения указанной дозировки лекарственных форм описывались на блистерной упаковке. Особенно предпочтительно, когда набор включает быстродиспергирующиеся лекарственные формы, содержащие апоморфин и домперидон и/или налаксон.
В соответствии с другим вариантом изобретения предлагается способ для совместного введения агониста дофамина и антирвотного средства и/или опиоидного антагониста пациенту, который включает введение в ротовую полость пациента композиции, содержащей агонист дофамина, как указывалось ранее, и введение антирвотного средства и/или опиоидного антагониста пациенту либо орально, либо парэнтерально. Предпочтительно, чтобы антирвотное средство и опиоидный антагонист, если он присутствует, также предоставлялись в виде быстродиспергирующихся лекарственных форм типа описанных выше, либо отдельно, либо в комбинации с агонистом дофамина, который также может быть введен в ротовую полость пациента.
Далее изобретение иллюстрируется следующими примерами.
Пример 1. Приготовление быстродиспергирующейся лекарственной формы апоморфина.
(а) Приготовление 2% диспергирующегося состава апоморфина гидрохлорида.
Желатин (792 г) и маннитол (594 г) диспергировали в порции очищенной воды (16 кг) путем осторожного смешивания в чане вакуумного смесителя. Смесь затем нагревали до 40±2oС и гомогенизировали в течение десяти минут. Смесь охлаждали до комнатной температуры (20-24oС). После охлаждения добавляли апоморфин гидрохлорид (360 г). Смесь гомогенизировали, обеспечивая растворение лекарства. Постепенно при перемешивании добавляли лимонную кислоту (166,32 г) до достижения рН раствора, равного 3,0. Оставшуюся воду (87,68 г) добавляли в смеситель и объем смеси гомогенизировали до достижения полного растворения.
(б) Приготовление 10-миллиграммовых доз апоморфина гидрохдорида.
500 мг 2% диспергирующегося состава апоморфина гидрохлорида, образованного после процедуры (а), смотри выше, расфасовывали в каждый из серийно приготовленных заранее блистеров, помещенных в лунки диаметром 16 мм. Оболочка блистера состояла из 200 мкм PVC (поливинилхлорида), покрытого PVdC (поливинилдихлоридом) из расчета 40 г на квадратный метр. Продукт немедленно замораживали в сосуде с жидким азотом. Замороженный продукт хранили при температуре ниже -20oС минимум в течение 12 часов перед высушиванием из замороженного состояния с помощью лиофильной сушки при температуре высушивания +10oС и давлении в камере 50 н/м2. Замороженные сухие единицы доз затем проверяли на наличие опасных дефектов и оставшиеся порции данной партии герметически упаковывали с помощью фольгового покрытия, состоящего из слоя бумаги и фольги (20 мкм алюминия). На блистерной упаковке каждой единицы дозы проставляли затем номер партии и упаковывали в предварительно приготовленный мешочек путем помещения в него пакетика и полного запаивания открытого конца мешочка. На каждом мешочке затем указывали номер продукта, номер партии, дату выпуска и название поставщика.
Каждая единица дозы имела состав, приведенный в табл.3.
Пример 2. Сравнительное фармакокинетическое исследование.
Целью этого исследования было сравнение биологической доступности апоморфина гидрохлорида после его введения либо оральным путем в виде быстродиспергирующейся лекарственной формы, приготовленной по методу, представленному в примере 1, либо введения коммерчески доступного состава путем подкожной инъекции (подкожное) 12 здоровым добровольцам. Проводили открытое, рандомизированное, сравнительное, 5-факторное перекрестное фармакокинетическое исследование.
Из-за свойств апоморфина индуцировать рвоту испытуемые предварительно получали домперидон как противорвотное средство. После предварительного приема домперидона в течение 2 дней случайные группы испытуемых получали следующие типы лечения апоморфином в течение последующих 5 дней:
5 мг апоморфина (половина единицы дозы из примера 1),
10 мг апоморфина (единица дозы из примера 1),
20 мг апоморфина (две единицы дозы из примера 1, введенные одновременно),
2,5 мг подкожная инъекция (Britaject) апоморфина в стенку брюшины,
10 мг апоморфина (одна единица дозы из примера 1) со следующим затем через 5 минут дополнительным введением
10 мг апоморфина (одна единица дозы из примера 1).
Образцы крови для фармакокинетического анализа собирали до введения дозы и с 6-часовым интервалом после введения каждой дозы апоморфина.
Оценку биологической доступности апоморфина проводили, используя фармакокинетический параметр AUC (область, отражающую кривую зависимости концентрации апоморфина в плазме от времени).
Дозы в 5 мг, 10 мг и 20 мг примера 1 вызывали дозозависимое увеличение биологической доступности апоморфина, оцененной с помощью AUC (см. табл. 4). Кроме того, получение двух 10-миллиграммовых доз с пятиминутным интервалом вызывало увеличение биологической доступности, превышающей таковую при единовременном применении дозы в 20 мг (см. фиг.1).
В примере 2 показано, что общая абсорбция апоморфина при введении его в виде быстрорассеивающейся лекарственной формы увеличивалась, когда доза в 20 мг вводилась как две порции по 10 мг с пятиминутным интервалом по сравнению с одновременным введением двух порций по 10 мг. Предполагается, что наблюдаемое увеличение абсорбции может быть обусловлено действием композиции на рН слюны рта, в которой лекарство должно раствориться до того, как произойдет прегастральная абсорбция.
Апоморфин является лекарством со свойствами основания, которое, как известно, проявляет оптимальную химическую стабильность в кислой среде. В этой связи композиции апоморфина обычно включают такие наполнители, как лимонная кислота, винная кислота или малеиновая кислота для создания максимальной химической стабильности. Не исключено, что эти наполнители могли бы вызвать снижение рН слюны, что может влиять на абсорбцию лекарства. Удивительно, но этот эффект можно свести к минимуму путем введения еще одной дозы через некоторый период времени.
В соответствии с другим вариантом изобретения, следовательно, предлагается фармацевтический продукт, включающий терапевтическую дозу фармацевтической композиции, содержащую агонист дофамина, как указывалось ранее, в которой терапевтическая доза композиции разделена по крайней мере на две порции, и фармацевтический продукт дополнительно включает инструкции, рекомендующие последовательно вводить по крайней мере две порции с определенным промежутком времени между введением каждой порции.
Изобретение также предлагает способ введения пациенту фармацевтического продукта, включающего терапевтическую дозу фармацевтической композиции, содержащую агонист дофамина, как отмечалось ранее, в которой указанная доза терапевтической композиции разделена по крайней мере на две порции и способ введения которой включает введение в ротовую полость пациента последовательно по крайней мере двух порций с определенным интервалом времени между введением каждой порции.
Предпочтительно, чтобы специфический интервал времени между введением каждой порции был в пределах от 2 до 15 минут, более предпочтительно от 5 до 10 минут. Предпочтительно также, чтобы инструкции по введению по крайней мере двух порций были описаны на пакете, содержащем эти порции. Более предпочтительно, чтобы по крайней мере две порции содержались в блистерной упаковке и предпочтительно, чтобы на ней помещались инструкции по введению.
В дополнительном варианте изобретения предлагается набор для введения композиции, содержащей агонист дофамина, как указано ранее, который включает по крайней мере первую и вторую обозначенные единицы лекарственных форм композиции и инструкции, отражающие временные интервалы последовательного введения обозначенных единиц лекарственных форм.
Изобретение также предлагает способ введения пациенту композиции, содержащей агонист дофамина, как указывалось ранее, включающий по крайней мере первую и вторую обозначенные единицы лекарственных форм композиции, данный способ включает последовательное введение указанных по крайней мере первой и второй обозначенных единиц лекарственных форм в ротовую полость пациента в соответствии с назначенной временной последовательностью.
Предпочтительно, чтобы временная последовательность была такова, чтобы включать интервал от 2 до 15 минут, более предпочтительно от 5 до 10 минут, который требуется для промежутка между введением первой и второй обозначенных единиц лекарственных форм. Предпочтительно, чтобы инструкции, определяющие временной интервал последовательного введения по крайней мере первой и второй обозначенных единиц лекарственных форм, были описаны на пакете, содержащем обозначенные единицы лекарственных форм. Особенно предпочтительно, чтобы обозначенные единицы лекарственных форм содержались в блистерной упаковке. Предпочтительно, чтобы на блистерной упаковке помещались инструкции.
Особенно предпочтительно, чтобы агонист дофамина, используемый как фармацевтический продукт или набор, как отмечалось ранее, представлял собой апоморфин, N-пропилнорапоморфин или их соли. Предпочтительно, чтобы каждая порция обозначенной единицы лекарственной формы содержала от 2,5 до 20 мг, более предпочтительно от 5 до 15 мг, особенно 10 мг апоморфина или его соли.
Еще один аспект данного открытия заключается в том, что абсорбция апоморфина может быть увеличена путем введения дозы в промежуток времени, когда рН слюны может поддерживаться в пределах нормальных физиологических колебаний в момент получения композиции апоморфина путем введения совместно с ней антацидной композиции. Это может быть или специально приготовленный состав, или коммерчески доступные композиции в виде таблеток или жидкого состава, такие как RennieTM, SettlersTM, BisodolTM, AludroxTM, AsilonTM, или RemegelTM. Антацид должен реагировать прямо с кислым наполнителем и предотвращать падение рН слюны, которое, как предполагается, снижает конечную абсорбцию апоморфина прегастральным отделом желудочно-кишечного тракта.
В соответствии с данным аспектом изобретения, таким образом, предлагается фармацевтический продукт или набор, как указывалось выше, который дополнительно содержит антацид.
Изобретение также предлагает способ введения агониста дофамина, фармацевтический продукт или обозначенные единицы лекарственных форм, содержащие агонист дофамина, как указывалось выше, способ совместного введения агониста дофамина и антирвотного средства и/или опиодного антагониста, как отмечалось выше, и способ лечения и/или оценки степени развития
болезни Паркинсона, как указывалось выше, все из которых включают дополнительный этап введения антацида в ротовую полость пациента. Антацид может вводиться непосредственно до или сразу после, или одновременно с введением агониста дофамина.
Предлагается также антацид, используемый для увеличения прегастральной абсорбции активного компонента композиции, содержащей агонист дофамина, как указывалось выше.
Пример 3. Исследование прегастральной абсорбции.
Целью настоящего исследования было сравнение биологической доступности 10 мг апоморфингидрохлорида после его орального введения как быстродиспергирующейся лекарственной формы (пример 1), помещенной в рот и способной к рассеиванию в нем, и при его заключении в твердую желатиновую капсулу и проглатывании капсулы целиком. Проводили открытое, случайное, сравнительное, 2-факторное перекрестное фармакокинетическое исследование 6 добровольцев.
Из-за наличия способности апоморфина вызвать рвоту испытуемые предварительно получали домперидон как противорвотное средство. После двухдневного получения домперидона рандомизированные группы испытуемых получали следующие варианты лечения апоморфином в два последующих дня:
10 мг апоморфина (пример 1)
10 мг апоморфина, заключенного в твердую желатиновую капсулу.
Образцы крови для фармакокинетического анализа отбирали перед введением апоморфина и через шестичасовые интервалы после каждой дозы апоморфина.
Оценку биологической доступности апоморфина проводили, используя фармакокинетический параметр AUC. Дозы в 10 мг (пример 1) вызывали профиль изменения концентрации апоморфина в плазме, сходный с наблюдаемым в примере 2 (см. фиг. 2). Однако та же композиция, заключенная в твердую желатиновую капсулу, вызывала при ее введении существенно сниженный профиль изменения концентрации апоморфина в плазме. Это отчетливо прослеживается по изменению фармакокинетического параметра AUC, который указывает на значительное снижение абсорбции в группе, получавшей инкапсулированный апоморфин (см. табл. 5).
Эти результаты подтверждают предположение о том, что апоморфин абсорбируется прегастрально при поступлении его в ротовую полость в виде быстродиспергирующейся лекарственной формы примера 1, так как, когда та же композиция вводится инкапсулированной (что должно предотвращать ее прегастральную абсорбцию), количество апоморфина, определяемого в плазме, становится существенно более низким.
Последующие примеры дополнительно иллюстрируют композиции, которые могут быть приготовлены с использованием процесса, описанного в примере 1.
Пример 4 (см. табл. 6).
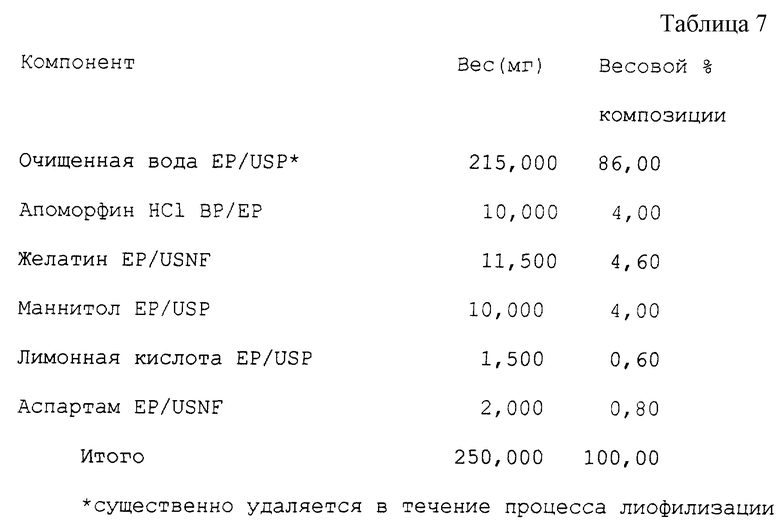
Пример 5 (см. табл. 7).
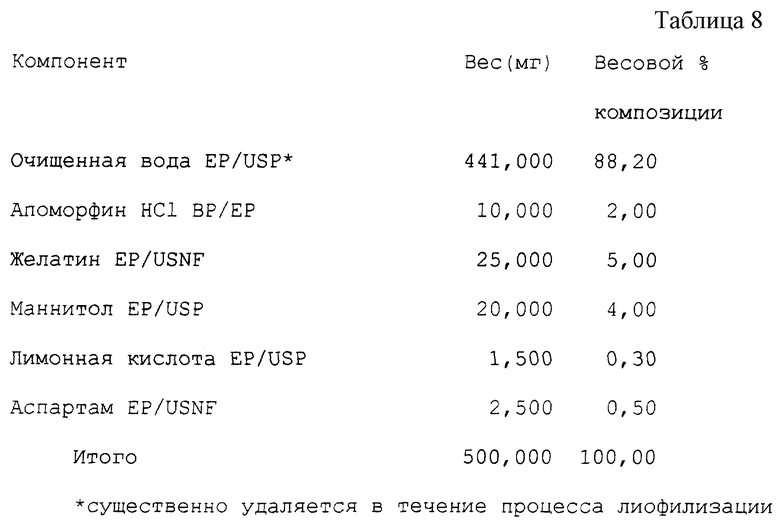
Пример 6 (см. табл. 8).
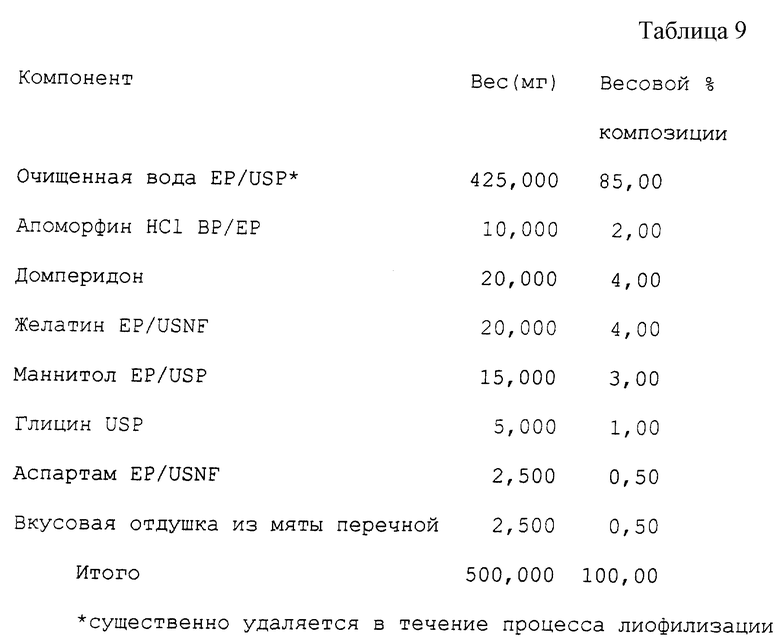
Пример 7 (см. табл. 9).
Пример 8 (см. табл. 10).
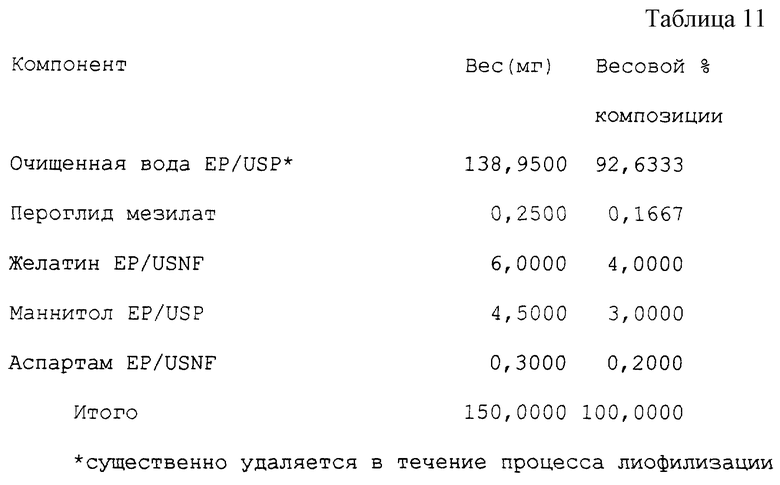
Пример 9 (см. табл. 11).
Пример 10 (см. табл. 12).
Пример 11 (см. табл. 13).
Пример 12 (см. табл. 14).
Пример 13 (см. табл. 15).
Пример 14 (см. табл. 16).
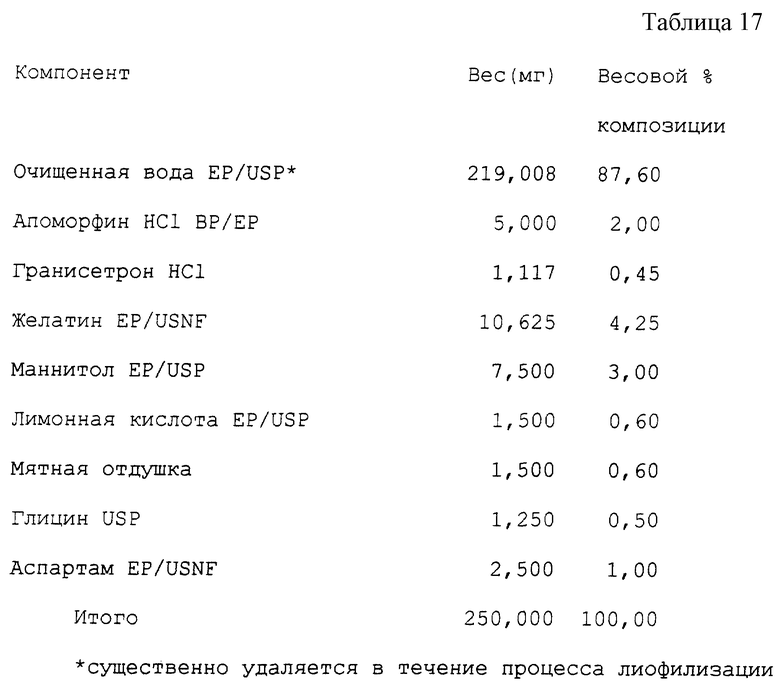
Пример 15 (см. табл. 17).
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННЫЕ ФОРМЫ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВА МУЖСКОЙ ЭРЕКТИЛЬНОЙ ФУНКЦИИ | 1998 |
|
RU2204413C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2009 |
|
RU2540470C9 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2008 |
|
RU2484823C2 |
| БЫСТРОДИСПЕРГИРУЮЩАЯСЯ ЛЕКАРСТВЕННАЯ ФОРМА, НЕ СОДЕРЖАЩАЯ ЖЕЛАТИН | 2000 |
|
RU2242968C2 |
| НОВЫЕ ПРИМЕНЕНИЯ | 2019 |
|
RU2836384C2 |
| ИОНОФОРЕТИЧЕСКАЯ ДОСТАВКА РОТИГОТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2003 |
|
RU2339372C2 |
| ИОНОФОРЕТИЧЕСКАЯ ДОСТАВКА РОТИГОТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2008 |
|
RU2478383C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ, ПРОФИЛАКТИКИ ИЛИ ОБЛЕГЧЕНИЯ ДВИГАТЕЛЬНЫХ РАССТРОЙСТВ И ЕЕ ПРИМЕНЕНИЕ | 2011 |
|
RU2611376C2 |
| ПЕРОРАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОДХОДЯЩАЯ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ДВИГАТЕЛЬНЫХ НАРУШЕНИЙ | 2013 |
|
RU2670272C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2017 |
|
RU2743513C2 |













Изобретение относится к области фармакологии и касается фармацевтической композиции для орального введения. Изобретение заключается в том, что композиция включает носитель и агонист дофамина как активный компонент, характеризующейся тем, что композиция представлена в виде быстродиспергирующейся лекарственной формы, предназначенной для быстрого высвобождения активного компонента в ротовой полости. Предлагаются также такие композиции, которые дополнительно содержат антирвотное средство и/или опиоидный антагонист. Кроме того, предлагается процесс для приготовления таких композиций, использование таких композиций для лечения и/или оценки степени развития болезни Паркинсона и терапевтические продукты и наборы для введения агониста дофамина и совместного введения агониста дофамина и антирвотного средства и/или опиоидного антагониста. Изобретение обеспечивает снижение нежелательных периферических эффектов. 10 с. и 16 з.п.ф-лы, 2 ил., 17 табл.
| RU 94046147 А1, 10.11.1996 | |||
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| 0 |
|
SU208447A1 | |
| МНОГОЦИЛИНДРОВЫЙ ДВИГАТЕЛЬ ВНУТРЕННЕГО СГОРАНИЯ С ПРИНУДИТЕЛЬНЫМ ЗАЖИГАНИЕМ | 1996 |
|
RU2173401C2 |
| DE 3831088 А1, 23.06.1988 | |||
| 0 |
|
SU263968A1 | |
Авторы
Даты
2002-09-20—Публикация
1996-08-16—Подача