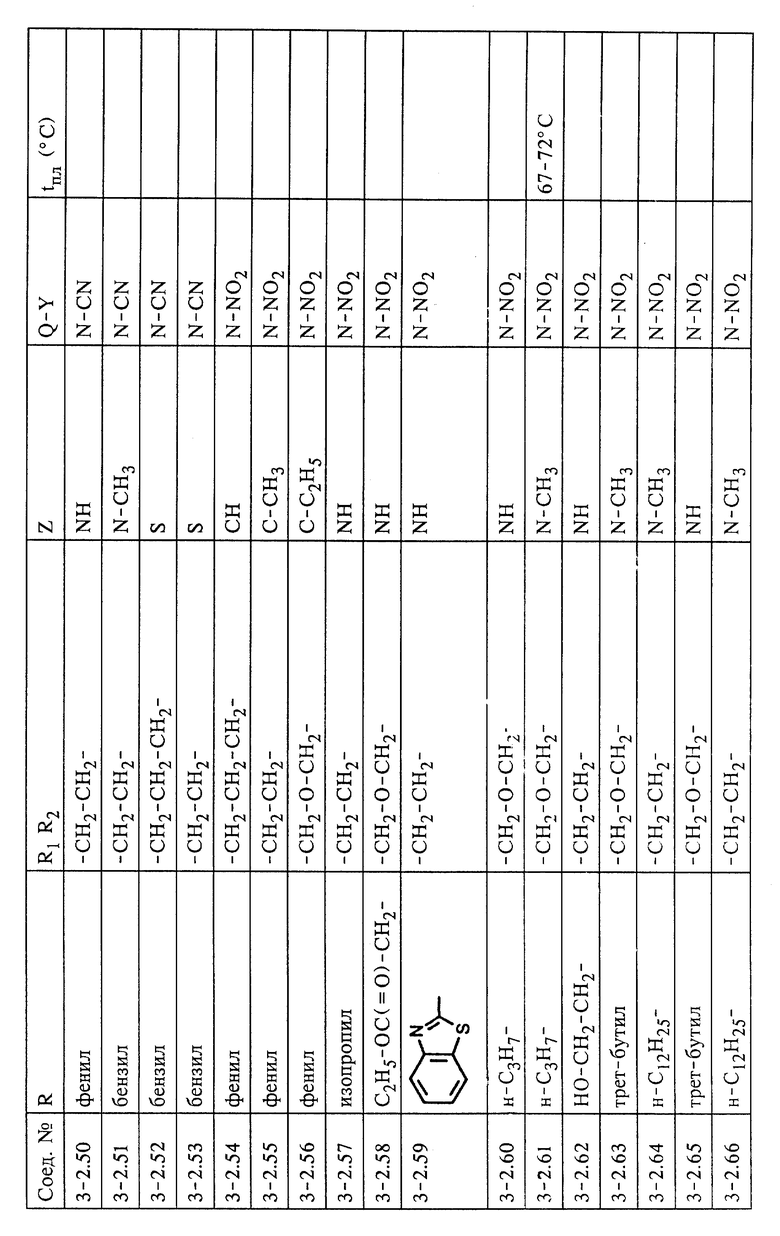
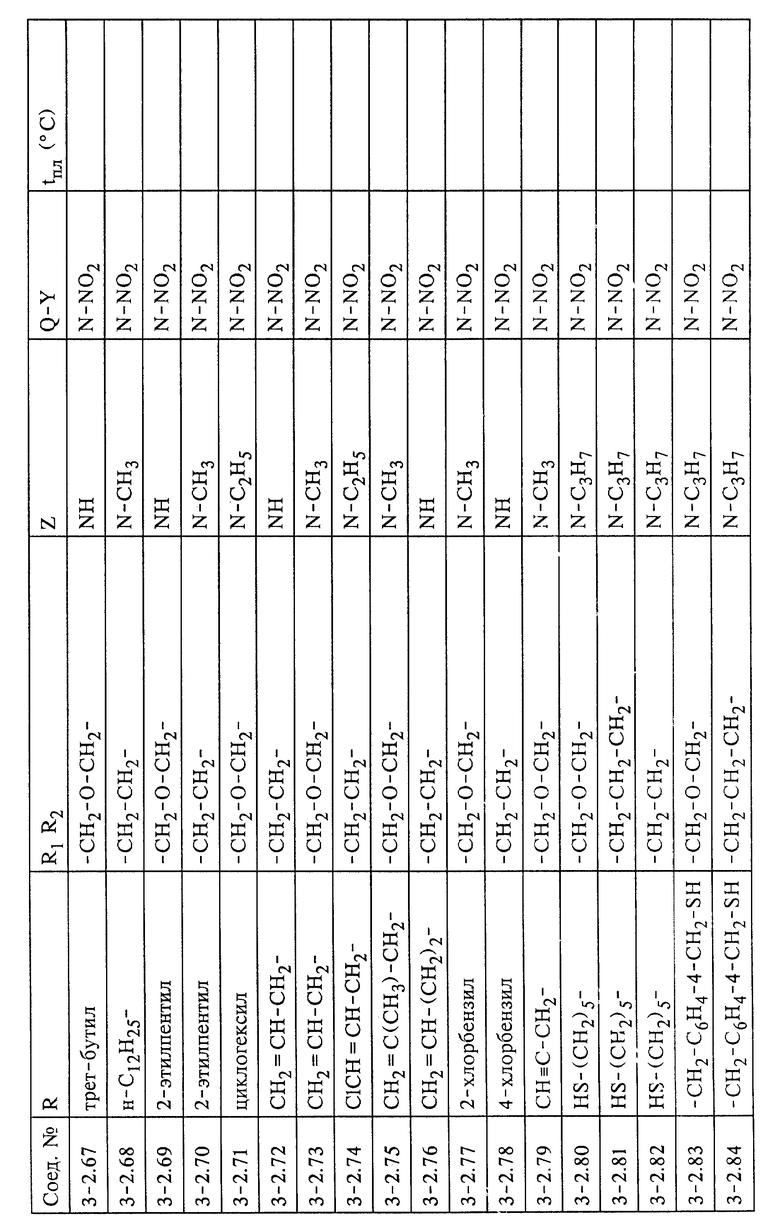
Изобретение относится к способу получения соединения формулы (I)
в каждом случае в свободной форме и в форме соли, где
Q означает СН или N,
Y означает NO2 или CN,
Z означает СНК3, О, NR3 или S,
R1 и R2 каждый независимо другг от друга означает водород, незамещенный или R4-замещенный С1-С8алкил, или они вместе образуют алкиленовый мостик из двух или трех углеродных атомов, причем упомянутый алкиленовый мостик может дополнительно содержать гетероатом, выбранный из группы, включающей NR5, О и S,
R3 означает Н или незамещенный или R4-замещенный C1-С12алкил,
R4 означает незамещенный или замещенный арил или гетероарил и
R5 означает Н или С1-С12алкил,
который включает превращение соединения формулы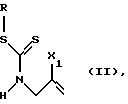
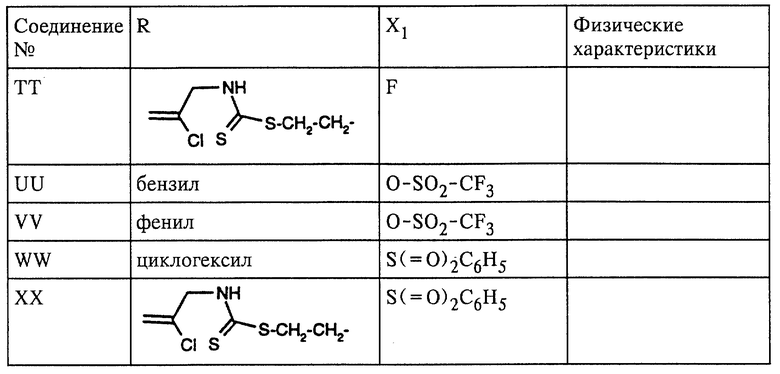
где R означает циклогексил, фенил, бензил или группу формулы
Х1 обозначает уходящую группу;
с помощью галогенирующего агента в соединение формулы
где Х означает галоген, а R и Х1 имеют значения, указанные для формулы (II),
превращение полученного соединения формулы (IV) путем взаимодействия с соединением формулы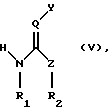
или, в случае применимости, его E/Z-изомера, смеси E/Z-изомеров и/или таутомера, в каждом случае в свободной форме и в форме соли, где R1, R2, Y, Z и Q имеют значения, указанные для формулы (I), в соединение формулы
в каждом случае в свободной форме и в форме соли, где R1, R2, Y, Z и Q имеют значения, указанные для формулы (I), a R имеет значения, указанные для формулы (II); и
превращение соединения формулы (VI) с помощью хлорирующего агента в соединение формулы (I).
Возможны и другие методы синтеза соединения формулы (I):
а) взаимодействие соединения формулы
и, в случае применимости, его E/Z-изомеров, смеси E/Z-изомеров и/или таутомеров, в каждом случае в свободной форме и в форме соли, которое известно или может быть получено известным способом, и где
R означает незамещенный или замещенный С1-С12алкил, незамещенный или замещенный С2-С4алкенил, незамещенный или замещенный С2-С4алкинил, незамещенный или замещенный С3-С6циклоалкил, незамещенный или замещенный арил, незамещенный или замещенный гетероциклил или -SR6, где
R6 означает незамещенный или замещенный С1-С12алкил, незамещенный или замещенный С2-С4алкенил, незамещенный или замещенный С2-С4алкинил, незамещенный или замещенный С3-С6циклоалкил, незамещенный или замещенный арил, незамещенный или замещенный гетероциклил, Х1 обозначает уходящую группу с галогенирующим агентом в присутствии основания, с образованием соединения формулы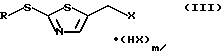
или, в случае применимости, его E/Z-изомера, смеси E/Z-изомеров и/или таутомера,
где R имеет указанные для формулы (II) значения,
m равно 0 или 1 и
Х обозначает галоген, или
б) превращение соединения формулы (IV) в отсутствие или в присутствии основания, предпочтительно в присутствии основания, в соединение формулы (III),
в) превращение соединения формулы (III) с помощью соединения формулы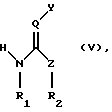
или, в случае применимости, его E/Z-изомера, смеси E/Z-изомеров и/или таутомера, в каждом случае в свободной форме и в форме соли, которое известно или может быть получено известным способом, и где R1, R2, Y, Z и Q имеют указанные выше для формулы (I) значения, в соединение формулы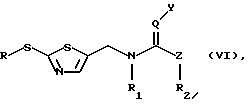
или, в случае применимости, в его E/Z-изомер, смесь E/Z-изомеров и/или таутомер, в каждом случае в свободной форме и в форме соли, которое известно или может быть получено известным способом, и где R1, R2, Y, Z и Q имеют указанные выше для формулы (I) значения, а R имеет указанные выше для формулы (II) значения, или
г) превращение соединения формулы (IV) при взаимодействии с соединением формулы (V) в соединение формулы (VI) и
д) превращение соединения формулы (VI) с помощью хлорирующего агента в соединение формулы (I),
и в каждом случае при необходимости превращение соединения формулы (I), полученного предлагаемым способом или другим методом, или его E/Z-изомера или таутомера, в каждом случае в свободной форме или в форме соли, в другое соединение формулы (I) или его E/Z-изомер или таутомер, в каждом случае в свободной форме или в форме соли, разделение смеси E/Z-изомеров, полученных предлагаемым способом, и выделение необходимого изомера и/или перевод свободной формы соединения формулы (I), полученного предлагаемым способом или другим методом, или его E/Z-изомера или таутомера в соль или перевод соли соединения формулы (I), полученной предлагаемым способом или другим методом, или его E/Z-изомера или таутомера в соединение формулы (I) в свободной форме, его E/Z-изомер или таутомер либо в другие соли.
Методы синтеза соединений формулы (I) описаны в литературе. Однако было установлено, что получение промежуточных веществ, которые должны использоваться в способах синтеза, известных из литературы, представляет проблему из-за высокого уровня токсичности этих соединений. Кроме того, количественное отделение этих веществ от активного соединения требует больших затрат. В связи с этим известные способы получения активных соединений неудовлетворительны и требуют усовершенствования.
Некоторые соединения формул (I), (II), (III), (IV), (V) и (VI) содержат асимметричные атомы углерода, в результате чего эти соединения могут существовать в оптически активной форме. Формулы (I)-(VI) включают все возможные изомерные формы, а также их смеси, например рацематы или смеси E/Z-изомеров.
Общие термины, используемые выше, и в последующем имеют следующие значения, если не указано иное.
Если не указано иное, каждая из углеродсодержащих групп или соединений содержит от 1 до 8, предпочтительно от 1 до 6, прежде всего от 1 до 4, более предпочтительно 1 или 2 углеродных атомов.
Алкил как самостоятельная группа или структурный элемент других групп и соединений, таких как галоидалкил, арилалкил или гидроксиалкил, является в каждом случае в соответствии с числом углеродных атомов, содержащихся в данной группе или соединении, линейной группой, например, метил, этил, пропил, бутил, пентил (амил) или гексил, или разветвленной группой, например, изопропил, изобутил, втор-бутил, трет-бутил, изопентил (изоамил), неопентил или изогексил.
Алкенил как самостоятельная группа или структурный элемент других групп и соединений, таких как галоидалкенил или арилалкенил, в каждом случае в соответствии с числом углеродных атомов, содержащихся в данной группе или соединении, является линейной группой, например, винил, 1-метилвинил, аллил, 1-бутенил или 2-гексенил, или разветвленной группой, например, изопропенил.
Алкинил как самостоятельная группа или структурный элемент других групп и соединений, таких как галоидалкинил, в каждом случае в соответствии с числом углеродных атомов, содержащихся в данной группе или соединении, является линейной группой, например, пропаргил, 2-бутинил или 5-гексинил, или разветвленной группой, например, 2-этинилпропинил или 2-пропаргил-изопропил.
С3-С6циклоалкил означает циклопропил, циклобутил, циклопентил или циклогексил, прежде всего циклогексил.
Арил означает фенил или нафтил, прежде всего фенил.
Гетероциклил означает 5-7-членную моноциклическую насыщенную или ненасыщенную структуру, содержащую от одного до трех гетероатомов, выбранных из группы, включающей N, О и S, прежде всего N и S, или бициклическую структуру, которая может содержать только в одном кольце, например, таком как тиазолил, тиазолинил, тиазолидинил, пирролил, пирролинил, пирролидинил, хинолинил, хиноксалинил, индолинил, бензотиофенил или бензофуранил, или в двух кольцах, например, таких, как птеридинил или пуринил, независимо друг от друга один или более гетероатомов, выбранных из N, О, S. Предпочтительны тиазолил, тиазолинил, пиридил, пиримидинил и бензотиазолил. Гетероарил означает ароматическую моноциклическую структуру или бициклическую структуру типа определенных выше.
Упомянутые гетероциклильные кольца необязательно могут иметь в зависимости от свойств циклической системы от одного до трех заместителей, выбранных из группы, включающей галоген, С1-С4алкил, галоген -С1-С4алкил и Х1, где Х1 определен ниже. Предпочтительны хлор и -CH2Cl.
Галоген как самостоятельная группа или как структурный элемент других групп и соединений, таких как галоалкил, галоалкенил и галоалкинил, означает фтор, хлор, бром или иод, прежде всего фтор, хлор или бром, более предпочтительны хлор или бром, наиболее предпочтителен хлор.
Галоидзамещенные группы и соединения, например, галоидалкил или галоидалкенил, могут быть частично или полностью галогенированы, при этом в случае полигалогенирования галоидные заместители могут быть идентичными или разными. Примерами галоидалкилов как самостоятельных групп или структурных элементов других групп и соединений, таких как галоидалкенил, являются метильные группы, содержащие от одного до трех атомов фтора, хлора и/или брома, например, CHF2 или СF3; этильная группа, включающая от одного до пяти атомов фтора, хлора и/или брома, например, CH2CF3, CF2CF3, СF2СCl3, CF2CHCl2, CF2CHF2, CF2CFCl2, CF2CHBr2, CF2CHClF, CF2CHBrF или CClFCHClF; пропил или изопропил, содержащие от одного до семи атомов фтора, хлора и/или брома, например, CH2CHBrCH2Br, СF2СНРСF3, CH2CF2CF3, СH(СF3)2; бутил или его изомер, включающие от одного до девяти атомов фтора, хлора и/или брома, например, CF(CF3)CHFCF3 или CH2(CF2)2CF3. Галоидалкенил представляет собой, например, СН2СН=СНСl, СН2СН=ССl2, CH2CF=CF2 или СН2СН=CHCH2Вг.
Под уходящей группой Х1 выше и в последующем подразумеваются известные специалистам в данной области техники атомы и группы, которые могут отщепляться в ходе химической реакции. Предпочтительно такими уходящими группами являются галогены, например фтор, хлор, бром и иод, -O-С(=O)-А, -O-Р(=O)(-А)2, -O-Si(C1-C8алкил)3, -O-(C1-C8алкил), -O-арил, -O-S(=O)2A, -S-P(=O)(-A)2, -S-P(= S)(-A)2, -S-S-(C1-C8алкил), -S-S-арил, -S-(С1-С8алкил), -S-арил, -S(= O)A или -S(= O)2A, где А означает С1-С8алкил, С2-С8алкенил, С2-С8алкинил, арил или бензил, которые могут быть замещенными или незамещенными, С1-С8алкокси или ди(С1-С8алкил)амин, в котором алкильные группы представлены независимо, NО3, NO2, сульфат, сульфит, фосфат, фосфит, карбоксил, иминоэфир, N2 или карбамат. В качестве уходящей группы предпочтительны хлор и бром, прежде всего хлор. Другие предпочтительные уходящие группы приведены в примерах.
Некоторые соединения формул (I), (V), (VI) могут существовать в форме таутомеров. Поэтому выше и в последующем под соединениями формул (I), (V), (VI) следует понимать также соответствующие таутомеры, даже если стереохимия соединений не обсуждается в каждом конкретном случае.
Соединения формул (I), (II), (III), (V) и (VI), которые имеют по крайней мере один основный центр, могут образовывать кислотно-аддитивные соли, например, с сильными неорганическими кислотами, такими как минеральные кислоты, например перхлорная, серная, азотистая, азотная, фосфорная или галогенводородная кислота, с сильными органическими карбоновыми кислотами, такими как незамещенные и замещенные, например галогензамещенные, С1-С4алканкарбоновые кислоты, например уксусная кислота, насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевая, малоновая, янтарная, малеиновая, фумаровая или фталевая кислоты, гидроксикарбоновые кислоты, например аскорбиновая, молочная, яблочная, винная или лимонная кислоты, или бензойная кислота либо органические сульфокислоты, незамещенные или замещенные, такие как галогензамещенные С1-С4алкан- или арилсульфокислоты, например, метан- или паратолуолсульфокислота. Кроме того, соединения формул (I), (II), (III), (IV), (V) и (VI), имеющие по крайней мере одну кислотную группу, могут образовывать соли с основаниями. Приемлемыми солями являются, например, соли металлов, такие как соли щелочных и щелочно-земельных металлов, например натриевые, калиевые или магниевые соли, или соли аммония или органического амина, например морфолина, пиперидина, пирролидина, моно-, ди- или три-гидрокси-(низш.)алкиламинов, например этил-, диэтил-, триэтил- или диметилпропиламин, или моно-, ди- или тригидрокси(низш.)алкиламинов, например, моно-, ди- или триэтаноламин. Кроме того, могут образовываться внутренние соли. Выше и в последующем под соединениями формул (I)-(VI) следует понимать соединения формул (I)-(VI) как в свободной форме, так и форме солей. То же самое относится к таутомерам соединений формул (I), (V), (VI) и их солям. В случае соединений формул (I)-(III), (V) и (VI) речь идет предпочтительно о способе получения этих соединений в свободной форме.
В предпочтительном варианте в настоящем изобретении предлагается способ получения соединения формулы (I), где
(1) R1 и R2 в соединениях формул (I), (V) и (VI) каждый независимо друг от друга означает водород или С1-С4алкил или вместе образуют алкиленовый мостик, который содержит 2 или 3 углеродных атома и который дополнительно может содержать геторатом, выбранный из группы, включающей О и S, или может содержать группу NR5, где R5 означает Н или C1-C4алкил;
(2) R в соединениях формул (II), (III), (IV) и (VI) означает фенил;
(3) Х в соединении формулы (IV) является атомом хлора или брома.
Реакции на описанных выше стадиях проводят в принципе в известных условиях, например, в отсутствие или обычно в присутствии соответствующего растворителя или разбавителя или их смеси, при необходимости реакцию проводят при пониженной температуре, при комнатной температуре или при нагревании, например, в диапазоне температур от -80oС до температуры кипения реакционной смеси, предпочтительно от примерно -20oС до примерно +120oС, прежде всего от 20oС до 80oС, и в случае необходимости в закрытом реакторе, под давлением, в атмосфере инертного газа и/или в безводной среде. Наиболее оптимальные условия проведения реакций приведены в примерах.
В каждом случае реагенты могут взаимодействовать друг с другом в отсутствие растворителей или разбавителей, например в расплавленном состоянии. Однако в большинстве случаев целесообразно добавлять инертный растворитель или разбавитель или их смесь. Примерами таких растворителей и разбавителей являются ароматические, алифатические и алициклические углеводороды и галогенированные углеводороды, такие как бензол, толуол, ксилол, мезитилен, тетралин, хлорбензол, дихлорбензол, бромбензол, нитробензол, нитрометан, петролейный эфир, гексан, циклогексан, дихлорметан (хлористый метилен), трихлорметан (хлороформ), тетрахлорметан (четыреххлористый углерод), дихлорэтан, трихлорэтилен или тетрахлорэтилен, сложные эфиры, такие как этилацетат, метилацетат, диметикарбонат, диэтилкарбонат, этоксиэтилацетат, метоксиэтилацетат, этилформиат, простые эфиры, такие как диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, диметоксидиэтиловый эфир, тетрагидрофуран или диоксан, кетоны, такие как ацетон, метилэтилкетон или метилизобутилкетон, спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, этиленгликоль или глицерин, амиды, такие как N,N-диметилформамид, N,N-диэтилформамид, N,N-диметилацетамид, N-метилпирролидон или триамид гексаметилфосфорной кислоты, нитрилы, такие как ацетонитрил или пропионитрил, сульфоксиды, такие как диметилсульфоксид, или смесь указанных растворителей. Если реакцию проводят в присутствии основания, например, триэтиламина, пиридина, N-метилморфолина или N,N-диэтиланилина, сами основания, присутствуя в избытке, выполняют функцию растворителя или разбавителя. Растворители, наиболее пригодные для проведения упомянутых реакций, указаны в примерах.
Стадия а)
Реакцию предпочтительно проводят при температуре в диапазоне от -40oС до 160oС, прежде всего от -20 до 100oС, обычно от -20 до 25oС.
В предпочтительных условиях реакции в качестве инертных растворителей используют такие, как алифатические или ароматические углеводороды, галогенированные углеводороды, низшие карбоновые кислоты, сложные эфиры, нитрилы, амиды, простые эфиры, например, петролейный эфир, пентан, гексан, гептан, хлорбензол, хлористый метилен, хлористый этилен, бромхлорметан, хлороформ, четыреххлористый углерод, тетрахлорэтилен, уксусная кислота, этилацетат, ацетонитрил, диметилформамид, диметилацетамид, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан или их смесь, обычно хлорбензол, хлористый метилен, бромхлорметан, этилацетат, ацетонитрил, нитробензол, нитрометан или смесь указанных растворителей.
При необходимости в реакционную смесь можно добавлять воду или основание. Основаниями, которые добавляют для ускорения реакции, являются, например, гидроксиды щелочных или щелочно-земельных металлов, гидриды, амиды, алканоляты, ацетаты, карбонаты, диалкиламиды или алкилсилиламиды, алкиламины, алкендиамины, свободные или N-алкилированные, насыщенные или ненасыщенные циклоалкиламины, основные гетероциклы, гидроксиды аммония, а также карбоциклические амины. Примерами таких оснований являются гидроксид натрия, гидрид натрия, метанолят натрия, ацетат натрия, карбонат натрия, трет-бутанолят калия, гидроксид калия, карбонат калия, гидрид калия, диизопропиламид лития, бис(триметилсилил)амид калия, гидрид кальция, триэтиламин, диизопропилэтиламин, триэтилендиамин, циклогексиламин, N-циклогексил-N,N-диметиламин, N, N-диэтиланилин, пиридин, 4-(N,N-диметиламино) пиридин, хинуклидин, N-метилморфолин, бензилтриметиламмоний гидроксид и 1,5-диазабицикло[5.4.0]ундец-5-ен (ДБУ). Предпочтительными добавками являются гидрокарбонат натрия и вода. На этой стадии в основном получают свободное соединение формулы (III) (m=0). Однако во многих случаях соединения формулы (III) могут быть получены в виде гидрогалогенидов, например, с целью упрощения процесса выделения. Гидрогалогениды формулы (III), где m=1, затем могут быть превращены в свободное соединение формулы (III) с помощью добавления основания или альтернативно при повышенной температуре без добавления основания, предпочтительно от 40oС до 140oС. Прежде всего приемлемыми галогенирующими агентами являются хлор, бром, иод, РОСl3, РСl3, РСl5, SO2Cl2 или SO2Br2, предпочтительны хлор, бром или SO2Cl2.
Заявленный способ
В отношении используемых растворителей и температуры реакцию проводят в аналогичных условиях, описанных на стадии а), однако без добавления основания.
Реакцию предпочтительно проводят при нормальном давлении.
Время реакции не имеет решающего значения и предпочтительно составляет от 0,1 до 24 ч, прежде всего от 0,5 до 6 ч.
Продукт реакции выделяют с использованием известных методов, например фильтрованием, кристаллизацией, дистилляцией или хроматографией или с помощью приемлемого сочетания указанных методов.
Стадия б)
Используемые на этой стадии растворители и основания подробно описаны на стадии а).
Реакцию предпочтительно проводят при температуре от примерно 0oС до примерно +180oС, прежде всего от примерно +10oС до примерно +80oС, во многих случаях от комнатной температуры до температуры дефлегмации растворителя. В наиболее предпочтительном варианте осуществления стадии б) соединение формулы (IV) вступает в реакцию при температуре от 0oС до 120oС, прежде всего от 20oС до 80oС, предпочтительно от 30oС до 60oС, в сложном эфире, прежде всего в диметилкарбонате, предпочтительно в присутствии основания, прежде всего К2СО3.
Реакцию предпочтительно проводят при нормальном давлении.
Время реакции не имеет решающего значения и предпочтительно составляет от 0,1 до 48 ч, прежде всего от 0,5 до 12 ч.
Продукт реакции выделяют с использованием известных методов, например, фильтрованием, кристаллизацией, дистилляцией или хроматографией или с помощью приемлемого сочетания указанных методов.
Стадии в) и г)
С целью ускорения реакции обычно используют основания, описанные на стадии а).
Реагенты могут взаимодействовать друг с другом без добавления растворителя или разбавителя, например, в расплавленном состоянии. Однако в большинстве случаев целесообразно добавлять растворитель или разбавитель. Примерами таких растворителей или разбавителей являются вода, ароматические, алифатические и алициклические углеводороды и галогенированные углеводороды, например, бензол, толуол, ксилол, мезитилен, тетралин, хлорбензол, дихлорбензол, бромбензол, петролейный эфир, гексан, циклогексан, дихлорметан, трихлорметан, четыреххлористый углерод, дихлорэтан, трихлорэтилен или тетрахлорэтилен, сложные эфиры, такие как этилацетат, метилацетат, диметилкарбонат, диэтилкарбонат, метилформиат, этилформиат, этоксиэтилацетат, метоксиэтилацетат, простые эфиры, такие как диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, диметоксидиэтиловый эфир, тетрагидрофуран или диоксан, кетоны, такие как ацетон, метилэтилкетон, метилизопропилкетон или метилизобутилкетон, спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, этиленгликоль или глицерин, амиды, например, N,N-диметилформамид, N,N-диэтилформамид, N,N-диметилацетамид, N-метилпирролидон или триамид гексаметилфосфорной кислоты, нитрилы, такие как ацетонитрил или пропионитрил, сульфоксиды, такие как диметилсульфоксид, или смеси указанных растворителей. Если реакцию проводят в присутствии основания, например, триэтиламина, пиридина, N-метилморфолина или N,N-диэтиланилина, сами основания, присутствуя в избытке, выполняют функцию растворителя или разбавителя.
В альтернативном варианте реакцию можно проводить в гетерогенной двухфазной смеси, например, в смеси органических растворителей или в смеси органического растворителя и водной фазы, при необходимости в присутствии межфазного катализатора, например, краун-эфира или соли тетраалкиламмония.
В предпочтительном варианте осуществления стадии в) реакцию проводят при температуре от 0oС до +180oС, прежде всего от +10oС до +80oС, во многих случаях от комнатной температуры до температуры дефлегмации растворителя. В предпочтительном варианте осуществления стадии в) соединение формулы (III) взаимодействует с соединением формулы (Y) при температуре от 0oС до 120oС, прежде всего от 20oС до 80oС, предпочтительно от 60oС до 80oС, в амиде, предпочтительно в N, N-диметилформамиде, предпочтительно в присутствии основания, прежде всего К2СО3.
Реакцию предпочтительно проводят при нормальном давлении.
Время реакции не имеет решающего значения и предпочтительно составляет от 0,1 до 48 ч, прежде всего от 0,5 до 12 ч, наиболее предпочтительно от 3 до 12 ч.
Продукт реакции выделяют с использованием известных методов, например фильтрования, кристаллизации, дистилляции или хроматографии или с помощью приемлемого сочетания указанных методов.
Выход полученных соединений обычно достаточно высокий и часто составляет 80% от теории.
Предпочтительные условия реакции описаны в примерах.
На стадии г) реакцию проводят в условиях, описанных на стадии в), однако в реакционную смесь добавляют дополнительный эквивалент основания типа описанных на стадии а), при этом добавляют по крайней мере три молярных эквивалента основания.
В предпочтительном варианте осуществления стадии г) соединение формулы (IV) взаимодействует с соединением формулы (V) при температуре от 0oС до 120oС, прежде всего от 20oС до 80oС, предпочтительно от 30oС до 60oС, в кетоне, предпочтительно в метилэтилкетоне, предпочтительно в присутствии основания, прежде всего K2CO3, предпочтительно в присутствии межфазного катализатора, прежде всего 1-(хлорметил)-4-аза-1-азонийбицикло [2.2.2] октанхлорида.
В другом предпочтительном варианте осуществления стадии г) соединение формулы (IV) взаимодействует с соединением формулы (V) при температуре от 0oС до 120oС, прежде всего от 20oС до 80oС, предпочтительно от 30oС до 60oС, в сложном эфире, особенно в диметилкарбонате, предпочтительно в присутствии основания, прежде всего К2СО3.
Стадия д)
Приемлемыми галогенирующими агентами являются, например, элементарный хлор, жавельева вода, полисульфодихлорид, сульфодихлорид, треххлористый фосфор, пятихлористый фосфор или смесь двух или более указанных реагентов, прежде всего элементарный хлор, жавельева вода, сульфодихлорид или смесь указанных соединений, наиболее предпочтительна жавельева вода.
Реагенты могут взаимодействовать друг с другом без добавления растворителя или разбавителя, например, в расплавленном состоянии. Однако в большинстве случаев целесообразно добавлять растворитель или разбавитель. Примерами таких растворителей или разбавителей являются вода, кислоты, такие как, например, соляная кислота, серная кислота, муравьиная кислота или уксусная кислота, ароматические, алифатические и алициклические углеводороды и галогенированные углеводороды, например, бензол, толуол, ксилол, мезитилен, тетралин, хлорбензол, дихлорбензол, бромбензол, петролейный эфир, гексан, циклогексан, дихлорметан, трихлорметан, четыреххлористый углерод, дихлорэтан, трихлорэтилен или тетрахлорэтилен, дихлорэтан, трихлорэтилен или тетрахлорэтилен, сложные эфиры, такие как этилацетат, простые эфиры, такие как диэтиловый эфир, дипропиловый эфир, диизопропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, диметоксидиэтиловый эфир, тетрагидрофуран или диоксан, кетоны, такие как ацетон, метилэтилкетон или метилизобутилкетон, спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, этиленгликоль или глицерин, амиды, такие как N,N-диметилформамид, N,N-диэтилформамид, N,N-диметилацетамид, N-метилпирролидон или триамид гексаметилфосфорной кислоты, нитрилы, такие как ацетонитрил или пропионитрил, и сульфоксиды, такие как диметилсульфоксид, или смеси указанных растворителей. В предпочтительном варианте реакцию проводят в галогенированном углеводороде, прежде всего в дихлорметане. В наиболее предпочтительном варианте реакцию проводят в водном растворе кислоты, например соляной кислоты.
Реакцию предпочтительно проводят при температуре от примерно 0oС до примерно +180oС, прежде всего от примерно +10oС до примерно +80oС, во многих случаях от комнатной температуры до температуры дефлегмации растворителя. В предпочтительном варианте осуществления стадии д) реакцию проводят при температуре от 0oС до 120oС, прежде всего от 10oС до 50oС, предпочтительно в водном растворе соляной кислоты.
Реакцию проводят предпочтительно при нормальном давлении.
Время реакции не имеет решающего значения и предпочтительно составляет от 0,1 до 48 ч, прежде всего от 2 до 12 ч.
Продукт реакции выделяют с использованием известных методов, например фильтрованием, кристаллизацией, дистилляцией или хроматографией или с помощью премлемого сочетания указанных методов.
Выход полученных соединений обычно достаточно высокий и часто составляет 50% от теории или более.
Предпочтительные условия реакции описаны в примерах.
Соли соединений формул (I)-(VI) могут быть получены с использованием известных методов. Например, кислотно-аддитивные соли получают с помощью обработки приемлемой кислотой или приемлемым ионообменным реагентом, а соли присоединения оснований получают с помощью обработки приемлемым основанием или приемлемым ионообменным реагентом.
Соли соединений формул (I)-(VI) могут быть превращены в свободные соединения формул (I)-(VI) по известным методам; например, кислотно-аддитивные соли могут быть получены с помощью обработки приемлемым основным реагентом или приемлемым ионообменным реагентом, а соли присоединения оснований - обработкой приемлемой кислотой или приемлемым ионнообменным реагентом.
Соли соединений формул (I)-(VI) могут быть превращены в различные соли соединений формул (I)-(VI) известными методами; например, кислотно-аддитивные соли могут быть превращены в другие кислотно-аддитивные соли, например, обработкой соли неорганической кислоты, такой как гидрохлорид, приемлемой солью металла, такой как соль натрия, бария или серебра с обычной кислотой, например, ацетат серебра, в приемлемом растворителе, в котором соль неорганической кислоты, например, хлорид серебра, нерастворима и благодаря этому может быть отделена от реакционной смеси.
В зависимости от способа и условий реакции соединения формул (I)-(VI), обладающие солеобразующими свойствами, могут быть получены в свободной форме или в форме солей.
Соединения формул (I)-(VI) и в каждом случае, в случае применимости, их таутомеры, в каждом случае в свободной форме или в форме солей, могут существовать в форме одного из возможных изомеров или в форме их смеси, например, в зависимости от числа асимметричных атомов углерода, имеющихся в молекуле, и их абсолютной или относительной конфигурации, и/или в зависимости от конфигурации неароматических двойных связей, имеющихся в молекуле, в форме чистых изомеров, таких как антиподы и/или диастереоизомеры или в форме смесей изомеров, таких как смеси энантиомеров, диастереоизомеров или рацематов. Изобретение относится как к чистым изомерам, так и ко всем возможным смесям изомеров, что подразумевается выше и в последующем описании, даже если стереохимия соединений не обсуждается в каждом конкретном случае.
Смеси диастереоизомеров и смеси рацематов соединений формул (I)-(VI), которые могут быть получены по предлагаемому способу, в соответствии со строением исходных соединений и используемыми методами или которые могут быть получены другим способом, или их соли могут быть разделены на чистые диастереоизомеры или рацематы известными методами, основанными на различных физико-химических свойствах компонентов смеси, например, с помощью фракционной кристаллизации, дистилляции и/или хроматографии.
Смеси энантиомеров, такие как рацематы, могут быть разделены соответствующими известными методами на оптические антиподы. Например, с этой целью можно использовать перекристаллизацию из оптически активного растворителя, хроматографию на хиральных сорбентах, например, жидкостную хроматографию высокого разрешения (ЖХВР) на ацетилцеллюлозе, а также можно использовать приемлемые микроорганизмы, расщепление специфическими иммобилизованными ферментами, образование соединений включения, например, с хиральными краун-эфирами, образующими комплекс только с одним из энантиомеров, или превращение в диастереоизомерные соли, например, при взаимодействии рацемата основного конечного продукта с оптически активной кислотой, такой как карбоновая кислота, например, камфорная, винная или яблочная кислоты, или сульфокислота, например, камфорсульфоновая кислота, с последующим разделением смеси полученных диастереоизомеров, например, с помощью фракционной кристаллизации за счет различия в растворимости, на диастереоизомеры, из которых необходимый энантиомер получают при обработке приемлемыми реагентами, например основными реагентами.
Независимо от разделения соответствующих смесей изомеров чистые диастереоизомеры или энантиомеры могут быть получены согласно изобретению по известным методам диастереоселективного и энантиоселективного синтеза, например, при проведении синтеза по изобретению с использованием исходных соединений, имеющих соответствующую стереохимию.
Соединения формул (I)-(VI) и их соли могут быть также получены в форме их гидратов и/или могут включать другие растворители, например, растворители, использованные для кристаллизации соединений, существующих в твердом состоянии.
В соответствии с указанными выше способами получаемые в качестве исходных или промежуточных соединения на любой стадии способа используются в качестве исходных, с которыми проводятся все или некоторые стадии, или исходные соединения в форме производных, солей и/или рацематов или антиподов прежде всего образуются в условиях реакции.
Соединения формул (I), (III), (IV), (V) и (VI), получаемые предлагаемым способом или по другому методу, могут быть превращены в различные соответствующие соединения с использованием известных методов.
В способе по настоящему изобретению предпочтительно используются такие исходные соединения или производные, в каждом случае в свободной форме или в форме соли, которые приводят к получению соединений формул (I)-(VI) или их солей, описанных в первой части описания как наиболее предпочтительные.
Изобретение прежде всего относится к способам, описанным в примерах Р1-Р4.
Настоящее изобретение относится также к соединениям формулы (IV) и, в случае применимости, к их E/Z-изомерам, смесям E/Z-изомеров и/или таутомеров, в каждом случае в свободной форме или в форме соли, в которых R имеет указанные выше для формулы (I) значения.
Настоящее изобретение относится также к способу получения соединения формулы (IV) из соединения формулы (II).
Значения заместителей R в формулах (II), (III), (IV) и (VI) указаны выше при описании способа получения соединений формулы (I).
Соединения формул (I), (II), (III), (V) и (VI) известны, например, как промежуточные вещества при получении пестицидов, или они могут быть получены с использованием известных способов.
Примеры получения соединений
Пример П-А: Бензиловый эфир (2-хлораллил)дитиокарбаминовой кислоты
47 г 2-хлораллил изотиоцианата и 40 г бензилмеркаптана растворяют в 150 мл ацетонитрила и 150 мл толуола. Затем добавляют 1 г 1,4-диазабицикло [2.2.2] октана, смесь нагревают до 75oС и перемешивают в течение 1 ч. После охлаждения до комнатной температуры растворитель удаляют упариванием и остаток кристаллизуют из смеси эфир/гексан. Таким путем получают указанное в заголовке соединение (соединение А), tпл 46-48oС.
Пример П-Б
Остальные соединения, перечисленные в таблице 1а, могут быть получены аналогичным способом, описанным в примере П-А.
Пример П1а: 2-бензилсульфанил-5-хлорметилтиазол
35,8 г бензилового эфира (2-хлораллил)дитиокарбаминовой кислоты и 31,8 г гидрокарбоната натрия добавляют к 250 мл хлорбензола в слабом токе азота. Смесь охлаждают до 5-6oС. Затем реакционный сосуд тщательно продувают азотом и в течение 120 мин добавляют 28,2 г сульфурилхлорида, при этом температуру реакционной смеси поддерживают на уровне 5-10oС. После завершения добавления реактива смесь перемешивают в течение приблизительно 20 мин. Реакционную смесь отфильтровывают через вакуум-фильтр, остаток промывают 20 мл хлорбензола и фильтрат тщательно дегазируют в вакууме при 20-25oС. Затем растворитель удаляют перегонкой при 30oС и при пониженном давлении. К остатку добавляют 90 мл гексана и вносят затравку, затем смесь перемешивают при 0oС и продувают приблизительно 0,8 г газообразного хлористого водорода до полного насыщения раствора (до прекращения поглощения газа). Смесь перемешивают в течение еще 15 мин, сырой продукт фильтруют при 0-5oС, осадок промывают 10 мл гексана и высушивают в вакууме. Таким путем получают 2-бензилсульфанил-5-хлорметилтиазол в форме гидрохлорида.
Пример П1б: 2-бензилсульфанил-5-хлорметилтиазол
5,0 г бензилового эфира (2-хлораллил)дитиокарбаминовой кислоты и 4,1 г гидрокарбоната натрия добавляют к 100 мл дихлорметана и охлаждают на ледяной бане. Затем в течение 3 мин добавляют раствор 3,2 г сульфурилхлорида в 10 мл дихлорметана и после завершения добавления реагента ледяную баню удаляют. Смесь перемешивают при комнатной температуре в течение 2 ч, фильтруют через вакуум-фильтр и фильтрат концентрируют упариванием. Остаток кристаллизуют при добавлении диэтилового эфира. После фильтрования получают 2-бензилсульфанил-5-хлорметилтиазол с tпл 129-131oС в форме гидрохлорида. С помощью экстракции маточного раствора полунасыщенным водным раствором гидрокарбоната натрия и удаления эфира перегонкой получают 2-бензилсульфанил-5-хлорметилтиазол с tпл 57-61oС.
Пример П1в
Другие соединения, перечисленные в таблице 1б, получают аналогичным способом, описанным в примерах П1а и П1б.
Пример П2а: Дигидробромид 1,2-бис(5'-бромметил-5'-хлор-4,5-дигидротиазод -2' -илмеркапто)этана
100 г ацетонитрила загружают в реактор, затем при перемешивании одновременно добавляют раствор 36 г 2-(2-хлораллилтиокарбамоилсульфанил)этиловый эфир (2-хлораллил)дитиокарбаминовой кислоты в 100 мл ацетонитрила и 34 г брома при 10-20oС в течение 30 мин. После завершения добавления реагентов перемешивание продолжают в течение еще 30 мин при 20oС. Продукт выделяют фильтрованием через стеклянную фритту, промывают 50 г ацетонитрила и высушивают в вакууме при 30oС. Продукт, указанный в заголовке, получают в форме дигидробромида (соединение 2.4).
Пример П2б: Гидробромид 2-бензилсульфанил-5-бромметил-5-хлор-4,5-дигидротиазола
19,9 г бензилового эфира (2-хлораллил)дитиокарбаминовой кислоты добавляют к 100 мл этилацетата в слабом токе азота и охлаждают до 0-1oС. Затем в процессе добавления брома реакционный сосуд тщательно продувают азотом. В течение 40 мин добавляют 14,0 г брома, при этом температуру реакционной смеси поддерживают на уровне 0-10oС. После завершения добавления реактива смесь перемешивают в течение приблизительно 20 мин. Реакционную смесь концентрируют в вакууме при 20-25oС. Добавляют 50 мл гексана, смесь отфильтровывают и остаток промывают 40 мл гексана и высушивают в вакууме при комнатной температуре. Продукт, указанный в заголовке, получают в форме гидробромида (соединение 2.1).
Пример П2в: Гидробромид 5-бромметил-5-хлор-2-фенилсульфанил-4,5-дигидротиазола
18,4 г фенилового эфира (2-хлораллил)дитиокарбаминовой кислоты добавляют к 100 мл бромхлорметана в слабом токе азота и охлаждают до 0-1oС. Затем до и в процессе добавления брома реакционный сосуд тщательно продувают азотом. В течение 120 мин добавляют 13,8 г брома, при этом температуру реакционной смеси поддерживают на уровне 0-10oС. После завершения добавления реактива смесь перемешивают в течение приблизительно 20 мин. Реакционную смесь концентрируют в вакууме при 20-25oС. К остатку добавляют 50 мл гексана, продукт отфильтровывают через вакуум-фильтр при 20-25oС, остаток промывают 30 мл гексана и высушивают в вакууме при комнатной температуре. Продукт, указанный в заголовке, получают в форме гидробромида (соединение 2.2).
Анализ: С 29,9%, N 3,6%, Cl 8,9%, S 15,8%, Br 39,1% (рассчитано: С 28,7%, N 3,5%, S 15,8%, Cl 8,8%, Br 38,5%).
Пример П2г: Гидробромид 5-бромметил-5-хлор-2-циклогексилсульфанил-4,5-дигидротиазола
19,0 г циклогексилового эфира (2-хлораллил)дитиокарбаминовой кислоты добавляют к 100 мл ацетонитрила в слабом токе азота и охлаждают до 0-1oС. Затем до и в процессе добавления брома реакционный сосуд тщательно продувают азотом. В течение 70 мин добавляют 14,0 г брома, при этом температуру реакционной смеси поддерживают на уровне 0-10oС. После завершения добавления реактива смесь перемешивают в течение приблизительно 20 мин. Реакционную смесь концентрируют в вакууме при 20-25oС. К сырому продукту добавляют 50 мл гексана, продукт отфильтровывают через вакуум-фильтр при 20-25oС, дважды промывают гексаном порциями по 45 мл и высушивают в вакууме при комнатной температуре. Продукт, указанный в заголовке, получают в форме гидробромида (соединение 2.3).
Пример П2д
Другие соединения, перечисленные в таблице 2, получают аналогичным способом, описанным в примерах П2а-П2г.
Пример П3а: 3-(2-фенилтиотиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадиазин
17,6 г 3-метил-4-нитроиминопергидро-1,3,5-оксадиазина, 0,1 г хлорида 1-(хлорметил) -4-аза-1-азонийбицикло [2.2.2] октана и 48,3 г порошкообразного карбоната калия добавляют к 100 г метилэтилкетона, 40,4 г порошкообразного гидробромида 5-бромметил-5-хлор-2-фенилсульфанил-4,5-дигидротиазола добавляют при температуре от 35 до 40oС в течение 2 ч. Через 4 ч в реакционную смесь добавляют 120 мл воды, рН среды доводят до 6 концентрированной соляной кислотой, смесь нагревают до 70oС и водную фазу отделяют. Органическую фазу концентрируют до половины объема и охдаждают до 0oС, твердый продукт отфильтровывают, промывают 10 мл холодного метилэтилкетона и высушивают в вакууме при 50oС. Таким путем получают требуемый продукт с tпл 147oС (соединение 3-2.3).
Пример П3б: 3-(2-фенилтиотиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадиазин
17,6 г 3-метил-4-нитроиминопергидро-1,3,5-оксадиазина, 0,1 г хлорида 1-(хлорметил)-4-аза-1-азонийбицикло [2.2.2] октана и 48,3 г порошкообразного карбоната калия смешивают в 100 г диметилкарбоната. 40,4 г порошкообразного гидробромида 5-бромметил-5-хлор-2-фенилсульфанил-4,5-дигидротиазола добавляют при температуре от 35 до 40oС в течение 2 ч. Через 4 ч в реакционную смесь добавляют 120 мл воды, рН среды доводят до 6 концентрированной соляной кислотой и смесь нагревают до 70oС. Продукт растворяется в органической фазе, а водную фазу отделяют. Органическую фазу концентрируют до половины объема и охдаждают до 0oС, твердый продукт отфильтровывают, промывают 10 мл холодного метилэтилкетона и высушивают в вакууме при 50oС. Таким путем получают требуемый продукт с tпл 147oС (соединение 3-2,3).
Пример П3в: 3-(2-циклогексилтиотиазол-5-ил-метил)-5-метил-4-нитроимино - пергидро-1,3,5- оксадиазин
17,6 г 3-метил-4-нитроиминопергидро-1,3,5-оксадиазина и 41,5 г порошкообразного карбоната калия смешивают в 100 г метилэтилкетона. 36,7 г порошкообразного гидробромида 5-бромметил-5-хлор-2-циклогексилсульфанил-4,5-дигидротиазола добавляют при температуре от 30 до 35oС в течение 2 ч. Через 4 ч в реакционную смесь добавляют 120 мл воды, рН среды доводят до 6 концентрированной соляной кислотой и смесь нагревают до 70oС. Продукт, растворенный в органической фазе, отделяют от водной фазы. Органическую фазу охлаждают до 0oС, твердый продукт отфильтровывают, промывают 10 мл холодного метилэтилкетона и высушивают в вакууме при 50oС. Таким путем получают продукт, указанный в заголовке, с tпл 109-110oС (соединение 3-2.10).
Пример П3г
Другие соединения, перечисленные в таблицах 3-1 и 3-2, получают аналогичным способом, описанным в примерах П3а-П3в.
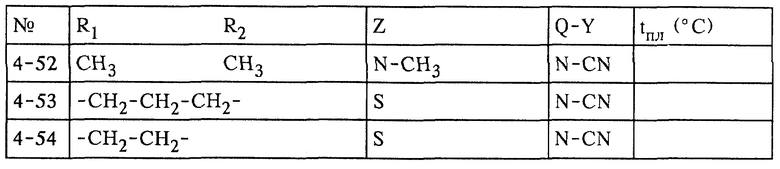
Пример П4: 3-(2-хлортиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадиазин (соединение 4-2)
а) 183 г 3-(2-фенилтиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадиазина добавляют с течение 5 мин при перемешивании в смесь 300 г соляной кислоты (32%-ной) и 150 г хлорбензола. Затем смесь продувают 124 г хлора при 20oС в течение 4 ч. Через 2 ч избыток хлора удаляют с помощью продувания азотом и фазы разделяют. рН водной фазы доводят до 5 раствором гидроксида натрия (30%-ным) и затем смесь фильтруют. Остаток промывают водой и высушивают в вакууме при 50oС. Таким путем получают продукт, указанный в заголовке, с чистотой 97%.
б) 186 г 3-(2-циклогексилтиотиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадизина добавляют в течение 5 мин при перемешивании в смесь 300 г соляной кислоты (32%-ной) и 150 г хлорбензола. Затем смесь продувают 124 г хлора при 20oС в течение 4 ч. Через 2 ч избыток хлора удаляют путем продувания азотом и фазы разделяют. рН водной фазы доводят до 5 раствором гидроксида натрия (30%-ным) и затем смесь фильтруют. Остаток промывают водой и высушивают в вакууме при 50oС. Таким путем получают продукт, указанный в заголовке, с чистотой 97%.
в) 190 г 3-(2-бензилтиотиазол-5-илметил)-5-метил-4-нитроимино-пергидро-1,3,5-оксадиазина добавляют с течение 5 мин при перемешивании в смесь 300 г соляной кислоты (32%-ной) и 150 г хлорбензола. Затем смесь продувают 124 г хлора при 20oС в течение 4 ч. Через 2 ч избыток хлора удаляют с помощью продувания азотом и фазы разделяют. рН водной фазы доводят до 5 раствором гидроксида натрия (30%-ным) и затем смесь фильтруют. Остаток промывают водой и высушивают в вакууме при 50oС. Таким путем получают продукт, указанный в заголовке, с чистотой 97%.
Пример П4г
Другие соединения, перечисленные в таблице 4, получают аналогичным способом, описанным в примерах П4а-П4в.















Изобретение относится к способу получения соединения формулы I в каждом случае в свободной форме и в форме соли, где Q означает СН или N, Y означает NO2 или CN, Z означает СНR3, О, NR3 или S, R1 и R2 каждый независимо друг от друга означает водород, незамещенный или R4-замещенный С1-С8алкил или вместе образуют алкиленовый мостик из двух или трех углеродных атомов, причем алкиленовый мостик может дополнительно содержать гетероатом, выбранный из группы, включающей NR5, О или S, R3 означает H, незамещенный или R4-замещенный С1-С12лкил, R4 означает незамещенный или замещенный арил или гетероарил, R5 означает Н или С1-С12алкил, путем превращения соединения формулы II, в котором R означает циклогексил, фенил, бензил или группу формулы (a), X1 означает уходящую группу, с помощью галогенирующего агента в соединение формулы IV, где Х означает галоген, превращение полученного соединения формулы IV путем взаимодействия с соединением формулы V в соединение формулы VI, которое затем превращают с помощью хлорирующего агента в соединение формулы I. В соединении формулы IV значения R, X, X1 указаны выше. Способ получения соединения формулы IV включает взаимодействие соединения формулы II с галогенирующим агентом. Технический результат - новый способ получения производных тиазола. 3 с. и 3 з.п.ф-лы, 6 табл.



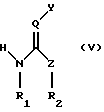


в каждом случае в свободной форме и в форме соли,
где Q означает СН или N;
Y означает NO2 или CN;
Z означает СНR3, О, NR3 или S;
R1 и R2 каждый независимо друг от друга означает водород, незамещенный или R4-замещенный С1-С8алкил или вместе образуют алкиленовый мостик из двух или трех углеродных атомов, причем упомянутый алкиленовый мостик может дополнительно содержать гетероатом, выбранный из группы, включающей NR5, О и S;
R3 означает Н, незамещенный или R4-замещенный С1-С12алкил;
R4 означает незамещенный или замещенный арил или гетероарил;
R5 означает Н или С1-С12алкил,
который включает превращение соединения формулы II
где R означает циклогексил, фенил, бензил или группу формулы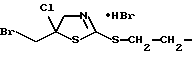
X1 обозначает уходящую группу,
с помощью галогенирующего агента в соединение формулы IV
где X означает галоген;
R и Х1 имеют значения, указанные для формулы II,
превращение полученного соединения формулы IV путем взаимодействия с соединением формулы V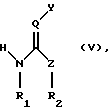
или, в случае применимости, его E/Z-изомера, смеси E/Z-изомеров и/или таутомера, в каждом случае в свободной форме и в форме соли,
где R1, R2, Y, Z и Q имеют значения, указанные для формулы I,
в соединение формулы VI
в каждом случае в свободной форме и в форме соли,
где R1, R2, Y, Z и Q имеют значения, указанные для формулы I,
R имеет значения, указанные для формулы II,
и превращение соединения формулы VI с помощью хлорирующего агента в соединение формулы I.
где R означает циклогексил, фенил, бензил или группу формулы
Х означает галоген;
Х1 означает уходящую группу.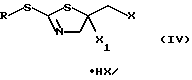
где R означает циклогексил, фенил, бензил или группу формулы
Х означает галоген;
X1 означает уходящую группу,
включающий взаимодействие соединения формулы II по п.1 с галогенирующим агентом.
| 0 |
|
SU285985A1 | |
| БИБЛИОТЕКА | 0 |
|
SU376279A1 |
| Полимерная композиция | 1973 |
|
SU471372A1 |
| Способ получения производных тиазола | 1975 |
|
SU582253A1 |
Авторы
Даты
2002-10-27—Публикация
1997-12-17—Подача