Изобретение относится к ранее неизвестному классу соединений, которые проявляют сильную активность в ингибировании нежелательной пролиферации клеток, например клеток кожи и раковых клеток, к фармацевтическим препаратам, содержащим эти соединения, к дозированным единицам таких препаратов и к их применению в лечении и профилактике заболеваний, характеризующихся аномальной дифференциацией клеток и/или пролиферацией клеток, таких как, например, псориаз и рак.
Соединения данного изобретения представлены общей формулой I: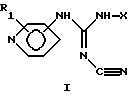
или их таутомерные формы, причем присоединение к пиридиновому кольцу происходит в 3- или 4-лоложении; R1 представляет один или более заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из: водорода, галогена, трифторметила, нитро-, амино-, циано-, карбоксигруппы или алкила, алкоксигруппы или алкоксикарбонила, содержание атомов с в которых может быть от 1 до 4; Х представляет линейную или разветвленную С9-С20-углеродную цепь, насыщенную или ненасыщенную, или Q-Ar-R, где Аr представляет фенил, Q представляет C5-С20-двухвалентный углеводородный радикал, который может быть линейным, разветвленным, насыщенным или ненасыщенным, и R представляет водород или один или более заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из гидрокси-, аминогруппы, галогена, трифторметила, циано-, нитро-, карбоксигруппы, карбамоила или алкила, адкокси-, алкилтио-, алкиламиногруппы или алкоксикарбонила, содержание атомов С в которых может быть от 1 до 4.
Если данные соединения содержат один или более асимметрических углеродных атомов, эти соединения могут образовывать оптические изомеры или диастереоизомеры. Данное изобретение включает также такие изомеры и их смеси. Настоящие соединения могут быть использованы в форме их солей, которые могут быть образованы с фармацевтически приемлемыми неорганическими кислотами или органическими кислотами, такими как соляная кислота, бромисто-водородная кислота, иодистоводородная кислота, фосфорная кислота, серная кислота, азотная кислота, 4-толуолсульфоновая кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, лимонная кислота, винная кислота, янтарная кислота, бензойная кислота и малеиновая кислота.
Даже если данные соединения хорошо абсорбируются после энтерального введения, в некоторых случаях может быть предпочтительно получать подходящие биообратимые производные соединений данного изобретения, то есть получать так называемые пролекарства, предпочтительно производные, физико-химические свойства которых ведут к улучшенной растворимости при физиологическом рН и/или абсорбции, и/или биологической доступности рассматриваемых соединений.
Такими производными являются, например, пиридил-N-оксидные производные соединений данного изобретения; такие соединения могут быть получены путем окисления N пиридила подходящим окислителем, например, 3-хлорпербензойной кислотой, в инертном растворителе, например дихлорметане.
С таким же успехом могут быть рассмотрены другие подходящие способы улучшения физико-химических свойств и/или растворимости этих соединений.
N-Алкил-N'-циано-N''-пиридилгуанидины, описанные в United Kingdom Patent 1489879, являются потенциальными активаторами калиевых каналов с выраженным предкапиллярным сосудорасширяющим действием, снижая общую периферическую резистентность животных и человека, и благодаря этому применимы в качестве гипотензивных средств. Как установлено в International Patent PCT/DK93/00291 от 13 сентября 1993, публикация WO 94/06770, введение арилоксисодержащих радикалов в алифатические группы процитированного выше UK патента дает структуры, проявляющие более специфическое фармакологическое действие на выделенные ткани и клетки с отсутствием или незначительным влиянием на 86Rb-отток из калиевого канала по сравнению с установленным эффектом соединений, относящихся к вышеупомянутому UK патенту.
Соединения данного изобретения ингибируют пролиферацию различных опухолевых клеточных линий в культурах при более низких концентрациях, чем известные соединения, приведенные в табл. 1, и увеличивают время выживания крыс, пораженных опухолями, что делает их потенциально применимыми в антинеопластичной хемотерапии.
Ингибирование пролиферации опухолевых клеток было изучено с использованием различных типов линии клеточной опухоли человека. При исследовании линий клеток использовали малоклеточную карциному легких (NYH), немалоклеточную карциному легких (NCl-H460) и рак молочной железы (MCF-7), по следующему общему способу:
Клетки культивировали in vitro 24 часа в присутствии исследуемого соединения. Синтез ДНК был измерен путем введения [3Н] тимидина и была рассчитана средняя ингибирующая концентрация (IC50) соединения.
Результаты представлены в табл. 1.
Эти результаты показывают, что соединения данного изобретения способны ингибировать пролиферацию раковых клеток in vitro в той же или в более низкой концентрации, что и соединения примеров 14 и 18 в PCT/DK93/00291.
Увеличение времени выживания пораженных опухолями крыс было изучено на LEW/Mol инбредных крысах женского пола, инокулированных клетками саркомы Yoshida в количестве 2•107 клеток. Пораженным опухолями крысам (6 животных в группе) вводили перорально один раз в день на 3 день после передачи опухолевых клеток и до смерти или максимум 21 день или до того, как вес тела снизился на 10%, как следствие разрастания опухоли. Среднее количество дней выживания леченных по сравнению с нелеченными крысами использовано для подсчета УИЖ (увеличенного интервала жизни). УИЖ = ((среднее число леченных/среднее число контрольных)-1)•100%. Результаты представлены в табл. 2.
Эти результаты показывают, что соединения данного изобретения лучше, чем соединения примера 18 из PCT/DK93/00291 продлевают время выживания крыс, пораженных опухолью Yoshida sarcoma.
Соединения данного изобретения хорошо переносимы и не токсичны и оказывают благоприятную активность без или с минимальным воздействием на общее кровяное давление. Обычно они могут быть введены перорально, внутривенно, внутрибрюшинно, интраназально или трансдермально.
Данное изобретение относится также к способам получения желаемых соединений общей формулы I. Соединения формулы I могут быть легко получены стандартными способами, описанными в технике. Варианты способов показаны на схеме I реакций.
Данные соединения предназначены для использования в фармацевтических составах, которые применимы при лечении указанных выше заболеваний.
Количество требуемого соединения формулы (I) (далее ссылка на него как на активный ингредиент) для достижения терапевтического эффекта, конечно, различно в зависимости как от конкретного соединения, так и от способа введения и пациента-млекопитающего. Подходящая доза соединения формулы (I) для системного лечения составляет от 0,1 до 400 мг на кг веса тела, более предпочтительна доза от 1,0 до 100 мг на кг веса тела млекопитающего, например от 5 до 20 мг/кг; вводимая один или более раз в день.
Ежедневная доза (для взрослого) может составлять от 1 мг до 10000 мг, предпочтительно от 70-5000 мг, и в ветеринарной практике, соответственно, в дневной дозе от 0,1 до 400 мг/кг веса тела.
Хотя можно вводить активный ингредиент отдельно в химически чистом виде, предпочтительно, чтобы он присутствовал в фармацевтическом составе. Обычно активный ингредиент составляет от 0,1 до 99% по весу состава. Обычно дозированные единицы состава содержат от 0,5 мг до 1 г активного ингредиента. Для местного применения активный ингредиент предпочтительно составляет от 1 до 20% по весу состава, но активный ингредиент может составлять более 50% по весу. Составы, пригодные для назального или буккального введения могут содержать от 0,1 до 20% по весу, например около 2% по весу активного ингредиента.
Под термином "дозированная единица" понимают унитарную, то есть единичную дозу, которая может быть введена пациенту и которая легко может быть изготовлена и упакована, оставаясь физически и химически стабильной единичной дозой, содержащей либо активный материал как таковой, либо его смесь с твердым или жидким фармацевтическим разбавителем или носителем.
Эти составы для использования как в ветеринарии, так и в медицине содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем и, возможно, другим(и) терапевтическим(и) ингредиентом(ами). Носитель (и) должен быть "приемлемым" в смысле его совместимости с другими ингредиентами состава и безвредности для реципиента.
Составы могут быть представлены в форме, подходящей для перорального, ректального, парентерального (включая подкожное, внутримышечное, внутривенное и внутрибрюшинное) введения.
Составы обычно могут быть в дозированной единичной форме и могут быть получены любым из способов, хорошо известных в фармации. Все методы включают стадию смешивания активного ингредиента с носителем, который объединяет один или более дополнительных ингредиентов. Обычно составы получают путем постоянного и тщательного перемешивания активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем, или с ними обоими и затем, если необходимо, придания желаемой формы составу.
Составы данного изобретения, пригодные для перорального введения, могут быть в форме дискретных единиц, таких как капсулы, облатки, таблетки или лепешки, каждая из которых содержит определенное количество активного ингредиента; в форме порошков или гранул; в форме растворов или суспензий в водной жидкости или неводной жидкости; или в форме эмульсии масло-в-воде или эмульсии вода-в-масле. Активный ингредиент может также быть введен в форме шарика, электуария или пасты.
Составы для ректального введения могут быть в форме суппозитория, содержащего активный ингредиент и носитель, такой как масло какао, или в форме клизмы.
Составы для парентерального введения обычно содержат стерильный масляный или водный препарат активного ингредиента, который предпочтительно является изотоническим с кровью реципиента.
В дополнение к вышеперечисленным ингредиентам составы данного изобретения могут содержать один или более дополнительных ингредиентов, таких как разбавители, буферы, отдушки, связующие, поверхностно-активные вещества, загустители, смазки, консерванты, например метилгидроксибензоат (включая антиоксиданты), эмульгаторы и подобные.
Эти составы могут далее содержать другие терапевтически активные соединения, обычно применяемые при лечении указанных выше патологических состояний, например, противоопухолевые вещества, которые могут оказывать синергическое действие на опухолевые клетки.
Данное изобретение далее будет теперь описано в следующих общих способах и примерах:
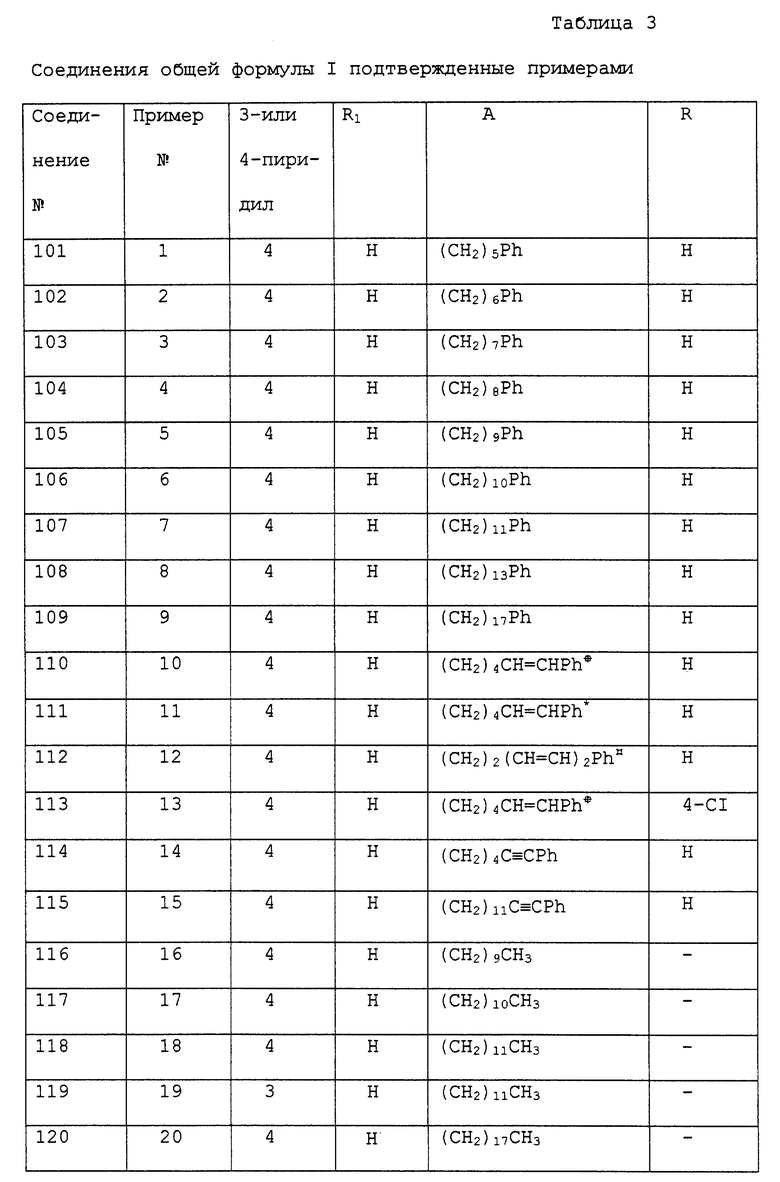
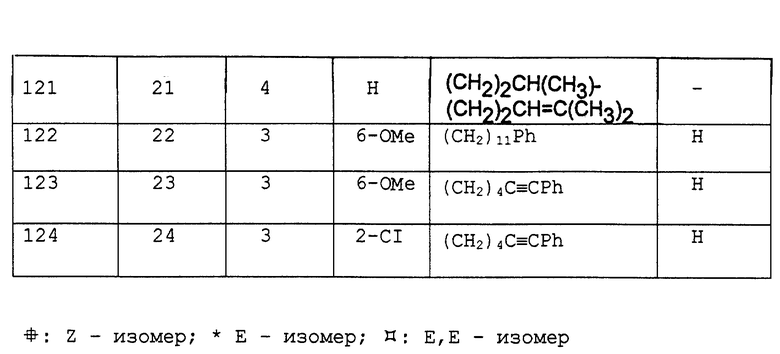
Служащие примерами соединения I приведены в табл. 3.
Все точки плавления не откорректированы для 1Н и 13С спектров (300 МГц) ядерного магнитного резонанса (ЯМР) приведены значения химических сдвигов (δ), если не указано иначе, для дейтерохлороформного (CDC13) и гексадейтеродиметил-сульфоксидного (ДМСО-D6) растворов относительно внутреннего тетраметилсилана (δ 0.00) или хлороформа (δ 7.25 1Н ЯМР) или 76.81 (13С ЯМР). Значения для мультиплета(м), либо определенные (дублет(д), триплет(т), квартет(к), либо неопределенные в соответствующей средней точке, даны без указания пределов (с. синглет, шир. широкий). Хроматография осуществлялась на силикагеле.
Общий способ 1: Превращение соединения общей формулы II в соединения общей формулы I.
Соединение общей формулы II (5 ммоль) суспендировали в ацетонитриле (12 мл) и прибавляли дициклогексилкарбодиимид (10 ммоль, ДЦКД), цианамид (10 ммоль, NH2CN) и триэтиламин (0,07 мл, Et3N). Реакционную смесь перемешивали при комнатной температуре 2 недели. Реакционную смесь фильтровали и промывали ацетонитрилом. Белое твердое вещество, содержащее продукт и дициклогексилтиомочевину, растирали с хлороформом (20 мл) в течение ночи и отфильтровывали, получая продукт общей формулы I в виде белых кристаллов.
Общий способ 2: Реакция сочетания, соединений общей формулы III с соединениями общей формулы IV с образованием соединений общей формулы 1.
Соединение общей формулы III (4 ммоль), соединение общей формулы IV (5 ммоль), триэтиламин (0.12 мл) и 4-диметиламинопиридин (15 мг, ДМАП) растворяли в пиридине (4 мл). Реакционную смесь перемешивали при 60oС 4 часа, если не указано иначе, и затем охлаждали до комнатной температуры. Реакционную смесь либо растирали с диэтиловым эфиром, получая продукт общей формулы I в виде белых кристаллов, либо упаривали в вакууме, получая сырой продукт. Дальнейшая очистка обычно осуществлялась флэш-хроматографией.
Пример 1
N-Циано-N'-(5-фенилпентил)-N''-4-пиридилгуанидин (Соединение 101)
Общий способ 1; вместо ацетонитрила использован этил-ацетат
Исходное соединение II: N-(5-фенилпентил)-N'-4-пиридилтиомочевина
Т.пл. 156oС
1H ЯМР (ДМСО-d6) δ: 9.37 (шир. с, 1Н), 8.37 (д, 2Н), 7.82 (шир. с, 1Н), 7.15-7.30 (м, 5Н), 7.20 (д, 2Н), 3.26 (шир. т, 2Н), 2.57(т, 2Н), 1.56 (м, 4Н), 1.28 (м, 2Н).
Пример 2
N-Циано-N'-(5-фенилгексил)-N''-4-пиридилгуанидин (Соединение 102)
Общий способ 1
Исходное соединение II: N-(6-фенилпентил)-N'-4-пиридилтиомочевина
1H ЯМР (ДМСО-d6) δ: 9.38 (шир. c, 1Н), 8.37 (д, 2Н), 7.82 (шир. с, 1Н), 7.15-7.30 (м, 7Н), 3,25 (м, 2Н), 2.56 (м, 2Н), 1.53(м, 4Н), 1.31 (м, 4Н).
Пример 3
N-Циано-N'-(7-фенилгептил)-N''-4-пиридилгуанидин (Соединение 103)
Общий способ 2; 6 дней при 20oС
Исходное соединение III: S-Метил-N-Циано-N'-4-пиридилизотиомочевина
Исходное соединение IV: 7-фенилгептиламин
Очистка: Кристаллы отфильтровывали и промывали пентаном
Т.пл. 137-138oС
13С ЯМР (HMCO-d6) δ: 157.0, 150.0, 145.7, 142.2, 128.1, 128.1, 125.5, 116.4, 114.5, 41.7, 35.0, 30.8, 28.6, 28.5, 28.4, 26.0.
Пример 4
N-Циано-N'-(5-фенилоктил)-N''-4-пиридидгуанидин (Соединение 104)
Общий способ 2; 6 дней при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридилизотиомочевина
Исходное соединение IV: 8-Фенилоктиламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн.) 95:5:0.5
Т.пл. 144-145oС
13С ЯМР (ДМСО-d6) δ: 157.1, 150.0, 145.8, 142.2, 128.1, 128.1, 125.5, 116.4, 114.5, 43.7, 35.1, 30.9, 28.7, 28.6, 28.5, 26.0.
Пример 5
N-Циано-N'-(9-феноксинонил)-N''-пиридилгуанидин (Соединение 105)
Общий способ 2; 5 дней при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридилизотиомочевина
Исходное соединение IV: 9-Фенилнониламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн.) 95:5:0.5
Т.пл. 132-133oС
13С ЯМР (ДМСО-d6) δ: 157.1, 150.0, 145.9, 142.2, 128.1, 128.1, 125.5, 116.4, 114.5, 41.7, 35.1, 30.9, 28,8, 28.7, 28.5, 26.0.
Пример 6
N-Циано-N'-(10-фенилдецил)-N"-4-пиридилгуанидин (Соединение 106)
Общий способ 2: 5 дней при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридилизотиомочевина
Исходное соединение IV: 10-Фенилдециламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн.) 95:5:0.5
Т.пл. 139-140oС
13С ЯМР (ДМСО-d6) δ: 157.1, 150.0, 145.7, 142.2, 128.1, 128.1, 125.5, 116.4, 314.5, 41.7, 35.1, 30.9, 28.8, 28.7, 28.5, 26.0.
Пример 7
N-Циано-N'-(11-фенилундецил)-N"-4-пиридилгуанидин (Соединение 107)
Общий способ 1
Исходное соединение II: N-(11-Фенилундецил)-N'-4-пиридилтиомочевина
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн. ) 100:5:1 с последующей кристаллизацией из хлороформа
Т.пл. 127-128oС
13С ЯМР (ДМСО-d6) δ: 157.3, 149.9, 146.0, 142.2, 128.1, 128.1, 125.5, 116.4, 114.5, 41.7, 35.1, 30.9, 28.9, 28.8, 28.6, 26.1.
Пример 8
N-Циано-N'-(13-фенилтридецил)-N''-4-пиридилгуанидин (Соединение 108)
Общий способ 1
Исходное соединение II: N-(1-Фенилтридецил)-N'-4-пиридилтиомочевина.
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн. ) 100:5:1 с последующей кристаллизацией из хлороформа
Т.пл. 125-126oС
13С ЯМР (СDС13) δ: 157.5, 150.2, 145.4, 143.0, 128.4, 128.2, 125.5, 115.8, 114.6, 42.7, 36.0, 31.5, 29.6, 29.6, 29.6, 29.5, 29.3, 29.2, 26.7.
Пример 9
N-Циано-N'-(17-фенилгептадецил)-N''-4-пиридилгуанидин (Соединение 109)
Общий способ 2; 14 дней при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридилизотиомочевина
Исходное соединение IV: 17-Фенилгептадециламин
Очистка: Растирание с пентаном с последующей кристаллизацией из хлороформа
13С ЯМР (CDCl3/CD3OD) δ: 157.8, 149.9, 146.6, 143.2, 128.6, 128.4, 125.8, 317.2, 115.6, 42.9, 36.2, 31.8, 29.9, 29.8, 29.8, 29.8, 29,6, 27.0, 0.0.
Пример 10
(Z)-N-Циано-N'-(6-фенилгекс-5-енил)-N''-4-пиридилгуанидин (Соединение 110)
Общий способ 1
Исходное соединение II: (Z)-N-(6-фенилгекс-5-енил)-N'-4-пиридилтиомочевина.
1H ЯМР (ДМСО-d6) δ: 9.39 (шир. с, 1Н), 8.37 (д, 2Н), 7.15-7.40 (м, 7Н), 6.42 (д, 1Н), 5.66 (м, 1Н), 3.22 (шир. т, 2Н), 2.84(шир. с, 1Н), 2.32 (м, 2Н0, 1.55 (м, 2Н), 1.47 (м, 2Н).
Пример 11
(Е)-N-Циано-N'-(6-фенилгекс-5-енил)-N''-4-пиридилгуанидин (Соединение 111)
Общий способ 1
Исходное соединение II: (Е)-N-(6-фенилгекс-5-енил)-N'-4-пиридилтиомочевина
1H ЯМР (ДМСО-d6) δ: 9.40 (шир. с, 1Н), 8.37 (д, 2Н), 7.87 (шир. с, 1Н), 7.15-7.40 (м, 7Н), 6.25-6.45 (м, 2Н), 3.31 (м, 2Н), 2.21 (к, 2Н), 1.40-1.65 (м, 4Н).
Пример 12
(Е, Е)-N-Циано-N'-(6-фенилгекс-3,5-диенил)-N''-4-пиридилгуанидин (Соединение 112)
Общий способ 1
Исходное соединение II: [Е,Е)-N-(6-фенилгекс-3,5-диенил)-N-4-пиридилтидмочевина
1H ЯМР (ДМСО-d6) δ: 9.45 (шир. с, 1Н), 8.36 (шир. д, 2Н), 7.88 (шир. т, 1Н), 7.49 (д, 2Н), 7.32. (т, 2Н), 7.23 (м, 3Н), 6.89(дд, 1Н), 6.54 (д, 1Н), 6.32 (м, 1Н), 5.85 (м, 1Н), 3.37 (к, 2Н), 2.40 (к, 2Н).
Пример 13
(Z)-N-Циано-N'-(6-(4-хлорфенил)гекс-5-енил)-N"-4-пиридилгуанидин (Соединение 113)
Общий способ 2
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: (Z)-6-(4-Хлорфенил)гекс-5-ениламин
Очистка: Хроматография с применением в качестве элюента метанола 0-13% в дихлорметане с последующей кристаллизацией из диэтилового эфира
13С ЯМР (ДМСО-d6) δ: 157.3, 149.9, 145.9, 135.8, 133.2, 131.1, 130.2, 128.2, 127.6, 116.4, 114,5, 41.5, 28.3, 27.6, 26.3.
Пример 14
N-Циано-N'-(6-фенилгекс-5-инил)-N"-4-пиридилгуанидин (Соединение 114)
Общий способ 2; 4 дня при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: 6-Фенилгекс-5-иниламин
Очистка: Растирание с пентаном
Т.пл. 198-199oС
13С ЯМР (ДМСО-Об) δ: 157.2, 150.0, 145.8, 131.1, 128.4, 127.8, 123.1, 116.4, 114.6, 90.3, 30.7, 41.2, 27.9/ 25.3, 18.2.
Пример 15
N-Циано-N'-(13-фенилтридека-12-инил)-N"-4-пиридилгуанидин (Соединение 115)
Общий способ 2: 14 дней при 20oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: 13-Фенилтридека-12-иниламин
Очистка: Растирание с простым, диэтиловым эфиром с последующей кристаллизацией из смеси хлороформ /диэтиловый эфир.
13С ЯМР (CDCl3) δ: 157.6, 150,7, 145.0, 131.5, 128.2, 127.5, 126.6, 124.1, 117.1, 115.8, 90.5, 80.6, 42.6, 29.5, 29.2, 29.1, 28.9, 28.7, 26.8, 19.4.
Пример 16
N-Циано-N'-децил-N"-4-пиридилгуанидин (Соединение 116)
Общий способ 2
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: н-Дециламин
1Н ЯМР (ДМСО-d6) δ: 9,37(шир.с, 1Н), 8.37 (д, 2Н), 7.82 (шир. с, 1Н), 7.20 (шир. д, 2Н), 3.26 (шир.т, 2Н), 1.51 (м, 2Н), 1.25 (шир.с, 14Н), 0,86 (шир.т, 3Н).
Пример 17
N-Циано-N'-ундецид-N"-4-пиридилгуанидин (Соединение 117)
Общий способ 2
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: н -Ундециламан
1Н ЯМР (ДMCO-d6) δ: 9.32 (шир.с, 1Н), 8.37 (д, 2Н), 7.81 (шир. с, 1Н), 7.20 (шир.д, 2Н), 3.25(шир.т, 2Н), 1.51 (шир.л, 2Н), 1.24 (шир.с, 16Н), 0.85 (т, 3Н).
Пример 18
N-Циано-N'-додецил-N"-4-пиридилгуанидин (Соединение 18)
Общий способ 1: в качестве растворителя вместо ацетонитрила использован этилацетат
Исходное соединение II: N-Додецил-N'-4-пиридилтиомочевина
1Н ЯМР (AMCO-d6) δ: 9.39 (шир.с, 1Н), 8.37 (д, 2Н), 7.82 (шир. с, 1Н), 7.21 (д, 2Н), 3.26 (шир.т, 2Н), 1.52 (н, 2Н), 1.24 (шир.с, 18Н), 0.85 (шир. т, 3Н).
Пример 19
N-Циано-N'-додецил-N"-3-пиридилгуанидин (Соединение 119)
Общий способ 2
Исходное соединение III: S-Метил-N-циано-N'-3-пиридил-изотиомочевина.
Исходное соединение IV: н -Додециламин
1H ЯМР (ДМСО-d6) δ: 9.04 (шир. с, 1Н), 8.45 (д, 1Н), 8.33 (дд, 1Н), 7.65(шир. д, 1Н), 7.38 (шир.с, 1Н), 7.36 (дд, 1Н), 3.28(шир.к, 2Н), 1.50 (м, 2Н), 1.24 (шир.с, 18Н), 0.85 (шир.т, 3Н).
Пример 20
N-Циано-N'-октадецил-N"-4-пиридидгуацинин (Соединение 120)
Общий способ 1: в качестве растворителя вместо ацетонитрила использован этилацетат
Исходное соединение II: N-Октадецил-N'-3-пиридилтио-мочевина.
Очистка: Кристаллизация из водного метанола
13С ЯМР (CDCl3/CD3OD): δ 150.1, 145.8, 117.1, 115.5, 42.7, 32.0, 29.8, 29.7, 29.6, 29.4, 29.3, 26.8, 22.8, 14.1.
Пример 21
N-Циано-N'-(3,7-диметилокт-6-енил)-N"-4-пиридилгуанидин (Соединение 121)
Общий способ 2; 3 дня при 60oС
Исходное соединение III: S-Метил-N-циано-N'-4-пиридил-изотиомочевина.
Исходное соединение IV: 3,7-Диметилокт-6-ениламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3, (водн. ) 95: 5:1 с последующей кристаллизацией из смеси хлороформ /диэтиловый эфир
13С ЯМР (ДМСО-d6) δ: 157.2, 149.9, 145.9, 130.5, 124.5, 116.4, 114.4, 39.9. 36.3, 35.5, 29.4, 25.4, 24.8, 19.2, 17.4.
Пример 22
N-Циано-N'-(11-фенилундецил)-N"-5-[2--метоксипиридил)гуанидин (Соединение 122)
Общий способ 2; 3 дня при 60oС
Исходное соединение III: S-Метил-N-циано-N'-5-(2-метоксипиридил) изотиомочевина.
Исходное соединение IV: 11-фенилундециламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол/NН3 (водн.) 98:2:0.2
Т.пл. 74-75oС
13С ЯМР (CDCl3): δ 163.3, 159.4, 145.1, 142.9, 137.5, 128.4, 128.2, 125.6, 125.5, 118.0, 112.0, 53.9, 42.1, 36.0, 31.5, 29.5, 29.5, 29.5, 29.3, 29.3, 29.2, 26.7.
Пример 23
N-Циано-N'-(6-фенилгекс-5-инил)-N"-5-(2-метоксипиридил) гуанидин (Соединение 123)
Общий способ 2; 3 дня при 60oС
Исходное соединение III; S-Метил-N-циано-N'-5-(2-метоксипиридил) изотиомочевина.
Исходное соединение IV: 6-Фенилгекс-5-иниламин
Очистка: Хроматография с применением в качестве элюента смеси дихлорметан/метанол 98:2
13С ЯМР (СDСl3): δ 163.3, 159.5, 145.1, 137.6, 131.5, 128.2, 127.7, 125.6, 123.6, 118.0, 1-1.2.0, 89.3, 81.3, 53.9, 41.5, 28.5, 25.7, 19.0.
Пример 24
N-Циано-N'-(6-фенилгекс-5-инил-N"-3- (2-хлорпиридил} гуанидин (Соединение 124)
Общий способ 2; 3 дня при 60oС
Исходное соединение III: S-Метил -N-циано-N'-3-(2-хлорпиридил)изотиомочевина.
Исходное соединение IV: 6-Фенилгекс-5-иниламин
Очистка: Кристаллизация из дихлорметан /метанол 98:2
13С ЯМР(ДМСО-d6) δ: 157.9, 147.8, 147.3, 138.1, 131.6, 131.1, 128.4, 127.8, 123.7, 123.2, 116.9, 90.3, 80.7, 40.9, 28.1, 25.3, 18.2.
Пример 25
Капсулы
1 Капсула содержит, мг:
N-Циано-N'-(9-фенилнонил)-N"-4-пиридилгуанидин (активное соединение) - 100
Полиэтиленгликоль - 962
Желатиновая капсула 00
Желатина - 122
Пример 26
Таблетки
Производство 10000 таблеток, кг:
I N-Циано-N'(9-фенилнонил)-N"-4-пиридилгуанилин - 10,000
Кросс-камелоза-натрий - 0,300
II Гидроксипропилметилцеллюлоза, низковязкого типа - 0,200
Олеат сорбимакроголя - 0,010
Очищенная вода - Дост. кол.
III Кросскамелоза-натрий - 0,200
Коллоидный безводный оксид кремния - 0,050
Стеарат магния - 0,050
Ингредиент I тщательно перемешивали в смесителе с высоким срезывающим усилием, увлажняли ингредиентом II и гранулировали во влажную массу. Влажный гранулят сушили в сушилке с псевдоожиженным слоем с температурой воздуха на входе 60oС до того момента, когда высушенный гранулят будет иметь активность по воде в пределах 0,3-0,4 (=равновесие с воздухом с отн. влажн. 30-40%).
Высушенный гранулят пропускали через сито с отверстиями 850 мкм.
Просеянный гранулят затем смешивали с ингредиентом III в коническом смесителе.
Конечный гранулят прессовали в таблетки массой 1071 г и достаточной твердости.
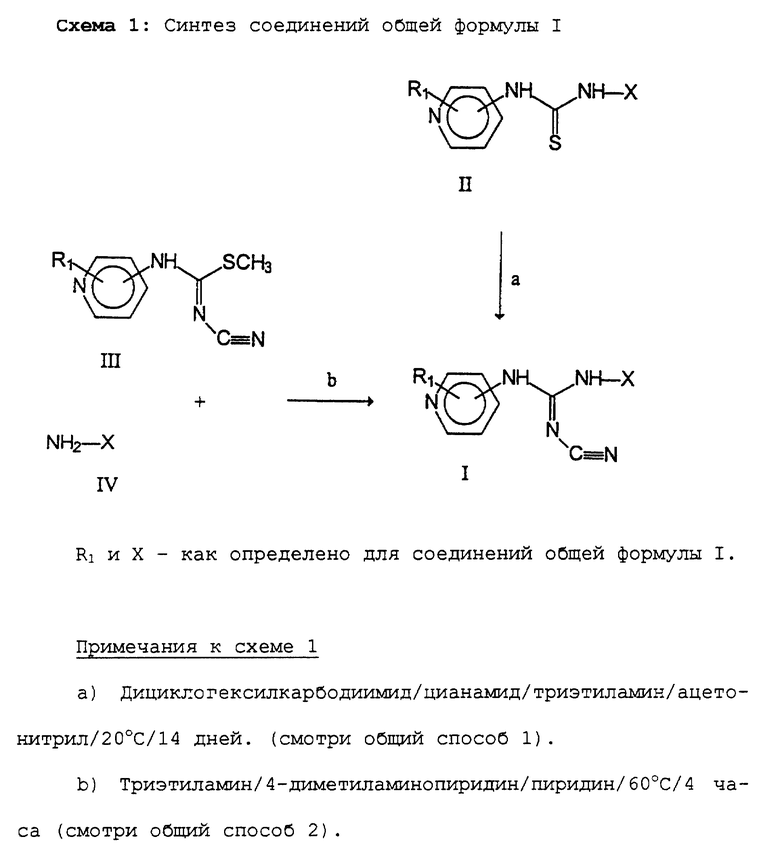
Изобретение относится к новым цианогуанидинам ф-лы (I)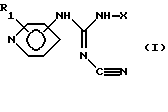
или их таутомерным формам, где присоединение к кольцу пиридина осуществляется в 3-м или 4-м положении; R1 представляет один или более заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из водорода, галогена или С1-С4-алкоксигруппы; Х - линейный или разветвленный, насыщенный или ненасыщенный C9-С20-углеводородный радикал или группа Q-Ar-R, где Ar - фенил, Q - линейный или разветвленный, насыщенный или ненасышенный C5-C20-двухвалентный углеводородный радикал, R - водород или галоген. Соединения ф-лы (I) ингибируют нежелательную пролиферацию клеток и могут найти применение в медицине. 4 с. и 4 з.п.ф-лы, 3 табл.
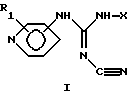
или их таутомерные формы,
где присоединение к кольцу пиридина осуществляется в 3-м или 4-м положении;
R1 - один или более заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из водорода, галогена или C1-C4 алкоксигруппы;
Х - линейный или разветвленный, насыщенный или ненасыщенный С9-С20 углеводородный радикал или группа Q-Ar-R, где Аr - фенил, Q - линейный или разветвленный, насыщенный или ненасыщенный С5-С20 двухвалентный углеводородный радикал, R - водород или галоген.
N-циано-N'-(5-фенилпентил)-N"-4-пиридил-гуанидина,
N-циано-N'-(8-фенилоктил)-N"-4-пиридил-гуанидина,
N-циано-N'-(9-фенилнонил)-N"-4-пиpидил-гyaнидинa,
N-циано-N'-(13-фенилтридецил)-N"-4-пиpидил-гyaнидинa,
(Z)-N-циано-N'-(6-фенилгекс-5-енил)-N"-4-пиpидил-гyaнидинa,
N-циано-N'-(6-фенилгекс-5-инил)-N"-4-пиридил-гуанидина
или их чистых энантиомерных форм.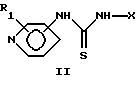
вводят в реакцию с дициклогексилкарбодиимидом и цианамидом в присутствии триэтиламина или другого третичного амина в ацетонитриле или другом инертном растворителе при комнатной температуре или выше.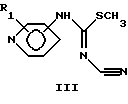
вводят в реакцию с соединением общей формулы (IV)
H2N-X IV
в присутствии триэтиламина или другого третичного амина и 4-диметиламинопиридина в пиридине или инертном растворителе при комнатной температуре или выше.
| Экономайзер | 0 |
|
SU94A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Экономайзер | 0 |
|
SU94A1 |
| RU 95105437 A1, 27.10.1996. | |||
Авторы
Даты
2002-12-27—Публикация
1998-05-15—Подача